(CHjO)iP(0)CHjC(0)(CH)4CH, (CH,0)j Р (O)CHjC(O) (СИг )« СИ,
()jP(0)CHiC(0)CH(CH,CH,) (СН), СИ (СН,0)Р(0)СИ2С(0)С(СН,) (Clli), СН, (CHjO)jP(0)(0)(CH,),CH,
Метод Б. К раствору 2,5 г диметилового эфира метилфосфоновой кислоты
в 15 МП безводного тетрагидрофурана, охлажденного ниже -70°С, добавляют
по каплям 18,5 мл раствора бутиллития в гексане (10 об/мае) охлажденного
до температуры ниже -70°С, смесь перемешивают в токе азота 30 мин и еще
15 мин при той же температуре.,Затем по каплям добавляют раствор этилового
эфира тридекановой кислоты (2,4 г) в 5 МП безводного тетрагидрофурана в
течение 10 мин и полученную смесь перемешивают 1 ч при температуре ниже
-70°С и еще 2 ч при комнатной температуре .
Полученную реакционную смесь охлаждают льдом, смешивают с 2 мл ледяной уксусной кислоты, концентрируют
при пониженном давлении, после чего
113-115°С/0,8 мм Hg
129-132°С/0,9 мм Hg 126-128 С/0,85 MMHg 104-108 с/а,25 TOiHg
120-123°С/0,4 мм Hg
трижды экстрагируют этиловым эфиром
каждый раз по 10 мп. Экстракты объединяют , промывают насьш;енным раствором
хлористого натрия, сушат над безводным сульфатом магния и концентрируют
при пониженном давлении с получением маслообразного продукта, который наносят на силикагель (40 ггг)
для колоночной хроматографии и элюи- руют этиловым эфиром с получением
2,5 г диметилового эфира 2-оксотридс- каноилфосфоновой кислоты, т.пЛ, 37- 38° С.
Ссылочный пример 8 (исходное вещо- ство, .используемое в примере 13).
После постепенного добавления 0,5 г 3,4-дибензилоксифешшацета.|: гида к 10 мг эфирного раствора н -ок
тилмагнийбромида, приготовленного из 0,12 г магния и 0,97 г н-октилброми
да, смесь перемешивают 30 мин при комнатной температурь, К полученной
реакционной смеси добавляют 10 мл 5%-ного водного раствора соляной кислоты и после перемешивания отделяют
эфирный слой. Эфирный раствор промьтают водой, высупшваютонад безводным сульфатом магния и концентрируют
при пониженном давлении с получением 0,5 г 1-3,4-дибензилоксифе- нил декан-2-ола, т.пл, ЗЗ-ЗУ с (н-
гексан).
Вычислено, %: С 80,54; Н 8,78.
С го
Найдено, %: С 80,68; Н 8,58.
Следуя методике ссылочного примера
8, получены соединения ссылочных примеров 9-11, названия их температуры плавления и/или спектры ядерного
магнитного резонанса (в CDClj, внутренний стандарт ТМС, ррт) даны ниже.
Ссьточный пример 9 (исходное вещество , используемое в примере 16).
1-(3,4-Дибензилоксифеш1л)нонан-2- ол.
ЯМР: 0,7-1,6 (15Н); 2,57 (2Н);
3,63 (1Н); 5,08 (4Н); 6,5-7 (1Н).
Ссылочный пример 10.(исходное ве-°
щество, используемое в примере 17).
1-(3,4-Дибензилоксифенил)ундекан-
2-ол, т.пд. 55-37 С.
ЯМР: 0,7-1,6 (19Н); 2,57 (2Н);
3,59 (1Н); 5,07 (4Н); 6,5-7,5 (13Н).
Вычислено, %: С 80,83; Н 8,75.
С J, Н
получают 0,8 г 1-(3,4-дибензилокси-
фенш1)ундекан-2-она, т.пл. 68°С. Вычислено, %: С 81,18; Н 8,35.
10
15
20
Найдено, %: С 80,83; Н 8,89.
Ссылочный пример 11 (исходное вещество
, используемое в примере 18).
2-(3,4-Дибензилоксифенил) -1 -цикло-
гексилэтан-1-ол, т.пл. 73-75 С.
Вычислено, %: С 80,73; Н 7,74.
CjgHj O,
,
Найдено, %: С 81,13; Н 8,28.
Ссылочный пример 13 (исходное вещество
, используемое в примере 15).
К раствору, приготовленному добавлением
200 мг гидрида натрия в масле (60%) к смеси 25 мл 1,2-димвтoкcимe-
тaнa и 10 мл диметилсульфоксида, добавляют по каплям смесь 1,2 г димети-
лового эфира 2-оксооктилсульфоновой кислоты и 3 мл диметоксиметана и после
добавления к ней небольших кусочков льда, смесь перемепшвают еще 5
5 мин. Затем к реакционной смеси добавляют 200 мл воды и экстрагируют
толуолом. Остаток подвергают колоночной хроматографии на силикагеле с
применением в качестве элюента смеси толуола с этилацетатом (10:1) и получают
0,5 г 1-(3,4-дибензилоксифенил)- дец-2-ен-4-она. Спектр ядерного магнитного
резонанса (в CDClj, внутренний стандарт ТМС, ррт): 0,7-1,8 (1Н); 2,42 (2Н); 3,24 (2Н); 5,09 (4Н); 6-
7,7 (15Н).
Ссылочный пример 14 (исходное вещество
, используемое в примере 19).
Используя методику ссылочного примера
13, получают 1-(3,4-дибензил- оксифенил)дец-3-ен-5-он из 1-(3,4- дибензилоксифенил)пропиоальдегида и
35 диметилового эфира 2-оксогексилфосфоО
новой кислоты, т.пл. 38-3.9 С.
Вычислено, %: С 81,41; Н 7,74.
25
30
Сзд Н,, О,
Найдено, %: С 81,48; Н 7,66.
Ссылочный пример 15 (исходное вещество , используемое в примере 20).
15а. Смесь 2 г гидрида натрия в масле (60%) и 90 мл диметилсульфоксида
пе|)емешивают 1 ч при 55-60°С,- после чего охлаждают до комнатной
температуры. Затем к смеси добавляют по каплям при комнатной температуре
раствор 11 г (4-карбоксибутил)трифе- нилфосфоний бромида в 25 мл диметилНайдено , %: С 80,65; Н 7,8.
Ссьточный пример 12 (исходное ве- 45
щество, используемое в примере 14).
К смеси 15 мл хлористого метилену
и 1,2 мл пиридина постепенно добавляют 2 г хромового ангидрида при температуре
(0)-(-5)°С к ней добавляют ра- 50 сульфоксида, перемешивают при комнат- створ 0,9 г 3,4-дибензилоксифенилунде- ной температуре 30 мин, после чего к
кан-2-ола в 3 мл хлористого метилена. полученной реакционной смеси добав- После перемешивания смеси 20 мин при ляют по каплям раствор 8 г 3,4-дибен-
0-1 верхний слой раствора хлорис- зилоксибензальдегида в 30 мл диметил-
того метилена концентрируют при пони- 55 сульфоксида. Смесь продолжают перемеженном давлении. Остаток подвергают шивать в течение 1 ч при комнатной
колоночной хроматографии на силикагеле с толуолом в качестве элюента и
температуре, после чего добавляют 5 г сухого льда, затем 250 мл воды и 30 мл
14247296
получают 0,8 г 1-(3,4-дибензилокси-
фенш1)ундекан-2-она, т.пл. 68°С. Вычислено, %: С 81,18; Н 8,35.
5
0
,
Найдено, %: С 81,13; Н 8,28.
Ссылочный пример 13 (исходное вещество
, используемое в примере 15).
К раствору, приготовленному добавлением
200 мг гидрида натрия в масле (60%) к смеси 25 мл 1,2-димвтoкcимe-
тaнa и 10 мл диметилсульфоксида, добавляют по каплям смесь 1,2 г димети-
лового эфира 2-оксооктилсульфоновой кислоты и 3 мл диметоксиметана и после
добавления к ней небольших кусочков льда, смесь перемепшвают еще 5
5 мин. Затем к реакционной смеси добавляют 200 мл воды и экстрагируют
толуолом. Остаток подвергают колоночной хроматографии на силикагеле с
применением в качестве элюента смеси толуола с этилацетатом (10:1) и получают
0,5 г 1-(3,4-дибензилоксифенил)- дец-2-ен-4-она. Спектр ядерного магнитного
резонанса (в CDClj, внутренний стандарт ТМС, ррт): 0,7-1,8 (1Н); 2,42 (2Н); 3,24 (2Н); 5,09 (4Н); 6-
7,7 (15Н).
Ссылочный пример 14 (исходное вещество
, используемое в примере 19).
Используя методику ссылочного примера
13, получают 1-(3,4-дибензил- оксифенил)дец-3-ен-5-он из 1-(3,4- дибензилоксифенил)пропиоальдегида и
5 диметилового эфира 2-оксогексилфосфоО
новой кислоты, т.пл. 38-3.9 С.
Вычислено, %: С 81,41; Н 7,74.
5
0
Сзд Н,, О,
Найдено, %: С 81,48; Н 7,66.
Ссылочный пример 15 (исходное вещество , используемое в примере 20).
15а. Смесь 2 г гидрида натрия в масле (60%) и 90 мл диметилсульфоксида
пе|)емешивают 1 ч при 55-60°С,- после чего охлаждают до комнатной
температуры. Затем к смеси добавляют по каплям при комнатной температуре
раствор 11 г (4-карбоксибутил)трифе- нилфосфоний бромида в 25 мл диметилсульфоксида
, перемешивают при комнат- ной температуре 30 мин, после чего к полученной реакционной смеси добав-
ляют по каплям раствор 8 г 3,4-дибен- зилоксибензальдегида в 30 мл диметил-
сульфоксида. Смесь продолжают перемешивать в течение 1 ч при комнатной
сульфоксида, перемешивают при комнат- ной температуре 30 мин, после чего к
полученной реакционной смеси добав- ляют по каплям раствор 8 г 3,4-дибен-
зилоксибензальдегида в 30 мл диметил- сульфоксида. Смесь продолжают перемешивать
в течение 1 ч при комнатной
температуре, после чего добавляют 5 г
сухого льда, затем 250 мл воды и 30 мл
10%-ного водного раствора соляной кислоты и экстрагируют 300 мл эфира. Полученный экстракт промывают водой,
высушивают над безводным сульфатом магния и концентрируют при пониженном
давлении с получением липкого продукта , который подвергают колоночной хроматографии на силикагеле (150 мл)
с применением в качестве элюента смесиН-гексана с эфиром (1:1) и получают 8,5 г 6-(3,4-дибензилоксифекил)-
гекс-5-еновой кислоты. Продукт растворяют в 30 мл этанола и каталитически
гидрируют с применением в качестве катализатора 1 г 10% палладия на угле до прекращения поглощения водорода
. Затем катализатор удаляют фильтрованием , а фильтрат концентрируют
при пониженном давлении с получением 3,8 г 6-(3,4-дибензш1оксифенил)гек- сановой кислоты, т.пл. 109 С.
156. Смесь 3,8 г 6-(3,4-дигидрок- сифенил)гексановой кислоты, 8,6 г
хлористого бензила, 9,4 г карбоната калия, О,1 г тетра-н-бутиламмонийбро-
МИДа и 50 МП Н,Ы-диметилформамида перемешивают в течение 1 сут при комнатной
температуре, nocrfe завершения
реакции к реакционной смеси добавляют .,,.дибензилоксифенил)гексила, 0,12 г
200 мл воды и экстрагируют триждыацетилацетона, 0,15 г карбоната каэфиром каждый раз по 100 мл. Экстрак-лия, 0,02 г йодистого натрия и 5 мл
ты объединяют, промьшают водой, вы-этанола кипятят 20 ч. Затем в реакцисушивают
над безводным сульфатомонной смеси добавляют 15 мл воды и
магиия и концентрируют при понижен-
ном давлении с получением липкого продукта, который подвергают колоночной хроматографии на силикагеле
(150 мл) с применением в элюента смеси толуола с этилацетатом (19:1) и получают 3,4 г 6-(3,4-дибен-
зилоксифенил)гексановой кислоты в виде ее бензилового эфира.
Полученный эфир растворяют в 20 мл эфира и полученный раствор добавляют
по каплям к смеси 0,5 г литийалюми- нийгидрида и 50 мл эфира при охлаждении льдом. Затем реакционную .
смесь перемешивают 1 ч при комнатной температуре и при охпаяц ении льдом
добавляют 30 мл 10%-ного водного раствора соляной кислоты. Полученный
органический слой отделяют, промывают водой, высушивают над безводным
сульфатом магния и концентрируют при
пониженном давлении с получением лип- 55 5 мл К,Н-диметилформамида и 500 мл
кого продукта, который подвергают йодистого метила при перемешивании колоночной хроматографии на силикагеле
(100 мл) с применением в качести охлаждении льдом. После перемешивания
смеси в течение 1 сут при ком
5
0
5
ве элюента смеси толуола с этил,п1и
татом (4:1) и папучают 1,95 г 6-(3,4- дибензилоксифенил) ге.ксанола.
Продукт растворяют в 10 мл хлористого метилена и полученный раствор добавляют по каплям при комнатной
температуре к раствору трифенилфос- финдибромида (приготовленного из
1,57 г трифенилфосфина и 0,88 г брома ) в хлористом метилене, в котором
также содержится 0,45 г пиридина. Затем смесь перемешивают в течение
1 сут при комнатной температуре, полученную реакционную смесь промъшают
разбавленной соляной кислотой, водой высушивают над безводным сульфатом
магния, концентрируют при пониженном давлении, остаток подвергают 1;очс ночной
хроматографии на силикагс ле (jO мгО с применением в качестве элюента
смеси н-гексана с толуолом (2:1) и получают 1,08 г 6-(3,4-дибенз1шокси- фенил)гекснлбромида.
Спектр ЯМР (в CDCl,, внутренний стандарт ТМС ррт): 1,0-2,0 (8Н);
2,50 (2Н); 3,38 (2Н); 5,13(2Н); 5,16 (2Н); 6,6-6,92 (311); 7,1-7,5 (ЮН).
15в. Смесь 0,5 г бромистого 6-(3,4
экстрагируют 20 мл эфира. Экстракт
промывают водой, высушивают над без- водньм сульфатом магния, концентрируют
при пониженном давлешти с получением липкого продукта, который подвергают колоночной хроматографии на
силикагеле (45 мл) с применением в качестве элюента смеси толуола с этил-
ацетатом (30:1) и получают 33 мг 9- (3,4-дибензилоксифенил)-нонан-2-она в виде масла.
Спектр ЯМР (в CdCl,, внутренний стандарт ТМС, ррт): 1-2 (ЮН); 2,1
(ЗН); 2,2-2,7(4Н); 3,08 (2Н); 3,1 (2Н);; 6,5-7 (ЗН); 7,2-7,6 (ЮН).
Ссылочный пример 16. К смеси 130мг гидрида натрия в масле (60%) и 15 мл
Н,Н-диметш1формамида добавляют по каплям последовательно раствор 1,27 г
1-(3,4-дибензилоксифе{ош)-4-метилокт- 1-ен-З-она (см. ссылочный пример 1) в
5 мл К,Н-диметилформамида и 500 мл йодистого метила при перемешивании
и охлаждении льдом. После перемешивания смеси в течение 1 сут при ком )
нпт11(1Й температуро к ней лобанляют 150 мл полы Т1 полученный экстракт
пролукт экстрагируют этилацетатом. Экстракт npoMi.maioT водой, высушивают
над безводным сульфатом магния, концентрируют при пон1с«енном давлении, с
получением липкого продукта, который подвергают колоночной хроматографии на силикагеле (0 г) с применением
в качестве элюента смеси н-гек- сана с эфиром (4:1) и получают 970 г 1-(3,А-дибензилоксифенил)-3-метокси-
Д-метилокт-1-ена, т.пл. 36-38 С.
Ссылочный пример 17 (исходное вещество
, используемое в примере 23).
17а. В 20 МП ксилола растворяют
при нагревании 35 г декандиола и после добавления к раствору 1,65 г металлического
натрия при 130 С смесь нагревают в течение часа при 125- 130 С. К полученной реакционной смеси
добавляют по каплям при 120-130°С Затем реакционную смесь охлаждают до и после добавления 50 мл
толуола смесь в горячем состоянии фильтруют. Фильтрат охлаждают льдом
до вьтадения кристаллического вещества , которое отделяют фильтрованием
с получением 24 исходного декандиола
При этом фильтрат концентрируют
при пониженном давлении с получением маслообразного продукта, который
хроматографируют на колонке с силика гелем с применением в качестве элюента смеси толуола с этилацетатон
(8:2) и получают 13 г маслообразного
10-бензилоксидекан-1-ола. I
Спектр ЯМР (в CDC1,, ТМС, ррт): 1,1-2 (16 Н, (СНг)ц, 3,43 (2Н, триплет
, -CHjO-); 3,59 (2Н, триплет, -CHjOH); 4,47 (2Н, синглет, -OCHjPh) 7,28 (5Н, Н бензольного кольца).
176. Смесь 7 г 10-бензилкосидекан 1-ола, 8 мл хлористого тионила и
0,2 МП диметилформамида нагревают 1 при 50 мл и -гексана и после промывания
раствора водой его высушивают
над безводным сульфатом магния, раст
воритель отгоняют и остаток подвергают колоночной хроматографии на силикагеле
с применением в качестве элго- ента толуола. Получено 6,7 г маслообразного 10-бензилокси-1-хлордекана,
т.кип. 135-140°С/0,6-0,9 мм Hg.
Спектр ЯМР (в спец, ТМС, ррт):
1,1-2 16М, (СИ,,),; 3,43 (2Н, триплет , -СИоО-); 3,49 (2Н, триплет.
142472910
-CUjCl ); 4,47 (2Н, синглет -ОСИ,-); 7,28 (5Н, Н бензольного кольца).
17в. К смеси 1 мл безводного эфи- ра и 0,6 г металлического магния до-
баиляют 0,1 мл йодистого метила и
0
0
5
0
5
0
кристаллик кристаллического иода, после чего для инициирования реакции
смесь нагревают и затем добавляют по каплям раствор 6,7 г 10-бензилокси
1-хлордекана в 10 мл безводного эфира . После завершения реакции реакционную
смесь кипятят 2 ч, охлаждают и затем добавляют по каплям при 0-5 С
5 к раствору 6 г 3,4-дибензилоксибенз- альдегида в 30 мл тетрагидрофурана.
Перемешивают 30 мин при комнатной температуре и после добавления 300 мл
1%-ного водного раствора соляной кислоты экстрагируют 100 мп толуола.
Экстракт промьшают водой, высушивают над безводным сульфатом магния, растворитель
отгоняют при пониженном давлении. Остаток растворяют в 30 мп этанола и оставляют на 1 сут при
0-5 С. Выпавшие кристаллы отделяют фильтрованием. После высушивания
кристаллов получают 5 г 11-бeнзилoкcи- 1 -( 3 , 4-бензш1оксифенил)ундекан-1-ола, т.пл. 50-52°С.
Вычислено, %: С 80,53; Н 8,18.
Найдено, %: С 80,55; Н 7,94.
Ссылочный пример 18 (исходное вещество , используемое в примере 2А).
18а. К раствору 2,16 г бензилового спирта в 30 мл диметилформамида добавляют
1,2 г гидрида натрия в масле (60%). После перемешивания смеси
30 мин при 20-25 С одной порцией добавляют 10 г 1,12-дибромододекана,
после чего перемешивают 2 ч при 25- 30°С. После окончания реакции к реакционной
смеси прибавляют 300 мп воды и экстрагируют .м -гексаном. Экстракт
промывают водой, высушивают над безводным сульфатом магния, затем растворитель
отгоняют. Маслообразный остаток подвергают колоночной хроматографии на силикагеле с применением
в качестве элюента смеси н-гексана с эфиром t9:1) и получают 3,8 г 12-
бензилокси-1-бромдодекана в виде маслообразного продукта.
Спектр ЯМР (в CDClj, ТМС, ррт): 1,2-2 Г(20Н, -(CHj),o -1; 3,38 (2Н,
триплет, - CHjBr); 3,44 (2Н, триплет, -CHjO-); 4,47 (2И, синглет, ); 7,28 (5Н, Н бензольного кольца).
5
0
ч1А24729
18б. По методике ссылочного примера 17в, используя соединение, полученное
на предшествующей стадии 18а получают 13-бензилокси-1-(3,4-дибензш1- оксифеннл)тридекан-1-ол, т,пл, 51-
53 С.
Вычислено, %: С 80,77; В 8,47.
50 4
Найд ено, %: С 81.01; Н 8,74. ю Ссылочный пример 19А (исходное
вещество, используемое в примере 25А) . 19а, По методике ссылочного примера
16а, используя 1,8-дибромоктан по1 2
мешивании и охлаждении льдом раствор 3,06 г диметилового эфира 2-оксооктш1
фосфоновой кислоты в 10 МП диметокси- этана. После добавления в реакционную
смесь 5 мл диметилсульфоксида и перемешивании 1 ч при комнатной температуре добавляют по каплям раствор
2,22 г 3,4-диацетоксибензальдегида в 10 мл диметоксиэтана и полученную
смесь перемешивают .3 ч при комнатной температуре. Затем добавляют 400 мп
воды, дважды экстрагируют эфиром, каждьй раз по 50 мл, экстракт промы20
лучен 8-бензилокси-1-бромоктан, в ви- 15 вают водой, высушивают над безводным де маслообразного продукта.
Спектр ЯМР (в CDCL, ТМС, ррт); 1,1-2,1 (12Н, -(СН.,) 3,38 (2Н, триплет, ); 3,44 tZH, триплет,
-CHjO -); 4,47 (2Н, синглет,); 7,28 (5Н, Н бензольного кольца).
196. По методике ссылочного примера 17в, используя соединение, полученное
на стадии 19а, получают 9бензилокси-1- (3,.4 бензилоксифеннл)но- 25 получены соединения ссылочных при-
нан-1-ол, т.пл. 46-48 С.меров 22-24.
Вычислено, %: С 80,26; Н 7,86. Ссыпочный пример 22 (исходное весульфатом
магния и концентрируют при пониженном давлении. Остаток подвергают
колоночной хроматографии на сн- ликагеле (120 г) с применением в качестве
злюента смеси толуола с этил - ацетатом и получают 2,67 г 1-(3,4-
диацетоксифенил)нон-1-ен-З-она.т. пл. 71-72°С.
По методике ссылочного примера 21
Найдено, %: С 80,08; Н 7,90.
Ссылочный пример 19Б (исходное вещество , используемое в примере 25Б).
19а. По методике ссылочного примера 17а и 176, используя нонандиол, получают 9-бензилокси-1-хлорнонан,
т.пл. 128-130 р/0,6-0,7 мм Hg.
196. По методике ссылочного приме-
ра 17в, используя 9-6ензилокси-1- хлорнонан, получают 10-6ензилокси-1-
(3,4-дибензилоксифенил декак-1-ол, т.пл. 45-47°С.
Вычислено, %: С 80,40; Н 8,02.
С-)7Н4404
Найдено, %: С 80,30; Н 8,02.
Ссьшочный пример 20.(исходное вещество
, используемое в примере 26).
.По методике ссылочного примера 17в,
используя 4-6ензилокси-3-метокси6енз- альдегид и 10-бензилокси-1-хлордекан,
получают 11-бензилокси-1-(4-6ензил- окси-3-метоксифенил)ундекан-1-ол, т.пл. 43-45 С.
Вычислено, %: С 78,33; Н 8,63.
щество, используемое в примере 28).
1-(3,4-Диацетоксифенил)-4-мет1Ш- 2Q окт-1-ен-З-он, маслообразный продукт .
Спектр ЯМР (в CDC1,, внутренний стандарт ТМС, ррт): 0,89 (ЗН); 1,05-
1,9 (9Н);. 2,8 (6Н); 2,75 (1Н); 6,6- 7,7 (5Н).
Ссылочный пример 23 (исходное вещество , используемое в примере 29).
1-(3,4-Диацетоксифенил)-4-мет1ш- нон-1-ен-З-он, маслообразный продукт.
Спектр ЯМР (в CDClj, внутренний стандарт ТМС, ррт): 0,88 (ЗН); 1,05-
1,9 (11Н); 2,3 (6Н);. 2,77 (1Н); 6,66- 7,7 (5Н).
Ссыпочный пример 24 (исходное вещество , используемое в примере 30).
1-(3,4-Диацетоксифенил)дец-1-ен- 3-он, т.пл. 66-67 С.
Вычислено, %: С 69,34; Н 7,56.
40
45
50
Сго
Найдено, %: С 69,38; Н 7,72.
Ссылочный пример 25 (исходное вещество , применяемое в примере 31).
К раствору 1,27 г 3,4-дибензилок- сибеизальдегида в 150 мл тетрагидро-
фурана добавляют по каплям реактив 55 Гриньяра, приготовленного из 10,4 г
2-метил-2-(6-бромгексил)-1,3-диокса- лана и 1,1 г магния, при температуре
ниже 5 С. После перемешивания смеси
С Я Н 410 4
Найдено, %: С 78,24; Н 8,62,
Ссыпочный пример 21 (исходное вещество
, используемое в примере 27).
К смеси 400 г гидрида натрия в
масле (60%) и 50 мп 1,2-диметокси- этана добавляют по каплям при пере1 2
мешивании и охлаждении льдом раствор 3,06 г диметилового эфира 2-оксооктш1-
фосфоновой кислоты в 10 МП диметокси- этана. После добавления в реакционную
смесь 5 мл диметилсульфоксида и перемешивании 1 ч при комнатной температуре добавляют по каплям раствор
2,22 г 3,4-диацетоксибензальдегида в 10 мл диметоксиэтана и полученную
смесь перемешивают .3 ч при комнатной температуре. Затем добавляют 400 мп
воды, дважды экстрагируют эфиром, каждьй раз по 50 мл, экстракт промывают
водой, высушивают над безводным
вают водой, высушивают над безводным
сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают
колоночной хроматографии на сн- ликагеле (120 г) с применением в качестве
злюента смеси толуола с этил - ацетатом и получают 2,67 г 1-(3,4-
диацетоксифенил)нон-1-ен-З-она.т. пл. 71-72°С.
По методике ссылочного примера 21
ество, используемое в примере 28).
1-(3,4-Диацетоксифенил)-4-мет1Ш- кт-1-ен-З-он, маслообразный проукт .
Спектр ЯМР (в CDC1,, внутренний стандарт ТМС, ррт): 0,89 (ЗН); 1,05-
1,9 (9Н);. 2,8 (6Н); 2,75 (1Н); 6,6- 7,7 (5Н).
Ссылочный пример 23 (исходное вещество , используемое в примере 29).
1-(3,4-Диацетоксифенил)-4-мет1ш- нон-1-ен-З-он, маслообразный продукт.
Спектр ЯМР (в CDClj, внутренний стандарт ТМС, ррт): 0,88 (ЗН); 1,05-
1,9 (11Н); 2,3 (6Н);. 2,77 (1Н); 6,66- 7,7 (5Н).
Ссыпочный пример 24 (исходное вещество , используемое в примере 30).
1-(3,4-Диацетоксифенил)дец-1-ен- 3-он, т.пл. 66-67 С.
Вычислено, %: С 69,34; Н 7,56.
Сго
Найдено, %: С 69,38; Н 7,72.
Ссылочный пример 25 (исходное вещество
, применяемое в примере 31).
К раствору 1,27 г 3,4-дибензилок-
сибеизальдегида в 150 мл тетрагидро- фурана добавляют по каплям реактив
Гриньяра, приготовленного из 10,4 г 2-метил-2-(6-бромгексил)-1,3-диокса-
лана и 1,1 г магния, при температуре ниже 5 С. После перемешивания смеси
2 ч при комнатной TeNmepaType к ней добавляют воду, подкисляют разбавленной
соляной кислотой и экстрагируют толуолом. Экстракт промьшают водой, высушивают над безводным сульфатом
магния и концентрируют при пониженном давлении. К остатку добавляют 300 МП ацетона и 0,1 г п-толуол-
сульфокислоты, полученную смесь пере- мешивают в течение 1 сут при комнатной
температуре и концентрируют при пониженном давлении. Остаток экстрагируют толуолом, экстракт промывают
5%-ным водным раствором гидрокарбо- ната натрия, затем водой, высушивают
над, безводным сульфатом магния и концентрируют при пониженном давлении с
получением маслообразного продукта.
который подвергают колоночной хрома
тографии на силикагеле (500 мл) с применением в качестве элюента смеси толуола
с этилацетатом (19:1),и получают 4,4 г 1-(3,4-дибензш1оксифеш1л) - нонан-1,8-дион, т.пл, 64-66 С.
Ссыпочньш пример 26 (исходное вещество , используемое в примере 32).
Раствор 0,8 г 1-(3,А-дибензил-окси- фенил)нонан-1,8-диона в 10 мл тетра-
гидрофурана добавляют при охлаждении льдом к раствору 0,1 г литийалюминий-
гидрида в 50 МП эфира, после чего смесь перемеппгвают 2 ч при комнатной
тe mepaтype. Затем к реакционной смеси прибавляют 50 мп толуола и подкисляют
добавлением разбавленной соляной кислоты. Раствор толуола отделяют, промывают 5%-ным водным раствором
бикарбоната натрия, затем водой, высушивают над безводным сульфатом
магния и концентрируют при пониженном давлении с получением в виде масла 0,8 г 1(3,4-ди-бензилоксифе-
|нил)нона-1,8-диола.
Спектр ЯМР (в CDCl,, ТМС, ррт):
1,05-1,8 (15Н); 3,8-4 (1Н); 4,56(1Н) 5,18 (2Н); 5,2 (2Ю; 6,8-6 (13Н).
Ссыпочный пример 27 (исходное вещество , используемое в примере 33).
27а. По методике ссыпочного примера 25, используя реактив Гриньяра, приготовленный из 3 г 3,5-дибензил-
оксифенилбензапьдегида, 2,5 г 2-ме- тил-(7-бромгептил)-1,3-диоксапана и
0,3 г магния, получают 0,8 г 1-(3,4- дибензилоксифенил)декан-1,9-диона, т.пл. 72-74°С.
276. По методике ссыпочного примера 26, используя 1 г 1-(3,4-дибензил
Q g
0
5
п
5
5
0
оксифенил)декан-1,9-диона в качестве исходного соединения, получают 1 г
1-(3,4-дибензилоксифенил)декан-1,9- диола, т.пл. 66°С.
Ссьоточный пример 28 (исходное вещество , используемое в примеру 34) .
По методике ссылочного примера 25, используя 8 г 3,4-дибензнпоксибенз-
альдегпда и реактив Гриньяра, приготовленный из 8 г 2-этил-2-(6-бром-
гексил)-,3-диоксалана и 850 иг магния , получают 2 г 1-(3,4-дибензил-
окси)декан-1,8-диона, -т.пл. 67-68 С,
Ссьшочный пример 29 (исходное вещество
, используемое в примере 35).
29а. Смесь 640 мг гидрида натрия
в масле (60%) и 10. мл диметилсул1)фок- сида перемешивают 45 мин при 75-80 С.
После охлаждения смеси к ней добавляют раствор 8,2 г 8-зтилендиоксино-
нилтрифенилфосфонийбромида, приготовленного из 2-метил-2-( 7-бромгептш1)-
1,3-диоксалана я трифенилфосфина, в 50 мл диметилсульфоксида. Через 10 мин
к смеси добавляют раствор 2,5 г 3,4- дибензилоксибензальдегида в 10 мп
диметилсульфоксида при комнатной температуре и перемешивают в течение
1 сут. Затем к реакционной смеси добавляют 500 мл воды и полученный про-
дукт экстрагируют эфиром. Экстракт промывают водой, высушивают над безводным
сульфатом магния и концентрируют при пониженном давлении с получением
маслообразного продукта, который подвергают колоночной хроматографии
на силикагеле (200 мл с применением в качестве элюента смеси hf-гек-
сана с эфиром (1:1) и получают 1,4 г 1-(3,4-дибензилоксифенил)-9-этнлен- диоксидец-1-ена.
Спектр ЯЬ (в CDC1,, ТМС, ррт): 1,05-1,8 (11Н); 1,9-2,4 (2Н); 3,85
(4Н); 5,04 (4Н); 6-7,5 (15Н).
296. Смесь 1,4 г 1-(3,4-дибензш1-
оксифенил)-9-этилендиоксидец-1-ена, 50 мл ацетона и 50 мг п -толуолсуль-
фоновой кислоты перемешивают в течение 1 сут при комнатной температуре.
Затем после добавления 50 мг карбоната натрия реакционную смесь концентрируют
при пониженном давлении после добавления 50 мг карбоната натрия реакционную смесь концентрируют при
пониженном давлении и после добавления 50 МП воды экстрагируют толуолом.
Экстракт промывают водой, высушивают над безводным сульфатом магния и кон10
1514247291Ь
центрируют при пониженном давлении с промывают водой, высушивают над без-
получением 1,1 г 1-(3,4-дибензилокси- водным сульфатом магния и раствори- фенил)дец-1-ен-9-она в виде масла.
Спектр ЯМР (в CDC1,, ТМС, ррт): 1,05-1,8 (8Н); 2,1 (ЗН); 2,1-2,6 (4И); 5,16 (4Н); 7-7,6 (15Н).
, Ссылочный пример 30 (исходное вещество , используемое в примере 36) .
По методике ссылочного примера 1а, используя 1,2 г 4-бензипокси-З-меток-
сибензальдегида и 1,53 г диметилового эфира 2-оксооктилфосфоновой кислоты,
получают 1,27 г 1-(4-бензилокси-3- метоксифенил)нон-1-ен-3-она, т.пл. .78-31 С.
Ссылочный пример 31 (исходное вещество , используемое в примере 37).
31а. К раствору 1,2 г 1-(3,4-ди- гидроксифенил)ионал-3-она в 10 ьш ди- -п
мгтилформамида добавляют 200 мг гидрида натрия в масле (60%) и после перемешивания
смеси 15 мин при комнатной температуре к ней добавляют 0,9 г
бромистого бензила, после чего пере- 25 экстрагируют 30 мп толуола. Экстракт
мешивают 15 мин при комнатной темпера- промывают водой, выс тиивают над без- туре. Затем добавляют еще 200 мг гидрида
натрия в масле (60%), перемешивают 15 мин при комнатной температуре, добавляют 0,9 бромистого бензила и
тель отгоняют при пониженном давлении с получением 1,6 г 1-(3,4-д11бг н-
зилоксифенил)-3-метил-нона 1-3-ола.
Спектр ЯМР (в CDC1,, ТМС, ррт):
0,88 (ЗН, -СН,); 1,1-1,9 15H, --CHj-COH(CH,)-(CH,)5-,l; 1,18 (ЗН, -СН,); 2,4-2,8 (211, ) ; 5,08
(4Н, -OCHjX 2); 6,5-7,6 (13Н).
Ссылочньй пример 32-(исходное вещество
, используемое в примере 38).
Раствор 0,4 г 3-3,4-дибензилокси-
5 фенил пропиоальдегида в 5 мл безводного тетрагидрофурана охлаждают до
0-5°С, после чего к нему добавляюТ 5 МП эфирного раствора циклогексил-
магиийбромида, приготовленного 0,12 г металлического магния и 0,82 г Oi-.i-
мистого циклогексила. Затем реакционную смесь перемешивают 13 мин и
после добавления к ней 50 мл 5%-Н()ГО водного раствора соляной кислоты
. 30 продолжают перемешивание 1,5 ч при
комнатной температуре. После доба1 ле-
ния к реакционной смеси 50 мл воды продукт экстрагируют толуолом. Экстракт
промывают водой, высушивают над безводным сульфатом магния и раство-
{ итель отгоняют при пониженном давлении . Полученный остаток подвергают
колоночной хроматографии на силика- геле с применением в качестве °элюводным сульфатом магния, растворитель отгоняют при пониженном давлении с получением маслообразного продукта,
который подвергают колоночной хроматографии на силикагеле с применением
в качеств е элюента толуола и получают 0,2 г 3-(3,4-дибензилоксифен1ш)-1-
циклогексилпропан-Т-ола, т.пл. 107- .
Вьиислено, %: С 80,89; И 7,96.
С 27 1Цо О э
Найдено, %: С 80,88; И 8,15.
Пример 1. В 20 мл этанола растворяют 0,4 г 1-(3,4-дибензилокситолуола и получают 1,8 г 1-(3,4- фенил)-4-метилокт-1-сн-3-ола и полуеита
дибеНзилоксифенил)нона-3-она в виде
липкого продукта.
Спектр ЯМР (в CDClj, ТМС, ррт): 0,87 (ЗН, -СН,); 1,05-1,8 8Н,
-(СН,) 1,3 (2 Н, ); 2,55- 2,85 4Н, (0)СН, 5,07 (4Н, 2); 6,5-7,5 (13Н).
316. Раствор 1,75 г 1-(3,5-ди- бензилоксифенил нонан-3-она в 10 мл тетрагидрофурана охлаждают до 0-5С,
после чего к нему по каплям добавляют реактив Гриньяра, приготовленный из 0,24 г металлического магния и
1,7 г йодистого метила. Затем полученную смесь перемешивают 15 мин и
после добавления 50 мл 5%-ного водного раствора соляной кислоты продукт экстрагируют толуолом. Экстракт
чеиный раствор ката.титически восстанав ливают при комнатной т,еьтературе и
атмосферном давлении, используя 0,1 10%-ного палладия на угле в качестве
катализатора, до прекращения поглоще ния водорода. Пос.че окончания реакци
катализатор отфильтровывают, а фкльт рат концентрируют при понюкенном дав
лении с получением 0,23 г (1-3, -«-ди гидроксифен1-ш) -4-метилоктал-3-ол.п.
Спектр ЯМР (в CDC1,, внутренний стандарт, ТМС, ррт): 0,7-1,8 (1 5Н);
2,57 С2Н); 3,45 (1Н); 6,4-6,8 (311). П р и- м е р 2. По методике иримс
55 ра 1, используя 0,85 г 1-(3,4-дибен- зилоксифенил)нон-1-ен-3-ола,
0,4 г 1-(3,4-дигидроксилфеиш1)нонан- 3-ола.
0
промывают водой, высушивают над без- водным сульфатом магния и раствори-
-п
25 экстрагируют 30 мп толуола. Экстракт промывают водой, выс тиивают над без-
тель отгоняют при пониженном давлении с получением 1,6 г 1-(3,4-д11бг н-
зилоксифенил)-3-метил-нона 1-3-ола.
Спектр ЯМР (в CDC1,, ТМС, ррт):
0,88 (ЗН, -СН,); 1,1-1,9 15H, --CHj-COH(CH,)-(CH,)5-,l; 1,18 (ЗН, -СН,); 2,4-2,8 (211, ) ; 5,08
(4Н, -OCHjX 2); 6,5-7,6 (13Н).
Ссылочньй пример 32-(исходное вещество
, используемое в примере 38).
Раствор 0,4 г 3-3,4-дибензилокси-
5 фенил пропиоальдегида в 5 мл безводного тетрагидрофурана охлаждают до
0-5°С, после чего к нему добавляюТ 5 МП эфирного раствора циклогексил-
магиийбромида, приготовленного 0,12 г металлического магния и 0,82 г Oi-.i-
мистого циклогексила. Затем реакционную смесь перемешивают 13 мин и
после добавления к ней 50 мл 5%-Н()ГО водного раствора соляной кислоты
экстрагируют 30 мп толуола. Экстракт промывают водой, выс тиивают над без-
водным сульфатом магния, растворитель отгоняют при пониженном давлении с
получением маслообразного продукта, который подвергают колоночной хроматографии
на силикагеле с применением в качеств е элюента толуола и получают 0,2 г 3-(3,4-дибензилоксифен1ш)-1-
циклогексилпропан-Т-ола, т.пл. 107- .
Вьиислено, %: С 80,89; И 7,96.
С 27 1Цо О э
Найдено, %: С 80,88; И 8,15.
Пример 1. В 20 мл этанола растворяют 0,4 г 1-(3,4-дибензилоксичеиный
раствор ката.титически восстанавливают при комнатной т,еьтературе и
атмосферном давлении, используя 0,1 г 10%-ного палладия на угле в качестве
катализатора, до прекращения поглощения водорода. Пос.че окончания реакции
катализатор отфильтровывают, а фкльт- рат концентрируют при понюкенном давлении
с получением 0,23 г (1-3, -«-ди гидроксифен1-ш) -4-метилоктал-3-ол.п. Спектр ЯМР (в CDC1,, внутренний
стандарт, ТМС, ррт): 0,7-1,8 (1 5Н); 2,57 С2Н); 3,45 (1Н); 6,4-6,8 (311).
П р и- м е р 2. По методике иримс55 ра 1, используя 0,85 г 1-(3,4-дибен- зилоксифенил)нон-1-ен-3-ола,
0,4 г 1-(3,4-дигидроксилфеиш1)нонан- 3-ола.
Спектр ЯМР (в CDClj, внутренний стандарт ТМС, ррга): 0,8-1,9 (1Н); 2,55 (2Н); 3,6 (1Н); 6,4-6,8 (ЗН).
При мер 3. Используя в качестве катализатора 0,2 г 10%-ного
палладия на угле, кэталитичеси восстанавливают при комнатной тe mepaтy
ре и атмосферном давлении до прекращения поглощения водорода 0,5 г 1- (3,А-дибензилоксифенил)нон-1-ен-З-он
в смеси 10 МП метанола и 10 мл этил- ацетата. Затем катализатор отфильтровывают
, а фильтрат концентрируют при пониженном давлении. Остаток подвергают колоночной хроматографии на
силикагеле с применением в качестве элюента смеси толуола с этилацетатом
(10:1) и получают белые кристаллы 1-(3,4-дигидроксифенилнонан-3-она, ЗО-ЗЗ С.
С 71,9; Н 8,86.
т.пл.
Вычислено,
С,Н„0, Найдено, %i
С 71,66; Н 8,77.
Пример 4.В смеси 30 мп этилацетата и 5 мл этанола растворяют 1,5 г 1-(3,4-дибензилоксифенил)-
пентедец-1-ен-3 оиа Н растворенное соединение каталитически восстанавливают при комнатной температуре и
атмосферном давлении с применением в качестве катализатора 0,2 г
10%тного палладия на угле до прекращения поглощения. Затем катализатор
отфильтровывают, а фильтрат концентрируют при пониженном давлении. Остаток
подвергают колоночной хроматографии на силикагеле с применением в качестве элюента смеси толуола с
этилацетатом (10:1) и получают 0,55 г 1-(3,4-дигидроксифенил)пентадекан-
З-она-в виде белых кристаллов, г.пл. 67-68 С.
Вьиислено, %: С 75,41; И 10,24.
1
Найдено, %: С 75,12; Н 10,38.
После конца элюирования 1-(3,4-ди- гидроксифенил)пентадекан-3-она элюиро
вание продолжают с использованием в качестве элюента и толуола и получают
0,1 г 1-(3,4-дигидроксифенил)пентада- кан-3-ола в виде белых кристаллов, т.пл. 63-64 С.
Вычислено, %: С 74,95; Н 10,78.
с„1Ч,о,
Найдено, Z: С 74,88; Н 10,78. По методике примера 4 полу1ены соединения примеров 5-8.
Пример 5 (используя соединение ссыпочного примера 4).
1-(3,4-Диоксифенил)-Д-этил-3-ок- таион), маслообразный продукт, выход 65%.
Спектр ЯМР (в СОСЦ, внутренний стандарт ТМС, ррт): 0,6-1,8 (14Н); 2,3 (1Н); 2,67 (4Н); 6,4-6,8 (ЗН).
1-(3,4-Диоксифенил)-4-этил-З-октанол (б), маслообразный продукт, выход
Спектр ЯМР (в CDClj, внутренний стандарт ТМС, ррт): 0,85 (6Н); 1,1-
1,9 (11Н); 2,67 (2Н); 3,63 (1Н); 6,4- 6,7 (ЗН).
Пример 6,(применяя соеди е-
ние ссылочного примера 5).
1 -(3,4-Диоксифенил) -3 -гексанон(а),
т.пл. 37-39 С, выход 60%.
Вычислено, %: С 69,21; Н 7,74. ibO,
Найдено, %: С 68,94; Н 7,91. 1-(3,4-Диоксифенил)-3-гексанол(б),
маслообразный продукт, выход 10%.
Спектр ЯМР (в CDCl, внутренний
стандарт ТМС, ррт): 0,9 (ЗН); 1,1- 1,9 (6Н); 2,6 (2Н); 3,75 (1Н); 6,6- 6,9 (ЗН).
Пример 7 (используя соединение ссыпочного примера 6).
1-(3,4-Диоксифенил-3-октанол(а), т,пл. 53-55 С, выход 63%.
Вычислено, %: С 71,16; Н 8,53.
Сд4 НгоО-
Найдено, %: С 70,87; Н 8,74.
1-(3,4-Диоксифенил)-3-октанол, маслообразный
продукт, выход 11%.
Спектр ЯМР (в CDC1,, внутренний
стандарт ТМС, ррт): 0,9 (ЗН); 1,1- 1,9 (ЮН); 2,6 (2Н); 3,65 (1Н); 6,5- 6,9 (ЗН).
Л р и м е р 8 (на основе соединения ссылочного примера 7).
1-(3,4-Диоксифенил)-3-деканон(а), т,пл. 65-6б С, выход 65%.
Вычислено, %: С 72,69; Н 9,15.
С ,
Найдено, %: С 72,42; Н 9,48.
1-(3,4-Диоксифенил)-3-деканол(б),
маслообразный продукт, выход 10%.
Спектр ЯМР (в CDC1,, внутренний
стандарт ТМС, ррт): П,9 (ЗН); 1,1- 1,9 (14Н); 2,6 (2Н); 3,65 (1Н); 6,5- 6,9 (ЗН).
По методике примера 1 получаются соединения примеров 9-11.
9142472920
Пример 9. 1-(3,4-Диоксифе-виде маслообразного продукта 0,1, г
нил)-3-у щеканол, т.пл. 45-А7 с, вы-1-( 3, А-диоксмФоиил)-Д-дсканол, 89%.
ход 69%.
Вычислено, %: С 72,82j Н 10,06.
CH HjeO,
Найдено, %: С 72,76; Н 10,29.
Пример 10. 1-(3,4-„Диоксиф нил)-3-додеканол, т.пл. 53-55°С, выход 80%.
Вычислено, %: С 73,43; Н 10,27.
С,8Н,сО,
Найдено, %: С 73,48; Н 10,47. Пример 11. 1-(3,4-Диоксифенил )-4-метш1-3-нонанол, маслообразн
продукт, выход 85%.
Спектр ЯМР (в CDC1,, внутренний стандарт ТМС, ррт): 0,7-1,9 (17Н); 2,48-(2Н); 3,55 (1Н); 6,5-6,9 (ЗН).
По методике примера 3 получают соединение примера 12.
Пример 12. 1-(3,4-Диоксифеннл 4-метил-З-октанон, маслообразный продукт, выход 70%.
Спектр ЯМР (в CDC1,, внутренний стандарт ТМС, ррт): 0,6-1,8 (12Н);
2,5 (1Н); 2,74(4Н); 6,4-6,8 (ЗН).
Пример 13. Раствор 0,5 г
1-(3,4-дибензилоксифенил)декан-3-ол в 10 мл этанола каталитически гидрируют
с использованием в качестве кализатора 0,2 г 10%-ного палладия на
угле при комнатной температуре и атмо-бензилоксифенил)-1-циклогексил-1сферном
давлении до прекращения погло-этанола, получают 0,06 г 2-(3,4-дищения водорода. После окончания реак-оксифенил)-1-циклогексил-1-этанола,
ции катализатор отфильтровьшают, ат.пл. 106-10В°С, выход 89%. фильтрат концентрируют при пониженном Вычислено, %: С 71,16; Н 8,53.
давлении с получением 0,28 г 1-(3,4- - диоксифенил)-2-деканол в виде маслоCM
Найдено,%: С 70,99; Н 8,61.
образного продукта.
Спектр ЯМР (в CDClj, внутренний
стандарт ТМС, ррш): 0,89 (ЗН, -СН,); 1,1-1,7 (14Н, (-СНг) ); 1,62 (2Н,
-CHj-); 3,74 (1Н, -СНОН-); 6,4-6,9 (ЗН, Н бензольного кольца).
Пример 14. По методике примера 13, используя 0,3 г 1-(3,4-дибензилоксифенил )-2-ундеканола, получают,
в виде маслообразного продукта 140 мг 1-(3,4-диоксифенил)-2-ундеканона, выход 96%.
Спектр ЯМР (в CDClj, внутренний стандарт ТМС, ррт): 0,86 (ЗН, -СН,);
1-1,7 (14Н, -(СН)у-); 2,47 (2Н, ); 3,56 (2Н, -СНг-); 6,6-6,9 (ЗН, Н бензольного кольца).
Пример 15. По методике примера 4, используя 0,8 г 1-(3,4-бензил-
оксифенил)-2-декан-4-он, получают в
выход 97%.
ход 69%.
Спектр ЯМР (р CDC1,, внутренний стандарт ТСМ, ррт): 0,86 (ЗН, -СИ,);
1,1-1,8 (14Н); 1,48 (2Н, -CH,-)i 3,61 (1Н, -СНОН); 6,4-6,8 (ЗН, Н бензольного кольца).
Пример 16. По методике примера 13, используя 0,5 г 1-(3,4-бен-
зилоксифенил)-2-нонанола,-получают в виде маслообразного продукта 0,27 г
1-(3,4-диг1одроксифенил)-2-нонанола,
Спектр ЯМР (в CDCLj), внутренний
стандарт ТМС, ррга): 0,89 (ЗН, - СН); 1,1-1,7 (12Н, -(СН,)б; 1,62 (2Н,
-CHj); 3,75 (1Н, -СНОН-); 6,4-6,9 (ЗН, Н бензольного кольца).
Пример 17. По методике примера 13,используя 0,5 г 1-(3,4-дибен- зилоксифенил)-2-ундеканола, получают
0,29 г 1-(3,4-дигидроксифенил)-2- ундеканола, получают 0,29 г 1-(3,4-
дигидроксифенил)-2-ундеканола, т.пл. 56-58° С, в ыход.95%.
Вычислено, %: С 72,82; Н 10,06.. ,
HjgO, Найдено, %: С 72,70; Н 10,26.
Пример 18. По методике примера 13, используя 0,15 г 2-(3,4-дит
.пл. 106-10В°С, выход 89%. Вычислено, %: С 71,16; Н 8,53.
CM
0
5
0
5
Найдено,%: С 70,99; Н 8,61.
Пример 19. По методике примера 4, используя 0,54 г 1-(3,4-дибензилоксифенил
)-3-децен-5 -она, получают 0,28 г 1-(3,4-диоксифенил)-5- деканона т. пл. 76-78 С, выход 71%.
Вычислено, %: С 72,14; Н 9,84.
16
Найдено, %: С 72,18; Н 9,75.
Пример 20. По методике примера
13, используя 0,3 г 9-(3,4-дибензилоксифенил )-2-нонанона, получают в виде маслообразного продукта
0,16 г 9-(3,4-диоксифенил)-2-нонано- на, выход 95%.
Спектр ЯМР (в CDC1,, внутренний стандарт ТМС, ррш): 1-1,8 (ЮН); 2,16
(ЗН); 2,3-2,6 (4Н); 6,5-6,9 (ЗН).
Пример 21. К раствору 150мг
1-(3,4-дигидроксифенш1)декан-5-она в 1,5 мл добавляют при охлаждении
211А24729 . . 22
льдом 20 мг Ооргидрида натрия, после По методике примера 23 получают
чего смесьперемешивают 30 мин. За- . соединения примеров 24 и 24А, Б, тем из реакционной смеси отгоняют растворитель
и после прибавления к полученному остатку 10 мл воды экстрагируют эфиром. Экстракт высушивают
над безводным сульфатом магния и после отгонки растворителя получают белые
кристалльт 1-(3,4-диг1вдрок.сифенил) декан-5-ола, которые после добавлеПример 24 (на основе соеди нения ссылочного примера 186).
13-(3,4-Диоксифенил)-1-тридекано т.пл. 93-95°С, выход 81%.
Вычислено, %: С 73,98; Н 10,46.
С ,9.H-}i -
Найдено, %: С 73,73; Н 10,75.
Пример 25А (на основе соединения
ссылочного примера 19А, ста дия б).
ния Н-гексана отфильтровьгоают. Выход 117 мг.
Вычислено, %: С 72,14; Н 9,84.
Найдено, %: С 72,18; Н 9,75.
Пример 22. Применяя в каче-
стйе катализатора 0,1 г 10%-иого палладия на угле, каталитически восстанавливают 560 мг 1-3,4-дибеизил-
оксифенил-З-метокси-4-метилокт-1-ена в смесж 5 мл метанола и 3 мл этилаце
тата при комнатной температуре и атмосферном давлении до прекращения
поглощения водорода. Затем катализатор отфильтровьшшрт, а фильтрат концентрируют
при пониженном давлении с получением 330 мг маслообразного 1- (3,4-дигидроксифенил)-3-метокси-4-ме
тилоктана.
Спектр ЯМР (в CDC1,, внутренний стандарт ТМС, ррт): 0,7-1,9 (5Н);
2,52 (2Н5; 3,05 (1Н); 3,4 (ЗН); 6,5- 6,9 (ЗН).
Пример 23. В 40 мл уксусной
кислоты растворяют 4,4 г 11-бензил- окси-1-(3,4-дибензш1оксифе нил)-унде-
кан-1-ола и растворенного соединение каталитически восстанавливают в присутствии 1 г 10%-ного палладия
на угле при комнатной температуре и атмосферном давлении до прекращения
поглощения водорода. После окончания реакции катализатор отфильтровывают
и после добавления к фильтрату 300мл воду продукт экстрагируют дважды этилацетатом.каждый раз по 70 мл.
Экстракт промывают водой, высушивают над безводным сульфатом магния, после чего растворитель отгоняют с
получением твердого , которы перекристаллизовьшают из смеси этап- ацетата с толуолом (1:1) с получение
1,5 г 11-(3,4-дигидроксифенил)унде- кан-1-ола, т.пл. 92-93 С.
Вычислено, %: С 72,82; Н 10,06.
С IT
Найдено, %: С 73,06; Н 10,29.
По методике примера 23 получают
соединения примеров 24 и 24А, Б,
Пример 24 (на основе соединения
ссылочного примера 186).
13-(3,4-Диоксифенил)-1-тридеканол,
т.пл. 93-95°С, выход 81%.
Вычислено, %: С 73,98; Н 10,46.
С ,9.H-}i -
Найдено, %: С 73,73; Н 10,75.
Пример 25А (на основе соединения ссылочного примера 19А, стадия б).
9-(3,4-Диоксифенил)-1-нонанол, т.пл. 89-91°С, выход 73%.
Вычислено, %: С 71,39; Н 9,59.
С,,Н,,0,
Найдено, %: С 71,12; Н 9,80.
Пример 25Б,(на основе сое-
динения ссылочного примера 19Б,стадия б) .
10-(3,4-Диоксифенил)-1-деканол,
т.пл. 89-91°С, выход 70%.
Вычислено, %: С 72,14; Н 9,84.
5
0
5
0
5
0
С еН2б 5с
Найдено, %: С 71,96; Н 10,11.
Пример 26,(на основе соединения ссылочного примера 20).
По методике примера 23 получают 11-(4-окси-З-метоксифенил)-1-ундека- иол, т.пл. 72-74 с, выход 90%.
Вычислено, %: С 73,33; Н 10,72.
С,
Найдено, %: С 73,09; Н 10,26.
Пример 27. В 10 мл метанола
растворяют 830 мг 1-(3,4-диацетокси- фенил)нон-1-ен-3-оно и после добавления
к раствору 7,5 мл водного 1 и. раствора гидроокиси натрия смесь пере
мешивают 30 мин при комнатной температуре . Затем реакционную смесь ох-
лажд,ают льдом и после добавления к ней 25 мл воды подкисляют водным 1 н.
раствором соляной кислоты с образованием кристаллов, которые отделяют
фильтрованием, промывают водой с получением 580 мг 1-(3,4-дигидроксифе-
нил)нон-1-ен-3-она, т.пл. 114-115°С.
Вычислено, %: С 72,55; Н 8,12.
С isHjoO,
Найдено, %: С 72,32; Н 8.23. Пример 28. Подкисленный соляной
кислотой водный раствор, полученный по методике примера 27, но с
использованием 1 г 1-(3,4-диацетокси- фенил)4-метилокт-1-ел-3-она, дважды,
экстрагируют эфиром каждый раз по 20 мл. Экстракт промывают водой, высушивают
над безводным сульфатом магния
23
при пониженном давлеи Концентрируют
НИИ с получением маслообразного 1
(3,4-дигидроксифенил)-4-метилокт-1-е3-она , выход 0,7 г.
Спектр ЯМР (в CDCl,, внутренний стандарт ТМС, ррт): 0,88 (ЗН); 1,05- 1,9 (9Н); 2,85 (1Н); 6,59-7,7 (5Н).
Пример 29. По методике при- мера 28,используя 1 г1-(3,4-диацеток-
сифенил)-4-метилнон-1-ен-З-она, получают 0,7 г маслообразного 1-(3,4-дигидроксифенил
) -4-метилнон- 1 -ен-З-она
Спектр ЯМР (п CDClj, внутренние
стандарт ТМС, ррга): 0,88 (ЗН); 1,05- 1,9 (11Н); 2,84 (ГН); 6,59-7,7 (5Н).
Пример 30. По методике примера 27, используя 0,25 г 1-(3,4-ди- ацетоксифенил)-1-децен-3-она, получают
О,14 г (-(3,4-диоксифенил-1-де- цен-3-она, т.пл. 11б-118 с.
Вычислено, %: С 73,25; Н 8,45.
CifeH zO,
Найдено, %: С 73,30; Н 8,71.
Пример 31. Используя 0,5 г
10%-ного палладия на угле, каталитически восстанавливают при комнатной
температуре и атмосферном давлении 3,2 г 1-(3,4-дибензилокс фенил-1,8- нонандиола в 50 мл этанола и
1,5 мл 5%-ной водной перхлорной кислоты до прекращения поглощения водорода
. После завершения реакции катализатор отфильтровьшают, а фильтрат концентрируют при пониженном давлени
Остаток подвергают колоночной хроматографии на силикагеле (50 мл) с применением в качестве элюента смеси
толуола с этилацетатом (4:1). Полученные кристаллы перекристаллизовы-
вают из смеси толуола с Н-гексаном с получением 1-(3,4-диоксифенил)-8-но-
нанола, т.пл. 73-75 С, выход 1,1 г.
Вычислено, %: С 71,97; Н 8,86.
С,5 О 3
Найдено, %: С 71,91; Н 9,12.
Пример 32. По методике примера 31, используя 780 мг 1-(3,4-дибензилоксифенил )-1,8-нонандиола, получают
210 мг 1-(3,4-диоксифенил)-8- нонанола с т.пл. 58-61 С.
Спектр ЯМР (в СВС1з,ТМС, ррт): 1-1,8 (15Н); 2,48 (2Н); 3,84 (1Н); 6,5-6,9 (ЗН).
Пример 33. По методике примера 31, используя 1 г 1-(3,4-дибeн- зшloкcифeнил)-1 ,9-декандиола, получают
340 мг 1-(3,4-диоксифенил)-9- деканола, т.пл. 43-4б С.
0
2 Л
Спектр ЯМР (в CDC1,, ТОС, ррга):.
1,05-1,8 (17Н); 2,5 (2И); 3,86 (1Н); 6,5-6,9 (311).
Пример 3. По методике примера 31, используя 2 г 1-(3,4-дибеи- зилоксифенил)декан-1,8-диола, получают
200 мг 1-(3,4-дигидроксифенил)- декан-8-она с т.пл. 76-78°С.
Спектр ЯМР (в СРС,, ТМС, ррт): 1,04 (ЗН); 1-1,8 (ЮН); 2,2-2,6 (6Н); 6,5-6,9 (ЗН).
Пример 35. Пе методике примера 1, используя в качестве исходно-
5 го продукта 1,02 1-(3,4-дибензилокси- фенил)дец-1-ен-9-она, получают ,
450 мг 1-(3,4-диг1щроксифенил)декан- 9она с т.пл. 74-76°С.
Спектр ЯМР (в CDC1}, ТМС, ррга): 0 1,05-1,8 (12Н); 2,1 (ЗН); 2,3-2,52 (4Н); 6,5-6,8 (ЗН).
Пример 36. По методике примера 4, используя в качестве исходного
соединения 1,2 г 1-(4-бензилокси- 5 3метоксифенил)нон-1-ен-3-он, получают
660 мл 1-(4-г1одрокси-3-метокси- )нонан-3-она(а) в виде масла и 120 мг маслообразного 1-(4-гидрокси-
3метоксифенил)нонан-3-ола(б).
Спектр ЯМР соединения а (в СВСЦ,
ТМС, ррт): 0,9 (ЗН); 1-1,8(811); 2,4 (2Н); 2,5-3 (АН); 3,88- (ЗН); 6,5-7 (ЗН).
Спектр ЯМР соединения б (в CDC1,, ТМС, ррш): 0,9 (ЗН); 1-2 (12Н); 2,5-
2,8 (2Н); 3,4-3,8 (1Н); 3,88 (ЗН); 6,6-7 (ЗН).
Пример 37. По методике примера 1, используя 1,4 г 1-(3,4-дибен-
зилоксифенил)-3-метилнснан-3-ол, получают 0,7 г 1-(3,4-дигцдроксифенил)-
3метилнонан-З-ола, т.пл. 81-83 С. «
Вычислено, %: С 72,14; Н 9,84.
0
5
0
С 16 ,
Найдено, %: С 71,96; Н 10,06.
Пример 38. К раствору 0,5 г 1-(3,4-дигидроксифенил)-4-метилоктан-
-3-ола (см. пример 1) в 20 мл уксусной кислоты добавляют по каплям раствор
0,37 г брома в 2 мл уксусной кислоты и после исчезновения окраски брома растворитель отгоняют при
пониженном давлении. Полученный остаток экстрагируют этилацетатом. Экстракт
промывают водой, высушивают над безводным сульфатом магния и растворитель
отгоняют при пониженном давлении с получением остатка, который подвергают
колоночной хроматографии на сили25
кагеле с применением в качестве
та смеси толуола с этнлацетатом (2:1) и получают 0,5 г 1-(2-бром-3,4-гидрок-
сифенил)-4-метилоктан-3-ола, т.пл. 68-7ГС.
Вычислено, %: С 54,39; Н 7,00;
В 24,12.
C,5Hj,BrO,
С 34,12; Н 7,12;
Найдено, % В 24,40.
Пример 39. По методике примера
1, используя 3-(3,4-дибензилок- сифенил)-1-циклогексилпропан-1-ол 0,2 г, получают 3-(3,4-дигидроксифе-
нил)-1-циклогексилпропан-1-ол, т.пл. 118-119°С.
Вычислено, %: С 71,97; Н 8,86.
(«
Найдено, Z: С 71,85; Н 8,95. Пример 40. Таблетки, мг: 11-(3,4-Дигидроксифенил)-
ундекан-1-ол (далее пазы- ваемый ALT-116).50
Лактоза113
Зерновой крахмал28
Гидроксипропилцеллюлоза 4 Кальцийкарбоксиметил-
целлишоза4.
Стеарат магния1
Всего200
После реакционного смешения 50 г ALT-188,- 113 г лактозы и 28 г крахмала
к смеси добавляют 40 мл 10%-ного (мае/об) водиого раствора гидрокси- пропилцеллюлозы и полученную смесь
гранулируют методом влажного гранулирования . Полученные гранулы смешивают
с А г кальцийкарбоисиметилцеллюлозы и 1 г стеарата магния, после чего смесь
прессуют в таблетки (200 мг в таблетке ).
Пример 41. Капсулы, мг:
50
10
15
20
25
ALT-118
Кристаллическая целлюлоза20 Кристаллическая лактоза 129 Стеарат магния1 Всего 200
Указанные компоненты (каждый в 1000-кратном количестве от указанного
количества) смешивают и смесью заполняют желатиновые капсулы (по 200 мг каждая капсула).
Пример 42, Ингаляция. После растворения 0,1 г ALT-118 примерно в 90 мл смеси, содержащей
этанол, пропкленгликоль и очищенную
1424729 26
злюен- воду (в соотношении по массе 30:10: :60), объем раствора доводят до
100 мл добавлением указанной смеси, после чего полученной смесью заполняют соответствующие контейнеры (в
каждом по 10 мл), которые- запечатывают для использования в виде ингаляций .
Соединения предлагаемого изобретения активно подавляют образование и
вьщеление МДВ-А (медленно действующие вещества, вызьшающую анафилаксию),
эти соединения применяют для профилактики и лечения различных аллергических
заболеваний, например: бронхиальной астмы, аллергического ринита , крапивницы и т.д., а также ише-
мических заболеваний сердца и воспалительных процессах, вызываемых МДВ-А.
Фармакологические испытания. А. Пассивная брюшинная анафилаксия (ПБА) на крысах.
Использованный метод основан на том, что мужские особи крыс весом .
275-325 г (Shizudka Ехр. Animal Agric, Coop Assoe) сенсибилизированы
внутриюрюшинной (в/б) инъекции 5 мл разбавленной (в 40 раз) машиной анти-
30 ДНФ (2,4-динитрофенил) реакционноспо- собной сыворотки (титр РСА пассивная
кожная анафилаксия -1280). Через 4 ч вводят инъекцией (в/б) 5 мл раствора
Тирода, содержащего 250 г гепарина и 2 мг ДНФ-альбумина бычьей сыворотки.
Испытуемое лекарство (100 г/кг) вводят инъекцией в/б за 30 с до введения
ангигана в растворе 0,6 мл соли.Спустя 5 мин, крыс обезглавливают и внут-
. рибрюшинную жидкость собирают в поликарбонатные трубочки на льду вскрытием
брюшной полости. Плавающее на поверхности вещество отделяют на биологические испытания от клеточного
остатка центрифугированием в течение 5 мин при 2000 об/мин и 4°С.
Испытания на гистамин и МДВ-А проводят на изолированном илеуме (пере-
ферическая часть малого кишечника, заканчивающаяся в прямой кишке) морских
свинок в присутствии -55712 (натрий (4-ацетил-3-гидрокси-2- пропилфенокси)-2-гидроксипропоксиЗ-4- -
оксо-8-пропил-4Н-1-бензопиран-2-кар35
45
50
55
боксилат), и 10 М мепирамина соотГЛ--Т
ветственно, а также атропина.
В данном испытании 1 ед. МДВ-В соответствует
концентрации, необходимой чтобы вызвать сокращение илеума морсИспытания на гистамин и МДВ-А проводят
на изолированном илеуме (пере- ферическая часть малого кишечника, заканчивающаяся
в прямой кишке) морских свинок в присутствии -55712 (натрий (4-ацетил-3-гидрокси-2-
пропилфенокси)-2-гидроксипропоксиЗ-4- оксо-8-пропил-4Н-1-бензопиран-2-карп -6
5
боксилат), и 10 М мепирамина соотГЛ--Т
ветственно, а также атропина.
В данном испытании 1 ед. МДВ-В соответствует
концентрации, необходимой чтобы вызвать сокращение илеума морс20
ствутот о различном действии предлага- ig с известными носителями, наполнителя- емых соединений и ДНХГ.
Б, Испытания на S-липогеназу и циклооксигеназу.
Данный метод основан на испытании
на активность по отношению к S-липо- геназе фракция энзимов клеток мастци-
томы Р-815 (10 клеток/мл) инкубируют с 0,2 uCi (1- с)-арахидоновой кислоты (56,9 Ci/моль), 0,8 мМ CaCl,
2x10 М индометацина и испытуемыми лекарствами в различной концентрации
при 37°С в течение 5 мин. В случае испытания на активность в отношении циклооксигеназы из упомянутой
инкубированной смеси исключают CaCl и индометацин и инкубирование проводят
при 37°С в течение 7 мин. После экстрагирования продукта 8 объемами
этилацетата экстракт концентрируют и наносят на пластину для ТСХ. Для
25
30
ми и т.д. Дозировка этих соединений
зависит от предмета лечения, способа введения, состояния болезни, в частности
взрослому вводят 0,1-500 мг в день, п ри пероральном или парентеральном введении два или три раза в
день.
Формула изобретения
Способ получения производных ка- техина общей формулы
ОН
он II
35
X-Y-Z
где X - алкилен нормального строения, содержащий 1-11 атомов углерода
, или виниленовая группа; карбонил или радикал (OR,)R2, где R, и R, одинаковые
или различные и означают водород или низший ал- кил;
отделения ГЕТЕ и простогландинов проводят тонкослойную хроматографию в
следующей системе растворителей: петролейный эфир - диэтиловый эфир - уксусная кислота (50:50:1) и этил-
ацетат-2,2,4-триметилпентан - уксусная кислота - вода (11:5:2:10 верхняя
фаза) соответственно. Радиоактивные пятна определяют авторадиографией , соскребают и радиоактивность
подсчитывают с помощью жидкостного сцинтилляционного спектрометра. Активность
5-липогеназы и циклоокси- . геназы вьфажают как сумму радиоактивностей 5-ГЕТЕ и 5,12-ди-ГЕТЕ, а
также простаглапдин D,) PGD , PGEj и PGEj соответственно. Значения 1C 50 подсчитывают по методу Пробита.
Предлагаемые соединения в зависимости от дозировки в пределах 0,01
10|ЧМ подавляют образование продуктов 5-липогеназы и значения 1C 50 для них
приведены в табл. 2 и 3. В концентрации 10(UM эти соединения слабо по
с известными носителями, наполнителя-
ми и т.д. Дозировка этих соединений
зависит от предмета лечения, способа введения, состояния болезни, в частности
взрослому вводят 0,1-500 мг в день, п ри пероральном или парентеральном введении два или три раза в
день.
Формула изобретения
Способ получения производных ка- техина общей формулы
ОН
он II
Y
X-Y-Z
где X - алкилен нормального строения, содержащий 1-11 атомов углерода
, или виниленовая группа; карбонил или радикал (OR,)R2, где R, и R, одинаковые
или различные и означают водород или низший ал- кил;
водород, алкил нормального или изостроения, содержащий 1-12 атомов углерода, причем
сумма атомов углерода в радикалах X и Y равна по меньшей мере 3;
отличающийся тем, что
соединение общей формулы
OR,
Z
X-Y,-Z,
R - бензил;
X, -алкилен нормального строения, содержащий 1-11 атоноп углерода , алкенилен формулы или радикал формулы
-CO-CCHz); карбонил «СН-ОН или liCH-O .ниэшая алкнпьная группа;
имеет указанные значения;
причем сумма атомов углерода
Х,и
Z равна по меньшей мере подвергают восстановлению с применением
катализатора палладия на угле, возможно в присутствии хлорной кислоты .
Приоритет по признакам
13.05.83 при X - С -алкилен,
Y карбонил или -СН-; Z - алкильон
сн снсоон
(кофейная кислота)
18
СН2СН2СНСН(СН2)зСНз ОН СНз
28
СН2СН2СН(СН2)5СНз ОН
27
СН2СН2С(СН2)5СНз О
ная группа нормального или изострое- ния С, X Z 5; R, - бензил
X, - алкениленовая группа Y, - карбонил СН-ОН.
25.10.83 при X - С,,-Cj-н-алкилен;
YСИ
(
-низший алкил; X + X,- С,-Сд-и-алкилен; Y, - -СН
О -низший.алкил;
29.12.83при X - С,-С„ -н-алкилен; Z - водород; X, --CO-(CH,)jj
24.02.84при X - винилен: Z - C,-Cj-M- или изо-алкил; Z + Y 3; Х| - С,-С,, -и-алкилен.
Таблица 1
23,5
13,8
37,8
76,6
5,2
57,3
22,6
55,9
ALT-NO
Пример
Лекарство формулы
ОН
70
СН2СН2СН(СН2)7СН5 ОН
69 11
ОН
СН2 СН2 СН СИ 1СН2)4 СНз
82U
СНгС(СН2)8СНз
о
он
5215
СН2СН2СН2СН(СН2)5СНз ОН
ALT N6
Пример
Лекарство формулы
он
181
СН2СН2СН СН(СН2)зСНз он СНз
ПБА крыс (100 мг в/б) Подавление (%)
Гистамин
МДВ-А
ОН
21,6
53,6
17,6
66,6
СН СИ 1
OHCHi
он
32,7
58,9
18,4
46,2
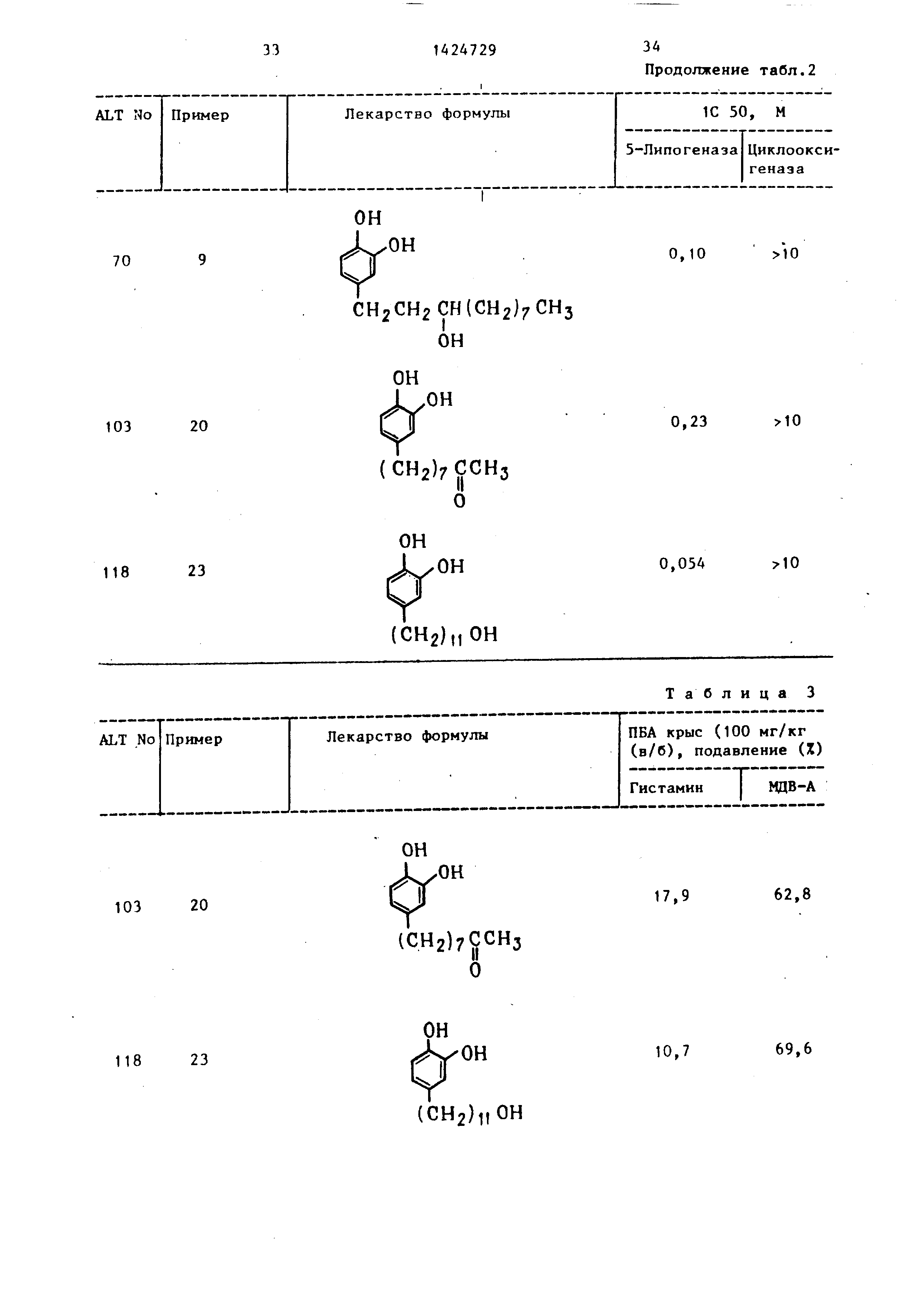
Таблица 2
1C 50, М
5-Липогеназа
Циклоокси-
геназа
0,30 Enhanced
ALT No
Пример
Лекарство формулы
70
он
СН2СН2СН(СН2)7СНз ОН
103 20
(СН2)7ССНз
о
118 23
(СН2)„ОН
ALT No
Пример
Лекарство формулы
10320
(СН2)7ССНз О
11823
1C 50, М
5-Липогеназа Циклоокси- геназа
0,10 10
он
0,
он
0,
Таблица 3
ПБА крыс (100 мг/кг (в/б), подавление (X)
Гистамин
Т
НДВ-А
он
17,9
62,8
ОН
10,7
69,6
(CH2)
117 25-а
77 29
CHlCH2)/fCH3 ОСНз
8,3
43,9
32,4




















Комментарии