Способ получения производных циклопропана - SU691076A3
Код документа: SU691076A3
Описание
(54) СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ ЦИКЛОПРОПАНА
















Реферат

Формула
Изобретение относится к способу гюлучения производных циклопропана общей формулы
% П ( -СИ-С-И где 2,и Zz водород, одинаковые ал
килы, арил, аралкил, алкенил, не сопряженный с циклопрс(пиловым кольцом
, алкинил, не сопряженный с циклопропиловым кольцом, циклоалкил,
циклоалкенил, гетероциклический остаток; R - гидроксил или группа
, OR , где R - низший алкил, .замеЩенньй или незамещенный, бензил
замещенный или незамещен ный в ариле или метилене остаток N- метилендикарб
оксимида или группа 2-R-З-метил-1-оксоциклопент -2-ен-4-ил общей формулы
HjC - R алкил, алкенил, например аляил , бутенил, пентадиенил,
алкинил, арил, аралкил, циклоалкил, циклоалкекил, например циклопентенил,
циклогексенил, гетероциклический радикал, например фУРФурил;
двухвалентный аллиловый остаток , нaпpимep общих формул 4 х
-;с«С11-сС; AS ij л - водород или низший алкил;
- алкил, аралкил, арил, алкенил, алкинил, циклоалкил , циклоалкенил, гетероциклический
радикал или образуют вместе оди
углеводородный гомоцикл содержащий 3-7 атомов углерода, ненасыщенный углеводородный гомоцикл
например циклогексенил, циклопентадиенил , гетероцикл, причем эти цикл
могут иметь один или несколько заместителей , например низший алкил или алкоксил, или образуют вместе
полициклический ароматический остаток , например флоуреновый; RI- низший алкил, например метил;
RS- водород, низший алкил или и RJ вместе образуют углеводород
ный гомоцикл, насыщенный или иенасьиденный , гетероцикл; У - метилен, углеводородная цеп
насыщеннай или ненасыщенная у - метин, углеводородная цепь насыщенная или ненасыщенная
обладаюиЕих высокой инсектицидной .активностью при малой ядовитости дл человека и животных.
i. Известны способы получения замененных циклопропанов, которые связа
вы с применением таких нестойких со динений, как диазоацетонитрил или
диазоуксусные эфиры, или характеризуются многостадийностью и малым выходом целевого продукта.
Согласно предложенному способу арилсульфинат щелочного металла общ формулы.,
, (HI) где М - щелочной металл, например натрий, калий;
Аг --арил, образованный одним или несколькими ароматичес кими кольцами , имеющими од
или несколько заместителей например низшие алкилы, алкоксилы, галогенметилы,
галогены, нитрогруппы, подвергают озаимодействию с галоид рОванным аллиловым производным общ
формулы Н-А-Х ;- Ci где X - галоген, мезиловый или тозиловый
остаток, А имеет вьааеуказанные значения в среде растворителя, например метанола
, этанола или муравьиной киЬлоты,. в присутствии щелочного агента, предпочтительно карбоната
натрия или калия с последующей обработкой полученного при этом арил аллилсульфоната общей формулы
() О О где А и АГ имеют вышеуказанные значения,
oi, fi -этиленовым сложным эфиром, замещенным в р-положении, общей
формулы ; J JH-COOR где Z. и 7,2 имеют вышеуказанные
значения, низший алкил, замещенный или незамещенный,
в среде органического растворителя, например бензола, толуола, тетрагидрофурана , Диметилсульфоксида,
ацетонитрила, в присутствии щелочного агента, например щелочного амида, гидрида или алкоголята,
образовавшийся при этом сложный эфир общей формулы Й-С11 СООВ
/ ч / R и А имеют вышегде Z.
указанные значения, гидролизуют щелочью в водно-спиртовой среде до
кислоты формулы (1), которую вылеляют в виде рацемата или оптически
активного изомера, полученного разделением рацемата известным способом.
Полученную кислоту как таковую или в виде ее функциональных производных , таких, как хлоранги 1рид,
ангидрид, смешанный ангидрид, металлическая соль, метиловый эфир, этерифицируют
соответствующим спирте известным способом. Предложенный способ позволяет получать
целевые продукты в одну стадию при использовании соединений, получение которых не представляет
больших трудностей. Получение исходных соединений. 1, З-Этил-1-пентен-З-ол.
К 615 мл раствора магнийхлористого винила в тетрагидрофуране концентрации
1,78 моль/л приливают в атмосфере азота в течение приблизительно 1 ч при температуре не выше
раствор, содержащий 93 г 3-пентанона в 100 мл сухого Тетрагидрофу рана. Массу перемешивают в течение
15ч при комнатной температуре, охлаждают до и вводят в нее 500 мл воды в вакууме при сильном
перемешивании, следя за тем, чтобы температура не превышала . Затем декантацией отделяют оргайический
слой, экстрагируют водный слой серным эфиром, соединяют органические слои и полученный раствор сушат
над сернокислым магнием. Растворители удаляют и остаток подвергают
ректификации при атмосферном давлении . При этом собирают 95 г 3-этил-1-пентен-З-ола
, т.кип. 131132 с ,п 1,4345, который используют на следующей стадии.
Аналогично получают; . из 4-гептанона - 3-пропил-1-гексен-З-ол
, .т.кип. б4-б8с/14 мм рт. ,438;
из 2,4-диметилпентан-З-оиа - 3-иэопропил-4-метил-1 .-пентен-3-ол, т.кип. ТХ-Тб С/ЗО мм рт.ст., п|
1,443;
из 2,б-диметил-4-гептанона - 3-изобутил-5-метил-1-гексен-3-ол ,
т.кип. Q1°C./2Q мм рт.ст. , Г 1,4395
из бензофенона - 1,1-дифенил-2-пропен-1-ол
, т.кип. 105-IIO C/ /0,04 мм рт.ст., и 1,593
из 4,4-диметилциклогексан-1-она-
1-ВЙНИЛ-4,4 -диметилциклогексан-1-ол т.кип.93-96С/20 мм рт.ст.
из 3,3,5, 5-тетраметилцикло1ексан-1-она - 3,3,5,5-тетраметил-1-винилциклогексан-1-ол , т.кип. 98с/
/18 мм рт.ст., . и 1,467;
из 2,3,5,6-тетрагидропиран-4-она
- 2,3,5,6-тетрагидро-4 -винил-. пиран-4-ол, т,кип. 97-ЮО С/ /21 мм рт.ст., П 1,473;
из циклобутамона - 1-винилциклобутан-1-ол , т,кип. 4б-50с/ /17 мм рт.ст., n|j 1,4590.
2. 1-Бром-3-этил-2-пентен.
В смесь, состоящую из 64 кг
З-этил-1-пентен-З-ола и 190 мл петролейного эфира, т.кип. 50-70с, вводят в течение приблизительно
1 ч при -20°С раствор 19,1 мл трехбромистого фосфора в 125 мл ,петролейного эфира, т.кип. 50-70 с
Затем перемешивают еще в течение 1,5 ч при -10°С, реакционную масс выливают в смесь соленой воды со
льдом, декантируют органический слой, промывают его водным раствором бикарбоната натрия, а затем
водным раствором хлористого натрия. Сеединенные водные слои снова экстрагируют с помощью петролейногб
эфира, экстракты присоединяют к основному органическому раствору,
полученный раствор сушат над сернокислым магнием, фильтруют, сушат и удаляют растворитель при нормальном
давлении в присутствии карбоната калин в инертной атмосфере в аппарате , оборудованном ректификационной
колонкой.
Полученный остаток подвергают ректификации при пониженном давлении
в присутствии карбоната калия в инертной атмосфере. Получают 57,175 г 1-бром-3-этил-2-пентена,
т.кип. 74с/23 мм РТ..СТ. Этот продукт используют в таком виде на следующей стадии. Продукт хранят
в инертной атмосфере над ка)бонатом калия.
Аналогично получают:
из З-пропил-1-гексен-З-ола - 1-бром-3--пропил-2-гексен , т. кип. 85
90С/17 мм рт.ст., п 1,483 и
1-бром-3-изопропил-4-метил-2-пентен;
т.кип. 92с/32 мм рт.ст., п 1,479
из 3-изобутил-5-метил-1-гексен-3-ола
- 1-бром-3-изобутил-5-метил-2-гексен , т.кип. 70-7бс/1 мм рт.ст. ц|, 1,4750
из 1,1-дифенил-2-пропен-1-ола - 1-бром-З,З-дифенил-2-пропен, т.пл.
из 2 ,б-диметил-. 1-винилциклогекСан-1-ола - 1-бром-2-(2,6-димeтилциклo0 гeкcилидeн)-этaн, т.кип. 115-120 С/ /20 мм рт.ст.
из 1-вин«л -4,4-диметиоциклогексан-1-ола - 1-бром-2-(4,4-диметилциклогексилиден )-этан, и 1,5060;
5
из 3,3,5,5-тетраметил-1-винилциклогексан-1-олг1-1-6РОМ-2-
(з, з, 5,5-тетраметилциклогексилиден )-этан, 4.кип. 87С/0,5 мм рт.ст. , п| 1,505
из 2,3,5,6-тeтpaгидpo-4-винилпиpaн0 -4-oлa - 1-бром-2-(2,3,5,6-тeтpaгидpo-4-пиpaнилидeн
)-этан, т.кип. ,5 мм рт.ст., г 1,529;
из 1-винилциклобутан-1-ола - 1-бром-2-циклобутилиденэтан , т.кип.
25
5 56-58 с/1В гФ5 рт.ст., h
1,51,60.
, . 3. 3-Метил-2-циклогексен-1-ол. I К 100 Mrt тетрагййррфураиа в атмос;фере
азота П йбавляют 8,25 г алюмо;гидрата лития и при в течение |приблизительно 40 мин приливают
0 раствор 33 г 3-метил--2-цйклогёксен-1-она в 35 мл тетрагидрофурана.
Смесь перемешивают в течение 1 ч при комнатной 1гемпературе, избыток
5
алюмогидрата лития разлагают этиловьм эфиром насыщеннкм водой, а затем
водой. Образовавшийся осадок удаляют фильтрацией, фильтрат сушат над
сульфатом магния, упаривают .досуха и получают 31,85 г 3-метил-2 цикло0 :гексен-1-ола (сырого), который в таком виде используют на следующей .- --. - - ; ,
Этот продукт представляет собой жидкость, я 1,4785.
5
Исходный З-метил-2-циклогексен-1-он может быть получен по Клацу
(Ann. 281, 94, 1894) .
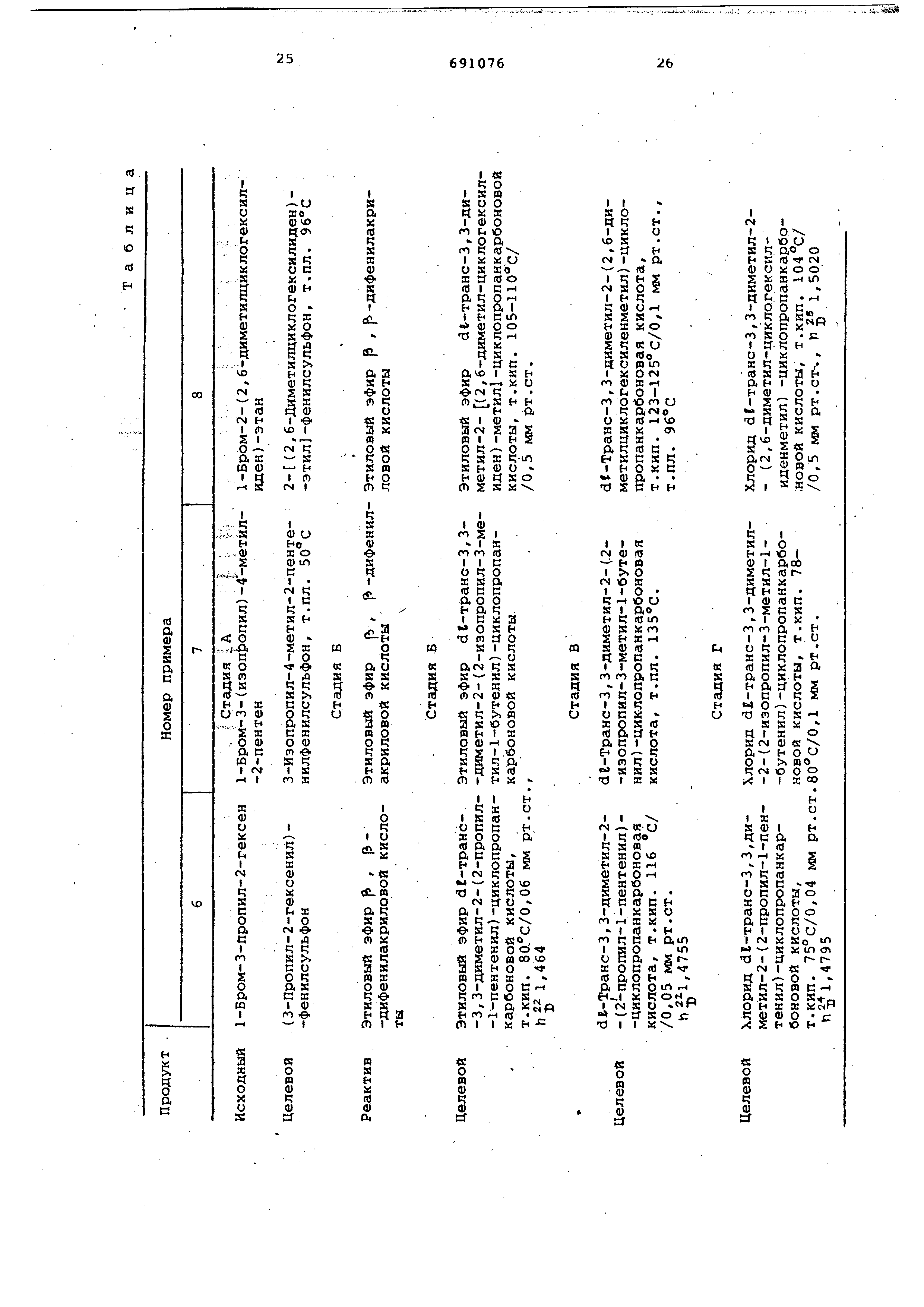
П р и м е р 1. dt-Транс-З,3-диметил-2
(2 -этил-l -бутенил)-циклопро0 панкарбоновая кислота и ее dг-aллетролоновый
эфир.
А. (З-Этил-2-пентенил)-фенилсульфон .
К суспензии 1,85 г карбоната
5 натрия и 18,5 г фенилсульфината
натрия в 60 мл метанола прибавляют в течение 30 мин при комнатной температуре
20 г 1-бром-3-этил-2-пентена . Смесь перемешивают в течение 1,5 ч при комнатной тзмпературе,
0 выливают в ледяную воду, отделяют органический слой, обрабатывают водный
слой эфиром, объединенные с органическим слоем вытяжки сушат над сульфатом магния, отгоняют раст5
воритель и получают 21,66 г (3-этил-2-пентенил
)-фенилсульфона, Пр дукт подвергают ректификации в ва кууме. Температура кипения его
125°C/Q,2 мм рт.ст., n|j 1,530. Найдено, %: С 65,4,-Н 7,6; 13,2 15 ie °2 Мол.вес. 238,34.
Вычислено, %: С 65,53 Н 7,61; 13,46. Б. Этиловый эфир dE -транс-3,3
-диметил-2-(2-этил- l-бутенил)-циклопропанкарбоновой кислоты. В 240 см диметилформамида раств
ряют 39 г трет.-бутилата калия (87%-ного), затем вводят 30 г (3-этил-2-пентенил )-фенилсульфона и
смесь перемешивают в течение 15 мин после чего прибавляют по каплям в течение Ю мин 29,1 этилового эфир
3,3-диметилакриловой кислоты. Далее смесь еще перемешивают в течение
2 ч при комнатной температуре, охлаждают до О С, выливают в смесь льда с водным разбавленным растворо
соляной кислоты, экстрагируют этило вым эфиром, соединяют эфирные растворы
, промывают их водным раствором хлористого натрия, затем водным раствором бикарбоната натрия и, на
конец, водным раствором хлористого натрия. Эфирный раствор сушат над сульфатом магния, упаривают досуха
в вакууме, затем подвергают ректиф кации при пониженном давлении и получают
25,57 г этилового эфира de-транс-3 ,З-диметил-2-(2-этил-l -бутенил )-циклопропанкарбоновой кис
лоты (сырого), т.кип. 70-72 /0,08 мм рт.ст., и 3 1,462. , В. dE-Транс-З,5-диметил-2-(2 -э
-1 -бутенил)-циклопропанкарбоновая кислота. В смесь из 100 СМ метанольног
2 и. раствора соды и 20 мл воды вводят 20 г сырого этилового эфира dE-транс-З,З-диметил-2-(2 -этил-l-
бутенил) -циклопропанкарбоновой кислоты, затем нагревают с обратным холодильником и выдерживают в
течение 1 ч. Метанол удаляют в вакууме , остаток разбавляют водой, водный слой экстрагируют этиловым
эфиром и соединяют эфирные экстракт Полученный эфирный раствор про
.мывают один раз водой. Водную вытяжку присоединяют к основному водному слою и подкисляют соединен
водные вытяжки разбавленным раство ром СОЛЯНОЙ кислоты. Подкисленный водный слой экстрагируют хлористым
метиленом. Хлористометиленовый рас вор промывают водой, сушат над сул фатом магния, а затем упаривают
досуха в вакууме. Остаток масла по вергают ректификации в вакууме и
получают 11,95 г df-TpaHc-3,3-диметил-2-{2 -этил-1-бутенил)-циклоп панкарбоновой кислоты, т.кип. /0,05 мм рт.ст., т.пл. . Образец этого продукта очищают
ректификацией в вакууме; т.кип. его 94°С/О,01 мм рт. ст., т.пл. 37°С. Найдено,%: С 73,5; Н 10,0.
Мол.вес. 196,28.. Вычислено, %; С 73,42; Н 10,27, Г. Хлорид- dP-транс-З,3-диметил-2-
(2-этил-l -бутенил)-циклопропанкарбоновой кислоты. В 10 мл петролейного эфира (т.
кип. 50-70°С ; вводят 5 г df-транс-3 ,З-диметил-2-(2-этил-1 -бутенил)циклопропанкарбоновой
кислоты, затем прибавляют 2,8 см хлористого тионила и перемешивают в течение
1,5 ч при комнатной температуре. Петролейный эфир и избыток хлористого
тирнила удаляют перегонкой, после чего смесь подвергают ректификации в вакууме и получают 5, хлорида
d,p-TpaHc-3 ,З-диметил-2- (2-этил-1-бутенил )-циклопропанкарбоновой кислоты
, т.кип. 68с/0 , 2 мм рт.ст. Д. dг-Aллeтpoлoнoвый эфир dг-транс-3 ,З-диметил-2- (2-этил-1-бутенил
)-циклопропанкарбоновой кислоты . В смесь 30 мл бензола и 6 мл пиридина
вводят 5,25 г хлорида dE-транс-3 , З-диметил-i- (2-этил-1-бутенил) -циклопропанкарбоновой
кислоты, затем при 0°С в течение приблизительно 10 мин прибавляют растаор
3,7 г dE-аллетролона в 5 см бензола . Смесь перемешивают около 15 ч
при комнатной температуре, удаляют фильтрованием образовавшийся гидрохлорид
, промывают органический слой разбавленным.водным раствором соляной кислоты, затем водой, водным
раствором бикарбоната натрия и, нако ,нец, водой. Полученный раствор сушат
над сульфатом магнием и упаривают досуха в вакууме. Остаток хром.атографируют
на окиси алюминия и при помощи элюции циклогексаном получают
5,445 г dE-аллетролонового эфира dt-транс-3 , З-диметил-2- (2 -этил-1 -бутенил
)-циклопропанкарбоновой кислоты . Этот продукт представляет собой
жидкость, П 1,4520. Найдено,%; С76,1;Н9,0. Cj HjjjOj. Мол.вес. 330,45.
Вычислено,%; С 76,32; Н 9,15. П р и м е р 2. dP-Транс-З,3-димeтил-2 (2 -изобутил-4 -метил-1 -пентенил
)-циклопропанкарбоновая кислота и ее сложный эфир с df-аллетролоном.
А. (3-Изобутил-5-метил-2-гексенил)-фенилсульфон . В 500 см метанола растворяют
55 г фенилсульфината натрия, прибавляют 8 г карбоната калия, 1 г йодида
натрия, затем 71 г 1-бром-З-изобутил-5-метил-2-гексена и перемешивают в течение 15 ч при комнатной температу ре, после чего упаривают досуха в вакууме, приливают воду, экстрагирую
водный слой хлористым метиленом, соединяют хлорметиленовые вытяжки, промывают водой полученный органичес
кий раствор, сушат его и упаривают досуха в вакууме. Остаток хроматогр фируют на кояонке с окисью алюминия
и получают 62,32 г (3-изобутил ,-5-метил-2-гексенил)-фенилсульфона. Этот продукт в литературе не опис
Б.. Метиловый эфир 3 -транс-3,3-диметил-2- (2-изобутил-4 -метил-1 -пентенил )-циклопропанкарбоновой кис
лоты . . 24,56 г 87%-ного трет.-бутилата калия растворяют в 12-0 см диметилформамида
, затем прибавляют 28 г (3-изобутил-5-метил-2-гексекил)-фени сульфона , перемешивают в течение
2 мин и вводят приблизительно в течение 10 мин. 18 мл метилового эфира f , р-диметилакриловой кислоты
. Далее перемешивают еще в течение 2ч при комнатной температуре, выливают реакционную массу в смесь раз
бавленного водного раствора соляной кислоты со льдом, экстрагируют водный
слой хлористым метиленом, соединяют хлорметиленовые вытяжки, промывают полученный органический раствор
последовательно водой, водным раствором бикарбоната натрия, водой , сушат его и упаривают досуха.
Остаток подвергают ректификации в вакууме и получают 24,68 г метиновог
эфира dfi -тpaнc-3,3-димeтил-2-(2-изoбyтил-4 -мртил-l -пентенил)-цикл пропанкарбоновой кислоты, т.кип.
113°C/1 мм рт.ст. Этот продукт в литературе не описан .
В. dP-Транс-З, З-диметил-2-(2изобутил-4 -метил-1 -пентенил -цикло пропанкарбоновая кислота.
В смесь 100 мл метанола и 10 мл воды вводят 18 мл 10 н. водного раст
вора соды, затем нагревг ют с обратн холодильником при барботировании
азота, выдерживают в течение 10 мин и прибавляют раствор 24,6 г метилового эфира dE-транс-3,3-диметил-2-
(2-изобутил-4-метил-1 -пентенил ) -циклопропанкарбоновой кислоты
в 30 мл мэтанола. Далее смесь перемешивают в течение 1 ч с обратньм
холодильником, прибавляют воду, удаляют метанол, охлаждают, экстрагируют этиловым эфиром водный слой,
соединяют эфирные экстракты, промывают полученный органический раствор водой и соединяют эту промывку с
основным водным слоем. Эфирный раствор , содержащий нейтральную фракцию, удаляют.
Соединенные водные слои подкисляю разбавленным водным раствором соляной кислоты. Кислый водный слой экстрагируют серным эфиром, эфирные экстракты соединяют, промывают
водой полученный органический раствор , сушат его и упаривают досуха.
Остаток кристаллизуют в петролейном эфире (т.кип. 35-70°С), затем
в Смеси изопропиловый эфир - петролейный эфир (т.кип. 35-70 С) и получают
d г-транс-3,З-диметил-2-(2-изобутил-4 -метил- 1 -пентенил)-циклопропанкарбоновую кислоту, т.пл.
74°С. Найдено, %: С 76,1; Н 10,9. С.,Ку.О„. Мол.вес. 252,38.
. В№1ислено,%: С 76,14; Н 11,18. Этот продукт в литературе не описан .
Г. Хлорид dг-транс-3,3-диметил-2- (2-изобутил-4-метил-1 -пентенил ) -циклопропанкарбоновой кислоты.
3 г df-транс-З,З-диметил-2-(2-изобутил-4-метил-1 -пентенил)-циклопропанкарбоновой кислоты растворяют
в 25 мл петролейного эфира (т.кип. 35-7о С) . в атмосфере азота, затем
медленно вводят 3,5 см хлористого тионила, перемешивают 1,5ч при комнатной температуре и 30 мин при
. Далее упаривают досуха в вакууме, подвергают ректификации и получают 7, 4 г хлорида dj-транс-3
,З-диметил-2-(2 -изобутил-4-метил-1 -пентенил)-циклопропанкарбоновой кислоты, т.кип. 118°С/
/1,5 мм рт.ст., М |j 1,4775. Этот продукт не описан в литературе .
Д. dC-Аллетролонового эфира de-транс-З, З- диметил-2- (2 -изобутил-4
-метил-1 -пентенил)-циклопропанкарбоновой кислоты. К 20 мл бензола прибавляют в
атмосфере азота 7,335 г хлорида dE-транс-З,З-диметил-2-(2-изобутил-4
-метил-1 -пентенил)-циклопропанкарбоновой кислоты, затем прибавляют при раствор 4 г dC-аллетролона
в смеси 8 мл пиридина и 20 мл бензола и перемешивают 15 ч при комнатной температуре, прибавляют 1 мл
муравьиной кислоты, экстрагируют водный слой этиловым эфиром, промывают
полученный органический раствор последовательно разбавленным водным раствором соляной кислоты, водным
раствором бикарбоната натрия, водой, сушат его и концентрируют досуха. Остаток растворяют в бензоле,
бензольный раствор пропускают через колонку с окисью алкминия, снова
концентрируют досуха и затем подвергают ректификации в вакууме. Получают
4,9 г df-аллетролонового эфира df-транс-3 ,З-диметил-2-(2-изобутил-4
-метил-1 -пентенил)-циклопропанкарбоновой кислоты, т.кип. 160С/ /0,07 мм рт.ст., П i 1,4950.
11
691076
Найдено,%: С 77,7; Н 9,7. C jHjgOj. Нол.вес. 386,55.
Вычислено,%: С 77,67 Н 9,91,, УФ-спектр (этанол) : . п 225 ммк ( € 20300).
Этот продукт в литературе не спи сан. Пример 3. d -Транс-3,3-диметил-2-
(2, 2-дифенилвинил) -циклопр панкарбоновая кислота и ее сложный эфир с dr-аллетролоном.
А. 3,3-Дифенйл-(2-пропенил)-фени сульфон. В 80 см метанола вйодят 15,5 г
фенилсульфината натрия, 1,5 г карбоната натрия, затем прибавляют при комнатной температуре в атмосфере
азота 25,6 г 1-бром-3,3-дифенил-2-пропена и перемешивают в течение 1,5 ч, выливают холодную воду,
экстрагируют хлористым метиленом/ соединяют хлорметиленовые экстракты
промывают водой полученный органи чёЬкиЙ раствор, сушат его и концентрируют досуха. Остаток частично
кристаллизуют. Образовавшийся осадок отжимают и получают 25,48 г 3,3-дифенил-(2-пропенил)-фенилсульфона
, т.пл. 104°С. Один образец кристаллизуют в изопропиловом эфире, т.пл, .
Найдено,%: С75,3;Н5,4;9,4. Cgg 50 . Мол .вес. 334,43. Вычислено, %: С 75,41; Н 5,42;
9,58. Этот продукт в литературе не опи сан .
Б. Этиловый эфир dH-транс-З,3-диметил-2- (2,2-дифенилвинил)-циклопропанкарбонрвой кислоты.
В 150 см диметилсульфоксида вводят в атмосфере азота 21,6г трет.-бутилата калия (87%-ного) и
28,08 г (3,З-дифенил-2-пропенил)фенилсульфона и смесь перемешивают в течение 3,0 мин при , затем
прибавляют17 , 5 см этилового эфира f) , (3-диметилакриловой кислоты.
перемешивают в течение 2 ч, прибав ляют еще 17,5 см этилового эфира диметилакриловой кислоты и переме
шивают еще в течение 7 ч при. 105с. Далее охлаждают приблизител но до 0°с, подкисляют разбавленным
водным раствором соляной кислоты, экстрагируют водный слой хлористым метиленом, соединяют хлорметиленовы
вытяжки , промывают полученный раст вор водным раствором бикарбоната н рия, а затем водой, сушат и упар
вают досуха. Остаток частично кристаллизуют, фильтруют и отделяют примеси. Маелянистый
фильтрат хроматографируют окиси алюминия в циклогексане и по луча1ют этиловый эфир dt-TpaHc-3,3
диметил-2-(2 ,2 -дифенилвинил)-цйклопропанкарбоновой кислоты, ко
12 торый употребляют в таком виде на следующей стадии.
Этот продукт в литературе не описан . В. dг-Tpaнc-3,3-димeтил-2-(2
2 -дифенилвинил)-циклопропанкарбоновая кислота. п
в 100 см метанола вводят 42,7см 2 Н. метанолового раствора соды, затем прибавляют 10 мл воды, 18,45г
этилового эфира df-транс-З,3-диметил-2- (2,2-дифенилвинил)-цйклопропанкарбоновой кислоты, нагревают
с обратным холодильником, ивыдерживают в течение 1,5 ч, после чего
метанол удаляют дистилляцией, к остатку прибавляют воду, водный слой
экстрагируют этиловым эфиром для удаления нейтральной фракции, промывают
водой- соединенные эфирные экстракты и присоединяют их к основному водному
слою. Сумму водных слоев подкисляют разбавленным водным раствором соляной кислоты, кислый водный
слой экстрагируют в несколько приемом при помощи хлористого метилена,
соединяют хлорметиленовые растворы, промывают водой полученный органический
раствор, сушат его и упаривают досуха. Получают 7,95 г df-транс-3
,3-диметил-2-(2,2-дифенилвинил)-цйклопропанкарбоновой кислоты, т.пл. 115°С.
Образец этого продукта кристаллизуют в смеси, состоящей из изопропилового и петролейного эфиров
, т.пл. 115°с. Найдено,%: С 82,1; Н 7,0. C oHgoO. Мол.вес. 292,36.
Вычислено,%: С 82,15; Н 6,89. По ЯМР-спектру этот продукт включает транспроизводное, содержащее
около10% цис-производного. Г. Хлорид df-транс-З,3-диметил-2-:
(2 ,2 -дифенилвинил)-цйклопропанкарбоновой кислоты. В 10 см бензола вводят 2,5 г
dE-транс-З,З-диметил-2-(2,2-дифенилвинил ) -цйклопропанкарбоновой кислоты
и прибавляют о , 9 см хлористого тионила , затем оставляют в течение 12мин
при комнатной температуре, нагревают до и выдерживают при этой температуре в течение 3 ч. Бензол и
избыток хлористого тионила удаляют перегонкой в вакууме. Полученный таким образом с. количественным
выходом хлорид d -транс-3 ,З-диметил-2-(2,2-дифенилвинил)-циклодропанкарбоновой кислоты употтребляют
в таком виде на следующей стадии. Этот продукт в литературе не описан
. Д. dC-Аллетролоновый эфир dB-транс-3 ,З-диметил-2-(2,2-дифенилвинил
)-цйклопропанкарбоновой кислоты. В 13 см бензола вводят сырой
хлорид df-транс-З , З-диметил-2-(2 2 -дифенилвинил)-циклопропанкарбоновой кислоты (количество соответствует
2,5 г кислоты), затем 1,2 см пиридина и 1,3 г dt-аллет ролона и перемешивают около 15 ч при
комнатной температуре. Образовавшийся осадок удаляют фильтрованием, бензольный фильтрат
промывают разбавленным водным раствором соляной кислоты, затем водой водным раствором бикарбоната натрия
и, наконец,водой. Бензольный раство сушат, а затем упаривают досуха. Остаток хроматографируют на окиси
алюминия и получают в бензольном элюате 2,034 г dE -аллетролонового эфира d -TpaHc-3,З-диметил-2-(2,
2 -дифенилвинил)-циклопропанкарбоно вой кислоты, ir 1,569, Найдено,%: С81,,2.
С29%оОз- Мол.вес. 426,53. Вычислено, %: С 81,66; Н 7,09. УФ-спектр (этанол): X макс при
227 ммк ( е 28 100) и при 262 ммк (е 17 050). Этот продукт в литературе не опи
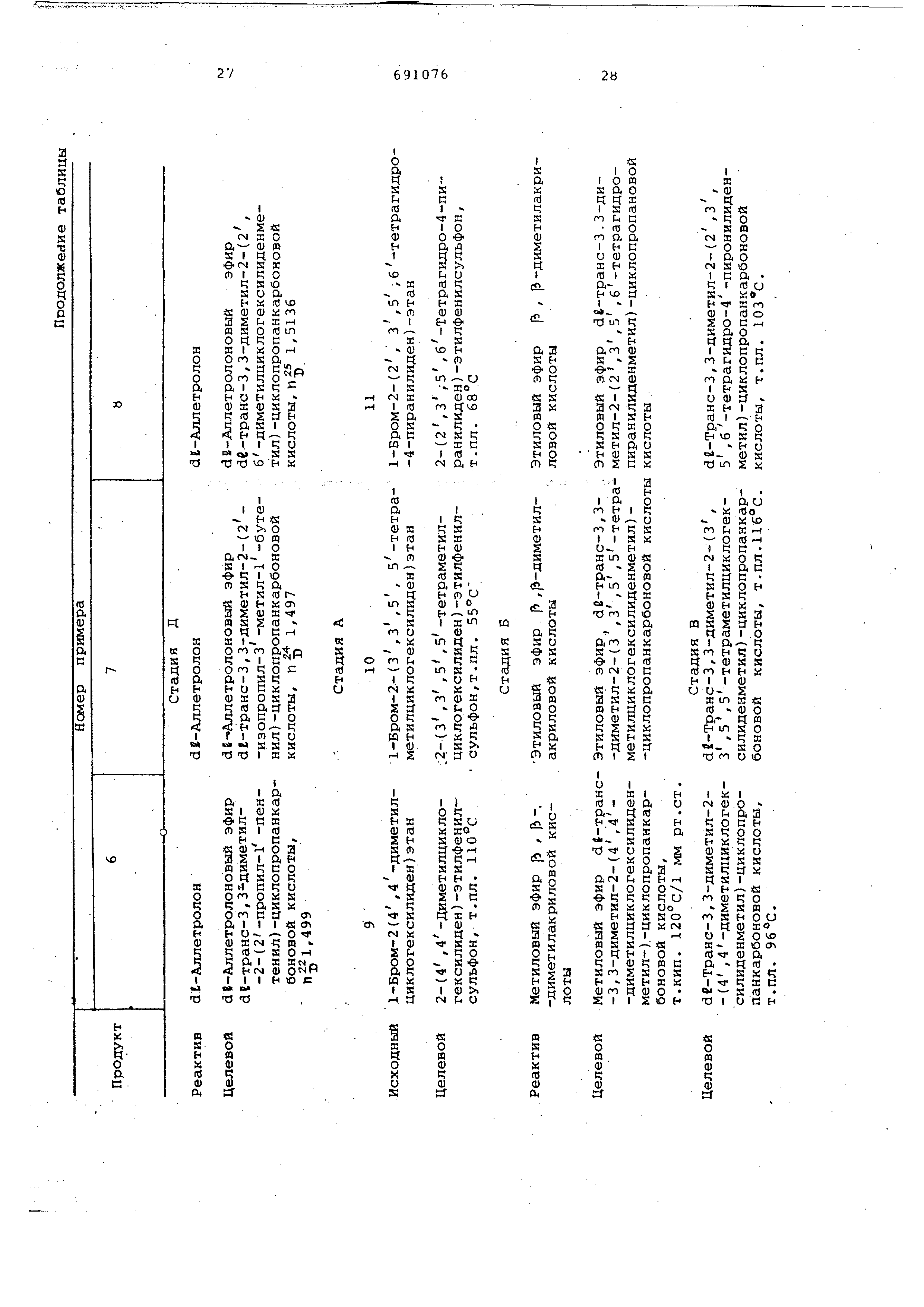
сан . П р и м е р 4. dE-транс-З,3-диметил-2-циклопентилиденметилцикло пропанкарбоновая кислота и ее сложны эфир с dE-аллетролоном. А. (2-Циклопентилидёнэтил)-фенил
сульфон. -., ,,В 50 см метанола вводят 22,3 г фенилсульфината натрия, 2,2 г карбоната
калия, 0,2 г йодида натрия и при прибавляют при переме шивании 23,6 г 1-бром-2-циклопентил
иденэтана, перемешивают в течение 2 ч при 20°С, затем реакционную
смесь выливают в ледяную воду, охлаждают до 0°С, отделяют образовав
шийся осадок выжиманием и сушат его в вакууме в присутствии поташа. Получают 15 г (2-циклопентилидёнэтил
)-фенилсульфона, т.пл. . Образец этого продукта кристаллиз ют в изопропиловом эфире: т.пл. 68°С
Найдено, %: С 65,8; н 6,8; 13,2. . Мол.вес, 236,33. .Вычислено, %: С 66,06; Н 6,82;
13,57. Этот продукт в литературе не описан .
1-Бром-2-циклопентилиденэтан может быть приготовлен по способу, описанному в BuEE. Soc. chim.Fr.1964
2618. Б. Этиловые эфиры dE-транс-З, 3-диметил-2-циклопентилиденметилцикло пропанкарбоновой кислоты. В 100 см диметилформамида вводя в атмосфере азота 16,5 г 87%-ногр
бутилата калия, затем 15 г (2-цикло пентилиденэтил)-ф&нилсульфона, CMeci
перемешивают в течение 10 мин, прибавляют к ней в течение 10 мин 16 см
этилового эфира р ,р-диметилакриловой кислоты и перемешивают в течение 3ч. Затем ее охлаждают до Ос и
выливают в разбавленный водный раствор соляной кислоты. Водный слой экстрагируют хлористым метиленом,
соединяют хлорметиленовые вытяжки, промывают их разбавленным водным раствором бикарбоната натрия, затем
водой, сушат и упаривают досуха в вакууме. Остаток подвергают ректификации
в вакууме и получают 12,28 г сырого этилового эфира de-транс-З,3-димётил-2-циклопентилиденметилциклопропанкарбоновой
кислоты,т.кип. /0,05 мм рт.ст. Этот продукт в литературе не
описан. В. dE-Tpaнc-3,3-димeтил-2-циклoпентилиденметилциклопро 1анкарбоновой кислоты.
В смесь 32 см 2 н. метанолового раствора соды и 5 см метанола вводят в атмосфере азота 12,28 г
сырого этилового эфира dj-транс-3 ,З-диметил-2-циклопентилиденметил-циклопропанкарбоновой кислоты и
нагревают с. обратным холодильником в течение 1,5 ч, затем охлаждают
до комнатной температуры, прибавляют смесь воды и льда, экстрагируют
водный слой этиловым эфиром для удаления нейтральных фракций, промывают
соединенные вытяжки водой, соединяют эти промьшные воды с основным
водным слоем, подкисляют разбавленным водным раствором соляной кислоты, экстрагируют подкисленный
водный слой хлористым метиленом, соединяют хлорметиленовые экстракты,
промывают водой полученный раствор, сушат его и упаривают досуха в вакууме .
Остаток подвергают ректификации IB вакууме и получают 5,27 dE-транс|-3
,З-диметил-2-циклопентилиденметилЬиклопропанкарбоновой кислоты, т.кип. , мм рт.ст.,
т.пл. 59°С. Найдено,%: С 74,1; Н 9,3, CiaHigOj. Мол.вес. 194,26.
Вычислено, %: С 74,19; Н 9,34. Этот продукт в литературе не описан .
Г. Xлopид de-транс-З,3-диметил-2-циклопентилиденметилциклопропанкарбоновой кислотыi А
В 10 см бензола вводят в атмосфере азота 2,5 г dE-тpaнc-3,3-диметил-2-циклопентилиденциклопропанкарбоновой
кислоты, затем приблизительно в течение 30 мин и при перемешивании прибавляют 1,04 см
хлористого тионила. Смесь Перемешивают 1 ч при комнатной температуре , избыток бензола и хлористого
тионила удаляют перегонкой, остаток подвергают ректификации в вакууме.
Получают 2,2 г сьфого хлорида dC-транс-3 ,З-диметил-2-циклопентил- , иденметилциклопропанкарбоновой кислоты
, т.кип, ,25 мм рт.ст., который используют в полученном виде в следующей стадии.
Этот продукт в литературе не опи ман. Д. dt-Аллетролоновый эфир dZ-траис-3
,З-диметил-2-циклопентилиде метилциклопропанкарбоновой кислоты. В 15 см безводного бензола вво
дят в атмосфере азота 2,2 г хлорида dC-транс-З,З-диметил-2-циклопентилиденметилциклопропанкарбоновой
кислоты и 2 см пиридина. Затем к ним в Течение -t-lO мин прибавляют
1,75 г dC-аллетролона. в 5 смбензола и СЙесь пёрэлешивают приблизйтельно в течение 15ч при комнатной тем
пературе. Образовавшийся осадок удаляют фильтрованием, бензольный фильтрат промывают соленой водой,затем
разбавленным водным раствором со ляной кислоты и снова соленой водой Водные слои экстрагируют серным эфи
ром и эфирные экстракты присоединяют к бензольному раствору. Полу .ченный. органический раствор сушат,
а затем упаривают досуха. Остаток хроматографируют на колон ке с окнсью алюминия и получают в
бензольных и хлорметиленовых элюатах 3,015 г dl-аллетролонового эфира
dE-транс-З,З-диметил-2-циклопентилиденметилциклопропанкарбоновой кислоты , h 1,5195.
, УФ-спекто (этанол): макс 225-226 ммк ( 20 700). Найдено,%: С 76,6; Н 8,40.
C2-I H2gO2 . Мол. вес. 328,43. Вычислено, %: С 76,79; Н 8,59. Этот продукт в литературе не описан
.-- - - П р и м е р 5. de-Tpaнc-3,3-димe тил-2-диклогексилиденметилциклопропанкарбоновой
кислоты и её сложного эфира с dt-аллетролоном. А. (2-Циклогексилиденэтил)-фенилсульфон
., В 116 см метанола вводят 38,5 г фейилсульфината натрия, затем
3,85 г карбоната натрия и затем прибавляют по каплям при перемешивании в течение приблизительно 30 мин
при комнатной температуре 44 г свеже приготовленного 1-бром-2-цйклогексил
иденэтана. Смесь перемешивают еще в течение 1,5ч при комнатной температуре и выливают В 400 см ледяной
воды. Образовавшийся осадок отжимают , промывают водой и сушат. Полученный сырой продукт растворяют
в горячем состоянии в смеси хлористы метилен - метанол. Полученный раствор
сушат над сернокислым магнием, концентрируют до небольшого объема
и прибавляют к нему изопропиловый эфир. Образовавшийся осадок отжимают и сушат. Получают 36,4 г
(2-циклогексилиденэтил)-фенилсульфона , т.пл. 70с. Образец этого продукта очищают
для анализа в изопропиловом эфире, т.пл. 70° С. . Найдено, %: С 67,00; Н 7,1; 12,50.
. Мол.вес. 250,35., Вычислено, %: С 67,16; Н 7,24; i2,8l.
Этот продукт в литературе не описан. 1-Бром-2-циклогексилиденэтан
может быть приготовлен по способу, описанному в Hetv. chim. (1942, 25, 29) .
Б. Этиловый эфир dt-транс-3- , 3-диметил-2-циклогексилиденметил циклопропанкарбоновой кислоты.
В 120см диметилформамида вводят 20,6 г 87%-ного трет.-бутилата калия
и затем прибавляют 20 г (2-цикло- . гексилиденэтил)-фенилсульфона. Через
10 мин прибавляют 17,3 см эгилового эфира |3 , Ь-диметилакриловой
кислоты и смесь перемешивают в течение 1 ч при комнатной температуре.
Далее охлаждают до приблизительно 5 С, подкисляют разбавленным водным
раствором соляной кислоты и экстрагируют водный слой хлористым м€ тиленом
. Полученный хлорметиленовый раствор промывают водным раствором бикарбоната натрия, затем водой,
сушат над сернокислым магнием, концентрируют досуха в вакууме и получают 22,75 г этилового эфира
dE-транс-З,З-диметил-2-циклогексилиденметилциклопропанкарбоновой кислоты
, который в таком виде используют в следующей стадии. Этот продукт в литературе не
описан. В. dЕ-Транс-3,3-диметил-2-циклогексилиденметилциклопропанкарбоновая кислота.. В смесь 70 см 2н. метанольного раствора соды, 2,5 мл воды к
25 CM метанола вводят 22,75 г этилового эфира dB -тpaнc-3,3-димeтил-2-циклoгeкcилидeнмётилциклoпpoпaнкapбoнoвoй
кислоты, смесь нагревают с обратным холодильником и: выдерживают в течение 45 мин. За.тем
удаляют в вакууме метанол прибавляют воду, отжимают образовавшийся нерастворимый
остаток (соль натрия Желаемой кислоты), промывают его водой, а затем эфиром.
Полученный продукт перемешивают до полного растворения с 100 см
разбавленного водного раствора соляной кислоты и 100 см хлористого I
метилена. Органический слой отделяют декантацией и промывают водой. Промывные воды экстрагируют еще раз хлористым метиленом. Эти экстракты объединяют с основным хлорметиленовым
раствором , сушат над сернокисльам магнием и упаривают досуха в вакууме .5
К остатку прибавляют петролейный эфир г образовавшийся осадок отжимают ,промывают петролейньлм эфиром
и сушат. Получают 1Л-транс-3,3-димётил-2-циклогексиленметилциклопро- Q
панкарбоновую кислоту, т.пл. 8в-89°С.
Найдено,%: С 75,1; Н 9,40.
Мол.вес. 208,29.
Вычислено,%: С 74,96; Н 9,67.
Этот продукт в литературе не опи- е сан.
Г. Хлорид (Зг-транс-3,3-диметил-2циклогексилиденметилциклопропанкарбоновой кислоты.
В 15 см 3 петролейного эфира, -. т .кип. 50-70°С, вводят 3 г de-транс-3
,З-диметил-2-циклогексилиденметилциклопропанкарбоновой кислоты, затем в течение приблизительно 30 мин
прибавляют 1,55 см хлористого тионила и перемешивают 1 ч при 25 комнатной температуре. Далее петролейный
эфир удаляют в вакууме, сырой хлорид кислоты подвергают ректификации в вакууме и получают 2,66 г хлорида
de-транс-З,З-диметил-2-цикло- 30 гексилиденметилциклопропанкарбоновой кислоты, т.кип. 88 90°С/
/0,35 мм рт.ст., который используют в таком виде на следующей стадии.
, Полученный продукт при комнатной 35 температуре находится в жидком состоянии .
Этот продукт в литературе не описан .
д. dЕ-Аллетролоновый эфир dS- 40 транс-3,З-диметил-2-циклогексилиденметилциклопропанкарбоновой кислоты
.
В смесь 15 см бензола и 1,9 см пиридина вводят 1,56 г хлорида dfi- дг
-транс-3,З-диметил-2-циклогекСилиденметилциклопропанкарбоновой кислоты , а затем в течение нескольких
минут . прикапывают раствор 1,050 г dB-аллетролона в 5 см бензола. -Q
Смесь перемешивают в течение л/ 15 ч при комнатной температуре, образовавшийся осадок отжимают, фильтрат
промывают последовательно разбавленным водным раствором соляной кислоты, водным раствором хлорида натрия
, водным раствором бикарбоната натрия и; наконец, водным раствором хлорида натрия.
Соединенные промывные воды экстрагируют бензолом.Бензольный экстракт Q
соединяют Е основным бензольным раствором ,сушат над сернокислым магнием,
после чего упаривают досуха в вакууме.
Остаток очищают хроматографически
на колонке с окисью алюминия ,и при 65
помощи элюации циклогексаном получают
1,500 г dE-аллетролонового эфира d -TpaHc-3,З-диметил-2-циклогексилиденметилциклопропанкарбоновой
кислоты , ч 1,515.
Найдено,%: ,С 77,4; Н 9,00.
СгаИзоОз- Мол.вес. 342,46.
Вычислено, %: С 77,15; Н 8,82.
УФ-спектр (этанол) : А уако 223 ммк ( 19500) .
Этот продукт не описан в литературе .
Исходя из различных аллильных
галоидзамещенных производных, способом , описанным в предыдущих примерах , получают:
арилаллилсульфоны (стадия А) ;
сложные эфиры низшего алкила с
циклопропанкарбоновыми кислотами (стадия Б)
циклопропанкарбоновые кислоты
(стадия В);
хлориды циклопропанкарбоновых кислот (стадия Г);
сложные эфиры этих кислот со спиртами (стадия Д).
Стадии получения и характеристики этих соединений приведены в нижеследующей таблице.
Соединения, полученные на различных стадиях, в литературе не описаны .
П р и м е р 20. de-.Цис- и транс2 ,5-триметил-спиро- 2,5}-4-октен-1-карбоновые
кислоты и сложный эфир транс-кислоты с dE-аллетролоном.
А. (З-Метил-2-циклогексенил)-фенисульфон .
в 400 см муравьиной кислоты вводят 34,2 г сырого- 3-метил-2-циклогексен-1-ола
, прибавляют 68 г фенилсуФината натрия и перемешивают в течен 15 ч при комнатной температуре, посл
чего выливают в смесь воды со льдом, экстрагируют хлористым метиленом,
соединяют хлорметиленовыё экстракты, промывают полученный раствор водой,
затем водным раствором карбоната натрия и, наконец, водой, сушаг и упаривают досуха.
К остатку прибавляют смесь изопропилового эфира с петролейным
эфиром. Образова вшийся осадок отделяют фильтрованием, промывают и
сушат. Получают 47 г (З-метил-2-циклогексенил )-фенилсульфона.
Образец этого продукта очищают растворением в Хлористом метилене, концентрированием и прибавлением
иэопропилового эфира. Температура плавления его 70С.
Найдено, %: С 66,3; Н 6,8; 13,3.
. Мол.вес. 236,33.
Вычислено, %: С 66,06; Н 6,82; 13,57.
Этот продукт в литературе не описан
.
Б, Этиловый эфир dl-цис- и тран-2
,2,5-триметилспиро- 2,5 -4-октев-1-карбоновой кислоты,
а)В 50 см диметилсульфоксида с 1,5% воды вводят 9,5 г трет.-бутилата
калия, а затем 10 г (З-метил-2-циклогексенил )-фенилсульфона, после
чего прибавляют приблизительно в течение 5 мин 9,5 см этилового эфира
р, 5-диметилакриловоЙ кислоты и перемешивают в течение 1 ч при комнатной температуре, далее охлаждают до Ос
подкисляют разбавленньл водньвл раствром соляной кислоты, экстрагируют
водный слой хлористым метиленом, соединяют хлорметиленовые экстракты,. промывают полученный органический
раствор водным раствором бикарбоната натрия, затем водой, сушат и концентрируют в вакууме.
Получают 8,8 г этилового эфира (ЗС-транс 2,2, 5-триметилспиро-| 2, 5j -4-октен-1-карбоновой
кислоты.
Полученный продукт содержит неболшое количество цис-изомера.
. Этот продукт в литературе не описан .
б)Аналогично п, а, но .заменяя
диметилсульфоксид с 1,5% воды диметилсульфоксидом с 0,08% воды, полу
.чают этиловый эфир с1Е-цис-2, 2 , 5-триметилспиро- 2, 5 -4-октен-1-карбоновой кислоты.
Полученный продукт содержит небольшое количество транс-изомера.
Этот продукт в литературе не описан.
В. а) d6-TpaHC-2,2,5-триметилспиро- 2
,5 -4-октен-1-карбоновой кислоты. , «
В смесь 20 см метанола и 0 см
2 н. метанольного раствора соды вводят в атмосфере азота 1 мл воды и 8,8 г этилового эфира dE -транс-2
,2, 5-триметилспиро- 2, 5 -4-октен-1-карбоноВ5 й кислоты, нагревают
с обратным холодильником и выдерживают в течение 1 ч. Затем удаляют
перегонкой метанол, остаток разбавляют водой, экстрагируют водный слой
этиловым эфиром/ соединяют эфирные экстракты и промывают водой полученный органический раствор. Далее
удаляют эфирный раствор, который содержит нежелаемую нейтральную ф аакцию.
. Объединенные водные слои подкисляют разбавленным водным растворо соляной кислоты, этот водный расРвор
экстрагируют хлористым метиленом , после чего хлорметиленовые экстракты объединяют, полученный
органический раствор промывают водным раствором хлористого натрия, сушат его и упаривают досуха.
К остатку прибавляют изопропиловы эфир, образовавшийся осадок отделя
отжиманием, сушат его и получают .
dC -транс-2 , 2 , 5-триметилспиро- .2 , 51;-4-октен-1-карбоновую кислоту,
т.пл. 122°С, затем т.пл. 130-132с (с перекристаллизацией между этими двумя температурами).
Найдено, %: С 74,4; Н 9,30. C.HjoO, . Мол. вес. 194,26.
Вы ислено,%: С,74,19; Н 9,33., , ямр-спектр этого продукта показывает этиленовый протон при 288 Гц,
характерный для транс-изомера.
Этот продукт в литературе не описан .
б) (38-Цис-2 , 2 , 5-триметилспиро- 2 ,5 -4-октен-1-карбоноБая кислота
Аналогично п. а), исходя из этилового эфира de-цис-2,2,5-триметилспиро- 2,5 -4-октен-1-карбоновой
кислоты, получают после перекристаллизации в изопропиловом эфире dE-цис-2
,2,5-триметилспиро- 2,5 -4-октен-1-карбоновую кислоту, т.пл. 140-142С.
Найдено, %; С 74,3; Н 9,40.
С.|2 Oj . Мол. вес. 194,26.
Вычислено, %: С 74,19, Н 9 ,33.
ЯМР-спёктр полученного продукта
показывает этиленовый протон при 322 Гц, характерный для цис-изомера .
Этот.продукт в литературе не описан .
Г. Хлорид dC-транс-2,2,5-триметилспиро- 2,5 -4-октен-1-карбоновой кислоты.
В смесь 15 см петролейного эфира (т.кип. 30-70с) и 5 см бензола
вводят 2,5 г (ЗЕ-транс-2,2,5-триметилспиро- 2,5 -4-октен-1-карбоновой кислоты, прибавляют по
каплям 1,4 см хлористого тионила и перемешивают в течение 1 ч при
комнатной температуре, а затем 20 м при . Далее прибавляют 1,4 см хлористого тионила, перемешива.ют
еще в течение 2,5 ч при комнатной, . температуре, Растворитель и избыток
хлористого тионила удаляют перегонкой в вакууме.
Остаток подвергают ректификации в вакууме и получают 0,836 г хлорид
d6-TpaHc-2,2,5-триметилспиро- 2,5 -4-октен-1-карбоновой кислоты, т.кип. 80с/0,5 мм рт.ст., который
в таком виде используют для получения аллетролонового сложного эфира
Этот продукт в литературе не описан.
Д. dE-Аллетролоновый эфир . dE-транс-2
,2,5-триметилспиро- 2,5 -4-октен-1-карбоновой кислоты..
В. 5 см бензола вводят 1
смпиридина и 0,836 г хлорида d.E-транс-2
,2,5-триметилспиро- 2,5 -4-октен-1-карбоновой кислоты, затем прибавляют
по каплям раствор 0,600 г d -аллетролона в 4 см бензола и перемешивают в течение .16 ч при комнатI
ной температуре, Образовавшийс.я осадок удаляют фильтрованием, бензольный
фильтра промывают последовательно разбавленным водным раствором coлян й кислоты, водой, водным растворим
бикарбоната натрия и водой. Раствор сушат над сернокислым магние и упаривают досуха.
Остаток растворяют в циклогексане и полученный раствор пропускают чере
колонку с окисью алюминия. Получают 0,981 г dE-аллетролонового эфира
(3€-транс-2,2, 5-триметилспиро ,5 -4-октея-1-карбоновой кислоты.
Найдено,%: С 76,7; Н 8,30.
Мол. вес.323,43.
Вычислено, %: С 76,79; Н 8,59.
Этот продукт в литературе не описан.
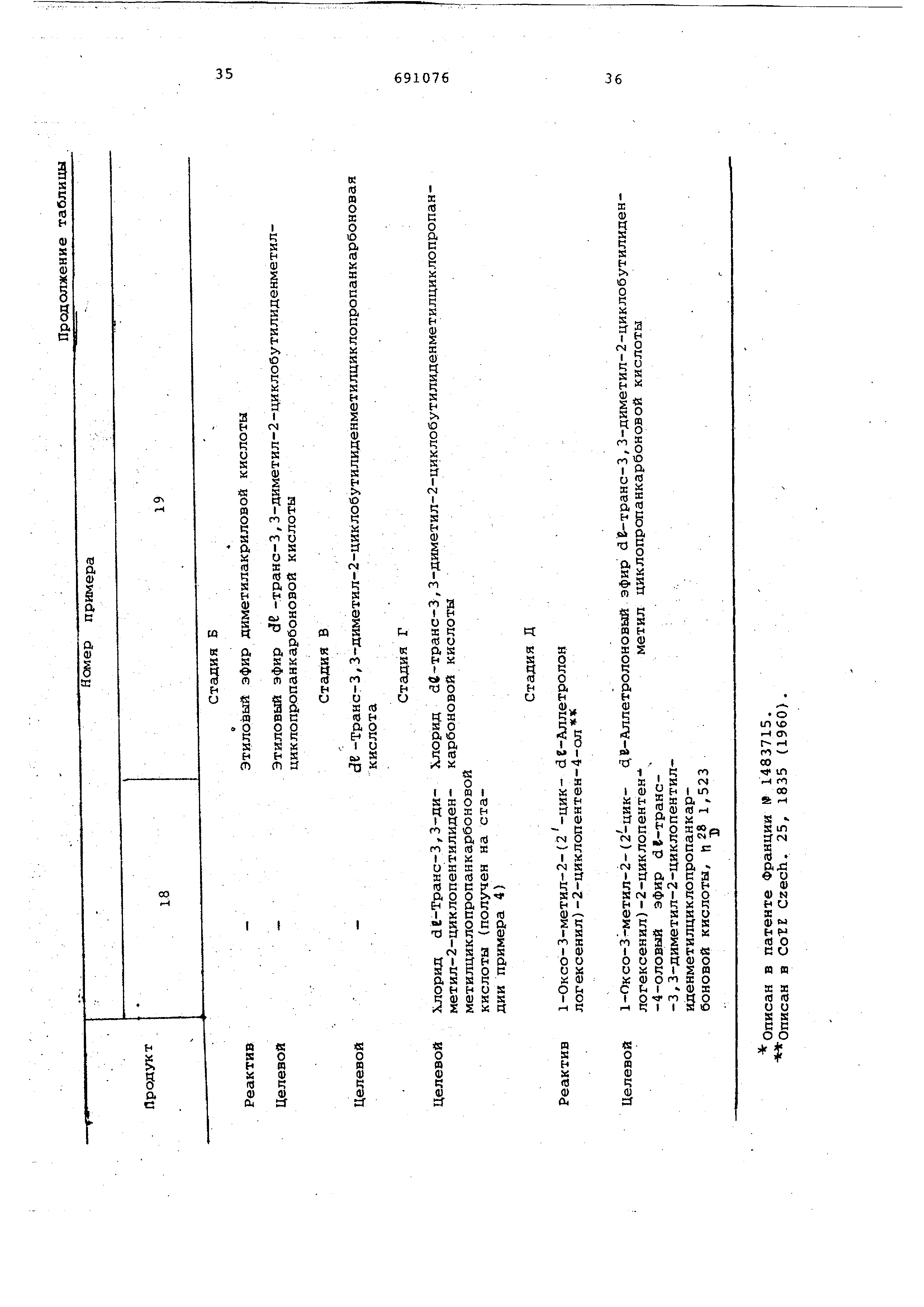
Пример 21. 5-Бензил-З-фурилметиловый эфир ЗЕ-транс-3,3-диметил-2-циклопентилиденметил-1г-ци1О1Опропанкарбоновой
кислоты.
А. Хлорид dE-транс-З,3-диметил-2-циклопентилиденметил-1-циклопропанкарбоновой
кислоты.
а)Натриевая соль кислоты. В 10 см метанола с 10% воды растворяют
1,08 г (ЗЙ-транс-З, 3-диметил-2-циклопентилиденметил-1-циклопропакарбоновой . кислоты, затем прибавляют
метилат натрия до появления елабого розового цвета по фенолфталеину удаляют перегонкой в вакууме метанол
, прибавляют бензол и снова перегоняют для полного удаления воды
из среды. Таким образом получают натриевую соль dE-транс-З,3-диметил-2-циклопентилиденметил-1-цикл6пропанкарбоновой
кислоты.
Полученное соединение в литературе не описано.
б)Хлорид кислоты.
Полученную соль натрия суспендируют
в 30 см бензола и охлаждают затем прибавляют 2 см пиридина, 4,7 см хлористого оксалила, перемешивают
, удаляют фильтрованием образовавшийся осадок, промлвают его бензолом, соединяют бензольньае
промывки с основным фильтратом и получают бензольный раствор хлорида
dЕ-транс- 3 , З-диметил-2-циклопентилиденметил-1-циклопропанкарбоновой кислоты, который в таком виде используют на следующей стащии,
Б. 5-Бензил-З-фурилметиловый эфир де-транс-3,3-диметил-2-цйклопентилиденметил-1-циклопропанкарбоновой
кислоты.
К бензольному раствору хлорида кислоты, полученному выше, прибавляют
1,5 см пиридина и 1,05 г, 5-бензил-З-фурилметилового спирта в 10 см бензола. Реакционную смес
перемешивают в течение 16 ч при комнатной температуре, затем, прибавляют воду, отделяют органи|ческий
слой декантацией, экстрагируют водный слой эфиром, промывают
соединенные органические слои последовательно холодным водным раствором соляной кислоты, водой,
водным раствором бикарбоната натри и снова водой, сушат и упаривают
досуха. Полученный продукт растворяют в бензоле, бензольный раствор пропускают через колонку с окисью
алюминия и элюат упаривают досуха.
Получают 1,234 г 5-бензил-З-фурилметилового
эфира dt-транс-З,3-дтил-2-циклопентилиденметйл-1-циклопропанкарбоновой кислоты, который
при комнатной температуре находит в твердом состоянии; т.пл. его ниж 140° С.
Найдено, %: С 79,4 Н 8,00.
Мол,вес. 364,46.
Отчислено, %: С 79,09; Н 7,74.
УФ-спектр (этанол) : Я при
207-208ММК ( 24000).
Это соединение в литературе не описано.
П р и м е р 22, 5-Бензил-З-фурилметиловый эфир d-TpaHC-3,3-диметил-2-циклопентилиденметил-1-циклопропанкарбоновой
кислоты.
А. d-Транс-З,3-димeтил-2-циклoпeнтилидeнмeтил-i-циклoпpoпaнкapбoнoвaя
кислота.
Проводят реакцию между t-эфедрином
и de-тpaнc-3,3-димeтил-2-циклопентилиденметил-1-циклопропакарбоновой кислотой в среде уксусноэтилового
эфира. Затем отжатием отделяют осадок, который после очистки дает соль Е-эфедрина d-транс-3
,3-диметил- -циклопентилиденметил-1-циклопропанкарбоновой кислоты (соль А), т.пл. ,
Tot -7° (с 1,1%, хлороформ).
Из фильтрата (раствор в уксусноэтиловом
эфире), извлекают продукт который после очистки дает соль
е-эфедрина -транс-3,3-димeтил-2-циклoпeнтилидeнм .5Tил- -циклoпpoпaнкapбoнoвoй кислоты (соль Б) ,
т.пл. 112°С, LdLl, -13° (с 1,1%, хлороформ).
Подкислением соли А получают d-транс-З,З-диметил-2-циклопентилиденметил-1-циклопропанкарбоновую кислоту, т.пл. бОс (не очень отчетливо ) , fot + 2 (с 1%, хлоро .) (кислота А) .
Подкисляя соль Б, получают Р-транс-3 ,З-диметил-2-циклопентилиденметил-1-циклопропанкарбоновую
кислоту, т.пл. (не очень отчетливо) , oLj ij° 0° (с 1%, хлороформ
) (кислота Б).
Несмотря на то, что способность
вращать плоскость поляризации у полученных кислот близка к нулю, разделение действительно происходит,
}Эзонизацией d-транс-хризантемовой . кислоты так же, как и озонизацией
кислоты А, получаемой из соли эфе рина, т.пл. 162°с, получают ту же t-транс-карбоновую кислоту,
т.пл. 212С, Го(.|° -35 {с 1,8%, м танол) H.Staudinger, Ruziska, HeC Chem. Acta, 2/ 201, 1924.
Соль t-эфедрина 3-транс-3,3-диметил-2-циклопентилиденметил-1-циклопропанкарбоновой кислоты;
d-транс-3,3-димeтил-2-циклoпeнтилидeнмeтил-l-циклoпpoпaнкapбoнoвaя кислота и е-транс-3,3-диметил-2-циклопентилиденметил-1-циклопро панкарбоновая кислота в литературе
не описаны. Б. Хлорид d-транс-З,3-димeтил-2-циклoпeнтилидeнмeтил-l-циклoпpoпaнкapбoнoвoй кислоты.
а)Натриевая соль кислоты. В 2 см метанола растворяют
1,14 г d-транс-З,3-димeтил-2-циклoпeнтилидeнмeтил-l-циклoпpoпa кapбoнoвoй кислоты, затем прибавл
ют 2,06 и. метанольный раствор соды в.количестве, необходимом для получения бледно-розовой окраски в
присутствии фенолфталеина, далее удаляют в вакууме метанол, прибавл бензол и еще раз упаривают досуха
вакууме для полного удаления воды. Получают натриевую соль d-транс-З,
-диметил-2-циклопентилиденметил-1-циклопропанкарбоновой кислоты. Это соединение в литературе не
описано. б)Хлорид кислоты. Полученную выше соль натрия сус
пендируют в 30 см бензола и охлаждают затем вводят в атмосфере азота 2 см пиридина, 4,7 с
хлористого оксалила, перемешивают упаривают в вакууме досуха, после чего прибавляют бензол и еще раз
упаривают досуха для полного удал |кия бензола и хлористого оксалила.
Образовавшийся осадок удаляют фильтрованием , промывают бензолом, соединяют
бензольные промывки с основным фильтратом и получают бензольный
раствор хлорида d-транс-З,3-диметил-2-циклопропилиденметил-1-циклопропанкарбоновой кислоть, который в
таком виде применяют на следующей стадии. . В. З-Бензил-З-фурилметиловый
эфир d-транс-З,З-Диметил-2-циклопентилиденметил-1-циклопропанкарбоновой кислоты.
К бензольному раствору хлорида d-транс-кислоты, полученному выше, прибавляют 2 см пиридина и 1,12 г
5-бензил-З-фурилметилового спирта , смесь перемешивают в течение 16 ч при
комнатной температуре и разбавляют водой, затем отделяют декантацией
органический слой, экстрагируют эфиром водный слой, присоединяют эфирные слои к бензольному раствору,
промывают полученный органический слой последовательно холодным водным
раствором соляной кислоты, водой, водным растворомбикарбоната натрия,
снова водой, сушат и упаривают досуха . Остаток растворяют в бензоле,
пропускают полученный бензольны: раствор через колонку с окисью алюминия
, упаривают элюат досуха и получают 1,3 г 5-бензил-З-фурилметилового
эфира d-транс-3,3-диметйл-2-циклопентилиденметил-1-циклопропанкарбоновой кислоты, hi5 1,5420.D
Найдено, %: С 79,1; Н 7,70. Мол.вес. 364,46. Вычислено, %; С 79,09; Н 7,74.
УФ-спектр (этанол) : Л уакс при 208 ммк ( 23500) . Это соединение в литературе не
описано.
I
(S 0 n
i
0)
X
о s
Формула изобретения
1. Способ получения производных циклопропана общей формулы
-CK-C-R
П)
где ZjH Zz- водород, одинаковые алкилы, аралкил, арил, алкенил,
не сопряженный с циклопропиловьм кольцом, алкинил, не сопряженный с циклопропиловым кольцом, циклоалкил
, циклоалкенил, ге.тероциклический остаток;
И - гидроксил или группа OR ,
где R - низший алкил, замещенный или НёзамёщённЙй, бен зил, замещенны
или незамещенный в ариле или метилене , остаток N - метилендикарбоксимида
или группа 2- Р-З-мети-1-оксоциклопентен-2-ен-4-ил обще . формулы
ll,fi
f) .
где алкил, алкенил, например
аллил, бутенил, пентадиенил, алкинил , арил, аралкил, циклоалкил, циклоалкенил, например циклопентенил
, циклогексенил, гетероциклический радикал, например фурфурил;
А - двухвалентный аллиловый остаток , например, общих формул
(
/
R
RI
/ с ;
/Чу/
iRj
V
С(1Н .
и/ Ej Y
где Tl-i - водород или низший алкил;
R j и R 3 - алкил,аралкил,арил, алкенил ,. алкинил, циклоалкил, циклоалкенил , гетероциклический радикал
или образуют вместе один углеводородный гомоцикл, содержащий от 3 до 7 углеродных атомов, ненасыщенный
углеводородный гомоцикл, например циклогексенил, циклопентадиенил , гетероцикл, причем эти
циклы могут имтть один или нескольк заместителей, например низший алкил или алкокси, или образуют вместе
полициклический ароматический остаток , например флоуреновый;
Rx - НИЗШИЙ алкил, например ме тил
Ry- водород, низший алкил или
К4И RS образуют вместе углеводородный гомоцикл, насыщенный или ненасыщенный, гетероцикл;
V - метилен, углеводородная цепь, насыщенная или ненасыщенная
Ч- метин, углеводородная цепь, насыщенная или ненасыщенная,
отлич. ающийся тем,
что арилсульфинат щелочного металла общей формулы
ш;
,
где М - щелочной металл, например натрий, калий;
5
AI- арил, Образованный одним или несколькими кольцами, имеющими
один или несколько заместителей, например низшие алкилы, алкоксилы,
галогенметилы, галогены, нитрогруп0 пы,
подвергают взаимодействию с галоидиг рованным аллиловым производным общей формулы „.. (р,
5
где X - галоген, мезиловый или
тозилрвый остаток;
: А имеет вышеуказанные значения,в
присутствии щелочного агента с последующей обработкой полученного при этом арилаллилсульфоната общей
0
„ с
Н A-S-AP ,
00
где Аг и А имеют вышеуказанные значения,
5
d., j -этиленовым сложным эфиром,
замещенным в f5-положении, общей формулы
Z,
ввсн-совк zr . f°
0
где Z и Z имеют вышеуказанные значения;
R - низший алкил, замещенный .
или незамещенный,
5 образовавшийся при этом сложный
эфир общей формулы
C -vCK-COOB
(И)
50
R
где
имеют выч
2
шеуказанные значения, подвергают щелочному гидролизу с получением соответствующей кислоты, которую
5 вьщеляют в виде рацемата или оптически активного изомера, полученного
разделением рацемата известным способом, с последующей этерификацией выделенной кислоты как
тиковой или превршденной известны0 ми приемами в ее функциональные
производные, например хлорангидрид, смешанный ангидрид,ангидрид,металлическую
соль,метиловый эфир,соответствующим спиртом.
5
39
2.Способ по п, 1, о т л и ч aго
щ и и с я тем, что Z и Z j -метилы , а Ry алкил, имеющий не менее двух углеродных атомов, аралкил,
арил, алкенил, алкинил, циклоалкил, циклоалкенил, гетероцикл
3.Способ по П.1, отличаю1 .и и с я тем, что 2у- водород, 4лкил, имеющий не менее двух углероных
атомов, аралкил, арил, алкенил, не сопряженный с циклопропиловья кольцсж, алкинил, не сопряженный с
циклопропиловым кольцом, циклоалкил циклоалкенил, гетероцикл.
4.Способ по П.1, о т л и ч а ющ и И с я тем, что соединение формулы (I) представляет собой цис-цинероловый
эфир dt-TpaHC-3,3-диметил-2-циклопентилиденметил-Г-циклопропанкарбоновой кислоты.
5.Способ по п.2, отличай)щ и и с я тем, что соединение формлы
(I) предстсшляет собой транс-рацемат-5-бензил-З-фурилметиловый
эфир 3,3-диметИл-2-циклопентилиден691076
40
1метил-1-циклопропанкарбоновой «сислоты
..
6.Способ поп.1,01:личающ и и с я тем, что соединение формулы
(I) представляет собой 5-Сенэил-3-фурилметиловый эфир df-трансили
d-транс-З,3-димeтил-2-циклoпeнтили teнмeтил-l-циклonpoпaнкapбoнoвoй кислоты.
7.Способ по пп.1 и 2, о т л ичающийся тем, что арилсульфинат щелочного металла подвергают
взаимодействию со спиртом общей
ФОРМУЛЫ,.д.
где А имеет вышеуказанные значения, в присутствии муравьиной кислоты. Приоритет по пунктам:
26.08.66; 26.08.66, 24.02.67; 16.06.67; 19.07.67 по П.1.
26.08.66по п.2.
24.02.67по п.3. 16 .06.67 по п.4.
19.07.67 по пп 5 и 6. 26.08.66по п.7.





Комментарии