Получение галогенированных спиртов - RU2129538C1
Код документа: RU2129538C1
Описание
Изобретение относится к новому способу получения некоторых галогенированных спиртов, применяемых в качестве промежуточных соединений для синтеза важных пестицидов.
Сложные эфиры 3-(2-хлор-3,3, 3-трифторпроп-1-ен-1-ил)-2,2-диметилциклопропанкарбоновой кислоты, например, с 3-феноксибензиловым спиртом, α-циано-3-феноксибензиловым спиртом и 2-метил-3-фенилбензиловым спиртом, являются важными инсектицидными и акарицидными продуктами, а простые алкиловые эфиры этой кислоты являются важными промежуточными соединениями при получении этих продуктов. Желательно обладать новыми способами синтеза этих промежуточных соединений для того, чтобы увеличить гибкость фирмы-производителя в ответ на колебания в цене и наличии необходимого сырья.
В Chem Abstr. 1988, v 108, N 11, 940647 и N 108 N 3, 22101, 1988 описаны способы получения 1,1,1-трифтор-2,2-дигалоид-5-метил-4-гексен -3-олов, где галоид - Cl, Br, F, и их производных взаимодействием 3-метил бут-2-ен-1-аля с 2,2, 2-трифтор - 1,1,1-тригалоидэтаном в присутствии Zn и CuCl.
Настоящее изобретение относится к новому способу получения некоторых галогенированных спиртов, которые могут быть, в свою очередь, использованы для нового синтеза вышеупомянутой кислоты и ее эфиров.
Соответственно настоящее изобретение предлагает способ получения соединений формулы (I),
CF3 -CXCl-CH(OH)-CH=C(CH3)2,
где X представляет собой хлор или бром, включающий взаимодействие соединения формулы II
CF3 -CHXCl
c
3-метилбутил-2-ен-1-алем в присутствии сильного основания и в инертном растворителе в интервале температур от -80 до -0oC.
При этом, когда соединение формулы (I) представляет собой 5,5-дихлор-4-гидрокси-2-метил-6,6,6-трифторгекс-2-ен, соединение формулы (II) представляет собой 1,1-дихлор-2,2,2-трифторэтан.
Когда же соединение формулы (I) представляет собой 5-бром-5-хлор-4-гидрокси-2-метил-6,6,6-трифторгекс-2-ен, соединение формулы (II) представляет собой 1-бром-1-хлор-2,2,2-трифторэтан.
Процесс проводят в присутствии сильного основания, которое, как полагают, действует благодаря генерированию пергалоидоалкильного иона, впоследствии взаимодействующего с альдегидом. К подходящим сильным основаниям относятся низшие алоксиды щелочных металлов, например изопропоксиды или третбутоксиды натрия или калия, однако могут применяться также и другие основания, например дисилилазиды щелочных металлов.
Процесс предпочтительно осуществляют при низких температурах во избежание образования нежелательных побочных продуктов. Предпочтительный температурный интервал составляет от -80oC до 0oC, в особенности, когда используют полярный апротонный растворитель. Процесс можно проводить в периодическом или непрерывном режиме. В случае непрерывного процесса реагенты подают под контролем в охлажденный раствор или суспензию основания в растворителе. Реакция идет очень быстро, особенно в интервале температур от -40 до 60oC.
Конкретные примеры таких растворителей, которые могут быть полезны при осуществлении способа, включают амиды, например диметилформамид, диметилацетамид и ди-н-бутилацетамид; циклические эфиры, например тетрагидрофуран, тетрагидропиран и диоксан; гликолевые эфиры, например диметиловый эфир этиленгликоля и диэтиловый эфир этиленгликоля; и сульфоксиды, например диметилсульфоксид. Однако могут применяться также и другие инертные растворители, такие как ароматические углеводороды, например толуол. В частности, тетрагидрофуран является особенно эффективным, когда основание применяют в виде раствора алкоксида щелочного металла, например трет-бутоксида натрия в диметилформамиде.
Способ используется для получения соединений формулы (I) с высоким выходом и чистой и позволяет легко выделять желаемый продукт. Любое непрореагировавшее или избыточное количество соединения формулы (II) можно легко выделить и вернуть на повторную реакцию.
Соединения формулы I могут быть использованы с синтезе 3-(2-хлор-3,3,
3-трифторпроп-1-ен-1-ил)-2,2-диметилциклопропанкарбоновой кислоты или ее эфира, в частности метилового или этилового, причем предлагаемый синтез включает следующие стадии:
а) взаимодействие
соединения формулы (I) с три-(низший алкил)-ортоацетатом, содержащим в каждой алкильной группе до четырех атомов углерода, в присутствии по крайней мере каталитического количества кислоты с получением
соединения формулы (III)
CF3-CXCl-CH=CH-С(CH3)2-CH2CO2R,
где R представляет собой алкил, содержащий до четырех атомов углерода;
б) обработка полученного соединения формулы (III) с помощью по крайней мере одного молярного эквивалента основания с получением алкильного эфира 3-(2-хлор-3,3,3-трифторпроп-1-ен-1-ил)-2,
2-диметилциклопропанкарбоновой кислоты; и
в) по желанию гидролиз указанного низшего алкилового эфира с получением свободной карбоновой кислоты.
Предпочтительно три-(низший алкил)-ортоацетат выбирают из триметил-ортоацетата и триэтилортоацетата.
Кислота, используемая на стадии а), предпочтительно представляет собой простую карбоновую кислоту, например пропионовую или масляную, в частности изомасляную кислоту, либо алкан- или арен-сульфоновую кислоту, в частности п-толуолсульфокислоту. Процесс ведут при повышенной температуре, предпочтительно при температуре перегонки, в условиях, когда спирт, получаемый этим способом, может быть удален из зоны реакции.
Основание, используемое на стадии б), предпочтительно представляет собой алкоксид щелочного металла, а процесс осуществляют в подходящем растворителе или разбавителе, например полярном апротонном растворителе, например в диметилформамиде, или в избытке спирта, соответствующего алкоксиду щелочного металла. Трет-бутоксид натрия или калия является предпочтительным основанием и реакцию проводят предпочтительно в диметилформамиде.
Дополнительные подробности, касающиеся предлагаемого способа, по которому могут быть получены соединения формулы (I) и затем использованы в синтезе эфиров 3-(2-хлор-3,3,3-трифторпроп-1-ен-1-ил)-2, 2-диметилциклопропанкарбоновой кислоты, представлены в приведенных ниже примерах.
Полагают, что на стадии а) описанного выше процесса взаимодействие соединения формулы (I) с
триалкилортоацетатом приводит первоначально к образованию соединения формулы (IV)
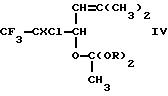
где X представляет собой хлор или бром и R представляет собой алкил, содержащий до четырех атомов углерода. Полагают также, что соединения формулы (IV) не были ранее описаны, причем в особенности это относится к следующим новым соединениям:
5-бром-5-хлор-4-(1,1-диэтоксиэтокси)-2-метил-6,6,6-трифторгекс-2-ен;
5,5-дихлор-4-(1,1-диэтоксиэтокси)-2-метил-6,6,6-трифторгекс-2-ен;
5-бром-5-хлор-4-(1,1-диметоксиэтокси)-2-метил-6,6,6-трифторгекс-2-ен;
5,5-дихлор-4-(1,1-диметоксиэтокси)-2-метил-6,6,6-трифторгекс-2-ен.
В условиях реакции соединения
формулы (IV) претерпевают перегруппировку, приводящую к образованию соединений формулы (III). Соединения формулы (III) также не были описаны ранее и, как полагают, в особенности это касается следующих
новых соединений:
этил-6-бром-6-хлор-3,3-диметил-7,7,7-трифторгепт-4-еноат;
метил-6-бром-6-хлор-3,3-диметил-7,7,7-трифторгепт-4-еноат;
этил-6,6-дихлор-3,3-диметил-7,7,
7-трифторгепт-4-еноат;
метил-6,6-дихлор-3,3-диметил-7,7,7-трифторгепт-4-еноат.
Способ, заявляемый в настоящем изобретении, иллюстрируется следующими примерами.
Пример 1
Пример иллюстрирует получение 5,5-дихлор-4-гидрокси-2-метил-6,6,6-трифторгекс-2-ена.
Трет-бутоксид натрия (2,4 мл 42% раствора в сухом диметилформамиде) по каплям и при перемешивании добавляют в течение 20 минут к смеси 1,1-дихлор-2,2,2-трифторэтана (1,38 г), 3-метилбут-2-ен-1-ала (0,636 г) и сухого тетрагидрофурана (30 мл), поддерживаемой при температуре -65oC с помощью внешнего охлаждения в атмосфере азота; после завершения добавления перемешиваемую реакционную смесь поддерживают при указанной температуре еще в течение 30 минут. Внешний холодильник удаляют и реакцию гасят прибавлением по каплям насыщенного водного раствора хлорида аммония до тех пор, пока температура не поднимается до -20oC. После этого смесь перемешивают до достижения температуры окружающей среды (около 20oC).
Водный и органический слой разделяют, водный слой обрабатывают дихлорметаном (2х20 мл), экстракты объединяют с органическим слоем и сушат над безводным сульфатом натрия. После удаления растворителей испарением при пониженном давлении остаток растворяют в гексане (20 мл), раствор промывают соляным раствором (3 х 5 мл), сушат над безводным сульфатом натрия и концентрируют путем удаления растворителя при пониженном давлении. Остаток растворяют в смеси этилацетата и петролейного эфира (интервал температуры кипения 40 - 60oC) (1:6 по объему, 20 мл) и очищают на короткой колонке с силикагелем (3,75 см), используя ту же смесь для элюирования (400 мл). Последовательные фракции (3) анализируют с помощью хроматографии и устанавливают, что желаемый продукт присутствует в первых двух фракциях. Элюат концентрируют испарением растворителей при пониженном давлении и остаток (1,33 г) анализируют методами спектроскопии ядерного магнитного резонанса (ЯМР) и хромато-масс-спектрометрии, идентифицируя его как 5,5-дихлор-4-гидрокси-2-метил-6,6,6-трифторгекс-2-ен.
Пример 2
Пример иллюстрирует получение 5-бром-5-хлор-4-гидрокси-2-метил-6,6,6-трифторгекс-2-ена.
Трет-бутоксид натрия (1,39 г 42% раствора в сухом диметилформамиде) по каплям и при перемешивании добавляют в течение 5 минут к смеси 1-бром-1-хлор-2,2,2-трифторэтана (0,535 мл), 3-метилбут-2-ен-1-ала (0,538 мл) и сухого тетрагидрофурана (10 мл), поддерживаемой при температуре - 78oC с помощью внешнего охлаждения в атмосфере азота. Реакционную смесь затем перемешивают при указанной температуре еще в течение 40 минут, после чего внешний холодильник удаляют и реакцию гасят прибавлением по каплям насыщенного водного раствора хлорида аммония. Затем смесь распределяют между водой и диизопропиловым эфиром, водную фазу отделяют, промывают диизопропиловым эфиром (3 х 25 мл) и промывные воды объединяют с органической фазой. Органическую фазу промывают соляным раствором, сушат над безводным сульфатом натрия и концентрируют испарением при пониженном давлении. После очистки по методике, описанной в примере 1, получают 5-бром-5-хлор-4-гидрокси-2-метил-6,6,6-трифторгекс-2-ен (1,39 г), идентифицируемый методами ядерного магнитного резонанса и инфракрасной спектроскопии.
Пример 3
Пример иллюстрирует получение 5-бром-5-хлор-4-гидрокси-2-метил-6,6,6-трифторгекс-2-ена.
Тетрагидрофуран (230 мл) и трет-бутоксид натрия (57,6 г; 40% раствор в диметилформамиде) загружают в реакционную колбу, имеющую несколько входных отверстий, и охлаждают при перемешивании до температуры -60oC. Туда же в течение 25 минут одновременно помещают 1-бром-1-хлор-2,2,2-трифторэтан (47,6 мг) и сенецил-альдегид (20,9 г) и смесь перемешивают при -60oС еще в течение 30 минут. По окончании реакции реакционную смесь гасят контролируемым добавлением насыщенного водного раствора хлорида аммония (120 мл). К смеси прибавляют гексан (500 мл), водную фазу отделяют и дополнительно экстрагируют гексаном (2 х 500 мл). Объединенные органические слои промывают сначала соляным раствором (2 х 100 мл), а затем водой (3 х 20 мл). Сушка с помощью сульфата натрия и концентрирование в вакууме дают продукт, идентифицируемый как 5-бром-5-хлор-4-гидрокси-2-метил-6,6,6-трифторгекс-2-ен в виде подвижного желтого масла (50,1 г, выход 70%).
1H ЯМР 1.30 (3H, с,: CMe2); 1.35 (3H, с,: CMe); 1.85 (1H, ш, OH); 4.20 и 4.30 (1H, д, CHOH диастереомеры); 4.90 (1H, д,: CH).
MC: 195 (CF3CClBr+), 85 (M+-CF3CClBr). ИКС: 3400 cm-1.
Пример 4
Пример иллюстрирует получение 5-бром-5-хлор-4-(1,1-диметоксиэтокси)-2-метил-6,6,6-трифторгекс-2-ена.
5-бром-5-хлор-4-гидрокси-2-метил-6,6,6-трифторгекс-2-ен (10,0 г), триметилортоацетат (48,0 г) и изомасляную кислоту (0,29 г) загружают в круглодонную колбу, снабженную отверстием для впуска азота и барботером, термометром и насадкой Дина-Старка, заполненной молекулярным ситом 5A. Смесь нагревают при перемешивании до температуры перегонки и отгоняют, собирая дистилляты до тех пор, пока температура не увеличится до 111oC (около 1 часа). Как только реакция завершается, остаточный триметилортоацетат удаляют с помощью вакуумной перегонки (при температуре около 50oC и давлении 50 мм Hg), получая продукт, идентифицируемый как 5-бром-5-хлор-4-(1,1-диметоксиэтокси)-2-метил-6,6,6-трифторгекс-2-ен в виде оранжевого масла (10,9 г, выход 85%).
1H ЯМР 1.45 (3H, с: MeCOMe); 1.75 (3H, с: CMe2); 1.85 (3H, с: CMe2); 3.28 (3H, с, OMe); 3.30 (3H, с, OMe); 4.98 и 5.02 (1H, д, CHOR - диастереомеры); 5.35 (1H, д,: CH). MC: 89 (MeC(COMe)2+).
Пример 5
Пример иллюстрирует получение метил-6-бром-6-хлор-3,3-диметил-7,7,7-трифторгепт-4-еноата.
5-бром-5-хлор-4-гидрокси-2-метил-6,6,6-трифторгекс-2-ен (10,0 г), триметилортоацетат (16,0 г) и монтмориллонит KSF (0,5 г) загружают в круглодонную колбу, снабженную отверстием для впуска азота и барботером, термометром и верхним сборником. Смесь нагревают при перемешивании и метанольно-триметилортоацетатные отгоны собирают до тех пор, пока температура не увеличится до 111oC (около 1 часа). Затем реакционную смесь нагревают до 135oC и выдерживают еще в течение 1 часа. Производят перегрузку метанольно-триметилортоацетатных отгонов и процедуру перегонки повторяют дважды. По завершении реакции монтмориллонит удаляют фильтрацией. Остаточный триметилортоацетат удаляют с помощью вакуумной перегонки (при температуре около 50oC и давлении 50 мм Hg), получая продукт, идентифицируемый как метил-6-бром-6-хлор-3,3-диметил-7,7, 7-трифторгепт-4-еноат в виде масла коричневого цвета (7,8 г, выход 59%).
1H ЯМР: 1.20 (6H, с, CMe2 ); 2.40 (2H, с, CH2CO2Me); 3.65 (3H, с, OMe); 5.75 (1H, д, CH); 6.45 (1H, д, CH).
MC: 305 (M+ - OMe); 257 (M+ - Br). ИКС: 1750 cm-1.
Пример 6
Этот пример иллюстрирует
получение этил-6,6-дихлор-3,3-диметил-7,7,7-трифторгепт-4-еноата.
Смесь триэтилортоацетата (25 мл), 5,5-дихлор-4-гидркоси-2-метил-6,6,6-трифторгекс-2-ена (3,5 г) и изомасляной кислоты (0,11 г) нагревают при температуре перегонки. Летучие конденсируют и собирают в аппарате Дина и Старка, заполненном молекулярным ситом 4A, для того, чтобы собрать побочный этанол и отделить его от ортоацетата, который был возвращен в реакционную смесь. Через 30 минут дополнительное количество летучих компонентов удаляют испарением при пониженном давлении и собирают масляный остаток, состоящий главным образом из 5,5-дихлор-4-(1,1-диэтоксиэтокси)-2-метил-6,6,6-трифторгекс-2-ена (3,8 г). Последний нагревают с изомасляной кислотой (10 мкл) при температуре перегонки в течение 16 часов с холодильником, содержащим молекулярные сита 4A, для удаления этанола из конденсата. Масляный остаток подвергают очистке хроматографией на колонке, заполненной силикагелем (200 - 300 меш, 60A), с использование в качестве элюента смеси гексан: этилацетат в соотношении 15: 1 (по объему), получая этил-6,6-дихлор-3,3-диметил-7,7,7-трифторгепт-4-еноат, идентифицируемый методами спектроскпии ЯМР и хромато-масс-спектрометрии.
Пример 7
Этот пример иллюстрирует получение метил-6,6-дихлор-3,3-диметил-7,7,7-трифторгепт-4-еноата.
Методика, аналогичная описанной в примере 6, была использована для получения целевого продукта из смеси триметилортоацетата (70 мл), 5,5-дихлор-4-гидрокси-2-метил-6,6,6-трифторгекс-2-ена (10 г) и изомасляной кислоты (0,37 г).
Пример 8
Этот пример иллюстрирует получение этил-3-(2-хлор-3,3,3-трифторпроп-1-ен-1-ил)-2,2-диметилциклопропанкарбоксилата.
Перемешиваемый раствор этил-6, 6-дихлор-3,3-диметил-7,7,7-трифторгепт-4-еноата (0,1 г) в диметиформамиде (10 мл) охлаждают до -25oC в атмосфере азота и по каплям прибавляют трет-бутоксид натрия (0,01 мл 42% раствора в диметилформамиде). Через 30 минут добавляют еще 5 капель этого раствора трет-бутоксида натрия и смесь перемешивают в течение 15 минут, прежде чем реакция будет погашена в течение 10 минут с помощью насыщенного раствора хлорида аммония (2 мл). Затем добавляют воду в количестве 40 мл и смесь экстрагируют гексаном (3 х 40 мл). Объединенный экстракт промывают соляным раствором (20 мл) и сушат над безводным сульфатом натрия. Высушенный раствор фильтруют и концентрируют испарением при пониженном давлении, получая 3-(2-хлор-3,3,3-трифторпроп-1-ен-1-ил)-2,2-диметилциклопропанкарбоксилат в виде смеси изомеров.
Пример 9
Этот пример иллюстрирует получение метил-3-(2-хлор-3,3,3-трифторпроп-1-ен-1-ил)-2,2-диметилциклопропанкарбоксилата.
Используя методику, аналогичную той, что была описана в предыдущем примере, получают целевой продукт путем обработки раствора метил-6,6-дихлор-3,3-диметил-7,7,7-трифторгепт-4-еноата (0,217 г) в сухом диметиформамиде (10 мл) при 0oC в атмосфере азота трет-бутоксидом натрия (0,02 мл 42% раствора в диметилформамиде). Продукт, идентифицируемый методом хромато-масс-спектрометрии, в основном состоит из метил-cis-3-(Z-2-хлор-3,3,3-трифторпроп-1-ен-1-ил)-2,2 -диметилциклопропанкарбоксилата.
Реферат
Изобретение относится к способу получения галогенированного спирта формулы I СF3-СХСl-СН(ОН)-СН= С(СН3)2, где X представляет собой хлор или бром, который включает взаимодействие соединения формулы II СF3-CHXCl с 3-метилбут-2-ен-1-алем в присутствии сильного основания и в инертном растворителе. Полученные продукты используются в качестве промежуточных соединений для получения инсектицидов. Полученные соединения являются промежуточными соединениями для получения ценных пестицидов. Способ позволяет получить соединения формулы I с высоким выходом и чистотой, а также позволяет легко выделить целевой продукт, а непрореагировавшее или избыточное соединение формулы II вернуть на повторную реакцию. 5 з.п.ф-лы.
Формула
CF3 - CXCl - CH(OH) - CH = C(CH3)2,
где Х представляет собой хлор или бром,
с использованием 3-метилбут-2-ен-1-аля, отличающийся тем, что 3-метилбут-2-ен-1-аль подвергают взаимодействию с соединением формулы II
CF3 - CHXCl,
в присутствии сильного основания и в инертном растворителе в интервале температур от -80 до 0oC.

Комментарии