. Изобретение относится к области получения новых пр1)изво/(ных пиперидина общей формулы
Ri
. (}
--/Мг
где R - атом водорода или низший
алкил; R - гидроксил, низший алкоксил , низший алкокси-
низший алкоксил, фенок- си - низший алкил, фен- окси - низший алкоксил,
в котором фенил может быть замещен низшим ал коксилом или низшим ал-
килом, амино, ди(низший алкил)амино, ди(низший алкил)амйно - низший алкоксил
, 4-морфолинил, 1-пирролидинил, 1-пипе- ридинил, (1-пирролидинил
) - низший алкоксил, (4-морфолинил) - низший алкоксил;
Аг и Аг - независимо один от дру- того фенил или фенил, моно- шш дизамещенный
разными группами, выбранными из атома галогена , низшего алкила,
низшего алкокси, алкок- сикарбонила, трифторме- тила или пиридинил, или
тиенил,
или их кислотно-аддитивных солей, или. их стереохимических изомерных
форм.
Цель изобретения - разработка на
основе известных методов способа получения новых производных пипериди-
на, обладающих выраженным противогис- таминным действием и низкой токсичностью .
А. Получениепромежуточных продуктов .
Пример. К перемешиваемому
и нагреваемому с обратным холодильником комплексу Гриньяра, ранее приготовленному
из 39,7 мае.ч. 1-бром-4- -фтор-2-метилбензола и 5,1 мае.ч. магния в 225 мае.ч, тетрагидрофурана
порциями добавляют 8,4 мае,ч. пара- формальдегида. После завершения реакции
перемешивание продолжают в течение ч е нагреванием е обратным хо-
лодильником. Реакционную емееь охлаждают и вьшивают на емесь измельченного
льда и уксусной кислоты. Продукт экстрагируют трихлорметаном. Экстракт
осушают, фильтруют и упаривают. Оетаток дистиллируют с получением 14 мае.ч. (47,Ъ%) 4-фтор-2-метилбен-
золметанола; т.кип. (пониженное
давление, даваемое водоструйным насосом
) .
Аналогичным путем получают также 4-хлор-З-(трифторметил)бензометанол;
т.кип. 90°С при давлении 0,4 мм.
Пример2. К 14,3 мае.ч. тио-
нилхлорида каплями добавляют раствор 14 мае.ч. 4-фтор-2-метилбензолмета-
нола и 0,9 мае.ч, N, N-диметилформа- мида Б 45 мае.ч. метилбензола при охлаждении
на льду с водой. Затем добавляют 135 мае,ч. метилбеизола и перемешивание продолжают в течение 1 ч
при комнатной температуре. Реакционную емееь упаривают, получают 17мае,
(100%) 1 -(хлорметил)-4-фтор-2-метил- бензола в качестве остатка.
Аналогичным путем получают также 1-хлор-4-(хлорметил)-2-(трифторме-
тил)бензол; т.кип. 100°С при давлении 10 мм.
Пример 3. Смееь 16 мае,ч,
1 -(хлорметил)-4-фтор-2-метилбензола, 7,8 мае.ч. раетвора цианиетого калия
в небольшом количеетве воды, 0,1 мае. йодистого калия и 240 мае.ч 2-пропа-
нона перемешивают и нагревают е обратным холодильником в течение 22 ч.
Реакционную емееь охлаждают и фильтруют . Фильтрат упаривают. Оетаток отбирают
в воде и продукт экстрагируют метилбензолом. Экстракт осушают, фильтруют и упаривают, получая
13 мае,ч, (87,2%) 4-фтор-2-метилбен- золацетонитрила в качестве остатка.
Аналогичным путем получают также 4-хлор-2-(трифторметил)бензолацето-
нитрил; т.кип. 83°С при давлении О,2 мм.
Пример 4. Смесь 221 мае,ч,
4-фторбензолацетонитрила, 700 мае,ч, раетвора (30%-ного) метилата натрия
и 900 мае.ч, диметилбензола перемешивают в течение 5 мин. Затем каплями
добавляют 309 мае.ч. метил-2-про- пеноата (реакция экзотермическая:
температура повьшгаетея до 65°С) , Пое- ле завершения реакции перемешивание
продолжают на протяжении ночи при температуре кипения е обратным холодильником
. Метанол отгоняют до тех пор, пока не будет доетигнута внутренняя температура . После охлаждения
каплями добавляют 1000 мае,ч 6 н. раетвора хлористоводородной кислоты
и.все это перемешивают и нагревают е обратным холодильником в течение 5 мин. Поеле охлаждения елои
разделяют. Органическую фазу осушают,
фильтруют и упаривают. Остаток перемешивают и нагревают с обратньпу лодильником в течение 4 ч вместе с
500 мае.ч. воды и 500 мае.ч. раствора хлористоводородной кислоты. После
охлаждения продукт экстрагируют три- хлорметаном. Экстракт последовательно
промывают водой, разбавленным раствором гидроокиси натрия и вновь водой
до нейтрализации, осушают, фильтруют и упаривают. Остаток кристаллизуют из
2-пропанола, получая 134,5 мае.ч. 1-(4-фторфенил)-4-оксоциклогексан- карбонитрила, т.пл. 91,8 С.
В соответствии с той же методикой и используя эквивалентное количество
подходящего арилацетонитрила в качестве исходного материала получают также следующие диклогексаноны
I общей формулы
о-О.
CN
Аг
1
Аг
2-Пиридинил
2-ОСНз-С Н
Температу-
ра, С
Т.пл. У0,1
Т,кип. 170/
/0,3 мм.рт.ст.
2-ОСН,,, 5-Cf-C,Hj
(
З-СРз , 4Cl-CgH
З-СНз-CgH
2,3-Cf,-C.H
63
Т.пл. 147,2
2-Br-CgH
2-СН,, 4-F-CgH,,
2-СН,,
Ь1
Ь о
2-F-C,H,
3,4-(CHj), , 2-СН , ЗС1-С Н 4-С,Н,-С,Н., ,
3-CF, -С Н,
3 S ц
Пример 5. К перемешиваемой и нагреваемой с обратным холодильником
смеси 71 мае.ч. цианистого натрия, 99 мае.ч. этанола и 85 мае.ч. воды
каплями добавляют раствор 134 мае.ч. 2-(хлорметил)-4-фтор-1-метилбензола
в 99 мае.ч. этанола. После завершения реакции перемешивание продолжают
внач;1ле в течение 6 ч при кипении е обратным холодильником, а затем в течение
ночи при комнатной температуре. Этанол отгоняют и остаток отбирают в
4-метил-2-пентаноне и воде. Слои разделяют и водную фазу трижды экетра-
гирутот, используя 4-метил-2-пента- нон. Скомбинированные органические
фазы дважды промьшают водой, осушают, фильтруют и упаривают. Остаток дистиллируют
, получая 98 мае.ч. 5-фтор- -2-метилбензолацетонитрила; т.кип. 124-128 С при давлении 10 мм.
Пример 6.К перемешиваемому и горячему раствору 8,5 мае.ч. N, N,
Ы-триэтилбензолметанаммонийхлорида, 40 мае.ч. гидроокиеи натрия и
360 мае.ч. 50%-ного раетвора гидроокиеи натрия каплями добавляют рает-
вор 72,7 мае.ч. N, N-бие (2-хлорэтил)- -4-метилбензол-сульфонамида и
45,5 мае.ч. 254-дихлорбензолацетонит- рила в 90 мае.ч.. тетрагидрофурана.
Поеле завершения реакции перемешивание продолжают в течение 3 ч при
50 С. Реакционную емееь охлаждают, добавляют 216 мае.ч. метилбензола и
480 мае.ч. воды и елои разделяют. Органическую фазу промывают водой,
осушают, фильтруют и упаривают. Остаток кристаллизуют из 2-пропанола,
получая 28 мае.ч. (29%) 4-(2,4-ди хлорфенил)-1-(4-метилфенилсульфонил)-
-4-пиперидинкарбонитрила, т.пл. 45 С. В соответствии с той же методикой
и используя эквивалентное количество подходящего арилацетонитрила получают :
4-(2-фторфенил)-1 -(4-метилфенил- еульфонил)-4-пиперидинкарбонитрил в виде остатка;(
4- (5-хлор-2-метокеифенил(-Г-(4-ме- тилфенилсульфонил)-4-пиперидинкарбо- натрил;
1 -(4-метилфенилсульфонил) -(трифторметил)фенил -4-пиперидинкар- бонитрил;
4-(2-метокеифенил)-1 -(4-метилфе- нилсульфонил)-4-пиперидинкарбонитрил.
Пример 7. Раствор 29,6мас.ч N, М-бис(2-хлорэтил)-4-метилбензол-
сульфонамида и 14,9 мас.ч. 4-фтор-2- метилбензолацетонитрила в 90 мас.ч.
метилбензола каплями добавляют к раствору 5,6 мас.ч. литий-амида в 270 мас.ч. метилбензола при 90 С.
После завершения реакции все нагревают до кипения с обратным холодильником
и перемешивают при этой температуре на протяжении ночи. Реакционную смесь охлаждают, выливают на воду
и разделяют слои. Органическую фазу осушают, фильтруют и упаривают. Остаток кристаллизуют из 2-пропанола
получая 27 мас.ч. (72,6%) 4-(4-фтор- -2-метилфенил)-1 -(4-метилфенилсуль- фонил)-4-пиперидинкарбонитрила.
В соответствии с той же методикой и используя эквивалентные количества
подходящих исходных материалов получают :
4-(З-хлор-2-метилфенил j-1 -(4-ме-
тилфенилоульфонил -4-пиперидинкарбо- нитрил;
4-(5-фтор-2-метилфенил)(4-ме-
тилфенилсульфонил)-4-пиперидинкарбо- нитрил, т.пл. 168°С;
(В)-4-(2-фторфенил -З-метил-1-(4- -метилфенилсульфонитрил)-4-пиперидин карбонитрил, т.пл. 154°С;
(А) (±)-4-(2-фтсрфенил)-3-метил- -1 -(4-метилфенилсульфонш1)-4-пипери-
динкарбонитрил, т.пл. 135°С.
Пример 8. Смесь 35,8 мас.ч.
4-(2-фторфенил)-1 -(4-метилфенилсуль- фонил)-4-пиперидинкарбонитрила и
50 мас.ч. 75%-ного раствора серной кислоты перемешивают в течение 4 ч при . Каплями добавляют
192 мас.ч. этанола. После завершения реакции перемешивание продолжают в
течение 5 ч при температуре кипения с обратным холодильником. Реакционную смесь охлаждают и выливают на
измельченный лед. Все это подщелачивают гидроокисью аммония и продукт
экстрагируют дихлорметаном. Экстракт осушают, фильтрзтот и упаривают, получая
17,2 мас.ч. (68,4%) этилового эфира 4-(2-фторфенил) -4-пиперидин- карбоновой кислоты в виде остатка.
Используя ту же методику гидролиза, исходя из соответствующего карбонит-
рила получают гидрохлорид этилового эфира 4-(3-метилфенил)-4-пипери-
,динкарбоновой кислоты и гидрохлорид : тилового эфира 4-(2,4-дихлорфенил )-4-пиперидинкарбоновой кислоты.
Пример 9. 16,32 мас.ч. 1-
-(4-метилфенилсульфонил)(трифторметил )-фенил|-4-пиперидинкарбонитрила добавляют порциями к 35мас.ч.
75%-ного раствора серной кислоты и смесь перемешивают и нагревают в течение
15 ч при 155°С. Затем каплями
добавляют 100 мас.ч. этанола. После
завершения реакции перемешивание продолжают на протяжении ночи при температуре
кипения с обратным холодильником . Реакционную смесь охлаждают
и выливают на лед - воду. Все это подщелачивают гидроокисью аммония и
продукт экстрагируют дихлорметаном. Экстракт осушают, фильтруют и упаривают
. Остаток переводят в гидрохлоридную соль в 2,2 -оксибиспропане и 2-пропаноле. Соль отфильтровывают и
сзшат, получая 6 мае.% (43,9%) гидрохлорида этилового эфира (эток- . сикарбонил)-фенил -4-пиперидин-,
карбоновой кислоты; т.пл. 121°С.
«
Пример 10. Смесь 11,3 мас.ч. 1-(4-метилфенилсульфонил)(три- фторметил)-фенил -4-пиперидинкарбонитрила
, 5,6 мас.ч. гидроокиси калия и 220 мас.ч. 1,2-этандиола перемешивают
и нагревают до кипения с обратным холодильником в течение 48 ч. Реакционную
смесь охлаждают и вьшивают
на лед - воду. Все это подкисляют
хлористоводородной кислотой и продукт экстрагируют дихлорметаном. Экстракт
осушают, фильтруют и упаривают, по- лучая 11,8 мас.ч. (100%) 1-(4-метилфенилсульфонил
)(трифторметил)- -фенил -4-пиперидинкарбоновой кислоты в виде остатка.
I
В соответствии с той же методикой гидролиза и исходя из соответствующего
карбонитрила получают:
4-(5-хдрр-2-метоксифенил)-1-(4-
-метилфенилсульфонил)-4-пиперидинкар- боновую кислоту;
4-(2-метоксифенил) -l-(4-мeтилфe- нилcyльфoнил)-4-пипepидинкapбoнoвyю кислоту Ь виде остатка;
4- (4-фтор-2-метилфенил)-1 -(4-ме- тилфенилсульфонил)-4-пиперидинкарбо-
новую кислоту;
4- (3-хлор-2-метилф€ нил) -1 - (4-ме-
тилфенилсульфонил)-4-пиперидинкарбо- новую кислоту;
ч- (5-|| гор--2-метилфенил) -1 - (4-ме- тил(|)сннлсул15фонн.п) -4 -пнперидинкпрбо- кислоту, т.пл. 57(;;
(В)-А-(2-фторфсннл)-З-метил-1- -(4-метилфенилсульфонил)-4-пиперидин-
карбоновую кислоту, т.пл.
(А) (+)-А-(2-фторфенил)-3-метил-
-1 -(А-метилфенилсульфоиил)-4-пицери- диякарбоновую кислоту в виде остатка.
Пример 11. К перемешиваемой и кипящей с обратным холодильником смеси 21 мае.ч. 4-(5-хлор-2-метокси-
фенил)-1 -(4-метилфенилсульфонил)-4- пиперидинкарбоновой кислоты и 270 мае,ч. бензола каплями добавляют
36 мае.ч, тионилхлорида. После завершения все перемегаивагот и нагревают
до кипения с обратным холодильником в течение 4 ч.Реакционную смесь упаривают
и остаток дважды промывают ме- тилбензолом, получая 22 мае.ч. (100%)
4- (5-хлор-2-метоксифенил)-1 -(4-мeтил- фeиилcyльфoнил)-4-пипepидинкapбoнил- xлopидa .
Аналогичным путем получают:
4-(2-метоксифенил)-1-(4-метилфенилсульфонил
) -4 пиперидинкарбонил хлорид в виде остатка;
1 -(4-метилфенилсульфонил)
-(трифторметил)-фенил -4-пиперидин- карбонилхлорид в виде остатка;
4-(4-фтор-2-метилфенил)-1-(4-ме- тилфенилсульфонил) --4-пиперидинкарбо- нилхлорид в виде остатка;
4- (3-хлор-2-метилфенил)-1 - (4-ме- тилфенилсульфонил)-4-пиперидинкарбо-
нилхлорид в виде остатка;
4-(5-фтор-2-метилфенил)1- 4-.4-
-метилфенилсульфонил)-4-ниперидин- карбонилхлорид в виде остатка;
(А) -3-метил- -- (4-метилфенилсульфонил ) -4-фенил-4-ниперидинкарбонил- хлорид;
(В)-4-(2-фторфенил;-З-метил-1-(4- -метилфенилсульфонил)-4-пиперидинкар бонилхлорид ,
(А) ( + ) -4-(2--фторфенил) -3-метил- 1 - - (4-метилфенилсул1)фонил) -4-пиперидин
карбонил в виде остатка;
(В)(-)-З-метил-1-(4-метнлфенил-
сульфонил)-4-фенил-4-пиперидинкарбо- нилхлорид;
(В)(+)-З-метил-1-(4-метилфенил-
сульфонил) -4-фе.нил--4-пиперидинкарбо- нилхлорид в пипа остатка.
Прим е р 12. Смесь 36,5 нас.ч 4- (3-х. 1(1р- , -г.1( |-ил(Ь(П1 нл) -1 - (4-ме1
нилгх льфг.пч.:) - - 1-пнперн.глинклрбт{ил
iO .
тспорида и 240 мае.ч. этанола перемешивают и наг ревают с обратн 1м холодильником
в течение ночи. Реакцион- . ную смесь обрабатывают активирован-
5 нын древесным углем в горячем состоянии . Последний отфильтровывают и продукту
дают возможность кристаллизоваться из фильтрата нри самопроизвольном охлаждении до комнатной темпера-
0 туры. Продукт отфильтровывают и осушают , получая 33 мае.ч. (89,1%) этилового
эфира 4-(3-хлор-2-метилфенил)- -1 -(4-метилфенилсульфонил)-4-пипери-
динкарбоновой кислоты; т.пл. 134°С. 5 В соответствии с той же методикой
этерификацин, вводя в реакцию соответствующий хлорангидрид кислоты с подходящим спиртом, получают:
этиловый эфир 4-(5-хлор-2-метокси- фенил)-I-(4-метилфенилеульфонил)-4-
-пиперидинкарбоновой кислоты;
этиловый эфир 4-(2-метоксифенил)
-1-(4-метилфенилсульфонил)-4-пипери- динкарбоновой кислоты;
этиловый эфир 1 - (4-метилфенилсуль- фонил)-4- 3-(трифторметил) -фенил}- 4-
-пиперидинкарбоновой кислоты;
этиловый эфир 4-(4-фтор-2-метилфе-
нил)-1 -(4-метилфенилсульфонил)-4-пи- 30 перидинкарбоновой кислоты, т.пл. 1 5 1 ° С;
этиловый эфир 4-(5-фтор-2-метилфе- нил)-I(4-метилфенилсульфонил)-4-пи-
перидинкарбоновой кислоты, т.пл. 94°С; 35 (А)-фенилметиловый эфир З-метил-
-I-(4-метилфенилсульфонил)-4-фенил- -4-пиперидинкарбоновой кислоты; .
(В)-фенилметиловый эфир 4-(2-фтор- , фенил)-3-метил-1-(4-метилфенилсульфо-
40 нил)-4-пиперидинкарбоновой кислоты, . т.пл.
(А) (+)-фенилметиловый эфир 4-(2- -фторфенил)-3-метил-1 -(4-метилфенилсульфонил
) -4-пиперидинкарбоновой кис45
лоты;
(В)(+)-фенилметиловый эфир З-метил-1 -(4-метилфенилсульфонил)-4-фе нил-4-пиперидинкарбоновой кислоты;
(Е)()-фенилметиловый эфир 3-ме- тил-1- (4-метилфенилсульфонил)-4-фе-
нил-4-пиперидинкарбоновой кислоты;
(В)-фенилметиловый эфир 3-метил-
-1 - (4-метилфенилсульфонил)-4-фенил- -4-пиперидинкарбоновой кислоты. Пример 13. Смесь 17 мае.ч.
этилового эфира 4-(5-хлор-2-метокси- фенил)(4-метилфенилсульфонил)-4- пиперидинкарбоновой кислоты.
7,5 мае.ч. фенОоаа и 135 мае.ч. рает-
вора бромиетоводородной киелоты в укеуеной киелоте перемешивают на протяжении
ночи при комнатной температуре . Реакционную емееь выливают на во- ду и вее вмеете промьшаюа 2,2 -океи-
биепропаном. Водную фазу при охлаждении подщелачивают гидроокиеью натрия
. Продукт экетрагируют трихлорметаном . Экетракт промьтают водой, оеу- О фракции 22 мае.ч., получая 28 мае.ч.
() с -метилбензолметанамина (В) (+)- -3-метил-1 -(Д-метилфенилеульфонил)-
-4-фенил-4-пиперидинкарбоновой киелоты (1:1)15 Смееь 28 мае.ч. с.-метилбензолме-
танамина (Б)(+)-3-метил-1-(4-метил- фенилеуЛьфонил)-4-фенил-4-пиперидин-
карбоновой киелоты (1:1), 60 мае.ч. концентрированной хлориетоводородной
20 киелоты и 1000 мае.ч. воды кипятят в течение определенного времени. Реакционную
емееь фильтруют. Оеадок на фильтре промьшают водой и перемешивают в кипящей воде. Продукт отфильт -
ровьтают и раетворяют в трихлормета- не. Последний оеушают, фильтруют и
згпаривают, Оеадок кипятят в 2,2 -ок- еибиепропане, получая 19,7 мае.ч.
(93%) (В)(+)-3-мeтшI-l-(4-мeтилфeнил- 30 еульфонил)-4-фенил-4-пиперидинкарбо- новой киелоты.
шают, фильтруют и упаривают. Оетаток преобразуют в гидрохлориднуто еоль в
2-пропаноле и 2,2 -оксибиепропане, ползшая 7 мае.ч. (55%) гидрохлорида этилового эфира 4-(5-хлор-2-меток-
еифенил)-4-пиперидинкарбоновой киелоты .
Пример 14. А. К перемешиваемому
и кипящему раетвору 73 мае.ч. (В)(+)-3-метил-1-(4-метилфенилеуль- фонил)-4-фенил-4 пиперидинкарбоновой
киелоты в 3200 мае.ч. 2-пропанола добавляют раетвор 24 мае.ч. (-).-
-метилбензолметанамина. Раетвору дают возможность криеталлизоватьея. Продукт
отфильтровывают и трижды пере- криеталлизовывают еоответетвенно из 4800, 4000 и 3200 мае.ч. 2-пропанола,
получая 27 мае.ч. (27%) о(-метилбен- золметанамина (В)(-)-3-метил-1-(4-ме-
тилфенилеульфонил)-4-фенил-4-пипери- динкарбоновой киелоты -(1:1).
Смееь 27 мае.ч. о(метилбензолме- танамина (В)(-)-3-метил-1-(4-метш1-
фенилеульфонил)-4-фeнил-4-пипepидин- кapбoнoвoй киелоты (1:1), 60 мае.ч,
концентрированной хлориетоводородной киелоты и 1000 мае.ч. воды перемешивают
и кипятят в течение некоторого времени. Оеажденный продукт отфильтровывают , промывают водой и кипятят
в воде. Продукт отфильтровывают и раетворяют в трихлорметане. Последний осушают, фильтруют и упаривают
. Остаток перемешивают в 2,2-ок- сибиспропане, получая 18,4 мае.ч. (94%) (Б)(-)-3-метил-1-(4-метилфенил-
еульфонил)-4-фенил-4-пиперидинкарбо- новой киелоты.
Б. К перемешиваемому и кипящему с обратным холодильником раствору 100 мае.ч. (В)(+)-3-метил-1-(4-метил-
фенилсульфонил)4- фенш1-4-пипери- динкарбоновой кислоты в 1600 мае.ч. 2-пропанола добавляют раетвор
32,5 мае.ч. ( + )-q -метилбензолметан- амина в 400 мае.ч. 2-пропанола. Реакционной
смеси дают возможность криПример 15. Суспензию
11 мае.ч. этилового эфира 1-(4-метил35 фенилеульфонил)(трифторметил)-
фенил}-4-пиперидинкарбоновой киелоты и 8 мае.ч.тетраэтиламмонийбромида в
200 мае.ч. этанола подвергают электролитическому детозилированию при
40 -2,15 В е использованием ртутного катода и смеси Ag и AgCT в качеетве
электрода сравнения. Этанольный раст- .вор декантируют и отгоняют растворитель
. Остаток отбирают в дихлормета45 не. Последний трижды промьтают водой,
оеушаютJ фильтруют и упаривают. .Остаток переводят в гидрохлоридную соль
в 2-пропаноле и 2,2 -оксибиепропане. Соль отфильтровьтаюТ и еушат с полу50
чением 6,9 мае.ч. (85,2%) гидрохлорида этилового эфира (трифторметил ) -фенил -4-пиперидинкарбоновой
кислоты,
55 Аналогичным путем получают:
гидрохлорид этилового эфира 4-(2- -метокеифенил)-4-пиперидинкарбоновой кислоты;
сталлизоватьея. Продукт отфильтровывают и четьфе раза перекриеталлизовы-
вают еоответетвенно из 6400, 5600, 4800 и 3200 мае.ч. 2-пропанола. Продукт
отфильтровывают и перекриеталли- зовывают из 2400 мае.ч. 2-пропанола. Его вновь отфильтровывают, получая
22 мае.ч. Фильтрат упаривают и остаток добавляют к криеталлизованной
Пример 15. Суспензию 11 мае.ч. этилового эфира 1-(4-метилфенилеульфонил )(трифторметил)-
фенил}-4-пиперидинкарбоновой киелоты и 8 мае.ч.тетраэтиламмонийбромида в
200 мае.ч. этанола подвергают электролитическому детозилированию при
-2,15 В е использованием ртутного катода и смеси Ag и AgCT в качеетве
электрода сравнения. Этанольный раст- .вор декантируют и отгоняют растворитель
. Остаток отбирают в дихлорметане . Последний трижды промьтают водой,
оеушаютJ фильтруют и упаривают. .Остаток переводят в гидрохлоридную соль
в 2-пропаноле и 2,2 -оксибиепропане. Соль отфильтровьтаюТ и еушат с получением
6,9 мае.ч. (85,2%) гидрохлорида этилового эфира (трифторметил ) -фенил -4-пиперидинкарбоновой
кислоты,
Аналогичным путем получают:
гидрохлорид этилового эфира 4-(2- -метокеифенил)-4-пиперидинкарбоновой кислоты;
3
этиловый эфир 4-(4-(3)ТОр-2-метшт-
фенил)-4-пиперидинкарбоновой кислоты в виде остатка;
этиловый эфир 4-(З-хлор-2-метил- фенил)-4-пиперидинкарбоновой кислоты в виде остатка;
этандиоат (В)-фенилметилового эфира 3-метил-4-фенил-4-пиперидинкарбоновой кислоты (1:1);
(А)-фенилметиловый эфир З-метил-4 -пиперидинкарбоновой кислоты в виде остатка;
гидрохлорид этилового эфира 4-(5- -фтор-2-метилфенил)-4-пиперидинкарбоновой
кислоты, т.пл. 198,8 с;
гидрохлорид (В)-фенилметилового
эфира 4-(2-фторфенил)-3-метил-4 -пипе ридинкарбоновой кислоты, т.пл, 220°С
этандиоат (А)(+)-фенилметилового эфира 4-(2-фторфенил)-З-метил-4-пипе ридинкарбоновой кислоты (1:1),
т.пл. 170°С;
гидрохлорид (в) (-)-фенилметш:(ово-
го эфира З-метил-4-фенил-4-пиперидин карбоновой кислоты;
гидрохлорид (В) (+)-фенилметилово го эфира 3-метил-4-фенил-4-пипери- динкарбоновой кислоты.
Пример 16. К перемешиваемой и кипящей с обратным холодильником
смеси 14 мае.ч, гидрохлорида 4-фе- нил-4-пиперидинкарбонилхлорида и
130 мае.ч. метилбензола каплями добавляют 6,9 мае.ч. 1-пиперидинпропа-
нола. После завершения добавления пе ремешивание продолжают в течение ночи
при температуре кипения с обратным холодильником. Метилбензольную фазу декантируют и остаточное масло
кипятят в смеси 2,2 -оксибиспропане и этаноле, Осаждег€ный продукт отфильтровывают и сушат с получением
4 мае.4. моногидрата дигидрохлорида 3-(1-пиперидинил)-пропилового эфира
4-фенил-4-пиперидинкарбоновой кисло- ты, т. пл. 1 7 6, 1 .
В соответствии с
и при использовании личеств подходящих алов получают:
дигидрохлорид 2-(диметиламино) этилового эфира 4-фенил-4-пиперидин- карбоновой кислоты, т.пл, 230°С;
дигидрохлорид 3-(диметиламино)про пилового эфира 4-фекил-4-пиперидинкарбоновой
ки( Л(ты, т.пл. 150 С;
дигидрохлорид 2-(-пирролидинил)
-этилового ; ф|-тра 4--феиил-4 пиперитой же методикой эквивалентных ко
исходных матери
25
5
- О
5
-- ;
- 20
-
30 - 35 40 45
-
lA кислоты,
-
динкарбоновой кислоты, т. пл, ,
этандиоат 2-(4-морфолинил)этилового ;эфира 4-фенил-4-пиперидинкарбо-
новой кислоты (:1), т.пл. 210°С.
Пример 17. Смесь 4,5 мае,ч.
4-ОКСО-1-(2-пиридинил)циклогексан- карбонитрила, 5,2 мае.ч. этилового
эфира 4-фенил-4-пиперидинкарбоновой кислоты, 1 мае.ч. 4-метилбензолеуль-
фокиелоты и 225 мае ,ч .метилбензола перемешивают и кипятят с обратным
холодильником в течение ночи с использованием водоотделителя, Реакционную
смесь упаривают и остаток кристаллизуют из 2-пропанола, получая 4,5 мае.ч. (45%) этилового эфира 1-
- 4-циано-4-(2-пиридинил)-1-дикло- гексенил -4-фeнил-4-пипepидинкapбoнo- вoй кислоты, т.пл. 160 С.
В соответствии с той же методикой и при использовании эквивалентных количеств
соответственно замещенных циклогексанов и пиридинов получают:
этиловый эфир 1-С4-циано-4-(4- -фторф нил)-1-циклогексен-1-ил -4- фенил-4-пиперидинкарбоновой кислоты
в виде остатка;
этиловый эфир 2-(4-циано-4-фенил-
-1-циклогексен-1-ил)-4-фенил-4-пипе- ридинкарбоновой кислоты в виде ос- татка J
этиловый эфир 1 - 4-циaнo-4-(4-мe- тoкcифeнил)-l -циклогексен-1-илЗ-4-
-фенил-4-пиперидинкарбоновой кислоты в виде остатка;
этиловый эфир (4-хлорфенил)- -4-циано-1-циклогексен-1-ил -4-фенил-
-4-пиперидинкарбоновой кислоты в виде остатка;
-(4-циано-4-фенил-1-циклогексен- -I-ил)-4-фенил-4-пиперидинилкарбонил пиперидин в виде остатка.
В. Получение целевых соединений.
Пример 18. В перемешиваемую
смесь, состоящую из 4,5 мае,ч, этилового эфира.1- 4-циано-4-(2-пириди-
нил)-1-циклoгeкcилj-4-фенил-4-пиперидинкарбоновой кислоты и 80 мае.ч. 50 этанола, по частям добавляют
0,4 мае,ч. борогидрида натрия. После этого перемешивание продолжают сначала
в течение ночи при комнатной тем пературе и затем в течение 30 мин при . Реакционную смесь охлаждают
и вливают в воду. Продукт экстрагируют дихлорметаном. Экстракт высушивают
, фильтруют и выпаривают. Остаток
55
подвергают кристаллизации из 2-nporia- нола, получая 2 мае.ч, (35%) этилового
эфира I - А-циано-4-(2-пиридинил)цикло гексил -4-фенил-4-пиперидипкарбоново
кислоты, т.пл, 157,1 С, выход 35%.
По этой методике получают:
этиловый эфир 1-(4-циaнo-4-фeнил- циклoгeкcил)-4-фeнил-4-пипepидинкap- бoнoвoй кислоты, т.пл. 130,, выхо
24%, температура реакции
этиловый эфир 1- 4-циано-4-(4-ме-
токсифенил)циклогексил |-4-фенил-4- -пиперидинкарбоновой кислоты, т.пл.
122,, выход 30%, температура реакции 100 °С;
этиловый эфир (4-xлopфeпил)-
-4-циaнoциклoгeкcил j-4-фeнил-4-пипe- ридинкарбоновой кислоты, т.пл. 155°С
выход 27%, температура реакции 100°С
1-фенил-4- 4-феиил-4-(1-пипериди-
нилкарбонил)- -пиперидинил -циклогек санкарбопитрил гидрохлорид, т.пл.
283,2 С, выход 19%, температура реакции 80 с.
Пример 19. К I мае.ч. раствора
2 мае.ч. тиофена в 40 мае.ч. этанола добавляют 4,7 мае.ч. 1-(4- -фтор-2-метилфенил)-4-оксо-циклогек-
санкарбонитрила, 5,4 мае.ч. гидрохлорида этилового эфира 4-фенил-4-пипе-
ридинкарбоновой кислоты, 2 мае.ч. ацетата натрия и 120 мае.ч. этанола.
Всю смесь гидрируют при нормальном давлении 30 С в присутствии 2 мае,ч.
10% палладиевого на подложке из древесного угля катализатора. После поглощения
расчетного количества водорода отфильтровывают с помощью фильтра Хуфло и фильтрат вьтари ают. Из
остатка вьщеляют свободное основание обычным способом с помощью .гидроокиси
аммония и продукт экстрагируют дихлорметаном. Экстракт высушивают,
фильтруют и выпаривают. Остаток очищают с помощью колоночной хроматографии
на силикагеле, используя смесь трихлорметана и этанола (98,5:1,5 по o6i3eMy) в качестве элюента. Чистые
фракции собирают и элюент выпаривают Остаток подвергают кристаллизации из
этанола, получая 3 мае.ч.(4%)этилового эфира 1 - 4-циано-4-{4-фтор-2-
-метилфенил)циклогексил -4-фенил-4- -пиперидинкарбоновой кислоты, т.пл. 135,2°С, выход 33%,
По той же метрдике, используя эквивалентные количества соответствующих
исходных веществ, получают сое
5
0
5
0
5
0
5
0
5
дниения, представленные в табл., в
табл. 2 и 3 дан элементный анализ для некоторых из них.
Пример 20. В перемешиваемую смесь 11,7 мае.ч. этилового эфира 1 - 4-циано-4- (.фторфенил)- -циклогек-
сеп-1-ил1-4-фенил-4-пиперидинкарбо- новой кислоты, 1 мае.ч. 30%-ного
раствора метоксида натрия и 320 мае.ч, метанола по частям добавляют 1 мае,ч.
боргидрида натрия. После этого перемешивание продолжают в течение ночи при температуре . Реакционную
смесь вливают в ледяную воду и продукт экстрагируют трихлорметаном.
Экстракт высушивают, фильтруют и выпаривают . Остаток подвергают кристаллизации
из этанола, получая 5,9мас.ч. (.В) -этила 1 - 4 циано-4- (4-фторфенил)
-1-циклогексил -4-фенил-4-пиперидин- карбоновой кислоты, т.пл.I45,8°С, выход 50%.
К 2 мае.ч. раствора 2 мае.ч. тиофена в 40 мае.ч. этанола добавляют
27 мае.ч. 1 -(4-фторфенил)-4-оксоцик- логексанкарбонитрила, 34 мае.ч. этилового
эфира 4-фенил-4-пиперидинкар- боновой кислоты гидрохлорида, 15 мае.ч. ацетата натрия и 400 мае.ч.
этанола. Всю смесь гидрируют при нормальном давлении и в присутствии
5 мае.ч. 10% палладиевого на подложке из древесного угля катализатора.
После поглощения расчетного количества водорода катализатор отфильт- .
ровывают на фильтре Хуфло и фильтрат вьтаривают. Из остатка выделяют свободное
основание обычным способом с помощью гидроокиси аммония и экстрагируют
дихлорметаном. Экстракт высушивают , фильтруют и выпаривают. Осадок частично (9,6 мае.ч.) очищают с
помощью колоночной хроматографии на силикагеле, используя смесь трихлорметана
и метанола (99:1 по объему) В качестве элюента. Очищенные фракций
собирают и элюент выпаривают. Остаток превращают в соль гидрохлорида в
2-пропаноле. Неочищенную фракцию отфильтровывают и фильтрат обрабатывают
активированным древесным углем. Последний отфильтровывают и фильтрат выпаривают
, получая 4,8 мае.ч. (А)-этилового эфира I-f4-циано-4-(4-фтор- фенил)-цикло гек с ил -4-фенил-4-пипе
ридинкарбоновой кислоты моногидрохло- рида, моногидрат, т.пл.210,7°С, выход 8%.
i о и м ер 21 . К I мае. ч. раст- .. : мае. ч. тиофена в 40 мае. ч. эта .
.-.- /-(обавляют 5,3 мае.ч. 1-(5-хлор- - .: . Г .жсифенил} -4-океоциклогекеанкар-
: . /.рила 5,4 мае .ч . этилового эфира ; -фгнил-4-пиперидинкарбоновой кислоты
.л-г охлорида, 3 мае. ч, ацетата натрия :-. :00 мае.ч. этанола. Всю смесь гид-
;):;- ч ют при нормальном давлении и ji V C в прр еутствии 2 мае.ч. платино-
: 1-:з подложке из древееного углк ;0 / катализатора. После поглощения
вычисленного количества водорода ка- та.г изатор отфильтровывают и промы- r .aioi смесью уксусной кислоты и
.., Фкльтрат выпаривают и к остат- ;.; ;р -шивают воду. Смесь нодщелачи-
Пс- ог едким натром и продукт экстрагируют трихлорметаном. Экстракт про-
- чиают водой, высушивают, фильтруют : ыпаривают. Остаток очищают на хро
:- ;гографической колонке на силика- гслт., используя смесь трихлорметана
; ;vV :tnoT(a (99: но объему) в чаче- элюе -гга.
И-арвую фракцию (А-изомер) собираю и э.гтоент выпаривают. Остаток подвер ii
.)i криеталлизации из 2,2 -окенбие уролана, получая 0,8 мае.ч, (8%)(А.)
- гилового эфира - 4-(5--хлор
тэ .-:; - И Ьенил) -4-цианоциклогексил ,;ил 4--пи11еридинк арбоновой кислоты
-.;i:.r(. 165,5°С, выход 8%,Вторую фракцию (В-изомер) собираю
;: ; 1- Уг,1ривают элюент. Остаток нодвер- лмг- кристаллизации из 2,2 -о ксибис-
p3i(aj:a. полз чая 1,2 мае.ч. (12%) ( .; Э 1 И.ггозого эфира 1- 4 (5 хлор-2
-;,; . : ок е ифе нил) -4 -ци ан о цикл о г е к сил J - -4 -()енил-4 - пиперидйнкарбоновой кис -
.( - м 5 т . лл . 3 1 5 8 С ; выход 12%.
П р и мер 22. К 2 мае. ч. рас-т-
зора 2 мае.г, тиофена в 40 мае.ч, эт:.1к.5ла добавляют 4,4 мае.ч, 1-(4-
-ф ./орфенил) -4-океоцикло гекеанкарбо- -гцгрила 5 мае. ч. (В)-этилового эфи-
р , 1 -метил-4-фе.нил-4-пинеридинкар- С -;овой киелоты, 3 мае.ч. ацетата
;1::трия и 160 мае. ч. этанола. Смесь Г идрируют при нормальном давлении
50°С в присутствии 2 мае.ч. палладие p.fVi-n на подложке из древееного угля
;0% катализатора. Поеле поглощения ;:асче гного количеетва водорода ка-
ч ,.-лизатор отфильтровывают и фильтрат зЬ паривают. Остаток очищают е помощь
колоночной хроматсчграфии на еилика- : e:ie, иепольгчуя гмг.еь трихлорметана
-
-
т ,
т
-
ю
20
25
- и
метанола (98:2 по объему) в качестве элюента. Очищенные фракции ео- бирают и элюент выпаривают. Остаток
подвергают криеталлизации из 2,2 - 5 океибиелропана, получая 3,3 мае.ч. (37%) ()-этилового эфира
-п,иано-4- (4 фторфенил)циклогексил - J-метил-4 фен ил 4-пиперидин к ар б о ново
и кислоты, т . пл . 1 33 , 3 С, выход 0 37%.
К 1 мае.ч. раствора 2 мае.ч. тиофена в 40 мае,ч. этанола добавляют
4j4 мае, ч. 1 (4-фторфенил) 4--оксоцик- логексанкарбонитрила, 5 мае,ч. (А)-
15 -этилового эфира 3-метил-4-фенил-4- пиперидинкарбоновой КИСЛОТЕЯ и 160 частей
этанола. /Змесь гидрируют при , нормальном давлении и в присутствии 2 мае,ч. налладиевого на подложке
из д,ревес1юго угля 10% катализатора ,. Поеле тюглощени я расчетного
количеетва водорода катализатор отфильтровывают м фильтрат выпаривают.
Остаток подверг ают криеталлизации из ацетонитрила. получая 2.6 мае, ч.
(28%) (В,,--А,)этилового эфира 1-1 4-циако 4- (4-фторфенил)циклогекеил -
- 3-ме:тш -4 фенил-4 ПИП ер идинкар боковой киелотрл, . 125;9 С выход 28%.
П р и м ер 23, К 1 мае,ч. раствора 2 мае,ч. тиофена в 40 мае.ч,, этаиола добавляют 4,4 , 1-(4-
фторгЬенил) -4-океоциклогексанкарбонит- 35 рила, 4 мае.ч. 4 фенил-4-пиперидин-
карбокеамида и 120 мае.ч. метанола. Смесь гидрируют при нормальном дав-
и 50°С в присутствии 2 мае.ч. палладиевого на подложке из древес-
40 ного угля 10% катализатора. После поглощения расчетного колгичества во-
дорора катализгггор отфильтровьшают и фильтрат выпаривают. Остаток очищают
с помощью колоночной хроматографии н силикагеле. Используя в качестве
элюента смесь трихлорметана и метанола (99:1 по объему), получают А-
-изокер, который подвергают кристал- лр зации из 2.2 -оксибиспропана. Про-
50 дукт отфильтровывают и рекристалли- зуют из этанола 5 получая 0,5 мае.ч.
(6%) (А) - 1 - 4-г;иано-4- (4-фторфенил) - -цикл о г ек еил J - 4 -ф е ни л - 4 -п ип ер идин к ар -
боксамида, т.нл. 171,4°С, выход 6%. 55 После эгтоирования емесью трихлорметана
и метанола (97:3 по обьему) получают В-изомер, который подвергают
кристаллизации из 2 ,. 2 -океибиепрона30
91230467
на. Продукт отфильтровывают и рекрис- талпизуют из этанола, получая
1 мае.ч. (12%) (В)-1- 4-циано-4-(4- -фторфенил)циклегексил -4-фенил-4-
пиперидинкарбоксамида, т.пл. 243,1°С, выход 12%.
Пример 24. Смесь 4,3 мае.ч.
1-(4-фторфенил)-4-океоциклогексанкар- бонитрила, 5,3 мае.ч. 4-(4-хлорфе20
таток подвергают очистке е помощью колонки на еиликагеле, иепользуя емееь трихлорметана и этанола (98:2
по объему) в качеетве элюента. Очищенные фракции собирают и элюент выпаривают
, Остаток превращают в хлористоводородную соль в этаноле и 2-
-пропаноле. Соль отфильтровывают, высушивают , получая 0,6 мае.ч. (21,6%)
нил)-Ы,Ы-диметил-4-пиперидинкарбоке- О (В.-Л)-этилового эфира 1- 4-цианоамида и 200 мае.ч. метанола подвергают
гидрированию при нормальном давлении и 50°С в приеутствии 2 мае.ч.
платинового на подложке из древесного угля 5% катализатора. После поглоще- 5
НИН расчетного количества водорода катализатор отфильтровывают и фильтрат
выпаривают. Остаток очищают е помощью колоночной хроматографии на еиликагеле
, используя смесь трихлорме- тана и метанола (99:1 по объему) в качестве элюента. Очищенные фракции
собирают и элюент выпаривают. Остаток подвергают кристаллизации из смеси
2-пропанола и 2,2 -оксибиспропана. Продукт отфильтровывают (маточную
жидкость отводят) и высушивают, получая 2 мае.ч. (А+В)-4-(4-хлорфенил)-1-
- 4-циано-4-(4-фторфенил)циклогек25
-4- (4-фторфенил)циклогексил -4-(4-ме-
токеифенил)-3-метил-4-пиперидинкарбо- новой кислоты моногидрохлорида, т.пл.-240,, выход 22%.
К 1 мае.ч. раетвора 2 мае.ч, тио- фена в 40 мае.ч. этанола добавляют
13 мае.ч. 1 -(4-фторфенил)-4-океоцик- логекеанкарбонитрила, 18,4 мае.ч.
(А)-фенилметилового эфира 3-метил- -4-фенил-4-пиперидинкарбоновой кислоты
и 200 мае.ч. 2-пропанола. Смесь гидрируют при нормальном давлении и
50°С в присутствии 2 мае.ч. платинового на подложке из древесного угля
5% катализатора. После поглощения расчетного количества водорода катализатор
отфильтровывают и фильтрат выпаривают. Остаток очищают с помощью колоночной хроматографии на
, Ы-диметил-4-пиперидинкарбоке- еиликагеле, используя смесь трихлор-
амида, т.пл. 184,4 С. Из маточной жидкости выкристаллизовывают другую фракцию, получая 1,5 мае,ч. (А)-4-
-(4-хлорфенил)-1 - 4-циано-4-(4-фторфенил )циклогексил -К, Ы-диметил-4-
-пиперидинкарбоксамида, т.пл. 21 2 ,2 с, выход 18%,
Пример 25. К 1 мае.ч. раетвора 2 мае.ч. тиофена в 40 мае.ч; этанола добавляют 1,2 мае.ч. 1-(4-
-фторфенил)-4-оксоциклог-ексанкарбо нитрила, 2 мае.ч. (А)-этилового эфи-
ра 3-метил-4-(4-метокеифенил)-4-пи- перидинкарбоновой кислоты этандиоата
(1:1), 2 мае.ч. ацетата натрия и 120 мае.ч. этанола. Смесь гидрируют
при нормальном давлении и 30°С в приеутствии 2 мае.ч. палладиевого на
подложке из древесного угля 10% катализатора . После поглощения расчетного
количеетва водорода катализатор отфильтровывают на фильтре Хуфло и промывают укеусной кислотой. Фильтрат
выпаривают. Из оетатка выделяют свободное оенование обычным способом,
используя гидроокись аммония, и экст- .рагируют дихло рметаном. Экстракт высушивают
, фильтруют и выпаривают. 0с20
таток подвергают очистке е помощью
колонки на еиликагеле, иепользуя емееь трихлорметана и этанола (98:2
по объему) в качеетве элюента. Очищенные фракции собирают и элюент выпаривают
, Остаток превращают в хлористоводородную соль в этаноле и 2-
-пропаноле. Соль отфильтровывают, высушивают , получая 0,6 мае.ч. (21,6%)
-4- (4-фторфенил)циклогексил -4-(4-ме- токеифенил)-3-метил-4-пиперидинкарбо-
новой кислоты моногидрохлорида, т.пл.-240,, выход 22%.
К 1 мае.ч. раетвора 2 мае.ч, тио- фена в 40 мае.ч. этанола добавляют
13 мае.ч. 1 -(4-фторфенил)-4-океоцик- логекеанкарбонитрила, 18,4 мае.ч.
(А)-фенилметилового эфира 3-метил- -4-фенил-4-пиперидинкарбоновой кислоты
и 200 мае.ч. 2-пропанола. Смесь гидрируют при нормальном давлении и
50°С в присутствии 2 мае.ч. платинового на подложке из древесного угля
5% катализатора. После поглощения расчетного количества водорода катализатор
отфильтровывают и фильтрат выпаривают. Остаток очищают с помощью колоночной хроматографии на
метана и метанола (98:2 по объему) в качеетве элюента. Первую фракцию
еобирают и элюент вьтаривают. Из остатка вьщеляют фракцию е помощью
бумажной хроматографии, иепользуя емееь гекеана, трихлорметана и метанола (100:100:0,5 по объему) в
качестве элюента. Очищенную фракцию собирают, элюент выпаривают и получают 1,5 мае.ч. (5%)()-(фенил-
метил)- - 4-циано-4-(4-фторфенил) циклогексил -3-метил-4-фенил-4- -пиперидинкарбоксилата, выход 5%.
К 1 мае.ч. раствора 2 мае.ч. тиофена в 40 мае.ч. этанола добавляют
3,5 мае.ч. 1-(4-фторфенил)-Д-окео- циклогекеанкарбонитрила, 6 нас.ч.
(В)-(фенилметнлового) эфира 4-(2- -фторфенил)-3-метил-4-пиперидинкарбоновой кислоты гидрохлорида,
4 мае.ч. ацетата калия и 160 мае.ч. 2-пропанола. Смееь гидрируют при нормальном
давлении и 50°С в приеутствии 2 мае.ч. платинового на подлож-.
ке из древесного угля 5% катализатора . После поглощения расчетного количества
водорода катализатор отфильтровывают и фильтрат выпаривают. Ос21
таток растворяют в трихлорметане, Раствор промывают водой для удаления неорганических веществ. Органическую
фазу высушивают, фильтруют и вьшари - вают. Остаток очищают с помощью коло- f,
ночной хроматографии на силикагеле, используя смесь трихлорметана н метанола (98:2) в качестве элюента.
Очищенные фракции собирают и элюент вьтаривают. В,Вр-фракцию отделяют с 10
2 U)4
25
помощью бумажной хроматографии, используя смесь трихлорметана, гексана и метанола (100:100:0,5 по объему).
Очищенную фракцию собирают и элюент выпаривают. Остаток превращают в хло
ристоводородную соль в 2-пропаноле. Соль о тфильтровывают и высушивают, получая 4,4 мае. ч. ( )-фенилмети
лового эфира 1 - 4-циано-4-(4-фторфе нил)циклогексил -4-(2-фторфенил)-3-
-метил -4-пиперидинкарбоновой кислоты моно гидрохлорида , т . пл . 239,4 С, в 11ход 47%.
К 1 мае.ч. раствора 2 мае.ч. тио- фена в. 40 мае.ч. этанола добавляют
3 мае.ч. 1 -(4-фторфенил)-4-океоцик- логексанкарбонитрила, 18,4 мае.ч.
(А)-фенилметилового эфира 3-метил- -4-фенил-4-пиперидинкарбоновой кислоты
и 160 мае.ч. 2-пропанола. Смееь гидрируют при нормальном давлении
и 50°С в присутствии 2 мае.ч. платинового на подложке из древесного угл
5% катализатора. После поглощения расчетного количества водорода катализатор отфильтровывают и фильтрат
выпаривают. Остаток очи1чают е помощъ 1СОЛОНОЧНОЙ хроматографии на силикагеле , используя смесь трихлор
метана и метанола (98:2 по объему) в качестве элюента. Очищенную фракцию собирают и элюент выпаривают
Остаток превращают в хлориетоводород еоль в 2-пропаноле. Соль отфильтровывают и выеущивают, получая
8,4 мае.ч. ( )-фенилметилового эфира 1- 4-циано-4- (4-фторфенил)цик-
логексил -3-метил-4-фенил-4-пиперидинкарбоновой кислоты моногидрохло- рида, т,пл. 223,, выход 25%.
К мае.ч. раетвора 2 мас.ч.тиофе на в 40 мае,ч. этанола добавляют
6,6 мае.ч. - (4-фторфенил)-4-оксоцик логекеанкарбонитрила, 10,5 мае.ч.
(В)-фенилметилового эфира З-метил-4- -фенил-4-пиперидинкарбоновой киелоты
гидрохлорида, 6 мае.ч. ацетата калия и 200 мае.ч. 2-лропа юла. Смееь гид
f, 10
20
30
15
. U
)46722
рируют при нормальном давлении и 50 С в присутствии 4 мае.ч. платинового
на подложке из древесного угля 5% катализатора . После поглощения раечет-
ного количества водорода катализатор отфильтровывают и промывают уксусной
кислотой. Фильтрат выпаривают и остаток растворяют в воде. Смесь подщелачивают
едким натром и продукт экстрагируют трихлорметаном. Экстракт промывают водой, высушивают, фильтруют
и выпаривают. Остаток очищают с помощью колоночной хроматографии на силикагеле
, используя смесь трихлорметана и метанола (98:2 по объему) в качестве элюента.Очищенные фракции
собирают и элюент выпаривают. От,остатка отделяют А -Вр-фракцию с помощью
бумажной хроматографии, используя смесь гексана, трихлорметана и метанола (100:100:0,5 по объему) в
качестве элюента. Очищенную фракцию собирают и элюент выпаривают, получая 0,8 мае.ч. (5%) ()-фенилме-
25 тилово1 о 1 - 4-циано-4-(4-фторфенил)- циклогексил -3-метил-4-фенил-4-пипе-
ридинкарбоновой кислоты, выход 5%. Таким же образом получают: ()-фенилметил-1- 4-циано-4-
-(4-фторфенш1)циклогекеил |-3-метил-4- -фенил-4-прП1еридинкарбоксилат,
т.пл. 131°С, выход 31%, температура реакции
(А, ) -фепилметил- - 4-циано-4- -(4-фторфенил)циклогексил 1-4-(2-фторфенил
) -3-метил-4-пиперидинкарбокеи- лат„ выход 11%, температура реакции
(В., -Ар,) (-н) -фенилметил- -14-циано- -4-(4-фторфенил)циклогексил -4-(2-
-фторфенил)-З-метил-4-пиперидинкар- бокеилата моногидрохлорид, т.пл.213, Г С; выход 29%, температура
реакции 30°С;
35
40
( „) ( + )-фенилметил- - 4-циано- -4-(4-фторметил)пиклогексил -4-(2-
-фторфенил)-З-метил-4-пиперидинкар- боксилат, выход 8%, температура реакции
(В, Вр) ( + ) -фенилметил-1 - 4-циано- -4-(4-фторфенил)цмклогекеил -З-метил-
-4ггфенил-4-пи11еридипкарбокеилата, выход 60%, температура реакции 30°С;
()(-)-феинлметил-1- 4-циано- -4- (4-фт(зpфeнпл) циlcJIoгeкeилJ --З-ме-
тил-4-фенил-4- |иперпдинкарбоксилат, выход 56%, температура реакции 30°С.
П р и м р р 26. С.месь 10,9 мае. ч ги.попот о чфира I - i 4-циппо-4-(
Ьснил) -1 .ил -Д-феинл-4-пи- мг ридиикарб(1новой кислоты, 11 ,2мас.ч гидроокиси калия, 50 мае.ч. воды и
)6 мае.ч. 2-про11а1юла перй.1ешивдтт и кипятят с обратным холодидьником в
течение 4 ч. Реакционную смесь фильтруют в горячем состоянрш на фильтре Хуфло и фильтр.ат выливают на
.ЮО мае.ч. воды. Все это нейтрализую уксусной кислотой до рН 6-7. Отфильтровывают
осажденный продукт, трижды промывают водой и преобраз тот в гид- рохлоридную соль в этаноле и 2-про-
паноле. Соль отфильтровывают и суе- пендируют в растворе 1,4 мае.ч. гидроокиси калия в 150 мае.ч. воды.
бодное основание четырежды экстрагируют 70 мае.ч. 1,1 -оксибисэтана. Водную фазу отделяют и перемешивают
в течение достаточного времени на центробежном испарителе для удаления
всех следов 1,1 -оксибиеэтана. Прозрачную водную фазу подкисляют 10%-ным раствором уксусной кислоты
до рН 6. Отфильтровывают осажденный продукт, промывают водой и сушат на
протяжении ночи при 105°С, получая 5,4 мае.ч. (66,6%) 1-(4-циано-4-(4-
-фторфенил)циклогекснл -4-фенил-4- -пиперидинкарбоновой кислоты, т.пл. 281 , 1°С.
В соответствии с той же методикой получают соединения общей формулы приведенные в табл.4.
Пример 27. Смесь 1,2 мае.ч. (в)-фенилметилового эфира 1-(4-циа-
но-4-(4-фторфенил)циклогексил -3- -метил-4-фенил-4-пиперидинкарбоновой
кислоты в 80 мае.ч. 2-пропанола гидрируют при нормальном давлении и комнатной
температуре с использованием 1 мае.ч. катализатора ;10% палладия
на угле). После отбора расчетного количества водорода катализатор отфильтровывают
и промывают метанолом, насыщенным аммиаком. Фильтрат упариваю и остаток отбирают в смеси гидроокиси
калия и воды. Все это промывают три- хлорметаном. Водную щелочную фазу
нейтрализуют 10%-ным раствором уксусной кислоты. Осажденный продукт отфильтровывают
, промывают водой, осушают и преобразуют в метаноле в гид- рохлоридную соль. Соль отфильтровывают
и сушат, получая 2 мае.ч. (66%) моногидрохлорида ()-l- 4-цианоДЬ7
-А- (А --фторфенил) -циклегексил i -4- (2- -(tl ropфeнил) -3-метил-4-ПИПеридинкар-
боновой кислоты, т.пл. 300,6°С.
Смесь , 7 мае. ч. (В,-Л )-фенилме-
5 тилового эфира 1 - А-циано-4-(4-фтор- фенрш)-циклогекеил 1-3-метил-4-фенил-
. -А-пигтеридинкарбоновой кислоты и 270 мае.ч. тетрагидрофурана гидрируют
ггри нормальном давлении и ком0 натнои температуре с использованием
2 мае.ч. катализатора (10% палладия на угле). После отбора расчетного количества
водорода катализатор отфильтровывают и фильтрат упаривают.
5 Остаток преобразуют в гидрохлоридную соль в смеси метанола и 2,2 -оксибис-
пропана. Соль отфильтровывают и сушат , получая 1 мае.ч. (16%) моногидрата моногидрохлорида (В.-А )
-циано-4-(4-фторфенил)циклогекеил 1-. -3-метил-4-фенил-А-пиперидинкарбоновой кислоты, т.пл. 291,.
Смесь 1,5 мае.ч. ( )- фенил- метилового эфира 1- А-циано-4-(4-
-фторфенил)циклогекеил -3-метил-А- -Ленил-А-пиперидинкарбоновой кислоты
и 90 мае.ч. тетрагидрофурана гидрируют при нормальном давлении и комнатной
температуре с использованием
1 мае.ч. катализатора (10% палладия
на угле). После отбора расчетного количества водорода катализатор от-
фильтровьтают и фильтрат упаривают. Остаток обрабатьшают водой и г идро5
окисью калия. Затем промывают три- хлорметаном. Водную щелочную фазу
нейтрализуют 10%-ным раствором уксусной кислоты. Осажденный продукт отфильтровывают
, промьшают водой, су0 шат и преобразуют в гидрохлоридную еоль в метаноле и 2, 2 -оксибиспропа-
не, получая 0,6 мае.ч. (42%) моногидрата моногидрохлорида (А -А )
циано-4-(А-фторфенил)циклогексилЗ-З- .
5 метил-А-фенил-А-пиперидинкарбоновой
кислоты, т.пл. 261,6 С.
Смесь 0,9 мае.ч. ()-фенилметилового
эфира 1 - А-циано-4-(4-фторфенил ) циклогекеил -4-(2-фторфенил)0
-З-метил-4-пиперидинкарбоновой кислоты и 90 мае.ч. тетрагидрофурана
гидрируют при нормальном давлении и комнатной температуре с иепользова-
нием 1 мае.ч, катализатора (10% пал5 ладия на угле) . После отбора расчетного
количеетва водорода катализатор отфильтровьшают и промьтают метанолом , насыщенным аммиаком. Фильтрат
упаривают и остаток отбирают в смеси
воды и гидроокиси калия. Все это про мь1вают трихлорметаном, Водную щелочную фазу нейтрализуют раство -
ром уксусной кислоты. Осажденный продукт отфильтровывают и преобразуют в гидрохлоридную соль в метаноле и
2,2 -оксибиспропане. Соль отфильтровывают и сушат, получая 0,3 мае.ч, (37%) моногидрата.моногидрохлорида
)-1- 4-диано-4-(4-фторфенил) диклогексил|-4-(2-фторфенил)-3-ме- тил-4-пйперидинкарбоновой кислоты,
т.пл. 242,2-244,4°С. . .
Пример 28. Смесь 0,7 мае.ч.
()(+)-фенилметилового эфира 1- - 4-циано-4-(4-фторфенил)циклогек- (2-фторфенил) -З-метил-4-пипе-
ридинкарбоновой кислоты и 90 мае.ч. тетрагидрофурана гидрируют при нормальном
давлении и комнатной температуре с использованием 1 мае,ч. катализатора (10% палладия на угле).После
отбора расчетного количества водорода катализатор отфильтровывают. Осадок на фильтре промывают метанолом
, насьщенным аммиаком и фильтрат упаривают. Остаток отбирают в воде и
гидроокиси калия. Все это промывают трихлорметаном. Водную щелочную фазу
нейтрализутот 10%-ньм раствором уксусной кислоты. Осажденный продукт отфильтровывают
, промывают водой, суша и преобразуют в гидрохлоридную соль в метаноле и 2,2 -оксибиспропане.
Соль отфильтровывают и сушат, получая 0,3 мае.ч. (49%) моногидрохлорида () (±)-1- 4- циано-4-(4-фтор-
фенил)циклогексил -4-(2-фторфенил)- -З-метил-4-пиперидинкарбоновой кислоты , т.пл.282,.
Аналогичнь(м путем получают моноги рохлорид ()(±)-1- 4-диано-4-(4-
-фторфенил)дикло г ексил J- 4-(2-фто рфе- нил)-З-метил-4-пиперидинкарбоновой кислоты, т.пл. 288,8°С.
Пример 29. Смесь 4 мае.ч. (Bp-Bp)(-)-феннлметилового эфира 1-
- 4-диано-4-(4-фторфенил)циклогексил -3-метил-4-фенил-4-пиперидинкарбоно -
вой кислоты и 225 мае.ч. тетрагидрофурана гидрируют при нормальном давлении
и комнатной температуре с ие- пользованием 2 мае. ч. катализатора (10% палладия на угле). Поеле отбора
расчетного количества водорода катализатор отфильтровывают и промывают метанолом, насыщенным аммиаком.
Фильтрат упарияан т. Остаток преобразуют в гидрохпоридную г-(,). Б метано-
ле, Соль отфильтровывают и сушат, получая 3 мае. ч. (82%) моногидрохлорида
(В -В,,) - (-) - 1 -1 4-циано-4- -(4-фторфенил)циклогекеил1-3-метил-
-4--фенил-4-пиперидинкарбоновой кис- лоты, т. пл. 298,.
Аналогичным путем получают моно- гидрохлорид (В,. -Вр ) ( + )- -14-циано-4-
-(4-фторфенил)-диклогексилJ-3-метил- -4-фенил-4-пиперидинкарбоновой кислоты , т. пл. 298,.
Пример 30. По методике, описанной в пТзимере 18, получают:
(+)()-фенилметил-1- 4-диано- -4-(4-фторфенил)циклогекеилj-3-метил- -4-фенил-4-пиперидинкарбоксилат,
т. пл. 130,8 С, выход 27%, температура реакции 30 С;
(+)()-1- 4-ииано-4-(4-фтор- фенил) циклогексил -З-метил- -фенил- -4-пиперидиновой кислоты моногидро-
хлорид, т. -пл. 300 С, выход 58%, температура реакции 45 С;
3-феноксипропил-1- 4-циано-4-(4- фторфенил)циклогекеил -4-фенил-4-пи-
перидинкарбоксилат, т. пл. 145,0°С, выход 47%, температура реакции 95°С;
3-(4-метокеифенокеи)пропил-1 -циано-4-(4-фторфенил)циклогексил - -4-фенил-4-пиперидинкарбоксилат,
т. пл. 189,3°С, выход 43%, температура реакции 100°С;
этил-1- 4-циано-4- 4-(2,3-дихлор- фенил)циклогекеил}-4-фенил-4-пипе-
ридинкарбоксилат, т. пл. 147,3°С, выход 32%, температ ура реакции 30 С;
(В)-этил-1- 4-(5-хлоро-2-метокси- фенил )-4-циано-циклогексил) -4-фенил-
-4- пиперидинкарбоксилат, т.пл. 130, Г С, выход 21%, температура ре- акдии 66 С;
этил-1- 4-(З-хлор-2-метилфенил)- 4-цианоциклогексил -4-фенил-4-пипе-
ридинкарбоксилата моногидрохлорид, т. пл. 231,6 С, выход 20%, темпера- . тура реакции 100°С;
3-метокеипропил-1 - 4-циано-4-(4- фторфенил)циклогексил -4-фенил-4-пи-
перидинкарбокеилата моногидрохлорид, т.(.,пл. 256,, выход 47%, температура реакции 30°С;
(А)-1 - Д-циано-4-(4-фторфенил) циклогексил -4-фенил-4-пиперидинкар-
бокеамид, т. пл. 171,0°С, выход 20%, температура реакции 50°С;
27 .
этил-I-{4-циано-4- З-(трифторме-
тил)фенил пиклогексил|-4-фенил-4-пи перидинкарбоксилата моногидрохлорид т. пл, 257,, выход 22%, температура
реакции 70 С;
2-(диметиламино) этил 1-г 4-циано-
-4-(4-фторфенил)диклогексил -4-фе- нил-4-пиперидинкарбоксилат, т. пл. ,8 С, выход 17%, температура ре-
акдии 30 с;
(А+В)-4-(4-хлорфенил)-1 - 4-пиа- но-4-(4-фторфенил)диклогексил -N,N-
-диметил-4-пиперидинка рбоксилат, т. пл. 179,6°С, выход 22%, температура реакдии 100 С;
4- l- 4-диано-4-(4-фторфенил)дик логексилЗ-4-фенил-4-пиперидинкарбо-
нилТморфолин, т. пл. 180,6 С, выход 31%, температура реакдии 100°С;
, 2-(1-пирролидинил)этил-1- 4-диан (4-фторфенил)диклогексил -4-фе- нил-4-пиперидинкарбоксилат, т. пл.
116,8°С, выход 24%, температура реакдии ,
2-(4-морфолинил)этил-1- 4-диано-
-4-(4-фторфенил)диклогексил -4-фе- нил-4-пиперидинкарбоксилат, т. пл.
125,3°С, выход 29%, температура реакдии 70°С;
1- 1- 4-диано-4-(4-фторфенил) диклогексил -4-(3-метилфенил)-4-пи- перидинкарбонил/пирролидин, т. пл.
179,9°С, выход 24%, температура реакдии 30°С;
этил-1- 4-диано-4-(4-фторфенил) диклогексил -4-ГЗ-(этоксикарбонил) фенил -4-пиперидинкарбоксилат,
т, пл. 130,, -выход 22%, температура реакдии 30 С.
Пример 31. По методике,
описанной в примерах 17 и 19, исходя из соответствующих диклогекса- нонов и пиперидинов получают:
этил-1- 4-циано-4-(2-пиридинил) диклогексил -4-фенил-4-пиперидинкар
боксилат, т. пл. 158,9°С, выход 31% температура реакдии 30 С;
1-фенил-4- 4-фенил-4-(1-пипери- динилка1)бонил)-1-пиперидинил -циклс
гексанкарбонитрила гидрохлорид, т. пл 283,2°С, выход 38%, температура реа5ции 30 С.
Получение монохлоргидрата , (j)-tl-(u-Mc), Зы, 4р-1-С4-диано-4-
-(2-тиенил)диклoгeкcил -3-мeтшI-4- -фeнил-4-пипepидинкapбoнoвoй кислоты .
728
Смесь 5 мае. ч. 4-оксо-1-(2-тие-
нил)-диклогексанкарбопитрила, 6 мае .ч. бромгидрята ( + )- 7Р «с-3-метил-4-фе-
нил-4-пиперидинкарбоновой кислоты, 1 мае. ч. двуокиси углерода, 7 мае.ч.
30%-ного раствора метилата натрия и 225 мае.ч. 2-метоксиэтанола подвергают гидрогенизадии при нормальном
давлении и при комнатной температуре с использованием 2 мае.ч. катализатора
(10% палладия на древесном угле ) . После расходования рассчитанного количества водорода катализатор
отфильтровывают через фильтр Хуфло и фильтрат выпаривают. Остаточный продукт вьтаривания суспендируют в
400 мае.ч. горячей воды и суспензию подкр сляют уксусной кислотой. Твердый
продукт отфильтровывают, три раза промывают водой и суспендируют в метаноле
. После нагревания суспензию подкисляют 2-пропанолом, насыщенным хлористым водородом. Образующаяся
хлоргидратная соль отфильтровывается и высушивается, в результате чего получается 3,4 мае.ч. (38,2%)
хлоргидрата (+)- 1-(и,ис ) , 3oi, 4(5-1- - 4-диано-4-(2-тиенил)-диклогексил -
-3-метил-4-фенил-4-пиперидинкарбоно- вой кислоты; т. пл. 260°С.
Найдено,%: С 63,12; Н 6,56; N 6,15.
Вычислено,%: С 64,78; Н 6,57;
N 6,29.
A.Осуществляя продесс, как описано в примере 18, получают:
1 - 4-диано-4-(фторфенил)-1-дикло- гексен-1-ил -4-фенил-4-пиперидинкар-
боксамид, т. пл. 187,3 С
Найдено,%: С 73,79; Н 6,25; 9,74.
Вычислено,%: С 74,42; Н 6,49; 10,41 .
1 - 4-циано-4-(4-фторфенил)-1-цик- о г ек се Н-1-ил -N,N-дине тил-4-фенил-
иперидинкарбоксамид; т. пл. 160,5°С.
Найдено,%: С 74,54; Н 6,95; N 9,53.
Вычислено,%: С 75,15; Н 7,01; 9,74.
B.Осуществляя продесс, как описано в примере 18, получают:
СА) -1-С4-циано(4-фторфенил)диклоексил -4-фенил-4-пиперидинкарбокс- мил, т.пл. 172,3 С; ,
(А+В)-4-(4-хлорфенил)-1- 4-циано- 4-(4-фторфенил)цикло г ек ,N-ди
291
метил-4-пиперидинкарбоксамид, т. пл .
160,5°С.
Соединения формулы (О и их фармацевтически
приемлемые соли присоединения кислоты являются мощными проти
вогистаминными средствами и могут использоваться для приготовления медикаментов
для терапевтического лечения людей и животных. Полезные проти вогистаминные свойства соединений
формулы (1) подтверждаются следующей методикой испытаний.
Защита крыс от летальности, вызываемой соединением 48/80.
Соединение 48/80, смесь олигоме-. ров, получаемых конденсацией, п -ме-
тoкcи-N-мeтил-фeнилэтилaминa и формальдегида , опис&вается как мощное
гистаминвысвобождающее средство. Защита от летального коллапса органов
кровообращения, вызьюаемого соединением 48/80, может служить простым путем количественной оценки про-
тивогистаминной активности испытываемых соединений. Крысы-самцы инбредно
расы Wistar, массой 240-260 г, использовались в качестве подопытных животных. После голодания на протя-
жении ночи крыс переносили в лаборатории (температура С, относительная влажность ) . Крысам
вводили подкожно или перорально испытуемое соединение или растворитель
(раствор NaCl 0,9%). Спустя 1 ч внутривенно делали иньекцию соединения 48/80, свежераствореиного в воде,
при дозировке 0,5 мг/кг (0,2 мл/100 массы тела). В контрольных экспериментах , где 250 животным, которым
вводили растворитель, делали иньекцию стандартной дозы соединения 48/80, спустя 4 ч выживало не более
2,8% животных. Поэтому выживание спустя 4 ч считалось безопасным критерием защитного эффйкта вводимого
лекарства.
В табл, 5 и 6 для ряда соединений формулы (1) даны пероральные дозы,
при которых крысы оказывались защищенными от летальности, вызьшаемой соединением 48/80.
Токсикологические данные.
Величина LD (смертельная доза
для 50% подопытных животных) составляет свыше 40 мг/кг массы тела для
всех составов, по которым приводятся фармаколог1-(ческие данные.
30
5
0
5
Предпочтительное соединение сог-- ласно изобретению моногидрохлорид
(Bj, -Вр) (-)-l- 4-циaнo-4-(4-флyopo- фeнил) циклогексил -3-метил-4-фенил-
-4-пиперидинкарбоксиловой кислоты, описанное в примере 29. Испытание 1.
Острая пероральная токсичность моногидрохлорида (В,-Вр) (-) -1 - 4-ци-
ано-4-(4-флуорофенил)циклогексил - 3-метил-4-фенил-4-пиперидинкарбокси-
ловой кислоты испытывалась на 30 самцах и 30 самках взрослых крыс Вистар,
первоначальная масса тела которых 239-277 г для самцов и 228-269 г для самок.
За день проведения испытания животных перевели из их садков в лабораторное
помещение с воздущным кондиционированием (температура воздуха 22 +2°С; относительная влажность
65jfl5%; цикл смены темноты и света 12 ч). На ночь их не кормили, вода
из-под крана предоставлять неогра-. ничейно.
HeifapCTBo вводили посредством желудочного зонда, введенного через,
нос, в количествах, выраженных в ми- лиграммах на килограмм массы тела,
в объеме 1 мл на 100 г массы тела. Животных разместили в отдельных
клетках и наблюдали за ними в течение 14 дней. Через равные промежутки
времени регистрировали количество смертельных случаев.
Помимо указанного раствора, испы-. тывали еще две дозы: 1280 и 2650 мг/кг.
Смертельных случаев не наблюдалось. Таким образом, расчетные величины
LDg через 4 дней после перорального введения состава следующие: для
самцов - более 2560 мг/кг, для самок - более 2650 мг/кг. Испытание 2,
Дл:я этого испытания было использовано 12 взрослых самцов и 12 взрослых
самок нечистокровных собак. Первоначальная масса тела собак 5,0- 9,8 кг для самцов и 4,4-11,8 кг для
0 самок.
Моногидрохлорид ()(-) -циано-4-(4-флуорофенил)-циклогек-
сил -3-метил-4-фенил-4-пиперидин- карбоксиловой кислоты вводили перо-
55 рально при помощи зонда. Использовали стандартную концентрацию 320 мг
на 1 1ЧЛ в трех различных дозах: 2,00, 4,00 и 8,00 мл на 1 кг массы
0
5
0
5
31,
тела, что соответствует дозам 640,
1280 и 2650 мг/кг. Смертность и значительные изменения в поведении за- письшали сразу же после введения
состава, периодически в течение первого дня и по крайней меро один раз в день в течение 14 дней наблюдения
. Массы тела измеряли перед введением состава, через 7 и 14 дней., Умершие в течение испытания животные
после вскрытия подвергались макроскопическому исследованию. Микроскопически ткани не исследовались.
Смертность. При дозе 640 мг/кг умерла одна самка на двенадцатый
день. При дозе 1280 мг/кг на шестой день умерли один самец и одна самка.
При дозе 2650 мг/кг два самца умерли на двенадцатый и на четырнадцатый
день, а две самки - на шестой день.
3046732
В условиях проведенных испытаний пероральное введение моногидрохлори-
да (В(.-Вр ) (-)-1- 4-циано-4-(4-флуо- рофенил)циклогексилЗ-3-метил-4-фенил-
5 -4-пиперидинкарбоксиловой кислоты было смертельным для одной самки из
четырех при дозе 640 мг/кг, для одного самца и одной самки из четьфех
при дозе 1280 мг/кг и для двух сам- 10 цов и двух самок из четырех при дозе 2560 мг/кг.
У двух собак в течение 6 ч после введения состава при дозах наиболее
высокого уровня бьти отмечены рвота и бледные экскременты. Расчетная пероральная LD через 14 дней после
введения состава как для самцов, так и для самок составила приблизительно 2560 мг/кг.
ts
20
Таблица 1
НС АР
О
II ,
C-0-R Аг2
Ar
Аг
.
C.H,
,
CJ 5
Я.Н,
4-F4:,H,
CeHa
C.HS C,H,
4-F-C.H,
C.HS
R
-CHj
(CH,),
Основа- ян
ц
-И-
- .i
НС1
142,23630
121,64830
144,16530
1«7.74830
245,7
15 45
4-ОСН -С Н -0-(СН Основа- ,6 53
35
нке
2-СН,)-(СН4)д- 4-CH ,(CH)
Ч
c,R,
««
CHj-CHj-CH{CHj)
2-OCHj-C4H -0-(CH)j
33
i23046734
Г1родолжсние табл. 1
Продолжение табл. 1
V
1Л
Оч
СО
о
л
чО
f.
о
IN
О
СП
1
r
Г-.
1
ЧО
м
vO
т
I f-О ) VD
co
I
f
«
.
I-1
e
(Q
at u
ss
S g
и
о
ю
in чГ
c г
vO СТ
Г
г
о
р
Й
Й
«
n о
о
оffi
м
я
M
и
Д
я
Я
я
V
Й
м
ш
U
Р5
я
я
я
lO
и
fa
о
-
X
u
w u
CT
ЦЗ I3i
V V
л rt(0
gP2к
uu
о
к
и
evj
#-
vj
И ty
6
Я
о
я
о
о о
-PC
и
и
ts
о
I
га
см
ИЗ у
- -.Г
г-4
О
1Л I л
м и
CN
И
о
( JX)
и
и t
(Л
I
л
я о
см
я
я
и I
fn
vr
я
VJ)
и
я
о
(14
и
я
vi
и
я
v°
t
я
я
v«
U
I
(14
-dи
I
k
-
39
4-F-C K
Ш.
ОснованиеA
74,0573,446,696,8910,3610.23
4-F-CgH 4-Cl-C H (з), Ь 69,2969,,686,838,988,75
73,2373,247,217,248,848,73
76,0875,967,667,788,878,71
73,2272,237,787,838,548,40
у Л -/ /соон
1 2 K)4fi7
40 Таблица 3
Таблица 4
d-o:; )ООл.
Таблица 5
0
1 к
d-oK
2
л.
Продолжение табл. 5
4-F-C,H. C .HS
4-F-C,H,2-CHj
, 4-F.-C
C.HS
4-F-C,H,a-cFj-c H 4-F-C , 4-F-C H,4-F- : ,K,4-F-CeH
,2-CH ,, 3-Cl-CglI
2-F-C H,
2-F-C,HC .HS
.C,H,
H H H H
4-F-C,H,2-CH .j, 5-Cl-CjHj
C,KS
Таблица 6
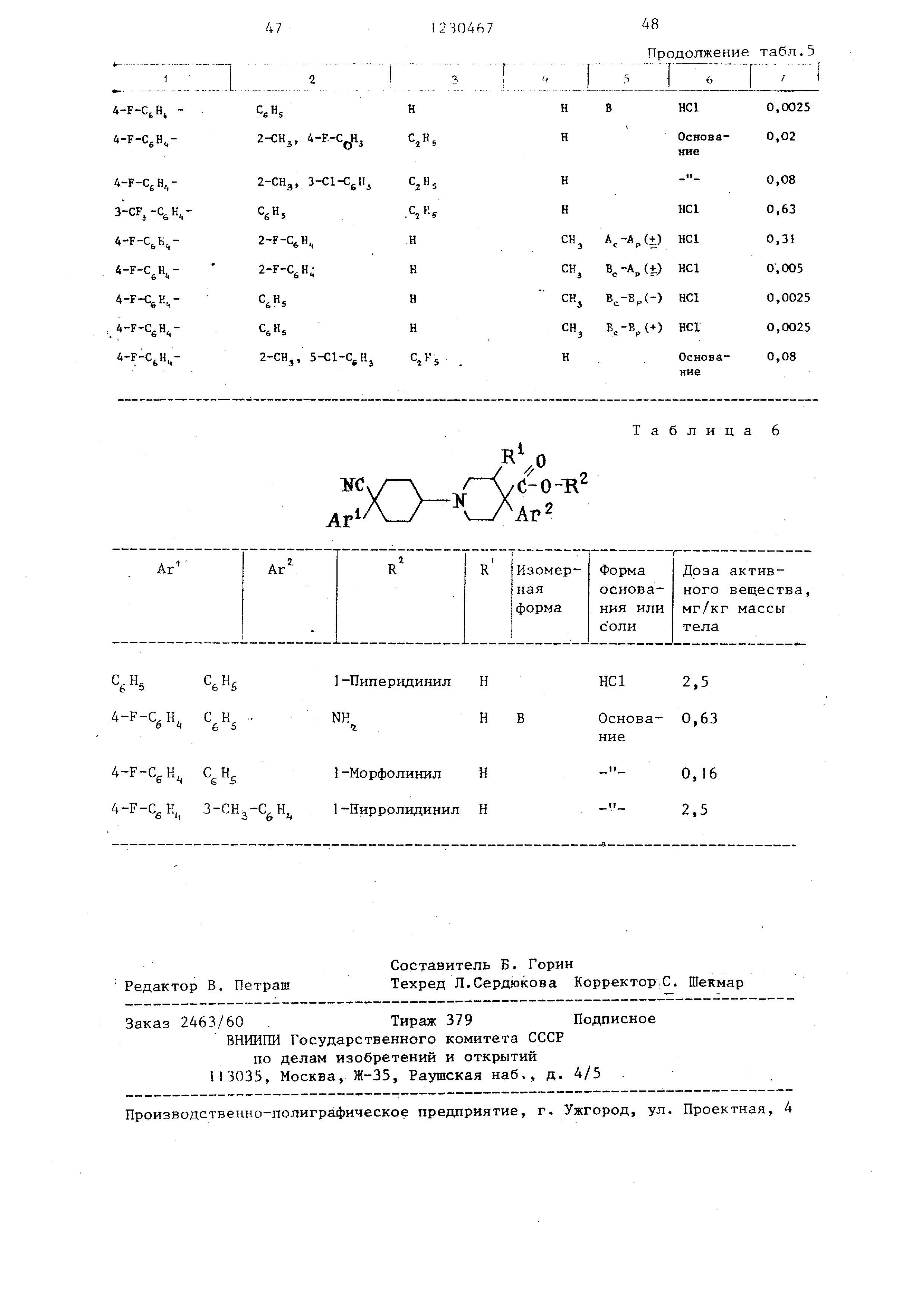
Cv/- / /С-0-Т1
. ,
Ar Ar R R Изомер-ФормаДоза активнаяоснова-ного вещества,
формания илимг/кг массы Iс олитела
CgHgC Hg1-Пиперидинил ННС12,5
4-F-CgH . ВОснова- 0,63
ние
4-F-CgH CgH 1-Морфолинил О, 6
4-F-CgH 1-Пирролидинил 2,5
Составитель Б. Горин Редактор В. Петраш Техред Л.Сердюкова Корректор С, Шекмар
Заказ 2463/60 .Тираж 379 Подписное
ВНИИГШ Государственного комитета СССР
по делам изобретений и открытий
113035, Москва, Ж-35, Раушская наб., д. 4/5.
„ .„. - - - ---. ----- - -. - - - - - - - - - - - - -- - - ---
Производственно-полиграфическое предприятие, г, Ужгород, ул. Проектная, А
Продолжение табл.5
HCl
Основание
HCl
A,-A/±)HCl
B,, -A (t)HCl
(-)HCl
E,-Bp(+)HCl
Основание
0,0025
0,02
0,08
0,63
0,31
0,005
0,0025
0,0025


























Комментарии