Способ получения алициклического спирта - RU2530880C2
Код документа: RU2530880C2
Описание
Область, к которой относится изобретение
Настоящее изобретение относится к способу получения алициклического спирта, который применим в качестве исходного материала для ароматизирующей смеси или аналогичного.
Уровень техники
Патентный документ 1 описывает, что алициклические спирты, представленные следующей ниже общей формулой (III), включают спирт, применимый в качестве исходного материала для ароматизирующей смеси. Патентный документ также описывает способ получения алициклических спиртов, представленных следующей ниже общей формулой (III), в котором, например, (4-изопропил-1-метилциклогексил)метанол получают восстановлением ненасыщенного спирта, полученного из 1-изопропил-4-метил-1,3-циклогексадиена и формальдегида, с использованием кислотного катализатора. Однако вышеуказанный способ имеет проблемы, например, поскольку 1-изопропил-4-метил-1,3-циклогексадиен, который является исходным материалом в данном способе, имеет сопряженную двойную связь, данное соединение нестабильно в присутствии кислотного катализатора и, более того, поскольку оно имеет множество реакционно-способных центров, оно обладает низкой селективностью реакции с низким выходом.
Кроме того, 1-изопропил-4-метил-1,3-циклогексадиен, который является исходным материалом, не содержится в обычном натуральном эфирном масле в высокой концентрации и, поэтому, необходимо использовать дистилляционную колонну, имеющую ряд ступеней, или выделять перегонкой после увеличения содержания предполагаемых для использования диеновых соединений с помощью реакции изомеризации, что вызывает множество проблем с точки зрения доступности и стоимости.
[Химическая формула 1]
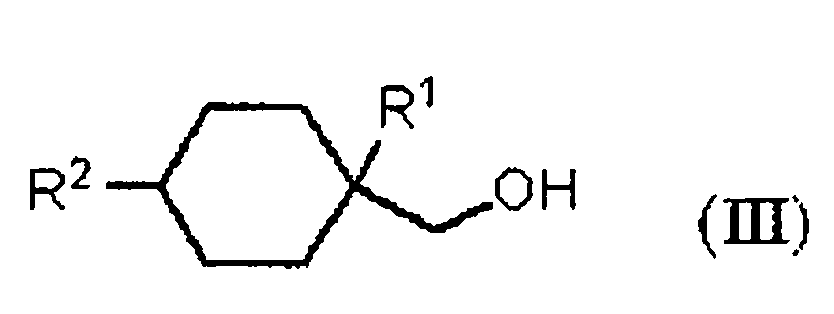
В вышеуказанной формуле (III), R1 представляет алкильную группу, содержащую 1-4 атома углерода. R2 представляет алкильную группу, содержащую 1-4 атома углерода.
Непатентный документ 1 описывает, что (4-изопропил-1-метилциклогексан)карбоновую кислоту получают карбонилированием п-ментена-1, используя BF3 в качестве катализатора, что однако требует давления монооксида углерода, равного 100 атм (1,01·107 Па) или более, для реакции карбонилирования. Непатентный документ 1 описывает, что для цели идентификации полученную таким образом (4-изопропил-1-метилциклогексан)карбоновую кислоту подвергают метил-этерификации, после чего следует восстановление посредством LiAlH4, с получением (4-изопропил-1-метилциклогексил)метанола. Однако он не дает подробного описания способа.
Когда карбоновую кислоту подвергают алкил-этерификации, в общем, она взаимодействует со спиртом в присутствии кислотного катализатора посредством удаления воды. Однако в случае третичной разветвленной карбоновой кислоты, такой как (4-изопропил-1-метилциклогексан)карбоновая кислота, скорость реакции этерификации является низкой, и выход является незначительным. Поэтому, не просто осуществить алкил-этерификацию эффективным образом после получения (4-изопропил-1-метилциклогексан)карбоновой кислоты согласно способу, описанному в непатентном документе 1. Таким образом, нельзя сказать, что он является подходящим промышленным способом получения предполагаемого для использования (4-изопропил-1-метилциклогексил)метанола с высоким выходом.
Тогда как способ карбонилирования соединения с одной двойной связью в присутствии HF общеизвестен из патентного документа 2, и способ получения соединения спирта гидрированием карбонильного соединения общеизвестен из патентного документа 3, не было известно объединение данных способов карбонилирования и гидрирования со способом получения алициклического спирта, представленного вышеуказанной общей формулой (III), который применим в качестве исходного материала для ароматизирующей смеси. Кроме того, не было известно простое получение вышеуказанного алициклического спирта посредством использования, в качестве исходного материала, натуральных эфирных масел, которые являются предпочтительными с точки зрения доступности и стоимости, например, лимонена, который является легкодоступным натуральным продуктом.
Документы предшествующего уровня техники
[Патентный документ]
Патентный документ 1: Патент Японии № 4102412.
Патентный документ 2: Публикация выложенного патента Японии № 2006-282658.
Патентный документ 3: Публикация выложенного патента Японии № 2000-001447.
[Непатентный документ]
Непатентный документ 1: Известия Академии Наук СССР, Серия химическая №4, стр.841-847 (1979), (Chemical Abstract Vol.91, № 70749).
Описание изобретения
Задачи, которые необходимо решить изобретением
Задача настоящего изобретения состоит в решении вышеуказанных проблем и предложении способа получения алициклического спирта, применимого в качестве исходного материала для ароматизирующей смеси или аналогичного с низкими затратами и высоким выходом.
Средство решения проблем
Авторы настоящей заявки исследовали способ получения алициклического спирта, представленного общей формулой (III), из ненасыщенного углеводорода, представленного общей формулой (I), и в результате они обнаружили, что ненасыщенный углеводород, представленный общей формулой (I), можно карбонилировать с высоким выходом в присутствии HF под низким давлением монооксида углерода (CO), равным 5 МПа или ниже, получая циклогексанкарбонильное соединение с высоким выходом, и далее, восстанавливая циклогексанкарбонильное соединение, можно получить предполагаемый для использования алициклический спирт с высоким выходом.
Таким образом, посредством вышеуказанных полученных данных, было осуществлено настоящее изобретение.
[Химическая формула 2]

В формулах, R1 представляет алкильную группу, содержащую 1-4 атома углерода. R2 представляет алкильную группу, содержащую 1-4 атома углерода. R3 представляет OH группу, фтор или OR4 группу. R4 представляет алкильную группу, содержащую 1-4 атома углерода.
То есть настоящее изобретение относится к способу получения алициклического спирта, показанному как следует ниже.
[1] Способ получения алициклического спирта, который включает
получение циклогексанкарбонильного соединения, представленного общей формулой (II), карбонилированием ненасыщенного углеводорода, представленного общей формулой (I), с использованием монооксида углерода в присутствии HF, и далее,
получение алициклического спирта, представленного общей формулой (III), восстановлением указанного циклогексанкарбонильного соединения, представленного общей формулой (II),
[Химическая формула 3]
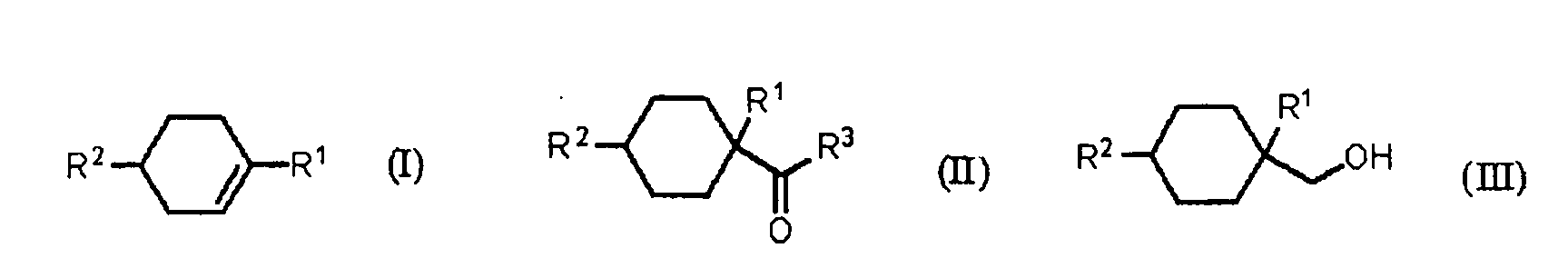
где R1 представляет алкильную группу, содержащую 1-4 атома углерода, R2 представляет алкильную группу, содержащую 1-4 атома углерода, R3 представляет OH группу, фтор или OR4 группу, и R4 представляет алкильную группу, содержащую 1-4 атома углерода.
[2] Способ согласно [1], в котором указанное карбонилирование осуществляют при давлении монооксида углерода, равном 5 МПа или ниже.
[3] Способ согласно [1] или [2], в котором указанное карбонилирование осуществляют при температуре от -50°C до -25°C.
[4] Способ согласно любому из [1]-[3], в котором R3 в указанной общей формуле (II) представляет собой OR4 группу, в которой R4 представляет алкильную группу, содержащую 1-4 атома углерода.
[5] Способ согласно любому из [1]-[4], в котором чистота цис-формы указанного циклогексанкарбонильного соединения, представленного общей формулой (II), полученного карбонилированием, составляет 85% или более.
[6] Способ согласно любому из [1]-[5], в котором указанное циклогексанкарбонильное соединение, представленное общей формулой (II), восстанавливают, используя водород.
[7] Способ согласно любому из [1]-[6], в котором указанное циклогексанкарбонильное соединение, представленное общей формулой (II), восстанавливают, используя водород и катализатор, включающий, по меньшей мере, один металл, выбранный из металлов 8-11 групп периодической таблицы.
[8] Способ согласно любому из [1]-[7], в котором указанный ненасыщенный углеводород, представленный общей формулой (I), получают частичным восстановлением соединения диена.
[9] Способ согласно [8], в котором указанное соединение диена представляет собой лимонен.
[10] Способ согласно [8] или [9], в котором указанное частичное восстановление соединения диена осуществляют, используя водород и катализатор, включающий, по меньшей мере, один металл, выбранный из металлов 8-11 групп периодической таблицы.
[11] Способ согласно любому из [8]-[10], в котором указанное частичное восстановление соединения диена осуществляют при давлении водорода 4 МПа или менее.
Эффект изобретения
Согласно настоящему изобретению алициклический спирт, представленный общей формулой (III), можно получить с высоким выходом из ненасыщенного углеводорода, представленного общей формулой (I), под низким давлением CO.
Согласно указанному методу, кроме того, предполагаемый для использования алициклический спирт можно получить при низких затратах с высоким выходом, используя, в качестве исходного материала, натуральные продукты, которые доступны без каких-либо проблем, такие как лимонен.
Более того, способ по настоящему изобретению обладает превосходной селективностью по цис-форме и, таким образом, можно получить алициклический спирт, имеющий высокую чистоту цис-формы с превосходным ароматическим запахом.
Режимы осуществления изобретения
Способ по настоящему изобретению, по меньшей мере, включает:
(1) способ, в котором циклогексанкарбонильное соединение, представленное общей формулой (II), (в дальнейшем, ″алициклическое карбонильное соединение″) получают карбонилированием ненасыщенного углеводорода, представленного общей формулой (I), (в дальнейшем, ″соединение с одной двойной связью″) с использованием монооксида углерода в присутствии HF (=фтористого водорода); в дальнейшем, ″способ карбонилирования″,
и
(2) способ, в котором алициклический спирт, представленный общей формулой (III), получают восстановлением указанного, полученного таким образом циклогексанкарбонильного соединения; в дальнейшем ″способ восстановления карбонильной группы″ или ″способ синтеза алициклического спирта″.
<Способ карбонилирования>
Реакцию карбонилирования соединения с одной двойной связью осуществляют под давлением монооксида углерода в присутствии HF. Посредством этого, получают цис-форму и транс-форму алициклического карбонильного соединения, представленного следующими ниже формулами, вместе с различными побочными продуктами, включая другие изомеры.
[Химическая формула 4]

В данных формулах R1-R3 являются такими же, как описано выше.
[Соединение с одной двойной связью]
В соединении с одной двойной связью, представленном общей формулой (I), R1 представляет алкильную группу, содержащую 1-4 атома углерода. R1, предпочтительно, представляет собой метильную группу или этильную группу, более предпочтительно, метильную группу, с точки зрения оттенка аромата алициклического спирта, представленного общей формулой (III), полученного по настоящему изобретению.
R2 представляет алкильную группу, содержащую 1-4 атома углерода. R1, предпочтительно, представляет собой алкильную группу, содержащую 2-4 атома углерода, более предпочтительно, изопропильную группу, с точки зрения оттенка аромата алициклического спирта, представленного общей формулой (III).
Соединение с одной двойной связью, представленное общей формулой (I), можно синтезировать, например, частичным гидрированием соответствующего соединения диена, используя катализатор гидрирования.
Соединение с одной двойной связью, синтезированное таким способом, можно использовать после осуществления удаления катализатора фильтрованием или аналогичным методом и/или очисткой дистилляцией или аналогичным методом. Однако обычно его используют непосредственно, просто удаляя катализатор, и вводят в реакцию карбонилирования без отделения растворителя, используемого в процессе взаимодействия соединения с одной двойной связью, или отделяя побочный реакционный продукт, который представляет собой полностью гидрированный побочный продукт.
[Синтез соединения с одной двойной связью]
В качестве соединения диена, используемого для синтеза соединения с одной двойной связью (в дальнейшем, ″соединения диена″), используют соединение, которое представляет собой углеводород, имеющий шестичленную циклическую структуру и содержащий углеводородные группы, имеющие 1-4 атома углерода только в 1-позиции и 4-позиции шестичленной циклической структуры соответственно. Его примеры включают алициклические углеводороды и терпеновые углеводороды. Его предпочтительные примеры включают лимонен, α-терпинен, β-терпинен, γ-терпинен, изолимонен, α-фелландрен, β-фелландрен, меноген, терпинолен и дипентен. Его более предпочтительные примеры включают лимонен, α-терпинен, γ-терпинен, изолимонен, α-фелландрен, терпинолен и дипентен. Его наиболее предпочтительные примеры включают лимонен с точки зрения доступности. Лимонен содержится в огромном количестве натуральных эфирных масел, получаемых удалением корки с апельсинов, лимонов, грейпфрутов или аналогичных фруктов, и данное соединение с чистотой 98% можно легко получить перегонкой с водяным паром. Кроме того, поскольку лимонен используется и в других областях, а также производится в промышленных масштабах, он является доступным, недорогим продуктом.
Катализатор гидрирования диенового соединения не следует особым образом ограничивать при условии, что его можно обычно использовать для гидрирования ненасыщенной связи. Предпочтительно использовать катализатор, содержащий, по меньшей мере, один металл, выбранный из металлов 8-11 групп периодической таблицы.
Примеры катализаторов включают катализатор, содержащий, по меньшей мере, один металл, выбранный из группы, состоящей из железа, кобальта, никеля, меди, рутения, родия, палладия, серебра, осмия, иридия, платины и золота.
Катализатор гидрирования может представлять собой твердый катализатор или гомогенный катализатор. Предпочтительно использовать твердый катализатор с точки зрения эффективности отделения от реакционного продукта.
Примеры твердого катализатора включают металлический катализатор, не нанесенный на подложку, и металлический катализатор, нанесенный на подложку. Примеры металлического катализатора, не нанесенного на подложку, включают катализатор Ренея, такой как никель Ренея, кобальт Ренея и медь Ренея, оксиды платины, палладия, родия, рутения или аналогичные, и коллоидный катализатор.
Примеры металлического катализатора, нанесенного на подложку, включают катализатор, в котором, по меньшей мере, один металл, выбранный из группы, состоящей из железа, кобальта, никеля, меди, рутения, родия, палладия, серебра, осмия, иридия, платины и золота, наносят или смешивают с носителем, таким как оксид магния, оксид циркония, оксид церия, диатомитовая земля, активированный древесный уголь, оксид алюминия, диоксид кремния, цеолит и оксид титана.
Их предпочтительные примеры включают нанесенный на подложку медный катализатор, такой как медно-хромовый катализатор (катализатор Адкинса), медно-цинковый катализатор или медно-железный катализатор, нанесенный на подложку платиновый катализатор, такой как Pt/C и Pt/оксид алюминия, нанесенный на подложку палладиевый катализатор, такой как Pd/C и Pd/оксид алюминия, нанесенный на подложку рутениевый катализатор, такой как Ru/C и Ru/оксид алюминия, и нанесенный на подложку родиевый катализатор, такой как Rh/C и Rh/оксид алюминия. Среди данных катализаторов с точки зрения активности и селективности реакции более предпочтительным является использование катализатора, содержащего медь.
Хотя используемое количество катализатора гидрирования различается в зависимости от типа катализаторов, его надлежит использовать в количестве 0,001-100 масс.%, предпочтительно, 0,01-30 масс.%, более предпочтительно, 0,1-20 масс.%, исходя из количества соединения диена в качестве исходного материала.
Гидрирование можно осуществить при обычном давлении или при повышенном давлении. Как правило, давление водорода находится в диапазоне 0,1-4,0 МПа, предпочтительно, 0,1-3,0 МПа, более предпочтительно, 0,1-2,0 МПа.
Реакцию гидрирования можно осуществить без использования растворителя или с использованием растворителя. Примеры растворителей включают воду, органические кислоты, такие как муравьиная кислота и уксусная кислота, сложные эфиры, такие как этилацетат и бутилацетат, ароматические соединения, такие как бензол, о-дихлорбензол, толуол и ксилол, углеводороды, такие как гексан, гептан и циклогексан, спирты, такие как метанол, этанол, изопропиловый спирт, трет-бутиловый спирт, этиленгликоль и диэтиленгликоль, простые эфиры, такие как диоксан, тетрагидрофуран, диметоксиэтан и диглим или их смеси.
Количество растворителя в случае использования растворителя для реакции гидрирования обычно находится в диапазоне 0,1-30-кратного количества по массе, предпочтительно, 0,2-20-кратного количества по массе, исходя из количества соединения диена в качестве исходного материала.
Температура реакции гидрирования обычно находится в диапазоне от -90°C до 200°C, предпочтительно, от 20°C до 150°C, более предпочтительно, от 20°C до 100°C.
Реакционный режим реакции гидрирования не следует ограничивать при условии, что реакцию каталитического гидрирования можно осуществить, и можно использовать общеизвестные, обычно используемые реакторы. Примеры реакторов включают реактор с взвешенным слоем, в котором реакцию каталитического гидрирования осуществляют ожижением катализатора с помощью текучей среды, реактор с неподвижным слоем, в котором реакцию каталитического гидрирования осуществляют подачей текучей среды путем заполнения катализатором и его фиксации, или аналогичные.
[Монооксид углерода]
Монооксид углерода, используемый в способе карбонилирования по настоящему изобретению, может содержать инертные газы, такие как азот, метан или аналогичные. Однако предпочтительно осуществлять способ при парциальном давлении монооксида углерода в диапазоне 0,5-5 МПа, предпочтительно, 1-3 МПа. Когда парциальное давление монооксида углерода выше чем 0,5 МПа, реакция карбонилирования протекает достаточно быстро, и предполагаемое для использования алициклическое карбонильное соединение можно получить с высоким выходом без протекания побочных реакций, таких как диспропорционирование и полимеризация. Кроме того, предпочтительно, чтобы парциальное давление монооксида углерода составляло бы 5 МПа или ниже, с точки зрения нагрузки на оборудование.
[Фтористый водород]
Поскольку HF, используемый в способе карбонилирования, действует как реакционный растворитель, катализатор и вспомогательное вещество, его используют, по существу, в безводном состоянии. Используемое количество HF равно 4-15 кратному количеству по молям, предпочтительно, 6-10 кратному количеству по молям, исходя из количества соединения с одной двойной связью в качестве исходного материала. Когда молярное отношение HF является 4-кратным (по молям) или более, реакция карбонилирования протекает эффективно, можно подавить побочные реакции, такие как диспропорционирование и полимеризация, и предполагаемое для использования алициклическое карбонильное соединение можно получить с высоким выходом. Кроме того, предпочтительно использовать HF в 15-кратном количестве (по молям) или менее с точки зрения стоимости исходного материала и производительности.
[Условия реакции]
Режим реакции карбонилирования не следует конкретно ограничивать, и можно использовать любые методы периодической реакции, полунепрерывной реакции и непрерывной реакции.
Температура реакции карбонилирования составляет от -50°C до 30°C, предпочтительно, от -40°C до 0°C, наиболее предпочтительно, от -50°C до -25°C. Когда температура реакции карбонилирования составляет 30°C или менее, особенно -25°C или менее, селективность по цис-форме является благоприятной. Кроме того, предпочтительно осуществлять реакцию при -50°C или выше с точки зрения скорости реакции.
Селективность по цис-форме обозначает отношение цис-формы алициклического карбонильного соединения в продуктах карбонилирования. Когда это значение является более высоким, выход в процессе очистки становиться лучше, и можно получить алициклическое карбонильное соединение высокого качества. Согласно предпочтительному способу по настоящему изобретению, можно получить алициклическое карбонильное соединение, имеющее чистоту цис-формы 85% или более. Чистота цис-формы алициклического карбонильного соединения обозначает долю цис-формы алициклического карбонильного соединения, исходя из общего количества карбонилированного продукта, включающего все побочные продукты, такие как другие изомеры.
В реакции карбонилирования фторангидрид, который является соединением, представленным формулой (II), в которой R3 представляет собой фтор, получают с помощью HF и монооксида углерода. Реакционную смесь полученного таким образом фторангидрида очищают обычным способом, например, перегонкой после удаления избыточного HF. Затем его можно использовать в качестве исходного материала в следующем процессе синтеза алициклического спирта. Однако обычным является применение метода взаимодействия с водой для получения алициклической карбоновой кислоты, представленной общей формулой (II), в которой R3=OH, или метода взаимодействия со спиртом, представленным общей формулой (IV):
в которой R4 представляет алкильную группу, содержащую 1-4 атома углерода, в дальнейшем, ″спирт (IV)″, с получением соединения алициклического сложного эфира, представленного общей формулой (II), в которой R3=OR4. Предпочтительным является превратить соединение алициклического сложного эфира с точки зрения нагрузки на оборудование. То есть, в качестве соединения, представленного общей формулой (II) в настоящем изобретении, соединение сложного эфира является более подходящим, чем карбоновая кислота или фторангидрид.
[Превращение в соединения алициклической карбоновой кислоты или алициклического сложного эфира]
В случае синтеза соединения алициклической карбоновой кислоты или алициклического сложного эфира взаимодействием реакционной смеси, полученной реакцией карбонилирования, с водой или спиртом (IV), можно сразу выделить фторангидрид и затем вновь осуществить взаимодействие с водой или спиртом (IV) в присутствии HF катализатора. Однако обычно для получения алициклической карбоновой кислоты используют метод непосредственного взаимодействия с водой или спиртом (IV) без выделения фторангидрида. В данном случае предпочтительно добавить предварительно определенное количество воды или спирта (IV) к фторангидридной реакционной смеси с точки зрения коррозионной активности по отношению к реакционной аппаратуре.
Что касается спирта, представленного общей формулой (IV), R4 представляет алкильную группу, содержащую 1-4 атома углерода. Примеры спирта включают метанол, этанол, н-пропанол, изопропанол, н-бутиловый спирт, изобутиловый спирт и трет-бутиловый спирт. Среди данных соединений, метанол или этанол являются предпочтительными с точки зрения реакционной способности.
Количество спирта, которое следует использовать, является 0,5-2,0-кратным по молям, предпочтительно, 0,8-1,5-кратным по молям, исходя из количества соединения с одной двойной связью в качестве исходного материала процесса карбонилирования. Предпочтительным является 0,5-кратное молярное отношение спирта (IV) по причине, что остающееся количество непрореагировавшего фторида является незначительным и подавляется коррозия аппаратуры в процессе, следующем далее. Менее предпочтительным является 2-кратное молярное отношение спирта (IV) с точки зрения эффекта подавления коррозии аппаратуры в результате подавления реакции межмолекулярной дегидратации спирта.
Реакционная температура при взаимодействии фторангидрида с водой или спиртом (IV), предпочтительно, составляет 20°C или менее с точки зрения подавления разложения соединения алициклической карбоновой кислоты или алициклического сложного эфира. В случае взаимодействия со спиртом (IV), в частности, реакционная температура, равная 20°C или менее, является предпочтительной по причине, что можно подавить реакцию межмолекулярной дегидратации спирта.
После отгонки HF от соединения алициклической карбоновой кислоты или алициклического сложного эфира, полученного таким образом, очистку осуществляют в обычной манере, например дистилляцией и, таким образом, можно получить соединение алициклической карбоновой кислоты или алициклического сложного эфира, имеющее высокую селективность по цис-форме.
<Способ восстановления карбонильной группы>
В способе восстановления карбонильной группы цис-форму и транс-форму циклогексанкарбонильного соединения, представленного общей формулой (II), получаемого в процессе карбонилирования, восстанавливают, получая соответствующую цис-форму и транс-форму циклического спирта соответственно.
[Химическая формула 5]
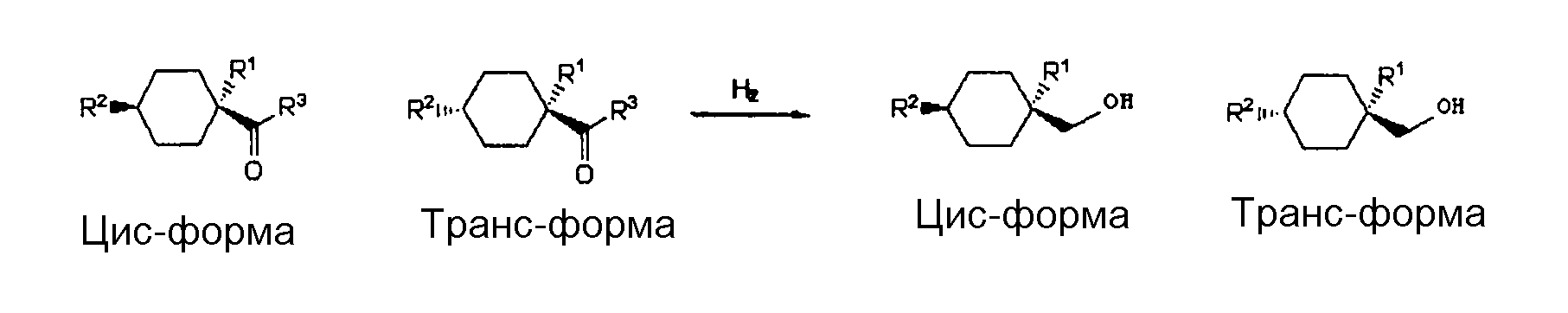
В формулах R1-R3 являются такими, как указано выше.
Способы восстановления циклогексанкарбонильного соединения, представленного общей формулой (II), получаемого в процессе карбонилирования, конкретно не ограничиваются, и можно использовать любые методы, обычно используемые для восстановления карбонильного соединения в спирт. Например, можно использовать любые методы, такие как восстановление гидридом, описанное в The Fifth Series of Experimental Chemistry, Vol. 14, p11-27, Maruzen, восстановление металлом или солями металлов и каталитическое гидрирование. Восстановление каталитическим гидрированием является предпочтительным с точки зрения экономической эффективности.
Катализаторы, которые следует использовать для каталитического гидрирования циклогексанкарбонильного соединения, не следует конкретно ограничивать при условии, что они обычно используются для гидрирования карбонильных соединений. Предпочтительно использовать катализатор, содержащий, по меньшей мере, один металл, выбранный из металлов 8-11 групп периодической таблицы.
Примеры катализаторов включают катализатор каталитического гидрирования, содержащий, по меньшей мере, один металл из группы, состоящей из железа, кобальта, никеля, меди, рутения, родия, палладия, серебра, осмия, иридия, платины и золота.
Катализатор гидрирования может представлять собой твердый катализатор или гомогенный катализатор. Предпочтительно использовать твердый катализатор с точки зрения эффективности отделения от реакционного продукта. Примеры твердого катализатора включают металлический катализатор, не нанесенный на подложку, и металлический катализатор, нанесенный на подложку.
Примеры металлического катализатора, не нанесенного на подложку, включают катализатор Ренея, такой как никель Ренея, кобальт Ренея и медь Ренея, оксиды платины, палладия, родия, рутения или аналогичные, и коллоидный катализатор.
Примеры металлического катализатора, нанесенного на подложку, включают катализатор, в котором, по меньшей мере, один металл, выбранный из группы, состоящей из железа, кобальта, никеля, меди, рутения, родия, палладия, серебра, осмия, иридия, платины и золота, наносят или смешивают с носителем, таким как оксид магния, оксид циркония, оксид церия, диатомитовая земля, активированный древесный уголь, оксид алюминия, диоксид кремния, цеолит и оксид титана.
Их предпочтительные примеры включают нанесенный на подложку медный катализатор, такой как медно-хромовый катализатор (катализатор Адкинса), медно-цинковый катализатор или медно-железный катализатор, нанесенный на подложку платиновый катализатор, такой как Pt/C и Pt/оксид алюминия, нанесенный на подложку палладиевый катализатор, такой как Pd/C и Pd/оксид алюминия, нанесенный на подложку рутениевый катализатор, такой как Ru/C и Ru/оксид алюминия, нанесенный на подложку родиевый катализатор, такой как Rh/C и Rh/оксид алюминия, и нанесенный на подложку никелевый катализатор, такой как никель/оксид алюминия (=катализатор никель Ренея), никель/диатомитовая земля (=стабилизированный никелевый катализатор) и никель/оксид циркония.
Среди данных катализаторов с точки зрения реакционной активности более предпочтительным является использование катализатора, содержащего никель и/или медь.
Хотя используемое количество катализатора каталитического гидрирования различается в зависимости от типа катализаторов, его надлежит использовать в количестве 1-100 масс.%, предпочтительно, 3-30 масс.%, исходя из количества циклогексанкарбонильного соединения в качестве исходного материала.
[Растворитель]
Способ восстановления карбонильной группы по настоящему изобретению можно осуществить без использования растворителя или с использованием растворителя.
Примеры растворителей для способа восстановления карбонильной группы по настоящему изобретению включают воду, органические кислоты, такие как муравьиная кислота и уксусная кислота, сложные эфиры, такие как этилацетат и бутилацетат, ароматические соединения, такие как бензол, о-дихлорбензол, толуол и ксилол, углеводороды, такие как гексан, гептан и циклогексан, спирты, такие как метанол, этанол, изопропиловый спирт, трет-бутиловый спирт, этиленгликоль и диэтиленгликоль, простые эфиры, такие как диоксан, тетрагидрофуран, диметоксиэтан и диглим, или их смеси.
В том числе, предпочтительно не использовать никакой растворитель или использовать ароматические соединения, такие как бензол, о-дихлорбензол, толуол и ксилол, углеводороды, такие как гексан, гептан и циклогексан, спирты, такие как метанол, этанол, изопропиловый спирт, трет-бутиловый спирт, этиленгликоль и диэтиленгликоль, простые эфиры, такие как диоксан, тетрагидрофуран, диметоксиэтан и диглим, или их смеси.
Количество растворителя в случае использования растворителя в способе восстановления карбонильной группы по настоящему изобретению обычно превышает в 0-30 раз по массе, предпочтительно, в 0-20 раз по массе, количество циклогексанкарбонильного соединения, представленного общей формулой (II), полученного способом карбонилирования.
[Реакционные условия]
Что касается давления водорода в способе восстановления карбонильной группы по настоящему изобретению, более высокое давление является предпочтительным с точки зрения сдвига равновесия реакции в сторону спирта. Однако, касаясь стоимости оборудования, предпочтительное давление водорода составляет 1-30 МПа, более предпочтительно, 2-20 МПа, наиболее предпочтительно, 5-10 МПа.
Температура реакции в способе восстановления карбонильной группы по настоящему изобретению, предпочтительно, составляет 100°C или выше, более предпочтительно, 150°C или выше, с точки зрения обеспечения достаточной скорости реакции. Кроме того, предпочтительно, она составляет 300°C или ниже, более предпочтительно, 280°C или ниже, наиболее предпочтительно, 250°C или ниже, с точки зрения подавления реакции переэтерификации между алициклическим спиртом, получаемым таким образом, и промежуточными соединениями сложных эфиров.
Режим способа восстановления карбонильной группы по настоящему изобретению не следует конкретно ограничивать. В случае осуществления способа каталитическим гидрированием, режим не следует конкретно ограничивать при условии, что можно осуществить реакцию каталитического гидрирования, и можно применить общеизвестные методы, которые обычно используются. Примеры реакторов включают реактор с взвешенным слоем, в котором реакцию каталитического гидрирования осуществляют ожижением катализатора с помощью текучей среды, реактор с неподвижным слоем, в котором реакцию каталитического гидрирования осуществляют подачей текучей среды путем заполнения катализатором и его фиксации, или аналогичные.
В случае использования соединения алициклической карбоновой кислоты или алициклического сложного эфира в качестве циклогексанкарбонильного соединения, которое является исходным материалом, в качестве побочного продукта получают воду или спирты, содержащие 1-4 атома углерода. Реакцию можно осуществить в присутствии данных побочных продуктов или ее можно осуществить, удаляя их непрерывно или периодически в течение взаимодействия.
После отделения катализатора гидрирования от полученного таким образом продукта, представляющего собой алициклический спирт, очистку осуществляют обычным способом, например перегонкой, и, таким образом, можно получить алициклический спирт высокой чистоты, имеющий высокое содержание цис-формы, предпочтительно алициклический спирт, имеющий чистоту цис-формы 85% или выше.
Используемый здесь термин чистота цис-формы обозначает долю цис-формы алициклического спирта, исходя из общего количества продукта, представляющего собой алициклический спирт, включающего все побочные продукты, такие как другие изомеры.
Примеры
Настоящее изобретение будет описано более подробно ниже со ссылкой к Примерам, которые не имеют намерения ограничивать объем настоящего изобретения.
В описании, следующем ниже, если не указано иным образом, ″%″ означает ″массовый %″.
<Условия газохроматографического анализа>
В случае анализа соединения с одной двойной связью и алициклического спирта, в качестве газового хроматографа использовали торговую марку ″GC-17A″, изготовленную корпорацией Shimadzu, и в качестве капиллярной колонки использовали торговую марку ″HR-1″, 0,32 ммφ×25 м, изготовленную Shinwa Chemical Industries, Ltd. Температуру повышали от 100°C до 250°C со скоростью 2°C/мин.
В случае анализа циклогексанкарбонильного соединения, в качестве газового хроматографа использовали торговую марку ″GC-17A″, изготовленную корпорацией Shimadzu, и в качестве капиллярной колонки использовали торговую марку ″DBWAX″, 0,32 ммφ×30 м, изготовленную J&W. Температуру повышали от 100°C до 250°C со скоростью 5°C/мин.
<Пример получения 1>
Получение 4-изопропил-1-метилциклогексена, в дальнейшем, ″DH-терпинена″, гидрированием лимонена:
[Химическая формула 6]

В автоклав из нержавеющей стали, имеющий внутренний объем 5 л, оборудованный мешалкой с приводом Nac, тремя входными соплами на верхней части и одним соплом для извлечения в нижней части, способный контролировать внутреннюю температуру с помощью рубашки, загружали 50,0 г катализатора Cu-Cr, торговая марка ″N-203S″, изготовленного JGC Catalyst and Chemicals Ltd., и 500,0 г гептана особой чистоты, изготовленного Wako Pure Chemical Industries Ltd., и активацию осуществляли в течение 1 часа.
После охлаждения загружали 500,0 г лимонена, изготовленного YASUHARA CHEMICAL Co., LTD., и реакцию гидрирования осуществляли, перемешивая в течение 3 часов при 95°C под давлением водорода 2 МПа. Затем реакционную смесь фильтровали, чтобы удалить катализатор, получая 957,4 г реакционной смеси, содержащей 4-изопропил-1-метилциклогексен с концентрацией 49,0%, 4-изопропил-1-метилциклогексан с концентрацией 1,4% и гептан с концентрацией 49,6%. Выход составлял 92,5%.
<Пример 1>
Получение этил(4-изопропил-1-метилциклогексаноата), в дальнейшем, ″DHT-сложного эфира″, карбонилированием и этерификацией DH-терпинена:
[Химическая формула 7]

<Способ карбонилирования>
Эксперимент осуществляли, используя автоклав из нержавеющей стали, имеющий внутренний объем 500 мл, оборудованный мешалкой с приводом Nac, тремя входными соплами на верхней части и одним соплом для извлечения в нижней части, способный контролировать внутреннюю температуру с помощью рубашки.
Сначала внутренний воздух в автоклаве вытесняли монооксидом углерода и затем в него вводили 100 г фтористого водорода. После установления температуры жидкости при -30°C прикладывали давление монооксида углерода вплоть до 2 МПа.
Поддерживая температуру реакционной смеси при -30°C и реакционное давление при 2 МПа, 201,3 г реакционной смеси, приготовленной в примере Получения 1, содержащей 4-изопропил-1-метилциклогексен с концентрацией 49,0%, 4-изопропил-1-метилциклогексан с концентрацией 1,4% и гептан с концентрацией 49,6%, где содержание 4-изопропил-1-метилциклогексена составляло 0,71 моль, подавали в верхнюю часть автоклава, чтобы осуществить реакцию карбонилирования.
После завершения подачи, перемешивание продолжали в течение приблизительно 10 минут, пока не было определено поглощение монооксида углерода.
<Этерификация>
Затем, поддерживая температуру реакционной смеси при -30°C, в верхнюю часть автоклава подавали 49,3 г (1,07 моль) этанола и осуществляли этерификацию, перемешивая в течение 1 часа.
Реакционную смесь извлекали из нижней части автоклава в воду со льдом. После отделения маслянистой фазы от водной фазы, маслянистую фазу два раза промывали 100 мл 2% водного раствора гидроксида натрия и два раза 100 мл дистиллированной воды, и затем осушали 10 г безводного сульфата натрия. В результате анализа полученной таким образом жидкой смеси методом газовой хроматографии было обнаружено, что реакционная смесь содержит следующие два типа алициклических сложноэфирных соединений.
[Химическая формула 8]
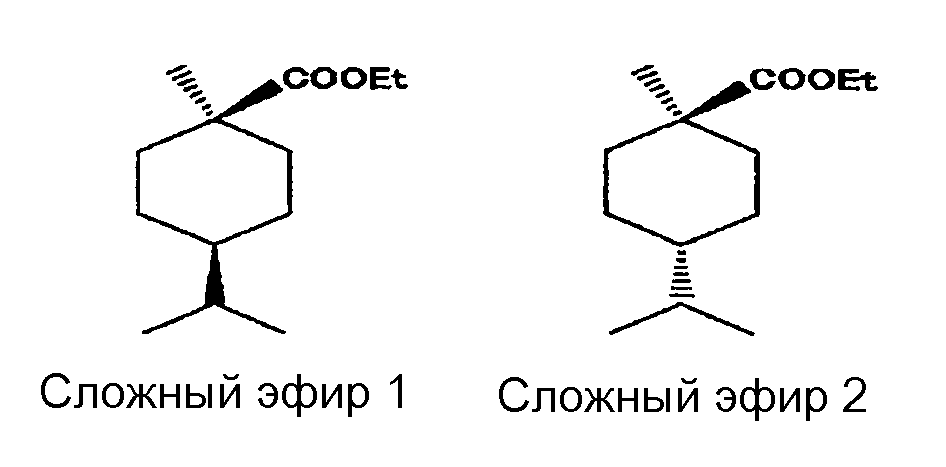
Касательно относительного содержания каждого алициклического сложноэфирного соединения в смеси двух алициклических сложноэфирных соединений, этил(цис-4-изопропил-1-метилциклогексаноат) (=Сложный эфир-1) составлял 89,8%, этил(транс-4-изопропил-1-метилциклогексаноат) (=Сложный эфир-2) составлял 3,8%, и другие изомеры составляли 6,4%.
Полученную таким образом жидкую смесь далее подвергали удалению низкокипящих компонентов с помощью выпарного аппарата, и затем очистке, используя ректификатор, имеющий число теоретических тарелок, равное 20, при температуре перегонки 150°C и вакууме, равном 60 торр (8 кПа). В результате получали 142,4 г смеси сложных эфиров, содержащей 89,4% сложного эфира-1 и 3,6% сложного эфира-2, в качестве основной фракции дистиллята, где общий выход сложного эфира-1 и сложного эфира-2 составлял 87,4% мол., исходя из количества 4-изопропил-1-метилциклогексена.
<Получение DHT-спирта {= (4-изопропил-1-метилциклогексил)метанола} восстановлением DHT-сложного эфира; Способ восстановления карбонильной группы>
[Химическая формула 9]
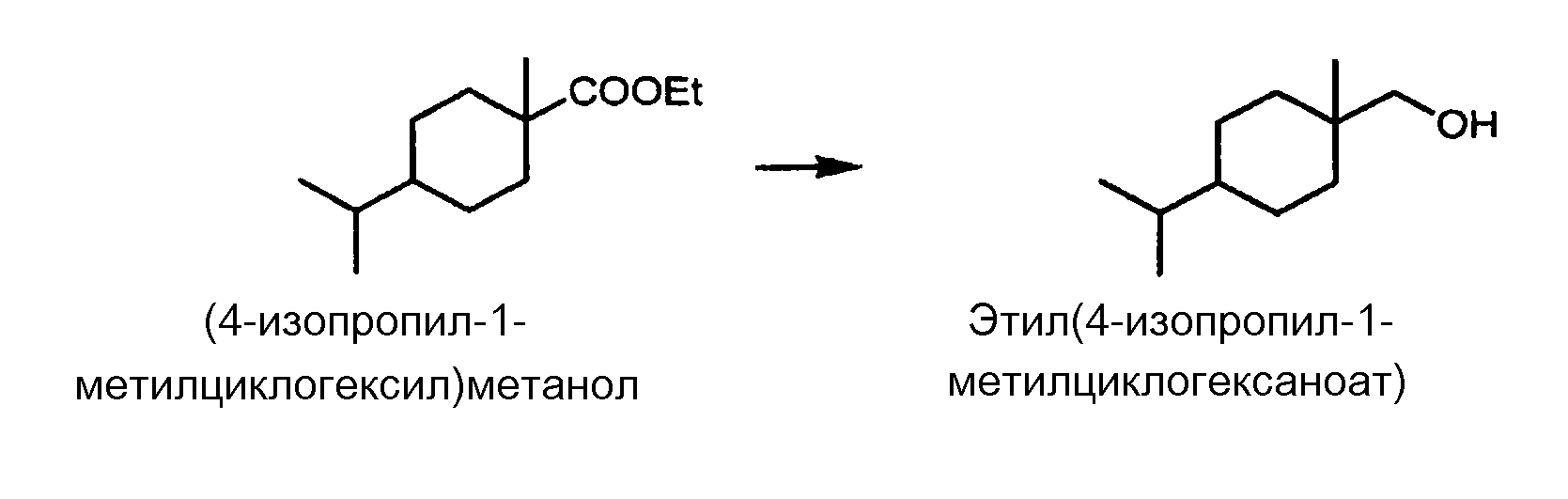
В автоклав из нержавеющей стали загружали 5,3 г медно-цинкового катализатора, нанесенного на оксид алюминия, изготовленного компанией JGC Catalysts and Chemicals Ltd., и 105 г смеси сложных эфиров, полученной в качестве основной фракции дистиллята, как указано выше, которая содержит 89,4% этил(цис-4-изопропил-1-метилциклогексаноата) и 3,6% этил(транс-4-изопропил-1-метилциклогексаноата), и реакцию восстановления осуществляли, перемешивая в течение 14 часов при 250°C под давлением водорода 10 МПа, при пропускании водорода.
После удаления из реакционной смеси катализатора посредством фильтрования получали 68 г конечного продукта, представляющего собой смесь, содержащую 85,8% (цис-4-изопропил-1-метилциклогексил)метанола (=Спирт-1) и 3,5% (транс-4-изопропил-1-метилциклогексил)метанола (=Спирт-2). Общий выход спирта-1 и спирта-2 составил 77% мол., исходя из общего количества сложного эфира-1 и сложного эфира-2.
[Химическая формула 10]

<Пример 2>
<Способ карбонилирования>
Эксперимент осуществляли таким же способом, как в примере 1, за исключением использования 34,3 г (1,07 моль) метанола в качестве спирта, используемого для этерификации.
В результате анализа реакционной смеси этерификации метанолом было обнаружено, что относительное содержание каждого алициклического сложноэфирного соединения в смеси двух алициклических сложноэфирных соединений для метил(цис-4-изопропил-1-метилциклогексаноата) составляло 89,8% для метил(транс-4-изопропил-1-метилциклогексаноата) составляло 3,8% и для других изомеров - 6,4%.
Далее смесь подвергали очистке, используя ректификатор, имеющий число теоретических тарелок, равное 20, при температуре перегонки 140°C и вакууме, равном 60 торр (8 кПа). В результате получали 134,5 г смеси сложных эфиров, содержащей 89,4% метил(цис-4-изопропил-1-метилциклогексаноата) и 3,6% метил(транс-4-изопропил-1-метилциклогексаноата), в качестве основной фракции дистиллята, где общий выход цис-формы и транс-формы составлял 88,4% мол., исходя из количества 4-изопропил-1-метилциклогексена.
<Способ восстановления карбонильной группы>
Эксперимент осуществляли таким же способом, как в примере 1, за исключением использования 6,3 г медно-цинкового катализатора, нанесенного на оксид алюминия, и 125 г смеси сложных эфиров в качестве исходного материала, которая содержит 89,4% метил(цис-4-изопропил-1-метилциклогексаноата) и 3,6% метил(транс-4-изопропил-1-метилциклогексаноата), и изменения времени реакции до 8 часов. Получали 91 г конечного продукта, представляющего собой смесь, содержащую 86,2% (цис-4-изопропил-1-метилциклогексил)метанола и 3,5% (транс-4-изопропил-1-метилциклогексил)метанола. Общий выход спирта-1 и спирта-2 составил 81% мол., исходя из общего количества метил(цис-4-изопропил-1-метилциклогексаноата) и метил(транс-4-изопропил-1-метилциклогексаноата).
Применимость в промышленности
Согласно способу по настоящему изобретению алициклический спирт, который применим в качестве исходного материала для ароматической смеси или аналогичного, можно получить при низких затратах с высоким выходом. Кроме того, поскольку способ получения можно осуществить при низком давлении монооксида углерода, способ является выгодным с точки зрения нагрузки на оборудование. Более того, согласно способу по настоящему изобретению селективность по цис-форме является высокой и, таким образом, можно получить алициклический спирт, имеющий высокую чистоту цис-формы с превосходным ароматическим запахом.
Реферат
Изобретение относится к улучшенному способу получения алициклического спирта структурной формулы (III). Способ включает получение циклогексанкарбонильного соединения, представленного общей формулой (II), карбонилированием ненасыщенного углеводорода, представленного общей формулой (I), с использованием монооксида углерода в присутствии HF с последующим получением алициклического спирта, представленного общей формулой (III), восстановлением указанного циклогексанкарбонильного соединения, представленного общей формулой (II). В структурных формулах (I)-(III) Rпредставляет алкильную группу, содержащую 1-4 атома углерода, Rпредставляет алкильную группу, содержащую 1-4 атома углерода, Rпредставляет ОН группу, фтор или ORгруппу, и Rпредставляет алкильную группу, содержащую 1-4 атома углерода. Способ позволяет получать продукт с низкими затратами, высоким выходом и высокой чистотой цис-формы. 10 з.п. ф-лы, 2 пр.
Формула
получение циклогексанкарбонильного соединения, представленного общей формулой (II), карбонилированием ненасыщенного углеводорода, представленного общей формулой (I), с использованием монооксида углерода в присутствии HF, и затем,
получение алициклического спирта, представленного общей формулой (III), восстановлением указанного циклогексанкарбонильного соединения, представленного общей формулой (II),
Химическая формула 1
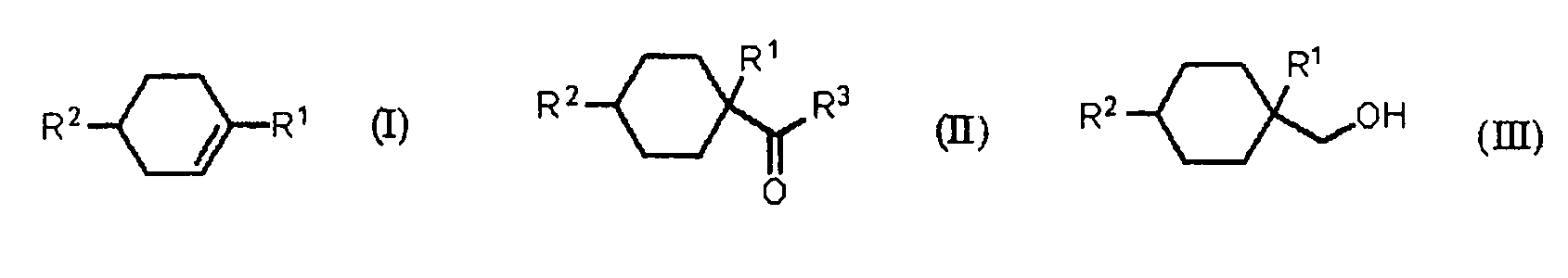
где R1 представляет алкильную группу, содержащую 1-4 атома углерода, R2 представляет алкильную группу, содержащую 1-4 атома углерода, R3 представляет ОН группу, фтор или OR4 группу, и R4представляет алкильную группу, содержащую 1-4 атома углерода.

Комментарии