Новое алициклическое диольное соединение и способ его получения - RU2646220C2
Код документа: RU2646220C2
Чертежи






Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к новому алициклическому диольному соединению, имеющему циклогексановое кольцо, и способу его получения.
Уровень техники
Смола сложного полиэфира, синтезированная из алициклической дикарбоновой кислоты и алициклического диола, может быть применена для использования в качестве оптических материалов, материалов для электронной информации и материалов медицинских инструментов вследствие наличия превосходных прозрачности, теплостойкости, атмосферостойкости, характеристик газонепроницаемости и оптических свойств.
Например, при использовании 1,4-циклогександикарбоновой кислоты (1,4-ЦГДК) в качестве алициклической дикарбоновой кислоты и 1,4-циклогександиметанола (1,4-ЦГДМ) в качестве алициклического диола синтезированы смола сложного полиэфира, превосходная по биоразлагаемости (обратитесь, например, к патентному документу 1), проводящий сложный полиэфир, выделяющий меньшее количество газа (обратитесь, например, к патентному документу 2), и сложный полиэфир, характеризующийся малым временем исчезновения пены и подходящий для использования в медицинской области применения (обратитесь, например, к патентному документу 3). Кроме того, при использовании трицикло[3.3.1.13,7]декандикарбоновой кислоты в качестве алициклической дикарбоновой кислоты и трицикло[3.3.1.13,7]декандиола в качестве алициклического диола синтезирована смола сложного полиэфира, характеризующаяся малой оптической анизотропией и превосходная по формуемости (обратитесь, например, к патентному документу 4).
Перечень документов предшествующего уровня техники
Патентный документ
Патентный документ 1
Японский опубликованный патент №2000-290356.
Патентный документ 2
Японский опубликованный патент №2004-124022.
Патентный документ 3
Японский опубликованный патент №2005-298555.
Патентный документ 4
Японский патент №3862538.
Краткое изложение изобретения
Проблемы, решаемые в изобретении
Одна цель настоящего изобретения заключается в предложении нового алициклического диольного соединения, имеющего циклогексановое кольцо, и способа его получения.
Средства разрешения проблем
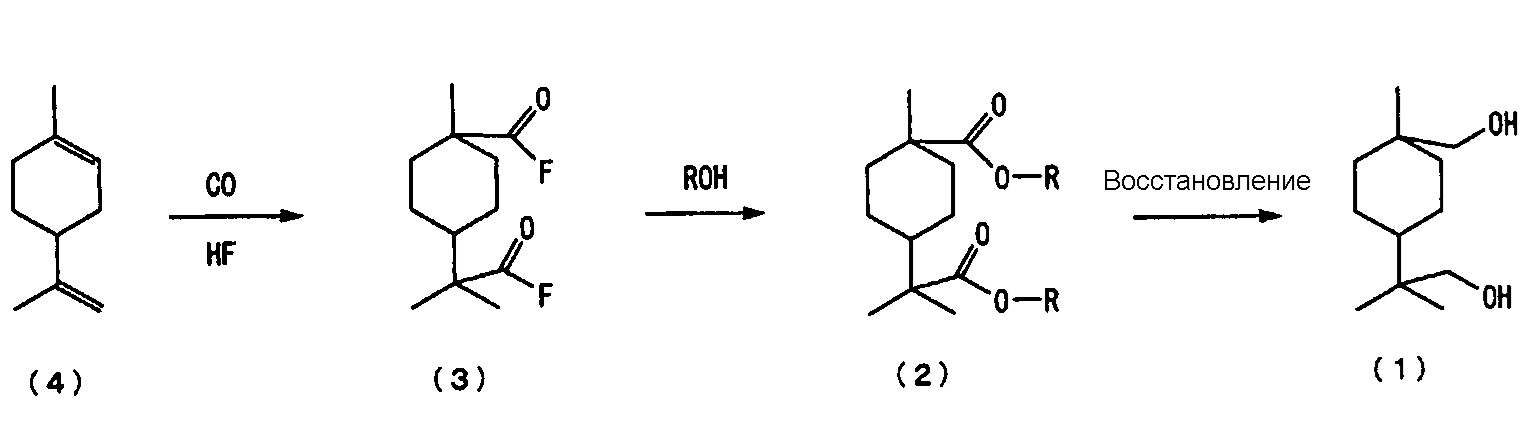
Изобретатель настоящего изобретения исследовал способ получения нового алициклического диольного соединения, описываемого следующей далее формулой (1), из 4-изопропенил-1-метил-1-циклогексена, описываемого следующей далее формулой (4), и установил возможность получения нового алициклического диольного соединения, описываемого следующей далее формулой (1), в результате, например, введения 4-изопропенил-1-метил-1-циклогексена, описываемого следующей далее формулой (4), в реакцию с монооксидом углерода в присутствии фтористого водорода (ниже в настоящем документе также обозначаемого как «HF») с последующими введением полученного фторангидрида алициклической дикарбоновой кислоты, описываемого следующей далее формулой (3), в реакцию со спиртом в целях получения сложноэфирного производного алициклической дикарбоновой кислоты, описываемого следующей далее формулой (2), и затем восстановлением сложноэфирного производного алициклической дикарбоновой кислоты, описываемого следующей далее формулой (2).
Таким образом, настоящее изобретение было осуществлено на основании данного обнаружения.

где каждый R независимо представляет собой алкильную группу, содержащую от 1 до 4 атомов углерода.
Более конкретно, настоящее изобретение описывается следующим далее образом.
[1] Алициклическое диольное соединение, описываемое следующей далее формулой (1).

[2] Способ получения алициклического диольного соединения, включающий стадии:
введения 4-изопропенил-1-метил-1-циклогексена, описываемого следующей далее формулой (4), в реакцию с монооксидом углерода в присутствии фтористого водорода в целях получения фторангидрида алициклической дикарбоновой кислоты, описываемого следующей далее формулой (3);
введения полученного фторангидрида алициклической дикарбоновой кислоты, описываемого следующей далее формулой (3), в реакцию со спиртом в целях получения сложноэфирного производного алициклической дикарбоновой кислоты, описываемого следующей далее формулой (2); и
восстановления полученного сложноэфирного производного алициклической дикарбоновой кислоты, описываемого следующей далее формулой (2), в целях получения нового алициклического диольного соединения, описываемого следующей далее формулой (1):
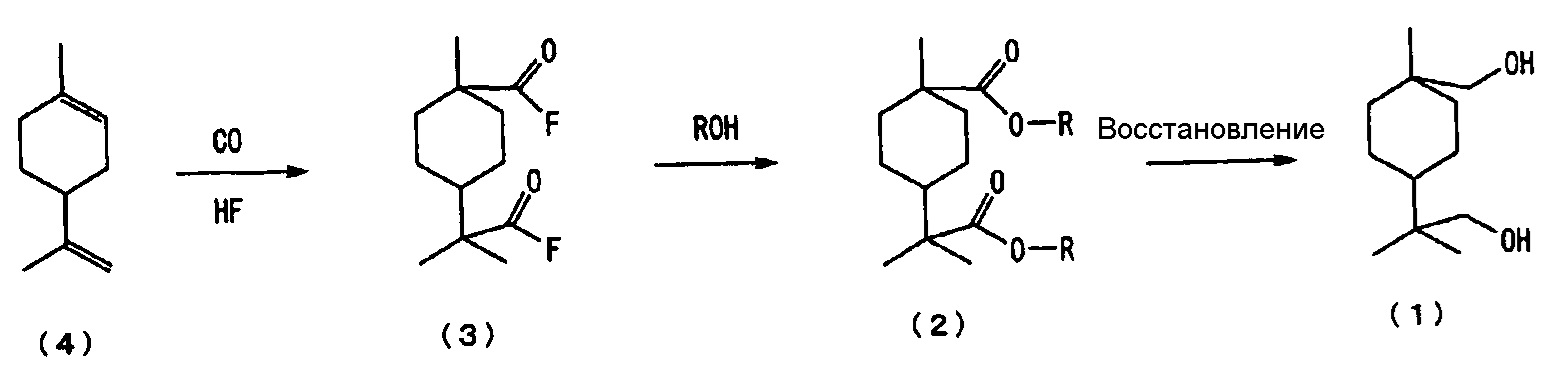
где каждый R независимо представляет собой алкильную группу, содержащую от 1 до 4 атомов углерода.
Преимущества изобретения
Новое алициклическое диольное соединение, описывающееся формулой (1) настоящего изобретения, может быть использовано, например, в качестве материала исходного сырья для смол сложного полиэфира. Вследствие использования в способе получения настоящего изобретения в качестве материала исходного сырья соединения, описываемого формулой (4) и произведенного из биомассы, можно сказать то, что способ получения является экологически безопасным в отношении углеродной нейтральности.
Краткое описание чертежей
Фигура 1 представляет собой диаграмму, демонстрирующую результаты измерений по методу ЯМР DEPT 45° для продукта, полученного в примере 1.
Фигура 2 представляет собой диаграмму, демонстрирующую результаты измерений по методу ЯМР DEPT 90° для продукта, полученного в примере 1.
Фигура 3 представляет собой диаграмму, демонстрирующую результаты измерений по методу ЯМР DEPT 135° для продукта, полученного в примере 1.
Фигура 4 представляет собой диаграмму, демонстрирующую результаты измерений по методу ЯМР Carbon i.g. для продукта, полученного в примере 1.
Фигура 5 представляет собой диаграмму, демонстрирующую результаты измерений по методу ЯМР INADEQUATE для продукта, полученного в примере 1.
Фигура 6 представляет собой увеличенную диаграмму, демонстрирующую результаты измерений на участке в диапазоне от 15 до 50 м. д. Фигуры 5.
Способ осуществления изобретения
Варианты осуществления настоящего изобретения (ниже в настоящем изобретении также называемые «настоящим вариантом осуществления») подробно описываются в последующем изложении. Однако следующие далее варианты осуществления предлагаются для иллюстрирования настоящего изобретения, и настоящее изобретение не ограничивается только этими.
Новое алициклическое диольное соединение настоящего варианта осуществления является соединением, описываемым следующей далее формулой (1).
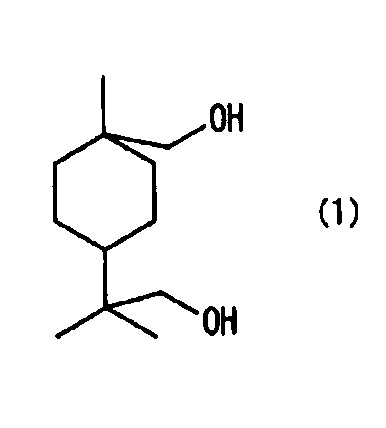
Алициклическое диольное соединение, описывающееся формулой (1), может быть использовано, например, в качестве материала исходного сырья для смол сложного полиэфира, и при использовании алициклического диольного соединения может быть изготовлен материал, превосходный по оптическим свойствам и теплостойкости. Примеры области применения материала, обладающего такими свойствами, включают нижеследующее, но не ограничиваются конкретно только этим: оптические материалы, такие как линзы.
Способ получения нового алициклического диольного соединения настоящего изобретения включает следующие далее стадии от (а) до (с):
(а) стадия введения 4-изопропенил-1-метил-1-циклогексена, описываемого следующей далее формулой (4), в реакцию с монооксидом углерода в присутствии фтористого водорода (ниже в настоящем документе также обозначаемого как «HF») в целях получения фторангидрида алициклической дикарбоновой кислоты, описываемого следующей далее формулой (3), (ниже в настоящем документе иногда сокращенно обозначаемая как «стадия карбонилирования»);
(b) стадия введения полученного фторангидрида алициклической дикарбоновой кислоты, описываемого следующей далее формулой (3), в реакцию со спиртом в целях получения сложноэфирного производного алициклической дикарбоновой кислоты, описываемого следующей далее формулой (2), (ниже в настоящем документе иногда сокращенно обозначаемая как «стадия этерифицирования с образованием сложного эфира»); и
(с) стадия восстановления полученного сложноэфирного производного алициклической дикарбоновой кислоты, описываемого следующей далее формулой (2), в целях получения алициклического диольного соединения, описываемого следующей далее формулой (1), (ниже в настоящем документе иногда сокращенно обозначаемая как «стадия восстановления»)
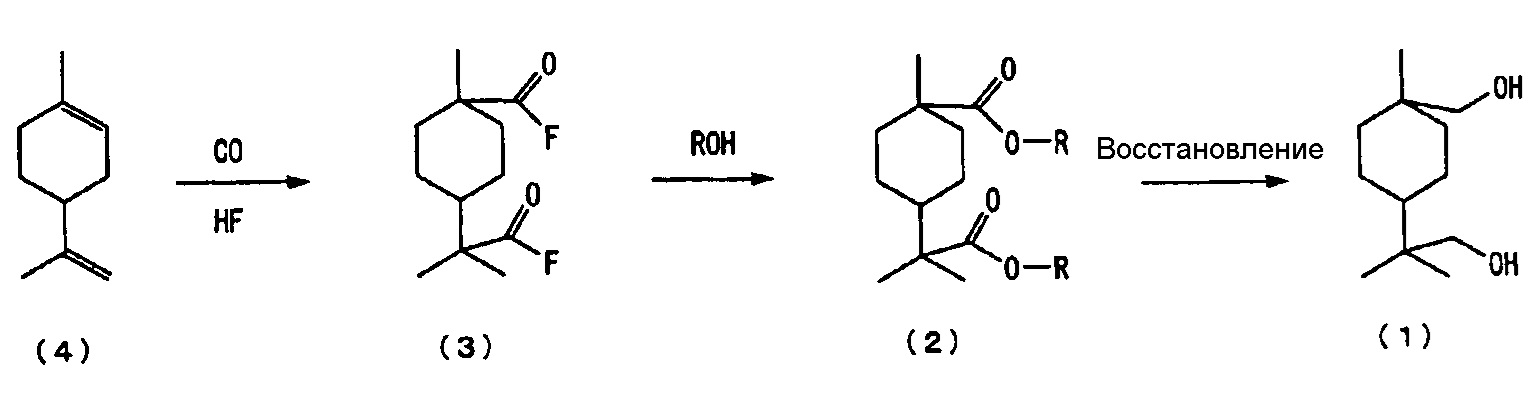
где каждый R независимо представляет собой алкильную группу, содержащую от 1 до 4 атомов углерода.
<(а) Стадия карбонилирования>
На стадии (а) реакцию карбонилирования для 4-изопропенил-1-метил-1-циклогексена, описываемого следующей далее формулой (4), предпочтительно проводят в присутствии HF под давлением монооксида углерода. В результате проведения стадии (а) получают алициклическое карбонильное соединение, описывающееся следующей далее формулой (3) (ниже в настоящем документе также обозначаемое как «фторангидрид алициклической дикарбоновой кислоты»). Продукт реакции карбонилирования на стадии (а) может содержать различные побочные продукты (содержащие другие изомеры).

[Монооксид углерода]
Монооксид углерода, предназначенный для использования на стадии карбонилирования, может содержать инертный газ, такой как азот и метан. Стадию карбонилирования проводят при парциальном давлении монооксида углерода в диапазоне предпочтительно от 0,5 до 5 МПа, более предпочтительно от 1 до 4 МПа, кроме того, предпочтительно от 1,5 до 3 МПа. При парциальном давлении монооксида углерода, большем, чем 0,5 МПа, реакция карбонилирования в достаточной степени протекает без одновременного прохождения побочных реакций, таких как диспропорционирование и полимеризация, так что целевое вещество, то есть фторангидрид алициклической дикарбоновой кислоты, может быть получено с высоким выходом. При рассмотрении нагрузки на оборудование предпочтительным является парциальное давление монооксида углерода, составляющее 5 МПа и менее.
[Фтористый водород]
Вследствие исполнения соединением HF, предназначенном для использования на стадии карбонилирования, функции растворителя, катализатора и вторичного материала исходного сырья для реакции предпочтительным является использование по существу безводного соединения HF. В настоящем варианте осуществления по существу безводное соединение HF обозначает HF при концентрации воды, составляющей 200 ч./млн и менее. На стадии карбонилирования количество соединения HF, предназначенного для использования, предпочтительно соответствует превышению в диапазоне от 4 до 30 раз при расчете на моли, более предпочтительно от 7 до 20 раз при расчете на моли, кроме того, предпочтительно от 10 до 15 раз при расчете на моли в сопоставлении с количеством материала исходного сырья в виде 4-изопропенил-1-метил-1-циклогексена. При применении количества соединения HF, предназначенного для использования, соответствующего превышению, составляющему 4 раза и более при расчете на моли, реакция карбонилирования протекает эффективно при подавлении одновременного прохождения побочных реакций, таких как диспропорционирование и полимеризация, так что целевое вещество, то есть, фторангидрид алициклической дикарбоновой кислоты, может быть получено с высоким выходом. При рассмотрении затрат на материал исходного сырья и производительность количество соединения HF, предназначенного для использования, предпочтительно соответствует превышению, составляющему 30 раз и менее при расчете на моли, более предпочтительно 15 раз и менее при расчете на моли.
[Условия проведения реакции]
На тип реакции карбонилирования на стадии (а) конкретных ограничений не накладывают. Может быть использован любой представитель, выбираемый из периодического типа, полунепрерывного типа, непрерывного типа и тому подобного.
Температура реакции для реакции карбонилирования на стадии (а) предпочтительно находится в диапазоне от -50°С до 30°С, более предпочтительно от -40°С до 0°С, более того, предпочтительно от - 30 до -10°С. При температуре реакции для реакции карбонилирования, составляющей 30°С и менее, в частности - 10°С и менее, имеет место тенденция к достижению улучшенной селективности. При рассмотрении скорости реакции реакцию карбонилирования на стадии (а) предпочтительно проводят при - 50°С и более.
Давление реакции для реакции карбонилирования на стадии (а) предпочтительно находится в диапазоне от 0,6 до 5,0 МПа, более предпочтительно от 1,1 до 4,0 МПа, более того, предпочтительно от 1,6 до 3,0 МПа.
<(b) Стадия этерифицирования с образованием сложного эфира>
Стадией этерифицирования с образованием сложного эфира является стадия введения фторангидрида алициклической дикарбоновой кислоты, полученного на стадии карбонилирования, в реакцию со спиртом, содержащим от 1 до 4 атомов углерода, в целях получения сложноэфирного производного алициклической дикарбоновой кислоты. На стадии этерифицирования с образованием сложного эфира может быть непосредственно использована реакционная жидкость, полученная на стадии карбонилирования. При рассмотрении корродирующего воздействия на реакционную аппаратуру на стадии этерифицирования с образованием сложного эфира предпочтительным является способ, по которому к реакционной жидкости, полученной на стадии карбонилирования, добавляют предварительно определенное количество спирта. В альтернативном варианте из реакционной жидкости, полученной на стадии карбонилирования, может быть отогнано избыточное количество HF, а после этого к реакционной жидкости для этерифицирования с образованием сложного эфира может быть добавлен спирт.
Вместо использования реакционной жидкости в виде фторангидрида кислоты, полученного по реакции карбонилирования на стадии этерифицирования с образованием сложного эфира: (I) после отгонки избыточного количества HF реакционная жидкость может быть очищена по обычному способу, такому как перегонка, для того чтобы фторангидрид кислоты мог бы быть непосредственно использован в качестве материала исходного сырья на последующей стадии восстановления; или (II) после отгонки избыточного количества HF реакционная жидкость может быть гидролизована для получения соответствующей карбоновой кислоты, которую очищают по обычному способу, такому как перегонка, для того чтобы карбоновая кислота могла бы быть использована в качестве материала исходного сырья на последующей стадии восстановления
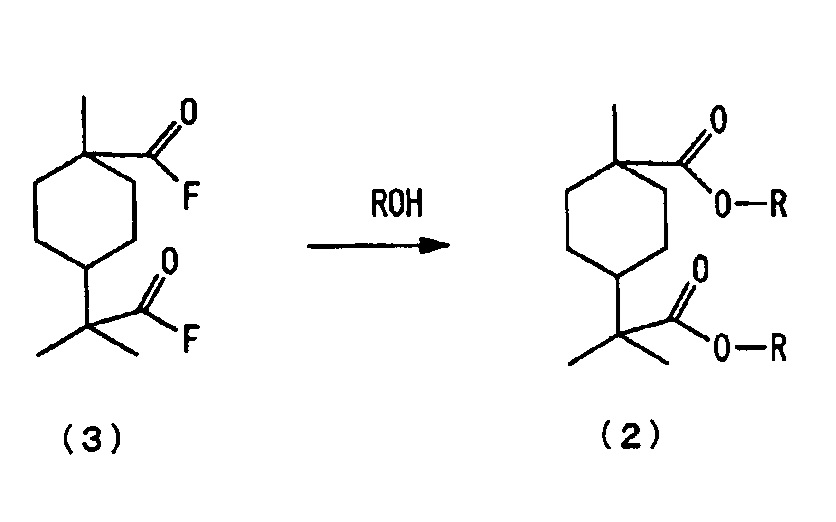
где каждый R независимо представляет собой алкильную группу, содержащую от 1 до 4 атомов углерода.
Конкретные примеры спирта, предназначенного для использования на стадии этерифицирования с образованием сложного эфира, включают метанол, этанол, н-пропанол, изопропанол, н-бутиловый спирт, изобутиловый спирт и трет-бутиловый спирт, однако без накладываемых конкретных ограничений. При рассмотрении реакционной способности в их числе предпочтительными являются метанол или этанол. На стадии этерифицирования с образованием сложного эфира может быть использован один тип спирта индивидуально или могут быть использованы два и более типа в комбинации.
Количество спирта, предназначенное для использования на стадии этерифицирования с образованием сложного эфира, предпочтительно соответствует превышению в диапазоне от 1,0 до 2,5 раза при расчете на моли, более предпочтительно от 1,2 до 2,3 раза при расчете на моли, более того, предпочтительно от 1,5 до 2,0 раза при расчете на моли в сопоставлении с количеством материала исходного сырья в виде 4-изопропенил-1-метил-1-циклогексена на стадии карбонилирования. При применении количества спирта, предназначенного для использования, соответствующего превышению, составляющему 1,0 раза и более при расчете на моли, остающееся количество непрореагировавшего фторангидрида алициклической дикарбоновой кислоты является малым, что приводит в результате к незначительной коррозии аппаратуры на последующей стадии, что является предпочтительным. С точки зрения подавления коррозии аппаратуры под действием воды, полученной при проведении реакции внутримолекулярной дегидратации спирта, предпочтительным является количество спирта, предназначенного для использования, соответствующее превышению, составляющему 2,5 раза и менее при расчете на моли.
С точки зрения подавления разложения сложноэфирного производного алициклической дикарбоновой кислоты, описываемого приведенной выше формулой (2), температура реакции на стадии этерифицирования с образованием сложного эфира предпочтительно составляет -40°С и более и 20°С и менее, более предпочтительно находится в диапазоне от -30°С до 10°С, более того, предпочтительно от -30°С до 0°С. При температуре реакции, составляющей -40°С и более, скорость этерифицирования с образованием сложного эфира может быть увеличена для улучшения выхода. При температуре реакции, составляющей 20°С и менее, может быть подавлено разложение сложного эфира, и может быть подавлено образование воды в виде побочного продукта вследствие прохождения реакции дегидратации спирта.
Стадию этерифицирования с образованием сложного эфира предпочтительно проводят при нормальном давлении.
<(с) Стадия восстановления>
На стадии (с) способ восстановления сложноэфирного производного алициклической дикарбоновой кислоты, описываемого формулой (2) (ниже в настоящем документе также обозначаемого как «сложноэфирное производное алициклической дикарбоновой кислоты»), полученного на стадии этерифицирования с образованием сложного эфира, может быть любым представителем обычного способа восстановления карбонильного соединения с образованием спирта без накладывания конкретных ограничений. Способ восстановления, предназначенный для использования, может быть, например, представлен любым, выбираемым из гидридного восстановления, восстановления при использовании металла и соли металла и восстановления в результате каталитического гидрирования, что описывается в публикации The Fifth Series of Experimental Chemistry Vol. 14 (Maruzen) pp. 11-27. С точки зрения экономической эффективности предпочтительным среди них является восстановление в результате каталитического гидрирования

где каждый R независимо представляет собой алкильную группу, содержащую от 1 до 4 атомов углерода.
[Катализатор каталитического гидрирования]
Несмотря на отсутствие конкретных ограничений, накладываемых на катализатор, предназначенный для использования при каталитическом гидрировании сложноэфирного производного алициклической дикарбоновой кислоты (ниже в настоящем документе также обозначаемый как «катализатор каталитического гидрирования»), до тех пор, пока это будут обычные катализаторы, предназначенные для использования при гидрировании карбонильного соединения, предпочтительно катализатор будет включать по меньшей мере один представитель, выбираемый из металлов в группах от 8 до 11 периодической таблицы.
Конкретные примеры катализатора каталитического гидрирования включают катализатор каталитического гидрирования, который содержит по меньшей мере один представитель, выбираемый из железа, кобальта, никеля, меди, рутения, родия, палладия, серебра, осмия, иридия, платины и золота, однако без накладываемых конкретных ограничений.
Хотя катализатор каталитического гидрирования может быть твердым катализатором или гомогенным катализатором, при рассмотрении выделения из продуктов реакции предпочтительным является твердый катализатор. Примеры твердого катализатора включают металлсодержащий катализатор, не нанесенный на носитель, и металлсодержащий катализатор, нанесенный на носитель, однако без накладываемых конкретных ограничений.
Предпочтительные примеры металлсодержащего катализатора, не нанесенного на носитель, включают катализатор Ренея, такой как никель Ренея, кобальт Ренея и медь Ренея, оксид платины, палладия, родия, рутения и тому подобного, и коллоидальный катализатор.
Примеры металлсодержащего катализатора, нанесенного на носитель, включают нанесенный на носитель металлсодержащий катализатор, образованный по меньшей мере из одного представителя, выбираемого из железа, кобальта, никеля, меди, рутения, родия, палладия, серебра, осмия, иридия, платины и золота и нанесенного на носитель или перемешанного с носителем, таким как оксид магния, диоксид циркония, диоксид церия, диатомитовая земля, активированный уголь, оксид алюминия, диоксид кремния, цеолит или диоксид титана, однако без накладываемых конкретных ограничений. В их числе предпочтительными являются нанесенный на носитель медный катализатор, такой как медно-хромовый катализатор (катализатор Адкинса), медно-цинковый катализатор или медно-железный катализатор, нанесенный на носитель платиновый катализатор, такой как Pt/C и Pt/оксид алюминия, нанесенный на носитель палладиевый катализатор, такой как Pd/C и Pd/оксид алюминия, нанесенный на носитель рутениевый катализатор, такой как Ru/C и Ru/оксид алюминия, или нанесенный на носитель родиевый катализатор, такой как Rh/C и Rh/оксид алюминия. В их числе в отношении активности при проведении реакции более предпочтительным является катализатор, который содержит по меньшей мере один представитель, выбираемый из группы, состоящей из никеля и меди.
На стадии восстановления количество катализатора каталитического гидрирования, предназначенного для использования, предпочтительно находится в диапазоне от 1 до 100 массовых частей, более предпочтительно от 3 до 30 массовых частей, кроме того, предпочтительно от 5 до 20 массовых частей по отношению к 100 массовым частям материала исходного сырья в виде сложноэфирного производного алициклической дикарбоновой кислоты несмотря на наличие зависимости от типа катализатора.
[Растворитель]
Стадия восстановления может быть проведена в отсутствие растворителя. В альтернативном варианте на данной стадии может быть использован растворитель.
Примеры растворителя, предназначенного для использования на стадии восстановления, включают воду; органические кислоты, такие как муравьиная кислота и уксусная кислота; ароматические соединения, такие как бензол, орто-дихлорбензол, толуол и ксилол; углеводороды, такие как гексан, гептан и циклогексан; спирты, такие как метанол, этанол, изопропиловый спирт, трет-бутиловый спирт, этиленгликоль и диэтиленгликоль; простые эфиры, такие как диоксан, тетрагидрофуран, диметоксиэтан и диглим; или их смесь; однако без накладываемых конкретных ограничений. В их числе предпочтительно используют вариант, свободный от растворителя; ароматические соединения, такие как бензол, орто-дихлорбензол, толуол и ксилол; углеводороды, такие как гексан, гептан и циклогексан; спирты, такие как метанол, этанол, изопропиловый спирт, трет-бутиловый спирт, этиленгликоль и диэтиленгликоль; простые эфиры, такие как диоксан, тетрагидрофуран, диметоксиэтан и диглим; или их смесь.
На стадии восстановления количество растворителя, предназначенного для использования, предпочтительно превышает в диапазоне от 0 до 30 раз при расчете на массу, более предпочтительно от 0 до 20 раз при расчете на массу, кроме того, предпочтительно от 0 до 10 раз при расчете на массу в сопоставлении с количеством сложноэфирного производного алициклической дикарбоновой кислоты, описываемого формулой (2) и полученного на стадии этерифицирования с образованием сложного эфира.
[Условия проведения реакции]
Для смещения равновесия реакции в сторону спирта более предпочтительным является повышенное давление водорода на стадии восстановления. При рассмотрении затрат на оборудование давление предпочтительно находится в диапазоне от 1 до 30 МПа, более предпочтительно от 5 до 25 МПа, кроме того, предпочтительно от 10 до 20 МПа.
С точки зрения получения достаточной скорости реакции температура реакции на стадии восстановления предпочтительно составляет 100°С и более, более предпочтительно 150°С и более, более того, предпочтительно 180°С и более. С точки зрения подавления прохождения реакции переэтерифицирования с образованием сложного эфира между получаемым ациклическим диольным соединением, описывающимся формулой (1), и сложноэфирным производным алициклической дикарбоновой кислоты, описывающимся формулой (2), температура реакции на стадии восстановления предпочтительно составляет 300°С и менее, более предпочтительно 290°С и менее, более того, предпочтительно 280°С и менее.
Давление реакции на стадии восстановления находится в диапазоне предпочтительно от 1,5 до 30 МПа, более предпочтительно от 6 до 25 МПа, более того, предпочтительно от 10 до 20 МПа.
На тип стадии восстановления конкретных ограничений не накладывают. Например, в случае восстановления в результате каталитического гидрирования на тип стадии восстановления конкретных ограничений накладывать не будут до тех пор, пока будет возможным прохождение реакции каталитического гидрирования, для того чтобы мог бы быть применен известный обычно использующийся тип. Примеры реактора, в котором проводят стадию восстановления, включают реактор с суспендированным слоем катализатора для проведения реакции каталитического гидрирования с катализаторами, псевдоожиженными в текучей среде, и реактор с неподвижным слоем катализатора, заполненный фиксируемыми катализаторами, для проведения реакции каталитического гидрирования в результате подачи текучей среды, однако без накладываемых конкретных ограничений.
На стадии восстановления в некоторых случаях во время проведения реакции в качестве побочных продуктов могут быть получены спирты, содержащие от 1 до 4 атомов углерода. Стадия восстановления может быть проведена при сохранении побочных продуктов или может быть проведена при непрерывном или периодическом удалении побочных продуктов во время проведения реакции.
<Другие стадии>
Способ получения настоящего варианта осуществления может включать и другие стадии, отличные от описанных выше стадий (а) и (b). Примеры другой стадии включают стадию экстракции жидкость-жидкость, стадию извлечения катализатора, стадию нейтрализации и промывания, стадию извлечения вспомогательного агента и стадию очистки, однако без накладываемых конкретных ограничений.
Примеры стадии очистки включают: после отгонки HF из реакционной жидкости, содержащей сложноэфирное производное алициклической дикарбоновой кислоты, описываемое формулой (2) и полученное на стадии этерифицирования с образованием сложного эфира, стадию очистки реакционной жидкости по обычному способу, такому как перегонка; и после отделения катализатора гидрирования от продуктов, содержащих алициклическое диольное соединение, описывающееся формулой (1) и полученное на стадии восстановления, стадию очистки продуктов по обычному способу, такому как перегонка и перекристаллизация; однако без накладываемых конкретных ограничений. В результате использования такой стадии очистки может быть получен новый высокочистый алициклический диол, описывающийся формулой (1).
Примеры
Ниже в настоящем документе настоящее изобретение будет конкретно описываться при обращении к примерам, но настоящее изобретение не предполагает ограничения данными примерами. Если только не будет указано другого, «%» в последующем изложении обозначает % (масс.).
<Аналитический метод и условия>
[Условия анализа для газовой хроматографии]
При газовой хроматографии использовали аппаратуру для измерения GC-17A, изготовленную компанией SHIMADZU CORPORATION, и капиллярную колонку HR-1, изготовленную компанией ULBON, (0,32 ммφ × 25 м × 0,50 мкм). Условия увеличения температуры задавали такими, чтобы температура увеличивалась бы от 100°С до 300°С при скорости 5°С/мин.
[Выход и доля изомера для сложноэфирного производного дикарбоновой кислоты]
В результате проведения анализа по методу газовой хроматографии получали доли площадей (% ГХ) для нескольких типов изомерных сложноэфирных производных дикарбоновых кислот в качестве продуктов, а выход и долю изомера для сложноэфирных производных дикарбоновых кислот рассчитывали по методу внутреннего стандарта при использовании следующего далее выражения.
{Выход сложноэфирного производного дикарбоновой кислоты (% (моль.)}={Совокупная собранная масса сложноэфирного производного дикарбоновой кислоты/256,3}/{Масса подачи материала исходного сырья/136,2}×100
{Доля изомера (%)}={Метил-4-(1-метокси-2-метил-1-оксопропан-2-ил)-1-метилциклогексанкарбоксилат (% ГХ)}/{Совокупное количество сложноэфирных производных дикарбоновых кислот (% ГХ)}×100
Изомер в описании изобретения обозначает структурный изомер, содержащий карбонильную группу в различных положениях вставления.
[Выход алициклических диольных соединений]
В результате проведения анализа по методу газовой хроматографии получали доли площадей (% ГХ) для нескольких типов изомерных диольных соединений в качестве продуктов, а выход 2-(4-(гидроксиметил)-4-метилциклогексил)-2-метилпропан-1-ола рассчитывали по методу внутреннего стандарта.
[ГХ-МС]
В качестве аппаратуры для измерения по методу ГХ-МС использовали спектрометр ГХ-МС POLARIS Q, изготовленный компанией Thermo ELECTRON Corporation.
[ЯМР]
Спектры по методу ЯМР измеряли в следующих далее условиях.
Аппаратура: Bruker Avance 600II (600 MHz-NMR).
Режим: протонный, углеродный, DEPT 45°, 90° и 135°, Carbon i.g. и INADEQUATE.
Растворитель: CDCl3 (дейтерированный хлороформ).
Вещество внутреннего стандарта: тетраметилсилан.
<Пример 1>
Получение метил-4-(1-метокси-2-метил-1-оксопропан-2-ил)-1-метилциклогексанкарбоксилата ((а) стадия карбонилирования и (b) стадия этерифицирования с образованием сложного эфира)

[Стадия карбонилирования]
При использовании автоклава из нержавеющей стали, имеющего внутренний объем 500 мл и включающего мешалку, относящуюся к типу Nack drive, и три сопла впускных отверстий наверху и одно сопло извлечения внизу при наличии рубашки для регулирования внутренней температуры, стадию карбонилирования проводили следующим далее образом.
Сначала атмосферу в автоклаве замещали монооксидом углерода. После этого в автоклав вводили 230 г (11,5 моля) безводного фтористого водорода и температуру жидкости в автоклаве устанавливали на -27°С. После этого давление во внутреннем пространстве автоклава увеличивали до 2 МПа при использовании монооксида углерода.
В автоклав, имеющий температуру реакции, выдерживаемую при -27°С, и давление реакции, выдерживаемое при 2 МПа, из верха автоклава подавали 104,4 г (0,77 моля) 4-изопропенил-1-метил-1-циклогексена, для того чтобы была бы проведена реакция карбонилирования. После завершения подачи перемешивание реакционной жидкости продолжали в течение приблизительно 10 минут вплоть до прекращения наблюдения какого-либо поглощения монооксида углерода, тем самым, получали фторангидрид алициклической дикарбоновой кислоты.
[Стадия этерифицирования с образованием сложного эфира]
После этого в автоклав, имеющий температуру реакции, выдерживаемую при -27°С, из верха автоклава подавали 49,1 г (1,53 моля) метанола, для того чтобы было бы проведено этерифицирование с образованием сложного эфира для фторангидрида алициклической дикарбоновой кислоты при перемешивании реакционной жидкости в течение 1 часа.
Реакционную жидкость извлекали из низа автоклава в воду со льдом, для того чтобы разделить масляную фазу и водную фазу. После этого масляную фазу подвергали промыванию два раза при использовании 100 мл 2%-ного водного раствора гидроксида натрия и два раза при использовании 100 мл дистиллированной воды и обезвоживанию при использовании 10 г безводного сульфата натрия. После обезвоживания полученную жидкость анализировали при использовании газовой хроматографии. В результате выход сложноэфирного производного дикарбоновой кислоты составил 26,6% (моль.) (при расчете на 4-изопропенил-1-метил-1-циклогексен), а выход метил-4-(1-метокси-2-метил-1-оксопропан-2-ил)-1-метилциклогексанкарбоксилата составил 21,1% (моль.) (при расчете на 4-изопропенил-1-метил-1-циклогексен, доля изомера: 79,2%).
[Выделение и очистка продукта реакции этерифицирования с образованием сложного эфира]
В результате перегонки при пониженном давлении для жидкости, полученной на стадии этерифицирования с образованием сложного эфира при использовании испарителя, из жидкости удаляли низкокипящие вещества. После этого жидкость после удаления низкокипящего вещества подвергали ректификации при использовании ректификационной колонны, характеризующейся числом теоретических тарелок 20 (температура перегонки: 177°С, величина вакуума: 20 торр). В результате ректификации получали 42,0 г продукта в виде основной фракции, характеризующейся долей изомера 92,0% согласно анализу по методу газовой хроматографии (выход перегонки: 93,2% (моль.), при расчете на метил-4-(1-метокси-2-метил-1-оксопропан-2-ил)-1-метилциклогексанкарбоксилат).
[Стадия восстановления]
Получение 2-(4-(гидроксиметил)-4-метилциклогексил)-2-метилпропан-1-ола

В автоклаве из нержавеющей стали размещали 3,0 г медно-цинкового катализатора, нанесенного на носитель в виде оксида алюминия (изготовленного компанией JGC Catalysts and Chemicals Ltd.), и 30,0 г продукта, полученного в виде основной фракции при выделении и очистке (содержащего метил-4-(1-метокси-2-метил-1-оксопропан-2-ил)-1-метилциклогексанкарбоксилат, характеризующийся долей изомера 92,0% и присутствием других изомеров в количестве 8,0%), и смесь перемешивали в течение 15 часов при 280°С при давлении водорода 15 МПа в состоянии, свободном от растворителя, и при пропускании водорода. Таким образом, проводили реакцию восстановления метил-4-(1-метокси-2-метил-1-оксопропан-2-ил)-1-метилциклогексанкарбоксилата.
Катализатор удаляли в результате фильтрования реакционной жидкости, таким образом получали 19,1 г продукта (смеси), содержащего 0,8% метил-4-(1-метокси-2-метил-1-оксопропан-2-ил)-1-метилциклогексанкарбоксилата, 9,6% полностью гидрированного продукта, 89,0% 2-(4-(гидроксиметил)-4-метилциклогексил)-2-метилпропан-1-ола и 0,6% других изомеров. Выход 2-(4-(гидроксиметил)-4-метилциклогексил)-2-метилпропан-1-ола составил 78,9% (мольн.) (при расчете на метил-4-(1-метокси-2-метил-1-оксопропан-2-ил)-1-метилциклогексанкарбоксилат).
[Перекристаллизационная очистка продукта реакции восстановления]
Продукт, полученный на стадии восстановления, растворяли в метаноле. После этого в полученный раствор медленно выливали 40 г н-гексана, и осажденные кристаллы отделяли в результате фильтрования. Полученный продукт представлял собой белое твердое вещество, характеризующееся степенью чистоты 100% (12,6 г, выход при кристаллизации: 65,7% (моль.), при расчете на 2-(4-(гидроксиметил)-4-метилциклогексил)-2-метилпропан-1-ол).
<Идентифицирование продукта>
В результате проведения анализа по методу ГХ-МС установили то, что продукт, полученный при перекристаллизационной очистке в примере 1, имел молекулярную массу 200.
При использовании аппаратуры для метода ЯМР проводили измерение по методу ЯМР1H, измерение по методу ЯМР13С, измерение по методу ЯМР DEPT 45°, 90° и 135°, измерение по методу ЯМР Carbon i.g. и измерение по методу ЯМР INADEQUATE. Результаты измерения по методу ЯМР1H и измерения по методу ЯМР13С продемонстрированы в последующем изложении, а результаты измерения по методу ЯМР DEPT 45°, 90° и 135°, измерения по методу ЯМР Carbon i.g. и измерения по методу ЯМР INADEQUATE продемонстрированы на чертежах в диапазоне от Фигуры 1 до Фигуры 6.
[Результаты измерения по методу ЯМР для продукта, полученного в примере 1]
ЯМР1H (600 МГц, CDCl3, ТМС, м.д.) δ: 0,700-0,955 (м., 9Н), 1,113-1,231 (м., 6Н), 1,473-1,560 (м., 2Н), 1,638-1,726 (м., 2Н), 3,281-3,457 (м., 4Н), 4,907 (м., 1Н).
ЯМР13С (600 МГц, CDCl3, ТМС, м.д.) δ: 22,27, 23,29, 28,22, 35,07, 36,02, 37,86, 43,94, 49,01, 66,64, 70,60.
Фигура 1 представляет собой диаграмму, демонстрирующую результаты измерений по методу ЯМР DEPT 45°. Как было установлено на основании Фигуры 1, четвертый и шестой пики для четвертичных атомов углерода отсутствовали. Фигура 2 представляет собой диаграмму, демонстрирующую результаты измерений по методу ЯМР DEPT 90°. Как было установлено на основании Фигуры 2, наблюдался интенсивный седьмой пик для третичного атома углерода. Фигура 3 представляет собой диаграмму, демонстрирующую результаты измерений по методу ЯМР DEPT 135°. Как было установлено, в направлении понижения наблюдались второй, пятый, восьмой и девятый пики для вторичных атомов углерода. Фигура 4 представляет собой диаграмму, демонстрирующую результаты измерений по методу ЯМР Carbon i.g. На основании Фигуры 4 было подтверждено количество атомов углерода. Фигура 5 и Фигура 6 представляют собой диаграммы, демонстрирующие результаты измерений по методу ЯМР INADEQUATE (Фигура 6 представляет собой увеличенную диаграмму, демонстрирующую результаты измерений на участке в диапазоне от 15 до 50 м. д. Фигуры 5). На основании Фигуры 5 и Фигуры 6 были разъяснены корреляции прямого связывания между атомами углерода.
Исходя из исчерпывающего определения на основании результатов измерений основной компонент продукта, полученного в примере 1, был идентифицирован как 2-(4-(гидроксиметил)-4-метилциклогексил)-2-метилпропан-1-ол.
Применимость в промышленности
Новое алициклическое диольное соединение, полученное в настоящем изобретении, является подходящим для использования в качестве различных промышленных химических исходных материалов и исходных материалов для получения функциональных оптических материалов и функциональных электронных материалов.
Реферат
Настоящее изобретение относится к способу получения алициклического диольного соединения формулы (1), которое может быть использовано в качестве материала исходного сырья для смол сложного полиэфира. Способ включает введение 4-изопропенил-1-метил-1-циклогексена формулы (4) в реакцию с монооксидом углерода в присутствии фтористого водорода в целях получения фторангидрида алициклической дикарбоновой кислоты формулы (3), введение полученного соединения формулы (3) в реакцию со спиртом в целях получения сложноэфирного соединения алициклической дикарбоновой кислоты формулы (2) и восстановление полученного соединения формулы (2) в целях получения алициклического диольного соединения формулы (1):где каждый R независимо представляет собой алкильную группу, содержащую от 1 до 4 атомов углерода. Предлагаемый способ является экологически безопасным в отношении углеродной нейтральности. 6 ил., 1 пр.
Формула

Комментарии