Способ получения 1,3-алкандиолов и 3-гидроксиальдегидов - RU2149156C1
Код документа: RU2149156C1
Чертежи




Описание
Изобретение относится к способу получения 1,3-алкандиолов и 3-гидроксиальдегидов посредством гидроформилирования оксирана (1,2-эпоксида). В частности, изобретение касается кобальт-катализируемого способа получения 1,3-пропандиола путем гидроформилирования оксида этилена и гидрогенизации гидроформилированного продукта. Гидроформилирование оксиранов для получения 3-гидроксиальдегидов описано в "New Syntheses with Carbon Monoxide", под редакцией J.Falbe (1980), стр. 131-132. Реакция проводится с катализатором на основе кобальта или фосфин-модифицированного катализатора на основе кобальта. Продукт гидроформилирования, будь то 3- гидроксиальдегид или циклический полуацеталь, т.е. его димер, может быть преобразован в 1,3-алкандиол с помощью гидрогенизации. Этот способ особенно важен для получения 1,3-пропандиола (PDO), промежуточного продукта в производстве полиэфира для волокон и пленок, которые могут быть получены посредством гидрогенизации 3-гидроксипропанола (НРА). Согласно этой книге были осуществлены попытки усовершенствовать реакцию гидроформилирования с помощью добавления малых количеств спиртов, простых эфиров, кетонов и сложных эфиров. Согласно US-A-3687981 в качестве промотора (активатора) гидроформилирования могут быть использованы также галогенсодержащие неорганические соединения, например, неорганические соли и кислоты, например, соляная кислота.
Наконец, из WO 94/18149 известен способ получения 1,3-алкандиолов и 3-гидроксиальдегидов, причем указанный способ проводят в присутствии фосфин-связанного кобальтового катализатора. Этот способ выходит за пределы комнатных условий при усовершенствовании по отношению к скорости реакции и избирательности к НРА. Кроме того, способ не удовлетворителен по отношению к рециркуляции катализатора.
Желательно получать продукт гидроформилирования с увеличенной скоростью. Поэтому задачей изобретения является создать способ получения 1, 3-алкандиолов и 3-гидроксиальдегидов повышенной скорости. Другой задачей изобретения является создание способа, при котором в основном весь катализатор может быть удобно рециркулирован.
Таким образом, изобретение обеспечивает способ получения 1,3-алкандиолов и 3-гидроксиальдегидов путем гидроформилирования оксирана монооксидом углерода и водородом в
присутствии катализатора на основе
кобальта и промотора, причем катализатор на основе кобальта не является фосфин-связанным катализатором, а промотор является липофильной четырехзамещенной солью
элемента V группы, выбранного из N, Р,
As
Оксиран включает органическое соединение, два атома углерода которого соединены окси-связью, также как и одинарной связью угле род-углерод. Вообще
говоря, оксиран включает
гидрокарбил-эпоксиды, имеющие, по меньшей мере, 2, предпочтительно до 30, более предпочтительно до 20, наиболее предпочтительно - до 10 атомов углерода. Гидрокарбильной
группой могут быть арильная,
алкильная, алкенильная, аралкильная, циклоалкильная или даже алкиленовая, неразветвленной цепочкой или разветвленной цепочкой. Подходящие примеры оксиранов включают в
себя 1,2-эпокси(цикло)алканы,
например, оксид этилена, оксид пропилена, 1,2-эпоксиоктан, 1,2-эпоксициклогексан, 1,2-эпокси-2,4,4- триметилгексан и 1,2-эпоксиалкены, например, 1,2-эпокси-4-пентен.
Предпочтительными являются оксид
этилена и оксид пропилена. С точки зрения требований к PDO оксид этилена (ЕО) является наиболее предпочтительным оксираном для использования в способе изобретения.
Реакцию гидроформилирования предпочтительно проводят в жидком растворителе, инертном к реагентам и продуктам реакции, т.е. не расходуется во время реакции. По завершении реакции жидкий растворитель облегчает отделение продукта гидроформилирования. Отделение может быть проведено путем расслаивания, как это раскрыто в US-A-3687981. Однако, как раскрывается ниже, предпочтительно проводить отделение посредством экстракции водосодержашей жидкостью. Вообще, идеальные растворители для способа гидроформилирования будут (а) обнаруживать полярность от низкой до средней, так что 3-гидроксиальдегид будет растворяться до концентрации, по меньшей мере, около 5% по весу в условиях гидроформилирования, в то время как значительное количество растворителя будет оставаться в качестве отдельной фазы при экстракции водной жидкостью, (b) растворять монооксид углерода и (c) по существу не смешиваемым с водой. Термин "по существу не смешиваемый с водой" означает, что растворитель имеет растворимость в воде при 25oC менее 25% по весу так, чтобы образовать отдельную богатую углеводородом фазу при экстракции 3-гидроксиальдегида из реакционной смеси гидроформилирования. Предпочтительно, чтобы эта растворимость была менее 10% по весу, более предпочтительно - менее 5% по весу. Растворимость монооксида углерода в выбранном растворителе должна быть обычно более 0.15 объем/объем (1 атм, 25oС), предпочтительно - более 0.25 объем/объем, выраженная в терминах коэффициентов Оствальда.
Предпочтительным классом растворителей
являются спирты и простые эфиры,
которые могут быть описаны согласно формуле 1
R1 - O - R2 (1),
где R1 является водородом или линейным,
разветвленным, циклическим, или ароматическим
C1-20 гидрокарбилом, или оксидом моно- или полиалкилена, или R1, R2 является линейным, разветвленным, циклическим или
ароматическим C1-20 гидрокарбилом,
алкокси, или моно-, или полиалкиленовым оксидом, или R1, a R2 и О вместе образуют циклический простой эфир. Наиболее
предпочтительные растворители гидроформилирования могут быть
описаны формулой 2

где R1 является водородом или C1-8 гидрокарбилом, a R3, R4 и R5 являются независимо выбранными из C1-8 гидрокарбила, алкокси и моно- или полиалкиленового оксида. Такие простые эфиры включают в себя, например, тетрагидрофуран, метил-t-бутиловый простой эфир, этил-t-бутиловый простой эфир, фенилизобутиловый простой эфир, этоксиэтиловый простой эфир, диэтиловый простой эфир, дифениловый простой эфир и диизопропиловый простой эфир. Смеси растворителей, например, t-бутиловый спирт/гексан, тетрагидрофуран/толуол и тетрагидрофуран/гептан также могут быть использованы для достижения желаемых свойств растворителя. В настоящее время предпочтительным растворителем из-за своего высокого выхода НРА, который можно получить при средних условиях реакции, является метил-t-бутиловый простой эфир.
Катализатор на основе кобальта может быть модифицированным соединением карбонила кобальта, например фосфин-связанным соединением или немодифицированным соединением карбонила кобальта. Хотя фосфин-связанный катализатор является активным для требуемой реакции гидроформилирования, желательно использовать способ, в ко тором высокий выход и избирательность достигаются без фосфин-лиганда, из-за дополнительных расходов на лиганд. Поэтому предпочти тельными являются немодифицировачные соединения карбонила кобальта.
Катализатор на основе кобальта может быть подан в реактор гидроформилирования в качестве карбонила кобальта, например дикобальтоктакарбонила или гидридокарбонила кобальта. Он может быть также подан по существу в любой другой форме, включая металл, металл-носитель, кобальт Ренея, гидроксид, оксид, карбонат, сульфат, ацетилацетонат, соль или жирную кислоту или водный раствор соли кобальта. Если катализатор не подается в виде карбонила кобальта, то рабочие условия должны быть отрегулированы так, чтобы образовывались карбонилы кобальта, например, посредством реакции H2 и CO, как описано в J. Falbe, "Carbon Monoxide in Organic Synthesis", Springer-Verlag, NY (1970). Обычно эти условия будут включать в себя температуру, по меньшей мере, равную 50oC и парциальное давление монооксида углерода, равное, по меньшей мере, 0.8 МПа (100 фунтов/дюйм2 избыточного давления). Для более быстрой реакции должны использоваться температуры 120 - 200oC и давления CO, равные, по меньшей мере, 3.5 МПа (500 фунтов/дюйм2). Известно, что добавление активированного углерода с большой площадью поверхности, или цеолитов, в особенности тех, которые содержат или являются носителями металлов платины или палладия, ускоряет образование карбонилов кобальта.
Катализатор предпочтительно содержится в стабилизированной атмосфере монооксида углерода, который также обеспечивает защиту от воздействия кислорода. Наиболее экономичный и предпочтительный способ активации и реактивации (или повторного использования) катализатора включает в себя преобразование соли кобальта (или производного вещества) в атмосфере H2/CO в присутствии промотора катализатора, применяемого для гидроформилирования. Преобразование Co2+ в искомый карбонил кобальта выполняется при температуре в диапазоне от 75 до 200oC, предпочтительно - от 100 до 140oC и давлении в пределах от 7.0 до 34.6 МПа (1000 до 5000 фунтов/дюйм2 избыточного давления) предпочтительно в течение менее 3 часов. Этап брикетирования может быть выполнен в реакторе высокого давления брикетирования или in-situ в реакторе гидроформилирования.
Количество кобальта, присутствующего в реакционной смеси, будет изменяться в зависимости от других условий реакции, но обычно будет находиться в пределах от 0.01 вес.% до 1 вес.%. предпочтительно - от 0.05 вес.% до 0.3 вес.% в расчете на вес реакционной смеси.
Реакция гидроформилирования выполняется в присутствии липофильной четырехзамещенной соли элемента V группы, выбранной из N, P, As для ускорения скорости реакции без придания свойств гидрофильности (растворимости в воде) для активизации катализатора. Термин "липофильный" означает, что промотор стремится остаться в органической фазе после экстракции 3-гидроксиальдегида водной жидкостью.
Липофильные четырехзамещенные соли элементов V группы, выбранных из азота, фосфора, мышьяка, представлены формулой 3
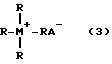
где каждая R группа независимо выбирается из незамещенного или инертно-замещенного C1-25 линейного, разветвленного, циклического или ароматического гидрокарбила, алкокси или моно-, или полиалкиленового оксида, М является атомом элемента V группы, выбранных из атомов азота, фосфора или мышьяка, а А является основным анионом, предпочтительно кислоты, имеющей сопряженные связи с pKa > 2, например, карбоксилат, фенат и гидроксид. Две или более R-групп вместе могут образовывать циклические ароматические структуры. Такие четырехзамещенные соли включают ацетат бензилтри(н-бутил) аммония, метилат бензилтриметиламмония, гидроксид бензилтриметиламмония и этоксилатные соли четырехзамещенного аммония, такие как доступные под фабричной маркой "ETHOQUAD"; ацетат тетра(н-бутил)фосфония, ацетат тетраоктилфосфония, гидроксид тетрафенилфосфония и ацетат бензилтриметилфосфония; и ацетат тетрафениларсония, ацетат тетра(н-бутил)арсония, и ацетат тетраоктиларсония.
Соли четвертичного основания должны присутствовать в количестве, эффективном для активирования реакции гидроформилирования до образования 3-гидроксиальдегида, которое обычно находится в пределах от 0.01 до 0.6 молей на моль кобальта. Предпочтительным является количество в пределах от 0.05 до приблизительно 0.3 молей на моль кобальта.
Обычно предпочитают регулировать концентрацию воды в реакционной смеси гидроформилирования, чрезмерные количества воды снижают избирательность по отношению к 1,3-алкандиолам и 3-гидроксиальдегидам ниже приемлемых уровней и могут вызвать образование второй жидкой фазы. При низких концентрациях вода может помогать в активировании образования требуемого вида катализатора карбонила кобальта. Приемлемые уровни воды будут зависеть от используемого растворителя, растворители с большей полярностью обычно больше терпимы к более высоким концентрациям воды. Например, оптимальные уровни воды для гидроформилирования в метил-t-бутил эфирном растворителе, как полагают, должны быть в пределах от 1 до 2.5 вес.%.
Водород и монооксид углерода должны быть обычно введены в реакционный сосуд в молярном отношении, находящемся в пределах от 1:2 до 8:1, предпочтительно от 1:1.5 до 5:1.
Реакция протекает при условиях, эффективных для
получения реакционной смеси гидроформилирования, заключающей в себе большую долю 3-гидроксиальдегида и меньшую долю побочного продукта. Более того,
уровень 3-гидроксиальдегида в реакционной смеси
предпочтительно поддерживается ниже, чем 15 вес. %, предпочтительно от 5 до 10 вес.%. (Для подачи растворителей, имеющих различные плотности,
концентрация 3-гидроксиальдегида в реакционной смеси
может быть выражена молярностью, т. е. ниже, чем 1.5 М, предпочтительно в пределах от 0.5 до 1 М.)
Обычно, реакция гидроформилирования
выполняется при повышенной температуре ниже, чем
100oC, предпочтительно от 60 до 90oC, наиболее предпочтительно от 75 до 85oC, и при давлении в пределах от 3.5 до 34.6
МПа (от 500 до 5000 фунтов/дюйм2
избыточного давления), предпочтительно (для экономичности процесса) от 7.0 до 24.2 МПа (от 1000 до 3500 фунтов/дюйм2 избыточного давления),
причем с более высокими давлениями обычно
связана более высокая избирательность. Концентрация 3-гидроксиальдегида в смеси промежуточного продукта может контролироваться регулированием условий процесса,
таких как концентрация оксирана,
концентрация катализатора, температура реакции и время взаимодействия (соприкосновения). В общем случае предпочтительны относительно низкие температуры протекания
реакции (ниже 100oC) и
относительно короткое время реакции, в пределах от 20 минут до 1 часа.
При практической реализации способа по изобретение представляется возможным достичь выхода 3-гидроксиальдегида (в расчете на превращение оксирана) выше 80%. Например, при гидроформилировании EO, является достижимым образование более, чем 7 вес.% НРА в разбавленной смеси продукта гидроформилирования, при скоростях более, чем 30 час-1. (Скорость каталитического процесса называется при этом "частотой оборачиваемости" или "TOF" и выражена в единицах молей на моль кобальта в час, или час-1.) Указанные скорости основываются на наблюдении того, что прежде, чем большая часть оксирана, в данном случае EO, преобразуется, реакция является в сущности нулевого порядка в концентрации EO и пропорциональна концентрации кобальта.
Как отмечено выше, разделение смеси продукта гидроформилирования производится экономически наиболее выгодно экстракцией водными жидкостями.
Предпочтительной водосодержащей жидкостью является вода. Количество воды, добавляемое в смесь продукта реакции гидроформилирования обычно должно быть таким, чтобы обеспечить весовое отношение вода: смесь в пределах от 1:1 до 1: 20, предпочтительно от 1:5 до 1:15. Добавление воды на этой стадии реакции может иметь дополнительное преимущество - подавление образования нежелательных тяжелых хвостовых фракций.
Экстракция с относительно малым количеством воды обеспечивает жидкую фазу, которая является более, чем на 20 вес.% 3-гидроксиальдегидом, предпочтительно более, чем на 35 вес.% 3-гидроксиальдегидом, позволяя осуществить экономичную гидрогенизацию 3-гидроксиальдегида в 1,3-алкандиол. Водная экстракция предпочтительно проводится при температуре в пределах от 25 до 55oC, избегая высоких температур для сведения к минимуму конденсации продуктов (тяжелых хвостовых фракций) и инактивирования каталитической диспропорции водно-растворимых соединений кобальта. Для того, чтобы максимально улучшить регенерацию катализатора (каталитическое восстановление), описанную выше, предпочтительно провести водную экстракцию под давлением от 0.5 до 1.5 МПа (от 50 до 200 фунтов/дюйм2 избыточного давления) монооксида углерода при температуре от 25 до 55oC.
После разделения продукт гидроформилирования соответственно гидрогенизируется, чтобы получить 1,3-алкандиол посредством реакции с водородом в присутствии катализатора гидрогенизации. Гидрогенизация может быть проведена в водном растворе при повышенной температуре, по меньшей мере, части этапа гидрогенизации при температуре, по меньшей мере 40oC, обычно в пределах от 50 до 175oC, при давлении водорода по меньшей мере 0.8 МПа (100 фунтов/дюйм2 избыточного давления), обычно в пределах от 1.5 до 13.9 МПа (от 200 до 2000 фунтов/дюйм2 избыточного давления). Реакция выполняется в присутствии катализатора гидрогенизации такого, как любой из основных металлов VIII группы, включающей никель, кобальт, рутений, платину и палладий, так же, как медь, цинк и хром, и смеси, и их сплавы. Катализаторы на основе никеля в сыпучем виде, на носителе и с неподвижным слоем, обеспечивают приемлемые активности и избирательности при умеренной цене. Наибольшие выходы достигаются в слабокислых реакционных средах.
Коммерческий процесс будет предпочтительно включать в себя эффективную регенерацию кобальтового катализатора по существу с полной рециркуляцией кобальта для реакции гидроформилирования. Предпочтительный способ регенерации катализатора включает две стадии, начиная с вышеописанной экстракции 3-гидроксиальдегида из смеси продукта гидроформилирования. Большая часть кобальтового катализатора будет оставаться в органической фазе, причем оставшийся кобальтовый катализатор будет проходить в водно-жидкостную фазу. Эта органическая фаза может быть возвращена в реактор гидроформилирования, с необязательной очисткой тяжелых хвостовых фракций. Необязательное последующее удаление кобальта из катализатора в водно-жидкостной фазе может быть осуществлено полным или частичным окислением кобальта с последующим осаждением и фильтрацией, дистилляцией, осаждением на твердый носитель, или экстракцией, используя подходящий экстрагент.
Способ дает возможность получения PDO с высоким выходом и избирательностью без использования фосфин-связанного кобальтового катализатора на стадии гидроформилирования. Способ также дает возможность регенерации и возвращения в процесс почти всего кобальтового катализатора.
Способ по изобретению может быть описан со ссылками на чертеж. С помощью примера будет раскрыто гидроформилирование EO как примера оксирана. Разделенные или комбинированные потоки EO (1), монооксида углерода и водорода (2) загружают в сосуд гидроформилирования (3), который может быть реакционным сосудом, рассчитанным на высокое давление, таким, как барботажная колонна или резервуар с перемешиванием, периодического или непрерывного действия. Питающие потоки контактируют в присутствии немодифицированного катализатора на основе кобальта, т.е. соединения карбонила кобальта, которое не вступает в предварительную реакцию с фосфиновым лигандом.
Вслед за реакцией гидроформилирования смесь (4) продукта реакции гидроформилирования, содержащая НРА, реакционный растворитель, PDO, кобальтовый катализатор и меньшее количество побочных продуктов реакции, проходит в экстракционную емкость (5), в которой водная жидкость, обычно вода и необязательно смешивающийся растворитель, добавляется по (6) для экстракции и концентрирования НРА для последующей стадии гидрогенизации. Жидкостная экстракция может быть осуществлена любыми подходящими средствами, такими, как установкой смесителя (мешалки), насадочной или тарелочной экстракционными колоннами или вращающимися дисковыми смесителями. Экстракция может, если требуется, проводиться в несколько этапов. Водная смесь продукта реакции гидроформилирования может проходить в отстойник (не показан) для разделения на водную и органическую фазы.
Органическая фаза, содержащая реакционный растворитель и большую часть кобальтового катализатора, может быть возвращена из экстракционной емкости в реакцию гилроформилирования по (7). Водный экстракт (8) необязательно проходит через один или более кислотных слоев (9) ионообменной смолы для удаления кобальтового катализатора, и смесь водного продукта (10), не содержащая кобальта, проходит в емкость (11) гидрогенизации и реагирует с водородом (12) в присутствии катализатора гидрогенизации с образованием смеси (13) гидрогенизированного продукта, содержащего PDO. Стадия гидрогенизации может также возвращать некоторые тяжелые хвостовые фракции в PDO. Растворитель и экстрагирующая вода (15) могут регенерироваться дистилляцией в колонне (14) и возвращаться в процесс водной экстракции по средством дополнительной дистилляции (не показана) для разделения и очистки легких хвостовых фракций. PDO-содержащий поток (16) может проходить в одну или более дистилляционные колонны (17) для регенерации PDO (18) из тяжелых хвостовых фракций (19).
Способ по изобретению допускает избирательный и экономичный синтез PDO при средних температурах и давлениях без использования лигандов фосфина для катализатора гидроформилирования. Способ включает в себя получение смеси продукта реакции, растворимой в НРА, затем концентрирование этой НРА посредством водной экстракции для последующей гидрогенизации НРА в PDO.
Сравнительный пример 1.
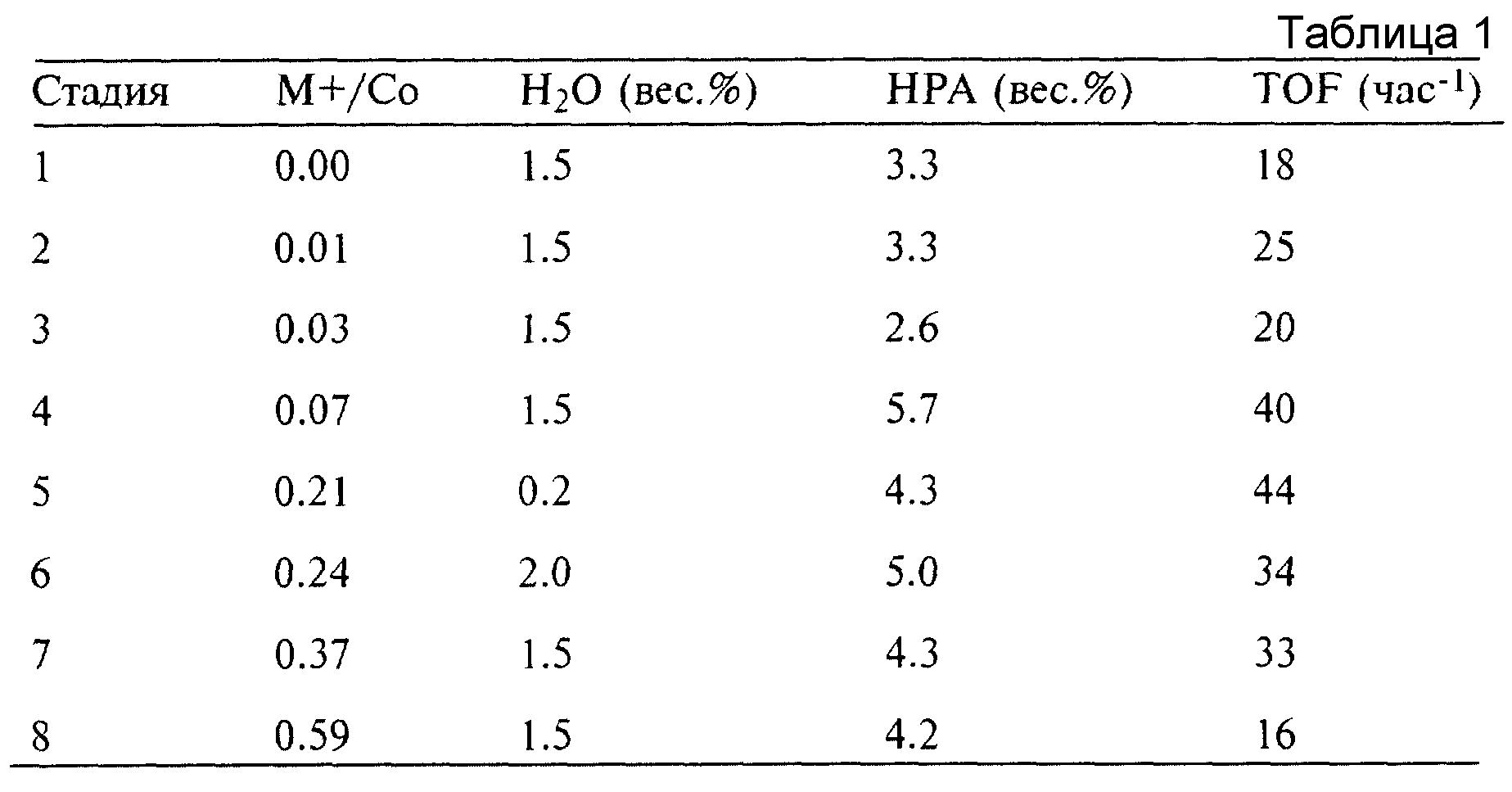
0.87 г дикобальтоктакарбонила, 1.5 г толуола (внутренний маркер), 2.0 г деионизованной воды и 146 г метил-1-бутилового простого эфира (МТВЕ), содержащего 0.2% по весу воды, предварительно подогревают в течение 1 часа в реакторе емкостью 300 мл со смесителем и насадкой для просеивания при 80oС при избыточном давлении 4.2 МПа (600 фунтов/дюйм2 избыточного давления) H2 и 6.3 МПа (900 фунтов/дюйм2 избыточного давления) при соотношении 1:1 CO/H2 синтез-газа. 10 г EO добавляют для инициации реакции гидроформилирования. Пробы отбирают для периодического анализа с помощью капиллярной газовой хроматографии (с детектором ионизации пламени) для измерения продукта реакции гидроформилирования НРА. Пробы после приблизительно 40 % преобразования EO, указывающие на образование 3.3 % по весу НРА, что соответствует скорости (ТОF) 18 час-1. Этот результат приведен в таблице 1 в качестве теста 1.
Пример 1.
Этот эксперимент иллюстрирует использование четырехзамещенной соли фосфония в качестве промотора гидроформилирования EO с кобальтом в качестве катализатора. Эксперимент повторяют с добавлением различных количеств (в расчете на кобальт) промотора ацетата тетра(н-бутил)фосфония. Результаты приведены в таблице 1. Для средних количеств промотора гидроформилирование ускоряется с наивысшей скоростью при мольном соотношении М+/Со в пределах от 0.05 до приблизительно 0.3.
Пример 2.
Этот пример иллюстрирует водную экстракцию кобальтового катализатора в атмосфере моноксида углерода в присутствии липофильного ацетата фосфония в качестве промотора. Реакционную смесь со стадии 6 примера 1 экстрагируют с 30 г деионизованной воды под давлением 1.5 МПа (200 фунтов/дюйм2 избыточного давления) моноксида углерода при 25oC. Извлекают 94.83 г верхнего органического слоя, содержащего 2184 ррм (частей на миллион) по весу кобальта. 24.90 г экстракта с низким содержанием воды (содержащего большую часть НРА продукта) восстанавливают и обнаруживают, что он содержит 88 ррм кобальта. Эти результаты соответствуют 98.5 % от всего кобальта, выделенного из водного продукта и оставшегося в органическом слое после экстракции.
Пример 3.
Этот пример иллюстрирует повторное использование кобальтового катализатора при липофильном гидроформилировании с апетатом фосфония в качестве промотора. 10.875 г дикобальтоктакарбонила, 7 г 70 вес.% ацетата тетра(н-бутил)фосфония в метаноле, 18.75 г толуола (маркер), 25 г деионизованной воды и 1838.0 г МТВЕ загружают в реактор емкостью 3.8 л (1 галлон) со смесителем и насадкой для просеивания и нагревают при 13.9 МПа (2000 фунтов/дюйм2 избыточного давления) H2 и 5.6 МПа (800 фунтов/дюйм2 избыточного давления) CO. По истечении 1 часа добавляют 123 г EO для инициирования реакции. Синтез-газ в соотношении 1:1 CO/H2 добавляют для пополнения его расхода в процессе гидроформилирования. Реакцию прерывают через 50 минут с образованием продукта НРА со скоростью 39 час-1. 375 г деионизованной воды добавляют для экстракции НРА при 38oC при избыточном давлении 1.5 МПа (200 фунтов/дюйм2 избыточного давления) синтез-газа в соотношении 1:1. 495 г водного экстракта восстанавливают, получая продукт НРА, соответствующий 66% EO, потребленного во время реакции. Менее 7% кобальтового катализатора экстрагируется в водной фазе.
Водный экстракт удаляют из реакции и для последующих циклов использования оставшуюся органическую фазу повторно нагревают под давлением синтез-газа (2.6 H2/CO) в течение одного часа. и добавляют 120 - 130 г ЕО для выполнения повторной реакции в течение 12 циклов. Результаты приведены в таблице 2.
НРА продукт в водных экстрактах, что показывает газовый хроматографический анализ, соответствует выходу (в расчете на потребленный ЕО) 70-89% при скоростях гидроформилирования нулевого порядка, составляющих 30 - 45 час-1. Скорости гидроформилирования остаются по существу постоянными для последовательных циклов по отношению к наблюдаемым изменениям в измерениях скорости. Повторное использование кобальта (% от общего количества кобальта, оставшегося в органической фазе после водной экстракции) в органической фазе изменяется от 93 до 99%. Менее 17 ррм фосфора в качестве промотора - ацетата тетра(н-бутил)фосфония - распределены в водную фазу.
Эти эксперименты демонстрируют последовательность рециркулирования кобальтового катализатора с органическим слоем после водной экстракции для отделения от продукта НРА в присутствии липофильного промотора - ацетата фосфония. Рециркулированный катализатор в большой степени сохраняет свою каталитическую активность и избирательность. Только небольшие количества промотора терялись в водной фазе при экстракции.
Сравнительный пример 2.
Реакцию гидроформилирования выполняют с 0.87 г дикобаль токтакарбонила, 1.5 r толуола (внутренний маркер) и 147 г МТВЕ. После предварительного установления равновесного состояния реакционной смеси в течение 1 часа при соотношении CO/H2 1:1 при 80oC, добавляют 20 г EO. Через три часа образуется 3.7 вес.%. НРА, что соответствует скорости (TOF) 4.6 час-1.
Сравнительный пример 3.
Сравнительный пример 2 повторяют с 0.077 г хлорида калия. Только 3.7 вес. %. НРА образуется за 3.5 часа при 80oC, соответствующей скорости (TOF) 4.0 час-1. Второй тест проводят в иных условиях - с 0.06 г хлорида натрия вместо хлорида калия. При приблизительно 25% превращении EO достигают скорости нулевого порядка только 4.3 час-1. Эти эксперименты демонстрируют ограниченную эффективность нейтральных солей сильных кислот и оснований в активировании реакции гидроформилирования вопреки утверждениям в US-A-3687981.
Пример 4.
Сравнительный пример 2 повторяют с добавлением 0.46 г 40% раствора метилата бензилтриметиламмония в метаноле. 4.73 вес. % НРА образуется менее, чем за 2 часа, что соответствует скорости (TOF) 11.8 час-1, т.е. в 2.6-кратной скоростью по сравнению с неактивированным сравнительным примером 2.
Пример 5.
Сравнительный пример 2 повторяют, используя гидроксид аммония (тест 2, сравнительный), "ETHOQUAD" 2C/11 (фабричная марка, ацетат бис(C12-13 алкил)(гидроксиэтил)метиламмония, использованный в тестах 3 и 5), метилат бензилтриметиламмония (стадия 4) и гидроксид бензилтриметиламмония (стадия 6* при H2CO = 2.3:1). Результаты приводятся и сравниваются с предыдущими примерами в таблице 3. Четырехзамещенный ацетат аммония активирует реакцию аналогично метилату. В то время как четырехзамещенный ацетат аммония активирует реакцию, гидроксид аммония - нет.
Пример 6.
Проводят серию экспериментов для определения эффекта экстракции под давлением моноксида углерода на восстановление кобальта после гидроформилирования.
Гидроформилирование проводят в 300 мл или 3.79 л (1 галлон) лабораторном резервуаре в присутствии "ETHOQUAD" 2C/11 (торговая марка) в качестве липофильного промотора (0.1 моля относительно кобальта) при 80oC в МТВЕ и соотношениях H2/CO 2.3:1 к 3.0:1 (с общими давлениями, приведенными в таблице 4).
Реакции ограничивают образованием менее, чем 10 вес. % НРА водной экстракцией. Экстракции водой выполняют при 25-40oC и 0.5 - 2.2 МПа (50 - 300 фунт/дюйм2 избыточного давления) CO, с изменением количеств воды, добавляемой к заданным отношениям органической фазы/водной фазе, равным 1.5:1 до 4: 1. Как видно из таблицы 2, использование в качестве промотора липофильной соли аммония и экстракции под CO, позволяющего рециркулировать 90% или более кобальтового катализатора с помощью растворителя реакции гидроформилирования, в то время как НРА преимущественно концентрируют и экстрагируют в водную фазу в соотношении более, чем 10:1. Таким образом, кобальтовый катализатор и НРА эффективно разделяют. Более того, стадию 7 представляет собой повторное использование катализатора со стадии 6 (3.79 л лабораторном резервуаре). Для стадии 7 получают скорость гидроформилирования 33 час-1 по сравнению со скоростью 35 час-1 в стадии 6. Эти примеры показывают, что согласно изобретению большая часть катализатора по существу в активной форме восстанавливается.
Сравнительный пример 4.
Сравнительный пример 1 повторяют в отсутствии добавленной воды и с добавлением 0.14 г тригидрата ацетата натрия в качестве промотора, добавленного в соотношении Na/Co, равному 0.2. НРА образуется со скоростью 41 час-1. После охлаждения и добавления 30 г деионизованной воды для экстракции только 77% кобальтового катализатора остается в верхнем органическом слое. 23% кобальта экстрагируется водным продуктом. Эта часть соответствует приблизительно количеству ацетата натрия, добавленного для ускорения реакции.
Пример 7.
Сравнительный пример 1 повторяют с добавлением 0.8 г в качестве промотора ацетата тетраоктилфосфония в соотношении 0.29 моля промотора на 1 моль кобальта. При около 40% конверсии образуется 3.19 вес.% НРА при скорости 27.9 час-1, или это соответствует 50% увеличению скорости по сравнению с наблюдениями при отсутствии промотора в сравнительном примере 1, тест 1. Окончательно образуется 8.1 вес.% НРА при 90% конверсии.
После реакции полученную смесь охлаждают до комнатной температуры. 30.5 г деионизованной воды добавляют к реакционной смеси для экстракции НРА при давлении 4.2 МПа (600 фунтов/дюйм2 избыточного давления) синтез-газа. Через 30 минут перемешивание прерывают и извлекают 33.3 г водного слоя продукта, содержащего 27 вес.% НРА. Водный слой содержит кобальта 57 ррм, или только 1% от общего веса загруженного кобальта. Верхний органический слой (110.5 г) анализируют и обнаруживают, что он содержит 0.19 вес.% кобальта, или очень малые потери его относительно начального количества загруженного кобальта. Повторное использование 99% кобальтового катализатора с органическим слоем дает снижение потерь кобальта в 23 раза по отношению к потерям с использованием ацетата натрия в качестве промотора в сравнительном примере 4.
Пример 8.
Сравнительный пример 1 повторяют с добавлением в качестве промотора 0.4 г ацетата тетрафениларсония в соотношении 0.18 моля промотора на 1 моль кобальта. При около 40% конверсии образуется 3.9 вес.% НРА при скорости 43.5 час-1, или более чем 2.3-кратной скоростью по сравнению с наблюдениями при отсутствии промотора в сравнительном примере 1. Реакцию прерывают и образуется 7.3 вес.% НРА при около 80% конверсии EO.
После реакции смесь продукта реакции охлаждают до комнатной температуры. 30.2 г деионизованной воды добавляли для экстракции продукта при давлении 1.5 МПа (200 фунтов/дюйм2 избыточного давления) синтез-газа. Через 30 минут смешивание прерывают, и выделяют 33.0 г водного слоя продукта, содержащего 20.5 вес. % НРА. Водный слой содержит только 39 частей на миллион кобальта, или менее 1% от общего веса загруженного кобальта. Верхний слой растворителя (108.4 г) анализируют, и обнаруживают, что он содержит 0.2 вес.% кобальта. Повторное использование более 99% кобальтового катализатора с верхним органическим слоем снижает потери кобальта в 23 раза по отношению к потерям с использованием ацетата натрия в качестве промотора в сравнительном примере 4.
Реферат
Способ получения 1,3-алкандиолов и 3-гидроксиальдегидов посредством гидроформилирования оксирана монооксидом углерода и водородом в присутствии катализатора на основе кобальта и промотора, который является липофильной четырехзамещенной солью элемента V группы, выбранного из азота, фосфора, мышьяка, дает возможность получения 1,3-пропандиола с высоким выходом и избирательностью. Технический результат состоит в повышении скорости гидроформилирования, а также в возможности рециркуляции катализатора. 8 з.п.ф-лы, 1 ил. 4 табл.

Формула

где R группа независимо выбирается из незамещенного или инертно-замещенного C1-25 линейного, разветвленного, циклического или ароматического гидрокарбила, алкокси, или моно-, или полиалкиленового оксида;
M является атомом V группы, выбранным из азота, фосфора или мышьяка;
A является основным анионом кислоты с сопряженными связями с pKa > 2.

Комментарии