Способ получения алкеновых производных или их солей - SU1508955A3
Код документа: SU1508955A3
Описание
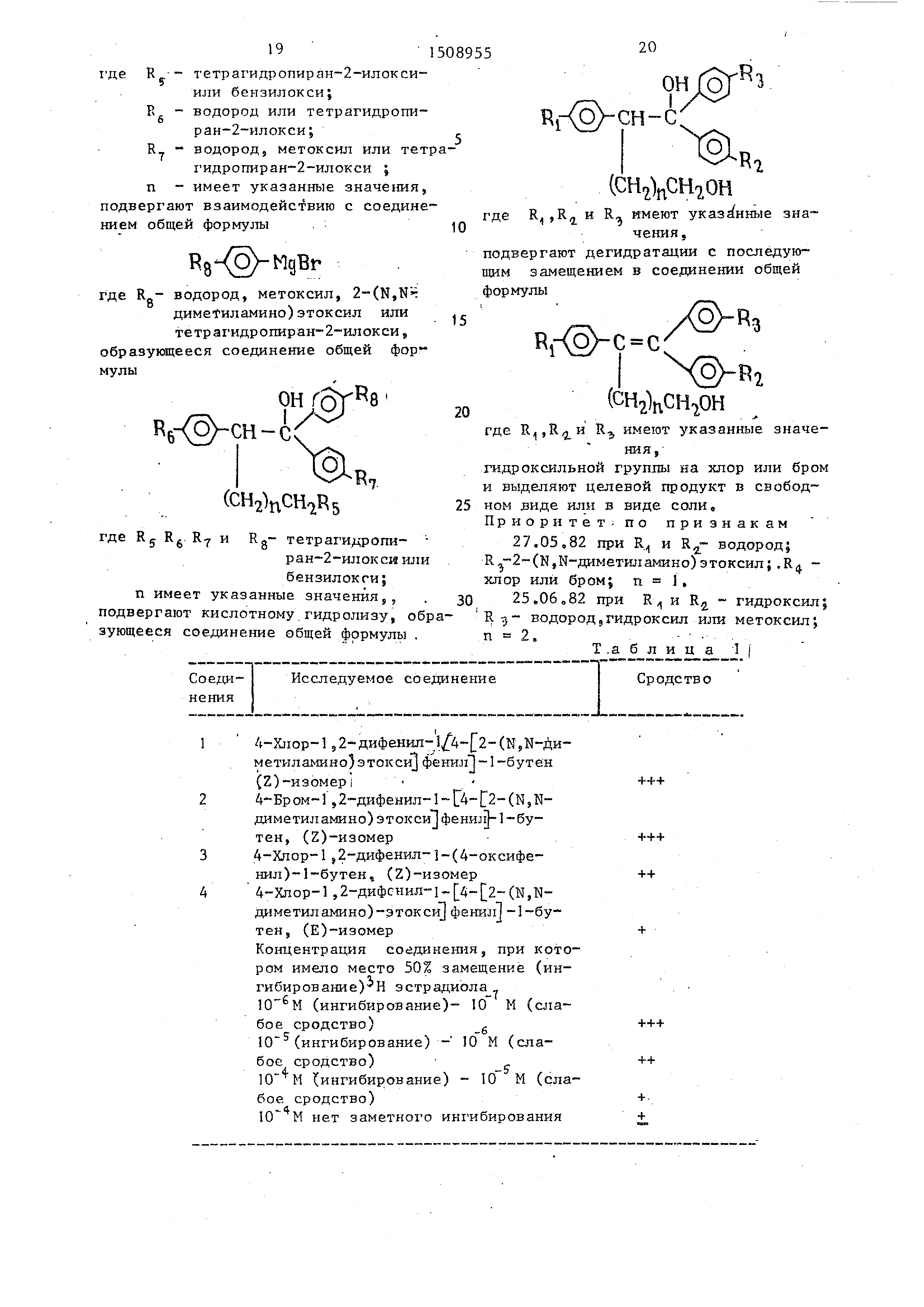
Изобретение относится к получению новых соединений, а именно алкеновых производных общей формулы
/ R,-(O) -
(CHi nCIhRl
где водород шти гидроксил;
водород,гидроксил,метоксил, или 2-(N,H-димeтилaминo)этoк сил;
хлор или бром; п 1 или 2,
или их солей, которые обладают эстро- генной, антиэстрогенной, прогеста- новойи противоопухолевой активностью и могут найти применение в медицине.
Цель изобретения - разработка на основе известного метода способа получения новых соединений, обладающих ценными фармакологическими свойствами .
Изобретение иллюстрируется следующими примерами,
, и м е р 1.а 4- (Тетрагидро- пиран-2-ил)окси -1 ,2-дифенилбутан- -1-он,
Смесь, содержащую 19,6 г дезокси- бензоина,20,9 г тетрагидропиран-2-ил- эфир-защищенного бромэтанола, 1,0 г ТЭБАХ и 50 мл 48%-ного раствора гидроокиси натрия, перемешивают в течение 2 ч при 75°С, Далее добавляют воду , продукт экстрагируют в толуоле. Раствор толуола промывают водой и сушат сульфатом натрия , В заключе- ние растворитель выпариваюту Получают количественный выход, но маслообразный продукт , содержит около 20% О-алкилированного продукта,
Ь. Получение А-(Тетрагидропи- ран-2-ил)окси2-1,1,2-трифенилбу- тан-1-ола.
Готовят комплекс Гриньяра-в без, водных .условиях с использованием 3,6 г магниевой стружки в 25 мл безводного тетрагидрофурана, которые pea гируют с 23,6 г бромбензола в 50 мл безводного тетрагидрофурана. Далее добавляют остаток, полученныйпосле выпа15ивания на стадии а , в 75 мл безводного тетрагидрофурана. Реакционную смесь кипятят . с обратным холодильником в течение 2ч, Охлажденную смесь выливают в насыщенный/раствор хлорида аммония. После перемешивания встряхиванием отделяют органичес- кий слой. Процесс экстракции повторя- ют с использованием эфира. Далее органические слои объединяют и суша сульфатом натрия, В заключение растворитель выпаривают,, ... . с. 1 ,1 ,2-Трифенилбутан-1.,-4-диол. Остаток, полученный в результате выпаривания на стадии в, подвергают
5
0
5
0
5
0
5
0
5
растворению в смеси, содержащей 400 мл абсолютного этанола, 10 г концентрированной серной кислоты и 75мл воды. Эту смесь перемешивают в течение 2-4 при комнатной температуре,затем полученный раствор нейтрализуют с использованием 2 М раствора гидроокиси натрия. Далее,этанол выпаривают , и к остатку добавляют воду. Затем полученный продукт экстрагируют в этилацетате. Этилацетатный раствор сушат сульфатом натрия, и растворитель выпаривают. Полученный продукт пepeкpиcтaлJтизoвывaют из толуола. Выход составляет 16,5 г (52% от дезокси- бензоина), т.пл, 185-187 С,
Спектр-ПМР () S : 2,06 (2Н, SK); 3,83 (2Н,Т); 3,92 (1Н, Т); 4,76 (2Н, с); 6,85-7,45 (13Н,М); 7,68 (2Н, gg).
Пример2, а. 4-(Teтpaгидpo- пиpaн-2-ил)oкcи 2-фeнил-l-(4-мeтoкcи- фeнил )-бутан-1-он,
Соединение получают из 22,6 г 4-метоксидезоксибензоина и 20,9 г тетрагидропиран-2-ил-эфир-защищенно- го бромэтанола в соответствии с методикой , , описанной В примере 1,
b,4-(Тетр аги др о пир ан- 2-ил ) ок си - -1,2-дифенил41-(4-метоксифенил)бу- тан-1-оп (RR,SS и RS. SR).
Изомеры (RR, SS) получают из остатка после выпаривания, приготовленного в примере la и 28,1 г 4-бромани- зола в соответствии с методикой, описанной в примере 1Ъ,
Изомеры (RS,SR) получают из остатка после выпаривания, приготовленного в примере 1Ь, и 23,6 г бромбензола в соответствии с той же самой методикой , что и указанные выше изомеры (RR, SS),.,
c,1,2-Дифенил-1-(4-метоксифенил)бу- тан-1,4-диол (RR,SS и RS,SR),
Изомеры (RR,SS) получают из остатка после выпаривания изомеров (RR,SS), произведенных на стадии b в соответствии с методикой, описанной в примере 1с. Продукт подвергают .перекрис-. таллизации из толуола Выход составляет 13,9 г (40% от дезоксибензоина). Т.пл,124- 2б с,
(RS,SR)-изомеры получают в результате выпаривания остатка () изомеров , полученных на стадии а в соответствии с той же самой методикой, что и (RS,SS)-изoмepы,yкaзaнныe выше,.
Продукт подвергают перекристаллизации из тйлуола. Выход составляет 16,0 г (46% от А-метоксибензои- на). Т.пл. 72-174°С.
d. 1,2-Дифeнил-l-(4-мeтoкcи- фeнил)- -бyтeн-A-oл (Z и Е),
Смесь изомеров (Z,E), Реакцию осуществляют в безводных условиях. Вначале 34,8 г 1,2-дифенил-1-(4-ме- Q {OKсифенил) бутан-I ,4-диола растворяют в 200 мл ангидрида уксусной кислоты . Далее добавляют 30 мл ацетил- хлорида. Полученную смесь выпаривав ют в течение 2 часов при 1 , после че- 5 го растворитель выпаривают (промежу- точный продукт представляет собой чистый (г,Е)-4-ацетокси-1,2-дифенил-1-(4- метоксифенил)-1-бутен). Далее добавпри комнатной температуре. Растворитель выпаривают, и остаток, полученный после вьптаривания, растворяют в 1 орячем петролейном эфире. Нерастворимый материап удаляют фильтрацией. Маточ 1ый раствор выпаривают и остаток, полученный после выпаривания , перекристаллизовывают из метанола . Выход щэодукта составляет 26,7 г (68%). Т.пл.116-118°С.
Спектр ПНР (CDC1,) : 3,01(2Н,т); 3,28 (2Н,т); 3,67 (ЗН,с); 6,54 (2Н,д); 6,8 (2Н,д); 7,17 (5Н,с); 7,32 (5Н,с).
Масс-спектр: т/е 392/394 (), 299(65), 221(79), 191(94), 121(100), 91(50),
Пример 3. а. 4- (Тетрагидро- пиран-2-ил) ,2-дифенил- -4-| 4ляют 200 мл 94%-ного этанола, 20 мл 20 (2-(N,N-димeтил-a шнo)этoкcи фeнил бy- воды и 45 мл 20%-ного раствора гидро- тан-1-ол (RR,SS и RS, SR)
(R,R и SS) изомеры получают из вы- паренног о осадка, полученного в примере 1а, и 36,6 г l-6poM-4- 2-(N,NT
окиси натрия к указанному остатку, образовавшемуся после выпаривания, Полученную смесь кипятят с обратным
нейтрализуют 2 М хлористоводородной кислотой, после чего этанол выпаривают . К остатку добавляют воду, и продукт экстраг ируют в этилацетате
35
40
холодильником, в течение 1 ч. РаствЬр 25 диметиламино)этокси | бензола по методике примера I.
(RS,SR) изомеры получают следующим путем.
Ь. 1 ,2-ДифенИл-1- 4- 2-(К,К-диме- Этилацетатный раствор сушат над суль- ЗО тиламино)этокси фенилJ6yTaH-1,4-диол фатом натрия, и растворитель выпари- (RR,SS и .RS,SR). вают. Выход чистой смеси изомеров (Z:E в соотношении 7:3) является коли- чественныму-Т.пл. 91-105 С,
Остаток, полученный после выпари- вaшiя смеси изомеров, перекристалли- зовывают из смеси, состоящей из гек- сана и этанола, в соотношении 95:5,. после чего получают 14,5 г (44%) (Е-)-изомера, т,пл.121-123 ,С.
Спектр ,)| : 1,28 ().; 2,73(2Н,т);3,57 (2Н,т); 8,63 (ЗН,с); 6,53 (2Н,д); 6,80 (2Н,д); 7,15 (5Н,м); 7,29 (5Н,с).тиламино)этокси1фенил -1-бутен-4-олМасс-спектр т/е: () ,299(100), дд (Z и Е). 221 (46), 191 (70), 121 (46).91 (60).По методике примера 2d получают
(Е)-изомер. Т.пл. 107-110°С.
Спектр ПМР (CDCl) S : 1,31 (lH,c), 2,80 (2Н,т), 3,6 (2Н,т); 3,81 (ЗН,. с); 6,80-7,35 (14Н,м).
е. 4-Бром-1,2-дифенил-1-(4-метокг сифенил)1-бутен (Z) .
33,0 г (Z)-l ,2-дифенил- 1-(4-меток- сифенил)- -бутен-4-ола растворяют в 500 мл безводного ацетонитрила.Далее при перемешивании добавляют 39,3 г трифенилфосфипа и 49,8 г
(RR,SS)-изoмepы получают из выпаренного осадка (RR,SS)-изoмepoв, полученных на стадии а соответственно по методике примера 2 с, исключая только то, что используют 20 г концентрированной серной кислоты. Выход 19,5 г (48% из дезоксиб нзиона).Т.пл. 165-167 с (из толуола).
(ИЗ,5К)-изомеры были получены таким же путем. Т.пл. 139-14 °С (из толуола ) .
с. 1,2-Дифенил-1 - 4- , N-димесмесь изомеров Z и Е.
Выделение (Z)-H3OMepa, как свободного основания.
50
55
Смесь изомеров (Z:E в соотношении 2:1) подвергают перекристаллизации из толуола, в результате чего получают 15,9 -г (41%) (Z)-H30Mepa, имеющего Т.пл. 110-112°С.
Спектр ПМР (CDCl) : 2,28(6Н,с); 2,60 (2Н,т); 2,7(2Н,т); 3,53 (2Н,т); 3,89 :(2Н,т); 6,53 (2Н,д); 6,78 (2Н,д); 7,12 (5Н,с), 7,28 (5Н,с).
тетрабромида углерода. Процесс перемешивания проводят в течение 1 ч
при комнатной температуре. Растворитель выпаривают, и остаток, полученный после вьптаривания, растворяют в 1 орячем петролейном эфире. Нерастворимый материап удаляют фильтрацией. Маточ 1ый раствор выпаривают и остаток, полученный после выпаривания , перекристаллизовывают из метанола . Выход щэодукта составляет 26,7 г (68%). Т.пл.116-118°С.
Спектр ПНР (CDC1,) : 3,01(2Н,т); 3,28 (2Н,т); 3,67 (ЗН,с); 6,54 (2Н,д) 6,8 (2Н,д); 7,17 (5Н,с); 7,32 (5Н,с).
Масс-спектр: т/е 392/394 (), 299(65), 221(79), 191(94), 121(100), 91(50),
Пример 3. а. 4- (Тетрагидро- пиран-2-ил) ,2-дифенил- -4-| 4 (2-(N,N-димeтил-a шнo)этoкcи фeнил бy тан-1-ол (RR,SS и RS, SR)
Ь. 1 ,2-ДифенИл-1- 4- 2-(К,К-диме- тиламино)этокси фенилJ6yTaH-1,4-диол (RR,SS и .RS,SR).
тиламино)этокси1фенил -1-бутен-4-ол (RR,SS)-изoмepы получают из выпаренного осадка (RR,SS)-изoмepoв, полученных на стадии а соответственно по методике примера 2 с, исключая только то, что используют 20 г концентрированной серной кислоты. Выход 19,5 г (48% из дезоксиб нзиона).Т.пл. 165-167 с (из толуола).
(ИЗ,5К)-изомеры были получены таким же путем. Т.пл. 139-14 °С (из тоуола ) .
с. 1,2-Дифенил-1 - 4- , N-димесмесь изомеров Z и Е.
Выделение (Z)-H3OMepa, как свободного основания.
Смесь изомеров (Z:E в соотношении 2:1) подвергают перекристаллизации из толуола, в результате чего получают 15,9 -г (41%) (Z)-H30Mepa, имеющего Т.пл. 110-112°С.
Спектр ПМР (CDCl) : 2,28(6Н,с); 2,60 (2Н,т); 2,7(2Н,т); 3,53 (2Н,т); 3,89 :(2Н,т); 6,53 (2Н,д); 6,78 (2Н,д); 7,12 (5Н,с), 7,28 (5Н,с).
7 15
Выделение (г)-изомера в виде хло- ристоводородной соли. Смесь изомеров (Z:E в соотношении 2:) подвергают растворению в этаноле, и затем добавляют избыточное количество концентрированной хлористоводородной кислоты. Растворитель выпаривают , и далее,полученный остаток дважды подвергаютг . - перекристаллизации из этанола, в результате чего получают 12,3 г (29%) (Е)-изомера в виде хлористоводородной соли, Т,пл, 166-168°С (из ацетона ).
Гидрохлорид (Z)-изомера также получают из (Z) изомерного основания . (Z)-изoмep растворяют в этаноле Далее пропускают через раствор газообразный хлористый водород, В заключение растворитель выпаривают.
Выделение СЁ)изомера,
Маточные растворы, полученные при выделении гидрохлорида (Z)-изoмepa,
Соль лимонной кислоты может быть получена следующим образом, 15Вначале 40,6 г (Z)-изoмepa-, в виде свободного основания, растворяют в 175 мл теплого ацетона и 24,5 г лимонной кислоты в 100 мл теплого ацетона. Затем растворы соединяют, 20 и смесь охпаждаютч Цитрат собирают фильтрацией, его температура плавления 160-162 С,
(Е)-изомер, Соединение.получают из СЕ)-1,2-дифенил-1- 4- 2-(Н,Ыобъединяют и растворитель выпаривают, 25 диметштамино)этокси фенил 1-бутен- Выпаренный остаток подвергают пере- -4-ола, по той же самой методике,что
и соответствующий (Z)-изoмep, Хло-- ристоводородную соль кристаллизуют из толуола. Выход составляет 35,8 г (81%), т,пл, 183- 85 С, Этот продукт может быть отделен от солевой формы по той же самой методике, что и соответствующий (Z)-изомерk Температура плавления равна 69-71 С. (из гексана % спектр ЯМР (с Clj): 2,34(бН,с) 2,74 (2Н,т); 2,97 (2Н,т);3,43 (2Н,т) 4,08 (2Н,т); 6,80-7,30 (14Н,м).
кристаллизации из ацетона, в результате чего получают 9,7 г (23%) (Е)- изомера в виде соли гидрохпорида, Т,пл. 235-237 С, (Е)-изомер может 30 быть отделен от соли тем же самым способом , что и смесь изомеров, указанных вьппе. Температура плавления (Е)-изомера, как свободного основания , составляет 129-131 С (из толуо- эс JJ
ла).
.Спектр ПИР;(CDC1,)S :2,31 (2Н,с); 2,71 (2Н,т); 2,78 (2Н,т);,3,57 (2Н,т); 4,05 (2H,T)j 6,87 (2Н,т); 6,94 U5H/C); 7,10 (5Н,с); 7,21 (2Н,д).40
d. 4-Хлор-1 ,2-дифенш1-1 (N,N : диметиламино)- этокси фенш -1-бутен (Z и Е).
(Z)-изомер. Реакцию проводят в безводных условиях. Вначале 42,4 г 45 (Z)-l,2-дифенил-1- 4-С2-(К,Н-диметил- амино) этокси фенш1| -1 -бутен-4-ола растворяют в 250 мл хлороформа. Далее по каплям добавляют 23,8 г тио- нилхлорида. Полученную смесь кипятят с обратньм холодильником в течение 3 ч. Из полученного продукта выпаривают растворитель и затем продукт перекристаллизовывают из этилацетата
50
8
0
раствора карбоната натрия, поате че- то продукт экстрагируют в толуоле Толуольный раствор сушат, и растворитель выпаривают, Т.пл. 108-110 С (из ацетона).
Спектр ПМР CCDCI,) : 2,27 (бН,с); 2,63 (2Н,т)1 2,91 (2Н,т); 3,41 (2Н,т); 3,92 (2Н,т); 6,54 (2Н,д); 6,79 (2Н,с); 7,15 (5Н,с); 7,31 (5Н,с).
Масс-спектр: т/е 405/407 (И ,7/3), 72 (20), 58 (100).
Соль лимонной кислоты может быть получена следующим образом, 5Вначале 40,6 г (Z)-изoмepa-, в виде свободного основания, растворяют в 175 мл теплого ацетона и 24,5 г лимонной кислоты в 100 мл теплого ацетона. Затем растворы соединяют, 0 и смесь охпаждаютч Цитрат собирают фильтрацией, его температура плавления 160-162 С,
(Е)-изомер, Соединение.получают из СЕ)-1,2-дифенил-1- 4- 2-(Н,Ы5 диметштамино)этокси фенил 1-бутен- -4-ола, по той же самой методике,что
диметштамино)этокси фенил 1-бутен- -4-ола, по той же самой методике,что
и соответствующий (Z)-изoмep, Хло-- ристоводородную соль кристаллизуют из толуола. Выход составляет 35,8 г (81%), т,пл, 183- 85 С, Этот продукт может быть отделен от солевой формы по той же самой методике, что и соответствующий (Z)-изомерk Температура плавления равна 69-71 С. (из гексана) % спектр ЯМР (с Clj): 2,34(бН,с); 2,74 (2Н,т); 2,97 (2Н,т);3,43 (2Н,т); 4,08 (2Н,т); 6,80-7,30 (14Н,м).
Масс-спектр: т/е 405/407 (), . 72 (19), 58 (100).
П р И м е р 4. а, 4-Бензилокси- - 1,2-дифенилбутан-1-он.
Соединение получают из 19,5 г дезоксибензоина и 21,5 г бензилэфй рно- го защищенного бромэтанола в соответ-; ствии с методикой, указанной в примере 1а, ..
Ь. 4-Бенвилокси-1,2-дифенш1-1-(4- тетрагидропиран-2-ил-окси фенил)бу- тан-1-ол (RR,SS).
Соединение получают из остатка,полученного пооле выпаривания, как указано в примере 4а, и из 38,6 г тетра- гидропиран-2-ил эфирного защищенного 4- бромфенола в соответствии с методи










Реферат
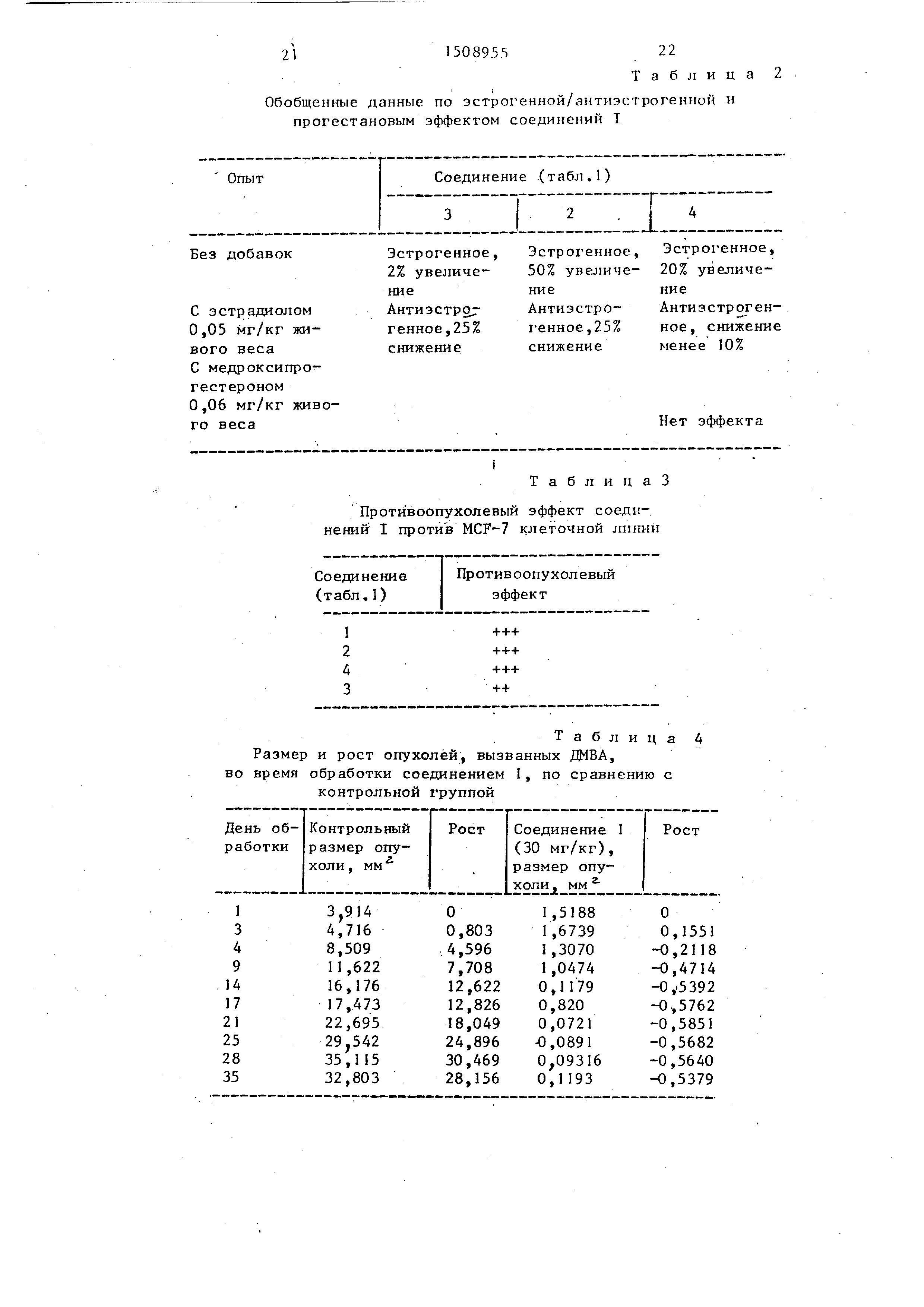
Изобретение касается ациклических ненасыщенных соединений , в частности, способов получения алмкеновых производных общей формулы R4-CH2-(CH2M)N-C(-C6H4-N-R1)-C(-C6H4-N-R2)*M99.(-C6H4-N-R3), где N=1 или 2
R1и MR2-H или OH
R3-H, OH, OCH3или 2-(NM,N-диметиламино)-этоксил
R4-CI или BR, или их м солей, обладающих эстрогенной, антиэстрогенной, прогестановмой и противоопухолевой активностью, что может быть использовано в медицине. Цель - создание новых активных соединений указанного класса. Синтез ведут реакцией соединения формулы R5-CH2-(CH2)N-CH(-C6H4-N-R6)-C(O)-C6H4-N-R7, где N имеет указанные значения
R5-тетрагидропиран-2-илокси или бензилокси
R6-H или тетрагидропиран-2-илокси
R7-H, метокси или тетрагидропиран-2-илокси, с соединением общей формулы R8-C6H4-N-MG BR, где R8-H, метокси, 2-(N,N-диметиламино)этокси или тетрагидропиран-2-илокси. Образующееся соединение, в котором R8-тетрагидропиран-2-илокси или бензилокси, подвергают кислотному гидролизу с последующей дегидратацией и замещением гидроксильной группы на CI или BR и выделением целевого продукта в свободном виде или в виде соли. Испытания показывают, что максимальный эстрогенный эффект соединения примера 1 слабее, чем у гексестрола и диэтилстильбэстрола, но оно может антагонизировать эстрогенный эффект этих соединений при их совместном применении. Кроме того, это соединение ингибирует рост MCF - 7 опухоли клеток IN VITRO. Так, увеличение числа выживших клеток в 2 раза по сравнению с контролем наблюдается при концентрации в 10 раз меньшей, чем для гексестрола и диэтилстильбэстрола. 5 табл.

Формула


Комментарии