Способ получения оксида алюминия и карбоната из богатых al материалов с интегрированной утилизацией co - RU2683754C2
Код документа: RU2683754C2
Чертежи



Описание
Уровень техники
Оксид алюминия (Al2O3) для производства алюминия в основном получают из боксита (более 95 масс. %).
Однако в последние годы доступность боксита хорошего сорта уменьшилась и цена, соответственно, возросла. Обработка боксита создает экологические проблемы (например, красный шлам), особенно при обработке боксита более низкого сорта. По этим причинам значительный интерес вызывает производство оксида алюминия из богатых алюминием силикатных пород, таких как анортозиты, нефелиновые сиениты и минералов полевой шпат/фельдшпатид, полученных из таких пород, так как известно, что эти породы и минералы можно непосредственно растворять в сильных неорганических кислотах без какой-либо затратной стадии предварительной обработки, такой как высокотемпературный обжиг.
Особенно большое внимание привлекли анортозиты с высоким содержанием анортита, примером является норвежский патент №323417 (Eriksen et al.). В последнее время осадочные породы, такие как аргиллит (глина/иловый известняк), также вызвали значительный интерес.
«Анортозит» является коллективным обозначением для магматических пород, отличающихся преобладанием плагиоклазового полевого шпата (90-100%) и минимальным мафическим компонентом (0-10%). Плагиоклазовые полевые шпаты содержат множество Na-Ca-Al силикатов между двумя конечными членами альбитом (NaAlSi3O8) и анортитом (CaAl2Si2O8). В Норвегии находятся богатые залежи анортозита, некоторые с высоким содержанием анортозита (от 70 до 80%) расположены на западном побережье. Из-за высокого содержания оксида алюминия (Al2O3>30%) в месторождении Gudvangen (оцененные запасы ≥500М тонн анортозита), расположенном в Sogn og Fjordane, извлечение оксида алюминия из норвежского анортозита было подвергнуто обширным исследованиям.
Одно из наибольших исследовательских усилий было приложено к проекту Anortal (1976-1987), способу получения оксида алюминия из анортозита, основанному на выщелачивании или растворении минерала неорганической кислотой и последующему осаждению гексагидрата треххлористого алюминия (AlCl3⋅6H2O) из кислой фазы. Технологический маршрут для способа применения азотной кислоты был запатентован (US 4110399 А) Институтом атомной энергии (Institutt for Atomenergi) (сейчас IFE). Позже была развита эта технологическая концепция и запатентована Eriksen et al. как норвежский патент №323417. Способ согласно этому патенту исходит из выщелачивания азотной кислотой, за которым следует экстракция растворителем нежелательных веществ (Fe, Ca) и частичное извлечение кислоты.
Во всем мире предпринимались и другие попытки получения оксида алюминия с помощью альтернативного способа, отличающегося от процесса Байера (Bayern).
В патенте US 4110399 (Gaudernack et al., 1978) показан способ извлечения оксида алюминия из содержащих Al силикатов, включающий выщелачивание серной кислотой, экстракцию железа в органическую фазу, при этом оставляя ионы Al в водной фазе, осаждение Al в виде гексагидрата хлорида алюминия и последующий обжиг.
В патенте US 4367215 заявлено получение диоксида кремния с регулируемыми свойствами путем кислого выщелачивания силикатов, однако ограниченное областью продукта в виде диоксида кремния и с отсутствием технологических решений для получения оксида алюминия или карбонатов, извлечения кислоты, отделения железа и т.п.
В патенте СА 2711013 А1 предлагается способ получения Al из глиноземных руд путем начального растворения руды в кислоте, однако решение направлено на последующее разделение ионов алюминия и железа с получением богатого железом концентрата и последующую экстракцию алюминия путем органической экстракции. Поэтому в этом способе не рассматривают ни стадии барботажа для начального отделения алюминия, ни использования CO2 для осаждения карбонатов, ни извлечения кислоты путем термической обработки аминами.
В патентной заявке US 2009/022640 А1 предлагается способ, в котором используют серную кислоту для выщелачивания содержащего алюминий твердого вещества и последующее использование соляной кислоты в течение стадии барботажа осуществляют при температуре менее 20°C.
В патентной заявке US 2012/0237418 A1 (Boudreault, Alex and Biasotto) описан способ получения алюминия путем выщелачивания соляной кислотой (давление не указано) и последующего отделения железа от алюминия с помощью нескольких стадий с регулируемым рН путем использования органических экстрагирующих веществ, и поэтому направленный на алюминиевые руды с высоким содержанием железа (например, аргиллит, нефелин). Отделения алюминия и железа осуществляют различными способами, и в заявке не упоминается ни использование CO2 и ни получение карбоната, ни регенерация кислоты.
В патенте US 4158042 предлагают растворение богатого Al минерала выщелачивающим раствором, содержащим ионы хлорида, кальция и фторида, последний использовали в качестве катализатора реакции (в форме H2SiF6 и в количестве 1-20 г/л). При применении к богатой Ca породе (анортозит) они предлагают осаждение и отделение части CaCl2 и объединение этого CaCl2 с диоксидом кремния при высокой температуре (1100°С) для извлечения части HCl. Этот способ извлечения кислоты, являющийся частью другого способа, является очень энергоемким, что весьма отрицательно действует на возможную выгодность способа.
Для отделения Al от выщелачивающего раствора John Е. Deutchman и Francoise Tahiani (патент US 4472361, 1984) сообщили о способе отделения Al и Na от исходной твердой смеси AlCl3 и NaCl (поступающей из количественного осаждения путем первого барботажа) с применением селективного повторного растворения AlCl3 в воде с получением водного раствора AlCl3 с пониженной концентрацией Na и твердого продукта NaCl, который можно отделить путем фильтрации. Второй барботаж газообразным HCl используют для повторного осаждения AlCl3 из водного раствора. После отделения AlCl3 (то есть АСН), концентрированный раствор HCl подают рециклом в способ на стадию первого барботажа, при этом твердый АСН направляют на технологическую стадию обжига.
Для отделения железа в патенте US 5585080 раскрыт способ извлечения хлоридов металлов из кремния и ферросилиция. В этой работе ТБП (третбутилфосфин) применяли для экстракции хлорида железа непосредственно после выщелачивания материала из кислого раствора, содержащего AlCl3 и CaCl2 в высоких концентрациях, затем следовал барботаж газообразным HCl для извлечения хлорида алюминия. После удаления FeCl3 продукт выщелачивания состоит из концентрированного раствора HCl с хлоридами металлов, такими как CaCl3, MgCl2, NaCl.
Что касается извлечения технологической кислоты, в нескольких патентах рассмотрена возможность использования органической экстракции (различными аминами) свободной HCl из разбавленных растворов и последующего извлечения концентрированной HCl путем десорбции амина (Baniel and Jansen, патентная заявка US 2012/0134912, Baniel and Eyal, патентная заявка US 2010/0093995, патентная заявка US 2011/0028710 и ЕР 2321218 А1, Baniel, Eyal and Jansen, WO 2010/064229 A2, Coenen, Kosswig, Hentschel и Ziebarth, патент US 4230681, Willi Ziegenbein, Ferdinand von Praun, патент US 4272502 A, DeVries, патент US 4640831 А). Эти публикации применимы для извлечения свободного HCl в растворе, но не для извлечения ионов Cl- из хлоридов металлов с осаждением соответствующего карбоната металла. Другие авторы предлагали применение CO2 для осаждения бикарбоната натрия (Hentschel, Coenen, Kosswig, von Praun и Ziebarth, патент US 4337234, Coenen, Laach, Kosswig, von Praun и Hans Regner, патент US 4321247 A, Hentschel, Jurgen, Coenen, Kosswig, Ferdinand von Praun, патент US 4320106 А) и для получения аммиака из хлорида аммония (Coenen, Laach, Kosswig Dieter патент US 4305917), однако их целью в дальнейшем не являлось извлечение кислоты из амина.
Самая последняя патентная заявка, связанная с производством алюминия - WO 2013/037054 А1, основана на хорошо известном образовании растворенных хлоридов металлов путем выщелачивания богатого алюминием материала с помощью HCl и затем повторном осаждении хлоридов металлов путем барботажа HCl. Таким образом, извлечения кислоты достигают только путем обжига различных хлоридов металлов, полученных в ходе данного способа (AlCl3⋅6H2O, FeCl3⋅xH2O, MgCl2⋅xH2O и т.п.) для формирования HCl в виде газа и получения оксидов металлов. Однако, можно ожидать низкого полного извлечения HCl, если этот способ применяют к любым содержащим алюминий материалам, которые обладают высоким содержанием Ca, так как гидропиролиз CaCl2 является трудным из-за его низкой температуры плавления и высокой температуры разложения CaCl2⋅2H2O. Кроме того, не приведено никакого технологического решения для эффективного отделения натрия, если руда содержит этот элемент, который должен осаждаться в виде NaCl вместе с хлоридом алюминия в течение стадии барботажа. Это означает, что применение этого способа, например, к анортозиту вряд ли должно быть экономичным из-за значительного содержания в нем кальция и натрия. Итак, технически некоторые богатые алюминием материалы можно обработать согласно стадиям WO 2013/037054 А1, но очевидно только некоторые материалы - в особенности те, которые богаты железом и магнием - являются наиболее подходящими сырьевыми материалами, которые могли бы привести к конкурентоспособному способу. Как и в предыдущих запатентованных альтернативах производства алюминия не упоминают использование CO2 и извлечение избыточной HCl по мере того, как получают карбонаты из остающихся в растворе хлоридов.
Поэтому, хотя некоторые из концепций альтернативных способов имели успех по отношению к извлечению продукта, однако либо рентабельность этих технологий оказалась невыгодной по сравнению с уже устоявшимся бокситным способом Байера, либо они были направлены только на части способа или не разрешали проблему извлечения кислоты, так чтобы сделать ее применимой для различных источников алюминия.
Цель изобретения
Целью настоящего изобретения является предоставление улучшенного способа получения оксида алюминия из богатых алюминием материалов устойчивым, экономически эффективным и экологически безопасным образом. Также целью изобретения является объединение получения сырьевого материала для алюминия со способом, в котором парниковый газ CO2 связывают путем получения карбоната металла, который можно безопасно осадить или продать.
Наконец, также целью изобретения является получение аморфного SiO2, который можно либо безопасно осадить, либо, по меньшей мере частично, продать.
Таким образом, настоящее изобретение не вызывает нагрузку на окружающую среду путем выработки токсичных твердых или жидких отходов.
Описание изобретения
Настоящее изобретение представляет новую технологию, объединенную в уникальный способ, для достижения современных экологических и экономических целей с помощью инновационного способа получения оксида алюминия с интегрированной утилизацией CO2.
Упомянутые выше цели настоящего изобретения реализуют как определено в пункте 1 формулы изобретения. Некоторые предпочтительные воплощения изобретения приведены в зависимых пунктах формулы изобретения.
Это изобретение является новым способом получения оксида алюминия из богатых алюминием материалов, которые в показателях экономической эффективности и воздействия на окружающую среду могут соперничать с бокситом. Изобретение дополнительно сконцентрировано на возможности достижения экологически благоприятного хранения CO2 путем осаждения карбонатов из водных металлсодержащих технологических потоков, происходящих из выщелачивания богатого Al материала или частичного растворения.
Настоящее изобретение в качестве всеобщего способа отличается от предшествующей попытки, разработанной Institutt for Atomenergi (патент US 4110399 А), в следующих аспектах:
- Предложенная для выщелачивания (и последующих технологических стадий) кислота является соляной кислотой вместо серной кислоты.
- Предложены различные технологические решения для минимизации примесей Al2O3 и потребления энергии на стадии барботажа путем включения способа ступенчатого барботажа с возможными повторными растворениями и повторными осаждениями AlCl3.
- При применении к богатым металлами материалам, которые могут образовывать карбонаты, CO2 можно утилизировать в виде безопасного хранения CO2 или в виде промышленного побочного продукта вместо получения из анортозита гипса (CaSO4), заявленного в патенте US 4110399 А. Поэтому, CO2 вводят в это настоящее изобретение в качестве ключевого фактора как по экологическим, так и по экономическим причинам.
- Представленное здесь объединенное получение карбоната и экстракции кислотой вводит в способ новую технологию для усиления общего извлечения кислоты и, таким образом, улучшения экономических аспектов изобретения.
Для лучшего понимания настоящего изобретения в данный документ были включены схемы технологические, на которых способ упрощен до основных технологических стадий и в качестве примера показано изобретение в некоторых предпочтительных воплощениях.
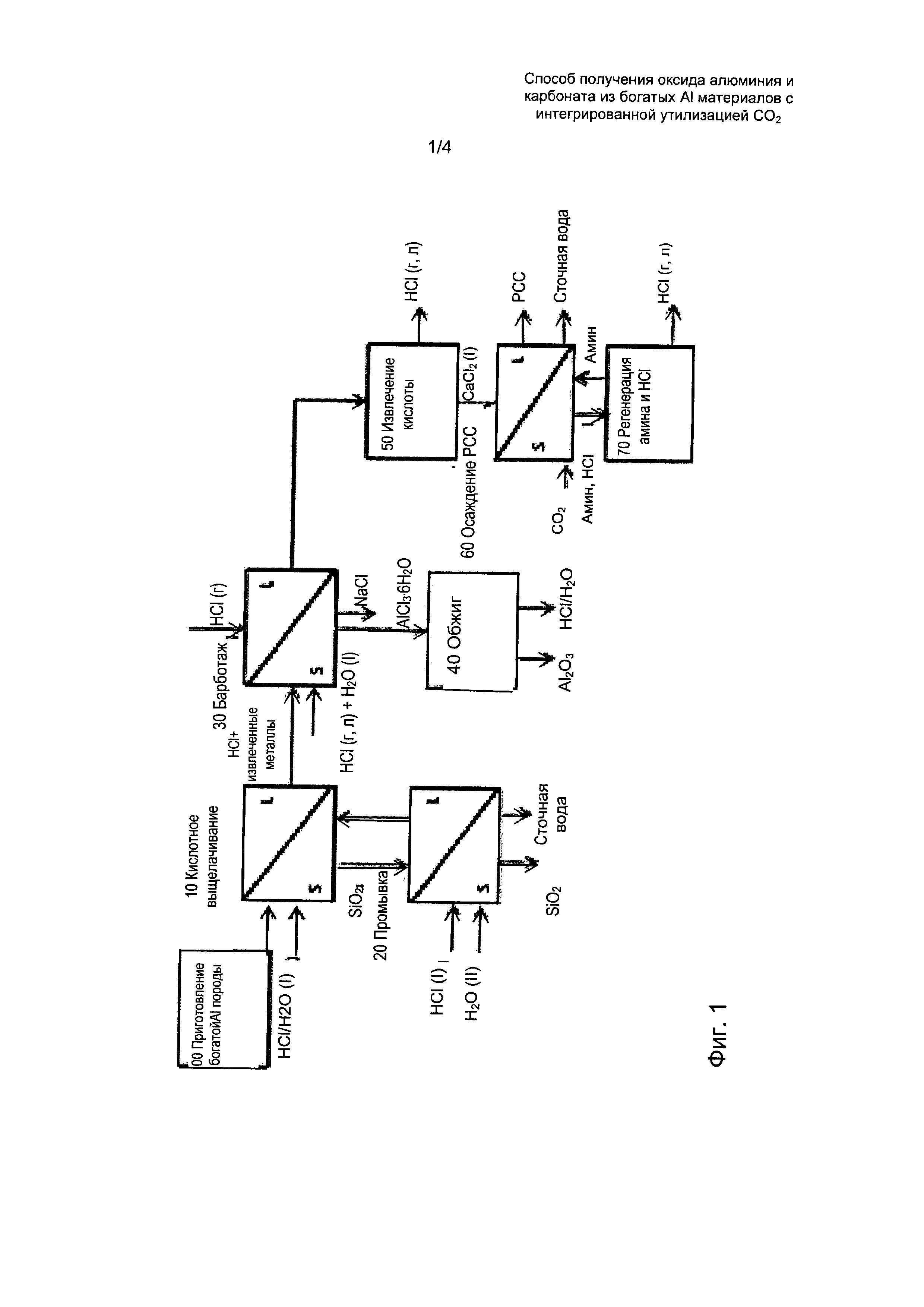
На Фиг. 1 показана упрощенная технологическая схема согласно одному предпочтительному воплощению настоящего изобретения.
На Фиг. 2 показана упрощенная технологическая схема настоящего изобретения согласно воплощению по п. 10 формулы изобретения, в котором включена стадия (80) удаления железа, чтобы избежать высокого содержания железа в получаемом осажденном карбонате кальция.
На Фиг. 3 показан предложенный способ, являющийся частью другого способа, для отделения алюминия от продуктов выщелачивания с помощью стадии (3b) барботажа в сравнении с технологией Deutchman et al. (патент US 4472361, 1984) (3а).
На Фиг. 4 показано другое предпочтительное воплощение для стадии барботажа для отделения алюминия от продуктов выщелачивания (см. 4b) в сравнении с технологией Deutchman et al. (патент US 4472361, 1984) (см. 4а).
Таким образом, в настоящем изобретении, упрощенно представленном на Фиг. 1 и 2, богатый Al материал дробят и измельчают до размера менее 20 мм и предпочтительно до размера менее 1 мм, более предпочтительно равного или меньшего 0,5 мм. Богатые Fe и Mg фракции можно удалить после дробления, по меньшей мере частично, с помощью магнитного отделения или предпочтительно удалить с помощью оптической сортировки. Таким образом, можно получить порошковый материал с пониженным содержанием железа и магния. Приготовленный материал затем растворяют непосредственно в растворе HCl с концентрацией в интервале от 1 до 13 М при температуре в интервале от 80°С до 180°С и давлении вплоть до 1 МПа (10 бар) в течение от 1 до 24 часов согласно реакции (1). Более предпочтительно температура составляет менее 160°С, концентрация менее 11 М, давление менее 500 кПа (5 бар) и время выщелачивания находится в интервале от 1 до 10 часов или даже более предпочтительно в интервале от 1 до 5 часов.
Упрощенную реакцию выщелачивания для идеального богатого Al материала можно представить в качестве примера с помощью теоретического состава анортита согласно следующему уравнению:

Определенные выше рабочие условия выбирали для оптимизации растворения Al3+ и других катионов из силиката (например, Са2+, Mg2+, Na+), при этом получая аморфный остаток SiO2 с требуемыми свойствами для продажи или осаждения.
Так как силикатные породы полностью выщелачиваются в HCl, настоящее изобретение также позволяет получать аморфный осажденный диоксид кремния в виде твердой фракции, остающейся от выщелачивания.
Использование HCl обеспечивает образование растворимых хлоридов металлов в маточном растворе, которые можно далее отделить путем барботажа газообразным HCl, в отличие от других упомянутых выше изобретателей, которые используют различные выщелачивающие растворы.
После растворения твердые остатки, например, непрореагировавшие частицы и SiO2 отделяют от продукта выщелачивания с помощью центрифугирования и/или фильтрации. Непрореагировавшие фракции можно отделить на основании разной плотности или других отличительных свойств, например, используя гидроциклоны. После отделения непрореагировавшие фракции можно повторно ввести на стадию кислотного выщелачивания.
После отделения нерастворенной фракции кислый продукт выщелачивания, содержащий в основном Al3+ и Са2+, направляют на вторую стадию способа: осаждение хлорида алюминия путем барботажа потоком газа, содержащего HCl, после чего его обычно фильтруют и промывают раствором, выбранным из воды и кислого раствора.
Алюминий можно осадить из выщелачивающего раствора путем барботажа раствора газом, содержащим хлороводород, используя эффект общего иона, то есть способствование осаждению гидратированного хлорида алюминия, AlCl3⋅6H2O (АСН), путем повышения концентрации ионов хлорида в растворе. Газообразный хлороводород легко растворяется в маточном растворе в широком диапазоне температур при атмосферном давлении. Из-за его более низкого предела растворимости, хлорид алюминия (и, до некоторой степени, хлорид натрия, если он присутствует) осаждается в виде гидратированной соли, при этом Fe2/3+, Са2+ и Mg2+ или другие более растворимые хлориды металлов остаются в основном в растворе.
AlCl3⋅6Н2О также можно кристаллизовать из богатого Al раствора хлорида металла путем смешивания с концентрированным раствором HCl, фильтрации и промывки раствором, таким как вода или кислый раствор. Осажденный AlCl3⋅H2O и примеси можно частично повторно растворить раствором, выбранным из водного раствора соляной кислоты и воды, и затем отфильтровать и подавать рециклом на стадию кристаллизации.
Обедненный Al раствор хлорида металла можно после стадии кристаллизации обработать путем жидкостной/жидкостной органической экстракции для уменьшения содержания железа. Более того, его можно обработать путем дистилляции, испарения или другого способа концентрирования, такого как использование бойлеров или концентраторов, для извлечения свободной кислоты и увеличения концентрации хлоридов металлов в растворе.
Другие технологии были предложены для уменьшения количества примесей NaCl в конечном продукте, когда продукт выщелачивания содержит натрий, включая последующую промывку и повторный обжиг осажденного оксида алюминия (патент US 4472361, 1984). Недостатками этих способов являются высокие энергетические затраты из-за следующих друг за другом стадий охлаждения и нагрева большого количества твердых веществ.
В настоящем изобретении предложен новый способ в рамках двух предпочтительных воплощений для барботажа и устранения примесей, основанный на эффекте общего иона, который экспериментально наблюдали Deutchman и Tahiani. Новые альтернативы сравнены со способом Deutchman и Tahiani на Фиг. 3 и 4, на которых 3а и 4а представляют собой технологию Deutchman и Tahiani, и 3b и 4b представляют собой два предпочтительных воплощения новых альтернатив, разработанных для настоящего изобретения.
На Фиг. 3b, когда прямоугольник разделен диагональной линией на две половинки, обозначенные S и L, это означает, что стадия включает разделение смеси на жидкую и твердую фракцию. В первом предпочтительном воплощении модифицируют стадии 10, 20 и 30 от Deutchman (Фиг. 3а) путем продувки богатой хлоридом кальция жидкости из системы барботажа (стадия 20) вместо подачи ее рециклом на стадию 10. Эта продувка решает проблему накопления примесей в системе, которая влияет на конфигурацию Deutchman'a. В самом деле, увеличение Са2+, Mg2+, Fe2/3+ в контуре рециркуляции должно за длительное время влиять на чистоту АСН. Другим преимуществом предложенного воплощения 1 является возможность извлечения HCl из потока, богатого хлоридом Ca, Mg или другого элемента, путем получения соответствующих карбонатов с утилизацией СО2, помимо извлечения HCl из обжига AlCl3 (стадия 70). Другая модификация, предложенная в модифицированном способе барботажа, состоит в использовании кислого раствора для частичного повторного растворения твердого NaCl/AlCl3 вместо использования только чистой воды (стадия 30). Эта альтернатива является предпочтительной на основании больших различий растворимости AlCl3 и NaCl в HCl по сравнению с водой.
Deutchman и Tahiani предлагают полное осаждение АСН и NaCl путем первого барботажа продуктов выщелачивания, полученных из твердой смеси АСН и NaCl, которую они частично повторно растворяют для устранения большей части твердого NaCl (Фиг. 3а) и 4а)). В настоящем изобретении представляют другое альтернативное предпочтительное воплощение, в котором предлагают выполнение способа фракционного или многостадийного осаждения (Фиг. 4b)).
Таким образом, во втором предложенном воплощении предлагают частичное осаждение АСН на стадии (20) первого барботажа. На этой стадии первого частичного барботажа получают почти чистый АСН до определенного предела получения продукта осаждения при температуре от 40 до 90°С, предпочтительно от 60 до 80°С. Эту стадию первого барботажа останавливают перед тем, как NaCl начинает осаждение количественно. Это означает, что количественная фракция почти чистого АСН осаждается на стадии 20, оставляя большую часть NaCl в растворе. Остающуюся жидкость направляют на стадию второго барботажа, на которой остающуюся фракцию АСН и большую часть NaCl можно осадить и дополнительно обработать (40), с помощью способа Deutchman и Tahiani или похожим образом, для устранения примесей NaCl в этом втором осадке. Повторно растворенный АСН можно направить на стадию (20) первого барботажа. Могут потребоваться несколько следующих друг за другом стадий повторного растворения NaCl и барботажа для достижения подходящего сорта оксида алюминия, в зависимости от применения Al2O3. Отделенный твердый NaCl можно использовать в качестве сырья для ячейки хлор-щелочного электролиза для извлечения HCl и получения NaOH или можно продать как побочный продукт. Продукт из стадии 20 направляют непосредственно на обжиг (50) и, если требуется, на стадии (60, 70) промывки и сушки.
После физического разделения и промывки твердый АСН ступенчато нагревают, сперва при температуре от 400 до 600°С, используя обжиговую печь с косвенным нагревом для разложения АСН и получения богатого HCl газа, который можно подавать рециклом на стадию барботажа. Полученный гидроксид алюминия далее направляют на стадию второго обжига, действующую при более высокой температуре, выше 600°С, предпочтительно от 900 до 1100°С, для превращения гидроксида в конечный оксид алюминия (Al2O3).
После способа барботажа остающаяся жидкость представляет собой концентрированный раствор HCl, содержащий остающиеся хлориды металлов (например, Са2+, Mg2+, Na+). Этот жидкий поток дополнительно обрабатывают для извлечения HCl с утилизацией CO2 для получения карбонатов.
Однако из-за до некоторой степени гетерогенной природы материалов, продукт выщелачивания может иметь более высокое содержание Fe2+/Fe3+, чем может быть допустимо в конечном карбонатном продукте. Если это имеет место, железо можно удалить способом жидко-жидкостной экстракции, похожим на тот, который предложен в патентах NO 323417 и US 5585080, путем использования органического раствора, несмешиваемого с водой, содержащего, например, бис(2-этилгексил)кислый фосфат (Eriksen et al., 2007, норвежский патент 323417), или как в способе Anortal (патент US 4110399).
Было показано, что использование разбавленного органического экстрагента является эффективным средством для удаления Fe2+/Fe3+ из концентрированного раствора HCl. При контакте с содержащей железо жидкостью, трибутилфосфат (ТБФ), разбавленный углеводородным растворителем, селективно экстрагирует катионы Fe3+. На второй стадии ТБФ регенерируют путем контакта загруженного раствора с кислотой или водой, удаляя хлориды металлов из органического раствора перед подачей рециклом на стадию экстракции.
Если требуется, HCl можно извлечь из концентрированного раствора FeCl3/FeCl2 с помощью пиролиза или гидролитической дистилляции (как предложено в ЕР 2310323 В1), получая таким образом Fe2O3, который можно продать в зависимости от его чистоты.
Этот раствор направляют на технологическую стадию, на которой свободную HCl извлекают путем нагрева раствора выше температуры кипения HCl/пара. Эта технологическая стадия выгодна из-за высокой концентрации хлоридных солей в растворе, так как она действует как «разрушитель азеотропного вещества» и уменьшает расход энергии в технологической стадии. Смесь HCl/пар извлекают, получая раствор соляной кислоты, который можно подавать рециклом в способ. Остающийся после извлечения кислоты раствор является концентрированным раствором хлоридов металлов с концентрацией свободной HCl настолько низкой, насколько это возможно.
В нескольких патентах представляют возможность использования органической экстракции (различными аминами) для извлечения HCl из разбавленных растворов и извлечения концентрированной HCl путем десорбции амина.
В отличие от способов предшествующего уровня техники (Baniel and Jansen, патентная заявка US 2012/0134912 и другие) в настоящем изобретении используют CO2 в способе извлечения HCl по меньшей мере частично из-за экологического преимущества утилизации CO2 для получения карбонатов, что отличает настоящее изобретение.
Предложенная здесь инновационная технологическая стадия ставит своей целью извлечение HCl из богатого хлоридом металла раствора со связыванием CO2 путем образования карбоната. Технологию на основе аминовой экстракции применяют к остающемуся раствору после дистилляции свободной кислоты. На этой стадии раствор хлоридов металлов контактирует с органическим раствором, содержащим по меньшей мере один амин, разбавленный в углеводородном растворе. Смесь водного и органического раствора механически смешивают в герметичном реакторе, в котором повышают давление содержащим CO2 газом до давления, составляющего по меньшей мере 200 кПа (2 бар). При условиях повышенного давления CO2 растворяется в водной фазе и реагирует с хлоридом металла и амином с получением соответствующего карбоната металла (который осаждается) и комплекса хлорида аммония (который остается в органической фазе). В качестве примера реакция двухвалентных катионов металлов является следующей:

Здесь М представляет металл в растворе и R3N комплекс третичного амина, в котором R3 является углеродной цепью (С6-С12).
Третичные амины более чем с 6 атомами углерода нерастворимы в воде и поэтому являются предпочтительными в этом изобретении. Третичные амины с цепями менее чем с 6 атомами углерода являются частично растворимыми в воде, в то время как их соответствующие соли хлорида аммония полностью растворимы в воде; таким образом, они не подходят для данного применения.
Так как водная фаза и органическая фаза не смешиваются, две фазы быстро разделяются, когда перемешивание останавливается. Твердый осажденный карбонат остается в водной фазе и его можно легко отделить путем фильтрации, при этом амин, насыщенный HCl, можно направить на стадию десорбции для регенерации HCl и раствора амина. Твердый осажденный карбонат или карбонат металла обычно представляет собой карбонат кальция, карбонат магния, карбонат натрия, бикарбонат натрия.
Для достижения высоких эффективностей извлечения может быть необходима многостадийная противоточная конфигурация. В этом случае можно предусмотреть два или более действующих последовательно реакторов в противоточном режиме для увеличения общего извлечения кислоты, вычисленного из экспериментальных данных, показанных в примере 3.
После экстракции амин, насыщенный HCl, должен быть регенерирован. Предпочтительным вариантом была бы непосредственная дистилляция амина путем нагрева органической фазы при температуре от 50 до 300°С, наиболее предпочтительно от 50 до 150°С, если необходимо, газом-носителем, таким как пар или инертный газ, с получением богатого HCl газа, как представлено в ЕР 2321218 А1 и US 4230681. Такая технология была ранее предложена для регенерации карбоновых кислот в биологических реакторах для извлечения свободного HCl в потоки разбавленной кислоты (PCT/IL 2009/000392). Предложенное в данном документе воплощение является первым опубликованным способом регенерации HCl из раствора растворенных хлоридов металлов, полученного путем кислотного выщелачивания богатых Al материалов.
Непосредственная дистилляция амина для извлечения газообразного HCl, чистого или смешанного с паром или другим газом-носителем, является предпочтительным технологическим маршрутом, так как полученный газ можно легко подавать рециклом в способ или десорбировать в абсорбционной колонне с получением непосредственно концентрированной соляной кислоты. Одним предпочтительным способом извлечения HCl является термическая обработка при температуре выше 80°C с получением содержащего HCl газа, который можно подавать рециклом в способ.
Другой предпочтительной альтернативой является контакт насыщенного HCl амина с сильно основным раствором, подобным, например, NaOH или КОН, для регенерации амина, который можно подавать рециклом на стадию осаждения карбоната, и получения концентрированного раствора NaCl, который можно подать в хлор-щелочной электролизер для получения концентрированного раствора соляной кислоты и NaOH.
После осаждения карбонатов водная фаза может содержать другие вторичные хлориды металлов в низкой концентрации. Водную фазу можно либо дополнительно обработать для извлечения HCl из этих хлоридов металлов, либо рассматривать как сточную воду и осадить после соответствующей обработки, чтобы соответствовать экологически благоприятным условиям.
Теперь вернемся более подробно к чертежам. На Фиг. 1 показана упрощенная технологическая схема согласно одному из предпочтительных воплощений настоящего изобретения.
Технологическая схема была упрощена и различные стадии с общей целью были сгруппированы в блоки:
- стадия 20 может включать 2 или более следующие друг за другом стадии промывки и фильтрации кислотой и/или водой,
- новая технология барботажа (30) была объяснена подробно в двух предпочтительных воплощениях на чертежах 3b) и 4b) в сравнении с предшествующей технологией 3а) и 4а), представленной другими авторами,
- обжиг (40) можно выполнять в двух следующих друг за другом печах при различных температурах для лучшего полного извлечения кислоты,
- извлечение (50) кислоты может включать несколько блоков оборудования (например, испаритель и блок быстрого испарения),
- осаждение может потребовать более одной стадии, выполняемых противоточными реакторами, и включает фазовое разделение между реакторами; регенерации амина и кислоты можно достичь с помощью различных технологий, указанных в формуле изобретения.
На Фиг. 2 показана упрощенная технологическая схема настоящего изобретения согласно воплощению по пункту 10 формулы изобретения, где включена стадия (80) удаления железа, чтобы избежать высокого содержания железа в полученном РСС.
Такой способ включает различные технологические стадии, которые объясняются подробно ниже со ссылкой на Фиг. 1.
В общем, способ может включать по меньшей мере следующие стадии.
1) Физическое приготовление богатого Al материала.
2) Кислотное выщелачивание Al3+ и других катионов, таких как промоторы карбоната, из материала; извлечение жидкости и твердого вещества.
3) Многостадийное осаждение AlCl3⋅6H2O (АСН) из водного продукта выщелачивания путем барботажа сухим газообразным HCl.
4) Обжиг АСН для регенерации газообразного HCl и получения Al2O3.
5) Экстракция железа путем способа жидкость-жидкостного разделения (при необходимости).
6) Извлечение кислоты путем испарения свободного HCl из продукта выщелачивания.
7) Осаждение карбонатов из богатого хлоридами металлов раствора с объединенной экстракцией HCl.
8) Регенерация HCl и амина из загруженного органического раствора.
1) Физическое приготовление силикатной породы. Фиг. 1 - стадия 00
Богатый Al исходный материал, например, анортозит, можно селективно добыть. Загрязняющие побочные фракции или пласты/включения можно оптически отсортировать. Физическое приготовление материала включает:
а) Дробление и измельчение до фракции по размеру частиц с диаметром менее 0,5 мм.
б) При необходимости, содержащие железо и магний фракции удаляют путем оптической сортировки, магнитной сепарации или другим подходящим способом, известным в уровне техники.
2) Кислотное выщелачивание Al3+ и других ионов металлов из материала.
Извлечение продукта выщелачивания и SiO2. Фиг. 1 - стадия 10 и 20
Раздробленный и предварительно обработанный материал растворяют в кислом растворе HCl (от 1 до 13 М) в реакторе растворения при 80°С и 160°С при атмосферном давлении или условиях давления, повышенного вплоть до 1 МПа (10 бар).
После растворения на стадии выщелачивания твердые остатки (непрореагировавшие фракции и SiO2) отделяют от продукта выщелачивания путем центрифугирования и/или фильтрации. Согласно технологической схеме непрореагировавшие фракции можно отделить от продукта аморфного SiO2, например, путем технологий различия в плотности/отделения зерен с использованием последовательных или параллельных гидроциклонов или любой другой подходящей технологии разделения, известной в уровне техники. После разделения непрореагировавшие фракции можно повторно ввести на стадию кислотного выщелачивания. Также, непрореагировавшую кислоту, покидающую реактор выщелачивания, можно по меньшей мере частично извлечь путем мгновенного испарения и подать рециклом на стадию выщелачивания.
Продукт SiO2 можно промыть, один раз или несколько, используя стадии промывки разбавленной кислотой и водой, организованные противотоком, для удаления следов растворенных катионов и HCl и получения промышленного продукта. При необходимости, можно выполнить дополнительную химическую обработку SiO2 для достижения более высокой чистоты продукта.
На практике стадию выщелачивания можно осуществлять множеством различных способов, изменяющихся от однократного способа - один или несколько реакторов выщелачивания, действующих параллельно, в зависимости от требований производительности - до многократной конфигурации с использованием реакторов выщелачивания, соединенных последовательно - в зависимости от кинетики растворения материала. Для руд с высокой реакционной способностью, когда время выщелачивания является практичным для промышленного масштаба, предпочтительной конфигурацией является однократный способ, который можно выполнять в параллельных реакторах, если обрабатывают большие объемы. Как описано в примере 1, однократная конфигурация была успешно испытана в экспериментальном масштабе с использованием анортозита. Лабораторные испытания также показали, что последовательные порции и для полунепрерывного выщелачивания (путем частичного замещения продуктов выщелачивания свежей кислотой в течение способа) могут быть выгодными для увеличения кинетики растворения и уменьшения общего времени выщелачивания, что может быть выгодным для руд с низкой реакционной способностью или в случае кислоты с низкой концентрацией.
3) Осаждение АСН из продукта выщелачивания путем барботажа сухим газообразным HCl. Фиг. 1 и 2 - стадия 30
Продукт выщелачивания, содержащий растворенные хлориды металлов, барботируют сухим газом, содержащим HCl, в реакторе кристаллизации, поддерживаемом при температуре от 50°С до 90°С, до тех пор, пока концентрация HCl в растворе не достигнет 30 масс. %. При этой концентрации максимальная растворимость Al3+ составляет 3 г/л, таким образом избыток Al3+, присутствующий в исходном продукте выщелачивания, осаждается в виде AlCl3⋅6H2O, гидратированной соли, которую можно отделить от кислого раствора, содержащего, наряду с другими элементами, растворенные Са2+, Mg2+ и Fe2/3+. Как объяснено выше («Описание изобретение»), предпочтительным воплощением для настоящего способа является выполнение способа фракционного или многостадийного осаждения (Фиг. 1 и 2).
4) Обжиг АСН для извлечения газообразного HCl и получения Al2O3. Фиг. 1 и 2 - стадия 40
Для извлечения газообразного HCl и получения Al2O3, твердый АСН нагревают в способе двухстадийного обжига. В первой обжиговой печи АСН разлагают при температуре от 400 до 550°C с получением газообразного HCl с использованием косвенного нагрева, чтобы избежать загрязнения газообразного HCl. На второй стадии гидроксид алюминия нагревают при температуре выше 1000°С в системе циркулирующего псевдоожиженного слоя или во вращающейся печи, чтобы получить Al2O3 с низкими потерями при прокаливании (LOI) и низким содержанием альфа-модификации.
5) Экстракция железа путем способа жидкость-жидкостного разделения (при необходимости). Фиг. 2 - стадия 80
Это необязательная стадия для отделения ионов железа от водного раствора с помощью способа жидкость-жидкостного разделения по пункту 10 формулы изобретения, показанная на Фиг. 2.
6) Извлечение кислоты путем испарения. Фиг. 1 и 2 - стадия 80
После барботажа и отделения осажденного АСН водный раствор содержит по меньшей мере 20 масс. % HCl вместе с остающимися в растворе хлоридами металлов. HCl извлекают из раствора продукта выщелачивания путем испарения или дистилляции. Способ в большой степени извлекает выгоду из высоких концентраций хлоридов металлов в подаваемом потоке, так как хлориды действуют как «разрушитель азеотропного вещества» и создают возможность для извлечения концентрированной HCl с меньшей энергией. Дистилляцию осуществляют до тех пор, пока не извлекут всю HCl. Если требуется, осажденные в течение повышения рН твердые вещества, такие как Al(OH)3, отфильтровывают из водной фазы и растворяют в реакторе выщелачивания.
7) Осаждение карбоната из богатого хлоридами металлов раствора с объединенной экстракцией HCl. Фиг. 1 и 2 - стадия 60
Богатый хлоридами металлов водный раствор приводят в контакт с органическим раствором, содержащим третичный или четвертичный амин, растворенный в по меньшей мере одном органическом растворителе, таком как один углеводородный разбавитель или смесь углеводородных разбавителей. Во время перемешивания органической и водной фазы в реактор закачивают содержащий CO2 газ с давлением, составляющем по меньшей мере 1 МПа (10 бар) и при температуре окружающей среды. После времени реакции от 3 до 20 минут давление в реакторных сосудах сбрасывают и водная фаза, содержащая твердый карбонат металла, отделяется от органической фазы, содержащей насыщенный HCl амин. После разделения двух жидких фаз богатый карбонатом раствор закачивают в место отложения или фильтруют для извлечения твердого карбоната.
8) Регенерация HCl и амина из насыщенного амина. Фиг. 1 и 2 - стадия 70
Органический раствор, насыщенный HCl (соль хлорида аммония/соль гидрохлорида амина), нагревают при температуре выше 150°С, чтобы разложить комплекс амин-HCl и образовать содержащий HCl газ, который можно подавать рециклом в способ. Дистилляцию можно выполнять, используя N2 или любой другой инертный газ-носитель. После дистилляции регенерированный амин подают рециклом на стадию осаждения карбоната.
Альтернативно, насыщенный HCl амин можно регенерировать путем приведения в контакт органической фазы с концентрированным водным основным раствором и подавать рециклом на стадию получения РСС. Полученный NaCl можно использовать в качестве исходного раствора для хлор-щелочного электролизера для получения HCl и NaOH.
Примеры
Все технологические стадии были испытаны в лабораторном масштабе и первая основная стадия в экспериментальном масштабе (выщелачивание богатого Al минерала), показывая возможность технической реализации. Следующие примеры служат только иллюстрацией практического применения этого изобретения и обеспечивают подходящее описание принципов и концептуальных аспектов этого изобретения, не ограничивая изобретение этими конкретными воплощениями.
Пример 1. Выщелачивание
В реакторе с проектной емкостью 100 литров 15 кг суспензии анортозита в воде (33 масс. % воды) смешивают с 38 л предварительно нагретого до 70°С раствора HCl (22 масс. % HCl). Размер частиц анортозита составляет 300 микрон. Смесь далее нагревают до 140°С (паром, протекающим через паровую рубашку реактора), наращивая давление до 250 кПа (2,5 бар) при интенсивном механическом перемешивании. Полное время реакции от начала перемешивания составляет 5 часов. Образцы смеси отбирают при 2,5 и 5 часах, фильтруют и анализируют с помощью МС-ИСП (масс-спектрометра с индуктивно связанной плазмой). Измеренный алюминий, извлеченный из анортозита в жидкую фракцию, составляет 88 масс. % при 2,5 часах и 95 масс. % при 5 часах.
Пример 2. Экстракция HCl и осаждение карбоната металла различными аминами
Несколько типов растворов амина испытывали для оценки влияния химической природы активной органической фазы на технологию РСС. Химические свойства функциональной аминогруппы связаны со способностью свободной электронной пары атома азота образовывать водородные связи. В случае способа кислотной экстракции сила амина (экстрагирующая способность) также определяется доступностью его необобщенной электронной пары для электрофильного протона подлежащей экстракции кислоты. Эта доступность определяется индуктивным эффектом атомов и цепей, связанных с атомом азота (Eyal et al., 1991). В силу индуктивного эффекта замещения Н алифатической цепью, ожидают, что третичные амины обладают более высокой основной силой по сравнению с первичными и вторичными аминами. К тому же, ожидают, что основность увеличивается с длиной алифатической цепи.
В этой технологии также ожидают, что основная сила амина играет важную роль в его способности реагировать с CaCl2 и HCO32- с получением соли гидрохлорида аммония и CaCO3. Основная сила функциональной аминогруппы должна быть достаточно высокой, чтобы сбалансировать подкисление водного раствора из-за растворения CO2 и образования угольной кислоты и позволить образование CaCO3. Однако амин с более высокой основной силой образует более стабильный комплекс гидрохлорида амина, что требует больше энергии для разложения или термолиза на стадии регенерации.
Здесь испытывали третичные амины (R3N) с различной длиной углеродной цепи, R от 4 до 12 атомов углерода, для осаждения CaCO3 из раствора CaCl2.
Оценивали следующие амины с прямыми углеродными цепями:
С4: трибутиламин (ТБА), С6: тригексиламин (ТГА), С8: триоктиламин (ТОА), триизооктиламин (ТИОА) и С12: тридодециламин (ТДА). Кроме того испытывали раствор разветвленного третичного амина с цепями 8С для реакции РРС: три-2-этилгексиламин (ТЭГА).
Испытания с ТБА показали близкое к 100% превращение амина в соль гидрохлорида аммония благодаря его низкой вязкости и очень эффективному образованию РРС. Однако в его соляной форме данный амин растворим в воде, что вызывает сложность регенерации HCl и ТБА без испарения или последующей обработки большого количества воды.
ТГА и ТОА при одинаковых экспериментальных условиях (50% амина в разбавителе 1/3 деканола - 2/3 Asol, отношение Ca к амину = 2, время, pCO2) представляли близкие к одинаковым высокоэффективные выходы.
Несмотря на его более сильную основность и более высокую термостойкость, ТДА (12С) является более проблемным органическим амином для использования в этом способе из-за его более высокой вязкости. При таких же условиях растворения как и для других аминов, получали более низкий выход РСС, составляющий 13%, из-за сложности надлежащего контакта водной и органической фаз в лабораторных сосудах. В будущей работе необходимо оценить дополнительные испытания в более разбавленных условиях (<50% амина в растворителе).
Наконец, 8С разветвленный амин, ТЭГА, не показал какого-либо осаждения CaCO3 или HCl в течение испытания, несмотря на его ожидаемую более сильную основность и низкую вязкость. Возможным объяснением этого поведения могла бы быть стерическая затрудненность функциональной аминогруппы разветвленными алифатическими группами, что уменьшает доступность электронной пары для совместного осаждения CaCO3 и экстракции HCl.
Конкретным примером возможного модификатора является использование органической кислоты помимо амина и разбавителя. Оказалось, что при добавлении к экстрагенту такие соединения увеличивают селективность и обратимость амина (Eyal et al., 1982).
Другие кислые экстрагенты, такие как четвертичные амины (Aliquat), или кислый экстрагент на основе фосфина, такой как ТБФ (третбутилфосфин), также могут быть интересными кандидатами для способа жидкостной экстракции с осаждением CaCO3, что требует дополнительной экспериментальной работы. Можно выполнить более тщательное исследование влияния этих аминов на технологию для определения критических параметров и оптимальных условий для этой новой технологии хранения СО2.
Из испытанных аминов достигали эффективностей выше 80 масс. % осаждения CaCO3 только на одной стадии с ТИОА, разбавленного деканолом/Asol, и с ТГА, разбавленным деканолом/Asol и додеканом. Эффективности, составляющей 76 масс. %, достигали с ТОА, разбавленным деканолом/Asol, которая могла бы быть достаточной при применении нескольких стадий, если регенерация амина происходит энергетически выгодно.
Пример 3. Вычисление необходимых стадий экстракции HCl
Из различных экспериментальных испытаний отобрали один типичный случай для определения требуемых противоточных стадий путем применения адаптированного способа диаграммы McCabe-Thiele. В этом случае органическая фаза представляла собой триизооктиламин (ТИОА) с отношением амина к органическим разбавителям 1:1 (об.) и деканолом и Asol в качестве разбавителей в пропорции 2:1 об.
Способ McCabe-Thiele широко используют в металлургии для предварительного технического и опытного проектирования, так как он дает хорошую аппроксимацию объемов, стадий, концентраций и т.п. с относительно низкой сложностью. Кривые распределения или изотермы равновесия получают экспериментально при условиях способа и представляют конечную концентрацию растворенного компонента в двух фазах (водной и органической), когда смесь достигает равновесия. Проверку концепции на основе технологических решений и образование точных технических данных можно выполнить только в экспериментальной установке, хотя ее эффективность вычисляют путем сравнения с лабораторными кривыми и данными.
В этом способе данный метод нужно было приспособить к уникальной природе реакции, которая не является обычной жидко-жидкостной органической экстракцией, а 4-фазной экстрактивной/химической реакцией. Таким образом, кальций не остается «растворенным» в органической фазе, но осаждается обратно в водную фазу в виде карбоната кальция, так что соответствующую теоретическую HCl в водном растворе нужно вычислить из химического уравнения.
Поэтому выполняли ряд экспериментов с фиксированной концентрацией CaCl2 (0,875 моль), изменяющимся отношением органической и водной фаз (О/В от 2,45 до 5,25) и барботажем CO2 при 5 МПа (50 бар) в течение 20 минут для достижения равновесия, чтобы определить осажденный карбонат кальция.
Определяли ожидаемую концентрацию CaCl2 в потоке поступающего материала в общем способе (поступающего из стадии барботажа и испарения), соответствующую 0,09 кг HCl/кг воды. Учитывая эффективность кислотной экстракции, составляющую 90%, оценивали количество противоточных стадий.
Из этих результатов для таких условий вычисляли две противоточные стадии экстракции и получали их конкретные составы потоков и учитывали балансы массы и энергии для перечня практической реализации оборудования и оценки стоимости способа. Важно подчеркнуть, что эти результаты являются специфическими для этих условий экстракции и типа амина, хотя количество требуемых стадий кажется реалистичным для кислотной экстракции.
Реферат
Изобретение может быть использовано в химической промышленности. Способ получения оксида алюминия из богатых алюминием материалов с интегрированной утилизацией СOвключает измельчение и выщелачивание богатых Al материалов в соляной кислоте. Отделяют непрореагировавшее твердое вещество от раствора хлорида металла. Отделяют Аlот указанного раствора путем кристаллизации AlCl⋅6НO. Получают АlOпутем обжига АlСl⋅6НO с извлечением HCl. Обжиг выполняют в две стадии: сначала путем косвенного нагрева при температуре от 400 до 600°С для образования богатого HCl газа, затем при температуре выше 600°С для получения AlO. Проводят утилизацию COв осадок карбонатов металлов из раствора хлорида металлов, поступающего из стадии отделения Al. Проводят регенерацию HCl и экстрактивного амина. Смешивают бедный алюминием раствор хлорида металла с органическим раствором, содержащим выбранный амин, и приводят в контакт смесь с содержащим COгазом для экстрагирования HCl путем образования комплекса соли хлорида аммония и осаждения карбоната металла. Отделяют карбонат металла. Обрабатывают термически или химически органический раствор, чтобы регенерировать амин для рециркуляции. Изобретение позволяет повысить экологическую безопасность при получении оксида алюминия из богатых алюминием силикатных пород. 13 з.п. ф-лы, 4 ил., 3 пр.
Формула
Документы, цитированные в отчёте о поиске
Способ получения чистой окиси алюминия

Комментарии