Способ получения фениламиноалканов - SU440825A3
Код документа: SU440825A3
Описание
1
Предлагается способ получения новых фениламиноалканов , которые обладают фармакологической активностью и могут поэтому найти применение в медицине.
Известен способ получения 1-(2-цианфенокси )-2-окси-3-этиламинопропана и его солей, которые обладают цепными терапевтическими свойствами.
Однако в литературе отсутствуют сведения о получении фениламипоалканов общей формулы 1
Rj СНт,
C-CH-NHRb
k
где С1 - хлор в 4- или 6-положении; RI иR2-водород или метил;
Rs - водород, низший алкил, бензил , теофиллин-(7)-этилгрунна или группы
-с„н.„-н,
где л 1 или 2;
R4 - карбоксил, алкоксикарбонил, аминоарбонил или нитрил,
или -С„Н2,п-1 -(C.HO-R
где ,3 или 4;
RS - галоген, окси, амино- или ациламиногруппа ,
-
где п 1 или 2;
R - низший алкил пли фенил,
CO-R,
где Re - низшая алкокси-, алкилтио- или бензилоксигруппа, или алкил, который может быть замещен галогеном, окси- или аминогруппой ,
обладающих ценными свойствами.
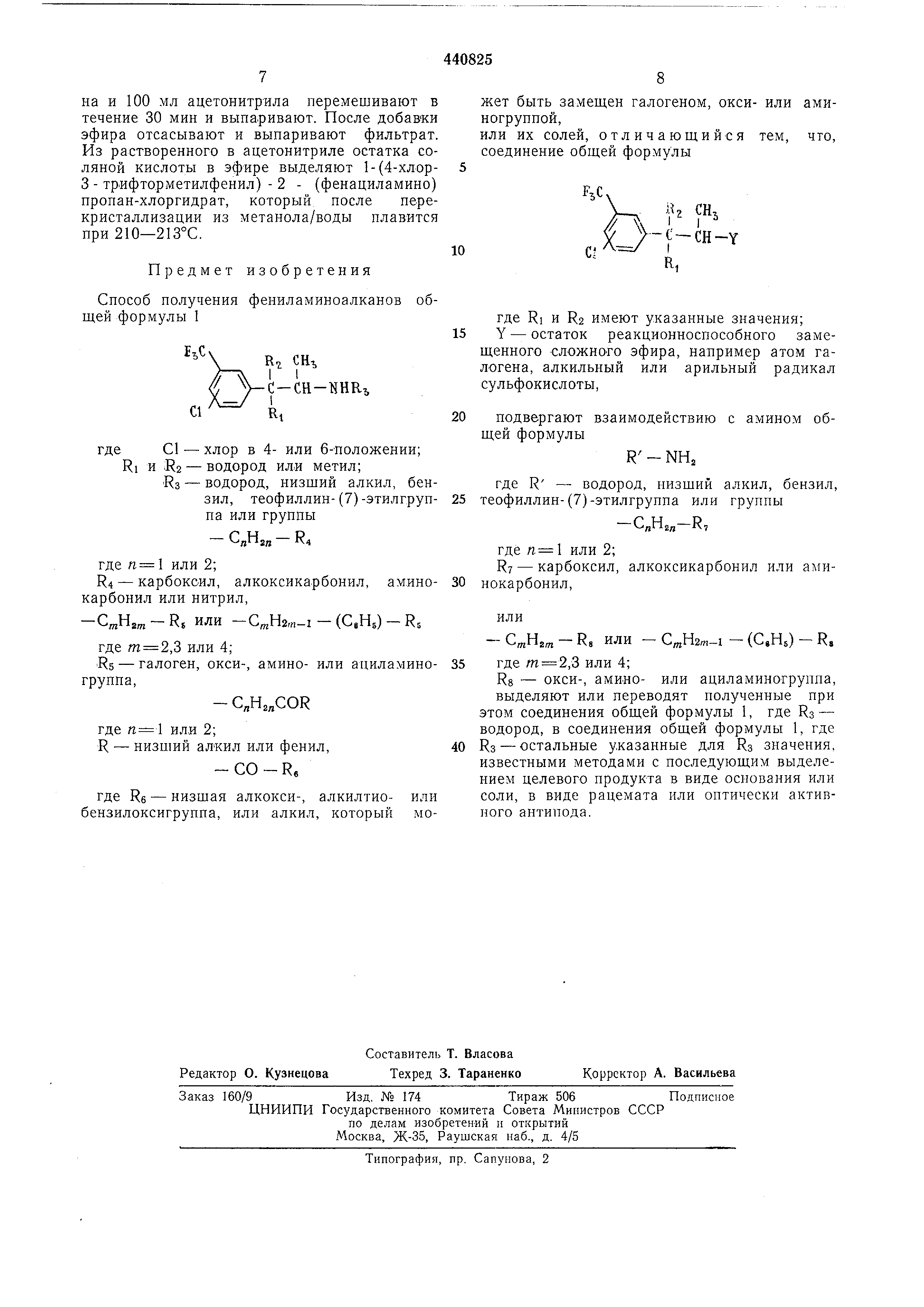
Предлагаемый способ получения фениламиноалканов общей формулы 1 или их солей заключается в том, что соединение общей формулы
20
R, Ш / V-r -CH-Y
25
где RI и Ra имеют указанные значения; Y - остаток реакционноспособного заме30 щенного сложного эфира, например атом галогена , алкильный или арильный радикал сульфокислоты,
подвергают взаимодействию с амином общей формулы
R - NH,
где RI - водород, низший алкил, бензил, теофиллин-(7)-этилгруппа или группы
- - R
где п 1 или 2;
RT - карбоксил, алкоксикарбонил или аминокарбонил; или
- ,„ - R. или - С,„Н2т-1 - (CeHs) - Re
где ,3 или 4;
Rs -ОКСИ-, амино- или ациламиногруппа.
В получаемые соединения общей формулы 1, где Rs -водород, далее можно известными методами вводить другие, указанные для Ra радикалы, кроме водорода, например, путем алкилирования или ацилирования. Кроме того, в соединениях, где Rs - радикалы , содержащие функциональные группы, можно превращать одну группу в другую известными приемами.
Целевой продукт выделяют известным способом в виде основания или соли, в виде рацемата или оптически активного антипода.
Пример 1. 1 - (4-Хлор-З-трифторметилфенил ) -2-бензиламиноп.ропан.
1-(4-Хлор-3-трифторметилфенил)-2 - пропаном восстанавливают боранатом натрия в соответствующий 2-пропанол (т. кип. 134С/ 12 мм рт. ст.) и хлоридом метансульфоновой кислоты переводят в 1-(4-хлор-3-трифторметилфенил )-2-пропанол-метансульфонат (т. ил. 70-С). 15 г этого соединения, 5,5 г бензиламина и 7 г КзСОз в 50 мл ксилола в течение 8 час кипятят с обратным холодильником, осадок затем отсасывают и ксилол отгоняют. Остаток растворяют в ацетонитриле и 1-(4хлор-3 - трифторметилфенил)бензиламинопропан-метансульфонат (т. пл. 158-162 С) оставляют выкристаллизовываться.
Аналогичным образом получают:
1-(4-хлор - 3-трифторметилфенил) - 2-оксиэтиламинон .ропанхлоргидрат, т. пл. 127-
128°С;
1-(4-хлор-3-трифторметилфенил) - 2 - этиламинопропан-хлоргидрат , т. пл. 199-200°С;
хлоргидрат М-(4-хлор-3-трифторметил - аметилфенэтил )-глицинэтилового эфира, т. пл. 165-167°С;
Ы-(4-хлор-3 - трифторметил - а - метилфенэтил )глицин-хлоргидрат, т. пл. 208-210°С (разложение);
1-{4-хлор-3-трифторметилфенил)-2 - аминопропан-хлоргидрат , т. пл. 196-198°С;
1-(4-хлор-3-трифторметилфенил) - 2 - (3-оксип ,ропиламино)пропанхлоргидрат, т. пл. 141 -
1-(6-хлор - 3-трифторметилфенил) - 2 - метиламинопропан-хлоргидрат , т. пл. 146- 148°С;
1-(4 - хлор-3-трифторметилфенил) - 2 - метиламинопропан-хлоргидрат , т. пл. 195- 198°С;
1-(6-хлор - 3-трифторметилфенил)-2-аминопропан-хлоргидрат , т. пл. 226-230°С. Пример 2. Этиловый эфир 4-хлор-З-трифторметил-а-метилфенэтилкарбаминовой кислоты .
К смеси из 7 г 1 (4-хлор-З-трифторметилфенил )-2-аминопропана, 4 г карбоната натрия и 50 мл ацетонитрила прибавляют по
каплям 3,3 г этилового эфира хлормуравьиной кислоты и в течение 15 мин нагревают до 40°С. Затем смесь перемешивают в течение 12 час, отсасывают и выпаривают. Остающееся масло растворяют в эфире, взбалтывают с
разбавленной соляной кислотой и выпаривают эфирную фазу. После фракционной дистилляции получают этиловый эфир 4-хлор-Зтрифторметил-а - метилфенэтилкарбаминовой кислоты (т. кип. 135-140°С/0,35 мм рт. ст.),
который перекристаллизовывают из пет,ролейного эфира (т. нл. 56-58°С).
Аналогичным образом получают этиловый эфир (4-хлор-3 -трифторметилфенил)-2пропил -тиолкарбаминовой кислоты, т. пл.
67°С.
Пример 3. 2-(4-Хлор-3-трифторметил-аметилфенэтил амино) ацетонитр ил.
К 13,7 г 38%-ного водного раствора бисульфита натрия добавляют 5 г 30%-ного раствора формалина и размешивают в течение 10 мин. Затем к смеси прикапывают 12 г 1-{4-хлор-3 - трифторметилфенил)-2 - аминопропана , причем температура повышается до 60°С. После прибавления по каплям раствора 3,75 Г цианида калия в 7,5 мл воды массу размешивают еще в течение 1 час, затем добавляют воду и извлекают эфиром. Эфирную фазу сущат и выпаривают, а остающееся масло подвергают фракционной дистилляции,
оно превращается в 2-(4-хлор-3-трифторметил-сс - метилфенэтиламино) ацетонитрил при 130-150°С/0,02 мм рт. ст., его растворяют в небольшом количестве уксусного эфира, подкисляют метансульфокислотой и выкристаллизовавшийся после добавки эфира метансульфонат перекристаллизовывают из спирта (т. пл. 181°С, разложение).
Пример 4. 1-(4-Хлор-3 - тр,ифторметилфенил )-2-(3 - хлорпропиламино)пропан.
3 г полученного аналогично примеру 31-(4-) хлор-3-трифторметилфенил) - 2-(3 - оксипропиламино )пропан-хлоргидрата в 50 мл ацетонитрила с 1 мл тионилхлорида в течение 30 мин кипятят с обратным холодильником,
реакционную смесь выпаривают, а остаток суспендируют в эфире. Кристаллический 1-(4-хлор-3-трифторметилфенил)-2-(3 - хлорпропнламино )-пропан-хлоргидрат отсасываю и он плавится после перекристаллизации из
воды при 150-152°С.
Аналогично получают из 1-(4-хлор-3-т,рифторметилфенил )-2 - (2 - оксиэтиламино) пропана с тионилхлоридом 1-(4-хлор-3-трифторметилфенил ) - 2-(2 - хлорэтиламино)пропанхлоргидрат , который плавится при 154- 156°С.
Пример 5.
А. 1-(4-Хлор - 3-трифторметилфенил)-2-{2хлорацетилам ,ино) пропан.
Смесь 62,8 г (0,2 моль) 4-(4-хлор-3-трифторметилфенил )-2-аминопропана и 10,2 мл 2хлорацетилхлорида в 250 мл ацетонитрила подвергают взаимодействию в течение 1 час при комнатной температуре. Затем отфильтровывают осадившуюся соль, сгущают ф-илырат и осаждают указанное соединение петролейным эфиром, т. пл. 59-63°С (основание).
Б. 1-(4-Хлор - 3-трифторметилфенил)-2-(2бензиламиноацетиламино )пропан.
12,6 г 1-(4-хлор-З-трифторметилфенил) - 2 (2-хлорацетиламино) пропана, полученного по пункту А взаимодействием 1-(4-хлор-3 - трифторметилфенил )-2-аминопропана с хлорацетилхлоридом в ацетонитриле при комнатной температуре, кипятят с обратным холодильником в 100 мл ацетонитрила с 9,4 г бензиламИна в течение 2 час. После удаления бензиламинхлоргидрата и растворителя промывают в уксусном эфире с водой и осаждают соляной кислотой в эфире 1-(4-хлор-З-трифторметилфенил )-2-(2 - бензиламиноацетиламино) пропан-хлоргидрат, который после перекристаллизации из воды плавится при 161 - 164°С.
Пример 6. 1-(4 - Хлор-3-трифторметилфенил ) -2- (2-ам1Иноацетиламино) пропан.
Путем взаимодействия 1-(4-хлор-З-трифторметилфенил ) -2- (2 - хлорацетиламино)пропана в диметилформамиде с фталимидкалием при 100°С получают 1- (4-хлор - 3 - трифто.рметилфен-ил )-2-(2 - фталлмидацетиламино) пропан. 16 г этого соединения в 250 мл этанола в течение 1 час кипятят с обратным холодильником с 3,8 г гидразингидрата, затем подкисляют уксусным эфиром, охлаждают, отсасывают и выпаривают. Остаток растворяют в воде, отсасывают над активным углем, подщелачивают аммиаком, экстрагируют уксусным эфиром, промывают водой, сушат и выпаривают . Остаток растворяют в ацетонятриле и подкисляют метансульфокислотой. 1-(4Хлор-3-тр ,ифторметилфенил)-2-(2 - аминоацетиламино ) пропанметансульфонат выкристаллизовывают . После перекристаллизации из спирта он плавится при 193-196°С.
Пример 7. 1-(4-Хлор-3-трифторметилфенил ) -2- (2-окси-2-фенилэтиламино) пропан.
Полученное из 7 г 1-(4-хлор-З-трифторметилфенил )-2 - (фенациламино)пропанхлоргид-рата основание при комнатной температуре восстанавливают в 50 мл этанола 0,7 г боргидрида натрия и после удаления раствор.ителя и разложения избыточного боргидрида натрия в эфире добавляют расчитанное количество соляной кислоты в эфире. 1-(4-Хлор-3трифторметилфенил )-2-(2-акси-2 - фенилэтиламино ) пропан-хлоргидрат выкристаллизовывают . После перекристаллизации из небольшого количества ацетонитрила он плавится при 165-167°С.
Пример 8. 1-(4-Хлор-3 - трифторметилфенил )(7 - теофиллинил)этиламино пропан . Смесь 15 г 1 - (4-хлор - 3 - трифторметилфенил )-2-аминопропана и 7,6 г 6-(2-хлорэтил) теофиллина нагревают до 190°С, происходит экзотермическая реакция. Затем массу в течение 1 час размешивают при 170°С, охлаждают , добавляют уксусный эфир, отсасывают
и подкисляют фильтрат соляной кислотой в эфире. Выкристаллизовавшийся -(4-хлор-Зтрифторметилфенил )-2 - 2-(7 - теофиллинил) этиламино пропан-хлоргидрат после перекристаллизации из метанола плавится при
244-248°С.
Пример 9. 1-(4-Хлор-3 - трифторметилфенил ) -2- (ацетониламино) пропан.
В ,кипящую смесь 6,45 г 1-(4-хлор-З-трифторметилфенил )-2-аминопропана, 50 мл ацетонитрила и 2,93 г карбоната натрия прибавляют по каплям 2,53 мл хло.рацетона и в течение 1 час кипятят с обратным холодильником . После отсасывания и выпаривания остаток растворяют в уксусном эфире и соляной
кислотой в эфире и эфиром осаждают 1-(4хлор-3-трифторметилфенил ) -2 - (ацетониламино ) пропан-хлоргидрат, который после перекристаллизации из изопропанола плавится при 191-194°С.
Пример 10. 1-(4-Хлор-3 - трифторметилфенил )-2 - (2-цианэтиламино)пропан.
Смесь 5 г 1-(4-хлор-З-трифторметилфенил)2-аминопропана и 1,2 г акрилонитрлла в течение 5 час размешивают при 90°С, затем отгоняют непрореагировавший еще амин (т. кип. 124°С/15 .мти рт. ст.) и из растворенного в уксусном эфире остатка соляной кислотой в эфире и эфиром выделяют 1-(4-хлор-3-трифторметилфе-нил )-2 - (2 - цианэтиламино)пропан-хлоргидрат , который после перекристаллизации из небольшого количества воды плавится при 170-173°С.
Пример 11. 1-(4-Хлор-3-трифторметилфенил ) -2- (2-оксиэтиламино) пропан.
Смесь 23,7 г 1-(4-хлор-3-трифтормстилфенил )-2-аминопропана, 3,6 г этиленоксида, 120 мл метанола и 1,25 мл воды в аппарате, работающем под давлением, в течение двух суток встряхивают при комнатой температуре . После отгонки растворителя остаток подвергают фракционной дистилляции. Полученный 1-(4-хло,р-3 - трифторметилфенил)-2-(2оксиэтиламино )-пропан (т. кип. 140-145°С/ 0,2 мм рт. ст.) в уксусном эфире соляной кислотой в эфире и эфиром переводят в хлоргидрат (т. пл. 127-128°С).
Пример 12. 1-(4-Хлор - 3-трифторметилфенил ) -2- (фенациламино) пропан. Смесь 23,8 г 1-(4-хлор-3-трифторметилфенил )-2-аминопропана, 9,3 г а-бромацетофенона и 100 мл ацетонитрила перемешивают в течение 30 мин и выпаривают. После добавки эфира отсасывают и выпаривают фильтрат. Из растворенного в ацетонитриле остатка соляной кислоты в эфире выделяют 1-(4-хлор3 - трифто.рметилфенил) - 2 - (фенациламино) пропан-хлоргидрат, который после перекристаллизации из метанола/воды плавится при 210-213°С.
Предмет изобретения
Способ получения фениламиноалканов общей формулы 1
гдеС1 - хлор в 4- или б-положении;
RI и S.2 - водород или метил;
Кз - водород, низший алкил, бензил , теофиллин- (7) -этилгруппа или группы
С„На„ - R4
где или 2;
R4 - карбоксил, алкоксикарбонил, ам.ипокарбонил или нитрил,
,Rs или -C H2«-i-(CeH,)-Rs
где от 2,3 или 4;
Rs - галоген, окси-, амино- или ациламиногруппа ,
-с„н,„сок
где п 1 или 2;
R - низший алкил или фенил,
-CO-R,
где Re - низшая алкокси-, алкилтио- или бензилоксигруппа, или алкил, который может быть замещен галогеном, окси- или аминогруппой ,
или их солей, отличающийся тем, что, соединение общей формулы
СН,
I
с-шCH-Y
R,
где RI и Ra имеют указанные значения; Y - остаток реакционноспособного замещенного СЛОЖНОГО эфира, например атом галогена , алкильный или арильный радикал сульфокислоты,
подвергают взаимодействию с амином общей формулы
R - NH,
где R - водород, низший алкил, бензил, теофиллин-(7)-этилгруппа или группы
С„Нг„-RV
где или 2;
Ry - карбоксил, алкоксикарбонил или аминокарбонил ,
или - ,„ - R, или - С;„Н2ш-1 - (C.Hs) - R,
где m 2,3 или 4;
Re - окси-, амино- или ациламиногруппа,
выделяют или переводят полученные при
этом соединения общей формулы 1, где Ra -
водород, в соединения общей формулы 1, где
Rs - остальные указанные для Rs значения, известными методами с последующим выделением целевого продукта в виде основания или соли, в виде рацемата или оптически активного антипода.



Реферат

Формула


Комментарии