Способ получения производных бензо (с) хинолинов или их фармацевтически приемлемых солей с кислотами - SU953981A3
Код документа: SU953981A3
Описание
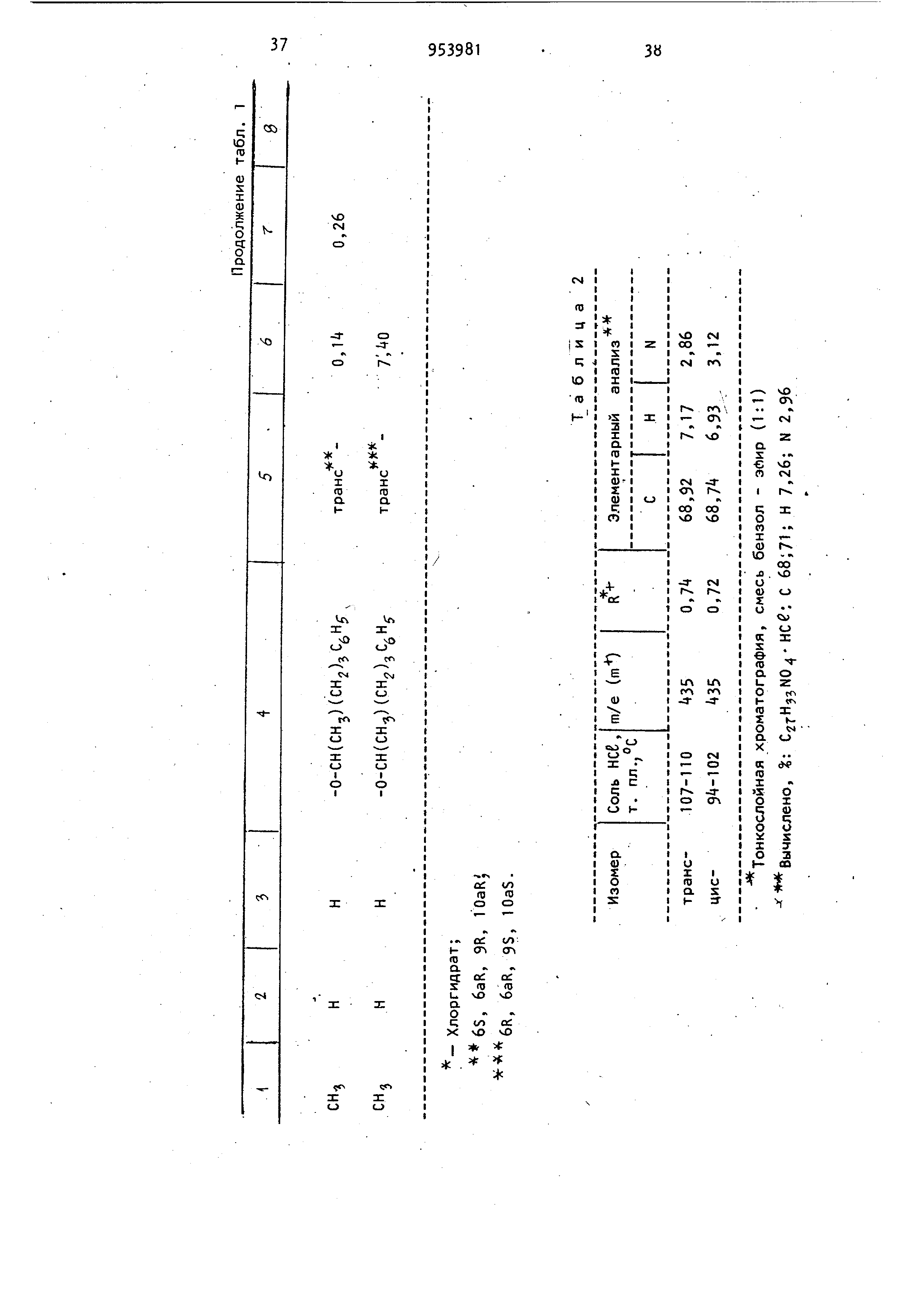
Изобретение относится к получению новых производных бензо(с)-хинолиноб общей формулы где R,- атом водорода или C -Cg-алкил; . R или R.- атом водорода или метил; Z-W - С -С -алкокси, С/|-С -алкилолссифенил или или их фармацевтически приемлемый солей с кислотами, которые обладают ценными фармацевтическими свойствами Известно восстановление ненасыщен ных кетонов до насыщенных литием в жидком аммиаке при 33-7бС l j. Известно восстановление циклических кетонов боргидридами металлов до соответствующих спиртов. Реакцию, как правило, проводят в органическом растворителе, например в тетрагидрофуране , в спирте и других растворитёлях при комнатной температуре или нагревании 2 , а также при охлаждении зЗ Цель изобретения - разработка на основе известного метода способа получения новых производных бензо(с)-хинолинов или их фармацевтически приемлемых солей с кислотами, которые об-, ладают анальгезическими свойствами. Поставленная цель достигается способом получения производных бёнзо(с)-xинoJOИнoв формулы I , заключающимся в том, что соединение общей формулы 395 где R. , Rg, и Z-W имеют приведенные значения, подвергают восстановле нию щелочным металлом в жидком аммиаке и полученное соединение общей формулы О где R, Rg, R и Z-W имеют приведенные значения, подвергают ацилировани а затем восстанавливают боргидридом металла, и целевой продукт выделяют в свободном виде или в виде фармацев тически приемлемой соли с кислотой. Целевые продукты выделяют в виде солей с такими кислотами, как хлористоводородная , бромистоводородная, серная, азотная, фосфорная или в вид цитрата, ацетата, сульфосалицилата, тартрата, гликолата, малоната, малеа та, фумарата, малата, 2-гидрокси-3 -нафтолата, памоата, салицилата, сте арата, фталата, сукцината, глюконата манделата, лактата или метансульфоната .Восстановление соединения общей формулы II осуществляют щелочным металлом , например литием в.жидком аммиаке при 35 80С. Полученное соединение общей форму лы III после а цилирования восстанавливают , предпочтительно боргидридом натрия, в качестве растворителей используют метанол, этанол или воду и реакцию ведут при О-ЗО С, Для повышения селективности реакцию можно проводить при пониженных температурах, вплоть до -70°С. Более высокие температуры способствуют деа тилированию и взаимодействию боргидр да с растворителем. I Анальзические свойства предлагаемых соединений определяют по тестам термического ноцицептивного раздражения , например прижигания хвоста у мышей, или по химическому ноцицептив ному раздражению, например измерению способности соединений подавлять болевой синдром у мышей, индуцированны с помощью фенилбензохинонового ирританта . Методика тестовых испытаний Следующая. Тесты термического ноцицептивного раздражения. а)испытание анальгезического действия на мышей с помощью горячей пластины . К лапкам мышей прикладывают алюминиевую пластину толщиной 3,1 мм, являющуюся регулируемым источником тепла . 250-ваттный инфракрасный рефлектор помещают снизу алюминиевой пластины . Терморегулятор в виде термистера, расположенного на поверхности пластины , регулирует нагрев лампы таким образом , чтобы поддерживать постоянную температуру пластины 57 С. Каждую мышь помещают в стеклянный цилиндр, основанием которого служит алюминиевая пластина , а отсчет времени начинают с момента, когда лапки мыши коснутся пластины. Спустя 0,5 и 2 ч после обработки тестовым соединением наблюдают за первыми конвульсивными движениями одной или обеих задних лапок или до установления 10-секундного интервала между этими движениями. Доза морфина составляет МРЕ 4-,5 мг/кг. МРЕ(МВЭ) - максимальный возможный эффект . б)испытание анальгезического действия на мышей по взмахам их хвостов. Используют регулируемую подачу интенсивного тепла на мышиный хвост. Каждую мышь помещают в металлический цилиндр так, чтобы ее хвост высовы вался из-одного конца цилиндра. Цилиндр этот устанавливают таким образом , чтобы хвост плоско лежал над экранированной лампой, являющейся источником тепла. В начале испытания удаляют алюминиевый экран над лампой, позволяя пучку света проходить через щель и фокусируя его на кончике хвоста . Одновременно включают таймер, определяют время возникновения конвульсивного движения хвоста. Мыши, не подвергавшиеся предварительной обработке , обычно реагируют спустя 3 с после экспозиции света лампы. Максимальный срок для защиты составляет 10 с. Каждую мышь подверагют испытанию спустя 0,5 и 2 ч после обработки морфином и тестовым соединением. Доза морфина составляет 3,2-5,6 мг/кг Тесты химического ноцицептивного раздражения. Подавление болевого синдрома, вызванного фенилбензохиноном. Группы, состоящие из мышей, предварительно обрабатывают путем подкожного или орального введения физиологическим раствором морфина , кодеина или 5.9 тестового соединения. Спустя 20 мин (при подкожном введении) или 50 мин (при оральном введении) каждую группу подвергают внутрибрюшинной инъекции фенилбензохинона, который, как известно, вызывает абдоминальные сокращения . Спустя 5 мин после инъекции возбудителя мышей наблюдают в течение 5 мин на предмет наличия или отсутствия конвульсивных сокращеНИИ . Определяют действие предварительно введенного препарата в дозе МВЭур на подавление конвульсивных сокрещений . Результаты описанных тестов выражают в процентах максимально возможного эффекта (% МВЭ). % МВЭ для каждой группы статистически сопоставляют с % МВЭ контрольного и предварительно обработанного животного. % МВ320 вычисляется следующим образом: о/ UDC, Тестовое время -6 nBJ - Время отсечки контрольное время X 100 . контрольное время С помощью описанных методов определяют анальгезирующуюактивность некоторых предлагаемых и известных соединений. . Анальгезирующая активность, выраженная в единицах МВЭ, т. е. доза, при которой достигается половина воз можного максимального эффекта, приведена в табл. 1. где РВЦ. - фенилбензохинон - возбудитель болевого синдрома; TF - метод конвульсии хвос та; HP - метод горячей пластины (t 9; ос 4DH). Возможность использования этих со единений в качестве препаратов, снижающих давление, определялась у крыс и собак, у которых давление было повышено искусственным способом, до ст тической величины при оральном введе нии препарата в указанных дозах. Их активность в качестве транквилизаторов определяют при оральном вв дении крысам дозами 0,01-50 мг/кг по соответствующему снижению спонтанной моторной активности. Дневная доза для млекопитающих составляет 0,01 100 мг/кг. Использование этих соединений при борьбе с глаукомой, по-видимому, свя зано с их способностью снижать внутр глазное давление. Их действие на 1 внутриглазное давление определяют по тестам на собаках. Испытуемый препарат вводят в глаз собаки в виде раствора систематически или в различные промежутки времени, после чего глаз анестезируют введением хлоргидрата тетрацина (1/2%-ный, 2 капли). Спустя несколько минут после такой местной анестезии, измеряют внутриглазное давление механическим тонометром. Испытываемое соединение обычно ис- пользовали в виде раствора, например следующего: испытуемый препарат 1 мг, этанол 0,05 мл, туин 80 (полиоксиалкиленовое производное сорбитанмонсо-; леата) и физиологический раствор (до 1 мл) или в виде более концентрированного раствора, где ингредиенты присутствуют в количестве 10 мг, 0,010 мл. 100 мг и 1 мл соответственно. Для людей можно использовать концентрации препарата от 0,01 до 10 мг/кг. Активность соединений в качестве диуретиков определялась на крысах. Для использования соединений в качестве анальгезирующих средств применялись те же дозы. При м е р 1.. d,1-5,6,6a,7,10, 10а-Гексагидро-1-гидрокси-6 3-метил-3- (2-гептилокси)бензо(с)-хинолин-9 (8Н)-он. Суспензию d, 1-5,6,6а,7-тетрагидро-1 -гидроксй-6 -метил-3- (2-гептилокси )бснзо(с)-хинолин-9(8Н)-она (1,0 г, 2,91 моль) в тетрагидрофуране (20 мл) по каплям добавляют через дополнительную воронку в интенсивно перемешивае 1Й раствор лития (0,1 г) в жидком аммиаке (75 мл, перегнанный через таблетки гидроокиси калия). Дополнительную воронку прЪмывают тетрагидрофураном (10 мл). Смесь перемешивают в течение 10 мин и затем твердый хлорист тый аммоний добавляют для уничтожения синего цвета. Избыточному количеству аммония дают возможность испариться и остаток выливают в воду (100 мл) и этилацетат (50 мл). Слой этилацетата отделяют и водную фазу экстрагируют этилацетатом (2 х 50 мл). Соединенные экстракты промывают солевым раствором , сушат (N9804) и концентрируют при пониженном давлении до получения коричневого полужидкого продукта (1,35 г). Тщательное растирание маслянистого продукта в смеси пентан и эфир (1:1) приводит к получению свет195 ло-коричневого твердого вещества (0,884 г), т. пл. 130-138°С. Указанную процедуру повторяют, ис пользуя 1,84 г (5,36 ммоль) бензо(с -хинолин-9-он-реагента,,0,184 г лития, 140 мл жидкого аммония и 45 мл тетрагидрофурана . Остаток (2,1 г), оставшийся после выпаривания аммония, раст воряют в бензоле и ВВОДЯТ в хроматографическую колонку ( х б1 см) с силикагелем (250 г). Колонку промывают объемом дегазированного бензола равным объему колонки, и затем 1700м дегазированной смеси бензол - эфир (9:1). Продолжение элюирования (1100 мл) приводит к получению яркокрасного элюента , который концентрируют до светло-пурпурного твердого соединения (580 г) при пониженном дав лении и растирании в смеси бензол эфир (1 :1). Получают 370 мг твердого соединения с т. пл. 154-156 С. Его хранят в атмосфере азота в темноте. Выделенное вещество представляет собой смесь цис- и транс-изомеров целевого соединения; rh/e-345 (m) . Пример 2. Изомерные 5,6,6а, 7,10,1Оа-гексагидро-1-ацетокси-6 J-ме тил-3-(2-гептилокси)бензо(-с)-хинолин -9(8Н)-оны. 2,2 мл пиридина добавляют к суспен зии 5,6,6а ,7,1 О,1Оа-гексагидро-1-гидрокси-6 В-метил-3-(2-гептилокси)бензо (с)-хинолин-9(8Н)-она (222 мг, 0,642 ммоль) в уксусном ангидриде (2,2 мл) в атмосфере азота. Смесь перемешивают в течение 1,5 ч при комнатной темпераутре и затем выливают в лед (50 мл). Смолу выделяют и экстрагируют эфиром (З х 50 мл) и соединенные экстракты промывают сначала водой (4 X 50 мл), а затем солевым раствором (1 X 60 мл). Полученный экстракт сушат (MgSO) и выпаривают при пониженном давлении до получения красного масла (250 мг). Масло растворяют в минимальном количестве горячего эфира и вводят в колонку с силикагелем (45 г), уплотненную и промытую смесью пентан эфир (3:1). Колонку промывают смесью пентан - эфир (3 х 1 ,200 мл) . Элюирование продолжают и собирают фракции по 10 мл каждая. Фракции 22-32 соединяют и концентрируют до получения пенообразного соединения (113,5 мг), которое кристаллизуют из петролейного эфира в виде белых кристаллов, т. пл. П2-114°С. Фракции 33-35 также соединяют и концентрируют до пенообразного соединения (89,7 мг), которое перекристаллизовывают из петролейного эфира в виде белых кристаллов, т. пл. 78824 . Продукты являются изомерными моноацетилированными соединениями. Пример 3. d,l-5,6,6a,7,10, 1 Оа-Гексагидро-1 -ацетокси-6 3 -метил-3- (2-гептилокси)бензо(с)-хинолин-9 ( ан)-он. Повторяют процедуру примера 1, однако используют удвоенное количество реагентов. Полученный продукт 22,2 г затем непосредственно ацетилируют по методике примера 2, в результате чего получают 2,35 г ацетилированного продукта . Этот продукт тщательно перетирают в смесь пентан - эфир (3:1) до получения рыжевато-коричневого твердого вещества (905 мг), которое при дальнейшей перекристаллизации из этанола дает 404 мг светло-коричневых кристаллов с т. пл. 112-113,5°С. Маточные растворы, из которых бы- ли выделены упомянутые соединения, объединяют и концентрируют. Остаток растворяют в минимальном количестве смеси бензол - эфир - хлористый метилен (1:1:1) и вводят в колонку с силикагелем (2б5 г), элюированную смесью петролейный эфир - простой эфир (3:1). Вначале элюирование осуществляют 2-мя л смеси петролейный эфир - простой эфир (3:1), а затем 1,5 л смеси петролейный эфир - эфир (2:1) и 2 л смеси петролейный эфир эфир (1:1). Фракции 2-11 (по 50 мл каждая) элюата из системы растворителя 1:1 собирают и концентрируют при пониженном давлении до получения пенообразного продукта (496 мг). После перекристаллизации из петролейного эфира получают белые кристаллы с т. пл. 100-113°С (410 мл). После перекристаллизации из смеси этанол води (1:1) получают d, 1-транс-5 ,6, ,1 0,1 Оа-гексагидро-1 -ацетокси-6 (3 -метил-3- (2-гептилокси)бензо(с)-хинолин-9 (8Н)-он с т. пл. П1-П2°С; т/е-387 (т+). Элементный анализ. Вычислено, %: С 71,629; Н 8,58; N3,61. СгзНззНО. 9 Найдено, I: С 70,95; Н 8, N 3,58. Фракции 12-18 и 19-27 по 50 мл .каждая собирают и концентрируют до получения соответственно 273 мл и 208 мл ацетилированного продукта. Кристаллизация остатка фракций 19из петролейного эфира приводит к п лучению белых кристаллов (119 мг) т. пл. 84-88 С.-После перекристалл зации из смеси этилацетат - гексан (1:10) получают d, 1-цис-5,6,6а. ,7, 10 , 1 Оа Р -гексагидро-1 -ацетокси-3- (2-гептилокси) -6 3 -метилбензо(с) -хинолин-9 (8Н)-он с т. пл. 8 -86°С Элементный анализ. Вычислено, С 71,29; Н 8,58; 3,61. C23ri-j N04 Найдено, %. С 71,05; Н 8,18; Аналогичным образом получают из соответствующих реагентов следующи соединения: d,l-TpaHc-5,6,6a р,7,10,10с6 -Ге сагидро-1 -ацетокси-бР) -метил-3- (5нил-2-пентилокси )бензо(с)-хинолин (8Н)-он, т. пл. 80-82 0; (т-). Элементный анализ. I: С ,5; Н 7,64; Вычислено, N 3,22. С27НззМ04. С 7t, Н 7,73; Найдено, -И N 3,38. d, 1-цис-5,6,6з 3 ,7,10,10а| -Гек гидро-1 -ацетокси-б -метил-З- (5-фен -2-пентилокси) бензо(с)-хинолин-9(8 -он, т.пл. 172-17б-С в виде хлорги рата, полученного из смеси ацетонэфир . Элементный анализ. Вычислено, С 68,71; Н 7,26; 2,97. Найдено, /;: С 68,86; Н 7,16; 2,97. d,1-транс-5,6,6а р ,7,10,10ао6-Г сагидро-1-ацетокси-3-(5-фенил-2-пе тилокси) -6;3-пропилбензо (с) -хинолин ( 8Н)-он, т , пл. 79-80°С; т/е - (т). d,l-циc-5,6,6a. ,7,10,10ар -Гек сагидро-1-ацетокси-3-(5-фенил-2-пе тилокси)-6р)-пропилбензо (с)-хинолин ( 8Н)-он, т. пл. 144-146.°С в виде ли нее,; т/е-463 (т-) . d-циc-5.b,6a/,7,10,10а/ -Гексагид-3 (5 Фенил-г-пентилокси; о-1-ацетокси бр-метилбензо(с)-хинолин-9(5Н)-он, . пл. (с разложением) в виде оли хлористоводородной кислоты; И2р5 +22,8° (с 0,31 СН.ОН); /e-t35 (m). Элементный анализ. Вычислено, %: С 8,71;Н 7,26; 2,96. C27H33N04- нее Найдено, %: С 69, Н 7,30; 3,01. d-TpaHC-5,6,6а(3,7,10,1 Оар-Окси-1 ацетокси-3- (5-фенил-2-пентилокси)бр-метилбензо (с)-хинолин-9(8Н)-он, . пл. 90-95°С (с разложением) в виде оли хлористоводородной кислоты; 12з.. 1-3 о ltd I п 1Э ru ли) . Е- 178,+6 (с 0,13, СН ОН); т/е435 (т-) . Элементный анализ. Выислено, %: С 6S,71; Н 7,26; N 2,97. С27НззМ04-нее Найдено, %: С 70,20; Н 7,23; N 3,07. 1-цис-5,6,6ар,7,10,Юар-Гексагидро-1-ацетокси-3- (5-фенил-2-пентилок-. си)-6р-метилбензо(с)-хинолин-9(8Н)-он, т. п/1. 90-92 С в виде хлоргидрата; 20,5° (с ± 0,19 ). Элементный анализ. Вычислено, 1: С 68,71; Н 7,26; N 2.97. С27Нзс}М04 : е 68,92; Н 1, Найдено, N 3,09. 1-транс-5,6,6ар,7,1 О,Юар-Гексагидро-1 -ацетокси-З- (5-фенил-2-пентилокси )-6й-метилбензо(с)-хинолин-Э(8Н) - -, л« -он, т. пл. 92-96 е в виде хлоргидри25 - да. -79,00 (с 0,10 еН.ОН); т/е - (т-) . т/Р - , fm+l Элементный анализ. I: е 68,71; Н 7,26; Вычислено, 2,97. не 27 : е 68,67; Н 1, Найдено, N 3,02. П р и.м е р k,. d, 1-5,6,бар,7,10, 1Оа-Гексагидро-1-ацетокси-б -метил-3- (5-фенил-2-пентилокси)бензо(с)-хинолин-9 (8Н)-он, транс- и цис-изоАммиак (1150 мл) вносят непосредственно в высушенную на пламени трехлитровую трехгорлую колбу (в атмесфере азота) ,снабженную механической мешалкой , 300-миллилитровой капельной воронn953
кой и хладагентом (твердый ацетон ). В нее помещают литиевуй проволоку (2,2 г., нарезанную на кусочки), .Немедленно появляется характерная синяя окраска. К перемешиваемому синему раствору при -78°С добавляют 3,1-5 ,6,6а, 7-тетрагидро-1 -oкcи-6|5-мeтил-3- Г5-фенил-2-пентилокси)бензо (с) -хинолин-9 (8Н)-он (21,5 г), растворенный в тетрагидрофуране (250 мл) по каплям в течение 10 мин. После дополнительного 10-минутного перемешивания при -78 С реакционную смесь резко охлаждают дополнительным количеством хлористого аммония (20 г). Затем охлаждение прекращают и реакционную смесь медленно нагревают на паровой бане до полного испарения аммиака. Затем добавляют этилацетат (2 л), воду (1 л) и смесь перемешивают в течение 10 мин. Затем разделяют слои и водную фазу еще раз экстрагируют этилацетатом (500 мл), Объединенные органические экстракты промывают еще раз водо1/ (1 л), сушат (МдЗОи) и концентрируют до коричневого полутвердого состояния (28 г). Полученный остаток немедленно растворяют в хлористом метилене (200 мл) добавляют -димеТиламинопиридин (7,5 г, 0,0б1 моль) и триэтиламин (6,1 г, 0,061 моль) и перемешивают раствор, охлажденный до 0°С (хладагент лед - вода) в атмосфере азота. Затем при интенсивном перемешивании за 5 мин прикапБшают уксусный ангидРИД (6,1 г, 0,0б1 моль).
После дополнительного перемешивания в течение 30 мин при реакционную смесь разбавляют этилацетатом (2 л), ;водой (1 л) и перемешивают еще 10 мин. Водную смесь еще раз экстрагируют водой и объединенные органические экстракты последовательно промывают водой (4 х 1 л), насыщенным бикарбонатом натрия (1 х 1 л) / солевым раствором (1 х 1 л), сушат (Мд$0;(|).и концентрируют до светлокоричневого масла (27 г). Остаток очищают на хромагографической колонке с 1,8 кг силикагеля, используя в качестве элюирующего растворителя смесь бензол - этилацетат. Собирают фракции (по 1 л). После элюирования менее полярных примесей фракции 16-20 соединяют и выпаривают до остатка, который затем кристаллизуют из смеси эфир - петролейный эфир, в результате чего получают 5,6 г (22,if) транс12
изомера целевого продукта. Фракции 21-27 соединяют и получают 7,6 г (31,8) смеси транс- и цис-изомеров, а фракции 28-32 соединяют и получают 2,5 г (Ю,) цис-изомера целевого соединения.
Хаоактеоистики транс-изомера: т/е - 35 (т-). НЯМР-спектр (60 мгГц)0(осе (ч. на млн.); 7,24 (с. 5Н, ароматика ) ; 5,97 (с. 2Н, мета HS); 2,28 Дс. ЗН, ); 1,23 д. ЗН, СН,СН1 ,20 (д. ЗН, CH -CH-N); 1,3-4,5 (м. 17Н, остальные протоны); т. пл. 8183°С .
Элементный анализ.
Вычислено. I: С 74,45; Н 7,64; N 3,22.
С2 .
Найдено, %: С 74,15; И 7,68; N 3,18.
Характеристики цис-изомера: т/е435 (т-); т. пл. соли НС.е 172-17б°С (с разложением) из смеси ацетон - . простой эфир).
Элементный анализ.
Вычислено, %: С 68,71; Н 7,26; N 2,97.
С2тНз Н04 -.неб.
Найдено, %: С 68,86; Н 7,16; N 2,97.
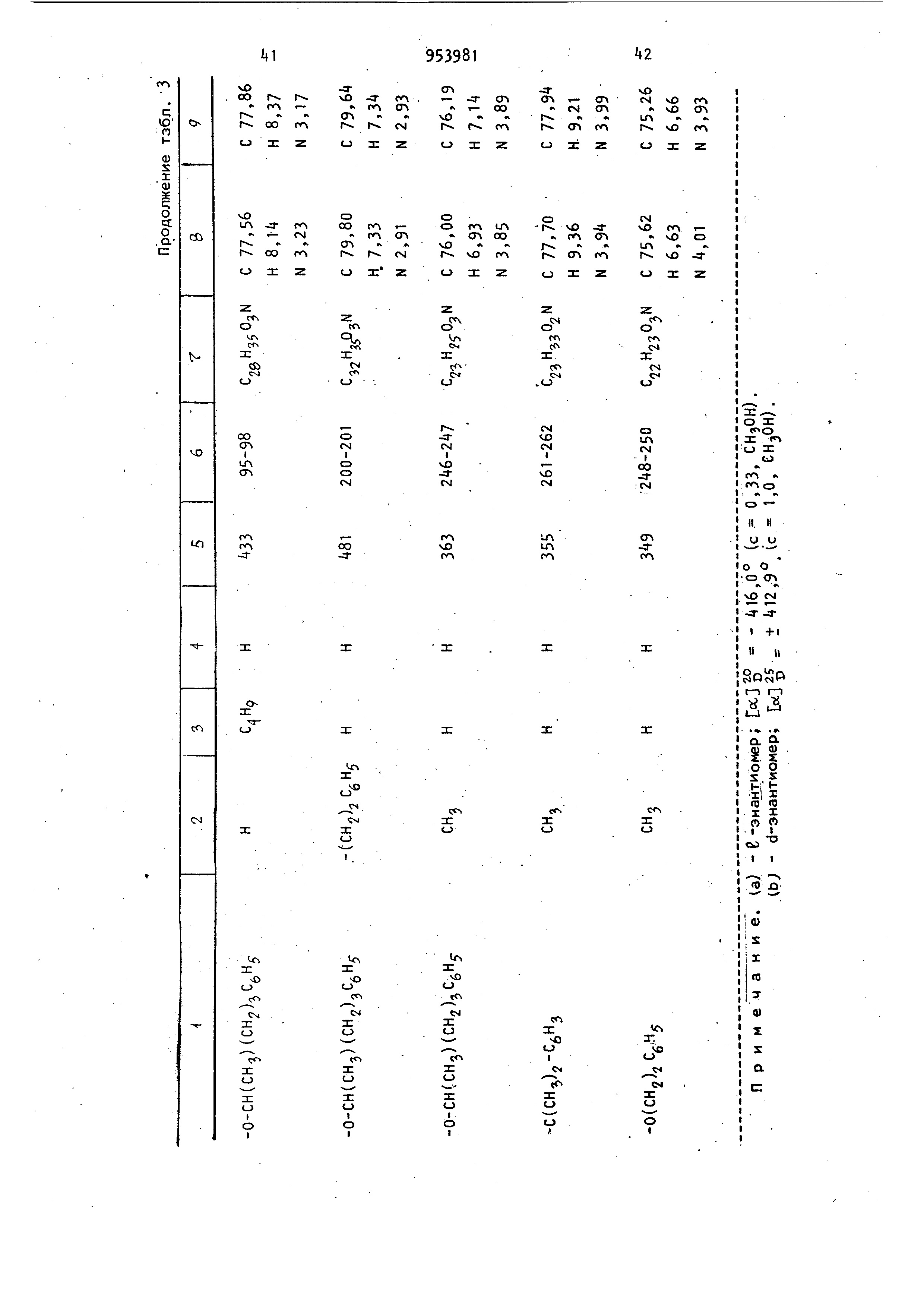
Пример 5. d,1-3 6,6а,7,10, 1Оа-ГексагидрЬ-1-ацетокси-6Й-метил-3- (4-фенилбутилокси)бензо(с)-хинолин-9 (8Н)-он, цис- и транс-изомеры.
В соответствии с процедурой примера 1 d, 1 -5,6,6а,7,10-тетрагидро-1-окси-6 (метил- (4-фенилбутокси)бензо (с)-хинолин-9(8н)-он вначале восстнавливают литием в аммиаке, а затем ацетилируют до получения нужного гексагидро-изомера. Выделение на хроматографической колонке с силикагеле с использованием простого эфира в качестве элюента приводит к получению вначале d,1-транс-5,6,ба,7,Ю,lOq-гексагидро-1-ацетокси-6р-метил-3 -(4-фенилбутилокси)бензо(с)-хинолин-9 (.8Н)-она, т. пл. 155-15бС, после перекристаллизации из смеси этилацетат - пентан (1:5).
Элементный анализ.
Вычислено, I: С 74,Об; Н 7,4Г; N 3,32.
Найдено, %: С 74,00; К 7,47; N 3,22.
т/е - 421 (т). 1395 Дальнейшая очистка последних фракций на хроматографической колонке с силикагелем с использованием.в качестве элюирующего растворителя смеси циклогексан - эфир (1:1) приводит к получению изомерного d,1-циc-5,6,6ap 7, Ю, lOafJ -гексагидро-1-ацетокси-6( -метил-3-(-Фенилбутилокси)бензо(с)-хинолин-9 (8Н)-она с т. пл. 95-9б°С после перекристаллизации из смеси . этилацетат - гексан (1:5) ; / - Л21 (т).. Элементный анализ. Вычислено, %. С 7«,08; Н 7,+1; N 3,32. Найдено, %: С 73,95; Н 7,51; N3,31. П р и м е р 6. d,l-5,6,6a,7,10, 1Оа-Гексагидро-1-ацетокси-3-(2-гептилокси )-бензо(с)-хинолин-9{8Н)-он. Раствор d, 1-5,6,6a,7-тeтpaгидpo-1-окси-3- (2-гептилокси)брнзо(с)-хинолин-9 (8Н)-она (9,0 г) в тетрагидро фуране (100 мл) прикапывают к быстро перемешиваемому раствору лития (0,1 г) в жидком аммиаке (750 мл). Во время прикапывания добавляют допо нительно 0,1 г лития по частям для сохранения синего цвета. Смесь перемешивают 10мин, затем синий раствор обесцвечивают, добавляя избыток хлористого аммония. Избыточному аммиаку дают возможность испариться, а остаток выливают в смесь воды и этилацетата Органический слой отделяют и водную фазу дважды экстрагируют этил ацетатом. Соединенные экстракты промывают водой солевым раствором, суша ( MgSO) и выпаривают до получения 8,5 г сырого продукта в виде коричневого твердого соединения. Неочищенный продукт (8,0 г) суспендируют в хлористом метилене (48 м при 0°С и обрабатывают N,N-диметил- -аминопиридином (3,2 г) и триэтил амином (3,72 мл). Затем добавляют уксусный ангидрид (2,52 мл) и полученную смесь перемешивают в течение 30 мин при 0°С. Ее разбавляют хлорис тым метиленом (300 мл), выделяют слой хлористого метилена,промывают водой (3 X 150 мл), насыщенным бикар бонатом натрия (1 X 100 мл), солевым раствором (1 X 100 мл) и сушат (MgSO После выпаривания хлористого мети/ieна получают 13,7 г темного масла, которое очищают на хроматографичесой колонке с силикагелем (450 г). олонку промывают последовательно месью эфир - гексан (1:1), эфир ексан (2:1) и эфиром. Собирают фрак ии по 18 мл. Фракции 176-22 соедияют и концентрируют до масла, кото ое перекристаллизовывают из гексана получают 3,2 г (32%) транс-изомера елевого соединения в виде кристал- ов светло-желтого цвета; т. пл. 3,5-684; т/е - 373 (т+). ИК-спектр (КВг): 5,82 (кетон ); 5,75 (сложный эфир ); 2,95 (NH)|U. ракции 2 6-290 соединяют и концентируют до получения 0,55 г (5) сырого цис-изомера целевого соединения в виде масла. В дальнейшем его очищат описанным образом на хроматограической колонке и получают чистый цис-изомер в виде масла; т/е - 373 ш-). ИК-спектр (СНСВз): 5,82 (кетон ); 5,67 (сложный эфир );2,92 (NH)y. Элементный анализ. ., Вычислено, %. С 70,75; Н 8,37;, N3,75. . C22H3iN04 Найдено, %: С 70,90; Н 8, N3,69. Фракции 225-245 соединяют и выпаривают до получения 2,69 г (26) смеси цис- и транс-изомеров, которые выделяют по описанной методике. Из d,1-5,6,6а,7-тетрагидро-1-окси-3- (5-фенил-2-пентилокси)бензо(с)-хинолин-9 (8Н)-она таким же способом получают следующие соединения: d, 1 -транс-5,6,6a{i, 7-10,10аоС-Гексагидро-1--ацетокси-3- (5-фенил-2-пентилокси )бензо(с)-хинолин-9(8Н)-он в виде масла mZ.e - 421 (m) . Элементный анализ. Вычислено, % С 74,08; Н 7,41; N З.,32. С2бНз «04 Найдено, % С 74,16; Н 7,59; N 3,20. d, 1-цис-5,6,,10,10ар.-Гексагидро-1-ацетокси-3- (5-фенил-2-пентилокси )бензо(с)-хинолин-9(8Н)-он в виде масла, т/е 42Г(). Элементный анализ. Вычислено, % С 74,08; Н 7,41; N 3,32. CgeH -iNOii Найдено, % С 74,04; Н 7,49; N 3,54. d,1-5,6,6а,7-Тетрагидрр-1-окси-бЛ -метил-3.(5 Фенил-2-пентилокси)бензо (с)-хинрлин-9(8Н)-он превращают вd ,1-транс-5,6,бар,7,10,1Оэй-гексзгид ро-1 -ацетокси-6с4.-метил-3- (5 фенил-2-пентилокси )бензо(с)-хинолин-9(8Н)-он и d, l-циc-5,6,6ap,7,10,10a/ -гeкca гидpo-1-aцeтoкcи-6o;-мeтил-3- (5-фенил -2-пентилокси)-бензо(с)-хинолин-9 (8Н) -QH. Изомерные продукты переводят в их соли хлористоводородной кислоты по способу, описанному в общей методике получения солей; Характеристики полученных солей приведены в табл. 2. Используя методики примеров 1-6, получают соединения, представленные в табл. 3. П р-и м е р 7- d, 1-транс-5,6,6af 7,10,1 ОаоС-Октагидро-1 -ацетокси-9-окси-6р-метил- (2-гептилокси)бензо(с)-хинолин . К перемешиваемой суспензии ,150 мг :(0,39 моль) dJ-TpaHC-5,6,6af,7,10, 10ао6-гексагидро-1-ацетокси-6/3-метил-3- (2-гептилокси)-бензо(с)-хинолин-9 .{8Н)-она в этаноле (10 мл) при 0°С добавляют 40 мг боргидрида натрия. Спустя 0,5 ч реакционную смесь влива ют в смесь ледяной уксусной кислоты (50 мл) и эфира (75 мл). Пос ле выделения эфирного слоя водную .фазу экстрагируют эфиром (2x50 мл) Соединенные эфирные фракции промывают последовательно водой (2 х 50 мл) насыщенным бикарбонатом натрия (1 х мл), солевым раствором (1 х X 65 мл), сушат (MgSO), фильтруют и концентрируют при пониженном давле НИИ до получения 156 мг белого пенообразного соединения, содержащего смесь аксиального (меньшая часть) и экваториального (оснод ная часть) cпиpJoв - транс-5,6,.8,9,1,0,10а -октагидро-1-ацетокси-9-окси-б|з-метил -3-(2-гептилокси)бензол(с)-хинолин; т/& -389 (т ). ИК-спектр () : 5,72р (карбонил сложного эфира). ЯМР-спектр (60 мгГц), дает характеристический синглет на 2,23 .(ч. на млн.) для метильной группы ацетата. Меньший и основной изомеры выделяют следующим образом: 180 мл спиртов а,1-транс-$,6,6а,7,8,9,10,10асзб-октагидро-1 -ацетокси-9-окси-6(-метил-395 16 -(2-гептилоксиУ-бензо(с)-хинолина вводят в колонку, содержащую 15 г силикагеля , и промывают растворителем, представляющим собой смесь 3 ч.бензола и 1 ч. эфира. Собирают фракции. Фракции 6-8 соединяют и концентрируют при пониженном давлении до получения 13 мг d,l-TpaHc-5,6,6af3,7,8,9,10,10ao -октагидро-1 -ацетокси-9о6-окси-р-метил -3-(2-гептилокси)бензо(с)-хинолина. Фракции 11-16 соединяют и концентрируют до получения 83 мг d,J-TpaHc-5 ,6,6ар,7,8,9,10,10а(-октагидро-1-ацетокси-9р-окси-6р-метил-3- (2-гептилокси )бензо(с)-хинолина. Таким же способом из соответствующих реагентов получают следующие соединения: d,1-TpaHc-5,6,6ap,7,8,9,10,10ao(;-OKтагидро-1 -ацетокси-9-окси-6)3-мётил-3- (5-фенил-2-пентилокси)бензо (с)-хинолин; (); ИК-спектр (СНСЮ; 5,70 У (карбонил сложного эфира); превращают в хлоргидрат с выходом твердого продукта, т. пл, 188-190°C; После перекристаллизации из смеси ацетон-метанол - эфир (25:1:100) получают аналитический образец 9р-спирта с т. пл. 193-19 С. Элементный анализ. Вычислено, %: С 68,2; Н 7,66; N 2,96.. с,27Нзь- о. нее Найдено, %: С 68,«8; Н 7,70; N 2,89. После взаимодействия с метансульфонатом (с помощью метансульфокислоты в дихлорметане) получают твердый продукт , который после перекристаллизации из этилацетата дает белые кристаллы с т. пл. ПО-11й°С. ИК-спектр (CHCej): 2,95; 3,70; 3,95; 5,60; 6,06; 6,19; 6,27/li . Элементный анализ. Вычислено, %: С 63,02; Н-7,37; N 2,63. Найдено, %: С 62,90; Н 7,31; N 2,7. d,l-циc-5,6a,6|i,7,8,9,10,10att: -Октагидро-1-ацетокси-9-окси-6р-метил-3- (5-фенил-2-пентилокси)бензо(с)-хинолин; 1П/е-437 (т). 1-транс-5,6,,8,9,10,10аоб-Октагидро-1 -ацетокси-9р-окси-6|3-метил-3- (5-фенил-2-пентилокси)бензо(с)-хинолин ,.т. пл, 120-125°С (с разложением ) в виде хлоргидрата. foilj 17953 -98,57 (с 0,351, СН,ОН); m/e-A37 Элементный анализ. - Вычислено, %: С 68,iZ; Н 7,66 N 2,96. С27Нз5МОа нее С 68, Н 7,68; Найдено, %: N 3,00. d-TpaHc-5,6,6ap,7,8,9,10,1U-OKTaгидро-1 -ацетокси-9р-окси-6р-метил-3- (5-фенил-2-пентилокси)бензо(с)-хинолин , т. пл. 120-125°С (с разложением) в виде хлоргидрата.М + 99,33° (с 0,30, ) ; .т/е - 437 () . Элементный анализ. Вычислено, %: С 68, Н 7,66-; N 2.96. C27H35N04 С 68,Л1; Н 7, Найдено, % N 2,95. Аналогичным способом из соответствующих реагентов получают соединения, приведенные в табл. 4 и 5При м е р 8. d,1-TpaHc-5,6,6aj 7,8,9,10,1 OaoL-Октагидро-1 -ацетокси-Э -окси-6р-метил-3- (5-фенил-3-пентил окси)бензо(с)-хинолин. К 200 мл метанола в атмосфере азоfa , охлажденного в (5ане ацетон -су-: ,;ой лед до около , добавляютборгидрид натрия (7,57 г, 0,2 моль). Полученную смесь перемешивают около 20 мин до растворения большей части или всего боргидрида натрия. Раствор d -TpaHC-5,6,6ap 7,83JO ,0 -гаксагидро-1-ацетокси-6р-метил-3- 5-фенил-2гпенти локси Ьензо (с) -хинолин-9(8Н)-она (8,71 г, 0,02 моль) в тетрагидро фуране (88 мл) охлаждают до -50°С, а затем прикапывают за 5-10 мин раствор боргидрида натрия. Реакционную смесь перемешивают при температуре около -70°С в течение 30 мин, а затем выливают в смесь воды (1000 мл), содержащей хлористый аммоний (45 г, ;0,80 моль), измельченный лед (250 мл) |и этилацетат (250 мл). Слои разделяют а водную фазу экстрагируют этилацетатом (3 X 200 мл). Соединенные экстракты промывают водой (1 х 100 мл) и сушат (MgSO). Высушенный экстракт охлаждают до около 5°С. Затем по каплям добавляют раствор этилацетата (15 мл), НС1 1,5 и.(0,025 моль) в
течение 15 мин. При перемешивании сме-55 N 2,73,
си при 0-5 С в осадок выпадает хлоргидрат целевого соединения. Затем смесь перемешивают еще в течение
Из соответствующих реагентов аналогичным способом получают соединения , представленные в табл. 7. 18 олучаса, фильтруют и полученную соль ушат при 25 С и 0,055 мм рт.ст. до получения 6,378 г (67,3) продукта с т. пл. 195-198°С (с разложением). Используя методику примера 2, получают соединения, представленные в табл. 6. , . Пример 9. d,l-uHc-5,6-,, 7,8,9,10,1 Оа-Октагидро-1 -ацетокси-9/ -гидрокси-6р-метил-3- (5-фенил-2-пентилокси )бензо(с)-хинолин. К раствору d,l-циc-5,6,6a(,7,0, 1 Оар -гексагидро-1 -ацетокси-6| -метил-3-{5-фенил-2-пентилокси )бензо(с)-хинолин-9 (8Н)-она (1,0 г, 2,29бммоль) в сухом тетрагидрофуране (100 мл) при добавляют при перемешивании втор.-бутилборгидрид калия (4,6 мл, 0,5 М, 2,29б ммоль) по каплям за 5 мин. Реакционную смесь перемешивают еще 30 мин при -78.°С и затем выливают при перемешивании в раствор уксусной кислоты (250 мл) и эфира (500 мл), предварительно охлажденных до ... Образующиеся слои разделяют и водный слои экстрагируют дополнительным количеством эфира . (250 мл). Соединенные эфирные-экстракты промывают последовательно- водой (2 X 250 мл), насыщенным раствором бикарбоната натрия (1 х 250 мл) и солевым раствором (1 х 250 мл), сушат (MgSO) и концентрируют в вакууме до получения желтого масла (1,4 г). Неочищенное масло хроматографируют на . ; - силикаГеле (100 г), используя в каче, ii . . стве элюирующего растворителя смесь бензол - эфир (3:1). После элюирова ,ния менее полярных примесей выделянэт в виде прозрачного .мае-;, ла целевой продукт (700 мг). растворяют в простом эфире (35 мл) и обрабатывают эфиром, насыщенным газоп образным НС8, для получения соли хлористоводородной кислоты целевого.соединения (448 мг), т.пл. 115-124 0 (после перекристаллизации из смеси эфир - хлороформ). Молекулярный ион 43б; ИК-спектр . (КВг): Ш (сложный эфир ). Элементный анализ. Вычислено. %; С 68,41; Н 7,66; N 2,96. С тНзз Оц-НС Найдено, %: С 68,52; Н 7,91; Элементный, анализ. Вычислено, %: С 68,88; Н 7,85; N2,87. . . С2 НзтМ04- НС1 Найдено, %: С 68,2; Н 7,78; N 2,75. П р и. м е р 10. d, 1-транс-5 ,6, 6а|,7,8,9,10,10ай-Октагидро-1 -ацеток си-9-окси-5 метил-3(5 Фенил-2-пентилокси )бензо(с)-хинолин. Формальдегид (1,1 мл) водного раствора добавляют к раствору d, 1 -транс-5,6,6а/3,7, Ю, 10ао -гексагидро-1-ацетокси-З (5 фенил-2-пентилокси )бензо{с)-хинолин-9{8Н)-она в ацетонитриле (15 мл) при комнатной температуре с последующим добавлением цианборгидрида натрия (0,2б2 г). Реакционную смесь перемешивают в течение 1 ч, за это время рН поддерживают нeйtpaльным, добавляя по мере надобности уксусную кислоту . К реакционной смеси добавляют дополнительное количество цианборгид рида натрия (0,2б2 г) и метанол (15 мл), затем ее подкисляют до рН 3 перемешивают в течение 2 ч и концент рируют при пониженном давлении до масла. Масло разбавляют водой 50 мл рН устанавливают с помощью водной гидроокиси натрия и щелочную смесь экстрагируют эфиром (З х 200м Соединенные эфирные экстракты промывают солевым раствором, сушат ( и концентрируют при пониженном давле НИИ до получения прозрачного масла. Масло затем растворякзт в смеси 50 эфир гексан и вводят ,в хроматографическую колонку с силикагелем. Вначале колонку промывают смеСЬЮ эфир - гексан, а затем соответст венно 60-ти, 70-ти и смесью эфир - гексан. Элюат исследуют с пом шью тонкослойной хроматографии (смес эфир 10 ч,- гексан 1 ч.). Первым . выделяют d, 1-транс-5,6,6ар j7,10, Oaa -гeкcaгидpo-1-aцeтoкc.и-5 мeтил-3(5-фeнил-2-пeнтилoкcи ),бeнзo(c) -хинолин -9(8Н)-он (0,125 г,);тЬ7е - 435 (т-). Элементный анализ. Вычислено, %: С 7,5; Н 7, N 3,22. C27H33N04 Найдено, I: С 7,06; Н 7,77; N 3,31. Вторым продуктом .выделяют -диастереомер целевого соединения (25 г);т/е - 437 (пт). 9 20 Элементный анализ. Вычислено, I: С 7,11; Н 8,Об; N 3,20. С2гНз5М04 Найдено, %: С 73,96; Н 8,34; N 3,00. Третьим продуктом выделяют 9р-окси-диастереомер целевого соединения (0,7 г); т/е - 437 (fP) . Элементный анализ. Вычислено, %: С 74,11; Н 8,Об; N 3,20. С 7Нз5М04 Найдено, %: С 73,5б; Н 7,86; N 3,21. Аналогично d, 1-транс-5,6,6а/,7, 1 0,1 Оаоб-гексагидро-1 -ацетокси-3- (2-гептилокси )бензо(с)-хинолин-9(8Н)-он обрабатывают цианборгидридом натрия, в результате чего получают: d, 1-транс-5,6, бар, 7,10,1089:-Гексагидро-1-ацетокси-5-метил-З- (2-гептилокси )бензо(с)-хинолин-9(8Н)-он в виде масла; т/е-387 (т ) ; ИК-спектр (CHClj): 5,80 (кетон ); 5,65 (, в сложном рфире)К. Элементный анализ. Вычислено, %: С 71,29; Н 8,58; N 3,61. С2зНззМ04 Найдено, %: С 70,78; Н 8,71; N 3,27. d, -транс-5,6,бар, 7,8,9 ,1 О , 1 Oaot -Октагидро-1 ацетокси-9р-гидрокси-5-метил-3 (2-гептилокси)бензо fc)-хинолин в виде масла; т/ё-389 (пТ) ИК-спектр (СНС1):2,80 (О-Н) ; 5,70 ( сложный эфир) , Элементный анализ. Вычислено, : С 70,92; Н 9,Об; N 3,60. С2зНз5 04 Найдено,: С 70,5б; Н 8,95; N 3,56. d, 1 -транс-5,6,бар,7,1 О , IOaoi-Гексагидро-1-ацетокси-6р-метил-3- (5 фенил-2-пентилокси )(с)-хинолин-9 (8Н)-он, который превращают в d,1-транс-5 ,6,6аВ ,7,1 0,1 Оао(,-гексагидро-1 -ацетокси-5-метил-6| -метил-3- (5-фенил-2-пентилокси )бензо(с)-хинолин-9 (8Н)-он; d,l-TpaHc-5,6,6ap,7,8,9,10, 1 Оаос-октагидро-1 -ацетокси-9р-гидрокси-5 .-метил-6| -метил-3(5 фенил-2-пентилокси )бензо(с)-хинолин, который выеляют в виде хлоргидрата, т. пл. 163-165°С; т/е-451 (т-.).. Пример П. d, 1-транс-5,6,6aR, 7,8,9,10,10аоС-Октагидро-1-ацетокси2195 -9р)-гидрокси-5-изобутирил-3-(фенил-2-пентилокси )бензо(с)-хинолин. Боргидрид натрия (38 мг, 1,0 ммол медленно добавляют к раствору d,1 -транс-5 ,6,6а,7, Ю, IOaoi-гексагидро-1-ацетокси-5 изобутирил-3 (5 фенил-2-пентилокси )бензо(с)-хинолин-9(8Н) -она (2бО мг, 0,529 ммоль) в абсолют ном этаноле (20 мл) при в атмосфере азота. Реакционную смесь перемешивают в течение 1 ч и затем под кисляют 10%-ной соляной кислотой. Эт нол удаляют отгонкой при пониженном давлении. К оставшемуся раствору добавляют 10 мл воды и проводят экст--ракцию этилацетатом (2 х 50 мл).. Экстракты соединяют, промывают соле вым раствором и затем сушат (MgSOx). После концентрирования в вакууме получают целевое соединение в виде тве дого аморфного вещества (213 мг), которое используют без дальнейшей очистки. Пример 12. d,1-транс-5,6, ,7,10,10ар-Гексагидро-1 -ацетокси-5-aцeтил-6{i-метил-3- (5 Фенил-2-пентилокси )бензо(с)-хинрлин-9(8Н)-он. 3,9 г (0,008 моль) d,l-TpaHc-5 ,6,6ар,7,8,9,10,10ао(-октагидро-1-ацетокси-6р-метил-3- (5-фенил-2-пентилокси )бензол(с)-хинолин-9(8Н)-она растворяют в 20 мл не содержащего спирт хлороформа, полученный раство охлаждают на водяной бане со льдом, после чего добавляют 1 мл пиридина, высушенного над гранулированной гидр окисью калия, затем добавляют 0,95м ( 0,013 моль) хлористого ацетилу, который растворяют в 5 мл хлороформа. гомогенный раствор перемешиваю при нормальной температуре в течени 18 ч. Реакционную смесь переливают 50 мл ледяной воды и дважды экстрагируют хлороформом (порциями по 25 мл). Объединенные органические слои промывают 25 мл насыщенного ра створа бикарбоната натрия, 25 мл во ( ды, 25 мл рассола, сушат над сульфа том магния, фильтруют и выпаривают досуха при пониженном давлении. Очи стку проводят хроматографией (200 г силикагеля Бринкмана, растворитель циклогексан-эфир 3:1) с образованием- 2, 20 г (выход 83,8)целевого соединения . Элементный анализ. Вычислено, I: С 72,90; Н 7,39, N2,80. Ce9H:i NOf Найдено, %.: С 72,б9; Н 7, N 2,19. Аналогичным образом d,l-циc-5 ,6,6а(3|7, ЮаВ-гексагидро-1-ацетоки-6-метил-З- (5-фенил-2-пентилокси) бензо(с)-хинолин-9(8Н)-он превраи(ют в d, 1-цис-5,6,6а,7,10а| -гексагидро- 1-ацетокси-5-ацетил-6р-метил-3- (5-фенил-2-пентилокси )бензо(с)-хинолин -9(8Н)-он; т. пл. 12б-128°С, выход 82. Элементный анализ. Вычислено, %: С 72,90; Н 7,39; N 2,80. Найдено, V С 72,80; Н 7,35; N 2,70. Пример 13. d,1-транс-5,6, бай, 7,10а у;-Гексагидро-5 ацетил-2-пентилокси )бензо(с)-хинолин. Шлам, состоящий из 0, г (0,039 моль) гидрида натрия (полученного промыванием 1,87 г 50 -ного раствора гидрида натрия в дисперсии с минеральным маслом сухим пентаном) в 57 мл диметилсульфоксида нагревают при в течение 2,5 ч. После добавления 15,32 г (0, моль)- трифе-. нилметилфосфоний -бромида реакционную смесь нагревают в течение 2 ч при 60°С. Добавляют раствор, состоящий из 1,86 г (0,004 моль) d,l-TpaHC-5 ,6,6aft,7,10,10асй-гексагидро-Т-ацетокси-5 ацетил-6-метил-3-( 5 Фенил-2-пентилокси )бензо(с)-хинолин-9(8н)-она в 57 мл диметилсульфоксида и реакционную смесь переливают в 200 мл смеси вода - лед, содержащей 20 г бикарбоната натрия. Полученную смесь дважды экстрагируют этилацетатом (порциями по 50 мл), объединенные органические слои промывают 50 мл воды, 50 мл рассола, сушат над сульфатом магния, фильтруют, выпаривают с образованием оранжевого окрашенного масла, которое содержит окись трифенилфосфина (согласно данным тонкослойной хроматографии). Путем хроматографической очистки (силикагель Бринкмана 125 г, растворитель циклогексан-эфир 3:1) получают целевое соединение в количе (выход 75), т, пл. 17 стве 1,252 г 76°С. Элементный анализ. %: С 77,56; Н 8,U; Вычислено, 3,23. C2SH35N03 С 77,29; Н 7,96; Найдено, 3,22. Аналогичным образом из соответств ющего исходного вещества получают d, I -цис-5,6,6ар, 7,10,1 Оа -гексагидро -5 ацетил-1- гидрокси-6р-метил-9 мети лен-3(5Фенил-2-пентилокси)бензо(с) -хинолин; т. пл. 168-169, (выход 8,8). Элементный анализ. С 77,56; Н 8,14; Вычислено, N 3,23. СзеНззМОз с 77,25; Н 8,14; Найдено, ; N 3,12. Пример 14. 2R,6S,6aR,9R, 10аЯ(-)(-)-1-Ацетокси-5,6,6а,7,8,9, 10,10а-октагидро-9 гидрокси-5,6-диме тил-3(5 фенил-2-пентилокси)бензо(с) -хинолин. К перемешиваемому раствору, состо ящему из 1,0 г (0,0021 моль) 2Я,б5,6аЯ,9Я,10аЯ,(-)(-)-1-ацетокси-5 ,6,6а,7,8,9,10-октагидро-9-гидрокси-6-метил-3 (5 фенил-2-пентилокси) бензо(с)-хинолин гидрохлорида в 30 м CHCSj, добавляют 30 мл насыщенного раствора NaHCOg и полученную смесь перемешивают в течение 5 мин при ком натной температуре. Слои разделяли и водный слой повторно экстрагируют (20 мл). Объединенные хлороформные слои сушат () , фильтруют/ и раст воритель удаляют в вакууме с образованием свободного основания в виде бесцветной пены. Эту пену растворяют в 50 мл тетра Гидрофурана ив полученный раствор добавляют 1,0,г 5 Pd/C, 1,05 (0,018 моль 8,7 экв) ледяной уксусной кислоты и 5,18 мл (0,20 моль 100 экв) 37 -ного раствора формальдегида. Эту смесь помещают в аппарат Парра и проводят гидрирование при давлении водорода 50 фут/дюйм в течение 50 мин. Катализаторотфиль ровывают на диатомитовой и про мывают этилацетатом. фильтрат разбав ляют до объема 150 мл этилацетатом и затем последовательно промывают 3 х X 100 мл насыщенного раствора 75 мл , 75 мл рассола, и сушат над MgS04. Растворитель отфильтровывают и Удаляют в вакууме с образованием жел того вязкого масла, которое подверга ют хроматографической очистке на 50 г силикагеля (0,04-0,63 мм) и элюируют смесью толуол - диэтиловый эфир (1:1). Одинаковые фракции объе диняют и выпаривают в вакууме с обра зованием окрашенного масла, которое повторно растворяют в 50 мл диэтилового эфира и через полученный раствор барботируют Hes в атмосфере азота при перемешивании. Полученное твердое вещество отфильтровывают в атмосфере азота и сушат в вакууме (0,1 мм) в течение 24 ч при комнатной температуре с образованием 0,45 г (44) целевого продукта; т. пл. 90-95®С (разл.). Элементный анализ. Вычислено, %: С 68,90; Н 7,85; N 2,87. нее Найдено, %: С 68,60; Н 7,92; N 2,77. Ир - 73 (с, 1,0 метанол); масс-спектр т/е-451 (т) . Следующие соединения получают аналогичным образом: d,1-1-ацетокси-5 ,6,6а,7,8,9,10,10ас -октагидро-9/ -гидрокси-5 ,6|3-диметил-3-(1 ,1 -диметилгептил )-бензо(с)-хинолин гидрохлорид, т. пл. 129-UO°C (разл.); m/e-4l5 (m) 100,а также d, l-1-ацетокси-5 ,6,6а,3,7,8,9,10,10, lOacd-октагидро-9 -гидрокси-5-метил-6|3-н-бутил-3- (5 Фенил-2-пентилокси)бензо(с)-хинолин гидрохлорид; т. пл. 106-108®С; т/е-493 (т). i . Элементный анализ. Вычислено, %: С 70,21; Н 8,37; N 2,6 : C3iH.,NO . НСГ Найдено, %: С 71,02; Н 8,43; N 2,6. Пример 15. d,1-5,6,бар,7,8, 9,1 Оа oi-Октагидро-1-ацетокси-5-бензоил-9-бензоилокси-6|3-метил-3 (1 -метил-4- ,фенилбутокси) бензол (с)-хинолин . Перемешиваемую суспензию 47,4 г (0,10 моль) d,l-5,6,6afi,7,8,9a,10, 10а|Х -октагидро-1 -ацетокси-9-гидрокси-6 -кетил-3- (1 -метил-4-фенилбутокси) бензо(с)-хинолингидрохлорида в 500 мл сне и), в. атмосфере азота охлаждают до и обрабатывают 250 мл пиридина , и затем 58 мл (0,50 моль) бензоилхлорида в 500 мл хлороформа. Полученный в результате гомогенный раствор нагревают с обратным холодильником на паровой бане в течение часа. Реакционную смесь переливают в колотый лед и экстрагируют хлороформом. Органические экстракты объединяют, промывают последовательно водой.(2 х 500 мл), 101-ной соляной кислотой, насыщенным раствором бикарбоната натрия (500 мл) и насыщенным раствором рассола (500 мл), сушат над MgSO;, фильтруют и концентрируют с образованием 119 г светло-желтого масла, В результате хроматографирования через 2000 г силикагеля ( этилацетат-циклогексан ) получают 50,5 г (78) d,l-5 ,6,6ар,7,8,9а,10,10ао -октагидро-1-ацетокси-5-бензоилокси-6|3-метил-3 -(1-метил- -фенилбутокси)бензо(с)-хинoлин с т. пл. С. Элементный анализ. Вычислено, %: С 76,24; Н 6,72; N 2,17. . С 76,35; Н 6,92; . Найдено, %: N 2,19. Разделение d,1-5,6,бар,7,8,9,Ю, 1 иао -октагидро-1 -ацетокси-5 бензоил-9-бензоилокси-6р1-метил-3 (1 а-метил - -фенилбутокси)бензо(с) - хинолина и d, 1-5,6,,7,8,9а, 10, Юаоб-октагидро-1-ацетокси-5-бензоил-9 бензоилокси-1 -метил-3- (Т-метил- -фенилбу токси)бензо(с)-хинолина. Перекристаллизацией 50,5.г d,1-5 ,6,бар.,7,8,9а, 10 ,10а(у;-октагидро-1.-ацетокси-5-бензоил-9-бензоилокси-6| -метил-3-(1-метил-1-фенилбутокси) бензо(с)хинолина из 2 л 2-пропанола получают 23,8 г твердого белого веще ства, т. пл, 136-138°С, которое дваж ды перекристаллизовывают из 2-пропанола и один раз из ацетонитрила с образованием 5,7 г d,1-5,,7,8, 9а, 10,10аоб-октагидро-1-ацетокси-5-бензоил-9 бензоилокси-6р-метил-3 -(1-метил- -фенилбутокси)бензо(с)хинолина , т. пл. l48-1i9°C. Фильтрат начальной перекристаллизации из 2-пропанола d,1-5,6,бар,7, 8,9а, 10,10ас -октагидро-1-ацетокси-5 -бензоил-9 бензоилокси-6 -метил-3 - (1 -метил-4-фенилбутокси)-бензо(с) -хинолина выпаривают до образования белой пены и обрабатывают 500 мл эфи ра с образованием 12,9 г белого . твердого вещества, т. пл. . Полученные твердые соединения дважды снова обрабатывают эфиром с образова нием 3,8 г d,l-5,6,6aA,7,8,9a,10,10a -пктягмлпп-1-д„Ртп,.гми-ррн,о,мп-ч-. октагидро-1-ацетокси-5-бензоил-9 -бёнзоилокси-6р -метил-3- (1 -метилг4-фенилбутокси )бензо(с)-хинолина, т. пл. 139 141°С. Получение, d, 1-5,6,6а/3,7,8,9а ,10, Юаоо-октагидро- -ацетокси-9-гидоокси 95 26 -6 1-метил-3-(1|3-метил-4-фенилбутокси)- -бензо(с)-хинолин гидрохлорида. К перемешиваемому раствору 2,0 г (5,3 ммоль) литийалюминий гидрида в 150 мл тетрагидрофурана в атмосфере азота по каплям добавляют раствор, состоящий из 5,7 г (8,8 моль) d,l-5 ,6,6а(5,7,8,9а,10,10ао(.-октагидро-1-ацетокси- -бензоил-9-бензоилокси-6р-метил-З (1p-мeтил- фeнилбyтoкcи)-бензо (с)-хинолина с 112 мл тетрагидрофурана в течение 5 мин. Полученную в результате смесь нагревают с обратным холодильником в течение 5 мин , охлаждают и осторожно переливают в охлаждаемую льдом смесь 1125 мл 5 ной уксусной кислоты в воде и 2250 мл эфира. Полученную двухфазную смесь перемешивают в течение 10 мин и разделяют слои, водный слой экстрагируют 500 мл эфира и объединенные эфирные слои последовательно промывают водой (3 X 500 мл), насыщенным раствором бикарбоната натрия (2 х 00 мл) и насыщенным раствором рассола (1 х X 500 мл), сушат над MgSO, фильтруют и выпаривают с образованием 5, г d, 1 -5-бензил-5,6,6а(,7,8,9а, 10, -октагидро-1,9-дигидрокси-6р-метил-3- (1(-метил-4-фенилбутокси)бензо(с)-хинолина в виде светло-фиолетового масла. d,1-5-Бензил-5,6,6ар,7,8,9а,10, 10ас -октагидро-1,9 дигидрокси-6|3-метил-3- (1р-метил-4-фенилбутокси)бензо (cj-хинолйн немедленно переносят в 450 мл метанола и гидрируют при атмосферном давлении над 4,27 г Pd/C в течение 3 ч с образованием d,l-5 ,6,6а(3,7,8, 9а, 10,10aoi-октагидро 1 ,9 Дигидрокси-6| -метил-3(1|3 метил-4-фенилбутокси )бензо(с)-хинолина после фильтрации катализатора и выпаривания метанола. d, 1-5,6,6a|i,7,8,9а,10,Юао -Октагидро-1 ,9 Дигидрокси-6|5 метил-3- (1 ft -метил-4 фенилбутокси)бензо(с)-хинолин немедленно растворяют в 210 мл хлористого метилена, охлаждают до О С в атмосфере азота и последователь ° обрабатывают Ь,35 мл триэтиламина, Г (9,7моль) 4-диметиламинопиридина и 0,834 мл (8,8 моль) уксусного ангидрида. Пясле перемешивания в течение 30 мин реакционную смесь переливают в 250 .мл воды и органические слои разделяют, бодный слой экстрагируют один раз метиленхлоридом и объединенные метиленхлоридные слои последовательно промывают насыщенным раствором бикарбоната натрия (2 х X 150 мл), водой (15 мл) и насыщенным раствором рассола, сушат над MgSO,4, фильтруют, выпаривают и хроматографируют на 300 г силикагеля, используя в качестве элюента смесь ЗЗ -ного эфира в толуоле, с образованием 1, г d, 1 -5,6,6aft,7,8,9a, 10, IOaoi-октагидро -1-ацетокси-9-гидрокси-6 -метил-3- (1р-метил- -фенилбутокси)бензо(с)-хинолина гидрохлорида в виде свободного основания. В результате обработки эфирного раствора d, 1-5,6,6а,7,8,9, 1 ОаоС-октагидро-1 -ацетокси-9-гидрокси-6 )-метил-3- (1|3-метил-4-фенилбутокси )бензо{с)-хинолина газообразной нее получают 795 мл d, 1-5,6,6а|3,7,8, 9а,10,10аЫ-октагидро-1-ацетокси-9 -гидрокси-6р-метил.-3 (1р-метил- -фенилбутоксибензо (с)-хинолин гиДрохлорид , т.пл. 213-215 С, после фильтрации и обработки ацетоном; т/е-+37 (т , 100).
Элементный анализ.
Вычислено,: М 68,42; Н 7,66; N 2,96.
нее
Найдено, %: С 68,8; Н 7,63; . N2,05.,
Аналогичным образом из 3,8 г d, 1-5,6,6ар),7,8,9а,Ю,10ао1:,-октагидро-1-ацетокси-5-бензоил-9-бензоилокси-бр-метил-З- (Ш-метил- -фенилбутокси) бензо(с)хинолина получают 1,1 г d,l-5 ,6,6aft,7.8,9a,10, 10а(х;-октагидро-1 -ацетокси-9 гидрокси-6 -метил-3 ( -метил-+-фенилбутокси)бензо(с)-хинолин гидрохлорид, т. пл; 202-205°С (разл.); т/е-437 (100, т)..
Элемйнтны анализ.
Вычислено, : С 68,42; Н 7,66; N 2,96.
С27Нз5М04 - НС1
Найдено, %: С 68,20; Н 7,5б; N 3,04.
Пример 16. Ди-транс-5 6,6а, 7,8,9,10,10а(Х.-октагидр6-1-ацетокси-3- (1,1-диметилгептил)-1,9-бета-окси-б-бета-метилбензо (с)-хинолин.
I. 1,3-Диокси-5-{1,1-диметилгептилбензол ). .
Смесь, состоящую из 1,3-ДиметилокСИ-Б- (1,1-диметилгептил)бензола (93,7 г, 0,355 ммоль) и пиридиний гидрохлорида , подвергают нагреванию при при перемешивании в течение
2 ч. К реакционной смеси добавляют лед и 100 мл 6н. хлористоводородной кислоты. Полученную таким образом реакционную смесь экстрагируют просты эфиром. Полученный эфирный экстракт промывают водой, сушат сульфатом магния и выпаривают. Полученный остаток
, кристаллизуют из гексана. Выход 83,5 от теоретического. Продукт характеризуется т. пл. 85-,87°С.
II. З-Амино-5-(1,1-диметилгептил) фенол.
Смесь, состоящую из 1,3-диокси-5 (1,1-диметилгептил)-бензола (1б г
.0,068 моль), хлорида аммония (17,7 г) бисульфита натрия (35 г) и гидроокиси аммония (100 мл), нагревают в стальном автоклаве при 182°С в течение 3 дней. Далее автоклав охлаждают содержимое извлекают и автоклав промывают этилацетатом и водой. Водную фазу отделяют, экстрагируют этилацетатом и соединенные этилацетатные растворы сушат сульфатом магния и подвергают концентрированию при пониженном давлении с получением масла темного цвета (17,8 г). Это масло выливают в толуол и вводят в колонку, заполненную силикагелем (900 г). Содержимое колонки элюируют с помощью смеси толуол - простой эфир в соотношении 3:1. Первые 2 л элюата выгружают и собирают по 500 мл в фракции. Фракции с 8 по 12 смешивают и подвергают отгонке до получения масла светло-коричневого цвета, которое далее кристаллизуют из петролейного эфира с получением белого твердого вещества с т. пл. б5-66°С в количестве
10,6 г (выход 66 от теоретического В результате перекристаллизации из холодного гексана точка плавления повышена до б7-б9°С. Продукт переводят в хлористоводородную соль путем растворения в простом эфире и барботирования сухого газообразного хлористог водорода через раствор. Выпавший осадок фильтруют.
III. Диэтил-3- З-окси-5-(1,1-диметилгептил ) анилино бутират.
З-АМИНО-З-(1,1-диметилгептил)фенолгидрохлорид (150,8 мл) превращают в целевое соединение (50,8 г). Выход 96,4% от теоретического. Продукт используют непосредственно без очистки.
IV. Диэтил-3- 3-Диокси-5-(1,1-дидиметилгептил )-М-этоксикарбонилани-
линобутират. Диэтил 3- 3-окси-5-(1,1-димeтил гeптил)-aнилинo -бyтиpaт (50,8 г) . превращают в целевое соединение (б2,8 г), которое используютбез очи стки в процедуре V. V. Ди-3- 3-окси-5-(1,1-диметилгеп тил) -N-этоксикарбониланилино1 масляна кислота. АИЭТИЛ-З- З-окси-5- (1,1 -диметилге тил)-N-этоксикарбонил анилинобутират ( б2,8 г) превращают в целевую кислот Выход 51 г, что соответствует 86,5% от теоретического. Полученный таким образом продукт используют без очист ки в процедуре VI. VI. Ди-5-окси-7-(1,1-диметилгепти -2-метил- -оксо-1 ,2,3, тетрагидрохинолин . Смесь, состоящую из ди-3 3 окси 5 (1,1-диметилгептил)-N-этоксикарбо нил анилиномасляной кислоты (51 г, 126 ммоль) и метансульфокислоты (510 мл), нагревают в атмосфере азота при 115°С в масляной бане в течение 3,5 ч. Полученную таким образом реакционную смесь охлаждают до 60°С, выливают в 2 л ледяной воды и 500 мл простого эфира. Полученную таким образом смесь перемешивают 15 мин, далее слой простого эфира удаляют и водные слои экстрагируют 200 мл простого эфира. Смешанные слои простых эфиров тщательно промывают водой (3 X 250 мл), один раз насыщенным раствором бикарбоната натрия, 100 мл рассола и сушат с помощью сульфата магния. После отгонки простого эфира получают масло красного цвета.. Его растворяют в 400 мл кипящего гексан и полученный раствор перемешивают 12 ч при комнатной температуре с пол чением кристаллического осадка желто го цвета. Выход Н,8 г. Продукт пере кристаллизовывают из гексана, т.. пл. 79-80°С. Элементный анализ. Вычислено, С 75,20; Н 9,63; N 4,63. С|9Н29 02 Найдено, I: С 75,25; Н 9,5б; N 4,58. Vll. Ди-1-формил-5-окси-7-(1 ,1-диметилгептил )-3 оксиметилен-2-метил- 3 оксимётилен-2 -метил- 4-оксо-1 ,2,3,4-тетрагидрохинолин. ДИ-5-ОКСИ-7-(1,1-диметилгептил)-2-метил-4-оксо-1 ,2,3,4-тетрагидрохинолин (16,65 г, 54,9 ммоль) превра Я 30. щают в целевое соединение (выход 19.7 г) в виде масла желтого цвета. VIII. Ди-1-формил-5-окси-7-(1 ,1-диметилгептил )-2-метил 4-оксо-3(3 -оксобутил)-,2,3,-тетрагидрохиноПолучают из ди-1-формил-5 окси-7 -(1,1-диметилгептил)-3(Зоксиметилен )-2-метил-А-оксо-1 ,2,3, -тетрагидрохинолина (19,7 г, 5,Э мм).. Выход полупродукта-сырца 26,7 г. В таком виде продукт используют в процессе, проводимом в соответствии С методи кой IX. IX.Ди-5,6,6а,7-тетрагидро-1-окси 3- (1 ,1-диметилгептил)-6-бета-метилбензо (с)-хинолин-9(8Н)-он. Ди-1-формил-6-оксо-7(1.1 Диметилгептил )-2-метил- -оксо-3-(3-оксобутил )-1,2,3,4-тетрагидрохинолин ( 33,0 г, 862 ммоль) превращают в целевое соединение. Выход 3,35 г. X.Ди-5,6,6а,7-тетрагидро-1-ацетокси-3- (1,1-диметилгептил)-6-метилбензо (с)-хинолин-9(8н)-он. В результате ацетилирования ди-5 ,6,6а,7-тетрагидро-1 -окси-3-(1 ,1-диметилгептил )-6-метилбензо(с)-хи- нолин 8(9Н)-она 03,0 г, 8,4 ммоль) получают 3,12 г целевого продукта; т. пл. 108-112°С. Элементный анализ. Вычислено, %: С 75,53; Н 8,87; N 3,52. C25H35N03 Найдено, %: С 75,62; Н 8,73; N 3,52. . XI.Ди-5,6,6а,7,10,10а-гексагидро-1-ацетокси-6-бета-метил-3 (1,1 диметилгептил )-бензо(с)-хинолин-9(8Н)-он . Суспензию ди-5,6,6а,7-тетрагидро-1-окси-6-бета-метил-З (1,1-диметилгептил )бензо(с)-хинолин-9(8Н)-она ( 2,0 г, 5,63 моль) в тетрагидрофуране (25 мл) добавляют по каплям через дозирующую воронку к быстро перемешиваемому раствору лития (0,236 г) в жидком аммиаке (120 мл, дистиллироварнного ванного через таблетки гидроокиси калия ) при (сухой лед - ацетон). Дозирующую воронку промывают 10 мл тетрагидрофурана. Полученную таким образом смесь перемешивают 10 мин добавляют 4 мг лития и перемешивают еще в течение 2 ч. Твердый .хлорид аммония (24 г) добавляют, чтобы уст31953981
ранить голубую окраску. Избыточное количество аммония выпаривают И; остаток выливают в воду (50 мл) и этилацетат (100 мл). Этилацетатный слой отделяют и водную фазу экстрагируют 5 два раза этилацетатом, каждый раз по 50 мл. Смешанные экстракты промывают рассолом, сушат с помощью безводного сульфата магния и концентрируют при пониженном давлении с получением полу-О твердого продукта коричневого цвета в количестве 1,35 г. Остаток вводят в 25 мл хлористого метилена, охлаждают до (в льдо-водяной бане) и добавляют 0,869 мл триэтиламина, 5 0,7б2 г диметиламинопиридина и 0,588 г уксуснокислого ангидрида в течение 1 мин. Полученную таким образом р1еакционную смесь перемешивают при в течение 30 мин, разбавляют 20 50 мл метиленхлорида и 25 мл воды. Полученную органическую фазу отделяют и водную фазу экстрагируют с помощью 50 мл метиленхлорида. Смешанные органические экстракты тщательно промы-25 вают 4 X 50 мл насыщенным раствором бикарбоната натрия, 1 х 50 мл рассола и сушат с помощью сульфата магния. Выпаривание растворителя при пониженном давлении позволяет получить остаток зо темно-коричневого цвета.
Полученный остаток растворяют в толуоле и загружают а хроматографичес«ую колонку (размером 3,8 х 61 см), содержащую 200 г силикагеля. Содёр- j5 жимое колонки элюируют смесью, состоящей из 3 ч, толуола и 1 ч. простого эфира, в количестве, равном объему колонки, и далее - с помощью дегазированной смеси толуол - простой эфир 40 (3:1). Продолжая элюирование и применяя хроматографирование на тонких пленках, получают элюат красного цве32
та, который концентрируют и обрабатывают с помощью безводной хлористоводородной кислоты с получением целевой соли гидрохлорида продукта в виде твердого вещества (0,40 г). Выход 17,8 от теоретического; т. пл. 135-137°С; масс-спектр т/е 399 (), Зб7, 273.
Элементный анализ.
Вычислено, I: С 68,87; Н 8,78; N 3,21.
С2 НзтМОз
Найдено,- : С 68,85; Н 8,92; N 3,18.
XII. Ди-транс-5,6,6а,7,8,Э,10, 1 Оа-а-октагидро-1 -.ацетокси-3- (1 ,1 -диметилгептил)-1,9-бета-окси-6-бета-метил-бензо (с)-хинолин.
Смесь, состоящую из ди-5,6,6а,7-тетрагидро-1-ацетокси-6-бёта-метил 3- (1,1-диметилгептил)бензо(с)-хинолин-9- (8Н)-она (kk6 мг, 1,12 ммоль) в метаноле (10 мл) и палладия на углероде (46 мг, 5) гидрогенизируют в аппарате Парра при комнатной температуре в течение 1,25 ч. Реакционную .смесь фильтруют, катализатор промываю хлористым метиленом и смешанные фильтрат и промывочный раствор выпаривают с получением 460 мг масла. Затирание масла в 10 мл смеси, состоящей из простого и петролейного эфиров (1:3) позволяет получить целевой продукт в виде кристаллической массы. Выход 235 мг (52/0 от теоретического) .
Элементный анализ.
Вычислено, %: С 1,11; Н 9,79; N 3,9. - C25H39N03
Найдено, %: С 7, Н 9,68; N 3,2.
Соединения общей формулы I могут быть применены в медицине в качестве анальгетиков.
03
s с;
ю ш
кю лз
х
сз
-
u з:
s/
I
0)
о
о
о
чО
§
сч
ч- О
с
еэ О а
ч
«ч
r
о
о
СМ
го о
00
ю.сг
СП
о
, «ч
о-чО
т-о
0
сэ
Lr чО
-:}
-3f«-v
-:Г
Г-смVD
оо
СМ
чО -СМ-3-- . о
CD
о

























Реферат

Формула


Комментарии