Оптически активный катализатор для асимметрического гидрирования замещенных акриловых кислот - SU663273A3
Код документа: SU663273A3
Описание
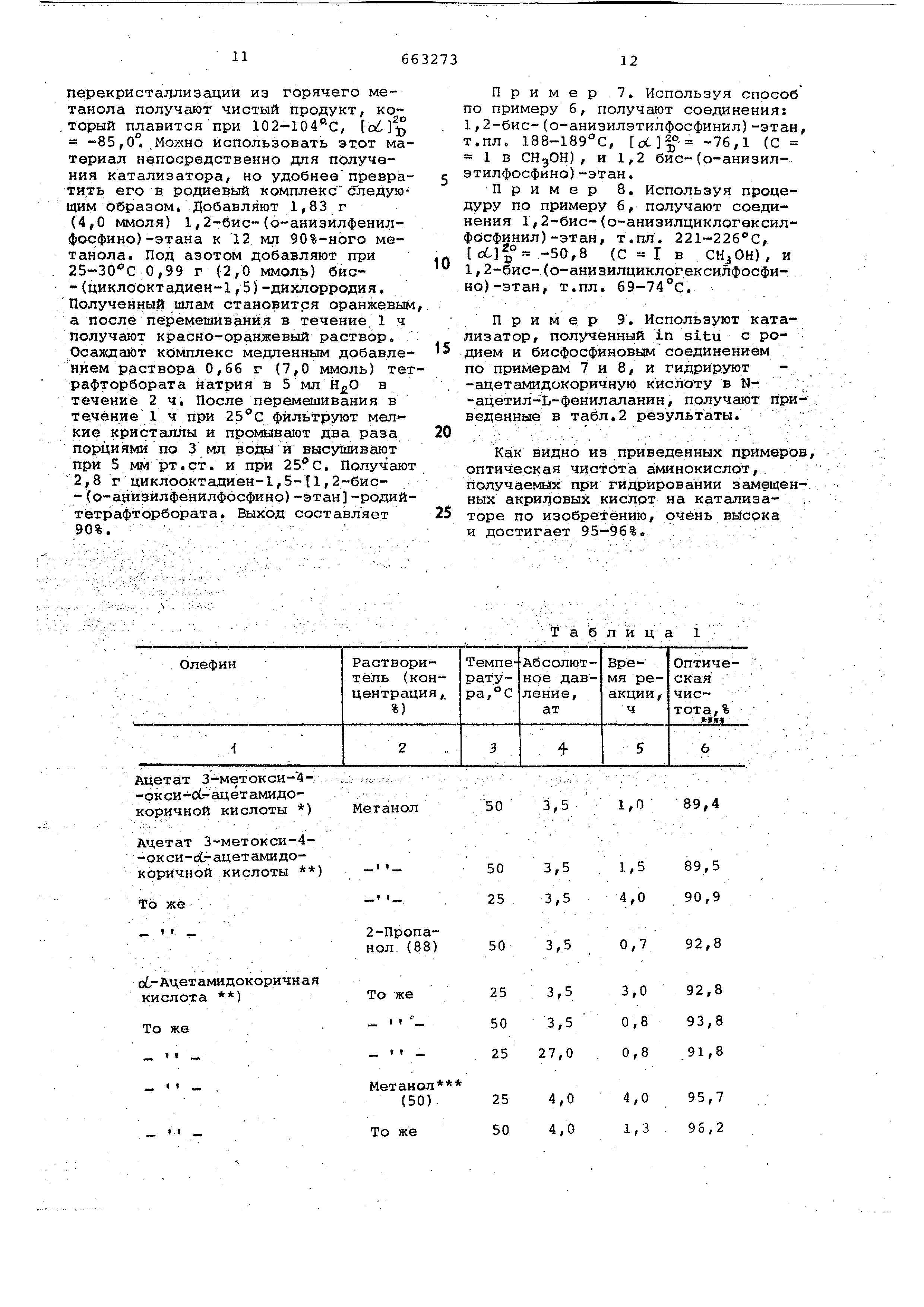
почтительно содержит 1,2-бис-(о -аниэилфенилфосфино)-этан. Указанные бисфосфиновые-соединения получают из их предшественников , которыми являются бисфосфиноксидные соединения общей формулы о о А-Р-СН СН -Р-А Ь Б В СВОЮ очередь эти бисфосфиноксидные соединения получают известным способом окислительной конденсации оптически активных монофосфин оксидных соединений общей формулы О А-Р-СН , . в. в присутствии подходящего раство рителя, бутиллития и соли меди. Примеры бисфосфиновых соединений согласно изобретению: 1,2-бис-(о-анизилфенилфосфино)-этан 1,2-бис-(о-анизил-4-метилфенилф фино)-этан. 1,2-бис-(о-анизил-4-клорфенилфосфино )-этан 1,2-бис-(о-анизил-3-хлорфенилфо фино)-этан 1,2-бис-{о-анизил-4-бромфенилфо фино)-этан 1,2-бйс-(2-метокси-5-хлорфенил -фенилфосфино -этан 1,2-бис-(2-метокси-5-бромфенил -фенилфосфино -этан 1,2-бис-(2-этоксифенилфенилфосф ) -этан л 1,2-бис- 0-анизил-(п-фенилфенил -фосфино -этан 1,2-бис (2-метокси-4-метилфени -фенилфосфино -этан 1,2-бис-(2-этоксифеНИл-4-хлорфв нилфосфино -этан 1,2-бис-(о-анизил-2-мётилфенилф фино)-этан 1,2-бис-(о-анизил-4-этилфенилфо но)-этан 1,2-бйс-(о-анизил-3-этилфенилфо фино)-этан Г, 2-бис-(о-анизил-3-фенилфенилфосфино )-этан Оптически .активные катгшизаторы полученные при применении новых оптически активных бисфосфиновых соединений формулы I, обеспечивают реакции каталитического асимметрического гидрирования, в результате чего получают очень большие количества желательного оптического антипода. Можно получить указанные оптиче ки активные катализаторы, содержащ переходный металл, .например родий иридий и рутений, в комбинации с о тически активным бисфосфиновым сое динением. Оптически активные катал заторы сбгласно изобретению являют ся растворимыми координационными комплексами, включающими металл, выбранный из группы, состоящей из родия, иридия и рутения в комбинаии по меньшей мере с О,5 моля оптически активного бис-фосфинового иганда на 1 моль металла. Указанные катализаторы растворимы э реакионной смеси, поэтому называются гомогенными Металлические комплексы могут быть представлены формулой MXL, в которой М означает переходный ме-. талл, выбранный из группы, состояей из родия, иридия и рутения; X выбирается из группы, состоящей из водорода, фтора, брома, хлора и йода; L означает оптический активный бисфосфиновый лиганд согласно приведенному определению. Можно достичь высоких выходов желательных антиподов не только с катализаторами формулы MXL, которые представляют собой координационные комплексы металла , выбранного из группы, состоящей из родия, иридия и рутения, но и при осуществлении гидрирования в присутствии катализатора, включающего раствор соли переходного металла (родия, иридия и рутения ) и по меньшей мере 0,5 моля оптически активного бисфосфинового лиганда на 1 моль металла. Например , можно получить указанные катализаторы растворением металлического соединения Б подходящем растворителе вместе с бисфосфиновым соединением в качестве лиганда, при соотношении по меньшей мере 0,5 моль лиганда на 1 моль металла, предпочтительно 1 моль лиганда на 1 моль металла. Можно получать катализатор in situ добавлением растворимого металлического соединения вместе с подходя дим количеством оптически активного лиганда к реакционной смеси перед гидрированием или во врется гидрирования. Предпочтительным металлом является родий. В качестве растворимых соединений родия используют треххлористЫй гидрат родия, трехбромистый гидрат родия, сульфат родия, органические родиевые комплексы, например с этиленом, пропиленом и диолефинами такими как 1,5-циклооктадиен и 1,5-гексадиен, бицикло- 2 ,2,1 -гепта-2,5-дИен и другие диены, которые могут образовать бидентатные лиганды, или активную форму металлического родия, который легко растворяется. Согласно изобретению используют оптически активный бисфосфиновый лиганд в соотношении примерно 0,52 ,0, предпочтительно 1,0 моль, на 1 моль металла. На практике предпочитают использовать оптически активный катализатор в твердом виде. так как он удобнее в работе и при хранении.Можно достичь укаэаннах результатов с твердыми катиойными комплексами металлов. Катионные металлические комплексы , содержащие 1 моль оптически активного бисфосфйнового лиган ,да на 1 моль металла, и желатирующий диолефин, представляют собой предпочтительные катализаторы. Указанные катионные координационные родиевые комплексы можно получить путем добавления к растаору органического родиевого ком комплекса в спирте, например этано ле, 1 моля оптически активного бис фосфйнового соединения на 1 моль родияf при этом образуется ионный раствор. При последующем добавлени к этому раствору подходящего анион нап ример тетрафторбората, тетрафён бората, происходит осаждение или кристаллизация твердого катионного металлического комплекса непосредственно из растворителя или после обработки в подходящем растворител Примерами катионных мета шйческих комплексов служат, например, циклооктадиен-1,5-t1,2-бис-(О-анизилфенилфосфино )-этан -родийтетрафторборат , циклооктадиен-1,,2-бис- (о-аниэилфенилфосфино)-этан -родийтетрафенйлборат и бицикло- 2 ,2,1 -гепта-2,5-диен- 1,2 бис- (о-анизилфенилфосфино)-этан -роди тетрафторборат. При;контакте с водородом катали затор превращается в активную форм Указанную акт 1йацйю можно осуществить непосредственно во время гидри ровайия или путем вОзд эйствия водО рода на катализатор перёд добавлением его к гидрируемой реакционной смеси / - . . .- : Замещенные акриловые КИСЛОТЫ,ко торые дают неожиданно высокие выхода желательного оптического айтипода аминокислот, представляют собой замещенные оС -ациламидоакрилойые кислоты и/или их сопи, сложные эфи ры или. амиды, нижеследующее уравне ние иллюстрирует такую реакцию (в .уравнений jS -заместителем является фенил)t сн с-сорн jH оптический |активный A. , -СНх-СН-СОО Й-Заместителем может быть также водород, алкил, замещенный алкил, арйл, замещенный арил, аралкил, амино, бензиламино, дибензиламино, нитро-, карбоксильная группа или сложнЕлй эфир карбоновой кислоты и T.nv / -Заместитель можно выбрать из большого числа групп, он ограничен лишь с6-аминокислотой, которая представляет собой желательный целевой продукт. Примерами об-аминокислот, антиподы которых мОжно быстро получить согласно изобретению, служат п-хлорфенйлаланин , триптофан, фенилаланин ,. 3-(3,4-диоксифенил)-аланин , 5-окситриптофан,. галогентриптофаны , лизин, гистидин, тирозин, лейцин, глутаминовая кислота и валин .- . . ;/ . Ацильная группа может представлять собой замещенный или незамещенный ацил, примерами таких групп служат ацетил, бензоил, формйл 11ропионил, бутирйл, толуил, нитробензоил или другие ациттьные группы, которые обычно используют в качестве блокирующих групп ори пептидном синтезе . ; - -; Указанное каталитическое гидрирование р|-замеченных сС-ациламидоакриловых кислот часто проводят в присутствии основания. р -Замещённые о,-ациламидоакриловые кислоты и/или их соли, сложные эфиры и амидал представляют собой предшественники замоиенных и незамещенных аланинов. . - : Представленныё нижеследующей структурной формулой соеде1н:ения дают отличные рё&ультата при применении катализатора согласно изобретению, следовательно, они представляют собой соедйнейия, которые особенно ответстве яы для ДАННОГО изобретения т-С е-соон .. н NH : т. где Т выбирается из группы, состоящей ИЗ водорода, карбоксила, незамещенного и замещенного алкила, тиенила, |5-индолила, .fi-имидазолила , фурила, пиперонила и в, с и D независимо.выбираются из руппы, состоящей из водорода, алкйа , карбоксила, гидроксила (и их еталлических солей), алкокси, галоиа , ацилокси, арилокси, аралкилокси, мино, алкиламино, нитро, циано; 2 выбирается из группы, состоящей з замещенного или незамещенного ациа , согласно вышесказанноь1у, р, g и г означают целые числа -5 при условии, что р, g и г в суме не превышают 5. В реакционную систему катализатор ожно вводить а готовом виде либо
виде компонентов, которые затем образуют катализатор in situ. В виде компонентов каталиэ атор можно добавять перед внесением ft-замещенной 6-ациламидоакриловой кислоты или после него. В состав компонентов для получения катализатора in situ входят растворимое металлическое соединение и оптически активное бисфосфиновое соединение. Можно добавлять катализатор в любом каталитически эффективном количестве, которое обычно составляет примерно 0,001 - 5% металла от; веса Ь-замещен ной об-ациламидоакриловой кислоты (и/или ее солей, сложных эфиров или амидов).
Следует избегать контакта катализатора или реакционной смеси с окислительными материалами, в частности с кислородом. Предпочтительно осуществляют реакцию получения катализатора в газах (отличных от Н), которые являются инертными относительно реагирующих веществ и катализаторов, например в азоте или аргоне.
Катализатор по изобретению позволяет непосредственно получать желательные оптические антиподы в брльишх количествах, устра:няя дорогостоящую и трудоемкую операцию разделения рацемата на антиподы,
Кроме того, катализаторы по изобретению -обеспечивают не только необыкновенно высокую оптическую чистоту получаемого оптического анти-, пода, но и высокую скорость гидрирования при низких концентрациях катализатора Эти катализаторы являются очень стабильными при повышенных давлениях водорода, в результате чего можно достичь указанных высоких скоростей гидрирования.
В приводимых примерах оптическая чистота определяется по уравнению {оптическая активность измеряется в Том же растворителе):
Наблюдается оп . : - тическая активОптическ ая „ дмеси чистота Оптическая активность чистого оптического изомера
Пример 1. Охлаждают раствор 34,0 г (0,137 моль) о-анизилметилфенилфосфиноксида , +25,9 (С, 1 в CHjOH), в 500 мл тетрагидРофурана до температуры . При -60°С добавляют 68 мл бутиллития в гексане (2,32 М, 0,157 моль) и выдерживают смесь при -60°С в течение 25 мин.Затем добавляют 22,3 г 0,1б6 моль) безводного CuCEj в виде твердого вещества при температуре от -50 до -60°С. Массу нагревают до в течение 1,5 ч и в Конце выдерживают при 34°С в течение 0,5 ч. В этот момент спектр ЯМР показы ваёт 45% непрореагировавшегося о-анизилметилфенилфосфиноксида . Подвергают смесь реакции гидролиза при 25 30С с 100 мл 10%-ной Добавляют 500 мл СНСе и экстрагированием разбавленным водным аммиаком удаляют медные соли. После высушивания органического слоя над MgSO и выпаривания растворителя получают 34 .г маслянистого остатка. В результате обработки 50 мл ацетона и 50 мл простого эфира получают 9,0 г кристаллов . В результате перекристаллизации из того же растворителя получают 7,0 г 1,2 бис-(о-анизилфенил . фосфинил)-этана, т.пл. 204-205°С, . -44,2 (С 1 в CHgOH). 5 Масс-спектры показывают максимум, соответствуйщий недиссоциированным молекулам, при 490. Осуществляют восстановлением 1,2-бис-(о-анизилфенилфосфинил )-этана. Нагревают с 0 обратным холодильником 16,5 г
(0,12 моль) трихлорсилана и 12,2 г (0,12 моль) триэтйламина в 188 мл
сухого бензола в течение 1 ч. Затем добавляют 3,0 г (0,012 моль) 1,25 -бис-(о-анизилфенилфосфинил)-этана в 75 мл сухого ацетонитрила и нагревают с обратным холодильником в течение 1,5 ч. Затем охлаждают в 30%-ном растворе едкого натра, отделяют и выпаривают органический
слой и получают 1,4 г сырых кристаллов, которые не растворяются в холодном метаноле. Дополнительная перекристаллизация из нагретого метанола дает 1,2-бис-(о-анизилфенилфосфино )-этан, т.пл. 102-104С, Id, - -83,4°(С 0,5 в СНСе). Массспектр показывает максимум, соответствующий недиссоциированным моп лекулам, при 458, и спектр ЯМР подтверждает структуру.
П р И М е р 2. Добавляют 1,80 г (18 ммоль) ацетилацетона в 25 мл простого эфира при 25°с к суспензии
., из 4,43 г (18 ммоль) бис-(цикло октадиен-1,5)-дихлордиродия
{КЬ(ЦОД) в 50 мл простого эфира. Охлаждают смесь до и добавляют 11 мл 25%-ного раствора гидроокиси Калия. Согревают порцию до
0 и добавляют 75 мл простого эфира и перемешивают в течение 0,5 ч.
Фильтруют полученн5по смесь, фильтрат сушат над MgSO и концентрируют до 125 мл. Затем охлаждают до -75°С
5 и фильтруют полученные кристаллы, в результате чего получают 4,34 г (циклооктадиен-1,5)-ацетилацетоната родия. Затем перемешивают 125 мг (0,4 ммоль) (циклооктадиен-1,5)60 -ацетилацетон-ата родия и 184 мг
(0,4 ммоль) 1,2-бис-(о-анизИлфенилфосфино )-этана, полученного в примере 1, в 2,Ь мл метанола. После перемешивания в Течение 45 млн получают
5 красновато-оранжевый раствор. Добавляют к этому растворупо каплям 88 мг ( 0,8 .) тетрафторбората натрия в 1,25 мл Фильтруют образовав шийся осадок и npoN JBaJOT водой и простым эфиром, в результате чего получают 202 мг тетрафторбората цйклооктадиен-1,5-(1,2-бис-(о-анизилфенилфосфино )-этан -родия. Пример 3. Получают раство из 0,013 г НЬ(ЦОД) (0,026 ммо и 0,024 г 1, 2--6ИС-(о-анизилфенилфосфияо )-этана, приготовленного по примеру 1 (0,051 гф-юль) в 5 мл метанола , перемеидиваяием в течение 15 мин при.. Без доступа возд ха добавляют 0,5 мл указанного рас вора к суспензии из 1,00 г ofацетамидокоричной кислоты в 25 мл 88%-н го изопропакола при и подвергают полученную массу давлению 3,5 (абсолютное давление) водорода,Реак ция гидрирозания заканчивается в .течение 0,7 ч„ Можно выделить N-ацетиЛ Ь-ф8Нилаланин из реакционной массы путем кристаллизации,Анал показывает, что опткческаячистота L-изомера составляет 92,.8%. Пример 4, й ательяо продувают раствор из 100,0 г (0,487 моль с6-ацета1ш-1докоричной кислоты в 100 м метанола, 81,5 мл зотл к 37,0 г 50%--ного едкого натра (0,463 моль) с целью удаления кислорода. Затем при 50°С и под давлением 2,87 кг/см .водорода впрыскивается каталитический раствор, состоящий из 0,0368 г тетрафторбората циклооктадиен-1, ,(о-анизилфенилфосфино)-э тан -родия , полученного по примеру 2, в 2 мл метанола, через резийо вую перегородку. Ги;Ечзирование заканчивается после 9 ч, в результате оптическая чистота продукта достигает 95-96%. Выделяют продукт из его натриевой соли добавлением 45,7 г (0,463 моль) 37%-ного НСб-. Получают 94,0 г Ы-адетил-Ь-фенилал.а нина, cL 4-47,(С 1 в 95%-ном этаноле). Пример 5, Осуществляют реа ции гидрирования.аналогично описанному в примерах 3 и 4, Результаты даны в табл.1. Все гидрирования проведены с 0, концентрациями родия в пересчете на вес гидрируемого олефина. Пример 6. Получают диизопропиламид лития добавлением 91,6 мл 2,4-бутиллития в гексане к 24,5 г (0,24 моль) дииэопропиламина в 100 мл тетрагидрофурана. Добавляют полученный раствор диизопропиламида лития к раствору 49,2 г (0,20 моль) о-анизилметилфенилфосфиноксида, +25,9° (С 1 в CHjOH), в 100 мл тетрагидрофурана при 5°С. После добавления перемешивают смесь 0,5ч при . Затем добавляют 20,0 г (0,20 экв) CuCej при 0-5 С. После перемешивания в течение 0,5 ч добавляют 26,9 г (0,2 моль) CuCGj с выдерживанием температуры . Нагревают реакционную смесь в течение 1 ч до 20-25С и выдерживают при этой температуре в течение 0,5 ч. Затем добавляют 100 мл концентрированной нее при 15-20°С, После осаждения отбрасывают верхний гексановый слой. Экстрагируют органические вещества хлороформом, промывают хлороформный слой 10%-ным НОи в конце содой до удаления солей меди. Отгоняют легкие фракции хлороформа из органического слоя до температуры 95°С и добавляют 200 мл н-бутилацетата. Нагревают полученную Массу, которая теперь представляет собой кристаллический осадок, -до температуры 116°с с целью удаления оставшихся следов хлороформа и медлеяно охлаждают до . Фильтруют продукт и промывают 50 мгЕ холодного бутилацетата и высушившот при и 200 к--- рт.ст. Выход составляет 33,5 г 1,2-бис (о-анизилфенилфосфинил)-этана, т.пл. 203-205 0, -44,9 (С 1 в ). Чистый 1,2-бис-(о-анизилфенклфосфинил )-этан плавится при 205-207 С -46,0°. Восстановление 1,2-бис-(о-аниэилфенияфосфинил )-этана проводят в атмосфере Wj. 60,0 г (0,122 моль) 1,2-бис- (о-анизилфенилфосфинил)-этана суспендируют в 450 мп сухого ацетонитрила . Затем добавляют 150 г сухого трибутилаМйна и нагревают смесь до 65-70с, пока не образуется раствор . Добавляют 97 г трихлорсилана к полученному раствору в течение 1 ч, выдерживая температуру 70-72 С. По окончании реакции в основном образуется одна жидкая фаза, которую выдерживают при 70с в течение 2 ч и затем охлаждают до 30-40°С, а при 2530с осаждают добавлением 25%-ного водного едкого натра до полученил 360 мл. В конце осаждения повышают температуру до 45-50°С с целью облегчения отделения слоя. Отделяют органическую фазу и промывают под Nj дополнительно 150 мл 25%-ного едкого натра. Концентриуют органическую фазу, состоящую з двух слоев, при 45-55с до тех пор, пока не останется лишь высококипящий трибутиламин. Затем добавяют небольшое количество (50 мл) ензола и повышают .температуру до 5®С при давлении 40 мм рт.ст. Доавляют БО мл метанола для кристализации , охлаждают смесь до фильтруют. Промывают осадок двумя орциями по 40 мл холодного метанола высушивают при 60°С и при 1 мм рт.ст., результате получают 50,8 г 1,2бис- (о-аниэилфенилфосфино)-этана, .пл. 96-101 С, -76,7° После
перекристаллизации из горячего метанола получают чистый продукт, который плавится при 102-104 С, -85,0°. .Можно использовать этот материал непосредственно для получения катализатора, но удобнеепревратить его в родиевый комплекс следующим образом. Добавляют 1,83 г (4,0 ммоля) 1,2-бис-(о-анизилфенилфосфино )-этана к 12 мл 90%-нбго метанола . Под азотом добавляют при 25-30С 0,99 г (2,0 ммоль) бис- (циклооктадиен-1,5)-дихлорродия. Полученный шлам становится оранжевым а после перемешивания в течение.1 ч получают красно-оранжевый раствор. Осаждайт комплекс медленным добавлением раствора 0,66 г (7,0 ммоль) тетрафторбората натрия в 5 мл в течение 2 ч. После перемешивания в течение 1 ч при 25°с фильтруют кристаллы и промывают два раза порциями по 3 мл воды и высушивают при 5 мм рт.ст. и при . Получают 2,8 г циклooктaдиeн-l,,2-биc- (о-анйзилфенилфосфино)-этан -родийтетрафтЬрбората , Выход составляет 90%. -
Пример 7. Используя способ по примеру 6, получают соединения: 1,2-бис-(о-анизилэтилфосфинил)-этан, т.пл. 188-189°С, оС.)°- -76,1 (С 1 в СНдОН), и 1,2 бис-(р-анизилэтилфосфино )-этан.
Пример 8. Используя процедуру по примеру 6, получают соединения 1,2-бис-(о-анизилдиклогаксилфсЗсфинил )-этан, т.пл. 221 226С, ,8 (С I в CHjOH), и 1,2-6ис-(о-анизилциклогексилфосфино )-этан, т.пл, б9-74°С.
Пример 9. Используют катализатор , полученный in situ с родием и бисфосфиновымсоединением по примерам 7 и 8, и гидрируют -ацетамидокоричную кислоту в N ацетил-ь-фенилаланин , получают приведенные в табл.2 результаты.
Как видно из приведенных примеров оптическая чистота аминокислот,. получаемых при гидрировании замещенных акриловых кислот на катализаторе по изобретению, очень высока и достигает 95-96% ; , ,






Реферат

Формула


Комментарии