Новые рутениевые комплексы, их применение в реакциях метатезиса и способ проведения реакции метатезиса - RU2586213C1
Код документа: RU2586213C1
Описание
Изобретение относится к новым комплексам металлов, их применению в качестве (пре)катализаторов в реакции метатезиса, а также к способу проведения реакции метатезиса.
Метатезис олефинов представляет собой важный инструмент органического синтеза (Handbook of Metathesis, Vol. I-III, Grubbs, R.H., ed.; Wiley-VCH, 2003).
В данной области техники известно множество рутениевых комплексов, активно катализирующих метатезис олефинов (см. обзор: Vougioukalakis, G.С.; Grubbs, R.Н. Chem. Rev. 2010, 110, 1746). Было показано, что комплексы III-го поколения (такие как Gru-III, Ind-III) очень хорошо подходят в качестве (пре)катализаторов реакции метатезисной полимеризации с раскрытием цикла (англ. ring-opening metathetic polymerisation, ROMP).

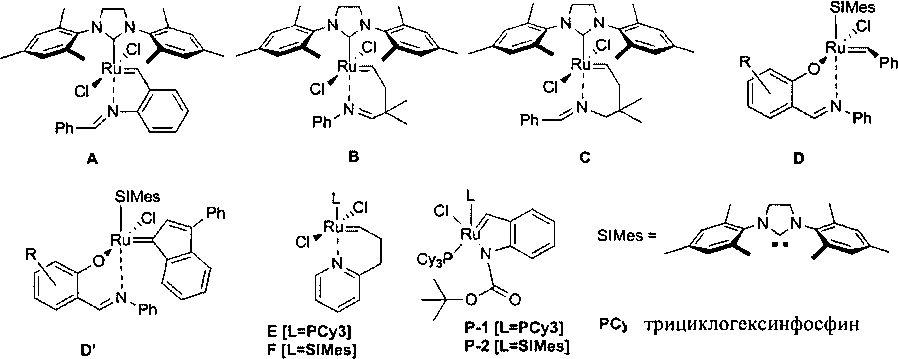
Катализаторы третьего поколения очень быстро инициируют реакцию метатезиса, в то время как в некоторых применениях реакции метатезиса, таких как полимеризация ROMP в пресс-форме, предпочтительно применять (пре)катализатор, который инициирует реакцию не сразу после добавления его к субстрату, а только после соответствующего инициирования химическими агентами, температурой или светом. Комплексы, характеризующиеся отложенным инициированием, часто называют "латентные катализаторы" (Monsaert, S.; Vila, A.L.; Drozdzak, R.; Van Der Voort, P.; Verpoort, F., Chem. Soc. Rev., 2009, 38, 3360; R. Drozdzak, N. Nishioka, G. Recher, F. Verpoort, Macromol. Symp. 2010, 293, 1-4). Примерами "латентных катализаторов" являются комплексы A-F, а также недавно полученные Р-1 и Р-2 (Pietraszuk, С.; Rogalski, S.; Powala, В.; Mietkiewski, М.; Kubicki, М.; Spólnik, G.; Danikiewicz, W.; Woźniak, K.; Pazio, A.; Szadkowska, A.; Kozłowska, A.; Grela, K., Chem. Eur. J, 2012, 18, 6465-6469).
Полимеризация ROMP в пресс-форме позволяет получать готовые изделия. Дициклопентадиен представляет собой один из часто используемых мономеров для полимеризации в пресс-форме. Полидициклопентадиен, который получают путем полимеризации дициклопентадиена, характеризуется, в частности, низким влагопоглощением, а также устойчивостью к нагрузкам и высокой температуре. По этой причине детали транспортных средств и специализированные емкости для химической промышленности все чаще производят с помощью ROMP-полимеризации дициклопентадиена (в пресс-форме).
С точки зрения практического применения в промышленности чрезвычайную важность имеет то, что (пре)катализаторы стабильны в присутствии кислорода, а также влаги, как во время синтеза, так и во время очистки, а также во время их применения в реакции метатезиса. Разработка устойчивых и активных (пре)катализаторов метатезиса олефинов (таких как G, H и I) позволила значительно расширить круг возможных применений этой реакции. Тем не менее эти комплексы все еще получают и применяют для реакции метатезиса в атмосфере инертного газа, в сухих растворителях, поскольку их устойчивость по отношению к кислороду и влаге ограничена.

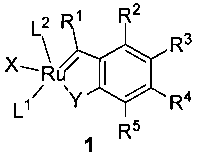
Было отмечено, что комплексы рутения, представленные формулой 1:

содержащие в своей структуре ковалентную связь металл-кислород или металл-сера, очень стабильны и могут быть получены без какой-либо защитной атмосферы инертного газа, а также в растворителях ч.д.а. (чистый для анализа). После надлежащей активации комплексы общей формулы 1 активно катализируют реакции метатезиса, проводимые в присутствии воздуха. Кроме того, комплексы общей формулы 1 активно катализируют реакции метатезиса только после того, как их активировали при помощи химических агентов и они почти не чувствительны к термической активации. Эти свойства обеспечивают возможность превосходного контроля времени начала реакции; это свойство очень полезно, особенно для реакций ROMP. Неожиданно было обнаружено, что комплексы общей формулы 1 позволяют получить полидициклопентадиен посредством реакции ROMP, проводимой на воздухе, при этом используемое количество (пре)катализатора значительно ниже, чем в случае использования классических комплексов. Даже 100 ppm (частей на миллион по весу) комплекса в соответствии с изобретением, который содержит лиганд NHC (N-гетероциклический карбеновый лиганд), эффективно катализирует полимеризацию дициклопентадиена (DCPD). Это количество соответствует мольному соотношению мономера к (пре)катализатору, составляющему примерно 65000:1. Таким образом, количество этого (пре)катализатора составляет менее половины от количества катализатора G (М. Perring, N.B. Bowden Langmuir, 2008, 24, 10480-10487). Кроме того, (пре)катализатор в соответствии с изобретением, содержащий два фосфиновых лиганда, более активен в ROMP-реакции полидициклопентадиена, чем структурно сходный комплекс G′. Кроме того, неожиданно было обнаружено, что влияние электроноакцепторного заместителя на скорость инициирования (пре)катализатора в случае комплексов общей формулы 1 было обратным по сравнению с классическим комплексом типа Ховейды-Граббса (K. Grela, S. Harutyunyan, A. Michrowska, Angew. Chem. Int. Ed. 2002, 41, No. 21).
Чрезвычайно ценной является возможность влияния на свойства (пре)катализатора путем изменения его лигандов и, как следствие, возможность оптимального подбора его активности для конкретной реакции. Как правило, более высокая стабильность наблюдается для катализаторов, содержащих в своей структуре iV-гетероциклический лиганд SIPr, по сравнению с (пре)катализаторами, содержащими лиганд SIMes, хотя различия в их эффективности в реакции метатезиса обычно не очень значительны. Неожиданно было обнаружено, что изменения N-гетероциклического карбенового лиганда (NHC) оказывали значительное воздействие на эффективность комплексов общей формулы 1 в соответствии с изобретением. Было обнаружено, что катализатор 1, содержащий NHC-лиганд SIPr, эффективно катализирует реакцию метатезиса с замыканием цикла, а также реакцию типа ен-ин, в то время как в реакции типа ROMP и перекрестном метатезисе СМ (англ. cross-metathesis) он демонстрирует более низкую активность. В свою очередь, катализатор общей формулы 1, содержащий NHC-лиганд SIMes, очень эффективно катализирует реакцию СМ, а также реакции типа ROMP, в то время как в реакции метатезиса с замыканием цикла он демонстрирует более низкую эффективность.
Изобретение относится к комплексам общей формулы 1:
где X представляет собой анионный лиганд;
Y представляет собой кислород или серу;
L1 и L2 независимо представляют собой нейтральный лиганд;
R1 представляет собой водород, C1-20алкил, C2-20алкенил, C2-20алкинил или C5-10арил;
R2, R3, R4 и R5 независимо представляют собой водород, галоген, C1-C16алкил, C1-C16алкокси, C1-C16перфторалкил, C3-C7циклоалкил, C2-C16алкенил, C5-C14арил, C5-C14перфторарил, С3-С12гетероциклил, -OR6, -NO2, -COOH, -COOR6, -CONR6R7, SO2NR6R7, -SO2R6, -CHO, -COR6, где R6 и R7 независимо представляют собой C1-C6алкил, C1-C6перфторалкил, C5-C14арил, C5-C14перфторарил; R2, R3, R4 и R5 необязательно совместно образуют замещенное или незамещенное конденсированное карбоциклическое кольцо C4-8 или замещенное или незамещенное конденсированное ароматическое кольцо; при условии, что, если X представляет собой хлор, Y представляет собой кислород, L1 представляет собой трициклогексилфосфин, каждый из R1, R2, R3 и R4 представляет собой водород и R5 представляет собой метил, то L2 отличен от L1. Кристаллическая структура комплекса, исключенная из объема настоящего изобретения путем введения вышеприведенного условия, уже описана в J.N. Coalter et al., Chem. Commun. 2001, 1158-1159.
Предпочтительно в формуле 1 заместители R1, R2, R3, R4 и R5, а также Y являются такими, как определено выше, и
X представляет собой галоген, -OR8, -O(C=O)R8, -O(SO2)R8, где R8 представляет собой C1-C12алкил, C3-C12циклоалкил, C5-C14арил, необязательно замещенный по меньшей мере одним из C1-C6алкила, C1-C6пергалогеналкила, C1-C6алкокси или галогена;
L1 представлен формулой PR9(R10) (R11), где R9, R10 и R11 независимо представляют собой C1-12алкил, C1-12алкокси, C3-12циклоалкил, C5-14арил, C5-14арилокси, C5-12гетероциклил; и два заместителя из R9, R10 и R11 в свою очередь совместно могут образовывать циклическую систему; или L1 представляет собой N-гетероциклическое соединение;
L2 представляет собой N-гетероциклический карбеновый лиганд.
Предпочтительно в формуле 1 заместители R1, R2, R3, R4 и R5, а также Y являются такими, как определено выше, и
X представляет собой галоген, -OR8, -O(C=O)R8, -O(SO2)R8, где R8 представляет собой C1-C12алкил, C3-C12циклоалкил, C5-C14арил, необязательно замещенный по меньшей мере одним из C1-C6алкила, C1-C6пергалогеналкила, C1-C6алкокси или галогена;
L1 и L2 независимо представлены формулой PR9(R10)(R11), где R9, R10 и R11 независимо представляют собой C1-12алкил, C1-12алкокси, C3-12циклоалкил, C5-14арил, C5-14арилокси, C5-12гетероциклил; и два заместителя из R9, R10 и R11 в свою очередь могут совместно образовывать циклическую систему; или L1 или L2 представляют собой N-гетероциклическое соединение, выбранное из группы, включающей: пиридин, 4-(N,N-диметиламино)пиридин, 3-бромпиридин, пиперидин, морфолин, пиридазин, пиримидин, пиразин, пиперазин, 1,2,3-триазол, 1,3,4-триазол, 1,2,3-триазин, а также 1,2,4-триазин.
Более предпочтительно в формуле 1
X представляет собой хлор;
R1 представляет собой водород;
R2, R3, R4 и R5 независимо представляют собой водород или нитро;
Y представляет собой кислород;
L1 представляет собой трициклогексилфосфин, трифенилфосфин, пиридин или 3-бромпиридин;
L2 представляет собой лиганд формулы 2а или 2b:
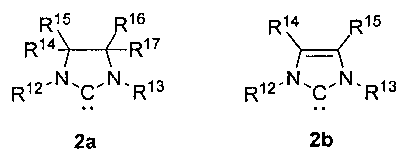
где R12, R13 независимо представляют собой C1-C12алкил, C3-C12циклоалкил, C2-C12алкенил, C5-C14арил, необязательно замещенный по меньшей мере одним из C1-C6алкила, C1-C6пергалогеналкила, C1-C6алкокси или галогена;
R14, R15, R16, R17 независимо представляют собой водород, C1-C12алкил, C3-C12циклоалкил, C2-C12алкенил, C5-C14арил, необязательно замещенный по меньшей мере одним из C1-C6алкила, C1-C6пергалогеналкила, C1-C6алкокси или галогена; R14, R15, R16, R17 могут совместно образовывать замещенное или незамещенное конденсированное C4-8 карбоциклическое кольцо или замещенное или незамещенное конденсированное ароматическое кольцо.
Более предпочтительно в формуле 1
X представляет собой хлор;
R1 представляет собой водород;
R2, R3, R4 и R5 независимо представляют собой водород или нитро;
Y представляет собой кислород;
L1 трициклогексилфосфин;
L2 представляет собой лиганд SIMes или SIPr:
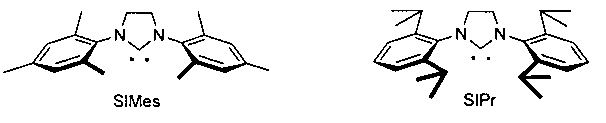
Изобретение относится также к применению комплексов общей формулы 1, где все заместители такие, как определено в пункте 1, в качестве (пре)катализаторов в реакциях метатезиса.
Предпочтительно комплексы общей формулы 1 применяют в качестве (пре)катализаторов в реакции метатезиса с закрытием цикла, перекрестного метатезиса, гомометатезиса, метатезиса алкен-алкинового типа; более предпочтительно, комплексы общей формулы 1 применяют в качестве (пре)катализаторов в реакции метатезисной полимеризации с раскрытием цикла.
Изобретение также относится к способу проведения реакции метатезиса олефинов, в котором по меньшей мере один олефин приводят в контакт с комплексом общей формулы 1 в качестве (пре)катализатора.
Предпочтительно реакцию метатезиса проводят в органическом растворителе; более предпочтительно, органический растворитель представляет собой дихлорметан, дихлорэтан, толуол, этилацетат.
Предпочтительно реакцию метатезиса проводят без какого-либо растворителя.
Предпочтительно реакцию метатезиса проводят в присутствии химического активирующего агента, более предпочтительно, химический активирующий агент представляет собой кислоту Бренстеда или Льюиса или галогенпроизводное алкана или силана; наиболее предпочтительно, активирующий агент представляет собой хлороводород, хлортриметилсилан или n-толуолсульфоновую кислоту.
Предпочтительно реакция метатезиса представляет собой метатезисную полимеризацию дициклопентадиена с раскрытием цикла.
Предпочтительно (пре)катализатор общей формулы 1 добавляют в твердой форме к дициклопентадиену.
В одном из предпочтительных вариантов реализации настоящего изобретения реакцию полимеризации инициируют путем нагревания смеси дициклопентадиена и (пре)катализатора общей формулы 1 до температуры 30°C или выше.
Предпочтительно исходный материал содержит по меньшей мере 94 масс. % дициклопентадиена.
В предпочтительном способе реакцию метатезиса проводят при температуре от 20 до 120°C.
В предпочтительном способе реакцию метатезиса проводят в течение периода времени, составляющего от 1 минуты до 24 часов.
Предпочтительно реакцию метатезиса проводят в присутствии добавки, способствующей образованию поперечных связей.
В одном из предпочтительных вариантов реализации настоящего изобретения реакцию метатезиса проводят с применением (пре)катализатора в количестве, равном или менее 1000 ppm.
Когда в описании изобретения и пунктах формулы по отношению к количеству вещества используются единицы "ppm" (частей на миллион), они приводятся по массе.
Поскольку авторы изобретения не желают быть связанными каким-либо конкретным механизмом катализа, термин "(пре)катализатор" используется, чтобы указать, что комплекс согласно изобретению может представлять собой либо сам катализатор, либо предшественник активных частиц, представляющих собой собственно катализатор.
Определения групп, которые не определены ниже, должны иметь самые широкие значения, известные в данной области техники.
Термин "необязательно замещенный" означает, что один или более атомов водорода данной группы были заменены указанными группами, при условии, что такая замена приводит к образованию стабильного соединения.
Термин "гало" или "галоген" обозначает элемент, выбранный из F, Cl, Br, I.
Термин "алкил" относится к углеводородному заместителю с насыщенной неразветвленной или разветвленной цепью, содержащему указанное число атомов углерода. Неограничивающими примерами алкилов являются: метил, этил, пропил, изопропил, бутил, втор-бутил, трет-бутил, пентил.
Термин "алкокси" относится к алкильному заместителю, как определено выше, связанному через атом кислорода.
Термин "перфторалкил" обозначает алкил, как определено выше, в котором все атомы водорода замещены атомами галогена, где атомы галогена могут быть одинаковыми или различными.
Термин "циклоалкил" относится к насыщенному моно- или полициклическому углеводородному заместителю, содержащему указанное число атомов углерода. Неограничивающими примерами циклоалкильного заместителя являются циклопропил, циклобутил, циклопентил, циклогексил.
Термин "алкенил" относится к нециклической линейной или разветвленной углеводородной цепи, содержащей указанное число атомов углерода и содержащей по меньшей мере одну углерод-углеродную двойную связь. Неограничивающими примерами алкенилов являются: винил, аллил, 1-бутенил, 2-бутенил.
Термин "арил" относится к ароматическому моно- или полициклическому углеводородному заместителю, содержащему указанное число атомов углерода. Неограничивающими примерами арила являются: фенил, мезитил, антраценил.
Термин "гетероциклил" относится к ароматическим, а также неароматическим циклическим заместителям, содержащим указанное количество атомов углерода, где один или более атомов углерода заменены на гетероатом, такой как азот, фосфор, сера, кислород, при условии, что в кольце нет двух непосредственно связанных атомов кислорода или серы. Неароматические гетероциклилы могут содержать от 4 до 10 атомов в кольце, тогда как ароматические гетероциклилы должны иметь по меньшей мере 5 атомов в кольце. Бензоконденсированные системы также относятся к гетероциклилам. Неограничивающими примерами неароматических гетероциклилов являются: пирролидинил, тетрагидрофуранил, дигидрофуранил, тетрагидротиенил, тетрагидропиранил, дигидропиранил, тетрагидротиопиранил, пиперидинил, морфолинил, тиоморфолинил, 2-пирролинил, индолинил. Неограничивающими примерами ароматических гетероциклилов являются: пиридинил, имидазолил, пиримидинил, пиразолил, триазолил, пиразинил, фурил, тиенил. Вышеуказанные группы могут быть связаны через атом углерода или атома азота. Например, заместитель, полученный путем связывания пиррола, может представлять собой пиррол-1-ил (N-связанный) либо пиррол-3-ил (C-связанный).
Термин "нейтральный лиганд" относится к заместителю, не имеющему электрического заряда, который способен координироваться с атомом рутения. Неограничивающими примерами таких лигандов являются: N-гетероциклические карбеновые лиганды, их амины, имины, фосфины и оксиды, алкил- и арил- фосфиты и фосфаты, простые эфиры, алкил- и арилсульфиды, координированные углеводороды, галогеналканы и галогенарены. Термин "нейтральный лиганд" также включает N-гетероциклические соединения; их неограничивающими примерами являются: пиридин, 4-(N,N-диметиламино)пиридин (DMAP), 3-бромпиридин, пиперидин, морфолин, пиридазин, пиримидин, пиразин, пиперазин, 1,2,3-триазол, 1,3,4-триазол, 1,2,3-триазин и 1,2,4-триазин.
Нейтральные лиганды L1 и L2 могут быть связаны с бензилиденовым лигандом, а также они могут быть связаны друг с другом с образованием бидентатного лиганда (L1-L2); кроме того, нейтральные лиганды могут быть связаны с анионным лигандом X с образованием полидентатных лигандов.
Термин "анионный лиганд" относится к заместителю, способному координироваться с металлическим центром и несущему электрический заряд, способный компенсировать заряд металлического центра, где такая компенсация может быть полной или частичной. Неограничивающими примерами анионных лигандов являются: анионы фторид, хлорид, бромид или иодид, анионы карбоновых кислот, анионы спиртов и фенолов, анионы тиола и тиофенола, анионы (органо)серной и (органо)фосфорной кислот, а также анионы их сложных эфиров. Анионный лиганд (X) и нейтральные лиганды (L1, L2) могут быть связаны друг с другом с образованием полидентатных лигандов. Неограничивающие примеры полидентатных лигандов представляют собой: бидентатный лиганд тридентатный лиганд (X1-L1-L2). Неограничивающие примеры таких лигандов представляют собой: анион 2-гидроксиацетофенона, анион ацетилацетона.
Термин "карбеновый" относится к молекуле, содержащей нейтральный атом углерода, имеющий валентность 2 и два неспаренных валентных электрона. Термин "карбеновый" охватывает также аналоги карбена, в которых атом углерода заменен другим химическим элементом, таким как: бор, кремний, азот, фосфор, сера. Термин "карбеновый" относится, в частности, к N-гетероциклическим карбеновым (NHC) лигандам. Неограничивающие примеры NHC лигандов представляют собой:

Неограничивающие примеры предпочтительных агентов, способствующих образованию поперечных связей, представляют собой трет-бутилпероксид, ди-трет-бутилпероксид, а также их смеси.
Примеры получения катализаторов
Пример 1 - Синтез комплекса 1а согласно настоящему изобретению
Коммерчески доступный комплекс G′ (200 мг, 0,24 ммоль) помещали в колбу и добавляли метиленхлорид (15 мл). Затем добавили соединение формулы:

(58 мг, 0,48 ммоль) и трициклогексилфосфин (0,136 мг, 0,49 ммоль). Полученный раствор перемешивали при температуре 40°C в течение 30 минут. Реакционную смесь охлаждали и вводили в верхнюю часть хроматографической колонки, заполненной силикагелем. Колонку элюировали раствором этилацетат-циклогексан (0-10% об. %), собирали фракцию зеленого цвета. После выпаривания растворителей получали комплекс 1а в виде зеленого твердого вещества (126 мг, выход 65%).

1H-ЯМР (300 МГц, CD2Cl2), δ ppm: 16,60 (s, 1H), 7,20 (dd, J=1,8 Гц, J=7,8 Гц, 1H), 7,14-7,09 (m, 1H), 6,90 (d, J=8,4 Гц, 1H), 6,47-6,42 (m, 1H), 2,02-0,85 (m, 66H).13С-ЯМР: (125 МГц, CD2Cl2) δ ppm: 279,34, 181,48, 149,47, 131,29, 122,44, 117,26, 113,05, 32,30, 29,93, 29,65, 29,43, 28,27, 27,89, 26,87, 23,11, 14,28.31P-ЯМР (124,5 МГц, CD2Cl2), δ ppm: 36,5.
Пример 2 - Синтез комплекса 2 согласно настоящему изобретению
Коммерчески доступный комплекс G′ (200 мг, 0,24 ммоль) помещали в колбу и добавляли сухой бескислородный метиленхлорид (6 мл). Затем добавляли соединение формулы:

(80 мг, 0,48 ммоль) и трициклогексилфосфин (136 мг, 0,49 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 24 часов. Реакционную смесь вводили в верхнюю часть хроматографической колонки, заполненной силикагелем (элюент: этилацетат/циклогексан, от 0 до 10 об. %). После выпаривания растворителей получали комплекс 2 в виде коричневого твердого вещества (144 мг, выход 70%).

1Н-ЯМР (500 МГц, CD2Cl2), δ ppm: 17,05 (s, 1H), 8,21 (d, J=2J Гц, 1H), 8,00 (dd, J=9,3, 2,7 Гц, 1H), 6,83 (d, J=9,3 Гц, 1H), 1,97-0,77 (m, 66Н).
13С-ЯМР: (125 МГц, CD2Cl2), δ ppm: 280,71, 185,31, 147,04, 135,13, 126,50, 118,18, 116,07, 35,79, 35,31, 32,53, 32,45, 32,38, 29,82, 29,52, 28,16, 28,12, 28,08, 27,77, 27,73, 27,69, 27,32, 27,28, 27,22, 26,68, 26,55.
Пример 3 - Синтез комплекса 3 согласно настоящему изобретению
Коммерчески доступный комплекс G (200 мг, 0,24 ммоль) помещали в колбу, в которую был добавлен метиленхлорид (6 мл). Затем добавляли соединение формулы:

(63 мг, 0,47 ммоль) и трициклогексилфосфин (132 мг, 0,47 ммоль). Полученный раствор перемешивали при температуре 40°C в течение 5 часов. Реакционную смесь вводили в верхнюю часть хроматографической колонки, заполненной силикагелем (элюент: этилацетат/циклогексан, от 0 до 10 об. %). После выпаривания растворителей получали комплекс 3 в виде зеленого твердого вещества (140 мг, выход 72%).

1H-ЯМР (500 МГц, CD2Cl2), δ ppm. 15,85 (s, 1H), 7,07 (s, 1H), 7,00-6,96 (m, 3H), 6,66 (d, J=8,4 Гц, 1H), 6,44 (dd, J=7,7, 1,4 Гц, 1H), 6,24 (s, 1H), 6,20 (t, J=7,2 Гц, 1H), 4,01-3,96 (m, 1H), 3,83-3,70 (m, 2H), 3,64-3,59 (m, 1H), 2,63 (s, 3H), 2,54 (s, 3H), 2,50 (s, 3H), 2,35 (s, 3H), 2,27 (s, 3H), 1,66-1,50 (m, 13H), 1,29 (s, 3H), 1,11-0,70 (m, 20Н),13С-ЯМР: (125 МГц, CD2Cl2) 6 ppm: 281,36, 222,21, 221,66, 180,31, 148,30, 139,54, 139,17, 138,78, 137,63, 137,32, 136,98, 134,69, 130,23, 130,05, 129,70, 129,00, 122,38, 116,17, 111,26, 32,52, 32,39, 29,45, 28,92, 28,23, 28,15, 28,12, 28,04, 27,34, 27,03, 21,33, 21,14, 19,40, 18,92, 18,66, 16,76.31P-ЯМР (124,5 МГц, CDCl3) δ ppm: 29,11.
Пример 4 - Синтез комплекса 3 согласно настоящему изобретению
Коммерчески доступный комплекс G (1.0 мг, 1,18 ммоль) помещали в колбу, в которую был добавлен метиленхлорид (24 мл). Затем добавляли соединение формулы:
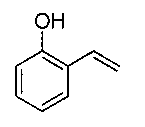
(141 мг, 1,17 ммоль) и трициклогексилфосфин (330 мг, 1,18 ммоль). Полученный раствор перемешивали при температуре 40°C в течение 5 часов. Реакционную смесь вводили в верхнюю часть хроматографической колонки, заполненной силикагелем (элюент: этилацетат/циклогексан, от 0 до 10 об. %). После выпаривания растворителей получали комплекс 3 в виде зеленого твердого вещества (797 мг, выход 82%). Данные ЯМР соответствуют Примеру 3.
Пример 5 - Синтез комплекса 4 согласно настоящему изобретению
Коммерчески доступный комплекс G (200 мг, 0,24 ммоль) помещали в колбу, в которую был добавлен метиленхлорид (6 мл). Затем добавляли соединение формулы:

(78 мг, 0,47 ммоль) и трициклогексилфосфин (132 мг, 0,47 ммоль). Полученный раствор перемешивали при температуре 40°C в течение 1 часа. Реакционную смесь вводили в верхнюю часть хроматографической колонки, заполненной силикагелем (элюент; этилацетат/циклогексан, от 0 до 10 об. %). После выпаривания растворителей получали комплекс 4 в виде коричневого твердого вещества (104 мг, выход 50%).

1Н-ЯМР (500 МГц, CD2Cl2), δ ppm: 16,42 (s, 1H), 8,00 (dd, J=9,3, 2,7 Hz, 1H), 7,53 (d, J=2,7 Hz, 1H), 7,12 (s, 1H), 7,06 (s, 2H), 6,69 (d, J=9,3 Hz, 1H), 6,22 (s, 1H), 4,07-4,03 (m, 1H), 3,88-3,77 (m, 2H), 3,73-3,67 (m, 1H), 2,64 (s, 3H), 2,56 (s, 3H), 2,51 (s, 3H), 2,39 (s, 3H), 2,27 (s, 3H), 1,64-1,50 (m, 13H), 1,46 (m, 3H), 1,12-0,75 (m, 20H).13C-ЯМР: (125 МГц, CD2Cl2) δ ppm: 282,23 (d), 220,27, 219,73, 184,63 (d), 145,82, 139,23 (d), 139,08, 138,89, 137,46, 136,76, 136,69, 134,24, 134,00, 130,55, 130,36, 129,41 (d), 125,78, 117,59, 115,27, 52,14 (d), 51,63 (d), 34,52, 32,77, 32,64, 29,40, 28,91, 28,00 (m), 26,90 (d), 22,73, 21,34, 21,01, 19,41, 18,63, 18,53, 17,10, 14,21.
Пример 6 - Синтез комплекса 5 согласно настоящему изобретению
Твердый карбеновый комплекс 4 (100 мг, 0,115 ммоль) помещали в колбу Шленка в защитной атмосфере аргона, затем добавляли безводный бескислородный метиленхлорид (7 мл) и безводный пиридин (93 мкл, 1,15 ммоль). Полученный раствор перемешивали при температуре 40°C в течение 24 часов. Реакционную смесь вводили в верхнюю часть хроматографической колонки, заполненной силикагелем. С этого момента все последующие операции проводили на воздухе, без необходимости использования защитной атмосферы аргона. Колонку элюировали с использованием раствора этилацетата-циклогексана (от 0 до 10% об. %). После выпаривания растворителей получали комплекс 5 в виде коричневого твердого вещества (42 мг, выход 54%).

1Н-ЯМР (500 МГц, CD2Cl2), δ ppm: 16,82 (s, 1H), 8,04 (dd, J=9,3, 2,7 Гц, 2H), 7,58 (s, 2Н), 7,51 (m, 1Н), 7,13 (d, J=4,5 Гц, 4H), 6,96 (s, 1Н), 6,71 (d, J=9,3 Гц, 2H), 3,95-3,90 (m, 4H), 2,49 (s, 9H), 2,25 (s, 9H).13C-ЯМР: (125 МГц, CD2Cl2) δ ppm: 284,48, 219,30, 184,74, 150,09, 134,63, 126,06, 123,98, 117,54, 115,74, 35,90, 27,16, 25,79, 24,42, 20,93, 18,36.
Синтез комплексов 5а-с.

Схема А. Синтез комплексов 5 а-с. SIMes и IMES представляют собой N-гетероциклические карбеновые лиганды.
Получение катализатора проводили в атмосфере аргона в предварительно высушенной стеклянной посуде с использованием методов Шленка. Безводные растворители сушили путем перегонки над следующими осушителями и переносили в атмосфере аргон: DCM (CaH2). Для полимеризации использовали толуол без стирольных стабилизаторов производства Sigma Aldrich (Chromasolv для ВЭЖХ, 99,9%). Колоночную флэш-хроматографиию проводили с использованием силикагеля 60 Aldrich (230-400 меш). Аналитическую тонкослойную хроматографию (ТСХ) проводили с использованием пластины с предварительным покрытием из силикагеля 60 F254 (толщина 0,25 мм) с флуоресцентным индикатором. ЯМР-спектры регистрировали при помощи Varian; Unity Plus 200 МГц, INOVA 500 МГц, Mercury 400 МГц, VNMRS 600 МГц в CDCl3, CD2Cl2; химические сдвиги (δ) приведены в ppm относительно ТМС, константы взаимодействия (J) приведены в Гц. ИК-спектры регистрировали при помощи РЕ SPECTRUM 2000 и JASCO FT/TR-6200: волновые числа приведены в см-1. Спектры МС (ESI) регистрировали при помощи Quattro LC (тройной квадрупольный масс-спектрометр). Газовая хроматография проводилась при помощи РЕ Clarus 580 с колонкой InertCap 5MS-Sil и газовая хроматография/масс-спектрометрия (ГХ/МС) Clarus при помощи РЕ 680/600S с колонкой InertCap 5. Индексы полидисперсности (PDI) и молекулярная масса были определены методом гель-проникающей хроматографии с использованием ТГФ в качестве элюента. Установка состоит из следующего: Насос Merck Hitachi L6000 (объем подачи: 1 мл/мин), разделительные колонки Polymer Standards Service (класс крупности 5 мкм), детектор показателя преломления от Wyatt Technology. Для калибровки использовали полистироловые стандарты от компании Polymer Standard Service. Соединение 7b получали в соответствии с процедурой, описанной в литературе. [1] Все другие коммерчески доступные реактивы использовались в том виде, в каком они были получены.
Синтез соединения 5а.
В колбу Шленка, снабженную магнитной мешалкой, в атмосфере аргона загружали комплекс Граббса II поколения (1) (200 мг, 0,236 ммоль), производное пропенилфенола 7а (63 мг, 0,47 ммоль), сухой DCM (7 мл) и РСу3 (132 мг, 0,47 ммоль). Реакционную смесь перемешивали при 50°C в течение 5 часов. По истечении этого времени растворитель выпаривали в вакууме и сырой продукт очищали с помощью колоночной хроматографии
(SiO2, 10% этилацетат/с-гексан). После удаления растворителей получили комплекс 5а в виде твердого вещества зеленого цвета (152 мг, выход 78%).
1H-ЯМР (500 МГц, CD2Cl2) δ ppm: 15,85 (s, 1Н), 7,07 (s, 1H), 7,01-6,96 (m, 3H), 6,66 (d, J=8,4 Гц, 1H), 6,44 (dd, J=7,7, 1,4 Гц, 1H), 6,24 (s, 1H), 6,20 (t, J=7,2 Гц, 1H), 4,01-3,96 (m, 1H), 3,83-3,70 (m, 2H), 3,65-3,598 (m, 1H), 2,63 (s, 3H), 2,54 (s, 3H), 2,50 (s, 3H), 2,35 (s, 3H), 2,27 (s, 3H), 1,66-1,50 (m, 13H), 1,29 (s, 3H), 1,11-0,70 (m, 20H).
13С-ЯМР: (126 МГц, CD2Cl2) δ ppm: 281,5, 222,4, 221,8, 180,5, 148,5, 139,7, 139,3, 138,9, 137,8, 137,5, 137,2, 134,9, 130,4, 130,2, 129,9, 129,2, 122,5, 116,3, 111,4, 52,0, 51,8, 32,7, 32,6, 29,6, 29,1, 28,4, 28,3, 28,2, 27,5, 27,2, 21,5, 21,3, 19,6, 19,1, 18,8, 16,9.
31P ЯМР (202 МГц, CD2Cl2) δ ppm: 29,11. ИК (пленка DCM): 2925, 2849, 1890, 1583, 1463, 1335, 1266, 1132, 849, 752 MC (времяпролетная масс-спектрометрия с лазерной ионизацией и десорбцией из жидкой матрицы, m/z): 828,34 [М+]
Синтез соединения 5b.
В колбу Шленка, снабженную магнитной мешалкой, в атмосфере аргона загружали коплекс Граббса II поколения (1) (500 мг, 0,59 ммоль), производное пропенилфенола 7b (107 мг, 0,649 ммоль), сухой DCM (15 мл) и PCy3 (496 мг, 1,77 ммоль). Реакционную смесь перемешивали при 50°C в течение 1 часа. По истечении этого времени растворитель выпаривали в вакууме и сырой продукт очищали с помощью колоночной хроматографии (SiO2, 10% этилацетат/c-гексан). После удаления растворителей получили комплекс 5b в виде твердого вещества коричневого цвета (253 мг, выход 52%).
1Н-ЯМР (500 МГц, CD2Cl2) δ ppm: 16,39 (s, 1Н), 7,96 (dd, J=9,3, 2,7 Гц, 1H), 7,49 (d, J=2,7 Гц, 1H), 7,08 (s, 1H), 7,02 (s, 2H), 6,65 (d, J=9,3 Гц, 1H), 6,18 (s, 1H), 4,05-3,97 (m, 1H), 3,86-3,72 (m, 2H), 3,70-3,61 (m, 1H), 2,60 (s, 3H), 2,52 (s, 3H), 2,47 (s, 3H), 2,35 (s, 3H), 2,24 (s, 3H), 1,64-1,50 (m, 13H), 1,46 (m, 3H), 1,12-0,75 (m, 20H).
13С-ЯМР: (126 МГц, CD2Cl2) δ ppm: 282,4 (d), 220,4, 219,9, 184,8, 146,0, 139,4, 139,4, 139,2, 139,1, 137,6, 136,9, 136,9, 134,4, 134,2, 130,7, 130,5, 129,6, 125,9, 117,8, 155,4, 52,3, 51,8, 34,7, 32,9, 32,8, 29,6, 29,1, 28,3, 28,2, 28,1, 28,0, 27,1, 22,9, 21,5, 21,2, 19,6, 18,9, 18,7, 17,3.
31P-ЯМР (202 МГц, CDCl3) δ ppm: 30,38. ИК (пленка DCM): 2926, 2850, 1579, 1483, 1434, 1307, 1267, 1077, 849, 735 MC (времяпролетная масс-спектрометрия с лазерной ионизацией и десорбцией из жидкой матрицы, m/z): 842,4 [M-Cl]+
Синтез соединения 5с.
В колбу Шленка, снабженную магнитной мешалкой, в атмосфере аргона загружали комплекс 1b (100 мг, 0,115 ммоль), производное пропенилфенола 7а (32 мг, 0,235 ммоль), сухой DCM (5 мл) и PCy3 (132 мг, 0,235 ммоль). Реакционную смесь перемешивали при 50°C в течение 2 часов. По истечении этого времени растворитель выпаривали в вакууме и сырой продукт очищали с помощью колоночной хроматографии (SiO2, 10% этилацетат/с-гексан). После удаления растворителей получили комплекс 5с в виде твердого вещества зеленого цвета (43 мг, выход 44%).
1Н-ЯМР (500 МГц, CD2Cl2) δ ppm: 16,06 (s, 1H), 7,18-6,90 (m, 5Н), 6,63-6,54 (m, 2Н), 6,26-6,18 (m, 1H), 2,42-2,24 (m, 14Н), 1,63-1,07 (m, 43Н).
13С-ЯМР: (126 МГц, CD2Cl2) δ ppm: 281,9, 188,0, 187,2, 180,6, 148,8, 139,1, 138,4, 137,3, 129,8, 126,7, 126,6, 126,5, 122,5, 116,1, 111,3, 32,8, 32,6, 29,6, 29,2, 28,4, 28,3, 28,2, 28,1, 27,2, 21,5.
31P-ЯМР (202 МГц, CD2Cl2) δ ppm: 31,71. ИК (пленка DCM): 3294, 2926, 2851, 1939, 1904, 1583, 1486, 1454, 1366, 1261, 1235, 849, 752, 524. MC (времяпролетная масс-спектрометрия с лазерной ионизацией и десорбцией из жидкой матрицы, m/z): 816,8 [М-Cl]+.
Пример 7 - Синтез комплекса 6 согласно настоящему изобретению

Комплекс 6 получали в соответствии со способом, описанным для комплекса 3 (в Примере 4), с получением продукта в виде зеленого твердого вещества с выходом 70%.
1Н ЯМР (500 МГц, CD2cl2) δ ppm: 15,67 (s, 1Н), 7,41 (d, J=4,7 Гц, 2H), 7,38-7,34 (m, 2H), 7,28 (t, J=7,7 Гц, 1H), 6,90-6,87 (m, 1H), 6,67-6,63 (m, 2H), 6,31 (dd, J=1,5 Гц, J=7,5 Гц, 1H), 6,07 (t, J=7,5 Гц, 1H), 4,15-4,04 (m, 2H), 3,94-3,88 (m, 2H), 3,80-3,77 (m, 1H), 3,75-3,68 (m, 2H), 2,33 (гептет, J=7,0 Гц, 1H), 1,66-1,45 (m, 21H), 1,41-1,38 (m, 3H), 1,29 (d, J=7,0 Гц, 3H), 1,21 (d, J=7,0 Гц, 3H), 1,08 (d, J=7,0 Гц, 3H), 1,04-0,98 (m, 9H), 0,91 (d, J=7,0 Гц, 3H), 0,89-0,85 (m, 6H), 0,79-0,70 (m, 3H), 0,32 (d, J=7,0 Гц, 3H).13C ЯМР: (125 МГц, CD2Cl2)
δ ppm: 281,27, 224,79, 224,23, 180,87, 152,55, 149,53, 149,20, 148,87, 147,47, 138,38, 136,02, 130,06, 129,05, 125,44, 124,45, 124,29, 124,05, 122,74, 117,33, 111,44, 31,87, 31,74, 29,70, 29,03, 28,23, 27,34, 26,89, 24,26, 23,84, 23,03, 21,35.
В следующих примерах используемые конкретные условия реакции, а также соответствующие комплексы, используемые в качестве (пре)катализаторов, представлены в соответствующих таблицах.
Пример 8 - метатезис с замыканием цикла

Диен S1 (100 мг, 0,416 ммоль) помещали в колбу Шленка, затем добавляли дихлорметан (DCM) (4 мл) и хлортриметилсилана (10 мол. %) [в экспериментах №№3 и 13 не добавляли какой-либо химический активатор], а затем (пре)катализатор (1 мол. %). Содержимое колбы перемешивали при температуре 40°C. Неочищенную реакционную смесь, к которой был добавлен винилэтиловый эфир (для того, чтобы погасить реакцию), анализировали с использованием газового хроматографа. Результаты представлены в таблице ниже.

Пример 9 - метатезис с замыканием цикла

Диен S2 (100 мг, 0,393 ммоль) помещали в колбу Шленка, затем добавляли DCM 4 мл и хлортриметилсилан (10 мол. %) [в экспериментах №№3 и 4 без добавления какого-либо химического активирующего агента], а затем (пре)катализатор (1 мол. %). Содержимое колбы перемешивали при температуре 40°C. Сырую реакционную смесь, к которой был добавлен винилэтиловый эфир (для того, чтобы погасить реакцию), анализировали с использованием газового хроматографа. Результаты представлены в таблице ниже.

Пример 10 - перекрестный метатезис

Раствор субстратов S3a (178 мг, 1,48 ммоль) и S3b (510 мг, 2,96 ммоль) в DCM (14 мл) помещали в колбу Шленка, затем добавляли хлортриметилсилан (10 мол. %), а затем (пре)катализатор (1 мол. %). Содержимое колбы перемешивали при температуре 40°C в течение 24 часов. Ход реакции контролировали при помощи газовой хроматографии. Продукт Р3 выделяли с помощью колоночной хроматографии. Результаты представлены в таблице ниже:

Пример 11 - метатезис алкен-алкинового типа

Раствор субстрата S4 (300 мг, 1,21 ммоль) в DCM (12 мл) помещали в колбу Шленка, затем добавляли хлортриметилсилан (10 мол. %) [в случае эксперимента №4 какой-либо химический активирующий агент не добавляли], а затем (пре)катализатор (1 мол. %). Содержимое колбы перемешивали при температуре 40°C. Продукт P4 выделяли с помощью колоночной хроматографии. Результаты представлены в таблице ниже:

Пример 12 - метатезисная полимеризация с раскрытием цикла
Получение полидициклопентадиена: Дициклопентадиен (1 г, 7,56 ммоль) загружали в виалу для полимеризации на воздухе и после его плавления виалу помещали на масляную баню при температуре 28°C. Затем добавляли соответствующие количества (пре)катализатора (в виде твердого вещества в экспериментах 2, 3, 6-11 или в виде раствора в минимальном количестве дихлорметана) и также химический активирующий агент (4 эквивалента по отношению к (пре)катализатору; без добавления активирующего агента в экспериментах 1-3) и виалу переносили на баню при соответствующей температуре (как указано в приведенной ниже таблице) и выдерживали в течение соответствующего периода времени (как указано в приведенной ниже таблице). Затем в виалу добавляли толуол и нагревали с обратным холодильником для того, чтобы вымыть непрореагировавший дициклопентадиен. Нерастворимый полидициклопентадиен P5 промывали толуолом и сушили при пониженном давлении в течение 12 ч. Результаты экспериментов представлены в таблице ниже:
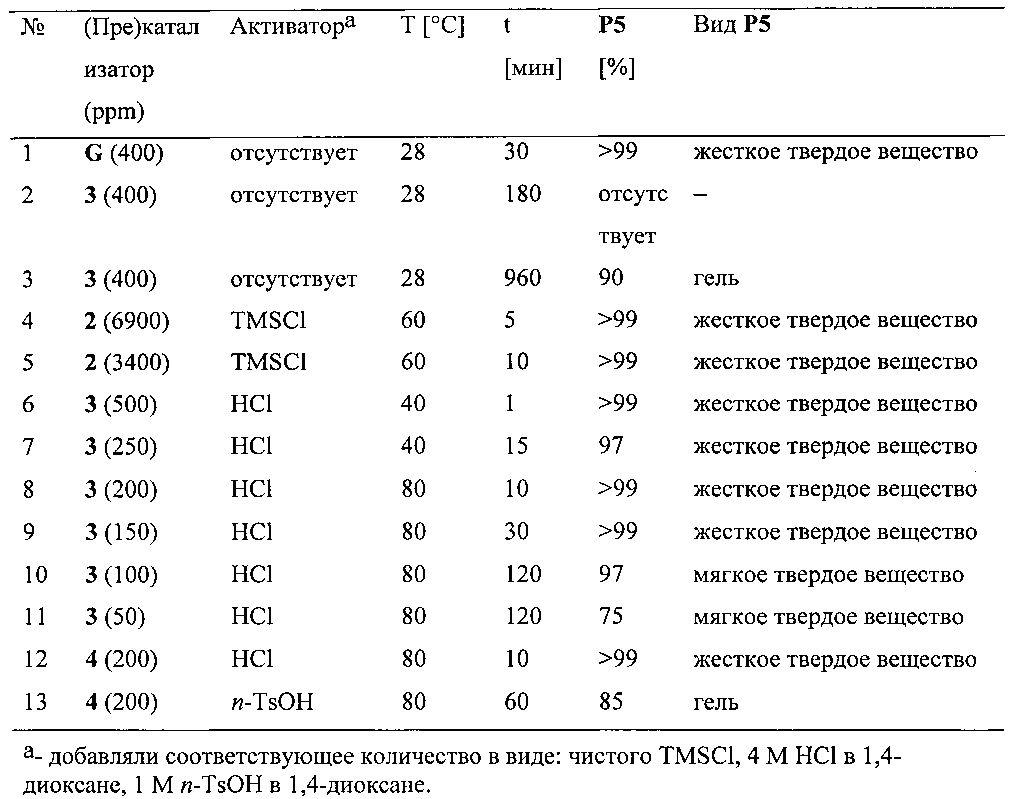
Пример 13 - метатезисная полимеризация с раскрытием цикла
Получение полидициклопентадиена: Дициклопентадиен (10 г, 76 ммоль) загружали в виалу для полимеризации на воздухе и после плавления помещали виалу на масляную баню при температуре 28°C. Затем добавляли (пре)катализатор 4 (в виде раствора в минимальном количестве дихлорметана) и виалу выдерживали на бане при температуре 28°C в течение 24 ч. Какого-либо преобразования субстрата не наблюдали (виала содержала только жидкий мономер). Затем HCl (4 эквивалента по отношению к (пре)катализатору, раствор в 1,4-диоксане) добавляли в виалу, виалу переносили на баню при температуре 60°C. Через 10 минут в виалу добавляли толуол и нагревали с обратным холодильником для того, чтобы вымыть непрореагировавший дициклопентадиен. Нерастворимый полидициклопентадиен, (P5) промывали толуолом и сушили при пониженном давлении в течение 12 ч. Выход реакции составил >99%.
Как показано в Примерах 8-13, комплексы общей формулы 1 в соответствии с изобретением после химической активации эффективно способствовали протеканию реакции метатезиса олефинов. В частности, комплексы 3 и 4 демонстрировали очень высокую эффективность в полимеризации с раскрытием цикла (ROMP) дициклопентадиена. Инициирование указанной реакции полимеризации можно в очень высокой степени контролировать благодаря отложенному характеру инициирования, характеризующему комплексы общей формулы 1. Известные из уровня техники комплексы формул D и D′ демонстрируют сходные и эффективность, как следует из литературных данных. Однако эти комплексы синтезируют с помощью соответствующих производных таллия, которые опасны для здоровья (соединения таллия, используемые в синтезе, очень токсичны); их применение также удлиняет и усложняет синтез таких комплексов. Свойства комплексов общей формулы 1 можно значительно изменять путем выбора соответствующих лигандов. Кроме того, высокая стабильность комплексов общей формулы 1 позволяет проводить процесс полимеризации в присутствии кислорода; благодаря этому нет необходимости в дезоксигенировании коммерчески доступного дициклопентадиена и также нет необходимости в использовании среды инертного газа в ходе самого процесса. Неожиданно было обнаружено, что ход реакции полимеризации (форму полимера) можно контролировать путем выбора активирующего агента. Например, применение 200 ppm комплекса 4 делает возможным получение жесткого твердого полимера в течение 10 минут, если для активации использовали хлороводород, тогда как применение n-толуолсульфокислоты (n-TsOH) позволяет получить полимер в виде геля. Дополнительным преимуществом некоторых комплексов общей формулы 1 является их превосходная растворимость в чистом жидком DCPD. Это исключает необходимость предварительного растворения (пре)катализатора в органическом растворителе. Как показано в Примерах 8, 12 и 13, комплексы общей формулы 1, содержащие электроноакцепторную группу, инициируют реакцию метатезиса медленнее, чем незамещенные комплексы. Таким образом, наблюдается эффект, обратный по сравнению с эффектом классических комплексов типа Ховейды-Граббса (Н и I). Как показано в Примерах 12 и 13, это имеет большое значение в случае полимеризации DCPD. Смесь комплекса 4 и мономера можно получать даже за 24 часа до планируемого запуска полимеризации в пресс-форме, тогда как комплекс 3 за это время вызывает частичную полимеризацию мономера.
Реферат
Изобретение относится к комплексу общей формулы 1:Значения радикалов следующие: X представляет собой анионный лиганд, такой как галоген; Y представляет собой кислород; Lпредставляет собой нейтральный лиганд формулы PR(R)(R), где R, Rи Rпредставляют собой Сциклоалкил; или Lпредставляет собой N-гетероциклическое соединение; Lпредставляет собой N-гетероциклический карбеновый лиганд формулы 2а или 2b:где R, Rнезависимо представляют собой С-Сарил, возможно замещенный по меньшей мере одним C-Салкилом; R, R, R, Rпредставляют собой водород или С-Салкил; Rпредставляет собой водород; R, R, Rи Rнезависимо представляют собой водород или нитро. Также предложены применение комплекса общей формулы 1 в качестве (пре)катализаторов для реакций метатезиса олефинов и способ проведения реакций метатезиса олефинов. Изобретение позволяет получить комплексы общей формулы 1, которые стабильны и могут быть получены без какой-либо защитной атмосферы инертного газа, а также в растворителях ч.д.а., и которые можно эффективно использовать для проведения реакций метатезиса олефинов. 3 н. и 19 з.п. ф-лы, 5 табл., 13 пр.
Формула

где
X представляет собой анионный лиганд, такой как галоген;
Y представляет собой кислород;
L1 представляет собой нейтральный лиганд формулы PR9(R10)(R11), где R9, R10 и R11 представляют собой С3-12 циклоалкил; или L1 представляет собой N-гетероциклическое соединение;
L2 представляет собой N-гетероциклический карбеновый лиганд формулы 2а или 2b:

где
R12, R13 независимо представляют собой С5-С14 арил, возможно замещенный по меньшей мере одним C1-С6 алкилом; R14, R15, R16, R17 представляют собой водород или С1-С12 алкил;
R1 представляет собой водород;
R2, R3, R4 и R5 независимо представляют собой водород или нитро.
X представляет собой галоген;
L1 представляет собой нейтральный лиганд формулы PR9(R10)(R11), где R9, R10 и R11 независимо представляют собой C3-12 циклоалкил; или L1 представляет собой N-гетероциклическое соединение;
L2 представляет собой N-гетероциклический карбеновый лиганд формулы 2а или 2b, как определено выше.
X представляет собой хлор;
R1 представляет собой водород;
R2, R3, R4 и R5 независимо представляют собой водород или нитро;
Y представляет собой кислород;
L1 представляет собой трициклогексилфосфин, пиридин или 3-бромпиридин;
L2 представляет собой лиганд формулы 2a или 2b:
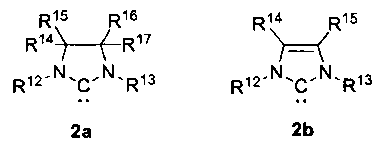
где
R12, R13 независимо представляют собой С5-С14 арил, необязательно замещенный по меньшей мере одним С1-С6 алкилом;
R14, R15, R16, R17 независимо представляют собой водород или С1-С12 алкил.
X представляет собой хлор;
R1 представляет собой водород;
R2, R3, R4 и R5 независимо представляют собой водород или нитро;
Y представляет собой кислород;
L1 представляет собой трициклогексилфосфин;
L2 представляет собой лиганд SIMes или SIPr:


Комментарии