Способ получения комплексных соединений щелочных металлов - SU1003758A3
Код документа: SU1003758A3
Описание
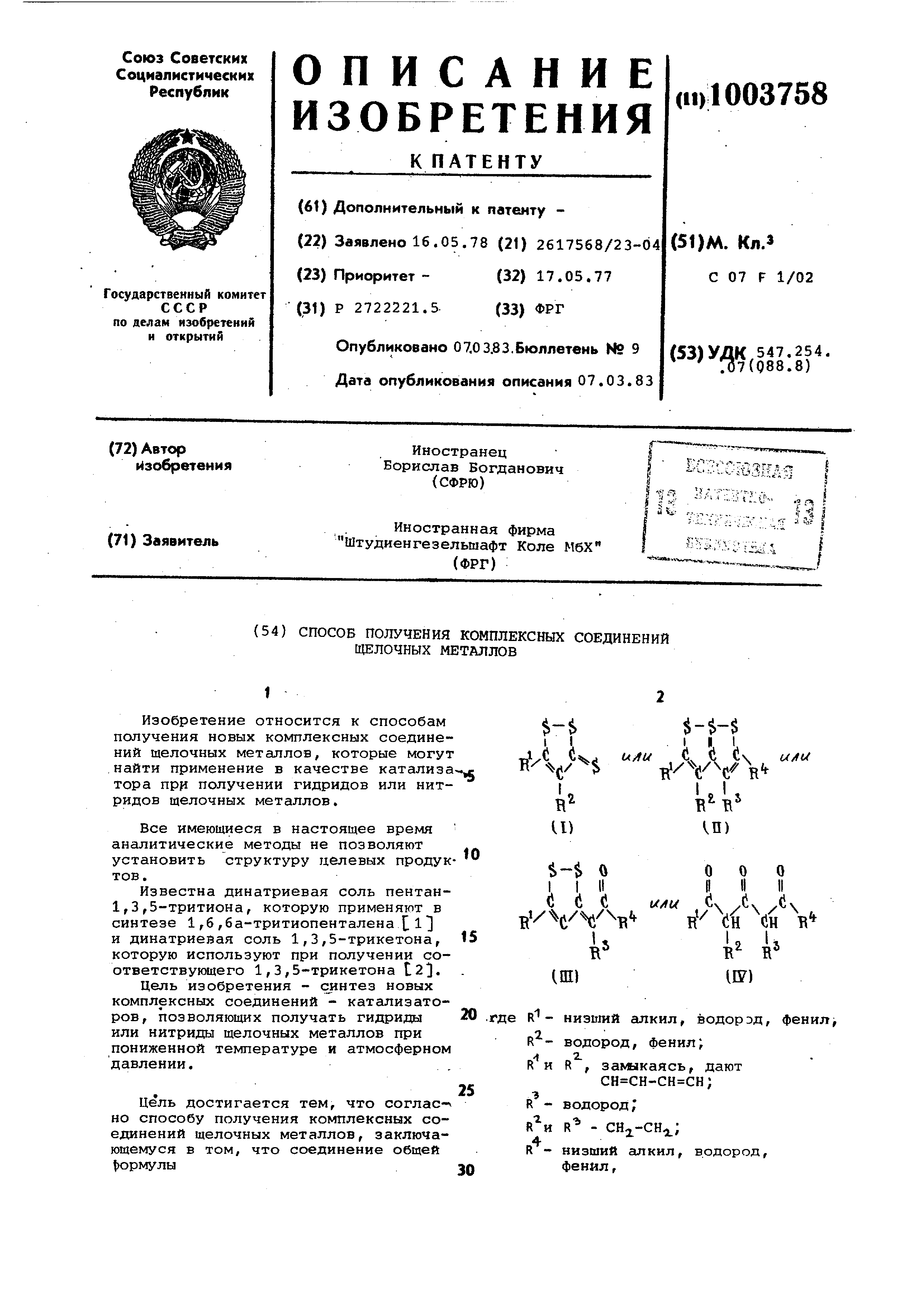
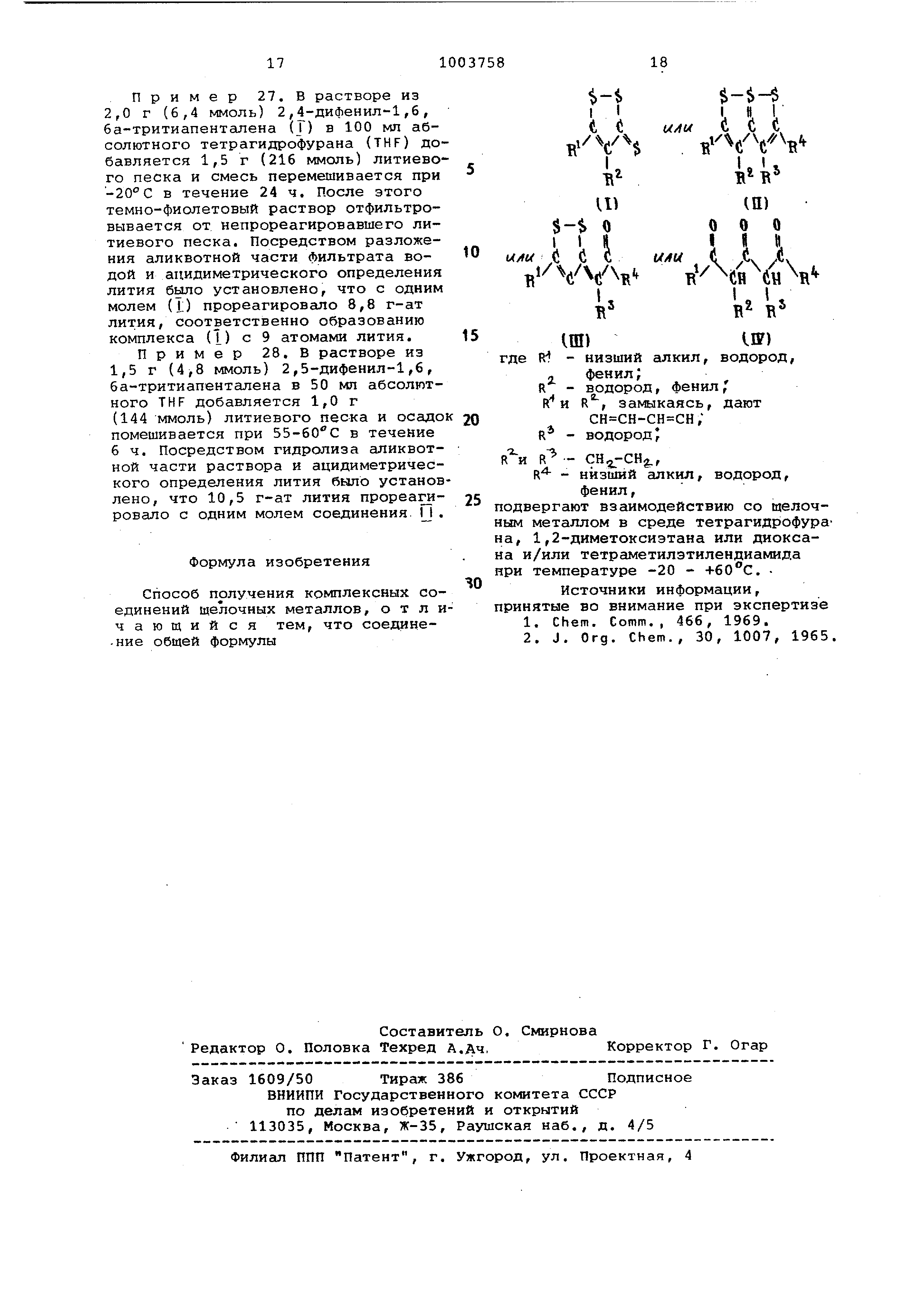
(54) СПОСОБ ПОЛУЧЕНИЯ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ ЩЕЛОЧНЫХ МЕТАЛЛОВ Изобретение относится к способам получения новых комплексных соединений щелочных металлов, которые могут найти применение в качестве катализа тора прр получении гидридов или нитридов щелочных металлов. Все имеющиеся в настоящее время аналитические методы не позволяют установить структуру целевых продук тов. Известна динатриевая соль пентан1 ,3,5-тритиона, которую применяют в синтезе 1,6,6а-тритиопенталена 1 и динатриевая соль 1,3,5-трикетона, которую используют при получении соответствующего 1,3,5-трикетона 12. Цель изобретения - cjiHTe3 новых комплексных соединений - катализаторов , позволяющих получать гидриды или нитриды щелочных металлов при пониженной температуре и атмосферном давлении. Цель достигается тем, что согласно способу получения комплексных соединений щелочных металлов, заключающемуся в том, что соединение общей )ормулы 1 $-$ -V с §-$ О I I II .(i ( i (i (i R/ i H B U i I E B R - низший алкил, водорэд, фенил. R - водород, фенил; 1 2. R и R , залыкаясь, дают сн сн-сн сн; R - водород; R - .; R - низший алкил, водород, фенил г
подвергают взаимодействию со щелочным металлом в среде тетрагидрофурана , 1,2-диметоксиэтана или диоксана и/или тетраметилэтилендиамида при температуре -20 - +60С.,
Число атомов щелочного металла в комплексах щелочных металлов, получаемых с помощью предлагаемого способа, в большой мере зависит от структуры применяемого в каждом отдельном случае соединения Т-IV или от типа его заместителей, щелочного металла, применяемого простого эфира , соответственно, амина и от условий , при которых проводят реакцию. Так, например, 1,2-дитиол-З-тион (I , R , R Н) реагирует с литием в тетрагидрофуране при с образованием дилитиевого производного, в п зотивоположность- чему при действии 4-фенил-1,2-дитиол-З-тиона .(l,R Н, R CgHj) с литием при таких же реакционных условиях получается литиевый комплекс с семью атомами лития в молекуле.
Получаемые предлагаемым способом комплексы щелочных металлов с более чем двумя атомами щелочного металла представляют собой обладающие высокой реакционной способностью металлоорганические соединения, чувствительные к действию воздуха и влаги, вследствие чето их получение необходимо осуществлять в атмосфере защитного газа. Получаемые предлагаемым способом комплексы щелочных металлов могут содержаться в растворе и затем применяться в растворенной форме, однако они также могут использоваться для катализатора в твердой, трико измельченной форме.
Предлагаемые комплексы щелочных металлов с несколькими а;томами щелочного металла в молекуле могут быть применены как таковые, так и в комбинации , например, с соединениями переходных металлов, для получения гидридов щелочных металлов, фиксирования молекулярного азота, а также в качестве катгшизаторов гидрирования .
Пример. К раствору 3,73 г (12,0 ммоль) 2,4-дифенил-1,6,ба-трйтиапенталена (j) в 200 мл абсолютного тетрагидрофурана (ТГФ) прибавляли 1,49 г (214 мг-ат) мелко измельчен-: ного лития и приготовленную смесь перемешивали в течение 18 ч при . После этого раствор, окрашенный в цвет от глубокого фиолетового до черного , отделяли при 0°С посредством фильтрования от не вступившего во взаимодействие мелко измельченного лития. Посредством разложения алик вотной части (2,0 мл) полученного раствора водой и ацидиметрического определения лития устанавливали, что 9,81 г-ат лития прореагировало с молем соединения (1), что соответствует степени превращения исходного соединения () в указанный ниже комплекс 98%. С целью выделения литиевого комплекса в твердой форме, тетрагидрофурановый раствор при ,и перемешивании смешивали с 500 мл пентана и смесь выдерживали в течение 2 ч. Затем окрашенную в черный цвет суспензию фильтровали при 0°С, полу0 ченный осадок промывали пентаном и сушили в вакууме (10 мм рт. ст.) при 20°С до постоянного веса. В результате получали 4,96 г (91,4%) комплекса, обладающего высокой чув5 ствительностью к действию воздуха. Рассчитано, %: С 55 ,63; Н 4 ,45 ; S 21,19; Li 15,32,
Cj H SjOLi o (М.в. 453,4). Найдено, %: С 55,22; Н 4,65,
0 S 21,13; Li 15,10.
Вьщеленный в твердой форме комплекс растворим в тетрагидрофуране, причем в результате прибавления пентана к тетрагидрофурановому раствору
снова может быть осажден комплекс ггакого же состава.
.П р и м е р 2. По ансшогии с примером 1 1,06 г (3,36 ммоль) 2,4-дифенил-1 ,6 ,6а-три1иапенталена (Г)
вводили во взаимодействие с 0,57 г (82,2 мг-ат) мелко измельченного лития в 50 МП тетрагидрофурана при . После проведения реакции в течение 5 ч раствор отделяли от не
5 вступившего во вз-аимодействие мелко измельченного лития и посредством гидролиза избыточного количества лития устанавливали, что 9,7 г-ат лития вступало в реакцию с молем
0 соединения (1), что соответствовало степени превращения (1) в декалитиевый комплекс () 97%. С целью- вьщеленИЯ декалитиевого комплекса в виде аддитивного соединения
5 с 1,2-диметоксиэтаном, раствор упаривали в вакууме (0,2-0,3 мм рт. ст.) до 25 мл и при 0°С остаток смешивали с 20 мл 1,2-диметоксиэтана, причем происходило выделение окрашенного д в черный цвет осадка. Суспензию выдерживали в течение 3 ч при , отфильтровывали осадок от имеющего глубокую окраску раствора, после чего осадок сушили в вакууме (20°С, 10 мм рт. ст.) до постоянного веса.
В результате получали 0,82 г
(51,5%) обладающего высокой чувствительностью к действию воздуха комплекса .
Рассчитано, % С 53,4; Н 4,70;
0 Li 14,70.
., (М.в. 471,5) Найдено, %: С 53,0; Н 4,80; Li 14,67.
Посредством добавления 40 мл
5 1,2-диметоксиэтана к маточному раствору можно было дополнительно вьщелить 0,27 г (17% от теоретически рассчитанного значения) такого же комплекса (рассчитано 14,70%, найде но 14,50%), так что общий выход полученного комплекса составлял 1,09 или 68,5% от теоретически рассчитан ного значения. П р и м-е р 3. По аналогии с примером 1 1,98 г (6,33 ммоль) 2,4-дифенил-1 ,6,6а-тритиапенталена (Т) вво дили-во взаимодействие с 3,59 г (156 мг-ат) мелко измельченного нат рия в 60 мл тетрагидрофурана при После проведения реакции в течение 21 ч имеющий глубокую фиолетовую ок раску раствор натриевого комплекса отделяли фильтрованием при О С от не вступившего во взаимодействие мел ко измельченного натрия. Посредством разложения аликвотной части получен ноге раствора водой и ацидиметричес кого определения натрия устанавлива ли,, что 9,98 г-ат натрия прореагиро вало с молем 2 4-дифенил-1,6,6а-тритиапентаьлена (1), что соответствовало практически количественному превращению исходного соединения (I) в деканатриевый комплекс (Т). Посредством добавления 120 мл 1,2-диметоксиэтана к тетрагидрофурановому раствору, по аналогии с описанным в примере 2, выделяли в твердой форме с выходом 2,30 г (57,5% от теоретически рассчитанного значения) деканатриевЕой комплекс в форме аддитивного соединения с 1,2-диметоксиэтанолом и соотношением I;. Рассчитано, %: На 36,4. (м. в. 632,4). Найдено, %: Na 36,25. Пример4. По аналогии с примером 1 2,15 г (6,90 ммоль) 2,5-дифенилг б ,6а-тритиапенталена ( М ) при вводили во взаимодействие с 1,25 г (179 мг-ат) мелкоизмельченного лития в 50 мл тетрагидрофурана После перемешивания реакционной сме|СИ в течение 16 ч при 0°С раствор, окрашенный в глубокий фиолетовый цвет, отделяли фильтрованием от не вступившего во взаимодействие лития Посредством гидролиза аликвотной час ти полученного раствора и ацидиметри ческого определения лития устанавливали , что соединение (И) практически количественно превр1а1цалось в декалитиевый комплекс (И) (10,2 г-ат лития взаимодействовгшо с молем соединения (П). В результате добавления 200 мл пентана к тетрагидрофурановому раствору с выходом 2,84 г (90,8% от теоретически рассчитанного значения), по аналогии с описанным в примере 1, получали в твердой фор ,ме декалитиевый комплекс в виде 1:1 аддукта с тетрагидрофураном, Рассчитано, %: Li 15,30. (М.в. 453,4) Найдено, %: Li 15,56. Для химической характеристики полученного комплекса использовали, кроме гидролиза, дейтеролиз (уравнение 1). Гидролиз комплекса в твердой форме (в виде аддукта с тетрагидрофураном ) или в тетрагидрофурановом растворе .давал- гидроокись лития, сульфид лития (выход 80% в расчете на связанную в комплексе серу), а также смесь углеводородов, содержащих 17 атомов углерода, которая состояла из изомеров 1,5-дифенил-1,3пентадиена и небольшого количества 1,5-дифенилпентененов (общий выход С-17-углеводородов приблизительно 70% от теоретически рассчитанного значения). При дейтеролизе комплекса получали тетрадейтеро-1,5-дифенил1 ,3-пентадиен и небольшое количество гексадейтеро-1,5-дифенилпентена.. Реакции гидролиза и дейтеролиза могут рассматриваться как доказательтво строения углеводородных остатков, (Которые находятся в комплексе. Кроме рого, декалитиевый комплекс 2,5-дифенил-1 ,0,6а-триапенталена охарак- теризован по его полосе поглочения на УФ-спектре около 580 нм, 11000 (в виде 51р молярного раствора в тетрагидрофуране). Пример 5. По аналогии с примером 1 0,84 г (2,84 ммоль) альфа- (4-фенил-1,2-дитиол-З-илиден)ацетофенона (I И) при вводили во взаимодействие с 0,51 г (73 мг-ат) мелко измельченного лития в 60 мл тетрагидрофурана. После перемешивания реакционной смеси в течение 18 ч при 0° С окрашенный в глубокий фиолетовый цвет раствор литиевого комплекса отделяли посредством фильтрования при 0°С от избыточного количества лития. После ацидиметрического определения количества лития в растворе оказалось, что 10,1 г-ат лития реагирует с молем соединения (Т1I) с образованием дeJ aлитиeвoгo комплекса соединения (II). Пример 6. К раствору, содержащему 9,46 г (35,6 ммоль) 1,5-дифенилпентан-1 ,5,5-триона (П/) в 450 мл абсолютного тетрагидрофурана, прибавляли 14,3 г (2,06 моль) мелкоизмельченного лития и смесь перемешивали при , причем после перемешивания в течение приблизительно 24 ч раствор принимал глубокую сине-фиолетовую окраску. После проведения реакции в течение 40 ч раствор отделяли фильтрованием от избыточного количества лития и посредством гидролиза аликвотной части раствора и ацидиметрического определения лития определяли , что 10,06 г-ат лития реагируют с молем трикетона ( LV-) t что соответствует количественному превращению трикетона в декалитиевый комплек соединения () С целью выделения комплекса в твердой Форме, раствор упаривали в вакууме до 200 мл, остаток смешивали с 400 мл тетраметилэти лендиамина (Me NCH-j CH NMe) и смесь перемешивали в течение 2 ч при . В результате фильтрования и сушки осадка в высоком вакууме с выходом 8,50 г (40% от теоретически рассчитанного значения) получали в твердой форме декапитиевый комплекс трикето на () в виде аддитивного соединения с 1 моль тетраметилэтилендиамина и 2 моль тетрагидрофурана. Рассчитано, %: N 4,70; Li 11,66. .дНаОрЬцо (М.В.. 595,4). Найдено, %: N 4,72J Li 11,48. Пример 7.К раствору, содержагаему 3,61 г (13,6 ммоль) 1,5-д фенилпентан-1,3,5-триона () в 115 мл абсолютного 1,2-диметоксиэта на ( , ) , прибавляли 6,4 ( 0,92 г-ат) мелко измельченного литин и приготовленную смесь перемеши вали при . За ходом реакции след ли посредством того, что через опре деленные промежутки времени отбирал от суспензии пробы по 5,0 мл. 11робы отфильтровывали от избыточного коли чества лития, фильтраты разлагали водой и титровали 0,1 и. раствором соляной, кислоты. После проведения реакции в течение 2,27 и 48 ч обнаруживали в растворе концентрации лития соответственно 7,9, 9,8 и 10,3 г-ат на моль соединения (LV). Это соответствовало количественному превращению трикетона (0) в описан ный в примере 6 декалитиевый комплекс соединения (у) , причем в это примере применяли в качестве реакционной среды 1,2-диметоксиэтан вме то тетрагидрофурана. Пример 8. По ан алогии с примером 1 2,02 г (9,9 ммоль) 6-фенилгексан-2 ,4,Б-триона (V) при вводили во взаимодействие с 2,85 г (0,41 г-ат) мелко измельченного лития в 75 мл тетрагидрофурана. После проведения реакции в течение 50 ч раствор отделяли посредством фильтрования и избыточного количества мелко измельченного лития и, как описано в примере 1, устанавливали, что 5,2 г-аТ лития реагирует с молем трикетона (V), что соответствуе количественному превращению трикето на (V) в пентсшитиевый комплекс. С целью выделения комплекса, раство упаривали в вакууме до 15 мл, остаток смешивали с 35 мл тетраметилэти лендиамина при и затем раствор упаривали в вакууме до 30 мл. Полученную в результате этого суспензиг перемешивали в течение 2 ч при , после чего производили фильтрование и полученный осадок сушили в высоком вакууме. В результате получали 2,05 г (56% от теоретиче1ски рассчитанного значения) комплекса. Рассчитано, %: N 3,80 L1 9,41. S 8 6o eNaLl,o (М.в. 737,4) . Найдено, %: N 3,81; Li 9,18. Пример 9. По аналогии с примером 1 1,05г (5,58 ммоль) 2,диметил-1 ,6,ба-тритиапенталена (Vj) при вводили во взаимодействие с 0,72 г (103 мг-ат) мелко измельченного лития в 30 мл тетрагидрофурана . После проведения реакции в течение 3ч, по аналогии с описанным в примере 1, устанавливали, что 4,0 г-ат лития реагируют с молем соединения (V,) а через последугацие 5 ч перемешивания реакционной смеси при концентрации лития в растворе практически оставалась постоянной . В соответствии с этим при 0°С в растворе происходило образование тетралитиевого комплекса соединения (yj). Пример 10. По аналогии с примером 1 0,27 г (1,3 25моль)..5-Фе нил-1,2-дитиол-З-тиона (УП ) при вводили во взаимодействие с 0,27 г (38 мг-ат) мелко измельченного лития в 50 мл тетрагидрофурана. Через различные промежутки времени от суспензии отбирали пробы по 0,5мл, пробы фильтровали, ({ильтрат смешивали с водой и избытком 0,1 н. соляной кислоты, после чего производили обратное титрование 0,1 н. раствором гидроокиси натрия. После проведения реакции в течение 3 ч было установлено, что 7,04 г-ат лития вступают в реакцию с молем соединения (Vil), и ц течение последующего часа концентрация лития в растворе практически оставалэсь постоянной . В .соответствии с этим, из сбединения (VII Г и лития при в тетрагидрофуране образовался гек салитиевый комплекс соединения (ViJ). С целью выделения комплекса в твердой форме, раствор отделяли фильтрованием от избыточного количества лития, смешивали с 33 мл тетраметилендиамина и упаривали в вакууме до 40 МП. В результате фильтрования и сушки образовавшегося осадка в высоком вакууме получали 0,38 г (66% от теоретически рассчитанного значения ) гекс литиевого комплекса соединения () в форме его 1:1 аддукта с тетраметилэтилендиамином и тетрагидрофураном . Рассчитано, %: N 6,27, Li 10,9. ,,S,NaOLi .(М.в. 448,2) Найдено, %: N 5,96; Li 11,4. Пример 11. По аналогии с примером 1 0,57 г (2,73 ммоль) 4-фенил-1 ,2-;Цитиол-3-тиона (VI II ) при вводили во взаимодействие с 2,34 г (102 мг-ат) мелкоизмельченно|Го натрия в 100 мл тетрагидрофурана. По аналогии с описанным в примере 10,
Время проведения реакции, ч
следили за ходом реакции посредством отбора проб (15,0 мп) и ацидометрического определения натрия в пробах. Течение реакции по времени :
I
Г-ат Ма I Окраска Моль (VI И)|раствора







Реферат

Формула


Комментарии