Соединения для органических электронных устройств - RU2419648C2
Код документа: RU2419648C2
Описание
Изобретение описывает новые соединения и их применение в органических электронных устройствах.
Общая структура органических электролюминесцентных устройств описана, например, в US 4539507, US 5151629, EP 0676461 и WO 98/27136. Однако эти устройства все еще демонстрируют большие проблемы, которые требуют незамедлительного решения путем усовершенствования:
1. Эффективность, особенно в случае флуоресцентных ОСИД (органических светоиспускающих диодов), остается очень низкой и должна быть повышена.
2. Операционная продолжительность жизни остается низкой, в частности, в случае голубого излучения, это означает, что до сих пор является возможным достичь только простого коммерческого применения.
3. Операционное напряжение является достаточно высоким в случае флуоресцентных ОСИД и, таким образом, должно быть снижено для того, чтобы улучшить коэффициент полезного действия. Это составляет огромную важность для мобильного применения.
4. Многие излучающие голубой свет эмиттеры, которые включают как ароматические амины, так и винильные группы, являются термически нестабильными и разлагаются при сублимации или при нанесении методом испарения. Следовательно, применение этих систем является возможным только с большими потерями и с высокой технической сложностью, если вообще такое возможно.
5. В материалах для слоя, обеспечивающего транспорт дыр, в соответствии с уровнем техники напряжение зависит от толщины транспортного слоя. На практике была бы желательной большая толщина слоя, обеспечивающего транспорт дыр. Однако этого нельзя достичь при использовании материалов в соответствии с уровнем техники по причине ассоциированного с этим повышения напряжения.
В качестве ближайшего аналога может быть упомянуто применение определенных арилвиниламинов Idemitsu (например, WO 04/013073, WO 04/016575, WO 04/018587). В этих источниках приведены очень хорошие сроки службы для устройств с темно-голубым излучением. Однако эти результаты являются чрезвычайно зависимыми от используемого материала основы, что означает, что приведенные сроки службы не могут сравниваться как абсолютные значения, а вместо этого всегда только при использовании оптимизированной системы. Кроме того, эти соединения являются термально нестабильными и не могут испаряться при отсутствии разложения, что, таким образом, делает технически очень сложным получение ОСИД и, таким образом, представляет собой важное техническое препятствие. Дополнительное препятствие заключается в цвете излучения этих соединений. Несмотря на то что Idemitsu продемонстрировал темно-голубую эмиссию (CIE в интервале координат 0,15-0,18), не представилось возможным воспроизвести эти координаты цвета в простых устройствах в соответствии с уровнем техники. В противовес этому, была получена зелено-голубая эмиссия. Является непонятным, каким образом могла быть фактически получена голубая эмиссия при использовании этих соединений.
Таким образом, существует потребность в соединениях, излучающих голубой свет, что приводит к хорошей эффективности в устройствах для электролюминесценции и в то же время обеспечивает длительные сроки службы, указанные соединения могут подвергаться переработке без каких-либо технических проблем. Неожиданно было обнаружено, что устройства для органической электролюминесценции, которые включают определенные соединения - упомянутые ниже - в качестве испускающих голубое излучение допантов (допирующих веществ) в материале хозяина, имеют важные преимущества по сравнению с уровнем техники. При использовании этих материалов является возможным получить более длительные сроки службы вместе с более высокой эффективностью. Кроме того, эти соединения могут, в отличие от соединений уровня техники, быть сублимированы без заметного разложения, даже в относительно больших количествах, и являются, таким образом, значительно более легкими в обращении, чем материалы в соответствии с уровнем техники. Настоящее изобретением, таким образом, относится к соединениям и к их применению в ОСИД.
Изобретение относится к соединениям формулы (1)

где используются следующие символы и индексы:
Y, Z являются идентичными или различными и представляют собой N, Р, Р=O, PF2, P=S, As, As=O, As=S, Sb, Sb=O, Sb=S, Bi, Bi=O, Bi=S, C=O, O, S, Se, Те, S=O, SO2, Se=O, SeO2, Te=O или ТеО2;
Ar1, Ar2, Ar3 являются в каждом случае идентичными или различными и представляют собой арильную или гетероарильную группу, содержащую от 5 до 24 ароматических кольцевых атомов, которые могут быть замещенными одним или более радикалами R1;
Ar4, Ar5, Ar6, Ar7 являются в каждом случае идентичными или различными и представляют собой ароматическую или гетероароматическую кольцевую систему, содержащую от 5 до 40 ароматических кольцевых атомов, которые могут быть замещенными одним или более радикалами R1;
Е в каждом случае, идентично или различно, представляет собой одинарную связь, N(R1), О, S, C(R1)2, Si(R1)2 или B(R1);
R1 в каждом случае, идентично или различно, представляет собой H, F, Cl, Br, I, CN, NO2, B(OR2)2, Si(R2)3, алкил с неразветвленной цепью, алкокси или тиоалкокси группу, содержащую от 1 до 40 атомов С, разветвленную или циклическую алкильную группу, алкокси или тиоалкокси группу, содержащую от 3 до 40 атомов С, каждый из которых может быть замещенным одним или более радикалами R2, где одна или более несмежных СН2 групп могут быть заменены -R2C=CR2-, -C≡C-, Si(R2)2, Ge(R2)2, Sn(R2)2, C=O, C=S, C=Se, C=NR2, -O-, -S-, -COO- или -CONR2- и где один или более атомов Н могут быть заменены F, Cl, Br, I, CN или NO2, или ароматическую или гетероароматическую кольцевую систему, содержащую от 5 до 40 ароматических кольцевых атомов, которые могут быть замещены одним или более неароматическими радикалами R1, или арилокси или гетероарилокси группу, содержащую от 5 до 40 ароматических кольцевых атомов, которые могут быть замещенными одним или более неароматическими радикалами R1, или комбинацию этих систем; в данном случае два или более заместителей R1 могут образовывать моно- или полициклическую кольцевую систему друг с другом;
R2 в каждом случае, идентично или различно, представляет собой Н, алифатический или ароматический углеводородный радикал, содержащий от 1 до 20 атомов С;
Х1, Х4 являются в каждом случае идентичными или различными и представляют собой мостиковую связь, которая с Аr1 и Аr2 определяет циклическую систему, выбранную из B(R1), C(R1)2, Si(R1)2, C=O, C=NR1, С=C(R1)2, O, S, S=O, SO2, N(R1), P(R1), P(=O)R1, P(=S)R1 или комбинацию двух, трех или четырех этих групп;
Х2, Х3 являются в каждом случае идентичными или различными и представляют собой мостиковую связь, которая с Аr2 и Аr3определяет циклическую кольцевую систему, выбранную из B(R1), C(R1)2, Si(R1)2, C=O, C=NR1, C-C(R1)2, O, S, S=O, SO2, N(R1), P(R1), P(=O)R1, P(=S)R1 или комбинацию двух, трех или четырех этих групп;
n, о, р являются в каждом случае идентичными или различными и представляют собой 0 или 1, при условии, что n, p и о могут только одновременно быть равными 0, если X1 представляет собой группу, отличную от C(R1)2 мостиковой связи, где R1 = алкильный радикал с открытой цепью; n=0 и о=0 и р=0 в данном случае означает, что два радикала Н или R1 присутствуют вместо мостиковой связи;
q, r в каждом случае равны 1, если соответствующий центральный атом группы Y или Z представляет собой элемент из 5-й основной группы, и в каждом случае являются равными 0, если соответствующий центральный атом группы Y или Z представляет собой элемент из 4-й или 6-й основной группы;
s равен 1, 2 или 3;
t в каждом случае, идентично или различно, представляет собой 0 или 1, где t=0 означает, что R1 радикалы являются связанными вместо группы Е; кроме того, t=0, если q=0.
Для целей настоящего изобретения, арильная группа или гетероарильная группа означает ароматическую группу или гетероароматическую группу, соответственно содержащую общую ароматическую электронную систему, где арильная группа содержит от 6 до 24 атомов С, а гетероарильная группа содержит от 2 до 24 атомов С и в общей сложности, по крайней мере, 5 ароматических кольцевых атомов. Гетероатомы являются предпочтительно выбранными из N, О и/или S. Для целей настоящего изобретения это может быть гомо- или гетероциклическое кольцо, например, бензол, пиридин, тиофен и т.д. или это может быть сконденсированная ароматическая кольцевая система, в которой, по крайней мере, два ароматических или гетероароматических кольца, например, кольца бензола, являются сконденсированными друг к другу, то есть имеют, по крайней мере, один общий край и, таким образом, также общую ароматическую систему. Эта арильная или гетероарильная группа может быть замещенной или незамещенной; любой присутствующий заместитель может также образовывать дополнительные кольцевые системы. Соответственно, такие системы, как например, нафталин, антрацен, фенантрен, пирен и т.д., являются такими, которые относятся к арильным группам для целей настоящего изобретения, а хинолин, акридин, бензотиофен, карбазол и т.д. являются такими, которые относятся к гетероарильным группам для целей настоящего изобретения, несмотря на то, что, например, бифенил, флуорен, спиробифлуорен и т.д. не являются арильными группами, поскольку здесь присутствуют раздельные ароматические электронные системы.
Для целей настоящего изобретения ароматическая кольцевая система содержит от 6 до 40 атомов С в кольцевой системе. Для целей настоящего изобретения гетероароматическая кольцевая система содержит от 2 до 40 атомов С и, по крайней мере, один гетероатом в кольцевой системе, при условии, что общее число С атомов и гетероатомов составляет, по крайней мере, 5. Гетероатомы являются предпочтительно выбранными из N, О и/или S. Для целей настоящего изобретения ароматическая или гетероароматическая кольцевая система означает систему, которая не содержит обязательно арильные или гетероарильные группы, но в которой, в дополнение, множество арильных или гетероарильных групп может быть прервано короткой неароматической единицей (менее чем 10% атомов, отличных от Н, предпочтительно менее чем 5% атомов, отличных от Н), такой, как, например, атом С, N или О. Таким образом, такие системы, как например, 9,9'-спиробифлуорен, 9,9-диарилфлуорен, триариламин, диариловый этер и т.д., также относятся к ароматическим кольцевым системам для целей настоящего изобретения.
Для целей настоящего изобретения С1-С40-алкильная группа, в которой индивидуальные атомы Н или СН2 группы могут также быть замещены упомянутыми выше группами, в частности, предпочтительно означают радикалы метил, этил, н-пропил, и-пропил, н-бутил, и-бутил, втор-бутил, трет-бутил, 2-метилбутил, н-пентил, втор-пентил, циклопентил, н-гексил, циклогексил, н-гептил, циклогептил, н-октил, циклооктил, 2-этилгексил, трифторметил, пентафторэтил, 2,2,2-трифторэтил, этенил, пропенил, бутенил, пентенил, циклопентенил, гексенил, циклогексенил, гептенил, циклогептенил, октенил, циклооктенил, этинил, пропинил, бутинил, пентинил, гексинил или октинил. С1-С40-алкокси группа, в частности, предпочтительно означает метокси, этокси, н-пропокси, и-пропокси, н-бутокси, и-бутокси, втор-бутокси, трет-бутокси или 2-метилбутокси. С2-С24-арильная или гетероарильная группа, которая может быть моновалентной или дивалентной в зависимости от применения и может также быть замещенной радикалами R1 и может быть связанной с ароматической или гетероароматической кольцевой системой посредством любых желаемых положений, означает, в частности группы, которые имеют происхождение от бензола, нафталина, антрацена, фенантрена, пирена, дигидропирена, хризена, перилена, флюорантена, тетрацена, пентацена, бензопирена, фурана, бензофурана, изобензофурана, дибензофурана, тиофена, бензотиофена, изобензотиофена, дибензотиофена, пиррола, индола, изоиндола, карбазола, пиридина, хинолина, изохинолина, акридина, фенантридина, бензо-5,6-хинолина, бензо-6,7-хинолина, бензо-7,8-хинолина, фенотиазина, феноксазина, пиразола, индазола, имидазола, бензимидазола, нафтимидазола, фенантримидазола, пиридимидазола, пиразинимидазола, хиноксалинимидазола, оксазола, бензоксазола, нафтоксазола, антроксазола, фенантроксазола, изоксазола, 1,2-тиазола, 1,3-тиазола, бензотиазола, пиридазина, бензопиридазина, пиримидина, бензопиримидина, хиноксалина, пиразина, феназина, нафтиридина, азакарбазола, бензокарболина, фенантролина, 1,2,3-триазола, 1,2,4-триазола, бензотриазола, 1,2,3-оксадиазола, 1,2,4-оксадиазола, 1,2,5-оксадиазола, 1,3,4-оксадиазола, 1,2,3-тиадиазола, 1,2,4-тиадиазола, 1,2,5-тиадиазола, 1,3,4-тиадиазола, 1,3,5-триазина, 1,2,4-триазина, 1,2,3-триазина, тетразола, 1,2,4,5-тетразина, 1,2,3,4-тетразина, 1,2,3,5-тетразина, пурина, птеридина, индолизина и бензотиадиазола. Для целей настоящего изобретения ароматические и гетероароматические кольцевые системы означают, в частности, бифенилен, трет-фенилен, флуорен, спиробифлуорен, дигидрофенантрен, тетрагидропирен и цис- или транс-инденофлуорен, в дополнение к упомянутым выше арильным и гетероарильным группам.
Предпочтение отдается соединениям формулы (1), в которых символы Y и Z, идентично или различно, обозначают азот, С=O, фосфор или Р=O, в частности, предпочтительно азот, С=O или Р=O. Y и Z особенно предпочтительно обозначают азот.
Предпочтение также отдается соединениям формулы (1), в которых символы Аr1, Аr2 и Аr3, идентично или различно, в каждом случае обозначают арильную или гетероарильную группу, содержащую от 5 до 16 ароматических кольцевых атомов, которые могут быть замещены одним или двумя радикалами R1, особенно предпочтительно арильную или гетероарильную группу, выбранную из бензола, нафталина, антрацена, фенантрена, пиридина, пирена и тиофена, в частности, бензола, каждая из которых может быть замещена одним или двумя радикалами R1. Прямое связывание между Y, Аr1, Аr2, Аr3 и Z, в частности, предпочтительно происходит через пара-положения бензола (или соответствующие положения других ароматических соединений).
В частности, предпочтение, таким образом, отдается соединениям формулы (1а)

где символы и индексы имеют то же значение, как описано выше.
Предпочтение также отдается соединениям Формул (1) и (1а), в которых символы Аr4, Аr5, Аr6 и Аr7, идентично или различно в каждом случае, обозначают ароматическую или гетероароматическую кольцевую систему, содержащую от 5 до 16 ароматических кольцевых атомов, триариламин или спиробифлуорен, каждый из которых может быть замещенным одним или более радикалами R1, в частности, предпочтительно ароматическую или гетероароматическую кольцевую систему, выбранную из бензола, нафталина, антрацена, фенантрена, пиридина, пирена, тиофена, трифениламина, дифенил-1-нафталинамина, дифенил-2-нафталинамина, фенилди(1-нафтил)амина и фенилди-(2-нафтил)амина, каждый из которых может быть замещенным R1. Символы Аr4, Аr5, Аr6 и Аr7, в частности, весьма предпочтительно обозначают, идентично или различно для каждого случая, фенил, 1-нафтил или 2-нафтил, каждый из которых может быть замещен одним или более радикалами R1.
Предпочтение также отдается соединениям Формул (1) и (1а), в которых индекс t=0 или в которых индекс t=1, а соответствующий символ Е обозначает одинарную связь, О, S или N(R1). Весьма предпочтительно, когда предпочтение отдается соединениям Формул (1) и (1а), в которых индекс t=0 или в которых индекс t=1, а соответствующий символ Е обозначает одинарную связь.
Предпочтение также отдается соединениям формулы (1), в которых символ R1, идентично или различно для каждого случая, обозначает H, F, CN, алкильную группу с неразветвленной цепью, содержащую от 1 до 5 атомов С или разветвленную алкильную группу, содержащую от 3 до 5 атомов С, где в каждом случае одна или более несмежных СН2 групп могут быть заменены -R2C=CR2-, -С=С-, -О- или -S- и где один или более атомов Н могут быть заменены F, или моновалентную арильную или гетероарильную группу, содержащую от 5 до 16 ароматических кольцевых атомов, которые могут быть замещены одним или более неароматическими радикалами R1, где два или более радикалов R1 могут образовывать кольцевую систему друг с другом; R1, в частности, предпочтительно обозначает Н, F, CN, метил, трет-бутил или моновалентную арильную или гетероарильную группу, содержащую от 4 до 6 атомов С, которые могут быть замещены одним или более неароматическими радикалами R1, где два ароматических радикала R1 могут образовывать кольцевую систему друг с другом, R1, в частности, весьма предпочтительно означает Н, если он является связанным непосредственно с одной из групп Аr1-Аr7.
R1 является предпочтительно, если он связан с группой X1, X2, X3 и/или X4, а также предпочтительно представляет собой алкильную группу с неразветвленной цепью, содержащую от 1 до 10 атомов С или разветвленную или циклическую алкильную группу, содержащую от 3 до 10 атомов С, где в каждом случае одна или более несмежных СН2 групп могут быть заменены -R2C=CR2-,

Предпочтение также отдается соединениям, в которых р=0 и один из двух индексов n и о равен 1, в то время, как остальные два индекса равны 0; в частности, предпочтительно, р и n=0 и о=1.
Особое предпочтение, таким образом, отдается структурам формул (1b) и (1с), в частности, формулы (1с), показанным ниже

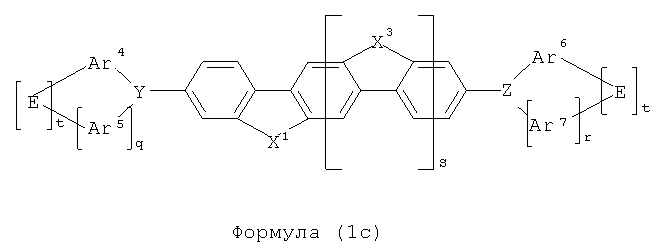
где символы и индексы имеют то же значение, как описано выше.
Предпочтение также отдается соединениям формул (1) и от (1а) до (1с), в которых символы X1, X2, X3 и X4 в каждом случае, идентично или различно, представляют собой мостиковую связь, которая совместно с Аr1 и Аr2 или с Аr2 и Аr3 определяет циклическую систему, выбранную из C(R1)2, C=O, C=NR1, О, S, S=O, SO2, N(R1), P(R1), P(=O)R1, C(R1)2-C(R1)2, C(R1)2-C(R1)2-C(R1)2, C(R1)2-O, C(R1)2-O-C(R1)2. В частности, особое предпочтение отдается соединениям формулы (1), в которых символы X1, X2, X3 и X4 в каждом случае, идентично или различно, являются выбранными из C(R1)2, N(R1), P(R1) и P(=O)(R1), в частности, особенно предпочтительно C(R1)2 и N(R1), в частности, C(R1)2.
В частности, особое предпочтение отдается соединениям формулы (1d)

где символы и индексы имеют то же значение, как описано выше.
В структурах формулы (1d) символы R1 являются предпочтительно выбранными из алкильных групп с неразветвленной цепочкой, содержащих от 1 до 10 атомов С или разветвленных или циклических алкильных групп, содержащих от 3 до 10 атомов С, где в каждом случае одна или две несмежные CH2 группы могут быть заменены -R2C=CR2-,

Если множество радикалов R1 образуют кольцевую систему друг с другом, то образуется спироструктура. Это может быть предпочтительным, если радикалы R1 обозначают фенильные группы. Это дает начало образованию структур общей формулы (1е)

где символы и индексы имеют то же значение, как описано выше и где каждая из спиросистем может быть замещенной одним или более неароматическими радикалами R1.
Предпочтение также отдается соединениям Формул (1) и от (1а) до (1d), в которых символ s=1 или s=2. Особое предпочтение отдается соединениям, в которых s=1.
Предпочтение также отдается соединениям формул (1) и от (1а) до (1е), в которых Y=Z. Особое предпочтение отдается соединениям, в которых, в дополнение, Аr4=Аr6 и, в случае присутствия, Аr5=Аr7 и, в случае присутствия, обе группы Е выбираются идентичными.
Примеры предпочтительных соединений формулы (1) представляют собой структуры от (1) до (104), представленные ниже.











Соединения в соответствии с изобретением, описанные выше, например, соединения в соответствии со структурами (63), (85), (86), (89) и (91), могут применяться, например, в качестве сомономеров для получения соответствующих конъюгированных, частично конъюгированных или неконъюгированных полимеров, олигомеров, а также в качестве ядра дендримеров. Полимеризацию в данном случае предпочтительно осуществляют с помощью галогеновых групп.
Таким образом, изобретение также относится к конъюгированным, частично конъюгированным или неконъюгированным полимерам, олигомерам и дендримерам, включающим одно или более соединений формулы (1), где один или более радикалов R1 представляют собой связи соединения формулы (1) с полимером или дендримером. Единичная структура формулы (1) предпочтительно связывается в полимер с помощью групп Аr4, Аr5, Аr6 и/или Аr7.
Эти полимеры могут включать повторяющиеся звенья. Такие повторяющиеся структурные единицы предпочтительно выбирают из группы, которая состоит из флуоренов (например, в соответствии с ЕР 842208 или WO 00/22026), спиробифлуоренов (например, в соответствии с ЕР 707020, ЕР 894107 или ЕР 04028865.6), триариламинов, пара-фениленов (например, в соответствии с WO 92/18552), карбозолов (например, в соответствии с WO 04/070772 и WO 04/113468), тиофенов (например, в соответствии с ЕР 1028136), дигидрофенантренов (например, в соответствии с WO 05/014689), инденофлуоренов (например, в соответствии с WO 04/041901 и WO 04/113412), ароматических кетонов (например, в соответствии с WO 05/040302), фенантренов (например, в соответствии с WO 05/104264) и/или комплексных соединений металлов, в частности, ортометаллированных комплексов иридия. Следует особо обратить внимание в данном случае, что полимеры могут также содержать множество различных повторяющихся структурных единиц, выбранных из одной или более упомянутых выше групп.
Соединения в соответствии с изобретением могут быть получены синтетическими способами, которые известны специалисту в данной области, такими, как, например, бромирование, конденсация Suzuki, конденсация Hartwig-Buchwald и т.д.
Таким образом, инденофлуореновые предшественники могут быть получены, например, так, как представлено на схеме синтеза 1: конденсация Suzuki бензолбороновой кислоты и 1,4-дибром-2,5-бис(метилкарбоксилат)бензола с последующим открыванием кольца при воздействии сильной кислоты и восстановление обеспечивает получение транс-инденофлуорена, который может быть алкилирован при использовании алкилирующих агентов. Таковой может быть либо галогенирован, например, бромирован, либо превращен в соответствующее аминосоединение с помощью нитрирования и восстановления. Бисдиариламиноинденофлуорены могут быть синтезированы с помощью конденсации Hartwig-Buchwald соединения диброма, как показано на схеме синтеза 2.
Содержащие инденофлуорен фосфины и окиси фосфинов могут быть синтезированы из диброминденофлуорена путем литиирования и реакции с диарилхлорфосфинами, как представлено на схеме синтеза 3. Последующее окисление обеспечивает получение окиси фосфина. В данном случае также могут использоваться другие электрофилы, такие, как, например, AsCl3, арилРСl2, SOCl2, Ar2S2 и т.д. Другие соединения в соответствии с изобретением могут быть легко синтезированы в соответствии с этими и подобными схемами синтеза при использовании процессов, известных специалисту в области органического синтеза. Кроме того, полученные соединения могут быть бромированы с помощью стандартных процессов, а также могут использоваться в качестве мономеров для полимеров, олигомеров и дендримеров.
Схема синтеза 1: Предшественники производных инденофлуорена



Схема синтеза 2: Соединения инденофлуоренамина

Схема синтеза 3: Соединения инденофлуоренфосфина

Электрофилы, которые могут подвергаться аналогичной реакции: AsCl3, SbСl3, BiCl3, арилРСl2, арил2РСl, SCl2, SOCl2, SO2Cl, Ar2S2, Ar2Se2, Ar2Te2 и т.д.
Соединения формулы (1) могут использоваться в органических электролюминесцентных устройствах. Определенное применение соединений в данном случае зависит от заместителей и, в частности, от выбора групп Y и Z, а также от выбора групп от X1 до X4.
В предпочтительном воплощении изобретения соединение формулы (1) используется в эмиссионном слое, предпочтительно в смеси, по крайней мере, с одним дополнительным соединением. Является предпочтительным для соединения формулы (1) в смеси быть излучающим соединением (допантом). Таковые используются, в частности, если символы Y и Z означают азот.
Предпочтительные основы для люминесцентного вещества представляют собой органические соединения, эмиссия которых имеет более короткую длину волны, чем у соединения формулы (1), или те, которые не излучают вообще.
Таким образом, изобретение также относится к смесям одного или более соединений формулы (1) с одной или более основами люминесцентного вещества.
Соотношение соединения формулы (1) в смеси излучающего слоя составляет от 0,1 до 99,0% по весу, предпочтительно от 0,5 до 50,0% по весу, в частности, предпочтительно от 1,0 до 20,0% по весу, в частности от 1,0 до 10,0% по весу. Соответственно, соотношение материала основы люминесцентного вещества в слое составляет от 1,0 до 99,9% по весу, предпочтительно от 5,0 до 99,5% по весу, в частности, предпочтительно от 80,0 до 99,0% по весу, в частности от 90,0 и 99,0% по весу.
Приемлемые материалы основы люминесцентного вещества представляют собой таковые из различных классов веществ. Предпочтительные материалы основы являются такими, выбранными из классов олигоариленов (например, 2,2',7,7'-тетрафенилспиробифлуорен в соответствии с ЕР 676461 или динафтилантрацен), в частности, олигоариленов, содержащие конденсированные ароматические группы, олигоариленвиниленов (например, DPVBI или спиро-DPVBI в соответствии с ЕР 676461), полиподальных комплексов металлов (например, в соответствии с WO 04/081017), соединений, образующих дыры (например, в соответствии с WO 04/058911), соединений, образующих электроны, в частности, кетонов, окисей фосфина, сульфоксидов и т.д. (например, в соответствии с WO 05/084081 или WO 05/084082), атропоизомеров (например, в соответствии с неопубликованной заявкой ЕР 04026402.0) или производных бороновой кислоты (например, в соответствии с неопубликованной заявкой ЕР 05009643.7). Особенно предпочтительные материалы основы представляют собой такие, выбранные из классов олигоариленов, содержащих нафталин, антрацен и/или пирен, или атропоизомеров этих соединений, олигоариленвиниленов, кетонов, окисей фосфина и сульфоксидов. Особенно предпочтительными являются материалы основы, выбранные из классов олигоариленов, содержащих антрацен и/или пирен, и атропоизомеров этих соединений, окисей фосфина и сульфоксидов.
Кроме того, является предпочтительным для соединений формулы (1) применяться в качестве материала транспорта дыр и/или в качестве материала введения дыр. Это является, в частности, применимым, если символы Y и Z и/или символы от X1 до X4 обозначают азот. Соединения также предпочтительно применяются в слоях транспорта дыр и/или в слоях введения дыр. Для целей настоящего изобретения слой введения дыр представляет собой слой, который непосредственно примыкает к аноду. Для целей настоящего изобретения слой транспорта дыр представляет собой слой, который расположен между слоем введения дыр и слоем эмиссии электронов. Если соединение формулы (1) используется как материал транспорта дыр или материал введения дыр, то может быть предпочтительным для них быть допированными электрон-акцепторными соединениями, например, F4-TCNQ или соединениями, как описано в ЕР 1476881 или ЕР 1596445.
Если соединение формулы (1) используется в качестве материала транспорта дыр в слое транспорта дыр, также может быть предпочтительным применять соотношение 100%, то есть применять это соединение в виде чистого материала.
Является также предпочтительным использовать соединения формулы (1) в качестве материала транспорта электронов и/или в качестве материала, блокирующего дыры, для флуоресцентных и фосфофлуоресцентных ОСИД и/или в качестве триплетного матриксного материала для фосфоресцентных ОСИД. Это применимо, в частности, к соединениям, в которых группы Y и Z обозначают С=O, Р=O или S=O.
Соединения формулы (1) могут также использоваться в полимерах, или в качестве излучающей единицы, и/или в качестве единицы транспорта дыр, и/или единицы транспорта электронов.
Предпочтение также отдается органическим электролюминесцентным устройствам, которые характеризуются тем, что множество излучающих соединений используется в одном и том же слое или различных слоях, где, по крайней мере, одно из этих соединений имеет структуру формулы (1). Эти соединения, в частности, предпочтительно имеют, в общем случае, множество максимумов эмиссии между 380 нм и 750 нм, что в итоге приводит к эмиссии белого света, то есть, в дополнение к соединению формулы (1), по крайней мере, одно дополнительное соединение, которое может быть флуоресцентным или фосфоресцентным и излучать желтый, оранжевый или красный свет, также может использоваться. Особое предпочтение отдается трехслойным системам, где, по крайней мере, один из этих слоев включает соединение формулы (1) и где слои демонстрируют голубое, зеленое и оранжевое излучение (для основной структуры, смотри, например, WO 05/011013). Излучатели широкого диапазона могут также использоваться для ОСИД, излучающих белый свет.
В дополнение к катоду, аноду и излучающему слою, органическое электролюминесцентное устройство может также включать дополнительные слои. Таковые могут представлять собой, например: слой введения дыр, слой транспорта дыр, слой блокирования дыр, слой транспорта электронов, слой введения электронов и/или слой получения заряда (Т. Matsumoto и др., Multiphoton Organic EL Device Having Charge Generation Layer, IDMC 2003, Taiwan; Session 21 OLED (5)). Однако следует отметить в этой связи, что каждый из этих слоев не должен обязательно присутствовать. Таким образом, в частности, при использовании соединений формулы (1) с образующими электроны материалами основы очень хорошие результаты могут быть также получены, если органическое электролюминесцентное устройство не включает отдельного слоя транспорта электронов и излучающий слой непосредственно примыкает к слою введения электронов или к катоду. Альтернативно, материал основы может также одновременно служить в качестве материала транспорта электронов в слое транспорта электронов. Является также предпочтительным для органического электролюминесцентного прибора, когда он не включает отдельного слоя транспорта дыр, а также чтобы излучающий слой непосредственно соседствовал со слоем введения дыр или с анодом. Является также предпочтительным для соединения формулы (1) использоваться одновременно в качестве допанта в излучающем слое и в качестве соединения, создающего дыры (либо как чистое вещество, либо в виде смеси) в слое транспорта дыр и/или в слое введения дыр.
Предпочтение также отдается органическому электролюминесцентному устройству, которое характеризуется тем, что один или более слоев покрыты при использовании процесса сублимации. Материалы в данном случае являются нанесенными с помощью испарения в вакуумном сублимационном устройстве при давлении ниже 10-5 мбар, предпочтительно ниже 10-6 мбар, в частности, предпочтительно ниже 10-7 мбар.
Предпочтение также отдается органическому электролюминесцентному устройству, которое характеризуется тем, что один или более слоев покрыты при использовании процесса OVPD (нанесение органического вещества в паровой фазе) с помощью сублимации при использовании газа-носителя. В данном случае материалы применяются при давлении от 10-5 мбар до 1 бара.
Предпочтение также отдается органическому электролюминесцентному устройству, которое характеризуется тем, что один или более слоев получены из раствора, такого, как, например, покрытие с помощью центрифугирования или с помощью желаемого процесса печатания, такого, как, например, растровый оттиск, флексографическая печать или офсетная печать, но особенно предпочтительным является LITI (индуцированное светом термическое формирование изображений, печатания с использованием термопереноса) или струйное печатание. Растворимые соединения формулы (1) являются необходимыми для этих целей. Высокая растворимость может быть достигнута с помощью приемлемого замещения соединений. Эти процессы для получения слоев являются особенно приемлемыми для полимеров.
Соединения в соответствии с изобретением обладают следующими неожиданными преимуществами по сравнению с уровнем техники при использовании в органических электролюминесцентных устройствах:
1. Эффективность соответствующих устройств является более высокой по сравнению с системами в соответствии с уровнем техники.
2. Стабильность соответствующих устройств является более высокой по сравнению с системами в соответствии с уровнем техники, что является особенно очевидным в значительно более продолжительном сроке службы.
3. При использовании соединений в соответствии с изобретением в качестве материала транспорта дыр в слое транспорта дыр и/или в слое введения дыр было обнаружено, что напряжение является независимым от толщины соответствующего слоя транспорта дыр и/или введения дыр. В противовес этому, материалы в соответствии с уровнем техники с относительно большой толщиной слоя транспорта дыр или введения дыр дают значительное повышение напряжения, которое, в свою очередь, приводит к более низкому коэффициенту полезного действия ОСИД.
4. Соединения могут быть хорошо сублимированы без значительного разложения, они следовательно более легко поддаются обработке и, таким образом, более приемлемы для применения в ОСИД, чем материалы в соответствии с уровнем техники. Не имея желания ограничиваться определенной теорией, мы предполагаем, что более высокая термальная стабильность может быть отнесена на счет отсутствия олефиновых двойных связей.
В тексте настоящей заявки, а также в приведенных ниже примерах целью было использовать соединения в соответствии с изобретением в отношении ОСИД и соответствующих дисплеев. Несмотря на это ограничение описания, для специалиста в области техники является возможным, не прибегая к изобретательскому творчеству, также использовать соединения в соответствии с изобретением в других целях в отличных электронных устройствах, например, для органических транзисторов с управляемым полем (O-FET), органических тонкопленочных транзисторов (O-TFT), органических светоизлучающих транзисторов (O-LET), органических интегральных микросхем (O-IC), органических солнечных батарей (O-SC), органических устройств с гасящим полем (O-FQD), светоизлучающих электрохимических батарей (LEC), органических фоторецепторов или также органических лазерных диодов (O-лазеров), которые являются упомянутыми только в качестве примера.
Настоящее изобретение также относится к применению соединения в соответствии с изобретением в соответствующих устройствах и к таким устройствам самим по себе.
Более подробно изобретение объясняется с помощью приведенных ниже примеров, без намерения ограничиваться таковыми.
Примеры:
Следующие синтезы осуществляли в атмосфере защитного газа, если не указано иное. Исходные материалы могут быть закуплены от ALDRICH или ABCR (палладий(II) ацетат, ди-трет-бутилхлорфосфин, амины, неорганические вещества, растворители). 6,12-дигидро[1,2b]инденофлуорен получают в соответствии со способом Hadizad и др., Org. Lett. 2005, 7(5), 795-797, [1,2b]инденофлуорен-6,12-дион получают с помощью способа Deuschel и др., Helv. С/г/от. Acta 1951, 34, 2403, 2-бром-4,4'-ди-трет-бутилбифенил получают с помощью способа Tashiro и др., J. Org. Chem. 1979, 44(17), 3037, 1,4-дибром-2,5-дийодбензол получают с помощью способа Chanteau и др., J. Org. Chem. 2003, 68(23), 8750, 3,9-дибром-5,11-диметилиндол[3,2-b]карбазол получают аналогично получению 3,9-дибром-5,11-бисдодецилиндол[3,2-b]карбазола с помощью способа Li и др.. Adv. Mat. 2005, 17(7), 849.
Пример 1: 2,8-бис(дифениламино)-6,6,12,12-тетраметил-6,12-дигидроиндено[1,2b]флуорен
а) 6,6,12,12-тетраметил-6,12-дигидроиндено|1,2b]флуорен

Получение осуществляют аналогично получению 9,9-диметилфлуорена из 6,12-дигидроиндено[1,2b]флуорена, диметилсульфата и раствора гидроокиси натрия в соответствии с JP 08113542. Выход 86,0% от теоретического; чистота 98% в соответствии с1Н-ЯМР.
b) 2,8-дибром-6,6,12,12-тетраметил-6,12-дигидроиндено[1,2b]флуорен

Раствор 155,9 г (1260 ммолей) карбоната натрия в 1000 мл воды прибавляли к раствору 122,0 г (393 ммолей) 6,6,12,12-тетраметил-6,12-дигидроиндено[1,2b]флуорена в 1800 мл дихлорметана. Прибавляли по каплям 56,4 мл (1100 ммолей) брома, разведенного 200 мл дихлорметана, при +5°С при отсутствии света и при интенсивном перемешивании, смесь перемешивали на протяжении дальнейших 6 часов, отфильтровывали преципитат при отсасывании и трижды промывали с помощью 300 мл смеси вода:этанол (1:1, об.:об.), а потом трижды с помощью 300 мл этанола. Выход: 178,1 г (380 ммолей), 96,8% от теоретического; чистота: 99% в соответствии с1Н-ЯМР.
с) 2,8-бис(дифениламино)-6,6,12,12-тетраметил-6,12-дигидроиндено-[1,2b]флуорен

23,1 г (240 ммолей) трет-бутоксида натрия, 235 мг (1,3 ммолей) ди-трет-бутилхлорфосфина и 225 мг (1 ммоль) палладия(II) ацетата прибавляли к суспензии 46,8 г (100 ммолей) 2,8-дибром-6,6,12,12-тетраметил-6,12-дигидроиндено[1,2b]флуорена и 37,2 г (220 ммолей) дифениламина в 1000 мл толуола, и смесь последовательно кипятили в течение 6 часов. После охлаждения прибавляли 300 мл воды, и отфильтровывали твердое вещество, трижды промывали каждый раз с помощью 300 мл воды и трижды с помощью 300 мл этанола каждый раз, последовательно перекристаллизовывали из NMP (N-метилпирролидона) и потом сублимировали под сниженным давлением (р=1×10-5 мбар, Т=360°С). Выход: 52,0 г (81 ммоль), 80,6% от теоретического; чистота: 99,9% в соответствии с ВЭЖХ.
Пример 2: 2,8-бис(бис(4-метилфенил)амино)-6,6,12,12-тетраметил-6,12-дигидроиндено(1,2b]флуорен
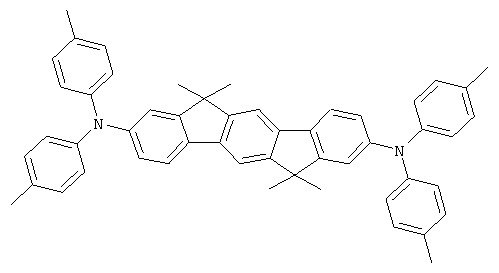
Процедура аналогична таковой Примера 1. Вместо дифениламина использовали 43,4 г (220 ммолей) бис(4-метилфенил)амина. Перекристаллизация шесть раз из о-дихлорбензола, сублимация р=1 × 10-5 мбар, Т - 365°С. Выход: 45,1 г (64 ммоля), 64,3% от теоретического; чистота: 99,8% в соответствии с ВЭЖХ.
Пример 3: 2,8-бис(бис(2-метилфенил)амино)-6,6,12,12-тетраметил-6,12-дигидроиндено[1,2b]флуорен

Процедура аналогична таковой Примера 1. Вместо дифениламина использовали 43,4 г (220 ммолей) бис(4-метилфенил)амина. Перекристаллизация пять раз из о-дихлорбензола, сублимация р=1×10-5 мбар, Т - 360°С. Выход: 57,4 г (82 ммолей), 81,9% от теоретического; чистота: 99,9% в соответствии с ВЭЖХ.
Пример 4: 2,8-бис(бис(4-трет-бутилфенил)амино)-6,6,12,12-тетраметил-6,12-дигидроиндено[1,2b]флуорен

Процедура аналогична таковой Примера 1. Вместо дифениламина использовали 61,9 г (220 ммолей) бис(4-трет-бутилфенил)амина. Перекристаллизация пять раз из NMP, сублимация р=1×10-5 мбар, Т=350°С. Выход: 73,0 г (84 ммолей), 84,0% от теоретического; чистота: 99,9% в соответствии с ВЭЖХ.
Пример 5: Синтез дополнительных инденофлуоренаминов
Следующие продукты получали аналогично Примеру 1 с чистотой 99,9% в соответствии с ВЭЖХ:
Соответствующие производные цис-инденофлуорена могут также быть синтезированы аналогично этим синтезам, где цис-инденофлуорендибромид в качестве исходного соединения может быть синтезирован в соответствии с WO 04/113412.
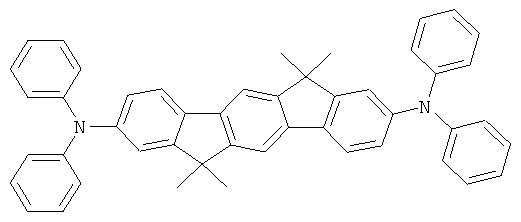
Пример 17: 2,8-бис(бис(4-трет-бутилфенил)амино)диспиро[2,7-ди-трет-бутилфлуорен-9,6'-инденофлуорен[1,2b]флуорен-12',9''-флуорен]
а) Диспиро[2,7-ди-трет-бутилфлуорен-9,6'-инденофлуорен[1,2b]флуорен-12',9''-флуорен]

Соответствующий реактив Гриньяра получали из 6,2 г (255 ммолей) магния и 86,3 г (250 ммолей) 2-бром-4,4'-ди-трет-бутилбифенила в 500 мл ТГФ. Дополнительные 500 мл ТГФ и 28,8 г (100 ммолей) [1,2b]инденофлуорен-6,12-диона прибавляли к этому реактиву Гриньяра. Реакционную смесь кипятили в течение 10 часов, охлаждали, прибавляли 50 мл этанола, и смесь выпаривали до осушения в условиях сниженного давления. Остаток подвергали кипячению в течение 3 часов в смеси 1000 мл уксусной кислоты и 25 мл концентрированной соляной кислоты. После охлаждения отфильтровывали бесцветные кристаллы с помощью отсасывания, промывали при использовании 100 мл уксусной кислоты, а потом трижды каждый раз с помощью 100 мл этанола и высушивали в условиях сниженного давления. Продукт последовательно дважды перекристаллизовывали из NMP. Выход: 56,9 г (73 ммолей), 73,0% от теоретического; чистота: 99% в соответствии с1Н-ЯМР.
b) 2,8-Дибромдиспиро[2,7-ди-трет-бутилфлуорен-9,6'-инденофлуорен-[1,2b]флуорен-12',9''-флуорен]

Раствор 16,8 г (200 ммолей) гидрокарбоната натрия в 500 мл воды прибавляли к раствору 39,0 г (50 ммолей) диспиро[2,7-ди-трет-бутил-флуорен-9,6'-инденофлуорен[1,2b]флуорен-12',9''-флуорена] в 2000 мл дихлорметана. 5,4 мл (105 ммолей) брома прибавляли по каплям к двухфазной смеси при интенсивном перемешивании, и смесь перемешивали на протяжении последующих 16 часов. После прибавления 1000 мл этанола отфильтровывали твердое вещество при отсасывании, промывали пять раз с помощью 300 мл воды каждый раз и трижды с помощью 200 мл этанола каждый раз, высушивали в условиях сниженного давления и перекристаллизовывали из о-дихлорбензола. Выход: 38.7 г (41 ммолей), 82,6% от теоретического; чистота 99% в соответствии с1Н-ЯМР.
с) 2,8-бис(бис(4-трет-бутилфенил)амино)диспиро[2,7-ди-трет-бутил-флуорен-9,6'-инденофлуорен[1,2b]флуорен-12',9''-флуорен]

Процедура аналогична таковой Примера 1. Вместо 2,8-дибром-6,6,12,12-тетраметил-6,12-дигидроиндено[1,2b]флуорена использовали 28,1 г (30 ммолей) 2,8-дибромдиспиро[2,7-ди-трет-бутилфлуорен-9,6'-инденофлуорен[1,2b]флуорен-12',9''-флуорена], и вместо дифениламина использовали 18,6 г (66 ммолей) ди-(4-трет-бутилфенил)амина. Перекристаллизация пять раз из о-дихлорбензола, сублимация р=1×10-5 мбар, Т - 390°С. Выход: 23,2 г (17 ммолей), 57,8% от теоретического; чистота: 99,9% в соответствии с ВЭЖХ.
Пример 18: 2,8-бис(бис(4-метилфенил)амино)диспиро[флуорен-9,6'-инденофлуорен[1,2b]флуорен-12',9''-флуорен]
а) 2,8-дибром[1,2b]инденофлуорен-6,12-дион

30,7 мл (600 ммолей) брома прибавляли по каплям при 80°С к суспензии 56,5 г (200 ммолей) [1,2b]инденофлуорен-6,12-диона и 3,0 г хлорида железа(III) (безводного) в 2000 мл 1,2-дихлорэтана, и смесь перемешивали при 80°С в течение 30 часов. После охлаждения выпавшее в осадок твердое вещество отфильтровывали при отсасывании, промывали при перемешивании дважды при кипячении с 1000 мл этанола каждый раз и высушивали в условиях сниженного давления. Выход: 81,6 г (85 ммолей), 92,7% от теоретического; чистота 95% в соответствии с1Н-ЯМР.
b) 2,8-Дибромдиспиро[флуорен-9,6'-инденофлуорен(1,2b]флуорен-12',9''-флуорен]

Получение является аналогичным таковому Примера 17а. Вместо 2-бром-4,4'-ди-трет-бутилбифенила и [1,2b]инденофлуорен-6,12-диона использовали 58,3 г (250 ммолей) 2-бромбифенила и 44,0 г (100 ммолей) 2,8-дибром[1,2b]инденофлуорен-6,12-диона. Перекристаллизация из о-дихлорбензола. Выход: 24,5 г (34 ммоля), 34,4% от теоретического; чистота: 98% в соответствии с1Н-ЯМР.
с) 2,8-Бис(дифениламино)диспиро(флуорен-9,6'-инденофлуорен[1,2b]-флуорен-12',9''-флуорен]
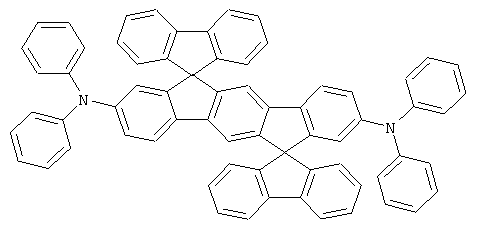
Получение аналогично таковому Примера 1с. Вместо 2,8-дибром-6,6,12,12-тетраметил-6,12-дигидроиндено[1,2b]флуорена использовали 71,3 г (100 ммолей) 2,8-дибромдиспиро[флуорен-9,6'-инденофлуорен[1,2b]флуорен-12',9''-флуорен]. Перекристаллизация из о-дихлорбензола, сублимация при р=1×10-5 мбар, Т=390°С. Выход: 71,9 г (81 ммоль), 80,9% от теоретического; чистота: 99,7% в соответствии с ВЭЖХ.
Пример 19: 2,8-бис(фенилкарбонил)(6,6,12,12-тетраметил-6,12-дигидроиндено[1,2b]флуорен)

84,0 мл (210 ммолей) н-бутиллития (2,5 М в гексане) прибавляли по каплям к суспензии 46,8 г (100 ммолей) 2,8-дибром-6,6,12,12-тетраметил-6,12-дигидроиндено[1,2b]флуорена в 700 мл ТГФ, охлажденной до -78°С. Смесь оставляли для нагревания до 0°С в течение 2 часов и перемешивали при 0°С в течение последующего 1 часа, потом прибавляли смесь 27,5 мл (230 ммолей) 4-метилбензонитрила в 100 мл ТГФ, и полученную смесь перемешивали при комнатной температуре в течение последующих 16 часов. 20 мл этанола, потом 100 мл IN соляной кислоты прибавляли по каплям к смеси, которую потом нагревали в течение 5 часов. После охлаждения растворитель удаляли в условиях сниженного давления, и остаток переносили в 500 мл NMP, 20 мл воды и 5 мл уксусной кислоты и подвергали кипячению в течение 5 часов. После охлаждения кристаллы отфильтровывали при отсасывании и трижды перекристаллизовывали из NMP. Сублимация при р=1×10-5 мбар, Т=320°С. Выход: 44,2 г (81 ммоль), 80,8% от теоретического; чистота: 99,9% в соответствии с ВЭЖХ.
Пример 20: Синтез дополнительных инденофлуоренкарбонилов
Следующие продукты получали аналогично Примеру 19 с чистотой 99,9% в соответствии с ВЭЖХ:
Пример 31: 2,8-бис(дифенилфосфинил)(6,6,12,12-тетраметил-6,12-дигидроиндено[1,2b]флуорен)

84,0 мл (210 ммолей) н-бутиллития (2,5 М в н-гексане) прибавляли к суспензии 46,8 г (100 ммолей) 2,8-дибром-6,6,12,12-тетраметил-6,12-дигидроиндено[1,2b]флуорена в 700 мл ТГФ, охлажденной до -78°С. Смеси позволяли медленно нагреваться до 0°С в течение периода времени 2 часа и перемешивали при 0°С на протяжении последующего часа, потом прибавляли смесь 41,3 мл (230 ммолей) хлордифенилфосфина в 100 мл ТГФ, и смесь перемешивали при комнатной температуре в течение последующих 16 часов. После прибавления 10 мл этанола растворитель удаляли в полном вакууме, остаток растворяли в 500 мл этилацетата, органическую фазу трижды промывали с помощью 300 мл воды, потом прибавляли по каплям смесь 22,2 мл (250 ммолей) перекиси водорода и 100 мл воды при интенсивном перемешивании, и смесь перемешивали при комнатной температуре в течение 16 часов. Выпавшее в осадок твердое вещество отфильтровывали при отсасывании, промывали с помощью этанола, высушивали и перекристаллизовывали из хлорбензола. Сублимация при р=1×10-5 мбар, Т=340°С. Выход: 46,0 г (65 ммолей), 64,7% от теоретического; чистота: 99,9% в соответствии с ВЭЖХ.
Пример 32: Синтез дополнительных оксидов инденофлуоренфосфина
Следующие продукты были получены аналогично таковым Примера 31 с чистотой 99,9% в соответствии с ВЭЖХ:
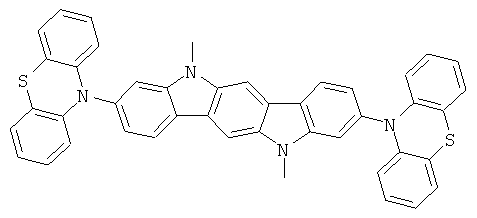
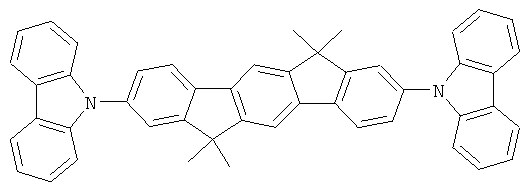
Пример 37: 3,9-бис(дифениламино)-5,11-диметилиндол[3,2-b]карбазол

Получение является аналогичным таковому Примера 1с. Вместо 2,8-дибром-6,6,12,12-тетраметил-6,12-дигидроиндено[1,2b]флуорена использовали 44,2 г (100 ммолей) 3,9-дибром-5,11-диметилиндол[2,3-b]карбазола. Перекристаллизация из NMP. Сублимация р=1×10-5 мбар, Т=350°С. Выход: 43,9 г (71 ммолей), 70,9% от теоретического; чистота: 99,8% в соответствии с ВЭЖХ.
Пример 38: Синтез дополнительных производных индолкарбазола
Следующие продукты были получены аналогично таковым Примера 37 с чистотой 99,9% в соответствии с ВЭЖХ:
Пример 45: 3,9-бис(дифениламино)-5,11-дифенилфосфиноиндол-(3,2-b]дибензофосфол
а) 2',5'-дибром-4,4,4',4'-тетра-п-толил-[1,1,4,4]-терфенил-4,4'-диамин

Суспензию 24,4 г (50 ммолей) 1,4-дибром-2,5-дийодбензола, 51,9 г (130 ммолей) 4-[4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил]-ди-п-толиламина, 26,5 г (250 ммолей) карбоната натрия и 116 мг (0,1 ммолей) тетракис(трифенилфосфино)палладия(0) в смеси 300 мл толуола, 100 мл диоксана и 300 мл воды подвергали кипячению в течение 18 часов. После охлаждения прибавляли 500 мл этанола к реакционной смеси, и отфильтровывали твердое вещество при отсасывании, трижды промывали с помощью 200 мл воды каждый раз и трижды с помощью 200 мл этанола каждый раз, высушивали в условиях сниженного давления и перекристаллизовывали из диоксана. Выход: 18,6 г (24 ммолей), 47,7% от теоретического; чистота: 97% в соответствии с ЯМР.
b) 3,9-бис(дифениламино)-5,11-дифенилфосфиноиндол[3,2-b]дибензофосфол 5,11-окись

16,8 мл (42 ммолей) н-бутиллития (2,5 М в н-гексане) прибавляли по каплям к раствору 15,6 г (20 ммолей) 2',5'-дибром-4,4,4',4'-тетра-п-толил-[1,1',4,4]-третфенил-4,4'-диамина в 500 мл ТГФ, охлажденному до -78°С, смесь перемешивали при -78°С в течение дополнительных 3 часов, и прибавляли смесь 6,2 мл (44 ммолей) фенилфосфорного дихлорида и 50 мл ТГФ в течение периода времени 1 минута. После медленного нагревания полностью удаляли растворитель в условиях сниженного давления, остаток переносили в 200 мл 1,2-дихлорэтана, прибавляли 26,7 г (200 ммолей) безводного хлорида алюминия и смесь подвергали кипячению в течение 15 часов. После охлаждения прибавляли 200 мл 5N соляной кислоты, отделяли органическую фазу, один раз промывали с помощью 100 мл 5N соляной кислоты и пять раз с помощью 300 мл воды каждый раз и высушивали над сульфатом магния, растворитель удаляли в условиях сниженного давления, после чего продукт перекристаллизовывали из NMP. Сублимация р=1×10-5 мбар, Т=360°С. Выход: 6,2 г (7,7 ммолей), 38,3% от теоретического; чистота: 99,8% в соответствии с ВЭЖХ, включая все стереоизомеры.
Пример 46: Получение ОСИД, включающих инденофлуорендиамины в качестве материала введения дыр или материала транспорта дыр в флуоресцентных ОСИД
ОСИД получают с помощью общего процесса, как описано в WO 04/058911, который адаптируется в индивидуальном случае для соответствующих обстоятельств (например, вариации толщины слоя для того, чтобы достигнуть оптимальной эффективности или цвета).
Результаты для различных ОСИД представлены в Примерах 47-62, приведенных ниже. Основная структура и используемые материалы (в отдельности от слоя транспорта дыр) являются идентичными в примерах для лучшего сравнения. ОСИД, имеющие следующую структуру, получают аналогично упомянутому выше общему процессу:
Слой введения дыр (HIL) 20 нм PEDOT (покрытие с помощью центрифугирования из воды, закупается у Н.С. Starck, Goslar, Германия; поли(3,4-этилендиокси-2,5-тиофен))
Слой транспорта дыр (НТМ1)В2 (соединение в соответствии с Примером 2)
или В1 (соединение в соответствии с Примером 1)
или В9 (соединение в соответствии с Примером 9)
или В15 (соединение в соответствии с Примером 15)
или В37 (соединение в соответствии с Примером 37)
в качестве сравнительного примера 4,4',4''-трис(N-1-нафтил-N-фениламино)трифениламин (сокращенное наименование NaphDATA, закупается у SynTec)
Слой транспорта дыр (НТМ2) 20 нм NPB (N-нафтил-N-фенил-4,4'-диаминобифенил)
Эмиссионный слой (EML) 30 нм допированный слой 9,10-бис(1-нафтил-антрацена) в качестве материала основы (сокращенное наименование H1), допированный 5% трис[4-(2,2-дифенилвинил)фенил]амина в качестве допанта (сокращенное наименование D1, нанесение методом испарения, синтезирован в соответствии с WO 06/000388)
Проводник первого рода (ETC) 20 нм A1Q3 (закупается у SynTec, трис(хинолинато)алюминий(III))
Катод 1 нм LiF, 150 нм А1 сверху.
ОСИД также могут быть получены без PEDOT в качестве слоя введения дыр. В этих случаях производная инденофлуорендиамина в соответствии с изобретением представляет собой соединение введения дыр. Эти ОСИД демонстрируют сравнительно хорошие свойства.
Эти ОСИД характеризуются с помощью стандартных методов; для этой цели спектры электролюминесценции, эффективность (измеряется в кд/А) и коэффициент полезного действия (измеряется в Im/Вт) определяют как функцию яркости, выведенную из характеристических линий ток/напряжение/яркость (IUL характеристические линии).
Таблица 1 показывает результаты для некоторых ОСИД (Примеры от 47 до 62), в которых варьирует толщина слоя транспорта дыр (НТМ1). Материал для сравнения, который использовали в сравнительных примерах, представляет собой NaphDATA.
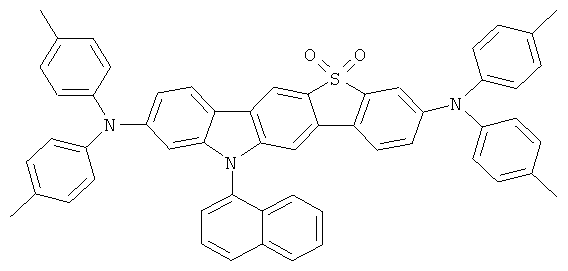
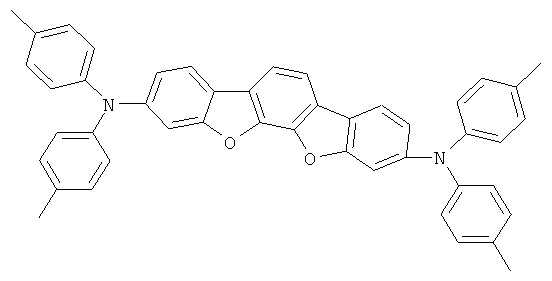
Материал основы H1 представляет собой 9,10-бис(1-нафтил)антрацен, а используемый допант D1. Структуры обоих показаны ниже:


Как можно увидеть из Примеров 51-62 в соответствии с изобретением в Таблице 1, ОСИД, включающие материал транспорта дыр в соответствии с изобретением (НТМ1), демонстрируют значительное более низкое напряжение оперативного постоянного тока по сравнению с использованием NaphDATA в качестве материала транспорта дыр уровня техники. Напряжение оперативного постоянного тока также является независимым от толщины слоя транспорта дыр. Это свойство представляет собой основное преимущество для конструирования полноцветных дисплеев, так как плотность пикселей первичных цветов голубого, зеленого и красного может быть сделана такой же путем вариации толщины слоя транспорта дыр. Материал транспорта дыр в соответствии с изобретением может, таким образом, в данном случае служить в качестве слоя компенсации толщины при отсутствии вредного воздействия на электрооптические свойства этого устройства. Как видно из сравнительных примеров, это не относится к материалу транспорта дыр (NaphDATA) в соответствии с уровнем техники: в данном случае значительно более высокое напряжение оперативного постоянного тока требуется при большей толщине слоя транспорта дыр.
Пример 63: Получение ОСИД, включающих инденофлуорендиамины в качестве материала введения дыр или материала транспорта дыр в флуоресцентных ОСИД
ОСИД получают с помощью общего процесса, как описано в WO 04/093207, который адаптируется в индивидуальном случае для соответствующих обстоятельств (например, вариации толщины слоя для того, чтобы достигнуть оптимальной эффективности или цвета).
Результаты для различных ОСИД представлены в Примерах 64-68, приведенных ниже. Основная структура и используемые материалы (в отдельности от слоя транспорта дыр) являются идентичными в примерах для лучшего сравнения. ОСИД, имеющие следующую структуру, получают аналогично упомянутому выше общему процессу:
Слой введения дыр (HIL) 20 нм PEDOT (нанесение покрытия методом центрифугирования из воды, закупается у Н.С. Starck, Goslar, Германия; поли(3,4-этилендиокси-2,5-тиофен))
Слой транспорта дыр (НТМ1) В2 (соединение в соответствии с Примером 2)
или в качестве сравнительного примера 4,4',4''-трис(N-1-нафтил-N-фениламино)трифениламин (сокращенное наименование NaphDATA, закупается у SуnТес) (стандарт для сравнения)
Слой транспорта дыр (НТМ2) 20 нм (нанесенный методом испарения; S-TAD, полученный в соответствии с WO 99/12888; 2,2',7,7' тетракис(дифениламино)спиробифлуорен)
или 20 нм NPB (N-нафтил-N-фенил-4,4'-диаминобифенил)
Эмиссионный слой (EML) 40 нм кетон 1 (бис(9,9'-спиробифлуорен-2-ил) кетон (нанесенный методом испарения, синтезированный в соответствии с WO 04/093207), допированный с помощью 15% тройного эмиттера Е1 (синтезированный в соответствии с WO 04/085449)
A1Q3 20 нм (нанесенный методом испарения; A1Q закупается у SynTec, трис(хинолинато)алюминий(III))
Катод 1 нм LiF, 150 нм А1 сверху.
ОСИД также могут быть получены без PEDOT в качестве слоя введения дыр. В этих случаях производная инденофлуорендиамина в соответствии с изобретением представляет собой соединение введения дыр. Эти ОСИД демонстрируют сравнительно хорошие свойства.
Эти ОСИД характеризуются с помощью стандартных методов; для этой цели спектры электролюминесценции, эффективность (измеряется в кд/А) и коэффициент полезного действия (измеряется в Im/Вт) определяют как функцию яркости, выведенную из характеристических линий ток/напряжение/яркость (IUL характеристические линии).
Таблица 2 показывает результаты для некоторых ОСИД (Примеры 64-68), в которых варьирует толщина слоя транспорта дыр (НТМ1). Материал для сравнения, который использовали в сравнительных примерах, представляет собой NaphDATA.


Как можно увидеть из Примеров 65-68 в соответствии с изобретением в Таблице 2, ОСИД, включающие материал транспорта дыр в соответствии с изобретением (НТМ1), демонстрируют значительное более низкое напряжение оперативного постоянного тока по сравнению с использованием NaphDATA в качестве материала транспорта дыр уровня техники. Напряжение оперативного постоянного тока также является независимым от толщины слоя транспорта дыр. Материал транспорта дыр в соответствии с изобретением может, таким образом, служить в качестве слоя компенсации толщины в данном случае при отсутствии вредного воздействия на электрооптические свойства этого устройства.
Пример 69: Получение ОСИД, включающих инденофлуорен кетоны или окиси инденофлуоренфосфина в качестве материала транспорта электронов в флуоресцентных ОСИД
ОСИД получают с помощью общего процесса, как описано в WO 04/093207, который адаптируется в индивидуальном случае для соответствующих обстоятельств (например, вариации толщины слоя для того, чтобы достигнуть оптимальной эффективности или цвета).
Результаты для различных ОСИД представлены в Примерах 70-73, приведенных ниже. Основная структура и используемые материалы (в отдельности от слоя транспорта электронов) являются идентичными в примерах для лучшего сравнения. ОСИД, имеющие следующую структуру, получают аналогично упомянутому выше общему процессу:
Слой введения дыр (HIL) 20 нм PEDOT (нанесение методом центрифугирования из воды, закупается у Н.С. Starck, Goslar, Германия; поли(3,4-этилендиокси-2,5-тиофен))
Слой транспорта дыр (НТМ2) 20 нм S-TAD (нанесенный методом испарения; S-TAD, полученный в соответствии с WO 99/12888; 2,2'7,7'-тетракис(дифениламино)спиробифлуорен)
Эмиссионный слой (EML) 40 нм кетона 1 (бис(9,9'-спиробифлуорен-2-ил) кетон (нанесенный методом испарения, синтезированный в соответствии с WO 04/093207), допированный с помощью 15% тройного эмиттера Е1 (синтезированный в соответствии с WO 04/085449)
Слой транспорта электронов 20 нм В19 (соединение в соответствии с Примером 19)
или 20 нм В26 (соединение в соответствии с Примером 26)
или 20 нм В31 (соединение в соответствии с Примером 31)
или 20 нм А1Q3 (А1Q3 закупается у SynTec; трис(хинолинато)алюминий(III), сравнение)
Катод 1 нм LiF, 150 нм А1 сверху.
Эти ОСИД характеризуются с помощью стандартных методов; для этой цели спектры электролюминесценции, эффективность (измеряется в кд/А) и коэффициент полезного действия (измеряется в Im/Вт) определяют как функцию яркости, выведенную из характеристических линий ток/напряжение/яркость (IUL характеристические линии).
Таблица 3 показывает результаты для некоторых ОСИД (Примеры 70-73), в которых варьирует толщина слоя транспорта электронов (ETL). Материал для сравнения, который использовали в сравнительных примерах, представляет собой Alq. Эмиттер Е1 и материал основы кетон 1 представлены в Примере 63.
Как можно увидеть из Примеров 71-73 в соответствии с изобретением в Таблице 3, ОСИД, включающие материал транспорта электронов в соответствии с изобретением, демонстрируют значительное более низкое напряжение оперативного постоянного тока и более высокую эффективность по сравнению с использованием Alq в соответствии с уровнем техники.
Пример 74: Получение красных фосфоресцентных ОСИД, включающих инденофлуорен кетоны или окиси инденофлуоренфосфина в качестве триплетного материала основы
ОСИД получают с помощью общего процесса, как описано в WO 04/093207, который адаптируется в индивидуальном случае для соответствующих обстоятельств (например, вариации толщины слоя для того, чтобы достигнуть оптимальной эффективности или цвета).
Результаты для различных ОСИД представлены в Примерах 75-78, приведенных ниже. Основная структура и используемые материалы (в отдельности от слоя транспорта электронов) являются идентичными в примерах для лучшего сравнения. ОСИД, имеющие следующую структуру, получают аналогично упомянутому выше общему процессу:
Слой введения дыр (HIL) 20 нм PEDOT (нанесение методом центрифугирования из воды, закупается у H.С. Starck, Goslar, Германия; поли(3,4-этилендиокси-2,5-тиофен))
Слой транспорта дыр (НТМ1) 20 нм 4,4',4''-трис(N-1-нафтил-N-фениламино)трифениламин (сокращенное наименование NaphDATA, закупается у SynTec)
Слой транспорта дыр (НТМ2) 20 нм S-TAD, (нанесенный методом испарения; S-TAD полученный в соответствии с WO 99/12888; 2,2'7,7'-тетракис(дифениламино)спиробифлуорен)
Эмиссионный слой (EML) 20 нм В 19 (соединение в соответствии с Примером 26)
или 20 нм В26 (соединение в соответствии с Примером 31)
или 20 нм В31 (соединение в соответствии с Примером 31)
или кетон 1 (бис(9,9'-спиробифлуорен-2-ил) кетон (нанесенный методом испарения, синтезированный в соответствии с WO 04/093207) (стандарт для сравнения), в каждом случае допированный с помощью 10% триплетного эмиттера Е2 (синтезированный в соответствии с WO 05/033244)
Слой транспорта электронов 20 нм А1Q3 (нанесенный методом испарения: А1Q3 закупается у SynTec; трис(хинолинато)алюминий(III))
Катод 1 нм LiF, 150 нм А1 сверху.
Эти ОСИД характеризуются с помощью стандартных методов; для этой цели спектры электролюминесценции, эффективность (измеряется в кд/А) и коэффициент полезного действия (измеряется в Im/Вт) определяют как функцию яркости, выведенную из характеристических линий ток/напряжение/яркость (IUL характеристические линии).
Таблица 4 показывает результаты для некоторых ОСИД (Примеры 75-78), в которых варьирует толщина триплетного материала основы эмиссионного слоя (EML). Материал для сравнения, который использовали в сравнительных примерах, представляет собой кетон 1.
Эмиттер Е1 и триплетный материал основы кетон 1 представлены ниже для ясности:


Как можно увидеть из Примеров 76-78 в соответствии с изобретением в Таблице 4, ОСИД, включающие материал транспорта электронов в соответствии с изобретением, демонстрируют значительное более низкое напряжение оперативного постоянного тока и более высокую эффективность по сравнению с использованием кетона 1 в соответствии с уровнем техники.
Пример 79: Получение ОСИД, включающих инденофлуорендиамины в качестве эмиттера
ОСИД получают с помощью общего процесса, как описано в WO 04/093207, который адаптируется в индивидуальном случае для соответствующих обстоятельств (например, вариации толщины слоя для того, чтобы достигнуть оптимальной эффективности или цвета).
Результаты для различных ОСИД представлены в Примерах 80-86, приведенных ниже. Основная структура и используемые материалы (в отдельности от эмиссионного слоя) являются идентичными в примерах для лучшего сравнения. ОСИД, имеющие следующую структуру, получают аналогично упомянутому выше общему процессу:
Слой введения дыр (HIL) 20 нм PEDOT (нанесение методом центрифугирования из воды, закупается у Н.С. Starck, Goslar, Германия; поли(3,4-этилендиокси-2,5-тиофен))
Слой транспорта дыр (НТМ1) 20 нм В2 (соединение, полученное в соответствии с Примером 2)
Слой транспорта дыр (НТМ2) 20 нм NPB (N-нафтил-N-фенил-4,4'-диаминобифенил)
Эмиссионный слой (EML) 30 нм слой H1, H2 или Н3 в качестве материала основы, допированного с помощью х% (см. таблицу) В2 (соединение в соответствии с Примером 2) или В17 (соединение в соответствии с Примером 17) в качестве допанта
Проводник первого рода (ETC) 20 нм (нанесенный методом испарения; АlQ3 закупается у SynTec, трис(хинолинато)алюминий (III)
Катод 1 нм LiF, 150 нм Аl сверху.
Эти ОСИД характеризуются с помощью стандартных методов; для этой цели спектры электролюминесценции, эффективность (измеряется в кД/A) и коэффициент полезного действия (измеряется в lm/Вт) определяют как функцию яркости, выведенную из характеристических линий ток/напряжение/яркость (IUL характеристические линии).
Таблица 5 показывает результаты для некоторых ОСИД (Примеры 80-86), в которых В2 (соединение в соответствии с Примером 2) или В17 (соединение в соответствии с Примером 17) используется в качестве эмиттера темно-голубого света, и его степень допирования варьирует.
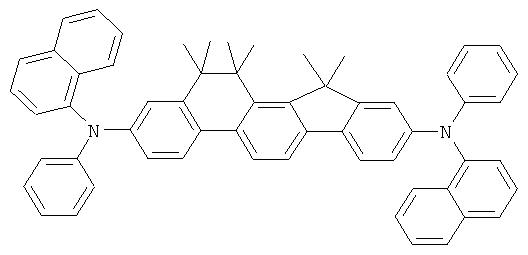
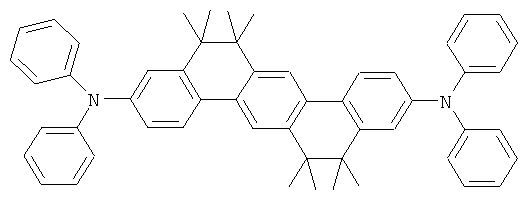
Материалы основы H1, H2 и Н3 показаны ниже:



Как можно увидеть из Примеров 80-86 в Таблице 5, ОСИД, включающие допанты В2 (соединение в соответствии с Примером 2) и В 17 (соединение в соответствии с Примером 17) в соответствии с изобретением, демонстрируют эффективное темно-голубое излучение. В противовес этому, цветовое соотношение только (0,15; 0,15) достигается при использовании коммерческих ОСИД. Внутренний квантовый выход является близким 100%.
Пример 87: Бис(N-(4-трет-бутилфенил)-N-(4-бромфенил)амино)-6,6,12,12-тетраоктил-6,12-дигидроиндено[1,2b]флуорен
а) Бис(N-(4-трет-бутилфенил)-N-фениламино)-6,6,12,12-тетраоктил-6,12-дигидроиндено[1,2b]флуорен

Раствор 17,2 г (20,0 ммолей) 6,6,12,12-тетраоктил-6,12-дигидро-[1,2b]инденофлуорен дибромида и 10,0 г (44,4 ммоля) 4-трет-бутилфенилфениламина в 130 мл сухого толуола насыщали аргоном. Потом прибавляли 81,0 мг три-трет-бутилфосфина, 45 мг палладийацетата и 5,97 г трет-бутоксида натрия. Реакционную смесь кипятили в течение 12,5 часов. После охлаждения до комнатной температуры, смесь экстрагировали с помощью 2М НСl (2×100 мл). Отделяли органическую фазу, фильтровали через целит и выпаривали на роторном испарителе. Сырьевой продукт перекристаллизовывали из ЕtOН/толуол, получая 18,6 г (81%) желтых кристаллов.
b) Бис(N-(4-трет-бутилфенил)-N-(4-бромфенил)амино)-6,6,12,12-тетраоктил-6,12-дигидроиндено[1,2b]флуорен

5,0 г (3,8 ммолей) бис(N-(4-трет-бутилфенил)-N-фениламино)-6,6,12,12-тетраоктил-6,12-дигидроиндено[1,2b]флуорена растворяли в 22,4 мл сухого ТГФ, и по каплям прибавляли раствор 1,5 г NBS в 22,4 мл ТГФ при 0°С. Реакционную смесь оставляли до достижения комнатной температуры, и растворитель удаляли. Твердое вещество промывали путем кипячения с этанолом и отфильтровывали при отсасывании. После высушивания при сниженном давлении сырьевой продукт перекристаллизовывали из ацетонитрила/толуола, получая при этом 2,16 г (43%) кристаллов светло-желтого цвета.
Бис(N-(4-трет-бутилфенил)-N-(4-бромфенил)амино)-6,6,12,12-тетраоктил-6,12-дигидроиндено[1,2b]флуорен может быть использован в качестве мономера для полимеризации, например, для полимеризации по Suzuki или Yamamoto. Это соединение является особенно приемлемым для встраивания в конъюгированные или частично конъюгированные полимеры и является особенно приемлемым в качестве соединения, образующего дыры в этих полимерах.
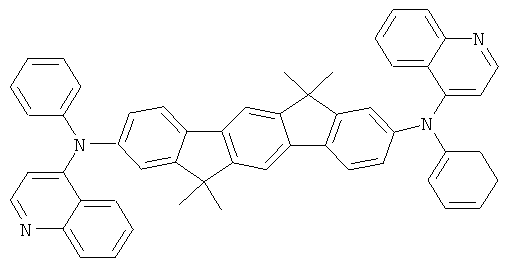
Пример 88: 2,10-бис(дифениламино)-12,15-дигидро-6,6,12,12,15,15-гексаметил-6Н-дииндено(1,2-b:2,1'-h]флуорен
a) 12,15-Дигидро-6,6,12,12,15,15-гексаметил-6Н-дииндено-[1,2-b:2',1'-h]флуорен

Получение осуществляют аналогично получению 9,9-диметилфлуорена из 12,15-дигидро-6Н-дииндено[1,2-b:2',1'-h]флуорена (Stauner и др., Helv. Chim. Acta 1970, 53(6), 1311), диметилсульфата и раствора гидроокиси натрия в соответствии с JP 08113542. Выход 61,0% от теоретического; чистота 97% в соответствии с1Н-ЯМР.
b) 2,10-Дибром-12,15-дигидро-6,6,12,12,15,15-гексаметил-6Н-дииндено[1,2-b:2',1''-h]флуорен

Получение является аналогичным таковому Примера 1b. Вместо 122,0 г (393 ммоля) 6,6,12,12-тетраметил-6,12-дигидроиндено[1,2b]флуорена использовали 167,7 г (393 ммоля) 12,15-дигидро-6,6,12,12,15,15-гексаметил-6Н-дииндено-[1,2-b:2''1'-h]флуорена. Выход: 198,5 г (339 ммолей), 86,4% от теоретического; чистота: 98% в соответствии с1Н-ЯМР.
с) 2,10-бис(дифениламино)-12,15-дигидро-6,6,12,12,15,15-гексаметил-6Н-дииндено[1,2-b:2',1'-h]флуорен

Получение является аналогичным таковому Примера 1с. Вместо 46,8 г (100 ммолей) 2,8-дибром-6,6,12,12-тетраметил-6,12-дигидроиндено[1,2b]флуорена использовали 58,4 г (100 ммолей) 2,10-дибром-12,15-дигидро-6,6,12,12,15,15-гексаметил-6Н-дииндено[1,2-b:2',1'-h]флуорена. Сублимация р=1×10-5 мбар, Т=390°С. Выход: 55,0 г (72 ммолей), 72,3% от теоретического; чистота: 99,9% в соответствии с ВЭЖХ.
Пример 89: 2,8-бис(бис(4-дифениламинофенил)амино)-6,6,12,12-тетраметил-6,12-дигидроиндено[1,2b]флуорен
а) 2,8-бис(бис(4-бромфенил)амино)-6,6,12,12-тетраметил-6,12-дигидроиндено[1,2b]флуорен

74,8 г (420 ммолей) N-бромсукцинимида прибавляли по частям при интенсивном перемешивании к раствору 64,5 г (100 ммолей) 2,8-бис(дифениламино)-6,6,12,12-тетраметил-6,12-дигидроиндено[1,2b]флуорена в 1500 мл дихлорметана, и смесь перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь концентрировали до объема 200 мл в условиях сниженного давления, прибавляли 1000 мл этанола, отфильтровывали преципитат при отсасывании, перемешивали с 1000 мл горячего этанола, отфильтровывали при отсасывании, трижды промывали с помощью 300 мл этанола каждый раз и высушивали в условиях сниженного давления. Выход: 82,1 г (85 ммолей), 85,5% от теоретического; чистота: 97% в соответствии с1Н-ЯМР.
b) 2,8-бис(бис(4-дифениламинофенил)амино)-6,6,12,12-тетраметил-6,12-дигидроиндено[1,2b]флуорен

Процедура аналогична таковой Примера 1с. Вместо 46,8 г (100 ммолей) 2,8-дибром-6,6,12,12-тетраметил-6,12-дигидроиндено[1,2b]флуорена использовали 48,0 г (50 ммолей) 2,8-бис(бис(4-бромфенил)амино)-6,6,12,12-тетраметил-6,12-дигидроиндено[1,2b]флуорена. Перекристаллизация из диоксана; сублимация р=1×10-5 мбар, Т=380°С. Выход: 48,8 г (37 ммолей), 74,3% от теоретического; чистота: 99,8% в соответствии с ВЭЖХ.
Пример 90: 2,8-бис((4-метилфенил)(4-дифениламинофенил)амино)-6,6,12,12-тетраметил-6,12-дигидроиндено[1,2b]флуорен
а) 2,8-бис((4-бромфенил)(4-метилфенил)амино)-6,6,12,12-тетраметил-6,12-дигидроиндено[1,2b]флуорен

74,8 г (420 ммолей) N-бромсукцинимида прибавляли по частям при интенсивном перемешивании к раствору 134,6 г (200 ммолей) 2,8-бис((фенил)(4-метилфенил)амино)-6,6,12,12-тетраметил-6,12-дигидроиндено[1,2b]флуорена (приготовление аналогично таковому Примера 1с) в 1500 мл дихлорметана, и смесь перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь концентрировали до объема 200 мл в условиях сниженного давления, прибавляли 1000 мл этанола, отфильтровывали преципитат при отсасывании, перемешивали с 1000 мл горячего этанола, отфильтровывали при отсасывании, трижды промывали с помощью 300 мл этанола каждый раз и высушивали в условиях сниженного давления. Выход: 139,0 г (167 ммолей), 83,6% от теоретического; чистота: 98% в соответствии с1Н-ЯМР.
b) 2,8-бис((4~метилфенил)(4-дифениламинофенил)амино)-6,6,12,12-тетраметил-6,12-дигидроиндено[1,2b]флуорен

Процедура аналогична таковой Примера 1с. Вместо 46,8 г (100 ммолей) 2,8-дибром-6,6,12,12-тетраметил-6,12-дигидроиндено[1,2b]флуорена использовали 83,1 г (100 ммолей) 2,8-бис((4-бромфенил)(4-метилфенил)амино)-6,6,12,12-тетраметил-6,12-дигидроиндено[1,2b]флуорена. Перекристаллизация из NMP; сублимация р=1×10-5 мбар, Т - 370°С. Выход: 83,6 г (83 ммолей), 82,9% от теоретического; чистота: 99,7% в соответствии с ВЭЖХ.
Пример 91: Получение ОСИД, включающих инденофлуорентетрамины или - гексамины в качестве материала введения дыр или материала транспорта дыр в флуоресцентных ОСИД
ОСИД получали в соответствии с общим процессом, как описано в WO 04/058911, который адаптируется в индивидуальном случае для соответствующих обстоятельств (например, вариации толщины слоя для того, чтобы достигнуть оптимальной эффективности или цвета).
Результаты для различных ОСИД представлены в Примерах 92-94, приведенных ниже. Основная структура и используемые материалы (отдельно от слоя транспорта дыр) являются идентичными в примерах для лучшей сравнимости. ОСИД, имеющие следующую структуру, получали аналогично упомянутому выше общему процессу.
Слой введения дыр (HIL) 20 нм PEDOT (нанесение методом центрифугирования из воды, закупается у Н.С. Starck, Goslar, Германия; поли(3,4-этилендиокси-2,5-тиофен))
Слой транспорта дыр (НТМ1) В89 (соединение в соответствии с Примером 89)
или В90 (соединение в соответствии с Примером 90)
или в качестве сравнительного примера 4,4',4''-трис(N-1-нафтил-N-фениламино)трифениламин (сокращенное наименование NaphDATA, закупается у SynTec)
Слой транспорта дыр (НТМ2) 20 нм NPB (N-нафтил-N-фенил-4,4'-диаминобифенил)
Эмиссионный слой (EML) 30 нм допированный слой 9,10-бис(1-нафтил-антрацена) в качестве материала основы (сокращенное название - H1), допированный 5% трис[4-(2,2-дифенилвинил)фенил]амина в качестве допанта (сокращение - D1), нанесенный методом испарения, синтезированный так, как описано в WO 06/000388)
Проводник первого рода 20 нм А1Q3 (закупается у SynTec, трис(хинолинато)алюминий (III))
Катод 1 нм LiF, 150 нм А1 сверху.
ОСИД могут также быть получены без PEDOT в качестве слоя введения дыр. В этих случаях производная инденофлуорентетрамина или - гексамина в соответствии с изобретением потом представляет собой соединение введения дыр. Эти ОСИД демонстрируют сравнительно хорошие свойства.
Эти ОСИД характеризуются с помощью стандартных методов; для этой цели спектры электролюминесценции, эффективность (измеряется в кд/А) и коэффициент полезного действия (измеряется в Im/Вт) определяют как функцию яркости, выведенную из характеристических линий ток/напряжение/яркость (IUL характеристические линии).
Таблица 6 показывает результаты для некоторых ОСИД (Примеры от 92-94), в которых варьирует толщина слоя транспорта дыр (НТМ1). Материал для сравнения, который использовали в сравнительных примерах, представляет собой NaphDATA.
Материал основы H1, который использовали, представляет собой 9,10-бис(1-нафтил)антрацен, используемый допант представляет собой D1. Оба представлены ниже:


Как можно увидеть из Примеров 92 и 93 в соответствии с изобретением в Таблице 6, ОСИД, включающие материал транспорта дыр в соответствии с изобретением (НТМ1), демонстрируют значительное более низкое напряжение оперативного постоянного тока по сравнению с использованием NaphDATA в качестве материала транспорта дыр уровня техники. Напряжение оперативного постоянного тока также является независимым от толщины слоя транспорта дыр. Это свойство представляет собой основное преимущество для конструирования полноцветных дисплеев, так как плотность пикселей первичных цветов голубого, зеленого и красного может быть сделана такой же путем вариации толщины слоя транспорта дыр. Материал транспорта дыр в соответствии с изобретением может, таким образом, служить в качестве слоя компенсации толщины в данном случае при отсутствии вредного воздействия на электрооптические свойства этого устройства. Как видно из сравнительных примеров, это не относится к материалу транспорта дыр (NaphDATA) в соответствии с уровнем техники: в данном случае значительно более высокое напряжение оперативного постоянного тока требуется при большей толщине слоя транспорта дыр.
Реферат
Изобретение относится к органическим электролюминесцентным устройствам на основе соединений формулы (1) ! ! где Y, Z выбраны из N, P, P=O, C=O, O, S, S=O и SO2; Ar1, Ar2, Ar3 выбраны из бензола, нафталина, антрацена, фенантрена, пиридина, пирена или тиофена, необязательно замещенных R1; Ar4, Ar5, Ar6, Ar7 выбраны из бензола, нафталина, антрацена, фенантрена, пиридина, пирена, тиофена, трифениламина, дифенил-1-нафтиламина, дифенил-2-нафтиламина, фенилди(1-нафтил)амина, фенилди(2-нафтил)амина или спиробифлуорена, необязательно замещенных R1; Е - одинарная связь, N(R1), О, S или C(R1)2; R1 представляет собой Н, F, CN, алкил, где СН2 группы могут быть заменены на -R2C=CR2-, -C≡C-, -О- или -S-, и Н может быть заменен на F, необязательно замещенные арил или гетероарил, где R1 могут образовывать кольцо друг с другом; R2 - Н, алифатический или ароматический углеводород; X1, X4, X2, X3 - выбраны из C(R1)2, C=O, C=NR1, О, S, S=O, SO2, N(R1), P(R1), P(=O)R1, C(R1)2-C(R1)2, C(R1)2-C(R1)2-C(R1)2, C(R1)2-O и C(R1)2-O-C(R1)2; n, о, p, q, r и t равны 0 или 1; s=1. Технический результат - получение новых соединений - допантов эмиссионного слоя, и новых электролюминесцентных устройств на их основе, излучающих голубой свет. 6 н. и 12 з.п. ф-лы, 6 табл.
Формула

где используются следующие символы и индексы:
Y, Z являются идентичными или различными и представляют собой N, Р, Р=O, С=O, О, S, S=O или SO2;
Ar1, Ar2, Ar3 являются в каждом случае идентичными или различными и представляют собой бензол, нафталин, антрацен, фенантрен, пиридин, пирен или тиофен, которые могут быть замещены одним или более радикалами R1;
Ar4, Ar5, Ar6, Ar7 являются в каждом случае идентичными или различными и представляют собой бензол, нафталин, антрацен, фенантрен, пиридин, пирен, тиофен, трифениламин, дифенил-1-нафтиламин, дифенил-2-нафтиламин, фенилди(1-нафтил)амин, фенилди(2-нафтил)амин или спиробифлуорен, которые могут быть замещены одним или более радикалами R1;
Е в каждом случае идентично или различно представляет собой одинарную связь, N(R1), О, S или C(R1)2;
R1 в каждом случае является идентичным или различным, и представляет собой Н, F, CN, алкил с неразветвленной цепью, содержащий 1-5 атомов углерода, или алкил с разветвленной цепью, содержащий 3-5 атомов углерода, где в каждом случае одна или более несмежных СН2 групп могут быть заменены на -R2C=CR2-, -С≡С-, -О- или -S-, и где один или более атомов Н могут быть заменены на F, или моновалентную арильную или гетероарильную группу, содержащую 2-16 атомов углерода, которая может быть замещена одним или более радикалами R2, два или более заместителей R1 также могут образовывать кольцевую систему друг с другом;
R2 в каждом случае является идентичным или различным, представляет собой Н или алифатический или ароматический углеводородный радикал, содержащий 1-20 атомов углерода;
X1, X4 являются в каждом случае идентичными или различными и представляют собой мостиковую связь, которая вместе с Ar1 и Ar2 представляет собой циклическую систему, выбранную из C(R1)2, C=O, C=NR1, О, S, S=O, SO2, N(R1), P(R1), P(=O)R1, C(R1)2-C(R1)2, C(R1)2-C(R1)2-C(R1)2, C(R1)2-O и C(R1)2-O-C(R1)2;
X2, X3 являются в каждом случае идентичными или различными и представляют собой мостиковую связь, которая вместе с Ar2 и Ar3 представляет собой циклическую кольцевую систему, выбранную из C(R1)2, C=O, C=NR1, О, S, S=O, SO2, N(R1), P(R1), P(=O)R1, C(R1)2-C(R1)2, C(R1)2-C(R1)2-C(R1)2, C(R1)2-O и C(R1)2-O-C(R1)2;
n, о, p являются в каждом случае идентичными или различными и равны 0 или 1, при условии что n, p и о могут только одновременно быть равными 0, если X1 представляет собой группу, отличную от мостика C(R1)2, где R1 - алкильный радикал с открытой цепью; n=0 и о=0 и р=0 в данном случае означает, что два радикала R1 присутствуют вместо мостика;
q, r в каждом случае равны 1, если соответствующий центральный атом группы Y или Z представляет собой элемент из 5-й основной группы, и в каждом случае равны 0, если соответствующий центральный атом группы Y или Z представляет собой элемент из 4-й или 6-й основной группы;
s равен 1;
t в каждом случае является идентичным или различным, равен 0 или 1, где t=0 означает, что радикалы R1 связаны вместо группы Е; кроме того, t=0, если q=0 и t=0, если r=0.

где символы и индексы имеют те же значения, как указано в п.1.


где символы и индексы имеют те же значения, как указано в п.1.

где символы и индексы имеют те же значения, как указано в п.1.












































































































































Комментарии