Циклопентадиенильные производные, способ их получения и промежуточные соединения для их получения - RU2168489C2
Код документа: RU2168489C2
Чертежи







Описание
Изобретение относится к новым мостиковым соединениям циклопентадиенильного типа и способу их получения.
Известно, что большая часть растворимых катализаторов, пригодных для гомо- и сополимеризации альфа-олефинов, состоит из комплексов циркония или титана, имеющих лиганды бис-инденильного, бис-флуоренильного типа или смешанные, например флуоренилциклопентадиенильные лиганды (P.c.Mohring, N.J.Coville, J. Organomet Chem. 479, 1, 1994).
Лиганды могут быть мостиковыми или немостиковыми. Наилучшие результаты, особенно с точки зрения высоких молекулярных масс, получают с мостиковыми лигандами (смотри J.C.W. Chem and D,He, Journal of Polymer Science, Part 11: Polymer Chemistry, Vol.29 (1991), page 1585).
Тетрагидроинденильные производные являются более эффективными, чем соответствующие ненасыщенные производные, в особенности при включении со- и трет-мономеров, и поэтому в настоящее время их наиболее широко используют.
Однако при этом возникает проблема, связанная с тем, что поскольку лиганды инденильного и флуоренильного типа являются легкодоступными, соответствующие тетрагидроинденильные производные получают прямым гидрированием циркониевого комплекса, когда трудно хемоселективно гидрировать исходные лиганды.
Процесс гидрирования комплекса циркония имеет различные недостатки. В действительности, как указывается несколькими экспертами (смотри E.Samuel, Bull. Soc. Chem. Fr, 3548, 1966 и S.Collins et al. in J.Organometallic Chem. , 342, 21, 1988), при проведении такого гидрирования вследствие низких выходов и/или тяжелых условий возникают определенные трудности. Кроме того, в процессе гидрирования инденильных комплексов циркония получают два идентичных лиганда тетрагидроинденильного типа; на самом деле, невозможно получить этим способом асимметричные комплексы, имеющие один тетрагидроинденильный и один инденильный лиганд.
Были найдены новые мостиковые циклопентадиенильные производные, при использовании которых преодолевают упомянутые выше недостатки, благодаря тому, что вследствие их структуры нет необходимости в вышеприведенной стадии гидрирования.
В соответствии с этим настоящее изобретение относится к мостиковым производным циклопентадиенила, имеющим общую формулу I.
A - X - B (I)
в которой:
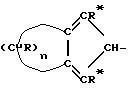
1) A представляет монофункциональный гидрокарбильный радикал, имеющий общую формулу II

в которой R и R' выбирают из:
--H
--монофункциональных алкильных радикалов, имеющих от 1 до 3-х атомов углерода,
--монофункциональных алкиларильных или арильных радикалов, при условии, что:
--количество R, отличающихся от H, составляет не более двух,
--по крайней мере один R' является H; предпочтительно все R=H и R' выбирают из H и CH3,
2) n представляет целое число от 2 до 20, и его предпочтительно выбирают из 3, 4, 5, 6, 10,
3) -X- представляет мостик между A и B и состоит из бифункционального радикала, выбранного из:
a) линейной, разветвленной или циклической C2-C20-алкиленовой группы,
b) алкил- или арилзамещенной силануленовой группы, имеющей от 1 до двух атомов кремния,
c) алкилзамещенной силалкиленовой группы,
d) силоксасиленовой группы или тетрааилкил- или тетраарилзамещенной -Si(R1)2 -O-Si(R2)2-,
4) B представляет монофункциональный гидрокарбильный радикал, выбранный из:
e) любого из радикалов A, определенных выше,
f) циклопентадиенильного радикала,
Группы A представляют монофункциональные циклопентадиенильные радикалы, соответствующие углеводороды вкратце в дальнейшем будут названы AH, и они описаны в находящейся на рассмотрении заявке на патент IT-A-MI 95A 002707. Типичные примеры углеводородов AH, имеющих оба R'=H, приведены в таблице 1.
Названия вышеприведенных углеводородов получены, используя Автономную программу института Бельштейна (Beilstein) - Информационную систему Бельштейна, и количество атомов углерода является
таким же, как и в формуле IIa

В частности, углеводороды AH и, следовательно, соответствующие монофункциональные гидрокарбильные радикалы A выбирают из:
-2,3,4,5,6,7,8-гексагидроазулена(R'=R=H и n = 5),
-4,5,6,7,8,9-гексагидро-2H-циклопентациклооктена (R'=R=H и n = 6);
-4,5,6,7,8,9,10,11,12,13-декагидро-2H-циклопентациклоциклододецена (R'= R==H и n = 10)
-1-метил-4,5,6,7,8,9,10,11,12,13-декагидро-2H-циклопентациклододецена R'=CH, R=H, n=10).
В одном варианте, -X- представляет линейный, разветвленный или циклический алкиленовый радикал, имеющий от 2 до 30 атомов углерода. Типичными примерами линейного -X- являются этилен, пропилен, бутилен, пентилен, гексилен. Типичными примерами разветвленного -X- являются изопропилиден (CH3-C-CH3), изобутилиден (CH3-C-C2H5 ), дифенилметилен (C6, H5-C-C6H5). Типичными примерами циклического алкиленового радикала X являются циклобутилен, циклопентилен, циклогексилен.
В другом варианте, -X- представляет алкил- или арилзамещенную силаниленовую группу, имеющую от 1 до 2 атомов кремния, например, диметилсиланилен или -Si(CH3)2-, диэтилсиланилен, тетраметилдисилиланилен, или -Si(CH3)2-Si(CH3)2, диметилдиэтилдисиланилен, предпочтительно диметилсиланилен.
В другом
варианте, -X- группа состоит из кремний-углеродных последовательностей, т. е. алкилзамещенной силалкиленовой группы, например -Si(R')2-C(R'')2-, в которой R' представляет низший
алкил и R'' является водородом или низшим алкилом. Типичными примерами силалкиленовых групп являются:
--1-сил-1,1-диметилэтилен,
--2-сил-2,2-диметилпропилен,
--1,3-дисил-1,1,
3,3-тетраметилпропилен,
В другом варианте, группа X представляет тетраалкил- или тетраарилзамещенный силоксасиланилен, т, е. -Si(R1)2-O-Si(R2)2,
где R1 и R2, являющиеся одинаковыми или различными, могут быть алкильными или арильными радикалами.
В предпочтительном варианте, -X- выбирают из линейных или разветвленных алкиленовых производных и диалкилсиланиленов, еще более предпочтительно ее выбирают из этилена, изопропилидена и диметилсиланилена.
Что же касается B, то он представляет
монофункциональный гидрокарбильный радикал, выбранный из:
(e) любого из радикалов A, определенных выше,
(f) циклопентадиенильного радикала,
Когда B равен любой из
производных A, определенных выше, продукт, имеющий общую формулу (I), будет состоять из двух циклопентадиенильных производных A, одинаковых или различных, соединенных друг с другом в положении 2 от
мостика-X-.
Эти структуры могут быть названы A-X-A', в которых как A, так и A', являющиеся одинаковыми или различными, имеют общую формулу (II), при условии, что в мостиковом продукте A-X-A двойные связи циклопентадиенильного кольца могут быть расположены в положениях 3,3a- и 1,(n+3)a- или в положениях 1,2- и 3a, (n+3)a-, где n имеет значение, определенное выше, и нумерацию положений, представленных в общей формуле (IIa), получают из упомянутой выше Автономной программы.
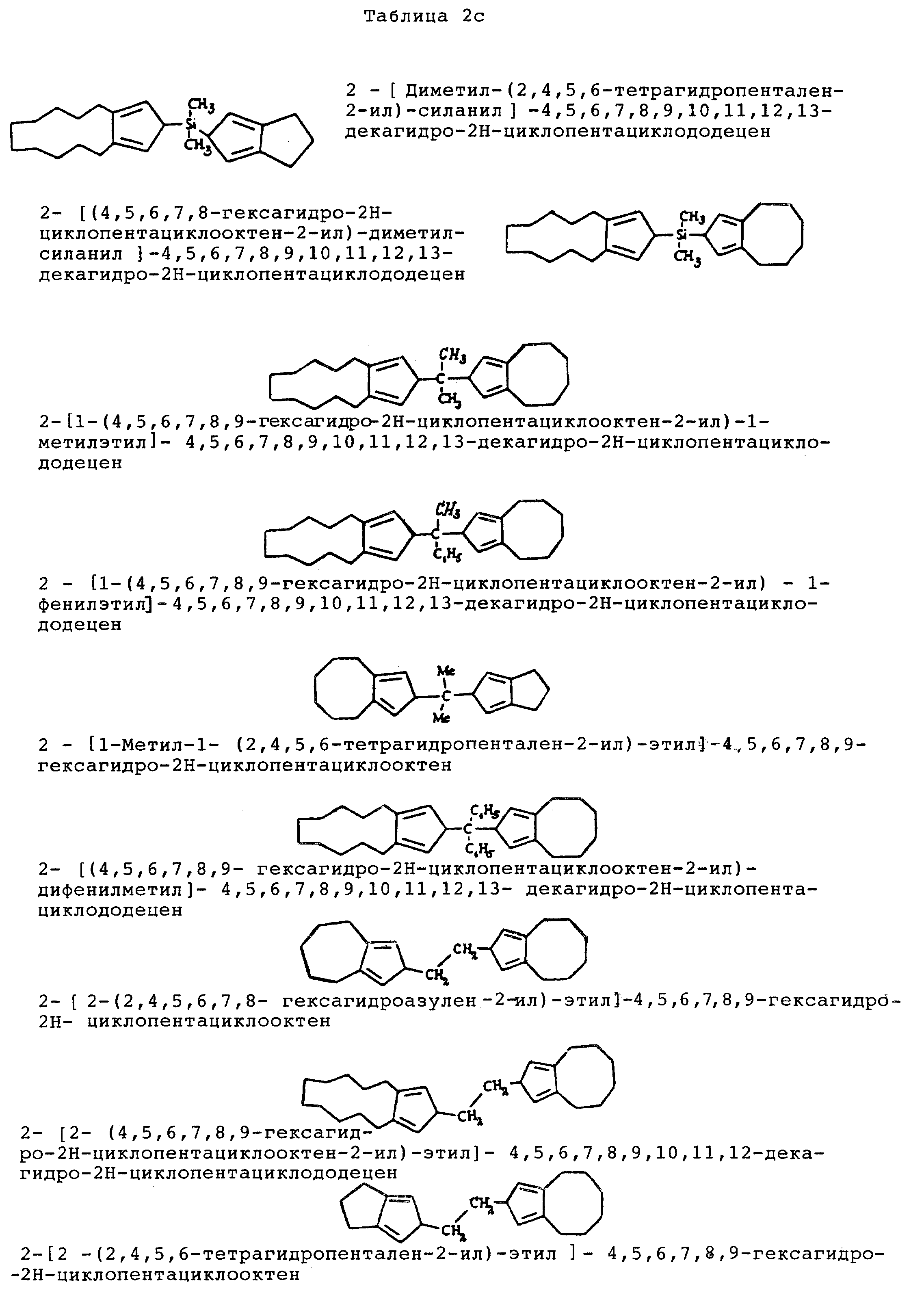
Типичными примерами структур A-X-A', в которых A' являются такими же или отличающимися от A, представлены в таблицах 2a, 2b, 2c, 2d.
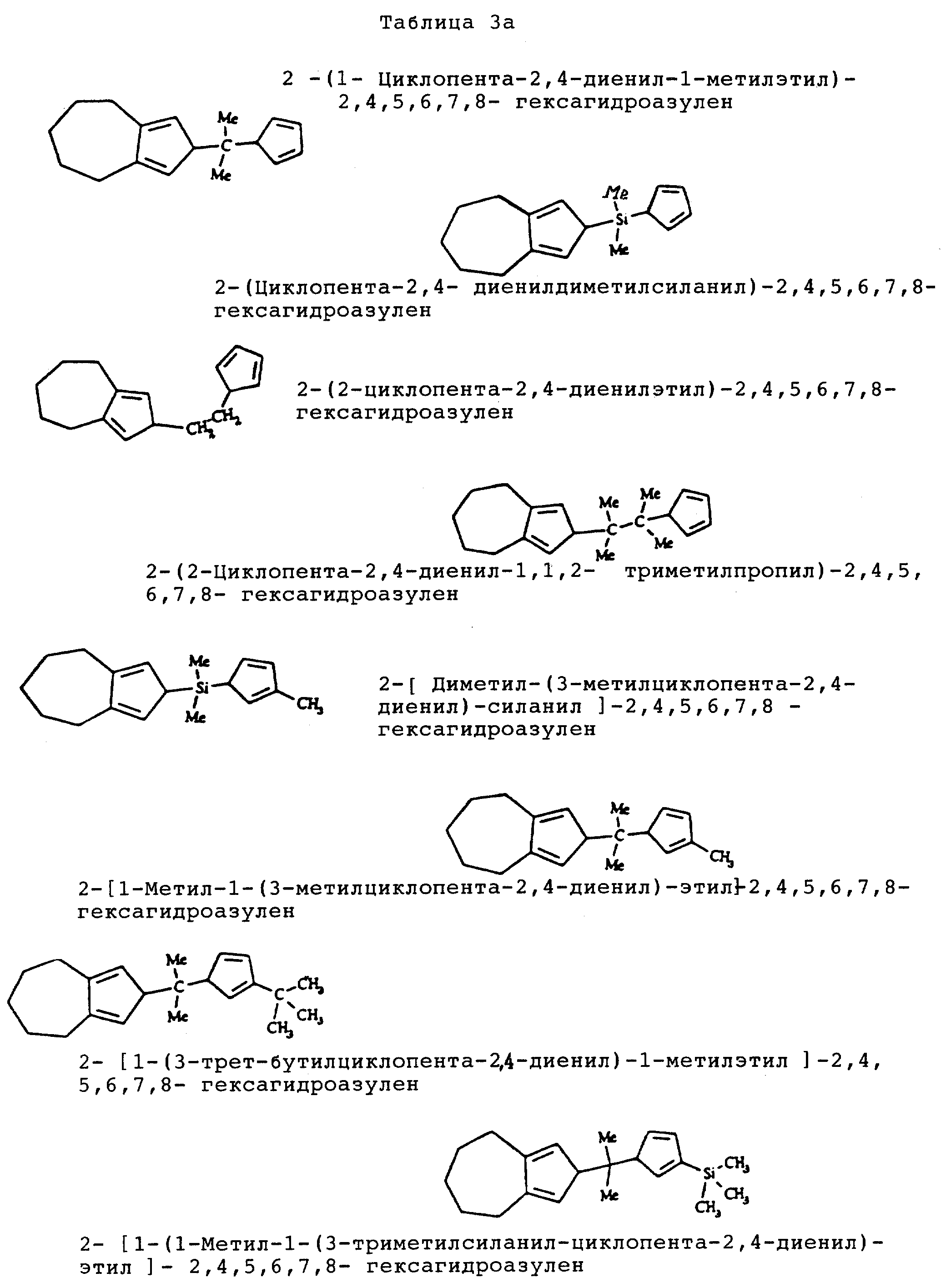
Когда B не является гидрокарбильным радикалом, имеющим общую формулу (II), В представляет монофункциональный циклопентадиенильный радикал (f), выбранный из циклопентадиенила, инденила, флуоренила и родственных алкил-, арил-, триалкилсилилзамещенных производных; (f) предпочтительно выбирают из циклопентадиенила, инденила и флуоренила. Эти соединения названы A-X-C.
Следует отметить, что как указано выше для продуктов A-X-A, в мостиковом продукте A-X-C двойные связи гидрокарбильного радикала A циклопентадиенильного кольца могут быть расположены в положениях 3, 3a- и 1,(n+3)a-, или 1,2- и 3a, (n+3)a-, где n имеет значение, определенное выше, и перечисление положений, представленных в общей формуле IIa, получают из упомянутой выше Автономной программы.
Углеводороды, соответствующие монофункциональным циклопентадиенильным радикалам (f) здесь названы -FH.
Место присоединения к мостику -X- вышеприведенных циклопентадиенильных производных (f) является таким, которое обычно получают в известной области. Инден, например, будет связан с мостиком -X- в положении 1 и флуорен в единственном неконденсированном положении 5-членного цикла.
Таблицы 3a-3d подтверждают примеры структур типа A-X-C, в которых C является любым из монофункциональных циклопентадиенильных радикалов (f).
Объектом настоящего изобретения является также способ получения соединений, имеющих общую формулу (1), в которой -X- выбирают из разветвленных или циклических алкиленовых производных и из диалкилзамещенных силаниленов.
Вышеприведенные соединения получают, исходя из углеводородов A-H, которые определены выше, (т.е. из углеводородов, соответствующих радикалам A, имеющим общую формулу IIa), и с использованием способа, который изменяется в соответствии со структурой -X-.
Когда -X- представляет бифункциональную производную типа R3-C-R4, где R3 и R4 выбирают из монофункциональных C1-C5-алкильных радикалов, фенила, или R3 и R4 вместе образуют C4-C5-алкиленовый радикал, реакция происходит в две стадии.
В соответствии с этим, настоящее
изобретение относится к способу получения соединений, имеющих общую формулу A-X-B, в которой A и B имеют вышеприведенное значение и -X- представляет радикал типа R3-C-R4, где
R3 и R4 имеют вышеприведенное значение, который включает следующие стадии:
i) конденсацию соединения общей формулы A-H, определенным выше, и кетона, имеющем общую
формулу R3-CO-R4, для получения фульвенового соединения, имеющего общую формулу III

(ii) и последующее добавление к фульвеновому соединению, полученному на стадии (i), углеводорода BH, при этом углеводород BH выбирают из любого из углеводородов AH и FH, определенных выше.
Стадию (i), вышеприведенной реакции, проводят в щелочной среде, предпочтительно с алкоголятом третичного спирта, еще более предпочтительно с третбутилатом калия.
Стадию (ii) вышеприведенного способа предпочтительно осуществляют путем получения аниона углеводорода BH и последующего взаимодействия аниона с продуктом (III), полученным на стадии (i).
Следует отметить, что описанный выше способ обеспечивает возможность получения соединений, в которых -X- образует мостик между радикалом A, всегда находящимся в положении 2, и циклопентадиенильным радикалом B в положении, определенном данной областью техники.
Кроме того настоящее изобретение относится к промежуточным соединениям фульвенового типа, имеющим общую формулу (III), в которой n, R, R', R3, и R4 имеют определенное выше значение; R=H,R' предпочтительно выбирают из H и CH3, R3=R4=CH3 или C6H5, n выбирают из 3, 4, 5, 6, 10.
Другой объект настоящего изобретения относится к способу получения соединений, имеющих общую формулу A1-X-A1, где X представляет диалкилсиланилен и радикалы A1, являющиеся одинаковыми, выбирают из радикалов A, определенных выше и который включает взаимодействие углеводорода A1H с диалкилгалогенсиланом, предпочтительно диалкилдихлорсиланом, при молярном соотношении A1H к диалкилгалогенсилану, равном около 2/1.
В предпочтительном варианте, способ осуществляют путем получения аниона углеводорода A1H, предпочтительно с алкиллитием, и взаимодействия полученного таким образом аниона с дигалогенсиланом.
Еще один объект настоящего изобретения относится к способу
получения соединений, имеющих общую формулу A1-X-B, в которой;
-X- является диалкилсиланиленом,
A1 представляет монофункциональный гидрокарбильный радикал, выбранный из радикалов A,
определенных выше,
B выбирают из:
--A2, где A2 представляет любой из радикалов B, определенных выше, отличающихся от A1,
--циклопентадиенильного радикала (f); вышеуказанный
способ осуществляют в две стадии, при этом первая стадия способа (стадия a) включает взаимодействие соединения A1H с диалкилдигалогенсиланом, предпочтительно диалкилдихлорсиланом, при молярном
соотношении A1H к диалкилдигалогенсилану, равном 1/1; вторая стадия включает взаимодействие соединения, полученного на стадии (a), с углеводородом BH при по существу эквимолярном соотношении
относительно полученного на стадии (a) продукта.
В предпочтительном варианте, способ осуществляют путем получения аниона углеводорода A1H, предпочтительно с алкиллитием и последующего взаимодействия, на первой стадии, вышеуказанного аниона с дигалогенсиланом при молярном соотношении, равном 1 : 1. На второй стадии получают анион углеводорода BH, предпочтительно с алкиллитием, и этот анион взаимодействует с полученным на первой стадии соединением при молярном соотношении 1 : 1.
Последующие примеры обеспечивают более лучшее иллюстрирование настоящего изобретения.
ПРИМЕР 1. Синтез бис(2,4,5,6,7,8-гексагидроазулен-2-ил)диметилсилана
12 мл раствора 2.5M н-бутиллития в гексане добавляют при комнатной температуре к раствору в
100 мл ТГФ (тетрагидрофурана), содержащему 4,1 г (0.03 моля) 2,4,5,6,7,8-гексагидроазулена (полученного как описано в заявке на патент того же самого заявителя IT-A-MI 95A 002707), В результате
экзотермической реакции образуется более твердое вещество. Смесь оставляют при перемешивании, осуществляемом в течение двух часов, затем охлаждают до -70oC и добавляют 1,93 г (0,015 моля)
диметилдихлорсилана в течение периода времени около 20 минут. В течение ночи температура возрастает, и получают желтый раствор.
После выпаривания растворителя продукт очищают на силикагельной колонке при элюировании петролейным эфиром. Полученный продукт загрязнен исходным диеном, который удаляют, сохраняя фракцию под механическим вакуумом в течение 24 часов.
Получают 2,2 г продукта (выход 45%), который, как показал анализ ЯМР и газовой хроматографией, был чистым. Спектр1H-ЯМР (CDCl3, частиц на миллион относительно ТМС (тетраметилсилан)) был следующим: 6,03(ш. с7, 4H), 3,07(ш. с., 2H), 2,50(м, 8H), 1,90-1,50(ш. с., 12H), 0,2(с, 6H).
ПРИМЕР 2 Синтез 2-[1H-инден-1-ил)-метилэтил]-1,4,5,6,7,
8-гексагидроазулена
Готовят раствор 4,5 г (0,033 моля) 2,4,5,6,7,8-гексагидроазулена и 0,3 г третбутилата калия в 10 мл MeOH и 10 мл ацетона. Этот раствор оставляют при температуре кипения на
20 часов, в конце дополнительно добавляют 2,7 г требутилата калия. Смесь выдерживают при температуре кипения в течение еще 25 часов, после чего смесь выливают в воду и экстрагируют этиловым эфиром.
После нейтрализации и ангидрификации эфирный экстракт выпаривают и остаток очищают элюированием петролейным эфиром на силикагельной колонке.
Получают 3,8 г фульвеновой производной 2-изопропилиден-2,4,5,6,7,8-гексагидроазулена в виде желтого твердого вещества (выход 66%). Спектр1H-ЯМР этого соединения (CDCl3 частей на миллион относительно ТМС) был следующим: 6,13(с, 2H), 2,47(м, 4H), 2,09(с, 6H), 1,64(м, 6H).
Получают эфирный раствор (100 мл) индена (4,0 г, 0,034 моля). Добавляют 12 мл 2,5М раствора бутиллития в гексане и смесь оставляют при перемешивании на 3 часа.
Затем к вышеприведенному раствору добавляют фульфеновую производную и охлаждают до -70oC. Дают температуре подняться при стоянии и смесь оставляют при перемешивании на 48 часов.
Затем реакционную смесь гидролизуют в воде и экстрагируют этиловым эфиром, после выпаривания которого получают твердое вещество, которое очищают на силикагельной колонке с использованием в качестве элюента петролейного эфира.
Получают 4,5 г продукта (выход 74%). Его спектр1H-ЯМР
(CDCl3, частей на миллион относительно ТМС) был следующим: 7,4-7,0(м, 4H), 6,8(дд, 1H), 6,45(дд, 1H), 5,95(с, 1H), 3,60(м, с., 1H), 3,10(ш. с., 2H), 2,40(м, 6H), 1,23(с, 3H), 0,94(с, 3H).
ПРИМЕР 3 Синтез бис(декагидроциклопентацилододецен-2-ил)диметилсиланов
22 мл 2,5M BuLi в гексане добавляют к раствору 11 г 4,5,6,7,8,9,10,11,12,
13-декагидро-2H-циклопентациклододецена, (полученного как описано в находящейся на рассмотрении заявке на патент IT-A-MI 95A 002707 того же самого заявителя), в 100 мл пентана. Смесь выдерживают при
перемешивании в течение ночи, полученный осадок отфильтровывают и сушат, получая при этом 9,0 г соответствующей литиевой соли.
Готовят раствор 3,4 г (0,16 молей) вышеприведенной литиевой соли в ТГФ (100 мл).
К этому раствору в ТГВ при -70oC в течение примерно 20 минут добавляют 1,0 г (0,008 молей) диметилдихлорсилана. Температура возрастает в течение всей ночи, в результате получают желтый раствор.
После выпаривания растворителя добавляют этиловый эфир и смесь гидролизуют разбавленной соляной кислотой. Эфирный экстракт
промывают до нейтральной реакции, сушат, выпаривают. Остаток (3,7 г) очищают на силикагельной колонке при элюировании петролейным эфиром,
Получают 2,2 г (выход 62%) продукта, анализ ЯМР
которого доказал, что он является смесью бис(4,5,6,7,9,10,11,12,13-декагидро-2H-циклопентациклододецен-2-ил) диметилсилана.1H-ЯМР (CDCl3, частей на миллион относительно ТМС): 6,
62(с), 6,39(шс), 6,21(шс), 6,12(шс), 3,23(м), 2,91(с), 2,35(м), 1,88-0,84(м), 0,08(шс), 0,21(шс).
13C-ЯМР (CDCl3, частей на миллион относительно ТМС): 153,35, 146, 07, 146,02, 141,49, 141,04, 138,44, 132,29, 132,01, 127,09, 125,09, 124,89, 121,46, 61,37, 46,25, 39,49, 32,30, 30,96, 30,76, 28,94, 28,90, 24,30.
ПРИМЕР 4 Синтез 1,2-бис-(1-метил-4,5,
6,7,8,9,10,11,12,13- декагидро-2H-циклопентациклододецен-2-ил)диметилсилана
28 мл (70. 10 ммолей) BuLi в гексане добавляют к 15,1 г (69,2•10-3 молей) 1-метил-4,5,6,7,8,9,10,
11,12,13-декагидро-2H-циклопентациклододецена, полученного в соответствии с примером 4 заявки IT-F-MI 95A 002707, и разбавляют 100 мл пентана. Смесь перемешивают в течение ночи и затем фильтруют.
Осадок извлекают и сушат, получают 12 г соответствующей литиевой соли.
К 5,6 г (25,7 10 молей) вышеприведенной литиевой соли, растворенной в 100 мл безводного ТГФ и охлажденной до -70oC, добавляют 1,7 г (13,2 10 молей) дихлорсилана: в течение ночи температура повышается до 20oC. После выпаривания растворителя добавляют диэтиловый эфир и реакционную смесь гидролизуют разбавленной HCl.
Органическую фазу промывают до нейтральной реакции, сушат и выпаривают. Остаток очищают на силикагельной колонке при элюировании петролейным эфиром.
Получают 3,5 г (выход 55oC) 1,2-бис-(1-метил-4,5,6,7,8,9,10,11,12,13-декагидро- 2H-циклопентациклододецен-2-ил)-диметилсилана.
Реферат
Изобретение относится к циклопентадиенильным производным общей формулы I
A-X-B
в которой 1) А представляет монофункциональный гидрокарбильный радикал,
имеющий общую формулу II
Формула
А-Х-В,
в которой 1) А представляет монофункциональный углеводородный радикал, имеющий общую формулу II

в которой R и R* выбирают из H, монофункциональных алкильных радикалов, имеющих от 1 до 3 атомов углерода; 2) n представляет целое число от 4 до 10; 3) -Х- представляет мостик между А и В и состоит из бифункционального радикала, выбранного из: а) линейной или разветвленной С2-С3-алкиленовой группы, б) алкилзамещенной силаниленовой группы, имеющей 1 атом кремния; 4) В представляет монофункциональный углеводородный радикал, выбранный из e) любого из радикалов А, определенных выше, f) циклопентадиенильного радикала.
i) конденсацию углеводорода общей формулы А-Н, где значение А определено выше, и кетона общей формулы R3-CO-R4 с получением фульвенового соединения, имеющего общую формулу III

ii) добавление к фульвеновому соединению, имеющему общую формулу III, полученному на стадии (i), углеводорода ВН,. где ВН выбран из любого углеводорода, соответствующего монофункциональным углеводородным радикалам (е) и (f), определенным в п.1.

в которой n, R, R*, R3 и R4 имеют вышеприведенные значения.

Комментарии