Способ гидрогенизации иминов и способ получения амина - RU2150464C1
Код документа: RU2150464C1
Чертежи

Описание
Настоящее изобретение относится к способу гидрогенизации иминов водородом под повышенным давлением в присутствии иридиевых катализаторов и галогенида, причем реакционная смесь содержит неорганическую или органическую кислоту, и к способу получения амина.
В патенте США 4994615 описывается способ асимметричной гидрогенизации прохиральных N-арилкетиминов, в котором используют иридиевые катализаторы, содержащие хиральные дифосфиновые лиганды и возможно галогенид. В описании к патенту США 5011995 описывается способ асимметричной гидрогенизации прохиральных N-алкилкетиминов с использованием тех же самых катализаторов. В описании к патенту США 5112999 в качестве катализаторов для гидрогенизации иминов используются полициклические иридиевые соединения и комплексная соль иридия, которая содержит дифосфиновые лиганды.
Эти способы гомогенного катализа доказали свою значимость. Однако в зависимости от каталитического предшественника, подложки и используемых дифосфиновых лигандов такие катализаторы часто в большей или меньшей степени проявляют тенденцию к дезактивации, в частности, при изготовлении относительно больших партий в серийном производстве или в промышленном масштабе. Во многих случаях, особенно при повышенных температурах, например, при температурах >25oC, которые необходимы для сокращения продолжительности реакции, полной конверсии достичь невозможно. Таким образом, для промышленного применения способа гидрогенизации производительность катализатора оказывается слишком низкой с точки зрения его экономической жизнеспособности.
Неожиданно было обнаружено, что каталитическую активность можно повысить в 10 или более раз в том случае, если реакционная смесь содержит галогенид и кислоту. Также неожиданно было обнаружено, что одновременно с этим можно значительно снизить или полностью предотвратить дезактивацию катализаторов. Кроме того, неожиданно обнаружено, что в определенных условиях энантиоселективность является высокой, а высокий выход оптического изомера, например до 80%, может быть достигнут даже при реакционных температурах, превышающих 50oC.
Настоящее изобретение относится к способу гидрогенизации иминов водородом под повышенным давлением в присутствии иридиевых катализаторов и в инертном растворителе или без него, при этом реакционная смесь содержит хлорид, бромид или иодид аммония или хлорид, бромид или иодид металла, растворимый в реакционной смеси, причем предпочтительным металлом является щелочной металл, и дополнительно содержит кислоту.
Предлагаемый согласно изобретению
способ относится к гидрогенизации имина водородом при повышенных давлении и температуре в присутствии иридиевого катализатора в среде инертного растворителя или без него и в присутствии хлорида,
бромида или иодида аммония или хлорида, бромида или иодида металла, который растворим в реакционной смеси, отличительной особенностью которого от известных способов является проведение процесса в
присутствии кислоты при температуре от минус 20 до 100oC с использованием в качестве иридиевого катализатора гомогенного катализатора, соответствующего формуле III, IIIa, IIIb, IIIc и
IIId
[XlrYZ] (III),
[XIrY]⊕A⊖ (IIIa),
[XIrZ4]⊖M⊕ (IIIb),
[YIrHZ2]2 (IIIc),
[YlrZ3]2 (IIId)
где X обозначает два олефиновых лиганда или диеновый лиганд, Y обозначает дифосфин, имеющий вторичные фосфиновые группы,
(а) фосфиновые группы которого связаны с разными углеродными атомами углеродной цепи, содержащей от 2 до 4 углеродных атомов, или
(б) фосфиновые группы которого в орто-положениях
циклопентадиенильного кольца присоединены либо напрямую, либо посредством мостиковой группы - CRaRb-, или каждая из групп связана с циклопентадиенильным кольцом ферроценила,
или
(в) одна фосфиновая группа которого связана с углеводородной цепью, содержащей 2 или 3 углеродных атомов, а другая фосфиновая группа которого связана с кислородным атомом или азотным
атомом, присоединенным к концу этой углеродной цепи, или
(г) фосфиновые группы которого связаны с двумя кислородными атомами или азотными атомами, присоединенными к концу C2
-углеродной цепи; вследствие чегов случаях (а), (б), (в) и (г) 5-, 6- или 7-членное кольцо образуется совместно с атомом Ir, радикалы Z каждый независимо друг от друга (других) обозначает Cl, Br или I,
A⊖ бозначает анион окси- или комплексной кислоты, а M⊖ обозначает катион щелочного металла или четвертичный аммоний и Ra и Rb каждый
независимо друг от друга обозначают водород. C1-C8алкил, C1-C4 фторалкил, фенил либо бензил или обозначают фенил или бензил, содержащие от 1 до 3 C1-C4 алкиловых или C1-C4 алкоксильных заместителей.
Предпочтительные имины содержат по меньшей мере одну группу



В указанных группах свободные связи соединены с водородом или органическими радикалами, содержащими от 1 до 22 углеродных атомов, или органическими гетерорадикалами, содержащими от 1 до 20 углеродных атомов и по меньшей мере один гетероатом из группы О, S, N и Р; или атом азота группы
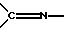
Обычно гидрогенезации подвергают имин, выбранный из альдимина, кетимина или
гидразона. В частности используемый имин представляет собой имин формулы I

который гидрогенизуют с получением амина формулы II

где
R3 представляет собой линейный или разветвленный C1-C12 алкил, циклоалкил, содержащий от 3 до 8 кольцевых углеродных атомов; гетероциклоалкил, связанный через углеродный атом и содержащий от 3 до 8 кольцевых атомов и 1 или 2 гетероатома из группы О, S и NR6; C7-C16 аралкил, связанный через алкильный углеродный атом, или C1-C12 алкил, замещенный упомянутыми циклоалкилом либо гетероциклоалкилом или гетероарилом; или где
R3 обозначает C6-C12 арил или C4-C11 гетероарил, связанный через кольцевой углеродный атом и содержащий в кольце 1 или 2 гетероатома; причем
R3 незамещен или замещен -CN, -NO2, F, Cl, C1-C12 алкилом, C1-C12 алкокси-группой, C1-C12 алкилтиогруппой, C1-C6 галоидалкилом, -ОН, C6-C12-арилом, -арилокси- или -арилтиогруппой, C7-C16-аралкилом, -аралкокси- или аралкилтиогруппой, вторичным амином, содержащим от 2 до 24 углеродных атомов, -CONR4R5 или -COOR4, причем ариловые радикалы и ариловые группы в аралкиловых, аралкокси- и аралкилтиогруппах в свою очередь незамещены или замещены -CN, -NO2, F, Cl, C1-C4 -алкилом, -алкокси- или -алкилтиогруппой, -OH, -CONR4R5 или -COOR4;
R4 и R5 каждый независимо друг от друга обозначает водород, C1-C5 алкил, фенил либо бензил, или
R4 и R'5 вместе обозначают тетра- или пентаметилен или 3-оксапентилен;
R6 независимо имеет те же значения, что и приведенные для R4;
R1 и R2 каждый независимо друг от друга обозначает водородный атом,
C1-C12 алкил или циклоалкил, содержащий от 3 до 8 углеродных атомов, каждый из которых незамещен или замещен -ОН, C1-C12 алкокси-, фенокси-, бензилоксигруппой, вторичным амином, содержащим от 2 до 24 углеродных атома, -CONR4R5 или -COOR4; C6-C12 арил или C7-C16 аралкил, который незамещен или замещен так же, как и R3, или - CONR4R5 или -COOR4, где значения R4 и R5 определены выше, или
R3 имеет значения, определенные выше, a R1 и R2 вместе обозначают алкилен, содержащий от 2 до 5 углеродных атомов, цепь которого необязательно прервана 1 или 2 радикалами -О-, -S- либо -NR6, и/или незамещен или замещен = О или так же, как и R1 и R2 в приведенном выше значении алкила, и/или сконденсирован с бензолом, пиридином, пиримидином, фураном, тиофеном или пирролом; или
R2 имеет значения, определенные выше, a R1 и R3 вместе обозначают алкилен, содержащий от 2 до 5 углеродных атомов, цепь которого необязательно прервана 1 или 2 радикалами -О-, -S- или - NR6, и/или незамещен или замещен = О или так же, как и R1 и R2 в приведенном выше значении алкила, и/или сконденсирован с бензолом, пиридином, пиримидином, фураном, тиофеном или пирролом.
Предпочтительно, когда R1 и R2 в качестве гетероарила означает 5- или 6-членное кольцо, содержащее 1 или 2 одинаковых
или различных гетероатома, либо, если R1 и R2 означает гетероарилзамещеный алкил, то предпочтительными являются производные 5- или 6-членного цикла, содержащего 1 или 2
одинаковых или различных гетероатома, либо, если R1 и R2 означает гетероциклоалкил или гетероциклоалкилзамещенный алкил, то предпочтительно они содержат от 4 до 6 атомов в кольце
и 1 или 2 одинаковых или различных
гетероатома из группы О, S и NR6, где R6 обозначает водород, C1-C12алкил, фенил или бензил.
Предпочтительны соединения формулы I, где R1, R2 и R3 представляют собой незамещенный или замещенный C1-C6алкил, либо R1, R2 и R3 незамещенный или замещенный циклоалкил содержащий от 3 до 6 углеродных атомов, либо R1, R2 и R3 представляют собой незамещенный или замещенный содержащий в алкилене от 1 до 10 углеродных атомов, либо R1 и R2 или R1 и R3 вместе с углеродным атомом или с группой -N=C, с которой они связаны, образуют соответственно 5- или 6-членный цикл, либо R3 обозначает 2,6-ди-C1-C4 алкилфен-1-ил, R1 обозначает C1-C4 алкил и R2 обозначает C1-C4 алкоксиметил или C1-C4 алкоксиэтил, в частности, R3 обозначает 2,6-диметилфен-1-ил или 2-метил-6-этилфен-1-ил. R1 обозначает этил или метил и R2 обозначает метоксиметил.
Преимущественно имин, указанный выше, соответствует формуле

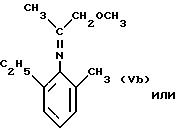

Иридиевый катализатор, используемый в предлагаемом способе, представляет собой гомогенный катализатор, который практически полностью растворим в реакционной среде.
Преимущественно в используемом катализаторе дифосфин в значении Y содержит по меньшей мере один хиральный углеродный атом, а значение Х в случае, когда означает олефиновый лиганд, то последний представляет собой разветвленный или линейный C1-C12 алкилен; а когда X означает диеновый лиганд то X представляет собой диен с открытой цепью или циклический диен, содержащий от 4 до 12 углеродных атомов.
В указанном дифосфине как правило вторичные фосфиновые группы содержат два одинаковых или различных радикалов, выбранных из
группы, включающей: линейный или разветвленный C1-C12алкил; незамещенный или C1-C6 алкил- или C1-C6 алкокси-замещенный C5
-C12 циклоалкил, C5-C12 циклоалкил-CH2-, фенил или бензил; или фенил либо бензил, замещенные галогеном (например, F, Cl или Br), C1-C6
галоидалкилом, (C1-C12 алкил)3),Si (C6Н5)3Si, C1-C6 галоидалкоксигруппой (например, трифторметоксигруппой),
-NH2, фенил2N-, бензил2N-, морфолинилом, пиперидинилом, пирролидинилом, (C1-C12 алкил)2N, -аммоний -X, -SO3M1, - CO2M1, -PO3M1 или -COO-C1-C6алкилом (например, группой - COOCH2), где M1 обозначает щелочной металл или водородный атом, а X
В частности дифосфин Y соответствует формуле:




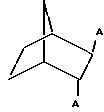





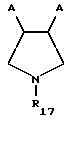



где
R15 и R16 каждый независимо друг от друга обозначают водород, C1-C4 алкил, фенил, бензил или фенил либо бензил, содержащие от 1 до 3 C1-C4 алкильных или C1-4 алкоксильных заместителей,
R14 обозначает водород, C1-4 алкил, фенил, бензил или фенил либо бензил, содержащие от 1 до 3 C1-C4 алкильных или C1-C4 алкоксильных заместителей,
R17 обозначает водород, C1-C4 алкил, фенил, бензил, C1-C6 алкокси -CO-, C1-C6 алкил-CO-, фенил-CO- или C1-C4 алкил NH-CO-
А может обозначать одинаковые или различные группы-PR2 где R обозначает C1-C6 алкил, циклогексил, фенил, бензил или фенил либо бензил, содержащие от 1 до 3 C1-C4 алкильных, C1-C4 алкоксильных заместителей, -CF3 или частично или полностью фторированных C1-C4 алкоксильных заместителей, и n обозначает 0,1 или 2.
Преимущественно дифосфин Y представляет собой
{
(R)-1-[S)-2-(дифенилфосфин)ферроценил] } этил-ди(3,5- диметилфенил)фосфин;
{ (R)-1-[(S)-2-(дифенилфосфин)ферроценил]}этил-ди(3,5- диметил-4-N,N-дипропиламинофенил) фосфин;
{
(R)-l-[(S)-2-(дифенилфосфин)ферроценил] }этил-ди(3,5- диизопропил-4-N, N-диметиламинофенил)фосфин;
{ (R)-l-[(S)-2-(дифенилфосфин)ферроценил] }этил-ди(3,5- диизопропил-4-N,
N-дибензилиламинофенил) фосфин;
{ (R)-l-[(S)-2-(дифенилфосфин)ферроценил]}этил-ди(3,5- диметил-4-N,N-дибензилиламинофенил) фосфин;
{ (R)-l-[(S)-2-(дифенилфосфин)ферроценил]}этил-ди(3,
5- диметил-4-1'-пиррол)фенил)фосфин;
{ (R)-l-[(S)-2-(дифенилфосфин)ферроценил]}этил- ди(3,5-диметил-4-N,N-дипeнтилaминoфeнил)фосфин;
{
(R)-l-[(S)-2-(дифенилфосфин)ферроценил]}этил-ди(3,5-диметил -4-N,N-диметиламинофенил) фосфин;
1,4-бис(дифенилфосфин)бутан или
{
(R)-l-[(S)-2-ди(4-метоксифенил)фосфин)ферроценил]}этил- ди(3,5-диметил-4-N,N-диметиламинофенил) фосфин.
Обычно хлорид, бромид или иодид аммония, хлорид, бромид или иодид металла, который растворим в реакционной смеси, используют в количестве от 0,01 до 200 мол.%, в пересчете на иридиевый катализатор, при этом как правило используемый хлорид, бромид или иодид металла представляет собой хлорид, бромид или иодид щелочного металла, в частности, хлорид, бромид или иодид аммония или щелочного металла представляет собой хлорид, бромид или иодид тетраалкиламмония, содержащий в алкильной группе от 1 до 6 углеродных атомов, или представляет собой хлорид, бромид или иодид натрия, лития или калия.
Используемая для гидрогенизации кислота представляет собой неорганическую или органическую кислоту. При этом как правило, кислоту используют в количестве от 0,001 до 50 вес.%, предпочтительно от 0,1 до 50 вес.%, в пересчете на имин.
Органической кислотой является алифатическая или ароматическая карбоновая кислота, сульфокислота или фосфорная (V) кислота.
В качестве органической кислоты можно использовать уксусную кислоту, пропионовую кислоту, трифторуксусную кислоту, хлоруксусную кислоту или метансульфокислоту, а в качестве неорганической кислоты H2SO4.
Величина молярного соотношения между имином и иридиевым катализатором предпочтительно составляет от 500000 до 20.
Давление водорода обычно составляет от 5 до 150 бар. Как правило, гидрогенизацию проводят в реакторе с циркуляцией. Причем альдимин или кетимин, полученные in situ, гидрогенизуют перед или во время гидрогенизации.
Данное изобретение относится также к способу получения амина
формулы

где R01, R02, R03 каждый независимо друг от друга обозначают C1-C4 алкил, а R04 обозначает C1-C4 алкил, C1-C4 алкоксиметил или C1-C4 алкоксиэтил, который заключается в том, что (1) проводят гидрогенизацию имина формулы

водородом в присутствии гомогенного иридиевого катализатора в среде инертного расворителя или без него и в присутствии кислоты и хлорида, бромида или иодида аммония или хлорида, бромида или иодида металла, который растворим в реакционной смеси, и (2) полученный при этом амин формулы

подвергают взаимодействию с соединением формулы
CICH1CO-Cl (VII)
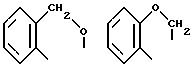
Предпочтительно используемый имин представляет собой соединение формулы


Пригодными иминами являются прежде всего такие, которые содержат по меньшей мере одну группу

Альдиминовые и кетиминовые группы обладают особой реакционноспособностью, благодаря чему применение способа в соответствии с изобретением дает возможность селективной гидрогенизации не только групп




Способ в соответствии с изобретением прежде всего пригоден для гидрогенизации альдиминов, кетиминов и гидразонов с получением соответствующих аминов и гидразинов, соответственно. Предпочтительными кетиминами являются N-замещенные кетимины. Предпочтительно использовать хиральные иридиевые катализаторы и гидрогенизации подвергать энантиомерно чистые хиральные или прохиральные кетимины, что позволяет получать оптические изомеры, причем выход оптического изомера (энантиомерный избыток или "эи") превышает, например, 30%, предпочтительно превышает 50%, а достигаемый выход составляет свыше 90%. Выход оптического изомера указывает на соотношение между двумя образующимися стереоизомерами, причем это соотношение может превышать, например, 2:1, а предпочтительно превышает 4:1.
Радикалы R1, R2 и R3 могут содержать один или несколько хиральных центров.
R1, R2 и R3 могут быть замещены в любом из желаемых положений одинаковыми или различными радикалами, например, 1-5, предпочтительно 1-3 заместителями.
Пригодными заместителями для R1, R2 и R3
являются:
C1-C12-, предпочтительно C1-C6- и особенно предпочтительно C1-C4-алкил, -алкокси- или - алкилтиогруппа, например,
метил, этил, пропил, н-, изо- и трет- бутил, изомеры пентила, гексила, октила, нонила, децила, ундецила и додецила, а также соответствующие алкокси- и алкилтиорадикалы:
C1-C6-, предпочтительно C1-C4-галоидалкил, содержащий в качестве галогена предпочтительно атомы F и Cl, например, трифтор- или трихлорметил, дифторхлорметил, фтордихлорметил, 1,
1-дифторэт-1-ил, 1,1- дихлорэт-1-ил, 1,1,1-трихлор- или 1,1,1-трифторэт-2-ил, пентахлорэтил, пентафторэтил, 1,1,1-трифтор-2,2-дихлорэтил, н- перфторпропил, изо-перфторпропил, н-перфторбутил, фтор- или
хлорметил, дифтор- или дихлорметил, 1-фтор- или 1-хлорэт-2-ил или -эт-1-ил, 1-, 2- или 3-фтор-, или 1-, 2- или 3-хлорпроп-1-ил или - проп-2-ил или -проп-3-ил, 1-фтор- или 1-хлорбут-1-ил, -бут-2-ил
- бут-3-ил или -бут-4-ил, 2,3-дихлорпроп-1-ил, 1-хлор-2-фторпроп-3- ил, 2,3-дихлорбут-1-ил;
C6-C12-арил, -арилокси или -арилтиогруппа, в которой арил представляет собой
предпочтительно нафтил и прежде всего фенил, C7-C16-аралкил, -аралкокси и -аралкилтиогруппа, в которой ариловый радикал представляет собой предпочтительно нафтил и прежде всего
фенил, а алкиленовый радикал является линейным или разветвленным и содержит от 1 до 10, предпочтительно от 1 до 6 и прежде всего от 1 до 3 углеродных атомов, например, бензил, нафтилметил, 1-,
2-фенилэт-1-ил или -эт-2-ил, 1-, 2-или 3-фенилпроп-1-ил, -проп-2-ил или -проп-3-ил, причем особенно предпочтителен бензил; радикалы, содержащие арильные группы, упомянутые выше, могут быть в свою
очередь моно- или полизамещенными, например, C1-C4-алкилом, -алкокси или - алкилтиогруппой, галогеном, -ОН, -CONR4R5 или -COOR5, где значения
R4 и R5 определены выше; примерами являются метил, этил, н- и изопропил, бутил, соответствующие алкокси- и алкилтиорадикалы, атомы F, Cl, Br, диметил-, метил-, этил- и
диэтилкарбамоил, а также метокси-, этокси-, фенокси- и бензилоксикарбонил;
галоген, предпочтительно F и Cl;
вторичный амин, содержащий от 2 до 24, предпочтительно от 2 до 12 и прежде
всего от 2 до 6, углеродных атомов, причем вторичный амин предпочтительно содержит 2 алкильные группы, например, диметил-, метилэтил-, диэтил-, метилпропил-, метил-н-бутил, ди-н-пропил-, ди-н-бутил-,
ди-н-гексиламин; -CONR4R5, где R4 и R5 каждый независимо друг от друга обозначает C1-C12-, предпочтительно C1-C6
- и прежде всего C1-C4-алкил, или R4 и R5 вместе обозначают тетра- или пентаметилен или 3-оксапентилен, причем алкил является линейным или разветвленным,
например, диметил-, метилэтил-, диэтил-, метил-н-пропил-, этил-н-пропил-, ди-н-пропил-, метил-н-бутил-, этил-н-бутил-, н-пропил-, н-бутил- и ди-н-бутил-карбамоилом;
-COOR4, где
R4 обозначает C1-C12, предпочтительно C1-С6-алкил, который может быть линейным или разветвленным, например метилом, этилом, н- и изопропилом, н-,
изо- и трет- бутилом, а также изомеры пентила, гексила, гептила, октила, нонила, децила, ундецила и додецила.
R1, R2 и R3 могут, в частности, включать в себя такие функциональные группы, как кетогруппы, -CN, -NO2, двойные углерод-углеродные связи, N-O-, ароматические галогенсодержащие группы и амидные группы.
R1 и R2 в качестве гетероарила предпочтительно представляют собой 5-или 6-членное кольцо, включающее в себя 1 или 2 одинаковых или различных гетероатома, прежде всего О, S или N, которое содержит предпочтительно 4 или 5 углеродных атомов и может быть сконденсировано с бензолом. Примерами гетероароматических радикалов, входящих в значение радикала R1 может быть фуран, пиррол, тиофен, пиридин, пиримидин, индол и хинолин.
R1 и R2 в качестве гетероарилзамещенного алкила предпочтительно означают производное 5- или 6-членного кольца, включающего в себя 1 или 2 одинаковых или различных гетероатома, прежде всего О, S или N, которое содержит предпочтительно 4 или 5 углеродных атомов и может быть сконденсировано с бензолом. Примерами гетероароматических соединений являются фуран, пиррол, тиофен, пиридин, пиримидин, индол и хинолин.
R1 и R2 в качестве гетероциклоалкила или гетероциклоалкилзамещенного алкила содержит предпочтительно от 4 до 6 атомов в цикле и 1 или 2 одинаковых или различных гетероатома из группы О, S и NR6 и может быть сконденсирован с бензолом и представляет собой производное, например пирролидина, тетрагидрофурана, тетрагидротиофена, индана, пиразолидина, оксазолидина, пиперидина, пиперазина или морфолина.
R1, R2 и R3 в качестве алкила представляют собой предпочтительно незамещенный или замещенный C1-C6-, прежде всего C1-C4-алкил, который может быть линейным или разветвленным. Примерами являются метил, этил, изо- и н-пропил, изо-, н- и трет-бутил, изомеры пентила, гексила, гептила, октила, нонила, децила, ундецила и додецила.
R1, R2 и R3 в качестве незамещенного или замещенного циклоалкила содержит предпочтительно от 3 до 6, прежде всего 5 или 6, кольцевых углеродных атомов в кольце. Примерами являются циклопропил, циклобутил, пиклопентил, циклогексил, циклогептил и циклооктил.
R1, R2 и R3 в качестве арила представляют собой предпочтительно незамещенный или замещенный нафтил и прежде всего фенил. R1, R2 и R3 в качестве аралкила представляют собой предпочтительно незамещенный или замещенный фенилалкил, содержащий в алкилене от 1 до 10, предпочтительно от 1 до 6 и прежде всего от 1 до 4 углеродных атомов, причем этот алкилен может быть линейным или разветвленным. Примерами являются прежде всего бензил, 1-фенилэт-1-ил. 2-фенилэт-1-ил, 1-фенилпроп- 1-ил, 1-фенилпроп-2-ил, 1-фенилпроп-3-ил, 2-фенилпроп-1-ил. 2- фенилпроп-2-ил и 1-фенилбут-4-ил.
В радикалах R2 и R3, представляющих собой -CONR4R5 и -COOR4, R4 и R5 представляют собой предпочтительно C1-C6-, прежде всего C1-C4-алкил, или R4 и R5 вместе являются тетраметиленом, пентаметиленом или 3-оксапентиленом. Примеры алкила приведены выше.
R1 и R2 вместе или R1 и R3 вместе означают алкилен, который может быть прерван одним -О-, -S- или -NR6-, предпочтительно
-О-. Либо, если R1 и R2 вместе или R1 и R3 вместе образуют с углеродным атомом или группой -N=C, с которыми они связаны, соответственно предпочтительно
5- или 6-членное кольцо, то в качестве заместителей они могут иметь вышеприведенные предпочтительные значения. В качестве сконденсированного алкилена R1 и R2 вместе или R1 и R3 вместе обозначают предпочтительно алкилен, сконденсированный с бензолом или пиридином. Примерами алкилена являются: этилен, 1,2- или 1,3-пропилен, 1,2-, 1,3- или 1,4-бутилен, 1,
5-пентилен и 1,6-гексилен. Примерами прерванного или =O-замещенного алкилена являются 2-окса-1,3-пропилен, 2-окса-1,4-бутилен, 2-окса- или 3- окса-1,5-пентилен, 3-тиа-1,5-пентилен, 2-тиа-1,4-бутилен,
2-тиа-1,3-пропилен, 2-метилими-но-1,3-пропилен, 2-этилимино-1,4-бутилен, 2- или 3-метилимино-1,5-пенти-лен, 1-оксо-2-окса-1,3-пропилен, 1-оксо-2-окса-1,4-бутилен, 2-оксо-3-окса-1,4-бутилен,
1-окса-2- оксо-1,5-пентилен. Примерами сконденсированного алкилена являются


Примерами сконденсированного и прерванного и незамещенного и =O- замещенного алкилена являются

R4 и R5 каждый независимо друг от друга предпочтительно обозначает водород, C1-C4 алкил, фенил или бензил. R6 предпочтительно обозначает водород или C1-C4
Предпочтительный класс соединений составляют прохиральные имины, в которых в формуле I каждый из R1, R2 и R3 отличен от другого и не обозначает водород.
В особенно предпочтительном классе соединений формулы I R3 обозначает 2,6-ди-C1-C4 алкилфен-1-ил и прежде всего 2, 6-диметилфен-1-ил или 2-метил-6-этилфен-1- ил, R1 обозначает C1-C4 алкил и прежде всего этил или метил, a R2 обозначает C1-C4 алкил, C1-C4 алоксиметил или C1-C4 алкоксиэтил и прежде всего метоксиметил.
Из этих соединений особо важное значение имеют имины формул


равно как и имин формулы

Имины формулы I известны или их можно получить в соответствии с известными способами из альдегидов или кетонов и первичных аминов.
Предпочтительные иридиевые катализаторы представляют собой гомогенные катализаторы, которые практически полностью
растворимы в реакционной среде. Термин "катализатор" включает в себя также каталитические предшественники, которые в начале гидрогенизации подвергают конверсии в активные каталитические формы.
Предпочтительные катализаторы соответствуют формулам III, IIIa, IIIb, IIIc и IIId,
[XlrYZ] (III),
[XIrY]⊕A⊖ (IIIa),
[XIrZ4
]⊖M⊕ (IIIb),
[YIrHZ2]2 (IIIc),
[YlrZ3]2 (IIId),
где X обозначает два олефиновых лиганда или
диеновый лиганд, Y обозначает дифосфин, имеющий вторичные фосфиновые группы
(а) фосфиновые группы которого связаны с различными углеродными атомами углеродной цепи, содержащей от 2 до 4
углеродных атомов, или
(б) фосфиновые группы которого в орто-положениях циклопентадиенильного кольца присоединены либо напрямую, либо посредством мостиковой группы -CRaRb
-, или каждая из групп связана с циклопентадиенильным кольцом ферроценила, или
(в) одна фосфиновая группа которого связана с углеродной цепью, содержащей 2 или 3 углеродных атомов, а другая
фосфиновая группа которого связана с кислородным атомом или азотным атомом, присоединенным к концу этой углеродной цепи, или
(г) фосфиновые группы которого связаны с двумя кислородными
атомами или азотными атомами, присоединенными к концу С2-углеродной цепи; при этом в случаях (а), (б), (в) и (г) образуют 5-, 6- или 7-членные кольца совместно с атомом Ir, радикалы Z
каждый независимо друг от друга (других) обозначает Cl, Br или I, A⊖ обозначает анион окси- или комплексной кислоты, а M⊕ обозначает катион щелочного металла или
четвертичного аммония и Ra и Rb каждый независимо друг от друга обозначают водород, C1-C8 алкил, C1-C4 фторалкил, фенил либо бензил
или обозначают фенил или бензил, содержащие от 1 до 3 C1-C4 алкиловых или C1-C4 алкоксильных заместителей. Rb предпочтительно обозначает водород.
Ra предпочтительно обозначает C1-C4 алкил и прежде всего метил.
Дифосфин Y содержит предпочтительно по меньшей мере один хиральный углеродный атом и представляет собой прежде всего оптически чистый стереоизомер (энантиомер или диастереоизомер) или пару диастереоизомеров, поскольку применение катализаторов, содержащих такие лиганды, приводит к оптическому превращению в реакциях асимметричной гидрогенизации.
X в качестве олефинового лиганда может обозначать разветвленный или предпочтительно линейный C2-C12 алкилен, прежде всего C2-C6 алкилен. Некоторыми примерами являются додецилен, децилен, октилен, 1-, 2- или 3-гексен, 1-, 2- или 3-пентен, 1- или 2-бутен, пропен и этен. X в качестве диенового лиганда может обозначать диен с открытой цепью или циклический диен, содержащий от 4 до 12, предпочтительно от 5 до 8 углеродных атомов, причем диеновые группы предпочтительно разделены одной или двумя насыщенными углеводородными группами. Примерами таких групп являются бутадиен, пентадиен, гексадиен, гептадиен, октадиен, декадиен, додекадиен, циклопентадиен, циклогексадиен, циклогептадиен, циклооктадиен и связанные мостиками циклодиены, такие как норборнадиен и бицикло-2,2,2-октадиен. Предпочтительны гексадиен, циклооктадиен и норборнадиен.
Фосфиновые
группы содержат предпочтительно два одинаковых или различных, предпочтительно одинаковых, незамещенных или замещенных углеводородных радикала, содержащих от 1 до 20, прежде всего от 1 до 12 углеродных
атомов. Предпочтительными являются дифосфины, в которых вторичные фосфиновые группы содержат два одинаковых или различных радикала из следующего класса, включающего: линейный или разветвленный C1-C12 алкил; незамещенный или C1-C6 алкил - либо C1-C6 алкоксизамещенный C5-C12 циклоалкил, C5-C12циклоалкил-CH2-, фенил и бензил; а также фенил и бензил, замещенные галогеном (например, F, Cl или Br), C1-C6 галоидалкилом, (C1-C12
алкил)3, (C6H5)3Si, C1-C6 галоидалкоксигруппой (например, трифторметоксигруппой), -NH2, фенил2N-, бензил2N-, морфолинилом, пиперидинилом, пирролидинилом, (C1-C12 алкил)2N-, аммоний -X
Вторичная
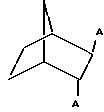
фосфиновая группа может также представлять собой радикал формулы

где m и n каждый независимо друг от друга обозначают целое число от 2 до 10, а сумма m+n составляет от 4 до 12, прежде всего от 5 до 8. Их примерами являются [3.3.1]- и [4.2.1]-фобилы формул

Примерами алкила, который содержит предпочтительно от 1 до 6 углеродных атомов, являются метил, этил, н-пропил, изопропил, н-, изо- и трет-бутил, а также изомеры пентила и гексила. Примерами незамещенного или алкилзамещенного циклоалкила являются циклопентил, циклогексил, метил- либо этилциклогексил и диметилциклогексил. Примерами алкил-, алкокси- и галоидалкоксизамещенного фенила и бензила являются метилфенил, диметилфенил, триметилфенил, этилфенил, метилбензил, метоксифенил, диметоксифенил, трифторметилфенил, бис-трифторметилфенил, трис- трифторметилфенил, трифторметоксифенил и бис- трифторметоксифенил. Предпочтительными фосфиновыми группами являются такие, которые содержат одинаковые или различные, предпочтительно одинаковые, радикалы, выбранные из класса C1-C6 алкила; циклопентил и циклогексил, которые незамещены или содержат от 1 до 3 C1-C4 или C1-C4 алкокризаместителей, бензил и прежде всего фенил, который незамещен или содержит от 1 до 3 C1-C4 алкильных, C1-C4 алкоксильных заместителей, F, Cl, C1-C4 фторалкильных или C1- C4 фторалкоксильных заместителей.
Y в качестве дифосфина предпочтительно соответствует
формуле IV, IVa, IVb, IVc или IVd
R7R8P-R9-PR10R11 (IV)
R7R8P-O-R12-PR10R11 (IVa)
R7R8P-NRc-R12-PR10R11 (IVb)
R7R8P-О-R13-O-РR10R11. (IVc)
R7R8P-NRc-R13-NRc -PR10R11 (IVd)
где
R7, R8, R10
и R11 каждый независимо друг от друга обозначают углеводородный радикал, содержащий от 1 до 20 углеродных атомов, который незамещен или замещен C1-C6 алкилом, C1-C6 алкоксигруппой, галогеном, C1-C6 галоидалкилом, (C1-C12 алкил)3Si, (C6H5)3Si, C1
-C6 галоидалкоксигруппой, -NH2, фенил2М-, бензил2М-, морфолинилом, пиперидинилом, пирролидинилом, (C1-C12алкил)2-N,
-аммоний- -X
R9 обозначает линейный C2-C4алкилен, который незамещен или замещен C1-C6 алкилом, C5- или C6-циклоалкилом, фенилом, нафтилом или бензилом; 1,2- или 1,3-циклоалкилен или -циклоалкенилен, - бициклоалкилен или -бициклоалкенилен, содержащие от 4
до 10 углеродных атомов, каждый из которых незамещен или замещен C1-C6 алкилом, фенилом или бензилом; 1,2-или 1,3-циклоалкилен или - циклоалкенилен, -дициклоалкилен или
-дициклоалкенилен, содержащий от 4 до 10 углеродных атомов, каждый из которых незамещен или замещен C1-C6 алкилом, фенилом или бензилом и в 1-м и/или 2-м положениях или в 3-м
положении которого присоединен метилен или C2-C4 алкилиден, как связь; 1,4-бутилен, замещенный во 2,3- положениях радикалом
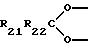
и незамещенный или замещенный в 1,4-положениях C1-C6 алкилом, фенилом или бензилом, где R21 и R22 каждый независимо друг от друга обозначают водород, С1-С6 алкил, фенил или бензил; 3,4- или 2,4-пирролидинилен или 2-метиленпирролидин-4-ил, азотный атом которого замещен водородом, C1-C12 алкилом, фенилом, бензилом, C1-C12 алкоксикарбонилом, C1-C8 ацилом или C1-C12 алкиламинокарбонилом; или 1,2-фенилен, 2-бензилен, 1,2- ксилилен, 1,8-нафтилен, 2,2'-динафтилен либо 2,2'-дифенилен, каждый из которых незамещен или замещен C1-C4 алкилом; или R9 обозначает радикал формулы






где R14 обозначает водород, C1-C8 алкил, C1-C4 фторалкил, фенил или фенил, содержащий от 1 до 3 C1-C4 алкильных или C1-C4 алкоксизаместителей;
R12 обозначает линейный C2- или C3- алкилен, который незамещен или замещен C1-C6 алкилом, C5- или C6-циклоалкилом, фенилом, нафтилом или бензилом; 1,2- или 1,3- циклоалкилен или -циклоалкенилен, -бициклоалкилен или
-бициклоалкенилен, содержащие от 4 до 10 углеродных атомов, каждый из которых незамещен или замещен C1-C6 алкилом, фенилом или бензилом; или 1,2- или 1,3-циклоалкилен или -циклоалкенилен, -бициклоалкилен или -бициклоалкенилен, содержащие от 4 до 10 углеродных атомов, каждый из которых незамещен или замещен C1-C6 алкилом, фенилом или бензилом и в 1-м и/или 2-м положениях или в 3-м положении которого присоединен метилен или C2-C4 алкилиден; как связь 3,4- или 2,4-пирролидинилен или 3-метиленпирролидин-4-ил, азотный атом которого замещен водородом, C1-C12 алкилом, фенилом, бензилом, C1 -C12 алкоксикарбонилом, C1-C8 ацилом или C1-C12 алкиламинокарбонилом; или 1,2-фенилен, 2-бензилен, 1,2-, 2,3- либо 1,8-нафтилен, каждый из которых незамещен или замещен C1-C4 алкилом;
R13 обозначает линейный C2 алкилен, который незамещен или замещен C1-C6 алкилом, C5- или C6-циклоалкилом, фенилом, нафтилом или бензилом; 1,2-циклоалкилен или -циклоалкенилен, -бициклоалкилен или -бициклоалкенилен, содержащие от 4 до 10 углеродных атомов, каждый из которых незамещен или замещен C1-C6 алкилом, фенилом или бензилом; 3,4-пирролидинилен, азотный атом которого замещен водородом, C1-C12 алкилом, фенилом, бензилом, C1-C12 алкоксикарбонилом, C1-C8 ацилом или C1-C12 алкиламинокарбонилом; или 1,2-фенилен, который незамещен или замещен C1-C4 алкилом, или обозначает радикал с менее, чем двумя гидроксильными группами в орто-положениях по отношению к моно- или дисахариду; и
Rc обозначает водород, C1-C4 алкил, фенил или бензил.
R7, R8, R10 и R11 обозначают предпочтительно одинаковые или различные, предпочтительно одинаковые, радикалы из следующего класса: C1-C6 алкил; циклопентил и циклогексил, которые незамещены или содержат от 1 до 3 C1-C4 алкильных или C1-C4алкоксильных заместителей, бензил и прежде всего фенил, который незамещен или содержит от 1 до 3 C1-C4 алкильных, C1-C4 алкоксильных заместителей, F, Cl, C1-C4 фторалкильных или C1-C4 фторалкоксильных заместителей.
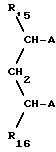
Предпочтительный подкласс дифосфинов
Y составляют такие, которые отвечают формулам













где
R15 и R16 каждый независимо друг от друга обозначают водород, C1-C4 алкил, фенил, бензил или фенил либо бензил, содержащие от 1 до 3 C1-C4 алкильных или C1-C4 алкоксильных заместителей,
R14 обозначает водород, C1-C4 алкил, фенил, бензил или фенил либо бензил, содержащие от 1 до 3 C1-C4 алкильных или C1-C4 алкоксильных заместителей,
R17 обозначает водород, C1-C4 алкил, фенил, бензил, C1-C6 алкокси-CO-, C1-C6 алкил-CO-, фенил-CO-, нафтил-CO- или C1 -C4 алкил NH-CO-,
А может обозначать одинаковые или различные группы -PR2, где R обозначает C1-C6 алкил, циклогексил, фенил, бензил или фенил либо бензил, содержащие от 1 до 3 C1-C4 алкильных, C1-C4 алкоксильных заместителей, -CF3 или частично или полностью фторированных C1-C4 алкоксильных заместителей, и n обозначает 0,1 или 2.
Из этих дифосфинов особенно предпочтительны хирально замещенные соединения.
Некоторыми предпочтительными
примерами дифосфинов Y являются следующие (Ph обозначает фенил):


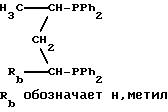




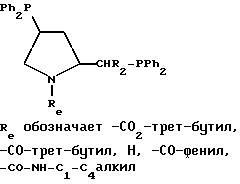

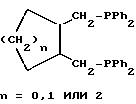


Приемлемые дифосфины и дифосфиниты описаны, например, у H.B.Kagan в Chiral Ligands for Asymmetric Catalysis, Asymmetric Synthesis, т. 5, стр. 13-23, Academic Press, Inc., N.Y. (1985). Получение ферроценилдифосфиновых лигандов описано, например, в заявке на Европейский патент 0564406 и в статье T.Hayashi и др. в Bull. Chem.Soc.Jpn., 53, стр. 1136-1151.
A⊖, в формуле IIIa может быть производным неорганических или органических оксикислот. Примерами таких кислот являются H2
SO4, HClO4, НСlO3, HBrO4 НIO4 HN03, Н3РО4, CF3SO3H, C6H5SO3H, CF3COOH и CCl3COOH. Комплексными кислотами, производным которых может быть A⊖ являются, например, галоидсодержащие комплексные кислоты элементов В, Р,
As, Sb и Bi. Предпочтительными примерами, A⊖ в формуле IIIa являются ClO
В том случае, когда в формуле IIIb M⊕ обозначает катион щелочного металла, он может представлять собой, например, катион Li, Na, К, Rb или
Cs. В том случае, когда M⊕ обозначает четвертичный аммоний, он может содержать в общей сложности от 4 до 40, предпочтительно от 4 до 24 углеродных атомов. M⊕ может
соответствовать формуле фенил-

Z в формуле III обозначает предпочтительно Br или Cl и прежде всего С1. В формуле IIb Z предпочтительно обозначает Br или 1, а в формулах IIIc и IIId Z предпочтительно обозначает 1.
Особенно пригодные дифосфиновые лиганды, которые предпочтительно могут
быть использованы в составе катализаторов формулы (III), представляют собой, например,
{ (R)-l-[(S)-2-(дифенилфосфин)ферроценил] } этил-ди(3,5-диметил -4-N,N-дипропиламинофенил)фосфин;
{ (R)-l-[(S)-2-(дифенилфосфин)ферроценил])этил-ди(3,5 -диизопропил -4-N, N-диметиламинофенил)фосфин;
{ (R)-1-[(S)-2-(дифенилфосфин)ферроценил] }этил-ди(3,5- диизопропил-4-N,
N-дибeнзилилaминoфeнил)фocфин;
{ (R)-l-[(S)-2-(дифенилфосфин)ферроценил] } этил-ди(3,5- диметил-4-N,N-дибензилиламинофенил)фосфин;
{ (R)-l-[(S)-2-(дифенилфосфин)ферроценил] }
этил-ди(3,5- диметил-4-(1'-пиррол)фенил)фосфин;
{ (R)-l-[(S)-2-(дифенилфосфин)ферроценил] } этил-ди(3,5- диметил-4-N,N-дипeнтилaминoфeнил)фосфин;
{
(R)-1-[(S)-2-(дифенилфосфин)ферроценил]} этил-ди (3,5- диметил-4-N,N-диметиламинофенил)фосфин;
1,4-бис(дифенилфосфин)бутан;
{ (R)-l-[(S)-2-ди(4-метоксифенил)фосфин)ферроценил] }
этил-ди (3,5-диметил-4-N,N-диметиламинофенил)фосфин и предпочтительно
{ (R)-l-[(S)-2-(дифенилфосфин)ферроценил] } этил-ди(3,5-диметил- фенил)фосфин.
Получение катализаторов как таковое известно и описано, например, в патентах США 4994615, 5011995, 5112999 и в EP A 0564406. Получение катализаторов формулы III можно осуществлять, например, реакцией дииридиевого комплекса формулы [lrXZ]2 с дифосфином Y. Иридиевые катализаторы можно добавлять в реакционную смесь в виде выделенных соединений. Однако предпочтительно получать катализатор in situ в растворителе или без него до реакции и добавлять при определенных условиях порциями или полностью кислоту и галогенид аммония или щелочного металла.
Иридиевые катализаторы предпочтительно использовать в количествах от 0,0001 до 10 мол.%, прежде всего от 0,001 до 10 мол.% и более предпочтительно от 0,01 до 5 мол.%, в пересчете на имин.
Величина молярного соотношения между имином и иридиевым катализатором может составлять, например, от 5000000 до 10, прежде всего от 2000000 до 20, более предпочтительно от 1000000 до 20 и наиболее предпочтительно от 500000 до 100.
Процесс предпочтительно проводить при температурах от -20 до 100oC, прежде всего от 0 до 80oC и предпочтительно от 10 до 70oC и предпочтительно под избыточным давлением водорода от 2•105 до 1,5•107 Па (от 5 до 150 бар), прежде всего от 106 до 107 Па (от 10 до 100 бар).
Вводимые хлориды, бромиды и иодиды предпочтительно использовать в концентрациях от 0,01 до 500 ммолей/л, прежде всего от 0,01 до 50 ммолей/л, в пересчете на объем реакционной смеси.
Способ в соответствии с изобретением включает в себя использование хлорида, бромида или иодида аммония либо металла. Хлориды, бромиды и иодиды предпочтительно применять в количествах от 0,01 до 200 мол.%, прежде всего от 0,05 до 100 мол.% и более предпочтительно от 0,5 до 50 мол.%, в пересчете на иридиевый катализатор. Иодиды предпочтительны. Предпочтительно применять тетраалкиламмоний, содержащий в каждой из алкильных групп от 1 до 6 углеродных атомов, а предпочтительным металлом является натрий, литий или калий. Особенно предпочтительны тетрабутиламмонийиодид и натрий.
При условии, что они растворимы в реакционной смеси, и при условии, что могут быть исключены реакции окисления с участием других реагентов, в способе в соответствии с изобретением можно использовать фактически любые хлориды, бромиды и иодиды металлов, т.е. тех, что относятся к основным группам и подгруппам Периодической таблицы элементов.
Реакцию можно проводить с использованием растворителей или без них. Пригодными растворителями, которые можно применять индивидуально или в виде смеси растворителей, предпочтительно являются апротонные растворители. Примерами являются алифатические и ароматические углеводороды, такие как пентан, гексан, циклогексан, метилциклогексан, бензол, толуол и ксилол; простые эфиры, такие как диэтиловый эфир, диэтиленгликольдиметиловый эфир, тетрагидрофуран и диоксан; галоидированные углеводороды, такие как хлористый метилен, хлороформ, 1,1,2,2-тетрахлорэтан и хлорбензол; сложные эфиры и лактоны, такие как этилацетат, бутиролактон и валеролактон; амиды и лактамы кислот, такие как диметилформамид, диметилацетамид и N-метилпирролидон, и кетоны, такие как ацетон, дибутилкетон, метилизобутил-кетон и метоксиацетон.
Способ в соответствии с изобретением включает в себя использование кислоты. Ею может быть неорганическая или предпочтительно органическая кислота. Кислоту предпочтительно использовать по меньшей мере в том же молярном количестве, что и иридиевый катализатор (эквивалентно каталитическим количествам), но ее можно также использовать и в избытке. Этот избыток используемой кислоты может даже служить в качестве растворителя. Предпочтительно применять от 0,001 до 50 вес.%, в частности, от 0,1 до 50 вес.% кислоты, в пересчете на амин. Во многих случаях может оказаться целесообразным использование безводных кислот.
Некоторыми примерами минеральных кислот являются Н2SO4, высококонцентрированная серная кислота (олеум), Н3РО4, ортофосфорная кислота, HF, HCl, HBr, HI, НClO4, HBF4, HPF6, HAsF6 HSbCl6, HSbF6 и HB(фенил)4. Особенно предпочтительна H2SO4.
Примерами органических кислот являются алифатические и ароматические, необязательно галоидированные (фторированные или хлорированные) карбоновые кислоты, сульфокислоты, фосфорные (V) кислоты (например, фосфоновые кислоты, фосфонистые кислоты), содержащие предпочтительно от 1 до 20, прежде всего от 1 до 12 и более предпочтительно от 1 до 6 углеродных атомов. Примерами являются муравьиная кислота, уксусная кислота, пропионовая кислота, масляная кислота, бензойная кислота, фенилуксусная кислота, циклогексанкарбоновая кислота, хлор- и фторуксусная кислота, дихлор- и дифторуксусная кислота, трихлор- или трифторуксусная кислота, хлорбензойная кислота, метансульфокислота, этансульфокислота, бензолсульфокислота, п-толуолсульфокислота, хлорбензолсульфокислота, трифторметансульфокислота, метилфосфоновая кислота и фенилфосфоновая кислота. Предпочтительными кислотами являются уксусная кислота, пропионовая кислота, трифторуксусная кислота, метансульфокислота и хлоруксусная кислота.
В качестве кислот можно также применять кислые ионообменники неорганической или органической природы.
Более конкретно способ в соответствии с изобретением можно осуществлять сначала приготовлением катализатора путем растворения, например, (Ir-диенCl)2 в растворителе или кислоте, или в их смеси, добавленияем дифосфина и затем галогенида щелочного металла или аммония и перемешивания смеси. (Ir-диенCl)2 можно также использовать в твердом виде. Раствор иминов добавляют в этот каталитический раствор (или наоборот) и создают в автоклаве избыточное давление водорода, удаляя таким путем атмосферу защитного газа, использование которого предпочтительно. Предпочтительно обеспечить возможность лишь кратковременного простоя каталитического раствора, и реакцию гидрогенизации иминов следует начинать как можно быстрее после приготовления катализатора. При необходимости, реакционную смесь подогревают и затем проводят гидрогенизацию. Там, где это необходимо, после прекращения реакции реакционную смесь охлаждают и в автоклаве сбрасывают избыточное давление. Реакционную смесь можно удалять из автоклава под давлением азота, а гидрогенизированное органическое соединение можно выделять и очищать известными методами, например, осаждением, экстракцией или перегонкой.
При гидрогенизации альмидинов и кетиминов эти альдимины и кетимины можно также получать in situ перед или во время гидрогенизации. В предпочтительном варианте амин и альдегид или кетон смешивают между собой и добавляют в каталитический раствор и полученный in situ альдимин или кетимин гидрогенизуют. Однако амин, кетон или альдегид можно также использовать совместно с катализатором как исходную смесь и добавлять в нее кетон, альдегид или амин либо сразу полностью, либо дозированными порциями.
Гидрогенизацию можно проводить непрерывно или по периодическому принципу в реакторах различных типов. Предпочтительны те реакторы, которые позволяют относительно хорошо перемешивать содержимое и хорошо отводить тепло, например, такие, как реакторы с циркуляцией. Реакторы такого типа доказали свою особую эффективность при использовании небольших количеств катализатора.
Способ согласно изобретению позволяет получать соответствующие амины проведением кратковременной реакции с одновременным достижением высокой степени химической конверсии, причем неожиданно хороший выход оптического изомера (эи), равный 70% или более, достигается также при относительно высоких температурах, превышающих 50oC, и даже при высоком молярном соотношении между имином и катализатором.
Гидрогенизованные органические соединения, которые могут быть получены в соответствии с изобретением, например, амины, представляют собой биологически активные вещества или промежуточные продукты для получения таких веществ, прежде всего при приготовлении фармацевтических и агрохимических препаратов. Так, например, производные o.o-диалкиларилкет-аминов, прежде всего такие, которые содержат алкильные и/или алкоксиалкильные группы, являются эффективными фунгицидами, прежде всего гербицидами. Такими производными могут быть аминовые соли, амиды кислот, например хлоруксусной кислоты, третичные амины и аммониевые соли (см., например, описания к заявкам на Европейские патенты 0077755 и 0115470).
С учетом этого, объектом изобретения является способ получения аминов
общей формулы VI, среди которых особенно важное значение имеют оптически активные амины формулы

которые могут быть получены из иминов формулы (V) с использованием способа в соответствии с изобретением, где R01, R02 и R03 каждый независимо друг от друга обозначает C1-C4 алкил, a R04 обозначает C1-C4 алкил, C1-C4 алкоксиметил или C1-C4 алкоксиэтил. Прежде всего амины формул


могут быть получены из иминов формул (Va) и (Vb) взаимодействием с использованием хлоруксусной кислоты с получением желаемых гербицидов хлорацетанилидного типа в соответствии с методами, обычными в данной области.
Сущность настоящего изобретения более подробно проиллюстрирована с помощью нижеследующих примеров. Химическую конверсию определяют газовой хроматографией [колонка DB 17/30 W (15 м), производитель JCW Scientific Inc., США, температурная программа от 60oC/1 мин до 220oC, ΔT: 10o• мин-1]. Выход оптического изомера (энантиомерный избыток, эи) определяют либо газовой хроматографией [колонка Chirasil-Val, 50 м, производитель Alltech, США, T = 150oC, изотермическая] , жидкостной хроматографией высокого давления (ЖХВД) (колонка Chiracel OD) или1Н-ЯМР-спектроскопией (с использованием сдвиговых реактивов).
Пример 1.
Получение N-(2'-метил-6'-этилфен-1'-ил)-N- (1-метоксиметил)этиламина
17,2 мг (0,027 ммолей) {(R)-1-[(S)-2-дифенилфосфин) ферроценил]}этил-ди(3,5-диметилфенил)фосфина и 40 мг (0,108
ммолей)тетрабутиламмонийиодида последовательно добавляют в раствор из 8,8 мг (0,013 ммоля) [Ir(1,5- циклооктадиен)Cl]2 в 10 мл уксусной кислоты (дегазированной) и перемешивают в течение 15
мин. Отдельно в 70 мл уксусной кислоты (дегазированной) растворяют 412 г (2 моля) М-(2'-метил-6'- этилфен-1'-ил)-N-(1-метоксиметил)эт-1-илиденамина. Иминовый раствор и каталитический раствор
последовательно помещают в стальной автоклав объемом 1000 мл, в котором создана инертная атмосфера. За четыре цикла (10 бар, нормальное давление) инертный газ замещают водородом. Затем в автоклаве
создают давление водорода 80 бар и нагревают до 50oC. Через 18 ч реакцию прерывают и реакционный раствор охлаждают до комнатной температуры. Избыточное давление водорода сбрасывают и под
давлением удаляют из автоклава реакционный раствор. Конверсия составляет 100%. Добавляют 100 мл толуола и затем в роторном испарителе удаляют толуол и уксусную кислоту. Остаток перегоняют в глубоком
вакууме (0,1 мбар), получая 401 г (97%-ный выход) чистого N-(2'-метил- 6'-этилфен-1'-ил) -N-(1-метоксиметил)этиламина. Для определения чистоты энантиомера образец (2 г) очищают быстрой хроматографией
[силикагель: 0,040-0,063 мм, элюент: гексан/этилацетат в соотношении 10:1]. Выход оптического изомера равен 75,6% (S).
Пример 2. Получение
N-(2'-метил-6'-этилфен-1'-ил)-N- (1-метоксиметил) этиламина
10,4 мг (0,0155 ммоля) [Ir(1,5-циклооктадиен) Cl]2, 21,4 мг (0,0335 ммоля) { (R)-1-[(S)-2- (дифенилфосфин)ферроценил] }
этил-ди(3,5- диметилфенил)фосфина и 50 мг (0,136 ммоля) тетрабутиламмонийиодида растворяют в 2,5 мл дегазированной уксусной кислоты и перемешивают 15 мин. Отдельно в 9 г безводного метоксиацетона
растворяют 17 г (0,083 моля) 2- метил-6-этиланилина. Метоксиацетоновый раствор и каталитический раствор последовательно помещают в стальной автоклав объемом 50 мл, в котором создана инертная
атмосфера. За четыре цикла (10 бар, нормальное давление) инертный газ замещают водородом. Затем в автоклаве создают давление водорода 40 бар и нагревают до 50oC. По истечении 18 ч реакцию
прерывают и реакционный раствор охлаждают до комнатной температуры. Обработку осуществляют в соответствии с примером 1. Конверсия составляет 97% (в пересчете на 2-метил-6-этиланилин) и выход
оптического изомера равен 75,6% (S).
Пример 3. Получение N-(2'-метил-6'-этилфен-1'-ил)-N-(1- метоксиметил)этиламина
14,0 мг (0,032 ммоля) (2S,4S)-бис(дифенилфосфин)пентана
(БДФП), 70 мг (0,19 ммоля)тетрабутиламмонийиодида и 0,3 мл метансульфокислоты последовательно добавляют в раствор из 10,2 мг (0,015 ммоля) [Ir(1,5-циклооктадиен)Cl]2 в 3,5 мл толуола
(дегазированного) и перемешивают в течение 5 мин. Отдельно в 3,2 мл толуола (дегазированного) растворяют 3,12 г (15,2 ммоля) N-(2'-метил- 6'-этилфен-1'-ил)-N-(1-метоксиметил)эт-1-илиденамина. С
помощью стального капилляра иминовый раствор и каталитический раствор последовательно помещают в стальной автоклав объемом 50 мл, в котором создана инертная атмосфера. За четыре цикла (10 бар,
нормальное давление) инертный газ замещают водородом. Затем в автоклаве создают давление водорода 30 бар. По истечении 2,5 ч при 25oC реакцию прерывают. Обработку осуществляют в
соответствии с примером 1. Конверсия составляет 100%, а выход оптического изомера равен 53,5% (R).
Пример 4. Получение N-(2'-метил-6'-этилфен-1'-ил)-N- (1-метоксиметил) этиламина
Процесс проводят аналогично примеру 3, а реакционные условия изменяют следующим образом: 0,35 мл трифторуксусной кислоты (вместо метансульфо-кислоты). Продолжительность реакции составляет 2 ч,
конверсия равна 95%, а выход оптического изомера равен 52,6% (R).
Пример 5. Получение N-(2'-метил-6'-этилфен-1'-ил)-N-(1- метоксиметил) этиламина
Процесс проводят аналогично
примеру 3, а реакционные условия изменяют следующим образом: 0,4 г ортофосфорной кислоты (вместо метансульфокислоты) и 6,6 мл тетрагидрофурана в качестве растворителя. Продолжительность реакции
составляет 2,5 ч, конверсия равна 98%, а выход оптического изомера равен 53,4% (R).
Пример 6. Получение N-(2',4'-диметилтиофен-3'-ил)-N-(1- метоксиметил) этиламина
8,6 мг (0,
0125 ммоля) [Ir(1,5-циклооктадиен)Cl]2, 17,2 мг (0,0268 ммоля) { (R)-1-[(S)-2-(дифенилфосфин)ферроценил]}этил-ди (3,5-диметилфе-нил)фосфина (лиганд) и 30 мг (0,08 ммоля)
тетрабутиламмонийиодида последовательно помещают в колбу Шленка, в которой создана аргоновая атмосфера. В нее добавляют 1 г (5 ммолей) N-(2',4'-диметилтиофен-3'-ил)-N-(1-метоксиметил)этилиденамина, 5
мл толуола и 2 мл уксусной кислоты. С помощью стального капилляра этот раствор помещают в стальной автоклав объемом 50 мл, в котором создана атмосфера аргона. Далее создают давление водорода в 30 бар,
как описано в примере 1, после чего реакционный раствор перемешивают 20 мин при комнатной температуре. Реакцию прерывают, избыточное давление водорода сбрасывают и реакционный раствор удаляют под
давлением из автоклава. Конверсия составляет 100%. Растворитель (толуол) и кислоту (уксусная кислота) удаляют в роторном испарителе, получая 1,2 г маслянистого сырого продукта, который далее очищают
быстрой хроматографией (силикагель 0,040-0,063 мм, элюент: гексан/этилацетат (3:1)). Степень энантиомерной чистоты выделенного продукта составляет 76,1%.
Пример 7. Получение N-(2',
4'-диметилтиофен-3'-ил)-N-(1- метоксиметил)этиламина
Процесс проводят аналогично примеру 6, а реакционные условия изменяют следующим образом: лиганд: 12,3 мг (0,028 ммоля) (2S,
4S)-бис(дифенилфосфин)пентана, 55 мг (0,149 ммоля) тетрабутиламмонийиодида. Продолжительность реакции составляет 1,4 ч. Конверсия является полной, а эи равен 47,5%.
Пример 8. Получение
N-бензил-N-(1-фенилэтил)амина
Процесс проводят аналогично примеру 6, но реакционные условия изменяют следующим образом: 0,636 г (3 ммоля) N-бензил-N-(1-фенилэтилиден)амина, 10,2 мг (0,0152
ммоля) [Ir(1,5-циклооктадиен)Cl]2, 21,4 мг (0,0333 ммоля) {(R)-1-[(S)-2-(дифенилфосфин)ферроценил] } этил-ди(3,5- диметилфенил)фосфина (лиганд) и 15 мг (0,04 ммоля) тетрабутиламмоний иодида,
2 мл уксусной кислоты, 15 мл толуола, давление водорода 30 бар, реакционная температура 25oC. Продолжительность реакции составляет 20 мин. Конверсия является полной, эи равен 31%.
Пример 9. Получение N-(2'-метил-6'-этилфен-1'-ил)-N-(1- метоксиметил) этиламина
2,7 мг (0,004 ммоля) [Ir(1,5-циклооктадиен)Cl]2 и 5,8 мг (0,009 ммоля) {
(R)-l-[(S)-2-(дифенилфосфин)ферроценил] } этил-ди (3,5-диметилфе-нил)фосфина помещают в колбу Шленка и затем в этой колбе Шленка создают аргоновую атмосферу. Далее с помощью шприца добавляют 2 мл
дегазированного тетрагидрофурана и оранжевый раствор перемешивают 30 мин. В лабораторный автоклав объемом 1 л помещают 210 г (2 моля) высокочистого МЭА-имина (>99%) формулы (Vb), 300 мг (0,8
ммоля) тетрабутиламмонийиодида и 200 мл уксусной кислоты. Затем с помощью шприца добавляют 0,5 мл вышеописанного каталитического раствора. Величина соотношения имин/Ir составляет 1000000. Автоклав
закрывают и продувают вначале азотом, а затем водородом. После этого создают давление водорода 80 бар и реакционный раствор перемешивают 65 ч при температуре внутри реактора 50oC. После
завершения поглощения водорода избыточное давление водорода сбрасывают и затем анализируют реакционный раствор. Конверсия составляет 100%, а энантиоселективность равна 75% эи (S).
Примеры 10-22. Получение N-2'-(2'-метил-6'-этилфен-1'-ил)-N- (1-метоксиметил) этиламина
В примерах 10-22 процесс проводят аналогично примеру 6, но реакционные условия изменяют следующим
образом: 105 г (0,5 моля) N-(2'-метил-6'-этилфен-1'-ил-N-(1-метоксиметил)этилиденамина, 1,7 мг (0,0025 ммоля) [Ir(1,5- циклооктадиен)Cl]2, 3,8 мг (0,0059 ммоля) {
(R)-1-[(S)-2-(дифенил-фосфин)ферроценил] } этил-ди(3,5-диметилфенил) фосфина, 70 мг (0,189 ммоля) тетрабутиламмонийиодида, давление водорода 80 бар и 50oC.
Использованные кислоты и результаты соответствующих испытаний приведены в таблице.
Пример 23. Получение N-(2'-метил-6'-этилфен-1'-ил)-N- (1- метоксиметил)этиламина
Процесс проводят
аналогично примеру 13, но с использованием следующего лиганда: 4,3 мг (0,0059 ммоля) ((R)-1-[(S)-2- (дифенилфосфин)ферроценил]}-этил-ди (3,5-диметил-4-N,N- дипропиламинофенил)фосфина. Время реакции
составляет 3,5 ч, конверсия 100%, степень чистоты энантиомера 83% (S).
Пример 24. Получение N-(2'-метил-6'-этилфен-1'-ил)-N-(1- метоксиметил)этиламина
Процесс проводят
аналогично примеру 13, но с использованием следующего лиганда: 4,2 мг (0,0059 ммоля) {(R)-1-[(S)-2-(дифенилфосфин)ферроценил]}-этил-ди (3,5-диизопропил-4-N, N-диметиламинофенил)фосфина. Время реакции
составляет 24 ч, конверсия 98%, степень чистоты энантиомера 66% (S).
Пример 25. Получение N-(2'-метил-6'-этилфен-1'-ил)-N-( 1-метоксиметил) этиламина
Процесс проводят
аналогично примеру 13, но с использованием следующего лиганда: 5,0 мг (0,0059 ммоля) {(R)-1-[(S)-2-(дифенилфосфин)ферроценил]}-этил-ди(3,5-диизопропил- 4-N, N-бензилиламинофенил)фосфина. Время реакции
составляет 22 ч, конверсия 99,5%, степень чистоты энантиомера 63% (S).
Пример 26. Получение N-(2'-метил-6'-этилфен-1'-ил)-N-(1- метоксиметил)этиламина
Процесс проводят
аналогично примеру 13, но с использованием следующего лиганда: 4,8 мг (0,0059 ммоля) {(R)-1-[(S)-2-(дифенилфосфин)ферроценил]}-этил-ди(3,5-диметил-4-N, N-дибензилиламинофенил)фосфина. Время реакции
составляет 24 ч, конверсия 85%, степень чистоты энантиомера 76% (S).
Пример 27. Получение N-(2'-метил-6'-этилфен-1'-ил)-N- (1-метоксиметил)этиламина
Процесс проводят
аналогично примеру 13, но с использованием следующего лиганда: 4,1 мг (0,0059 ммоля) {(R)-1-[(S)-2-(дифенилфосфин)ферроценил]}-этил-ди(3,5-диметил-4- (1'-пирроло)фенил)фосфина. Время реакции
составляет 3 ч, конверсия 100%, степень чистоты энантиомера 69% (S).
Пример 28. Получение N-(2'-метил-6'-этилфен-1'-ил)-N-(1- метоксиметил)этиламина
Процесс проводят
аналогично примеру 13, но с использованием следующего лиганда: 4,6 мг (0,0059 ммоля) {(R)-1- [(S)-2-(дифенилфосфин)ферроценил]}-этил-ди(3,5-диметил-4-N,N -дипентиламинофенил)фосфина. Время реакции
составляет 21 ч, конверсия 90%, степень чистоты энантиомера 82,5% (S).
Пример 29. Получение N-(2'-метил-6'-этилфен-1'-ил)-N-(1 - метоксиметил)этиламина
Процесс проводят
аналогично примеру 13, но с использованием следующего лиганда: 4,0 мг (0,0059 ммоля) {(R)-1- [(S)-2-(дифенилфосфин)ферроценил]}-этил-ди(3,5-диметил-4-N,N- диметиламинофенил)фосфина. Время реакции
составляет 1 ч, конверсия 100%, степень чистоты энантиомера 80% (S).
Пример 30. Получение N-бензил-N-(1-фенилэтил)амина
Процесс проводят аналогично примеру 8, но реакционные
условия изменяют следующим образом: 0,636 г (4,8 ммоля) N-бензил-N-(l-фенилэтилиден)амина, 3,2 мг (0,0048 ммоля) [Ir(1,5-циклооктадиен)Cl]2, 4,5 мг (0,01 ммоля) 1,4-бис(дифенилфосфин)бутана
(лиганд) и 30 мг (0,08 ммоля) тетрабутиламмонийиодида, 2 мл уксусной кислоты, 5 мл толуола, давление водорода 40 бар, реакционная температура 25oC . Продолжительность реакции составляет 2 ч,
конверсия является полной.
Пример 31. Получение 1'-(2'-метил-6'-этилфен-1'-ил)- N-( 1-метоксиметил)этиламина
Процесс проводят аналогично примеру 13, но с использованием
следующего лиганда: 4,1 мг (0,0059 ммоля) {[R)-1-[(S)-2-ди(4-метоксифенил)фосфин)-ферроценил] } -этил-ди (3,5 диметил-4-N,N-диметиламинофенил) фосфина. Время реакции составляет 3,5 ч, конверсия 100%,
степень чистоты энантиомера 76% (S).
Пример 32. Получение N-(2'-метил-6'-этилфен-1'-ил)-N-( 1-метоксиметил)этиламина
Процесс проводят аналогично примеру 13, но с
использованием следующих каталитических предшественников вместо катализатора, полученного in situ: 10,4 мг (0,1 ммоля) [Ir(1,5-циклооктадиен)-({(R)-1-[(S)-2- (дифенилфосфин)ферроценил] }этил-ди-(3,
5-диметилфенил)- фосфин)]-BF4, 135 мг (0,365 ммоля) тетрабутиламмонийиодида; стальной автоклав объемом 0,3 л. Время реакции составляет 45 мин, конверсия 100%, степень чистоты энантиомера
78% (S).
Пример 33. Получение N-(2'-метил-6'-этилфен-1'-ил)-N-( 1-метоксиметил)этиламина
Процесс проводят аналогично примеру 13, но с использованием следующих каталитических
предшественников вместо катализатора, полученного in situ: 9,9 мг (0,01 ммоля) [Ir(l,5-циклооктадиен) -({(R)-I-[(S)-2-(дифенилфосфин)ферроценил] } этил- ди(3,5-диметилфенил)фосфин)-Cl] , 135 мг (0,365
ммоля) тетрабутиламмонийиодида; стальной автоклав объемом 0,3 л. Время реакции составляет 35 мин, конверсия 100%, степень чистоты энантиомера 77,8% (S).
Пример 34. Получение N-(2',
6'-диметилфен- 1'-ил)-N-(1-метоксиметил)этиламина
Процесс проводят аналогично примеру 6, но реакционные условия изменяют следующим образом: 514 г (2,6 моля) N-(2',
6'-диметилфен-1'-ил)-N-(1- метоксиметил)этиламина, 77 мг (0,115 ммоля) [lr(l,5-циклооктадиен)Cl]2 (далее обозначено как [Ir(ЦОД)Cl]2) 214 мг (0,27 ммоля)
{(R)-1-[(S)-2-(дифенилфосфин)ферроценил] } этил-ди(3,5- диметил-4-N, N-дипропиламинофенил)фосфина, 3,5 г (9,5 ммоля) тетрабутиламмонийиодида, 50 мл уксусной кислоты, давление водорода 80 бар,
температура 50-60oC. Время реакции составляет 2,5 ч, конверсия 100%, степень чистоты энантиомера 78,9% (S).
Пример 35. Получение N-(2',
6'-диметилфен-1'-ил)-N-(1- метоксиметил)этиламина
Процесс проводят аналогично примеру 33, но реакционные условия изменяют следующим образом: 5 мл (0,024 моля) N-(2',
6'-диметилфен-1'-ил)-N-(1-метоксиметил)этиламина, 10,2 мг (0,015 ммоля) [lr(l,5-циклооктадиен)Cl]2, 21,5 мг (0,033 ммоля) {(R)-1-[(S)-2-(дифенилфосфин)ферроценил]}этил-ди(3,
5- диметилфенил)фосфина, 50 мг (0,135 ммоля) тетрабутиламмонийиодида, 2 мл уксусной кислоты, давление водорода 80 бар, температура 50-60oC, небольшой автоклав объемом 50 мл. Время реакции
составляет 1 ч, конверсия 100%, степень чистоты энантиомера 56,2% (S).
Пример 36. Процедуру осуществляют аналогично примеру 6, но в следующих измененных реакционных условиях: 31 кг (148,3 моля) N-(2'-метил-6'-этилфен-1'-ил)-N-(1-метоксиметил)этилиденамина помещают в стальной автоклав объемом 50 л с последующим добавлением 500 мг (0,744 ммоля) [Ir(1,5-циклооктадиен)Cl]2, 1,15 г (1,8 ммоля) {(R)-1-[(S)-2-(дифенилфосфин)ферроценил]} этил-ди (3,5-диметилфенил)фосфина, 22,5 г (61 ммоль) тетрабутиламмонийиодида и 3 л уксусной кислоты. Давление водорода составляет 75 бар, реакционная температура 50oC. По истечении времени реакции, равного 13 ч, конверсия является полной. Величина эи равна 75% (S).
Пример 37. Получение S-2-хлор-N-(2,
6-диметилфенил)-N-(2- метокси-1-метилэтил)-ацетамида
При перемешивании и с одновременным пропусканием азота через смесь к раствору из 883 г (4,57 моля) S-2,
6-диметил-N-(2-метокси-1- метилэтил)анилина (эи 78,2%) в 1,8 л толуола по каплям при температуре 15-20oC в течение 25 мин добавляют 433 г (5,48 моля) пиридина. Затем с охлаждением льдом при
15-20oC в смесь в течение 1,5 ч по каплям добавляют 547 г (4,84 моля) хлорацетилхлорида. Когда добавление по каплям завершают, образовавшуюся таким образом суспензию перемешивают еще в
течение 1,5 ч при комнатной температуре. Для обработки реакционную смесь выливают в 2 л воды и дважды экстрагируют с использованием 200 мл толуола каждый раз. Органические фазы объединяют, один раз
промывают 300 мл 2н. соляной кислоты, дважды с использованием 300 мл каждый раз насыщенного раствора хлорида натрия и один раз 600 мл насыщенного раствора бикарбоната натрия, сушат над сульфатом
натрия, фильтруют и удаляют в вакууме растворитель. Для очистки полученный таким образом сырой продукт подвергают фракционной перегонке. Температура кипения под остаточным давлением 0,3 мм рт.ст.
138-140oC, эи 78,1%.
Пример 38. Получение S-2-хлор-N-(2-этил-6-метилфенил)-N-(2-метокси-1-метилэтил)-ацетамида
10,52 кг (50,7 моля)
S-2-этил-N- (2-метокси-1-метилэтил)-6-метиланилина (эи 80,9%; [α]D20: 16,43, концентрация 2,6112 в гексане) вводят в 20 л толуола и при 10oC добавляют
4812 г (60,8 моля) пиридина. Затем с охлаждением льдом при 10-20oC в течение 2,5 ч в полученный таким образом реакционный раствор по каплям добавляют 6073 г (53,7 моля) хлорацетилхлорида.
Когда добавление по каплям завершают, образовавшуюся суспензию перемешивают 16 ч при комнатной температуре. Для обработки реакционную смесь выливают в 20 л воды и образовавшуюся эмульсию интенсивно
перемешивают в течение 10 мин. После удаления органической фазы водную фазу один раз экстрагируют 10 л гексана. Объединенные органические фазы один раз промывают 10 л воды, один раз 5 л 2н. соляной
кислоты и один раз 10 л воды, сушат над сульфатом натрия, фильтруют и концентрируют в роторном испарителе. Для очистки полученный таким образом сырой продукт подвергают фракционной перегонке.
Температура кипения под остаточным давлением 0,1 мм рт.ст. 135-140oC; эи 81,0%; [α]D20: - 6,53, концентрация 2,2364 в гексане.
Пример 39. 40 кг (194 моля) МЭА-имина формулы (Vb) втягивают с помощью закрытой вакуумной системы в инертный контейнер, а остаточное пониженное давление устраняют азотом. Далее содержимое контейнера под давлением вводят в инертный реактор с циркуляцией объемом 50 л (реактор с циркуляцией, выпускаемый фирмой Buss). После ввода в реактор через промывной затвор с твердыми частицами смеси из 0,14 г (2, 08•10-4моля) [Ir(ЦОД)Cl]2, 0,27 г (4,23•10-4моля) { (R)-1-[(S)-2-(дифенилфосфин)ферроценил]}этил-ди(3,5-диметилфенил) фосфина в качестве лиганда и 6,20 г (1,66•10-2моля) ТБАИ (тетрабутиламмонийиодида) осуществляют промывку с помощью 4,1 кг (68 молей) уксусной кислоты (безводной) и в реакторе сбрасывают давление. Затем в реакторе с помощью водорода давление дважды повышают до 5 бар и сбрасывают. Производят одновременный подогрев реактора до Ta = 50oC. Далее в реакторе с циркуляцией водородом создают давление 80 бар и включают циркуляционный насос. Наблюдают быстрое поглощение водорода, которое по истечении приблизительно 1 - 2 ч достигает теоретически возможного потребления водорода. После того, как более не наблюдается никакого дальнейшего поглощения водорода, содержимое реактора охлаждают до комнатной температуры и сбрасывают давление. Затем в реакторе с помощью азота создают инертную атмосферу и содержимое удаляют. Гидрогенизованный раствор подвергабт дистилляции и продукт выделяют с 98%-ным выходом.
Пример 40. Процесс проводят аналогично примеру 6, но реакционные условия изменяют следующим образом: в реакционном сосуде объемом 1 л используют 413 г (2,004 ммоля) имина, 2,8 мг иридиевого соединения, 6,4 мг дифосфинового лиганда и 124,2 мг иодида. Вместо 2 мл уксусной кислоты используют 0,1 г H2SO4. Конверсия составляет 100%. После выделения и очистки в соответствии с примером 6 достигается 99%-ный выход целевого продукта, а выход оптического изомера составляет 76,0% (S).
Реферат
Описывается способ гидрогенизации имина водородом при повышенных давлении и температуре в присутствии иридиевого катализатора в среде инертного растворителя или без него и в присутствии хлорида, бромида или иодида аммония или хлорида, бромида или иодида металла, который растворим в реакционной смеси, отличающийся тем, что процесс ведут в присутствии кислоты при температуре от (-20) до 100oC с использованием в качестве иридиевого катализатора гомогенного катализатора, соответствующего формуле [XJrYZ] (III), [XIrY]⊕A⊖ (IIIa), [XIrZ4]⊖M⊕ (IIIb), [YJRHZ2]2 (IIIc), [YJrZ3]2 (IIId), где значения X, Y и Z, A, M указаны в п.1 формулы изобретения. Описывается также способ получения амина. Технический результат - повышение каталитической активности, энантиоселективности, а также увеличение выхода оптического изомера. 2 c. и 33 з.п. ф-лы, 1 табл.
Формула
[XIrYZ] (III),
[XIrY]⊕A⊖ (IIIa),
[XIrZ4]⊖M⊕ (IIIb),
[YIrHZ2]2 (IIIc),
[YIrZ3]2 (IIId),
где X обозначает два олефиновых лиганда или диеновый лиганд, Y обозначает дифосфин, имеющий вторичные фосфиновые группы,
(а) фосфиновые группы которого связаны с разными углеродными атомами углеродной цепи, содержащей 2 - 4 углеродных атомов, или
(б) фосфиновые группы которого в ортоположениях циклопентадиенильного кольца присоединены либо напрямую, либо посредством мостиковой группы -CRaRb-, или каждая из групп связана с циклопентадиенильным кольцом ферроценила, или
(в) одна фосфиновая группа которого связана с углеродной цепью, содержащей 2 или 3 углеродных атомов, а другая фосфиновая группа которого связана с кислородным атомом или азотным атомом, присоединенным к концу этой углеродной цепи, или
(г) фосфиновые группы которого связаны с двумя кислородными атомами или азотными атомами, присоединенными к концу C2-углеродной цепи;
вследствие чего в случаях (а), (б), (в) и (г) 5-, 6- или 7-членное кольцо образуется совместно с атомом Ir, радикалы Z каждый независимо друг от друга (других) обозначают Cl, Br или I, A⊖ обозначает анион окси- или комплексной кислоты, а M⊕ обозначает катион щелочного металла или четвертичный аммоний и Ra и Rb каждый независимо друг от друга обозначают водород, C1 - C8-алкил, C1 - C4-фторалкил, фенил либо бензил или обозначают фенил или бензил, содержащие 1 - 3 C1 - C4-алкиловых или C1 - C4-алкоксильных заместителей.

3. Способ по п.1, отличающийся тем, что имин содержит по меньшей мере одну из групп

и дополнительно ненасыщенные группы

4. Способ по п.3, отличающийся тем, что свободные связи соединены с водородом или органическими радикалами, содержащими 1 - 22 углеродных атома, или органическими гетерорадикалами, содержащими 1 - 20 углеродных атомов и по меньшей мере один гетероатом из группы O, S, N и P; или азотный атом группы

соединен с NH2 или первичной аминогруппой, содержащей 1 - 22 углеродных атома, или вторичной аминогруппой, содержащей 2 - 40 углеродных атомов.

который гидрогенизуют с получением амина формулы II

где R3 представляет собой линейный или разветвленный C1 - C12-алкил, циклоалкил, содержащий 3 - 8 кольцевых углеродных атомов; гетероциклоалкил, связанный через углеродный атом и содержащий 3 - 8 кольцевых атомов и 1 или 2 гетероатома из группы O, S и NR6; C7 - C16-аралкил, связанный через алкильный углеродный атом, или C1 - C12-алкил, замещенный упомянутыми циклоалкилом либо гетероциклоалкилом или гетероарилом; или
R3 обозначает C6 - C12-арил или C4 - C11-гетероарил, связанный через кольцевой углеродный атом и содержащий в кольце 1 или 2 гетероатома, причем R3 незамещен или замещен -CN, -NO2, F, Cl, C1 - C12-алкилом, C1 - C12-алкоксигруппой, C1 - C12-алкилтиогруппой, C1 - C6-галоидалкилом, -OH, C6 - C12-арилом, -арилокси- или -арилтиогруппой, C7 - C16-аралкилом, -аралкокси- или аралкилтиогруппой, вторичным амином, содержащим 2 - 24 углеродных атома, -CONR4R5 или -COOR4, причем ариловые радикалы и ариловые группы в аралкиловых, аралкокси- и аралкилтиогруппах в свою очередь незамещены или замещены -CN, -NO2, F, Cl, C1 - C4-алкилом, -алкокси- или -алкилтиогруппой, -OH, -CONR4R5 или -COOR4;
R4 и R5 каждый независимо друг от друга обозначает водород, C1 - C12-алкил, фенил либо бензил, или
R4 и R5 вместе обозначают тетра- или пентаметилен или 3-оксапентилен;
R6 независимо имеет те же значения, что и приведенные для R4;
R1 и R2 каждый независимо друг от друга обозначает водородный атом, C1 - C12-алкил или циклоалкил, содержащий 3 - 8 углеродных атомов, каждый из которых незамещен или замещен -OH, C1 - C12-алкокси-, фенокси-, бензилоксигруппой, вторичным амином, содержащим 2 - 24 углеродных атома, -CONR4R5 или -COOR4; C6 - C12-арил или C7 - C16-аралкил, который незамещен или замещен так же, как и R3, или -CONR4R5 или -COOR4, где значения R4 и R5 определены выше, или
R3 имеет значения, определенные выше, а R1 и R2 вместе обозначают алкилен, содержащий 2 - 5 углеродных атомов, цепь которого необязательно прервана 1 или 2 радикалами -O-, -S- либо -NR6, и/или который незамещен или замещен = O или так же, как и R1 и R2 в приведенном выше значении алкила, и/или сконденсирован с бензолом, пиридином, пиримидином, фураном, тиофеном или пирролом; или R2 имеет значения, определенные выше, а R1 и R3 вместе обозначают алкилен, содержащий 2 - 5 углеродных атомов, цепь которого необязательно прервана 1 или 2 радикалами -O-, -S- или -NR6, и/или который незамещен или замещен = O или так же, как и R1 и R2 в приведенном выше значении алкила, и/или сконденсирован с бензолом, пиридином, пиримидином, фураном, тиофеном или пирролом.


или

17. Способ по п.1, отличающийся тем, что иридиевый катализатор представляет собой гомогенный катализатор, который практически полностью растворим в реакционной среде.









где R15 и R16 каждый независимо друг от друга обозначают водород, C1 - C4-алкил, фенил, бензил или фенил либо бензил, содержащие 1 - 3 C1 - C4-алкильных или C1 - C4-алкоксильных заместителей;
R14 обозначает водород, C1 - C4-алкил, фенил, бензил или фенил либо бензил, содержащие 1 - 3 C1 - C4-алкильных или C1 - C4-алкоксильных заместителей;
R17 обозначает водород, C1 - C4-алкил, фенил, бензил, C1 - C6-алкокси-CO-, C1 - C6-алкил-CO-, фенил-CO-, нафтил-CO- или C1 - C4-алкилNH-CO-;
A может обозначать одинаковые или различные группы -PR2, где R обозначает C1 - C6-алкил, циклогексил, фенил, бензил или фенил либо бензил, содержащие 1 - 3 C1 - C4-алкильных, C1 - C4-алкоксильных заместителей, -CF3 или частично или полностью фторированных C1 - C4-алкоксильных заместителей;
n обозначает 0, 1 или 2.
{ (R)-1-[(S)-2-(дифенилфосфин)ферроценил] } этил-ди(3,5-диметилфенил)фосфин;
{ (R)-1-[(S)-2-(дифенилфосфин)ферроценил]}этил-ди(3,5-диметил-4-N,N-дипропиламинофенил)фосфин;
{ (R)-1-[(S)-2-(дифенилфосфин)ферроценил] } этил-ди(3,5-диизопропил-4-N, N-диметиламинофенил)фосфин;
{ (R)-1-[(S)-2-(дифенилфосфин)ферроценил] } этил-ди(3,5-диизопропил-4-N, N-дибензилиламинофенил)фосфин;
{ (R)-1-[(S)-2-(дифенилфосфин)ферроценил] }этил-ди(3,5-диметил-4-N,N-дибензилиламинофенил)фосфин;
{ (R)-1-[(S)-2-(дифенилфосфин)ферроценил] } этил-ди(3, 5-диметил-4-(1'-пиррол)фенил)фосфин;
{ (R)-1-[(S)-2-(дифенилфосфин)ферроценил] }этил-ди(3,5-диметил-4-N,N-дипентиламинофенил)фосфин;
{ (R)-1-[(S)-2-(дифенилфосфин)ферроценил] }этил-ди(3,5-диметил-4-N,N-диметиламинофенил)фосфин;
1,4-бис(дифенилфосфин)бутан или
{ (R)-1-[(S)-2-ди(4-метоксифенил)фосфин)ферроценил] } этил-ди(3,5-диметил-4-N, N-диметиламинофенил)фосфин.

где R01, R02 и R03 каждый независимо друг от друга обозначают C1 - C4-алкил, а R04 обозначает C1 - C4-алкил, C1 - C4-алкоксиметил или C1 - C4-алкоксиэтил, отличающийся тем, что (1) проводят гидрогенизацию имина формулы V

водородом в присутствии гомогенного иридиевого катализатора в среде инертного растворителя или без него и в присутствии кислоты и хлорида, бромида или иодида аммония или хлорида, бромида или иодида металла, который растворим в реакционной смеси, и (2) полученный при этом амин формулы VI

подвергают взаимодействию с соединением формулы VII
ClCH2CO-Cl
35. Способ по п.34, отличающийся тем, что используемый имин представляет собой соединение формулы

или


Комментарии