Новые сильные кислоты, способ их получения, их раствор, соль и способ получения соли - RU2297421C2
Код документа: RU2297421C2
Описание
Настоящее изобретение относится к кислотам общей формулы [I]

в которой
у=1, 2 или 3, и в которой
лиганды R могут быть одинаковыми или различными, и
R представляет собой перфторированную C1-C8-алкильную или арильную группу или R представляет собой частично фторированную C1-C8 -алкильную или арильную группу, в которой некоторые атомы F или H могут быть заменены хлором.
Кроме того, настоящее изобретение относится к способу получения кислот в соответствии с изобретением, к солям, содержащим катион и анион одной из кислот в соответствии с изобретением, и к способу получения солей. Изобретение, кроме того, относится к применению кислот и солей металлов в соответствии с изобретением.
Гексафторфосфорная кислота, HPF6 используется в качестве катализатора в органической химии или в качестве исходного соединения для получения различных солей. В промышленности, гексафторфосфорную кислоту получают реакцией [1] пентоксида фосфора с безводной фтористоводородной кислотой.
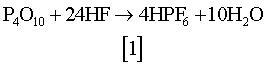
Недостатками данного способа являются токсичность и риск, связанный с обращением с исходным фтороводородом, и высокоэкзотермическое выделение тепла при прохождении реакции.
Гексафторфосфорная кислота является коммерчески доступной как 65% по весу водный раствор. Этот раствор является неустойчивым при более высоких концентрациях. Чистая гексафторфосфорная кислота может быть получена в жидком диоксиде серы, но является неустойчивой при комнатной температуре (D.E.C. Colbridge, Phosphorus. An Outline of chemistry, Biochemistry and Technology (Second Edition) Elsevier Scientific Publishing Comp. Amsterdam-Oxford-New York, 1980). Низкая устойчивость высококонцентрированных растворов гексафторфосфорной кислоты ограничивает потенциальные возможности применения этой кислоты в качестве катализатора. Кроме того, координация протона с фосфорным гексафторид анионом снижает активность протона этой кислоты.
Кроме того, целью настоящего изобретения является обеспечение соединениями фторфосфорной кислоты, которые не имеют недостатков предыдущего уровня техники.
Эта цель достигается кислотой общей формулы [I]

в которой
у=1, 2 или 3,
и в которой
лиганды R могут быть одинаковыми или различными, и
R представляет собой перфторированную C1-C8-алкильную или арильную группу или R представляет собой частично фторированную C1-C8-алкильную или арильную группу, в которой некоторые атомы F или Н могут быть заменены хлором.
Перфторированные и частично фторированные алкильная или арильная группы R могут быть в форме цепной или кольцевой структуры.
Предпочтение отдается кислотам, в которых по крайней мере одна группа R представляет собой перфторированную н-, изо- или трет-бутилъную группу или пентафторфенильную группу и более предпочтительно представляет собой пентафторэтильную группу.
Кроме того, предпочтение отдается кислотам, в которых у=2 или 3. Особое предпочтение отдается кислотам, в которых у=3.
Особое предпочтение отдается кислотам, согласно изобретению: трифтортрис(пентафторэтил)фосфорная кислота, трифтортрис(нонафтор-н-бутил)фосфорная кислота, трифтортрис(гептафтор-н-пропил)фосфорная кислота, тетрафторбис(нонафтор-н-бутил)фосфорная кислота, пентафтор(нонафтор-н-бутил)фосфорная кислота и тетрафторбис(гептафтор-изопропил)фосфорная кислота.
В отношении номенклатуры фторированных фосфорных кислот, можно сослаться на IUPAC номенклатуру (A Guide to IUPAC Nomenclature of Organic Compounds. Recommendations, R. Panico, W.H. Powell и Jean-Claude Richer, Blackwell Science, 1993).
Кислоты согласно изобретению имеют преимущество над фторфосфорными кислотами, известными до настоящего времени, которое заключается в том, что они легки в получении, имеют высокую активность протона и стабильны при комнатной температуре в высококонцентрированном растворе.
Кроме того, настоящее изобретение относится к способу получения кислот согласно изобретению, в которых перфторалкилфосфоран подвергают реакции с фтороводородом в присутствии подходящего растворителя и/или акцептора протонов.
Получение перфторалкилфосфоранов как исходных соединений для способа согласно изобретению является хорошо известным специалисту, квалифицированному в данном уровне техники, из предыдущего уровня техники, например, из Германской Патентной Заявки DE 19846636 A1, которая включена здесь и, таким образом, рассматривается как часть описания.
Подходящими растворителями и/или акцепторами протонов для способов согласно изобретению являются предпочтительно соединения, которые имеют один, два или больше следующих атомов: О, N, S, P, Se, Те и As.
Предпочтение отдается воде, спирту, простым эфирам, сульфидам, аминам, фосфинам, карбоновым кислотам, сложным эфирам, гликолям, полигликолям, полиаминам, полисульфидам или смесям по крайней мере двух этих растворителей и/или акцепторов протонов.
Особенно предпочтительными растворителями и/или акцепторами протонов являются вода, метанол, этанол, уксусная кислота, диметиловый эфир, диэтиловый эфир, диметилкарбонат, диметилсульфид, диметилформамид, триэтиламин или трифенилфосфин, или смеси по крайней мере 2 из этих соединений.
Концентрация фтороводорода в подходящем растворителе равна предпочтительно больше чем 0,1% по весу HF, предпочтительно больше чем 5% по весу HF и более предпочтительно больше чем 10% по весу и наиболее предпочтительно больше чем 20% по весу, но меньше чем 100% по весу HF.
В предпочтительном воплощении, реакцию перфторалкилфосфорана в способах согласно изобретению выполняют при температуре от -50 до +100°С, предпочтительно при температуре от -35 до +50°С, более предпочтительно при температуре от 0 до 25°С.
Способ согласно изобретению позволяет легко получать кислоты общей формулы [I] с высокими выходами.
Настоящее изобретение также относится к растворам кислот согласно изобретению, которые имеют концентрацию больше чем 2% по весу, предпочтительно больше чем 20% по весу, более предпочтительно больше чем 70% по весу, наиболее предпочтительно больше чем 80% по весу, кислоты в подходящем растворителе.
Растворы согласно изобретению, в особенности в высоких интервалах концентраций, позволяют получить протонные активности, которые могут быть с трудом достигнуты только с растворами других фторфосфорных кислот. Это особенно предпочтительно при использовании кислот согласно изобретению в высококонцентрированных формах, например, в качестве катализатора в реакционной смеси. Высококонцентрированный раствор позволяет также избежать нежелательного разбавления реакционных смесей.
Кроме того, настоящее изобретение, относится к солям общей формулы [II]
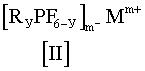
в которой
Мm+ представляет собой моновалентный, дивалентный или тривалентный катион,
m=1, 2 или 3
и у=1, 2 или 3,
и в которой
лиганды R могут быть одинаковыми или различными, и
R представляет собой перфторированную C1-C8-алкильную или арильную группу или R представляет собой частично фторированную C1-C8-алкильную или арильную группу, в которой некоторые атомы F или Н могут быть заменены хлором.
Катион Мm+ может представлять собой катион металла или органический катион.
Подходящие органические катионы известны специалисту, квалифицированному в данном уровне техники, и описаны, например, в Германской Патентной Заявке DE 10109032.3 на страницах 4-6. Этот источник включен здесь в качестве ссылки и, таким образом, рассматривается как часть данного описания.
Соли общей формулы [II] предпочтительно содержат Li, Zn, Mg, Cu, Ag, аммоний, фосфоний, оксоний, сульфоний, арсоний, тропилий, нитрильный катион, нитрозильный катион или катион трис (диалкиламино) карбония.
Преимуществом солей согласно изобретению является их хорошая растворимость в органических растворителях.
В предпочтительном воплощении, эти соли получают способом, в котором кислоту согласно изобретению вводят в реакцию в подходящем растворителе с солью общей формулы [III]

в которой
Мm+ представляет собой моновалентный, дивалентный или тривалентный катион,
А представляет собой основный или нейтральный анион или смесь
основных анионов или смесь по крайней мере одного основного и
по крайней мере одного нейтрального аниона,
и m=1, 2 или 3,
или с металлами, гидридами металлов, оксидами металлов или гидроксидами металлов.
Способ предпочтительно выполняют, используя соли формулы [III], которые содержат по крайней мере один оксид, гидрид, карбонат, гидроксид, хлорид, фторид, формиат, ацетат и/или трифторацетат анион.
Способ предпочтительно выполняют, используя анионы, которые образуют легколетучие кислоты, такие как, например, соляная кислота, муравьиная кислота или уксусная кислота.
В данном способе, используемыми металлами являются предпочтительно Li, Na, К, Rb, Mg, Cs, Ca, Sr, Ba, Sc, Y, Yb, La, Al, In, Cd и/или Zn, используемыми оксидами являются предпочтительно Li2O, Na2O, K2O, MgO, CaO, SrO, BaO, Sc2O3, Y2О3, Yb2О3, La2O3, Al2О3, CdO, ZnO, CuO, FeO и/или Fe2О3, используемыми гидроксидами являются предпочтительно LiOH, NaOH, КОН, RbOH, CsOH, Mg(OH)2, Ca(OH)2, Sr(OH)2, Ba(OH)2, Cd(OH)2, Zn(OH)2, Sc(ОН)3, Al(ОН)3 и/или Cu(OH)2 и используемыми гидридами являются предпочтительно LiH, NaH, CaH2, YH3 и/или AlH3.
Способ получения солей согласно изобретению является простым в выполнении и предлагает высокие выходы.
Кроме того, настоящее изобретение относится к применению одной из солей согласно изобретению в качестве катализатора, катализатора фазового переноса, растворителя, в особенности в качестве ионной жидкости, или в качестве проводящей соли в электролитах различных электрохимических приборов.
Специалисту, квалифицированному в данном уровне техники, следует понимать "ионную жидкость" как органические соединения, которые имеют ионную структуру и низкую точку плавления, например, соли N,N-диалкилимидазолила [С.Е.Song, E.J.Roh, Chem. Comm. (Camebridge) 2000, 10, стр.837-838; J. Howarth, Tetrahedron Lett. 41 (2000) 34, стр.6627-6629; С.Е.Song, С.Е.Oh, E.J.Roh, D.J.Choo, Chem. Comm. (Camebridge) 2000, 18, стр.1743-1744).
Настоящее изобретение также относится к применению кислоты согласно изобретению в качестве катализатора при получении органических соединений.
Кислоты согласно изобретению особенно подходят в качестве замены для кислот HPF6 и/или HBF4 в химических реакциях.
Кислоты и/или соли согласно изобретению предпочтительно используют в одном из следующих способов:
способы
- получения фоточувствительных полимеров [СА (Chemical Abstracts) 110:15956е],
- получения дигидроксидиарильных соединений [СА 110:94679t], поверхностной обработки металлов [СА 110: 139975е],
- получения электропроводящих анилиновых полимеров [СА 110:155067r],
- получения карбоновых кислот и сложных эфиров карбоновых кислот [СА 110:233613g],
- получения высокомолекулярных диазониевых соединений [СА 110:87472n],
- получения эпоксидных смол [СА 111:135490r],
-получения электропроводящих материалов из амино-подобных соединений [СА 112:46758n],
- получения октадиенолов [СА 112:98016р],
- карбоаминирования или карбоамидирования олефинов [СА 112:161007d],
- изомеризации бутенов [СА 112:157653u],
- получения электропроводящих полиалкокситиофенов [СА 115:50551u],
- десульфирования масла и эффлюента [СА 116: 261878q],
- получения композиций на основе триглицидилтриметилолалкана [СА 117:92344а],
- получения полимеров из стирола и монооксида углерода [СА 117:172290v],
- получения органических солей для хранения информации [СА 117:17381g],
- производства носителей информации, которые обладают хорошей устойчивостью к свету [СА 115:267063w],
- получения кремниевых материалов подложек для катализаторов [СА 117:74989k],
- полимеризации производных пиррола [СА 117: 70577b],
- сополимеризации монооксида углерода и олефиново ненасыщенного соединения [СА 118:7520h],
- получения электропроводящих полимеров [СА 118:137707k],
- получения магнитоконтрастных агентов [СА 118:299355х],
- получения полимерных покрытий [СА 119:54608у],
- удаления оксидных слоев на нержавеющей стали [СА 119:77272у],
- синтеза метил трет-бутилового простого эфира [СА 119:202992m],
- получения циклических сульфониевых солей, содержащих 5-7 атомов углерода [СА 119:249826а],
- получения циклосилоксанов [120:108008u],
- переработки тяжелых масел и асфальта [СА 120:195633k],
- обработки соединений алюминия [СА 120:283104u],
- получения четвертичных пиридиниевых или анилиновых солей [СА 121:9165g],
- сополимеризации олефинов и монооксида углерода [СА 121:10209f),
- получения гидроксильных ароматических соединений [СА 121:133684q],
- получения производных уксуснокислых сложных эфиров [СА 121:157308w],
- получения смол из диалкенилбензола и полиариламинов [СА 122:70050с],
- получения замещенных пирролопиримидин-4-онов [СА 122:314562q],
- восстановления нефти [СА 122:295102w],
- применения в качестве безводных аккумуляторных электролитов [СА 122:118595j],
- получения устойчивых метальных катионов [СА 124:288639q],
- получения циклических сульфониевых солей [СА 125:114470h],
- получения материалов для оптического запоминающего устройства [СА 125:127895а],
- получения сопряженных фторпиридиниевых солей [СА 125:119500с],
- получения комплексов иридий/дифосфин [СА 126:226760е],
- асимметрического гидрирования иминов [СА 126:225097g],
- гидроформилирования ненасыщенных соединений [СА 126:225032g],
- синтеза полимеров [СА 126:104554v],
- получения полимеров из полициклоолефинов с силильными группами [СА 127:110414m],
- получения рутениевых катализаторов [СА 127:83071р],
- получения ибупрофена [СА 127:318741у],
- получения соединений циклогексадиенила [СА 126:212225х],
- сополимеризации олефинов [СА 126:199931с],
- получения неорганических метилимидазолиниевых солей [СА 128:167423р],
- получения SiCO и SiC керамических волокон [СА 128:234151p],
- получения материалов с регулярным термоклеевым покрытием [СА 128:210892е],
- получения полимеров [СА 129:317091r],
- получения азиридин-полиэфирных соединений [СА 131:35901v],
- получения дисложных эфиров дикарбоновой кислоты [СА 131:199417t],
- гидроксилирования ароматических углеводородов [СА 129:218223d],
- получения карбоновых кислот и сложных эфиров карбоновых кислот [СА 129:216347у],
- предобработки литографской печатной формы [СА 129:195815g].
Изобретение объяснено ниже с помощью примеров. Эти примеры служат только объяснением изобретения и не ограничивают основную идею изобретения.
Способ согласно изобретению может использоваться для получения, например, трифтортрис(перфторалкил)фосфорных кислот с практически количественным выходом по реакции дифтортрис(перфторалкил)фосфоранов с фтороводородом в подходящих растворителях. Неожиданно, этот выход практически не затронут гидролизом.
Способ согласно изобретению может использоваться, например, для получения высококонцентрированного водного раствора трифтортрис(пентафторэтил)-фосфорной кислоты в течение нескольких минут реакцией дифтортрис(пентафторэтил)фосфорана с 18,3% по весу водным HF. Эта реакция протекает в соответствии со следующим уравнением реакции [2]:
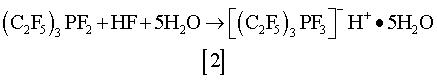
Полученный раствор имеет концентрацию 83,2% по весу и является устойчивым в течение нескольких недель при комнатной температуре.
Концентрации кислоты меньше чем 83,2% по весу могут быть также получены таким образом, например путем разбавления подходящим растворителем или реакцией фосфорана с более разбавленным раствором фтороводорода.
Однако, реакция фосфоранов с более разбавленными водными растворами фтороводорода, например, 2% по весу, занимают больше времени. В случае более разбавленных водных растворов фтороводорода, сначала образуется аддукт воды и фосфорана, и затем он медленно превращается в более устойчивый продукт.
Скорость превращения аддукта в продукт зависит от температуры. При комнатной температуре, превращение в соответствии с реакцией [2] с 2% по весу раствором фтороводорода занимает 2 дня. При -21°С и при тех же концентрационных соотношениях, только 30% аддукта превращается в трифтортрис(пентафторэтил)фосфорную кислоту в течение шести дней.
При реакции фосфорана на ледяной бане в соответствии с уравнением реакции [2] с 4,3% по весу водным раствором фтороводорода образуется смесь аддукта фосфоран/вода и трифтортрис(пентафторэтил)фосфорная кислота в соотношении 1:2 в течение 2-3 минут.
Данная реакция может быть выполнена при атмосферном давлении или давлении выше атмосферного, при необходимости также в атмосфере защитного газа.
Трифтортрис(пентафторэтил)фосфорная кислота может существовать в двух различных конформациях, меридиональной конформации и фациальной конформации. Эти две структуры существуют в равновесии. Это равновесие зависит от температуры и концентрации фтороводорода в воде в течение реакции исходных веществ. В начальной стадии образуется меридиональная структура, которая затем достигает равновесия с фациальной структурой.
Специалист, квалифицированный в данном уровне техники, понимает, что протон в сильной кислоте согласно изобретению находится в форме комплекса с соответствующим растворителем. Поэтому, в представлении формул в примерах комплекс протона и растворителя не был представлен.
Содержание полного описания всех заявок, патентов и публикаций упомянутых выше и ниже, и соответствующей заявки DE 10130940.6, дата подачи 27.06.2001, введено в данное описание в качестве ссылки.
Даже без дополнительных комментариев, предполагается, что специалист, квалифицированный в данном уровне техники, будет способен использовать описание, данное выше, в самом полном объеме. Поэтому, предпочтительные воплощения и примеры следует просто рассматривать в качестве наглядного описания, которое никоим образом не ограничивает изобретение.
Все ЯМР спектры записаны на Bruker WP 80 SY спектрометре (1H: 80 МГц,19F 75,47 МГц).
Примеры
Пример 1
3,74 г воды добавляют к 3,14 г 40% по весу водной фтористоводородной кислоте (62,8 ммоль HF) (в общем 312,1 ммоль воды) в FEP (фторэтиленовый полимер) колбе. Затем эту смесь охлаждают на ледяной бане, в течение 2 минут добавляют 26,55 г (62,3 ммоль) дифтортрис(пентафторэтил)фосфорана при перемешивании с использованием магнитной мешалки. Фосфоран полностью растворился в течение 3 минут, и образовался бесцветный, прозрачный раствор водной [(С2F5)3PF3]-Н+ кислоты. Получают 33,4 г 83,2% по весу раствора трифтортрис(пентафторэтил)фосфорной кислоты с практически количественным выходом.
Соединение соответствует формуле: [(С2F5)3PF3]-Н+5Н2О.
Раствор проанализировали при помощи19F ЯМР спектроскопии. Спектр записывали с использованием FEP пробирки с ацетон-D6 пленкой в качестве внешнего затвора и CCl3F в качестве внешнего стандарта.
19F ЯМР, δ, м.д.: -44,03 dm (PF); -80,61 m (CF3); -82,47 m (2CF3); -88,99 dm (PF2); -115,36 dm (3CF2); J1P,F=889 Гц; J1P,F=907 Гц; J2P,F=92 Гц.
Эти сигналы относятся к меридиональной структуре кислоты [(С2F5)3PF3]-Н+5Н2O. В течение 2 дней, образовался новый дублет в19F ЯМР спектре при -67,41 м.д.; J1P,F=786 Гц (PF3 группа), который может быть отнесен к фациальной структуре кислоты [(С2F5)3PF3]-Н+5Н2O. Никаких других изменений не наблюдалось в течение хранения при комнатной температуре на протяжении последующих 3 недель. При комнатной температуре образовалась 83,2% по весу кислота в равновесной смеси из около 90% меридиональной конформации и 10% фациальной конформации кислоты.
Пример 2
2,24 г воды добавляют к раствору 1,88 г 40% по весу водной фтористоводородной кислоты (37,6 ммоль HF) (в общем 186,8 ммоль воды) в FEP колбе. 15,88 г (37,3 ммоль) дифтортрис(пентафторэтил)фосфорана добавляют к раствору водной HF при комнатной температуре на протяжении 3 минут при перемешивании реакционной смеси с использованием магнитной мешалки. Во время растворения фосфорана, в связи с экзотермической реакцией температура достигла 50°С. Образовалось 20,0 г бесцветного, прозрачного раствора [(С2F5)3PF3]-Н+ в воде с концентрацией 83,2% по весу, с практически количественным выходом.
Раствор проанализировали при помощи19F ЯМР спектроскопии. Спектр был записан с использованием FEP пробирки с ацетон-D6 пленкой в качестве внешнего затвора и CCl3F в качестве внешнего стандарта.
19F ЯМР (меридиональная конформация), δ, м.д.: -44,46 dm (PF); -81,05 m (CF3); -82,85 m (2CF3); -89,54 dm (PF2); -115,74 dm (3CF2); J1P,F=889 Гц; J1P,F=905 Гц; J2P,F=93 Гц.
19F ЯМР (фациальная конформация), δ, м.д.: -67,82 dm (PF3); J1P,F=784 Гц. Другие сигналы фациальной конформации перекрываются с сигналами меридиональной конформации.
Спектр показывает, что в этом случае обе конформации кислоты, как меридиональной, так и фациальной конформации, образуются во время получения раствора.
Пример 3
10,57 г воды добавляют к раствору 3,91 г 40% по весу, водной фтористоводородной кислоты (78,2 ммоль HF) (в общем 716,8 ммоль воды) в FEP колбе. Затем эту смесь охлаждают на ледяной бане, добавляют 33,34 г (78,2 ммоль) дифтортрис(пентафторэтил)фосфорана на протяжении 3 минут при перемешивании с использованием магнитной мешалки. Фосфоран полностью растворился в течение этого времени, и образовался прозрачный раствор [(С2F5)3PF3]-H+. Получили 47,8 г водной трифтортрис(пентафторэтил)фосфорной кислоты (I) с концентрацией 73,0% по весу с количественным выходом.
19F ЯМР (CCl3F - внешний стандарт): -44,45 dm (PF); -80,84 m (CF3); -82,57 m (2CF3); -89,13 dm (PF2); -115,75 dm (3CF2); J1P,F=889 Гц; J1P,F=909 Гц; J2P,F=92 Гц.
Указанные сигналы относятся к меридиональной структуре кислоты [(С2F5)3PF3]-H+ и в течение 5 дней никаких изменений в спектре не наблюдалось. Таким образом, кислота [(С2F5)3PF3]-H+ преимущественно находится в меридиональной конформации при такой концентрации при комнатной температуре.
Пример 4
12,46 г воды добавляют к раствору 1,51 г 40% по весу водной фтористоводородной кислоты (30,2 ммоль HF) (в общем 741,7 ммоль воды) в FEP колбе. Затем эту смесь охлаждают на ледяной бане, добавляют 12,74 г (29,9 ммоль) дифтортрис(пентафторэтил)фосфорана на протяжении 3 минут при перемешивании с использованием магнитной мешалки. Фосфоран полностью растворился в течение этого времени, и получили 26,7 г бесцветного, прозрачного раствора кислоты с практически количественным выходом.
19F ЯМР спектр указывает на присутствие двух форм гексакоординированного фосфора. Первая форма представляет собой комплекс дифтортрис(пентафторэтил)фосфорана с водой:
19F ЯМР (CCl3F - внешний стандарт): -80,39 m (CF3); -81,31 m (2CF3); -89,19 dm (PF2); -113,78 dm (3CF2); -164,59 s (Н3О+ HF) J1P,F=846 Гц; J2P,F=89 Гц.
Вторая форма представляет собой обычную меридиональную конформацию трифтортрис(пентафторэтил)фосфорной кислоты [(С2F5)3PF3]-Н+.
19F ЯМР (CCl3F - внешний стандарт): -44,60 dm (PF); -80,81 m (CF3); -82,49 m (2CF3); -89,34 dm (PF2); -115,96 dm (3CF2); J1P, F=889 Гц; J1P,F=884 Гц; J2P,F=95 Гц.
В течение 4 дней хранения при комнатной температуре,19F ЯМР спектр показал на присутствие в растворе только меридиональной конформации трифтортрис(пентафторэтил)фосфорной кислоты [(С2F5)3PF3]-Н+.
Пример 5
29,60 г воды добавляют к раствору 1,47 г 40% по весу водной фтористоводородной кислоты (29,4 ммоль HF) (в общем 1691,6 ммоль воды) в FEP колбе. Затем эту смесь охлаждают на ледяной бане, добавляют 12,47 г (29,3 ммоль) дифтортрис(пентафторэтил)фосфорана на протяжении трех минут при перемешивании с использованием магнитной мешалки. Фосфоран полностью растворился в течение этого периода, и было получено 43,5 г бесцветного, прозрачного раствора.
19F ЯМР спектр указывает, что в этом случае непосредственно при добавлении фосфорана образовался преимущественно водный аддукт.
19F ЯМР (CCl3F - внешний стандарт): -79,49 m (CF3); -80,74 m (2 CF3); -88,60 dm (PF2); -113,35 dm (3CF2); -162,54 s (Н3О+ HF) J1P,F=842 Гц; -J2P,F=89 Гц.
В течение пяти дней, при комнатной температуре, этот аддукт полностью превратился в трис(пентафторэтил)трифторфосфорную кислоту [(С2F5)3PF3]-Н+.
Что было подтверждено при помощи19F ЯМР спектроскопии.
Пример 6
5,64 г (122,3 ммоль) диметилового эфира охлаждают до -35°С в FEP колбе с использованием этанольной бани. К реакционной смеси, по порядку, сначала медленно добавляют 1,42 г (71,0 ммоль) фтороводорода (HF) и затем, на протяжении пяти минут, добавляют 30,25 г (71,0 ммоль) дифтортрис(пентафторэтил)фосфорана при перемешивании реакционной смеси с использованием магнитной мешалки. После того как фосфоран растворился, и реакционная смесь нагрелась до комнатной температуры, получили 37,3 г бесцветного, прозрачного раствора.
Раствор проанализировали при помощи19F ЯМР спектроскопии. Спектр был записан с использованием FEP пробирки с ацетонитрил-D3 пленкой в качестве внешнего затвора и CCl3F в качестве внутреннего стандарта.
19F ЯМР спектр указывает, что в этом случае кислота [(С2F5)3PF3]-Н+ преимущественно образуется с меридиональной структурой.
19F ЯМР меридиональной конформации: -43,58 dm (PF); -80,19 m (CF3); -81,90 m (2CF3); -87,03 dm (PF2); -115,51 dm (3CF2); J1P,F=888 Гц; J1P, F=894 Гц; J2P,F=94 Гц.
В течение трех дней, в смеси возросла концентрация фациальной конформации кислоты [(С2F5)3 PF3]-Н+.
19F ЯМР спектр фациальной конформации: -66,12 dm; J1P,F=798 Гц (PF3 группа).
Другие сигналы фациальной конформации перекрываются с сигналами меридиональной конформации.
Никаких других изменений в19F ЯМР спектре не наблюдалось в течение пяти недель хранения при комнатной температуре.
Пример 7
6,04 г (81,5 ммоль) сухого диэтилового эфира в FEP колбе охлаждают на ледяной бане. При перемешивании с использованием магнитной мешалки, сначала к диэтиловому эфиру медленно добавляют 0,92 г (45,9 ммоль) фтороводорода (HF) и затем, на протяжении 5 минут, добавляют 18,67 г (43,8 ммоль) дифтортрис(пентафторэтил)фосфорана. После растворения фосфорана в течение от одной до двух минут и нагревания реакционной смеси до комнатной температуры, образовалось 25,6 г бесцветного, прозрачного раствора.
Раствор проанализировали при помощи19F ЯМР спектроскопии. Спектр был записан с использованием FEP пробирки с ацетонитрил-D3 пленкой в качестве внешнего затвора и CCl3F в качестве внутреннего стандарта.
19F ЯМР спектр указывает, что кислота [(С2F5)3PF3]-Н+ образовалась в двух конформациях.
19F ЯМР меридиональной конформации (приблизительно 85 молярных %): -43,68 dm (PF); -80,00 m (CF3); -81,71 m (2CF3); -86,93 dm (PF2); -115,31 dm (3CF2); J1P,F=890 Гц; J1P,F=897 Гц; J2P,F=92 Гц.
19F ЯМР спектр фациальной формы (приблизительно 15 молярных %): -67,37 dm; J1P,F=793 Гц (PF3 группа). Другие сигналы фациальной конформации перекрываются с сигналами меридиональной конформации.
В течение двух месяцев хранения при комнатной температуре никаких изменений в19F ЯМР спектре не наблюдалось.
Пример 8
3,33 г (103,9 ммоль) метанола в FEP колбе охлаждают с использованием ледяной бани. При перемешивании с использованием магнитной мешалки, сначала в метанол медленно добавляют 0,91 г (45,5 ммоль) фтороводорода (HF) и на протяжении последующих пяти минут к реакционной смеси добавляют 18,05 г (42,4 ммоль) дифтортрис(пентафторэтил)фосфорана. После растворения фосфорана и нагревания реакционной смеси до комнатной температуры, получили 22,2 г бесцветного, прозрачного раствора.
Этот раствор проанализировали при помощи19 F ЯМР спектроскопии. Спектр был записан с использованием FEP пробирки с ацетонитрил-D3 пленкой в качестве внешнего затвора и CCl3F в качестве внутреннего стандарта.
19F ЯМР показывает, что в этом случае кислота [(С2F5)3PF3]-Н+ образовалась в двух конформациях.
19F ЯМР меридиональной конформации (приблизительно 85 молярных %): -43,80 25 dm (PF); -80,50 m (CF3); -81,93 m (2CF3); -87,50 dm (PF2); -114,93 dm (3CF2); J1P,F=887 Гц; J2P,F=95 Гц.
19F ЯМР спектр фациальной конформации (приблизительно 15 молярных %): -66,44 dm; J1P,F=780 Гц (PF3 группа). Другие сигналы фациальной формы перекрываются с сигналами меридиональной формы.
В течение одного месяца хранения при комнатной температуре никаких изменений в19F ЯМР спектре не наблюдалось.
Пример 9
3,02 г (48,8 ммоль) диметилсульфида (СН3)2S в FEP колбе охлаждают на ледяной бане. При перемешивании с использованием магнитной мешалки, сначала к диметилсульфиду добавляют 0,98 г (49,0 ммоль) фтороводорода (HF) и затем, на протяжении пяти минут, добавляют 20,88 г (49,0 ммоль) дифтортрис(пентафторэтил)фосфорана. После того как весь фосфоран был добавлен, реакционная смесь полностью затвердела. После дополнительного механического перемешивания и высушивания реакционной смеси при комнатной температуре в потоке защитного газа аргона, получили 23,9 г бесцветного, твердого вещества.
0,4 г этого вещества растворили в ацетонитриле-D3, и этот раствор проанализировали при помощи19F ЯМР спектроскопии. CCl3F использовали в качестве внутреннего стандарта.
19F ЯМР спектр указывает, что в этом случае кислота [(С2F5)3PF3]-Н+ образовалась в меридиональной конформации.
19F ЯМР: -43.54 dm (PF); -79,66 m (CF3); -81,25 m (2CF3); -86,83 dm (PF2); -115,28 dm (3CF2); J1P,F =889 Гц; J1P,F=906 Гц; J2P,F=92 Гц.
Пример 10
3,23 г (12,3 ммоль) трифенилфосфина (Ph3Р) в FEP колбе охлаждают до -25°С на бане этанол/сухой лед. При перемешивании реакционной смеси с использованием магнитной мешалки, сначала в трифенилфосфин медленно добавляют 0,66 г (33,0 ммоль) фтороводорода (HF) и затем, на протяжении последующих пяти минут, добавляют 5,25 г (12,3 ммоль) дифтортрис(пентафторэтил)фосфорана. После того как весь фосфоран был добавлен, реакционная смесь полностью затвердела. После дополнительного механического перемешивания и высушивания реакционной смеси при комнатной температуре в потоке защитного газа аргона, получили 8,8 г бледно-желтого твердого вещества.
0,4 г этого вещества растворили в ацетонитриле-D3, и раствор проанализировали при помощи19F ЯМР спектроскопии. CCl3F использовали в качестве внутреннего стандарта.
19F ЯМР спектр указывает, что в этом случае кислота [(С2F5)3PF3]-Н+ образовалась в виде комплекса с трифенилфосфином в меридиональной конформации.
19F ЯМР: -43,65 dm (PF); -79,75 m (CF3); -81,34 m (2CF3); -86,99 dm (PF2); -115,45 dm (3CF2); J1P,F=889 Гц; J1P,F=906 Гц; J2P,F=92 Гц.
Небольшой сигнал остаточного HF виден в19F ЯМР спектре (-181,75 м.д.).
1Н ЯМР: 7,8 m (Ph3РН+)
Пример 11
1,71 г (23,4 ммоль) диметилформамида, НС(O)N(СН3)2 в FEP колбе охлаждают до -25°С на бане этанол/сухой лед. При перемешивании с использованием магнитной мешалки, сначала к диметилформамиду медленно добавляют 0,566 г (28,3 ммоль) фтороводорода (HF) и затем при 0°С, на протяжении пяти минут, добавляют 9,92 г (23,3 ммоль) дифтортрис(пентафторэтил)фосфорана. После того как весь фосфоран был добавлен, реакционную смесь нагревают до комнатной температуры. Получили 12,2 г высокоплотного, практически твердого, белого вещества.
Небольшие количества этого вещества растворили в диметилформамиде и в ацетонитриле-D3, и эти растворы проанализировали при помощи19F и1Н ЯМР спектроскопии. CCl3F и TMS были использованы в качестве внутреннего стандарта.
19F ЯМР спектр указывает, что в этом случае кислота [(С2F5)3PF3]-Н+ образовалась в меридиональной конформации.
19F ЯМР (растворитель: ацетонитрил-D3): -43,64 dm (PF); -79,76 m (CF3); -81,35 m (2CF3); -87,08 dm (PF2); -115,35 dm (3CF2); J1P,F=889 Гц; J2P,F=906 Гц; J2P,F=90 Гц.
Небольшой сигнал остаточного фтороводорода снова наблюдался в19F ЯМР спектре (-182,30 м.д.).
1H ЯМР (растворитель: ацетонитрил-D3): 3,12 s (СН3); 3,27 s (СН3); 8,19 s (CH); 10,97 s (H+).
19F ЯМР (растворитель: диметилформамид): -43,88 dm (PF); -79,76 m (CF3); -81,35 m (2CF3); -87,08 dm (PF2); -115,35 dm (3CF2); J1P,F=889 Гц; J1P,F=906 Гц; J2P,F =90 Гц.
Небольшой сигнал остаточного фтороводорода снова наблюдался в19F ЯМР спектре (-182,30 м.д.).
Пример 12
4,92 г (81,9 ммоль) уксусной кислоты, СН3СООН, в FEP колбе охлаждают на ледяной бане. При перемешивании с использованием магнитной мешалки, сначала в уксусную кислоту медленно добавляют 0,424 г (21,2 ммоль) фтороводорода (HF) и затем, на протяжении пяти минут, добавляют 8,83 г (20,7 ммоль) дифтортрис(пентафторэтил)фосфорана. После того как фосфоран растворился и реакционная смесь нагрелась до комнатной температуры, получили 14,17 г бесцветного, прозрачного раствора.
Раствор проанализировали при помощи19F ЯМР спектроскопии. Спектр был записан с использованием FEP пробирки с ацетон-D6 пленкой в качестве внешнего затвора и CCl3F в качестве внешнего стандарта. В этом примере,19F ЯМР спектр показывает, что кислота [(С2F5)3PF3]-Н+ преимущественно образуется с меридиональной структурой.
19F ЯМР меридиональной формы: -44,65 dm (PF); -80,94 m (CF3); -82,58 m (2CF3);
-88,59 dm (PF2); -116,16 dm (3CF2); J1P,F=890 Гц; J2P,H =92 Гц.
1H ЯМР (ацетонитрил-D3 пленка): 2,43 s (СН3); 12,43 s (H+).
Пример 13
0,077 г раствора 40% по весу водной фтористоводородной кислоты (1,54 ммоль HF) смешивают с 0,124 г воды (в общем 9,44 ммоль воды) в FEP колбе. При перемешивании с использованием магнитной мешалки, этот раствор охлаждают на ледяной бане, и на протяжении двух минут добавляют 0,836 г (1,15 ммоль) дифтортрис(нонафтор-н-бутил)фосфорана. Фосфоран полностью растворился в течение последующих пяти минут, и образовался бесцветный, прозрачный раствор [(С4F9)3PF3]-H+ в воде.
Получили 1,037 г раствора трифтортрис(нонафтор-н-бутил)фосфорной кислоты с концентрацией 83,6% по весу в воде, с практически количественным выходом.
Раствор был проанализирован при помощи19F ЯМР спектроскопии. Спектр был записан с использованием FEP пробирки с ацетон-D6 пленкой в качестве внешнего затвора и CCl3F в качестве внешнего стандарта.
19F ЯМР, δ, м.д.: -44,91 dm (PF); -82,47 m (3CF3); -87,29 dm (PF2); -112,32 m (3CF2); -120,15 m (1CF2); -122,52 m (2CF2); -126,24 m (3CF2); J1P,F =904 Гц; J1P,F=929 Гц.
Пример 14
0,272 г (3,67 ммоль) сухого диэтилового эфира в FEP колбе охлаждают с использованием ледяной бани. При перемешивании с использованием магнитной мешалки, сначала в диэтиловый эфир медленно добавляют 0,043 г (2,15 ммоль) фтороводорода (HF) и затем, на протяжении пяти минут, добавляют 0,864 г (1,19 ммоль) дифтортрис(нонафтор-н-бутил)фосфорана. Во время добавления, фосфоран полностью растворился, и получили 1,17 г бесцветного, прозрачного раствора.
Раствор был проанализирован при помощи19F ЯМР спектроскопии. Спектр был записан с использованием FEP пробирки с ацетонитрил-D6 пленкой в качестве внешнего затвора и CCl3F в качестве внутреннего стандарта.
19F ЯМР спектр подтверждает образование кислоты [(С4F9)3PF3]-Н+ (III).
19F ЯМР, δ, м.д.: -44,17 dm (PF); -81,37 m (3CF2); -84,76 dm (PF2); -112,00 m (3CF2);
-119,18 m (1CF2); -121,32 m (2CF2); -125,15 m (3CF2); J1P,F=907 Гц; J1P,F=939 Гц.
Пример 15
0,68 г раствора 18,3% по весу водной фтористоводородной кислоты (6,22 ммоль HF) медленно добавляют при 0°С к 3,27 г (6,22 ммоль) трифторбис(нонафтор-н-бутил)фосфорану при перемешивании с использованием магнитной мешалки. Фосфоран полностью растворился в течение трех минут, и образовался бесцветный, прозрачный раствор Н+ [(C4F9)2PF4]- в воде. Получили 3, 95 г раствора тетрафторбис(нонафтор-н-бутил)фосфорной кислоты с концентрацией 85,9% по весу в воде с практически количественным выходом. Продукт отвечает формуле H+[(C4F9)2PF4]-·5Н2O.
Раствор был проанализирован при помощи19F ЯМР спектроскопии. Спектр был записан с использованием FEP пробирки для образцов внутри ЯМР пробирки с 5 мм толщиной стенки, с использованием ацетон-D6 пленки в качестве внешнего затвора и CCl3F в пленке в качестве стандарта.
19F ЯМР спектр, δ, м.д.: - 70,72 dm (PF4); -81,191 (2CF3); -115,15 dm (2CF2); -122,58 m (2CF2); -124,771 (2CF2); J1P,F=958 Гц; J2P,F=105 Гц; J4F,F=9,3 Гц; J4F,F=16,4 Гц;
Пример 16
0,713 г (1,67 ммоль) трифторбис(гептафтор-изопропил)фосфорана медленно добавляют (на протяжении 2 минут) при 0°С к раствору 0,217 г 20,8% по весу, водной фтористоводородной кислоты (2,26 ммоль HF) при перемешивании с использованием магнитной мешалки. На протяжении этого времени, фосфоран полностью растворился, и образовался бесцветный, прозрачный раствор тетрафторбис(гептафтор-изопропил)фосфорной кислоты, Н+[(i-С3F7)2PF4]-, в воде.
Раствор был проанализирован при помощи19F ЯМР спектроскопии. Спектр был записан с использованием FEP пробирки для образцов внутри ЯМР пробирки с 5 мм толщиной стенки, с использованием ацетон-D6 пленки в качестве внешнего затвора и CCl3F в пленке в качестве стандарта.
19F ЯМР спектр, δ, м.д.: -58,37 dm (PF4); -71,23 m (4CF3); -182,72 dm (2CF); J1P,F=955 Гц; J2P,F=78,4 Гц.
В19F ЯМР спектре был определен сигнал избытка HF при 168,89 м.д.
Пример 17
6,57 г (36,7 ммоль) диметилового эфира триэтиленгликоля (триглим) в FEP колбе охлаждают на ледяной бане. Сначала в триглим медленно добавляют 0,74 г (37,0 ммоль) фтороводорода (HF) и затем, на протяжении последующих пяти минут, добавляют 14,90 г (35,0 ммоль) дифтортрис(пентафторэтил)фосфорана при перемешивании реакционной смеси с использованием магнитной мешалки. Затем реакционную смесь перемешивают в течение последующего часа при комнатной температуре. Получили 22,19 г желто-коричневого, очень вязкого вещества. Небольшое количество этого вещества разбавили дихлорметаном, и раствор проанализировали при помощи19F ЯМР спектроскопии. Спектр был записан с использованием FEP пробирки для образцов внутри 5 мм ЯМР пробирки с ацетон-D6 пленкой в качестве внешнего затвора и CCl3F в качестве внутреннего стандарта.
19F ЯМР спектр показал, что в этом случае образовался 1 моль кислоты Н+[(С2F5)3PF3]- на один моль триглима.
19F ЯМР спектр меридиональной формы (приблизительно 90%): -44,41 dm (PF); -80,35 m (CF3); -82,00 m (2CF3); -87,94 dm (PF2); -115,87 dm (3CF2); J1P,F=890 Гц; J1P,F=891 Гц; J2P,F=90 Гц.
19F ЯМР спектр фациальной формы (приблизительно 10%): -68,29 dm; J1P,F=794 Гц (PF3 группа).
Некоторые сигналы фациальной формы перекрываются с сигналами меридиональной формы.
Пример 18
6,78 г (16,9 ммоль) полиэтиленгликоля 400 (PEG 400) поместили в FEP колбу и охладили с использованием ледяной бани. При перемешивании с использованием магнитной мешалки, сначала в PEG 400 медленно добавили 0,79 г (39,5 ммоль) фтороводорода (HF), а затем, на протяжении последующих трех минут, добавили 15,27 г (35,8 ммоль) дифтортрис(пентафторэтил)фосфорана. Затем эту реакционную смесь перемешивают при комнатной температуре в течение 10 часов. Получили 21,8 г желто-коричневого, густого, желатиноподобного вещества. Небольшое количество этого вещества разбавили дихлорметаном, и раствор проанализировали при помощи19F ЯМР спектроскопии. Спектр был записан с использованием FEP пробирки для образцов внутри 5 мм ЯМР пробирки с ацетон-D6 пленкой в качестве внешнего затвора и CCl3F в качестве внутреннего стандарта.
19F ЯМР спектр показывает, что в этом случае кислота и H+[(С3F5)3PF3]- образовалась в полимерной матрице, приблизительно 2 моль кислоты на моль полиетиленгликоля 400.
19F ЯМР спектр меридиональной формы (приблизительно 80%): -44,64 dm (PF); -80,48 m (CF3); -82,07 m (2CF3); -88,00 dm (PF2); -115,94 dm (3CF2); J1P,F=889 Гц; J1P,F=894 Гц; J2P,F=95 Гц.
19F ЯМР спектр фациальной формы (приблизительно 20%): -68,16 dm; J1P,F=788 Гц (PF3 группа).
Другие сигналы фациальной формы перекрываются с сигналами меридиональной формы.
Пример 19
Исходное вещество, дифтортрис(пентафторфенил)фосфоран, получают следующим образом: 0,711 г (1,34 ммоль) трис(пентафторфенил)фосфина в 5 см3 толуола смешивают с 0,300 г (1,77 ммоль) дифторида ксенона. Газ высвобождают путем нагревания реакционной смеси от 50 до 60°С. Реакция завершилась в течение 20 минут. Затем растворитель упаривают при пониженном давлении. Выделили 0,750 г белого, твердого вещества. Выход дифтортрис(пентафторфенил)фосфорана составил 98,5 молярных %.19F ЯМР спектр соединения соответствует спектру, известному из литературы (М.Fild и R.Schmutzler, J.Chem. Soc. (A), 1969, страницы 840-843).
0,50 г сухого диэтилового эфира и 0,107 г (0,187 ммоль) дифтортрис(пентафторфенил)фосфорана в FEP колбе охлаждают на ледяной бане. Сначала добавляют 0,050 г (2,5 ммоль) фтороводорода, HF, и затем, на протяжении двух минут, добавляют 0,3 г триэтиламина при перемешивании реакционной смеси с использованием магнитной мешалки. В течение добавления, фосфоран полностью растворился, и гидрофторид триэтиламмония выпал в осадок. Затем осадок отделяют и растворитель упаривают при пониженном давлении. Выделили 0,13 г вязкого вещества. Небольшое количество этого вещества растворили в ацетоне-D6, и этот раствор проанализировали при помощи19F и1Н ЯМР спектроскопии. Спектр подтвердил образование трифтортрис(пентафторфенил)фосфорной кислоты, [(С6F5)3PF3]-Н+, в виде комплекса с триэтиламином.
19F ЯМР спектр (растворитель: ацетон-D6; стандарт: CCl3F, внутренний), δ, м.д.: -6,73 dm (PF); -39,71 dm (PF2); -132,06 m (4F); -134,75 m (2F); -160,421 (1F); -161,24 t (2F); -166,20 m (6F); J1P,F=811 Гц; J1P,F=797 Гц; J3F,F=20 Гц.
1Н ЯМР спектр (растворитель: ацетон-D6; стандарт: TMS, внутренний), δ, м.д.: 1,27 t (3СН3), 3,04 q (3СН2), 12,11 s (NH+); J3H,H=7,3 Гц.
Пример 20
6,36 г (70,6 ммоль) сухого диметилкарбоната, (СН3О)2СО, в FEP колбе охлаждают с использованием ледяной бани. Сначала к диметилкарбонату медленно добавляют 10,99 г (25,8 ммоль) дифтортрис(пентафторэтил)фосфорана и затем к реакционной смеси, на протяжении 5 минут, добавляют 0,615 г (30,7 ммоль) фтороводорода (HF) при перемешивании с использованием магнитной мешалки. После того как фосфоран растворился, реакционную смесь нагревают до комнатной температуры. Получили 17,8 г бесцветного, прозрачного раствора.
Раствор был проанализирован при помощи19F ЯМР спектроскопии. Спектр был записан с использованием FEP пробирки для образцов внутри 5 мм ЯМР пробирки с ацетон-D6 пленкой в качестве внешнего затвора и CCl3F в качестве внутреннего стандарта.
19F ЯМР спектр показал, что в этом случае образовалась меридиональная структура кислоты [(С2F5)3PF3]-H+.
19F ЯМР спектр: -44,34 dm (PF); -80,26 m (CF3); -81,93 m (2CF3); -87, 78 dm (PF2); -115,85 dm (3CF2); J1P,F=889 Гц; J1P,F=92 Гц.
1Н ЯМР спектр (ацетон-D3 пленка, стандарт: TMS): 4,49 s (СН3); 17,54 s (H+).
Применение трифтортрис(перфторалкил)фосфорных кислот
Пример 21
12,15 г 83,2% по весу, водной трифтортрис(пентафторэтил)фосфорной кислоты (полученной, как описано в Примере 1) нейтрализуют при 0°С при перемешивании путем добавления небольшими порциями 0,95 г моногидрата гидроксида лития. Получили 13,1 г прозрачного раствора трифтортрис(пентафторэтил)фосфата лития с концентрацией 78,2% по весу в воде. Выход трифтортрис(пентафторэтил)фосфата лития был практически количественным. Раствор был проанализирован при помощи19F ЯМР спектроскопии. Спектр был записан с использованием FEP пробирки для образцов внутри 5 мм ЯМР пробирки с ацетон-D6 пленкой в качестве внешнего затвора и CCl3F в качестве внутреннего стандарта.
19F ЯМР спектр, δ, м.д.: -43,48 dm (PF); -79,54 m (CF3); -81,30 m (2CF3); -88,07 dm (PF2); -114,21 dm (3CF2); J1P,F=891 Гц; J1P,F=908 Гц; J2P,F=92 Гц.
Пример 22
20,44 г 83,2% по весу, водной трифтортрис(пентафторэтил)фосфорной кислоты (полученной, как описано в Примере 1) нейтрализуют путем добавления небольшими порциями 1,42 г карбоната лития при перемешивании. Выход составил 21,0 г прозрачного раствора трифтортрис(пентафторэтил)фосфата лития с концентрацией 82,0% по весу в воде. Выход трифтортрис(пентафторэтил)фосфата лития был практически количественным. Раствор был проанализирован при помощи19F ЯМР спектроскопии. Спектр был записан с использованием FEP пробирки для образцов внутри 5 мм ЯМР пробирки с ацетон-D6 пленкой в качестве внешнего затвора и CCl3F в качестве внутреннего стандарта.
19F ЯМР спектр, δ, м.д.: -43,31 dm (PF); -79,44 m (CF3); -81,19 m (2CF3); -87,96 dm (PF2); -114,20 dm (3CF2); J1P,F =891 Гц; J1P,F=907 Гц; J2P,F=92 Гц.
Пример 23
А раствор 6,38 г (14,3 ммоль) трифтортрис(пентафторэтил)фосфорной кислоты в 1,9 г диэтилового эфира (полученной аналогично способу Примера 7) нейтрализуют путем медленного добавления 6,0 см3 (15,0 ммоль) 2,5 M раствора бутиллития в гексане при 0°С при перемешивании. Смесь перемешивают в течение последующего получаса, и комплекс трифтортрис(пентафторэтил)фосфата лития с диэтиловым эфиром (нижний, бледно-желтый, вязкий слой) отделяют от гексана (верхний слой).19F ЯМР спектр раствора диэтилового эфира показал на присутствие трифтортрис(пентафторэтил)фосфата лития, который был получен с практически количественным выходом. Спектр был записан с использованием FEP пробирки для образцов внутри 5 мм ЯМР пробирки с ацетон-D6 пленкой в качестве внешнего затвора и CCl3F в качестве внутреннего стандарта.
19F ЯМР спектр меридиональной формы (приблизительно 85 молярных %): -47,19 dm (PF); -79,80 m (CF3); -81,34 m (2CF3); -88,77 dm (PF2); -114,84 dm (3CF2); J1P,F=867 Гц; J1P,F=905 Гц; J2P,F=92 Гц.
19F ЯМР спектр фациальной формы (приблизительно 15 молярных %): -66,88 dm; J1P,F=776 Гц (PF3 группа).
Другие сигналы фациальной формы перекрываются сигналами меридиональной формы.
Пример 24
10,77 г 83,2% по весу, водной трифтортрис(пентафторэтил)фосфорной кислоты (полученной, как описано в Примере 1) разбавляют 10 см3 воды и нейтрализуют 1,52 г гидроксикарбоната магния (Мерк, доля Mg катиона составляет по крайней мере 24%) небольшими порциями при охлаждении на ледяной бане и при перемешивании. Избыток гидроксикарбоната магния отфильтровывают, и раствор трифтортрис(пентафторэтил)фосфата магния в воде анализируют при помощи19F ЯМР спектроскопии. Спектр был записан с использованием FEP пробирки для образцов внутри 5 мм ЯМР пробирки с ацетон-D6 пленкой в качестве внешнего затвора и CCl3F в качестве внутреннего стандарта.
19F ЯМР спектр, δ, м.д.: -43,34 dm (PF); -79,35 m (CF3); -80,99 m (2CF3), -88,11 dm (PF2); -114,54 dm (3CF2); J1P, F=874 Гц; J1P,F=899 Гц; J2P,F=91 Гц.
Пример 25
7,19 г 83,2% по весу, водной трифтортрис(пентафторэтил)фосфорной кислоты (полученной, как описано в Примере 1) разбавляют 10 см3 воды при охлаждении на ледяной бане и при перемешивании, и нейтрализуют путем добавления небольшими порциями 1,76 г гидроксикарбоната цинка (Флука, доля Zn катиона >58%). Избыток гидроксикарбоната цинка отфильтровывают, и раствор трифтортрис(пентафторэтил)фосфата цинка в воде анализируют при помощи19F ЯМР спектроскопии. Спектр был записан с использованием FEP пробирки для образцов внутри 5 мм ЯМР пробирки с ацетон-D6 пленкой в качестве внешнего затвора и CCl3F в качестве внутреннего стандарта.
19F ЯМР спектр, δ, м.д.: -43,40 dm (PF); -79,56 m (CF3); -81,23 m (2CF3); -87,91 dm (PF2); -114,45 dm (3CF2); J1P,F=890 Гц; J1P,F=913 Гц; J2P,F=96 Гц.
Пример 26
10,78 г 83,2% по весу, водной трифтортрис(пентафторэтил)фосфорной кислоты (полученной, как описано в Примере 1) разбавляют 10 см3 воды на ледяной бане при перемешивании и нейтрализуют добавлением небольшими порциями 2,78 г гидроксикарбоната меди (II). Избыток гидроксикарбоната меди отфильтровывают, и раствор трифтортрис(пентафторэтил)фосфата меди в воде анализируют при помощи19F ЯМР спектроскопии. Спектр был записан с использованием FEP пробирки для образцов внутри 5 мм ЯМР пробирки с ацетон-D6 пленкой в качестве внешнего затвора и CCl3F в качестве внутреннего стандарта.
19F ЯМР спектр меридиональной формы, δ, м.д.: -47,88 dm (PF); -84,03 m (CF3); -85,59 m (2CF3); -92,70 dm (PF2); -119,27 dm (3CF2); J1P,F=895 Гц; J2P,F=87 Гц.
Небольшой сигнал фациальной формы соли меди также присутствовал в спектре:
-71,44 d (PF3); J1P,F=790 Гц.
Пример 27
3,10 г 73,0% по весу, водной трифтортрис(пентафторэтил)фосфорной кислоты (полученной, как описано в Примере 3) разбавляют 5 см3 воды при охлаждении на водяной бане и при перемешивании, и нейтрализуют добавлением небольшими порциями 0,74 г карбоната серебра. Избыток карбоната серебра отфильтровывают, и раствор трифтортрис(пентафторэтил)фосфата серебра в воде анализируют при помощи19F ЯМР спектроскопии. Спектр был записан с использованием FEP пробирки для образцов внутри 5 мм ЯМР пробирки с ацетон-D6 пленкой в качестве внешнего затвора и CCl3F в качестве внутреннего стандарта.
19F ЯМР спектр, δ, м.д.: -42,60 dm (PF); -78,66 m (CF3); -80,35 m (2CF3); -87,41 dm (PF2); -114,06 dm (3CF2); J1P,F=890 Гц; J2P,F=92 Гц.
Пример 28
Раствор 16,68 г (37,4 ммоль) трифтортрис(пентафторэтил)фосфорной кислоты в 14,52 г диэтилового эфира (полученной, как описано в Примере 7) медленно добавляют при комнатной температуре при перемешивании к 20,50 г 50% по весу раствора тетра-(н-бутил)фосфоний хлорида (10,25 г или 34,8 ммоль) в толуоле. Смесь перемешивают в течение последующих 30 минут, и растворитель смеси отгоняют при пониженном давлении порядка 13,3 Па. Таким образом получают 24,46 г белого, твердого вещества. Выход трифтортрис(пентафторэтил)фосфата тетра(н-бутил)фосфония был практически количественным. Точка плавления после кристаллизации из смеси метанол/вода составляет 73-74°С.
Анализ: С 37,31%, Н 5,06%; рассчитано: 37,51%, Н 5,15%.
19F ЯМР спектр (растворитель: ацетон-D6; стандарт: CCl3F внутренний): -43,83 dm (PF); -79,72 m (CF3); -81,23 m (2CF3); -86,77 dm (PF2); -115,43 dm (3CF2); J1P,F=890 Гц; J1P,F=905 Гц; J2P,F=92 Гц.
1Н ЯМР спектр (растворитель: ацетон-D6; стандарт: TMS внутренний): 0,95 t (4СН3), 1,57 m (8CH2); 2,34 m (4CH2).
Пример 29
11,37 г 20% по весу, водного раствора гидроксида тетраэтиламмония медленно добавляют (на протяжении 2 минут) при перемешивании и охлаждении на ледяной бане к 8,28 г 83,2% по весу водной трифтортрис(пентафторэтил)фосфорной кислоты (полученной, как описано в Примере 1). Реакционную смесь разбавляют 100 см3 воды и перемешивают при комнатной температуре в течение последующих 10 минут. Белый осадок отфильтровывают и дважды промывают 30 см3 воды. После высушивания в течение ночи в атмосфере воздуха, получили 8,55 г белого, твердого вещества. Выход трифтортрис(пентафторэтил)фосфата тетраэтиламмония составил 96,3%. Анализ: С 29,14%, Н 3,40%, N 2,49%; рассчитано: С 29,23%, Н 3,50%, N 2,43%. Точка плавления после кристаллизации этого продукта из смеси метанол/вода осталась неизменной при 95°С.
19F ЯМР спектр (растворитель: ацетон-D6; стандарт: CCl3F внутренний): -43,78 dm (PF); -79,69 m (CF3); -81,24 m (2CF3); -86,80 dm (PF2); -115,36 dm (3CF2); J1P,F=889 Гц; J1P,F=906 Гц; J2P,F=89 Гц.
1Н ЯМР спектр (растворитель: ацетон-D6; стандарт: TMS внутренний): 1,39 tm (4СН3), 3,48 q (4СН2); J3H,H=7,3 Гц.
Пример 30
10,85 г 73, 0% по весу, водной трифтортрис(пентафторэтил)фосфорной кислоты (полученной, как описано в Примере 3) медленно добавляют на протяжении 3 минут при перемешивании и охлаждении на бане лед-вода к 81,47 г водному гидроксиду тетраметиламмония (получают из 6,47 г 25% по весу водного (СН3)4N+-ОН путем разбавления 75 см3 воды). Реакционную смесь перемешивают при комнатной температуре в течение последующих 10 минут. Белый осадок отфильтровывают и трижды промывают 30 см3 воды. После высушивания в течение ночи в атмосфере воздуха, получили 8,55 г белого, твердого вещества. Выход трифтортрис(пентафторэтил)фосфата тетраметиламмония составил 95,2%. Точка плавления равняется 112°С.
19F ЯМР спектр (растворитель: ацетон-D6; стандарт: CCl3F внутренний): -43,70 dm (PF); -79,70 m (CF3); -81,24 m (2CF3); -86,75 dm (PF2); -115,43 dm (3CF2); J1P,F=889 Гц; J1P,F=909 Гц; J2P,F=88 Гц.
1Н ЯМР спектр (растворитель: ацетон-D6 ; стандарт: TMS внутренний): 3,42 s (4СН3).
Пример 31
3,95 г 85,9% по весу водной тетрафторбис(нонафтор-н-бутил)фосфорной кислоты (полученной, как описано в Примере 15) медленно добавляют на протяжении 3 минут к 54,58 г водному гидроксиду тетраэтиламмония (получают из 4,58 г 20% по весу, водного раствора (C2H5)4N+-ОН путем разбавления 50 см3 воды) при перемешивании и при охлаждении реакционной смеси на ледяной бане. Реакционную смесь перемешивают при комнатной температуре в течение последующих 10 минут. Белый осадок отфильтровывают и дважды промывают 10 см3 воды. После высушивания в течение ночи в атмосфере воздуха, получили 3,05 г белого, твердого вещества. Выход тетра-фторбис(нонафтор-н-бутил)фосфата тетраэтиламмония составил 72,6%.
19F ЯМР спектр (растворитель: ацетон-D6; стандарт: CCl3F внутренний): -70,20 dm (PF4); -80,87 m (2CF3); -116,04 dm (2CF2); -122,34 m (2CF2); -124,61 t (2CF2); J1P,F=930 Гц; J2P,F=94 Гц; J4P,F=15,7 Гц.
1Н ЯМР спектр (растворитель: ацетон-D6; стандарт: TMS внутренний): 1,38 tm (4СН3), 3, 48 q (4CH2); J3H,H=7,3 Гц.
Пример 32
0,030 г литиевого порошка добавляют небольшими порциями при комнатной температуре и при перемешивании с использованием магнитной мешалки к раствору 1,72 г трифтортрис(пентафторэтил)фосфорной кислоты в диметилкарбонате, полученной как описано в Примере 20. Вначале, реакционная смесь реагирует бурно с выделением водорода. Завершение реакции реагирующих веществ было достигнуто путем нагревания реакционной смеси до 60°С в течение 30 минут.
После отделения избытка литиевого порошка, раствор трифтортрис(пентафторэтил)фосфата лития в диметилкарбонате анализируют при помощи19F ЯМР и1Н ЯМР спектроскопии. Спектр был записан с использованием FEP пробирки для образцов внутри 5 мм ЯМР пробирки с ацетон-D6 пленкой в качестве внешнего затвора и CCl3F в качестве внутреннего стандарта.
19F ЯМР спектр меридиональной формы (≈85 молярных %): -44,53 dm (PF); -79,90 m (CF3); -81,71 m (2CF3); -87,77 dm (PF2); -115,23 dm (3CF2); J1P,F=888 Гц; J2P,F=91 Гц.
19F ЯМР спектр фациальной формы (≈15 молярных %): -67,98 dm; J1P,F=785 Гц (PF3 группа). Другие сигналы фациальной формы перекрываются с сигналами меридиональной формы.
1Н ЯМР спектр (ацетон-D6 пленка, стандарт: TMS): 4,35 s (СН3).
Пример 33
16,09 г трифтортрис(пентафторэтил)фосфорной кислоты в диметилкарбонате, полученной как описано в Примере 20, разбавляют 6,78 г сухого диметилкарбоната и вводят в реакцию с 0,25 г гидрида лития, который добавляют к реакционной смеси небольшими порциями при перемешивании с использованием магнитной мешалки и при охлаждении на ледяной бане. Вначале, эта реакционная смесь реагирует бурно с выделением водорода. После добавления всего гидрида лития, смесь нагревают до комнатной температуры и дополнительно перемешивают в течение часа.
После отделения избытка гидрида лития, раствор трифтортрис(пентафторэтил)фосфата лития в диметилкарбонате анализируют при помощи19F ЯМР и1Н ЯМР спектроскопии. Спектр был записан с использованием FEP пробирки для образцов внутри 5 мм ЯМР пробирки с ацетон-D6 пленкой в качестве внешнего затвора и CCl3F в качестве внутреннего стандарта.
19F ЯМР спектр меридиональной формы (≈ 85 молярных %): -44,07 dm (PF); -80,12 m (CF3); -81,77 m (2CF3), -87,52 dm (PF2); -115,17 dm (3CF2): J1P,F=888 Гц; J2P,F=87 Гц.
19F ЯМР спектр фациальной формы (≈15 молярных %): -68,40 dm; J1P,F=795 Гц (PF3 группа). Другие сигналы фациальной формы перекрываются с сигналами меридиональной формы.
1Н ЯМР спектр (ацетон-D3 пленка, стандарт: TMS): 4,21 s (СН3).
Этот раствор может быть применен непосредственно для получения электролитов для литиевых батарей.
Реферат
Настоящее изобретение относится к фторированным фосфорным кислотам общей формулы [RуPF6-у]-H+ [I], в которой у=1, 2 или 3, лиганды R являются одинаковыми и R представляет собой перфторированную C1-C8-алкильную или арильную группу или частично фторированную C1 -C8-алкильную или арильную группу, в которой некоторые атомы F или Н могут быть заменены хлором. Настоящее изобретение, кроме того, относится к способу получения описанных выше кислот взаимодействием перфторалкилфосфорана с фтороводородом в присутствии подходящего растворителя и/или акцептора протонов, к солям, содержащим катион и анион описанной выше кислоты, и к способу получения солей. Кислоты [I] легки в получении, имеют высокую активность протона и стабильны при комнатной температуре в высококонцентрированном растворе. 5 н. и 13 з.п. ф-лы.
Формула

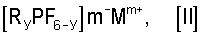


Комментарии