Гомогенный катализатор для синтеза метанола, способ его получения и способ получения метанола - RU2062648C1
Код документа: RU2062648C1
Чертежи

Описание
Изобретение относится к новым гомогенным катализаторам для синтеза метанола из СО и Н2, способу его получения и способу получения метанола с использованием гомогенного катализатора.
При использовании в синтезе метанола традиционных твердых гранулированных катализаторов, как правило, образуются участки перегрева в реакторе, препятствующие эффективному протеканию процесса. Более того, катализаторы традиционного типа, например катализаторы в форме таблетки, обычно показывают степень газовой конверсии примерно 16-30% за проход и требуют обязательной рециркуляции исходного газа для обеспечения работы технологической системы с экономичным КПД. Хотя частичное окисление природного газа приводит к выходу идеального газа в качестве сырья для синтеза метанола, указанное частичное окисление нельзя использовать для получения загружаемого газа в традиционных каталитических системах, так как такие системы требуют, чтобы исходный сырьевой газ содержал очень низкие концентрации инертных газов, особенно азота. Инертные газы, например азот, которые содержатся в потоке рециклового газа для эффективности процесса, следует удерживать на низком уровне. Для получения исходных сырьевых газов с низким содержанием инертных газов, как правило, приходится проводить частичное окисление при использовании кислорода, и такой подход делает этот способ получения сырьевого газа экономически неприемлемым.
Кроме того, как правило, традиционные способы требуют проведения синтеза при высоких температурах (250oС) и высоком давлении (53,79 кг/см2), и при этом они ограничены низкой степенью конверсии в равновесном состоянии (60%).
В литературе также описано использование гомогенных каталитических систем для проведения синтеза метанола или других низших алифатических спиртов из окиси углерода и водорода в жидкофазной среде.
Так, известна гомогенная каталитическая система, включающая трирутений додекарбонил, промотор
из редкоземельных металлов и окись три-n- пропилфосфина в качестве растворителя. Синтез с использованием этой системы ведут при температуре 100-400oС и давлении 500-15000 psi. [1]
Известна также гомогенная каталитическая система, включающая алкоголят щелочного металла, медный катализатор, метанол и сорастворитель в количестве по меньшей мере 50% (объемн.). Процесс синтеза
метанола ведут при температурах в пределах 90-130oС и давлении 75-900 psi. [2]
Наиболее близкой по числу совпадающих признаков и достигаемому результату для синтеза низших
алифатических спиртов является гомогенная каталитическая система, включающая карбонил переходного металла дикарбонил димарганца, формиат, бикарбонат или карбонат щелочного или щелочно-земельного
металла, метанол и сорастворитель. Синтез ведут при 200- 300oС и давлении 100-400 атм.
Указанный катализатор получают введением в органический раствор, содержащий метанол и
дикарбонил димарганца, формиата, бикарбоната или карбоната щелочного или щелочно-земельного металла. [3]
Известные гомогенные каталитические составы предлагаемого изобретения устраняют часть
недостатков, присущих традиционным твердофазным катализаторам синтеза метанола.
Так, вследствие того, что гомогенный катализатор используют в растворе, отвод тепла в результате взаимодействия можно осуществлять независимо от кинетики процесса. Таким образом, в отличие от традиционных методов оптимальный режим можно изменять как с химической, так и с теплотехнической точки зрения в технологической системе по отдельности, оптимизируя отвод тепла и регулируя скорость протекания процесса.
При использовании катализаторов предлагаемого изобретения синтез метанола можно проводить при низких температурах и давлении с высокой степенью конверсии в равновесном состоянии.
Более того, предлагаемая каталитическая система в отличие от традиционных позволяет использовать способ частичного окисления природного газа для получения сырьевого синтез-газа, так как высокая степень конверсии исключает необходимость использования рециклового газового потока и тем самым позволяет утилизировать воздух вместо кислорода, что приводит к сокращению больших затрат на генерацию кислорода. Следующее улучшение, являющееся результатом высокой эффективности предлагаемого способа, позволяющего проводить процесс конверсии за один проход, заключается в том, что атмосферный азот, вводимый в систему через стадию частичного окисления воздуха, выходит из реактора при давлении реакции, при этом он может увеличиваться в объеме с образованием энергии, например, для сжатия воздуха.
Настоящее изобретение предлагает гомогенный катализатор, который делает возможным получение метанола из синтез-газа в качестве сырья, содержащего инертные газы, при низких температурах и давлениях, а также при высоких показателях газовой конверсии. Указанный катализатор значительно улучшает реакционные условия и эффективность процесса по сравнению с традиционными катализаторами, используемыми в синтезе метанола.
Получение гомогенного катализатора настоящего изобретения не вызывает никаких трудностей, при этом он проявляет высокую активность по сравнению с традиционными катализаторами, используемыми в синтезе метанола, делает возможным использование низких температур и давлений в реакторе, позволяет использовать сырьевой газ, содержащий инертные газы в дополнение к СО и Н2, и приводит к высоким показателям газовой конверсии.
Предлагаемый гомогенный катализатор для синтеза метанола из окиси углерода и водорода при низких температурах и давлении содержит комплекс карбонила
переходного металла, выбранного из группы, включающей медь, никель, кобальт, молибден, рутений и их смеси, и алкоголятный компоненталкоголят общей формулы: AM-OR, где AM Na+, К+,
N(Me4)+, OR- остаток С1-С5-алифатического спирта, растворитель метанол и органический сорастворитель при следующем соотношении компонентов,
ммоль:
Комплекс переходного карбонила металла 1-20
Алкоголятный компонент 40-800
Растворитель метанол не более 2500
Сорастворитель не более 1500
При этом
соотношение (в молях) комплекса карбонила переходного металла и алкоголятного компонента составляет 1:2-800.
Отличием предлагаемого катализатора от наиболее близкого по качественному и количественному составу катализатора [3] является то, что он содержит в качестве комплекса карбонила переходного металла комплекс, включающий карбонил переходного металла, выбранного из группы: медь, никель, кобальт, молибден, рутений и их смеси и алкоголятный компонент алкоголят общей формулы AMOR, где AM- К+, Na+, N(Me4)+, OR- остаток C1-C5 алифатического спирта при вышеуказанных соотношениях.
Предпочтительными являются катализаторы, содержащие в качестве карбонила переходного металла карбонилы металла, выбранные из группы, состоящей из никеля, молибдена и меди, преимущественно никеля; в качестве сорастворителя - сорастворитель, выбранный из группы: тетрагидрофуран, р-диоксан, трет.-амиловый или трет.-бутиловый спирт, полиэтиленгликоль.
Наиболее предпочтительны катализаторы, содержащие в качестве комплекса карбонила переходного металла тетракарбонил никеля, в качестве алкоголята - метилат, растворенные в системе сорастворителей, состоящих из метанола и тетрагидрофурана или метанола и р-диоксана или метанола и полиэтиленгликоля или его диметилового эфира или диметилового эфира триэтилен- или тетраэтиленгликоля.
Согласно настоящему изобретению предлагается также способ получения вышеуказанного гомогенного катализатора, который заключается в том, что карбонил переходного металла или его предшественник, выбранные из группы металла: медь, никель, кобальт, молибден, рутений или их смеси, подвергают взаимодействию с реагентом, который образует алкоголят щелочного металла или аминопроизводного в присутствии системы метанола и органического сорастворителя, выбранного из группы, включающей тетрагидрофуран, р-диоксан, трет.-амиловый или трет.-бутиловый спирт, полиэтиленгликоль.
Отличием предлагаемого способа от наиболее близкого способа получения гомогенного катализатора [3] является использование вышеуказанного комплекса карбонила переходного металла или его предшественника реагента, образующего в условиях реакции алкоголят щелочного металла или аминопроизводного, и системы растворителей.
Предпочтительным является использование в качестве карбонила переходного металла тетракарбонил никеля, в качестве реагента, образующего алкоголят -ион С1-С5 -алкоголят щелочного металла, преимущественно метилат калия или тетраметиламмония. Желательно использование в качестве алкоголятного реагента смеси метилата калия и метилата меди, в качестве карбонила переходного металла тетракарбонил никеля, которые в процессе взаимодействия образуют метилат-ион и комплекс тетракарбонил никеля/карбонил меди. Возможно также введение в процесс карбонила переходного металла на носителе, в качестве которого преимущественно используют цеолит.
Задачей данного изобретения является также разработка способа получения метанола из окиси углерода и водорода с использованием нового гомогенного катализатора.
Наиболее близким по числу совпадающих признаков к достигаемому результату является способ получения метанола в смеси с этанолом взаимодействием окиси углерода и водорода в присутствии каталитической системы, включающей карбонил переходного металла трирутений додекакарбонил, промотор галоидсодержащее соединение, растворитель окись трипропилфосфина. Процесс ведут при 100-350oС, преимущественно 195-240oС и давлении 35-1400 атм.
Основным недостатком способа является преобладающее количество этанола.
Способ получения метанола согласно данному изобретению состоит в контактировании синтез-газа с гомогенным катализатором, включающим комплекс карбонила переходного металла, выбранного из группы, включающей медь, никель, кобальт, молибден, рутений или их смеси, и алкоголятный компонент алкоголят общей формулы AMOR, где AM К+, Na+, NO(Me)4, OR- - остаток С1-С5 алифатического спирта, растворенный в метаноле или в смеси метанола и сорастворителя, при соотношении компонентов, ммоль: комплекс карбонила переходного металла 1-20; алкоголятный компонент 40-800; растворитель метанол до 2500; сорастворитель до 1500 при соотношении комплекса переходный металл:алкоголятный компонент AMOR/l:2-800.
Преимущественно в качестве переходного металла использовать никель, в качестве алкоголята С1-С5-алкоголят, предпочтительно метилат К или Na, а метанол использовать совместно с сорастворителем, выбранным из группы: тетрагидрофуран, метилгетрагидрофуран, р-диоксан, трет-амиловый спирт, полиэтиленгликоль, диметиловый эфир триэтилен- или тетраэтиленгликоля. Желательно использовать в качестве комплекса карбонила переходного металла тетракарбонил никеля и метилат, полученный из метилата К, и в качестве системы растворителей метанол и сорастворитель, выбранный из группы, включающей тетрагидрофуран, р-диоксан, полиэтиленгликоль, диметиловый эфир триэтилен- или тетраэтиленгликоля.
Оптимальными условиями проведения процесса являются режим низкой температуры в интервале от 100 до 150oС и низкого давления 7,03- 10,55 атм.
В реакционную массу желательно вводить инактиватор карбонила переходного металла, в частности вводить инактиватор катиона, связанного с алкоголятным ионом. Преимущественно вводить полиэтилен, который реагирует аналогично краун-эфирам.
Используемый синтез-газ может быть разбавлен инертным газом. Способ получения метанола желательно проводить введением гомогенного катализатора, состоящего из тетракарбонила никеля и метилата калия в герметичный реактор, с последующим введением СО и Н2 при начальном давлении 52,73 атм и конечном давлении примерно 8,08 атм для перевода катализатора в жидкую фазу с выделением метанола из полученного раствора.
Гомогенный катализатор настоящего изобретения состоит из двух компонентов, растворенных в метаноле или смеси метанола с сорастворителем. Указанная двухкомпонентная система включает комплексное карбонильное соединение переходного металла и алкоголята. Переходный металл выбирают из группы, состоящей из меди, никеля, кобальта, рутения, молибдена или их смесей. В качестве предпочтительного переходного металла используют никель.
Предлагаемый двухкомпонентный катализатор представлен в растворе метанола, образуемого из метанольного продукта в реакторе. Можно также использовать любой сорастворитель, предпочтительно органический кислородсодержащий сорастворитель, который обладает способностью смешиваться с метанолом. К предпочтительным сорастворителям относятся тетрагидрофуран, 2-метилтетрагидрофуран, пара-диоксан, третичный амиловый спирт, трет.-бутанол, многоатомные спирты производные гликолей, например, полиэтиленгликоль и триглим.
Поскольку предлагаемый катализатор обладает высокой активностью, каталитический способ получения метанола из СО и Н2 можно проводить в умеренном режиме. Указанный катализатор действует эффективно при температурах в интервале от 20 до 150oС, причем температурный интервал от 100 до 150oС предпочтителен. Аналогичным образом давление, преимущественно создаваемое в реакторе, может быть ниже 3,515 кг/см2 и выше 21,09 кг/см2.
В качестве сырьевого газа для производства метанола в случае использования предлагаемого изобретения предпочтителен синтез-газ, получаемый путем частичного окисления природного газа в присутствии воздуха. Указанный сырьевой газ может быть разбавлен инертными газами, например,такими как азот и метан. В сырьевом газе возможно присутствие незначительных количеств сероводорода, двуокиси углерода и воды, однако предпочтительно использовать почти безводный, не содержащий СО2 синтез-газ.
Предлагаемый гомогенный катализатор представляет собой продукт взаимодействия двух реагентов, используемых для получения указанного катализатора, в частности соединение переходного металла и алкоголят. Соединение переходного металла представляет собой вещество, способное образовывать карбонил соответствующего переходного металла в метанольном растворе. Соединение переходного металла может быть карбонилом металла или карбонильным предшественником. Термин "карбонильный предшественник", как используется в данном описании, означает материал, который при растворении в метаноле образует карбонил переходного металла in situ. Карбонил переходного металла или предшественник карбонила переходного металла можно использовать при получении предлагаемого катализатора в своей одноядерной или кластерной форме. В случае, когда предпочтительным переходным металлом является никель, любое производное карбонила никеля, например тетракарбонил никеля Ni(CO)4, либо любой предшественник карбонила никеля, обладающий способностью к образованию карбонильного никелата в метанольном растворе, можно использовать в процессе получения этого гомогенного катализатора. Возможно также использование биметаллической системы, где применяют смесь из двух карбонильных соединений переходных металлов либо их предшественников, например карбонила никеля и карбонила молибдена. В другом случае использования биметаллической системы карбонил переходного металла либо его предшественник, например тетракарбонил никеля, используют вместе с реагентом, дающим алкоголят, например метилат натрия, и, кроме того, можно использовать также алкоголят переходного металла, например метилат меди.
Карбонил переходного металла или его продукт-предшественник можно также вводить в раствор метанола на носителе с образованием на его поверхности, например, карбонила никеля. В этом случае гомогенный катализатор на носителе типа цеолит может действовать либо как гомогенный, либо как гетерогенный катализатор.
Вторым реагентом, используемым в процессе получения предлагаемого гомогенного катализатора, является материал, дающий алкоксидный компонент. В качестве указанного второго реагента можно использовать соединение щелочного металла или амина, которое образует или приводит к образованию алкоголятов в присутствии системы метанол/растворитель, где алкоксильная группа образована из алифатических спиртов с 1-5 атомами углерода.
Природа R в группе OR не имеет критического значения. В присутствии метанола в реакторе преобладающим элементом, влияющим на синтез метанола, является анион метилата Оме-. Таким образом, начально используемый алкоголят вступает в реакцию согласно следующему уравнению: RО- + МеОН - ROH + МеО+.
В случае, когда алкоголятный компонент вводят в реактор в процессе получения гомогенного катализатора, можно также вводить реагент, который инактивирует катион или ион-неалкоголят во время физико-химического взаимодействия для повышения концентрации алкоголят-иона в растворе. К подходящим комплексообразующим и/или координационным агентам, или лигандам для этих целей относятся краун-эфиры, криптанды и полидентаты катионов щелочных и щелочно-земельных металлов. К предпочтительным комплексообразователям и/или лигандам координационных соединений относятся 2,2'-дипиридил, диметиловый эфир диэтиленгликоля или 15-краун-5 с натрием, тетраметилендиамин или триэтаноламин с литием и дибензо-18-краун-6 с калием (см.Chem. Rev. вып.79, стр. 415, 1979).
В предпочтительном составе гомогенного катализатора в качестве переходного металла, как его компонента, используют комплекс из тетракарбонила никеля, а в качестве алкоголята используют метилат-анион, МеО-, причем связываемым катионом является либо щелочной металл (Na, К), либо тетраметиламмоний; указанные катионы повышают растворимость компонентов катализатора, растворенных в метанольных растворах. Соотношение металлической и алкоголятной составляющих в составе катализатора варьируется в зависимости от того, используется ли метанол в чистом виде в качестве растворителя либо в смеси с другим растворителем. Если метанол в чистом виде используют в качестве растворителя, предпочтительное молярное соотношение составляет 1:100, в то время как при использовании тетрагидрофурана в качестве сорастворителя предпочтительное молярное соотношение составляет 1:0,5.
При использовании гомогенных катализаторов предлагаемого изобретения достигнута скорость подачи сырья для синтеза метанола более 21,09 кг/см2/мин. Простота указанного рассматриваемого катализатора заключается в том, что продукт (метанол) одновременно выступает в качестве растворителя и из указанного продукта можно получить алкоголятную составляющую, тем самым делая каталитическую систему простой с точки зрения механизма ее действия и экономически выгодной. Целевой метанол можно удалять из реакционной зоны вместе с непрореагировавшими СО и Н2 в виде газа одновременно в процессе реакции в жидкой фазе. Указанный катализатор имеет чрезвычайно высокую избирательность для синтеза метанола. При этом достигают стабильного показателя конверсии в метанол вплоть до 94% При проведении реакции в присутствии сорастворителя можно увеличить скорость взаимодействия СО и Н2. К особенно предпочтительным сорастворителям относятся тетрагидрофуран, 2-метилтетрагидрофуран, пара-диоксан, третичный амиловый спирт, трет. -бутанол, триглим и полиэтиленгликоли, известные как ПЭГ-200 и ПЭГ-400. Вышеуказанные сорастворители используют предпочтительно в эквимолярном или почти эквимолярном количестве относительно метанола. При желании однако можно подбирать также большие или меньшие их дозировки.
Вследствие того, что реакция между СО и Н2 для получения метанола, катализируемая предлагаемым гомогенным катализатором, происходит в жидкой фазе, исходный газ можно подавать в катализатор для их непосредственного взаимодействия в любой реактор, предназначенный для режима работы в системе жидкость/газ. Синтез метанола можно осуществлять в реакторной системе, сконструированной для непрерывного, полунепрерывного или периодического процесса.
Предпочтительно, чтобы синтез метанола при использовании предлагаемого катализатора проводился в реакторе, который характеризуется хорошей смешиваемостью газовой и жидкой фаз. Метанол выводят из реактора путем пропускания через реактор избытка СО и Н2 или инертного газового носителя, например азота. При удалении метанола в виде газа достигают преимуществ относительно предлагаемой технологии, связанной с указанным катализатором, его активностью, временем жизни и обработкой. В альтернативном варианте метанол можно выделять в жидкой фазе, при этом растворенный катализатор выносится потоком продукта из реактора. Затем продукты подвергают мгновенному испарению в зоне для разделения и отделенный катализатор вводят в реактор для его рециркулирования.
Сочетание низких рабочих температур, которые необходимы при использовании предлагаемого катализатора, и его высокой каталитической активности при очень непродолжительном его контакте позволяет достигнуть очень высокой глубины конверсии сырьевого газа при синтезе метанола. Равновесная конверсия синтез-газа, содержащего 2 моля водорода на моль окиси углерода при 100oС и 10,55 кг/см2, как стабильно показывают анализы, составляет примерно 94% Более того, жидкостной характер предлагаемой каталитической системы позволяет прервать контактирование газа, находящегося в растворе для ускорения реакции, с отводимым теплом из реактора в результате экзотермической реакции СО и Н2. Такое прерывание контакта можно осуществлять, например, путем циркулирования газа через внешний охладитель или путем введения инертного низкокипящего реагента в каталитическую систему, которая может быть охлаждена снаружи и введена для рециркуляции в реактор. Сочетание высокого термодинамического равновесия процесса и способности к разъединению кинетики и теплопередачи приводит к устранению ограничений к конструкции реактора имеющихся в настоящее время технологий производства катализаторов.
Согласно настоящему изобретению гомогенный катализатор возможно получать in situ в реакторе путем введения компонента на основе карбонила переходного металла и алкоголятного компонента в раствор метанола, и требуемых сорастворителей, активаторов и т.д. Синтез метанола может начаться сразу же после образования катализатора. В альтернативном варианте гомогенный катализатор можно получить заранее вне реактора с последующей его загрузкой в реактор в случае необходимости.
В еще одном варианте синтеза метанола при использовании катализатора, находящегося в жидкой фазе, исходный синтез-газ вводят в реактор, работающий при температуре 110oС и давлении 10,55 кг/см2. Газ проходит через раствор катализатора и образует метанол с выделением тепла, которое отводят, например, циркулированием охладителя через змеевик реактора. Хотя эта система охлаждения не полностью отводит тепло реакции, передача тепла на змеевик происходит быстро, при этом реакция протекает по существу изотермально при благоприятном температурном режиме вследствие интенсивного перемешивания и турбулентности указанного жидкого катализатора, обусловленных газовым потоком. Объем отходящего газа незначителен, и охладитель, сепаратор и компрессор для рециркуляции неконвертированного газа имеют очень небольшие размеры по сравнению с требованиями к аналогичным элементам, используемым в случае традиционных гетерогенных катализаторов. Небольшой объем газа может оказаться недостаточным для переноса всего верхнего погона метанола в виде пара. В таком случае необходимо отделять жидкость от реакционного продукта. Указанную жидкость затем смешивают с конденсатом из сепаратора с отделением неочищенного метанола, который стекает из указанной разделительной системы. При удалении жидкости из реактора в первой дистилляционной колонне происходит отделение летучих компонентов катализатора и их возврат в реактор. Во второй дистилляционной колонне образуется метанол в виде дистиллята. При использовании этого метода для синтеза метанола и при необходимости использования сорастворителя в предлагаемой каталитической системе сорастворитель выбирают с точкой кипения ниже температуры кипения метанола, в результате чего метанол и сорастворитель отделяют друг от друга во второй дистилляционной колонне, при этом сорастворитель возвращают повторно в реактор в виде любой жидкой формы.
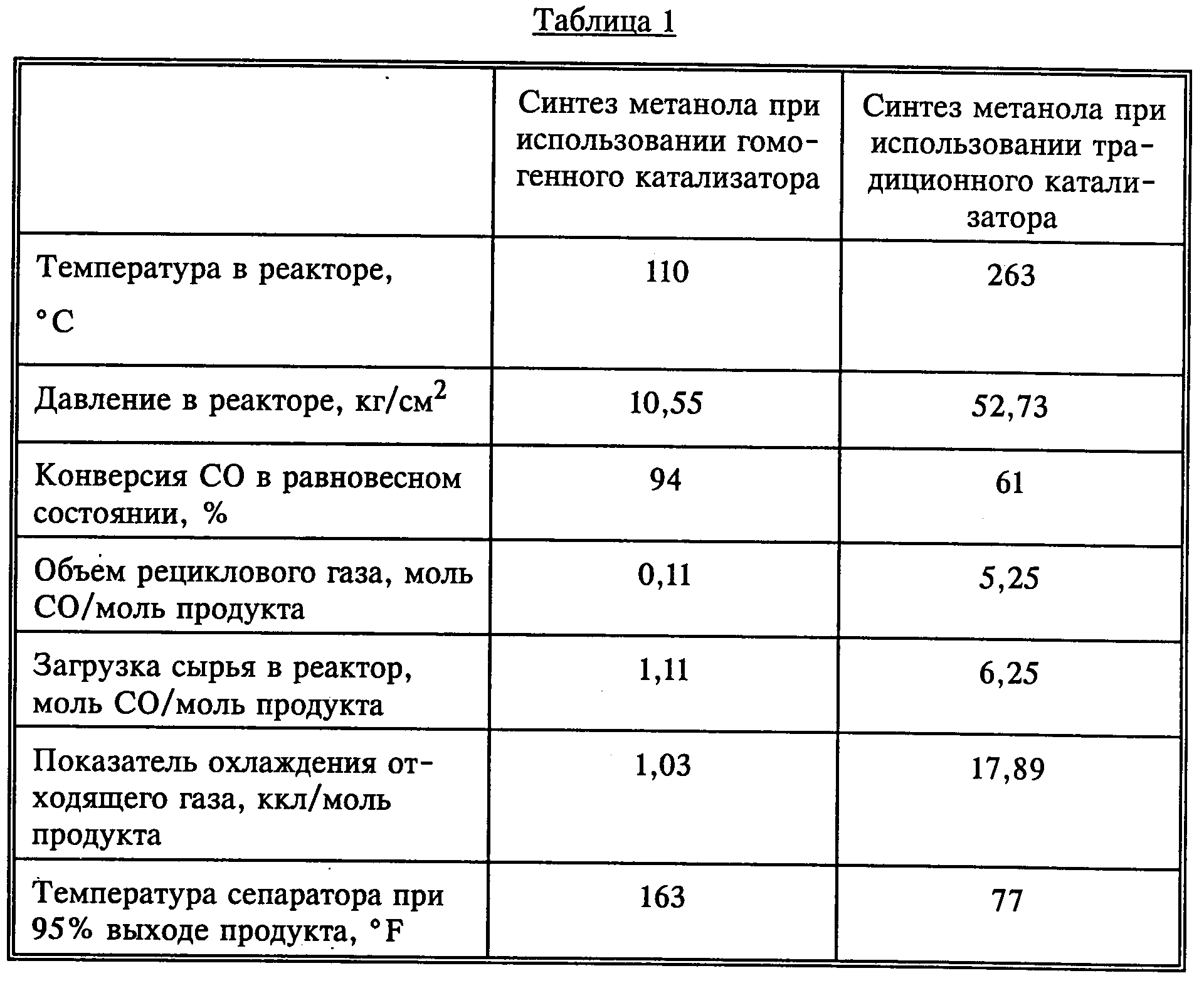
Способ получения метанола по настоящему изобретению с использованием низкотемпературного жидкого катализатора приводит практически к полной конверсии синтез-газа в метанол за один проход через реактор в процессе. Это позволяет достичь присутствие атмосферного азота в синтез-газе и при этом объем поступаемого в реактор газа меньше необходимого объема газа в современных реакторах для синтеза метанола. В нижеследующей таблице приведены данные сравнительного анализа предлагаемой технологии и традиционного каталитического процесса в синтезе метанола. Отмечено значительное улучшение как реакционных условий, так и повышение выхода продукта (см.табл.1).
Приводимые ниже примеры дополнительно иллюстрируют настоящее изобретение, но оно не ограничено указанными примерами. В этих примерах, приводимых ниже, полное давление в реакторе варьируется от примерно 53,85 кг/см2 в начале каждого прохода до примерно 3,515-10,55 кг/см2 при завершении, причем это давление на стадии завершения реакции эквивалентно требуемому рабочему давлению реактора с непрерывным режимом работы.
Пример 1.
Трет-амилат натрия (40 ммоль), полученный при взаимодействии NaH (40 ммоль) при незначительном избытке трет-амилового спирта (32 ммоль) в 269 ммолях тетрагидрофурана вводят в реактор вместе с 860 ммолями тетрагидрофурана с получением 1229 ммолей ТГФ в сумме. Затем реактор продувают Н2. Прибавляют 10 ммолей Ni(CO)4 и в реактор вводят синтез-газ при давлении 21,09 кг/см2 (Н2:СО/2:1). После нагревания реакционной смеси до 100oС скорость подачи газа составляет 0,21; О,56; 0,49 кг/см2/мин соответственно во время первой, второй и третьей загрузки (при давлении 21,09 кг/см2 каждой) соответственно. Получают 164 ммоля метанола, что соответствует 86% от расхода газа.
Пример 2.
В этом примере показано влияние щелочного металла на скорость подачи сырья. Получение алкоголята и загрузку сырья в реактор осуществляют по методике примера 1, кроме того, вместо гидрида натрия берут гидрид калия. Таким образом, 40 ммолей трет-амилата калия получают при взаимодействии КН (40 ммолей) с 52 ммолями трет-амилового спирта в 269 ммолях тетрагидрофурана. Полученный раствор выливают в реактор и прибавляют еще 860 ммолей ТГФ. Реактор герметично закрывают и пропускают Н2, а затем добавляют 10 ммолей Ni(CO)4. Сжатый при давлении 21,09 кг/см2 синтез-газ (Н2:СО/2:1) вводят в реактор и реактор нагревают до 100oС. Средняя скорость подачи газа составляет 2,25; 3,51; 1,54; 0,56 кг/см2/мин при загрузках 1 (21,09 кг/см2), 2 (21,09 кг/см2), 3 (21,09 кг/см2), 4 (52,73 кг/см2) соответственно. Получают 0,35 молей метанола.
Пример 3.
Данный пример иллюстрирует положительное влияние повышения концентрации алкоголята на расход сырья, а также то, что процесс является истинно каталитическим в присутствии основания и никеля. Концентрацию трет-амилата калия увеличивают до 110 ммолей вместо ранее использованных 40 ммолей и повторяют методику, описанную в примере 2. Средний расход газа составляет 3,797; 2,18; 4,50 кг/см2/мин при загрузках 1 (21,09 кг/см2), 2, 3, 4 и 5 (в каждой давление 52,73 кг/см2). Получают 1 моль метанола, что соответствует 94% газовой конверсии. Полученный метанол соответствует по крайней мере 100 циклам при использовании Ni и 10 циклам при использовании основания, что подтверждает каталитический характер предлагаемого изобретения.
Пример 4.
Метанол в количестве 212 ммолей получают при нагревании до 100oС и перемешивании в реакторе смеси, содержащей лиганд 2,2'-дипиридил (5 ммолей) в дополнение к реагентам, описанным в примере 2. Расход сырья при падении давления составляет 6,328; 1,969 и 0,844 кг/см2/мин при загрузках 1, 2, 3 (давление каждой 21,09 кг/см2) соответственно. Выход метанола в чистом виде составляет 82% от расхода газа.
Пример 5.
Следуют методике примера 2 за исключением того, что в реактор нагнетают синтез-газ, содержащий Ni (вместо традиционной смеси Н2:СО/2:1). В результате получают метанол. Расход газа составляет 3,234 и 1,055 кг/см2/мин соответственно при загрузках 1 и 2 (52,73 кг/см2 каждая, содержащая N2, сжатый при давлении 28,12 кг/см2, и синтез-газ (Н2:СО/2:1) соответственно. N2 проходит через систему без действия на него катализатора. Получают 639 ммолей метанола, что составляет более 98% его выхода от суммарного потребления газа.
Пример 6.
Следуют методике примера 2 за исключением того, что газовая смесь содержит от 84 до 90% СН4 вместо обычной газовой смеси из Н2 и СО (2:1). Получают 153 ммоля метанола, что составляет 98% его выхода от суммарного количества газа, израсходованного в процессе производства, свидетельствуя о том, что метан не оказывает отрицательного воздействия на активность катализатора.
Пример 7.
Следуют методике примера 2 за исключением того, что исходная газовая смесь содержит H2S. Расход газовой смеси составляет 2,32 и 0,35 кг/см2/мин при загрузках 1 (газовая смесь, сжатая при давлении 21,09 кг/см2, содержащая 2% H2S) и 2 (сжатая газовая смесь при давлении 21,09 кг/см2 с 4% H2S) соответственно. Получают 238 ммолей метанола, что составляет более 99% выхода от суммарного расхода газа, свидетельствуя о том, что предлагаемый катализатор обладает высокой устойчивостью относительно отравляющего сероводорода.
Пример 8.
Отмечено незначительное повышение глубины конверсии, когда для получения алкоголята в качестве компонента предлагаемого катализатора вместо КН используют К. Итак, раствор, содержащий 40 ммолей третичного амилата калия (полученного из калия (40 ммолей) и трет-амилового спирта (52 ммоля), 1229 ммолей ТГФ, и 5 ммолей Ni(CO)4, нагревают до 100oС в реакторе с введенным в него сжатым синтез-газом (Н2:СО/2:1) при давлении 21,09 кг/см2. Получают 260 ммолей метанола. Расход составляет 1,828, 3, 656 и 1,758 кг/см2/мин при загрузках 1, 2 и 3 соответственно (каждая при давлении 21,09 кг/см2).
Пример 9.
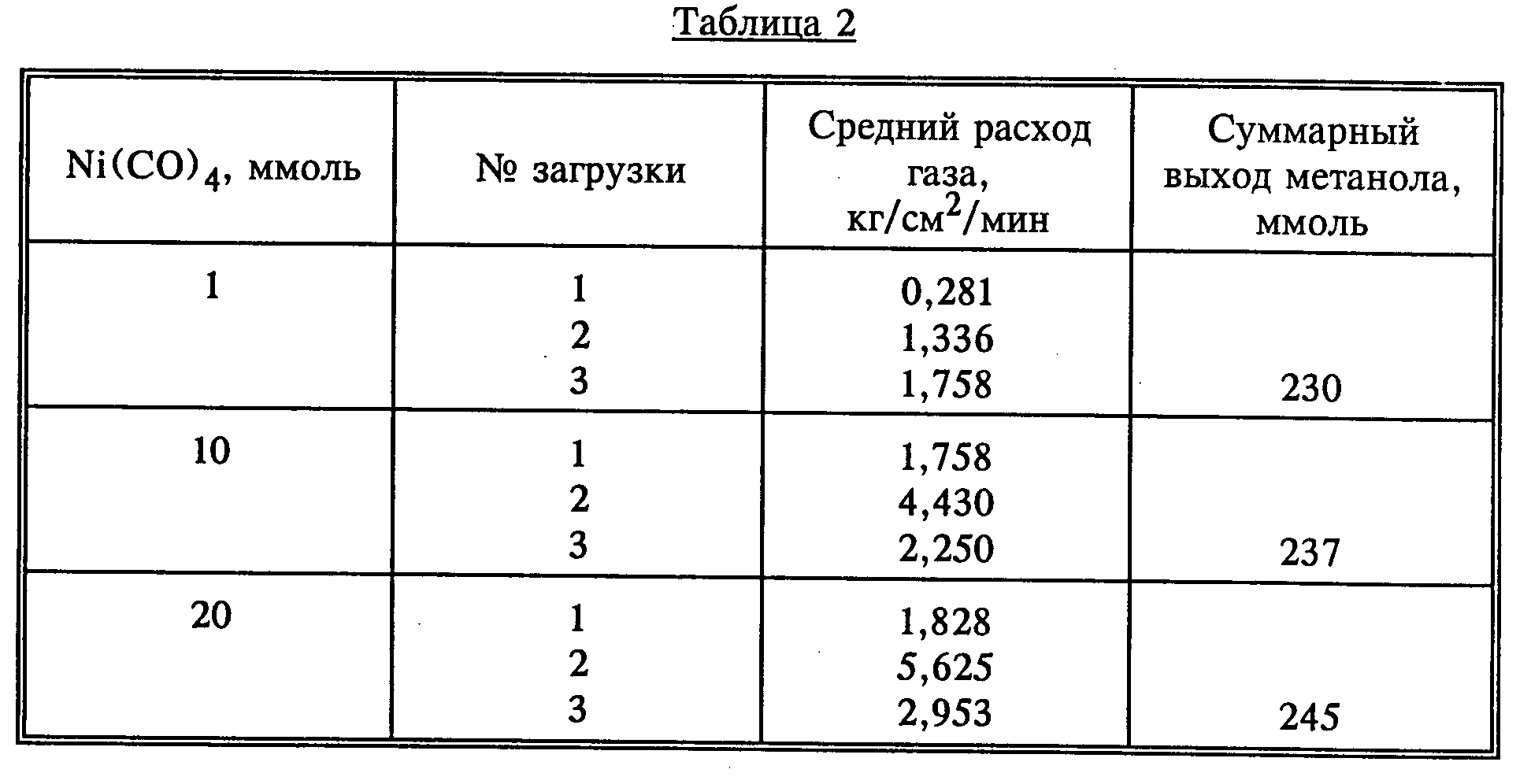
Для исследования влияния концентрации карбонила переходного металла в качестве компонента катализатора на скорость синтеза метанола проводят следующие эксперменты. Используют методику, описанную в примере 8, за исключением того, что изменяют концентрацию тетракарбонила никеля. В таблице 2 приведены данные относительно скоростей расхода газовой смеси для загрузки 1, 2 и 3 соответственно (каждая сжата при давлении 21,09 кг/см2).
При заданной концентрации основания (40 ммоль в данном случае) скорость расходования увеличивается при повышении концентрации карбонила никеля, но не в линейной зависимости. В каждом случае процесс имеет каталитический характер.
Пример 10.
В данном примере показано, что каталитическая активность в синтезе метанола не зависит от объема растворителя. Трет-амилат натрия (40 ммолей) загружают в реактор Парра емкостью 300 мл вместе с 246 ммолями ТГФ. После продувания водорода в реактор вводят синтез-газ (Н2:СО/2:1), сжатый при давлении 21,09 кг/см2. Расход газа составляет 2,531 кг/см2/мин. Для загрузок 2 и 3 (каждая, сжатая при давлении 21,09 кг/см2), расход газовой смеси составляет 3, 305 и 2,109 кг/см2/мин соответственно, что свидетельствует о высокой объемной производительности при использовании предлагаемого катализатора.
Пример 11.
На скорость синтеза метанола влияет соотношение основание:никель. Так, например, при повторении одного из экспериментов по примеру 9 при использовании соотношения основания к никелю 100 ммоль/1 ммоль (100:1) расход составляет 0,562, 2,812 и 3,656 кг/см2/мин для загрузок 1, 2 и 3, соответственно (каждая при давлении 21,09 кг/см2).
Пример 12.
Повторяют методику, описанную в примере 8, за исключением того, что вместо трет-амилата калия используют 40 ммолей трет-бутилата калия (полученного из К и трет-бутанола). Расход газа составляет 0,844, 4,500 и 2,109 кг/см2 при загрузках 1, 2 и 3 соответственно. Расход зависит от природы спирта, из которого получен алкоголят.
Пример 13.
Повторяют эксперимент, описанный в примере 8 при использовании 40 ммолей метилата калия (КОМе) (указанный алкоголят получают из МеОН первичного спирта в отличие от трет-амилата калия и трет-бутилата калия, которые получают из третичных спиртов), при этом отмечено значительное повышение производительности (5,18, 2,17 и 1,547 при загрузках 1, 2 и 3 соответственно). Получают 303 ммоля МеОН, что составляет 97% выход от израсходованного синтез-газа.
Пример 14.
0,1 моля метилата тетраметиламмония растворяют в 2500 ммолях, разведенного 50% пара-диоксаном и прибавляют 3 ммолей Ni(CO)4 для получения полностью однородной смеси. В реакторе создают давление 56,25 кг/см2 при введении синтез-газа (Н2: СО/2: 1) с нагреванием реактора до 120oС. Производительность синтеза метанола составляет 0,211 кг/см2/мин, которая сопоставима с наблюдаемой в случае использования KOCH3 в аналогичном реакционном режиме.
Пример 15.
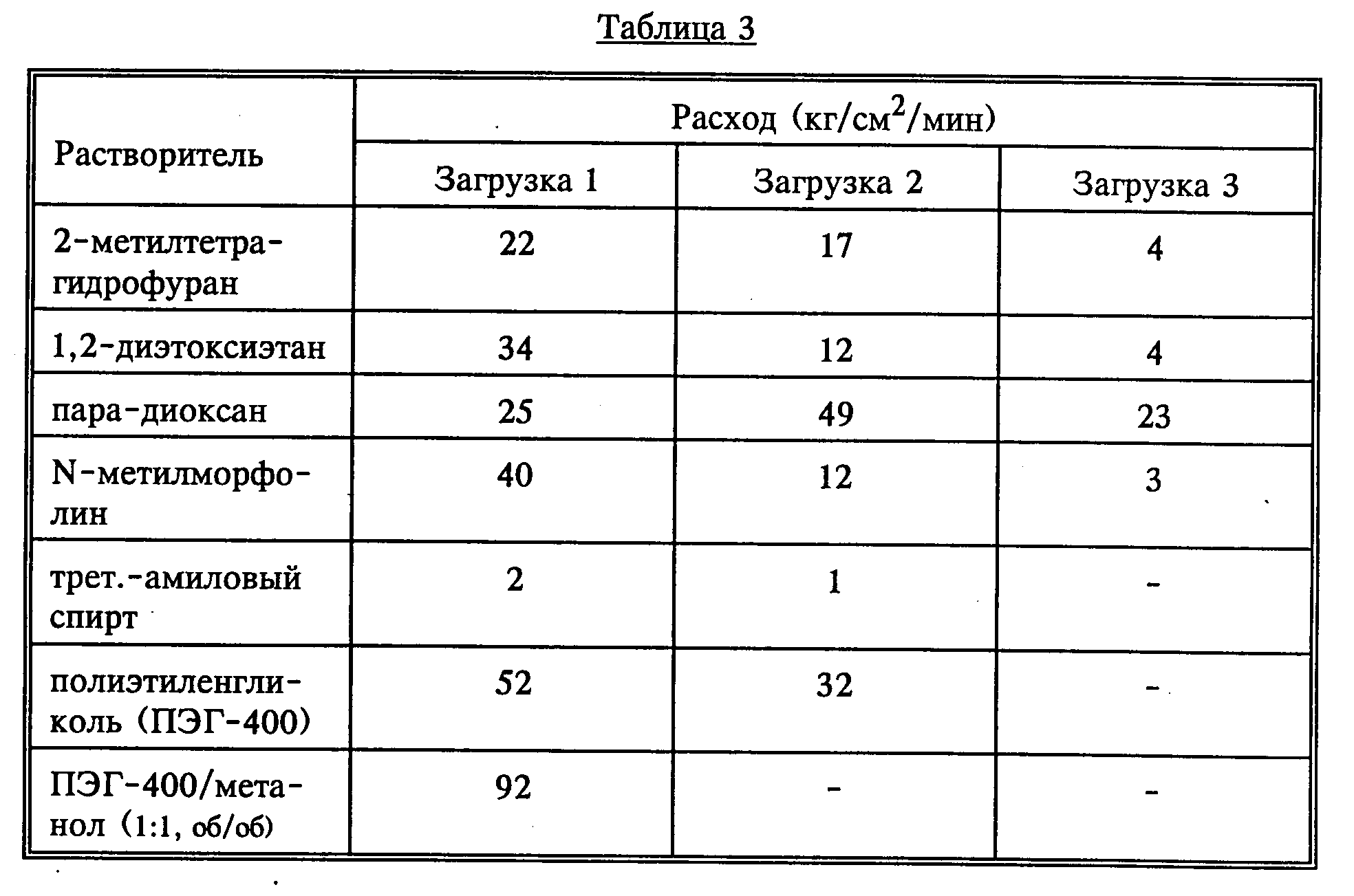
Повторяют методику, описанную в примере 8, за исключением того, что вместо тетрагидрофурана используют сорастворитель, приведенный в таблице 3. Данные расхода приведены в таблице 3.
Предлагаемый гомогенный катализатор действует более эффективно при использовании ТГФ, пара-диоксана или полиэтиленгликоля в качестве сорастворителя.
Пример 16 (с использованием полиэтиленгликоля).
Являясь превосходными сорастворителями, полиэтиленгликоли отличаются тем, что реагируют аналогично краун-эфирам в процессе капсулирования щелочных металлов.
200 ммолей КОМе растворяют в 282 ммолях полиэтиленгликоля (ПЭГ400), а затем добавляют 10 ммолей Ni(CO)4 с получением полностью гомогенного раствора красного цвета. В реакторе понижают давление при введении синтез-газа (Н2: СО/2:1) при давлении 56,25 кг/см2 и нагревают его до температуры 120oС. Синтез метанола начинается при температуре ниже 50oС, причем расход газа составляет 3,656 и 2,25 кг/см2/мин при загрузках 1 и 2 соответственно.
Пример 17.
В другом примере разводят 50% ПЭГ-400, а затем добавляют КОМе и 10 ммолей Ni(CO)4 с образованием раствора катализатора темнокрасного цвета. Давление исходного синтез-газа, сжатого при давлении 57,65 кг/см2 (Н2:СО/2:1) в реакторе понижают до 3,445 кг/см2 с началом синтеза метанола при температуре ниже 40oС. Скорость синтеза метанола составляет 6,469 кг/см2/мин, а самая высокая температура в процессе взаимодействия составляет 115oС, а самая предпочтительная 120oС. Получают 296 ммолей метанола, при этом избирательность метанола составляет более 98,5% Конечный раствор имеет красный цвет и полную гомогенность, при этом достигают 94% глубины конверсии СО по крайней мере через 5 минут.
Пример 18.
40 ммолей трет-амилата натрия, 1229 мл ТГФ и 5 ммолей Ni(CO)4 перемешивают в присутствии аргона с получением раствора красного цвета. Через 2 дня при выдерживании раствора при комнатной температуре его загружают в реактор и нагревают до температуры 100oС после создания давления в реакторе 21,09 кг/см2 при введении синтез-газа (Н2:СО/2:1). Активность предварительно перемешанного катализатора аналогична той, которую имеет раствор свежего катализатора, описанного в примере 8.
Пример 19.
Влияние увеличения концентрации метанола и основания на производительность процесса изучена при температуре 110oС и давлении 52,73 кг/см2 при использовании 5 ммолей тетракарбонила никеля, пара-диоксана в качестве сорастворителя и КОМе в качестве алкоголята. Полученные результаты приведены в таблице 4.
Из таблицы 4 видно, что расход снижается при увеличении концентрации метанола при заданной концентрации основания. Однако в случае простого повышения концентрации основания возможно и увеличение производительности процесса. Взаимосвязь между соотношением основания к МеОН описана в следующем примере.
Пример 20.
Раствор, содержащий 5 ммолей карбонила никеля, 2500 ммолей метанола и метилата калия нагревают при температуре 110oС при давлении синтез-газа (Н2: СО/2: 1) 52,73 кг/см2. При повышении концентрации основания (более 400 ммолей) газ расходуется даже до достижения требуемой температуры. Приводимые ниже результаты данного эксперимента свидетельствуют о том, что скорость синтеза метанола зависит от соотношения КОМе к МеОН (основания к растворителю).
КОМе (ммоль) Расход газа (кг/см2/мин)
400 0,773
600 >4,219
800 >>5,062
Пример 21.
Растворы катализатора, содержащие 600 ммолей КОМе, 2500 ммолей МеОН и Ni(CO)4, нагревают до 110oC при давлении синтез-газа 52,73 кг/см2 (Н2:СО/2: 1). Как видно из следующих данных, расход увеличивается при увеличении концентрации карбонила никеля.
Ni(CO)4 (ммоль) Расход газа (кг/см2/мин)
1 1,055
5 4,212
20 7,03
При более высоких концентрациях Ni(CO)4 (например, 20 ммолей), газ полностью конверсируется через 3 минуты с образованием метанола.
Пример 22.
Исследовано влияние реакционной температуры на скорость синтеза метанола. В случае, когда 100 мл (1174 ммолей) пара-диоксана, содержащего 100 ммолей КОМе и 5 ммолей Ni(CO)4, сжимают до 52, 73 кг/см2 при введении синтез-газа (Н2: СО/2: 1), расход газа составляет 1,055, 3,023, 4,43 и 12,66 кг/см2/мин соответственно при температурах 70, 77, 90 и 100oС. Для этой реакции получают кривую Аррениуса Eфакт= 23,3 ккал/моль. Синтез метанола начинается при температуре ниже комнатной при использовании более высоких концентраций катализатора, однако система действует эффективно в интервале от 50 до 150oС.
Пример 23.
Предлагаемая каталитическая система может выдерживать действие ряда традиционных
каталитических ядов, которые имеют отрицательное влияние на общеизвестные катализаторы, используемые в синтезе метанола, что подтверждается данными эффективности процесса, полученными в результате
взаимодействия загружаемого сырья. Так, например, в случае использования катализатора вместе с 400 ммолями КОМе, описанного в примере 8, отмечены следующие эффекты различных ядовитых веществ: (1) при
введении синтез-газа, сжатого при 52,73 кг/см2, который содержит 8% СО2 (остальное составляет Н2 и СО, 2:1), отмечено 20% снижение каталитической активности; (2) при
использовании синтез-газа (52,73 кг/см2), содержащего 26% N2, 7,4% СО2 и 2,5% H2S (остальное составляет Н2 и СО, 2:1), производительность
процесса снижается на 50%
Пример 24.
В еще одном варианте осуществления изобретения 3,0 г просушенного цеолита (13-кратное количество высушенного в вакууме при 400o С в течение 4 часов) вводят в процессе загрузки сырьевого материала вместе с 400 ммолями КОМе в 100 мл метанола. Реактор продувают водородом, добавляют 5 ммолей Ni(CO)4. Понижают давление в реакторе до 52,73 кг/см2 при введении синтез-газа (Н2: СО/2: 1), а затем нагревают до 110oС. Скорости расхода были на 10% выше по сравнению с расходом при использовании растворов катализатора, не содержащих цеолит. К преимуществам использования носителя карбонила переходного металла, такого как цеолит, относятся: (1) фактическое отсутствие метилформиата, который обычно присутствует в незначительных количествах в виде побочного продукта, и (2) иммобилизация Ni(CO)4 на цеолите. Результаты ИК-анализа газовой фазы свидетельствуют о том, что концентрация Ni(CO)4 в газовой фазе снижается при использовании цеолитовой подложки.
Пример 25.
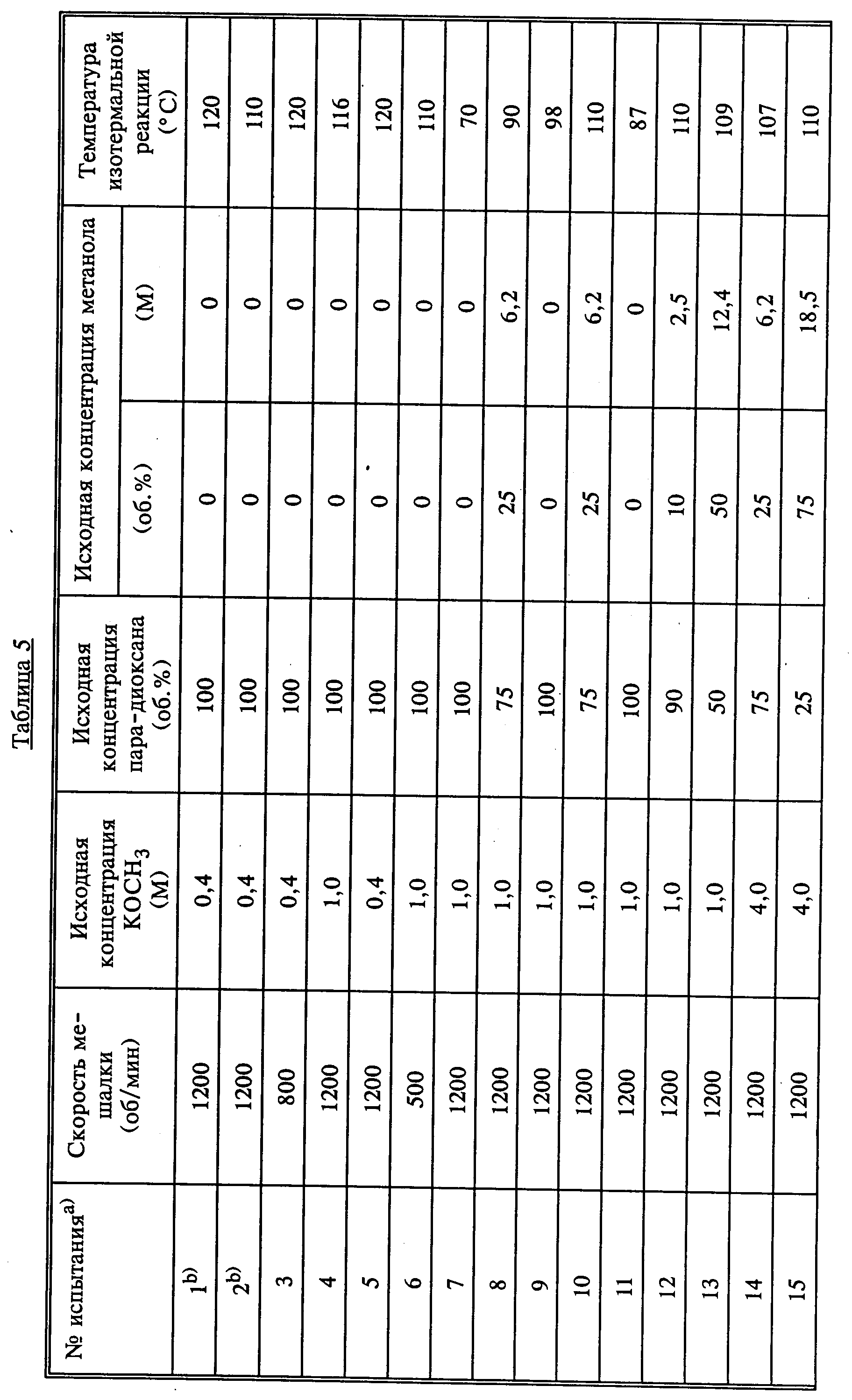
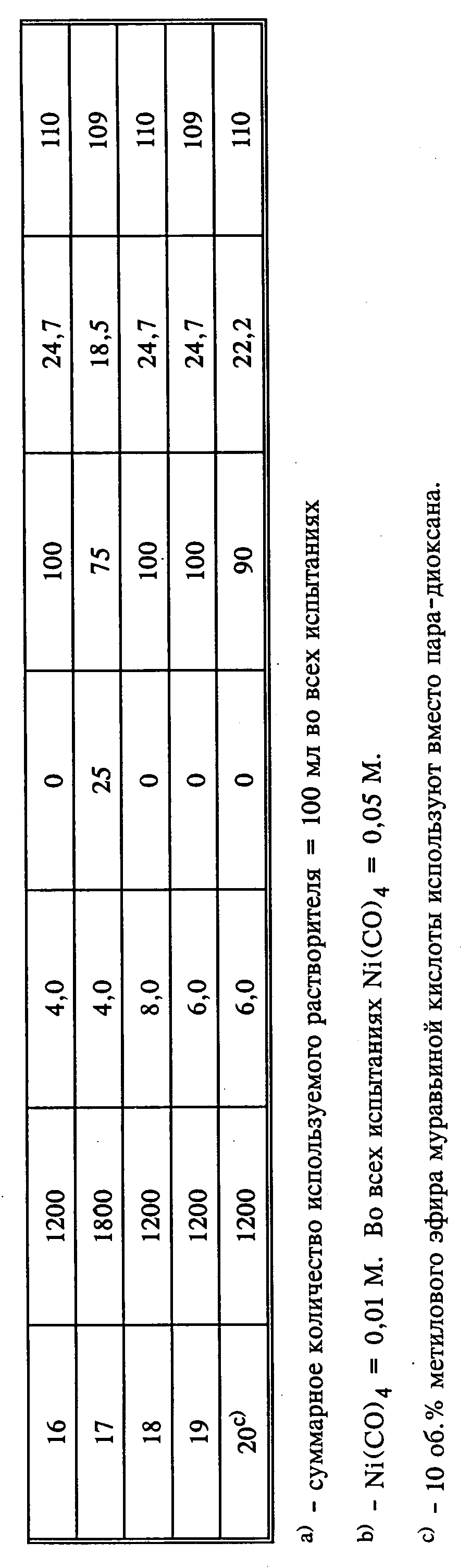
Для определения степени влияния температуры, концентрации метанола, концентрации основания, PH2, PCO и скорости мешалки на скорость реакции были проведены эксперименты при введении 20 порций сырья. В таблице 5 приведены реакционные условия каждого испытания. Все испытания проводили при исходной концентрации Ni(CO)4 0,05 М, кроме испытаний 1 и 2, где использовали исходную концентрацию порядка 0,01 М. Испытание 21 проводили с использованием метилового эфира муравьиной кислоты в качестве растворителя вместе с метанолом, в то время как в других экспериментах использовали либо чистый метанол, либо смесь метанол/пара-диоксан в качестве растворителя.
Концентрации метанола, основания и Ni(CO)4 в жидкой фазе, приведенные в таблице 5, рассчитаны из предположения, что (1) никакого изменения в объеме не происходит при смешивании пара-диоксана, метанола и KOCH3 и (2) никакого изменения плотности жидкой фазы не происходит в интервале от 25oС до температуры реакции. Таким образом, концентрации метанола KOCH3 и Ni(CO)4 более точно приведены как моль/л при 25oС.
Испытания 1 и 2 относятся к единственным экспериментам, проводимым при использовании концентрации Ni(CO)4 порядка 0,01 М, так как они связаны с концентрацией катализатора, при которой получают умеренную скорость протекания реакции. Умеренную (не чрезмерную) скорость реакции определяют как скорость, для которой требуется от 2 минут до 2 часов для снижения давления в начале реакции от 52,73 до 7,03-10,55 кг/см2. Скорость протекания реакции в испытаниях 1 и 2 относительно замедлена и, как полагают, снизится еще при использовании интересуемого интервала низких температур. Таким образом, для всех последующих испытаний использовали более высокую исходную концентрацию Ni(CO)4. Указанная концентрация Ni(CO)4 приводит к умеренной скорости протекания реакции.
Испытания 3 и 5 проводили с целью определения скорости реакции в данных экспериментах в случае ограничения массопереноса Испытания 4, 7, 9 и 11 проводили при температурах 116, 70, 98 и 87oС соответственно с целью выяснения влияния температуры на скорость протекания реакции. В испытании 6 предпринята попытка повторения методики опыта 4, но при более медленной скорости мешалки для определения изменения скорости реакции при ограничении массопереноса. Однако испытание 6 было закончено до того, как была достигнута температура реакции в соответствии с испытанием 4.
Испытание 8 было первым испытанием, проводимым в присутствии метанола, используемого в начале реакции. Это испытание проводили при 90oС, так как не была известна скорость реакции при использовании раствора, содержащего метанол в большей концентрации. Скорость реакции при температуре 90oС была медленнее, чем ожидалось, поскольку во всех последующих испытаниях, где метанол присутствовал с начала синтеза, реакционная температура удерживалась примерно на уровне 110oC.
Испытания 10, 12 и 13 проводили с целью определения влияния метанола на скорость реакции. Исходные концентрации метанола, используемые в этих экспериментах, составляли соответственно 25, 10 и 50 об. Испытания 14, 15 и 16 проводили также для установления влияния концентрации метанола на скорость реакции при различных концентрациях основания в катализаторе. Эти испытания проводили при исходных концентрациях метанола 25, 75 и 100 об. соответственно, а начальная концентрация KOCH3 составляла 4,0 М.
Испытание 17, которое повторяло методику испытания 15, за исключением того, что скорость мешалки была выше, проводили с целью установления: ограничивает ли массоперенос скорость протекания реакции в экспериментах с более высокими концентрациями основания. Испытания 18 и 19, повторяющие методику испытания 16, но при использовании более высоких концентраций основания проводили с целью установления влияния концентрации основания на скорость протекания процесса при использовании абсолютного метанола (100 об. метанола). Испытание 21, где повторяли методику испытания 19, но с использованием в качестве растворителя 10 об. метилового эфира муравьиной кислоты проводили с целью определения степени влияния метилформиата на скорость реакции.
Кроме того, был проведен еще один эксперимент (испытание 18) для подтверждения того, что Ni(CO)4 и метилат калия не расходуются полностью в процессе синтеза, и функционируют в качестве катализаторов. Это испытание проводили в течение 3 дней при многократном снижении давления в реакторе при введении синтез-газа, в результате чего давление в реакторе понижалось до 14,06 кг/см2.
Пример 26.
В приводимом далее примере показан синергический эффект двухкомпонентной системы в синтезе метанола. 1 ммоль Ni(CO)4, 5 ммолей метилата меди и 0,6 моля KOCH3 растворяют в 100 мл метанола. В реакторе создают низкое давление при введении синтез-газа (Н2: СО/2:1) с последующим нагреванием до 120oС. Метанол получают при расходе газа примерно 0,352 кг/см2/мин.
Пример 27.
5 ммолей Ni(CO)4 добавляют к раствору, содержащему 0,4 моля КОМе, растворенного в смеси 30% метанола и 70% триглима (диметилтриэтиленгликоль), а затем в реакторе понижают давление до 52,73 кг/см2 при введении синтез-газа (Н2: СО/2: 1). Расход синтез-газа составляет 8,08 кг/см2/мин при нагревании реактора до 120oС.
Пример 28 с использованием Ni/Mo-системы.
Смесь ацетата никеля (10 ммолей), гексакарбонила молибдена (5 ммолей) и 100 ммолей трет-амилата натрия нагревают в 100 мл тетрагидрофурана при давлении 21,09 кг/см2 синтез-газа (Н2:СО/2:1) при 100oС. Расход газа составляет 0,14 кг/см2/мин и получают 87 ммолей метанола.
Пример 29 с использованием Ni/Co-системы.
Когда нагревают смесь, содержащую 8 ммолей ацетата никеля, 2 ммоля ацетата кобальта, 100 ммолей трет-амилата натрия в 100 мл тетрагидрофурана при 100oС при давлении 21,09 кг/см2 синтез-газа, а после 2 дополнительных загрузок при давлении 21,09 кг/см2 каждой, синтезированный МеОН составляет 163 ммоля. Расход газа составляет 0,13, 0, 25, 0,21 кг/см2/мин при загрузках 1,2,3 соответственно.
Пример 30 с использованием Ni/Cu-системы.
Прибавляют 7 ммолей Ni(OAc)2, 3 ммоля Сu(ОАс)2 и 100 ммолей третамилата натрия к 100 ммолям тетрагидрофурана и нагревают смесь при 100oС при давлении 21,09 кг/см2 синтез-газа. При 3 последовательных загрузках расход газа составляет 0,07, 0,04, 0,12 кг/см2/мин соответственно. Получаются 36 ммолей МеОН. При этих условиях Ru и Pd не производят МеОН.
Пример 31 с использованием Сu-системы.
Смешивают 5 ммолей CuCI, 120 ммолей основания КОМе, 300 ммолей МеОН и 108 мл триглима и нагревают их при 120oС при давлении 21,09 кг/см2 (Н2:СО/2: 1). 120 ммолей H2 и 170 ммолей СО расходуются для образования до 60 ммолей МеОН. Дополнительный расход СО идет на получение побочного продукта метилформиата.
Пример 32 с использованием Со-системы.
10 ммолей Со(ОАс)2, 60 ммолей трет-амилата натрия и 100 мл тетрагидрофурана нагревают при температуре 100oС при давлении 21,09 кг/см2 синтез-газа (Н2: СО/2: 1). Давление уменьшается и после 260 минут реактор охлаждается. Получают 16 ммолей МеОН в течение реакции.
Пример 33 с использованием Мо-системы.
Нагревают 5 ммолей Мо(СО)6, 120 ммолей КОМе, 300 ммолей МеОН и 108 мл триглима при 150oС при 53,43 кг/см2 синтез-газа (Н2:СО/2:1). Расход газа составляет 0,05 кг/см2 112 ммолей СО и 106 ммолей Н2 соответственно до 53 ммолей МеОН.
Пример 34.
60 ммолей трет-амилата калия, 25 мл трет-бутилового спирта в качестве растворителя и 5 ммолей тетракарбонила никеля загружают в реактор Парра емкостью 300 мл и содержимое смешивают и нагревают при давлении (21 кг/см2) синтез-газа (Н2:СО/2:1) при температуре 100oС. После того, как давление уменьшают до 0,7 кг/см2 через 8,5 минут, реактор перезаряжают до 21 кг/см2. В общей сложности три загрузки дают 124 ммоля МеОН.
Пример 35.
Систему Ru3(CO)12/KOMe испытывают в диметиловом эфире триэтиленгликоля в качестве первичного растворителя без добавления метанола. Давление снижается от 69,51 до 60,55 кг/см2 через 22 минуты при температуре 150oС. Конечное давление составляет 4,046 кг/см2 при 25oС. Реакция была резко замедлена, так как расход газа упал до 0,07 кг/см2/мин. Полученный раствор был темно-коричневой жидкостью, содержащей 20 ммолей МеОН.
В этой системе можно использовать диметиловый эфир тетраэтиленгликоля вместо диметилового эфира триэтиленгликоля.
Литература
1.
Патент США N 4590216, кл. С 07 С 27/08, 1986.
2. Патент США N 4731386, кл. С 07 С 27/06, 1988.
3. Патент США N 4476334, кл. С 07 С 20/00, 1984.
4. Патент США N 4301253, кл. С 07 С 27/06, 1981. ТТТ1 ТТТ2 ТТТ3 ТТТ4 ТТТ5 ТТТ6
Реферат
Гомогенный катализатор для синтеза метанола из окиси углерода и водорода, содержащий следующие компоненты, ммоль: комплекс карбонила переходного металла, выбранного из группы,
включающей медь, никель, кобальт, молибден, рутений или их смеси 1-20; алкоголят ф-лы AM-OR, где АМ-Nа, K, NMe, OR-производное (C
Формула
Комплекс карбонила переходного металла 1-20
Алкоголятный компонент из вышеуказанной группы 40-800
Комплекс карбонила переходного металла /АМ-ОR-соотношение 2-800
Растворитель метанол Не более 2500
Сорастворитель Не более 1500
2. Катализатор по п. 1, отличающийся тем, что переходный металл выбран из группы, состоящей из никеля, молибдена и меди.
Комплекс карбонила переходного металла 1-20
Алкоголятный комплекс вышеуказанной группы 40-800
Комплекс карбонила переходного металла /АМ-OR соотношение 2-800
Растворитель метанол Не более 2500
Сорастворитель Не более 1500
17. Способ по п. 16, отличающийся тем, что в качестве переходного металла используют никель, а в качестве алкоголята C1-C5 алифатический алкоголят, а метанол используют совместно с растворителем, выбранным из группы тетрагидрофурана, метилентетрагидрофурана, парадиоксана, третичного амилового спирта, полиэтиленгликоля и диметилового эфира триэтиленгликоля или диметилового эфира тетраэтиленгликоля.

Комментарии