Способ получения диметил-1,5-нафталиндикарбоксилата - RU2270830C2
Код документа: RU2270830C2
Чертежи

Описание
Область техники
Данное изобретение относится в общем к синтезу соединений на основе нафталина и, более конкретно, относится к синтезу 1,5-диметилнафталинов и применению этих соединений и промежуточных продуктов для их синтеза.
Уровень техники
Известно, что полимеры на основе диметил-2,6-нафталиндикарбоксилата (2,6-NDC) пригодны для различных целей.
Пленки, изготовленные из полимеров на основе 2,6-NDC, являются более прочными и термостойкими по сравнению с пленками и волокнами из других полимеров, таких как полиэтилентерефталат (PET). Эти улучшенные свойства привели к использованию полимеров на основе 2,6-NDC для изготовления фотопленки, пленки для видеомагнитофонов, а также электротехнических изделий и изделий для электроники. Полимеры на основе 2,6-NDC обладают также повышенной стойкостью к диффузии газов, таких как двуокись углерода, водяной пар и кислород. Это сопротивление диффузии газов делает эти полимеры пригодными для изготовления пленок и контейнеров для упаковки разнообразных пищевых продуктов и напитков.
Превосходная прочность полимеров на основе 2,6-NDC позволяет использовать эти полимеры в областях, где требуется высокая прочность, таких как изготовление корда для автомобильных и мотоциклетных шин.
Однако получение 2,6-NDC в промышленном масштабе представляет собой сложный многоступенчатый процесс, который может привести к довольно высокой стоимости 2,6-NDC по сравнению с другими полимерами.
Синтез 2,6-NDC обычно включает несколько стадий. Обычно орто-ксилол и бутадиен реагируют над щелочным металлом или другим катализатором с получением алкенилированного5-орто-толилпентена(5-ОТР). 5-ОТР затем циклизуется над кислым катализатором с образованием 1,5-диметилтетралина (1,5-DMT). 1,5-DMT дегидрируют над благородным металлом или другим катализатором дегидрирования с получением 1,5-диметилнафталина (1,5-DMN), который затем изомеризуется с образованием 2,6-диметилнафталина (2,6-DMN).
Как только 2,6-DMN образовался, он окисляется с образованием 2,6-нафта-линдикарбоновой кислоты (2,6-NDA), которую этерифицируют с получением 2,6-NDC. Этот 2,6-NDC можно затем подвергать полимеризации в присутствии, например, этиленгликоля с получением полиэтиленнафтата (PEN), используемого в качестве мономера или сомономера в областях, рассмотренных выше.
Вышеописанный состоящий из 7 стадий способ получения PEN требует, чтобы каждая стадия синтеза была селективной и приводила к высокому выходу желательного конечного продукта, если NDC необходимо производить в промышленном масштабе экономичным методом.
Необходимо обеспечить мономер на основе нафталина, который можно было бы получить эффективным и экономичным способом.
Сущность изобретения
Было установлено, что экономичные материалы для многих областей применения можно обеспечить получением их на основе 1,5-NDC, а не на основе 2,6-NDC. Устранение реакции изомеризации и очистки 2,6-DMN, требующейся для превращения 1,5-DMN в 2,6-DMN, снижает стоимость процесса, повышает выход и может привести к увеличению производительности в тех случаях, когда реакция изомеризации или очистка изомеризованного продукта лимитируют процесс производства. За счет определения областей применения нескольких промежуточных продуктов, образующихся в процессе синтеза 1,5-NDC, было обнаружено, что получение этих промежуточных продуктов не должно ограничиваться каким-либо количеством, необходимым для производства конечного 1,5-NDC, тем самым количество оборудования становится менее критическим и производство полимера NDC становится более экономичным, поскольку излишки промежуточных продуктов могут быть использованы в других целях.
Кроме того, уникальные физические и химические свойства 1, 5-NDC делают его более предпочтительным веществом по сравнению с другими мономерами, такими как изофталевая кислота, во многих областях применения, что увеличивает потребность в производстве NDC.
Краткое описание чертежей
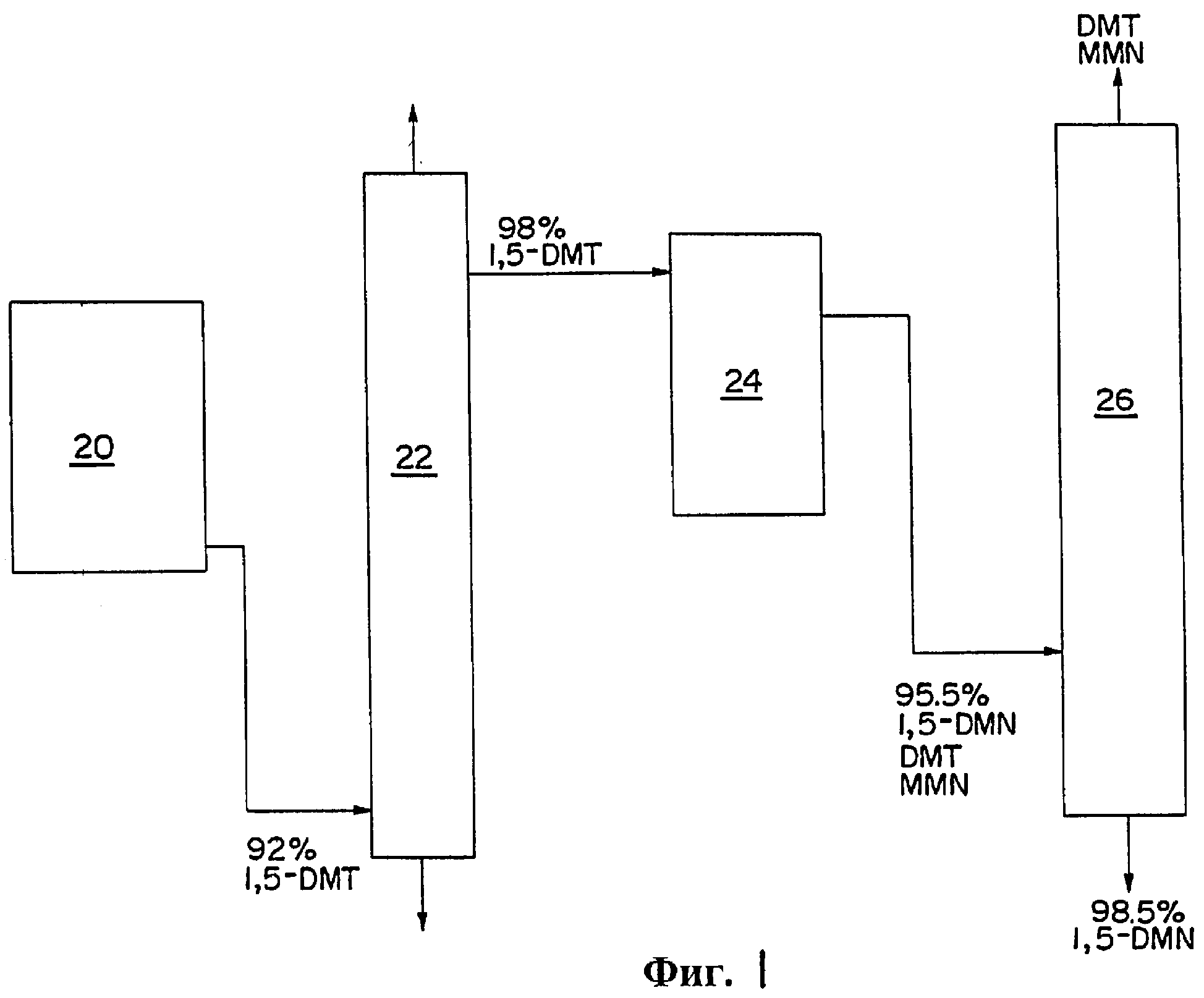
На фиг.1 представлена схема производства 1,5-DMN из 1,5-DMT.
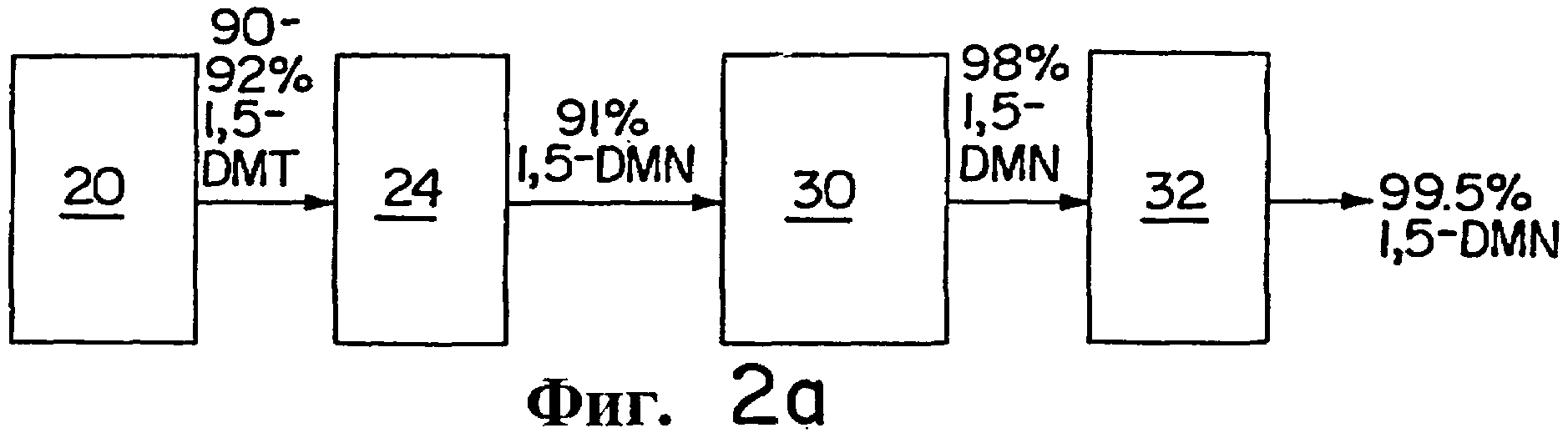
На Фиг.2а и 2b показаны схемы, иллюстрирующие альтернативные способы получения
1,5-DMN высокой степени чистоты из 5-ОТР.
Описание предпочтительных вариантов осуществления изобретения
Нижеследующее описание процесса синтеза 1, 5-NDC и обсуждение его применения, а также областей применения промежуточных продуктов является только иллюстративным. Специалистам в данной области после ознакомления с нижеследующим описанием будут очевидны другие варианты. Следовательно, данное описание никоим образом не ограничивает изобретение.
Синтез 1,5-NDC можно в общем осуществить по методу получения 2,6-NDC, за исключением того, что изомеризация 1,5-DMN в 2,6-DMN не является необходимой. Устранение этой стадии уменьшает капитальные и производственные расходы, а также позволяет получить продукт, обладающий превосходными свойствами, необходимыми во многих областях применения.
Обычно первой стадией способа получения 1,5-DMN является взаимодействие орто-ксилола и бутадиена с образованием продукта алкенилирования 5-орто-толилпентена (5-ОТР). Примеры альтернативных методов алкенилирования алкилбензолов, используемых на этой стадии, можно найти в патенте США 4990717, Sikkenga, и патентах США 5198594 и 5334796, Lillwitz и др.
Предпочтительный метод осуществления этой реакции заключается в использовании 10-300 ч/млн катализатора NaK (эвтектическая смесь натрия и калия) в присутствии стехиометрического избытка орто-ксилола по отношению к бутадиену, составляющего, по меньшей мере, 5:1, при температурах от примерно 80°С до 150°С, при давлении 1-3 атм и времени пребывания около 1 часа. Селективность по 5-ОТР может быть увеличена добавлением аминного промотора, например N,N,N',N'-тетраметилэтилендиамина. Реакцию предпочтительно обрывать добавлением воды, метанола или их смеси с последующим выделением 5-ОТР любым известным методом. Реакции циклизации, используемые для получения промежуточного диметилтетралина в процессе синтеза 1,5-NDC, хорошо известны и обычно включают реакцию промежуточного 5-ОТР над кислым катализатором. Поскольку предпочтительна высокая степень селективности, предпочтительными являются способы, использующие высокоселективные кристаллические аминосиликаты Y-типа, описанные в патентах США 4950825, 5030781, 5034561, 5073670 и 5401892, Sikkenga. Примеры получения диметилтетралина в дистилляционном аппарате можно найти в патенте США 5284987, Sikkenga и др. Эти источники включены в данное описание в качестве ссылок.
Предпочтительно проводить реакцию при повышенной температуре между примерно 150°С и 250°С при давлении между примерно 0,3 и 5 атм, предпочтительно, в отсутствие растворителя, хотя могут быть использованы парафиновые и ароматические растворители, которые химически инертны в реакционных условиях, такие как тетрадекан или антрацен. Из реакционной смеси следует исключить воду.
Дегидрирование 1,5-DMT может быть проведено, например, с использованием любого твердого катализатора дегидрирования, обладающего пригодной для промышленного производства жизнеспособностью в условиях дегидрирования. Обычно катализатором является благородный металл на активном угле или подложке из двуокиси алюминия, который содержит до примерно 15% вес. благородного металла в расчете на общий вес катализатора. Условия процесса, подходящие для осуществления дегидрирования в присутствии этих и других катализаторов, можно найти в патентах США 5012024 и 5118892, Sikkenga и др., а дополнительная информация, касающаяся подходящих катализаторов для этой реакции, содержится в патентах США 5189234 и 5401705, Amelese, которые также включены в данное описание в качестве ссылок. Обычно температура и давление будут примерно такими же, как описано в вышеуказанных ссылках для реакции циклизации.
1,5-NDA обычно можно получить жидкофазным окислением 1,5-DMN в присутствии источника молекулярного кислорода, причем растворитель содержит монокарбоновую кислоту и воду, а катализатор включает кобальт, марганец и бром, температура реакции равна от примерно 100°С до 260°С. Соотношения компонентов катализатора и растворителя в исходном сырье можно определить эмпирически при выбранных температуре и давлении с тем, чтобы свести к минимуму образование нежелательных продуктов реакции и содержание остаточных металлов катализатора в 1,5-NDA. Реакцию предпочтительно проводить в среде монокарбоновой кислоты, такой как уксусная кислота или смесь уксусной кислоты и воды, при соотношении растворителя к DMN, равном примерно 2:1-12:1, соотношении марганца к кобальту 5:1-0,3:1, соотношении брома к сумме марганца и кобальта, равном примерно 0,3:1-0,8:1, и общем количестве кобальта и марганца до 1% вес. от количества растворителя.
Дополнительная информация, касающаяся окисления DMN в NDA, содержится в патентах США 5292934, Sikkenga и др., и 5254719, Holzhauer и др.
Методы, описанные в этих патентах, используемые для окисления 2,6-DMN, легко адаптируются специалистами для окисления 1,5-DMN.
1,5-NDA, полученный вышеописанным способом, может быть очищен одно- или двухстадийным методом перед этерификацией с получением 1,5-NDC с целью повышения степени чистоты и выхода конечного NDC. Подходящие методы очистки включают перекристаллизацию, промывку растворителем и/или дистилляцию продукта окисления 1,5-NDA, что является очевидным для специалистов.
Этерификация 1,5-NDA с получением 1,5-NDC обычно осуществляется путем нагревания смеси метанола и 1,5-NDA до температуры между примерно 80°С и 200°С, давлении до 40 атм и времени пребывания реагентов порядка 20-150 минут. Предпочтительные температура и давление составляют примерно 90-150°С и 3-15 атм. Температуру и давление следует выбирать таким образом, чтобы часть метанола находилась в жидком состоянии при осуществлении реакции этерификации.
Как и в случае исходного NDA, очистка продукта этерификации до его использования в качестве мономера является предпочтительной, и такую очистку обычно можно осуществить путем промывки растворителем, перекристаллизации и/или вакуумной дистилляции реакционного продукта.
Для оптимизации степени чистоты и выхода 1,5-NDC и промежуточных продуктов при его получении можно использовать различные комбинации вышеописанных стадий. Например, был получен сравнительно чистый 1,5-DMN путем дегидрирования 1,5-DMT над платиной, находящейся на подложке из двуокиси алюминия, с образованием 1,5-DMN со степенью чистоты около 88% вес. Хотя степень чистоты этого 1,5-DMN может быть повышена путем кристаллизации из растворителя, этот процесс является довольно дорогим, а очистка дистилляцией не является особенно эффективной вследствие довольно близких значений температур кипения 1,5-DMN и других примесей, содержащихся в продукте дегидрирования.
На Фиг.1 представлен альтернативный способ, который можно использовать для экономичного получения 1,5-DMN высокой степени чистоты (по меньшей мере 95%вес.) из 1,5-DMT. Согласно этому способу 92% вес. чистого 1, 5-DMT из реактора циклизации 20 подвергают дистилляции в дистилляционной колонне 22. Колонна 22 содержит примерно 20 тарелок Oldershaw, коэффициент опрокидывания потока составляет примерно 15:1 и температура перегонки равна примерно 253°С. Из-за имеющихся примесей, являющихся в основном более низкокипящими ОТР и более высококипящими DMN, дистиллят из колонны 22 на 98-98,5% вес. состоит из 1,5-DMT. Этот дистиллят затем дегидрируют в реакторе дегидрирования 24 над высокоселективным катализатором дегидрирования, который в данном случае содержал примерно 0,5% К и 0,5% Pt на цинк-алюминатной пшинели (ZnAl2O4), с получением продукта реакции, содержащего около 95,5% вес. 1,5-DMN вместе с различными DMT и монометилнафталатными (MMN) примесями. Этот продукт затем подвергают перегонке во второй дистилляционной колонне 26 с получением 1,5-DMN со степенью чистоты 98,5%.
На Фиг.2а и 2b представлены диаграммы, иллюстрирующие способы превращения 5-ОТР в 1,5-DMN высокой степени чистоты.
Как показано на Фиг.2а, 5-ОТР циклизуется в реакторе 20, дегидрируется в реакторе 24 и полученный 1,5-DMN кристаллизуется в кристаллизаторе 30. Для получения сравнительно чистого (98%) 1,5-DMN из кристаллизатора 30 выбирают условия кристаллизации, при которых в кристаллизатор 30 при температуре около 120°С добавляют расплав исходного 1,5-DMN. Скорость добавления в кристаллизатор 30 должна быть такой, чтобы растворитель NORPAR (смешанный С10-13 растворитель, поставляемый Exxon Chemical) или другой подходящий растворитель были при температуре, предпочтительно не превышающей примерно 27°С. Поддержание этой разницы между температурами кристаллического расплава и растворителя является предпочтительным для того, чтобы в кристаллизаторе 30 можно было достигнуть значительного повышения степени чистоты 1,5-DMN от примерно 91% до 98%. Полученный чистый 1,5-DMN со степенью чистоты 98% может быть затем промыт дополнительным количеством NORPAR или другим растворителем в узле промывки 32 для увеличения степени чистоты 1,5-DMN до примерно 99,5%. Можно применять другие величины температур расплава и растворителя при перекристаллизации при проведении вышеуказанной стадии перекристаллизации, но предпочтительно, чтобы растворитель при перекристаллизации был при температуре, по меньшей мере, на 60°С ниже, чем температура расплава на стадии перекристаллизации, предпочтительнее, по меньшей мере, на 80°С ниже, чем температура расплава на стадии перекристаллизации.
Схема на Фиг.2b отличается от схемы на Фиг.2а тем, что дистилляционная колонна 22 следует за реактором циклизации 20. Это позволяет повысить степень чистоты 1,5-DMT, поступающего в реактор дегидрирования 24, до примерно 98%. 1,5-DMN, полученный в реакторе дегидрирования 24, имеет степень чистоты, равную примерно 96%. Использование кристаллизатора 30 и следующего за ним средства для промывки 32, как описано в случае Фиг.2b, позволяет получить 1,5-DMN со степенью чистоты до примерно 99,9%. Полагают, что использование башни 22 для получения продукта дегидрирования 1,5-DMT высокого качества позволяет повысить выход на стадии очистки примерно на 10-15% по сравнению со способом, показанным на Фиг.2а.
Мы также получили очищенный 1, 5-NDC из технического продукта окисления 1,5-DMN способом, согласно которому техническую кислоту превращают в эфир методом каталитической этерификации при низких температурах и давлении в метаноле с последующей кристаллизацией в метаноле и дистилляцией кристаллического продукта, как описано ниже в Примере 1.
Пример 1.
1180 г технической NDA загружают в реактор из нержавеющей стали объемом 5 галлонов (3,78 дм3) вместе с 10315 г чистого метанола, 105 г концентрированной серной кислоты и 23,6 г воды. Реактор закрывают и создают азотом давление 100 ф/дюйм2 (689,5 кПа). Эту продувку азотом повторяют 3 раза и затем нагревают реактор до достижения внутри реактора температуры, равной 120°С. Во время нагрева из реактора при примерно 55°С удаляли диметиловый эфир, образовавшийся при катализируемой кислотой реакции с метанолом.
После достижения начальной температуры, равной 120°С, выдерживают содержимое реактора в течение 6 часов. Во время этого периода давление в реакторе возрастает от 70 ф/дюйм2 (482,6 кПа) до 105 ф/дюйм2 (1034,2 кПа) вследствие образования диметилового эфира. Через 6 часов эту стадию заканчивают, нагреватели выключают и реактор охлаждают. После достижения безопасной (комнатной) температуры суспензия из реактора направляется в сосуд объемом 5 галлонов (3,78 дм3), который затем помещают в холодную комнату на ночь для ускорения кристаллизации.
Кристаллический продукт затем снова суспендируют и отфильтровывают, используя бумажный фильтр Whatman #1. С учетом количества полученного продукта требуются четыре воронки, каждый остаток на фильтре промывают свежим метанолом в весовом отношении к остатку, равном 1:1. Влажный остаток затем помещают в реактор с достаточным количеством метанола (6:1). Реактор закрывают и три раза промывают азотом, создавая давление 100 ф/дюйм2 (689,5 кПа). Затем реактор нагревают до 120°С и выдерживают при этой температуре в течение 30 минут. Через 30 минут выдержку прекращают, нагреватели выключают и реактор охлаждается. После достижения безопасной (комнатной) температуры суспензию из реактора направляют в сосуд емкостью 5 галлонов (3,78 дм3). Как указано выше, для ускорения кристаллизации сосуд помещают в холодную комнату на ночь. Полученный продукт вновь суспендируют и отфильтровывают, используя бумажный фильтр Whatman #1, как и ранее полученный влажный остаток помещают в вакуумную печь при 62°С и сушат.
Высушенный продукт загружают в сосуд для дистилляции. К дистилляционной колонне подключают вакуум до достижения давления, равного 20 торр. Затем сосуд нагревают до температуры расплава, равной 238°С, и температуру в рубашке, окружающей колонну, устанавливают равной 204°С, отфильтрованный продукт перегоняют в течение 1 часа. Затем подключают разделитель при коэффициенте опрокидывания потока, равном 2:1. Начальную фракцию отбирают после того, как 50 мл верхнего погона были собраны. Фракции верхнего погона отбирают с интервалом 120 мл.
После прогона отобранным фракциям дают охладиться в течение ночи. Каждую фракцию затем измельчают и отбирают из нее пробу. Все фракции, кроме первой, смешивают в одну порцию. Для повышения полного выхода первые фракции первых двух циклов дистилляции добавляют в питатель для направления на третью дистилляцию. Это позволяет отобрать только один первый погон из всех трех циклов. В конце третьего цикла перегонки все три порции смешивают в конечный композит.
Степень чистоты рассчитывают с учетом всех известных и неизвестных компонентов, отличающихся от желательного продукта, их вычитали из 100%. Величину степени чистоты определяют методами жидкостной хроматографии (99,87%), газовой хроматографии (99,95%) и ядерного магнитного резонанса (99,72%). Одной из примесей, определенной методом масс-спектроскопии и согласующейся с данными ЯМР, является 1-бром-5-карбометоксинафталин в количестве примерно 2400 ч/млн. Методом титрования было определено кислотное число (2 мэкв/кг). Другой единственно идентифицированной известной органической примесью был 2,6-NDC, что было установлено методом жидкостной хроматографии (155 ч/млн), газовой хроматографии (9310 ч/млн) и ядерного магнитного резонанса (205 ч/млн). Поскольку конечный продукт перегоняли, анализ неорганических веществ был сделан только для серы (не определена) и брома (6 ч/млн). Цвет продукта был превосходным, L*=97,87, а*=-0,26, b*=1, 56.
Среднее содержание органических компонентов в перекристаллизованном остатке на фильтре после трех циклов, проведенных, как описано выше: 99,61% вес. - 1,5-NDC, 0,203% вес. - 2,6-NDC и неизвестные примеси - остальное.
1,5-NDA был также очищен методом, согласно которому технический 1,5-NDA взаимодействует с гидроокисью натрия с последующей обработкой углеродом и фильтрованием и подкислением соляной кислотой. Остаток на фильтре, полученный в результате осуществления этого метода, повторно суспендируют в свежей порции воды и снова отфильтровывают от маточной жидкости. Хотя была достигнута довольно высокая степень чистоты (99%), этот метод требует больших количеств растворителя и жидкости для промывки и обеспечивает довольно плохое удаление натрия и хлора, поэтому этот метод не является предпочтительным для очистки 1,5-NDA.
Полученный, как описано выше, 1,5-NDC при поликонденсации с этиленгликолем приводит к получению 1,5-PEN с более высокой плотностью аморфного полимера, чем у 2,6-PEN. Полагают, что более высокая плотность коррелируется с превосходными барьерными свойствами, что означает, что 1,5-PEN может быть предпочтительным материалом для изготовления упаковки, когда важны хорошие защитные свойства для сохранения качества упакованного материала. Точно также 1,5-NDA можно использовать в различных областях применения полимерных материалов, как указано ниже, как 2,6-NDA можно использовать аналогично 2,6-NDC, что известно специалистам в области полимерной химии. Далее, 1,5-нафталиндикарбоксильное звено, обычно получаемое при использовании или 1,5-NDA, или 1,5-NDC, будет называться 1,5-нафталиндикарбоксильным фрагментом. Там, где это звено входит в состав сложного полиэфира, оно будет называться 1, 5-нафталиндикарбоксилатным фрагментом. Это подобно случаю, когда, например, полимерное звено, полученное из терефталевой кислоты, называется терефталатным фрагментом.
Олигомеризация очищенного 1,5-NDC описана в примерах 2 и 3 ниже, а получение сополимера PET/1,5-NDC описано в примере 4.
Пример 2.
Осуществляют переэтерификацию 1,5-NDC этиленгликолем при температуре 180°С и молярном отношении этиленгликоля к 1,5-NDC, равном примерно 1,6-2,2, без использования конденсатора. Хотя, как ожидалось, эти условия должны привести к полной переэтерификации в промышленном масштабе с использованием конденсатора, в этом примере полная переэтерификация не завершилась, что подтверждает наличие метильных групп в реакционной смеси (ядерный магнитный резонанс).
Пример 3.
Процесс, описанный в примере 2, проводят при температуре 200-210°С и молярном отношении этиленгликоля к 1,5-NDC, равном 3 к 1. Получают олигомеры с характеристической вязкостью 0,05 дл/г и отношением этиленгликоля к нафталату 1,15/1,00. Как показывают данные ЯМР, количество концевых групп метилового эфира составляет около 1%. Полагают, что такие олигомеры удовлетворяют в настоящем промышленным требованиям. Ожидается, что при характеристической вязкости около 0,4 дл/г температура стеклования 1,5-PEN будет равна примерно 87°С и температура плавления - около 235-240°С, а скорость кристаллизации будет находиться между соответствующими величинами PET и 2,6-PEN. Эти характеристики делают полимер особенно пригодным для упаковки и изготовления формованных материалов.
Пример 4.
PETN-8 сополимер, содержащий 8 мол.% 1,5-NDC и 92 мол.% полиэтилентерефталата (PET), получают путем осуществления первоначальной реакции переэтерификации при температуре 193°С в течение примерно 120 минут с последующей второй стадией переэтерификации при 215°С в течение примерно 60 минут. Последующая поликонденсация в течение 174 минут при температуре 280°С и скорости перемешивания 50-60 об/мин приводит к образованию полимера с характеристической вязкостью около 0,60 дл/г. При сравнении со способом получения полимера на основе 2,6-NDC требуемое время поликонденсации при получении PETN-8 тем же методом было примерно на 45% больше.
На основании этого примера можно предположить, что 1,5-NDA или 1,5-NDC можно применять в полимерах на основе PET при низких концентрациях от примерно 1 до 10 мол.% вместо или в сочетании с 2,6-NDC (например, в сополимере PETN-8) для улучшения свойств PET без значительного ухудшения перерабатываемости и увеличения стоимости полимера.
Полагают также, что составы, содержащие 1, 5-нафталиндикарбоксилат, могут быть использованы для получения линейных полиамидов и сополиамидов. Эти материалы могут быть использованы для изготовления волокон, пленок, формованных изделий, полых контейнеров для упаковки, в качестве конструкционных полимеров, упаковочных материалов с барьерными свойствами и в других областях, где полезны вышеуказанные свойства. Эти новые полиамиды и сополиамиды являются полукристаллическими, поглощают небольшие количества воды и неожиданно имеют температуры плавления кристаллитов менее 300°С.
Предпочтительно, чтобы гомополиамиды содержали звенья 1,5-NDA и алифатических или циклоалифатических диаминов, содержащих от 2 до 20 атомов углерода. Кислотные сомономеры в сополиамидах представляют собой 1,5-NDA и вторую алифатическую или ароматическую дикарбоновую кислоту (до 40 мол.% от общего количества кислот), а в качестве аминов используются алифатические или циклоалифатические диамины, содержащие 2-20 атомов углерода.
Примерами алифатических дикарбоновых кислот, применяемых для получения этих сополиамидов, являются С3-20 дикарбоновые кислоты, особенно адипиновая кислота. Примерами ароматических дикарбоновых кислот, пригодных для тех же целей, являются C8-20 кислоты, особенно терефталевая, изофталевая и 2,6-NDA. Исходные составы включают также 1,5-NDA при использовании с диаминным компонентом, представляющим собой смесь 1:99-99:1 двух или более С2-20 алифатических или циклоалифатических диаминов. Получение поли(гексаметилен-1,5-нафталамида) описано подробно ниже в примере 5.
Пример 5.
Поли(гексаметилен-1,5-нафталамид) можно получить следующим образом.
В реактор 4CV Helicone (изготовленный Atlantic Research), предварительно нагретый до 88-100°С, добавляют 648 г 1,5-нафталиндикарбоновой кислоты, 356 г 1,6-гексаметилендиамина, 213 г деионизованной воды и 0,5 г гипофосфита натрия в качестве катализатора. Устанавливают температуру, равную 320°С, и скорость мешалки, равную 10 об/мин. Через примерно 26 минут давление в реакторе достигает 120 ф/дюйм2 (827 кПа). Поддерживают это давление еще 15 минут, достигая температуру расплава, равную 506°F (263,3°C).
Снижают давление до 100 ф/дюйм2 (689,5 кПа) в течение 3 минут и поддерживают эту величину в течение примерно 10 минут. Затем в течение 2 минут снижают давление до атмосферного. Температура расплава равна примерно 263°С, наблюдается увеличение вязкости расплава.
Полимер удаляют из реактора. Характеристическая вязкость полиамида (измеренная в смеси 60/40 фенол/тетрахлорэтан при 30°С) составляет 0,91 дл/г. Полиамид белого цвета перерабатывают в волокна.
Еще одно новое применение материала на основе 1,5-нафталата заключается в изготовлении волокна. Хотя полимер на основе 2,6-NDC использовали для изготовления волокон с превосходной жесткостью и химстойкостью, использовать этот полимер на обычном оборудовании для изготовления волокон трудно. Поскольку большинство оборудования для изготовления волокон предназначено для работы с PET, который плавиться в интервале температур 250-255°С, применение полимера на основе 2,6-NDC с его более высокой температурой плавления 262-267°С требует усовершенствованного оборудования, например более мощных нагревательных элементов и более длинных бочек. Вытягивание волокон на основе 2,6-NDC после экструзии также затруднено, так как 2,6-PEN имеет очень высокую температуру стеклования, около 127°С (для сравнения у PET около 80°С), что делает использование обычного оборудования для вытягивания PET проблематичным. С другой стороны, 1,5-PEN имеет температуру плавления, равную 235°С (ниже, чем у PET), и температуру стеклования, равную примерно 85-87°С (выше, чем у PET), что делает применение 1,5-PEN более предпочтительньм для изготовления волокон, обладающих жесткостью, химстойкостью и УФ-защитными свойствами, чем PEN.
Преимущество применения полимеров на основе 1,5-нафталата по сравнению с полимерами на основе 2,6-нафталата не ограничивается только переработкой волокна, как описано выше. Ожидается, что более низкие температура стеклования и температура плавления обеспечат более простое изготовление преформ, формованных изделий и пленок вообще. Например, более низкая температура плавления имеет преимущество при формовании тонкостенных изделий или при инжекционном формовании, когда критической является хорошая текучесть материала в узких частях форм. Применение материала на основе 1,5-NDC с его более низкой температурой плавления будет способствовать уменьшению пожелтения полимера и образования побочного ацетальдегида. Более низкие температуры стеклования и плавления полимера на основе 1,5-NDC позволяют заменять 1,5-NDC на такие сомономеры, как изофталевую кислоту, что позволяет улучшить барьерные свойства полимера.
Эти преимущества точно так же могут быть использованы при получении жидкокристаллических полимеров. Обычно высокие температуры, применяемые при производстве жидкокристаллических полимеров с использованием 2,6-NDC, могут быть снижены при применении 1,5-NDC.
Ожидается также, что разница в абсорбции УФ-света материалами на основе 1,5-NDC и 2,6-NDC может сделать применение 1,5-NDC предпочтительным в некоторых областях. Максимум абсорбции для материала на основе 1,5-NDC составляет примерно 320 нм, а для материала на основе 2,6-NDC он равен примерно 380 нм. Следовательно, 1,5-NDC будет предпочтительньм в тех областях, где желательна защита от УФ-света. Разница в максимумах абсорбции будет преимущественно использоваться в материале, содержащем как 1,5-, так и 2,6-NDC или в качестве сомономеров или же в составе отдельных слоев или компонентов, где желательны стойкость или защита от УФ в широких пределах.
Считается, что 1,5-NDC более растворим во многих органических растворителях, таких как стирол, чем 2,6-NDC. Эта повышенная растворимость может улучшить реакционноспособность во время полимеризации, при этом 1,5-NDC легче использовать, чем 2,6-NDC.
Промежуточные продукты при получении 1,5-NDC можно использовать и в других областях. Полагают, например, что промежуточные продукты, такие как 5-ортотолилпентен, 1,5-диметилтералин, 1,5-диметилнафталин, а также 2,6-DMN, образующийся при получении 2,6-NDC, пригодны в качестве промышленных растворителей, теплопередающих жидкостей, синтетических смазок и промежуточных продуктов при получении агрохимикатов и фармацевтических препаратов.
Примером использования ОТР (орто-толилпентена) в качестве промежуточного продукта при получении фармпрепататов является синтез лекарств, таких как противораковый препарат АВТ-839, в Abbor Laboratories. В процессе этого синтеза к ОТР путем дегидрирования может быть присоединена диеновая боковая цепь с последующим взаимодействием боковой цепи с рядом электрофильных соединений по реакции Дильса-Альдера с образованием замещенных бифенильных фрагментов, пригодных при синтезе лекарств, таких как АВТ-839. Полагают, что применение ОТР в качестве исходного вещества позволит значительно уменьшить число стадий синтеза, иначе требующихся при получении такого лекарства.
1,6-диметилнафталин использовали в качестве реагента при получении агонистов и антагонистов рецептора на основе октагидробензо-(f)-хинолина, как описано в патенте США 5863928, а 1,5- и 2,6-нафталины могут быть присоединены при синтезе аналогичных соединений. 1,5-DMN использовали в качестве исходного материала при получении ингибитора альдозоредуктазы Tolrestat, как описано в патенте США 4562286. Примером применения промежуточного 1,5-DMT, кроме синтеза NDA и NDC, является его использование в качестве заменителя других тетралинов. Например, 1,5-DMT можно использовать как заменитель тетралина в реакции со стиролом при получении теплопередающих жидкостей, таких как жидкости RP, производимые Dow Chemical Company.
Диметилнафталины пригодны также при получении графических изображений методом печати и другими методами. Например, сульфированный 1,5-нафталин использовался при приготовлении стабильных чернил, что описано в патенте Японии 10298474, a 1,5-DMN использовался непосредственно как основной (60%) компонент чернил, как описано в патенте Японии 10298477, 2, 6-нафталины также используются для повышения чувствительности индуцированных лазерным излучением термических систем получения изображений, как описано в патенте США 5747217. 2,6-DMN также пригодны в качестве исходного вещества при синтезе акрилоилдиметилнафталинов, которые могут применяться в качестве фоторезистов, применяющихся, например, при изготовлении печатных плат, описанных в патенте Японии 09255726. Мы полагаем, что 1,5-нафталины также могут быть использованы в этих и других областях графики и при получении изображений.
Агрохимическое применение диметилнафталинов включает использование DMN в качестве ингибитора проростков при создании тумана при хранении картофеля, как описано в заявке WO 94-US11419.
Диметилнафталины, такие как 1,5- и 2,6-DMN, пригодны в качестве исходных веществ при получении разнообразных полимеров, таких как нафталиннитрилы, которые могут быть получены каталитической реакцией DMN и аммиака в присутствии кислорода, как описано в заявке Японии 07126238, а также при получении дибензоилнафталиновых мономеров типа описанных в патенте Японии 06234848. Они также используются при получении других замещенных нафталиновых систем, таких как 1,2,5,6-нафталинтетракарбоновая кислота, как описано, например, в патенте Японии 05117202, или галоидированных нафталинов, таких как 2,6-бис-(бромметил)нафталин, как описано в патенте Японии 04282327. Диметилнафталины можно также применять в качестве катализаторов при получении неорганических химикатов. Например, литийалюминийгидрид может быть получен взаимодействием лития и водорода в присутствии катализатора DMN, как описано в патентах Китая 1033610 и 1011218.
Другие промышленные области применения диметилнафталинов включают получение других замещенных нафталинов для пропитки электроизоляционных материалов, таких как изоляционная бумага, используемая для изготовления подводных кабелей, как описано в патенте США 4225747, использованная в качестве исходных веществ при синтезе органолептических агентов или в качестве органолептических агентов, как, например, описано в патенте США 3702253; применение в качестве реагентов при изготовлении клеев или в качестве адгезивных веществ для соединения полистирола или других органических материалов, как описано в патенте Японии 48102844; применение в качестве антибактериальных агентов в других органических системах, таких как реактивное топливо, как описано в патенте США 3361545.
Другие методы синтеза и другие области применения, относящиеся к вышеописанному синтезу диметил-1, 5-нафталиндикарбоксилата и промежуточных продуктов, очевидны специалистам в данной области на основе информации, приведенной в данном описании.
Реферат
Изобретение относится к усовершенствованному способу получения диметил-1,5-нафталиндикарбоксилата, который используется для получения полимеров на его основе и изделий из этих полимеров. Экономичный и эффективный способ включает стадии: дегидрирование 1,5-диметилтетралина с получением 1,5-диметилнафталина; окисление 1,5-диметилнафталина, полученного на стадии дегидрирования, с получением 1,5-нафталиндикарбоновой кислоты без осуществления сопутствующей стадии изомеризации и этерификацию 1,5-нафталиндикарбоновой кислоты, полученной на стадии окисления, в присутствии метанола с получением диметил-1, 5-нафталин-дикарбоксилата. 8 з.п. ф-лы, 2 ил.
Формула
Документы, цитированные в отчёте о поиске
Способ получения диалкилового эфира нафталиндикарбоновой кислоты
Патенты аналоги
Способ получения диалкилового эфира нафталиндикарбоновой кислоты

Комментарии