Синтез и применение (-)-бета-элемена и (-)-бета-элеменала - RU2445305C2
Код документа: RU2445305C2
Чертежи
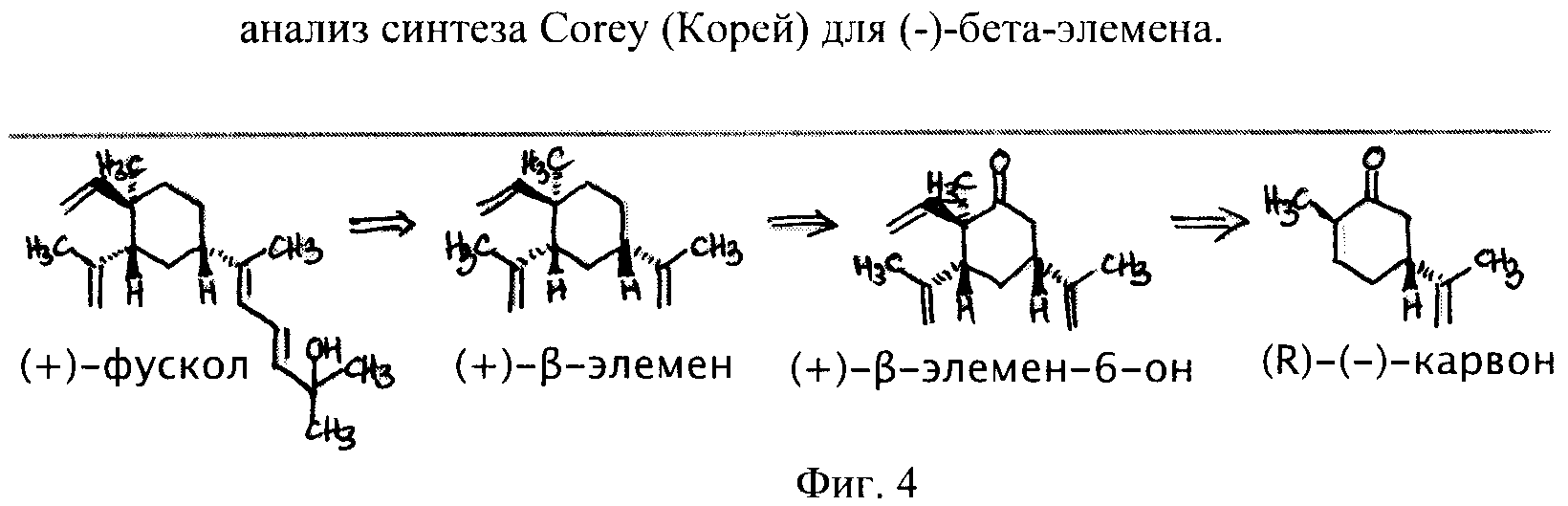

Описание
ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к области аналогов элемена и аналогов элеменала. В частности, данное изобретение относится к способам изготовления (-)-бета-элемена, (-)-бета-элеменала (метаболита (-)-бета-элемена в организме млекопитающих), (-)-бета-элеменола, фторида (-)-бета-элемена и их аналогов, которые могут использоваться в качестве нецитотоксичных противоопухолевых лечебных средств, и их влиянию на эффект резистентности ко множеству препаратов. Композиции и использование (-)-бета-элемена, (-)-бета-элеменала, (-)-бета-элеменола, фторида (-)-бета-элемена и их аналогов, а также производных продуктов для изготовления (-)-бета-элемена являются предметом защиты.
Данное изобретение можно использовать для лечения различных видов рака у млекопитающих, и ссылки на биохимию организма человека не должны рассматриваться как ограничительные, но только как иллюстративные. Термин больной или тело, или ссылки на организм человека используются для удобства, но включает всех больных млекопитающих и их тела.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
I. Противораковая эффективность смеси элеменов.
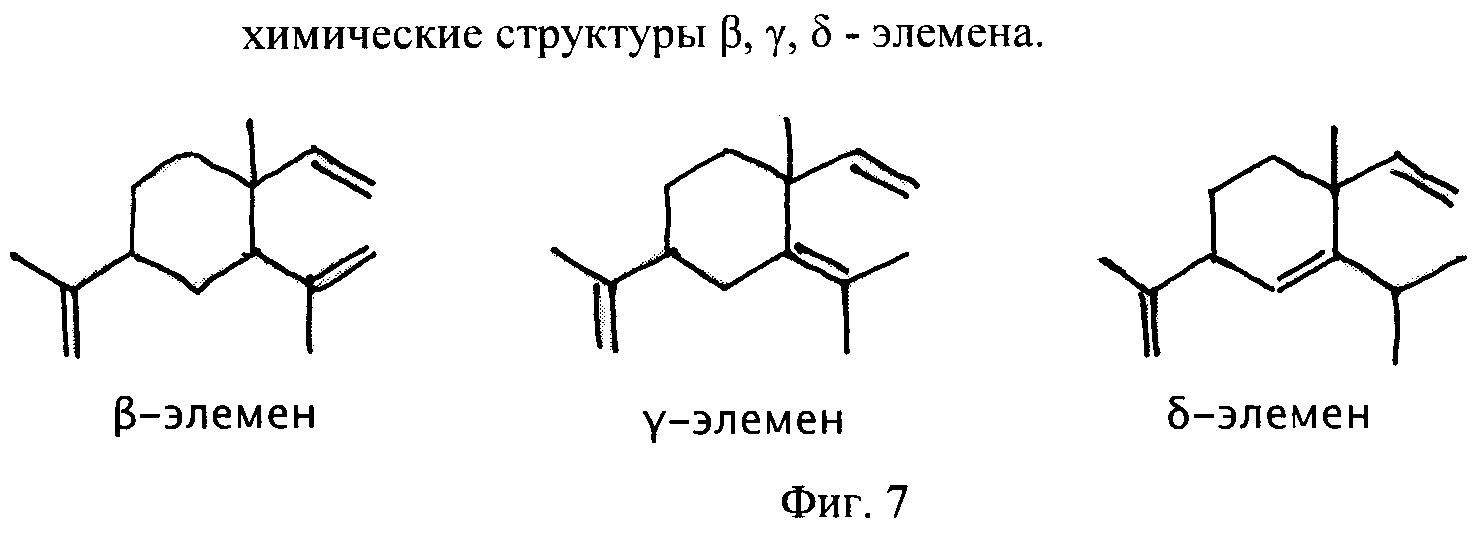
Смесь элеменов (смесь β (бета), λ (гамма), δ (дельта)-элеменов, где главной составляющей является форма бета) представляет собой смесь встречающихся в природе соединений, которые можно выделить из многих источников, включая: G.Cymbopogon winterianus Jowitt, цветы Zhangzhou Aglaia odorata, цветы Fuzhou Aglaia odorata, цветы Chunging Aglaia odorata, листья Chunging Aglia odorata, листья Zhangzhou Aglaia odorata, листья герани Yibin, листья герани Kunmin, Litchi chenensis cinnamomifblium, сухой лавр благородный, листья лимона, листья винограда Vitis vinifera, листья Clausena lansium, листья Fortunella margarita, Fortunella odorata, C. Wenyunjin Chen и Магнолию Зубольда. Впервые оно было выделено в 1954 году (Herout, V., Moti, О., Sorm, F., Coll. Czech. Chem. Commun 1954, 19, 990). В Китае начиная с 1983 года, смесь элеменов проходила изучение в качестве противоракового лекарственного средства. Лекарственный препарат элемена представляет собой смесь изомеров элемена, в которой главным компонентом является форма бета.
В 1993 году эмульсия из смеси элеменов (общее содержание в лекарственной композиции 0,5% β, λ, δ-элемена при чистоте 65%) была одобрена в КНР для лечения больных с плевральной жидкостью, обусловленной раком легкого. После одобрения в 1993 году эмульсия и смесь элеменов (0,5%, 65% чистоты) проявила свою эффективность вне утвержденных показаний при лечении более чем 10000 раковых больных, и его эффективность/безопасность документально отражена в китайской медицинской литературе. Его показания для лечения различных видов рака включают рак легких, рак печени, рак толстой кишки, рак молочной железы, рак простаты и др.
Терапевтические свойства элеменов еще недостаточно понятны. Действительно, неизвестно, является ли необходимым для проявления активности только один главный компонент или все главные компоненты; или второстепенный изомер, или энантиомер, одного из этих компонентов проявляет активность. В наших исследованиях эксперименты над животными показали, что (-)-бета-элемен 98% чистоты давал такой же клинический эффект, как и смесь элеменов (2% инъекционный раствор 85% чистоты).
В нашем изобретении мы впервые обнаружили, что основным активным компонентом являлся (-)-бета-элемен (C15H24, с молекулярным весом 200,4), который, кроме того, может проходить через гемато-энцефалический барьер и является идеальным средством для лечения пациентов с опухолью головного мозга.
II. Молекулярный механизм.
1) Механизм смеси элеменов (0,5% эмульсия, 65% чистоты)
По всей видимости, смесь элеменов (65% чистоты) подавляет рост/деление раковых клеток благодаря блокированию перехода клеточного цикла из фазы G0/G1 к фазе S (Xu, X.J. et al. Studies of β-Elemene's induction of human liver cancer cells, Chinese Journal of Clinical Oncology, July: 30-32, 1999). Согласно данным проточной цитометрии (элемен 20 мкг/мл клетки рака печени SMMC), элемен, очевидно, блокирует фазовый переход от G0/G1 к S.
Иммуноцитохимические данные указывают на то, что смесь элеменов вызывает экспрессию супрессора опухоли р53, который, возможно, приводит к замедлению фазового перехода от G0/G1 к S, необходимого для восстановления ДНК (Xu, X.J. et al. Studies of β-Elemene's induction of human liver cancer cells, Chinese Journal of Clinical Oncology, July: 30-32, 1999).
Смесь элеменов вызывала апоптоз клеток рака печени человека в зависимости от дозы и времени, согласно данным электронной микроскопии и фрагментации ДНК (Xu, X.J. et al. Studies of β-Elemene's induction of human liver cancer cells, Chinese Journal of Clinical Oncology, July: 30-32, 1999). Смесь элеменов вызывает также апоптоз и снижает выражение протеина Bсl-2 в клетках К562 лейкемии человека (Yuan. J et al. Elemene induces apoptosis and regulates expression of bcl-2 protein in human leukemia К562 cells, Zhongguo Yao Li Xue Bao (Chinese Pharmacology Journal), 20: 103-106, 1999). Смесь элеменов вызывает дифференциацию клеток опухоли легкого (Aip-937, A549, SPC-A1, мелкоклеточного рака легкого Н128) (Qian, J. et al. The studies of Elemene Emulsion on the Reversion of human lung cancer cells, Chinese Journal of Clinical Oncology, July: 7-10, 1999), клеток меланомы В16 (Qiang, j.Etal. The induction of Differentiation of В16 cells by Elemene Emulsion, Chinese Journal of Clinical Oncology, July: 16-19, 1999). Ультраструктура показала морфологические изменения, такие как уменьшение микроворсинок и пикнозис ядра.
Апоптоз, вызванный смесью элеменов, может происходить вследствие влияния на уровень экспрессии протеина: уменьшение Bcl-2 и C-myc и повышение р53. Bcl-2 замедляет апоптоз. В нормальных клетках печени белок Bcl-2 не выражен и высокий уровень его экспрессии может привести к выживанию клеток опухоли. C-myc представляет собой сигнальный протеин, предшествующий путям трансдукции сигнала. C-myc может вызывать деление клеток. Р53, супрессор признаков опухоли, особенно связан с апоптозом. Когда ДНК в клетках повреждается, уровень протеина р53 повышается, чтобы замедлить переход из фазы G0/G1 в фазу S для восстановления ДНК. Длительная задержка, вызванная повышенным уровнем р53, вызывает апоптоз.
В целом, смесь элеменов (65% чистоты) отличается от прочих цитотоксичных противораковых препаратов и обладает высоким IC50 (50% ингибиторной концентрации) для клеток опухоли (20-50 мкг/мл in vitro). Его клинический эффект по уменьшению размеров опухоли проявляется, очевидно, вследствие того, что данная смесь способна вызывать апоптоз, замедлить клеточный цикл и вызвать дифференциацию. Однако данный активный компонент был неизвестен до нашего открытия.
2) Механизм (-)-бета-элемена (98% чистоты)
Мы впервые установили, что активным компонентом смеси элеменов является (-)-бета-элемен. Также нами был проведен эксперимент in vitro с целью прояснить молекулярный механизм (-)-бета-элемена, обуславливающий его противораковое действие.
(-)-бета-элемен показал различную активность по подавлению роста клеток для линий клеток немелколеточного рака легких (NSCLC) и линий клеток легочной фибробластомы и бронхиального эпителия. Кроме того, было обнаружено, что (-)-бета-элемен останавливает клетки NSCLC на фазе G2-M клеточного цикла, причем эта остановка сопровождается снижением уровня циклина В1 и фосфор-Сdc2 (треозин-161) и повышением уровней p27kipl и фосфор-Сdc2 (теоксин-15). А также (-)-бета-элемен уменьшал выражение Cdc25C, который дефосфорилирует/активизирует Cdc2, но повышал выражение киназы контрольной точки, Chk2, которая фосфорилирует/инактивирует Cdc25C. Эти факты позволяют предположить, что влияние (-)-бета-элемена на задержание G2-M в клетках NSCLC осуществляется частично благодаря механизму, зависящему от Chk2. Кроме того, (-)-бета-элемен является спусковым механизмом апоптоза в клетках NSCLC. Результаты ясно показывают, что (-)-бета-элемен вызывал активность каспазы-3,-7,-9, снижал выражение Вс1-2, вызывал выделение цитохрома с и повышал уровни расщепленной каспазы-9 и поли(АDP-рибозыполимеразы) в клетках NSCLC. Эти данные указывают на то, что влияние (-)-бета-элемена на гибель клеток рака легких может осуществляться посредством митохондриального рилизинга или обусловленного цитохромом с пути апоптоза (Wang, G. et al. Antitumor effect of (-)-beta-elemene in non-small-cell lung cancer cells is mediated via induction of cell cycle arrest and apoptotic cell death. Cell. Mol. Life. Sci., 62 (2005), in press).
3) Преодоление бета-элеменом множественной лекарственной устойчивости ко многим лекарственным препаратам
Элемент не вызывает эффекта множественной лекарственной устойчивости (MDR) (Wang, B.C. et al. The Experimental Studies of Association between Elemene and Tumor Multidrug Resistance, Chinese Journal of Clinical Oncology, July: 10-13, 1999). Линия клеток BEL-7402 рака печени человека была выращена и был получен ее штамм, BEL-7402/DOX, обладающий устойчивостью к лекарствам. После шести недель введения элемена в количестве 48,9 мкг/мл устойчивые к лекарствам клетки BEL-7402 все еще не выражали MDR1 mRNA или Р-гликопротеин. Таким образом, устойчивые к лекарствам клетки опухоли оказываются чувствительными к элемену.
В связи с этим, изобретатели произвели полный синтез (-)-бета-элемена, и в результате этого разработали эффективные способы производства (-)-бета-элемена, а также его производных. Каждый их включенных способов является недостаточным для целей получения (-)-бета-элемена. В данном изобретении предлагаются также новые промежуточные продукты, полезные при синтезе (-)-бета-элемена и его аналогов, композиции, полученные из такого (-)-бета-элемена и его аналогов, очищенные соединения (-)-бета-элемена и аналогов, помимо способов использования (-)-бета-элемена и аналогов (-)-бета-элемена при лечении рака. Необходимо отметить, что предложенные в данном изобретении (-)-бета-элемен и его производные имеют исключительно высокие характеристики как противораковые средства in vivo, и они более эффективны для лечения рака и менее токсичны для нормальных клеток, чем основные химиотерапевтические средства, используемые в настоящее время, включая таксол, винбластин, адриамицин и камптотецин.
III. В области лечения опухоли головного мозга требуются новые лекарственные препараты
1) Общие сведения об опухолях головного мозга
Развитие новых эффективных способов лечения опухолей головного мозга отстает по сравнению с лечением других злокачественных новообразований, и при этом прогноз и уровень смертности аналогичен том, который был 30 лет назад. Злокачественные глиомы, самый распространенный подтип первичных опухолей головного мозга, представляют собой агрессивные, высокоинвазивные и разрушительные для нервной системы опухоли. Из них самым злокачественным проявлением является глиобластома, при которой медиана переживаемости составляет от 9 до 12 месяцев, несмотря на максимальные усилия при лечении.
В США ежегодно сообщается о 15000 случаев опухоли головного мозга. Поскольку более 50% этих опухолей представляют собой злокачественные глиомы, можно ожидать, что ежегодно возникает до 7500 новых случаев глиобластомы и анапластической астроцитомы. Опухоли головного мозга являются второй по значимости причиной смерти от рака среди детей в возрасте до 15 лет и молодых людей в возрасте до 34 лет. Опухоли головного мозга являются второй по скорости возрастания причиной смерти от рака среди людей старше 65 лет. Следовательно, имеется неотложная потребность разработать эффективные способы лечения глиобластомы с тем, чтобы продлить жизнь этих пациентов и улучшить качество их жизни.
2) Классификация опухолей головного мозга
Глиомы были определены патологически как опухоли, которые демонстрируют глиальную дифференциацию при гистологическом, иммуногистохимическом и ультраструктурном исследовании. Наиболее широко используемая схема классификации глиом и распределение их по группам была предложена Всемирной организацией здравоохранения (ВОЗ). Глиомы классифицируются согласно их предполагаемой линии дифференциации, т.е. демонстрируют ли они отличительные характеристики клеток астроцитарной глиомы, олигодендроглии или эпендимных клеток. Кроме того, они распределяются по шкале от I до IV группы, согласно степени их злокачественности, определяемой по различным гистологическим характеристикам. Опухоли первой группы являются биологически доброкачественными и могут быть излечены хирургическим путем, если это признается допустимым во время постановки диагноза; опухоли группы II проявляют низкую степень злокачественности и могут подвергаться длительным курсам лечения, но не могут быть излечены хирургическим путем; опухоли группы III являются злокачественными и приводят к смерти в течение нескольких лет; опухоли группы IV (глиобластома) проявляют высокую степень злокачественности, как правило, не поддаются химиотерапии и приводят к летальному исходу в течение 9-12 месяцев.
3) Современные способы лечения головного мозга
Основные способы лечения включают 1) хирургический, 2) лучевую терапию, 3) химиотерапию и 4) биологическую терапию. Поскольку головной мозг представляет серьезную проблему по доставке в него лекарств, химиотерапия обычно сочетается с применением блокиратора гематоэнцефалического барьера (например, маннита). Более 50% пациентов обращаются за альтернативными методами лечения в добавление к традиционным. В настоящее время в США химиотерапия включает следующие препараты:
1) Вещества, препятствующие развитию сосудов, которые прерывают снабжение опухолей кровью. Эти вещества проходят в настоящее время исследования и включают талидомит, TNP-470, тромбоцитный фактор 4 (PF4), интерферон и ангиостатин.
2) Дифференцирующие вещества представляют собой класс лекарственных препаратов, которые могут превращать незрелые делящиеся клетки опухоли в зрелые клетки, останавливая тем самым рост опухоли. К ним относятся, например, ретиноевая кислота, фенилацетат и бриостатин (bryostatin).
3) Иммунотерапевтические средства, предназначенные для повышения эффективности иммунной системы в поиске и разрушении раковых клеток. В настоящее время проводятся исследования нескольких инструментов, признанных полезными для стимулирования иммунной системы: интерферона, лимфоцитов и вакцин опухолей.
4) Другие способы лечения включают следующие лекарственные препараты: СРТ-11 (камитотецин), PCV (пенициллин), тамоксифен, талидомит, VP-16/эпотиазид и BCNU. Химиотерапия с помощью адъювантов, обычно BCNU (1,3-бис(2-хлорэтил)-1-нитрозомочевина), незначительно увеличивает выживаемость. Попытки ввести BCNU посредством внутриартериальных инъекций встретились с затруднениями, вызванными необратимой энцелофалопатией и ипсилатеральной потерей зрения, вызванной токсическим поражением сетчатки.
В настоящее время самым многообещающим препаратом для химиотерапии опухолей головного мозга является TEMODAR (темозоломид), который был одобрен Комиссией по пищевым продуктам и лекарствам (FDA) США в августе 1999 года для взрослых пациентов с рецидивирующей формой анапластической астроцитомы. TEMODAR (темозоломид) является первым химиотерапевтическим препаратом для орального приема, который, как было обнаружено, способен преодолеть гемато-энцефалический барьер. Этот цитотоксический алкилирующий препарат для орального применения является лидером в новом классе соединений, известных как имидазотетразины. Общий уровень реагирования опухоли на TEMODAR составил 22%, включая полное реагирование (9%) и частичное реагирование (13%). Полное реагирование (ПР) определяется как исчезновение опухоли, по крайней мере, на два последующих месяца по результатам измерения с помощью магниторезонансной томографии (МРТ). Уменьшение площади опухоли более чем на 50% на два месяца определяется как частичное реагирование (ЧР).
4) Эффективность использования смеси элеменов для лечения опухолей головного мозга
Элемен проходит через гематоэнцефалический барьер (ГЭБ) (Qian, J., New anti-tumor drug, Elemene's pharmacology and Clinical results, Chinese Journal of Clinical oncology, July: 1-3,1999). Элемен, помеченный изотопом3H, вводился внутривенно или давался перорально экспериментальным животным. Радиоактивность была обнаружена в мозге животных.
Смесь элеменов для инъекций (2% инъекционный раствор, 85% чистоты) рассматривается Комиссией по пищевым продуктам и лекарствам КНР на предмет одобрения для лечения пациентов с первичными и вторичными опухолями головного мозга. Данная формула уже прошла одобрение техническим советом по лекарствам в КНР. При проведенных в Китае клинических испытаниях испытывалась эта новая формула смеси элеменов (2% инъекционный раствор, 85% чистоты), в которой содержится один и тот же активный фармацевтический ингредиент (АФИ), но различные неактивные компоненты, предназначенные для стабилизации элемена. При испытаниях на 61 пациенте смесь элеменов (2% инъекционный раствор, 85% чистоты) показала лучшие результаты, чем имеющиеся на рынке препараты (включая TEMODAR, BCNU and CCNU), при лечении больных с опухолью головного мозга, при этом в данной группе пациентов эффект уменьшения опухоли составил 35-40% (ПР+ЧР). Препарат TEMODAR имеет уровень ПР+ЧР около 20%. ПР обозначает полное реагирование, т.е. уменьшение размера опухоли после лечения до неопределяемого; ЧР обозначает частичное реагирование, т.е. уменьшение размера более чем на 50% по сравнению с размером опухоли до лечения. Самое продолжительное время переживания пациента с глиобластомой составило 62 месяца после лечения смесью элемена (2% инъекционный раствор, 85% чистоты).
IV. Бета-элеменал как метаболит бета-элемена
Как показано в статье Li, Z. et al, Даляньсая группа изучала метаболиты бета-элемена (98% чистоты, главным образом, бета-элемен) в желчи крыс. После внутривенной инъекции бета-элемена (98% чистоты) в дозе 100 мг/кг метаболит из крысиной желчи извлекался при помощи эфира. Для анализа метаболита в крысиной желчи после внутривенной инъекции бета-элемента использовались масс-спектрометрия, ядерный магнитный резонанс, инфракрасная спектрометрия и ультразвуковая спектрометрия. По результатам ядерного магнитного резонанса было высказано предложение, что метил углерода №11, соединяясь с углеродом №10 метаболита в крысиной желчи был окислен до альдегида. Молекулярный вес метаболита равнялся 218, что было определено при помощи масс-спектрометрии. Инфракрасная спектрометрия и ультрафиолетовая спектрометрия подтвердили, что в метаболите имелся альдегид. Было высказано предположение, что структура метаболита в крысиной желчи является производной от бета-элемена, возможно, бета-элеменала. Таким образом, очевидно, что биотрансформация бета-элемена существует in vivo.
Однако, в указанных выше публикациях авторы не указывали на то, какой именно стереоэнантиомер элеменала был обнаружен. И, кроме того, они не изучали активность и использование элеменала.
Согласно нашим данным, полученным при экспериментах над животными, бета-элемен, помеченный тритием, и его производные и/или его метаболиты могут проходить через гематоэнцефалический барьер (ГЭБ). Но не производились точные эксперименты, чтобы понять, проходит ли через ГЭБ сам бета-элемен или его производные или его метаболиты или их комбинация. Таким образом, остается неизвестным, каким образом действует элемен при лечении опухолей головного мозга.
V. Множественная лекарственная устойчивость, вызываемая традиционными химиотерапевтическими препаратами
1) Действие традиционных химиотерапевтических препаратов
Цисплатин, 5-FU, таксол и производные таксола являются традиционными эффективными химиотерапевтическими препаратами, но их полезные качества ухудшаются вследствие вызываемой ими множественной лекарственной устойчивости и их потенциальной цитотоксичности.
Цисплатин является хорошо изученным противораковым препаратом. Впервые Цисплатин был синтезирован в 1845 г., но его цитотоксические характеристики не были описаны до 1965 г. Был проведен эксперимент, чтобы выяснить, будет ли электрический ток подавлять репродукцию бактерий E.coli. По результатам эксперимента был сделан вывод, что продукты электролиза платинового электрода являются причиной подавления. Цисплатин проходил клинические испытания в 1971 г. Цисплатин представляет собой неорганический комплекс, образованный атомом платины, окруженным атомами хлорида и аммиака в цис-положении горизонтальной плоскости. С точки зрения внутриклеточных процессов вода замещает хлорид и образует платиновые комплексы с высокой реакционной способностью. Эти комплексы подавляют ДНК благодаря ковалентным связям, приводящим к образованию поперечных межмолекулярных связей внутри цепочек ДНК, между цепочками ДНК и в белках ДНК. Экспериментальные и клинические данные говорят о том, что Цисплатин повышает эффективность лучевой терапии. По результатам ранних исследований предполагалось, что Цисплатин является неспецифическим препаратом относительно фазы клеточного цикла, но недавние исследования показали его комплексное и изменяющееся воздействие на клеточный цикл.
Цисплатин используется, главным образом, против рака мочевого пузыря, рака яичников и рака семенников. Среди других локализаций рака лечение Цисплатином может включать такие виды рака, как рак коры надпочечников, опухоли головного мозга, рак молочной железы, рак шейки матки, внутриматочный рак, рак желудочно-кишечного тракта, герминома, гинекологическая саркома, рак головы и шеи, гепатобластома, злокачественная меланома, нейробластома, неходжкинская лимфома, остеосаркома и рак щитовидной железы.
Оба, таксол и 5-FU, являются эффективными противораковыми препаратами, но они вызывают эффект множественной лекарственной устойчивости. Таксол впервые был открыт вначале прошлого века, но клинические испытания этого препарата начались в 1983 г. Таксол воздействует на контрольную точку митоза в клеточном цикле. Таксол используется, главным образом, при лечении рака молочной железы, рака яичника, рака головы и шеи и рака легких. 5-FU был разработан в 1957 г. на основе результатов наблюдений, показывающих, что клетки опухоли используют урацил спаренных оснований для синтеза ДНК эффективнее, чем нормальные клетки микоза тонкого кишечника. Именно фторированный пиримидин метаболизируется внутриклеточно до своей активной формы фтордеоксиуридина монофосфата (FdUMP). Активная форма подавляет синтез ДНК благодаря подавлению нормальной выработки тимидина. 5-FU является специфическим для фаз клеточного цикла (S-фаза). 5-FU, используется, главным образом, для лечения рака молочной железы, рака толстой и прямой кишки, рака желудка и рака печени. Менее распространенные области применения 5-FU включают актинический кератоз, рак мочевого пузыря, рак шейки матки, внутриматочный рак, рак головы и шеи, немелкоклеточный рак легких, рак яичников, рак поджелудочной железы и рак простаты.
2) Явление множественной лекарственной устойчивости у раковых клеток
Явление множественной лекарственной устойчивости у раковых клеток является одной из главных причин неудачи при применении многих химиотерапевтических препаратов. После воздействия на раковые клетки химиотерапевтическим препаратом А, эти раковые клетки становятся не только устойчивыми к препарату А, но также устойчивыми к препаратам с отличной от препарата А химической структурой, функцией и механизмом подавления. В настоящее время считается, что избыточное выражение гликопротеина Р170 на клеточной мембране является одной из главных причин возникновения множественной лекарственной устойчивости. Гликопротеин Р170 представляет собой насос, зависящий от энергии. Р170 выкачивает лекарственные препараты из клеток с тем, чтобы клетки могли понизить концентрацию лекарственного препарата внутри клетки, что называется явлением множественной лекарственной устойчивости. К настоящему времени ученые открыли много препаратов, противодействующих явлению устойчивости, которые можно сгруппировать следующим образом: 1) блокираторы каналов кальция, 2) ингибиторы кальмодулина, 3) стероиды и гормоны, 4) иммуномодуляторы, 5) антибиотики. Перечисленные выше препараты, противодействующие устойчивости, показали свою эффективность в экспериментах in vitro, но оказались слишком токсичными для испытаний на людях.
Цисплатин вызывает экспрессию Р-гликопротеина. Согласно отчету Yang et al's р-гликопротеин выражался в линии клеток рака яичников после воздействия на них Цисплатина (Yang, X, and Page, M, P-glycoprotein expression in ovarian cancer cell line following treatment with cisplatin, Oncol. Res. 1995, 7(12): 619-24). Линия SKOV3 клеток рака яичников человека выращивалась в течение четырех месяцев в присутствии увеличивающихся концентраций Цисплатина (25-100 мкг/мл). В ходе эксперимента в клетках наблюдались значительные морфологические изменения, включая уменьшение размеров клеток, исчезновение клеточных выступов и склеивание. Это сопровождалось появлением р-гликопротеина на клеточной мембране. Новая клетка, обозначенная SKOV3/CIS, приобрела устойчивость к классическим лекарственным препаратам, вызывающим устойчивость, таким как доксорубицин, таксол, и actinomycine D. Верапамил повышал чувствительность SKOV3/CIS к доксорубицину (в 260 раз), что согласуется с предложенным механизмом влияния р-гликопротеина на устойчивость к лекарственным препаратам, но он не усиливал цитотоксичность цисплатина в клетках SKOV3/CIS.
Было показано, что некоторые лекарственные препараты снижают вызываемый цисплатином эффект множественной лекарственной устойчивости. В литературе отмечается, что SDZ PSC 833, полусинтетический ундекапептид, являющийся производным от циклоспорина D, представляет собой один из наиболее мощных и известных ингибиторов Р-гликопротеина, транспортера множества лекарств (Baekelandt, M et al.. Phase I/II trial of cisplatin and doxorubicin with SDZ PSC 833 in patients with refractory ovarian cancer, Proc. Annu. Meet. Am. Soc. Clin. Oncol 1997; 16:
A757). Отбирались больные с гистологически установленным раком яичника, если они имели клинически установленное заболевание, определяемое либо как стабильное заболевание после не менее чем трех циклов, либо как прогрессирующее заболевание после не менее чем двух циклов, при этом проводилось лечение комбинацией цисплатина и антрациклина. Затем лечение было продолжено цисплатином в дозе 50 мг/м2 и доксорубицином с добавлением PSC. Максимальная переносимая доза доксорубицина была определена равной 35 мг/м2 с PSC. При внутривенном введении SDZ PSC 833 вместе с цисплатинами и доксорубицином клиницистами наблюдалась сильная реакция у пациентов, прошедших тяжелый курс предварительного лечения с прогрессирующим заболеванием, и приемлемая токсичность.
Применение препаратов, препятствующих возникновению множественной лекарственной устойчивости, является принципиальным методом, который побеждает клиническую устойчивость к лекарственным препаратам и усиливает эффективность химиотерапии. Хотя за прошедшие два десятилетия было обнаружено много противодействующих соединений, клиническое применение этих препаратов ограничено вследствие их высокой токсичности и наличия побочного действия.
Мы являемся первыми изобретателями, которые обнаружили, что (-)-бета-элемен может противодействовать явлению множественной лекарственной устойчивости, вызываемому цисплатином, 5-FU или таксолом (или производными таксола). (-)-бета-элемен или его аналоги можно использовать как препарат для сочетанной терапии вместе с цисплатином, 5-FU или таксолом (или производными таксола), поскольку он представляет собой нецитотоксичный противораковый препарат. Клинические испытания продемонстрировали, что смесь бета-элемена (главным активным ингредиентом является (-)-бета-элемен) не оказывала отрицательного действия на сердце, печень или почки и не оказывала подавляющего действия на костный мозг.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Во всех следующих параграфах (-)-бета-элеменал, (-)-бета-элеменол и (-)-бета-элемен-фторид являются аналогами (-)-бета-элемена.
1) Одной из целей данного изобретения является создание способов приготовления (-)-бета-элемена и его аналогов, используемых в качестве противораковых терапевтических средств.
2) Еще одной целью данного изобретения является создание различных соединений, используемых в качестве промежуточных продуктов при приготовлении (-)-бета-элемена, а также его аналогов.
3) Еще одной целью данного изобретения является создание способов синтеза для приготовления подобных промежуточных продуктов.
4) Еще одной целью данного изобретения является создание рецептур, которые можно использовать при лечении пациентов, страдающих от рака, включающих любые аналоги (-)-бета-элемена, которые можно получить согласно способам приготовления, предложенным в данном изобретении, возможно, в сочетании с фармацевтическими носителями.
5) Еще одной целью данного изобретения является создание способов лечения больных, страдающих от рака, используя любой из аналогов (-)-бета-элемена, который можно получить согласно способам приготовления, предложенным в данном изобретении, возможно, в сочетании фармацевтическими носителями.
6) Еще одной целью данного изобретения является использование (-)-бета-элемена и его аналогов в сочетанной терапии рака различных локализаций совместно с цисплатином или таксолом (или его производными) или 5-FU. (-)-бета-элемен и его аналоги являются эффективными не только в качестве средства противодействия множественной лекарственной устойчивости в раковых клетках, как in vitro, так и in vivo, но также была установлена их активность как вспомогательных чувствительных препаратов, которые проявляют большую цитотоксичность по отношению к клеткам со множественной лекарственной устойчивостью, чем к нормальным клеткам, и их синергистическое действие, проявляющееся в их большей активности в сочетании с другими цитотоксичными препаратами, такими как цисплатин, чем при их индивидуальном применении при тех же концентрациях, (-)-бета-элемен или его аналоги могут снизить IC50 цисплатина или таксол (или его аналогов), или 5-FU, необходимую для подавления роста опухоли в линиях раковых клеток, и они могут снизить дозу цисплатина или таксола (или его аналогов), назначаемую раковым больным, и, тем самым, снизить побочное действие этих цитотоксичных препаратов.
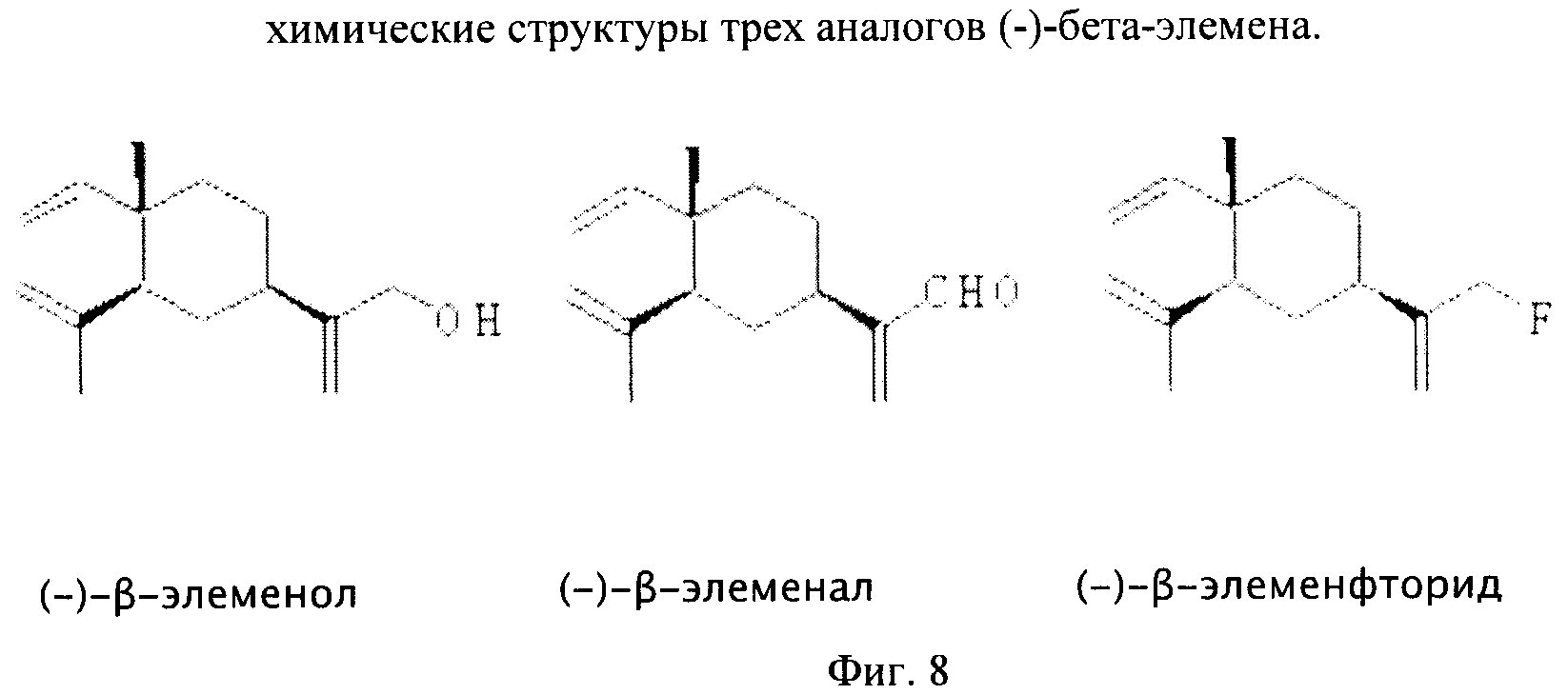
(-)-бета-элеменал, метаболит (-)-бета-элеменала, является более мощным противораковым средством, чем (-)-бета-элемен
Авторы данного изобретения однозначно осуществили синтез (-)-бета-элеменала и в результате этого разработали эффективные способы получения (-)-бета-элеменала, а также его аналогов. В данном изобретении также предлагается новая функция (-)-бета-элеменала и его аналогов. Неожиданными оказались обнаруженные возможности применения, (-)-бета-элеменал оказался обладающим более мощной противораковой активностью, чем (-)-бета-элемен. Кроме того, (-)-бета-элеменал, представляющий собой метаболит (-)-бета-элемена, потенциально может иметь более длительный период полувыведения из организма человека и, тем самым, упростить схему дозировки лекарственного препарата.
Другие аналоги (-)-бета-элемена
Авторы данного изобретения провели синтез (-)-бета-элеменола и в результате этого разработали эффективный способ получения (-)-бета-элеменола, а также его аналогов, (-)-бета-элеменол более растворим, чем (-)-бета-элемен, что дает ему потенциальные преимущества. В качестве противоракового средства (-)-бета-элеменол является таким же мощным препаратом, как и (-)-бета-элемен.
Авторы данного изобретения также осуществили синтез (-)-бета-элемена-фторида, нового соединения, и в результате этого разработали эффективный способ получения (-)-бета-элемена-фторида, а также его аналогов, (-)-бета-элемен-фторид (имеющий в своем составе радиоактивный фтор-18) является соединением, которое возможно использовать для получения рентгеновских изображений, например мозга, и в качестве терапевтического средства при лучевой терапии. В качестве противоракового средства (-)-бета-элемен-фторид является таким же мощным препаратом, как и (-)-бета-элемен.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
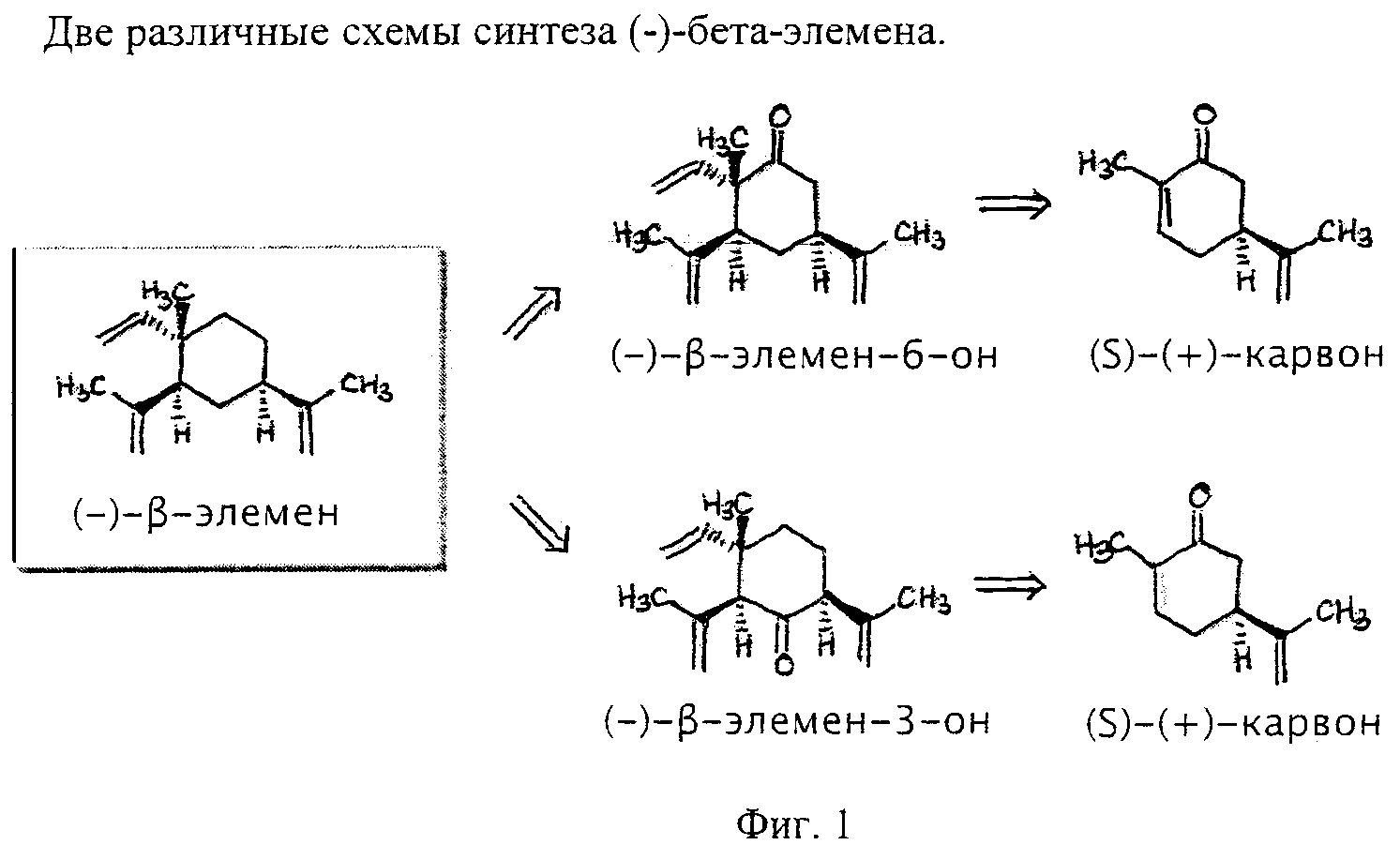
Фиг.1 - две различных схемы синтеза (-)-бета-элемена.
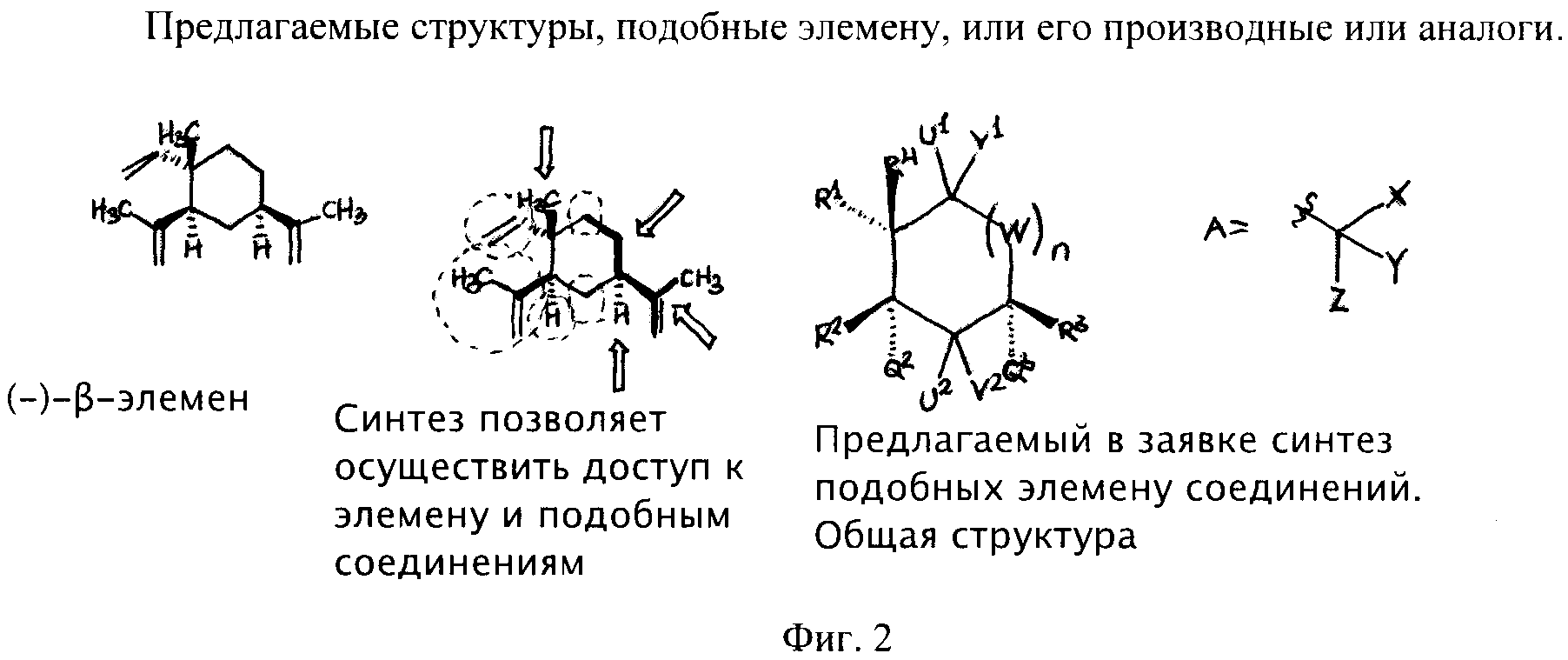
Фиг.2 - предлагаемые в заявке структуры, подобные элемену, или их производные.
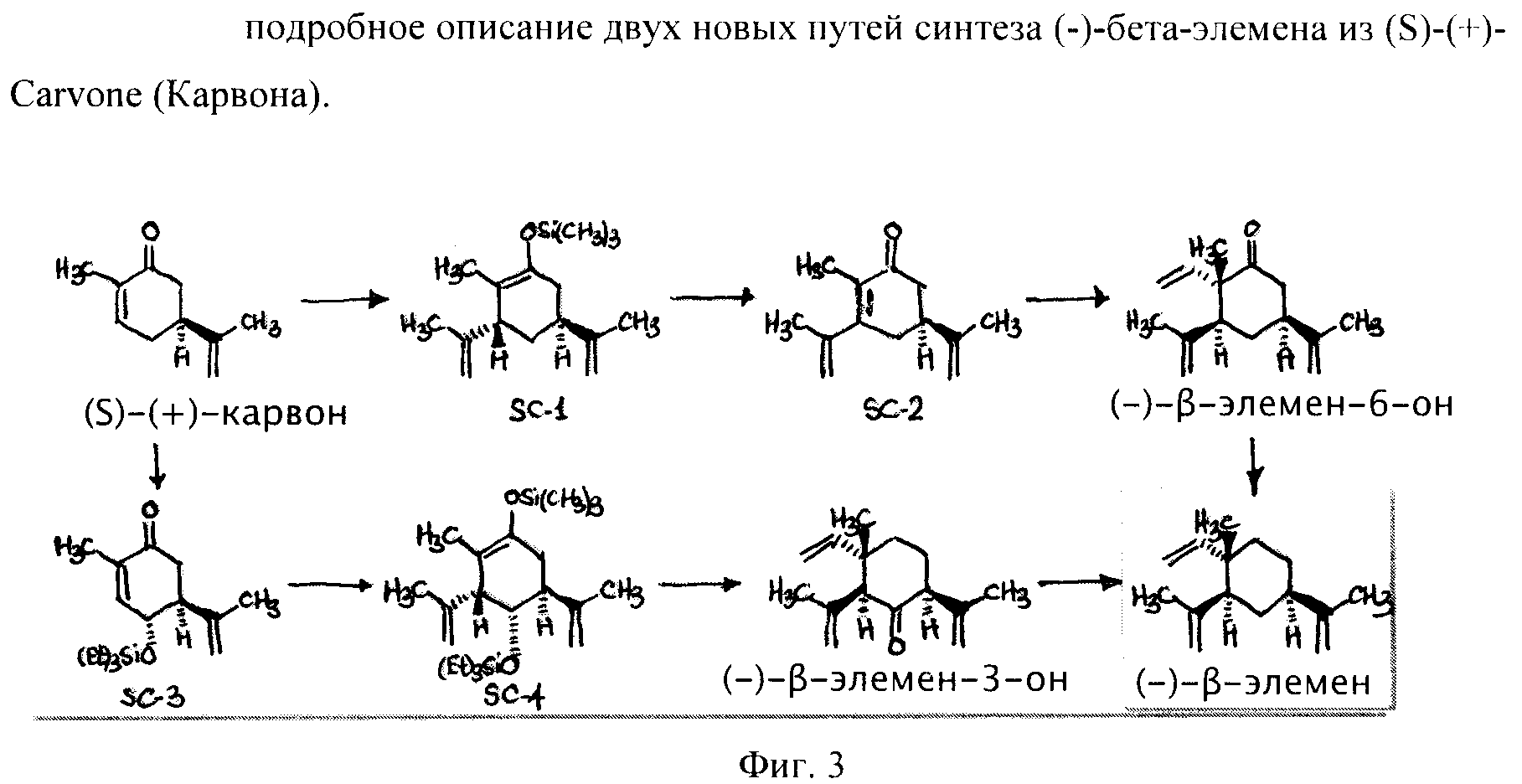
Фиг.3 - подробное описание двух новых путей синтеза (-)-бета-элемена из (S)-(+)-Carvone (Карвона).
Фиг.4 - анализ синтеза Corey (Корей) для (-)-бета-элемена.
Фиг.5 - приготовление производного элемена (+)-Fuscol из (R)-(-)-Carvone.
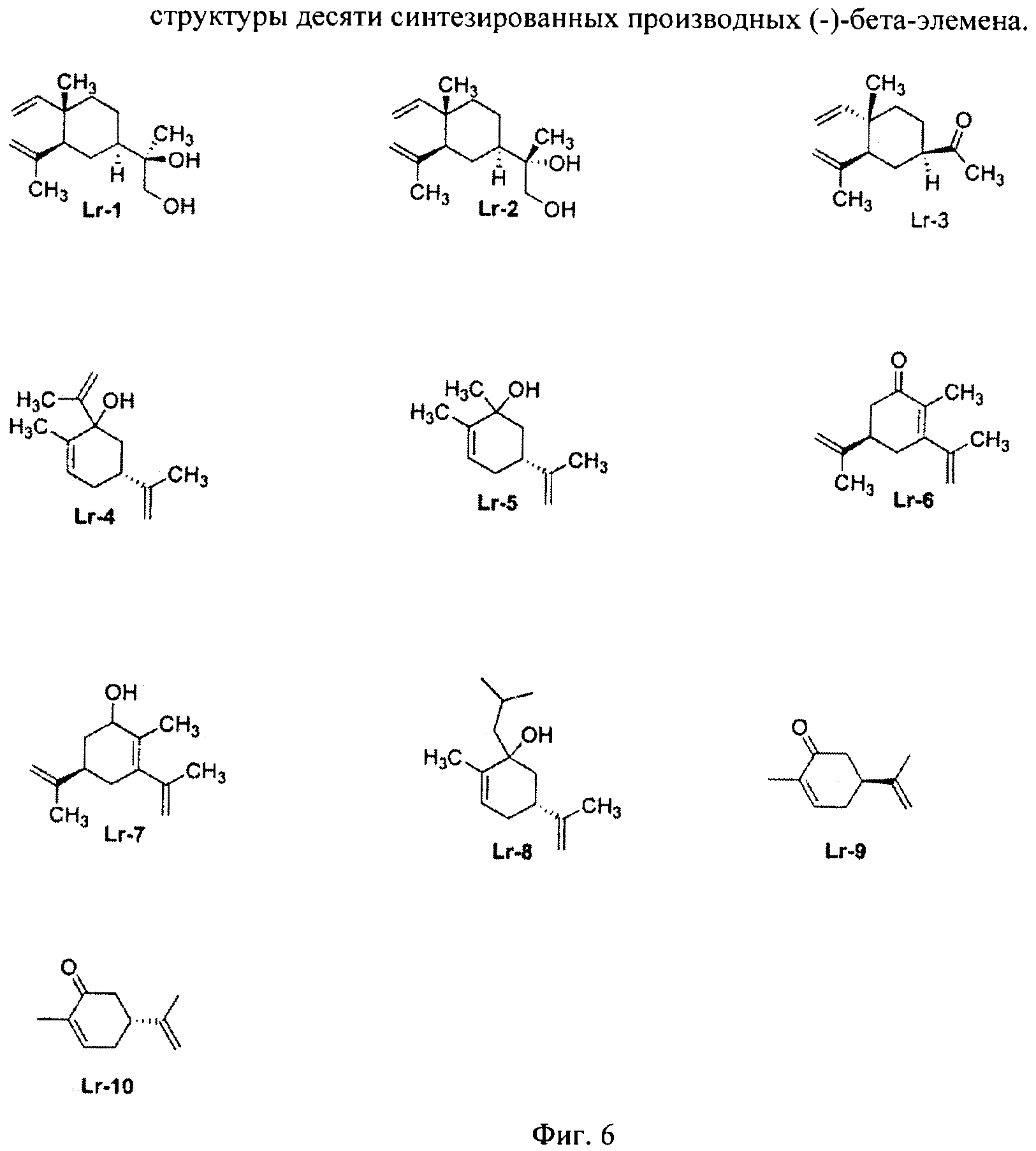
Фиг.6 - структуры десяти синтезированных производных (-)-бета-элемена.
Фиг.7 - химические структуры β, γ, δ - элемена.
Фиг.8 - химические структуры трех аналогов (-)-бета-элемена.
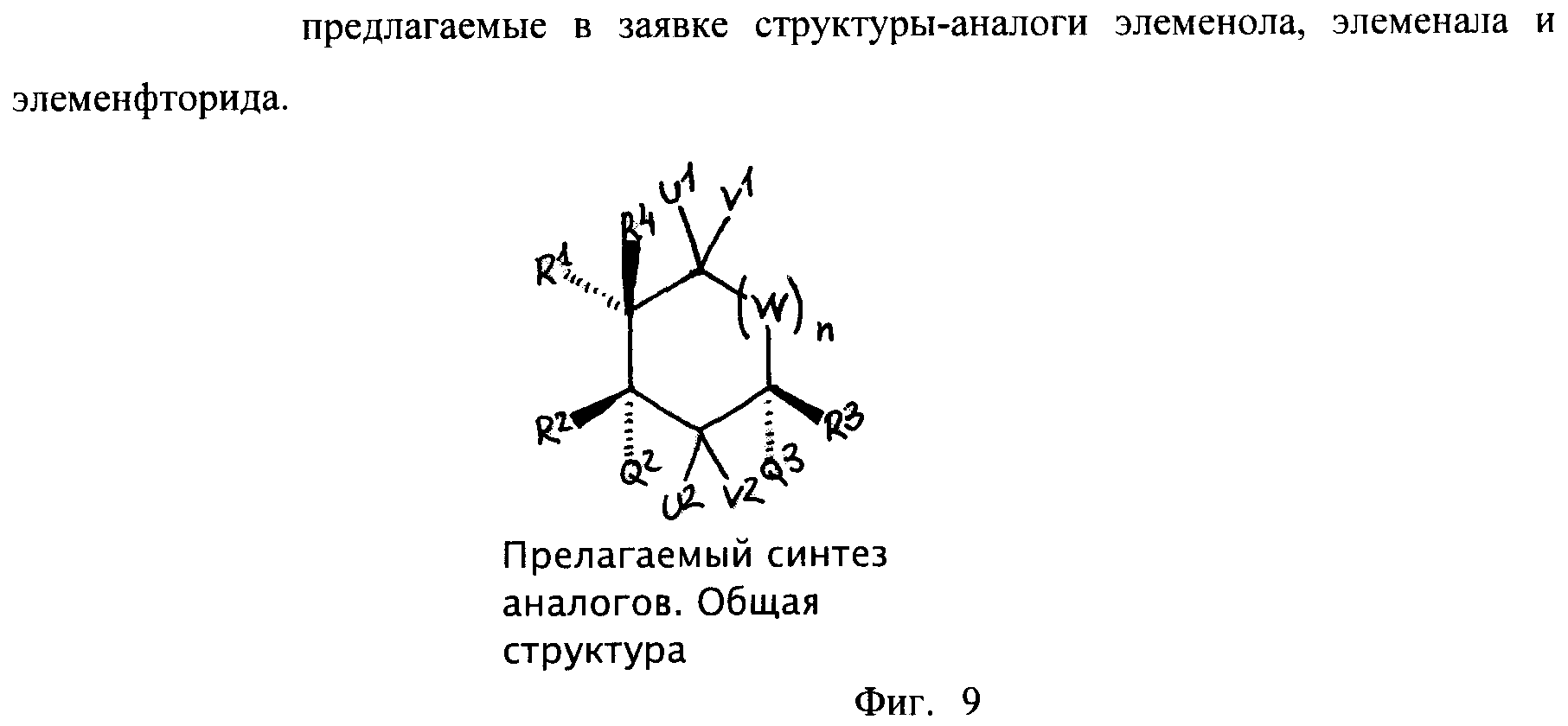
Фиг.9 - предлагаемые в заявке структуры-аналоги элеменола, элеменала и элемена-фторида.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
1) Предлагаемые в заявке пути синтеза и рецептуры (-)-бета-элемена и его аналогов
Авторы данного изобретения утверждают об обнаружении неожиданного эффективного, безопасного и не вызывающего множественной лекарственной устойчивости, нетоксичного действия и возможности широкого применения (-)-бета-элемена в качестве противовирусного, противомикробного, антибиотического и особенно в качестве противоракового химиотерапевтического средства; кроме того, предлагаются (-)- структуры-аналоги бета-элемена, а также способы получения указанных структур и способы получения (-)-бета-элемена. Также предлагается использование (-)-бета-элемена и аналогов (-)-бета-элемена в чистом виде или в сочетании в качестве противовирусного, противомикробного и противоракового средства.
Синтез (-)-бета-элемена
Интересно отметить, что (-)-бета-элемен не был до настоящего времени синтезирован в энантиомерно чистой форме. Энантиомерная чистота является критической для правильной оценки лекарственного препарата. Например, энантиомеры Thalidimide (Талидимида) могут быть либо высокоэффективными лекарствами, либо ужасно уродующими тератогенами, в зависимости от энантиомера. Основные результаты наших последних исследований (-)-бета-элемена, сформулированные отдельно или совместно с другими, позволили авторам изобретения предложить синтез (-)-бета-элемена и аналогов (-)-бета-элемена. Ниже представлены четыре плана синтеза.
Часть 1: Во-первых, предлагаются два новых синтеза (-)-бета-элемена и широкого спектра подобных (-)-бета-элемену соединений из (S)-(+)-карвона (Carvone). Предлагается следующее:
A) Начиная с (S)-(+)-Carvone, производное соединение SC-1 (-)-бета-элемена может быть легко получено путем реакции присоединения со звеном 2-пропенила, например, посредством купрата лития-ди-2-пропенила (реагент Гильмана) и захвата энолата, например, посредством триэтилсилилхлорида, чтобы образовать силилэноловый эфир. Превращение SC-1 в SC-2 делает возможным образование (-)-бета-элемена-6-один в результате короткой последовательности следующим образом: окисление энолового эфира SC-1 до энола SC-2 [используя палладий II]. Последующая реакция присоединения конъюгата 1,4 с гидридом, проводимая, например, с медным реагентом, с последующим захватом метилйодида образует α,α-диметилкетон. Активация связей С-Н в экваториальном метиле (при использовании, например, оксима, полученного из кетона) может сопровождаться дальнейшим окислением полученного в результате этого спирта до альдегида, за которым следует олефинация, дающая (-)-бета-элемен-6-один. В качестве окислителя в связи С-Н может использоваться, например, палладий (0) или платина (II). Превращение (-)-бета-элемена-6-один в (-)-бета-элемен может быть осуществлено путем реакции восстановления (например, гидразином, гидроксидом калия, теплом - реакция восстановления Вольфа-Кишнера).
B) Второй путь с использованием (S)-(+)-Карвона также обрисован в общих чертах, и он подобен описанному выше плану А, но, однако, этот второй путь обеспечивает доступ к некоторым другим молекулам, подобным (-)-бета-элемену: избирательное окисление (S)-(+)-Карвона в позиции 3 [используя нумерацию (-)-бета-элемена], с последующей подходящей защитой, в том случае, если она необходима, даст SC-3 (в данном примере защита 3-гидроксила дается в виде триэтилсилилэфира). Следуя тем же путем, что и в описанном выше способе (A), SC-4 можно легко получить путем реакции присоединения конъюгата со звеном 2-пропенил, например, посредством купрата лития-ди-2-пропенила (реагент Гильмана) и захвата энолата в виде энолового эфира (например, с триэтил силил хлоридом), как показано. Превращение этого аддукта в (-)-бета-элемен-3-один можно кратко описать следующим образом: Окисление SC-4 до энона можно осуществить, используя, например, палладий (II); за ним следует реакция присоединения конъюгата 1,4 с гидридом (проводимая, например, с медным реагентом), с последующим захватом метилйодида образует α,α-диметилкетон. Активация связи С-Н в экваториальном метиле при использовании оксима, полученного из кетона, сопровождается окислением до альдегида и последующей олефинацией этого альдегида. Оставшийся карбонил можно удалить посредством реакции восстановления. Удаление триэтилсилилэфира с целью получения алкоголя и последующее окисление дадут (-)-бета-элемен-3-один. Превращение (-)-бета-элемена-3-один в (-)-бета-элемен можно легко осуществить путем восстановления карбонила.
Часть 2: На основе синтеза Корея (Corey)
(+)-фускол (##STR2##) с чистотой выше 99% через промежуточный продукт терпеноид (-)-бета-элемена (##STR6##).
Реакция гераниола с 1,1 эквивалентом β,β-диметилакрилоилхлорида и 1,5 эквивалентом триэтиламина (СН2Сl2, -78°С, 3 часа) дала β,γ-ненасыщенный эфир ##STR3## (выход 99%) в результате интересной реакции, которая, вероятно, происходит через промежуточный продукт винилкетена. Воздействие на ##STR3## в толуоле 1,1 эквивалентом (S,S)-бромборана ##STR1## и 8,3 эквивалентом триэтиламина (-70°С в течение 27 часов, затем 4°С в течении 36 часов) дало продукт ##STR4a## Ireland-Claisen (продукт Ирланда-Кляйзена) в качестве основного продукта вместе с второстепенным диастереомером (общий выход 85%). Восстановление смеси до соответствующих первичных спиртов (LiAlH4, Et2O, 23°С, 24 часа) и хроматография на пропитанном AgNO3 силикагеле дали диастереомерно чистый продукт ##STR4b## (70% выход) с энантиомерной чистотой выше 99%. Воздействие на ##STR4c## 1,1 эквивалентом Et2AlCl (CH2Cl2, -78°C, 1,5 часа) с последующим экстрактивным выделением и хроматографией на силикагеле AgNO3 дало циклический экваториальный алкоголь ##STR5a## (88% выход) вместе с 3% выхода менее полярного диастереомера (имеющего экваториальный гидроксил и аксиальный бета-изопропенил как замещающие группы). Реакция ##STR5a## с 2-хлор-1,3-диметил-1,3,2-диазафосфоланом и триэтиламином (CH2Cl2, 23°C, 75 минут) дала после окисления с 1,2 эквивалентами H2O2 в течение 10 минут ##STR5b##, который восстанавливался избыточным количеством лития и терм-амил алкоголя (4 эквивалента) в жидком NH3-THF (-33°С, 10 часов) и образовывал (+)-бета-элемен (##STR6##, выход 95%), [alpha]23D+15.4 (c=0.6, СНСl3), который был неразличим при помощи ядерного магнитного резонанса и инфракрасного спектроскопического сравнения от подлинного образца, полученного естественным путем (-)-бета-элемена.
(-)-бета-элемен (##STR6##) был превращен в метилкетон ##STR7## за два последовательных шага. Каталитическая реакция дигидроксилиравания со связанным с фталазином бисэфиром Шарплесса (Sharpless) с дигидрохинидином, (DHQD)2-PHAL (0,1 эквивалент), K2OsO4 (0,01 эквивалент), K3Fе(СN)6 (3 эквивалента), K2СО3 (3 эквивалента) и CH3SO3NH2 эквивалент) в 1:1 растворе терт-бутилалкоголя в воде при 0°С в течение 11 часов дала после хроматографии на силикагеле диол, полученный в результате избирательного воздействия на изопропениловую добавку (1,4-) к угловой метильной группе (выход 76%; выход 92%, скорректированный для восстановленной ##STR6##). Расщепление полученного 1,2-диола с 3 эквивалентами NaIO4 (4:1 THF-Н2О, 23°С, 30 минут) дало ##STR7## при 96% выходе. Высокоизбирательное воздействие OsО4 всего лишь на одну из трех двойных связей в ##STR6## при катализе посредством (DHQD)2-PHAL было предсказано на основе механистической модели, недавно предложенной для асимметричной реакции дигидроксилирования. Соединение метилкетона ##STR7## с 20 эквивалентам каждого из следующих соединений: (n-BuO)2POCH2CH=CHCOOn-Bu и LiOt-Bu (добавляемых в виде четырех порций, раствор THF, 23°С, 48 часов) давало тетраэновый эфир ##STR8## (бутил 5-[(1'S,3'R,4'R)-3'-изопропенил-4'-метил-4'-винилциклогексил]-(Е,Е)-гексадиеноат) при 80% выходе после хроматографии на силикагеле. Реакция ##STR8## с 5 эквивалентами MeLi (Et2O, -30°С, 12 часов) дала (+)-фускол (##STR2##), [α]23D+19.7° (с=1, СНСl3), в виде бесцветного масла при выходе 95%.
В используемом здесь смысле, термин "алкил линейной или разветвленной цепи" включает следующие соединения, но не ограничивается ими: метил, этил, пропил, изопропил, t-бутил, втор-бутил, циклопентил или циклогексил. Алкильная группа может содержать один атом углерода или до четырнадцати атомов углерода, но в предпочтительном варианте содержит один атом углерода или до 9 атомов углерода и может быть замещена различными группами, к которым относятся, но не ограничиваются ими, ацил-, арил-, алкокси-, арилокси-, карбокси-, гидрокси-, карбоксамидо- и/или N-ациламино-группы.
В используемом здесь смысле термины "алкоксикарбонил", "ацил" и "алкокси" включают, но не ограничиваются такими соединениями, как метоксикарбонил, этоксикарбонил, пропоксикарбонил, n-бутокикарбонил, бензилоксикарбонил, гидроксипропилкарбонил, аминоэтоксикарбонил, втор-бутоксикарбонил и циклопентилоксикарбонил. Примеры ацил-групп включают, но не ограничиваются такими группами, как формил, ацетил, пропионил, бутирил и пенаноил-группы. Примеры алкокси-групп включают, но не ограничиваются такими группами, как метокси, этокси, n-бутокси, втор-бутокси и циклопентилокси-группы.
В используемом здесь смысле, термин "арил" включает, но не ограничиваются такими группами, как фенил-, пиридил-, пиррил-, индолил-, нафтил-, тиофенил- или фурил-группа, каждая из которых может быть замещена различными группами, которые включают, но не ограничиваются следующими: ацил, арил, алкокси, арилокси, карбокси, гидрокси, карбоксамидо или N-ациламино-группы. Примеры арилокси-групп включают, но не ограничиваются следующими: фенокси, 2-метилфенокси, 3-метилфенокси и 2-нафтокси-группы. Примеры ацилоки-групп включают, но не ограничиваются следующими: ацетокси, пропаноилокси, бутирилокси, пентаноилокси и гексаноилокси-группы.
В данном изобретении предлагаются аналоги бета-элемена для целей химиотерапии, к которым относится соединение, имеющее структуру: ##STR7## и ##STR8##,
где R, R.sub.0 и R' могут независимо друг от друга обозначать Н, алкил с линейной или разветвленной цепью, который возможно заменить гидрокси, алкокси, фтором, NR.sub.1, R.sub.2, N-гидроксимино или N-алоксимино, где R.sub.1, R.sub.2 могут обозначать независимо друг от друга Н, фенил, бензил, алкил с линейной или разветвленной цепью; где R" представляет собой -CHY.dbd.CHX, или Н, алкил с линейной или разветвленной цепью, фенил, 2-метил-1,3-тиазолинил, 2-фуранил, 3-фуранил, 4-фуранил, 2-пиридил, 3-пиридил, 4-пиридил, имидазолил, 2-метил-1,3-оксазолинил, 3-индолил или 6-индолил; и где Х представляет собой Н, алкил с линейной или разветвленной цепью, фенил, 2-метил-1,3-тиазолинил, 2-фуранил, 3-фуранил, 4-фуранил, 2-пиридил, 3-пиридил, 4-пиридил, имидазолил, 2-метил-1,3-оксазолинил, 3-индолил или 6-индолил; где Y представляет собой Н или алкил с линейной или разветвленной цепью; где Z представляет собой О, N (OR.sub.3) или N-NR.sub.4 R.sub.5, где R.sub.3, R.sub.4 и R.sub.5 могут независимо друг от друга обозначать Н или алкил с линейной или разветвленной цепью; и где n обозначает 0, 1, 2 или 3. В одном варианте выполнения изобретения предлагается соединение, имеющее структуру ##STR6##,
где R представляет собой Н, метил, этил, n-пропил, n-бутил, n-гексил, CH.sub.2ОH, или (CH.sub.2).sub.3ОH.
В данном изобретении также предлагается соединение, имеющее структуру: ##STR4##,
где R, R.sub.0 и R' могут независимо друг от друга обозначать Н, алкил с линейной или разветвленной цепью, который возможно заменить гидрокси, алкокси, фтором, NR.sub.1, R.sub.2, N-гидроксимино или N-алоксимино, где R.sub.l, R.sub.2 могут обозначать независимо друг от друга Н, фенил, бензил, алкил с линейной или разветвленной цепью; где R" представляет собой -CHY.dbd.CHX, или Н, алкил с линейной или разветвленной цепью, фенил, 2-метил-1,3-тиазолинил, 2-фуранил, 3-фуранил, 4-фуранил, 2-пиридил, 3-пиридил, 4-пиридил, имидазолил, 2-метил-1,3-оксазолинил, 3-индолил или 6-индолил; и где Х представляет собой Н, алкил с линейной или разветвленной цепью, фенил, 2-метил-1,3-тиазолинил, 2-фуранил, 3-фуранил, 4-фуранил, 2-пиридил, 3-пиридил, 4-пиридил, имидазолил, 2-метил-1,3-оксазолинил, 3-индолил или 6-индолил; где Y представляет собой Н или алкил с линейной или разветвленной цепью; где Z представляет собой О, N (OR.sub.3) или N- NR.sub.4 R.sub.5, где R.sub.3, R.sub.4 и R.sub.5 могут независимо друг от друга обозначать Н или алкил с линейной или разветвленной цепью; и где n=0, 1, 2 или 3. В некоторых вариантах выполнения данного изобретения предлагается соединение, имеющее структуру ##STR4##
где R обозначает Н, метил, этил, n-пропил, n-бутил, n-гексил, CH.sub.20H, или (CH.sub.2).sub.3ОH.
Кроме того, в изобретении предлагается соединение, имеющее структуру: ##STR5##,
где R, R.sub.0 и R' обозначают независимо друг от друга Н, алкил с линейной или разветвленной цепью, который возможно замещать гидрокси, алкокси-группами, фтором, NR.sub.1, R.sub.2, N-гидроксимино или N-алоксимино, где R.sub.1, R.sub.2 обозначают независимо друг от друга Н, фенил, бензил, алкил с линейной или разветвленной цепью; где R" представляет собой -CHY.dbd.CHX, или Н, алкил с линейной или разветвленной цепью, фенил, 2-метил-1,3-тиазолинил, 2-фуранил, 3-фуранил, 4-фуранил, 2-пиридил, 3-пиридил, 4-пиридил, имидазолил, 2-метил-1,3-оксазолинил, 3-индолил или 6-индолил; и где Х обозначает Н, алкил с линейной или разветвленной цепью, фенил, 2-метил-1,3-тиазолинил, 2-фуранил, 3-фуранил, 4-фуранил, 2-пиридил, 3-пиридил, 4-пиридил, имидазолил, 2-метил-1,3-оксазолинил, 3-индолил или 6-индолил; где Y представляет собой Н или алкил с линейной или разветвленной цепью; где Z представляет собой О, N (OR.sub.3) или N-NR.sub.4 R.sub.5, где R.sub.3, R.sub.4 и R.sub.5 обозначают независимо друг от друга Н или алкил с линейной или разветвленной цепью; и где n=0, 1, 2 или 3.
В частном случае, в изобретении предлагается соединение, имеющее структуру ##STR6##,
где R обозначает Н, метил, этил, n-пропил, n-бутил, CH.sub.2ОH, или (CH.sub.2).sub.3ОH.
Кроме того, в изобретении предлагается соединение, имеющее структуру: ##STR7##,
где R, R.sub.0 и R' обозначают независимо друг от друга Н, алкил с линейной или разветвленной цепью, который возможно замещать гидрокси, алкокси, фтором, NR.sub.1, R.sub.2, N-гидроксимино или N-алоксимино, где R.sub.1, R.sub.2 обозначают независимо друг от друга Н, фенил, бензил, алкил с линейной или разветвленной цепью; где R" представляет собой -CHY.dbd.CHX, или Н, алкил с линейной или разветвленной цепью, фенил, 2-метил-1,3-тиазолинил, 2-фуранил, 3-фуранил, 4-фуранил, 2-пиридил, 3-пиридил, 4-пиридил, имидазолил, 2-метил-1,3-оксазолинил, 3-индолил или 6-индолил; и где Х обозначает Н, алкил с линейной или разветвленной цепью, фенил, 2-метил-1,3-тиазолинил, 2-фуранил, 3-фуранил, 4-фуранил, 2-пиридил, 3-пиридил, 4-пиридил, имидазолил, 2-метил-1,3-оксазолинил, 3-индолил или 6-индолил; где Y представляет собой Н или алкил с линейной или разветвленной цепью; где Z представляет собой О, N (OR.sub.3) или N-NR.sub.4 R.sub.5, где R.sub.3, R.sub.4 и R.sub.5 обозначают независимо друг от друга Н или алкил с линейной или разветвленной цепью; и где n=0, 1, 2 или 3.
Преимущества пути синтеза, описанного в Части 1, по сравнению с известными техническими решениями
Помимо того, что описанный способ является единственным энантиоселективным синтезом (-)-β-элемена, данный путь является стереоселективным и общим по отношении к изменению структуры. В отличие от других способов синтеза, данный способ обеспечивает доступ к производным продуктам С1, С2, С3, С4, С5 и С6, включая удаление изопропениловой группы в С4 и получение в качестве производного продукта метильной группы в С1.
Каждый из этих продуктов описан ниже.
С1. Положением С1 можно манипулировать избирательно на шаге реакции присоединения конъюгата 1,4, вводя гидрид в позицию С2, за которой следует алкилирование. Алкилирующая группа может изменяться в широких пределах и соответствовать в этом случае R4 в общей структуре, изображенной на схеме. Если алкилирующий реагент представляет собой метил, при этом образуется α,α-кетон, можно осуществить последующее окисление экваториального метила, соответствующего группе R1, кроме того, легко осуществить манипулирование этим окисленным метилом, таким как спирт, кетон или другие продукты, производные карбонила, а также последующее получение подобных производных карбонила, вызывающих появление широкого диапазона заместителей R1. Отсюда следует, что и R1 и R4 можно манипулировать по желанию в процессе данного синтеза, причем оба из них находятся в положении С1.
С2. Положением С2 также можно избирательно манипулировать. Группы R2 и Q2 в положении С2 присоединяются избирательно любым из двух путей. Во-первых, используют путь А синтеза: реакция присоединения конъюгата 1,4 образует структуры, подобные SC-1 и далее SC-2, и внедряет эти группы. Таким образом можно ввести широкий спектр заместителей и манипулировать ими. Эта универсальность также присутствует в следующем пути В; однако путь В имеет и дополнительную универсальность. (-)-b-элемен-3-один в принципе можно получить избирательно в положении С2, в зависимости от соседних заместителей в положении С4, воспользовавшись реакционной способностью карбонила/энолата.
С3. Положение С3 может быть избирательно получено в качестве производного, если воспользоваться путем В, например, каждое соединение SC-3 и SC-4 и (-)-b-элемен-3-один представляют собой модификацию положения C3; кроме того, замещение триэтилсилил-окси-группы в SC-3 или SC-4 или получение в качестве производного кетона на C3 в (-)-b-элемене-3-один может быть осуществлено избирательно и заменено широким спектром заместителей, таких как U2 и V2.
С4. Производные положения С4 также легко могут быть получены. Важно отметить, что имеется присущая SC-1 и SC-4 почти полная симметрия, и эта почти полная симметрия позволяет осуществлять прямой доступ к соединениям, подобным (-)-β-элемену. Кроме того, оба пути А и В позволяют осуществлять прямой контроль над заместителями в С4. Например, окисление 2-пропениловой группы в С4 (это можно осуществить непосредственно на карвоне) приводит к образованию производных соединений, подобных (-)-b-элемену-6-один и (-)-b-элемену-3-один, которые легко можно заместить в положении С4 (введя группу Q1). Действительно, удаление 2-пропениловой группы в С4 может быть осуществлено путем окисления олефина до кетона, за которым следует конденсация ретро-Кляйзена. Также легко осуществить получение этого изопропенилового звена. Таким образом, широкий спектр групп Q1 и R1 может быть избирательно введен в С4.
С5. Следуя стандартным протоколам, α,α-двузамещенные кетоны, например, α,α-диметилкетон и другие соединения, родственные (-)-b-элемену-6-один, можно выделить избирательно в положении С5, если воспользоваться химией энолатов и образовать заместители U3 и V3.
С6. Модификации в С6 можно осуществить аналогично тому, как осуществлялись модификации в C3, т.е. производные карбонила могут быть легко приготовлены стереоселективно, и можно выполнить дальнейшие модификации, например олефинацию, а также присоединить другие заместители, включая широкий спектр заместителей Е1 и VI.
Следует отметить, что помимо описанных изменений также можно осуществить расширение кольца и сжатие кольца, чтобы вызвать образование производных (-)-бета-элемена, содержащих либо пять, либо семь атомов в центральном кольце. W может представлять собой углерод, азот или кислород, а также в случае заместителей, содержащих углерод, может быть эквивалентно U и V. Точно так же, если W представляет собой азот, группа R может изменяться в широких пределах и включать широкий спектр заместителей, как будет описано ниже.
Заявление о синтезе аналогов (-)-бета-элемена и полученном соединении
Изобретатели заявляют об открытии неожиданно эффективного, безопасного, нетоксичного действия и возможность широкого применения (-)-бета-элеменола, (-)-бета-элеменала и (-)-бета-элеменфторида в качестве противораковых химиотерапевтических средств. Кроме того, предлагаются следующие соединения: (-)-бета-элеменол, (-)-бета-элеменал, (-)-бета-элеменфторид и их аналоги. Однозначно установлен способ синтеза (-)-бета-элеменола, (-)-бета-элеменала, (-)-бета-элеменфторида. (-)-бета-элеменфторид представляет собой совершенно новое соединение, никогда ранее не синтезированное. Также предлагаются рецептуры использования (-)-бета-элеменола, (-)-бета-элеменала, (-)-бета-элеменфторида в отдельности и в сочетании в качестве противораковых средств.
Интересно отметить, что (-)-бета-элеменал не был целью полного химического синтеза ни в рацемическом, ни в энантиомерном чистом виде. Энантиомерная чистота является критической для правильной оценки лекарственного препарата. Например, энантиомеры талидимида являются либо высокоэффективными лекарствами, либо ужасно уродующими тератогенами, в зависимости от энантиомера. Имея цели, которые были сформулированы в ходе наших последних исследований, в отдельности или в сочетании друг с другом, авторы изобретения предлагают синтез (-)-бета-элемена и его аналогов.
Смесь, содержащая (-)-бета-элеменал и другие растительные экстракты, была выделена в чистом виде из растений (Ito, S, Endo,K, Honma,H, and Ota,K, New constitutes of Thujopsis Dolabrata, Tetrahedron Letters, 1965, 42, 3777-3781. and de Kraker, J, et al. Germacrenes from fresh costus roots, Phytochemistry 2001, 58, 481-487). В смеси невозможно определить активность (-)-бета-элеменала в чистом виде. В данном изобретении мы однозначно получили (-)-бета-элеменал как производное из чистого (-)-бета-элемена (98% чистоты) и использовали ядерно-магнитный резонанс и опыт с ротацией для подтверждения его строения.
Вещество, которое, согласно утверждению, было бета-элеменалом, было выделено в желчи крыс, получавших бета-элемен 98% чистоты, в виде метаболита бета-элемена. Однако данные по метаболиту никогда строго не устанавливали относительную или абсолютную стереохимию данного вещества. И никогда не удавалось исследовать его биологическую активность. Авторы данного изобретения впервые установили биологическую активность чистого (-)-бета-элеменала, что будет подробно описано ниже.
2) Предложение использовать в качестве противоопухолевого средства
Производные (-)-бета-элемена синтезированы и испытаны на способность подавлять рост линии клеток опухолей
Десять производных (-)-бета-элемена (Фиг.6) и еще три аналога (-)-бета-элемена (Фиг.8) были синтезированы и испытаны in vitro на способность подавлять линию клеток опухолей.
Кроме того, в данном изобретении предлагается способ лечения рака у больных, страдающих им, включающий назначение больному терапевтически эффективного количества любого из аналогов, относящихся к (-)-бета-элемену и описанных здесь, по выбору в сочетании с подходящим фармацевтическим носителем. Данный способ можно использовать в случаях, когда рак представляет собой плотную опухоль или лейкемию. В частности, данный способ можно применять в тех случаях, когда рак представляет собой опухоль головного мозга, рак легкого, рак молочной железы, рак простаты, рак яичника, рак толстой и прямой кишки, рак тонкого кишечника или рак желудка.
В данном изобретении также предлагается фармацевтическая композиция для лечения рака, содержащая любой из описанных выше аналогов (-)-бета-элемена в качестве активного ингредиента, обычно, хотя и с возможностью выбора, в сочетании с фармацевтически подходящими носителями. Фармацевтическая композиция, предлагаемая в данном изобретении, может, кроме того, содержать другие терапевтически активные ингредиенты.
Описанные выше соединения, связанные с (-)-бета-элеменом, эффективны при лечении рака, в особенности, в тех случаях, когда имеется устойчивость ко многим лекарственным препаратам, как in vivo, так и in vitro. Способность этих соединений не становиться причиной возникновения устойчивости к лекарственным препаратам в клетках, что будет показано ниже в таблицах, говорит о том, что эти соединения могут применяться для лечения, профилактики и улучшения течения рака у больных, страдающих данным заболеванием.
Величина терапевтической дозы предлагаемых в изобретении соединений будет изменяться в зависимости от природы и тяжести подлежащего лечению заболевания, от того, какое именно соединение будет использовано и способов его применения. В общем случае, диапазон дневных доз для достижения противораковой активности находится в пределах от 3 до 300 мг/кг веса тела млекопитающего, предпочтительно 10-40 мг/кг, в виде одной или нескольких доз.
Можно использовать любой подходящий способ применения для обеспечения млекопитающих, в особенности человека, эффективной дозой описанного здесь соединения. Например, можно использовать оральные, ректальные, местные, парентеральные, назальные способы применения, а также через глаза и легкие. Формы дозирования включают таблетки, пастилки, дисперсии, суспензии, растворы, капсулы, кремы, мази, аэрозоли и т.п.
Композиции включают составы, пригодные для орального, ректального, местного (включая устройства для чрезкожного введения, аэрозоли, кремы, мази, лосьоны и пудры), парентерального (включая подкожное, внутримышечное, внутриартериальное и внутривенное), глазного (глазное лекарственное средство), легочного (ингаляции через нос или рот) и назального применения. Хотя наиболее подходящий способ в каждом конкретном случае будет в большой степени зависеть от природы и тяжести требующего лечения заболевания и от природы активного ингредиента. Их удобно представлять в форме единичной дозы и приготавливать любым способом, хорошо известным в области фармакологии.
При приготовлении форм дозирования для орального применения можно использовать любую специфическую фармацевтическую среду, такую как вода, гликоли, масла, спирты, вкусовые добавки, консерванты, красители и тому подобное в случае приготовления жидких форм для орального приема (например, суспензий, эликсиров и растворов); или носители, такие как крахмалы, сахара, микрокристаллическая целлюлоза, наполнители, гранулирующие добавки, пластификаторы, связующие добавки, расщепляющие добавки и т.п. в том случае, когда твердые формы для орального приема, такие как порошки, капсулы и таблетки, являются более предпочтительными, чем жидкие формы для орального применения. Если необходимо, капсулы можно покрыть оболочкой, используя стандартные водные и безводные способы. Помимо описанных выше форм дозирования предложенные в изобретении соединения могут применяться при помощи устройств и способов с регулируемым высвобождением.
Фармацевтические композиции, предложенные в данном изобретении и предназначенные для орального применения, могут быть изготовлены в виде отдельных элементов, таких как капсулы, облатки или таблетки, каждый из которых содержит заданное количество активного ингредиента в форме порошка или гранул, или в виде раствора или суспензии в содержащей или не содержащей воду жидкости или эмульсии масла в воде или воды в масле. Каждая композиция может быть приготовлена любым способом, известным в фармакологии. В общем случае композиции изготавливаются путем равномерного и однородного смешивания активного ингредиента с жидкими носителями, тонко измельченными твердыми носителями или обоими одновременно и, затем, придания продукту требуемой формы. Например, таблетку можно изготовить путем прессования или формования с одним или несколькими второстепенными ингредиентами, по выбору. Прессованные таблетки можно изготовить путем прессования в соответствующей машине активного ингредиента в свободно текущей форме, такой как порошок или гранулы, по желанию смешанными со связующим, пластификатором, инертным наполнителем или поверхностно-активной или диспергирующей добавкой. Формованные таблетки могут быть изготовлены путем формования в соответствующей машине смеси порошкообразного соединения, смоченного инертным жидким разбавителем.
Данное изобретение будет легче понять, пользуясь подробным описанием экспериментов, которое дано ниже. Однако специалисты легко поймут, что специфические способы и результаты, описанные здесь, являются лишь иллюстрацией изобретения, как оно описано в пунктах патентных притязаний, которые приводятся ниже. Будет понятно, что предлагаемые в данном изобретении технологические процессы изготовления (-)-бета-элеменола, (-)-бета-элеменала, (-)-бета-элеменфторида, их аналогов и промежуточных продуктов включают использование различных альтернативных предохраняющих групп, известных в данной области. Эти предохраняющие группы, используемые далее в описании, включая примеры, являются всего лишь иллюстративными.
3) Сочетанная терапия при лечении рака
(-)-бета-элемен, его производные и его аналоги могут быть использованы при лечении рака и в тех случаях, когда имеется устойчивость ко многим лекарственным препаратам, как in vivo, так и in vitro. Способность этих соединений не становится причиной возникновения устойчивости к лекарственным препаратам в клетках, как будет показано ниже в Примерах, говорит о том, что эти соединения могут применяться для лечения, профилактики и улучшения течения рака у больных, страдающих данным заболеванием.
Предпочтительный вариант выполнения изобретения, который не ограничивает его использование или использование фармацевтических эквивалентов описанных в нем соединений, заключается в применении терапевтической дозы цисплатина 5-FU, или таксола, или одного из производных таксола в сочетании с терапевтической дозой одного из веществ, подробно описанных выше [(-)-бета-элемена, его производных и его аналогов], начиная с минимальных рекомендованных доз каждого лекарственного препарата. Показано, что (-)-бета-элемен повышает эффективность цисплатина или 5-FU, или таксола или одного из производных таксола в экспериментах с линиями раковых клеток. Вещества подробно описаны выше, представляют собой аналоги (-)-бета-элемена и, таким образом, они могут обладать такой же способностью.
Термин "терапевтически эффективное количество" обозначает такое количество лекарственного препарата или фармацевтического средства, которое вызывает биологическую или медицинскую реакцию ткани, системы, животного или человека, которой добивается исследователь, ветеринар, врач или другой клиницист. Терапевтическое изменение представляет собой изменение в измеренной биохимической характеристике в направлении, которое согласно предположению должно облегчить течение болезни или состояния, подлежащие лечению. Термин "профилактически эффективное количество" обозначает такое количество фармацевтического препарата, которое предотвратит или уменьшит риск возникновения биологического или медицинского случая, предотвращение которого в ткани, системе, животном или человеке добиваются исследователь, ветеринар, врач или другой клиницист. Термин "терапевтическое окно" обозначает диапазон доз между минимальным количеством, необходимым для достижения терапевтического изменения, и максимальным, которое приводит к реакции, которая представляет собой реакцию, за которой немедленно следует токсичность для пациента.
Режим дозирования при применении цисплатина, таксола, паклитаксола, taxotere или 5-FU в сочетании с одним из описанных выше веществ [(-)-бета-элемен, его производные и его аналоги] выбирается в соответствии со множеством факторов, включая тип, вид, возраст, вес, пол и медицинское состояние пациента; тяжесть болезни, которую требуется лечить, способ применения, сердечную, почечную и печеночную функцию у пациента; конкретное используемое соединение или его соль или эфир. Дозы во всех случаях должны быть ограничены терапевтическим окном. Поскольку в сочетанной терапии используются совместно два различных активных вещества, необходимо также учитывать активность каждого из веществ и эффект их взаимодействия, возникающий при их сочетании. Учет этих факторов вполне находится в пределах компетенции клинициста обычной квалификации и он должен определить терапевтически эффективную и профилактически эффективную дозу.
Элемен убивает раковые клетки, вызывая апоптоз и остановку клеточного цикла. Другие противораковые препараты останавливают неконтролируемый рост раковых клеток благодаря различным механизмам, таким как блокирование путей трансдукции сигнала или подавление киназы. Таким образом, сочетание элемена с одним или несколькими противораковыми препаратами, имеющими различный молекулярный механизм, может быть эффективным способом лечения рака, подобно тому, как коктейль лекарственных препаратов для лечения AIDS.
В данном изобретении предлагается фармацевтическая композиция для лечения рака, содержащая 1) один или несколько противораковых препаратов, включая следующие, но не ограничиваясь ими: цисплатин, таксол, производные таксола, 5FU и другой противораковый препарат с молекулярным механизмом, отличным от элемена, предназначенный для борьбы с раком, и 2) вещество, подробно описанное выше [одно или несколько из следующих: (-)-бета-элемен, его производные и его аналоги], обычно, но с возможностью выбора, в сочетании с фармацевтически подходящим носителем. Фармацевтические композиции, предлагаемые в данном изобретении, могут, кроме того, содержать другие терапевтически активные ингредиенты. Кроме того, в данном изобретении предлагается способ лечения рака у больных, страдающих данным заболеванием, включающий назначение больному терапевтически эффективного количества 1) одного или нескольких противораковых препаратов, включая следующие, но не ограничиваясь ими: цисплатин, таксол, производные таксола, 5FU и другой противораковый препарат с молекулярным механизмом, отличным от элемена, предназначенный для борьбы с раком, и 2) одного или нескольких из следующих веществ: (-)-бета-элемена и родственных ему веществ и 3) фармацевтически подходящий носитель. Данный способ может быть особенно эффективен в тех случаях, когда рак представляет собой плотную опухоль, такую как опухоль головного мозга, рак легкого, рак яичника, рак мочевого пузыря, рак шейки матки, рак толстой кишки, рак молочной железы и рак простаты.
Можно использовать любой подходящий способ применения для обеспечения млекопитающего, в особенности человека, эффективными дозами описанного здесь соединения. Например, можно использовать оральный, ректальный, местный, парентеральный, глазной, легочный, назальный и т.д. способы. Формы дозирования включают таблетки, пастилки, дисперсии, суспензии, растворы, капсулы, кремы, мази, аэрозоли и т.п. Композиции включают составы, пригодные для орального, ректального, местного применения (включая устройства для чрезкожного введения, аэрозоли, кремы, мази, лосьоны, и пудры), парентерального (включая подкожное, внутримышечное и внутривенное), глазного (глазное лекарственное средство), легочного (ингаляции через нос или рот) или назального применения. Хотя наиболее подходящий способ в каждом конкретном случае будет в большой степени зависеть от природы и тяжести требующего лечения заболевания и от природы активного ингредиента. Их удобно представлять в форме единичной дозы и приготавливать любым способом, хорошо известным в области фармакологии.
ПРИМЕРЫ
ПРИМЕР 1
Синтез ##STR3##
(Е)-геранил 3-метил-3-бутенат
Раствор гераниола (225 мкл, 1.29 ммоль, 1.0 эквивалент) и триэтиламина (271 мкл, 1.94 ммоль, 1.5 эквивалент) в сухом дихлорометане (1 мл) охлаждался до -78°С, а затем в него по каплям добавлялся 3,3-диметилакрил хлорид (159 мкл, 1.43 ммоль, 1.1 эквивалент). Через 3 часа раствор разбавлялся водой (1 мл) и дихлорометаном (1 мл), и охлаждающая ванна удалялась. Смесь извлекалась при помощи дихлорометана (3×20 мл) и соединенные органические вещества высушивались (MgSO4) и концентрировались in vacuo. Очистка путем радиальной хроматографии (пластина из SiО2 толщиной 4 мм, промывание 7% этилацетатгексаном; продукт, фракции 4-6; 30 мл каждой фракции) дала ##STR3## (301 мг, 1.27 ммоль, выход 99%) в виде бесцветного масла: Rf - исходный материал, 0.14; продукт 0.51 (5:1 гексан-этилацетат, анисальдегид); FTIR (пленка) 2970, 2919, 2858, 1738, 1653, 1445, 1377, 1206, 1153, 987, 896 cm-1; .sup.1 H NMR (400 MHz, CDCl3) δ 5.31-5.35 (m, 1H), 5.04-5.08 (m, 1H), 4.88 (bs, 1H), 4.83 (bs, 1H), 4.60 (s, 1H), 4.58 (s, 1H), 3.01 (s, 2H), 2.00-2.09 (m, 4H), 1.79 (s, 3H), 1.69 (s, 3H), 1.66 (s, 3H), 3.01 (s, 2H), 2.00-2.09 (m, 4H), 1.79 (s, 3H), 1.69 (s, 3H), 1.66 (s, 3H), 1.58 (s, 3H); .sup.13 С NMR (101 MHz, CDCl3) δ 171.2, 142.2, 138.6, 131.7, 123.7, 118.2, 114.5, 61.4, 43.4, 39.4, 26.2, 25.6, 22.3, 17.6, 16.4; HRMS (EI, Pos) m/z рассчитано для [С15Н24О2]+236.1776, результат составил 236.1768.
ПРИМЕР 2
Синтез ##STR4a##
(2S,3S)-2-изопропенил-3,7-диметил-3-винил-6-октеновая кислота
3,5-Двойной(трифторметил)бензенсульфонамид из (R,R)-1,2-дифенил-1,2-диаминэтана (718 мг, 0.940 ммоль, 1.0 эквивалент) высушивался в условиях вакуума при 70°С в течение 3 часов. Затем колба вынималась и промывалась три раза сухим N2. Добавлялся свежедистиллированный дихлорметан (32 мл) и гомогенный раствор охлаждался до -78°С. Через 10 минут добавлялся свежедистиллированный Вbr3 (3.76 мл, 0.5 моль в СН2Сl2, 1.88 ммоль, 2.0 эквивалент) и раствор перемешивался в течение 5 минут при -78°С, а затем нагревался до 23°С. Через 16 часов все летучие вещества удалялись в условиях вакуума, полученное белое твердое вещество вновь растворялось в дихлорметане (20 мл), и раствор концентрировался снова. Через 60 минут колба вынималась и промывалась три раза N2, и полученное белое твердое вещество растворялось в свежедистиллированном толуоле (32 мл). Бромоборановый комплекс (##STR1##) охлаждался до -78°С, Et3N (983 мкл, 7.05 ммоль, 7.5 эквивалент) добавлялся по каплям, и смесь перемешивалась, чтобы образовался раствор (25 минут). Предварительно охлажденный раствор ##STR3## (175 мг, 0.740 ммоль, 0.8 эквивалент) в толуоле (4 мл) добавлялся по каплям при -78°С, и полученный в результате этого раствор перемешивался при -70°С в течение 27 часов и затем нагревался до 4°С. Через 36 часов реакционный раствор нагревался 23°С, разбавлялся диэтиловым эфиром (40 мл), подкислялся до рН 1 10% НСl и экстрагировался при помощи диэтилового эфира (4 × 60 мл). Эфирный экстракт высушивался (MgSO4) и концентрировался in vacuo, чтобы образовать смесь в сочетании 3:1 ##STR4a## и второстепенного диастереомера в виде желтого масла (149.2 мг, 0.631 ммоль, 85% выхода): Rf исходный материал, 0.71; продукт, 0.26 (5% МеОН-СНCl3, Verghns); FTIR (film) 3084, 3055, 2972, 2927, 2859, 2729, 1707, 1638, 1452, 1413, 1377, 1265, 916, 742 cm-1; .sup.1 H NMR (400 MHz, CDCl3) δ 6.09, 5.86 (dd, 1H, J=10.9, 17.5, major), 4.96-5.12 (m, 5HO, 3.08 (s, 1H, major), 3.07 (s, 1H, minor), 1.85-1.91 (m, 2H), 1.85 (s, 3H), 1.67 (s, 3H), 1.60 (s, 3H), 1.41-1.57 (m, 2H), 1.18 (s, 3H, major), 1.12 (s, 3H, minor); HRMS (EI, Pos) m/z рассчитано для [С15Н24O2]+236.1776, результат составил 236.1783.
ПРИМЕР 3
Синтез ##STR4b##
(2S,3S)-2-изопропенил-3,7-диметил-3-винил-6-октенол
В смесь ##STR4a## и второстепенного диастереомера (18 мг, 0.076 ммоль, 1.0 эквивалент) в сухом диэтиловом эфире (2 мл) добавлялся LiAlH4 (15 мг, 0.381 ммоль, 5.0 эквивалент) при 23°С. Через 12 часов добавлялись дополнительные порции LiAlH4 (15 мг, 0.381 ммоль, 5.0 эквивалент) и диэтилового эфира (2 мл). Еще через 12 часов последовательно добавлялись Н2О (50 мкл), NaOH (15% веса в объеме (массовая доля), 50 мкл) и Н2О (150 мкл). Смесь перемешивалась в течение 10 минут, фильтровалась, высушивалась (MgSO4) и концентрировалась in vacuo. Флэш-хроматография (10 г SiO2; элюент, 10% этилацетатгексан; продукт, фракции 7-21; 10 мл каждой фракции) выявила смесь в соотношении 3:1 ##STR4b## и второстепенного диастереомера в виде бесцветного масла (15.8 мг, 0.071 ммоль, 93% выхода: Rf исходный материал, 0.46; продукт, 0.72 (12% МеОН-СНСl3, анисальдегид). Смесь диастереомеров в отношении 3:1 выделялась при помощи радиальной хромотографии с насыщением AgNO3 (4 мм пластина SiO2; элюент, 4:1 этилацетатгексан; второстепенные фракции 11-15; ##STR4b##, фракции 16-35; 30 мл каждой фракции) с последующим пропусканием через силикагель (20 г; 200 мл 10% этилацетатгексана), что давало диастереомерно чистый ##STR4b##: насыщенный AgNO3 TLC: Rf ##STR4b##, 0.20; второстепенный 0.35 (12% МеОН-СНСl3, анисальдегид). Энантиомерная чистота ##STR4b## была определена большей 99:1 при помощи хиральной жидкостной хроматографии высокого разрешения (колонка Chiralcel OD, 1% 2-пропанолгексан, 214 нм, 1 мл/мин, время задержки S,S-изомера, ##STR4b## составило 9.4 мин, R,R-изомера - 23 мин): [α]23D -40.2° (с=0.54, СНСl3); FTIR (film) 3377, 3080, 2969, 2925, 2858, 1639, 1450, 1414, 1376, 1033, 1005, 912, 893 cm-1; .sup.1 H NMR (500 MHz, CDCl3) δ 5.80 (dd, 1H, J=10.8, 17.5), 5.02-5.08 (m, 3H), 4.91 (dd, 1H, J=1.3. 17.5), 4.83 (d, 1H, J=1.6), 3.72 (dd, 1H, J=4.3, 10.7), 1.82-1.90 (m, 2H), 1.77 (m, 3H), 1.67 (d, 3H, J=0.8), 1.57 (s, 3H), 1.30-1.44 (m, 2H), 1.04 (s, 3H); .sup.13 С NMR (101 MHz, CDCl3) δ 144.4, 144.3, 131.3, 124.7, 115.7, 112.8, 61.1, 58.6, 41.2, 39.4, 25.7, 23.2, 22.6, 20.8, 17.6; HRMS (CI, NH3) m/z рассчитано для [C15H26O]+NH3 240.2327, результат составил 240.2317.
ПРИМЕР 4
Синтез ##STR4c##
(2S,3S)-2-изопропенил-3,7-диметил-3-винил-6-октенал
Суспензия реагента Десс-Мартина (Dess-martin reagent) (232 мг, 0.546 ммоль, 1.5 эквивалент) в сухом дихлорметане (5 мл) добавлялась к ##STR4b## (81 мг, 0.364 ммоль, 1.0 эквивалент) в дихлорметане (2 мл) при 23°С. Через 1 час раствор фильтровался через Celite 545, концентрировался in vacuo, повторно разводился в гексанах и фильтровался через Celite 545. Фильтрат концентрировался in vacuo и разделялся посредством флэш-хроматографии (10 г SiO2; элюент, 4% этилацетатгексан, продукт, фракции 4-8; 10 мл каждой фракции), в результате чего получался ##STR4c## (79 мг, 0.359 ммоль, 98% выхода) в виде бесцветного масла; Rf исходный материал, 0.28; продукт, 0.58 (5:1 гексан этилацетат, анисальдегид); [α]23D -40.2° (с=0.91, СНСl3); FTIR (film) 2970, 2921, 2859, 1721,1638,1453, 1377, 914 cm-1; .sup.1H NMR (500 MHz, CDCl3) δ 9.65 (d, 1H, J=4.5), 5.92 (dd, 1H, J=10.9, 17.6), 5.14-5.17 (m, 2H), 5.06 (t, 1H, J=7.1), 5.00 (d, 1H, J=17.6), 4.88 (s, 1H), 2.70 (s, 3H), 1.38-1.50 (m, 2H), 1.15 (s, 3H), 1.67 (s, 3H), 1.57 (s, 3H), 1.38-1.50 (m, 2H), 1.15 (s, 3H); sup.13 С NMR (126 MHz, CDCl3) d 202.0, 143.1, 139.5,131.5, 124.2, 116.8, 114.2, 67.1, 42.3, 39.1, 25.7, 25.6, 22.4, 20.6, 17.6; HRMS (EI, Pos) m/z рассчитано для [С15Н24O]+220.1827, результат составил 220.1817.
ПРИМЕР 5
Синтез ##STR5a##
(1S,2S,3S,6S)-2,6-диизопропенил-3-метил-3-винилциклогексанол
Раствор диэтилалюминиевого хлорида (210 мкл, 1.8 М в толуоле, 0.379 ммоль, 1.1 эквивалент) добавлялся по каплям к раствору ##STR4c## (76 мг, 0.344 ммоль, 1.0 эквивалент) в сухом дихлорметане (10 мл) при -78°С. Через 1.5 часа добавлялся триэтиламин (500 мкл), охлаждающая ванна удалялась и раствор добавлялся к смеси насыщенного NaHCO3 (20 ml) и дихлорметана (2×20 мл), и органические фракции соединялись, высушивались (MgSO4) и концентрировались in vacuo. Флэш-хроматография (15 г SiO2; элюент, 4% этилацетатгексана; продукт, фракции 11-23; 10 мл каждой фракции) выявила смесь в отношении 96:4 ##STR5a## и второстепенного диастереомера (70.1 мг, 0.318 ммоль, 92% выхода): Rf исходный материал, 0.58; продукт, 0.41 (5:1 гексан этилацетат, анисальдегид). Диастереомерная смесь разделялась посредством радиальной хроматографии с насыщением AgNO3 (2-мм пластина; элюент, 5:1 этилацетатгексан; продукт, фракции 10-33; 3 мл каждой фракции), за которой следовало пропускание через силикагель (10г; 150 мл 4% этилацетатгексана), что давало чистый ##STR5a## (88% выхода) в виде бесцветного масла: TLC, насыщенный AgNO3: Rf ##STR5a##, 0.08; второстепенный, 0.17 (12% МеОН-CHСl3; анисальдегид); [α]23D +17.8° (с=0.91, СНСl3); FTIR (film) 3566, 3486, 2969, 2931, 1639, 1454, 1375, 1004, 910, 889 cm-1; sup.1 H NMR (500 MHz, CDCl3) δ 5.78 (dd, 1H, J=10.9,17.4), 5.06 (s, 1H), 4.88-4.92 (m, 4H), 4.76 (s, 1H), 3.77 (t, 1H, J=10.4), 2.08 (dt, 1H, J=4.8, 10.8), 1.98 (d, 1H, J-10.4), 1.90 (bs, 1H), 1.80 (s, 3H), 1.79 (s, 3H), 1.51-1.66 (m, 3H), 1.42 (dt, 1H, J=3.1, 13.0), 1.06 (s, 3H); sup.13 С NMR (101 MHz, CDCl3) δ 148.9, 147.1, 144.2, 114.1, 112.2, 110.3, 69.3, 59.7, 53.7, 41.3, 39.0, 26.2, 25.0, 19.5, 18.1; HRMS (EI, Pos) m/z рассчитано для [С15Н24O]+220.1827, результат составил 220.1826.
ПРИМЕР 6
Синтез ##STR5b##
Реакция 2-хлор-1,3-диметил-1,3,2-диазафосфолан с ##STR5a## для получения ##STR5b##
2-хлор-1,3-диметил-1,3,2-диазафосфолан (10 мкл, 0.076 ммоль, 1.4 эквивалент) добавлялся по каплям к раствору ##STR5a## (12 мг, 0.054 ммоль, 1.0 эквивалент) и триэтиламина (8 мкл, 0.06 ммоль, 1.1 эквивалент) в сухом дихлорметане (1 мл) при 23°С. Через 75 минут добавлялась перекись водорода (7 мкл, 30% водный раствор, 0.065 ммоль, 1.2 эквивалент) и реакционная смесь интенсивно перемешивалась в течение 10 минут, а затем реакция гасилась насыщенным Na2SO4 (1 мл). После 5 минут насыщенного перемешивания раствор добавлялся в смесь дихлорметана (20 мл) и воды (20 мл). Водная часть экстрагировалась при помощи дихлорметана (2×20 мл), а органические фракции все вместе высушивались (Na2SO4) и концентрировались in vacuo. Флэш-хроматография (10 г SiO2; элюент 1% МеОН-СНСl3; продукт, фракции 12-15; 10 мл каждой фракции) выявила помимо выделенного ##STR5a## (2.5 мг, 21% выхода), ##STR5b## (15 мг, 0.042 ммоль, 77% выхода, 92% после двух циклов) в виде бесцветного масла: Rf исходный материал, 0.78; продукт, 0.35 (5% МеОН-СНСl3, Verghns); [α]23D +25.4° (с=1.03, СНСl3); FTIR (film) 3079, 2934, 2880, 1647, 1451, 1269, 1240,1161,1003,941 cm-1; sup.1 H NMR (500 MHz, CDCl3) δ 5.74 (dd, 1H, J=10.3), 2.93-3.04 (m, 4H), 2.50-2.54 (m, 6H), 2.17-2.22 (m, 1H), 2.00-2.06 (m, 1H), 1.87 (s, 3H), 1.36-1.70 (m, 4H), 1.04 (s, 3H); sup.13 С NMR (101 MHz, CdCl3) δ 148.5, 146.9, 142.7, 114.6 (bm), 112.9, 110.4, 77.8 (bm), 58.7 (bm), 53.8, 47.3 (d), 41.7, 38.7, 33.8, 33.6, 27.9, 20.3, 18.3; sup.31 P NMR (121 MHz, CDCl3, Ph3P внешний стандарт при -6 миллионных долей) δ 22.65 (t, J=10); HRMS (EI, Pos) m/z рассчитано для [C19H33O2N2P]+352.2280, результат составил 352.2285.
ПРИМЕР 7
Синтез ##STR6##
(-)-бета-элемен
Раствор сухого ##STR5b## (53 мг, 0.152 ммоль, 1.0 эквивалент, азеотропный с толуолом) и третичный амиловый спирт (67 мкл, 0.608 ммоль, 4.0 эквивалент) в сухом тетрагидрофуране (1.5 мл) вводился по трубочке в голубой раствор избытка лития в жидком аммиаке (5 мл) при -33°С. Промежуточная колба промывалась тетрагидрофураном (0.5 мл) и раствор перемешивался в течение 10 часов. Раствор последовательно гасился путем добавления по каплям изопрена (приблизительно 300 мкл) и насыщенного водного раствора NH4Cl (2 мл) и разводился пентанами (4 мл). После нагревания до 23°С раствор добавлялся в смесь пентанов (2×30 мл) и органические фракции высушивались (Na2SO4) все вместе и концентрировались in vacuo. Флэш-хроматография (10 г SiO2; элюент, пентаны; продукт, фракции 4-7; 10 мл каждой фракции) выделила ##STR6## (29.5 мг, 0.144 ммоль, 95% выхода) в виде бесцветного масла: Rf исходный материал, 0.00; продукт, 0.71 (пентаны, Verghns); [α]23D -15.4° (с=0.59, СНСl3); FTIR (film) 3083, 2969, 2931, 1644, 1454, 1440, 1374, 1004, 909 cm-1; sup.1 H NMR (500 MHz, CDCl3) δ 5.82 (dd, 1H, J=11.0, 17.4), 4.88-4.92 (m, 2H), 4.82 (t, 1H, J=1.6), 4.70-4.72 (m, 2H), 4.59 (bs, 1H), 1.99-2.03 (m, 1H), 1.92-1.96 (m, 1H), 1.75 (s, 1H), 1.71 (s, 3H), 1.42-1.63 (m, 6H), 1.01 (s, 3H); sup.13 С NMR (101 MHz, CDCl3) δ 150.4, 150.3, 147.7, 112.1, 109.8, 108.2, 52.8, 45.7, 39.9, 39.8, 32.9, 26.8, 24.7, 21.1, 16.6; HRMS (EI, Pos) m/z рассчитано для [С15Н24]+204.1878, результат составил 204.1869.
ПРИМЕР 8
Синтез ##STR7##
(1S,3R,4R)-1-ацетил-3-изопропенил-4-метил-4-винилциклогексан
Раствор (DHQD)2-PHAL (11 мг, 0.0137 ммоль, 0.1 эквивалент), дигидрата осмата (VI) калия (0.5 мг, 0.0014 ммоль, 0.01 эквивалент), ферроцианида калия (135 mg, 0.411 ммоль, 3.0 эквивалент), карбоната калия (57 мг, 0.411 ммоль, 3.0 эквивалент) и метансульфонамида (13 мг, 0.137 ммоль, 1.0 эквивалент) в водном растворе 1:1 2-метил-2-пропанола (1.5 мл) охлаждался до 0°С. Двухфазная смесь добавлялась к ##STR6## (28 мг, 0.137 ммоль, 1.0 эквивалент) при 0°С и реакционная смесь перемешивалась в течение 11 часов. Раствор гасился избыточным количеством Na2SO3 (до выпадения осадка и исчезновения окрашивания). После нагревания до 23°С раствор добавлялся в смесь дихлорметана (20 мл) и воды (20 мл). Водная часть извлекалась при помощи дихлорметана (2×20 мл) и органические фракции высушивались (Na2SO4) все вместе и концентрировались in vacuo. Флэш-хроматография (15 г SiO2; элюент, 28% этилацетатгексан; продукт, фракции 19-30; 10 мл каждой фракции) выделила, помимо выделенного ##STR6## (5 мг, 0.024 ммоль, 17% выхода), смесь в отношении 3:1 диастереомеров 1,2-диола (24.8 мг, 0.104 ммоль, 76% выхода) в виде бесцветного масла.
Периодат натрия (62 мг, 0.289 ммоль, 3.0 эквивалент) добавлялся к раствору 1,2-диола (23 мг, 0.096 ммоль, 1.0 эквивалент) в водном растворе 4:1 тетрагидрофурана (2 мл) при 23°С. Через 30 минут этот раствор добавлялся к смеси дихлорметана (20 мл) и воды (20 мл). Водная часть извлекалась при помощи дихлорметана (2×20 мл) и органические фракции высушивались все вместе (Na2SO4) и концентрировались in vacuo. Флэш-хроматография (10 г SiO2; элюент, 7% этилацетатгексан; продукт, фракции 3-9; 10 мл каждой фракции) выделила ##STR7## (19 мг, 0.092 ммоль, 96% выхода) в виде бесцветного масла: Rf исходный материал, 0.07; продукт, 0.61 (3:1 гексан-этилацетат, Verghns); [α]23D +37.0° (с=1.0, СНСl3); FTIR (film) 3082, 2971, 2935, 2864, 1711, 1638, 1441, 1373, 1353, 908, 892 cm-1; sup.1 H NMR (500 MHz, CDCl3) δ 5.80 (dd, 1H, J=10.6, 17.8), 4.89-4.93 (m, 2H), 4.84 (t, 1H, J=1.4), 4.60 (s, 1H), 2.37-2.43 (m, 1H), 2.16 (s, 3H), 1.97-2.00 (m, 1H), 1.74-1.78 (m, 1H), 1.67-1.71 (m, 5H), 1.46-1.59 (m, 3J), 1.00 (s, 3H); sup.13 С NMR (101 MHz, CDCl3) δ 211.6, 149.6, 146.9, 112.6, 110.3, 52.0, 51.9, 39.6, 39.1, 29.4, 28.2, 24.7, 23.7, 16.5; HRMS (EI, Pos) m/z рассчитано для [С14Н22O]+206.1671, результат составил 206.1661.
ПРИМЕР 9
Синтез ##STR2##
(+)-Фускол (Fuscol)
n-Бутиллитий (244 мкл, 1.57 М в гексанах, 0.384 ммоль, 4.95 эквивалент) добавлялся к раствору 2-метил-2-пропанола (37 мкл 0.388 ммоль, 5.0 эквивалент) в тетрагидрофуране (0.5 мл) при -78С. Через 15 минут добавлялся бутил (дибутилфосфоно)-2-бутеноат (108 мкл, 0,388 ммоль, 5.0 эквивалент), и смесь быстро нагревалась, чтобы вызвать растворение. Через 15 минут при -78°С анионный раствор желтого фосфоната вводился через трубочку в ##STR7## (16 мг, 0.078 ммоль, 1.0 эквивалент) в тетрагидрофуране (0.5 мл) с температурой 23°С. Через 18 часов 5 эквивалентов фосфонатного аниона было добавлено таким же образом. Этот процесс повторялся через 28 часов и 41 час от начала процесса. После 48 часов перемешивания реакционная смесь разводилась в дихлорметане, пропускалась через силикагель (15 г, 200 мл СН2Сl2) и концентрировалась in vacuo. Флэш-хроматография (15 г SiO2; элюент, 1.5% этилацетатгексана; продукт, фракции 7-15; 10 мл каждой фракции) выделила бутил 5-[(1'S,3'R,4'R)-3'-изопропенил-4'-метил-4'-винилциклогексил]-(Е,Е)-гексадиеноат (22.1 мг, 0.067 ммоль, 87% выхода) в виде смеси 12:1 диастереомеров: Rf исходный материал, 0.55; продукт, 0.75 (5:1 гексан-этилацетат, анисальдегид). Препаративная тонкослойная хроматография (пластинка 0.5 мм, 9:1 пентандиэтилэфир, Rf транс, транс-5-[(1'S,3'R,4'R)-3'-изопропенил-4'-метил-4'-винилциклогексил]-(Е,Е)-гексадиеноат, 0.42) выделила в чистом виде 5-[(1'S,3'R,4'R)-3'-изопропенил-4'-метил-4'-винилциклогексил]-(Е,Е)-гексадиеноат (80% выхода) в виде бесцветного масла: [α]23D +24.5° (с=1.17, СНСl3).
В раствор 5-[(1'S,3'R,4'R)-3'-изопропенил-4'-метил-4'-винилциклогексил]-(Е,Е)-гексадиеноата (16 мг, 0.048 ммоль, 1.0 эквивалент) в диэтиловом эфире (2 мл) добавлялся метиллитий (161 мкл, 1.5 М в диэтиловом эфире, 0.242 ммоль, 5.0 эквивалент) при температуре -30°С. Через 12 часов реакция гасилась при помощи водного раствора NFH4Cl, подогретого до 23°С, и продукт реакции добавлялся в смесь диэтилового эфира (10 мл) и воды (10 мл). Водная часть извлекалась при помощи диэтилового эфира (2×20 мл), и органические фракции высушивались все вместе (Nа2SO4) и концентрировались in vacuo. Флэш-хроматография (15 г SiO2; элюент, 6% этилацетат-1% триэтиламин-гексан; продукт, фракции 10-20; 10 мл каждой фракции) выделила ##STR2## (12.5 мг, 0.043 ммоль, 90% выхода) в виде бесцветного масла: Rf исходный материал, 0.75; продукт, 0.27 (5:1 гексан-этилацетат, анисальдегид); [α]23D +19.7° (с=1.0, СНСl3); FTIR (film) 3402, 3360, 3082, 2971, 2928, 2860, 1637, 1441, 1374, 966, 908, 890 cm-1; UV/vis λmax=240 nm, ε=35,000; sup.1 H NMR (500 MHz, CDCl3) δ 6.48 (dd, 1H, J=10.8, 15.3), 5.87 (d, 1H, J=10.8), 5.82 (dd, 1H, J=11.1, 17.2), 5.76 (d, 1H, J=15.3), 4.88-4.92 (m, 2H), 4.81 (t, 1H), J=1.5), 4.58 (s, 1H), 2.01 (dd, 1H, J=3.5,12.6), 1.95-1.98 (m, 1H), 1.79 (s, 3Н), 1.70 (s, 3Н), 1.43-1.60 (m, 6H), 1.35 (s, 6H), 1.00 (s, 3H); sup.13 С NMR (126 MHz, CDCl3), δ 150.2, 147.6, 143.4, 139.3, 123.1, 122.3, 112.1, 109.9, 70.9, 52.8, 47.7, 39.9, 39.8, 32.7, 29.9, 26.6, 24.7, 16.7, 15.3; HRMS (EI, Pos) m/z рассчитано для [С20Н32O]+288.2453, результат составил 288.2440.
ПРИМЕР 10
Синтез ##STR9## (Lr-1)
(R или S)-2-((1R,3S,4S)-3-изопропенил-4-метил-4-винил-циклогексил)-пропан-1,2-диол
1H NMR (400 MHz, CDCl3): δ=6.10 (1H, dd, J=17.6, 10.8 Hz), 5.15 (1H, d, J=18 Hz) 5.06 (1H, d, J=10.8 Hz), 4.70 (2H, s), 3.42 (1H, dd, J=11.2, 8.4 Hz), 3.23 (1H, dd, J=11.2, 5.2 Hz), 2.78 (1H, s), 2.15 (1H, dd, J=8.0, 5.2 Hz), 2.01 (1H, dd, J=12.4, 3.2 Hz), 1.93 (1H, tt, J=12.0, 3.2 Hz), 1.73 (3H, s), 1.61-1.56 (1H, m), 1.52-1.24 (5H, series of m), 1.26 (3H, s), 1.09 (3H, s).
ПРИМЕР 11
Синтез ##STR10## (Lr-2)
(S)-2-((1R,3S,4S)-3-изопропенил-4-метил-4-винил-циклогексил)-пропан-1,2-диол и (R)-2-((1R,3S,4S)-3-изопропенил-4-метил-4-винил-циклогексил)-пропан-1,2-диол
1H NMR (400 MHz, CDCl3): δ=5.79 (1H, dd, J=17.6, 10.8 Hz), 4.81-4.91 (3H, m), 4.58 (s, 0.5 H), 4.56 (s, 0.5 H), 3.58 (1H, 1/2ABq, J=10.8 Hz), 3.43 (1H, 1/2ABq, J=10.8 Hz), 2.26 (1H, br s), 2.08 (1H, br s), 1.96 (1H, dd, J=12.4, 4.0 Hz), 1.70 (s, 1.5 H) и 1.69 (s, 1.5 H), 1.64-1.22 (7H, series of m), 1.14 (3H, s), 0.98 (3H, s).
ПРИМЕР 12
Синтез ##STR11## (Lr-3)
1-((1R,3S,4S)-3-изопропенил-4-метил-4-винил-циклогексил)-этанон
1H NMR (400 MHz, CDCl3): δ=5.89 (1H, dd, J=17.6,10.4 Hz), 4.91 (1H, d, J=13.6 Hz), 4.91 (1H, d, J=15.6 Hz), 4.84 (1H, s), 4.60 (1H, s), 2.46-2.36 (1H, s), 2.16 (3H, s), 1.99 (1H, dd, J=9.2, 7.2 Hz), 1.79-1.66 (2H, m), 1.71 (3H, s), 1.57-1.44 (4H, m), 0.99 (3H, s).
ПРИМЕР 13
Синтез ##STR12## (Lr-4)
(S)-1,5-диизопропенил-2-метил-циклогекс-2-энол и (-R)-l,5-диизопропенил-2-метил-циклогекс-2-энол
1H NMR (400 MHz, CDCl3): δ=1.55 (t, 1H, 2JHH=12.5 Hz), 1.61 (br s, 1H), 1.67 (s, 3H), 1.72 (s, 3H), 1.81 (s, 3H), 1.94 (m, 0.5H), 1.97 (m, 0.5H), 2.03 (m, 0.5H), 2.06 (m, 0.5H), 2.10 (m, 0.5H), 2.15 (m, 0.5H), 2.25 (m, 1H), 1.94 (m, 0.5H), 1.97 (m, 0.5H), 4.72 (s, 2H), 4.81 (s, 1H), 4.97 (s, 1H), 5.62 (s, 1H)
ПРИМЕР 14
Синтез ##STR13## (Lr-5)
(S)-5-изопропенил-1,2-диметил-циклогекс-2-энол и (R)-5-изопропенил-1,2-диметил-циклогекс-2-энол
1Н NMR (400 MHz, CDCl3): δ=1.33 (s, 3H), 1.50 (bs, 1H), 1.66 (t, 1H, 2JHH=12.1 Hz), 1.74 (s, 6H), 1.89-1.98 (m, 2H), 2.09 (m, 1H), 2.30 (brt, 1H), 4.74 (s, 2H), 5.41 (s, 1H)
ПРИМЕР 15
Синтез ##STR14## (Lr-6)
(S)-3,5-диизопропенил-2-метил-циклогекс-2-энон
1H NMR (400 MHz, CDCl3): δ=1.75 (br s, 6H), 1.88 (s, 3H), 2.29-2.70 (m, 5H), 4.76 (s, 2H), 4.81 (s, 1H), 5.05 (s, 1H)
ПРИМЕР 16
Синтез ##STR15## (Lr-7)
(1S,5S)-3,5-диизопропенил-2-метил-циклогекс-2-энол и (1R,5S)-3,5-диизопропенил-2-метил-циклогекс-2-энол
1H NMR (400 MHz, CDCl3): δ=1.53 (t, 1H, xJHH=12.0 Hz), 1.65 (br s, 1H), 1.72 (s, 3H), 1.74 (s, 3H), 1.78 (s, 3H), 2.09-2.18 (m, 3H), 2.26 (brt, 1H), 4.18 (brt, 1H), 4.65 (s, 1H), 4.73 (s, 1H), 4.93 (s, 1H)
ПРИМЕР 17
Синтез ##STR16## (Lr-8)
(1R,5S)-1-изобутил-3,5-диизопропенил-2-метил-циклогекс-2-энол и (1S,5S')-1-изобутил-3,5-диизопропенил-2-метил-циклогекс-2-энол
1H NMR (300 MHz, CDCl3): δ=0.92 (2, d, 3H), 0.99 (2,d, 3H), 1.54 (m, 2H) 1.72 (s, 3H), 1.74 (s, 3H), 1.83 (m, 1H), 1.87 (m, 1H), 1.95 (m, 1H), 2.10-2.18 (2 sets of m, 1H) 2.28 (brt, 1H), 4.74 (s, 2H), 5.37 (m, 1H)
ПРИМЕР 18
Синтез ##STR17## (Lr-9, Lr-10)
(S)-5-изопропенил-2-метил-циклогекс-2-энон и (R)-5-изопропенил-2-метил-циклогекс-2-энон
1H NMR (300 MHz, CDCl3): δ=1.67 (s, 3H), 1.69 (s, 3H), 2.30-2.69 (m, 5H) 4.76 (s, 1H), 4.80 (s, 1H), 6.77 (brs, 1H)
ПРИМЕР 19
Синтез ##STR21##
(-)-бета-элеменол
К раствору (-)-бета-элемена (##STR6##, 98% чистоты, 780 мг, 3.823 ммоль) в дихлорметане (DCM, 50 мл) добавлялся К2СО3 (580 мг, 4.205 ммоль) и смесь до 0°С. m-CPBA (70% чистоты по весу, 942 мг, 3.823 ммоль) добавлялся порциями в течение 15 минут. После перемешивания в течение 2 часов при 0°С белый осадок удалялся путем фильтрации и этот осадок промывался дихлорметаном (10 мл). Вся органическая фаза концентрировалась при пониженном давлении и комнатной температуре с образованием вязкой прозрачной жидкости, которая затем очищалась посредством (FCC (гранецентрированная кубическая решетка), SiO2). В результате промывания 3% этилацетатом в гексанах образовывался невступивший в реакцию (-)-бета-элемен (198 мг, 25%). Дальнейшее промывание 5% этилацетатом в гексанах привело к образованию смеси 2:1 диастереомерных эпоксидов (450 мг, 53%), которые использовались как таковые для следующего шага без дальнейшей очистки. К раствору диизопропиламина в сухом эфире (10 мл), охлажденному до -70°С, добавлялся n-BuLi (5.96 мл 1.6М раствора в гексанах) и смесь в течение 10 минут нагревалась до комнатной температуры. К этой смеси добавлялся по каплям раствор указанных выше эпоксидов (350 мг, 1.591 ммоль) в сухом эфире (20 мл) и эта смесь перемешивалась в аргоне в течение 5 часов при комнатной температуре. Реакция гасилась водой (5 мл) и экстрагировалась при помощи пентана (150 мл). Органическая фаза промывалась водой (30 мл), рассолом (30 мл) и высушивалась через NaSO4. После испарения растворителя оставалась желтая вязкая жидкость, которая после очистки (FCC, SiO2) с использованием 20% этилацетата в гексанах представляла собой смесь 2:1 аллиловых спиртов (270 мг, 77%). Искомый основной изомер (##STR21##, (-)-бета-элеменол) был выделен в чистом виде путем многократной колончатой хроматографии. Спектральные данные для ##STR21##, (-)-бета-элеменол: IR νmax (neat)/cm-1 3336, 3080, 2928, 1639, 1439, 890; δн (300 MHz, CDCl3) 5.82 (1H, dd, J=15.0, 10.5), 5.05 (1H, bs), 4.95-4.92 (2H, m), 4.88 (1H, bs), 4.83 (bs, 1H), 4.59 (bs, 1H), 4.15 (bs, 2H), 2.10-1.98 (2H, m), 1.71 (3H, s), 1.70-1.40 (6H, series of m), 1.02 (3H, s); δC (75 MHz, CDCl3) 153.8, 150.2, 147.6, 112.3, 110.1,108.1, 65.5, 53.0, 41.7, 40.2, 40.1, 33.6, 27.5, 25.1, 16.9. [α]D25 -25 (с 0.9, СНСl3).
ПРИМЕР 20
Синтез ##STR22##
(-)-бета-элеменал
К МnО2 (430 мг, активизированной при 150°С в вакууме в течение 12 часов) добавлялся раствор ##STR21##, (-)-бета-элеменола (43 мг, 0.195 ммоль) в гексанах (5 мл) и смесь перемешивалась при комнатной температуре в течение 25 минут. МnО2 удалялась путем фильтрации и осадок промывался гексанами (5 мл). Фильтрат выпаривался и оставшаяся часть очищалась (FCC, SiO2) с использованием 1:3 этилацетатгексана в качестве элюента, при этом был выделен чистый альдегид ##STR22##, (-)-бета-элеменал в виде бесцветной жидкости (34 мг, 80%). IR νmax (neat)/cm-1 3081, 2927, 2698, 1691, 1637, 1438, 1372, 890; δН (300 MHz, CDCl3) 9.53 (1H, s), 6.29 (1H, s), 5.99 (1H, s), 5.83 (1H, dd, J=17.7, 10.5), 4.94-4.82 (3H, series of m), 4.57 (bs, 1H), 2.62-2.48 (1H, m), 2.14-2.04 (1H, m), 1.71 (3H, s), 1.78-1.40 (6H, series of m), 1.03 (3H, s); δc (75 MHz, CDCl3) 194.6, 154.9, 150.0, 147.4, 133.1, 112.3, 110.2, 52.7, 40.0, 39.9, 36.7, 33.0,27.1,25.2,16.9. [α]D25 -35.4 (с 0.9, СНСl3).
ПРИМЕР 21
Синтез ##STR23##
(-)-бета-элемен фторид
К раствору ##SТR21##, (-)-бета-элеменола (38 мг, 0.173 ммоль) в сухом дихлорметане (0.3 мл), охлажденном до -70°С, добавлялся DAST (диэтиламиносульфертрифторид, 23 мкл, 0.173 ммоль) по каплям и смесь перемешивалась в аргоне в течение 1.5 часов, и за это время температура смеси опускалась до комнатной. Реакционная смесь гасилась насыщенным раствором NаНСО3 (1 мл) при 0°С и экстрагировалась при помощи дихлорметана (15 мл). Органическая фаза промывалась водой (6 мл × 2), рассолом (10 мл) и высушивалась, При испарении растворителя образовывался желтый осадок, который затем очищался (FCC, SiO2) с использованием 0.05% этилацетата в пентане в качестве элюента, при этом был выделен высоколетучий, чистый фторид ##STR23##, (-)-бета-элемен фторид, в виде бесцветной жидкости (14 мг, 36%). IR νmax (neat)/cm-1 3081, 2929, 1638, 1439, 1373, 995, 906; δН (300 MHz, CDCl3) 5.82 (1H, dd, J=17.7, 10.5), 5.11 (1H, d, J=2.7), 5.05 (1H, bs), 4.93 (2H, d, J-3.6), 4.89 (1H, bs), 4.84 (1H, t, J=1.2), 4.78 (1H, s), 4.60 (1H, bs), 2.18-2.00 (2H, m), 1.72 (3H, s), 1.71-1.44 (6H, series of m), 1.02 (3H, s); δc (75 MHz, CDCl3) 150.1, 147.5, 112.4, 111.9, 111.8, 110.2, 85.2 (d, J-664 Hz), 52.9, 41.1, 40.1, 40.0, 33.3, 27.3, 25.1, 16.9. [α]D25 -61 (с 0.9, СНСl3).
ПРИМЕР 22
Влияние чистого (-)-бета-элемена на подавление раковых клеток in vitro
Влияние (противоопухолевая активность) чистого (-)-бета-элемена на клетки карциномы человека определялось при помощи испытания на выживаемость с МТТ, или используя промышленно изготавливаемый испытательный комплект с МТТ (Cell Titer 96 Aqueous One Solution Cell Proliferation Assay; Promega Corporation, Madison, WI) согласно инструкции изготовителя. Испытание с МТТ представляет собой широко используемый метод оценки выживаемости клеток, основанный на способности жизнеспособных клеток преобразовывать МТТ, растворимую тетразолевую соль [3-(4,5-диметилтуазол-2-ил)-2,5 бромдифенил тетразол], в нерастворимый осадок формазан, что определялось количественно путем спектрофотометрии после растворения в диметилсульфоксиде (DMSO).
Кратко, клетки карциномы, обработанные одним (-)-бета-элеменом, в кюветах с 96 ячейками с культурой ткани выдерживались с МТТ (2 мкг/мл) в течение 4 часов. Затем клетки растворялись в 125 мкл DMSO и показания спектральной поглощающей способности снимались при использовании прибора Opsys MRI Microplate Reader с 96 ячейками (ThennoLabsystems; Chantilly, VA). Степень уменьшения окрашивания МТТ рассчитывалась на основе разности между спектральной поглощающей способностью при 570 нм и 630 нм. Жизнеспособность обработанных клеток выражалась как степень уменьшения окрашивания по отношению к окрашиванию необработанных контрольных клеток. Ячейки, которые содержали только субстрат и 10 мкл МТТ, использовались в качестве слепых проб для устройства считывания с планшета. Были проведены три ряда экспериментов в 8-12 ячейках для каждого типа обработки.
ПРИМЕР 23
Влияние чистого (-)-бета-элемена in vivo на подавление роста опухоли
Исследование эффективности
Согласно исследованиям в области фармакологии, внутривенная инъекция (-)-бета-элемена в дозе 7.5, 15, 30, или 60 мг/кг один раз в день в течение 10 дней может увеличить продолжительность жизни 1) голых мышей с ксенографированной в головной мозг линией SHG-44 клеток глиомы человека до 132.84, 140.46, 150.37, и 159.81% по сравнению с контролем; 2) голых мышей с ксенографированной в головной мозг линией G422 клеток глиомы мышей до 138.78, 144.90, 153.06 и 163.27% по сравнению с контролем. Эти эксперименты были повторены, и результаты оказались совпадающими. Степень подавления опухоли в моделях с ксенографом глиомы G422 (ксенограф под кожу) (3 концентрации) составила 60.89%, 47.11% и 32.00%, соответственно. Степень подавления опухоли в моделях с ксенографом глиомы SHG-44 (ксенограф под кожу) (3 концентрации) составила 63.24%, 51.35% и 37.83%, соответственно.
Согласно руководству по фармакологии противораковых лекарственных препаратов противораковый препарат считается эффективным, если он обеспечивает коэффициент увеличения продолжительности жизни, превышающий 125%.
Согласно руководству по фармакологии противораковых лекарственных препаратов противораковый препарат считается эффективным, если он обеспечивает коэффициент увеличения продолжительности жизни, превышающий 125%.
Внутривенные инъекции (-)-бета-элемена в дозах 12.5, 25 и 50 мг/кг, дважды в день в течение 10 дней могут подавить 1) рост рака (Cap-37) молочной железы человека у ксенографированных мышей до 36.09, 45.31 и 51.33%; 2) рост рака (НСТ-8) толстой кишки человека у ксенографированных мышей до 38.32, 49.49 и 57.15%; 3) рост рака (С-3М) простаты человека у ксенографированных мышей до 27.95, 34.78 и 46.58%; 4) рост рака яичника (ао 10/17) человека у ксенографированных мышей до 28.28, 35.03 и 44.14%. Все эти эксперименты были повторены.
Материалы:
Испытуемый лекарственный препарат: инъекции (-)-бета-элемена (10 мг/мл) и контрольный раствор пустой эмульсии. Растворитель: контрольный раствор пустой эмульсии
Положительный контроль: циклофосфамид (СТХ), инъекции, изготовлен Шанхайской фармацевтической компанией, i.p. (введение через желудок), один раз в день, непрерывно в течение 7 дней.
Источники опухоли: 1) рак ао10/17 яичника человека, 2) рак простаты РС-3М человека, 3) рак А549 легких человека, 4) рак QGY печени человека, 5) рак НСТ-8 толстой кишки и 6) рак Всар-37 молочной железы человека, 7) глиома SHG422 человека, 8) глиома G422 мышей. Линии клеток глиомы SHG44 человека, рака MGC поджелудочной железы, рака QGY печени и лейкемии HL60 были предоставлены Шанхайским исследовательским институтом фармацевтической промышленности.
Животные:
Источник: голые мыши, поставляемые центром экспериментальных животных Академии наук Китая, Шанхай. Сертификат качества: No.005, Hudong Certificate. Куныминские мыши предоставлены собственным виварием. Сертификат качества: No.107, Hudong Certificate.
Вес: голые мыши, в возрасте 6 недель, 18-20 г.
Пол: самки и самцы. В каждом эксперименте использовались животные одного пола.
Количество животных: испытуемая группа и группа положительного контроля содержали каждая по 6 голых мышей. Каждая группа куныминских мышей содержала по 10 особей. Были две группы отрицательного контроля.
Доза: инъекция β-элемена в дозе 50,25 и 12.5 мг/кг/раз.
Протокол применения лекарственного препарата: внутривенные инъекции (i.v.), дважды в день, непрерывно в течение 10 дней. Все 20 раз использовались внутривенные инъекции.
Контрольный опыт: Объем раствора пустой эмульсии, который давался группе отрицательного контроля, был таким же, как и в испытуемых группах. Протокол применения: внутривенная инъекция дважды в день, непрерывно в течение 10 дней. СТХ давался группе положительного контроля в дозе 30 мг/кг каждый раз, один раз в день, непрерывно в течение семи дней. Инъекции митомицина С (ММС), полученного из Xiehe Fermentation Industrial Co., использовались как положительный контроль при экспериментах in vitro.
Эксперименты In vivo:
Ксенограф под кожу: в боксе клеточной культуры (безбактериальная среда), источник опухоли (1×107 /мл клеточного раствора, 0.2 мл каждой мыши) вводился в виде инъекции под кожу подмышечной впадины голых мышей. На второй день ксенографированным мышам давался лекарственный препарат β-элемен. Через 3 недели мыши умертвлялись. Опухоль каждой мыши извлекалась и взвешивалась. Коэффициент подавления опухоли рассчитывался по следующей формуле:
Коэффициент подавления % = [(Средний вес опухоли в группе отрицательного контроля - Средний вес опухоли в испытуемой группе) / Средний вес опухоли в группе отрицательного контроля] × 100
Модели ксенографов с источниками опухоли человека осуществлялись с использованием одной и той же процедуры. Но пища, прокладка, клетка и оборудование стерилизовались перед использованием. Голые мыши выращивались на подставке из сенглиу (cengliu).
Модели на мышах с опухолью, ксенографированной в головной мозг мыши: линия G-422 или SHG44 клеток глиомы (логарифмическая фаза) разводились до 2×107/мл в боксе клеточной культуры (безбактериальная среда). Каждой мыши производилась инъекция в мозг 0.05 мл клеток опухоли. На второй день ксенографированные мыши получали лечение препаратом β-элемен. Время переживания этих мышей записывалось на протяжении последующих 30 дней. Увеличение продолжительности жизни вычислялось по следующей формуле:
Коэффициент увеличения продолжительности жизни = [(Средняя продолжительность жизни в днях в контрольной группе - Средняя продолжительность жизни в днях в испытуемой группе) / Средняя продолжительность жизни в днях в контрольной группе) × 100
Результаты:
Коэффициент подавления опухоли в модели с ксенографом рак А549 легкого при использовании β-элемена в дозах 50, 25 и 12.5 м г/кг/раз, iv×10 два раза в день составил 43.08%, 40.0% и 31.28% соответственно.
Коэффициент подавления опухоли в моделях с ксенографом рака печени QGY (протокол совпадает с описанным выше) составил 45.89%, 37.20% и 30.92%, соответственно.
Коэффициент подавления опухоли в моделях с ксенографом рака яичников ао10/17 (протокол совпадает с описанным выше) составил 46.42%, 36.25% и 31.08%, соответственно.
Коэффициент подавления опухоли в моделях с ксенографом рака простаты РС-3М (протокол совпадает с описанным выше) составил 46.58%, 34.78% и 27.95%, соответственно.
Коэффициент подавления опухоли в моделях с ксенографом рака толстой кишки НСТ-8 (протокол совпадает с описанным выше) составил 54.20%, 46.01% и 35.10%, соответственно.
Коэффициент подавления опухоли в моделях с ксенографом рака молочной железы человека Всар-37 (протокол совпадает с описанным выше) составил 48.08%, 43.23% и 33.08%, соответственно.
Примечание: В Примере 23 β-элемен представляет собой (-)-бета-элемен. Исследование общей фармакологии
Согласно исследованиям в области общей фармакологии медленная внутривенная инъекция инъекционного раствора (-)-бета-элемена в дозах 20, 40 и 80 мг/кг могла выражено замедлить сердцебиение у гончей собаки даже через два часа после инъекции. У группы, получавшей 40 и 80 мг/кг, удлинялся интервал Q-R. У группы, получавшей 80 мг/кг, снизилось систолическое давление. Следовательно, эти данные указывают на то, что инъекция (-)-бета-элемена может замедлить функцию сердца, но не влияет на ЭКГ и дыхание. Инъекция (-)-бета-элемена, кроме того, влияет на способность к координации движений у мышей.
ПРИМЕР 24
Эксперименты по токсичности с использованием (-)-бета-элемена
Исследование острой токсичности
Отдел токсикологии Шанхайского исследовательского института фармацевтической промышленности провел данные исследования. В Таблице 12 приводятся LD50 (средняя летальная доза) 0,5% эмульсии β-элемена, определенной для грызунов.
У выживших животных не наблюдалось выраженных клинических симптомов. Большинство смертей произошло в течение 24 часов после применения лекарственного препарата. Клинические признаки токсичности проявлялись в виде затрудненности дыхания, рвоты, диареи. У мертвых животных не было обнаружено заметного повреждения внутренних органов.
Исследование хронической токсичности
Отделом токсикологии Шанхайского исследовательского института фармацевтической промышленности были проведены два исследования по хронической токсичности; одно на гончих собаках и другое на крысах. В исследовании с использованием гончих собак трем группам гончих собак (6 особей в каждой группе) вводился (внутривенно) β-элемен в дозах 15, 30 и 75 мг/кг/в день (i.v.) в течение 28 дней. Группа, получавшая высокую дозу, испытывала тошноту, рвоту, потерю аппетита, потерю веса, слюнотечение и другие побочные эффекты. В группе, получавшей высокую дозу, изменились некоторые биохимические параметры. Значительных патологических изменений, связанных с применением лекарственного препарата, не было обнаружено в группах, получивших низкую и среднюю дозу. В группе, получавшей 15 мг/кг, наблюдалось некоторое раздражение в месте инъекции и никаких других симптомов. Таким образом, доза 15 мг/кг была признана нетоксичной.
В исследовании с использованием крыс три группы крыс (по 20 особей в каждой группе, половина - самцы и половина - самки) получали β-элемен внутрибрюшинно в дозах 7.5, 15 и 30 мг/кг/день последовательно в течение 28 дней. Шесть крыс, получавших высокую дозу, умерли. В желудке этих крыс была обнаружена кровь (40-100 мл). Асцит развивался у всех животных, получавших средние и высокие дозы. Асцит не проходил полностью в течение 4 недель без приема лекарств. В группах, получавших низкие дозы, и двух контрольных группах, получавших 10% глюкозу и эмульсию плацебо, не было обнаружено существенных изменений. Биологические исследования крови и плазмы показали, что у крыс из групп, получавших средние и высокие дозы препарата, развилась анемия, увеличилось количество белых кровяных телец. На стадии выздоровления ненормальные уровни ACT и АЛТ наблюдались у некоторых крыс из групп, получавших средние и высокие дозы препарата. Гистологические исследования указывали на значительное утолщение мембран и выпадение коричневых частиц в брюшной полости, тазовой полости и трахеи крыс из групп, получавших средние и высокие дозы. Наблюдалось воспаление в некоторых органах крыс в группах, получавших средние и высокие дозы препарата. Накопленная токсичность β-элемена (при внутрибрюшинном введении) не была серьезной, за исключением местного раздражения в зоне введения. Безопасная доза 7.5 мг/кг/день.
ПРИМЕР 25
Эффективность бета-элемена (2% эмульсия) при лечении опухоли головного мозга у больных людей
Лекарственный препарат бета-элемен имеет значительный клинический эффект для больных с опухолями головного мозга. В клинических испытаниях, проведенных Yuanda, лекарственный препарат элемен в виде внутриартериальных или внутривенных инъекций. Клинические испытания проводились с марта 1999 г. по апрель 2001 г. в госпиталях, определенных Комитетом по пищевым продуктам и лекарствам Китая (FDA). У 39 пациентов, страдающих глиобластомой и принимавших участие в испытаниях, полное реагирование (CR) наблюдалось у 5%, частичное реагирование (PR) - у 31%. Таким образом, общий уровень реагирования опухоли составил 36%. У TEMODAR общий уровень реагирования (CR+PR) составил только 20%. Кроме того, у 90% больных уменьшились следующие симптомы: головокружение, головная боль, нарушение речи, нервные расстройства и паралич. Некоторые пациенты жаловались на незначительный зуд, который облегчался при помощи горячих компрессов. Не наблюдалось никаких аллергических реакций. Не наблюдалось отрицательных реакций со стороны печени, почек, сердца, желудка, желудочно-кищечного тракта, нервной системы и т.п. Ни у одного пациента не наблюдались серьезные реакции с летальным исходом. Не наблюдалась рвота или гематологические отклонения.
ПРИМЕР 26
Эффективность бета-элемена (0.5% эмульсия) при лечении рака легких
Исследование 1 - Сочетанная терапия инъекций эмульсии элемена и лучевой терапии при лечении IV стадии немелкоклеточного рака легких. Jie Li & Ju-Sheng Hou, Онкологическая больница Второго филиала госпиталя Даляньского медицинского университета, Далянь, Китай.
Исследование 2 - Сравнительное исследование введения в две артерии элемена и химиотерапевтических препаратов при лечении рака легких. Xin Li, Shao-Xiong Xu, & Guo-Yan Shang, Отделение радиологии Даляньского медицинского университета, Далянь, Китай.
Исследование 3 - Исследование эмульсии элемена при лечении рака легких в поздней стадии. Jia-liu Zhang, Xue-chang Zhang, & Jing-san Zhang. Отделение дыхательной системы Куныминского народного госпиталя №1, Кунымин, Китай.
Исследование 4 - Результаты наблюдений при клинических испытаниях больных раком легких, получающих лечение эмульсией элемена. Shu-kui Qin, Jun Qian, Lin Wang, & Ze-ming He; Терапевтическое отделение Онкологического центра Наньцзинской больницы Байи, Наньцзин, Китай.
ПРИМЕР 27
Эффективность бета-элемена (0.5% эмульсия) при лечении рака пищевода и рака поджелудочной железы.
Исследование 5 - Клиническая оценка элемена при лечении рака пищевода и рака поджелудочной железы. Shi-yong Yang, Группа оценки клинических эффектов элемена у больных раком пищевода и рака поджелудочной железы. Сиань, Китай.
ПРИМЕР 28
Эффективность бета-элемена (0.5% эмульсия) при лечении опухолей желудочно-кишечного тракта
Исследование 6 - Лечение 30 больных со злокачественными опухолями желудочно-кишечного тракта путем применения элемена несколькими способами. Qing-zhen Zhang, Li-xian Си, & Xian-jun Zhu, Народный госпиталь Чжанцю, Чжанцю, Китай.
Исследование 7 - Клиническая эффективность эмульсии элемена при лечении опухолей желудочно-кишечного тракта на поздних стадиях посредством индуцирования асцита желудка. Gui-fen Niu & Nan-sheng Cheng, Отделение систем пищеварения Сучжоуского народного госпиталя №2; Сучжоу, Китай.
ПРИМЕР 29
Эффективность бета-элемена (0.5% эмульсия) при лечении рака толстой и прямой кишки
Исследование 8 - Анализ клинической эффективности лечения 65 случаев лечении рака толстой и прямой кишки при использовании эмульсии элемена, Gao Xiang, Xue-zai Chen, & Gui-feng Chen, Отделение онкологии Наньпиньского госпиталя №1, Наньпинь, провинция Фуцзянь, Китай.
Исследование 9 - Наблюдение за краткосрочной клинической эффективностью лечения больных с раком толстой и прямой кишки на поздних стадиях эмульсией элемена, вводимой через консервативную клизму. Qun-xiong Pan, & Jie-ji Guo, Хирургическое отделение Цюаньчжоуского госпиталя №1, Цюаньчжоу, провинция Фуцзянь, Китай.
Исследование 10-18 случаев непроходимости толстой кишки после хирургического лечения рака толстой кишки, пролеченных эмульсией элемена, вводимой внутривенно под ключицу. Rui-lan Li, & Zhong-de Liu, Хунаньский госпиталь лечения опухолей лекарственными растениями. Чангша, провинция Хунань, Китай.
ПРИМЕР 30
Эффективность бета-элемена (0.5% эмульсия) при лечении рака желудка
Исследование 11. Наблюдение за злокачественными опухолями желудка, пролеченными эмульсией элемена через тонкий кишечник, Jin-lian Zhang, & Mei-xia Wu, Госпиталь №2 Луняньского района провинции Фупзянь. Лунянь, провинция Фуцзянь, Китай.
ПРИМЕР 31
Эффективность бета-элемена (0.5% эмульсия) при лечении первичного рака печени
Исследование 12 - Обобщение результатов клинических испытаний терапии больных с первичным раком печени эмульсией элемена, вводимого через печеночную артерию. Li-seng Xiao, & Wei-ming Zhu, Усиский народный госпиталь №4, Усиси, провинция Цзянсу, Китай.
ПРИМЕР 32
Испытание противоопухолевой активности производных элемена от LR1 до LR10 по методу МТТ
Используя тот же протокол испытаний по методу ММТ, который был описан подробно в Примере 22, мы определили IС50 для LR1-LR10 в подавлении роста линии клеток глиомы человека. Таблица приведена ниже.
ПРИМЕР 33
Влияние противоопухолевой активности (-)-бета-элемена (0.5% эмульсия), взятого в качестве контроля, и (-)-бета-элеменола, (-)-бета-элеменала и (-)-бета-элеменфторида, называемых в следующем параграфе для простоты испытуемыми продуктами, на клетки карциномы человека определялось при помощи испытания на выживаемость с МТТ, или используя промышленно изготовленный испытательный комплект с МТТ (Cell Titer 96 Aqueous One Solution Cell Proliferation Assay; Promega Corporation, Madison, WI) согласно инструкции изготовителя. Испытание с МТТ представляет собой широко используемый метод оценки выживаемости клеток, основанный на способности жизнеспособных клеток преобразовывать МТТ, растворимую тетразолевую соль [3-(4,5-диметилтуазол-2-ил)-2,5 бромдифенил тетразол], в нерастворимый осадок формазан, что устанавливается количественно путем спектрофотометрии после растворения в диметилсульфоксиде (DMSO).
Кратко, клетки карциномы, обработанные только испытуемыми продуктами, в кюветах с 96 ячейками с культурой ткани выдерживались с МТТ (2 мкг/мл) в течение 4 часов. Затем клетки растворялись в 125 мкл DMSO и показания поглощения снимались с помощью прибора Opsys MRI Microplate Reader (ThermoLabsystems; Chantilly, VA). Степень уменьшения окрашивания МТТ рассчитывалась на основе разности между спектральной поглощательной способностью при 570 нм и 630 нм. Жизнеспособность обработанных клеток выражалась как степень уменьшения окрашивания по отношению окрашиванию необработанных контрольных клеток. Ячейки, которые содержали только субстрат и 10 мкл МТТ, использовались в качестве слепых проб для устройства считывания с планшета. Были проведены три серии экспериментов 8-12 ячейках для каждого варианта обработки, что показано в Таблице 15.
ПРИМЕР 34
Синергистический эффект при сочетании (-)-бета-элемена с цисплатином
Влияние противоопухолевой активности (-)-бета-элемена и/или цисплатина на клетки карциномы человека определялось при помощи испытания на выживаемость с МТТ, или используя промышленно изготавливаемый испытательный комплект с МТТ (CellTiter 96 Aqueous One Solution Cell Proliferation Assay; Promega Corporation, Madison, WI) согласно инструкции изготовителя. Испытание с МТТ представляет собой широко используемый метод оценки выживаемости клеток, основанный на способности жизнеспособных клеток преобразовывать МТТ, растворимую тетразолевую соль [3-(4,5-диметилтуазол-2-ил)-2,5 бромдифенил тетразол], в нерастворимый осадок формазан, что определяется количественно путем спектрофотометрии после растворения в диметилсульфоксиде (DMSO).
Кратко, клетки карциномы, необработанные и обработанные одним цисплатином или сочетанием (-)-бета-элемена (при уровне IС20 каждой линии раковых клеток) и цисплатином в кюветах с 96 ячейками с культурой ткани выдерживались с МТТ (2 мкг/мл) в течение 4 часов. Затем клетки растворялись в 125 мкл DMSO и показания спектральной поглощающей способности снимались при помощи прибора Opsys MRI Microplate Reader (ThermoLabsystems; Chantilly, VA). Степень уменьшения окрашивания МТТ рассчитывалась на основе разности между спектральной поглощающей способностью при 570 нм и 630 нм. Жизнеспособность обработанных клеток выражалась как степень уменьшения окрашивания по отношению к окрашиванию необработанных контрольных клеток. Ячейки, которые содержали только субстрат и 10 мкл МТТ, использовались в качестве слепых проб для устройства считывания с планшета. Были проведены три серии экспериментов в 8-12 ячейках для каждого варианта обработки
ПРИМЕР 35
Характеристики сочетаемости нового противоопухолевого растительного лекарственного препарата (-)-бета-элемена с таксанами (taxanes) при лечении рака легких человека, полученные in vitro
Эффекты сочетаемости, оцененные посредством синергистического анализа
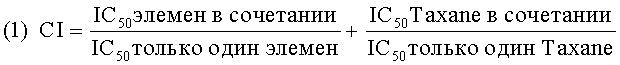
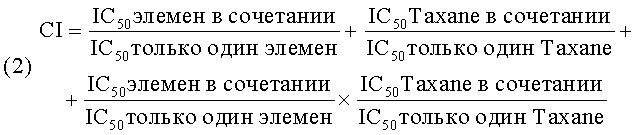
Основная классификация имеет следующий вид: CI<1.0 указывает на синергизм; CI=1.0 добавочное действие и СI>1.0 антагонизм.
Влияние сочетания (-)-бета-элемена с паклитакселом или доцетакселом при более высоких уровнях цитотоксичности (при IC50) на подавление пролиферации клеток рака легкого человека показано в Таблице 17. Из этих данных можно сделать вывод, что в любом случае, предполагались ли механизмы действия лекарств взаимно исключающими или взаимно неисключающими, CI для сочетания (-)-бета-элемена с паклитакселом или доцетакселом показал цитотоксичное действие в диапазоне от слабого синергизма до синергизма. Значительно более сильные синергистические эффекты от взаимодействия при таком сочетании наблюдались в мутации Р53 и клетках нулевого типа Р53, чем в клетках дикого типа Р53. Кроме того, CI (-)-бета-элемена с паклитакселом или доцетакселом изменялись в зависимости от типа исследуемых клеток. Эти изменения могут отражать различия тех путей, по которым клетки рака легких борются с повреждениями, вызванными лекарственными средствами. Однако, не было замечено существенного различия между CI, полученными при сочетании (-)-бета-элемена и паклитаксела, и CI, полученными при сочетании (-)-бета-элемена и доцетаксела, на четырех рассматриваемых линиях клеток.
ПРИМЕР 36
Действие сочетания 5-Fu с (-)-бета-элеменом на клетки рака толстого кишечника человека
Открытие:
(1) Сочетание 5-fu и оксалиплатина с (-)-бета-элеменом при одновременном применении производило антагонистические эффекты во всех четырех линиях клеток рака толстого кишечника, НСТ-116, НСТ-15, Сасо-2 и Colo 205;
(2) Сочетание 5-fu с (-)-бета-элеменом при последовательном применении производило антагонистические эффекты в клетках рака толстого кишечника НСТ-116, НСТ-15 и аддитивные эффекты или синергистические эффекты в линиях Сасо-2 и Colo 205;
(3) Сочетание оксалиплатина с (-)-бета-элеменом при одновременном применении производило аддитивные или синергистические эффекты во всех четырех линиях клеток рака толстого кишечника, НСТ-116, НСТ-15, Сасо-2 и Colo 205.
Культура клеток и воздействие лекарственным препаратом
Линии НСТ-15, НСТ-116, Сасо-2, Colo 205, НСТ-15(+СОХ-2) клеток рака толстого кишечника человека были получены из Американской коллекции культур (American Type Culture Collection (Manassas, VA)) и выращены в устройстве RPMI 1640 с добавлением 10% сыворотки плода крупного рогатого скота. Клетки выдерживались при температуре 37°С во влажной атмосфере с содержанием 5% CO2. Клетки высевались за 24 часа до воздействия на них лекарственным препаратом. Изучалось действие (-)-бета-элемена и 5-Fu (Sigma) на линии клеток рака толстого кишечника. Лекарственные препараты растворялись в 100% DMSO и затем разводились экспериментальным субстратом.
Определение жизнеспособности клеток
Клетки высеивались в количестве 3000 клеток/в ячейку на планшете, содержащем 96 ячеек, за 24 часа до воздействия на них лекарственным препаратом и затем обрабатывались (-)-бета-элеменом, только одним 5-Fu или оксалиплатином в различных концентрациях на 4, 8, 12, 24, 48, 72 часа. Исследовались эффекты взаимодействия 5-Fu, оксалиплатина в сочетании с (-)-бета-элеменом в отношении линий НСТ-116, НСТ-15, Сасо-2, Colo 205 и НСТ-15(+СОХ-2) клеток рака толстого кишечника человека при одновременном и последовательном регламенте приема. При этом на линии НСТ-116, НСТ-15, НСТ-15(+СОХ-2) воздействовали элеменом в дозе 160 мкг/мл, а на линии Сасо-2, Colo 205 воздействовали (-)-бета-элеменом в дозе 80 мкг/мл в сочетании с такими же концентрациями только одного 5-Fu и только одного оксалиплатина при одновременном применении в течение 4, 8, 12, 24, 48, 72 часов, или на линии НСТ-116 и НСТ-15 воздействовали (-)-бета-элеменом в дозе 160 мкг/мл в течение 2, 4, 8, 6, 12, 24, 36 часов с последующим воздействием только одним 5-Fu с теми же концентрациями в течение 2, 4, 8, 6, 24, 36 часов; а на линии клеток Сасо-2 и Colo 205 воздействовали элеменом в дозе 80 мкг/мл в течение 2, 4, 8, 6, 12, 24, 36 часов с последующим воздействием таких же концентраций только одного 5-Fu и только одного оксалиплатина в течение 2, 4, 8, 6, 24, 36 часов. Жизнеспособность клеток оценивалась при помощи прибора CellTiter96® AQueous One Soultion Reagent (Promega, Madison, WI), который содержал новое соединение [3-(4,5-dimethylthiazol-2-ил)-5-(3-карбоксиметоксифенил)-2-(4-сульфофенил)-2Н-тетразолиум, внутренняя соль; MTS], раствор которого добавлялся к субстрату с конечной концентрацией 1 мг/мл/ячейка, после инкубирования при 37°С в течение 1-2 часов. Спектральная поглощающая способность измерялась на длине волны 490 нм на приборе для считывания с микропланшета с 96 ячейками (Molecular Devices, Wokingham, United Kingdom).
Результаты
Тест с MTS показал, что действие (-)-бета-элемена в сочетании с 5-FU и оксалиплатином в течение 4-72 часов при одновременном режиме приводило к антагонистическим эффектам в отношении всех четырех линий клеток НСТ-116, НСТ-15, Сасо-2 и Colo 205. Последовательное воздействие (-)-бета-элеменом в течение 2, 4, 6, 12 часов 5-FU в течение 2, 4, 6, 12 часов производило синергистические эффекты, а последовательное воздействие (-)-бета-элеменом в течение 24, 36 часов и 5-FU в течение 24, 36 часов производило аддитивные эффекты в отношении линий Colo 205 и Сасо-2; при этом одновременное воздействие приводило к антагонистическим эффектам в отношении линий НСТ-15 и НСТ-116; более того, последовательное воздействие (-)-бета-элеменом в течение 2 - 36 часов и оксалиплатином в течение 2-36 часов производило синергистический эффект. В следующих таблицах в качестве аббревиатуры для (-)-бета-элемена используется элемен.
Реферат
Настоящее изобретение относится к способу получения (-)-бета-элеменала, к применению (-)-бета-элеменала в качестве противоопухолевого средства, а также к фармацевтической композиции и лекарственному средству на его основе. Способ заключается во взаимодействии смеси изомерных бета-элеменолов (2:1) с MnO2, активизированным в вакууме при 150°С, в качестве катализатора. При этом исходную смесь изомерных бета-элеменолов (2:1) получают при взаимодействии смеси диастереомерных эпоксидов (2:1) с диизопропиламином в присутствии n-BuLi. 4 н.п. ф-лы, 21 табл., 9 ил., 36 пр.

Комментарии