Способ получения 2-винилнорборнана - RU2665488C1
Код документа: RU2665488C1
Чертежи






Описание
Изобретение относится к новому способу синтеза 2-винилнорборнана, который может быть использован в различных отраслях народного хозяйства, в частности, как мономер для получения сополимеров различного назначения, а также топлив, в частности, ракетных и для дальней авиации.
В настоящее время 2-винилнорборнан получают, используя приемы тонкой органической химии, металлоорганического катализа (гидровинилированием (гетеродимеризацией) норборнена с этиленом) или парциальным гидрированием 2-винил-5-норборнена, который получают из доступного сырья - циклопентадиена, являющегося побочным продуктом пиролиза нефтяных фракций, и дивинила. Интерес к 2-винилнорборнану обусловлен возможностью синтеза широкого набора высокоэнергетических соединений, обладающих комплексом полезных свойств (высокими импульсом и плотностью, низкими температурами замерзания и токсичностью).
Получение 2-винилнорборнана с помощью приемов тонкой органической химии
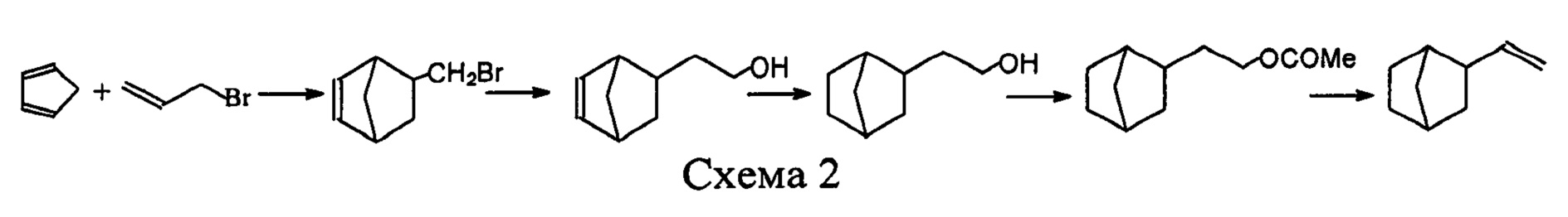
Впервые синтез 2-винилнорборнана, а также его полимеризация, были описаны в работе [Н.А. Беликова, В.А. Каргин, А.Ф. Платэ, Н.А. Платэ, Г.С. Тайц, И.Н. Лямина. Синтез и полимеризация 2-винилбицикло[2.2.1]гептана. // Нефтехимия. 1961. Т. 1. С. 218-223]. В этой работе реализованы два метода синтеза 2-винилнорборнана (схемы 1 и 2).

Первый метод, состоящий из пяти стадий, исходит из винилацетилена и включает его гидратацию с образованием метилвинилкетона, а также последующую диеновую конденсацию полученного алкена с циклопентадиеном с образованием 5-ацетилбицикло[2.2.1]гепт-2-ена. Гидрирование циклоаддукта дало 2-(α-оксиэтил)бицикло[2.2.1]гептан, из которого далее был синтезирован соответствующий ацетат. При пиролизе (425°С) данного ацетата был получен 2-винилнорборнан (55%) в смеси с 2-этилиден-норборнаном (45%).
Первой стадией второго метода (схема 2) являлась диеновая конденсация циклопентадиена и бромистого аллила с образованием бромметилнорборнена. Реакция реактива Гриньяра, синтезированного из бромметилнорборнена, с формальдегидом привела к 2-(β-оксиэтил)норборнену. Гидрирование этого производного норборнена и последующее ацилирование позволило получить ацетат. Пиролиз синтезированного ацетата давал чистый 2-винилнорборнан.
В работе [М. Imoto, Т. Otsu, A. Tanaka. Preparation and polymerization of 2-vinylbicyclo[2.2.1]heptane. // Koguo Kagaki Zasshi. 1965. V. 68. №2. P. 369-373] 2-винилнорборнан синтезирован с 20% выходом с использованием реакции Кневенагеля из норборнанового альдегида (эндо-бицикло[2.2.1]гептан-карбальдегида) и малоновой кислоты под действием хинолина при 50-90°С и последующего декарбоксилирования образовавшейся дикарбоновой кислоты (200-220°С) (схема 3).

Схема 3
В работе [Т. Hayashi, К. Kanehira, Т, Hicki, М. Kumada. Kinetic resolution of racemic Grignard reagents by Nickel-catalysed asymmetric Grignard cross-coupling. // Tetrahedron Letters. 1981. V. 22. P. 137-140] описывается получение 2-винилнорборнана кросс-сочетанием норборнилмагнийхлорида с вини л бромид ом (схема 4).

Общим недостатком всех перечисленных способов получения 2-винилнорборнана является большое число стадий синтеза, что неизбежно приводит к низким выходам целевого соединения - 2-винилнорборнана. Кроме того, все подходы предполагают использование дорогостоящих и малостабильных, а иногда и токсичных, реагентов. Все это не позволяет получать 2-винилнорборнан в широком масштабе.
Получение 2-винилнорборнана гидровинилированием (гетеродимеризацией) норборнена этиленом, катализируемое соединениями переходных металлов
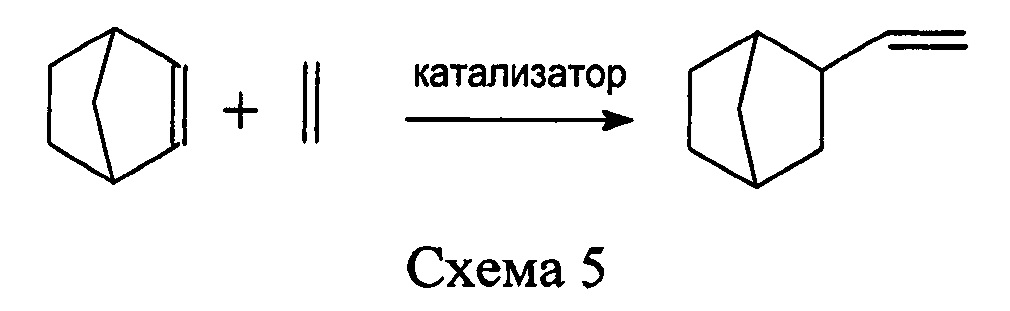
Реакция гидровинилирования представляет собой взаимодействие этилена с норборненом, катализируемое соединениями переходных металлов (схема 5).
В 1970-е годы G. Wilke с сотрудниками разработали каталитические системы гидровинилирования (гетеродимеризации), состоящие из π-аллилникельгалогенида, кислоты Льюиса и фосфина. Эти катализаторы эффективны в реакции гидровинилирлования с такими ненасыщенными циклическими углеводородами, как норборнен и циклооктадиен-1,3. Начиная с 1980-х годов интерес к вовлечению норборненов и других ненасыщенных карбоциклов в гетеродимеризацию с этиленом значительно возрос, и в 1980 году G. Wilkinson ввел в употребление для реакции содимеризации с этиленом термин «гидровинилирование». Содимеризация этилена с норборненом легко протекает при невысоких температурах, а выходы 2-винилнорборнана достигают 80% [В. Bogdanovic, В. Henc, В. Meister, Н. Pauling, G. Wilke. Eine katalytisch verlaufende asymmetrische Synthese. // Angew. Chem. 1972. V. 84. №21. P. 1070-1071; B. Bogdanovic, B. Henc, B. Meister, H. Pauling, G. Wilke. A Catalyzed Asymmetric Synthesis. // Angew. Chem. Int. Ed. Engl. 1972. V. 11. №11. P. 1023-1024; B. Bogdanovic. Asymmetric Synthesis with the Aid of Homogeneous Transition Metal Catalysts. // Angew. Chem. Int. Ed. Engl. 1973. V. 12. №12. P. 954-964; B. Bogdanovic. Asymmetrische Synthesen mit homogenen Ubergangsmetall-katalysatoren. // Angew. Chem. 1973. V. 85. №23. P. 1013-1023].
Исследование реакции гидровинилирования были направлены на создание новых эффективных катализаторов. Были получены комплексы различных металлов (Ni, Со, Ru, Pd, Rh) с новыми специально синтезированными лигандами [Comprehensive Organometallic Chemistry: book series / Wilkinson G., Stone F.G., Abel E.W. - Oxford, Pergamon Press.-1982. V. 8. P. 486]. При использовании в качестве лигандов азафосфоленов формулы:

получены эффективные катализаторы гидровинилирования норборнена этиленом. Селективность образования 2-винилннорборнана не превышала 90% при конверсии норборнена 70-80%, т.е. выход не превышал 72% [Neue Azaphospholene und ihre Verwendung: pat. DE3618169: MПК: C07F 9/65/ Wilke G., Monkiewicz J., Kuhn H. Заявитель Studiengesellschaft Kohle mbH (DE) №DE 19863618169, заявл. 30.05.1986, опубл. 03.12.1987; Azaphospholenes: pat. US 4900866: МПК: C07F 9/22 / Wilke G., Monkiewicz J., Kuhn H. Заявитель Studiengesellschaft Kohle mbH (DE) №246228, заявл. 19.09.1988, опубл. 13.02.1990; Azaphospholenes and use thereof: pat. US 4912274: МПК: C07C 2/50 / Wilke G., Monkiewicz J., Kuhn H. Заявитель Studiengesellschaft Kohle mbH (DE) №385614, заявл. 26.07.1989, опубл. 27.03.1990; Formation of vinylbicycloheptane: pat. CA1318919: МПК: B01J 31/00, C07C 2/04, С07С 5/31/ Wilke G., Monkiewicz J., Kuhn H., Заявитель Studiengesellschaft Kohle mbH (DE) №CA 19910616184, заявл. 26.09.1991, опубл. 08.06.1993].
Недостатками описанных процессов получения 2-винилнорборнана по реакции гидровинилирования норборнена этиленом являются недостаточный выход целевого продукта, необходимость использования дорогостоящих катализаторов, содержащих сложные лиганды, и в отдельных случаях требуется проведения синтеза под давлением этилена.
Получение 2-винилнорборнана гидрированием 2-винил-5-норборнена
Наиболее перспективным подходом для широкомасштабного получения 2-винилнорборнана представляется селективное гидрирование доступного 2-винил-5-норборнена (схема 7).

При гидрировании 2-винил-5-норборнена (1) возможно образование трех продуктов (схема 8).

Целевой продукт - 2-винилнорборнан (2) образуется в результате присоединения водорода по двойной связи бицикла 2-винил-5-норборнена (1), гидрирование винильной группы 2-винил-5-норборнена приводит к 2-этил-5-норборнену (3), а при гидрировании обеих двойных связей образуется 2-этилнорборнан (4). Следовательно, для получения 2-винилнорборнана (2) из 2-винил-5-норборнена (1) необходимо осуществить максимально селективное гидрирование внутрициклической (норборненовой) двойной связи. Во всех технических решениях, посвященных гидрированию 2-винил-5-норборнена, наряду с целевым продуктом - 2-винилнорборнаном (2) наблюдалось образование побочного продукта - 2-этилнорборнана (4). Главным условием преимущественного образования целевого продукта является существенное превышение скорости гидрирования двойной связи бицикла над скоростью гидрирования винильной группы. Для этого необходимо подобрать условия проведения процесса и исследовать кинетику с целью определения соотношения скоростей целевого и побочного направлений реакции гидрирования и возможности целенаправленного подбора условий реакции.
В опубликованных работах, посвященных гидрированию 2-винил-5-норборнена, используют как гетерогенные, так и гомогенные катализаторы. С технологической точки зрения гетерогенные катализаторы имеют преимущества над гомогенными, так как их легко отделить от катализата (не прореагировавшего исходного соединения и продуктов реакции) и, в большинстве случаев, они могут быть регенерированы.
Первое сообщение о получении 2-винилнорборнана гидрированием 2-винил-5-норборнена описано в работе [И.С. Коломников, И.Л. Нахшунова, Ф. Прухник, Н.А. Беликова, М.Е. Вольпин. Восстановление непредельных соединений с переносом водорода от спирта в присутствии солей переходных металлов. // Изв. АН СССР, серия хим. 1972. №5. С. 1180-1181]. Восстановление было осуществлено реакцией переноса водорода от спирта в присутствии солей переходных металлов RhCl3⋅nH2O или RuCl3 в этаноле (схема 9). Выход 2-винилнорборнана составлял 40% и 36% для RhCl3⋅nH2O и для RuCl3, соответственно.

В 1970-х годах было показано, что на скелетных Ni, Pd и Pt чернях гидрируются обе двойные связи 2-винил-5-норборнена с образованием смеси 2-винилнорборнана и 2-этилнорборнана [Беликова Н.А. Синтез, свойства и изомерные превращения мостиковых бициклических углеводородов состава С8 и С9.:, дис. докт хим. наук: 02.00.03.: защищена 05.05.71; утверж. 14.01.72 - М., 1971. - 401 с. Библиогр. с. 379-401].
В работе [Н.С. Зефиров, В.И. Соколов. Напряженная двойная связь. // Успехи химии. 1967. Т. 36. С. 243-268] показано, что эндоциклическая (норборненовая) двойная связь обладает большим напряжением и гидрируется либо в равной, либо в несколько большей степени, чем двойная связь винильной группы.
В работе [Ю.Г. Осокин, В.А. Михайлов, И.А. Зубович, В.Ш. Фельдблюм. Стереохимия и механизм гидрирования 5-винилбицикло[2.2.1]гептена-2 на металлах платиновой группы. // Докл. АН СССР. 1975. Т. 220. №4. С. 851-853] исследованы катализаторы на основе металлов платиновой группы Ru, Rh и Ir, а также их смеси (Ir+nRu) и (Ir+nRh), нанесенные на силикагель. Для всех катализаторов реакция протекает не селективно и в результате гидрирования образуются продукты, приведенные на схеме 10.

В патенте [US 8716508 Method for preparing a metal catalyst, С07C 233/00, С07C 5/05, С07F 15/00 / Abdur-Rashid K., Amoroso D., Chen X., Guo R., Lu Sh. Tsang C.-W., заявитель и патентообладатель Abdur-Rashid K. (CA), Amoroso D. (CA), Chen X. (CA), Guo R. (CA), Lu Sh. (CA), Tsang C. (CA) Kanata Chemical Technologies Inc (CA), №US200913123982, заявл. 08.10.2009, опубл. 06.05.2014] описан синтез родиевых комплексов с аминофосфиновыми лигандами (схема 11) и использование их в качестве катализаторов гидрирования 2-винил-5-норборнена (давление водорода 7 атм, температура 25°С). Циклооктадиенаминофосфиновый комплекс родия Rh(cod)(Ph2PCH2CH2NH2)BF4 синтезирован лигандным обменом тетрафторборатааминофосфина с циклоктадиенацетилацетонатом родия. Согласно результатам, описанным в данном патенте, селективность процесса не превышает 63% при конверсии 2-винил-5-норборнена 85%, т.е. максимальный выход 2-винилнорборнана 54%.

Недостаток приведенного способа заключается в том, что реакция протекает не селективно.
В патенте [DD106343 Verfahren zur Herstelhmg von 2-Vinylbicyclo-[2.2.1]-heptan, С07C 13/40 / Kohlman M., Esser G., Hauthal H., Pritzkow W., заявитель - №DDR 166880, заявл. 16.11.72, опубл. 12.06.1974] описан способ гидрирования 2-винил-5-норборнена в присутствии палладиевого катализатора (0,5% Pd на γ-Аl2O3 с добавкой 15% СаО). Гидрирование проводили при парциальном давлении водорода до 10 атм и температуре 25°С, с использованием в качестве растворителя метанола, в присутствии отравляющих добавок газообразного СО или пиридина. Максимальный выход целевого продукта получен в присутствии СО и составляет 87%. Конверсия 2-винил-5-норборнена - 91% при селективности 95,5%.
В патенте [JP 07109232 Preparation of norbornane derivatives by selective hydrogenation of norbornene derivatives, C07С - 13/40 / Hayashi Sh., Ito H., заявитель и патентообладатель Shin Nippon Rika Kk (Japan) №JP1993-277896, заявл. 07.10.1993, опубл. 25.04.1995] предложен способ гидрирования 2-винил-5-норборнена в растворе циклогексана или метанола в присутствии палладия, нанесенного на сульфат бария. При 80°С и давлении водорода 2 атм, за 6 часов достигается 100%-я конверсия при селективности по 2-винилнорборнану 92%, т.е. выход 2-винилнорборнана 92%. Это лучший показатель из всех результатов научной и патентной литературы. При использовании в качестве растворителя, метанола также достигается 100%-я конверсия, но селективность образования 2-винилнорборнана не превышает 40%.
Этот способ по совокупности существенных признаков и достигаемому результату является наиболее близким к заявленному и принят как наиболее близкий аналог (прототип).
Общим недостатком всех описанных технических решений получения 2-винилнорборнана гидрированием 2-винил-5-норборнена является использование металлов платиновой группы. Кроме того, как в случае гомогенного, так и гетерогенного катализа процесс ведут под давлением водорода, что требует использования специального оборудования, при этом выход целевого 2-винилнорборнана недостаточен. Следует также отметить, что во всех технических решениях, посвященных синтезу 2-винилнорборнана гидрированием 2-винил-5-норборнена, наряду с целевым продуктом образуется побочный продукт исчерпывающего гидрирования - 2-этилнорборнан. Максимальный выход целевого продукта будет при максимальной конверсии и селективности.
Задача настоящего изобретения заключается в разработке экономичного и препаративно удобного способа получения 2-винилнорборнана с высокими конверсией и селективностью и, следовательно, с высоким выходом целевого продукта. Процесс осуществляют без дорогостоящих соединений, при комнатной температуре и атмосферном давлении без использования специального оборудования.
Поставленная задача решается тем, что предложен способ получения 2-винилнорборнана, включающий гидрирование 2-винил-5-норборнена в растворе спирта в присутствии окислителя и катализатора, согласно которому гидрирование ведут гидразингидратом, в качестве катализатора используют сульфат меди или ноль-валентную медь в количестве 2-5% масс. на гидразингидрат.
В качестве окислителя могут использовать кислород воздуха или чистый кислород при температуре 20-25°С.
В качестве спирта используют метанол или этанол.
Процесс предпочтительно ведут в гетерофазных условиях в метаноле при мольном соотношении 2-винил-5-норборнен : гидразингидрат : метанол = 1:2:1,5. При таком соотношении компонентов условия будут гетерофазными.
Предлагаемый способ реализуется с помощью реакции, представленной на схеме 12.

Гидразингидрат окисляется до диимида, который селективно восстанавливает эндоциклическую двойную связь в 2-винил-5-норборнене (схема 13). Введение в реакционную смесь соединений меди (сульфат меди, ноль-валентная медь) ускоряет окисление гидразингидрата и способствует более эффективному гидрированию 2-винил-5-норборнена.

Нижеследующие примеры иллюстрируют предлагаемое изобретение.
Материалы, подготовка реагентов и растворителей
Все используемые в работе растворители, а также сульфат меди(II) были закуплены в компании «Компонент-Реактив» и использовались без предварительной очистки. 2-Винил-5-норборнен и гидразингидрат были закуплены в «Acros Organics» и использовались без дополнительной очистки.
Методы исследований
ЯМР спектры регистрировали на ЯМР-спектрометрах Varian Inova 500, Bruker Avance DRX 400 и на BrukerMSL-300. Для1Н-ЯМР-спектров частота регистрации 499.8 МГц, 400.1 МГц и 300 МГц соответственно. Сигналы в спектрах1Н относили по остаточным протонам CDCl3 (7.24 м.д.).
Хромато-масс-спектрометрический анализ проводили на газовом хромато-масс-спектрометре Finnigan МАТ 95 XL (энергия ионизации 70 эВ, диапазон масс 20-800 а.е.м., разрешение 1000, температура источника 200°С, скорость сканирования 1 с/декада масс) и хроматографе HP 6890+ с капиллярной колонкой 30 м×0.25 мм с фазой DB-5 (полидиметилсилоксан, содержащий 5% фенильных групп), газ-носитель - гелий (деление потока 1:30).
Газохроматографический анализ проводили на газовом хроматографе Кристалл 5000 с капиллярной колонкой SGE Analytical Science и пламенно-ионизационным детектором (ГТИД). Длина колонки 25 м×0.32 мм, фаза - НТЕ8 (полисилоксанкарборан, содержащий 8% фенильных групп), газ-носитель - азот. Параметры ПИД: температура на детекторе - 200°С, расход водорода - 25 мл/мин, расход воздуха - 250 мл/мин, расход азота - 25 мл/мин. Параметры колонки: температура термостатирования колонки - 40°С, давление газа-носителя - 71.519 кПа, поток газа-носителя - 2.5 мл/мин, скорость газа-носителя - 39.7 см/с, сбросной расход 30 мл/мин. Температура на испарителе - 250°С.
ИК спектры регистрировали на спектрометре IFSG6V/S в тонком слое.
Нижеследующие примеры иллюстрируют изобретение, но никоим образом не ограничивают его.
А. Гидрирование 2-винил-5-норборнена гидразингидратом с воздушной подушкой
Пример 1
В одногорловую круглодонную колбу с керном помещают 9,6 г (0,08 моль) 2-винил-5-норборнена, 58 мл этилового спирта, 4,4 г (0,088 моль, 1.1 эквивалент) гидразингидрата. Реакцию проводят при перемешивании с открытым керном.
Полученный 2-винилнорборнан в чистом виде выделяли следующим образом. Реакционную массу нейтрализовали водным раствором соляной кислоты (2,5%). Затем отделяли водно-спиртовой слой, который экстрагировали гексаном (3 порции по 25 мл). Гексан отгоняли, а остаток подвергали ректификации при атмосферном давлении, отбирая фракцию с температурой кипения 146-148°С, чистоту контролировали с помощью капиллярной ГЖХ.
Строение 2-винилнорборнана было подтверждено с помощью ЯМР, ИК-спектроскопии и хромато-масс-спектрометрии.
1Н ЯМР спектр. В спектре1Н ЯМР 2-винилнорборнана содержатся винильные группы двойная связь в области 4.7-5.9 м.д. с соотношением интегралов олефиновых протонов 1:2, а также сигналы протонов норборнанового фрагмента в области 0,5-2,5 м.д. с суммарным интегралом 11Н. В спектре отсутствуют сигналы от протонов норборненовой двойной связи (область 6.0-6.2 м.д.), что свидетельствует об отсутствии исходного 2-винил-5-норборнена.
Масс-спектр. Молекулярный ион М+ 124(5), 109(5), 96(27), 95(78), 82(42), 67(100), 55(22), 41(50), 27(15). Спектр совпадает со спектром базы данных Американского бюро стандартов.
ИК-спектр. В ИК-спектре 2-винилнорборнана присутствуют валентные колебания двойной связи винильной группы 1640 см-1 и отсутствуют валентные колебания двойной связи в цикле район 1652-1662 см-1, также присутствуют симметричные и антисимметричные валентные колебания С-Н (2850 и 2925 см-1).
Так, реакция протекает медленно, конверсия 2-винил-5-норборнена через 30 часов 7% при селективности 100%.
Пример 2
Способ осуществляют по примеру 1, отличием которого является увеличение количества гидразингидрата в два раза: до 8,8 г (0,175 моль, 2.2 эквивалента).
Скорость реакции увеличивается, конверсия 2-винил-5-норборнена через 30 часов 16%. Селективность 100%.
Пример 3
Способ осуществляют по примеру 1, отличием которого является увеличение количества гидразингидрата в три раза: до 13,2 г (0,26 моль, 3.3 эквивалента).
Скорость реакции увеличивается, конверсия 2-винил-5-норборнена через 30 часов 29%. Селективность 100%.
Гидрирование 2-винил-5-норборнена гидразингидратом с кислородной подушкой
Пример 4
Способ осуществляют по примеру 1, в котором над реакционной массой создают кислородную подушку, а не воздушную (используют 1 эквивалент гидразингидрата).
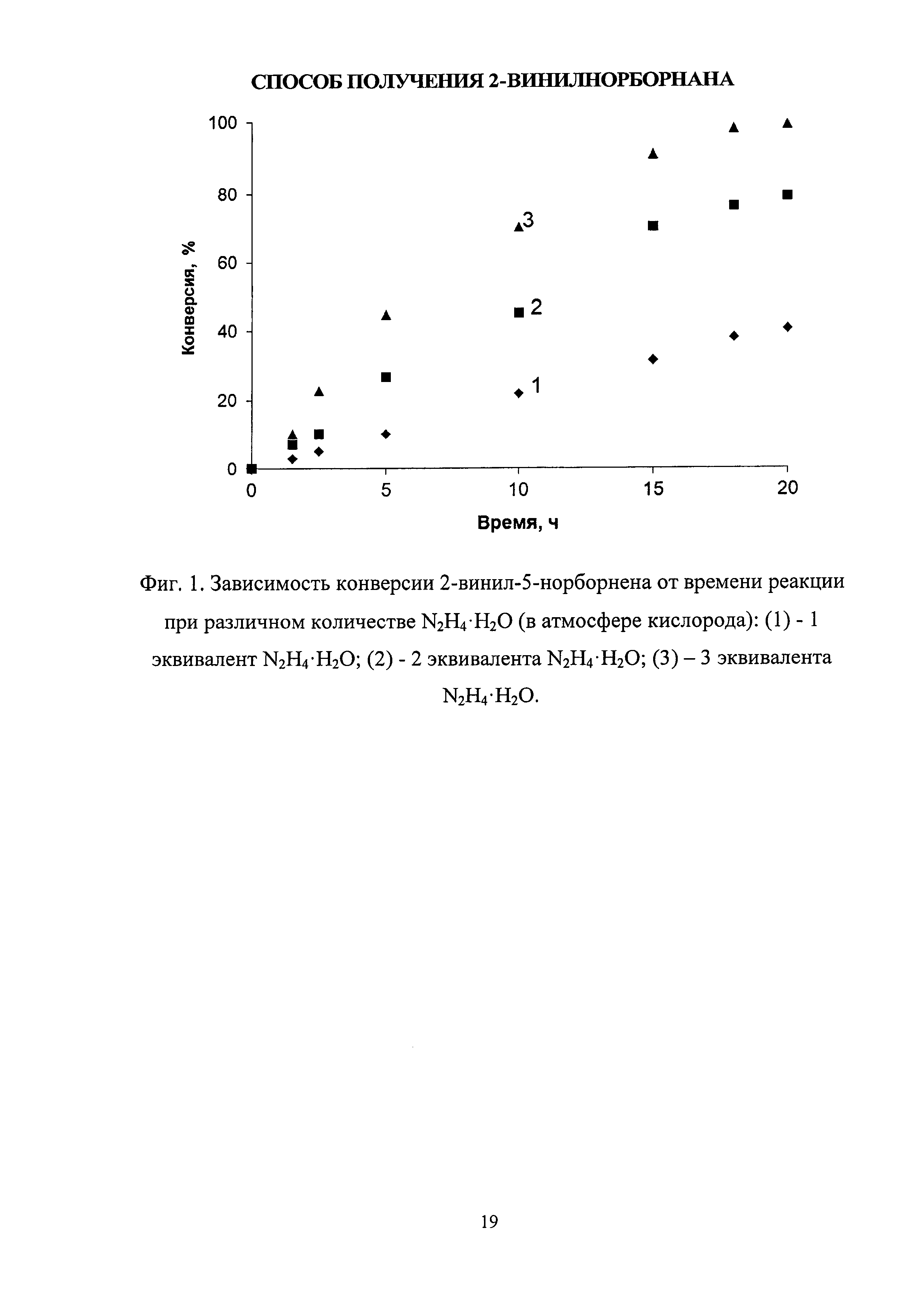
Конверсия 2-винил-5-норборнена через 20 часов 40%. Селективность 100%.
Пример 5
Способ осуществляют по примеру 2, в котором над реакционной массой создают кислородную подушку, а не воздушную (используют 2 эквивалента гидразингидрата).
Конверсия 2-винил-5-норборнена через 20 часов 75%. Селективность 96%.
Пример 6
Способ осуществляют по примеру 3, в котором над реакционной массой создают кислородную подушку, а не воздушную (используют 3 эквивалента гидразингидрата).
Конверсия 2-винил-5-норборнена через 20 часов 100%. Селективность 90%.
Зависимость конверсии 2-винил-5-норборнена от времени реакции при различном количестве гидразингидрата по примерам 4-6 представлена на фиг. 1.
Б. Гидрирование 2-винил-5-норборнена гидразингидратом при барботировании кислородом в этиловом или метиловом спирте
Пример 7
В этаноле. В одногорлую круглодонную колбу помещают 25 мл этилового спирта, 5.0 г (0,042 моль) 2-винил-5-норборнена и 4,17 г (0,084 моль, 2 эквивалента) гидразингидрата. Реакцию проводят при перемешивании, барботируя кислород (115 мл/мин) через реакционную смесь.
Конверсия 2-винил-5-норборнена через 20 часов 100%, селективность 90%.
Зависимость конверсии 2-винил-5-норборнена от времени для данного примера приведена на фиг. 2. Скорость реакции выше, чем с кислородной подушкой (пример 5).
Пример 8
В метаноле. В одногорловую круглодонную колбу помещают 50 мл метилового спирта, 9,6 г (0,08 моль) 2-винил-5-норборнена, 8.0 г (0,16 моль, 2 эквивалента) гидразингидрата. Реакцию проводят при перемешивании, барботируя кислород через реакционную смесь.
Конверсия 2-винил-5-норборнена через 20 часов 100%, селективность 90%.
Зависимость конверсии 2-винил-5-норборнена от времени для данного примера приведена на фиг. 3.
Пример 9
Отличается от примера 8 тем, что концентрация 2-винил-5-норборнена выше (75 мл метилового спирта, 30 г (0,25 моль) 2-винил-5-норборнена и 25.0 г (0,5 моль, 2 эквивалента) гидразингидрата). В результате образуется гетерофазная система, состоящая из двух фаз.
Конверсия 2-винил-5-норборнена через 20 часов 100% (фиг. 4), селективность 90%.
Для выделения целевого продукта 2-винилнорборнана водно-спиртовую фазу отделяют от органической, которую затем нейтрализуют поликислотой фиг. 5 и перегоняют при атмосферном давлении, отбирая фракцию с температурой кипения 146-148°С. Процесс выделения целевого продукта проще, чем в примере 1.
В. Гидрирование 2-винил-5-норборнена гидразингидратом в присутствии катализатора сульфата меди и кислорода воздуха.
Пример 10
Реакцию проводили в термостатируемом трехгорловом стеклянном реакторе с магнитной мешалкой, обратным холодильником и барботером для подачи воздуха. В смесь метанола (57 мл), гидразингидрата 12 мл (12.0 г, 0,24 моль, 3 эквивалента) и 2-винил-5-норборнена 11 мл (10 г.0,083 моль) прикапывали раствор пентагидрата сульфата меди (0,21 г в 10 мл метанола) или 2% масс. на гидразингидрат. Затем при перемешивании пропускали воздух со скоростью 3,5 л/час. Следует отметить, что в отсутствии воздуха реакция не протекает. Через определенные промежутки времени отбирали пробы и анализировали методом ГЖХ.
Конверсия 2-винил-5-норборнена 100% после 6 часов реакции, что значительно быстрее, чем в отсутствие катализатора. Селективность 90%.
Как уже отмечалось выше, знание кинетики реакции гидрирования позволяет определить разницу в скоростях гидрирования циклической двойной связи и двойной связи винильной группы. Только значительное превосходство константы k1 над k2 (схема 14) позволяет проводить процесс с высокой селективностью и приведет к увеличению выхода целевого 2-винилнорборнана.

На фиг. 6 приведена зависимость изменения концентрации 2-винил-5-норборнена и продуктов реакции (2-винилнорборнана и 2-этилнорборнана) от времени для примера 10. Характер зависимостей свидетельствует о том, что гидрирование протекает в соответствии со схемой 14 как последовательная реакция первого порядка.
Полулогарифмическая зависимость изменения концентрации 2-винил-5-норборнена от времени реакции, представленная на фиг. 7, является линейной, что подтверждает первый порядок. Такие реакции описываются уравнениями 1-4.

Время достижения максимальной концентрации целевого продукта 2-винилнорборнана составляет 4 часа (фиг. 6). На основе уравнений 1-4 и фиг. 6-7 определено значение k1=0,74 ч-1. Значение второй константы k2=0,027 ч-1. Таким образом, значение k2 в 27 раз меньше, чем k1) т.е. константа скорости гидрирования 2-винил-5-норборнена в 2-винилнорборнан в 27 раз больше, чем константа скорости следующей последовательной и побочной реакций - гидрирования 2-винилнорборнана до 2-этилнорборнана. Соответственно, это позволяет проводить гидрирование 2-винил-5-норборнена гидразингидратом с высокой селективностью при 100% конверсии, получая преимущественно целевой продукт 2-винилнорборнан с небольшим содержанием побочного продукта.
Еще более высокие показатели процесса получены при более низкой концентрации гидразингидрата.
Пример 11
Условия проведения процесса отличаются от примера 10 только, тем, что вместо метанольного раствора сульфата меди используют порошок металлической меди (0,5 г, 5% масс. на гидразингидрат)
За 15 часов проведения процесса конверсия близка к 90% при селективности 94%. Таким образом, выход 2-винилнорборнана 84,6%.
Пример 12
Условия проведения процесса отличаются от примера 10 только количеством гидразингидрата (6.0 г, 0,12 моль, 1,5 эквивалента) в смеси, что в 2 раза меньше, чем в примере 10.
За 13 часов проведения процесса конверсия близка к 100% при селективности 95%.
Таким образом, предлагаемое изобретение позволяет обеспечить выход 2-винилнорборнана до 95%, что выше, чем во всех вышеперечисленных технических решениях и в том числе прототипе, более простым и экономичным способом, с использованием доступных соединений, без использования дорогостоящих соединений платиновой группы и при атмосферном давлении и температурах 20-25°С.
Реферат
Изобретение относится к способу синтеза 2-винилнорборнана, который может быть использован в различных отраслях народного хозяйства, в частности как мономер для получения сополимеров различного назначения, а также топлив, в частности ракетных и для дальней авиации. Способ получения 2-винилнорборнана включает гидрирование 2-винил-5-норборнена гидразингидратом в растворе спирта в присутствии окислителя и катализатора - сульфата меди или ноль-валентной меди, взятого в количестве 2-5% масс. на гидразингидрат. В качестве окислителей используют кислород воздуха или чистый кислород при температуре 20-25°С. В качестве спирта используют метанол или этанол. Процесс предпочтительно ведут в гетерофазных условиях в метаноле при мольном соотношении 2-винил-5-норборнен:гидразингидрат:метанол = 1:2:1,5. Технический результат - повышение селективности образования до 95% при 100% конверсии 2-винил-5-норборнена при исключении применения дорогостоящих соединений платиновой группы и возможности получения 2-винилнорборнана при атмосферном давлении и температурах 20-25°С. 3 з.п. ф-лы, 7 ил., 12 пр.

Комментарии