Катализаторы на основе переходного металла 8 группы, способ их получения и способ их применения в реакции метатезиса - RU2674471C2
Код документа: RU2674471C2
Чертежи



Описание
Катализаторы на основе переходного металла 8 группы, способ их получения и способ их применения в реакции метатезиса
ОПИСАНИЕ
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к катализаторам на основе переходного металла 8 группы, способу их получения и их применения в реакции метатезиса.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Метатезис олефинов является каталитическим процессом, предусматривающим в качестве ключевой стадии реакцию между первым олефином и первым алкилиденовым комплексом переходного металла с получением таким образом нестабильного промежуточного металлциклобутанового кольца, которое затем подвергается превращению во второй олефин и второй алкилиденовый комплекс переходного металла согласно нижеприведенному уравнению (1). Реакции этого вида являются обратимыми и конкурирующими друг с другом так, что общий результат в значительной степени зависит от их соответствующих скоростей, и, если происходит образование летучих или нерастворимых продуктов, равновесие смещается.
Реакции метатезиса широко применяются в области химических реакций, например, метатезис с замыканием кольца (RCM), кросс-метатезис (CM), метатезис с раскрытием кольца (ROM), метатезисная полимеризация с раскрытием кольца (ROMP), метатезис ациклических диенов (ADMET), самометатезис, превращение олефинов с алкинами (ениновый метатезис), полимеризация алкинов и т. д.
Типичными применениями метатезиса олефинов без ограничения являются реакционное инжекционное формование (RIM), намотка волокон, пултрузия дициклопентадиена (DCPD), которые представляют собой пример метатезисной полимеризации с раскрытием кольца. В промышленном применении полимеризации DCPD требуются латентные катализаторы, которые позволяют продлить эксплуатацию смеси мономера-катализатора до начала полимеризации. Другими примерами метатезисной полимеризации с раскрытием кольца являются ROMP норборнена и его производных, coполимеризация разных циклических олефинов. Этенолиз, химический процесс, в котором внутренние олефины разрушаются при применении этилeна в качестве реагента, является примером кросс-метатезиса, CM этена с 2-бутеном, деполимеризации ненасыщенных полимеров и т. д.
Несмотря на то, что большой интерес представляет гомосочетание (уравнение 3a), то же самое относится и к перекрестному сочетанию между двумя разными концевыми олефинами (уравнение 3b). Реакции сочетания, вовлекающие диены, дают линейные и циклические димеры, олигомеры и, прежде всего, линейные или циклические полимеры (уравнение 6). Как правило, последнюю реакцию предпочтительно осуществлять в высококонцентрированных растворах или в объеме, тогда как циклизацию предпочтительно осуществлять при низких концентрациях. Если происходит внутримолекулярное сочетание диена с получением циклического алкена, то процесс называется метатезисом с замыканием кольца (уравнение 2). Циклические олефины могут быть раскрыты и олигомеризованы или полимеризованы (метатезисная полимеризация с раскрытием кольца, показанная в уравнении 5). Если алкилиденовый катализатор быстрее реагирует с циклическим олефином (например, норборненом или циклобутеном) чем с двойной связью углерод-углерод в растущей полимерной цепи, то может происходить «живая метатезисная полимеризация с раскрытием кольца», т. e. имеет место небольшое ограничение до или после реакции полимеризации. Деформированные кольца могут быть раскрыты с применением алкилиденового катализатора со вторым алкеном согласно механизмам кросс-метатезиса. Движущей силой является облегчение деформирования кольца. Поскольку продукты содержат концевые винильные группы, может происходить множество дополнительных реакций кросс-метатезиса. Поэтому, условия реакции (время, концентрации и т. д.) должны быть оптимизированы для обеспечения желаемого продукта (уравнение 4). Ениновый метатезис представляет собой катализируемую металлкарбеном реакцию перегруппировки связи между алкинами и алкенами с получением 1,3-диенов. Межмолекулярный процесс называют перекрестным ениновым метатезисом (7), тогда как внутримолекулярные реакции называют ениновым метатезисом с замыканием кольца (RCEYM).
Большое коммерческое значение имеет кросс-метатезис двух реактантных олефинов, при этом каждый реактантный олефин содержит по меньшей мере один ненасыщенный участок, для получения новых олефинов, которые отличаются от реактантных олефинов. Один или более каталитических металлов, обычно один или несколько переходных металлов, как правило, катализируют реакцию кросс-метатезиса.
Одним таким коммерчески значимым применением является кросс-метатезис этилена и внутренних олефинов с получением альфа-олефинов, который обычно называют этенолиз. Более конкретно, кросс-метатезис этилена и внутреннего олефина с получением линейных α-олефинов представляет особую коммерческую ценность. Линейные α-олефины применимы в качестве мономеров или сомономеров в некоторых (со)полимерных поли α-олефинах и/или в качестве промежуточных соединений при получении эпоксидов, аминов, оксоспиртов, синтетических смазок, синтетических жирных кислот и алкилированных ароматических соединений. Olefins Conversion Technology™, основанная на процессе «Триолефин» от Phillips (Phillips Triolefin Process), является примером реакции этенолиза с превращением этилена и 2-бутена в пропилен. В этих процессах применяют гетерогенные катализаторы на основе вольфрама и оксидов рения, которые не зарекомендовали себя как эффективные для внутренних олефинов, содержащих функциональные группы, такие как цис-метилолеат, сложный метиловый эфир жирной кислоты.
1-Децен является побочным продуктом, как правило, полученным при кросс-метатезисе этилена и метилолеата. Алкилолеаты представляют собой сложные эфиры жирной кислоты, которые могут быть главными компонентами биодизеля, полученного переэтерификацией спирта и растительных масел. Растительные масла, содержащие по меньшей мере один участок ненасыщенности, включают каноловое, соевое, пальмовое, арахисовое, горчичное, подсолнечное, тунговое, талловое, перилловое, масло виноградных косточек, рапсовое, льняное, сафлоровое, тыквенное, кукурузное и многие другие масла, экстрагированные из семян растений. Подобным образом, алкилэрукаты являются сложными эфирами жирной кислоты, которые могут быть главными компонентами в биодизеле. Применимыми биодизельными композициями являются те, которые, как правило, характеризуются высокими концентрациями олеата и сложных эфиров эруката. Такие сложные эфиры жирной кислоты предпочтительно характеризуются одним участком ненасыщенности так, что кросс-метатезис с этиленом дает 1-децен в качестве побочного продукта.
Растительные масла, используемые в приготовлении пищи (жарка мяса, овощей, и т. д.), могут быть рекуперированы, а после очищения, превращены с применением, например, этенолиза, в применимые продукты, используемые в биодизеле.
Биодизель представляет собой топливо, полученное из возобновляемых источников, таких как растительные масла или животные жиры. Для получения биодизеля триацилглицериды, основные соединения растительных масел и животных жиров, превращают в алкиловые сложные эфиры жирной кислоты (т. e., биодизель) и глицерин путем реакции со спиртом в присутствии основного, кислотного или ферментативного катализатора. Биодизельное топливо можно применять в дизельных двигателях, либо отдельно, либо в смеси с дизелем на нефтяной основе, или можно дополнительно модифицировать для получения других химических продуктов.
Известны некоторые металл-карбеновые комплексы для метатезиса олефинов, однако, различие между этими структурами может заключаться в карбеновой части. Патенты WO-A-96/04289 и WO-A-97/06185 являются примерами катализаторов метатезиса с общей структурой
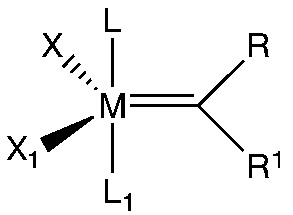
где
M представляет собой Os или Ru, R и R1представляют собой органические части из карбенового фрагмента, которые характеризуются большой структурной вариабельностью, X и X1 представляют собой анионные лиганды, а L и L1 представляют собой нейтральные доноры электронов. «Анионные лиганды» согласно литературным источникам из области катализаторов метатезиса олефинов представляют собой лиганды, которые отрицательно заряжены и, таким образом, несут полную электронную оболочку, когда отделяются от металлического центра.
Хорошо известным примером этого класса соединений являются катализаторы Граббса 1го поколения.

G1
Другим хорошо известным примером этого класса соединений является катализатор Граббса 2го поколения, который описан в WO-A-0071554, и гекса-координированный катализатор Граббса 3го поколения, который описан в WO-A03/011455.



Катализатор Граббса 2го пок. (G2) Катализатор Граббса 3го пок. (G3) Катализатор Ховейды 2го пок. (H2)
Существуют некоторые другие хорошо известные катализаторы, описанные в литературных источниках, которые особенно применимы в области метатезиса олефинов и которые служат общей информацией для такого применения.
Кроме того, известны другие катализаторы, в которых оба атома углерода карбенового фрагмента соединены мостиком, и некоторые из них представлены:


Furstner (F) Nolan (N)
Мостиковый карбеновый фрагмент был впервые синтезирован Hill et al. (K.J. Harlow, A.F. Hill, J.D.E.T. Wilton-Ety, J.Chem.Soc.DaltonTrans. 1999, 285-291), однако, структура была описана неверно. Fürstner et al. откорректировали это несоответствие (J.Org.Chem. 1999, 64, 8275-8280) и описали полную характеристику. Следовательно, происходит реорганизация, в результате чего атомы углерода карбенового фрагмента соединяются мостиком, и в этом конкретном случае образуется «3-фенил-инденилиденкарбен» (Chem. 2001, 7, No 22, 4811-4820). Аналоги такого катализатора, несущие один NHC-лиганд и один фосфиновый лиганд, были описаны Nolan в WO-A-00/15339. Такие типы соединений не только являются катализаторами метатезиса олефинов; но их также можно применять как исходный продукт при получении других рутений-карбеновых соединений путем кросс-метатезиса (WO-A-2004/112951).
Более того, в US-A-2003/0100776 на странице 8, абзац [0087], описаны катализаторы, в которых атомы углерода карбеновой части соединены мостиком, и тем самым вновь образованная циклическая группа может быть алифатической или ароматической и может нести заместители или гетероатомы. Кроме того, указывается, что образовавшаяся кольцевая структура состоит из 4-12, а предпочтительно содержит 5-8 атомов. Однако не описываются или не приводятся точные кольцевые структуры или примеры.
Для некоторых процессов желательно, чтобы инициация катализатора была контролируемой. Гораздо меньше работы было направлено на понижение скорости инициации катализаторов на основе рутения. В таких случаях применение триггерного фактора, такого как световая активация (например, фотооблучение), химическая активация (например, добавление кислоты), температурная активация (например, нагревание образца) или механическая активация (например, ультразвук), может помочь контролировать инициацию. Эффективным реакциям метатезисной полимеризации с раскрытием кольца (ROMP) требуется равномерное перемешивание мономера и катализатора, прежде чем произойдет полимеризация. Для таких применений желательны катализаторы, которые инициируют полимеризацию с высокой скоростью только после активации. Впрочем, как катализатор Граббса 2го поколения, так и Ховейды 2го поколения отвечают требованиям катализаторов метатезиса при комнатной температуре или ниже, поэтому сами по себе не подходят для применений, где целесообразна латентность катализатора (Org. Lett. 1999, 1, 953−956; J. Am. Chem. Soc. 2000, 122, 8168−8179; Tetrahedron Lett. 2000, 41, 9973−9976).
Экспериментальные исследования показали, что, в случае большинства рутениевых катализаторов, диссоциация донорного лиганда обеспечивает начало катализаторного цикла. Можно выработать несколько стратегий для замедления диссоциации лиганда. Важный аспект заключается в том, что способ, применяемый для замедления инициации, не должен нарушать активность катализатора. Добавление избытка фосфина в реакцию может способствовать замедлению инициации, как показано в случае I (схема 1)(J.Am.Chem.Soc. 1997, 119, 3887−3897). К сожалению, добавление фосфина обычно приводит еще и к понижению скоростей распространения.
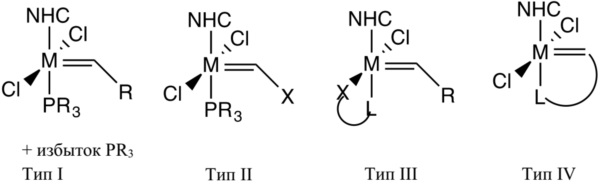
Схема 1: стратегии контроля инициации катализатора
Другая стратегия для замедления инициации катализатора заключается в том, чтобы заменить рутениевый карбен Шрок-типа на карбен Фишера (II тип, схема 1). Такой подход применяли для создания нескольких латентных катализаторов метатезиса с помощью карбенов Фишера, показывающих замещение кислорода, серы и азота (Organometallics 2002, 21, 2153−2164.;J. Organomet. Chem. 2000, 606, 65−74). В некоторых случаях понижение активности с помощью таких систем является настолько большим, что их считают метатезис-неактивными. Фактически, добавление этилвинилового эфира с образованием карбенового комплекса Фишера является стандартным способом гашения реакций ROMP.
Van der Schaaf с сотрудниками следовали другому подходу (IV тип, схема 1) для разработки термически активируемого, медленно инициирующего катализатора метатезиса олефинов (PR3)(CI)2Ru(CH(CH2)2-C,N-2-C5H4N) (1 на схеме 2), согласно которому температуры инициации регулировали путем изменения схемы замещения пиридинового кольца (J. Organomet. Chem. 2000, 606, 65-74). К сожалению, активности известных комплексов были неприемлемо низкими; ограничены 12000 эквив. DCPD. Позже Ung сообщил об аналогичных настраиваемых каталитических системах, полученных путем частичной изомеризации транс-(SIMes)(CI)2Ru(CH(CH2)2-C,N-2-C5H4N) (2 на схеме 2) в цис-аналог (Organometallics 2004, 23, 5399-5401). Однако ни один из таких катализаторов не мог храниться в мономере DCPD в течение длительного времени, поскольку ROMP DCPD завершается на 25 минуте после введения катализатора.

Схема 2: примеры систем IV типа для контроля инициации
В другой методике в отношении рационально разрабатываемого термостабильного катализатора метатезиса олефинов для полимеризации DCPD усилия были направлены на разработку окруженных лигандами O,N-бидентатного Шиффового основания Ru-карбеновых катализаторов, проработанных Grubbs (патент США № 5977393; схема 3, 4, где L = PR3) и Verpoort (WO 03/062253; схема 3, 4, где L=SIMes, и 5, где L = PR3, SIMes). Было показано, что такие комплексы крайне неактивны при комнатной температуре для полимеризации незначительно деформированных циклических олефинов, поэтому их можно хранить в DCPD в течение месяцев и можно термоактивировать с получением повышенной активности для полимеризации DCPD в объеме, но с промышленной точки зрения катализаторы, характеристики которых легко перестраиваются путем простой прямой модификации, не описаны (EP1468004; J.Mol.Cat.A: Chem. 2006, 260, 221-226).

Схема 3: примеры систем III типа для контроля инициации
Недавно синтезировали серию латентных катализаторов метатезиса олефинов, несущих бидентатные K2-(O,O) лиганды (схема 3, 3). Комплекс 3 оказался неактивным для полимеризации DCPD без растворителя. Более того, было показано, что комплекс 3 (схема 3, L = PCy3, SIMes) легко активируется при облучении смеси катализатора/мономера, содержащей фотокислотный генератор, и было обнаружено, что он применим в ROMP DCPD (WO 99/22865). Хотя облучение раствора DCPD и 3 (L=SlMes) в минимальном количестве CH2CI2 привело к полной желатинизации в течение 1 ч., но отвердевший и сшитый мономер не получили.
Это указывает на низкую активность катализатора и операцию на небольшом количестве активных видов соединений. Подводя итоги, латентные катализаторы имеют большое значение для процессов метатезисной полимеризации с раскрытием кольца незначительно деформированных циклических олефинов, поскольку они позволяют смешивать мономер и катализатор без сопутствующей желатинизации или микрокапсулирования предварительного катализатора.
Все вышеописанные катализаторы, несущие инденилиденовую часть карбена, основаны на нехелатирующей фенил-инденилиденовой структуре без каких-либо заместителей или функциональных групп. Катализаторы с хелатирующей фенил-инденилиденовой структурой были описаны в PCT/US2010/059703 (WO 2011/100022 A2), при этом описывали катализатор на основе инденилидена, в соответствии с чем один фосфиновый лиганд замещается нейтральным донорным лигандом, который связан с инденилиденкарбеном. Полученный в результате катализатор представляет собой 3-фенилинденилиденовый аналог катализатора Ховейды.
В PCT/US2011/029690 (WO 2011/119778 A2) заявляется гекса-координированный катализатор, однако в данном документе катализаторы не выделяли; раскрывается способ синтеза для образования in-situ катализаторов метатезиса олефинов, поскольку согласно Schrödi синтез таких комплексов является сравнительно проблематичным. Синтез, как правило, предусматривает более чем одну стадию и требует выделения катализаторов для удаления ингибирующих катализатор побочных продуктов, таких как выделившиеся фосфины. Все полученные in-situ образовавшиеся катализаторы являются фенилинденилиденовыми аналогами катализатора Ховейды.
Другие нехелатирующие инденилиденовые катализаторы, несущие функциональные группы или заместители на инденилиденовой части и отличные от фенилинденилидена, до настоящего времени неизвестны.

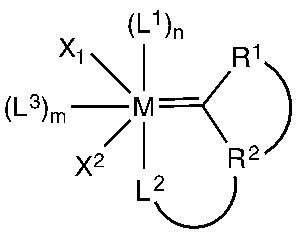
WO 2011/100022 A2 WO 2011/119778 A2
В WO 2011/009721 A1 катализаторы, содержащие бис-Шиффово основание, описаны на странице 18-20 «посредством способа B», начиная с 5 с L = SIMes, где сказано, что реакционную смесь исследовали с помощью1H и31P ЯМР, раскрывающего количественное превращение в необходимый катализатор, содержащий бис-Шиффово основание. Однако, ни одно из тех соединений вообще не содержит P-лиганда. Более того, катализаторы, полученные посредством «способа A», исследовали с помощью1H и31P ЯМР, раскрывающего количественное превращение в необходимый катализатор, содержащий бис-Шиффово основание, однако, значения не приводятся.
Кроме того, сказано, что катализатор, содержащий бис-Шиффово основание (катализатор 4 на странице 22), имеет чрезвычайно латентный характер даже при 200°C (соотношение катализатор 4/DCPD: 1/15000), что было доказано с помощью DSC. Однако, хорошо известно, что DCPD при нагревании выше 150°С подвергается ретро-реакции Дильса-Альдера с выходом циклопентадиена и температурой кипения 170°С.
Кроме того, в «кратком описании изобретения» на странице 4 говорится, что катализаторы получают с помощью простого, эффективного, экологически безопасного процесса синтеза с высоким выходом. Однако, процедуру синтеза катализаторов, которая длится 72 ч. (без этапов очищения), нельзя назвать «эффективной» или промышленно перспективной. Помимо всего, не приведен выход синтезированных катализаторов.
Часть рутениевого карбена (инденилидена) в WO 2011/009721 A1 определяется как в WO 00/15339. Наиболее предпочтительной карбеновой частью является фенилинденилиденовый лиганд. Несмотря на это, замещенные фенилинденилиденовые лиганды не заявляются.
Несмотря на успехи, достигнутые в получении и разработке катализаторов метатезиса олефинов, сохраняется потребность в новых улучшенных способах синтеза и в новых катализаторах. Особенный интерес представляют способы, которые обеспечивают получение новых катализаторов, которые можно легко получать в промышленном масштабе.
Несмотря на различные доступные катализаторы, с промышленной точки зрения крайне желательными катализаторами являются те, у которых характеристики легко перестраиваемые путем простой прямой модификации. Особый интерес представляют катализаторы, которые можно модифицировать от совершенно латентных до высокоактивных; латентные катализаторы легко нашли применение в ROMP, например, полимеризации DCPD посредством RIM, при этом высокоактивные катализаторы легко нашли применение в кросс-метатезисе, например, этенолизе.
Более того, легко перестраиваемые катализаторы можно получать с помощью перестройки электронной плотности катализатора путем изменения алкилидена (например, инденилидена) в комбинации с лигандами (например, дитопными или мультитопными лигандами). Однако, комбинация нехелатирующего замещенного/функционализированного инденилидена с дитопными или мультитопными лигандами до сих пор не существует и имеет дополнительное преимущество с точки зрения инициации перестраиваемости, что приводит к катализаторам, которые могут изменяться от абсолютно латентных до высокоактивных.
Кроме того, катализаторы по настоящему изобретению могут являться латентными катализаторами, стабильными в мономере и высокоактивными после промышленно приемлемого процесса активации, на свойство которого все еще есть высокий спрос.
Кроме того, катализирующие метатезис соединения в соответствии с настоящим изобретением обеспечивают как мягкий и коммерчески экономичный, так и «атом-экономичный» путь для требуемых олефинов, которые в свою очередь можно применять для получения линейных альфа-олефинов, ненасыщенных полимеров, циклических олефинов и т. д.
Другой важный параметр для оценки катализаторов метатезиса заключается в том, что катализаторы должны легко отделяться от конечного продукта метатезиса. Для применений реакций метатезиса в фармацевтической промышленности уровень рутения в лекарственных средствах не должен превышать 5 ppm. (http://www.emea.europa.eu/pdfs/human/swp/444600en.pdf for EMEA regulations) До сегодняшнего дня в разных протоколах сообщалось об удалении рутения из продуктов метатезиса, чтобы отвечать этим критериям. Используемые протоколы включают удаление рутения с помощью реакций окисления (H2O2, PPh3O, DMSO или Pb(OAc)4, экстракции водой, акцепторов, осажденных на подложку фосфиновых лигандов или с помощью обработки активированным углем в комбинации с хроматографией. Такие протоколы лишь уменьшали концентрацию рутения в конечном продукте до 100-1200 ppm, что далеко от необходимых критериев для фармацевтических применений. Иммобилизация катализаторов (на органической или неорганической подложке) дала многообещающие результаты с умеренным успехом в отношении эффективного удаления рутения. В качестве другой стратегии также сообщалось о модификации лигандов более полярными группами или смене их стерических препятствий для упрощения отделения от продуктов метатезиса. Grela успешно модифицировал катализаторы по типу Ховейды-Граббса с ионно-меченными лигандами, которые проявляют хорошее сродство в отношении силикагеля (Green Chem., 2012, 14, 3264). Однако, синтез ионно-меченного лиганда является проблематичным. Катализаторы по настоящему изобретению, полученные посредством процедуры прямого синтеза, показали чрезвычайно высокое сродство в отношении кремнезема, особенно катализаторы, несущие мультитопные лиганды, делающие их чрезвычайно применимыми и перспективными для фармацевтических и тонких химических применений.
Синтез RuCl2(PCy3)2(3-фенилинденилидена) оказался применимым в обеспечении легкого пути получения рутений-алкилиденов, который позволяет избежать затратных получений диазосоединений (Platinum Metals Rev. 2005, 49, 33).
Чтобы достигнуть экономически эффективного способа получения линейных α-олефинов ( например, 1-децена) посредством кросс-метатезиса этилена и биодизельного топлива (такого как масла животного или растительного происхождения), должны быть разработаны катализаторы с большей активностью или более стабильные катализаторы. Более того, сохраняется потребность в разработке катализаторов с эквивалентными или более высокими эксплуатационными характеристиками, но синтезируемых непосредственно из менее дорогих и легкодоступных исходных материалов.
Поскольку в данной области техники существует постоянная потребность в улучшении эффективности катализаторов, т. е. в улучшении выхода реакции, катализируемой указанным каталитическим компонентом, то по истечении определенного периода времени при заданных условиях (например, температуре, давлении, растворителе и соотношении реагент/катализатор) или иначе, при заданном выходе реакции обеспечиваются более мягкие условия (более низкая температура, давление, близкое к атмосферному, более легкое отделение продукта от реакционной смеси и его очищение) или требуется меньшее количество катализатора (т. е. более высокое соотношение реагент/катализатор), и это, таким образом, приводит в результате к более экономичным и экологически безопасным условиям эксплуатации. Такая потребность еще более жесткая для применения в процессах реакционного инжекционного формования (RIM), таких как без ограничения полимеризация в объеме эндо- или экзодициклопентадиена или их составов.
В данной области техники существует также конкретная потребность, которая является еще одной целью настоящего изобретения, заключающаяся в улучшении процессов реакционного инжекционного формования (RIM), процессов литьевого прессования полимера (RTM) и процессов реакционно-центробежного формования (RRM), таких как без ограничения полимеризация в объеме эндо- или экзодициклопентадиена или их coполимеризация с другими мономерами, или их составов. Более конкретно, существует необходимость улучшить такие процессы, которые выполняются в присутствии мультикоординированных комплексов переходных металлов, в частности, комплексов рутения. Все вышеуказанные потребности составляют различные цели, которые должны быть достигнуты с помощью настоящего изобретения; тем не менее, другие преимущества настоящего изобретения будут абсолютно понятны из последующего описания.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение направлено на решение одной или более из вышеупомянутых проблем. Настоящее изобретение основано на неожиданном открытии того, что улучшенный метатезис ненасыщенных соединений, таких как олефины и алкины, можно получить с помощью катализаторов, характеризующихся общей структурой формулы (I-II) и (VII), путем модификации алкилиденовой части катализаторов на основе металлов 8 группы из уровня техники в комбинации с дитопным(дитопными) или мультитопным(мультитопными) лигандом(лигандами).
В настоящем изобретении предусматриваются катализаторы, которые можно легко и эффективно активировать с помощью химического активатора (кислота Брэнстеда и кислота Льюиса) или фотоактиватора (фотокислотный генератор, PAG), при этом показывающие исключительную активность после активации. Катализаторы по настоящему изобретению также можно активировать с помощью образования in-situ кислоты Брэнстеда за счет объединения кислоты Льюиса, которая по меньшей мере содержит один атом галогена, с любой содержащей -OH или –SH молекулой(молекулами) (жидкое или твердое вещество, органическое вещество или неорганическое).
В предпочтительном варианте осуществления настоящего изобретения ненасыщенные карбоновые кислоты и/или сложные эфиры ненасыщенных карбоновых кислот по отдельности, и/или смеси ненасыщенных карбоновых кислот, или смеси сложных эфиров ненасыщенных карбоновых кислот можно превращать. Катализаторы по настоящему изобретению предпочтительно применяют в концентрациях, меньших или равных 1000 ppm, в частности, в диапазоне от 1 до 1000 ppm, предпочтительно от 5 до 200 ppm. Способ по настоящему изобретению можно проводить при температурах от 0 до 100°C, предпочтительно от 20 до 90°C; в частности, его реализуют при температурах от 40 до 80°C.
Способ можно выполнять с применением общепринятых растворителей, в которых растворяются реагент(реагенты) и катализатор, например, углеводороды или спирты. В предпочтительном варианте осуществления настоящего изобретения способ можно проводить без растворителя.
Посредством способа по настоящему изобретению получали ненасыщенные α,ω дикарбоновые кислоты и ненасыщенные α,ω сложные диэфиры дикарбоновых кислот совместно с соответствующими ненасыщенными углеводородами. Разделение смеси можно выполнить, например, путем дистилляции, фракционированной кристаллизации или путем экстракции. Такие продукты, полученные с помощью способа по настоящему изобретению, ненасыщенные α,ω дикарбоновые кислоты и сложные диэфиры ненасыщенных α,ω дикарбоновых кислот, можно применять, например, в косметических препаратах. В случае необходимости продукты, полученные таким образом, можно подвергнуть гидрированию.
Настоящее изобретение также основано на неожиданном открытии того, что время синтеза металлорганических соединений формулы (I-II) и (VII) можно уменьшить до 4 часов или менее при сохранении высоких выходов.
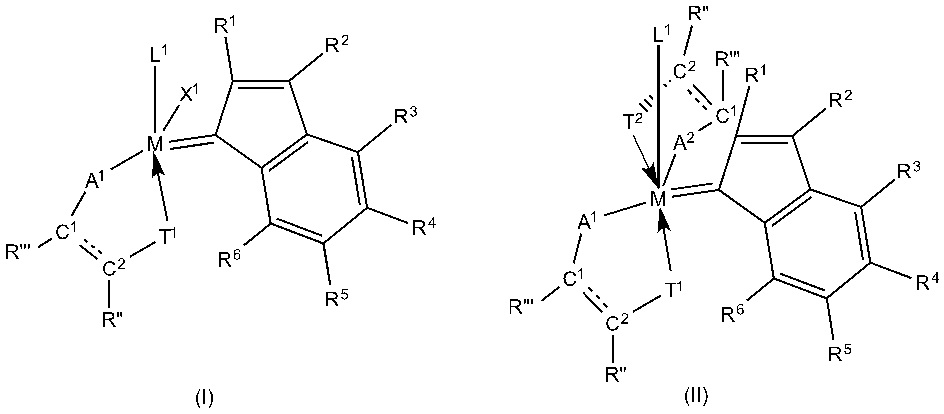
Металлорганические каталитические соединения по настоящему изобретению можно приготовить путем приведения в контакт содержащего металл 8 группы соединения-предшественника с по меньшей мере одним дитопным лигандом, который, в качестве альтернативы, может нести по меньшей мере дополнительный хелатирующий фрагмент,
где
M представляет собой металл 8 группы, предпочтительно рутений или осмий,
R1-R6 являются идентичными или различными и выбраны из Н, гидрокарбила, замещенного гидрокарбила, содержащего гетероатом гидрокарбила, замещенного содержащего гетероатом гидрокарбила и функциональных групп, за исключением того, что R2 не представляет собой фенил, если R1 = R3 = R4 = R5 = R6 = H;
где, в качестве альтернативы, в каждом случае два непосредственно смежных радикала из группы R1-R6, в том числе атомы углерода кольца, к которым они присоединены посредством образующей мостик циклической группы, образуют одну или более циклических структур, в том числе ароматических структур;
X1 предпочтительно представляет собой анионный лиганд;
L1 предпочтительно представляет собой нейтральный донор электронов;
L1 и X1 могут быть соединены с образованием мультидентатной моноанионной группы и могут образовывать единое кольцо, содержащее не более 30 отличных от водорода атомов, или многоядерную кольцевую систему, содержащую не более 30 отличных от водорода атомов;
A1–A2являются идентичными или различными и выбраны из группы, включающей кислород, серу, селен, NR’’’’, PR’’’’, POR’’’’, AsR’’’’, AsOR’’’’, SbOR’’’’ и SbR’’’’.
T1–T2 являются идентичными или различными и выбранны из группы, включающей:


где E предпочтительно представляет собой донорный атом, выбранный из группы, включающей азот, фосфор, кислород, серу и селен; при этом для группы


R, R’, R’’, R’’’ и R’’’’ являются идентичными или различными и выбраны из H, гидрокарбила, замещенного гидрокарбила, содержащего гетероатом гидрокарбила, замещенного содержащего гетероатом гидрокарбила и функциональных групп;
где, в качестве альтернативы, в каждом случае два непосредственно смежных радикала из группы R, R’, R’’, R”’ и R’’’’, в том числе атомы углерода, к которым они присоединены, образуют одну или более циклических структур, в том числе ароматических структур;
C1–C2представляют собой атомы углерода, соединены друг с другом посредством одинарной или двойной связи, где в случае одинарной связи каждый атом углерода несет дополнительный заместитель из RC1 и RC2; RC1 и RC2 являются идентичными или различными и такими, как определено для R’, R’’, R’’’ и R’’’’.
В следующем аспекте в настоящем изобретении предусматривают способ осуществления каталитической реакции метатезиса, включающий контакт по меньшей мере одного олефина или олефинового соединения с катализатором метатезиса в соответствии с настоящим изобретением. Олефин включает отдельный олефин, мультиолефин, а также комбинацию или смесь двух или более олефинов; ссылка на «заместитель» охватывает отдельный заместитель, а также два или более заместителей и т. д.
В дополнительном аспекте настоящее изобретение основано на неожиданном открытии того, что лучшие катализаторы (I-II, VII) применимы в метатезисе ненасыщенных соединений, таких как олефины и алкины, при этом их активность можно еще дополнительно повысить путем введения в контакт комплекса металлов (I-II, VII) с активирующим соединением (в данном документе также называемым «активатор»), выбранным из кислот Брэнстеда (кислоты Брэнстеда представляют собой доноры протонов, применение которых является общепринятой практикой среди химиков). По своей природе кислота Брэнстеда может быть жидкой, твердой, неорганической или органической. Хорошо известными типичными соединениями кислот Брэнстеда без ограничения являются HCl, HBr, H2SO4, CH3COOH, сульфокислотные смолы и т. д.
В дополнительном аспекте настоящее изобретение основано на неожиданном открытии того, что лучшие катализаторы, применимые в метатезисе ненасыщенных соединений, таких как олефины и алкины, можно получить путем введения в контакт комплекса металлов (I-II, VII) с активирующим соединением (в данном документе также называемым «активатор»), выбранным из группы, включающей:
- Ma(I) галогенидов,
- соединений, представленных формулой MaX2-yRay(0≤y≤2),
где
Ra сравним с R1-R6, определенными в данном документе выше,
X представляет собой атом из группы галогенов и в случае, если присутствует больше одного атома галогена, то они являются идентичными или различными, и
Ma представляет собой атом с атомной массой от 27 до 124, и выбран из группы, включающей IB, IIB, IIIA, IVB, IVA и VA группы периодической таблицы элементов, при таких условиях, чтобы происходило по меньшей мере частичное расщепление связи между металлом и дитопным или мультитопным лигандом указанного катализатора.
- Соединения, представленные формулой MaX3-yRay(0≤y≤3), где Ra, X и Ma определены в данном документе выше.
- Соединения, представленные формулой MaX4-yRay(0≤y≤4), где Ra, X и Ma определены в данном документе выше.
- Соединения, представленные формулой MaX5-yRay(0≤y≤5), где Ra, X и Ma определены в данном документе выше.
- Соединения, представленные формулой MaX6-yRay(0≤y≤6), где Ra, X и Ma определены в данном документе выше.
В еще одном особом варианте осуществления настоящее изобретение основано на неожиданном открытии того, что применимые каталитические виды соединений могут быть соответствующим образом получены путем приведения в реакцию активатора, такого как определено в данном документе выше, при условии, что указанный активатор включает по меньшей мере один атом галогена, в присутствии по меньшей мере одного дополнительного реагента, характеризующегося формулой RYH, где Y выбран из группы, включающей кислород, серу и селен, и R определен в данном документе выше. Согласно этому особому варианту осуществления сильная кислота (такая как галогеноводород) может быть образована in situ путем реакции указанного активатора с указанным дополнительным реагентом, характеризующимся формулой RYH, при этом указанная сильная кислота, если она получена в достаточном количестве, может, в свою очередь:
- на первой стадии протонировать дитопный (или мультитопный) лиганд и декоординировать T1 (в случае структуры (I)), или T1 или T2, или обоих (в случае структуры (II)) указанного дитопного (или мультитопного) лиганда из металла, участвующего в образовании комплекса, и
- на второй стадии декоординировать дополнительный гетероатом указанного дитопного (или мультитопного) лиганда из металла, участвующего в образовании комплекса.
В данном особом варианте осуществления по меньшей мере частичное расщепление связи между металлом и дитопным (или мультитопным) лигандом указанного комплекса металлов происходит, как при отсутствии дополнительного реагента, характеризующегося формулой RYH, но координирование T1 или T2, или обоих атомов дитопного (или мультитопного) лиганда к активатору происходит реже, поскольку оно неблагоприятно конкурирует с механизмом протонирования/декоординирования, возникающим в результате образования in situ сильной кислоты (такой как галогеноводород). Такой альтернативный механизм, однако, вполне эффективен в катализе реакций метатезиса олефинов и алкинов, так как он обеспечивает более неупорядоченное распределение сильной кислоты в реакционной смеси, нежели если ту же самую сильную кислоту вводят непосредственно в присутствии катализатора (I-II, VII).
Новые каталитические виды соединений по настоящему изобретению можно получить одновременно, разрозненными, очищенными и приспособленными для раздельного применения в реакциях органического синтеза позже или же их можно получить in situ в ходе соответствующей химической реакции (например, метатезиса ненасыщенных органических соединений) путем введения подходящего количества активатора в реакционную смесь перед введением исходного каталитического соединения, одновременно с ним или, в качестве альтернативы, после него. Настоящее изобретение также предусматривает каталитические системы, включающие, дополнительно к указанным новым каталитическим видам соединений или продуктам реакций, носитель, подходящий в виде подложки для указанных каталитических видов соединений или продуктов реакций.
Настоящее изобретение также предусматривает способы и процессы, в которых предполагается применение таких новых каталитических видов соединений или продуктов реакций, или любой смеси таких видов соединений, или таких каталитических систем в широком диапазоне реакций органического синтеза, в том числе в метатезисе ненасыщенных соединений, таких как олефины и алкины, и, в частности, настоящее изобретение предусматривает улучшенный процесс полимеризации с раскрытием кольца деформированных циклических олефинов, таких как, но без ограничения, дициклопентадиен.
В контексте настоящего изобретения все вышеупомянутые и нижеупомянутые определения, параметры или пояснения в общих или предпочтительных диапазонах по отношению друг к другу, а также в соответствующих диапазонах и предпочтительных диапазонах можно комбинировать любым способом.
В контексте настоящего изобретения в отношении различных типов метатезисных катализаторов термин «замещенный» означает, что атом водорода или атом замещен определенной группой или атомом, и валентность указанного атома не превышается, и замещение приводит к стабильному соединению.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На фигуре 1 показан ход реакции через 1 ч. при синтезе катализатора 12.
На фигуре 2 показан ход реакции через 5 ч. при синтезе катализатора 12.
На фигуре 3 показано сравнение коммерческого катализатора N и 5A, 6A и 7A по настоящему изобретению касательно метатезиса с замыканием кольца (RCM) диэтилдиаллилмалоната (DEDAM) с применением активации.
На фигуре 4 показано сравнение катализатора F и 5A-7A при загрузке 0,1 мол.% касательно RCM DEDAM.
На фигуре 5 показано влияние количества активатора на каталитические характеристики в случае RCM DEDAM.
На фигуре 6 показана ROMP DCPD с применением катализатора 4A, 8A, 9A и 12 по настоящему изобретению.
На фигуре 7 показана ROMP DCPD с применением активации in-situ.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Терминология и определения
Если не упоминается иное, настоящее изобретение не ограничивается специфическими реагентами, заместителями, катализаторами, условиями реакции, или т. п., которые по сути могут варьировать. Также следует понимать, что терминология используется в настоящем документе исключительно с целью описания конкретных вариантов осуществления и не предназначена для ограничения.
В настоящем описании и в следующей формуле изобретения упоминается ряд терминов, которые определяются следующими значениями.
Используемый в данном документе термин «алкил» относится к линейной, разветвленной или циклической насыщенной углеводородной группе, как правило, хотя не обязательно, содержащей от 1 до приблизительно 24 атомов углерода, предпочтительно от 1 до приблизительно 12 атомов углерода, такой как метил, этил, н-пропил, изопропил, н-бутил, изобутил, трет-бутил, октил, децил и т. д., а также циклоалкильным группам, таким как циклопентил, циклогексил и т. д. Как правило, хотя опять таки не обязательно, алкильные группы в настоящем документе содержат от 1 до приблизительно 12 атомов углерода. Термин «C1-C6-алкил» означает алкильную группу из 1-6 атомов углерода и специальный термин «циклоалкил» означает циклическую алкильную группу, как правило, содержащую 3-8 атомов углерода.
Термин «замещенный алкил» относится к алкилу, замещенному одной или более группами-заместителями, а термины «содержащий гетероатом алкил» и «гетероалкил» относятся к алкилу, у которого по меньшей мере один атом углерода замещен гетероатомом. Если не указано иное, термин «алкил» включает линейный, разветвленный, циклический, незамещенный, замещенный и/или содержащий гетероатом алкил.
Используемый в данном документе термин «алкилен» относится к бифункциональной линейной, разветвленной или циклической алкильной группе, при этом «алкил» определен выше.
Используемый в данном документе термин «алкенил» относится к линейной, разветвленной или циклической углеводородной группе, содержащей от 2 до приблизительно 24 атомов углерода, содержащей по меньшей мере одну двойную связь, такой как этенил, н-пропенил, изопропенил, н-бутенил, изобутенил, октенил, деценил, тетрадеценил, гексадеценил, эйкозенил и т. д. Предпочтительные алкенильные группы по настоящему документу содержат от 2 до приблизительно 12 атомов углерода. Термин «циклоалкенил» означает циклическую алкенильную группу, предпочтительно содержащую 5-8 атомов углерода. Термин «замещенный алкенил» относится к алкенилу, замещенному одной или более группами-заместителями, а термины «содержащий гетероатом алкенил» и «гетероалкенил» относятся к алкенилу, в котором по меньшей мере один атом углерода замещен гетероатомом. Если не указано иное, термин «алкенил» включает линейный, разветвленный, циклический, незамещенный, замещенный и/или содержащий гетероатом алкенил.
Используемый в данном документе термин «алкенилен» относится к бифункциональной линейной, разветвленной или циклической алкенильной группе, при этом «алкенил» определен выше.
Используемый в данном документе термин «алкинил» относится к линейной или разветвленной углеводородной группе, содержащей от 2 до приблизительно 24 атомов углерода и содержащей по меньшей мере одну тройную связь, такой как этинил, н-пропинил и т. д. Предпочтительные алкинильные группы по настоящеу документу содержат от 2 до приблизительно 12 атомов углерода. Термин «замещенный алкинил» относится к алкинилу, замещенному одной или более группами-заместителями, а термины «содержащий гетероатом алкинил» и «гетероалкинил» относятся к алкинилу, в котором по меньшей мере один атом углерода замещен гетероатомом. Если не указано иное, термин «алкинил» включает линейный, разветвленный, незамещенный, замещенный и/или содержащий гетероатом алкинил, соответственно.
Используемый в данном документе термин «алкокси» означает алкильную группу, соединенную с помощью одинарной концевой эфирной связи; то есть «алкокси»-группа может быть представлена как -O-алкил, где «алкил» определен выше. Аналогичным образом, «алкенилокси» относится к алкенильной группе, соединенной с помощью одинарной концевой эфирной связи, а «алкинилокси» относится к алкинильной группе, соединенной с помощью одинарной концевой эфирной связи.
Используемый в данном документе термин «арил», если не указано иное, относится к ароматическому заместителю, содержащему отдельное ароматическое кольцо или несколько ароматических колец, которые конденсированы вместе, непосредственно связаны или опосредованно связаны (так, что разные ароматические кольца связаны с общей группой, такой как метиленовый или этиленовый фрагмент). Предпочтительные арильные группы содержат 5-24 атомов углерода, а особенно предпочтительные арильные группы содержат 5-14 атомов углерода. Иллюстративные арильные группы содержат одно ароматическое кольцо или два конденсированных или связанных ароматических кольца, например, фенил, нафтил, бифенил, дифениловый эфир, дифениламин, бензофенон и т. д. «Замещенный арил» относится к арильному фрагменту, замещенному одной или более группами-заместителями, а термины «содержащий гетероатом арил» и «гетероарил» относятся к арильным заместителям, у которых по меньшей мере один атом углерода замещен гетероатомом, как будет более подробно описано infra.
Используемый в данном документе термин «арилокси» относится к арильной группе, соединенной с помощью одинарной концевой эфирной связи, где «арил» определен выше. Группа «арилокси» может быть представлена как -O-арил, где «арил» определен выше. Предпочтительные арилоксигруппы содержат 5-24 атомов углерода, а особенно предпочтительные арилоксигруппы содержат 5-14 атомов углерода. Примеры арилоксигрупп включают, без ограничения, фенокси, oрто-галоген-фенокси, мета-галоген-фенокси, пара-галоген-фенокси, oрто-метокси-фенокси, мета-метокси-фенокси, пара-метокси-фенокси, 2,4-диметокси-фенокси, 3,4,5-триметокси-фенокси и т. д.
Термин «алкарил» относится к арильной группе с алкильным заместителем, а термин «аралкил» относится к алкильной группе с арильным заместителем, где «арил» и «алкил» определены выше. Предпочтительные алкарильные и аралкильные группы содержат 6-24 атомов углерода. Алкарильные группы включают без ограничения, например, пара-метилфенил, 2,4-диметилфенил, пара-циклогексилфенил, 2,7-диметилнафтил, 7-циклооктилнафтил, 3-этил-циклопента-1,4-диен и т. д. Примеры аралкильных групп включают без ограничения бензил, 2-фенил-этил, 3-фенил-пропил, 4-фенил-бутил, 5-фенил-пентил, 4-фенилциклогексил, 4-бензилциклогексил, 4-фенилциклогексилметил, 4-бензилциклогексилметил и т. д. Термины «алкарилокси» и «аралкилокси» относятся к заместителям формулы -OR, где R представляет собой алкарил или аралкил, соответственно, как уже определено.
Термин «ацил» относится к заместителям, характеризующимся формулой -(CO)-алкил, -(CO)-арил или -(CO)-аралкил, и термин «ацилокси» относится к заместителям, характеризующимся формулой -O(CO)-алкил, -O(CO)-арил или -O(CO)-аралкил, где «алкил», «арил» и «аралкил» такие, как определено выше.
Термины «циклическая» и «кольцевая» относятся к алициклическим или ароматическим группам, которые могут быть или могут не быть замещены и/или содержат гетероатом, и которые могут быть моноциклическими, бициклическиими или полициклическими. Используемый в традиционном смысле термин «алициклический» относится к алифатическому циклическому фрагменту, в противоположность ароматическому циклическому фрагменту, и может быть моноциклическим, бициклическим или полициклическим.
Используемые в традиционном смысле термины «галоген» и «галогеновый» относятся к заместителю хлору, брому, фтору или йоду.
«Гидрокарбил» относится к одновалентным гидрокарбильным радикалам, содержащим от 1 до приблизительно 30 атомов углерода, предпочтительно от 1 до приблизительно 24 атомов углерода, наиболее предпочтительно от 1 до приблизительно 12 атомов углерода, в том числе линейные, разветвленные, циклические, насыщенные и ненасыщенные части молекулы, такие как алкильные группы, алкенильные группы, арильные группы и т. д. Термин «гидрокарбилен» означает двухвалентный гидрокарбильный фрагмент, содержащий от 1 до приблизительно 30 атомов углерода, предпочтительно от 1 до приблизительно 24 атомов углерода, наиболее предпочтительно от 1 до приблизительно 12 атомов углерода, в том числе линейные, разветвленные, циклические, насыщенные и ненасыщенные части молекулы. «Замещенный гидрокарбил» относится к гидрокарбилу, замещенному одной или более группами-заместителями, а термины «содержащий гетероатом гидрокарбил»" и «гетерогидрокарбил»" относятся к гидрокарбилу, в котором по меньшей мере один атом углерода замещен гетероатомом. Подобным образом, «замещенный гидрокарбилен» относится к гидрокарбилену, замещенному одной или более группами-заместителями, а термины «содержащий гетероатом гидрокарбилен» и «гетерогидрокарбилен» относятся к гидрокарбилену, в котором по меньшей мере один атом углерода замещен гетероатомом. Если не указано иное, термины «гидрокарбил» и «гидрокарбилен» следует понимать как замещенные и/или содержащие гетероатом гидрокарбильные и гидрокарбиленовые фрагменты, соответственно.
Термин «содержащий гетероатом» как в «содержащей гетероатом гидрокарбильной группе» относится к углеводородной молекуле или к гидрокарбильному молекулярному фрагменту, в котором один или более атомов углерода замещены атомом, отличным от углерода, например, азотом, кислородом, серой, фосфором или кремнием, как правило, азотом, кислородом или серой. Подобным образом, термин «гетероалкил» относится к алкильному заместителю, который содержит гетероатом, термин «гетероциклический» относится к циклическому заместителю, который содержит гетероатом, термины «гетероарил» и «гетероароматический», соответственно, относятся к «арильным» и «ароматическим» заместителям, которые содержат гетероатом и т. д. Следует отметить, что «гетероциклические» группа или соединение могут быть или могут не быть ароматическими, а также что «гетероциклы» могут быть моноциклическими, бициклическими или полициклическими, как описано выше в отношении термина «арил». Примеры гетероалкильных групп включают алкоксиалкил, замещенный алкилсульфанилом алкил, N-алкилированный аминоалкил и т. д. Примеры гетероарильных заместителей включают пирролил, пирролидинил, пиридинил, хинолинил, индолил, пиримидинил, имидазолил, 1,2,4-триазолил, 1,2,3-триазолил, тетразолил и т. д., а примерами содержащих гетероатом алициклических групп являются пирролидино, морфолино, пиперазино, пиперидино и т. д.
«Замещенный» как в «замещенном гидрокарбиле», «замещенном алкиле», «замещенном ариле» и т. д., как указано в некоторых вышеупомянутых определениях, означает, что в гидрокарбиле, алкиле, ариле или другом фрагменте по меньшей мере один атом водорода, связанный с атомом углерода (или другим), замещен одним или более отличными от водорода заместителями. Примеры таких заместителей включают без ограничения: функциональные группы, такие как галоген, гидроксил, сульфгидрил, C1-C24алкокси, C2-C24алкенилокси, C2-C24алкинилокси, C5-C24арилокси, C6-C24аралкилокси, C6-C24алкарилокси, ацил (в том числе C2C24алкилкарбонил (-CO-алкил) и C6-C24арилкарбонил (-CO-арил)), ацилокси (-O-ацил, в том числе C2C24алкилкарбонилокси (-O-CO-алкил) и C6-C24арилкарбонилокси (-O-CO-арил)), C2C24алкоксикарбонил (-(CO)-O-алкил), C6-C24арилоксикарбонил (-(CO)-O-арил), галогенкарбонил (-CO)X, где X представляет собой галоген), C2-C24алкилкарбонато (-O-(CO)-O-алкил), C6-C24арилкарбонато (-O-(CO)-O-арил), карбокси(-COOH), карбоксилато (-COO-), карбамоил (-(CO)-NH2), моно-(C1-C24алкил)-замещенный карбамоил (-(CO)-NH(C1-C24алкил)), ди-(C1-C24алкил)-замещенный карбамоил (-(CO)N(C1-C24алкил)2), моно-(C5-C24арил)-замещенный карбамоил (-(CO)-NH-арил), ди-(C5-C24арил)-замещенный карбамоил (-(CO)-N(C5-C24арил)2), N((C1-C24алкил) (C5-C24арил))-замещенный карбамоил, тиокарбамоил (-(CS)-NH2), моно-(C1-C24алкил)-замещенный тиокарбамоил (-(CS)NH(C1-C24алкил)), ди-(C1-C24алкил)-замещенный тиокарбамоил (-(CS)-N(C1-C24алкил)2), моно-(C5-C24арил)-замещенный тиокарбамоил (-(CS)-NH-арил), ди-(C5-C24арил)-замещенный тиокарбамоил ((CS)-N(C5-C24арил)2), N-(C1-C24алкил) N-(C5-C24арил)-замещенный тиокарбамоил, карбамидо (NH-(CO)-NH2), циано (-C=N), цианато (-O-C=N), тиоцианато (-S-C=N), формил (-(CO)-H), тиоформил (-(CS)-H), амино (-NH2), моно-(C1-C24алкил)-замещенный амино, ди-(C1-C24алкил)-замещенный амино, моно-(C5-C24арил)-замещенный амино, ди-(C5-C24арил)-замещенный амино, C2-C24алкиламидо (-NH-(CO)-алкил), C6-C24ариламидо (-NH-(CO)-арил), имино (-CR=NH, где R = водород, C1-C24алкил, C5-C24арил, C6-C24алкарил, C6-C24аралкил и т. д.), C2-C20алкилимино (-CR=N(алкил), где R = водород, C1-C24алкил, C5-C24арил, C6-C24алкарил, C6-C24аралкил и т. д.), арилимино (-CR=N(арил), где R = водород, C1-C20алкил, C5-C24арил, C6-C24алкарил, C6-C24аралкил и т. д.), нитро (-NO2), нитрозо (-NO), сульфо (-SO2-OH), сульфонато (-SO2-O-), C1-C24алкилсульфанил (-S-алкил; также называемый «алкилтио»), C5-C24арилсульфанил (-S-арил; также называемый «арилтио»), C1-C24алкилсульфинил (-(SO)-алкил), C5-C24арилсульфинил (-(SO)-арил), C1-C24алкилсульфонил (-SO2-алкил), C5-C24арилсульфонил (-SO2-арил), борил (-BH2), бороно (-B(OH)2), боронато (-B(OR)2, где R представляет собой алкил или другой гидрокарбил), фосфоно (-P(O)(OH)2), фосфонато (-P(O)(O-)2), фосфинато (-P(O)(O-)), фосфор (-PO2) и фосфино (-PH2), и углеводородные фрагменты C1-C24алкил (предпочтительно C1-C12алкил, более предпочтительно C1-C6алкил), C2-C24алкенил (предпочтительно C2-C12алкенил, более предпочтительно C2-C6алкенил), C2-C24алкинил (предпочтительно C2-C12алкинил, более предпочтительно C2-C6алкинил), C5-C24арил (предпочтительно C5-C24арил), C6-C24алкарил (предпочтительно C6-C16алкарил) и C6-C24аралкил (предпочтительно C6-C16аралкил).
«Функционализированный», например, «функционализированный гидрокарбил», «функционализированный алкил», «функционализированный олефин», «функционализированный циклический олефин» и т. д., означает, что в гидрокарбиле, алкиле, олефине, циклическом олефине или в другом фрагменте по меньшей мере один атом водорода, связанный с атомом углерода (или другим), замещен одной или более функциональными группами, такими как описанные выше.
Кроме того, вышеупомянутые функциональные группы, если позволяет конкретная группа, могут быть дополнительно замещены одной или более дополнительными функциональными группами или одним или более гидрокарбильными фрагментами, такими как специально приведенные выше. Аналогичным образом, вышеупомянутые гидрокарбильные фрагменты могут быть дополнительно замещены одной или более функциональными группами или дополнительными гидрокарбильными фрагментами, такими как специально упомянутые.
Настоящее изобретение предусматривает новое семейство катализирующих метатезис соединений, применимых для различных типов реакций метатезиса олефинов и алкинов, в том числе без ограничения метатезиса с замыканием кольца (RCM), кросс-метатезиса (CM), метатезиса с раскрытием кольца (ROM), метатезисной полимеризации с раскрытием кольца (ROMP), метатезиса ациклических диенов (ADMET), самометатезиса, превращения олефинов с алкинами (енинового метатезиса), полимеризации алкинов, этиленового кроссметатезиса и т. д.

M представляет собой металл 8 группы, предпочтительно рутений или осмий,
R1-R6являются идентичными или различными и представляют собой водород, галоген, гидроксил, альдегид, кето, тиол, CF3, нитро, нитрозо, циано, тиoциано, изоцианаты, карбодиимид, карбамат, тиокарбамат, дитиокарбамат, амино, амидо, имино, аммоний, силил, сульфонат (-SO3-), -OSO3-, -PO3- или -OPO3-, ацил, ацилокси или представляют собой алкил, циклоалкил, алкенил, циклоалкенил, замещенный алкенил, гетероалкенил, содержащий гетероатом алкинил, алкенилен, алкинил, замещенный алкинил, арил, замещенный арил, гетероарил, карбоксилат, алкокси, алкенилокси, алкинилокси, арилокси, алкарил, аралкил, алкарилокси, аралкилокси, алкоксикарбонил, алкиламино-, алкилтио-, арилтио, алкилсульфонил, алкилсульфинил, диалкиламино, алкиламмоний, алкилсилил или алкоксисилил, где каждый из данных радикалов и необязательно все могут быть замещены одной или более вышеупомянутыми группами, определенными для R1-R6, и за исключением того, что R2 не представляет собой фенил, если R1 = R3 = R4 = R5 = R6 = H;
или, в качестве альтернативы, в каждом случае два непосредственно смежных радикала из группы R1-R6, в том числе атомы углерода кольца, к которым они присоединены посредством образующей мостик циклической группы, образуют одну или более циклических структур, в том числе ароматических структур.
C1-C6алкил представляет собой, но без ограничения, например, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, трет-бутил, н-пентил, 1-метилбутил, 2-метилбутил, 3-метилбутил, неопентил, 1-этилпропил и н-гексил.
C3-C8циклоалкил включает без ограничения циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил.
C6-C24арил включает ароматический радикал с 6-24 скелетными атомами углерода. Предпочтительные моно-, би- или трициклические карбоциклические ароматические радикалы содержат 6-10 скелетных атомов углерода, например, но без ограничения, фенил, бифенил, нафтил, фенантренил или антраценил.
X1 предпочтительно представляет собой анионный лиганд.
В общих формулах X1 может представлять собой, например, радикалы водорода, галогена, псевдогалогена, прямого или разветвленного C1-C30алкила, C6-C24арила, C1-C20алкокси, C6-C24арилокси, C3-C20алкилдикетоната, C6-C24арилдикетоната, C1-C20карбоксилата, C1-C20алкилсульфоната, C6-C24арилсульфоната, C1-C20алкилтиола, C6-C24арилтиола, C1-C20алкилсульфонила или C1-C20алкилсульфинила.
Вышеназванный радикал X1 также может быть замещен одним или более дополнительными остатками, например, галогеном, предпочтительно фтором, C1-C20алкилом, C1-C20алкокси или C6-C24арилом, где данные группы в свою очередь необязательно могут быть замещены одним или более заместителями из группы, включающей галоген, предпочтительно фтор, C1-C5алкил, C1-C5алкокси и фенил.
L1 и X1 могут быть соединены с образованием мультидентатной моноанионной группы и могут образовывать единое кольцо, содержащее не более 30 отличных от водорода атомов, или многоядерную кольцевую систему, содержащую не более 30 отличных от водорода атомов.
В предпочтительном варианте осуществления X1 означает галоген, в частности, фтор, хлор, бром или йод, бензоат, нитрат, C1-C5карбоксилат, C1-C5алкил, фенокси, C1-C5алкокси, C1-C5алкилтиол, C6-C24арилтиол, C6-C24арил или C1-C5алкилсульфонат.
В особенно предпочтительном варианте осуществления X1 представляет собой хлор, CF3COO, CH3COO, CFH2COO, (CH3)3CO, нитрат, (CF3)2(CH3)CO, (CF3)(CH3)2CO, PhO (фенокси), C6F5O (пентафторфенокси), MeO (метокси), EtO (этокси), тозилат (пара-CH3-C6H4-SO3), мезилат (2,4,6-триметилфенил) или CF3SO3 (трифторметансульфонат).
A1–A2являются идентичными или различными и выбраны из группы, включающей кислород, серу, селен, NR’’’’, PR’’’’, POR’’’’, AsR’’’’, AsOR’’’’, SbOR’’’’ и SbR’’’’.
T1 – T2являются идентичными или различными и выбраны из группы, включающей


где E предпочтительно представляет собой донорный атом, выбранный из группы, включающей азот, фосфор, кислород, серу и селен; при этом для группы


R, R’, R’’, R”’ и R’’’’ являются идентичными или различными и представляют собой водород, галоген, гидроксил, альдегид, кето, тиол, CF3, нитро, нитрозо, циано, тиoциано, изоцианаты, карбодиимид, карбамат, тиокарбамат, дитиокарбамат, амино, амидо, имино, аммоний, силил, сульфонат (-SO3-), -OSO3-, -PO3- или -OPO3-, ацил, ацилокси или представляют собой алкил, циклоалкил, алкенил, циклоалкенил, замещенный алкенил, гетероалкенил, содержащий гетероатом алкинил, алкенилен, алкинил, замещенный алкинил, арил, замещенный арил, гетероарил, карбоксилат, алкокси, алкенилокси, алкинилокси, арилокси, алкарил, аралкил, алкарилокси, аралкилокси, алкоксикарбонил, алкиламино-, алкилтио-, арилтио, алкилсульфонил, алкилсульфинил, диалкиламино, алкиламмоний, алкилсилил или алкоксисилил, где каждый из данных радикалов и необязательно все могут быть замещены одной или более вышеупомянутыми группами, определенными для R, R’, R’’, R”’ и R’’’’, при этом, в качестве альтернативы, в каждом случае два непосредственно смежных радикала из группы R, R’, R’’, R”’ и R’’’’, в том числе атомы, к которым они присоединены, образуют одну или несколько циклических структур, в том числе ароматических структур.
C1-C6алкил представляет собой без ограничения, например, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, трет-бутил, н-пентил, 1-метилбутил, 2-метилбутил, 3-метилбутил, неопентил, 1-этилпропил и н-гексил.
C3-C8циклоалкил включает без ограничения циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил.
C6-C24арил включает ароматический радикал с 6-24 скелетными атомами углерода. Предпочтительные моно-, би- или трициклические карбоциклические ароматические радикалы содержат 6-10 скелетных атомов углерода, например, без ограничения фенил, бифенил, нафтил, фенантренил или антраценил.
В качестве альтернативы, R необязательно замещен нейтральным донорным лигандом (L2), как определено L1.
C1 – C2 представляют собой атомы углерода, соединенные друг с другом посредством одинарной или двойной связи, где в случае одинарной связи каждый атом углерода несет дополнительный заместитель из RC1 и RC2.
RC1 и RC2 являются идентичными или различными и такими, как определено для R’, R’’, R’’’ и R’’’’.
L1 предпочтительно представляет собой нейтральный донор электронов.
Лиганд L1 может, например, представлять собой фосфин, сульфонированный фосфин, фосфат, фосфинит, фосфонит, фосфит, арсин, стибин, простой эфир, амин, амид, сульфоксид, карбоксил, нитрозил, пиридин, замещенный пиридин, пиразин, тиокарбонил, тиоэфир, триазолкарбен, мезоионный карбен (MIC), N-гетероциклический карбен («NHC»), замещенный NHC, циклический алкиламинокарбен (CAAC) или замещенный CAAC.
Предпочтительно лиганд L1 представляет собой фосфиновый лиганд, характеризующийся формулой P(Q1)3, где Q1 являются идентичными или различными и представляют собой алкил, предпочтительно C1-C10алкил, более предпочтительно C1-C5алкил, циклоалкил-, предпочтительно C3-C20циклоалкил, более предпочтительно C3-C8циклоалкил, предпочтительно циклопентил, циклогексил и неопентил, арил, предпочтительно C6-C24арил, более предпочтительно фенил или толуил, C1-C10алкил-фосфабициклононан, C3-C20циклоалкил-фосфабициклононан, сульфированный фосфиновый лиганд формулы P(Q2)3, где Q2представляет собой моно- или полисульфированный Q1-лиганд, C6-C24арил- или C1-C10алкилфосфинитный лиганд, C6-C24арил- или C1-C10алкилфосфонитный лиганд, C6-C24арил- или C1-C10алкилфосфитный лиганд, C6-C24арил- или C1-C10алкиларсиновый лиганд, C6-C24арил- или C1-C10алкиламиновые лиганды, пиридиновый лиганд, C6-C24арил- или C1-C10алкилсульфоксидный лиганд, C6-C24арил- или C1-C10алкилэфирный лиганд или C6-C24арил- или C1-C10алкиламидные лиганды, все из которых могут быть многократно замещены, например, фенильной группой, где такие заместители в свою очередь необязательно замещены одним или более из галогена, радикалов C1-C5алкила или C1-C5алкокси.
Термин «фосфин» включает, например, PPh3, P(пара-Tol)3, P(орто-Tol), PPh(CH3)2, P(CF3)3, P(пара-FC6H4)3, P(орто-CF3C6H4)3, P(C6H4-SO3Na)3, P(CH2C6H4-SO3Na)3, P(изопропил)3, P(CHCH3(CH2CH3))3, P(циклопентил)3, P(циклогексил)3, P(неoпентил)3 и циклогексил-фосфабициклононан.
Термин «фосфинит» включает, например, трифенилфосфинит, трициклогексилфосфинит, триизопропилфосфинит и метилдифенилфосфинит.
Термин «фосфит» включает, например, трифенилфосфит, трициклогексилфосфит, три-трет-бутилфосфит, триизопропилфосфит и метилдифенилфосфит.
Термин «стибин» включает, например, трифенилстибин, трициклогексилстибин и триметилстибин.
Термин «сульфонат» включает, например, трифторметансульфонат, тозилат и мезилат.
Термин «сульфоксид» включает, например, CH3S(=O)CH3 и (C6H5)2SO.
Термин «тиоэфир» включает, например, CH3SCH3, C6H5SCH3, CH3OCH2CH2SCH3 и тетрагидротиофен.
Термин «пиридин» в данной заявке является общим термином и включает все незамещенные и замещенные азотсодержащие лиганды, описанные в WO-A-03/011455 и US 6759537 B2. Примерами являются: пиридин, пиколины (α-, β- и γ-пиколин), лютидины (2,3-, 2,4-, 2,5-, 2,6-, 3,4- и 3,5-лютидин), коллидин (2,4,6-триметилпиридин), трифторметилпиридин, фенилпиридин, 4-(диметиламино)пиридин, хлорпиридины (2-, 3- и 4-хлорпиридин), бромпиридины (2-, 3- и 4-бромпиридин), нитропиридины (2-, 3- и 4-нитропиридин), бипиридин, пиколилимин, гамма-пиран, фенантролин, пиримидин, бипиримид, пиразин, индол, кумарин, карбазол, пиразол, пиррол, имидазол, оксазол, тиазол, дитиазол, изоксазол, изотиазол, хинолин, бисхинолин, изохинолин, бисизохинолин, акридин, хромен, феназин, феноксазин, фенотиазин, триазин, тиантрен, пурин бензимидазол, бисимидазол, бисоксазол пиррол, имидазол и фенилимидазол.
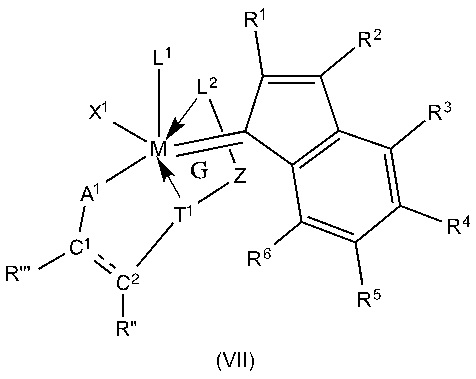
В другом применимом варианте осуществления лиганд L1 представляет собой N-гетероциклический карбен (NHC), обычно характеризующийся структурой формул (IIIa) или (IIIb):

(IIIa) (IIIb),
в которых
R7-R14, R11’, R12’ являются идентичными или различными и представляют собой водород, галоген, гидроксил, альдегид, кето, тиол, CF3, нитро, нитрозо, циано, тиoциано, изоцианаты, карбодиимид, карбамат, тиокарбамат, дитиокарбамат, амино, амидо, имино, аммоний, силил, сульфонат (-SO3-), -OSO3-, -PO3- или -OPO3-, ацил, ацилокси или представляют собой алкил, циклоалкил, алкенил, циклоалкенил, замещенный алкенил, гетероалкенил, содержащий гетероатом алкинил, алкенилен, алкинил, замещенный алкинил, арил, замещенный арил, гетероарил, карбоксилат, алкокси, алкенилокси, алкинилокси, арилокси, алкарил, аралкил, алкарилокси, аралкилокси, алкоксикарбонил, алкиламмоний, алкиламино-, алкилтио-, арилтио, алкилсульфонил, алкилсульфинил, диалкиламино, алкилсилил или алкоксисилил, где каждый из данных радикалов и необязательно все могут быть замещены одной или более вышеупомянутыми группами, определенными для R1-R6.
Необязательно один или более радикалов R7-R14, R11’, R12’ независимо друг от друга могут быть замещенными одним или несколькими заместителями, предпочтительно прямым или разветвленным C1-C10алкилом, C3-C8циклоалкилом, C1-C10алкокси или C6-C24арилом, где такие вышеупомянутые заместители в свою очередь могут быть замещены одним или более радикалами, предпочтительно выбранными из группы, включающей галоген, в частности, хлор или бром, C1-C5алкил, C1-C5алкокси и фенил.
В качестве уточнения, изображаемые структуры N-гетероциклического карбена в общих формулах (IIIa) и (IIIb) сравнимы с N-гетероциклическими карбенами, описанными в литературе, где часто применяют структуры (IIIa') и (IIIb'), которые демонстрируют карбеновый характер N-гетероциклического карбена. Это также применимо к соответствующим предпочтительным показанным ниже структурам (IVa) - (IVf)
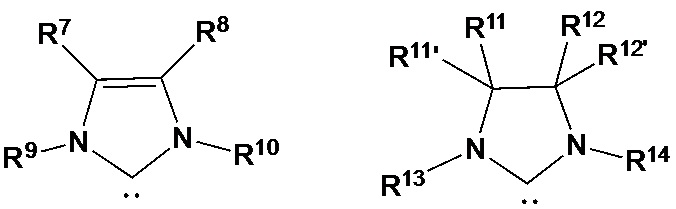
(IIIa’) (IIIb’)
В предпочтительном варианте осуществления катализаторов в общих формулах (IIIa) и (IIIb) R7, R8, R11, R11’, R12 и R12’ независимо друг от друга означают водород, C6-C24арил, особенно предпочтительно фенил, прямой или разветвленный C1-C10алкил, особенно предпочтительно пропил или бутил, или вместе с включением атомов углерода, к которым они присоединены, образуют циклоалкильный или арильный радикал, где все вышеназванные радикалы необязательно могут быть замещены одним или более дополнительными радикалами, выбранными из группы, включающей прямой или разветвленный C1-C10алкил, C1-C10алкокси, C6-C24арил, и функциональная группа выбрана из группы, включающей гидрокси, тиол, тиоэфир, кетон, альдегид, сложный эфир, простой эфир, амин, имин, амид, нитро, карбоновую кислоту, дисульфид, карбонат, изоцианат, карбодиимид, карбоалкокси, карбамат и галоген.
В особенно предпочтительном варианте осуществления катализаторы общих формул (I-II) имеют один N-гетероциклический карбен (NHC) в качестве лиганда L1, где радикалы R9, R10, R13 и R14 являются идентичными или различными и представляют собой неразветвленный или разветвленный C1-C10алкил, особенно предпочтительно изопропил или неопентил, C3-C10циклоалкил, предпочтительно адамантил, C6-C24арил, особенно предпочтительно фенил, C1-C10алкилсульфонат, особенно предпочтительно метансульфонат, C1-C10арилсульфонат, особенно предпочтительно пара-толуолсульфонат.
При необходимости вышеупомянутые остатки замещены, в виде значений R9, R10, R13 и R14, одним или более дополнительными радикалами, выбранными из группы, включающей прямой или разветвленный C1-C5 алкил, особенно метил, C1-C5алкокси, арил, и функциональной группой, выбранной из группы, включающей гидрокси, тиол, тиоэфир, кетон, альдегид, сложный эфир, простой эфир, амин, имин, амид, нитро, карбоновую кислоту, дисульфид, карбонат, изоцианат, карбодиимид, карбоалкокси, карбамат и галоген.
В частности, радикалы R9, R10, R13 и R14 могут быть идентичными или различными и обозначают изопропил, неопентил, адамантил, мезитил или 2,6-диизопропилфенил.
Особенно предпочтительные N-гетероциклические карбены (NHC) характеризуются следующей структурой (IVa) - (IVf), в которой Mes выступает 2,4,6-триметилфенильным радикалом или, в качестве альтернативы, во всех случаях, 2,6-диизопропилфенильным радикалом.

В альтернативном варианте осуществления нейтральный лиганд L можно выбрать из лигандов любой из формул (Va-Vc):
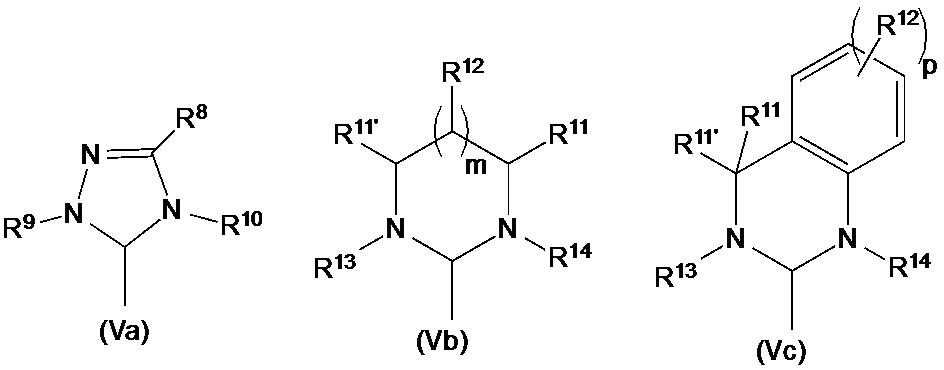
R8, R9, R10, R11, R11’, R12, R13, R14являются идентичными или различными и сравнимы с R3-R6, определенными в данном документе выше. Любая смежная группа R11, R11’ и R12в структуре (Vb) и (Vc) может образовывать 3-, 4-, 5-, 6- или 7-членный циклоалкил, алкиленовый мостик или арил.
В других применимых вариантах осуществления одна из N-групп, связанных с карбеном в формуле (IIIa) или (IIIb), замещена другим гетероатомом, предпочтительно S, O или P, предпочтительно гетероатомом S. Другие применимые N-гетероциклические карбены включают соединения, описанные в Chem. Eur. J 1996, 2, 772 и 1627; Angew. Chem. Int. Ed. 1995, 34, 1021; Angew. Chem. Int. Ed. 1996, 35, 1121; и Chem. Rev. 2000, 100, 39.
Для целей настоящего изобретения и его формулы изобретения «циклические алкиламинокарбены» (CAAC) представлены формулой (VI):
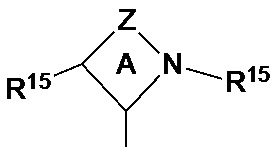
(VI),
где кольцо A представляет собой 4-, 5-, 6- или 7-членное кольцо, а Z представляет собой связывающую группу, содержащую один - четыре связанных вершинных атома, выбранных из группы, включающей C, O, N, B, Al, P, S и Si, при этом доступные валентности необязательно заняты водородом, оксо или R-заместителями, где R независимо выбран из группы, включающей C1-C12гидрокарбильные группы, замещенные C1-C12гидрокарбильные группы и галогениды, и каждый R15 независимо представляет собой гидрокарбильную группу или замещенную гидрокарбильную группу с 1-40 атомами углерода, предпочтительно метил, этил, пропил, бутил (в том числе изобутил и н-бутил), пентил, циклопентил, гексил, циклогексил, октил, циклооктил, нонил, децил, циклодецил, додецил, циклододецил, мезитил, адамантил, фенил, бензил, толуил, хлорфенил, фенол или замещенный фенол.
Некоторые особенно применимые CAAC включают:

Другие применимые CAAC включают соединения, описанные в патенте США № 7312331 и в Angew. Chem. Int. Ed. 2005, 44, 7236-7239.
Для случая, если группа R, присутствующая в T1 или T2 катализаторов по настоящему изобретению с общей формулой (I), дополнительно замещена нейтральным донорным лигандом, то могут быть получены следующие примеры, со структурами общей формулы (VII).

Где кольцо G представляет собой 4-, 5-, 6-, 7-, 8-, 9- или 10-членное кольцо, а Z представляет собой связывающую группу, содержащую один - семь связанных вершинных атомов, выбранных из группы, включающей C, O, N, P, S и Si, при этом доступные валентности необязательно заняты водородом, галогеном, гидроксилом, альдегидом, кето, тиолом, CF3, нитро, нитрозо, циано, тиoциано, изоцианатами, карбодиимидом, карбаматом, тиокарбаматом, дитиокарбаматом, амино, амидо, имино, аммонием, силилом, сульфонатом (-SO3-), -OSO3-, -PO3- или -OPO3-, ацилом, ацилокси или представляют собой алкил, циклоалкил, алкенил, циклоалкенил, замещенный алкенил, гетероалкенил, содержащий гетероатом алкинил, алкенилен, алкинил, замещенный алкинил, арил, замещенный арил, гетероарил, карбоксилат, алкокси, алкенилокси, алкинилокси, арилокси, алкарил, аралкил, алкарилокси, аралкилокси, алкоксикарбонил, алкиламино-, алкилтио-, арилтио, алкилсульфонил, алкилсульфинил, диалкиламино, алкиламмоний, алкилсилил или алкоксисилил, где каждый из таких вершинных атомов и необязательно все могут быть замещены одной или более вышеупомянутыми группами, определенными для R, R’’, R”’ и R’’’’,
или, в качестве альтернативы, в каждом случае два непосредственно смежных вершинных атома из Z образуют одну или более циклических структур, в том числе ароматических структур.
L1 и L2 являются идентичными или различными лигандами, при этом предпочтительно представляют собой нейтральные доноры электронов, и L2имеет такое же значение, что и L1, как определено в структурах (I-II),
где M, X1, A1, T1, L1, R1- R6и R’, R”, R”’ и R’’’’ имеют такие же значения, как определено в общих структурах (I-II).
В качестве примеров катализаторов в соответствии с настоящим изобретением можно упомянуть следующие структуры:


В определенных вариантах осуществления каталитическое соединение, используемое в процессах метатезиса олефинов, может быть связано с твердой подложкой катализатора или осаждено на ней. Твердая подложка катализатора обеспечит гетерогенность каталитического соединения, что упростит восстановление катализатора. Кроме того, подложка катализатора может повысить силу и устойчивость к износу катализатора. Подходящие подложки катализатора включают без ограничения кремнеземные, глиноземные, кремнезем-глиноземные, алюмосиликаты, в том числе цеолиты и другие кристаллические пористые алюмосиликаты; а также оксид титана, оксид циркония, оксид магния, углерод, углеродные нанотрубки, графен, металлоорганические каркасные структуры и сшитые сетчатые полимерные смолы, такие как функционализированные сшитые полистиролы, например, хлорметил-функционализированные сшитые полистиролы.
Каталитическое соединение может быть осаждено на подложку любым способом, известным специалистам в данной области, в том числе, например, путем пропитывания, ионного обмена, осаждения-отложения, Π-Π взаимодействий и осаждения из паровой фазы. В качестве альтернативы, каталитическое соединение может быть химически связанным с подложкой посредством одной или более ковалентных химических связей, например, каталитическое соединение может быть иммобилизовано одной или более ковалентными связями с одним или более заместителями инденилиденового лиганда, или непосредственно иммобилизовано посредством одной или более химических связей с металлом 8 группы путем замещения одного или более анионных лигандов, или иммобилизовано посредством одной или более химических связей между лигандом L1 и подложкой.
Если применяют подложку катализатора, то каталитическое соединение может быть загружено на подложку катализатора в любом количестве, при условии, что процесс метатезиса протекает до получения необходимых продуктов метатезиса. Как правило, каталитическое соединение загружают на подложку в количестве, которое больше приблизительно 0,01 вес. % металла 8 группы от общего веса каталитического соединения с подложкой. Как правило, каталитическое соединение загружают на подложку в количестве, которое составляет менее приблизительно 20 вес. % металла 8 группы от общего веса каталитического соединения с подложкой.
В целом, ацетиленовые соединения, применимые в соответствии с настоящим изобретением, могут содержать хелатирующий фрагмент формулы (VIII),

(VIII),
где
D представляет собой уходящую группу;
R16-R17 определены ниже;
R16 выбран из водорода, галогена, алкила, алкенила, алкинила, арила, гетероалкила, содержащего гетероатом алкенила, гетероалкенила, гетероарила, алкокси, алкенилокси, арилокси, алкоксикарбонила, карбонила, алкиламино, алкилтио, аминосульфонила, моноалкиламиносульфонила, диалкиламиносульфонила, алкилсульфонила, нитрила, нитро, алкилсульфинила, тригалогеналкила, перфторалкила, карбоновой кислоты, кетона, альдегида, нитрата, циано, изоцианата, гидроксила, сложного эфира, простого эфира, амина, имина, амида, галогензамещенного амида, трифторамида, сульфида, дисульфида, сульфоната, карбамата, силана, силоксана, фосфина, фосфата или бората, и где, если R16 представляет собой арил, полиарил или гетероарил, то R16 может быть замещен любой комбинацией R1, R2, R3, R4, R5 и R6 и может быть связан с любым из R1, R2, R3, R4, R5 и R6 с образованием одной или более циклических ароматических или неароматических групп.
R17 выбран из аннуленов, характеризующихся общей формулой CnHn (если n представляет собой четное число) или CnHn+1 (если n представляет собой нечетное число). Хорошо известными типичными соединениями аннуленов, но без ограничения, являются циклобутaдиен, бензол и циклооктатетраен. Аннулены могут быть ароматическими или антиароматическими. Каждый H-атом из аннуленового фрагмента может быть замещен галогеном, алкилом, алкенилом, алкинилом, арилом, гетероалкилом, содержащим гетероатом алкенилом, гетероалкенилом, гетероарилом, алкокси, алкенилокси, арилокси, алкоксикарбонилом, карбонилом, алкиламино, алкилтио, аминосульфонилом, моноалкиламиносульфонилом, диалкиламиносульфонилом, алкилсульфонилом, нитрилом, нитро, алкилсульфинилом, тригалогеналкилом, перфторалкилом, карбоновой кислотой, кетоном, альдегидом, нитратом, циано, изоцианатом, гидроксилом, сложным эфиром, простым эфиром, амином, имином, амидом, галогензамещенным амидом, трифторамидом, сульфидом, дисульфидом, сульфонатом, карбаматом, силаном, силоксаном, фосфином, фосфатом или боратом, и где, если R17 представляет собой арил, полиарил или гетероарил, то R17 может быть замещен любой комбинацией R1, R2, R3, R4, R5 и может быть связан с любым из R1, R2, R3, R4, R5 и R6 с образованием одной или более циклических ароматических или неароматических групп.
Примеры подходящих уходящих групп включают без ограничения гидроксил, галогенид, сложный эфир, пергалогенированный фенил, ацетат, бензоат,C2-C6ацил, C2-C6алкоксикарбонил, C1-C6алкил, фенокси, C1-C6алкокси, C1-C6алкилсульфанил, арил или C1-C6алкилсульфонил. В еще более предпочтительных вариантах осуществления D выбран из гидроксила, галогенида, CF3CO2, CH3CO2, CFH2CO2, (CH3)3CO,(CF3)2(CH3)CO, (CF3)(CH3)2CO, PhO, MeO, EtO, тозилата, мезилата или трифторметансульфоната. В конкретных вариантах осуществления D преимущественно представляет собой гидроксил (OH).
Предпочтительные органические ацетиленовые соединения характеризуются формулой (IX),

(IX),
где
m* представляет собой целое число от 1 до 5;
R* выбран из R1, R2, R3, R4, R5 и R6 или их комбинаций, определенных выше.
D и R16 определены выше.
Предпочтительные органические ацетиленовые соединения включают:

Синтез катализирующих метатезис соединений
Каталитические соединения, описываемые в настоящем изобретении, можно синтезировать любыми способами, известными специалистам в данной области.
Типичные способы синтеза описанного в настоящем документе каталитического соединения, по типу содержащего элемент 8 группы, включают, например, обработку раствора ацетиленового соединения в подходящем растворителе, таком как диоксан, реактантным комплексом металла 8 группы, таким как дихлорбис(трифенилфосфин)рутений(ll), и хлороводородом (в диоксане). Реакционную смесь можно нагревать в течение периода времени, необходимого для получения желаемого модифицированного инденилиденового каталитического соединения. Как правило, удаление летучих соединений и промывка гексаном обеспечивают высокий выход (> 80%) содержащего элемент 8 группы модифицированного инденилиденового соединения 1го поколения (схема 4) .
Затем, при необходимости, может быть добавлен фосфиновый лиганд, такой как трициклогексилфосфин, циклогексил-фосфабициклононан, фосфинит или фосфинит. Условия реакции, как правило, включают смешивание реактантного соединения, содержащего элемент 8 группы, и предпочтительного фосфинового лиганда в подходящем растворителе, например, дихлорметане, в течение времени, достаточного для осуществления обмена фосфиновых лигандов, при подходящей температуре, как правило, температуре окружающей среды, при этом выход (>90%).
При необходимости к соединению 1го поколения (схема 4) можно добавлять N-гетероциклические карбены (NHC), такие как 1,3-бис(2,4,6-триметилфенил)-2-имидазолидинилиден, 1,3-бис(2,6-диизопропилфенил)-2-имидазолидинилиден или CAAC. Условия реакции, как правило, включают смешивание реактантного соединения, содержащего элемент 8 группы, 1го поколения (схема 4) и предпочтительного лиганда NHC, CAAC в подходящем растворителе, например, толуоле, в течение времени, достаточного для осуществления обмена фосфиновых лигандов, при подходящей температуре, как правило, от температуры окружающей среды до 80°C. Путем добавления изопропанола с последующим фильтрованием и промыванием получают необходимое соединение 2го поколения (схема 4) с высоким выходом (> 85%).
При необходимости, к соединению 2го поколения (схема 4) можно добавлять пиридиновый лиганд, такой как пиридин, 3-Br-пиридин. Условия реакции, как правило, включают смешивание реактантного соединения, содержащего элемент 8 группы, 2го поколения (схема 4) и предпочтительного пиридинового лиганда в растворителе в течение времени, достаточного для осуществления обмена фосфиновых лигандов, при подходящей температуре, как правило, от температуры окружающей среды до 80°C. Фильтрование и промывание дают необходимое соединение 3го поколения (схема 4) с высоким выходом (> 85%).
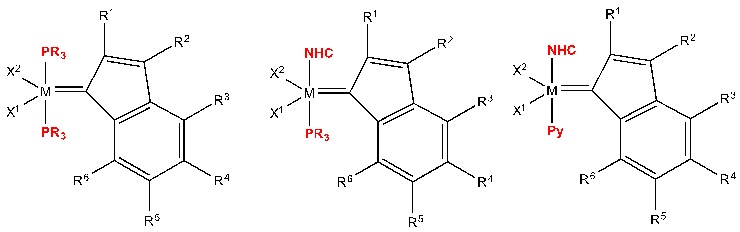
1е поколение 2е поколение 3е поколение
Схема 4: разные поколения нехелатирующих модифицированных инденилиденовых катализаторов.
Обработка раствора дитопного (или мультитопного) лиганда, например, O,N-бидентатных лигандов, в подходящем растворителе, таком как THF, с помощью нехелатирующего модифицированного инденилиденового комплекса 1го, или 2го, или 3го поколения (смотри схему 4), например, (Simes)(PCy3)Cl2Ru(3-2-метилфенил-5-метилфенилинден-1-илидена), в соотношении 1:1, и добавление необходимого количества серебра (например, AgO2) в течение времени, достаточного для осуществления обмена лигандов, при подходящей температуре, как правило, от температуры окружающей среды до 80°C с выходом необходимого модифицированного инденилиденового каталитического соединения. Затем температуру реакции понижали до комнатной температуры, белый осадок PCy3AgCl (побочный продукт) и избыток Ag2O удаляли фильтрованием и фильтрат концентрировали при пониженном давлении. Выделенный твердый осадок предоставляет необходимый продукт (I тип) с высоким выходом (> 85%).
Обработка раствора дитопного (или мультитопного) лиганда, например, O,N-бидентатных лигандов, в подходящем растворителе, таком как THF, с помощью нехелатирующего модифицированного инденилиденового комплекса 1го, или 2го, или 3го поколения (смотри схему 4), например, (Simes)(PCy3)Cl2Ru(3-2-метилфенил-5-метилфенилинден-1-илидена), в соотношении 2:1 и добавление эквивалентного количества серебра (например, AgO2) в течение времени, достаточного для осуществления обмена лигандов, при подходящей температуре, как правило, от температуры окружающей среды до 80°C с выходом необходимого модифицированного инденилиденового каталитического соединения. Затем температуру реакции понижали до комнатной температуры, белый осадок PCy3AgCl (побочный продукт) и избыток Ag2O удаляли фильтрованием и фильтрат концентрировали при пониженном давлении. Выделенный твердый осадок предоставляет необходимый продукт (II тип) с высоким выходом (> 85%).
Обработка раствора дитопного (или мультитопного) лиганда, например, O,N-бидентатных лигандов, в подходящем растворителе, таком как THF, с помощью катализатора I-го типа в соотношении 1:1 и добавление необходимого количество серебра (например, AgO2) в течение времени, достаточного для осуществления обмена лигандов, при подходящей температуре, как правило, от температуры окружающей среды до 80°C с выходом необходимого модифицированного инденилиденового каталитического соединения. Затем температуру реакции понижали до комнатной температуры, белый осадок PCy3AgCl (побочный продукт) и избыток Ag2O удаляли фильтрованием и фильтрат концентрировали при пониженном давлении. Выделенный твердый осадок предоставляет необходимый продукт (II тип) с высоким выходом.
Обмен дитопных (или мультитопных) лигандов также можно выполнять посредством образования первой соли лиганда (натриевой, калиевой, магниевой солей, соли таллия и т. д.), как это хорошо известно специалистам в данной области.
Примеры дитопных или мультитопных лигандов, но без ограничения, описаны в WO 2005035121, европейском патенте № 1468004, EP 08290747.
Несмотря на то, что в настоящем изобретении описывается ряд комплексов переходных металлов, применимых в катализе реакций метатезиса, следует понимать, что такие комплексы можно образовать in situ. Следовательно, можно добавлять дополнительные лиганды в реакционный раствор в виде отдельных соединений или могут быть образованы комплексы с металлическим центром с образованием металл-лигандного комплекса до введения в реакцию.
Далее приводятся протоколы синтеза для типичных 1,1-замещенных проп-2-ин-1-оловых лигандов, дитопных, мультитопных лигандов и соответствующих рутений-алкилиденовых комплексов. Другие замещенные проп-2-ин-1-оловые, дитопные, мультитопные лиганды и их соответствующие металлические комплексы могут быть получены аналогичным образом.
Пример 1: 2-[(4-бром-2,6-диметилфенилимино)метил]-4-нитрофенокси (PCy3)(3-2-метилфенил-5-метилинден-1-илиден)Ru(II)Cl (1F)
Синтез (PPh3)2Cl2Ru(3-2-метилфенил-5-метилинден-1-илидена) (1D)


Стадия 1:бис(2-метилфенил)метанон (1A):
К раствору 2-бромтолуола (2 экв., 2,6 мл, 21,79 ммоля,) в 26 мл диэтилового эфира при -90oC каплями добавляли трет-BuLi (1,9 M в пентане) (3 экв., 32,7 ммоля, 17,2 мл). Раствор перемешивали в течение 30 минут при комнатной температуре, а затем каплями добавляли N,N-диметилкарбамоилхлорид (1 экв., 1 мл, 10,9 ммоля), реакционную смесь перемешивали еще 3 часа. Неочищенную реакционную смесь гасили с применением 35 мл 1 N HCl и разбавляли диэтиловым эфиром. Органическую фазу промывали водой, а водную фазу экстрагировали дважды диэтиловым эфиром, после чего фракции простого эфира объединяли и сушили с помощью безводного MgSO4. С помощью удаления MgSO4 фильтрованием, последующим очищением с применением колоночной флэш-хроматографии (силикагель, гексан в качестве растворителя) и в конечном итоге выпариванием растворителя, получали белое твердое вещество 0,93 г (40,6%).
1H ЯМР (300 МГц, CDCl3, TMS): δ 7,38 (td, 2H), 7,29 (td, 4H), 7,20 (td, 2H), 2,44 (s, 6H).
13C ЯМР (75 МГц, CDCl3): δ 200,79, 139,01, 138,17, 131,43, 131,07, 130,31, 125,42, 20,67.
Стадия 2: 1,1-бис-метилфенил-3-(триметилсилил)проп-2-ин-1-ол (1B)
Каплями добавляли н-BuLi (2,5 M в гексанах) (1,5 экв., 5,7 мл, 14,28 ммоля) в перемешиваемый раствор триметилсилилацетилена (1,5 экв., 2 мл, 14,28 ммоля) в безводном THF (17 мл) при -90oC в атмосфере аргона. После добавления полученный в результате раствор перемешивали еще 5 минут в холодной бане, а затем перемешивали в течение 30 минут при комнатной температуре. Затем в раствор медленно добавляли бис(2-метилфенил)метанон (9,52 ммоля, 2 г) в 17 мл сухого THF при -90°C, обеспечивали нагревание полученной в результате смеси и нагревали с обратным холодильником в течение 30 минут. Неочищенную реакционную смесь гасили с применением 15 мл 1 N HCI и разбавляли диэтиловым эфиром. Органическую фазу промывали водой, а водную фазу объединяли и экстрагировали дважды простым эфиром, после чего фракции простого эфира объединяли и сушили с помощью безводного MgSO4. После удаления MgSO4 фильтрованием и выпаривания растворителя получали желтую жидкость с количественным выходом. Полученный продукт использовали без дополнительной очистки.
1H ЯМР (300 МГц, CDCl3, TMS): δ 7,95 (dd, 2H), 7,27 (dd, 4H), 7,15 (dd, 2H), 2,75 (s, 1H), 2,14 (s, 6H), 0,27(d, 9H).
13C ЯМР (75 МГц, CDCl3): δ 141,01, 136,76, 132,37, 128,13, 127,45, 125,58, 107,10, 92,44, 75,01, 21,40, 0,00.
Стадия 3: 1,1-бис-2-метилфенил-проп-2-ин-1-ол (1C)
Раствор 1,1-бис-метилфенил-3-(триметилсилил)проп-2-ин-1-ола получали из предыдущей стадии, и K2CO3 (1 экв., 1,3 г 9,52 ммоля) в сухом метаноле (10 мл) перемешивали при комнатной температуре в течение 3 ч. Неочищенную реакционную смесь гасили с применением 20 мл 1 N HCl и разбавляли диэтиловым эфиром. Органическую фазу промывали водой, а водную фазу экстрагировали дважды диэтиловым эфиром, после чего фракции простого эфира объединяли и сушили над безводным MgSO4. С помощью удаления MgSO4 фильтрованием, последующим очищением с применением колоночной флэш-хроматографии (силикагель, гексан/EtOAc=30/1) и в конечном итоге выпариванием растворителя, получали желтоватое твердое вещество (2,06 г, выход 92% для стадий 2+3).
1H ЯМР (300 МГц, CDCl3, TMS): δ 7,95 (m, 2H), 7,23 (m, 4H), 7,09(m, 2H), 2,89 (s, 1H), 2,67(s, 1H), 2,02(s, 6H).
13C ЯМР (75 МГц, CDCl3): δ 140,60, 136,33, 132,30, 128,19, 127,24, 125,58, 85,52, 76,80, 74,75, 21,16.
ESI[M-OH]: 219,1, рассчитанное значение: 219,1.
Стадия 4: (PPh3)2Cl2Ru(3-2-метилфенил-5-метилфенилинден-1-илиден) (1D):
(PPh3)3RuCl2 (1 экв., 0,575 г, 0,6 ммоля) и 1,1-бис-2-метилфенил-проп-2-ин-1-ол (соединение C, 1,5 экв., 0,213 г, 0,9 ммоля) добавляли в 4 мл раствора HCl/диоксана (0,15 моля/л). Раствор нагревали до 90oC в течение 3 часов, после чего растворитель удаляли под вакуумом. В колбу добавляли гексан (20 мл) и твердое вещество удаляли со стенок с помощью ультразвука. Полученную в результате суспензию фильтровали и дважды промывали с использованием гексана (5 мл). Оставшийся растворитель выпаривали с получением красно-коричневого порошка; 0,52 г (выход: 95%). Продукт характеризовали с помощью ЯМР спектров1H и31P.
1H ЯМР (300 МГц, CDCl3, TMS): δ 7,56 (dd, 11 H), 7,37 (t, 6 H), 7,21-7,31 (m, 13 H), 7,09 (тетра, 3 H), 6,95 (t, 3 H), 6,47 (t, 1 H), 6,14 (s, 1 H), 2,20 (s, 3 H), 1,66 (s, 3 H).
31P ЯМР (121,49 МГц, CDCl3): δ 29,33.
Стадия 5: синтез (PCy3)2Cl2Ru(3-2-метилфенил-5-метилинден-1-илидена (1E)
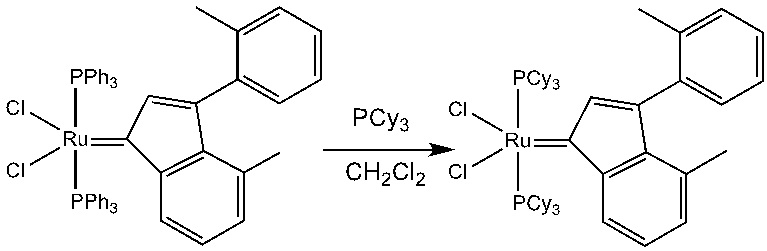
(1D) (1E)
25 мл сосуд заполняли (PPh3)2Cl2Ru(3-2-метилфенил-5-метилинден-1-илиденом) (1 экв., 0,4574 г, 0,5 ммоля), трициклогексилфосфином (3 экв., 0,42 г, 1,5 ммоля) и дихлорметаном (10 мл). После завершения реакции (1 ч.) полученную в результате взвесь сушили под вакуумом и добавляли 20 мл изопропанола. Фильтрацией получали красно-коричневый порошок, который после промывания 5 мл изопропанола (2 x) и сушки под вакуумом давал 0,44 г катализатора (выход: 93 %). Продукт характеризовали с помощью ЯМР спектров1H и31P.
1H ЯМР (300 МГц, CDCl3, TMS): δ 8,54 (d, 1 H), 7,24-7,29 (m, 1 H), 7,10-7,17 (m, 4 H), 7,07 (s, 1 H), 7,02 (d, 1 H), 2,61 (d, 6 H), 2,22 (s, 3H), 1,18-1,96 (m, 63 H).
31P ЯМР (121,49 МГц, CDCl3): δ 31,75, 31,56.
Характеристические значения1H и31P: H-C8: 8,54 ppm (d, 1 H) и P: 31,75 и 31,56 ppm.
Стадия 6: синтез 2-[(4-бром-2,6-диметилфенилимино)метил]-4-нитрофенокси (PCy3)(3-2-метилфенил-5-метилинден-1-илидена)Ru(II)Cl (1F)

(1E) (1F)
(PCy3)2Cl2Ru(3-2-метилфенил-5-метилинден-1-илиден (0,53 ммоля) и 2-[(4-бром-2,6-диметилфенилимино)метил]-4-нитрофенол (0,53 ммоля) (синтезированный согласно литературным данным), оксид серебра (I) (0,32 ммоля) добавляли в колбу Шленка в атмосфере аргона. Сухой THF (20 мл) переносили в колбу Шленка, а затем нагревали (40°C) и перемешивали в течение 4 ч периода с последующим охлаждением до комнатной температуры. Белый осадок PCy3AgCl (побочный продукт) и избыток AgO2удаляли фильтрованием. Фильтрат собирали в колбу Шленка и растворитель удаляли выпариванием при пониженном давлении.
Реакционную смесь исследовали на1H и31P ЯМР, который показал количественное превращение в комплекс 1F.
Характеристические значения1H и31P: H-C8: 6,75 ppm (d, 1 H) и P: 39,65 ppm.
Выделенный твердый осадок перекристаллизовывали из пентана с получением катализатора. Выход после перекристаллизации: 75%.
Пример 2: синтез (S-IMes)(2-[(2-метилфенилимино)метил]-4-нитрофенокси) (3-2-метилфенил-5-метилинден-1-илидена)Ru(II)Cl (2B)
Стадия 1: синтез (S-IMes)(PCy3)Cl2Ru(3-2-метилфенил-5-метилинден-1-илидена) (2A)
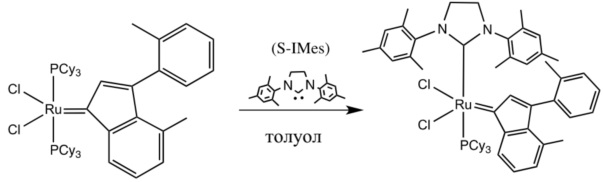
(1E) (2A)
S-IMes = насыщенный 1,3-бис(мезитил)-имидазолидин-2-илиден (1,3-бис(2,4,6-триметилфенил)-2-имидазолидинилиден)
10 мл сосуд заполняли (PCy3)2Cl2Ru(3-2-метилфенил-5-метилинден-1-илиденом) (1 экв., 0,3804 г, 0,4 ммоля) и S-IMes (1,1 экв., 0,134 г, 0,44 ммоля). Добавляли сухой толуол (3 мл) в инертной атмосфере. Смесь энергично перемешивали при 50°C в течение 30 минут и сушили под вакуумом, а затем добавляли 10 мл изопропанола. После фильтрации и промывания (два раза 5 мл изопропанола) получали оранжевый порошок; 0,33 г (выход: 84%). Продукт характеризовали с помощью ЯМР спектров1H,13C и31P.
1H ЯМР (300 МГц, CDCl3, TMS): δ 8,47 (d, 1 H), 7,44 (dd, 1 H), 7,20-7,28 (m, 2 H), 7,04-7,11 (m, 3 H), 6,99 (d, 1 H), 6,93 (s, 1 H), 6,88 (d, 1 H), 6,81 (s, 1 H), 6,05 (s, 1 H), 3,70-4,07 (m, 4 H), 2,74 (s, 3 H), 2,68 (s, 3 H), 2,38 (s, 3 H), 2,33 (s, 3 H), 2,14 (s, 3 H), 2,02 (s, 3 H), 1,87 (s, 3H), 0,86-1,83 (m, 36 H).
13C ЯМР (75 МГц, CDCl3): δ 294,06, 293,96, 217,16, 216,19, 143,91, 140,11, 139,79, 139,52, 139,39, 138,77, 138,29, 136,94, 136,85, 136,27, 135,69, 134,04, 130,70, 130,01, 129,88, 129,57, 128,94, 128,58, 128,14, 127,25, 127,13, 126,27, 125,30, 125,05, 52,68, 52,64, 52,29, 52,26, 33,09, 32,87, 29,47, 29,24, 27,70, 27,57, 26,20, 21,18, 20,91, 20,32, 20,15, 19,36, 18,97, 18,92, 18,44.
31P ЯМР(121,49 МГц, CDCl3): δ 26,75.
Стадия 2: синтез (S-IMes)(2-[(2-метилфенилимино)метил]-4-нитрофенокси)(3-2-метилфенил-5-метилинден-1-илидена)Ru(II)Cl (2B)

(2A) (2B)
(Simes)(PCy3)Cl2Ru(3-2-метилфенил-5-метилфенилинден-1-илиден) (0,51 ммоля), 2-[(2-метилфенилимино)метил]-4-нитрофенол (0,51 ммоля) и оксид серебра (I) (0,32 ммоля) добавляли в колбу Шленка в атмосфере аргона. Сухой THF (20 мл) переносили в колбу Шленка, а затем нагревали (40°C) и перемешивали в течение 4 ч периода с последующим охлаждением до комнатной температуры. Белый осадок PCy3AgCl (побочный продукт) и избыток AgO2 удаляли фильтрованием. Фильтрат собирали в колбу Шленка и растворитель удаляли выпариванием при пониженном давлении.
Реакционную смесь исследовали на1H и31P ЯМР, который показал количественное превращение в комплекс 2B.
Характеристические значения1H: H-C8: 8,39 ppm (d, 1 H). (в комплексе отсутствовал пик31P ЯМР)
Выделенный твердый осадок предоставлял катализатор с выходом 85%.
Пример 3: (S-IMes)(2-[(2-хлорфенилимино)метил]-4-нитрофенокси) (3-2-метилфенил-5-метилинден-1-илиден)Ru(II)Cl (3A)
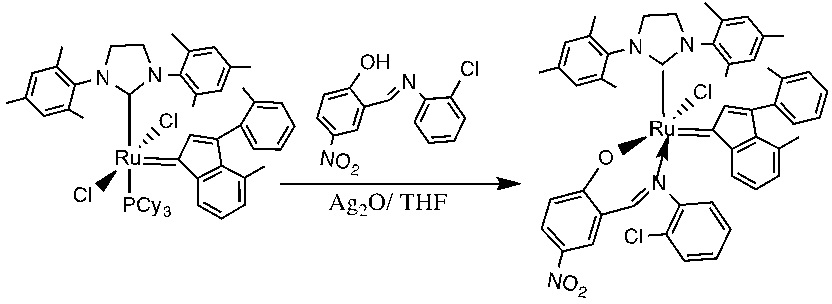
(2A) (3A)
(Simes)(PCy3)Cl2Ru(3-2-метилфенил-5-метилфенилинден-1-илиден) (0,51 ммоля),2-[(2-хлорфенилимино)метил]-4-нитрофенол (0,51 ммоля) и оксид серебра (I) (0,32 ммоля) добавляли в колбу Шленка в атмосфере аргона. Сухой THF (20 мл) переносили в колбу Шленка, а затем нагревали (40°C) и перемешивали в течение 4 ч периода с последующим охлаждением до комнатной температуры. Белый осадок PCy3AgCl (побочный продукт) и избыток AgO2 удаляли фильтрованием. Фильтрат собирали в колбу Шленка и растворитель удаляли выпариванием при пониженном давлении.
Реакционную смесь исследовали на1H и31P ЯМР, который показал количественное превращение в комплекс 3A.
Характеристические значения1H: H-C8: 8,33 ppm (d, 1 H). (в комплексе отсутствовал пик31P ЯМР)
Выделенный твердый осадок предоставлял катализатор с выходом 87%.
Пример 4: Синтез (S-IMes)(2-[(4-бром-2,6-диметилфенилимино)метил]-4-нитрофенокси) (3-2-метилфенил-5-метилинден-1-илидена)Ru(II)Cl (4A)

(2A) (4A)
(Simes)(PCy3)Cl2Ru(3-2-метилфенил-5-метилинден-1-илиден (0,51 ммоля), 2-[(4-бром-2,6-диметилфенилимино)метил]-4-нитрофенол (0,53 ммоля) и оксид серебра (I) (0,32 ммоля) добавляли в колбу Шленка в атмосфере аргона. Сухой THF (20 мл) переносили в колбу Шленка, а затем нагревали (40°C) и перемешивали в течение 4 ч периода с последующим охлаждением до комнатной температуры. Белый осадок PCy3AgCl (побочный продукт) и избыток AgO2 удаляли фильтрованием. Фильтрат собирали в колбу Шленка и растворитель удаляли выпариванием при пониженном давлении.
Реакционную смесь исследовали на1H и31P ЯМР, который показал количественное превращение в комплекс 4A.
Характеристические значения1H: H-C8: 8,45 ppm (d, 1 H). (в комплексе отсутствовал пик31P ЯМР)
Выделенный твердый осадок предоставлял катализатор с выходом 89%.
Пример 5: синтез (S-IMes)(2-[(2,6-диметилфенилимино)метил]-4-нитрофенокси) (3-2-метилфенил-5-метилинден-1-илидена)Ru(II)Cl (5A)
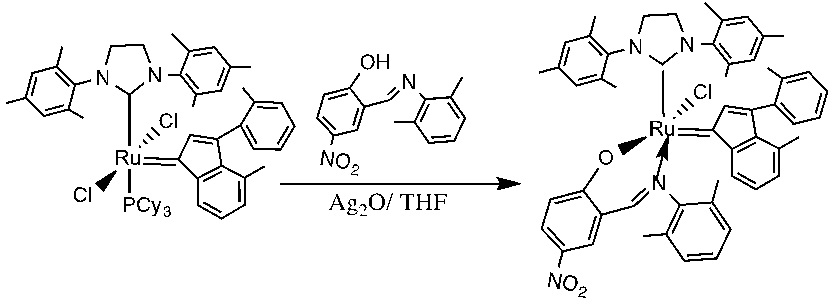
(2A) (5A)
(Simes)(PCy3)Cl2Ru(3-2-метилфенил-5-метилинден-1-илиден (0,51 ммоля), 2-[(2,6-диметилфенилимино)метил]-4-нитрофенол (0,53 ммоля) и оксид серебра (I) (0,32 ммоля) добавляли в колбу Шленка в атмосфере аргона. Сухой THF (20 мл) переносили в колбу Шленка, а затем нагревали (40°C) и перемешивали в течение 4 ч периода с последующим охлаждением до комнатной температуры. Белый осадок PCy3AgCl (побочный продукт) и избыток AgO2 удаляли фильтрованием. Фильтрат собирали в колбу Шленка и растворитель удаляли выпариванием при пониженном давлении.
Реакционную смесь исследовали на1H и31P ЯМР, который показал количественное превращение в комплекс 5A.
Характеристические значения1H: H-C8: 8,87 ppm (d, 1 H). (в комплексе отсутствовал пик31P ЯМР)
Выделенный твердый осадок предоставлял катализатор с выходом 91%.
Пример 6: синтез (S-IMes)(2-[(2,6-диметилфенилимино)метил]фенокси) (3-2-метилфенил-5-метилинден-1-илидена)Ru(II)Cl (6A)

(2A) (6A)
(Simes)(PCy3)Cl2Ru(3-2-метилфенил-5-метилинден-1-илиден (0,51 ммоля), 2-[(2,6-диметилфенилимино)метил]-фенол (0,53 ммоля) и оксид серебра (I) (0,32 ммоля) добавляли в колбу Шленка в атмосфере аргона. Сухой THF (20 мл) переносили в колбу Шленка, а затем нагревали (40°C) и перемешивали в течение 4 ч периода с последующим охлаждением до комнатной температуры. Белый осадок PCy3AgCl (побочный продукт) и избыток AgO2 удаляли фильтрованием. Фильтрат собирали в колбу Шленка и растворитель удаляли выпариванием при пониженном давлении.
Реакционную смесь исследовали на1H и31P ЯМР, который показал количественное превращение в комплекс X6A.
Характеристические значения1H: H-C8: 9,10 ppm (d, 1 H). (в комплексе отсутствовал пик31P ЯМР)
Выделенный твердый осадок предоставлял катализатор с выходом 91%.
Пример 7: синтез (S-IMes)(2-[(2,6-диметилфенилимино)метил]-4-метоксифенокси) (3-2-метилфенил-5-метилинден-1-илидена)Ru(II)Cl (7A)

(2A) (7A)
(Simes)(PCy3)Cl2Ru(3-2-метилфенил-5-метилинден-1-илиден (0,51 ммоля), 2-[(2,6-диметилфенилимино)метил]-4-метоксифенол (0,53 ммоля) и оксид серебра (I) (0,32 ммоля) добавляли в колбу Шленка в атмосфере аргона. Сухой THF (20 мл) переносили в колбу Шленка, а затем нагревали (40°C) и перемешивали в течение 4 ч периода с последующим охлаждением до комнатной температуры. Белый осадок PCy3AgCl (побочный продукт) и избыток AgO2 удаляли фильтрованием. Фильтрат собирали в колбу Шленка и растворитель удаляли выпариванием при пониженном давлении.
Реакционную смесь исследовали на1H и31P ЯМР, который показал количественное превращение в комплекс 7A.
Характеристические значения1H: H-C8: 9,15 ppm (d, 1 H). (в комплексе отсутствовал пик31P ЯМР)
Выделенный твердый осадок предоставлял катализатор с выходом 87%.
Пример 8: синтез (S-IMes)(2-[(пентафторфенилимино)метил]-4-нитрофенокси) (3-2-метилфенил-5-метилинден-1-илидена)Ru(II)Cl (8A)

(2A) (8A)
(Simes)(PCy3)Cl2Ru(3-2-метилфенил-5-метилинден-1-илиден (0,51 ммоля) и 2-[пентафторфенилимино)метил]-4-нитрофенол (0,53 ммоля) и оксид серебра (I) (0,32 ммоля) добавляли в колбу Шленка в атмосфере аргона. Сухой THF (20 мл) переносили в колбу Шленка, а затем нагревали (40°C) и перемешивали в течение 4 ч периода с последующим охлаждением до комнатной температуры. Белый осадок PCy3AgCl (побочный продукт) и избыток AgO2 удаляли фильтрованием. Фильтрат собирали в колбу Шленка и растворитель удаляли выпариванием при пониженном давлении.
Реакционную смесь исследовали на1H и31P ЯМР, который показал количественное превращение в комплекс 8A.
Характеристические значения1H: H-C8: 8,25 ppm (d, 1 H). (в комплексе отсутствовал пик31P ЯМР)
Выделенный твердый осадок предоставлял катализатор с выходом 82%.
Пример 9: синтез (S-IMes)(2-[(3s,5s,7s)-адамантан-1-илиминометил]-4-нитрофенокси)(3-2-метилфенил-5-метилинден-1-илидена)Ru(II)Cl (9A)
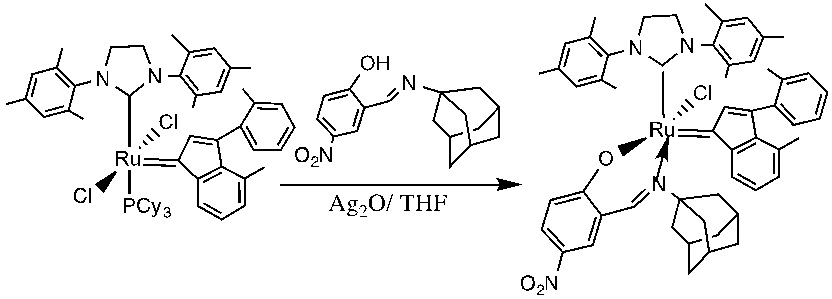
(2A) (9A)
(Simes)(PCy3)Cl2Ru(3-2-метилфенил-5-метилинден-1-илиден (0,51 ммоля), 2-[(3s,5s,7s)-адамантан-1-илиминометил]-4-нитрофенол (0,51 ммоля) и оксид серебра (I) (0,31 ммоля) добавляли в колбу Шленка в атмосфере аргона. Сухой THF (20 мл) переносили в колбу Шленка, а затем нагревали (40°C) и перемешивали в течение 4 ч периода с последующим охлаждением до комнатной температуры. Белый осадок PCy3AgCl (побочный продукт) и избыток AgO2 удаляли фильтрованием. Фильтрат собирали в колбу Шленка и растворитель удаляли выпариванием при пониженном давлении.
Реакционную смесь исследовали на1H и31P ЯМР, который показал количественное превращение в комплекс 9A.
Характеристические значения1H: H-C8: 8,39 ppm (d, 1 H). (в комплексе отсутствовал пик31P ЯМР)
Выделенный твердый осадок предоставлял катализатор с выходом 84%.
Пример 10: синтез (2-[(2-метилфенилимино)метил]-4-нитрофенокси) (3-2-метилфенил-5-метилинден-1-илидена)Ru(II)Cl (10D)
Синтез (PPh3)2Cl2Ru(3-изопропилинден-1-илидена) (10B)

10A

10B
Стадия 1: 1-изопропил-1-фенил-проп-2-ин-1-ол (10A)
Этинилмагния бромид (1,2 экв., 12,7 ммоля, 25,4 мл) (0,5 M в THF) добавляли к (изопропил)(фенил)метанону (1 экв., 10,6 ммоля, 1,57 г) в сухом THF (7 мл). Обеспечивали нагревание полученного в результате раствора с обратным холодильником в течение ночи. Неочищенную смесь гасили добавлением 1 N HCI (15 мл) и разбавляли диэтиловым эфиром. Органический слой отделяли, водный слой дважды экстрагировали диэтиловым эфиром. Органические слои объединяли, сушили над безводным MgSO4, фильтровали и концентрировали под вакуумом. Полученный продукт после колоночной хроматографии (гексан: EtOAc 20:1) представлял собой 1,75 г желтой жидкости, выход 95%.
1H ЯМР (300 МГц, CDCl3): δ 7,61 (dt, 2H), 7,22-7,36 (m, 3H), 2,66 (s, 1H), 2,50 (s, 1H), 2,09 (sept, 1H), 1,06 (d, 3H), 0,81 (d, 3H).
13C ЯМР (75 МГц, CDCl3): δ 143,42, 127,95, 127,74, 126,14, 85,03, 77,07, 74,99, 40,16, 17,90, 17,38.
Стадия 2: (PPh3)2Cl2Ru(3-изопропилинден-1-илиден) (10B):
(PPh3)3RuCl2 (1 экв., 0,575 г, 0,6 ммоля) и 1-(изопропил)-1-фенилпроп-2-ин-1-ол(соединение 18A, 1,5 экв., 0,144 г, 0,9 ммоля) добавляли в 4 мл раствора HCl/диоксана (0,15 моль/л). Раствор нагревали до 90oC в течение 3 часов, после чего растворитель удаляли под вакуумом. В колбу добавляли гексан (20 мл) и твердое вещество удаляли со стенок с помощью ультразвука. Полученную в результате суспензию фильтровали и дважды промывали с использованием гексана (5 мл). Оставшийся растворитель выпаривали с получением красно-коричневого порошка; 0,48 г (выход: 93%). Продукт характеризовали с помощью ЯМР спектра31P.
31P ЯМР (121,49 МГц, CDCl3): δ 29,55.
Стадия 3: Синтез (PCy3)2Cl2Ru(3-i-изопропил-инден-1-илидена) (10C)
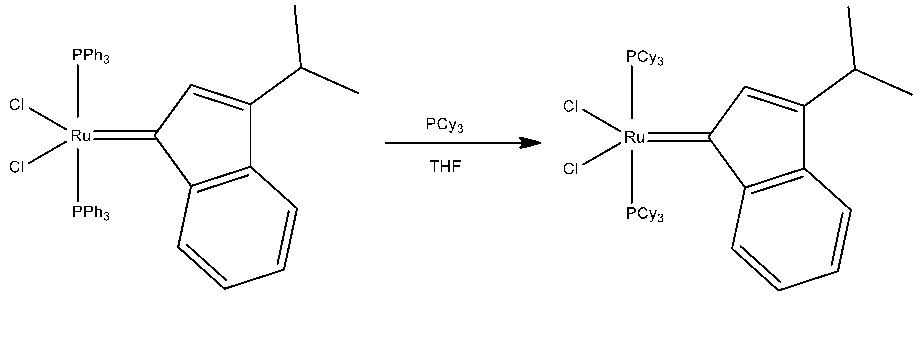
10B 10C
25 мл сосуд заполняли (PPh3)2Cl2Ru(3-изопропил-инден-1-илиденом) (1 экв., 0,4260 г, 0,5 ммоля), трициклогексилфосфином (3 экв., 0,42 г, 1,5 ммоля) и дихлорметаном (10 мл). После завершения реакции (1 час) полученную в результате взвесь сушили под вакуумом и добавляли 20 мл изопропанола. Фильтрацией получали красно-коричневый порошок, который после промывания 5 мл изопропанола (2 x) и сушки под вакуумом давал 0,40 г катализатора (выход: 90%). Продукт характеризовали с помощью ЯМР спектров1H и31P.
Характеристические значения1H и31P: H-C8: 8,57 ppm (d, 1 H) и P: 31,44 ppm.
Стадия 4: синтез (2-[(2-метилфенилимино)метил]-4-нитрофенокси)(3-2-метилфенил-5-метилинден-1-илидена)Ru(II)Cl (10D)
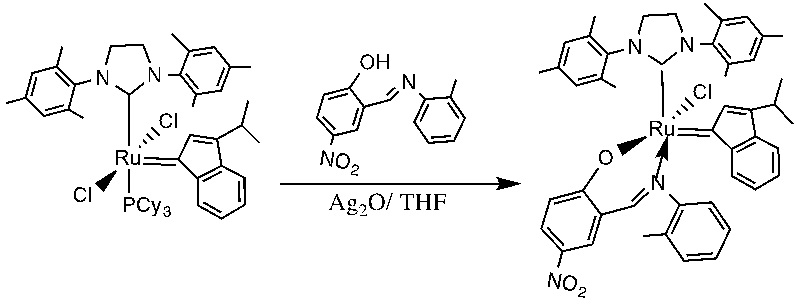
(10C) (10D)
(Simes)(PCy3)Cl2Ru(3-изопропил-инден-1-илиден) (0,50 г, 0,55 ммоля), 2-[(2-метилфенилимино)метил]-4-нитрофенол (0,14 г, 0,55 ммоля) и оксид серебра (I) (0,33 ммоля) добавляли в колбу Шленка в атмосфере аргона. Сухой THF (20 мл) переносили в колбу Шленка, а затем нагревали (40°C) и перемешивали в течение 4 ч периода с последующим охлаждением до комнатной температуры. Белый осадок PCy3AgCl (побочный продукт) и избыток AgO2 удаляли фильтрованием. Фильтрат собирали в колбу Шленка и растворитель удаляли выпариванием при пониженном давлении.
Реакционную смесь исследовали на1H и31P ЯМР, который показал количественное превращение в комплекс 10D.
Характеристические значения1H: H-C8: 8,29 ppm (d, 1 H). (в комплексе отсутствовал пик31P ЯМР)
Выделенный твердый осадок предоставлял катализатор с выходом 84%.
Пример 11: синтез (PCy3)(2-[(1-имидазол-3-пропилимино)метил]-фенокси) (3-2-метилфенил-5-метилинден-1-илидена)Ru(II)Cl (11B)
Стадия 1: синтез (1-имидазол-3-пропилимино)метилфенола (11A)
Салицилальдегид (37,54 ммоля, 4,00 мл), 1-(3-аминопропил)имидазол (37,54 ммоля, 4,50 мл) и 15 мл этилового спирта добавляли в 100 мл колбу и нагревали с обратным холодильником в течение 4 часов. Полученный в результате желтый раствор охлаждали в течение ночи, фильтровали и промывали холодным этанолом (3x1 мл). Выделяли ярко-желтые кристаллы с выходом 90%.
1H ЯМР (300 МГц, CDCl3): δ 13,09 (s, 1H), 8,25 (s, 1H), 7,39 35 (s, 1H), 7,26 (t, J = 7,8 Гц, 1H), 7,18 (d, J = 8,2 Гц, 1H), 7,01 (s, 1H), 6,93–6,79 (m, 3H), 4,00 (t, J = 6,9 Гц, 2H), 3,48 (t, J = 6,5 Гц, 2H), 2,12 (p, J = 6,7 Гц, 2H),13C ЯМР (75 МГц, CDCl3) δ 166,10, 160,90, 137,11, 132,57, 131,42, 129,79, 118,99, 116,98, 40 77,48, 76,64, 55,86, 44,30, 31,78 MS (EI, 70 эВ, отн. интенсивность): 229 (100, M+).
Стадия 2: синтез (PCy3)(2-[(1-имидазол-3-пропилимино)метил]-фенокси) (3-2-метилфенил-5-метилинден-1-илидена)Ru(II)Cl (11B)

(1E) (11B)
(PCy3)2Cl2Ru(3-2-метилфенил-5-метилинден-1-илиден (0,53 ммоля), (1-имидазол-3-пропилимино)метил-фенол (0,53 ммоля), оксид серебра (I) (0,32 ммоля) добавляли в колбу Шленка в атмосфере аргона. Сухой THF (20 мл) переносили в колбу Шленка, а затем нагревали (50°C) и перемешивали в течение 4 ч периода с последующим охлаждением до комнатной температуры. Белый осадок PCy3AgCl (побочный продукт) и избыток AgO2 удаляли фильтрованием. Фильтрат собирали в колбу Шленка и растворитель удаляли выпариванием при пониженном давлении.
Реакционную смесь исследовали на1H и31P ЯМР, который показал количественное превращение в комплекс 11B.
Характеристические значения1H и31P: H-C8: 7,25 ppm (d, 1 H) и P: 36,95 ppm.
Выделенный твердый осадок предоставлял катализатор с выходом 75%.
Пример 12: синтез (S-IMes)(2-[(2-метилфенилимино)метил]фенокси)2(3-2-метилфенил-5-метилинден-1-илидена)Ru(II) (12)
Способ A: Начинали с (Simes)(PCy3)Cl2Ru(3-2-метилфенил-5-метилфенилинден-1-илидена) (2A)

(2A) (12)
(Simes)(PCy3)Cl2Ru(3-2-метилфенил-5-метилфенилинден-1-илиден) (0,51 ммоля), 2-[(2-метилфенилимино)метил]фенол (1,1 ммоля) и оксид серебра (I) (0,65 ммоля) добавляли в колбу Шленка в атмосфере аргона. Сухой THF (20 мл) переносили в колбу Шленка, а затем нагревали (40°C) и перемешивали в течение 5 ч периода с последующим охлаждением до комнатной температуры. Белый осадок PCy3AgCl (побочный продукт) и избыток AgO2 удаляли фильтрованием. Фильтрат собирали в колбу Шленка и растворитель удаляли выпариванием при пониженном давлении. С помощью добавления 2 мл CH2Cl2 и избытка холодного пентана осаждали катализатор в виде темно-красного порошка; выход: 85%.
Реакционную смесь исследовали на1H и31P ЯМР, который показал количественное превращение в комплекс 12.
Характеристические значения1H: H-C8: 8,11 ppm (d, 1 H). (в комплексе отсутствовал пик31P ЯМР)
Ход реакции отслеживали с применением H-ЯМР; на фигуре 1 представлен ход реакции через 1 ч. Очевидно, что это все еще смесь начального Ru-предшественника, дитопного O,N-лиганда, моно-O,N-рутениевого комплекса и бис-O,N-рутениевого комплекса. На фигуре 2 показан ход реакции через 5 ч, подтверждающий завершение реакции.
Способ B: начинали с (SIMes)(2-[(2-метилфенилимино)метил]фенокси) (3-2-метилфенил-5-метилинден-1-илидена)Ru(II)Cl

(12)
(SIMes)(2-[(2-метилфенилимино)метил]фенокси) (3-2-метилфенил-5-метилинден-1-илиден)Ru(II)Cl (0,51 ммоля), 2-[(2-метилфенилимино)метил]фенол (0,52 ммоля) и оксид серебра (I) (0,32 ммоля) добавляли в колбу Шленка в атмосфере аргона. Сухой THF (20 мл) переносили в колбу Шленка, а затем нагревали (40°C) и перемешивали в течение 5 ч периода с последующим охлаждением до комнатной температуры. Белый осадок PCy3AgCl (побочный продукт) и избыток AgO2 удаляли фильтрованием. Фильтрат собирали в колбу Шленка и растворитель удаляли выпариванием при пониженном давлении. С помощью добавления 2 мл CH2Cl2 и избытка холодного пентана осаждали катализатор в виде темно-красного порошка; выход: 85%.
Реакционную смесь исследовали на1H и31P ЯМР, который показал количественное превращение в комплекс 12.
Характеристические значения1H: H-C8: 8,11 ppm (d, 1 H). (в комплексе отсутствовал пик31P ЯМР)
Характеристики катализаторов по настоящему изобретению
Пример 13: сравнение коммерчески доступного катализатора (N) с катализаторами по настоящему изобретению 5A, 6A и 7A в отношении RCM DEDAM с применением активацииa
На фигуре 3 показано сравнение коммерческих катализаторов N и 5A, 6A и 7A касательно метатезиса с замыканием кольца диэтилдиаллилмалоната (DEDAM) с применением активации (aс применением катализатора N и химически активированных 5A, 6A и 7A 0,5 мол.%, 20 экв. PhSiCl3, загрузка субстрата: 0,41 ммоля DEDAM, температура: 20°C, растворитель: 0,60 мл CDCl3, степень превращения определяли с помощью1H ЯМР).
После химической активации комплексы 6A и 7A значительно превосходят коммерческий комплекс N при температуре окружающей среды.
Пример 14: Эффект загрузки катализатора, сравнение коммерчески доступного катализатора (N) с впервые разработанными катализаторами 5A, 6A и 7A в отношении RCM DEDAM после активации.
На фигуре 4 показано сравнение катализаторов F и 5A-7A при загрузке 0,1 мол.% в отношении RCM DEDAM (aс применением катализатора F и химически активированных 5A–7A 0,1 мол.%, 10 экв. PhSiCl3, загрузка субстрата: 0,41 ммоля DEDAM, температура: 20°C, растворитель: 0,60 мл CDCl3, степень превращения определяли с помощью1H ЯМР).
При меньших загрузках катализатора срок службы катализатора становится все более важным. Все описанные в данном документе катализаторы, содержащие Шиффово основание, при активации PhSiCl3 давали количественный выход RCM DEDAM с загрузкой катализатора 0,1 мол.% в CDCl3 при комнатной температуре, за исключением 5A, для которого требуется температура 60°C. Во всех случаях характеристики салицилальдиминовых систем 5A-7A являются лучше, чем у коммерчески доступного комплекса F.
Пример 15: сравнение коммерчески доступных катализаторов (N) с впервые разработанным катализатором в отношении RCM DEDAM в протонном растворителе MeOH при 50°C
Таблица 1: сравнение TON (число оборотов) известных катализаторов и катализатора по настоящему изобретению
a: TON = число оборотов; RCM DEDAM с применением 0,5 мол.% катализатора в MeOH-d4 при 50°C
Пример 16: сравнение коммерчески доступных катализаторов и катализатора по настоящему изобретению в отношении RCM DEDAM-2

RCM DEDAM2 (диэтилдиметилаллилмалонат)
Хорошо известно, что DEDAM-2 является проблематичным субстратом для замыкания кольца, поскольку он несет метильную группу на каждой двойной связи, что вводит серьезное стерическое затруднение для катализатора.
Таблица 2: сравнение катализаторов касательно субстратного противопоказания DEDAM-2
aСтепень превращения, полученная посредством1H ЯМР.b Выполнено в толуоле.c Выполнено в CD2Cl2, данные по ссылке (Organometallics 2006, 25, 5740).d Выполнено в C6D6, данные по ссылке (Org. Lett. 2007, 9, 1589)*: Катализатор готовили согласно описанию 4A, за исключением того, что в качестве дитопного лиганда применяли2-[(2,6-диизопропилфенилимино)метил]-4-нитрофенол. ** Катализатор готовили согласно описанию 4A, за исключением того, что в качестве дитопного лиганда применяли2-[(2,4,6-триметилфенилимино)метил]фенол.
Катализаторы по настоящему изобретению показали 100% превращение при загрузке 5 мол.%. Уменьшение загрузки катализатора до 0,5 мол.% приводит к TON 136 в случае 13 и 110 в случае 14. Эти результаты превосходят прежнее самое высокое TON 38 в случае Мод. H2 (модифицированного катализатора Ховейды) и представляют собой 20-кратное увеличение по сравнению со стандартным катализатором Граббса 2го поколения. Поэтому, 13 и 14 представляют собой отличное решение «основной проблемы разработки новых более эффективных катализаторов».
Пример 17: Влияние количества активатора на характеристики катализатора 6A по настоящему изобретению касательно RCM DEDAM

RCM DEDAM (диэтилдиаллилмалонат)
Условия: 0,5 мол.% катализатора, переменная величина - экв. PhSiCl3, загрузка субстрата: 0,41 ммоля DEDAM, температура: 20°C, растворитель: 0,60 мл CDCl3, степень превращения определяли с помощью1H ЯМР.
На фигуре 5 показано влияние количества активатора (сверху вниз количество уменьшается от 50 экв. до 0,5 экв. PhSiCl3) на каталитические характеристики касательно RCM DEDAM.
Очевидно, что для активации катализаторов по настоящему изобретению избыток активатора больше не требуется, и они безусловно превосходят системы, описанные в EP 1577282; EP 1757613. Более того, избыток активатора не сразу разрушает катализатор, демонстрируя устойчивость систем.
Пример 18: Контролирование метатезисной полимеризации с раскрытием кольца (ROMP) дициклопентадиена (DCPD)
Необходимое количество катализатора растворяли в минимальном количестве дихлорметана (CH2Cl2), а затем добавляли к 80 г DCPD, который содержит необходимое количество активатора (в данном документе применяли PhSiCl3). Смесь перемешивали и реакцию полимеризации контролировали как функцию времени, начиная с 20°C, с помощью термопары, которую помещали в реакционную смесь для сбора данных по температуре. Катализатор/DCPD: 1/60000.
Применяли катализаторы 4A, 8A, 9A и 12. Для катализатора 4A и 8A соотношение катализатор/активатор = 1/5, притом, что для 9A и 12 соотношение катализатор/активатор = 1/0,5.
На фигуре 6 показана ROMP DCPD с применением катализатора 4A, 8A, 9A и 12 по настоящему изобретению.
Рутениевые катализаторы Verpoort (WO 03/062253) и Telene (WO 2011/009721 A1), содержащие один и два бидентатных лиганда класса Шиффовых оснований, соответственно, применяли в качестве эталонного катализатора; смотри таблицу 3.


Verpoort (VP) Telene (T)
Очевидно, что катализаторы по настоящему изобретению превосходят катализаторы, описанные в WO 2011009721 и (WO 03/062253; Tetrahedron Lett.,2002, 43, 9101-9104; (b) J. Mol. Catal. A: Chern.,2006, 260, 221-226; (c) J. Organomet. Chem., 2006, 691, 5482-5486).
Введение дополнительных групп, заместителей на инденилиденовую часть катализаторов, приводит в результате к большему стерическому напряжению в молекуле, что способствует инициации катализатора после его активации.
Таблица 3: сравнение существующего катализатора (T и VP) и катализаторов по настоящему изобретению (4A,8A, 9A и 12) касательно ROMP DCPD
* только для справки
Все катализаторы по настоящему изобретению показали отличную латентность в отношении DCPD (в случае 9A удовлетворительную латентность), они неактивны при комнатной температуре. Все катализаторы по настоящему изобретению показали улучшенную стабильность и являются лучше других катализаторов, применяемых в качестве эталона (T и VP), смотри таблицу 3.
После химической активации катализатор I-I типа, например 12 и 9A, согласно настоящему изобретению, демонстрирует повышенную инициацию по сравнению с эталонным катализатором (T и VP), поскольку ему требуется всего-навсего меньше 1 эквивалента PhSiCI3 для образования высокоактивной системы. Если ROMP DCPD катализируется химически активированным комплексом VP (эталонным), то при таких же условиях (меньше 1 эквивалента PhSiCI3) наблюдали низкую каталитическую активность.
Более того, соотношение катализатор/мономер увеличивается на 66% по сравнению с эталонными катализаторами (T и VP), лучшие характеристики которых безусловно уступают характеристикам катализаторов по настоящему изобретению.
Пример 19: Контролирование метатезисной полимеризации с раскрытием кольца (ROMP) циклооктадиена (COD)

После заполнения трубки для ЯМР соответствующим количеством катализатора, растворенного в дейтерированном растворителе (CDCl3), добавляли COD. Реакцию полимеризации контролировали как функцию времени при 20°C путем интегрирования1H-сигналов олефинов образованного полимера (5,38-4,44 ppm) и расходуемого мономера (5,58 ppm).
Катализатор/COD: 1/3000, концентрация катализатора: 0,452 мM.
Tаблица 4. ROMP COD (3000 эквив.)
a Условия: Концентрация катализатора: 0,453 мМ, растворитель: CDCl3, температура: 20°C, степень превращения определяли с помощью1H ЯМР.b Процент олефинов с цис-конфигурацией в основной цепи полимера; соотношение мономер/катализатор на основе данных ЯМР спектров1H и13C (ЯМР-спектроскопия13C: δ = 32,9 ppm у аллильного углерода в транс-конфигурации; δ = 27,6 ppm у аллильного углерода в цис-конфигурацииc, см., Nature 2007, 450, 243-251d) равняется 300.
Катализаторы по настоящему изобретению являются лучшими по сравнению с другими катализаторами, при этом полученное TON по меньшей мере в 2 раза выше по сравнению с катализатором VP и еще в 6 раз выше или более по сравнению с другими катализаторами.
Пример 20: Активация in-situ с применением TiCl4/iPrOH катализатора 4A касательно ROMP дициклопентадиена (DCPD).
Данный пример демонстрирует возможность активации in-situ катализаторов по настоящему изобретению. В данной ситуации 40 г DCPD, в котором присутствует TiCl4, смешивали с 40 г DCPD, в котором присутствовали iPrOH и катализатор. Чтобы проследить за повышением температуры во всей смеси DCPD (80 г) в ходе полимеризации, помещали термопару. Из графика следует, что все мономеры подвергались превращению, как только температура поднималась до 200°C. Соотношение DCPD/катализатор/кислота Льюиса-спирт = 30000/1/10-10 и 30000/1/5-5.
На фигуре 7 показана ROMP DCPD с применением активации in-situ катализатора 4A.
Такие отличные результаты подтверждают, что все виды комбинаций между кислотами Льюиса и молекулами RYH можно применять для активации in-situ катализаторов по настоящему изобретению, указанных в описании.
Пример 21: Удаление оставшегося рутения (11B) из реакционной смеси.
После применений RCM или кросс-метатезиса, чтобы удалить из конечных продуктов метатезиса оставшийся рутений, реакционные смеси пропускали через силикагель (3 г на 0,006 ммоля катализатора 11B) с разными элюентами (см. таблицу 5). Силикагель также можно вводить непосредственно в реакционную смесь. Полное обесцвечивание наблюдали в течение 10 минут интенсивного перемешивания. Содержание рутения в некоторых выбранных продуктах метатезиса определяли с помощью анализа ICP-MS. С помощью применения обычного фильтрования через силикагель содержание рутения в продуктах с начальным содержанием рутения в 500 ppm понижалось до 1 ppm.
Таблица 5: оставшийся рутений из реакционных смесей после колоночной хроматографии.
Пример 22: Кросс-метатезис FAME (сложных метиловых эфиров жирной кислоты) с применением катализатора 4A
50 мл смеси сложного метилового эфира (состоит из 92,0% метилолеата и 2,9% метиллинолеата; процентные содержания указаны, исходя из метода калиброванной GC) в присутствии 150 ppm катализатора (4A) нагревали при 50°C в течение 1 часа. После завершения реакции получили 27% сложного диметилового эфира и 24% 9-октадецена.
Реферат
Настоящее изобретение относится к катализаторам на основе переходного металла 8 группы для метатезиса олефинов, способам синтеза катализаторов, способам активации катализатора, к их применению в разных способах метатезиса олефинов, например метатезиса с замыканием кольца (RCM), кросс-метатезиса (СМ), метатезиса с раскрытием кольца (ROM), метатезисной полимеризации с раскрытием кольца (ROMP), самометатезиса, реакции алкенов с алкинами, и к способу получения альфа-олефина, который включает приведение в контакт сложного эфира ненасыщенной жирной кислоты и/или алкилового сложного эфира ненасыщенной жирной кислоты с алкеном и катализаторами, где полученный альфа-олефин содержит по меньшей мере на один атом углерода больше, чем алкен. Катализаторы характеризуются общими структурами формул (I), (II) или (VII), где значения радикалов указаны в формуле изобретения. Технический результат – улучшение эффективности катализатора в различных реакциях метатезиса олефинов. 9 н. и 26 з.п. ф-лы, 7 фиг., 5 табл., 22 пр.
Формула


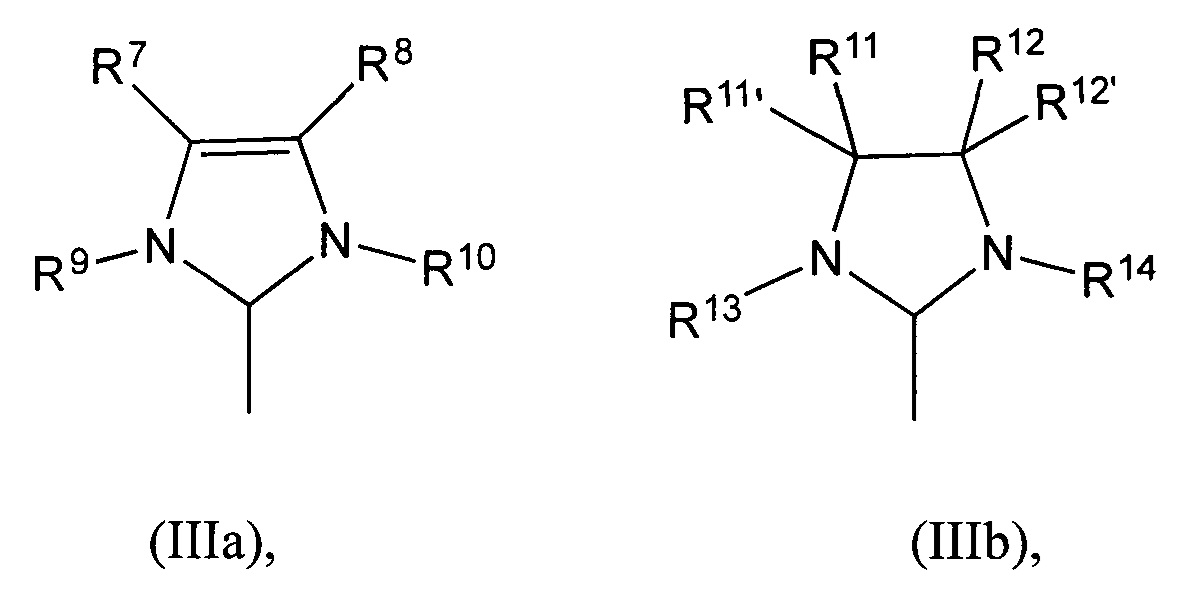
















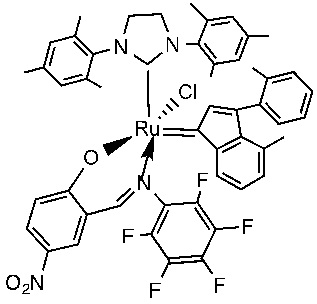


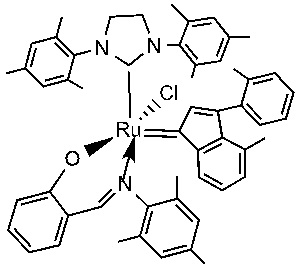




Комментарии