Способ регенерации азота и фосфора из сточных вод осаждением их ионов в форме струвита - RU2756807C1
Код документа: RU2756807C1
Чертежи
Описание
Изобретение относится к химической технологи утилизации отходов на основе принципа рецикла азота и фосфора с получением гексагадрата магнийаммонийфосфата.
Регенерация азота и фосфора из сточных вод осаждением их ионов - NH4+ и PO43- в форме струвита (гексагидрата магнийаммонийфосфата, MgNH4PO4 6H2O), являющегося комплексным удобрением пролонгированного действия, позволяет возвращать регенерированные биогенные элементы в виде удобрения в природный круговорот веществ, а также способствовать решению проблемы предотвращения эвтрофикации природных водоемов за счет удаления азота и фосфора из промышленных и сельскохозяйственных стоков.
Известные способы решения задачи осаждения ионов NH4+ и PO43- из сточных вод в форме струвита представлены в следующих патентах.
Известен способ получения гранулированного карбамида, включающего в качестве модификатора магнийаммонийфосфата, полученного при очистке сточных вод от фосфат-ионов (см. патент РФ, RU №2 285 684 C1, С05С 9/00, B01j/2/28, 09.06.2005).
Недостатками известного способа является то, что он не предусматривает совместное извлечение ионов NH4+и PO43- из сточной воды и, допуская изменение содержания ингредиентов в составе осадка струвита в очень широких пределах (вес, %): MgO от 4,9 до 29,4; P2O5 от 8,7 до 51,7; NH3 от 2,1 до 12,4; H2O - остальное, он не дает рекомендаций по достижению высокого содержания питательных элементов в струвите как удобрении.
Известен способ получения фосфата из фосфорсодержащих сточных вод по технологии осаждения струвита (см. патент Китая, CN 102 690000 А, 11.05.2012). Предназначен для извлечения ионов РО43- из сточных вод при отсутствии в них ионов Mg2+и NH4+. Поэтому для осаждения струвита в сточную воду дополнительно вводится необходимое количество магния в виде MgCl2 и необходимое количество азота - в виде NH4Cl. В сточной воде устанавливается молярное соотношение Mg: N: Р, которое при разных вариантах осуществления способа составляет: 1,2:1,1:1; 1,5:1:1; 1:1,5:1; 1,3:1,2:1, и рН устанавливают на уровне 8,2. Лучшие результаты по снижению остаточной концентрации фосфора в сточной воде получены при введении в нее избытка как ионов Mg2+ так и ионов NH4+ по отношению к РО43-, участвующему в образовании струвита.
Недостатком известного способа является его применение только для регенерации фосфора из фосфорсодержащих сточных вод и необходимость для наиболее полного извлечения ионов РО43- обязательно вводить в сточную воду достаточно высокий избыток ионов NH4+, сточная вода после очистки сохраняет избыточные ионы NH4+, что нецелесообразно при решении задачи предотвращения эвтрофикации водоемов.
Известен способ переработки аммиачно-азотных сточных вод с получением струвита (см. патент Китая, CN 103 848540 А, 10.01.2014). Предназначен для извлечения ионов NH4+ из сточной воды, которая не содержит ионы Mg2+ и PO43-, эти ионы дополнительно вводят в сточную воду в количествах, необходимых для образования струвита. В одном из вариантов применения способа предусмотрено в качестве источников магния и фосфора использовать соответственно MgO и Н3РО4. В других вариантах - MgCl2 и Na2HPO4 или NaH2PO4. Мольные соотношения Mg : N : Р в сточной воде при осаждении струвита устанавливали равными 1:1:1; 1,2:1:1; 1,2:1:0,8 и 1,4:1:0,8, и рН в сточной воде поднимали с помощью NaOH от 7,4 (иногда ниже) до 8,5.
Результаты по степени извлечения ионов NH4+ из сточных вод самые низкие оказались в варианте с MgO и H3PO4 - только 70%. В других вариантах с использованием MgCl2 и Na2HPO4 или NaH2PO4, в порядке выше перечисленных соотношений Mg : N : Р, степень извлечения ионов NH4+ составила (%): 86, 89, 95-96 и 94. Самое высокое из них значение получено при отношении Mg : N : Р 1,2:1:0,8 и рН 9,2. Степень извлечения ионов NH4+ оказалась в сильно выраженной зависимости от исходной концентрации ионов аммония в сточной воде, что подтверждается следующими экспериментальными данными согласно известному патенту:
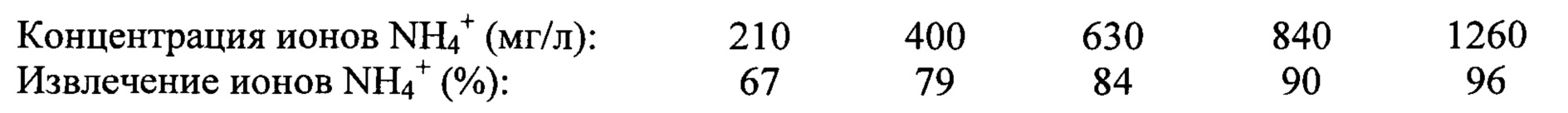
Соответственно, чем ниже содержание ионов NH4+, тем труднее и в меньшей степени происходит их выделение из сточной воды. Такой результат является существенным недостатком известного способа, так как большинство типов сточных вод имеют содержание ионов аммония ниже 500 мг/л. Известный способ не предусматривает одновременное извлечение ионов NH4+ и РО43- из сточных вод.
Известен способ получения композиции удобрений, обеспечивающей медленное (за счет струвита) и быстрое (за счет моноаммонийфосфата) высвобождение фосфора, а также и других необходимых для питания растений веществ и микроэлементов (см. патент США, US 2016/0130191 А1 05.12.2016). Получение композиции основывается на включении в ее состав струвита, образующегося при очистке сточных вод. За счет струвита композиция становится устойчивым источником фосфора на весь период вегетации растений, но по причине умеренной растворимости струвита предотвращается «обжигание» корней растений и сокращаются потери Mg, N и Р из почвы под действием дождей, поливов. Обнаружено также благоприятное влияние магния - повышение эффективности поглощения фосфора из почвы растениями.
Недостатком известного изобретения является ограниченность характеристики состава струвита, как продукта осаждения из сточных вод, представленной лишь ссылкой на его химическую формулу, и при этом не раскрываются условия, которые могут обеспечить образование в сточной воде струвита с составом, близким к его стехиометрии, и не приводятся остаточные концентрации ионов NH4+ и РО43- в сточной воде после осаждения струвита, и не показана степень их извлечения из сточной воды при осаждении струвита.
Наиболее близким способом того же назначения к заявленному изобретению по совокупности признаков является способ регенерации азота и фосфора в форме струвита из сточной воды производства полупроводников (см. публикацию: Warmadewanthi, J.С. Liu. Recovery of phosphate and ammonium as struvite from semiconductor wastewater. Separation and purification technology, - 2009, vol. 64, p. 368-373). Известный и предлагаемый способы предназначаются для одновременного извлечения ионов NH4+ и РО43- из сточных вод путем осаждения их в форме струвита, который является комплексным удобрением пролонгированного действия, и его последующее использование по назначению позволяет осуществить рецикл азота и фосфора и внести вклад в экономию энергетических и минеральных ресурсов. К тому же, удаление биогенных элементов (N и Р) из сточных вод способствует предотвращению эвтрофикации водоемов. Исходя из одного и того же назначения известный способ выбран в качестве прототипа.
Основные недостатки известного способа, принятого за прототип, сводятся к следующему. В известном способе не удалось решить задачу выбора условий, обеспечивающих достаточно полное извлечение ионов NH4+ и РО43- из сточной воды при их одновременном осаждении в форме струвита. Так, эффективность извлечения ионов РО43- возрастает в последовательности повышения рН: 48,7% при рН 8, 84,2% при рН 9 и 93,2% при рН 10. Однако повышение рН, по крайней мере выше 8, приводит к снижению степени извлечения ионов NH4+ из сточной воды. Например, при рН 9 степень извлечении ионов NH4+ составляет лишь 33,5%.
Другой недостаток. При осаждении струвита желательно иметь молярное соотношение [Mg2+] : [NH4+] : [РО43-] в сточной воде, близким стехиометрическому в составе струвита. Но такое соотношение ионов при использовании способа согласно прототипу оказалось малоэффективным, что потребовало введения в сточную воду достаточно большого избытка ионов Mg2+ и/или NH4+ против содержания в виде ионов РО43-. Так, при отношениях [Mg2+] : [РО43-], равных 1:1 и 2:1, степень извлечения ионов NH4+ из сточной воды достигла лишь 1,9% и 40% соответственно. Показано, что увеличение отношений [NH4+] : [PO43-] в сточной воде от 4,8:1 до 15:1 повышает степень извлечения ионов PO43- до 92,5%. Поскольку избыток в сточной воде любого иона, входящего в состав струвита, делает неизбежным его накопление в форме остаточной концентрации после осаждения струвита, такой путь повышения эффективности извлечения ионов РО43- или NH4+ представляется нецелесообразным с позиции экологии и экономики.
Признаки прототипа, совпадающие с признаками заявленного решения:
• осаждение струвита проводят непосредственно в сточной воде;
• при этом решается задача приблизить отношение [Mg2+] : [NH4+] : [РО43-] в сточной воде к 1:1:1, которое соответствует стехиометрии этих ионов в составе струвита;
• поддержание оптимального для осаждения струвита интервала рН от 8,0 до 9,5;
• выполнение осаждения струвита путем введения в сточную воду дополнительно ионов тех элементов, содержание которых недостаточно для образования гексагидрата магнийаммонийфосфата;
• в случае необходимости проводят предподготовку сточной воды с учетом особенностей ее состава.
Задача заявленного способа - повысить степень извлечения ионов NH4+ и РО43- из сточных вод при одновременном осаждении ионов аммония и фосфата в форме струвита, включая использование способа при осаждении струвита из сточных вод с разной концентрацией ионов NH4+, в том числе, относительно низких, и при установлении в сточной воде молярного отношения [Mg2+] : [NH4+] : [РО43-], близкого к стехиометрическому в составе струвита, то есть не прибегая при осаждении струвита к значительным избыткам относительно друг к другу ионов элементов, входящих в его состав, обеспечить при этом наиболее полное насыщение струвита ионами NH4+, не допуская появления в составе осажденного продукта примеси других фаз кроме струвита.
Поставленная задача была решена за счет того, что в известном способе регенерации азота и фосфора из сточных вод осаждением их ионов в форме струвита, включающем осаждение струвита непосредственно в сточной воде при исходном молярном отношении [Mg2+] : [NH4+] : [РО43-], близким стехиометрическому составу струвита, при рН сточной воды в диапазоне от 8,0 до 9,5, путем введения в сточную воду дополнительных ионов тех элементов, содержание которых недостаточно для образования струвита, в случае необходимости проводят предподготовку сточной воды с учетом особенностей ее состава, согласно изобретению недостающие для образования струвита ионы Mg2+ и РО43- вводят в сточную воду в виде промежуточного продукта, который получают смешением высококонцентрированных растворов, а именно раствора соли магния, используя растворимую соль магния, например, хлорид или сульфат в количестве, позволяющем получать в сточной воде молярное отношение Mg2+/NH4+ от 1,1 до 1,2, и раствора фосфатов натрия или калия, включая Na3PO4 или K3PO4 и Na2HPO4 или K2HPO4 в таком количестве и соотношении, которые позволяют устанавливать в сточной воде рН в диапазоне, рекомендованном для осаждения струвита, и молярное отношение РО43-/NH4+ близкое 1,0, растворы солей смешивают и используют для получения промежуточного продукта при температуре от 25 до 70°С, общее содержание солей в расчете на массу безводных солей и воды в расчете на массу добавленной воды и воды кристаллогидратов при приготовлении промежуточного продукта характеризуется массовым отношением соли : вода в интервале от 1:3,2 до 1:8,7, полученные растворы смешивают при интенсивном перемешивании в течение 1-2 мин для приготовления промежуточного продукта и полученный промежуточный продукт, и непосредственно после приготовления вводят в сточную воду при ее перемешивании, что вызывает образование струвита, полученную суспензию перемешивают в течение 15-20 мин, отстаивают осадок в течение 20-30 мин и осветленную воду отделяют от осадка декантацией.
В качестве растворов фосфатов натрия или калия используют раствор продуктов нейтрализации фосфорной кислоты, который получают в ходе приготовления промежуточного продукта, используя для нейтрализации в количестве до 3 моль NaOH или KOH на 1 моль H3PO4, или используя 1 моль Na2CO3 или K2CO3 на 1 моль H3PO4 и до 1 моль NaOH или KOH на 1 моль H3PO4, нейтрализацию проводят при 45 - 70°С в течение 60 мин.
Признаки предлагаемого способа, отличительные от прототипа: использование для осаждения струвита в сточной воде промежуточного продукта, включающего недостающие для осаждения струвита ионы Mg2+и РО43-, который получают смешением в определенных соотношениях высококонцентрированных растворов солей и воды, а именно: раствора соли магния, используя растворимую соль магния, например, хлорид или сульфат, и раствора фосфатов натрия или калия, или фосфорной кислоты, нейтрализованной гидроксидом натрия или последовательно карбонатом натрия и далее - гидроксидом натрия. Для нейтрализации фосфорной кислоты возможно использование калиевых аналогов - K2CO3 и KOH, если это требуется для получения комплексного удобрения на основе струвита.
При получении промежуточного продукта необходимо соблюдать ограничения по количеству используемой воды. Поэтому высококонцентрированные растворы солей магния и фосфата получают при температурах 25-70°С и отношении по массе между солями (в расчете на безводные соли) и водой (в расчете на воду кристаллогидратов и добавленную воду), которое допустимо в пределах от 1: 3,2 до 1: 8,7. Увеличение температуры выше 25(способствует лучшей растворимости солей при меньших допустимых значениях доли воды в смеси. Но количество воды меньшее, чем рекомендовано в этом диапазоне,, ограничивает возможность растворения солей, и поэтому не рекомендуется, но верхний предел по количеству воды ограничен более строго, так как избыток воды приводит к понижению активности промежуточного продукта при осаждении струвита. Полученные растворы смешивают при интенсивном перемешивании (при скорости вращения мешалки до 600 об/мин) в течение 1-2 мин, смесь приобретает некоторую вязкость, и полученный продукт после смешения готов для введения в сточную воду. Его вводят в сточную воду для осаждения струвита непосредственно после приготовления.
Согласно заявленному способу предусмотрена возможность замены при получении промежуточного продукта источников ионов Mg2+ и ионов РО43- на более дешевые и доступные реагенты, а именно: реактива MgCl2⋅6H2O на природный минерал бишофит, основным компонентом которого является гексагидрат хлорида магния, но возможны примеси и отклонения по составу кристаллизационной воды, и солей Na3PO4⋅12H2O и Na2HPO4⋅12H2O экстракционной 68%-ной фосфорной кислотой, нейтрализованной с помощью Na2CO3 и NaOH с образованием солей Na3PO4⋅12H2O и Na2HPO4⋅12H2O в заданном соотношении. При необходимости нейтрализацию Н3РО4 можно проводить с помощью K2CO3 и KOH.
Как показали примеры осуществления заявляемого способа, замена реактива MgCl2⋅6H2O бишофитом практически не влияет на его эффективность как источника ионов Mg2+ при осаждении струвита из сточной воды при условии контроля фактического содержания в этом материале ионов Mg2+.
Подтвердилась также возможность замены готовых фосфатов натрия на продукты нейтрализации Н3РО4. Использованы два варианта нейтрализации фосфорной кислоты: в первом для нейтрализации 1 моль Н3РО4 расходовали до 3 моль NaOH, и, во втором, нейтрализацию проводили в две стадии - на первой расходовали 1 моль Na2CO3 и на второй - использовали дополнительно до 1 моль NaOH, при нейтрализации поддерживали температуру 45-70°С, общая продолжительность операции до 60 минут при умеренном перемешивании смесей. В большинстве случаев в качестве продукта необходима смесь солей Na3PO4 и Na2HPO4 и поэтому не требуется проводить полную нейтрализацию Н3РО4. Уместно отметить, что согласно предлагаемому способу полученные при нейтрализации фосфаты натрия нет необходимости выделять в индивидуальном виде - они так и остаются в промежуточном продукте.
Используемые для приготовления промежуточного продукта компоненты, значения массовых отношений солей и воды в составе промежуточного продукта и результаты выделения ионов NH4+ из сточной воды при использовании полученных образцов промежуточного продукта в расчете на 1 л сточной воды представлены в таблице 1.
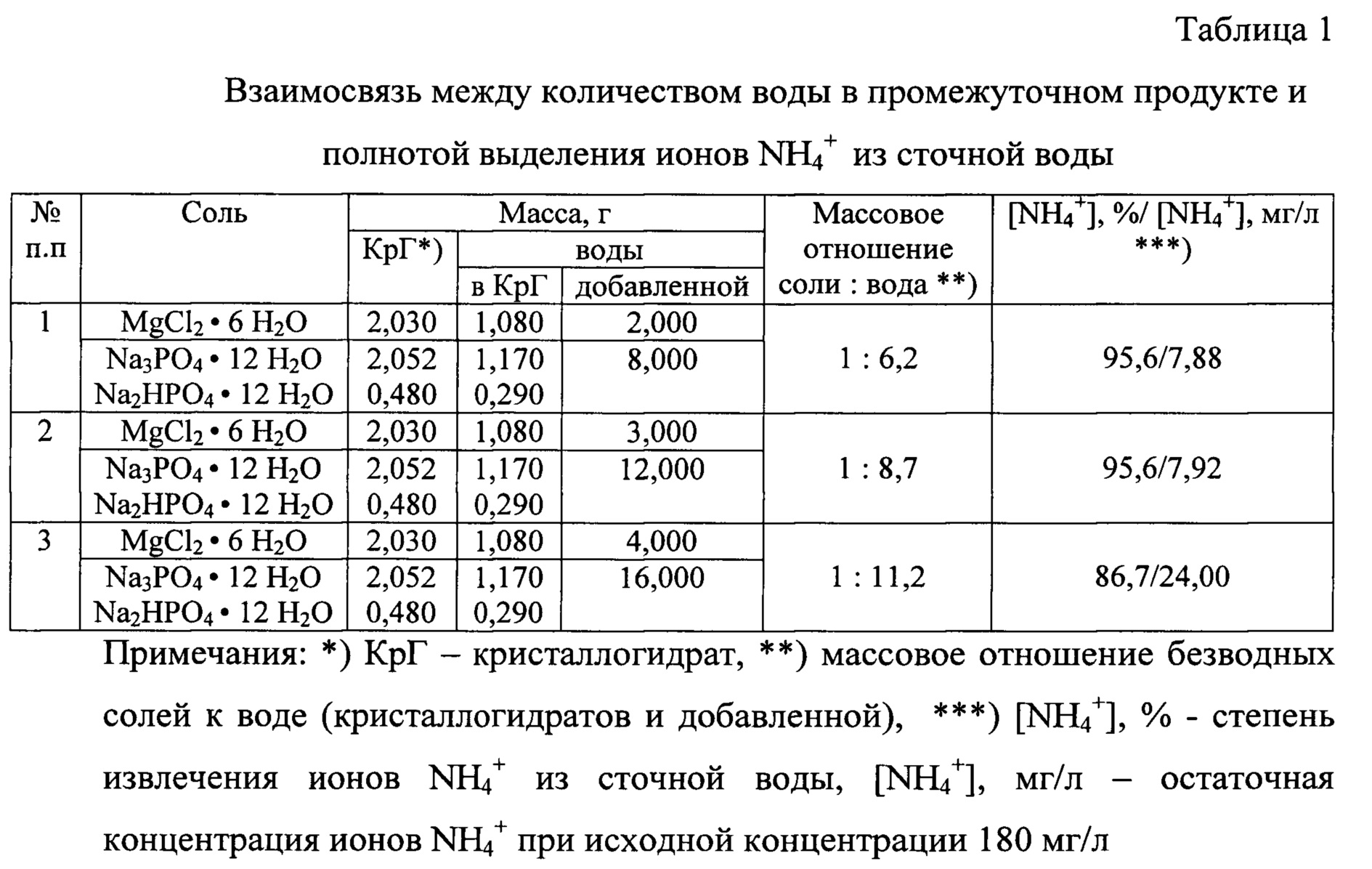
Полученные данные подтверждают, что нижний предел по содержанию воды в промежуточном продукте строго не ограничен и определяется лишь способностью солей растворяться, и возможностью снижения излишней вязкости полученного продукта, однако превышение верхнего предела по содержанию воды, соответствующего массовому отношению безводные соли : вода, равному 1:8,7, приводит к снижению активности промежуточного продукта при осаждении ионов NH4+ из сточной воды в форме струвита.
Проведена проверка также результатов выделения ионов NH4+ из сточной воды при использовании двух вариантов нейтрализации фосфорной кислоты: в первом, для нейтрализации 1 моль Н3РО4 использовали до 3 моль NaOH, и, во втором, нейтрализацию Н3РО4 осуществляли в две стадии - использовали Na2CO3 в количестве 1 моль Н3РО4 на первой стадии и до 1 моль NaOH на второй, при нейтрализации поддерживали температуру 45-70°С, продолжительность операции до 60 минут при умеренном перемешивании. Расход NaOH на нейтрализацию и, следовательно, требуемая степень нейтрализации Н3РО4 зависит от рН сточной воды.
При разработке способа с использованием двух вариантов нейтрализации Н3РО4 проверялось также, как может отразиться на результаты процесса очистки сточной воды значение исходной концентрации в ней ионов NH4+, которое приняли равным 180 мг/л в первом варианте и 540 мг/л во втором. Соответственно использовали разные количества MgCl2⋅6H2O в расчете на 1 л воды: 2,003 г и 6,090 г, при этом в обоих вариантах при осаждении струвита в сточной воде получили соотношение [Mg2+] : [NH4+] : [РО43-], близкое 1:1:1. Полученные данные, отнесенные к обработке 1 л сточной воды, представлены в таблице 2.
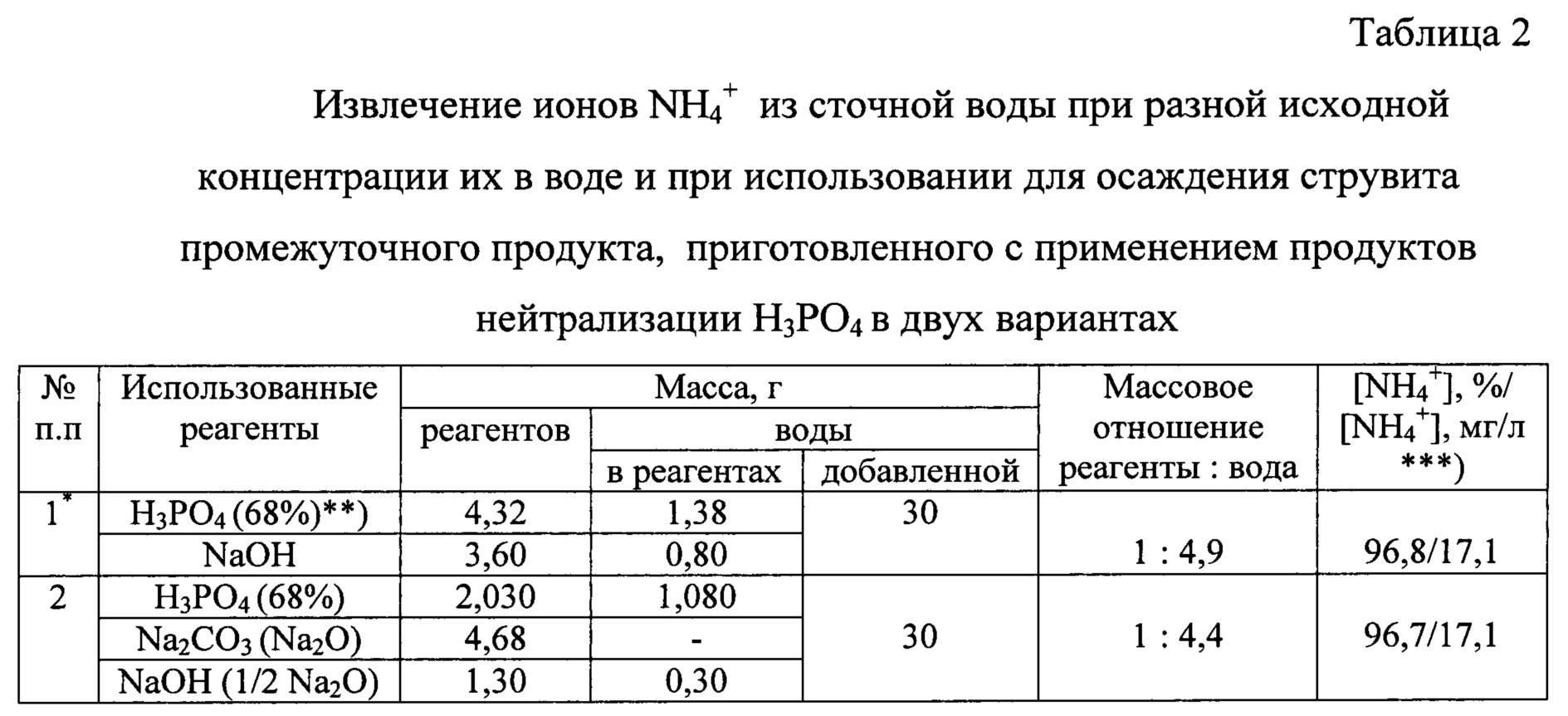

Полученные результаты подтверждают возможность использования Н3РО4 как источника ионов фосфата при получении промежуточного продукта и возможность проведения операции ее нейтрализации в двух вариантах без изменений других условий приготовления промежуточного продукта.
При получении промежуточного продукта предусматривается также выбор соотношения между кислотными и щелочными компонентами. Поддержание необходимого уровня рН для осаждения струвита достигается за счет регулирования соотношения компонентов в промежуточном продукте между фосфатами и гидрофосфатами, например, между Na3PO4 (0,5 М раствор имеет рН ~ 12,1) и Na2HPO4 (0,5 М раствор имеет рН ~ 8,9). При нейтрализации Н3РО4 нужного результата можно достигнуть, используя разное количество NaOH или KOH на заключительной стадии нейтрализации фосфорной кислоты, так как это позволяет устанавливать разное соотношение между фосфатом и гидрофосфатом в продуктах нейтрализации, что необходимо для регулирования значения рН в сточной воде.
На основе экспериментальных данных установлено, что для очистки типичных сточных вод, характеризующихся нейтральными и слабощелочными значениями рН в диапазоне 6-8, соотношение между фосфатами и гидрофосфатами в промежуточном продукте целесообразно устанавливать на уровне 80%\20%. В случае кислых вод, характеризующихся значениями рН 4-6, долю гидрофосфатов в составе промежуточного продукта рекомендуется понизить до 10%.
Установлено также, что при разных исходных концентрациях ионов NH4+ в сточной воде, включая относительно высокую (540 мг/л) и низкую (180 мг/л), и соответственно разных количеств необходимого для осаждения струвита промежуточного продукта, не повлияло на степень извлечения ионов NH4+ из сточной воды, она составила 96,7-96,8%.
Согласно известному способу переработки аммиачно-азотных сточных вод с получением струвита (см. патент Китая, CN 103848540 А, 10.01.2014) эффективность извлечения из них ионов NH4+ существенно зависит от исходных концентраций извлекаемых ионов в воде, поэтому данная зависимость была более детально исследована в условиях, когда аналогичная задача решается с помощью заявленного способа. В серии опытов все условия приготовления промежуточного продукта и осаждения струвита из сточной воды оставлены без изменения. Различия касаются содержания ионов аммония в сточной воде и соответственно количеств промежуточного продукта, и количеств реагентов для его приготовления. Полученные экспериментальные данные, отнесенные к 1 л сточной воды, представлены в таблице 3.
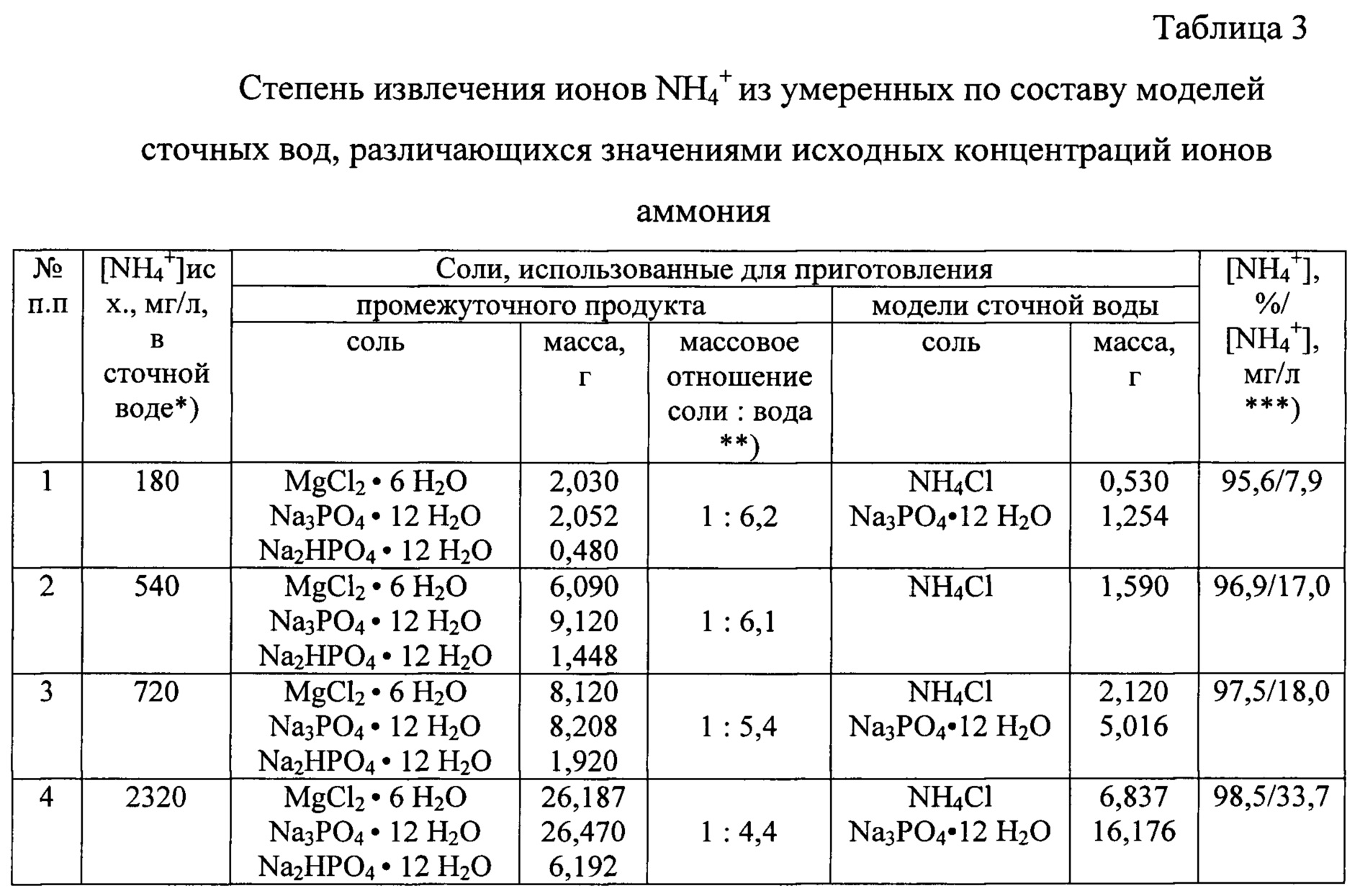

Полученные результаты подтверждают, что использование заявляемого способа позволяет извлекать ионы NH4+ из модельных сточных вод при варьировании в них исходных концентрации [NH4+] от 180 до 2320 мг/л, и при этом степень извлечения ионов аммония сохраняется в диапазоне от 95,6 до 98,5%. Установлено также, что при получении промежуточного продукта, потребность в минимальном количестве воды, выраженном через массовое отношение соли: вода, может минимизироваться при увеличении масштабов производства.
Как показывает анализ результатов использования известных способов извлечения ионов РО43- из сточных вод при их осаждении в форме струвита, степень извлечения фосфат-ионов существенно зависит от избытка ионов Mg2+ в сточной воде против стехометрического соотношения Mg/PO4, равного ионов РО43-, и одновременно ионов NH4+, из сточной воды в зависимости от исходного молярного соотношения ионов [Mg2+] : [NH4+] : [PO43-] в воде при осаждении струвита по заявленному способу была определена в диапазоне этих соотношений от 0,933:1:1 до 1,5:1:1. Эксперименты проведены на базе модели сточной воды, соответствующей по составу сточной воде, перерабатываемой по способу согласно прототипу. При извлечении ионов NH4+ и РО43- из воды все операции проводили согласно заявленному способу и при этом контролировали остаточные концентрации ионов аммония и фосфатов в сточной воде после осаждения струвита, степени извлечения этих ионов из сточной воды, а также рН сточной воды в конце процесса осаждения. Полученные результаты представлены в таблице 4.
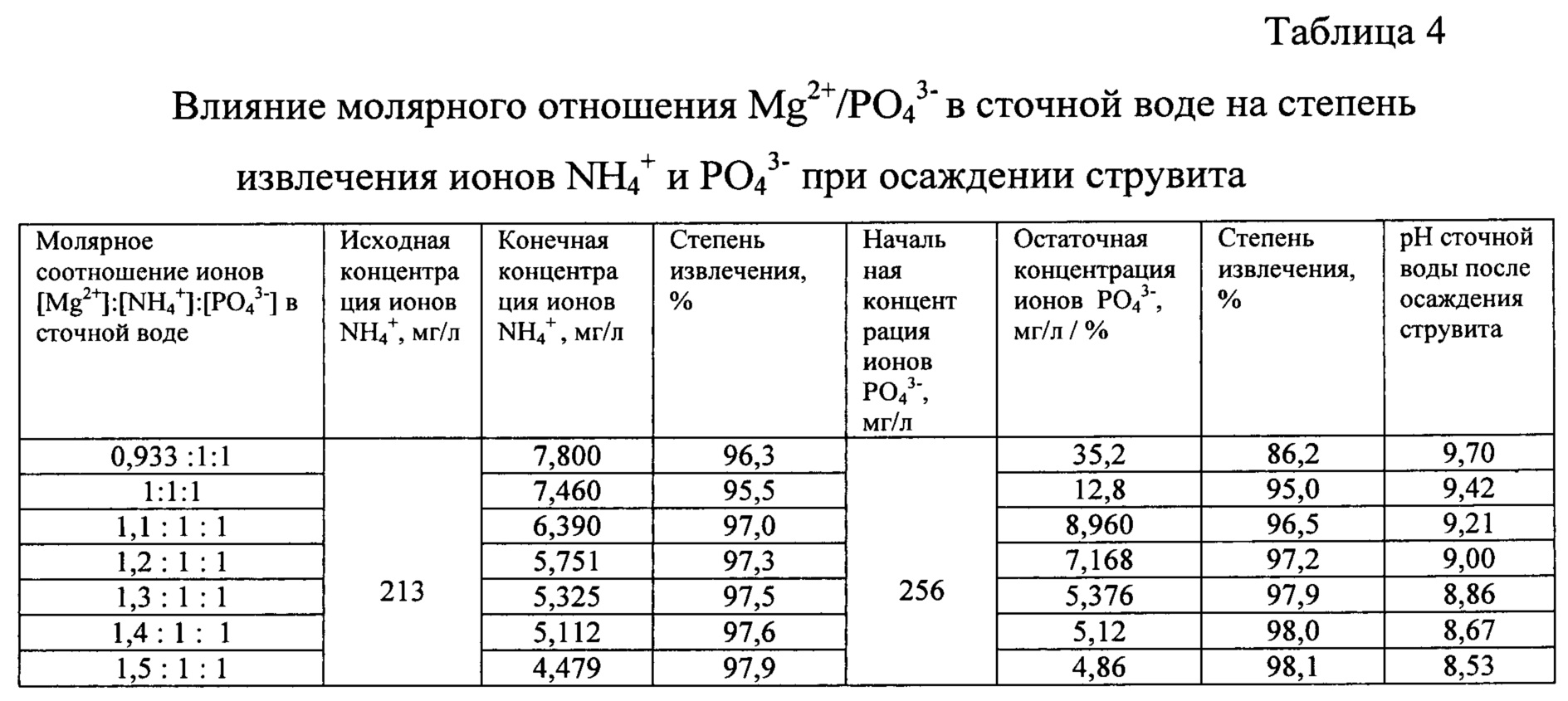
Судя по результатам, полученным при использовании способа извлечения ионов NH4+ и РО43- из сточной воды при осаждении струвита, даже небольшой недостаток ионов Mg2+ против стехиометрического соотношения в составе струвита (0,933:1:1) заметным образом снижает степень извлечения ионов [РО43-] (до 86,2%) при соотношении, соответствующему стехиометрическому в составе струвита (1:1:1), степень извлечения [РО43-] повышается до 95,0%. Избыток ионов Mg2+ (1,1:1:1) приводит к некоторому дополнительному росту степени извлечения ионов [РО43-] - до 96,5%, при этом остаточная концентрация ионов [РО43-] в сточной воде после осаждения струвита понижается с 7,46 до 6,39 мг/л. Дальнейшее увеличение избытка ионов Mg2+ (1,2:1:1) повышает степень извлечения ионов [PO43-] до 97,2% и приводит к снижению остаточной концентрации ионов [РО43-] до 5,75 мг/л. Одновременно показано, что избыток ионов Mg2+ при осаждении струвита приводит к некоторому повышению степени извлечения также ионов NH4+ из сточной воды.
Таким образом, при извлечении ионов NH4+ и РО43- можно рекомендовать использовать положительный эффект избытка ионов Mg2+ в сточной воде при осаждении струвита, но заявленный способ позволяет ограничиться соотношением 1,1:1:1 и лишь при очень высоких требованиях к понижению остаточной концентрации ионов NH4+ и РО43- в сточной воде можно использовать соотношение вплоть до 1,2:1:1. Из практики работы с разными препаратами магния следует, что за счет их гигроскопичности всегда остается опасность получить недостаток ионов Mg2+ при осаждении струвита и поэтому приходится прибегать к небольшому избытку магния, чтобы избежать риска снижения эффекта очистки сточной воды.
Далее приведены примеры, показывающие эффективность извлечения ионов NH4+ и РО43- из моделей сточных вод при осаждении струвита с использованием заявленного способа. Представлены результаты очистки сточной воды не только аналогичной использованной в прототипе, но и примеры очистки сточных вод других типов, различающихся по составу.
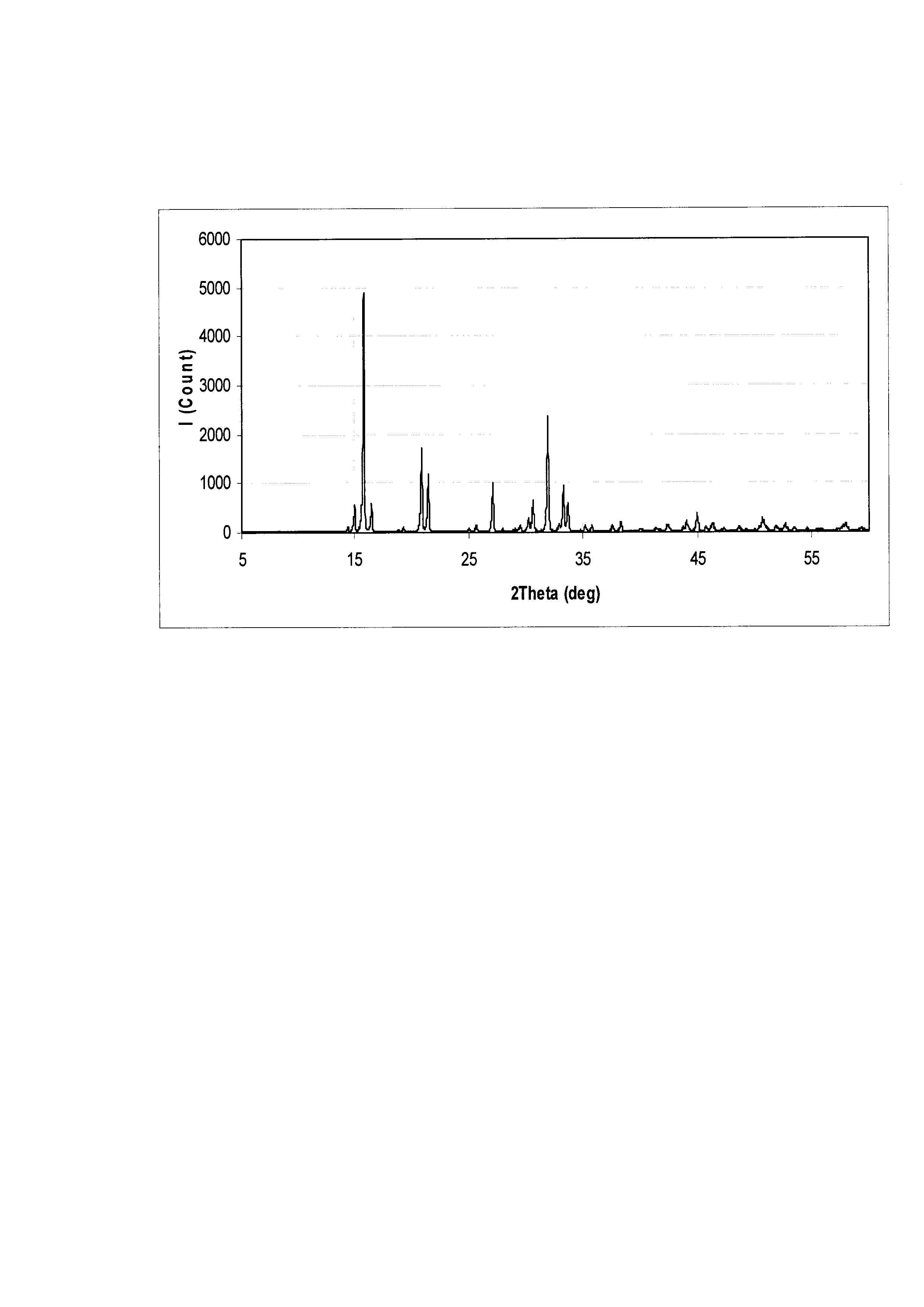
На чертеже приведена рентгенограмма образца струвита, полученного в примере №1
Примеры
Пример 1.
Провели регенерацию азота и фосфора из сточной воды путем осаждения струвита. Модель сточной воды по составу соответствует прототипу: NH4+ 213 мг/л, PO43- 256 мг/л, SO42- 1365 мг/л, F- 1336 мг/л, рН 8,96.
Предподготовку сточной воды для удаления ионов F- провели согласно прототипу с помощью добавки карбоната кальция. При осаждении фторида кальция воду перемешивали со скоростью вращения мешалки 60 об/мин в течение 30 минут и осадок отстаивали 7 минут. Регенерацию азота и фосфора из сточной воды осуществляли путем осаждения ионов аммония и фосфата в форме струвита согласно заявляемому способу. Для осаждения струвита использовали промежуточный продукт, в составе которого содержание ионов Mg2+ и PO43- устанавливали таким, чтобы в сточной воде после введения в нее промежуточного продукта молярное соотношение [Mg2+] : [NH4+] : [PO43-] стало близким 1,1:1:1. Это было достигнуто за счет смешения следующих компонентов в расчете на использование при очистке 1 л сточной воды: MgCl2⋅6H2O 2,8 г и 4 г воды; Na3PO4⋅12H2O 2,766 г, Na2HPO4⋅12H2O 0,652 г и 10 г воды. Смеси готовили при температуре 40°С. Далее их объединили и смешали с помощью лопастной мешалки со скоростью 600 об/мин в течение 2 минут. Суммарное отношение масс солей и воды, включая кристаллизационную воду кристаллогидратов солей, в промежуточном продукте составило 1:5,2. Полученный промежуточный продукт в течение времени до 5 минут после приготовления ввели в сточную воду и за счет перемешивания равномерно распределили его в объеме воды, при этом рН сточной воды составил 9,12. Полученную суспензию выдерживали в воде при умеренном перемешивании в течение 15 минут, далее отстаивали 30 минут и осветленную воду декантировали.
Определили остаточную концентрацию ионов Mg2+, NH4+, PO43- в очищенной сточной воде, а также содержание этих же ионов в составе струвита как конечного продукта. Результаты анализа приведены в таблице 5.
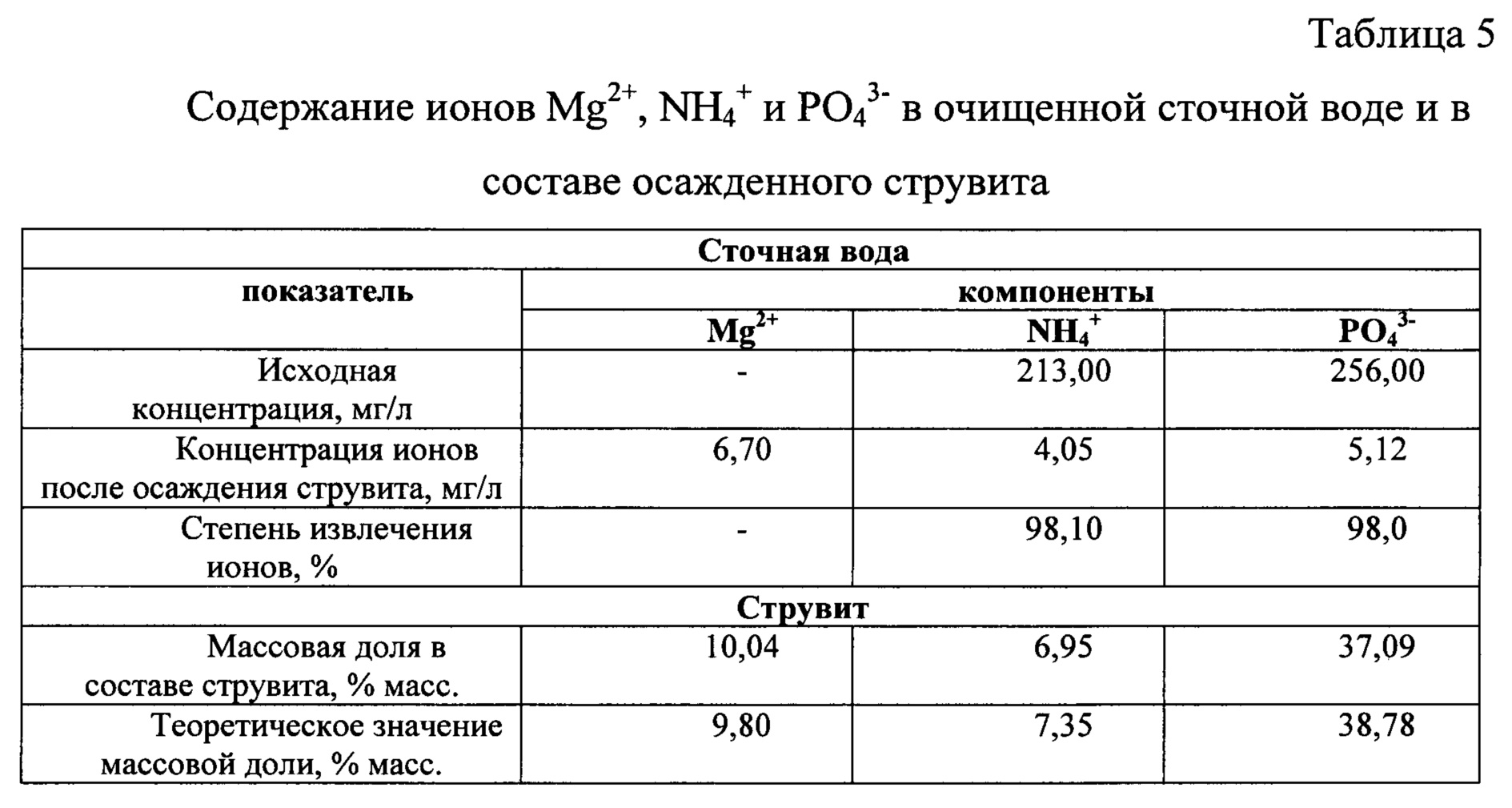
Состав полученного струвита по результатам анализа близок к теоретическому по содержанию в нем ионов [Mg2+], [NH4+] и [PO43-].
При использовании заявляемого способа удалось достигнуть степень извлечения ионов NH4+ 98,10%, и одновременного извлечения ионов РО43- 98,0%, при молярном соотношении [Mg2+]: [NH4+]: [PO43-] в сточной равным 1,1:1:1. При использовании способа согласно прототипу при аналогичном составе сточной воды и молярном отношении в сточной воде [Mg2+] : [PO43-] равном 1:1, удалось извлечь лишь 47,4% РО43-. Даже при молярном отношении [Mg2+] : [PO43-] равном 2,5:1, извлечение составило: ионов PO43- 84,2% и ионов NH4+ 33,5%. Полученный результат подтверждает более высокую эффективность заявленного способа по сравнению со способом по прототипу. Остаточные концентрации ионов аммония и фосфата в сточной воде после очистки имеют низкий уровень, что резко снижает риск эвтрофикации водоемов при сбросе в них очищенных сточных вод, а полученный после осаждения струвит имеет состав близкий к теоретическому, по данным рентгенофазного анализа в нем отсутствуют посторонние фазы (фиг.), его можно рекомендовать к использованию в качестве удобрения пролонгированного действия.
Пример 2.
Провели регенерацию азота и фосфора из сточной воды путем осаждения струвита. Модель сточной воды по составу соответствует прототипу: NH4+ 213 мг/л, PO43- 256 мг/л, SO42- 1365 мг/л, F- 1336 мг/л, рН 8,96.
Предподготовку сточной воды для удаления ионов F- провели согласно прототипу с помощью добавки карбоната кальция. При осаждении фторида кальция воду перемешивали со скоростью вращения мешалки 60 об/мин в течение 30 минут и осадок отстаивали 7 минут. Регенерацию азота и фосфора из сточной воды осуществляли путем осаждения ионов аммония и фосфата в форме струвита согласно заявляемому способу. Для осаждения струвита использовали промежуточный продукт, в составе которого содержание ионов Mg2+ и PO43- устанавливали таким, чтобы в сточной воде после введения в нее промежуточного продукта молярное соотношение [Mg2+] : [NH4+] : [PO43-] стало близким 1,1:1:1.
В качестве источника фосфатов в данном примере использовали продукты нейтрализации экстракционной 68%-ной фосфорной кислоты, предварительно нейтрализованной NaOH. В расчете на очистку 1 л сточной воды использовали 1,311 г 68%-ой фосфорной кислоты, к которой при температуре 70°С постепенно добавляли измельченный NaOH в количестве 0,8736 г, предварительно растворенный в 15 г воды, смесь выдерживали 1 ч. Количество щелочи для нейтрализации выбрано с учетом сохранения 20%-ной доли гидрофосфата от общего содержания фосфатов в составе промежуточного продукта. В качестве источника ионов магния использовали бишофит, который в количестве 3,75 г смешивали с 5 г воды. Обе смеси готовили при температуре 70°С. Далее их объединили и смешали с помощью лопастной мешалки при скорости вращения 600 об/мин в течение 2 минут. Суммарное отношение масс солей и воды, включая кристаллизационную воду кристаллогидратов солей, в промежуточном продукте составило 1:8,1. Полученный промежуточный продукт в течение времени до 5 минут после приготовления ввели в сточную воду и за счет перемешивания равномерно распределили его в объеме воды, при этом рН сточной воды составил 9,12. Полученную суспензию выдерживали в воде при умеренном перемешивании в течение 15 минут, далее отстаивали 30 минут и осветленную воду декантировали.
Определили остаточную концентрацию ионов Mg2+, NH4+, PO43- в очищенной сточной воде, а также содержание этих же ионов в составе струвита как конечного продукта. Результаты анализа приведены в таблице 6.
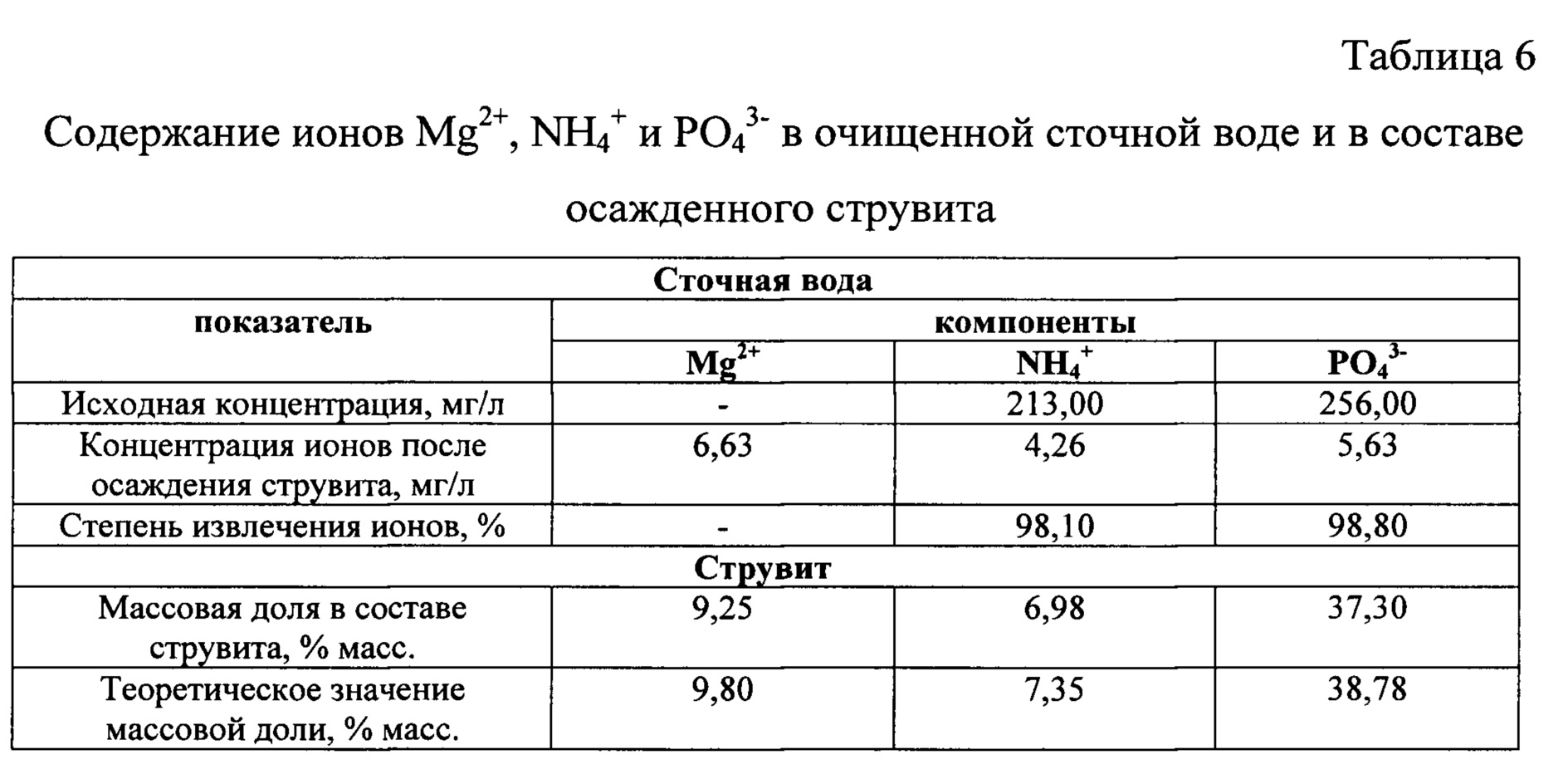
Состав полученного струвита по результатам анализа близок к теоретическому по содержанию в нем ионов [Mg2+], [NH4+] и [PO43-].
При использовании заявленного способа для осаждения ионов NH4+ и PO43- из сточной воды в форме струвита в условиях применения для приготовления промежуточного продукта в качестве источника ионов магния бишофита и источника ионов фосфата - продуктов нейтрализации экстракционной 68%-ной фосфорной кислоты и щелочью - NaOH удалось достигнуть степени извлечения NH4+ 98,10%, и одновременного извлечения ионов PO43-, которое составило 97,8%, при молярном соотношении [Mg2+] : [NH4+] : [PO43-] в сточной равным 1,1:1:1. Полученный результат подтверждает более высокую эффективность заявленного способа по сравнению со способом по прототипу.
Пример 3.
Провели регенерацию азота и фосфора из сточной воды путем осаждения струвита. Модель сточной воды по составу соответствует сточной воде, подвергнутой обработке в работе H.-D. Ryu et.al Journal of Harardous Material 156 (2008) 163-169: NH4+ 127 мг/л, PO43- 284,8 мг/л, Ca2+ 8,6 мг/л, Na+ 13,2 мг/л, K+ 9 мг/л, Cl- 9,4 мг/л, SO42- 6,4 мг/л, F- 164,5 мг/л, рН 8,62.
В составе воды ионы F-, способные взаимодействовать с ионами Mg2+, присутствуют в относительно низких концентрациях и предподготовка воды не проводилась.
Регенерацию азота и фосфора из сточной воды осуществляли путем осаждения ионов аммония и фосфата в форме струвита согласно заявляемому способу. Для осаждения струвита использовали промежуточный продукт, в составе которого содержание ионов Mg2+ и PO43- устанавливали таким, чтобы в сточной воде после введения в нее промежуточного продукта молярное соотношение [Mg2+] : [NH4+] : [PO43-] стало близким 1,1:1:1.
Это было достигнуто за счет смешения следующих компонентов в расчете на использование при очистке 1 л сточной воды: MgSO4⋅7H2O 1,738 г и 2 г воды, K3PO4⋅8H2O 0,891 г и K2HPO4⋅3H2O 0,144 г и 2 г воды. Смеси готовили при температуре 25°. Далее их объединили и смешали с помощью лопастной мешалки со скоростью 600 об/мин в течение 2 минут. Суммарное отношение масс солей и воды, включая кристаллизационную воду кристаллогидратов солей, в промежуточном продукте составило 1:5,8. Полученный промежуточный продукт в течение времени до 5 минут после приготовления ввели в сточную воду и за счет перемешивания равномерно распределили его в объеме воды, при этом рН сточной воды составил 9,01. Полученную суспензию выдерживали в воде при умеренном перемешивании в течение 15 минут, далее отстаивали 30 минут и осветленную воду декантировали.
Определили остаточную концентрацию ионов Mg2+, NH4+, PO43- в очищенной сточной воде, а также содержание этих же ионов в составе струвита как конечного продукта. Результаты анализа приведены в таблице 7.
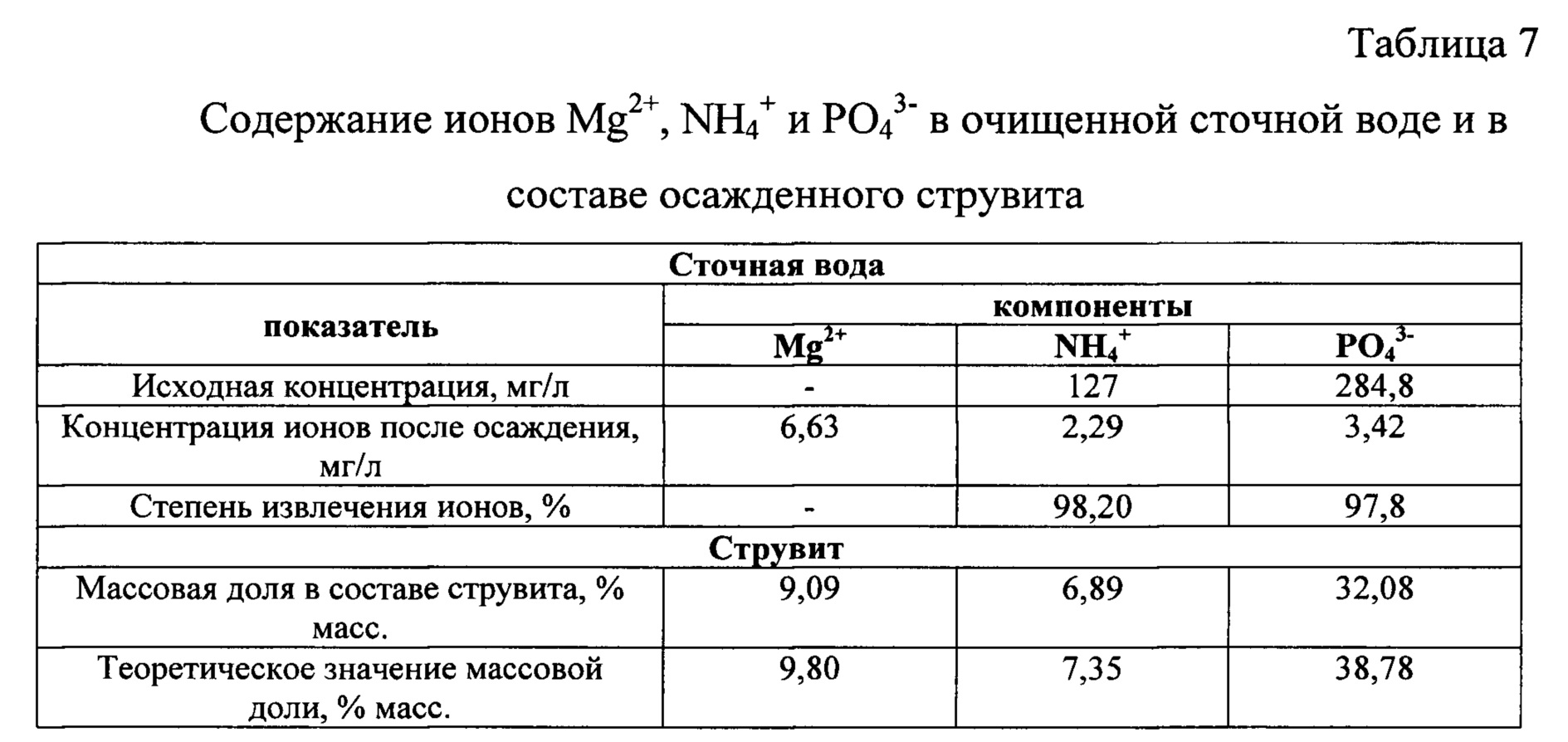
Содержание ионов Mg2+ и NH4+ в составе полученного струвита по результатам анализа близко к теоретическому, но на некоторое понижение содержание ионов PO43-, вероятно, сказалось присутствие в сточной воде ионов F-, способных конкурировать с ионами PO43-, взаимодействуя с ионами Mg2+.
При использовании заявленного способа для осаждения ионов NH4+ и PO43- из сточной воды в форме струвита в условиях применения для приготовления промежуточного продукта в качестве источника ионов магния сульфата магния и источника ионов фосфата взяты соли K3PO4⋅8H2O и K2HPO4⋅3Н2О, при этом удалось достигнуть степень извлечения ионов аммония 98,20%, и одновременного извлечения ионов PO43- - 97,8%, при молярном соотношении [Mg2+] : [NH4+] : [PO43-] в сточной равным 1,1:1:1. В известном способе (H.-D. Ryu et al.) максимальная степень извлечения ионов аммония составила 89%, в то время как задача извлечения фосфатов из сточных воды не предусматривалась. Полученный результат подтверждает более высокую эффективность заявленного способа по сравнению с результатами, полученными при использовании известного способа.
Пример 4.
Провели регенерацию азота и фосфора из сточной воды путем осаждения струвита. Модель сточной воды по составу соответствует сточной воде, подвергнутой обработке в работе M. Quintana et al. Chemical Engineering journal 136 (2008) 204-209.: NH4+ 414 мг/л; PO43- 197,35 мг/л; Ca2+ 49,2 мг/л; ХПК 675 мг/л; рН 8,84.
При применении заявленного способа предподготовка воды этого состава перед осаждением струвита не потребовалась.
Регенерацию азота и фосфора из сточной воды осуществляли путем осаждения ионов аммония и фосфата в форме струвита согласно заявляемому способу. Для осаждения струвита использовали промежуточный продукт, в составе которого содержание ионов Mg2+ и PO43- устанавливали таким, чтобы в сточной воде после введения в нее промежуточного продукта молярное соотношение [Mg2+] : [NH4+] : [PO43-] стало близким 1,15:1:1.
В качестве источника фосфатов в данном примере использовали продукты нейтрализации экстракционной 68%-ной фосфорной кислоты, предварительно нейтрализованной КОН. В расчете на очистку 1 л сточной воды использовали 3,02 г 68%-ной фосфорной кислоты, к которой постепенно при температуре 45°С добавляли измельченный КОН в количестве 1,908 г и 17 г воды, смесь выдерживали 1 ч. Количество щелочи для нейтрализации выбрано с учетом 20%-ной доли гидрофосфатов в составе промежуточного продукта, чтобы установить в сточной воде рН в диапазоне, рекомендованном для осаждения струвита. В качестве источника ионов магния использовали MgCl2⋅6H2O в количестве 5,7 г и 6 г воды. Оба раствора готовили при температуре 45°С. Далее их объединили и смешали с помощью лопастной мешалки при скорости вращения 600 об/мин в течение 2 минут. Суммарное отношение масс солей и воды, включая кристаллизационную воду кристаллогидратов солей, в промежуточном продукте составило 1:3,2. Полученный промежуточный продукт в течение времени до 5 минут после приготовления ввели в сточную воду и за счет перемешивания равномерно распределили его в объеме воды, при этом рН сточной воды составил 9,08. Полученную суспензию выдерживали в воде при умеренном перемешивании в течение 15 минут, далее отстаивали 30 минут и осветленную воду декантировали.
Определили остаточную концентрацию ионов Mg2+, NH4+, PO43- в очищенной сточной воде, а также содержание этих же ионов в составе струвита как конечного продукта. Результаты анализа приведены в таблице 8.
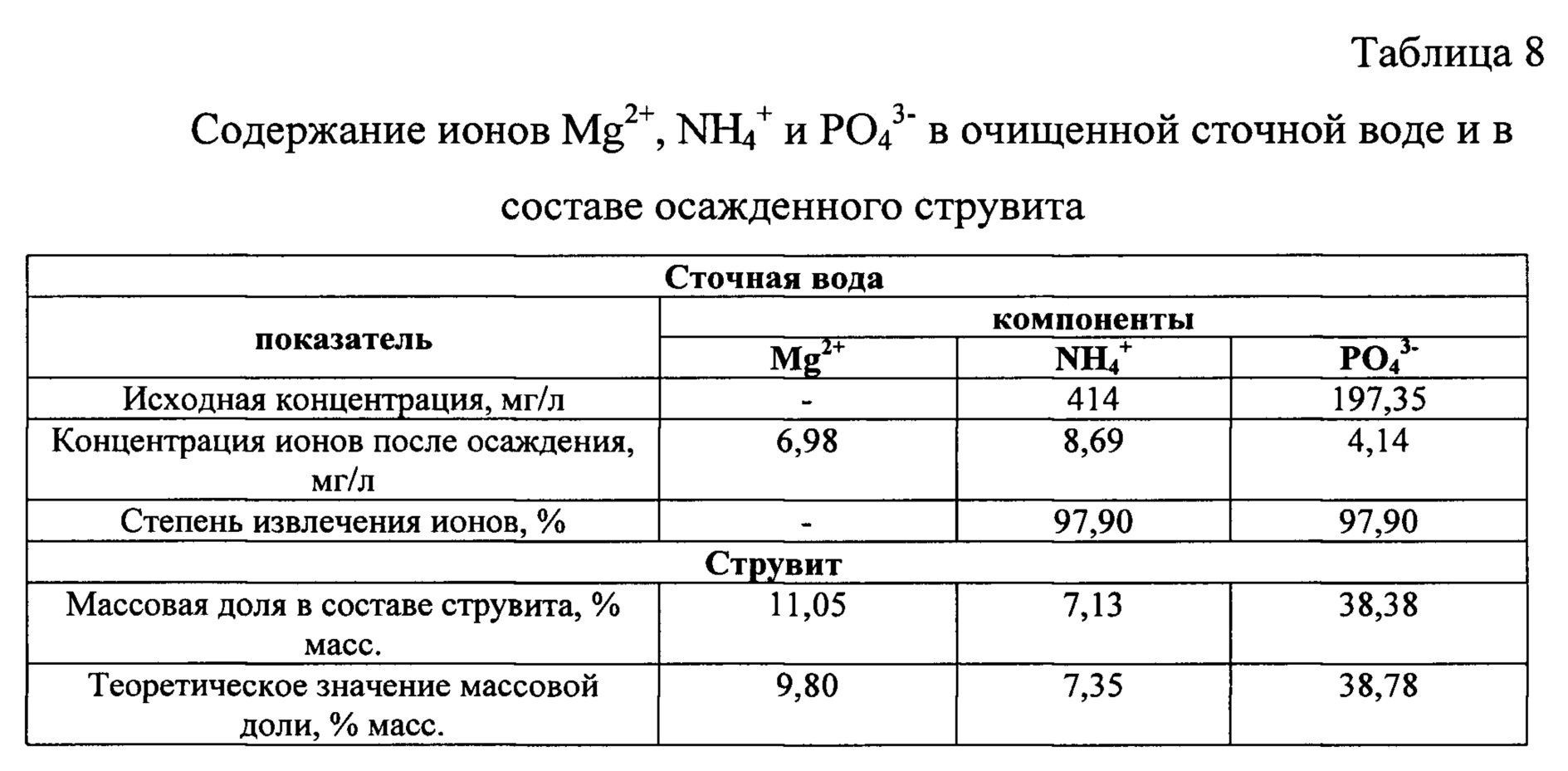
Содержание ионов NH4+ и PO43- в составе полученного струвита по результатам анализа близко к теоретическому. Некоторое повышение содержания ионов Mg2+ объясняется увеличением их избытка при осаждении струвита.
При использовании заявленного способа для осаждения ионов NH4+ и PO43- из сточной воды в форме струвита в условиях применения для приготовления промежуточного продукта в качестве источника ионов магния хлорида магния и источника продуктов нейтрализации экстракционной 68%-ной фосфорной кислоты щелочью - КОН удалось достигнуть степени извлечения NH4+ 97,90%, и одновременного извлечения ионов PO43- - 97,90%, при молярном соотношении [Mg2+] : [NH4+] : [PO43-] в сточной воде равным 1,15:1:1. При этом избыточный магний почти полностью переходит в состав осадка. В известном способе (M. Quintana et al.) максимальная степень извлечения фосфатов составила 90%, а степень извлечения ионов аммония достигла лишь 30%. Полученный результат подтверждает более высокую эффективность заявленного способа по сравнению с известным способом.
Пример 5.
Провели регенерацию азота и фосфора из сточной воды путем осаждения струвита. Модель сточной воды по составу соответствует прототипу: NH4+ 213 мг/л, PO43- 256 мг/л, SO42- 1365 мг/л, F- 1336 мг/л, рН 8,96.
Предподготовку сточной воды для удаления ионов F- провели согласно прототипу с помощью добавки карбоната кальция. При осаждении фторида кальция воду перемешивали со скоростью вращения мешалки 60 об/мин в течение 30 минут и осадок отстаивали 7 минут. Регенерацию азота и фосфора из сточной воды осуществляли путем осаждения ионов аммония и фосфата в форме струвита согласно заявляемому способу. Для осаждения струвита использовали промежуточный продукт, в составе которого содержание ионов Mg2+ и PO43- устанавливали таким, чтобы в сточной воде после введения в нее промежуточного продукта молярное соотношение [Mg2+] : [NH4+] : [PO43-] стало близким 1,2:1:1. Это было достигнуто за счет смешения следующих компонентов в расчете на использование при очистке 1 л сточной воды: MgCl2⋅6H2O 3,0247 г и 4 г воды; 1,315 г 68%-ой фосфорной кислоты, к которой при температуре 55°С постепенно добавили Na2CO3 в количестве 0,9646 г, растворенного в 5 г воды, а затем NaOH в количестве 0,147 г, растворенного в 4 г воды, смесь выдерживали в нагретом состоянии в течение 1 ч. Далее их объединили и смешали с помощью лопастной мешалки со скоростью 600 об/мин в течение 2 минут. Суммарное отношение масс солей и воды, включая кристаллизационную воду кристаллогидратов солей, в промежуточном продукте составило 1:3,5. Полученный промежуточный продукт в течение времени до 5 минут после приготовления ввели в сточную воду и за счет перемешивания равномерно распределили его в объеме воды, при этом рН сточной воды составил 9,12. Полученную суспензию выдерживали в воде при умеренном перемешивании в течение 15 минут, далее отстаивали 30 минут и осветленную воду декантировали.
Определили остаточную концентрацию ионов Mg2+, NH4+, PO43- в очищенной сточной воде, а также содержание этих же ионов в составе струвита как конечного продукта. Результаты анализа приведены в таблице 9.
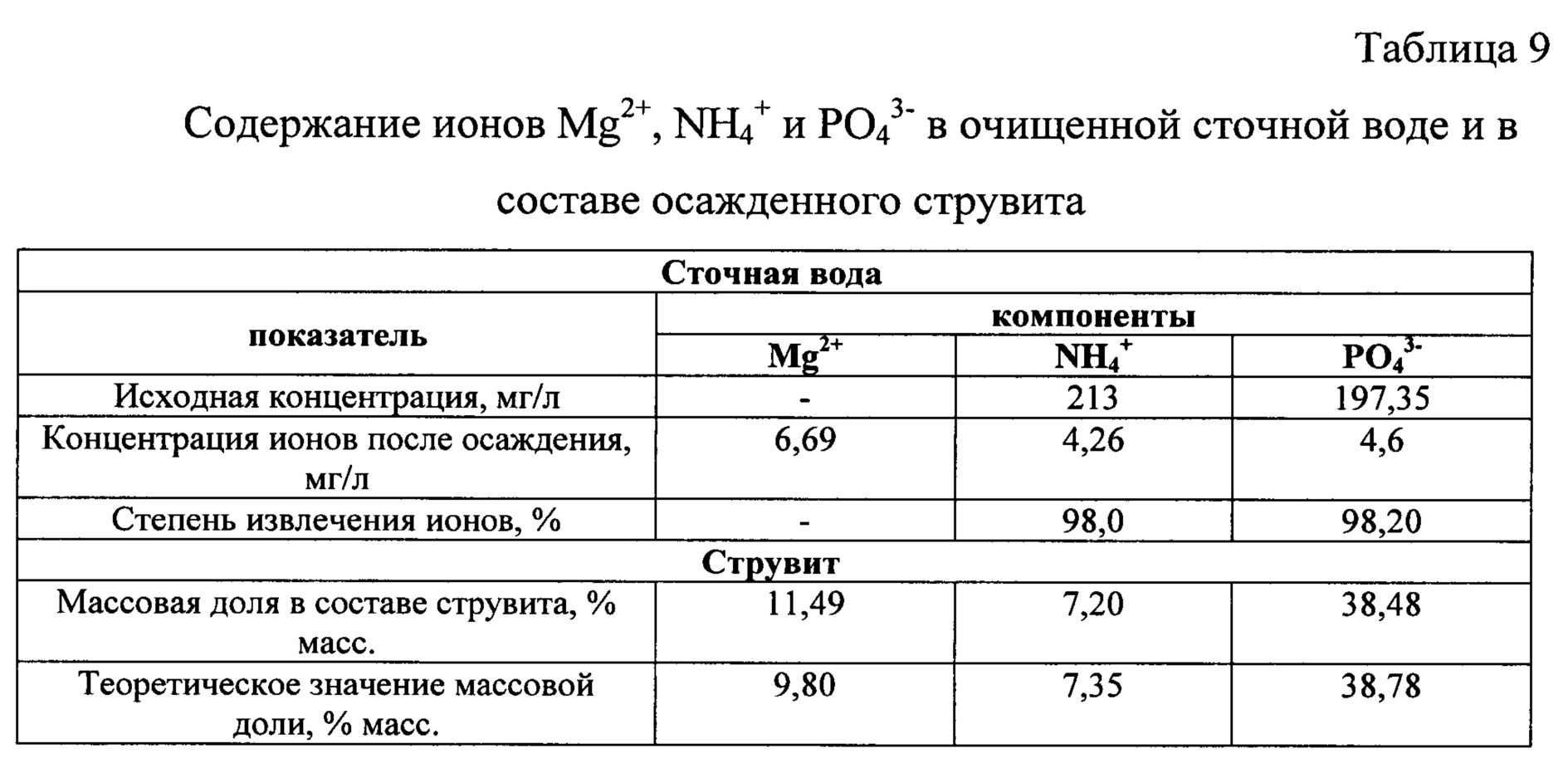
Содержание ионов NH4+ и PO43- в составе полученного струвита по результатам анализа близко к теоретическому, но некоторое увеличение содержания ионов Mg2+ связано с ростом его избытка при осаждении струвита.
При использовании заявленного способа для осаждения ионов NH4+ и PO43- из сточной воды в форме струвита в условиях применения для приготовления промежуточного продукта в качестве источника ионов магния хлорид магния и источника ионов фосфата - продуктов нейтрализации экстракционной 68%-ной фосфорной кислоты реагентами Na2CO3 и NaOH удалось достигнуть степени извлечения NH4+ 98,0%, и одновременного извлечения ионов PO43-, которое составило 98,20%, при молярном соотношении [Mg2+] : [NH4+] : [PO43-] в сточной равным 1,2:1:1. Полученный результат подтверждает более высокую эффективность заявленного способа по сравнению со способом по прототипу.
Реферат
Изобретение может быть использовано при очистке сточных вод. Способ регенерации азота и фосфора из сточных вод осаждением их ионов в форме струвита включает осаждение струвита при исходном молярном отношении [Mg2+]:[NH4+]:[РО43-], близком стехиометрическому составу струвита. При наличии в сточной воде ионов фтора проводят предподготовку воды путем добавления карбоната кальция, осаждения и отделения осадка фторида кальция. Недостающие для образования струвита ионы Mg2+и РО43-вводят в сточную воду в виде промежуточного продукта, который получают смешением растворов. При этом смешивают раствор хлорида или сульфата магния в количестве, позволяющем получать в сточной воде молярное отношение Mg2+/NH4+от 1,1 до 1,2, и раствор фосфатов натрия или калия, таких как Na3PO4или K3PO4и Na2HPO4или K2HPO4, в количестве и соотношении, которые позволяют устанавливать в сточной воде рН в диапазоне от 8,0 до 9,5 и молярное отношение РО43-/NH4+равное 1,0. Полученные растворы смешивают при 25-70°С и интенсивном перемешивании в течение 1-2 мин для приготовления промежуточного продукта, который непосредственно после приготовления вводят в сточную воду при ее перемешивании. Полученную суспензию перемешивают в течение 15-20 мин, отстаивают осадок в течение 20-30 мин, осветленную воду отделяют декантацией. Изобретение позволяет повысить степень извлечения ионов NH4+и РО43-из сточных вод при одновременном осаждении ионов аммония и фосфата в форме струвита, не допуская появления в составе осажденного продукта примеси других фаз. 1 з.п. ф-лы, 1 ил., 9 табл., 5 пр.

Комментарии