Способ получения дигидрата бис(дигидродифосфато)купрата(ii) калия и его использование в промышленности - RU2703178C1
Код документа: RU2703178C1
Описание
Изобретение относится к неорганической химии, к промышленной экологии и к гальванотехнике, в частности к способам получения кристаллических бис(дифосфато)купратов(II) калия, и может быть использовано, в частности для получения кристаллического бис(дигидродифосфато)диаквакупрата(II) калия формулы K2Cu(H2P2O7)2⋅2H2O, для утилизации отходов гальванического производства - отработанных электролитов дифосфатного меднения, для приготовления электролитов дифосфатного меднения стали, чугуна, алюминия и его сплавов, сплавов цинка, титана, а также диэлектриков.
Известен кристаллический дифосфатокупрат(II) калия формулы K3Cu2H(P2O7)2 (Effenberger Н. The structure of tripotassium dicopper(II) hydrogendipyrophosphate // Acta crystallographica. Sect. C. 1987. vol. 43. №7. pp. 1237-1239). Кристаллы соединения триклинные (пространственная группа симметрии




Известен кристаллический дигидрат
бис(дигидродифосфато)купрата(II) калия формулы K2Cu(H2P2O7)2⋅2Н2О (Khaoulaf R., Ennaciri A., Ezzaafrani М., Capitelli F. Structure and vibrational spectra of a new acidic diphosphate K2Cu(H2P2O7)2⋅2Н2О // Phosphorus, sulphur, silicon. 2013. vol. 188. №8. pp. 1038-1052) зеленого цвета. Кристаллы соединения триклинные (пространственная группа симметрии




Известен кристаллический дигидрат
бис(дигидродифосфато)купрата(II) калия формулы
K2Cu(H2P2O7)2⋅2H2O (Essehli R., El Bali В., Alaoui Tahiri A., Lachkar M., Manoun В.,



Известен кристаллический дигидрат
бис(дигидродифосфато)купрата(II) калия формулы K2Cu(H2P2O7)2⋅2H2O (Khaoulaf R., Ennaciri A., Ezzaafrani М., Capitelli F. Structure and vibrational spectra of a new acidic diphosphate K2Cu(H2P2O7)2⋅2Н2О // Phosphorus, sulphur, silicon. 2013. vol. 188. №8. pp. 1038-1052) зеленого цвета. Кристаллы соединения ромбические (пространственная группа симметрии Pnma, z=4) с параметрами элементарной ячейки (при Т=293 K) а=9,8990±0,0006



2K4P2O7+CuCl2⋅2H2O+4HCl→K2Cu(H2P2O7)2⋅2H2O+6KCl.
Недостатком способа является то, что он предназначен для получения только монокристаллов целевого продукта. Другим недостатком способа является необходимость материальных затрат на реагенты (дигидрат хлорида меди и дифосфат калия). Способ не предусматривает утилизацию отходов промышленного производства.
Целью заявленного изобретения является расширение арсенала способов получения дигидрата бис(дигидродифосфато)купрата(II) калия формулы K2Cu(H2P2O7)2⋅2H2O, снижение материальных затрат на получение однофазного целевого продукта, расширение арсенала способов утилизации отработанного электролита дифосфатного меднения, расширение арсенала способов приготовления свежего электролита дифосфатного меднения.
Поставленная цель достигается тем, что способ получения дигидрата бис(дигидродифосфато)купрата(II) калия включает приготовление реакционного водного раствора, содержащего медь(II) и дифосфат калия, выдерживание реакционного водного раствора в течение времени, достаточного для образования осадка целевого продукта, отделение осадка целевого продукта от раствора. Новым в заявленном способе является то, что для приготовления реакционного водного раствора качестве источника меди(II) и дифосфата калия используют жидкий отход производства покрытий - отработанный раствор дифосфатного меднения, содержащий в качестве основных компонентов медь(II) и дифосфат калия, и в реакционном водном растворе устанавливают рН от 1,0 до 5,5, что желательно делать путем прибавлением хлороводородной или азотной кислот. Для повышения выхода целевого продукта в реакционный водный раствор желательно добавлять уксусную кислоту. Полученный в оптимальных условиях целевой продукт является однофазным веществом формулы K2Cu(H2P2O7)2⋅2H2O, которое кристаллизуется в ромбической сингонии (пространственной группе симметрии Pnma, z=4) с параметрами элементарной ячейки а=9,901±0,002



Заявленный способ получения дигидрата
бис(дигидродифосфато)купрата(II) калия заключается в приготовлении реакционного водного раствора, содержащего в качестве основных компонентов медь(II), дифосфат-ионы и катионы калия. Названный реакционный водный раствор готовят из отработанного электролита дифосфатного меднения, содержащего комплексный анион [Cu(P2O7)2]6- и катионы калия, создавая в нем необходимые для кристаллизации целевого продукта условия путем прибавления подходящих веществ или растворов. Обязательным условием является рН реакционного водного раствора от 1,0 до 5,5. При более низком рН реакционного водного раствора целевой продукт кристаллизуется с недостаточно высоким выходом, при более высоком рН целевой продукт может быть загрязнен другими соединениями меди(II) с анионами дифосфорной кислоты. Для создания оптимального интервала рН в реакционном водном растворе в отработанный электролит дифосфатного меднения прибавляют хлороводородную кислоту или азотную кислоту, или отработанный раствор, содержащий хлороводородную кислоту, например, отработанный раствор травления меди (после термообработки) в растворе хлороводородной кислоты или отработанный раствор химической активации меди; прибавлять серную кислоту не следует, так как это может привести к выпадению кристаллов сульфата калия. Оптимальное значение рН в реакционном водном растворе также может быть создано путем прибавления к отработанному электролиту дифосфатного меднения уксусной кислоты в количестве, обеспечивающем содержание уксусной кислоты в реакционном водном растворе от 10 до 80 об. %. При более низком содержании уксусной кислоты в реакционном водном растворе оптимальное значение рН не обеспечивается, а при более высоком - возможно загрязнение целевого продукта дигидродифосфатом калия

Таким образом, заявленный способ позволяет получать целевой продукт, используя в качестве реагентов отходы производства, в оптимальном варианте без расходования каких-либо покупных реактивов.
Заявленный способ получения дигидрата
бис(дигидродифосфато)купрата(II) калия основан на химических реакциях, например:
K6[Cu(P2O7)2]+4HNO3+2H2O→K2Cu(H2P2O7)2⋅2H2O+4KNO3
K6[Cu(P2O7)2]+4СН3СООН+2H2O→
K2Cu(H2P2O7)2⋅2H2O+4CH3COOK
K6[Cu(NH3)2(P2O7)2]+6HNO3+2H2O→
K2Cu(H2P2O7)2⋅2H2O+4KNO3+2NH4NO3.
K6[Cu(H2NCH2CH2NH2)(P2O7)2]+6HCl+2H2O→
K2Cu(H2P2O7)2⋅2H2O+4KCl+H3NCH2CH2NH3Cl2.
K6[Cu(HOCH2CH2NH2)2(P2O7)2]+6HNO3+2H2O→
K2Cu(H2P2O7)2⋅2H2O+4KNO3+2HOCH2CH2NH3 NO3.
K6[CuN(CH2CH2OH)3(P2O7)2]+5CH3COOH+2H2O→
K2Cu(H2P2O7)2⋅2H2O+4CH3COOK+(HOCH2CH2)3NH CH3COO.
Дигидрат бис(дигидродифосфато)купрата(II) калия формулы K2Cu(H2P2O7)2⋅2H2O, полученный заявленным способом, представляет собой кристаллическое вещество голубого цвета, которое кристаллизуется в ромбической сингонии (пространственной группе симметрии Pnma, z=4) с параметрами элементарной ячейки (при Т=293 K) а=9,901±0,002



Дигидрат бис(дигидродифосфато)купрата(II) калия растворим в воде, водных растворах сильных минеральных кислот, сульфаминовой кислоты, муравьиной кислоты, водных растворах гидроксидов щелочных металлов, водных растворах карбонатов щелочных металлов, водных растворах гидрокарбонатов щелочных металлов, водных растворах


дифосфатов щелочных металлов, водных растворах аммиака, моноэтаноламина, диэтаноламина, триэтаноламина, диметиламиноэтанола, диэтиламиноэтанола, этилендиамина, диэтилентриамина, триэтилентетрамина; плохо растворим в этаноле, изопропаноле, бутаноле, этиленгликоле, глицерине, уксусной кислоте, этилацетате, ацетоне, диоксане, диметилсульфоксиде, диметилформамиде, дихлорметане, трихлорметане, тетрахлориде углерода, 1,2-дихлорэтане, гексане, бензоле.
Дигидрат бис(дигидродифосфато)купрата(II) калия устойчив при хранении на воздухе при комнатной температуре и не гигроскопичен; при нагревании выше 130-140°С начинает с заметной скоростью терять кристаллизационную воду, при 150°С плавится в кристаллизационной воде.
В промышленности широко используются электролиты меднения стали, чугуна, меди, алюминия (в том числе анодированного, оксидированного и фосфатированного) и его сплавов, сплавов цинка, титана и его сплавов, а также диэлектрических материалов, содержащие в качестве основного компонента дифосфатный комплекс меди [Cu(P2O7)2]6- (ГОСТ 9.305-84. Покрытия металлические и неметаллические неорганические. Операции технологических процессов получения покрытий. М.: ИПК Стандартов, 2003. Пурин Б.А., Цера В.А., Озола Э.А., Витиня И.А. Комплексные электролиты в гальванотехнике. Рига: ЛИЕСМА, 1978. с. 46. Konno Н., Nagayama М. The role of pyrophosphate in copper deposition from cupric pyrophosphate solution // Electrochimica acta. 1978. vol. 23. №10. pp. 1001-1007. Лошкарёв M.А., Попович В.А., Герасимов В.В., Половцев Ю.А., Нифонтова З.С., Путырский А.Ф. Электролит блестящего меднения. Авт. свид. СССР №796249. Опубл. 1981. Мелащенко Н.Ф. Гальванические покрытия диэлектриков. Справочник. Минск: Беларусь, 1987. с. 107. Кольчугин А.В., Ополовников В.Р., Прияткин Г.М., Васильев В.В. Электролит для меднения алюминия и его сплавов. Патент РФ №2094543. Опубл. 1997. Милушкин А.С. Электролит блестящего меднения. Патент РФ №2194097. Опубл. 2002), позволяющие получать мелкокристаллические покрытия с хорошими физико-механическими свойствами. Отработанные электролиты дифосфатного меднения содержат термодинамически прочные комплексы [Cu(P2O7)2]6- (Bottari Е., Ciavatta L. The copper(II)-pyrophosphate complexes in 1 M Na+(ClO-4) medium at 25°C // Inorganica chimica acta. 1968. vol. 2. pp. 74-80. Новый справочник химика и технолога. Химическое равновесие. Свойства растворов. С.-Пб.: АНО НПО «Профессионал», 2004. с. 103), являются токсичными отходами производства (Виноградов С.С. Экологически безопасное гальваническое производство. М.: Глобус, 2002. с. 56) и подлежат обезвреживанию или переработке. Они имеют состав, например:
или
или
или
или
или
Заявленный способ позволяет осуществить переработку отработанного электролита дифосфатного меднения с получением чистого однофазного химического продукта - дигидрата
бис(дигидродифосфато)купрата(II) калия формулы K2Cu(H2P2O7)2⋅2Н2О, который имеет высокое качество и может использоваться в качестве фунгицида, алгицида, компонента составов для предотвращения отложения солей жесткости (Иванов А.М., Пшеничникова В.Г., Ратушняк И.Б. Состав для предотвращения отложений солей жесткости. Патент РФ №2175309), микроэлементной добавки к кормам животных, а также может служить исходным веществом для приготовления свежего электролита дифосфатного меднения.
Из уровня техники известны способы приготовления электролитов дифосфатного меднения (Ажогин Ф.Ф., Беленький М.А., Галль И.Е. и др. Гальванотехника: Справочное издание. М.: Металлургия, 1987. с. 176. Гальванические покрытия в машиностроении. Справочник. Т. 1 / под ред. Шлугера М.А. М.: Машиностроение, 1985. с. 96. ОСТ 107.460092.001-86 Книга 2. Покрытия металлические и неметаллические неорганические. Типовые технологические процессы, 1986). Первый способ основан на смешивании раствора сульфата меди с раствором дифосфата калия, взятого в избытке:
CuSO4+2K4P2O7→K6[Cu(P2O7)2]+K2SO4.
Недостатком способа является неустойчивость высококонцентрированного электролита из-за кристаллизации соли K2SO4. Второй способ основан на получении дифосфата меди Cu2P2O7⋅nH2O с последующим растворением свежеприготовленного осадка в растворе дифосфата калия, взятого в избытке:
2CuSO4+K4P2O7+nH2O→Cu2P2O7⋅nH2O+2K2SO4
Cu2P2O7⋅nH2O+3K4P2O7→2K6[Cu(P2O7)2]+nH2O.
Способ позволяет получать стабильные электролиты дифосфатного меднения, не содержащие сульфатов. Недостатком способа является необходимость использовать свежеприготовленный творожистый осадок Cu2P2O7⋅nH2O, для очистки которого от растворимых примесей требуется обильное промывание водой.
Согласно заявленному способу свежий электролит дифосфатного меднения готовят путем растворения кристаллического дигидрата бис(дигидродифосфато)купрата(II) калия в водном растворе гидроксида щелочного металла (предпочтительно, но не обязательно, гидроксида калия или гидроксида натрия) или в водном растворе азотсодержащего основания (предпочтительно, но не обязательно, аммиака, моноэтаноламина, диэтаноламина, триэтаноламина, диметиламиноэтанола, диэтиламиноэтанола, этилендиамина, диэтилентриамина, триэтилентетрамина), или в водном растворе гидроксида щелочного металла (предпочтительно, но не обязательно, гидроксида калия или гидроксида натрия), содержащем моноэтаноламин, диэтаноламин, триэтаноламин, этилендиамин, диэтилентриамин, триэтилентетрамина, или в водном растворе гидроксида щелочного металла (предпочтительно, но не обязательно, гидроксида калия или гидроксида натрия), содержащем дифосфат калия или дифосфат натрия, или в водном растворе карбоната щелочного металла (предпочтительно, но не обязательно, карбоната калия или карбоната натрия), или в водном растворе карбоната щелочного металла (предпочтительно, но не обязательно, карбоната калия или карбоната натрия), содержащем моноэтаноламин, диэтаноламин, триэтаноламин, этилендиамин, диэтилентриамин, триэтилентетрамин, или путем смешивания водного раствора (или суспензии), полученного из кристаллического дигидрата бис(дигидродифосфато)купрата(II) калия, с упомянутыми выше щелочными растворами. Заявленный способ приготовления свежего электролита дифосфатного меднения из дигидрата бис(дигидродифосфато)купрата(II) калия основан на химических реакциях, например:
K2Cu(H2P2O7)2⋅2H2O+4KOH→K6[Cu(P2O7)2]+6H2O
3K2Cu(H2P2O7)2⋅2H2O+12NaOH→K6[Cu(P2O7)2]+
2Na6[Cu(P2O7)2]+18H2O
K2Cu(H2P2O7)2⋅2H2O+4KOH+2NH4OH→
K6[Cu(NH3)2(P2O7)2]+8H2O
K2Cu(H2P2O7)2⋅2H2O+4KOH+2HOCH2CH2NH2→
K6[Cu(HOCH2CH2NH2)2(P2O7)2]+6H2O
K2Cu(H2P2O7)2⋅2H2O+4KOH+2(HOCH2CH2)3N→
K6[CuN(НОСН2СН2)3(P2O7)2]+6H2O
K2Cu(H2P2O7)2⋅2H2O+4KOH+H2NCH2CH2NH2→
K6[Cu(H2NCH2CH2NH2)(P2O7)2]+6H2O
K2Cu(H2P2O7)2⋅2H2O+4K2CO3→K6[Cu(P2O7)2]+4KHCO3+2H2O
K2Cu(H2P2O7)2⋅2H2O+4K2CO3+H2NCH2CH2NH2→
K6[Cu(H2NCH2CH2NH2)(P2O7)2]+4KHCO3+2H2O.
Заявленный способ позволяет готовить стабильные во времени электролиты дифосфатного меднения с высокой концентрацией меди(II), не содержащие соли щелочных металлов с анионами, кроме аниона дифосфорной кислоты, например, сульфата калия или сульфата натрия, которые могут кристаллизоваться из электролита в процессе его использования и ухудшать качество медных покрытий. Преимуществом заявленного способа приготовления электролитов дифосфатного меднения перед способом, основанным на растворении свежеприготовленного дифосфата меди Cu2P2O7⋅nH2O в избытке раствора дифосфата калия K4P2O7, является то, что дигидрат бис(дигидродифосфато)купрата(II) калия формулы K2Cu(H2P2O7)2⋅2H2O, полученный заявленным способом, в отличие от Cu2P2O7⋅nH2O, является кристаллическим устойчивым при хранении веществом, имеет постоянный состав, его легко очистить от примесей промыванием на фильтре, нет необходимости использовать свежеприготовленный препарат.
Пример 1.
100 мл отработанного раствора дифосфатного меднения с концентрациями сульфата меди 48 г/л, дифосфата калия 337 г/л, борной кислоты 16 г/л, селенита натрия 0,003 г/л охлаждают до 2-4°С и при перемешивании прибавляют 153 мл раствора азотной кислоты с концентрацией 105 г/л. Раствор оставляют стоять при температуре 2-4°С в течение 10 ч. Выпавший осадок отфильтровывают на стеклянном фильтре ПОР 40 при пониженном давлении, промывают 3 раза смесью вода-этанол (1:1), высушивают на воздухе при комнатной температуре до постоянной массы.
Пример 2.
К 100 мл отработанного раствора дифосфатного меднения с концентрациями меди(II) 11 г/л, дифосфата калия 210 г/л, моноэтаноламина 11 г/л при перемешивании прибавляют сначала 53 мл раствора соляной кислоты с концентрацией хлороводорода 110 г/л, затем 150 мл уксусной кислоты. Раствор оставляют стоять при комнатной температуре в течение 5 ч. Выпавший осадок отфильтровывают на стеклянном фильтре ПОР 40 при пониженном давлении, промывают сначала 3 раза 50%-ным водным раствором уксусной кислоты, затем 2 раза этанолом и высушивают на воздухе при комнатной температуре до постоянной массы.
Пример 3.
13,2 г дигидрата бис(дигидродифосфато)купрата(II) калия, полученного по примеру 1, при комнатной температуре при перемешивании растворяют в 96 мл водного раствора с концентрациями гидроксида калия 58 г/л, триэтаноламина 38 г/л. Полученный электролит дифосфатного меднения имеет состав: бис(дифосфато)купрат(II) калия 0,25 моль/л, триэтаноламин 0,25 моль/л.
Пример 4.
В 97 мл водного раствора с концентрациями гидроксида калия 46 г/л, дифосфата калия 84,5 г/л, этилендиамина 12,5 г/л при комнатной температуре при перемешивании растворяют 10,6 г дигидрата бис(дигидродифосфато)купрата(II) калия, полученного по примеру 1. Электролит имеет состав: бис(дифосфато)купрат(II) калия 0,20 моль/л, дифосфат калия 0,25 моль/л, этилендиамин 0,20 моль/л.
Пример 5.
В 98 мл водного раствора с концентрацией карбоната калия 85,5 г/л при комнатной температуре при перемешивании растворяют 5,3 г дигидрата бис(дигидродифосфато)купрата(II) калия, полученного по примеру 1. Приготовленный электролит имеет состав:
бис(дифосфато)купрат(II) калия 0,10 моль/л, карбонат калия 0,20 моль/л, гидрокарбонат калия 0,40 моль/л.
Пример 6.
В 93 мл водного раствора с концентрацией карбоната калия 119 г/л при комнатной температуре при перемешивании растворяют 10,6 г дигидрата бис(дигидродифосфато)купрата(II) калия, полученного по примеру 1, и при перемешивании прибавляют 3,7 мл моноэтаноламина. Электролит имеет состав: бис(дифосфато)купрат(II) калия 0,20 моль/л, гидрокарбонат калия 0,80 моль/л, моноэтаноламин 0,60 моль/л.
Как видно из описания изобретения и приведенных примеров, заявленный способ позволяет с минимальной себестоимостью получать чистый кристаллический дигидрат бис(дигидродифосфато)купрата(II) калия формулы K2Cu(H2P2O7)2⋅2Н2О в форме однофазного препарата ромбической модификации, используя в качестве сырья для получения целевого продукта отходы гальванического производства - отработанные растворы дифосфатного меднения и некоторые другие отработанные растворы, а также позволяет готовить свежие устойчивые при работе электролиты дифосфатного меднения различного состава.
Реферат
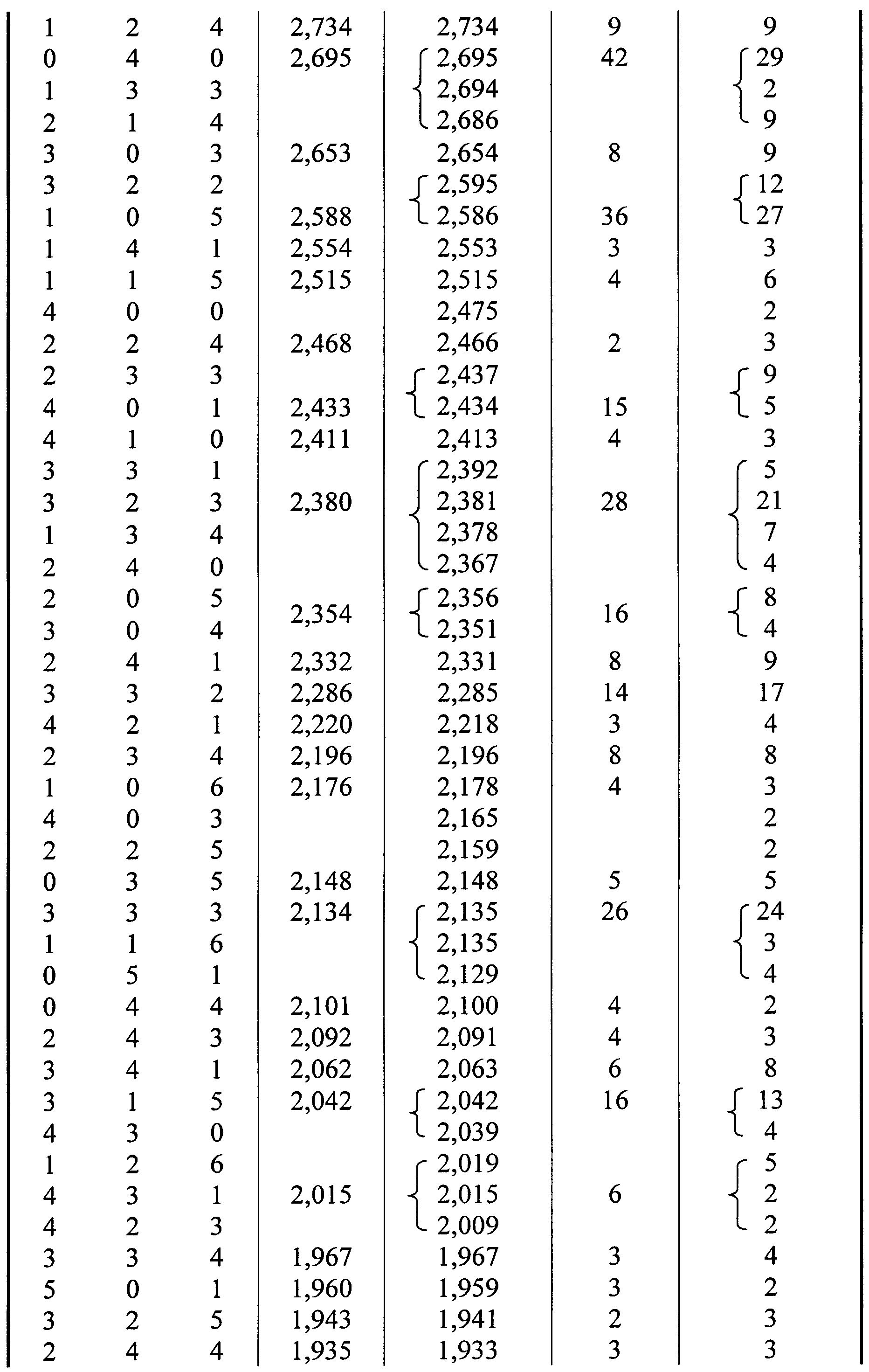
Изобретение относится к неорганической химии, к промышленной экологии и к гальванотехнике, в частности к способу получения дигидрата бис(дигидродифосфато)купрата(II) калия формулы KCu(HPO)⋅2HO, и может быть использовано для утилизации отходов гальванического производства - отработанных электролитов дифосфатного меднения и для приготовления электролитов дифосфатного меднения стали, чугуна, алюминия и его сплавов, сплавов цинка, титана, а также диэлектриков. Способ осуществляют путем приготовления реакционного водного раствора, содержащего медь(II) и дифосфат калия. Затем выдерживают реакционный водный раствор в течение времени, достаточного для образования осадка целевого продукта. Далее отделяют осадок целевого продукта от раствора. При этом для приготовления реакционного водного раствора используют жидкий отход производства покрытий - отработанный раствор дифосфатного меднения, содержащий в качестве основных компонентов медь(II) и дифосфат калия, и в реакционном водном растворе устанавливают рН от 1,0 до 5,5. Технический результат заключается в получении чистого однофазного целевого продукта ромбической модификации с низкой себестоимостью и утилизации токсичных отходов производства. 9 з.п. ф-лы, 1 табл., 6 пр.
Формула




Комментарии