Твердые формы ингибитора ttk - RU2753905C2
Код документа: RU2753905C2
Чертежи
Описание
РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет согласно предварительной заявке на патент США №62/363424, поданной 8 июля 2016 года. Полное содержание вышеупомянутой заявки включено в настоящий документ посредством ссылки.
УРОВЕНЬ ТЕХНИКИ
TTK-протеинкиназа (TTK) человека, также известная как тирозин-треонинкиназа, протеинкиназа TTK двойной специфичности, киназа Mps1 (Monopolar Spindle 1) и PYT (Phosphotyrosine-Picked Threonine Kinase), представляет собой консервативную полиспецифическую киназу, которая способна фосфорилировать остатки серина, треонина и тирозина при ее экспрессии в E.coli (Mills et al., J. Biol. Chem. 22(5): 16000-16006 (1992)). мРНК протеинкиназы TTK не экспрессируется в большинстве физиологически нормальных тканей человека (см. там же). мРНК протеинкиназы TTK экспрессируется в некоторых быстро пролиферирующих тканях, таких как яичко и тимус, а также в некоторых опухолях (например, мРНК TTK не экспрессируется в почечно-клеточной карциноме, экспрессируется в 50% образцов рака молочной железы, экспрессируется в опухолях яичка и образцах рака яичника) (см. там же). TTK экспрессируется в некоторых раковых клеточных линиях и опухолях при сравнении с соответствующими нормальными вариантами (см. там же, а также WO 02/068444 A1).
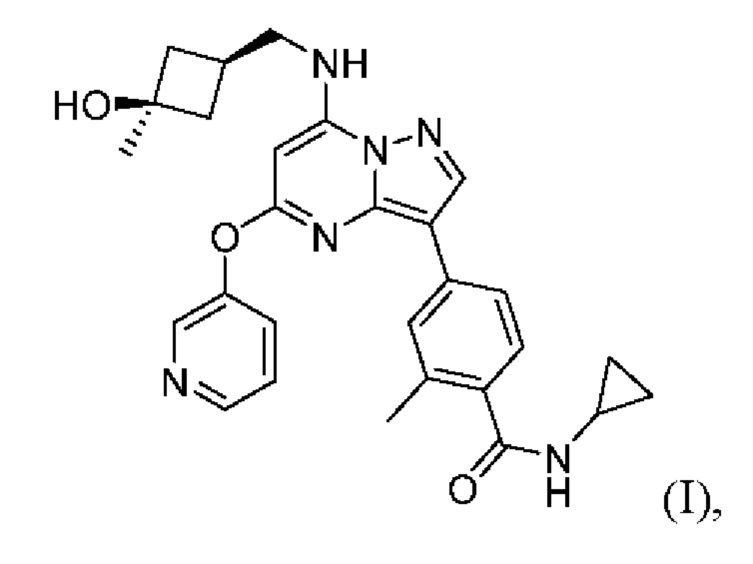
Агенты, которые ингибируют TTK, являются перспективными для лечения рака. Несколько эффективных ингибиторов TTK описаны в публикациях международных патентных заявок №WO 2014/075168 и WO 2015/070349 (полное содержание которых включено в настоящий документ посредством ссылки). Одним примером ингибитора TTK является N-циклопропил-4-(7-((((1s,3s)-3-гидрокси-3-метилциклобутил)метил)амино)-5-(пиридин-3-илокси)пиразоло[1,5-a]пиримидин-3-ил)-2-метилбензамид, структура которого приведена ниже как соединение (I):
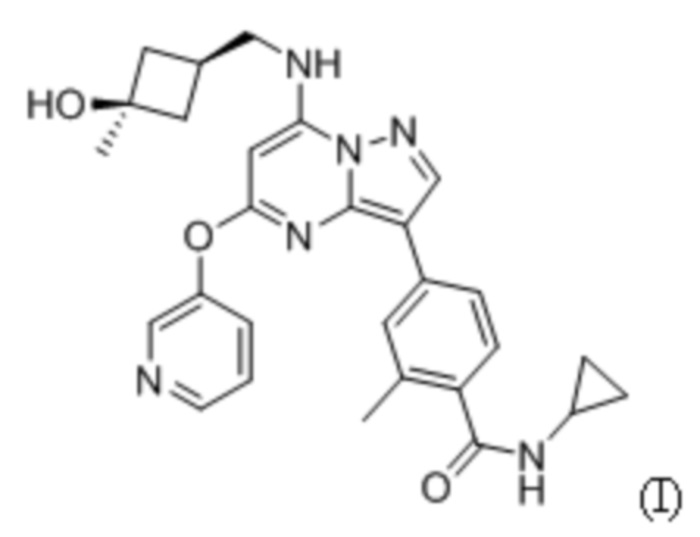
Существует потребность в солевых формах указанного соединения, которые являются кристаллическими и вообще имеют физические свойства, обеспечивающие возможность крупномасштабного производства. Также существует потребность в фармацевтических лекарственных формах, в которых указанный потенциальный лекарственный препарат является стабильным и в которых обеспечена его эффективная доставка пациенту.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новому сокристаллу соединения (I) и молекулы сокомпонента, где указанная молекула сокомпонента представляет собой фосфорную кислоту. Настоящее изобретение также относится к гидробромидной соли соединения (I), где молярное соотношение между соединением (I) и бромистоводородной кислотой составляет 1:1. По сравнению с формой свободного основания и с другими солевыми формами соединения (I), новые твердые формы демонстрируют существенно улучшенные свойства, включая повышенную растворимость в воде, температуры плавления и фармакокинетическое воздействие. В частности, как показано ниже в примере 5, сокристалл соединения (I) и фосфорной кислоты, а также соль соединения (I) с бромистоводородной кислотой в кристаллической форме обеспечивают существенно повышенные концентрации в плазме по сравнению со свободным основанием соединения (I) как у крыс, так и у собак после перорального введения. Это имеет значительное преимущество, поскольку новые твердые формы можно вводить перорально с обеспечением эффективной концентрации лекарства в плазме.
В первом варианте реализации настоящее изобретение относится к сокристаллу соединения (I) и молекулы сокомпонента или к сольвату указанного сокристалла, где молекула сокомпонента представляет собой фосфорную кислоту.
Во втором варианте реализации настоящего изобретения предложен сокристалл согласно первому варианту реализации, отличающийся тем, что молярное соотношение соединение (I): фосфорная кислота в указанном сокристалле составляет 1:2.
В третьем варианте реализации настоящего изобретения предложен сокристалл согласно первому или второму варианту реализации, отличающийся тем, что указанный сокристалл представляет собой гидрат.
В четвертом варианте реализации настоящего изобретения предложен сокристалл согласно первому, второму или третьему варианту реализации, отличающийся тем, что молярное соотношение соединение (I): фосфорная кислота: H2O в указанном сокристалле составляет 1:2:1/2.
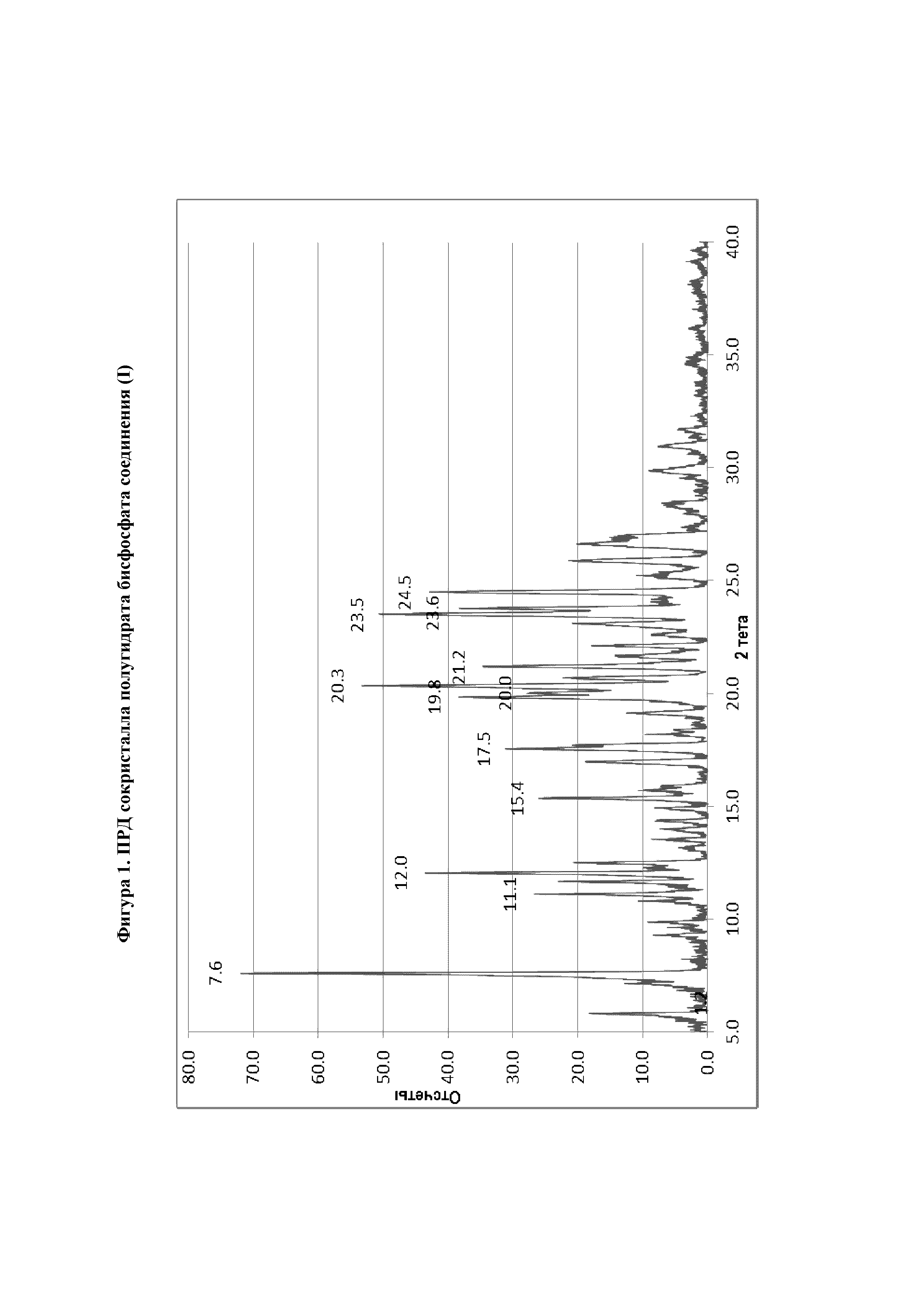
В пятом варианте реализации настоящего изобретения предложен сокристалл согласно первому, второму, третьему или четвертому варианту реализации, отличающийся тем, что на диаграмме порошковой рентгеновской дифракции указанный сокристалл характеризуется любыми тремя, четырьмя или пятью пиками при 7,6°, 12,0°, 20,3°, 23,5° и 24,5°±0,2 в градусах 2θ.
В шестом варианте реализации настоящего изобретения предложен сокристалл согласно первому, второму, третьему или четвертому варианту реализации, отличающийся тем, что на диаграмме порошковой рентгеновской дифракции указанный сокристалл характеризуется любыми тремя, четырьмя, пятью, шестью, семью, восемью, девятью, десятью или одиннадцатью пиками при 7,6°, 11,1°, 12,0°, 15,4°, 17,5°, 19,8°, 20,0°, 20,3°, 21,2°, 23,5°, 23,6° и 24,5°±0,2 в градусах 2θ.
В седьмом варианте реализации настоящего изобретения предложен сокристалл согласно первому, второму, третьему или четвертому варианту реализации, отличающийся тем, что на диаграмме порошковой рентгеновской дифракции указанный сокристалл характеризуется пиками при 7,6°, 11,1°, 12,0°, 15,4°, 17,5°, 19,8°, 20,0°, 20,3°, 21,2°, 23,5°, 23,6° и 24,5°±0,2 в градусах 2θ.
В восьмом варианте реализации настоящего изобретения предложен сокристалл согласно первому, второму, третьему или четвертому варианту реализации, отличающийся тем, что указанный сокристалл характеризуется диаграммой рентгеновской порошковой дифракции, представленной на фиг.1.
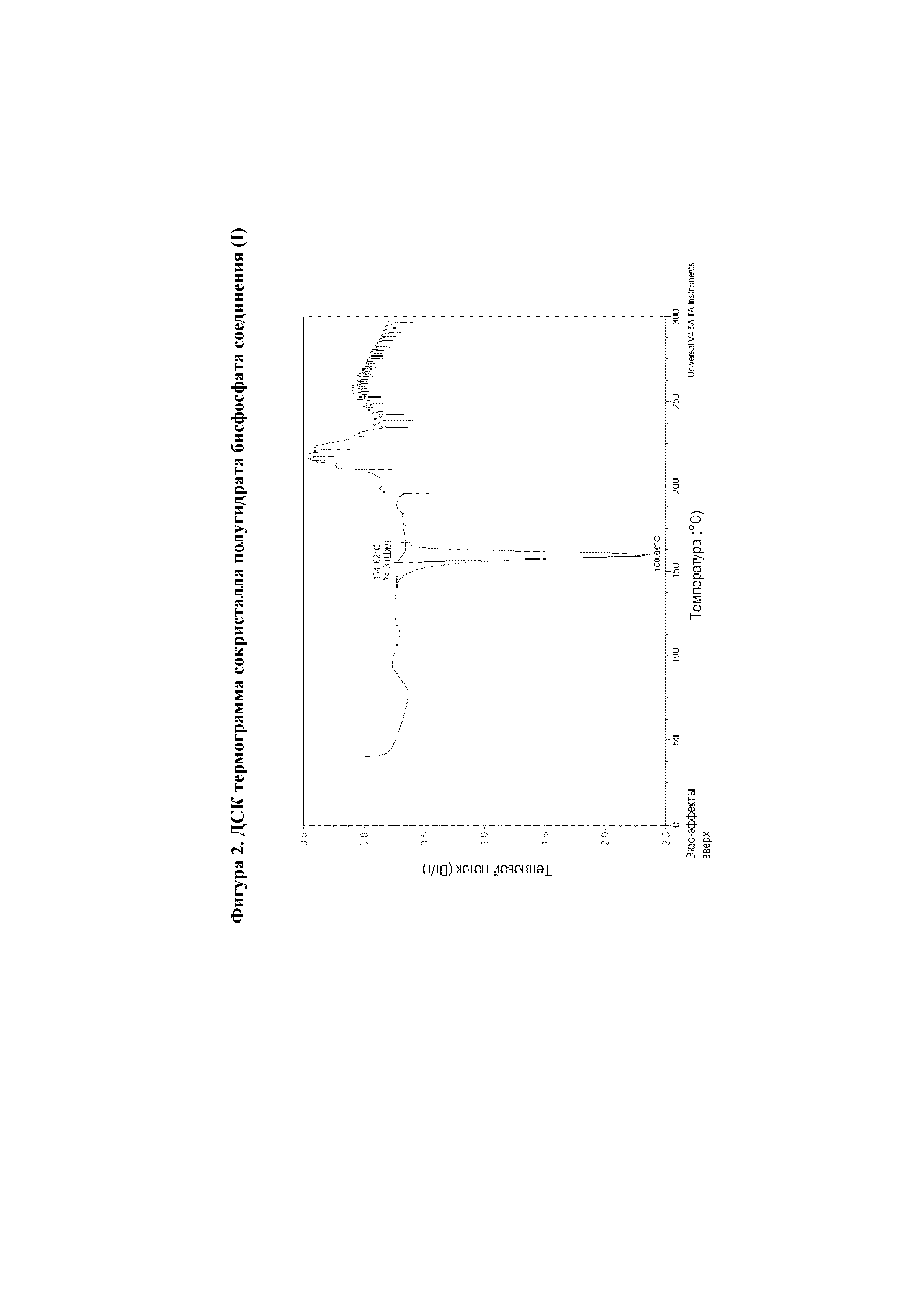
В девятом варианте реализации настоящего изобретения предложен сокристалл согласно первому, второму, третьему, четвертому, пятому, шестому, седьмому или восьмому варианту реализации, отличающийся тем, что указанный сокристалл характеризуется пиковой температурой фазового перехода на диаграмме, полученной с помощью дифференциального сканирующего калориметра (ДСК), составляющей 160±4°C.
В десятом варианте реализации настоящего изобретения предложен сокристалл согласно первому, второму, третьему, четвертому, пятому, шестому, седьмому, восьмому или девятому варианту реализации, отличающийся тем, что между атомом водорода фосфорной кислоты и атомом азота пиридинового кольца соединения (I) образована водородная связь, имеющая длину 2,5-2,9 Å.
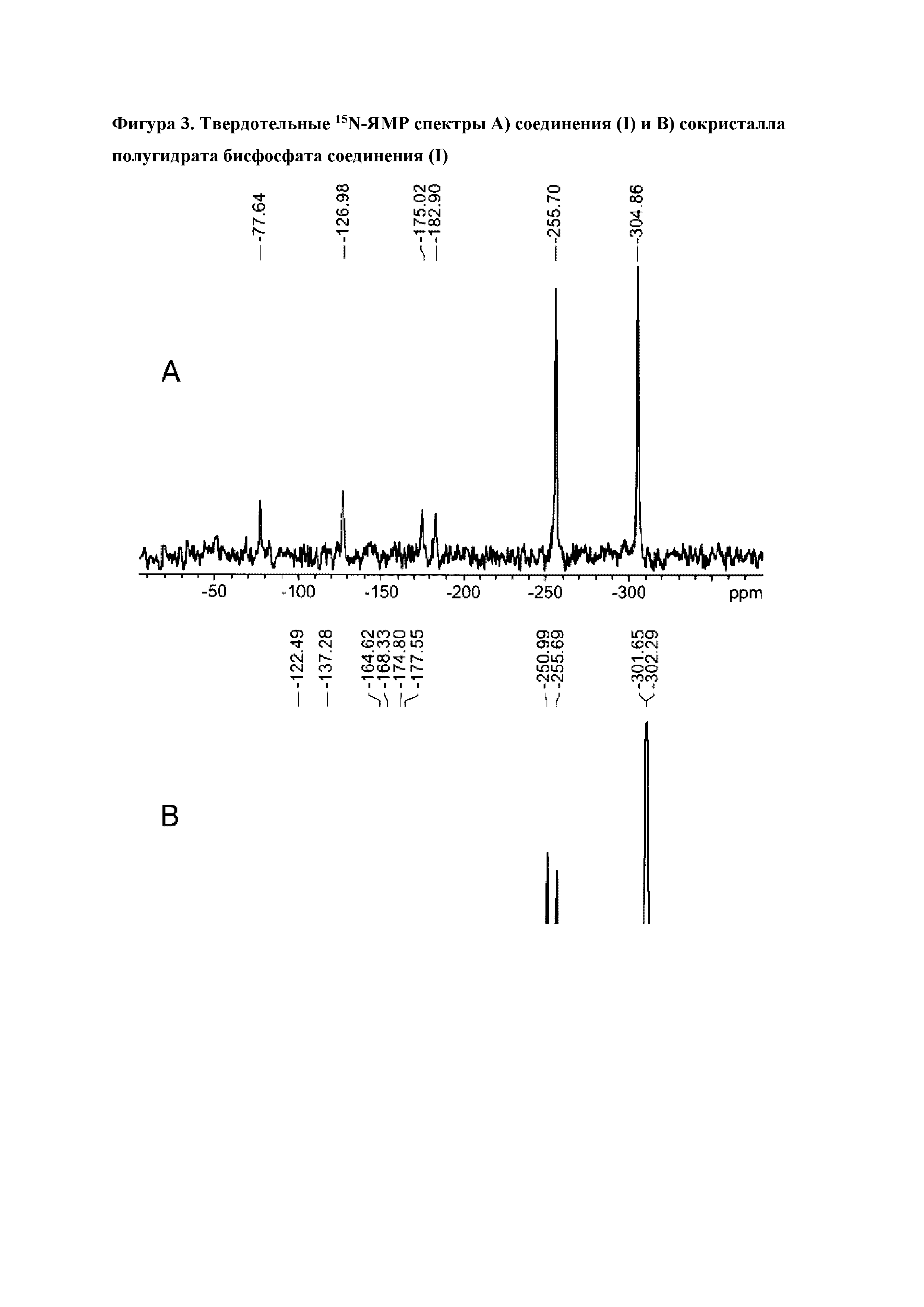
В одиннадцатом варианте реализации настоящего изобретения предложен сокристалл согласно первому, второму, третьему, четвертому, пятому, шестому, седьмому, восьмому, девятому или десятому варианту реализации, отличающийся тем, что указанный сокристалл характеризуется пиком твердотельной спектроскопии15N-ядерного магнитного резонанса (15N-ттЯМР) при -122,5±2 м.д., и интенсивность пика при -122,5 м.д. по меньшей мере на 40-70% меньше интенсивности пика при -302 м.д. В одном варианте реализации интенсивность пика при -122,5 м.д. по меньшей мере на 40%, 50%, 60% или 70% меньше интенсивности пика при -302 м.д. В другом варианте реализации указанный сокристалл характеризуется пиками твердотельной спектроскопии15N-ядерного магнитного резонанса (15N-ттЯМР), представленными на фиг.3B.
В двенадцатом варианте реализации настоящего изобретения предложена фармацевтическая композиция, содержащая сокристалл согласно первому, второму, третьему, четвертому, пятому, шестому, седьмому, восьмому, девятому, десятому или одиннадцатому варианту реализации и фармацевтически приемлемый носитель или разбавитель.
В тринадцатом варианте реализации настоящего изобретения предложена гидробромидная соль соединения (I) или ее сольват, где молярное соотношение между соединением (I) и бромистоводородной кислотой составляет 1:1.
В четырнадцатом варианте реализации настоящего изобретения предложена гидробромидная соль согласно тринадцатому варианту реализации, отличающаяся тем, что указанная соль представлена в несольватированной форме.
В пятнадцатом варианте реализации настоящего изобретения предложена гидробромидная соль согласно тринадцатому или четырнадцатому варианту реализации, отличающаяся тем, что гидробромидная соль согласно настоящему изобретению является кристаллической.
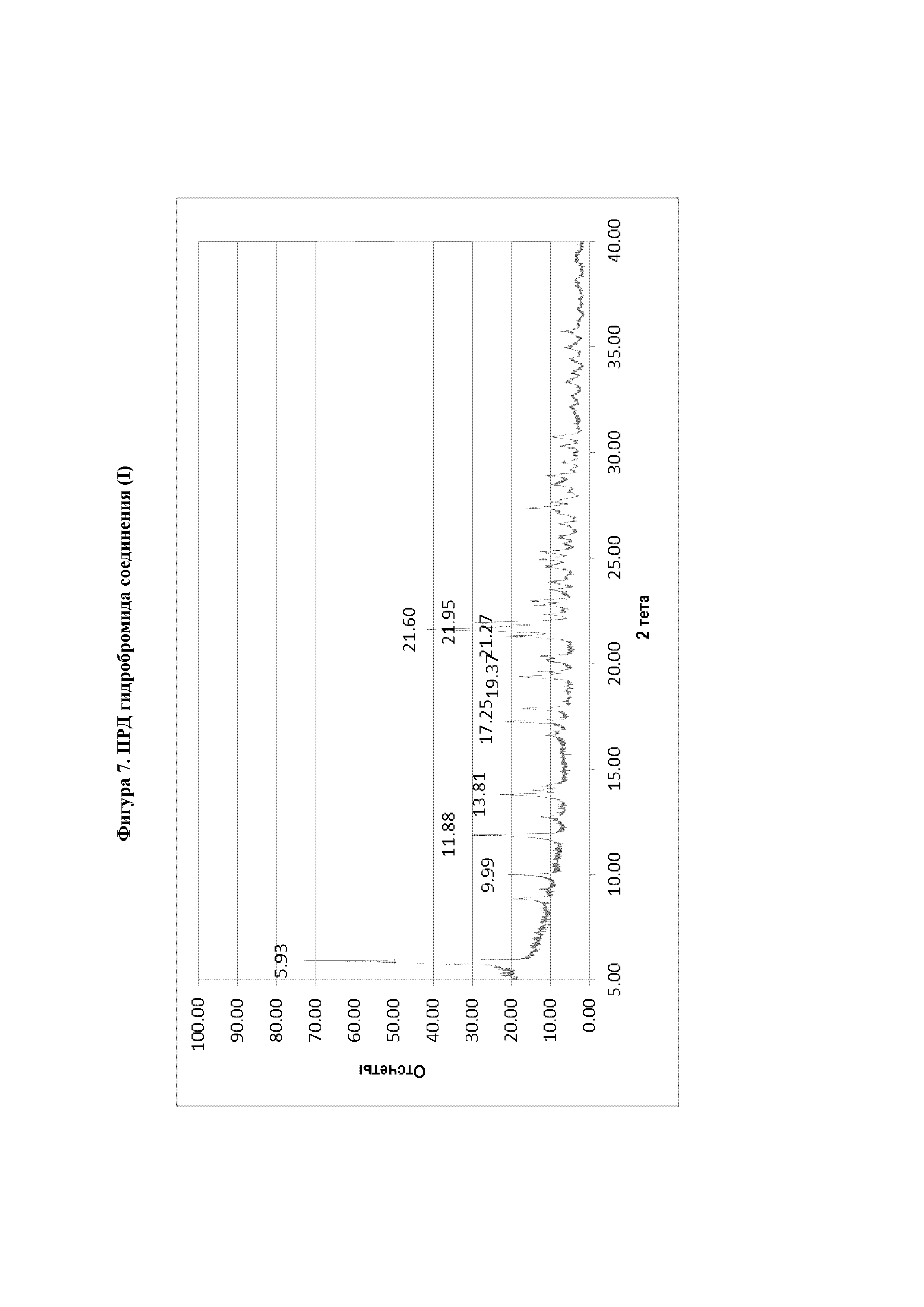
В шестнадцатом варианте реализации настоящего изобретения предложена гидробромидная соль согласно пятнадцатому варианту реализации, отличающаяся тем, что на диаграмме порошковой рентгеновской дифракции указанная кристаллическая гидробромидная соль характеризуется тремя или четырьмя пиками при 5,9°, 11,9°, 21,6° и 22,0°±0,2 в градусах 2θ.
В семнадцатом варианте реализации настоящего изобретения предложена гидробромидная соль согласно пятнадцатому варианту реализации, отличающаяся тем, что на диаграмме порошковой рентгеновской дифракции указанная кристаллическая гидробромидная соль характеризуется любыми тремя, четырьмя, пятью, шестью, семью или восемью пиками при 5,9°, 10,0°, 11,9°, 13,8°, 17,3°, 19,4°, 21,3°, 21,6° и 22,0°±0,2 в градусах 2θ.
В восемнадцатом варианте реализации настоящего изобретения предложена гидробромидная соль согласно пятнадцатому варианту реализации, отличающаяся тем, что на диаграмме порошковой рентгеновской дифракции указанная кристаллическая гидробромидная соль характеризуется пиками при 5,9°, 10,0°, 11,9°, 13,8°, 17,3°, 19,4°, 21,3°, 21,6° и 22,0°±0,2 в градусах 2θ.
В девятнадцатом варианте реализации настоящего изобретения предложена гидробромидная соль согласно пятнадцатому, шестнадцатому, семнадцатому или восемнадцатому варианту реализации, отличающаяся тем, что указанная гидробромидная соль характеризуется пиками на диаграмме рентгеновской порошковой дифракции, представленной на фиг.7.
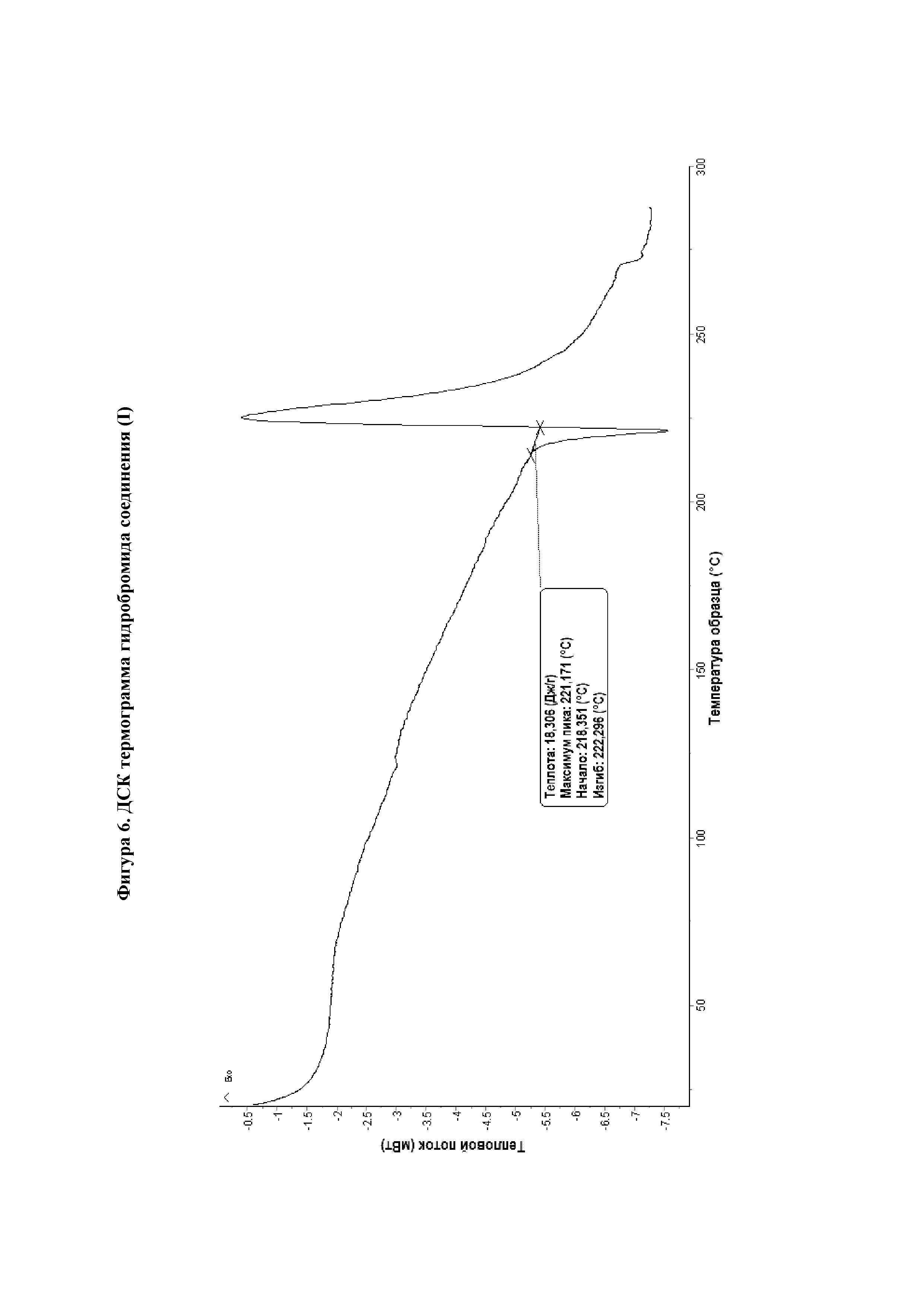
В двадцатом варианте реализации настоящего изобретения предложена гидробромидная соль согласно тринадцатому, четырнадцатому, пятнадцатому, шестнадцатому, семнадцатому, восемнадцатому или девятнадцатому варианту реализации, отличающаяся тем, что указанная гидробромидная соль характеризуется пиковой температурой фазового перехода на диаграмме, полученной с помощью дифференциального сканирующего калориметра (ДСК), составляющей 221±2°С.
В двадцать первом варианте реализации настоящего изобретения предложена фармацевтическая композиция, содержащая гидробромидную соль согласно тринадцатому, четырнадцатому, пятнадцатому, шестнадцатому, семнадцатому, восемнадцатому, девятнадцатому или двадцатому варианту реализации и фармацевтически приемлемый носитель или разбавитель.
В одном аспекте настоящего изобретения предложен способ лечения субъекта, страдающего от рака, включающий введение указанному субъекту эффективного количества сокристалла согласно первому, второму, третьему, четвертому, пятому, шестому, седьмому, восьмому, девятому, десятому или одиннадцатому варианту реализации.
В другом аспекте настоящего изобретения предложен способ лечения субъекта, страдающего от рака, включающий введение указанному субъекту эффективного количества гидробромидной соли согласно тринадцатому, четырнадцатому, пятнадцатому, шестнадцатому, семнадцатому, восемнадцатому, девятнадцатому или двадцатому варианту реализации.
Другой аспект настоящего изобретения представляет собой применение сокристалла согласно первому, второму, третьему, четвертому, пятому, шестому, седьмому, восьмому, девятому, десятому или одиннадцатому варианту реализации для производства лекарственного средства для лечения субъекта, страдающего от рака.
Другой аспект настоящего изобретения представляет собой применение гидробромидной соли согласно тринадцатому, четырнадцатому, пятнадцатому, шестнадцатому, семнадцатому, восемнадцатому, девятнадцатому или двадцатому варианту реализации для производства лекарственного средства для лечения субъекта, страдающего от рака.
Другой аспект настоящего изобретения представляет собой сокристалл согласно первому, второму, третьему, четвертому, пятому, шестому, седьмому, восьмому, девятому, десятому или одиннадцатому варианту реализации для лечения рака.
Другой аспект настоящего изобретения представляет собой гидробромидную соль согласно тринадцатому, четырнадцатому, пятнадцатому, шестнадцатому, семнадцатому, восемнадцатому, девятнадцатому или двадцатому варианту реализации для лечения рака.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На фиг.1 представлена диаграмма порошковой рентгеновской дифракции (ПРД) сокристалла полугидрата бисфосфата соединения (I).
На фиг.2 представлена термограмма дифференциального сканирующего калориметрического анализа (ДСК) сокристалла полугидрата бисфосфата соединения (I).
На фиг.3A и 3B представлены твердотельные спектры15N-ЯМР соединения (I) и сокристалла полугидрата бисфосфата соединения (I), соответственно.
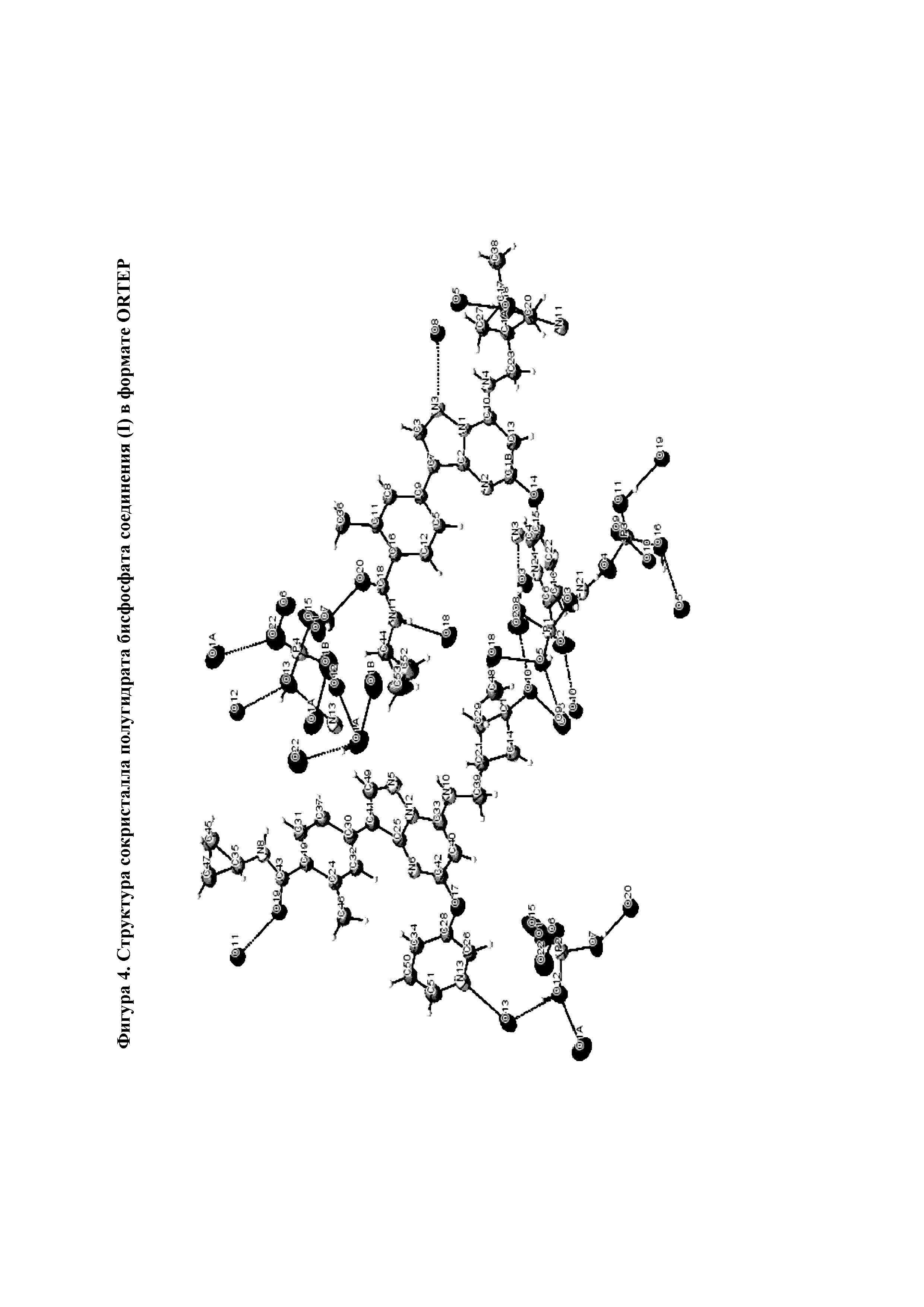
На фиг.4 представлена структура сокристалла полугидрата бисфосфата соединения (I) в формате ORTEP.
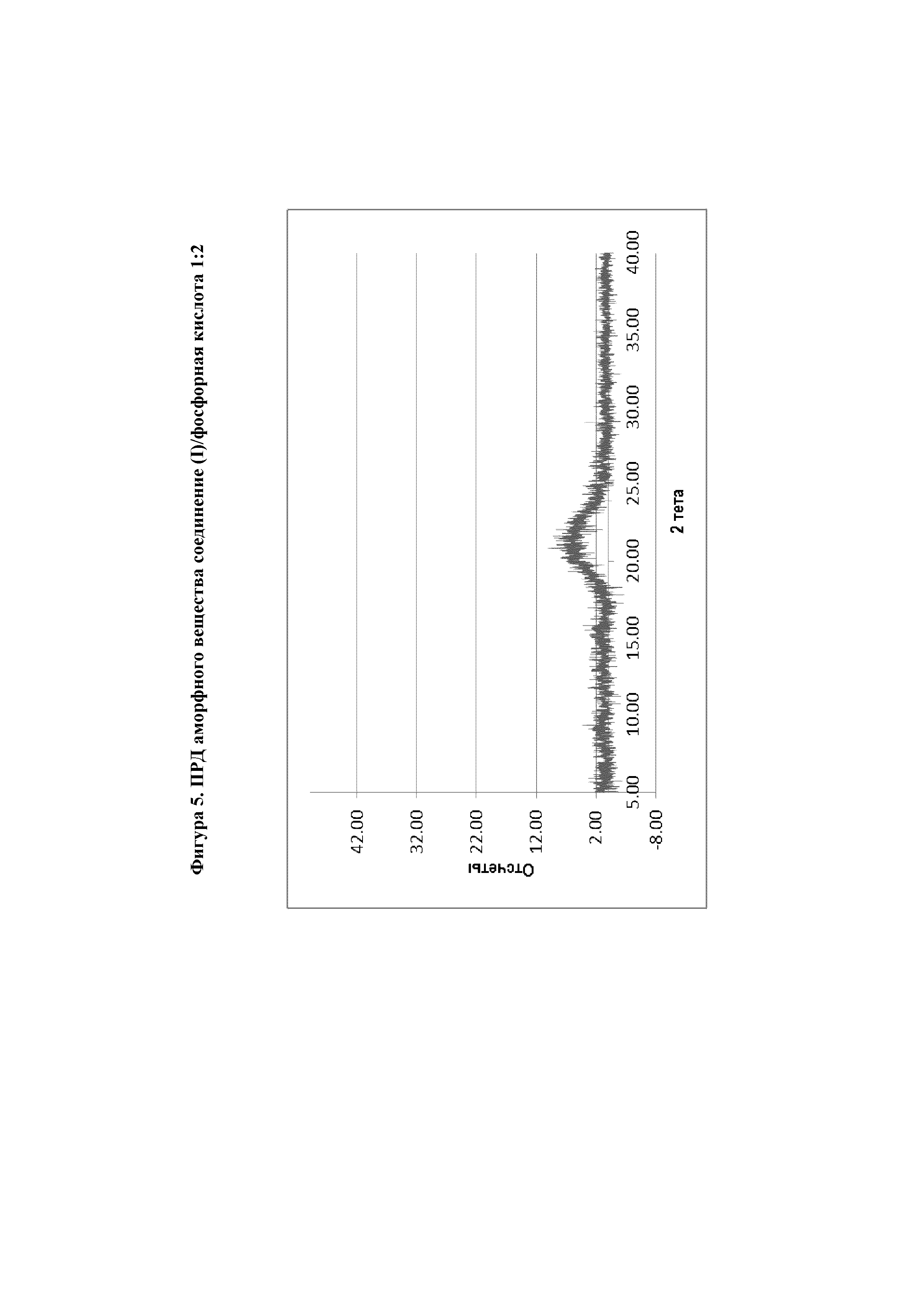
На фиг.5 представлена диаграмма ПРД аморфного вещества соединение (I)/фосфорная кислота 1:2.
На фиг.6 представлена ДСК термограмма гидробромида соединения (I) 1:1.
На фиг.7 представлена ПРД диаграмма гидробромида соединения (I) 1:1.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В настоящем изобретении предложены новые твердые формы соединения (I), которое представляет собой N-циклопропил-4-(7-((((1s,3s)-3-гидрокси-3-метилциклобутил)метил)амино)-5-(пиридин-3-илокси)пиразоло[1,5-a]пиримидин-3-ил)-2-метилбензамид. В частности, было обнаружено, что соединение (I) и фосфорная кислота могут образовывать сокристалл в четко определенных условиях с образованием негигроскопичной кристаллической формы. Также было обнаружено, что соль соединения (I) с бромистоводородной кислотой 1:1 может кристаллизоваться в четко определенных условиях с образованием негигроскопичных кристаллических форм. Обе твердые формы обеспечивают высокую биодоступность при пероральном введении.
Термин «сокристалл» (или «со-кристалл») относится к многокомпонентной системе, в которой присутствуют молекула или молекулы активного фармацевтического ингредиента, представляющие собой «хозяина» (АФИ, например, соединение (I)), и молекула или молекулы «гостя» или сокомпонента (например, фосфорной кислоты). Молекулы АФИ и сокомпонента взаимодействуют посредством водородного связывания и возможно других нековалентных взаимодействий, без ионных взаимодействий и без существенного или полного протонного обмена между молекулой АФИ и молекулой «гостя». В настоящее изобретение также включены сольваты, в том числе гидраты описанного сокристалла. В сокристалле и молекула АФИ, и молекула «гостя» (или молекула сокомпонента) существуют в виде твердого вещества при комнатной температуре, если они представлены отдельно в своей чистой форме.
«Форма сольвата» относится к твердому веществу или кристаллической форме соединения (I) в форме свободного основания или соли, в которой молекула растворителя объединена со свободным основанием соединения (I) или соответствующей солью в определенном соотношении (например, молярное соотношение соединение (I):растворитель составляет 1:1 или 1:2) как неотъемлемая часть твердого вещества или кристалла. «Несольватированная форма» относится к форме, которая является несольватированной, т.е. нет определенного соотношения между молекулой растворителя и свободным основанием соединения (I) или соответствующей солью соединения (I), и молекула растворителя по существу отсутствует (например, присутствует в количестве менее 10% по массе) в указанной твердой форме. Молекулы хорошо известных растворителей включают воду, метанол, этанол, н-пропанол и изопропанол. Новые твердые формы, описанные в настоящем изобретении, включают сольватированную форму или несольватированную форму.
В данном контексте «кристаллический» относится к твердому веществу, имеющему кристаллическую структуру, в которой отдельные молекулы имеют высокооднородную, постоянную, фиксированную химическую конфигурацию. Сокристалл соединения (I) и фосфорной кислоты может представлять собой кристаллы монокристаллической формы соединения (I):фосфорной кислоты 1:2, или смесь кристаллов различных монокристаллических форм. Монокристаллическая форма означает соединение (I) с фосфорной кислотой 1:2 в виде монокристалла или множества кристаллов, где все кристаллы имеют одинаковую кристаллическую форму.
Сокристалл соединения (I) и фосфорной кислоты
В одном варианте реализации настоящего изобретения предложен сокристалл соединения (I): фосфорной кислоты с молярным соотношением примерно 1:2 (см. примеры в данном документе). Настоящее изобретение также включает сокристалл в других молярных соотношениях соединения (I): фосфорной кислоты.
В другом варианте реализации сокристалл согласно настоящему изобретению представлен в форме сольвата (например, с водой). В одном конкретном варианте реализации молярное соотношение в указанном сокристалле является следующим: соединение (I) х 2 фосфорная кислота х 1/2 H2O.
В другом варианте реализации по меньшей мере определенный процент по массе сокристалла соединения (I) и фосфорной кислоты имеет форму монокристалла. Конкретные массовые проценты включают 70%, 72%, 75%, 77%, 80%, 82%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5%, 99,9% или массовый процент 70%-75%, 75%-80%, 80%-85%, 85%-90%, 90%-95%, 95%-100%, 70-80%, 80-90%, 90-100%. Например, в конкретном варианте реализации по меньшей мере 80% (например, по меньшей мере 90% или 99%) по массе материала в форме частиц представлены в форме монокристалла. Следует понимать, что все значения и диапазоны между указанными значениями и диапазонами включены в настоящее изобретение.
Если определенный процент по массе сокристалла соединения (I) и фосфорной кислоты 1:2 представлен в форме монокристалла, то остальная часть сокристалла представляет собой некую комбинацию аморфного вещества соединение (I)/фосфорная кислота, и/или одну или более других кристаллических форм соединение (I)/фосфорная кислота, кроме монокристаллической формы.
В сокристалле соединения (I) и фосфорной кислоты 1:2 чистота соединения (I) составляет по меньшей мере 60%, 70%, 80%, 90%, 99% или 99,9% по массе относительно других стереоизомеров, т.е. отношение массы данного стереоизомера к массе всех стереоизомеров.
Кристаллические формы гидробромида соединения (I) 1:1
В одном варианте реализации настоящего изобретения предложено соединение (I) с бромистоводородной кислотой в молярном соотношении примерно 1:1 (см. примеры в данном документе). В одном варианте реализации по меньшей мере определенный процент по массе гидробромида соединения (I) 1:1 является кристаллическим.
В другом конкретном варианте реализации по меньшей мере определенный процент по массе гидробромида соединения (I) 1:1 представлен в форме монокристалла. Конкретные массовые проценты включают 70%, 72%, 75%, 77%, 80%, 82%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99,5%, 99,9% или массовый процент 70%-75%, 75%-80%, 80%-85%, 85%-90%, 90%-95%, 95%-100%, 70-80%, 80-90%, 90-100%. Например, в одном варианте реализации по меньшей мере 80% (например, по меньшей мере 90% или 99%) по массе гидробромида соединения (I) 1:1 представлено в форме монокристалла. Следует понимать, что все значения и диапазоны между указанными значениями и диапазонами включены в настоящее изобретение.
Кристаллический гидробромид соединения (I) 1:1 может представлять собой кристаллы монокристаллической формы гидробромида соединения (I) 1:1, или смесь кристаллов различных монокристаллических форм. Монокристаллическая форма означает гидробромид соединения (I) 1:1 в виде монокристалла или множества кристаллов, где все кристаллы имеют одинаковую кристаллическую форму.
Если определенный процент по массе гидробромида соединения (I) 1:1 представлен в форме монокристалла, то остальная часть гидробромида соединения (I) 1:1 представляет собой некую комбинацию аморфного гидробромида соединения (I) 1:1, и/или одну или более других кристаллических форм гидробромида соединения (I) 1:1, кроме указанной монокристаллической формы.
В гидробромиде соединения (I) 1:1 чистота соединения (I) составляет по меньшей мере 60%, 70%, 80%, 90%, 99% или 99,9% по массе относительно других стереоизомеров, т.е. отношение массы данного стереоизомера к массе всех стереоизомеров.
Получение кристаллических форм гидробромида соединения (I) 1:1 и сокристалла соединения (I) и фосфорной кислоты
Конкретные твердые формы гидробромида соединения (I) 1:1 и сокристалл соединения (I) и фосфорной кислоты можно получать, например, посредством медленного выпаривания, медленного охлаждения и осаждения с применением антирастворителя.
В данном контексте «антирастворитель» относится к растворителю, в котором гидробромид соединения (I) 1:1 или сокристалл соединения (I) и фосфорной кислоты имеет низкую растворимость, и который вызывает выпадение из раствора в осадок указанной бромидной соли или сокристалла в форме мелкого порошка или кристаллов.
Альтернативно, гидробромид соединения (I) 1:1 (или сокристалл соединения (I) и фосфорной кислоты) можно перекристаллизовать из подходящего растворителя с добавлением или без добавления затравочного кристалла.
В одном варианте реализации настоящего изобретения предложен способ получения сокристалла соединения (I) и фосфорной кислоты, включающий:
смешивание суспензии соединения (I) и фосфорной кислоты в подходящем растворителе; и удаление растворителя. Подходящие растворители включают, но не ограничиваются этим, ацетон, диэтиловый эфир, MeOH/ТГФ, уксусную кислоту и 1,4-диоксан. При использовании в способе получения MeOH/ТГФ, соотношение между указанными двумя растворителями составляет от 3:2 до 2:3 (об.:об.).
В одном варианте реализации молярное отношение между соединением (I) и фосфорной кислотой, используемой при получении, составляет от 1:2 до 1:8.
В одном варианте реализации настоящего изобретения предложен способ получения гидробромида соединения (I) 1:1. В частности, к суспензии соединения (I) в подходящем растворителе (например, бутаноле и/или МЭК) добавляют раствор HBr (например, в растворе бутанола и/или МЭК); полученную смесь нагревают при 60°С в течение 2 часов, а затем выдерживают при 5°С в течение ночи. Затем твердое вещество выделяют фильтрованием. Подходящие растворители включают, но не ограничиваются этим, бутанол и/или МЭК, и/или воду.
Получение каждой конкретной твердой формы описано ниже в экспериментальной части.
Способы лечения
Другой аспект настоящего описания относится к способу лечения субъекта, страдающего от рака, включающему введение указанному субъекту эффективного количества сокристалла соединения (I) и фосфорной кислоты (или гидробромидной соли соединения (I)), описанного в настоящем документе. В одном варианте реализации сокристаллы (или соли соединения (I) с бромистоводородной кислотой), описанные в настоящем документе, подавляют рост опухоли. Например, сокристаллы (или соли соединения (I) с бромистоводородной кислотой), описанные в настоящем документе, подавляют рост опухоли, сверхэкспрессирующей TTK.
Раковые заболевания, которые можно лечить (включая снижение вероятности рецидива) способами согласно настоящему описанию, включают рак легкого, рак молочной железы, рак толстой кишки, рак головного мозга, нейробластому, рак предстательной железы, меланому, мультиформную глиобластому, рак яичника, лимфому, лейкоз, меланому, саркому, паранеоплазию, остеосаркому, герминому, глиому и мезотелиому. В одном варианте реализации рак выбран из лейкоза, острого миелоидного лейкоза, хронического миелогенного лейкоза, рака молочной железы, рака головного мозга, рака толстой кишки, рака толстой и прямой кишки, рака головы и шеи, гепатоцеллюлярной карциномы, аденокарциномы легкого, метастатической меланомы, рака поджелудочной железы, рака предстательной железы, рака яичника и рака почки. В одном варианте реализации рак представляет собой рак легкого, рак толстой кишки, рак головного мозга, нейробластому, рак предстательной железы, меланому, мультиформную глиобластому или рак яичника. В другом варианте реализации рак представляет собой рак поджелудочной железы, рак предстательной железы, рак легкого, меланому, рак молочной железы, рак толстой кишки или рак яичника. В другом варианте реализации рак представляет собой рак молочной железы, рак толстой кишки и рак яичника. В другом варианте реализации рак представляет собой рак молочной железы. В другом варианте реализации рак представляет собой рак молочной железы базального подтипа или рак молочной железы люминального подтипа B. В другом варианте реализации рак представляет собой рак молочной железы базального подтипа, сверхэкспрессирующий TTK. В другом варианте реализации рак молочной железы базального подтипа представляет собой рак молочной железы, негативный к ER (рецептору эстрогена), HER2 и PR (рецептору прогестерона). В другом варианте реализации рак представляет собой рак мягкой ткани. «Рак мягкой ткани» является принятым в данной области техники термином, включающим опухоли, происходящие из любой мягкой ткани тела. Такие мягкие ткани соединяют, поддерживают или окружают различные структуры и органы тела, включая, но не ограничиваясь этим, гладкую мускулатуру, скелетную мускулатуру, сухожилия, фиброзные ткани, жировые ткани, кровеносные и лимфатические сосуды, периваскулярную ткань, нервы, мезенхимальные клетки и синовиальные ткани. Таким образом, рак мягких тканей может быть раком жировой ткани, мышечной ткани, нервной ткани, соединительной ткани, кровеносных сосудов, лимфатических сосудов и фиброзных тканей. Рак мягких тканей может быть доброкачественным или злокачественным. В целом, злокачественный рак мягких тканей называют саркомой или саркомой мягких тканей. Существует множество типов опухолей мягких тканей, включая липому, липобластому, гиберному, липосаркому, лейомиому, лейомиосаркому, рабдомиому, рабдомиосаркому, нейрофиброму, шванному (неврилемому), неврому, злокачественную шванному, нейрофибросаркому, нейрогенную саркому, узловатый теносиновит, синовиальную саркому, гемангиому, гломусную опухоль, гемангиоперицитому, гемангиоэндотелиому, ангиосаркому, саркому Капоши, лимфангиому, фиброму, эластофиброму, поверхностный фиброматоз, фиброзную гистиоцитому, фибросаркому, фиброматоз, возвышающуюся дерматофибросаркому (DFSP), злокачественную фиброзную гистиоцитому (MFH), миксому, зернисто-клеточную миобластому, злокачественную мезенхимому, альвеолярную саркому мягких тканей, эпителиоидную саркому, светлоклеточную саркому и десмопластическую мелкоклеточную опухоль. В конкретном варианте реализации рак мягкой ткани представляет собой саркому, выбранную из группы, состоящей из фибросаркомы, желудочно-кишечной саркомы, лейомиосаркомы, дедифференцированной липосаркомы, плеоморфной липосаркомы, злокачественной фиброзной гистиоцитомы, круглоклеточной саркомы и синовиальной саркомы.
В данном контексте «лечение субъекта, страдающего от рака» включает частичное или существенное достижение одного из следующих: остановка роста, уменьшение степени рака (например, уменьшение размера опухоли), подавление скорости роста рака, облегчение или улучшение клинического симптома или показателя, связанного с раком (такого как компоненты ткани или сыворотки), или увеличение продолжительности жизни субъекта; а также уменьшение вероятности рецидива рака.
В данном контексте термин «уменьшение вероятности рецидива рака» означает частичное или полное подавление, отсрочку повторного возникновения рака у первичного очага или вблизи него и/или у вторичного очага после периода ремиссии. Он также означает, что рак менее вероятно повторно возникнет при обеспечении лечения, описанного в настоящем документе, чем при его отсутствии.
В данном контексте термин «ремиссия» относится к состоянию ракового заболевания, при котором клинические симптомы или показатели, связанные с раком, исчезают или не могут быть обнаружены, обычно после успешного лечения субъекта противораковой терапией.
В целом, эффективное количество соединения, предложенного в настоящем документе, варьируется в зависимости от различных факторов, таких как данное лекарство или соединение, фармацевтическая лекарственная форма, способ введения, тип заболевания или расстройства, идентичность субъекта или реципиента, подлежащего лечению, и т.п., но тем не менее специалист в данной области техники может определить его обычным образом. Эффективное количество соединения согласно настоящему описанию может быть легко определено специалистом в данной области стандартными способами, известными в данной области техники.
Термин «эффективное количество» означает количество, которое при введении субъекту приводит к преимущественным или требуемым результатам, включая клинические результаты, например, ингибирует, подавляет или ослабляет рак (например, по результатам определения на основании клинических симптомов или количества раковых клеток) у субъекта, по сравнению с контролем.
В одном варианте реализации эффективное количество гидробромида соединения (I) 1:1 (или сокристалла соединения (I) и фосфорной кислоты) составляет от примерно 0,01 до примерно 1000 мг/кг массы тела. Специалистам в данной области техники понятно, что некоторые факторы могут влиять на дозу, необходимую для эффективного лечения субъекта, страдающего от рака, и такие факторы включают, но не ограничиваются этим, тяжесть заболевания или расстройства, предшествующее лечение, общее состояние здоровья и/или возраст субъекта и другие присутствующие заболевания.
Кроме того, схема «лечения» субъекта эффективным количеством соединения согласно настоящему изобретению может состоять из однократного введения или, альтернативно, может включать серию введений. Например, гидробромид соединения (I) 1:1 (или сокристалл соединения (I) и фосфорной кислоты) можно вводить по меньшей мере один раз в неделю. Однако в другом варианте реализации указанное соединение можно вводить субъекту от примерно одного раза в неделю до одного раза в сутки для данного лечения. Продолжительность периода лечения зависит от различных факторов, таких как тяжесть заболевания, возраст пациента, концентрация и активность соединения согласно настоящему изобретению, или их комбинации. Также следует понимать, что эффективную дозу соединения, используемого для лечения или профилактики, можно увеличивать или уменьшать в течение конкретной схемы лечения или профилактики. Изменения дозы могут возникать и проявляться в стандартных диагностических анализах, известных в данной области техники. В некоторых случаях может потребоваться постоянное введение.
«Субъект» представляет собой млекопитающее, предпочтительно человека, но также может представлять собой животное, нуждающееся в ветеринарном лечении, например, домашние животные (например, собаки, кошки и т.п.), сельскохозяйственные животные (например, коровы, овцы, свиньи, лошади и т.п.) и лабораторные животные (например, крысы, мыши, морские свинки и т.п.).
Соединения согласно настоящему изобретению можно вводит пациенту в различных формах, в зависимости от выбранного способа введения, как понятно специалистам в данной области техники. Соединения согласно настоящему изобретению можно вводить, например, пероральным, парентеральным, буккальным, сублингвальным, назальным, ректальным способом, с помощью пластыря, помпы или посредством трансдермального введения и фармацевтических композиций, составленных соответствующим образом. Парентеральное введение включает внутривенный, внутрибрюшинный, подкожный, внутримышечный, транс-эпителиальный, назальный, интрапульмональный, интратекальный, ректальный и местный способы введения. Парентеральное введение можно осуществлять непрерывной инфузией в течение выбранного периода времени.
Фармацевтические композиции
Гидробромид соединения (I) 1:1 (или сокристалл соединения (I) и фосфорной кислоты), описанный в настоящем документе, можно надлежащим образом составлять в фармацевтические композиции для введения субъекту.
В одном варианте реализации настоящего изобретения предложена фармацевтическая композиция, содержащая гидробромид соединения (I) 1:1 (или сокристалл соединения (I) и фосфорной кислоты), как описано выше, и фармацевтически приемлемый носитель или разбавитель.
Фармацевтические композиции согласно настоящему описанию необязательно содержат один или более фармацевтически приемлемых носителей и/или разбавителей, таких как лактоза, крахмал, целлюлоза и декстроза. Также можно включать другие вспомогательные вещества, такие как вкусоароматические агенты; подсластители; и консерванты, такие как метил-, этил-, пропил- и бутилпарабены. Более полный перечень подходящих вспомогательных веществ представлен в книге Handbook of Pharmaceutical Excipients (5ое изд., Pharmaceutical Press (2005)). Специалистам в данной области техники известно, как получать лекарственные формы, подходящие для различных способов введения. Традиционные способы и ингредиенты для выбора и получения подходящих лекарственных форм описан, например, в Remington, Pharmaceutical Sciences (2003 - 20-ое издание) и в фармакопее США: Национальный формуляр (USP 24 NF19), опубликованной в 1999 году. Носители, разбавители и/или вспомогательные вещества являются «приемлемыми» в том смысле, что они совместимы с другими ингредиентами фармацевтической композиции и не являются вредными для реципиента.
Как правило, для перорального терапевтического введения соединение согласно настоящему описанию можно объединять со вспомогательным веществом и использовать в форме таблеток для проглатывания, буккальных таблеток, пастилок, капсул, эликсиров, суспензий, сиропов, облаток и т.п.
Как правило, для парентерального введения растворы соединения согласно настоящему описанию обычно можно получать в воде, надлежащим образом смешанной с поверхностно-активным веществом, таким как гидроксипропилцеллюлоза. Дисперсии также можно получать в глицерине, жидких полиэтиленгликолях, ДМСО и их смесях со спиртом или без спирта, а также в маслах. В обычных условиях хранения и применения указанные препараты содержат консервант для предотвращения роста микроорганизмов.
Как правило, для применения методом инъекции подходят стерильные водные растворы или дисперсии, а также стерильные порошки соединения, описанного в настоящем документе, для экстемпорального получения стерильных растворов или дисперсий для инъекций.
Настоящее изобретение иллюстрировано следующими примерами, которые никоим образом не предназначены в качестве ограничения.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Сокращения:
Условия анализа
Порошковая рентгеновская дифракция (ПРД)
Анализ ПРД проводили на дифрактометре Bruker D8 Discover с конфигурацией DAVINCI, сканируя образцы от 1,5 до 45° углов 2θ. Использовали приблизительно 1-2 мг каждого исследуемого образца.
Рентгеновская дифракция монокристалла (РД монокристалла)
Анализ РД монокристалла проводили при 293 K на дифрактометре X-Calibur производства Oxford Diffractions с источником Mo Kα и графитовым монохроматором. Определение и уточнение структур осуществляли с помощью SHELXS-97 и SHELXL-97, соответственно.
Термогравиметрический анализ/анализ дифференциальной сканирующей калориметрии (ТГА/ДСК)
3-10 мг материала взвешивали в открытом алюминиевом тигле и помещали в калориметр для одновременного термогравиметрического анализа/дифференциальной сканирующей калориметрии (ТГА-ДТА/ДСК) Setaram LABSYS EVO с автоматом и выдерживали при комнатной температуре. Затем образец нагревали со скоростью 10°С/мин от 30°С до 350°С, и в течение этого времени записывали изменение массы образца, а также любые дифференциальные термические события. В качестве продувочного газа использовали азот со скоростью потока 100 см3/мин. Перед анализом прибор взвешивали и калибровали температуру, используя эталонную массу 100 мг и индиевый эталонный стандарт, соответственно. Анализ образца проводили с помощью программного обеспечения CALISTO, где соответствующую потерю массы и температуру термических событий регистрировали как температуру начала, измеренную по спецификации производителя. Все анализы проводили со скоростью нагревания 10°С/мин. и вычитали фоновое значение.
Дифференциальная сканирующая калориметрия (ДСК)
1-4 мг вещества взвешивали в алюминиевом тигле для ДСК и негерметично закрывали алюминиевой крышкой. Затем тигель с образцом помещали в прибор TA Instruments Q2000 (оснащенный охладителем). По достижении стабильного теплового потока при 35°С образец и эталон нагревали до 300°С со скоростью 10°С/мин. и наблюдали обусловленный этим тепловой поток. Перед анализом прибор калибровали по температуре и тепловому потоку, используя эталонный индиевый стандарт.Анализ образца проводили с помощью программного обеспечения TA Universal Analysis 2000, где температуру термических событий регистрировали как температуру начала и пиковую температуру, измеренную по спецификации производителя.
Спектроскопия1H-ядерного магнитного резонанса (1H-ЯМР)
Измерения ядерного магнитного резонанса проводили на приборе Bruker Avance DRX 400 при 400 МГц и комнатной температуре, используя ДМСО-d6 или CD3OD в качестве растворителя, без внутреннего стандарта.
Твердотельная спектроскопия15N-ядерного магнитного резонанса (15N-ттЯМР)
Анализ твердотельного15N ядерного магнитного резонанса проводили на твердотельном спектрометре Bruker Avance III при 500 МГц. Спектры15N записывали посредством CP-MAS (кросс-поляризации при вращении под магическим углом) на измерительной головке Bruker 4 мм, используя два радиочастотных канала и частоту вращения образца 7 кГц.
Пример 1: Комбинаторный отбор солей
Отбор солей проводили с применением шести растворителей (H2O, ДМСО, 1,4-диоксан, уксусная кислота, MeOH/ТГФ (1:1), 1-BuOH/МЭК 1:1 и NMP) и двенадцати фармацевтически приемлемых кислот (HCl, HBr, H3PO4, H2SO4, pTSA, BSA, нафталинсульфоновая кислота, этансульфоновая кислота, метансульфоновая кислота, этандисульфоновая кислота, L-малеиновая кислота и 2-аминосульфоновая кислота).
Кислоты добавляли к соединению (I) (15 мг, раствор или суспензия в данном растворителе) либо в твердом виде, либо в виде 10% раствора в соответствующем растворителе. Для всех растворителей, кроме NMP, использовали отношение кислоты к основанию 1,05:1 и 2,2:1. Для экспериментов с NMP использовали только молярное отношение 2,2:1. Полученные растворы выдерживали при комнатной температуре в течение ночи. Твердые вещества собирали и анализировали. Оставшиеся растворы охлаждали или обрабатывали антирастворителем. При отсутствии образования осадка после охлаждения/обработки антирастворителем, растворы подвергали вакуумной сушке. Наконец, все выделенные твердые вещества помещали в климатическую камеру при 40°С и ОВ 75% на 5 дней и проводили повторный анализ. Затем повторно оценивали комбинации растворителя и противоиона, подходящие для образования соли с соединением (I), в укрупненном масштабе.
Кристаллический материал получали с исследованными одиннадцатью из двенадцати противоионов. Эксперименты с 2-аминосульфоновой кислотой приводили лишь к выделению материала в форме свободного основания. В экспериментах с HCl, метансульфоновой кислотой, этандисульфоновой кислотой и p-TSA получали несколько кристаллических форм. Стресс-исследования приводили к превращению в дополнительные кристаллические формы, что свидетельствует о склонности к полиморфизму. Соли, полученные в экспериментах с малеиновой кислотой, были сольватированными, имели низкую кристалличность и разрушались во время анализа ДСК. Соли, полученные из нафталинсульфоновой кислоты, бензолсульфоновой кислоты и серной кислоты, были чрезвычайно гигроскопичными.
Кристаллический материал, полученный в экспериментах с бромистоводородной кислотой и фосфорной кислотой, как показано, имел повышенную растворимость по сравнению со свободным основанием, низкую гигроскопичность и был стабильным в стрессовых условиях (40°/75% ОВ, 80°С, естественное освещение в течение 7 дней). Обе твердые формы разрушались под действием окислительного стресса (3% водн. H2O2). Свойства каждой выделенной кристаллической формы представлены в таблице 1.
Таблица 1. Свойства кристаллических форм соединения (I)
Пример 2: Получение сокристалла соединения (I) и фосфорной кислоты 1:2
Способ А: Соединение (I) (605,5 мг, 1 экв.) суспендировали в ацетоне (14 мл). Суспензию перемешивали при комнатной температуре в течение 5 минут для достижения гомогенизации. Затем быстро добавляли раствор H3PO4 (459,46 мг, 4 экв.) в ацетоне (6 мл). Получали желтый гель и выдерживали смесь при комнатной температуре при перемешивании в течение 2 дней. Затем отфильтровывали осадок, промывали ацетоном (20 мл) и сушили при 4°С/10 мбар. Затем полученное твердое вещество описывали как полугидрат бисфосфата с помощью ТГА, ПРД, ДСК,1H ЯМР, твердотельной15N ЯМР, ИК, Рамановской спектроскопии и рентгеновской кристаллографии монокристалла.
Способ В: Раствор H3PO4 (494,7 г, 4 экв.) в MeOH/ТГФ (10,5 мл, 1:1 об./об.) добавляли в пробирку, содержащую соединение (I) (506,88 мг, 1 экв.). Полученную смесь перемешивали при комнатной температуре до получения желтого раствора. Раствор оставляли выпариваться при 50°С и атмосферном давлении при перемешивании с помощью вортекса. Получали желтый гель и затем добавляли ацетон (15 мл), и оставляли на вортексе при комнатной температуре на 1 день. Суспензию оставляли перемешиваться еще на 3 дня. Затем отфильтровывали кристаллическое твердое вещество и определяли, что оно является идентичным по кристаллической форме материалу, полученному способом A.
1H ЯМР (400 МГц, CD3OD) δ 8,53-8,58 (м, 1H), 8,46-8,50 (м, 1H), 8,36 (с, 1H), 7,80-7,86 (м, 1H), 7,72-7,76 (м, 1H), 7,55-7,61 (м, 2H), 7,18 (д, J=8,0 Гц, 1H), 5,92 (с, 1H), 3,52 (д, J=6,8 Гц, 2H), 2,77-2,86 (м, 1H), 2,28-2,38 (м, 1H), 2,25 (с, 3H), 2,18-2,24 (м, 2H), 1,88-1,99 (м, 2H), 1,37 (с, 3H), 0,75-0,84 (м, 2H), 0,54-0,64 (м, 2H).
Таблица 2. ПРД полугидрата бисфосфата соединения (I)
Данные рентгеновской кристаллографии монокристалла полученного фосфатного комплекса соединения (I) свидетельствуют о том, что каждая элементарная ячейка содержит 2 молекулы соединения (I), 4 молекулы фосфорной кислоты и 1 молекулу воды. Все водородные связи в полученном комплексе имеют длину 2,5-2,9 Å, что говорит об отсутствии ионного характера между протонами фосфорной кислоты и основным атомом азота пиридинового кольца. Полученный результат согласуется с наблюдениями твердотельной спектроскопии15N-ЯМР. В совокупности, полученные результаты подтверждают, что полугидрат бисфосфата соединения (I) имеет форму сокристаллического комплекса. Кристаллографические данные полугидрата бисфосфата соединения (I) представлены в таблице 3. Изображение в формате ORTEP представлено на фиг.4.
Таблица 3. Кристаллографические данные для полугидрата бисфосфата соединения I
Твердотельный анализ15N-ЯМР проводили на свободном основании соединения (I) и на полугидрате бисфосфата соединения (I). Наложенные друг на друга спектры представлены на фиг.3. Сдвиг и относительная интенсивность пика пиридинового атома азота в фосфатном соединении по сравнению со свободным основанием указывают на то, что взаимодействие между данными атомами по своей природе является водородным связыванием и не имеет ионного характера. Не выявлено никакого смещения протона к пиридильному атому азота, что подтверждает тот факт, что полученный фосфат является сокристаллом.
Полугидрат бисфосфата соединения (I) также можно получить кристаллизацией аморфного или полукристаллического сокристалла соединения (I) и H3PO4 с использованием условий, представленных в таблице 4. Альтернативно, можно инициировать кристаллизацию вязкого геля с получением полугидрата бисфосфата соединения (I) посредством нанесения геля вместе с небольшим количеством твердого вещества на стеклянную поверхность большего размера и соскабливания его с помощью шпателя. Кроме того, гель можно кристаллизовать посредством обработки ультразвуком.
Таблица 4. Кристаллизация полугидрата бисфосфата соединения (I)
Пример 3: Получение аморфного вещества соединение (I)/фосфорная кислота 1:2
К смеси MeOH/ТГФ (9,7 мл, 1:1 об./об.) добавляли соединение (I) (500 мг, 1 экв.) в стеклянной пробирке при комнатной температуре. Затем добавляли H3PO4 (238 мг, 2 экв.) и перемешивали полученную смесь при комнатной температуре в течение 2 часов. Раствор изменил цвет, но осадок не образовался. Затем прозрачный раствор оставляли стоять на 1 день при 5°С, и затем еще на 1 день при -20°С.Твердое вещество не образовалось. Затем растворитель удаляли при 30°С/10 мбар и анализировали полученное твердое вещество с помощью ПРД, и было установлено, что оно является аморфным.1H ЯМР (400 МГц, CD3OD) δ 8,53-8,58 (м, 1H), 8,46-8,50 (м, 1H), 8,36 (с, 1H), 7,80-7,86 (м, 1H), 7,72-7,76 (м, 1H), 7,55-7,61 (м, 2H), 7,18 (д, J=8,0 Гц, 1H), 5,92 (с, 1H), 3,52 (д, J=6,8 Гц, 2H), 2,77-2,86 (м, 1H), 2,28-2,38 (м, 1H), 2,25 (с, 3H), 2,18-2,24 (м, 2H), 1,88-1,99 (м, 2H), 1,37 (с, 3H), 0,75-0,84 (м, 2H), 0,54-0,64 (м, 2H).
Аморфный материал также можно получить посредством растворения соединения (I) в 1,4-диоксане и добавления этилацетата или ацетона в качестве антирастворителя, или посредством растворения соединения (I) в 1-этоксиэтаноле и добавления этилацетата в качестве антирастворителя.
Пример 4: Получение кристаллической соли соединения (I)/HBr 1:1
К смеси 1-бутанола и МЭК (60 мл, 1:1 об./об.) добавляли соединение (I) (502 мг, 1 экв.). Суспензию нагревали при 60°С и добавляли HBr (4,8% раствор в 1-бутаноле и МЭК (2,5 мл, 2 экв.). Смесь перемешивали при 60°С в течение 2 часов, а затем при 5°С в течение ночи. Затем твердое вещество выделяли фильтрованием, промывали диэтиловым эфиром и описывали как гидробромид с помощью ПРД, ТГА, ИК, Рамановской спектроскопии и ДСК.
Таблица 5. ПРД гидробромида соединения (I)
Пример 5: Фармакокинетические анализы
Способы:
Однократную пероральную дозу каждой формы в виде «порошка в капсуле» вводили трем (n=3) самкам крыс Спрага-Доули и трем самцам собак породы бигль (n=3) в количестве 5 мг активного фармацевтического ингредиента на кг массы тела. Затем анализировали плазму для определения содержания соединения в плазме с помощью ЖХ/МС.
Получение экспериментального препарата для капсульного введения крысам и собакам:
Соединение измельчали с помощью ступки и пестика и осторожно помещали в желатиновую капсулу, взвешенную на аналитических весах. Наполнение продолжали до достижения требуемой массы соединения. Использовали капсулы 9 размера для введения крысам и капсулы 3 размера для собак. Примечание: количество соединения корректировали по соотношению биоэквивалентности каждой формы.
После перорального введения брали образцы крови из боковой подкожной вены, используя пробирки, покрытые литий-гепарином (для крыс) или покрытые K2-ЭДТА (для собак), в заданные моменты времени. Плазму собирали и хранили в замороженном состоянии при -80°С до проведения анализа.
Анализ плазмы крыс:
Образцы плазмы (20 мкл) и точное количество стандартных образцов плазмы разбавляли в пять раз ледяным ацетонитрилом, содержащим 100 нг/мл верапамила в качестве внутреннего стандарта. Образцы и стандарты фильтровали через 0,22 мкм мембраны в 96-луночном формате. Затем фильтраты разбавляли водой до концентрации 30% ацетонитрила.
10 мкл каждого образца и стандарта вводили в колонку Waters Acquity CSH 1,7 мкм 2,1x100 мм со скоростью 0,6 мл/мин с помощью системы Acquity UPLC. Колонку C18 уравновешивали при концентрации 5% ацетонитрила в воде. Соединения элюировали градиентом до 99% ацетонитрила. Все подвижные фазы содержали 0,1% (об./об.) муравьиной кислоты.
Градиент элюирования ВЭЖХ:
Элюент колонки анализировали на тандемной квадрупольной масс-спектрометрической системе с электрораспылительной ионизацией (ИЭР-МС/МС, Waters Xevo TQ). Состав элюента анализировали по трем ионным парам, специфическим для внутреннего стандарта, и по трем ионным парам, специфическим для аналита. Экспериментальные образцы сравнивали с кривыми стандартных образцов для определения концентраций соединения. Фармакокинетические параметры определяли с помощью модуля Excel «PKfit».
Анализ плазмы собак:
Образцы плазмы (20 мкл) и точное количество стандартных образцов плазмы разбавляли в одиннадцать раз ледяным ацетонитрилом, содержащим 40 нг/мл диклофенака в качестве внутреннего стандарта. Смесь перемешивали на вортексе в течение 2 минут и центрифугировали. 0,5 мкл надосадочной жидкости вводили в колонку Waters Acquity BEH 1,7 мкм 2,1x50 мм со скоростью 0,6 мл/мин с помощью системы Acquity UPLC. Колонку уравновешивали при концентрации 10% метанола в воде. Соединения элюировали градиентом до 95% метанола. Подвижные фазы содержали 0,025% (об./об.) муравьиной кислоты и 1 мМ NH4OAc.
Градиент элюирования ВЭЖХ:
Элюент колонки анализировали на тандемной квадрупольной масс-спектрометрической системе с электрораспылительной ионизацией (ИЭР-МС/МС, API-6500). Состав элюента анализировали по одной ионной паре, специфической для внутреннего стандарта, и по одной ионной паре, специфической для аналита. Экспериментальные образцы сравнивали с кривыми стандартных образцов для определения концентраций соединения. Фармакокинетические параметры определяли с помощью WinNonlin Professional 6.2.
Сокристалл полугидрата бисфосфата и гидробромидная соль соединения (I) демонстрировали превосходную фармакокинетику по сравнению со свободным основанием. Соединения перорально вводили крысам Спрага-Доули и собакам породы бигль в виде порошка в капсуле. Как показано в таблице 6, сокристалл полугидрата бисфосфата и кристаллическая гидробромидная соль соединения (I) демонстрируют повышенные концентрации в плазме по сравнению со свободным основанием соединения (I).
Таблица 6. Фармакокинетические параметры сокристалла полугидрата бисфосфата, гидробромидной соли и свободного основания соединения (I) после перорального введения крысам Спрага-Доули и собакам породы бигль в форме порошка в капсуле
Реферат
Изобретение относится к сокристаллу соединения (I) и молекулы сокомпонента,где молекула сокомпонента представляет собой фосфорную кислоту, при этом сокристалл представляет собой гидрат и молярное соотношение соединение (I):фосфорная кислота:Н2О в указанном сокристалле составляет 1:2:1/2, к способам получения сокристалла и фармацевтическим композициям, содержащим указанный сокристалл. Технический результат: получен новый сокристалл, который демонстрирует повышенные концентрации в плазме и может использоваться в производстве лекарственного средства для применения при лечении рака, связанного со сверхэкспрессией ТТК. 4 н. и 13 з.п. ф-лы, 6 табл., 5 пр., 7 ил.
Формула
Документы, цитированные в отчёте о поиске
Пиразоло[1,5-a]пиримидины, применяемые в качестве ингибиторов протеинкиназ

Комментарии