N-фенил-диоксо-гидропиримидины, используемые в качестве ингибитора вируса гепатита с (hcv) - RU2542099C2
Код документа: RU2542099C2
Чертежи




















Описание
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ПАТЕНТНЫЕ ЗАЯВКИ
[0001] По настоящей патентной заявке испрашивается приоритет предварительной патентной заявки США №60/972,887 (поданной 17 сентября 2007) и предварительной патентной заявки США №61/096,794 (поданной 13 сентября 2008). Полный текст этих заявок включен в качестве ссылки в эту заявку.
ОБЛАСТЬ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0002] Настоящее изобретение относится: (а) к соединениям и их солям, которые, среди прочего, применяются в качестве ингибиторов вируса гепатита С (HCV); (b) к промежуточным соединениям, применяемым для получения таких соединений и солей; (с) композициям, содержащим такие соединения и соли; (d) способам получения таких промежуточных соединений, соединений, солей и композиций; (е) способам применения таких соединений, солей и композиций; и (f) наборам, содержащим такие соединения, соли и композиции.
ПРЕДПОСЫЛКИ К СОЗДАНИЮ ИЗОБРЕТЕНИЯ
[0003] Гепатит С представляет собой переносимое с кровью инфекционное вирусное заболевание, вызываемое гапатотропным вирусом, называемым HCV. К настоящему времени известно по меньшей мере шесть различных генотипов HCV (с несколькими подтипами в пределах каждого генотипа). В Северной Америке преобладает HCV генотипа 1а, за которым следует HCV генотипов 1b, 2а, 2b и 3а. В Соединенных Штатах, HCV генотипов 1, 2 и 3 являются наиболее распространенными, при этом примерно у 80% пациентов с гепатитом С имеется HCV генотипа 1. В Европе, преобладающим является HCV генотипа 1b, за которым следуют HCV генотипов 2а, 2b, 2c и 3а. HCV генотипов 4 и 5 обнаруживаются почти исключительно в Африке. Как рассмотрено ниже, генотип HCV пациента является клинически важным в определении потенциальной реакции пациента на лечение и требуемой продолжительности такого лечения.
[0004] HCV инфекция может вызывать воспаление печени (гепатит), которое зачастую протекает бессимптомно, но в результате хронический гепатит может приводить к циррозу печени (фиброзному рубцеванию печени), раку печени и/или печеночной недостаточности. По оценкам Всемирной Организации Здравоохранения примерно 170 миллионов человек во всем мире хронически инфицированы HCV, примерно от трех примерно до четырех миллионов человек вновь инфицируются каждый год по всему миру. В соответствии с данными Центров по контролю заболеваний и профилактике, примерно четыре миллиона людей в Соединенных Штатах инфицировано HCV. Широко распространено совместное инфицирование вирусом иммунодефицита человека (ВИЧ), и показатели HCV инфекции среди ВИЧ-положительных популяций являются более высокими.
[0005] Существует небольшой шанс спонтанного освобождения от вируса, но большинство пациентов с хроническим гепатитом С не избавятся от него без лечения. Показания для лечения обычно включают подтвержденную HCV инфекцию и постоянно не соответствующие норме функциональные пробы печени. Существует две схемы лечения, которые в первую очередь применяются при лечении гепатита С: монотерапия (с использованием интерферонового средства -либо «обычного», либо пэгилированного интерферона длительного действия), и комбинированная терапия (с использованием интерферонового средства и рибавирина). Интерферон, который вводят в кровоток, работает посредством стимуляции иммунного ответа на HCV; и считается, что рибавирин, который применяют перорально, работает путем предотвращения репликации HCV. Принимаемый отдельно, рибавирин эффективно не подавляет уровни HCV, а сочетание интерферон/рибавирин является более эффективным, чем только интерферон. Обычно, гепатит С лечат сочетанием пэгилированного интерферона альфа и рибавирина в течение 24 или 48 недель, в зависимости от генотипа HCV.
[0006] Целью лечения является устойчивый вирусологический ответ - означающий, что HCV не определяется в крови после завершения лечения. После лечения сочетанием пэгилированного интерферона альфа и рибавирина, устойчивые показатели эффективности лечения (устойчивый вирусологический ответ) примерно 75% или лучше, встречаются у людей с HCV генотипов 2 и 3 через 24 недели лечения, примерно 50% у людей с HCV генотипа 1 при лечении 48 недель, и примерно 65% у людей с HCV генотипа 4 через 48 недель лечения.
[0007] Лечение может быть тяжелым физически, особенно у тех, у кого в анамнезе злоупотребление наркотиками или алкоголем, поскольку и интерферон, и рибавирин имеют многочисленные побочные эффекты. Широко распространенные побочные эффекты, связанные с интерфероном, включают в себя гриппоподобные симптомы, чрезмерную усталость, тошноту, потерю аппетита, проблемы с щитовидной железой, высокий уровень сахара в крови, выпадение волос и кожные реакции в месте введения. Возможные серьезные побочные эффекты, связанные с интерфероном, включают психозы (например, суицидальное поведение), проблемы с сердцем (например, сердечный приступ, низкое кровяное давление), повреждение других внутренних органов, проблемы с кровью (например, опасное снижение формулы крови), и появление или ухудшение аутоиммунного заболевания (например, ревматоидного артрита). Побочные эффекты, связанные с рибавирином, включают анемию, усталость, раздражительность, кожную сыпь, заложенность носа, синусит и кашель. Рибавирин также может вызывать патологии родов, поэтому следует избегать беременности пациентам женского пола и партнерам женского пола пациентов мужчин во время лечения и в течение шести месяцев после.
[0008] Некоторые пациенты не заканчивают лечение вследствие серьезных побочных эффектов, рассмотренных выше; другие пациенты (пациенты с отсутствием клинического ответа) несмотря на лечение, продолжают иметь определяемые уровни HCV; а у других пациентов (больных с рецидивом заболевания) во время лечения вирус «выводится», но вирус иногда возвращается после завершения схемы лечения. Таким образом, сохраняется необходимость в альтернативных соединения, композициях и способах лечения (применяемых либо в сочетании, либо вместо интерферонового средства и/или рибавирина) для облегчения симптомов гепатита С, тем самым, обеспечивая частичное или полное купирование симптомов. Настоящее изобретение относится к соединениям (в том числе их солям), композициям и способам лечения, которые главным образом направлены на эту потребность.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0009] Настоящее изобретение относится к соединениям, структура которых соответствует формуле I:

[0010] В формуле I:

R1 выбран из группы, состоящей из водорода, метила и азот-защищающей группы;
R2 выбран из группы, состоящей из водорода, гало, гидрокси, метила, циклопропила и циклобутила;
R3 выбран из группы, состоящей из водорода, гало, оксо, и метила;
R4 выбран из группы, состоящей из гало, алкила, алкенила, алкинила, нитро, циано, азидо, алкилокси, алкенилокси, алкинилокси, амино, аминокарбонила, аминосульфонила, алкилсульфонила, карбоциклила, и гетероциклила, где:
(a) амино, аминокарбонил и аминосульфонил необязательно замещены:
(1) одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила, алкенила, алкинила и алкилсульфонила, или
(2) двумя заместителями, которые вместе с аминоазотом образуют однокольцевой гетероциклил, и
(b) алкил, алкенил, алкинил, алкилокси, алкенилокси, алкинилокси и алкилсульфонил, необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из гало, оксо, нитро, циано, азидо, гидрокси, амино, алкилокси, триметилсилила, карбоциклила и гетероциклила, где:
амино необязательно замещен:
(1) одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила, алкенила, алкинила, алкилкарбонила, алкилсульфонила,алкилоксикарбонила, карбоциклила, гетероциклила, карбоциклилалкила и гетероциклилалкила, или
(2) двумя заместителями, которые вместе с аминоазотом образуют однокольцевой гетероцикл, и
(с) карбоциклил и гетероциклил необязательно замещены заместителями, вплоть до трех, независимо выбранными из группы, состоящей из алкила, алкенила, алкинила, гало, оксо, нитро, циано, азидо, гидрокси, амино, алкилокси, триметилсилила, карбоциклила и гетероциклила, где:
амино необязательно замещен:
(1) одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила, алкенила, алкинила, алкилкарбонила, алкилсульфонила, алкилоксикарбонила, карбоциклила, гетероциклила, карбоциклилалкил и гетероциклилалкила, или
(2) двумя заместителями, которые вместе с аминоазотом образуют однокольцевой гетероцикл;
R5 выбран из группы, состоящей из водорода, гидрокси, алкила, алкенила, алкинила, алкилокси, алкенилокси, алкинилокси, алкилсульфонилокси, карбоциклилсульфонилокси, галоалкилсульфонилокси, и гало;
L выбран из группы, состоящей из C(RA)=C(RB), этилена и циклопропил-1,2-ена;
RA и RB независимо выбраны из группы, состоящей из водорода, C1-С6-алкила, C1-С6-алкилокси, С3-С8-циклоалкила и гало, где:
C1-С6-алкил необязательно замещен одним или более заместителями, независимо выбранными из группы, состоящей из карбокси, гало, гидрокси, нитро, оксо, амино, циано, алкилоксикарбонила, алкилкарбонилокси, алкилокси, карбоциклила и гетероциклила;
R6 выбран из группы, состоящей из С5-С6-карбоциклила, 5-6-членного гетероциклила, конденсированного 2-кольцевого карбоциклила, и конденсированного 2-кольцевого гетероциклила, где каждый такой заместитель необязательно замещен одним или более заместителями, независимо выбранными из группы, состоящей из RE, RF, RG, RH, RI, RJ и RK;
каждый RE независимо выбран из группы, состоящей из гало, нитро, гидрокси, оксо, карбокси, циано, амино, имино, азидо и альдегидо, где:
амино необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила, алкенила и алкинила;
каждый RF независимо выбран из группы, состоящей из алкила, алкенила и алкинила, где:
каждый такой заместитель необязательно замещен одним или более заместителями, независимо выбранными из группы, состоящей из карбокси, гидрокси, гало; амино, имино, нитро, азидо, оксо, аминосульфонила, алкилсульфонила, алкилоксикарбонила, алкенилоксикарбонила, алкинилокеикарбонила, алкилкарбонилокси, алкенилкарбонилокси, алкинилкарбонилокси, алкилокси, алкенилокси, алкинилокси, карбоциклила, гетероциклила, циано и аминокарбонила, где:
амино, имино, аминосульфонил, аминокарбонил, карбоциклил и гетероциклил необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из алкила, алкенила, алкинила, алкилсульфонила, алкенилсульфонила, алкинилсульфонила, алкилсульфониламино, гидрокси и алкилокси,
где:
амино часть алкилсульфониламино необязательно замещена заместителем, выбранным из группы, состоящей из алкила, алкенила и алкинила;
каждый RG независимо выбран из группы, состоящей из карбоциклила и гетероциклила, где:
каждый такой заместитель необязательно замещен одним или более заместителями, независимо выбранными из группы, состоящей из алкила, алкенила, алкинила, карбокси, гидрокси, гало, амино, нитро, азидо, оксо, аминосульфонила, алкилоксикарбонила, алкенилоксикарбонила, алкинилоксикарбонила, алкилкарбонилокси, алкенилкарбонилокси, алкинилкарбонилокси, алкилокси, алкенилокси, алкинилокси, карбоциклила, гетероциклила, циано и аминокарбонила, где:
амино, аминосульфонил и аминокарбонил необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из алкила, алкенила, алкинила, алкилсульфонила, алкенилсульфонила и алкинилсульфонила;
каждый RH независимо выбран из группы, состоящей из алкилокси, алкенилокси, алкинилокси, алкилсульфонилокси, алкенилсульфонилокси и алкинилсульфонилокси, где:
каждый такой заместитель необязательно замещен одним или более заместителями, независимо выбранными из группы, состоящей из карбокси, гидрокси, гало, амино, нитро, азидо, оксо, аминосульфонила, алкилоксикарбонила, алкенилоксикарбонила, алкинилоксикарбонила, алкилкарбонилокси, алкенилкарбонилокси, алкинилкарбонилокси, алкилокси, алкенилокси, алкинилокси, карбоциклила, гетероциклила, циано и аминокарбонила, где:
амино, аминосульфонил и аминокарбонил необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из алкила, алкенила, алкинила, алкилсульфонила, алкенилсульфонила и алкинилсульфонила;
каждый RI независимо выбран из группы, состоящей из алкилкарбонила, алкенилкарбонила, алкинилкарбонила, аминокарбонила, алкилоксикарбонила, карбоциклилкарбонила и гетероциклилкарбонила, где:
(a) алкилкарбонил, алкенилкарбонил и алкинилкарбонил необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из карбокси, гидрокси, гало, амино, нитро, азидо, оксо, аминосульфонила, алкилоксикарбонила, алкенилоксикарбонила, алкинилоксикарбонила, алкилкарбонилокси, алкенилкарбонилокси, алкинилкарбонилокси, алкилокси, алкенилокси, алкинилокси, карбоциклила, гетероциклила, циано и аминокарбонила, и
(b) аминокарбонил необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила, алкенила, алкинила, алкилоксиалкила, карбоциклила, гетероциклила, алкилсульфонила и алкилсульфониламино, где:
карбоциклил и гетероциклил необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из гало, алкила и оксо;
каждый RJ независимо выбран из группы, состоящей из карбоциклилсульфониламино, гетероциклилсульфониламино, алкилкарбониламино, алкенилкарбониламино, алкинилкарбониламино, алкилоксикарбониламино, алкенилоксикарбониламино, алкинилоксикарбониламино, алкилеульфониламино, алкенилсульфониламино, алкинилсульфониламино, аминокарбониламино, алкилоксикарбониламиноимино, алкилсульфониламиноимино, алкенилсульфониламиноимино и алкинилсульфониламиноимино, где:
(a) амино часть таких заместителей необязательно замещена заместителем, независимо выбранным из группы, состоящей из карбоциклилалкила, гетероциклилалкила, алкилкарбонилокси, аминокарбонилалкила, алкила, алкенила, алкинила, алкилкарбонила, алкенилкарбонила, алкинилкарбонила, алкилоксикарбонила, алкилоксиалкилоксикарбонила, алкилкарбонилоксиалкила и алкилсульфонила, где:
(1) карбоциклильная часть карбоциклилалкила и гетероциклильная часть гетероциклилалкила необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из алкила, алкенила, алкинила, карбокси, гидрокси, алкилокси, алкенилокси, алкинилокси, гало, нитро, циано, азидо, оксо и амино, и
(2) амино часть аминокарбонилалкила необязательно замещена одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила, алкенила и алкинила,
(b) алкильная, алкенильная и алкинильная часть таких заместителей необязательно замещена одним или более заместителями, независимо выбранными из группы, состоящей из карбокси, гало, оксо, амино, алкилоксикарбонила, алкилкарбонилокси, гидрокси, алкилокси, карбоциклила, гетероциклила и циано, где:
амино необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила, алкенила, алкинила, алкилокси, алкенилокси и алкинилокси, где:
алкил необязательно замещен одним или более гидрокси;
(c) карбоциклильная и гетероциклильная части таких заместителей необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из алкила, алкенила, алкинила, карбокси, гидрокси, алкилокси, алкенилокси, алкинилокси, гало, нитро, циано, азидо и амино, где:
амино необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила, алкенила и алкинила; и
каждый RK независимо выбран из группы, состоящей из аминосульфонила, алкилсульфонила, алкенилсульфонила и алкинилсульфонила, где:
(а) алкилсульфонил, алкенилсульфонил и алкинилсульфонил необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из карбокси, гидрокси, гало, амино, нитро, азидо, оксо, аминосульфонила, алкилоксикарбонила, алкенилоксикарбонила, алкинилоксикарбонила, алкилкарбонилокси, алкенилкарбонилокси, алкинилкарбонилокси, алкилокси, алкенилокси, алкинилокси, карбоциклила, гетероциклила, циано и аминокарбонила, где:
амино, аминосульфонил и аминокарбонил необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из алкила, алкенила и алкинила; и
(b) аминосульфонил необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила, алкенила и алкинила.
[0011] Настоящее изобретение также относится к солям (в том числе, фармацевтически приемлемым солям) соединений по настоящему изобретению.
[0012] Настоящее изобретение также относится к композициям (в том числе, фармацевтическим композициям), которые содержат одно или более соединений и/или солей по настоящему изобретению, и, необязательно, один или более дополнительных терапевтических агентов.
[0013] Настоящее изобретение также относится к наборам, которые содержат одно или более соединений и/или солей по настоящему изобретению, и, необязательно, один или более дополнительных терапевтических агентов.
[0014] Настоящее изобретение также относится к способам применения соединений, солей, композиций и/или наборов по настоящему изобретению, например, для ингибирования репликации РНК-вируса (в том числе HCV), лечения заболевания, поддающегося лечению путем ингибирования полимеразы рибонуклеиновой кислоты (РНК) HCV (в том числе, гепатита С).
[0015] Настоящее изобретение также относится к применению одного или более соединения и/или солей по настоящему изобретению для получения лекарственного средства. Лекарственное средство необязательно может содержать один или более дополнительных терапевтических агентов. В некоторых вариантах осуществления, это лекарственное средство применимо для лечения гепатита С.
[0016] Дополнительные преимущества изобретения Заявителей будут очевидны специалисту в данной области из текста настоящей патентной заявки.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0017] Фигура 1 демонстрирует иллюстративную порошковую дифракционную рентгенограмму для девятиводной динатриевой соли соединения IB-L1-1.1.
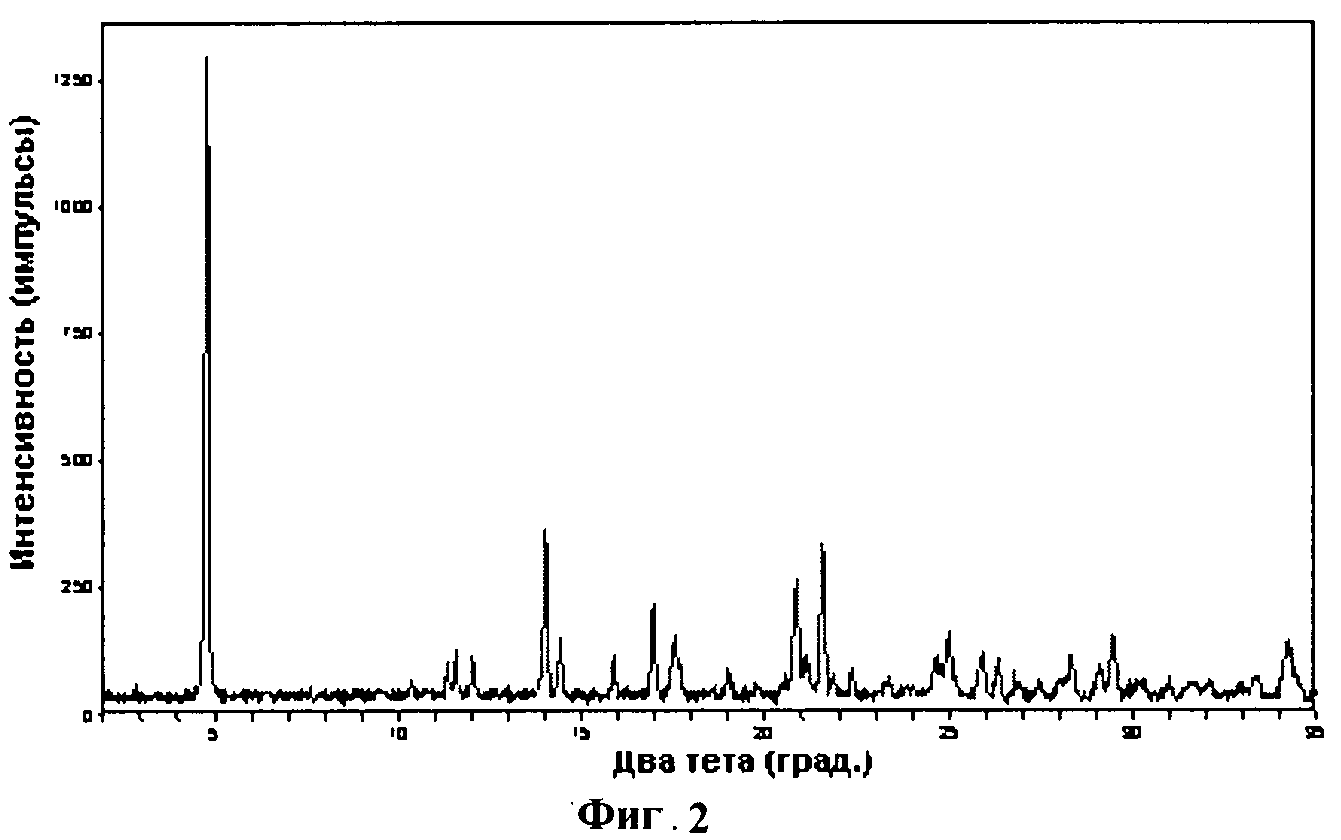
[0018] Фигура 2 демонстрирует иллюстративную порошковую дифракционную рентгенограмму для четырехводной динатриевой соли соединения IB-L1-1.1.
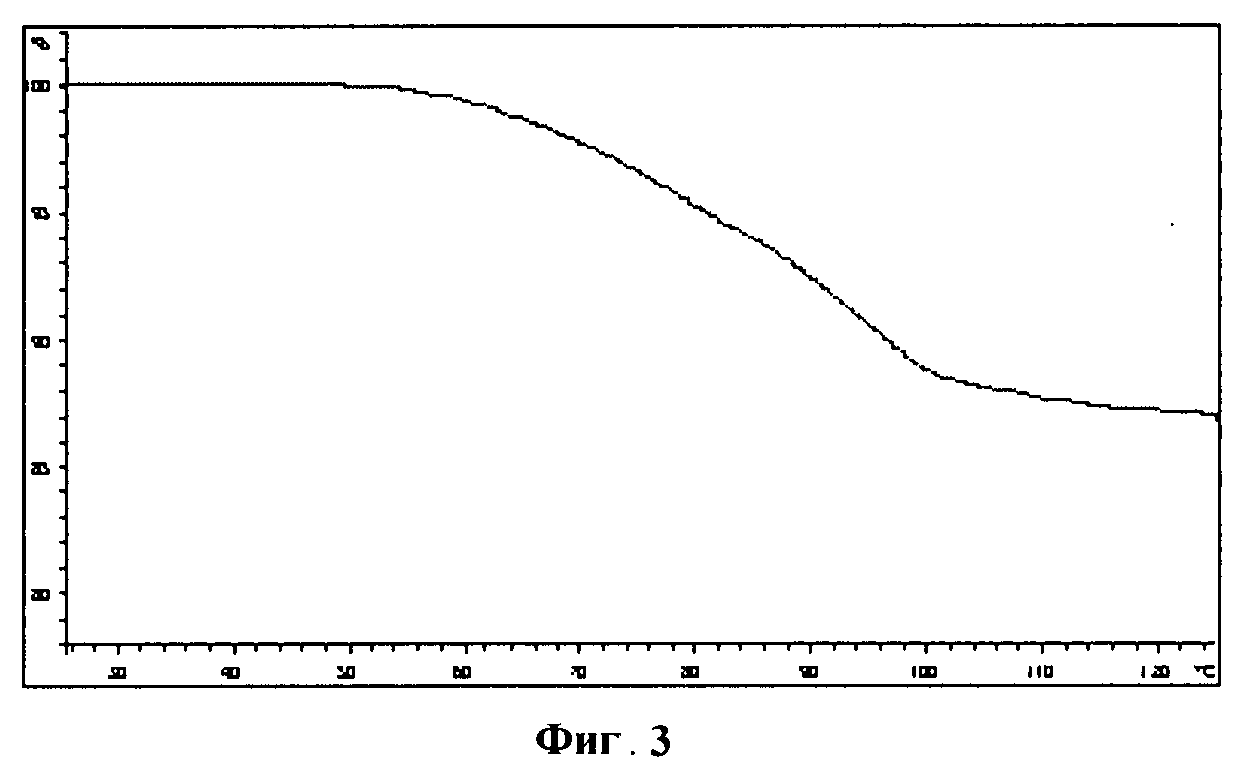
[0019] Фигура 3 демонстрирует иллюстративный профиль TGA четырехводной динатриевой соли соединения IB-L1-1.1.
[0020] Фигура 4 демонстрирует иллюстративную порошковую дифракционную рентгенограмму для четырехводной дикалиевой соли соединения IB-L1-1.1.
[0021] Фигура 5 демонстрирует иллюстративную порошковую дифракционную рентгенограмму для тригидрата монокалиевой соли соединения IB-L1-1.1.
[0022] Фигура 6 демонстрирует иллюстративную порошковую дифракционную рентгенограмму для дигидрата монокалиевой соли соединения IB-L1-1.1.
[0023] Фигура 7 демонстрирует иллюстративный профиль TGA дигидрата монокалиевой соли соединения IB-L1-1.1.
[0024] Фигура 8 демонстрирует иллюстративную порошковую дифракционную рентгенограмму для 1/7 калиевой соли соединения IB-L1-1.1.
[0025] Фигура 9 демонстрирует иллюстративную порошковую дифракционную рентгенограмму для четырехводной монодиэтиламинной соли соединения IB-L1-1.1.
[0026] Фигура 10 демонстрирует иллюстративный профиль TGA четырехводной монодиэтиламинной соли соединения IB-L1-1.1.
[0027] Фигура 11 демонстрирует иллюстративную порошковую дифракционную рентгенограмму для образца А полиморфного соединения IB-L1-1.1.
[0028] Фигура 12 демонстрирует иллюстративный профиль дифференциальной сканирующей калориметрии образца А полиморфного соединения IB-L1-1.1.
[0029] Фигура 13 демонстрирует иллюстративную порошковую дифракционную рентгенограмму для образца В полиморфного соединения IB-L1-1.1.
[0030] Фигура 14 демонстрирует иллюстративную порошковую дифракционную рентгенограмму для образца С полиморфного соединения IB-L1-1.1.
[0031] Фигура 15 демонстрирует иллюстративную порошковую дифракционную рентгенограмму для образца D полиморфного соединения IB-L1-1.1.
[0032] Фигура 16 демонстрирует иллюстративную порошковую дифракционную рентгенограмму для образца А гидрата соединения IB-L1-1.1.
[0033] Фигура 17 демонстрирует иллюстративный профиль TGA образца А гидрата соединения IB-L1-1.1.
[0034] Фигура 18 демонстрирует иллюстративную порошковую дифракционную рентгенограмму для образца В гидрата соединения IB-L1-1.1.
[0035] Фигура 19 демонстрирует иллюстративный профиль TGA образца В гидрата соединения IB-L1-1.1.
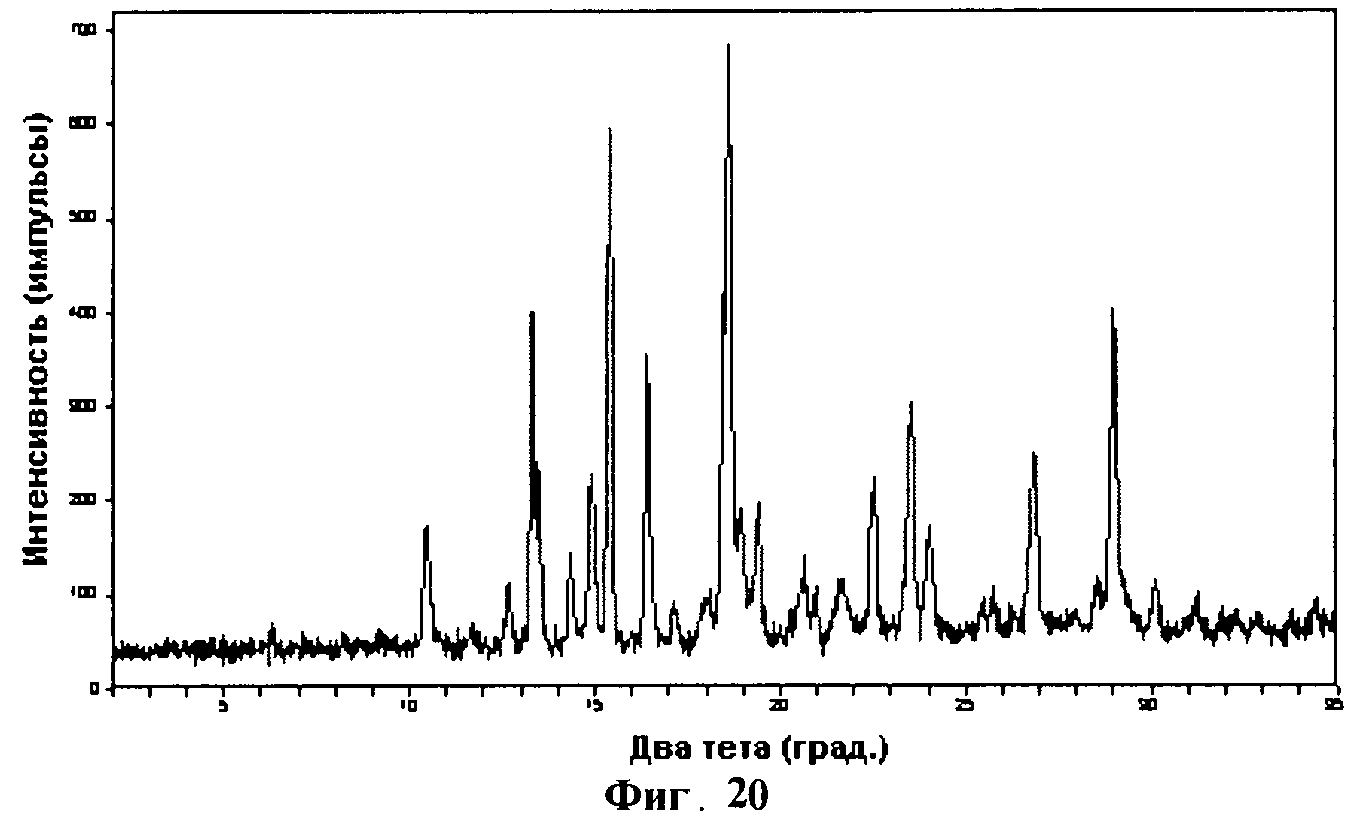
[0036] Фигура 20 демонстрирует иллюстративную порошковую дифракционную рентгенограмму для образца С гидрата соединения IB-L1-1.1.
[0037] Фигура 21 демонстрирует иллюстративный профиль TGA образца С гидрата соединения IB-L1-1.1.
[0038] Фигура 22 демонстрирует иллюстративную порошковую дифракционную рентгенограмму для образца D гидрата соединения IB-L1-1.1.
[0039] Фигура 23 демонстрирует иллюстративную порошковую дифракционную рентгенограмму для образца Е гидрата соединения IB-L1-1.1.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0040] Настоящее подробное описание предназначено только для ознакомления специалистов в данной области с изобретением Заявителей, его принципами и его практическим применением, так, чтобы другие специалисты в данной области могли адаптировать и применить настоящее изобретение в его многочисленных формах, которые могут наилучшим образом соответствовать требованиям практического применения. Это описание и его конкретные примеры предназначены только для иллюстрации. Настоящее изобретение, следовательно, не ограничивается вариантами осуществления, описанными в настоящей заявке, и может быть модифицировано различными способами.
А. Определения.
[0041] Термин «алкил» (отдельно или в сочетании с другим термином (терминами)) означает насыщенный углеводородный заместитель с прямой или разветвленной цепью, обычно содержащий от 1 до 20 атомов углерода, более характерно от 1 примерно до 8 атомов углерода, и еще более характерно от 1 примерно до 6 атомов углерода. Примеры таких заместителей включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, изо-амил и гексил. Как в этом определении, по всему тексту подробного описания Заявители представили наглядные примеры. Предоставление таких наглядных примеров не следует интерпретировать так, что представленные наглядные примеры являются единственными вариантами, доступными специалисту в данной области.
[0042] Термин «алкенил» (отдельно или в сочетании с другим термином (терминами)) означает углеводородный заместитель с прямой или разветвленной цепью, содержащий одну или более двойных связей, и обычно от 2 примерно до 20 атомов углерода, более характерно примерно от 2 примерно до 8 атомов углерода, и еще более характерно примерно от 2 примерно до 6 атомов углерода. Примеры таких заместителей включают этенил (винил), 2-пропенил, 3-пропенил, 1,4-пентадиенил, 1,4-бутадиенил, 1-бутенил, 2-бутенил и 3-бутенил.
[0043] Термин «алкинил» (отдельно или в сочетании с другим термином (терминами)) означает углеводородный заместитель с прямой или разветвленной цепью, содержащий одну или более тройных связей и обычно от 2 примерно до 20 атомов углерода, более характерно примерно от 2 примерно до 8 атомов углерода, и еще более характерно примерно от 2 примерно до 6 атомов углерода. Примеры таких заместителей включают этинил, 2-пропинил, 3-пропинил, 2-бутинил и 3-бутинил.
[0044] Термин «карбоциклил» (отдельно или в сочетании с другим термином (терминами)) означает насыщенный циклический (т.е., «циклоалкильный»), частично насыщенный циклический (т.е., «циклоалкенильный»), или полностью ненасыщенный (т.е., «арильный») углеводородный заместитель, содержащий от 3 до 14 кольцевых атомов углерода («кольцевыми атомами» являются атомы, связанные вместе с образованием кольца или колец циклического заместителя). Карбоциклил может представлять собой одиночное кольцо, которое обычно содержит от 3 до 6 кольцевых атомов. Примеры таких однокольцевых карбоциклилов включают циклопропил (циклопропанил), циклобутил (циклобутанил), циклопентил (циклопентанил), циклопентенил, циклопентадиенил, циклогексил (циклогексанил), циклогексенил, циклогексадиенил и фенил. Альтернативно карбоциклил может представлять собой 2 или 3 кольца, конденсированные вместе, такие как нафталенил, тетрагидронафталенил (тетралинил), инденил, инданил (дигидроинденил), антраценил, фенантренил и декалинил.
[0045] Термин «циклоалкил» (отдельно или в сочетании с другим термином (терминами)) означает насыщенный циклический углеводородный заместитель, содержащий от 3 до 14 кольцевых атомов углерода. Циклоалкил может представлять собой одиночное углеродное кольцо, которое обычно содержит от 3 до 6 кольцевых атомов углерода. Примеры однокольцевых циклоалкилов включают циклопропил, циклобутил, циклопентил и циклогексил. Альтернативно циклоалкил может представлять собой 2 или 3 углеродных кольца, конденсированных вместе, например, декалинил.
[0046] Термин «арил» (отдельно или в сочетании с другим термином (терминами)) означает ароматический карбоциклил, содержащий от 6 до 14 кольцевых атомов углерода. Примеры арилов включают фенил, нафталенил и инденил.
[0047] В некоторых случаях, число атомов углерода в углеводородном заместителе (например, алкиле, алкениле, алкиниле или циклоалкиле) указывается с помощью индекса «Cx-Cy-», где x означает минимальное, а у означает максимальное число атомов углерода в этом заместителе. Таким образом, например, «C1-С6-алкил» относится к алкильному заместителю, содержащему от 1 до 6 атомов углерода. Поясняя дополнительно, С3-С6-циклоалкил означает насыщенное углеводородное кольцо, содержащее от 3 до 6 кольцевых атомов углерода.
[0048] Термин «водород» (отдельно или в сочетании с другим термином (терминами)) означает водородный радикал и может обозначаться -H.
[0049] Термин «гидрокси» (отдельно или в сочетании с другим термином (терминами)) означает -ОН.
[0050] Термин «нитро» (отдельно или в сочетании с другим термином (терминами)) означает -NO2.
[0051] Термин «циано» (отдельно или в сочетании с другим термином (терминами)) означает -CN, который также может обозначаться как -C≡N.
[0052] Термин «кето» (отдельно или в сочетании с другим термином (терминами)) означает оксо радикал и может быть обозначен как =O.
[0053] Термин «карбокси» (отдельно или в сочетании с другим термином (терминами)) означает -С(O)-ОН.
[0054] Термин «амино» (отдельно или в сочетании с другим термином (терминами)) означает -NH2.
[0055] Термин «имино» (отдельно или в сочетании с другим термином (терминами)) означает =NH.
[0056] Термин «аминоимино» (отдельно или в сочетании с другим термином (терминами)) означает =NNH2.
[0057] Термин «галоген» или «гало» (отдельно или в сочетании с другим термином (терминами)) означает радикал фтора (который может быть обозначен как -F), радикал хлора (который может быть обозначен как -Cl), радикал брома (который может быть обозначен как -Br), или радикал йода (который может быть обозначен как -I).
[0058] Заместитель является «замещаемым» если он содержит по меньшей мере один атом углерода или азота, который связан с одним или более атомами водорода. Таким образом, например, водород, галоген и циано не подпадают под это определение. Кроме того, атом серы в гетероциклиле, содержащем такой атом, является замещаемым одним или двумя оксо заместителями.
[0059] В тех случаях, если заместитель описан как «замещаемый», не водородный радикал находится на месте водородного радикала на углероде или азоте заместителя. Таким образом, например, замещенный алкильный заместитель представляет собой алкильный заместитель, у которого по меньшей мере один не водородный радикал находится на месте водородного радикала на алкильном заместителе. Для пояснения, монофторалкил представляет собой алкильный заместитель с фтор-радикалом, а дифторалкил представляет собой алкил, замещенный двумя радикалами фтора. Должно быть понятно, что в том случае, когда существует более одной замены на заместителе, такой не водородный радикал может быть идентичным или отличным (если не указано иное).
[0060] В том случае, если заместитель описан как «необязательно замещенный», этот заместитель может быть, либо (1) незамещенным, либо (2) замещенным. Если заместитель описан как необязательно замещенный вплоть до конкретного числа не водородных радикалов, этот заместитель может быть, либо (1) незамещенным; либо (2) замещен вплоть до того конкретного числа не водородных радикалов, или вплоть до максимального числа замещаемых положений на заместителе, смотря что меньше. Таким образом, например, если заместитель описывается как гетероарил, необязательно замещенный вплоть до 3 не водородных радикалов, то любой гетероарил менее чем с 3 замещаемыми положениями был бы необязательно замещен только вплоть до такого количества не водородных радикалов, сколько гетероарил имеет замещаемых положений. Для пояснения, тетразолил (который имеет только одно замещаемое положение) может быть необязательно замещен вплоть до одного не водородного радикала. Для дальнейшего пояснения, если аминоазот описывается как необязательно замещенный вплоть до 2 не водородных радикалов, то первичный аминоазот будет необязательно замещен вплоть до 2 не водордных радикалов, тогда как вторичный аминоазот будет необязательно замещен только вплоть до 1 не водородного радикала.
[0061] В настоящей патентной заявке используются термины «заместитель» и «радикал» взаимозаменяемо.
[0062] Приставка «гало» указывает на то, что заместитель, к которому присоединяется эта приставка, замещен одним или более независимо выбранными галогеновыми радикалами. Например, галоалкил означает алкильный заместитель, в котором по меньшей мере один водородный радикал заменен галогеновым радикалом. Примеры галоалкилов включают хлорметил, 1-бромэтил, фторметил, дифторметил, трифторметил и 1,1,1-трифторэтил. Должно быть понятно, что если заместитель замещен более чем одним галогеновым радикалом, эти галогеновые радикалы могут быть одинаковыми или разными (если не указано иное).
[0063] Приставка «пергало» указывает на то, что каждый водородный радикал на заместителе, к которому эта приставка присоединена, заменен независимо выбранными галогеновыми радикалами, т.е., каждый водородный радикал на заместителе заменен галогеновым радикалом. Если все галогеновые радикалы являются одинаковыми, эта приставка обычно будет обозначать галогеновый радикал. Таким образом, например, термин «перфтор» означает, что каждый водородный радикал на заместителе, к которому присоединена эта приставка, замещен радикалом фтора. Для пояснения, термин «перфторалкил» означает алкильный заместитель, в котором радикал фтор находится на месте каждого водородного радикала.
[0064] Термин «карбонил» (отдельно или в сочетании с другим термином (терминами)) означает -С(O)-.
[0065] Термин «аминокарбонил» (отдельно или в сочетании с другим термином (терминами)) означает -C(O)-NH2.
[0066] Термин «окси» (отдельно или в сочетании с другим термином (терминами)) означает эфирный заместитель и может быть обозначен -О-.
[0067] Термин «алкокси» (отдельно или в сочетании с другим термином (терминами)) означает алкилэфирный заместитель, т.е., -O-алкил. Примеры такого заместителя включают метокси (-O-СН3), этокси, п-пропокси, изопропокси, п-бутокси, изо-бутокси, втор-бутокси и трет-бутокси.
[0068] Термин «алкилкарбонил» (отдельно или в сочетании с другим термином (терминами)) означает -С(O)-алкил.
[0069] Термин «аминоалкилкарбонил» (отдельно или в сочетании с другим термином (терминами)) означает -С(O)-алкил-NH2.
[0070] Термин «алкоксикарбонил» (отдельно или в сочетании с другим термином (терминами)) означает -С(O)-O-алкил.
[0071] Термин «карбоциклилкарбонил» (отдельно или в сочетании с другим термином (терминами)) означает -С(O)-карбоциклил.
[0072] Аналогично, термин «гетероциклилкарбонил» (отдельно или в сочетании с другим термином (терминами)) означает -С(O)-гетероциклил.
[0073] Термин «карбоциклилалкилкарбонил» (отдельно или в сочетании с другим термином (терминами)) означает -С(O)-алкил-карбоциклил.
[0074] Аналогично, термин «гетероциклилалкилкарбонил» (отдельно или в сочетании с другим термином (терминами)) означает -С(O)-алкил-гетероциклил.
[0075] Термин «карбоциклилоксикарбонил» (отдельно или в сочетании с другим термином (терминами)) означает -С(O)-O-карбоциклил.
[0076] Термин «карбоциклилалкоксикарбонил» (отдельно или в сочетании с другим термином (терминами)) означает -С(O)-O-алкил-карбоциклил.
[0077] Термин «тио» или «тиа» (отдельно или в сочетании с другим термином (терминами)) означает тиаэфирный заместитель, т.е., эфирный заместитель, где двухвалентный атом серы находится на месте эфирного атома кислорода. Такой заместитель может быть обозначен как -S-. Это, например, «алкил-тио-алкил» означает алкил-8-алкил (алкил-сульфанил-алкил).
[0078] Термин «тиол» или «сульфгидрил» (отдельно или в сочетании с другим термином (терминами)) означает сульфгидрильный заместитель, и может быть обозначен как -SH.
[0079] Термин «(тиокарбонил)» (отдельно или в сочетании с другим термином (терминами)) означает карбонил, в котором атом кислорода был заменен серой. Такой заместитель может быть обозначен как -C(S)-.
[0080] Термин «сульфонил» (отдельно или в сочетании с другим термином (терминами)) означает -S(O)2.
[0081] Термин «аминосульфонил» (отдельно или в сочетании с другим термином (терминами)) означает -S(O)2-NH2.
[0082] Термин «сульфинил» или «сульфоксид» (отдельно или в сочетании с другим термином (терминами)) означает -S(O)-.
[0083] Термин «гетероциклил» (отдельно или в сочетании с другим термином (терминами)) означает насыщенную (т.е., «гетероциклоалкильную»), частично насыщенную (т.е., «гетероциклоалкенильную»), или полностью ненасыщенную (т.е., «гетероарильную») кольцевую структуру всего из 3-14 кольцевых атомов. По меньшей мере один из атомов кольца представляет собой гетероатом (т.е., кислород, азот или серу), остальные атомы кольца независимо выбраны из группы, состоящей из углерода, кислорода, азота и серы.
[0084] Гетероциклил может представлять собой одиночное кольцо, которое обычно содержит от 3 до 7 атомов в кольце, более характерно от 3 до 6 атомов в кольце и еще более характерно от 5 до 6 атомов в кольце. Примеры однокольцевых гетероциклилов включают фуранил, дигидрофуранил, тетрагидрофуранил, тиофенил (тиофуранил), дигидротиофенил, тетрагидротиофенил, пирролил, пирролинил, пирролидинил, имидазолил, имидазолинил, имидазолидинил, пиразолил, пиразолинил, пиразолидинил, триазолил, тетразолил, оксазолил, оксазолидинил, изоксазилидинил, изоксазолил, тиазолил, изотиазолил, тиазолинил, изотиазолинил, тиазолидинил, изотиазолидинил, тиодиазолил, оксадиазолил (в том числе,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил (фуразанил), или 1,3,4-оксадиазолил), оксатриазолил (в том числе 1,2,3,4-оксатриазолил или 1,2,3,5-оксатриазолил), диоксазолил (в том числе 1,2,3-диоксазолил, 1,2,4-диоксазолил, 1,3,2-диоксазолил или 1,3,4-диоксазолил), оксатиазолил, оксатиолил, оксатиоланил, пиранил, дигидропиранил, тиопиранил, тетрагидротиопиранил, пиридинил (азинил), пиперидинил, диазинил (в том числе пиридазинил (1,2-диазинил), пиримидинил (1,3-диазинил) или пиразинил (1,4-диазинил)), пиперазинил/гриазинил (в том числе 1,3,5-триазинил, 1,2,4-триазинил и 1,2,3-триазинил)), оксазинил (в том числе 1,2-оксазинил, 1,3-оксазинил или 1,4-оксазинил)), оксатиазинил (в том числе 1,2,3-оксатиазинил, 1,2,4-оксатиазинил, 1,2,5-оксатиазинил или 1,2,6-оксатиазинил)), оксадиазинил (в том числе 1,2,3-оксадиазинил, 1,2,4-оксадиазинил, 1,4,2-оксадиазинил или 1,3,5-оксадиазинил)), морфолинил, азепинил, оксепинил, тиепинил и диазепинил.
[0085] Гетероциклил альтернативно может представлять собой 2 или 3 кольца, конденсированные вместе, например, такие как индолизинил, пиранопирролил, 4Н-хинолизинил, пуринил, нафтиридинил, пиридопиридинил (в том числе [3,4-b]-пиридинил, пиридо[3,2-b]-пиридинил или пиридо[4,3-b]-пиридинил), и птеридинил. Другие примеры гетероциклилов с конденсированными кольцами, включают бензо-конденсированные гетероциклилы, такие как индолил, изоиндолил (изобензазолил, псевдоизоиндолил), индоленил (псевдоиндолил), изоиндазолил (бензпиразолил), бензазинил (в том числе хинолинил (1-бензазинил) или изохинолинил (2-бензазинил)), фталазинил, хиноксалинил, хиназолинил, бензодиазинил (в том числе циннолинил (1,2-бензодиазинил) или хиназолинил (1,3-бензодиазинил)), бензопиранил (в том числе хроманил или изохроманил), бензоксазинил (в том числе 1,3,2-бензоксазинил, 1,4,2-бензоксазинил, 2,3,1-бензоксазинил или 3,1,4-бензоксазинил), и бензизоксазинил (в том числе 1,2-бензизоксазинил или 1,4-бензизоксазинил).
[0086] Термин гетероциклил «с 2-конденсированными кольцами» (отдельно или в сочетании с другим термином (терминами)) означает насыщенный, частично насыщенный или арилгетероциклил, содержащий 2 конденсированных кольца. Примеры гетероциклилов с 2 конденсированными кольцами включают индолизинил, хинолизинил, пуринил, нафтиридинил, птеридинил, индолил, изоиндолил, индоленинил, изоиндазолил, фталазинил, хиноксалинил, хиназолинил, бензодиазинил, бензопиранил, бензотиопиранил, бензоксазолил, антранилил, бензодиоксолил, антранилил, бензодиоксолил, бензодиоксанил, бензоксадиазолил, бензофуранил, изобензофуранил, бензотиазолил, бензотиадиазолил, бензимидазолил, бензотриазолил, бензотриазолил, бензоксазинил и тетрагидроизохинолинил.
[0087] Термин «гетероарил» (отдельно или в сочетании с другим термином (терминами)) означает ароматический гетероциклил, содержащий от 5 до 14 атомов в кольце. Гетероарил может представлять собой одиночное кольцо или 2 или 3 конденсированных кольца. Примеры гетероарильных заместителей включают 6-членные кольцевые заместители, такие как пиридил, пиразил, пиримидинил, пиридазинил и 1,3,5-, 1,2,4- или 1,2,3-триазинил; 5-членные кольцевые заместители, такие как имидазил, фуранил, тиофенил, пиразолил, оксазолил, изоксазиолил, тиазолил, 1,2,3-, 1,2,4-, 1,2,5- или 1,3,4-оксадиазолил и изотиазолил; заместители с 6/5-членными конденсированными кольцами, такие как бензотиофуранил, бензизоксазолил, бензоксазолил, пуринил и антранилил; и 6/6-членными конденсированными кольцами, такими как бензопиранил, хинолинил, изохинолинил, циннолинил, хиназолинил и бензоксазинил.
[0088] Приставка, присоединенная к многокомпонентному заместителю применяется только к первому компоненту. Для пояснения, термин «алкилциклоалкил» содержит два компонента: алкил и циклоалкил. Таким образом, приставка C1-С6- у C1-С6-алкилциклоалкила означает, что алкильный компонент алкилциклоалкила содержит от 1 до 6 атомов углерода; приставка C1-С6-не описывает циклоалкильный компонент. Для дальнейшего пояснения, приставка «гало» у галоалкоксиалкила указывает, что только алкокси компонент алкоксиалкильного заместителя замещен одним или более галогеновыми радикалами. Если галогеновое замещение может альтернативно или дополнительно происходить на алкильном компоненте, заместитель был бы описан как «галоген-замещенный алкоксиалкил», а не «галоалкоксиалкил». И, наконец, если галогеновое замещение может происходить только на алкильном компоненте, заместитель вместо этого был бы описан как «алкоксигалоалкил».
[0089] Если заместители описываются как «независимо выбранные» из группы, каждый заместитель выбирается независимо от другого. Каждый заместитель, следовательно, может быть идентичным или отличным от другого заместителя (заместителей).
[0090] В тех случаях, когда для описания заместителя используют слова, крайний справа описанный компонент заместителя представляет собой компонент, который имеет свободную валентность.
[0091] В тех случаях, когда для описания заместителя используют химическую формулу, тире на левой стороне формулы указывает на часть заместителя, которая имеет свободную валентность.
[0092] В тех случаях, когда химическую формулу используют для описания связующего элемента между двумя другими элементами изображенной химической структуры, крайнее слева тире у заместителя указывает на часть заместителя, которая связана с левым элементом в изображенной структуре. Тире крайнее справа, с другой стороны, указывает часть заместителя, которая связана с правым элементом в изображенной структуре. Для пояснения, если изображенная химическая структура представляет собой X-L-Y, a L описан как -C(O)-N(H)-, тогда химическое вещество представляло бы собой X-C(O)-N(H)-Y.
[0093] При ссылке на использование слов «содержат» или «содержит» или «содержащий» в настоящей патентной заявке (в том числе формуле изобретения). Заявители отмечают, что если по контексту не требуется иное, эти слова используются на основании и четком понимании, что их следует интерпретировать включительно, а не исключительно, и Заявители имеют ввиду, что каждое из этих слов интерпретируется таким образом в толковании настоящей патентной заявки, включая приведенную ниже формулу изобретения.
[0094] Программное обеспечение ChemDraw было использования для составления названий соединений в настоящей патентной заявке.
[0095] Термин «некристаллическое» применительно к соединению, относится к твердому состоянию, в котором молекулы соединения представлены в неупорядоченной структуре и не образуют различимую кристаллическую решетку или элементарную ячейку. При проведении рентгеновской порошковой дифрактометрии, некристаллическое соединение не дает каких-либо характеристических кристаллических пиков.
[0096] Термин «кристаллическая форма» применительно к соединению, относится к твердому состоянию, в котором молекулы соединения расположены с образованием различимой кристаллической решетки (i) содержащей различимые элементарные ячейки, и (и) дают пики на рентгенограмме, при воздействии рентгеновского излучения.
[0097] Термин «чистота», кроме случаев, оговоренных особо, означает химическую чистоту соединения в соответствии с общепринятым ВЭЖХ анализом.
[0098] Термин «фазовая чистота» означает чистоту твердого состояния соединения относительно конкретной кристаллической или некристаллической формы соединения, определенную с помощью аналитических способов рентгеновской порошковой дифрактометрии.
[0099] Термин «фазовочистый» относится к чистоте относительно других форм соединения в твердом состоянии, и не обязательно предполагает высокую степень химической чистоты относительно других соединений.
[00100] Термин «PXRD» означает рентгеновскую порошковую дифрактометрию.
[00101] Термин «TGA» означает термогравиметрический анализ.
[00102] Термин «DSC» означает дифференциальную сканирующую калориметрию.
В. Соединения.
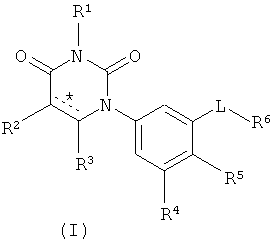
[00103] Настоящее изобретение частично относится к соединениям, которые представляют собой производные фенил-урацила, структура которых соответствует формуле I:
[00104] В этих соединениях,

[00105] В некоторых вариантах осуществления,


[00106] В других вариантах осуществления,


B1. Заместитель R1.
[00107] R1 выбран из группы, состоящей из водорода, метила и азот-защищающей группы.
[00108] В некоторых вариантах осуществления, R1 представляет собой водород.
[00109] В некоторых вариантах осуществления, R1 представляет собой метил.
[00110] В некоторых вариантах осуществления, R1 выбран из группы, состоящей из водорода и метила.
[00111] В некоторых вариантах осуществления, R1 представляет собой азот-защищающую группу. В этих вариантах осуществления, эти соединения применимы в качестве промежуточных соединений для получения соединений формулы I. Азот-защищающие группы подходящие для получения соединений формулы I, известны специалистам в данной области.
B2. Заместитель R2.
[00112] R2 выбран из группы, состоящей из водорода, гало, гидрокси, метила, циклопропила и циклобутила.
[00113] В некоторых вариантах осуществления, R2 представляет собой водород.
[00114] В некоторых вариантах осуществления, R2 представляет собой гало. В некоторых таких вариантах осуществления, R2 выбран из группы, состоящей из фтора и хлора. В других таких вариантах осуществления, R2 представляет собой фтор. В других таких вариантах осуществления, R2представляет собой хлор. В других таких вариантах осуществления, R2 представляет собой бром. В дополнительных таких вариантах осуществления, R2 представляет собой йод.
[00115] В некоторых вариантах осуществления, R2 представляет собой гидрокси.
[00116] В некоторых вариантах осуществления, R2 представляет собой метил.
[00117] В некоторых вариантах осуществления, R2 представляет собой циклопропил.
[00118] В некоторых вариантах осуществления, R2 представляет собой циклобутил.
[00119] В некоторых вариантах осуществления, R2 выбран из группы, состоящей из водорода, метила, гидрокси и гало. В некоторых таких вариантах осуществления, R2 выбран из группы, состоящей из водорода, метила, гидрокси, фтора и хлора. В других таких вариантах осуществления, R2 выбран из группы, состоящей из водорода, метила, гидрокси и фтора. В других таких вариантах осуществления, R2 выбран из группы, состоящей из водорода, метила, гидрокси, и хлора. В других таких вариантах осуществления, R2 выбран из группы, состоящей из водорода, метила, гидрокси и брома. В дополнительных таких вариантах осуществления, R2 выбран из группы, состоящей из водорода, метила, гидрокси и йода.
[00120] В некоторых вариантах осуществления, R2 выбран из группы, состоящей из водорода, метила и гало. В некоторых таких вариантах осуществления, R2 выбран из группы, состоящей из водорода, метила, фтора и хлора. В других таких вариантах осуществления, R2 выбран из группы, состоящей из водорода, метила и фтора. В других таких вариантах осуществления, R2 выбран из группы, состоящей из водорода, метила и хлора. В других таких вариантах осуществления, R2выбран из группы, состоящей из водорода, метила и брома. В дополнительных таких вариантах осуществления, R2 выбран из группы, состоящей из водорода, метила и йода.
[00121] В некоторых вариантах осуществления, R2 выбран из группы, состоящей из водорода и галогена. В некоторых таких вариантах осуществления, R2 выбран из группы, состоящей из водорода, фтора и хлора. В других таких вариантах осуществления, R2 выбран из группы, состоящей из водорода и фтора. В других таких вариантах осуществления, R2 выбран из группы, состоящей из водорода и хлора. В других таких вариантах осуществления, R2 выбран из группы, состоящей из водорода и брома. В дополнительных таких вариантах осуществления, R2 выбран из группы, состоящей из водорода йода.
В3. Заместитель R3.
[00122] R3 выбран из группы, состоящей из водорода, гало, оксо, и метила. В некоторых таких вариантах осуществления, R3 выбран из группы, состоящей из водорода, фтора, оксо, и метила. В других таких вариантах осуществления, R3 выбран из группы, состоящей из водорода, хлора, оксо, и метила. В других таких вариантах осуществления, R3 выбран из группы, состоящей из водорода, брома, оксо, и метила. В других таких вариантах осуществления, R3 выбран из группы, состоящей из водорода, йода, оксо, и метила.
[00123] В некоторых вариантах осуществления, R3 выбран из группы, состоящей из водорода, гало, и оксо. В некоторых таких вариантах осуществления, R3 выбран из группы, состоящей из водорода, фтора и оксо. В других таких вариантах осуществления, R3 выбран из группы, состоящей из водорода, хлора и оксо. В других таких вариантах осуществления, R3 выбран из группы, состоящей из водорода, брома и оксо. В других таких вариантах осуществления, R3 выбран из группы, состоящей из водорода, йода и оксо.
[00124] В некоторых вариантах осуществления, R3 выбран из группы, состоящей из водорода и метила.
[00125] В некоторых вариантах осуществления, R3 представляет собой водород.
[00126] В некоторых вариантах осуществления, R3 представляет собой метил.
[00127] В некоторых вариантах осуществления, R3 представляет собой оксо.
[00128] В некоторых вариантах осуществления, R3 представляет собой гало. В некоторых таких вариантах осуществления, R3 представляет собой фтор. В других таких вариантах осуществления, R3представляет собой хлор. В других таких вариантах осуществления, R3 представляет собой бром. В дополнительных таких вариантах осуществления, R3 представляет собой йод.
В4. Заместитель R4.
[00129] R4 выбран из группы, состоящей из гало, алкила, алкенила, алкинила, нитро, циано, азидо, алкилокеи, алкенилокси, алкинилокси, амино, аминокарбонила, аминосульфонила, алкилсульфонила, карбоциклила, и гетероциклила, где:
(a) амино, аминокарбонил, и аминосульфонил необязательно замещены:
(1) одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила, алкенила, алкинила, и алкилсульфонила, или
(2) двумя заместителями, которые вместе с аминоазотом образуют однокольцевой гетероцикл,
(b) алкил, алкенил, алкинил, алкилокеи, алкенилокси, алкинилокси, и алкилсульфонил, необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из гало, окео, нитро, циано, азидо, гидрокси, амино, алкилокеи, триметилсилила, карбоциклила, и гетероциклила, где:
амино необязательно замещен:
(1) одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила, алкенила, алкинила, алкилкарбонила, алкилсульфонила,алкилоксикарбонила, карбоциклила, гетероциклила,карбоциклилалкила, и гетероциклилалкила, или
(2) двумя заместителями, которые вместе с аминоазотом образуют однокольцевой гетероцикл, и
(c) карбоциклил и гетероциклил необязательно замещены заместителями, вплоть до трех, независимо выбранными из группы, состоящей из алкила, алкенила, алкинила, гало, оксо, нитро, циано, азидо, гидрокси, амино, алкилокеи, триметилсилила, карбоциклила, и гетероциклила, где:
амино необязательно замещен:
(1) одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила, алкенила, алкинила, алкилкарбонила, алкилсульфонила,алкилоксикарбонила, карбоциклила, гетероциклила, карбоциклилалкила и гетероциклилалкила, или
(2) двумя заместителями, которые вместе с аминоазотом образуют однокольцевой гетероцикл.
[00130] В некоторых вариантах осуществления, R4 выбран из группы, состоящей из гало, алкила, алкенила, алкинила, нитро, циано, азидо, алкилокеи, алкенилокси, алкинилокси, амино, аминокарбонила, аминосульфонила, алкилсульфонила, карбоциклила и гетероциклила, где:
амино, аминокарбонил, и аминосульфонил необязательно замещены:
(1) одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила, алкенила, алкинила и алкилсульфонила, или
(2) двумя заместителями, которые вместе с аминоазотом образуют однокольцевой гетероцикл.
[00131] В некоторых вариантах осуществления, R4 выбран из группы, состоящей из гало, алкила, алкенила, алкинила, нитро, циано, азидо, алкилокси, алкенилокси, алкинилокси, амино, аминокарбонила, аминосульфонила, алкилсульфонила, карбоциклила и гетероциклила, где:
алкил, алкенил, алкинил, алкилокси, алкенилокси, алкинилокси и алкилсульфонил, необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из гало, оксо, нитро, циано, азидо, гидрокси, амино, алкилокси, триметилсилила, карбоциклила и гетероциклила, где:
амино необязательно замещен:
(1) одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила, алкенила, алкинила, алкилкарбонила, алкилсульфонила, алкилоксикарбонила, карбоциклила, гетероциклила, карбоциклилалкила и гетероциклилалкила, или
(2) двумя заместителями, которые вместе с аминоазотом образуют однокольцевой гетероцикл.
[00132] В некоторых вариантах осуществления, R4 выбран из группы, состоящей из гало, алкила, алкенила, алкинила, нитро, циано, азидо, алкилокси, алкенилокси, алкинилокси, амино, аминокарбонила, аминосульфонила, алкилсульфонила, карбоциклила и гетероциклила, где:
карбоциклил и гетероциклил необязательно замещены заместителями, вплоть до трех, независимо выбранными из группы, состоящей из алкила, алкенила, алкинила, гало, оксо, нитро, циано, азидо, гидрокси, амино, алкилокси, триметилсилила, карбоциклила и гетероциклила, где:
амино необязательно замещен:
(1) одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила, алкенила, алкинила, алкилкарбонила, алкилсульфонила,алкилоксикарбонила, карбоциклила, гетероциклила, карбоциклилалкила и гетероциклилалкила, или
(2) двумя заместителями, которые вместе с аминоазотом образуют однокольцевой гетероцикл.
[00133] В некоторых вариантах осуществления, R4 выбран из группы, состоящей из гало, алкила, алкенила, алкинила, нитро, циано, азидо, алкилокси, алкенилокси, алкинилокси, амино, аминокарбонила, аминосульфонила, алкилсульфонила, карбоциклила и гетероциклила, где:
(a) амино, аминокарбонил, и аминосульфонил необязательно замещены:
(1) одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила, алкенила и алкинила, или,
(2) двумя заместителями, которые вместе с аминоазотом образуют однокольцевой гетероцикл; и
(b) алкил, алкенил, алкинил, алкилокси, алкенилокси, алкинилокси, алкилсульфонил, карбоциклил, и гетероциклил необязательно замещены заместителями, вплоть до трех, независимо выбранными из группы, состоящей из гало, оксо, нитро, циано, азидо, гидрокси, амино, алкилокси, карбоциклила, и гетероциклила, где амино необязательно замещен:
(1) одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила, алкенила, алкинила, алкилкарбонила, алкилсульфонила,алкилоксикарбонила, карбоциклила, гетероциклила, карбоциклилалкила, и гетероциклилалкила, или,
(2) двумя заместителями, которые вместе с аминоазотом образуют однокольцевой гетероцикл.
[00134] В некоторых вариантах осуществления, R4 выбран из группы, состоящей из гало, алкила, алкенила, алкинила, нитро, циано, азидо, алкилокеи, алкенилокси, алкинилокси, амино, аминокарбонила, аминосульфонила, алкилсульфонила, карбоциклила и гетероциклила, где:
амино, аминокарбонил и аминосульфонил необязательно замещены:
(1) одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила, алкенила и алкинила, или,
(2) двумя заместителями, которые вместе с аминоазотом образуют однокольцевой гетероцикл.
[00135] В некоторых вариантах осуществления, R4 выбран из группы, состоящей из гало, алкила, алкенила, алкинила, нитро, циано, азидо, алкилокеи, алкенилокси, алкинилокси, амино, аминокарбонила, аминосульфонила, алкилсульфонила, карбоциклила и гетероциклила, где:
алкил, алкенил, алкинил, алкилокеи, алкенилокси, алкинилокси, алкилсульфонил, карбоциклил, и гетероциклил необязательно замещены заместителями, вплоть до трех, независимо выбранными из группы, состоящей из гало, оксо, нитро, циано, азидо, гидрокси, амино, алкилокеи, карбоциклила, и гетероциклила, где амино необязательно замещен:
(1) одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила, алкенила, алкинила, алкилкарбонила, алкилсульфонила,алкилоксикарбонила, карбоциклила, гетероциклила,карбоциклилалкила, и гетероциклилалкила, или,
(2) двумя заместителями, которые вместе с аминоазотом образуют однокольцевой гетероцикл.
[00136] В некоторых вариантах осуществления, R4 выбран из группы, состоящей из гало, C1-C4-алкила, С2-С4-алкенила, С2-С4-алкинила, амино, С1-С4-алкилсульфонила, С3-С6-карбоциклила, и 5-6-членного гетероциклила, где:
(a) амино необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила, алкенила, алкинила, и алкилсульфонила,
(b) С1-С4-алкил, С2-С4-алкенил, и С2-С4-алкинил необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из гало, оксо, гидрокси, алкилокеи, и триметилсилила, и
(c) С3-С6-карбоциклил и 5-6-членный гетероциклил необязательно замещены заместителями, вплоть до трех, независимо выбранными из группы, состоящей из алкила, алкенила, алкинила, гало, и амино, где:
амино необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила, алкенила, алкинила, и алкилсульфонила.
[00137] В некоторых вариантах осуществления, R4 выбран из группы, состоящей из С1-С4-алкила, С2-С4-алкенила, С2-С4-алкинила, амино, С1-С4-алкилсульфонила, С3-С6-карбоциклила, и 5-6-членного гетероциклила, где:
(a) амино необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила, алкенила, алкинила, и алкилсульфонила,
(b) С1-С4-алкил, С2-С4-алкенил, и С2-С4-алкинил необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из гало, окео, гидрокси, алкилокси, и триметилеилила, и
(c) С3-С6-карбоциклил и 5-6-членный гетероциклил необязательно замещены заместителями, вплоть до трех, независимо выбранными из группы, состоящей из алкила, алкенила, алкинила, гало, и амино, где:
амино необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила, алкенила, алкинила, и алкилсульфонила.
[00138] В некоторых вариантах осуществления, R4 выбран из группы, состоящей из гало, С1-С4-алкила, С3-С6-карбоциклила, и 5-6-членного гетероциклила, где:
(a) С1-С4-алкил необязательно замещен заместителями, вплоть до трех, независимо выбранными из группы, состоящей из гало, оксо, гидрокси, алкилокси, и триметилеилила, и
(b) С3-С6-карбоциклил и 5-6-членный гетероциклил необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из алкила, гало, и алкилсульфониламино.
[00139] В некоторых вариантах осуществления, R4 выбран из группы, состоящей из гало, С1-С4-алкила, С3-С6-карбоциклила, и 5-6-членного гетероциклила, где:
(a) С1-С4-алкил необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из гало, оксо, гидрокси, алкилокси, и триметилеилила, и
(b) С3-С6-карбоциклил и 5-6-членный гетероциклил необязательно замещены заместителем, выбранным из группы, состоящей из алкила, гало, и алкилсульфониламино.
[00140] В некоторых вариантах осуществления, R4 выбран из группы, состоящей из С1-С4-алкила, С3-С6-карбоциклила, и 5-6-членного гетероциклила, где:
(a) С1-С4-алкил необязательно замещен заместителями, вплоть до трех, независимо выбранными из группы, состоящей из гало, оксо, гидрокси, алкилокси, и триметилеилила, и
(b) С3-С6-карбоциклил и 5-6-членный гетероциклил необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из алкила, гало, и алкилсульфониламино.
[00141] В некоторых вариантах осуществления, R4 выбран из группы, состоящей из гало, трет-бутила, С3-С6-карбоциклила, и 5-6-членного гетероциклила, где:
С3-С6-карбоциклил и 5-6-членный гетероциклил необязательно замещены заместителем, выбранным из группы, состоящей из алкила, гало и алкилсульфониламино.
[00142] В некоторых вариантах осуществления, R4 выбран из группы, состоящей из трет-бутила, С3-С6-карбоциклила, и 5-6-членного гетероциклила, где:
С3-С6-карбоциклил и 5-6-членный гетероциклил необязательно замещены заместителем, выбранным из группы, состоящей из алкила, гало и алкилсульфониламино.
[00143] В некоторых вариантах осуществления, R4 выбран из группы, состоящей из гало, алкила, галоалкила, карбоксиалкила, гидроксиалкила, алкилоксиалкила, триметилсилилалкинила, алкилкарбоциклила, карбоциклила, алкилгетероциклила, гетероциклила, галокарбоциклила, алкилсульфониламино, и алкилсульфонила.
[00144] В некоторых вариантах осуществления, R4 выбран из группы, состоящей из гало, алкила, алкенила, алкинила, нитро, циано, азидо, алкилокси, алкенилокси, алкинилокси, амино, аминокарбонила, аминосульфонила, алкилсульфонила, карбоциклила, и гетероциклила.
[00145] В некоторых вариантах осуществления, R4 выбран из группы, состоящей из гало, C1-C4-алкила, С2-С4-алкенила, С2-С4-алкинила, амино, С1-С4-алкилсульфонила, С3-С6-карбоциклила, и 5-6-членного гетероциклила. В некоторых таких вариантах осуществления, R4 выбран из группы, состоящей из гало, С1-С4-алкила, С2-С4-алкенила, С2-С4-алкинила, амино, С1-С4-алкилсульфонила, С6-карбоциклила, и 5-6-членного гетероциклила. В другом таком варианте осуществления, R4 выбран из группы, состоящей из гало, С1-С4-алкила, С2-С4-алкенила, С2-С4-алкинила, амино, C1-C4-алкилсульфонила, фенила и 5-6-членного гетероарила.
[00146] В некоторых вариантах осуществления, R4 выбран из группы, состоящей из С1-С4-алкила, С2-С4-алкенила, С2-С4-алкинила, амино, С1-С4-алкилсульфонила, С3-С6-карбоциклила, и 5-6-членного гетероциклила. В некоторых таких вариантах осуществления, R4 выбран из группы, состоящей из C1-С4-алкила, С2-С4-алкенила, С2-С4-алкинила, амино, С1-С4-алкилсульфонила, С6-карбоциклила, и 5-6-членного гетероциклила. В другом таком варианте осуществления, R4 выбран из группы, состоящей из С1-С4-алкила, С2-С4-алкенила, С2-С4-алкинила, амино, С1-С4-алкилсульфонила, фенила, и 5-6-членного гетероарила.
[00147] В некоторых вариантах осуществления, R4 выбран из группы, состоящей из гало, C1-C4-алкила, С3-С6-карбоциклила и 5-6-членного гетероциклила. В некоторых таких вариантах осуществления, R4 выбран из группы, состоящей из гало, С1-С4-алкила, С6-карбоциклила и 5-6-членного гетероциклила. В других таких вариантах осуществления, R4 выбран из группы, состоящей из гало, C1-C4-алкила, фенила и 5-6- членного гетероарила.
[00148] В некоторых вариантах осуществления, R4 выбран из группы, состоящей из C1-C4-алкила, С3-С6-карбоциклила и 5-6-членного гетероциклила. В некоторых таких вариантах осуществления, R4выбран из группы, состоящей из C1-C4-алкила, С6-карбоциклила и 5-6-членного гетероциклила. В других таких вариантах осуществления, R4 выбран из группы, состоящей из C1-C4-алкила, фенила и 5-6-членного гетероарила.
[00149] В некоторых вариантах осуществления, R4 выбран из группы, состоящей из гало, трет- бутила, С3-С6-карбоциклила и 5-6-членного гетероциклила. В некоторых таких вариантах осуществления, R4 выбран из группы, состоящей из гало, трет-бутила, С6-карбоциклила и 5-6-членного гетероциклила. В других таких вариантах осуществления, R4 выбран из группы, состоящей из гало, трет-бутила, фенила и 5-6-членного гетероарила.
[00150] В некоторых вариантах осуществления, R4 выбран из группы, состоящей из трет-бутила, С3-С6-карбоциклила и 5-6-членного гетероциклила. В некоторых таких вариантах осуществления, R4выбран из группы, состоящей из трет-бутила, С6-карбоциклила и 5-6-членного гетероциклила. В других таких вариантах осуществления, R4 выбран из группы, состоящей из трет-бутила, фенила и 5-6-членного гетероарила.
[00151] В некоторых вариантах осуществления, R4 выбран из группы, состоящей из С3-С6-карбоциклила и 5-6-членного гетероциклила. В некоторых таких вариантах осуществления, R4выбран из группы, состоящей из С6-карбоциклила и 5-6-членного гетероциклила. В других таких вариантах осуществления, R4 выбран из группы, состоящей из фенила и 5-6-членного гетероарила.
[00152] Подходящие карбоциклилы для приведенных выше вариантов осуществления включают, например, циклопропил и фенил.
[00153] Подходящие гетероциклилы для приведенных выше вариантов осуществления включают, например, фуранил, тиенил и пиридинил.
[00154] В некоторых вариантах осуществления, R4 выбран из группы, состоящей из гало, алкила, и алкилокси.
[00155] В некоторых вариантах осуществления, R4 представляет собой алкил.
[00156] В некоторых вариантах осуществления, R4 представляет собой трет-бутил.
В5. Заместитель R5.
[00157] R5 выбран из группы, состоящей из водорода, гидрокси, алкила, алкенила, алкинила, алкилокси, алкенилокси, алкинилокси, алкилсульфонилокси, карбоциклилсульфонилокси, галоалкилсульфонилокси, и галогена.
[00158] В некоторых вариантах осуществления, R5 выбран из группы, состоящей из водорода, гидрокси, алкилокси и галогена. В некоторых таких вариантах осуществления, R5 выбран из группы, состоящей из водорода, гидрокси, алкилокси и фтора. В других таких вариантах осуществления, R5выбран из группы, состоящей из водорода, гидрокси, алкилокси и фтора. В других таких вариантах осуществления, R5 выбран из группы, состоящей из водорода, гидрокси, алкилокси и хлора. В других таких вариантах осуществления, R5 выбран из группы, состоящей из водорода, гидрокси, алкилокси и брома. В дополнительных таких вариантах осуществления, R5 выбран из группы, состоящей из водорода, гидрокси, алкилокси и йода.
[00159] В некоторых вариантах осуществления, R5 выбран из группы, состоящей из водорода, гидрокси, метокси и галогена. В некоторых таких вариантах осуществления, R5 выбран из группы, состоящей из водорода, гидрокси, метокси и фтора. В других таких вариантах осуществления, R5выбран из группы, состоящей из водорода, гидрокси, метокси и хлора. В других таких вариантах осуществления, R5 выбран из группы, состоящей из водорода, гидрокси, метокси и брома. В дополнительных таких вариантах осуществления, R5 выбран из группы, состоящей из водорода, гидрокси, метокси и йода.
[00160] В некоторых вариантах осуществления, R5 выбран из группы, состоящей из водорода, гидрокси и алкилокси. В некоторых таких вариантах осуществления, R5 выбран из группы, состоящей из водорода, гидрокеи, метокси и этокси.
[00161] В некоторых вариантах осуществления, R5 представляет собой водород.
[00162] В некоторых вариантах осуществления, R5 представляет собой гидрокси.
[00163] В некоторых вариантах осуществления, R5 представляет собой алкилокси.
[00164] В некоторых вариантах осуществления, R5 представляет собой метокси.
[00165] В некоторых вариантах осуществления, R5 представляет собой этокси.
В6. Заместитель L.
[00166] L выбран из группы, состоящей из C(RA)=C(RB), этилена и циклопропил-1,2-ена, где RA и RB рассмотрены ниже.
[00167] В некоторых вариантах осуществления, L представляет собой C(RA)=C(RB), где RA и RBрассмотрены ниже. В этих вариантах осуществления, соединения формулы I соответствуют по структуре формуле I-L1:

[00168] В некоторых таких вариантах осуществления, соединения соответствуют по структуре формуле IA-L1:

[00169] В других таких вариантах осуществления, соединения соответствуют по структуре формуле IB-L1:

[00170] Обычно, соединения формулы I-L1 являются более эффективными, если R6 и фенил-урацил находятся по разные стороны двойной связи (т.е., в транс-конфигурации относительно двойной связи).
[00171] В некоторых вариантах осуществления, L представляет собой этилен. В этих вариантах осуществления, соединения формулы I соответствуют по структуре формуле I-L5-2:

[00172] В некоторых таких вариантах осуществления, соединения соответствуют по структуре IA-L5-2:

[00173] В других таких вариантах осуществления, соединения соответствуют по структуре формуле IB-L5-2:

[00174] В некоторых вариантах осуществления, L представляет собой циклопропил-1,2-ен. В этих вариантах осуществления, соединения формулы I соответствуют по структуре формуле I-L8:

[00175] В некоторых таких вариантах осуществления, соединения соответствуют по структуре формуле IA-L8:

[00176] В других таких вариантах осуществления, соединения соответствуют по структуре формуле IB-L8:
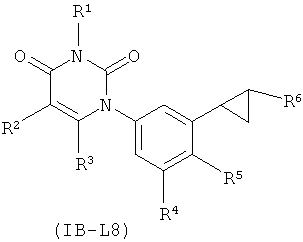
В7. Заместители RA и RB.
[00177] RA и RB независимо выбраны из группы, состоящей из водорода C1-C6-алкила, C1-C6-алкилокси, С3-С8-циклоалкила, и гало, где:
C1-C6-алкил необязательно замещен одним или более заместителями, независимо выбранными из группы, состоящей из карбокси, гало, гидрокси, нитро, оксо, амино, циано, алкилоксикарбонила, алкилкарбонилокси, алкилокси, карбоциклила, и гетероциклила.
[00178] В некоторых вариантах осуществления, один из RA и RB представляет собой водород, а другой выбран из группы, состоящей из C1-C6-алкила, C1-C6-алкилокси, С3-С8-циклоалкила и гало, где:
C1-C6-алкил необязательно замещен одним или более заместителями, независимо выбранными из группы, состоящей из карбокси, гало, гидрокси, нитро, оксо, амино, циано, алкилоксикарбонила, алкилкарбонилокси, алкилокси, карбоциклила, и гетероциклила.
[00179] В некоторых вариантах осуществления, RA и RB независимо выбраны из группы, состоящей из водорода, C1-C6-алкила, C1-C6-алкилокси, С3-С8-циклоалкила, и гало.
[00180] В некоторых из представленных выше вариантов осуществления, RA представляет собой водород. В другом из представленных выше вариантов осуществления, RB представляет собой водород.
[00181] В некоторых вариантах осуществления, один из RA и RB представляет собой водород, а другой выбран из группы, состоящей из водорода, метила, метокси, и гало.
[00182] В некоторых вариантах осуществления, RA представляет собой водород, a RB выбран из группы, состоящей из метила, метокси, и гало. В некоторых таких вариантах осуществления, RB выбран из группы, состоящей из метила, метокси и фтора. В других таких вариантах осуществления, RB выбран из группы, состоящей из метила, метокси, и хлора. В других таких вариантах осуществления, RB выбран из группы, состоящей из метила, метокси, и брома. В дополнительных таких вариантах осуществления, RB выбран из группы, состоящей из метила, метокси, и йода. Еще в таких дополнительных вариантах осуществления, RB выбран из группы, состоящей из метила, метокси, хлора и фтора.
[00183] В некоторых вариантах осуществления, RB представляет собой водород, a RA выбран из группы, состоящей из метила, метокси, и гало. В некоторых таких вариантах осуществления, RA выбран из группы, состоящей из метила, метокси и фтора. В других таких вариантах осуществления, RA выбран из группы, состоящей из метила, метокси, и хлора. В других таких вариантах осуществления, RA выбран из группы, состоящей из метила, метокси, и брома. В дополнительных таких вариантах осуществления, RA выбран из группы, состоящей из метила, метокси, и йода. Еще в таких дополнительных вариантах осуществления, RA выбран из группы, состоящей из метила, метокси, хлора и фтора.
[00184] В некоторых вариантах осуществления, RA представляет собой водород, а RB представляет собой водород.
В8. Заместитель R6.
[00185] R6 выбран из группы, состоящей из С5-С6-карбоциклила, 5-6-членного гетероциклила, конденсированного 2-кольцевого карбоциклила и конденсированного 2-кольцевого гетероциклила, где каждый такой заместитель необязательно замещен одним или более заместителями, независимо выбранными из группы, состоящей из RE, RF, RG, RH, RI, RJ и RK где RE, RF, RG, RH, RI, RJ и RKрассмотрены ниже. В некоторых таких вариантах осуществления, С5-С6-карбоциклил, 5-6-членный гетероциклил, конденсированный 2-кольцевой карбоциклил и конденсированный 2-кольцевой гетероциклил не замещены. В других таких вариантах осуществления, С5-С6-карбоциклил, 5-6-членный гетероциклил, конденсированный 2-кольцевой карбоциклил и конденсированный 2-кольцевой гетероциклил замещены заместителем, выбранным из группы, состоящей из RE, RF, RG, RH, RI, RJ, и RK. В других таких вариантах осуществления, С5-С6-карбоциклил, 5-6-членный гетероциклил, конденсированный 2-кольцевой карбоциклил и конденсированный 2-кольцевой гетероциклил замещены заместителем, выбранным из группы, состоящей из RE, RF, RI, RJ и RK. В других таких вариантах осуществления, С5-С6-карбоциклил, 5-6-членный гетероциклил, конденсированный 2-кольцевой карбоциклил, и конденсированный 2-кольцевой гетероциклил замещены заместителем, выбранным из группы, состоящей из RE, RF, и RJ. В других таких вариантах осуществления, С5-С6-карбоциклил, 5-6-членный гетероциклил, конденсированный 2-кольцевой карбоциклил, и конденсированный 2-кольцевой гетероциклил замещены заместителем, выбранным из группы, состоящей из RF и RJ. В других таких вариантах осуществления, С5-С6-карбоциклил, 5-6-членный гетероциклил, конденсированный 2-кольцевой карбоциклил и конденсированный 2-кольцевой гетероциклил замещены RJ. В других таких вариантах осуществления, С5-С6-карбоциклил, 5-6-членный гетероциклил, конденсированный 2-кольцевой карбоциклил и конденсированный 2-кольцевой гетероциклил замещены двумя заместителями, независимо выбранными из группы, состоящей из RE, RF, RG, RH, RI, RJ и RK. В других таких вариантах осуществления, С5-С6-карбоциклил, 5-6-членный гетероциклил, конденсированный 2-кольцевой карбоциклил и конденсированный 2-кольцевой гетероциклил замещены двумя заместителями, независимо выбранными из группы, состоящей из RE, RF, RI, RJ и RK. В других таких вариантах осуществления, С5-С6-карбоциклил, 5-6-членный гетероциклил, конденсированный 2-кольцевой карбоциклил и конденсированный 2-кольцевой гетероциклил замещены двумя заместителями, независимо выбранными из группы, состоящей из RE, RF и RJ. В других таких вариантах осуществления, С5-С6-карбоциклил, 5-6-членный гетероциклил, конденсированный 2-кольцевой карбоциклил и конденсированный 2-кольцевой гетероциклил замещены двумя заместителями, независимо выбранными из группы, состоящей из RF и RJ. В дополнительных таких вариантах осуществления, С5-С6-карбоциклил, 5-6-членный гетероциклил, конденсированный 2-кольцевой карбоциклил и конденсированный 2-кольцевой гетероциклил замещены тремя заместителями, независимо выбранными из группы, состоящей из RE, RF, RG, RH, RI, RJ и RK. В дополнительных таких вариантах осуществления, С5-С6-карбоциклил, 5-6-членный гетероциклил, конденсированный 2-кольцевой карбоциклил и конденсированный 2-кольцевой гетероциклил замещены тремя заместителями, независимо выбранными из группы, состоящей из RE, RF, RI, RJ и RK. В дополнительных таких вариантах осуществления, С5-С6-карбоциклил, 5-6-членный гетероциклил, конденсированный 2-кольцевой карбоциклил и конденсированный 2-кольцевой гетероциклил замещены тремя заместителями, независимо выбранными из группы, состоящей из RE, RF и RJ. В дополнительных таких вариантах осуществления, С5-С6-карбоциклил, 5-6-членный гетероциклил, конденсированный 2-кольцевой карбоциклил и конденсированный 2-кольцевой гетероциклил замещены тремя заместителями, независимо выбранными из группы, состоящей из RF и RJ. В дополнительных таких вариантах осуществления, С5-С6-карбоциклил, 5-6-членный гетероциклил, конденсированный 2-кольцевой карбоциклил и конденсированный 2-кольцевой гетероциклил замещены одним, двумя или тремя заместителями, независимо выбранными из группы, состоящей из RE, RF, RG, RH, RI, RJ и RK. В дополнительных таких вариантах осуществления, С5-С6-карбоциклил, 5-6-членный гетероциклил, конденсированный 2-кольцевой карбоциклил и конденсированный 2- кольцевой гетероциклил замещены одним, двумя или тремя заместителями, независимо выбранными из группы, состоящей из RE, RF, RI, RJ и RK. В дополнительных таких вариантах осуществления, C5-С6-карбоциклил, 5-6-членный гетероциклил, конденсированный 2-кольцевой карбоциклил и конденсированный 2-кольцевой гетероциклил замещены одним, двумя или тремя заместителями, независимо выбранными из группы, состоящей из RE, RF и RJ. В дополнительных таких вариантах осуществления, С5-С6-карбоциклил, 5-6-членный гетероциклил, конденсированный 2-кольцевой карбоциклил и конденсированный 2-кольцевой гетероциклил замещены одним, двумя или тремя заместителями, независимо выбранными из группы, состоящей из RF и RJ.
[00186] В некоторых вариантах осуществления, R6 выбран из группы, состоящей из С5-С6-карбоциклила и 5-6-членного гетероциклила, где каждый такой заместитель необязательно замещен одним или более заместителями, независимо выбранными из группы, состоящей из RE, RF, RG, RH, RI, RJ и RK. В некоторых таких вариантах осуществления, С5-С6-карбоциклил и 5-6-членныйгетероциклил не замещены. В других таких вариантах осуществления, С5-С6-карбоциклил и 5-6-членный гетероциклил замещены заместителем, выбранным из группы, состоящей из RE, RF, RG, RH, RI, RJ, и RK. В других таких вариантах осуществления, С5-С6-карбоциклил и 5-6-членный гетероциклил замещены двумя заместителями, независимо выбранными из группы, состоящей из RE, RF, RG, RH, RI, KJ, и RK. В дополнительных таких вариантах осуществления, С5-С6-карбоциклил и 5-6-членный гетероциклил замещены тремя заместителями, независимо выбранными из группы, состоящей из RE, RF, RG, RH, RI, RJ и RK. В дополнительных таких вариантах осуществления, С5-С6-карбоциклил и 5-6-членный гетероциклил замещены одним, двумя или тремя заместителями, независимо выбранными из группы, состоящей из RE, RF, RG, RH, RI, RJ и RK.
[00187] В некоторых вариантах осуществления, R6 представляет собой С5-С6-карбоциклил, необязательно замещенный одним или более заместителями, независимо выбранными из группы, состоящей из RE, RF, RG, RH, RI, RJ и RK. В некоторых таких вариантах осуществления, С5-С6-карбоциклил не замещен. В других таких вариантах осуществления, С5-С6-карбоциклил замещен заместителем, выбранным из группы, состоящей из RE, RF, RG, RH, RI, RJ и RK. В других таких вариантах осуществления, С5-С6-карбоциклил замещен двумя заместителями, независимо выбранными из группы, состоящей из RE, RF, RG, RH, RI, RJ и RK. В дополнительных таких вариантах осуществления, С5-С6-карбоциклил замещен тремя заместителями, независимо выбранными из группы, состоящей из RE, RF, RG, RH, RI, RJ и RK. В дополнительных таких вариантах осуществления, С5-С6-карбоциклил замещен одним, двумя или тремя заместителями, независимо выбранными из группы, состоящей из RE, RF, RG, RH, RI, RJ и RK.
[00188] В некоторых вариантах осуществления, R6 представляет собой 5-6-членный гетероциклил, необязательно замещенный одним или более заместителями, независимо выбранными из группы, состоящей из RE, RF, RG, RH, RI, RJ и RK. В некоторых таких вариантах осуществления, 5-6-членный гетероциклил не замещен. В других таких вариантах осуществления, 5-6-членный гетероциклил замещен заместителем, выбранным из группы, состоящей из RE, RF, RG, RH, RI, RJ и RK. В других таких вариантах осуществления, 5-6-членный гетероциклил замещен двумя заместителями, независимо выбранными из группы, состоящей из RE, RF, RG, RH, RI, RJ и RK. В дополнительных таких вариантах осуществления, 5-6-членный гетероциклил замещен тремя заместителями, независимо выбранными из группы, состоящей из RE, RF, RG, RH, RI, RJ и RK. В дополнительных таких вариантах осуществления, 5-6-членный гетероциклил замещен одним, двумя или тремя заместителями, независимо выбранными из группы, состоящей из RE, RF, RG, RH, RI, RJ и RK.
[00189] В некоторых вариантах осуществления, R6 выбран из группы, состоящей из конденсированного 2-кольцевого карбоциклила и конденсированного 2-кольцевого гетероциклила, где каждый такой заместитель необязательно замещен одним или более заместителями, независимо выбранными из группы, состоящей из RE, RF, RG, RH, RI, RJ и RK. В некоторых таких вариантах осуществления, конденсированный 2-кольцевой карбоциклил и конденсированный 2-кольцевой гетероциклил не замещены. В других таких вариантах осуществления, конденсированный 2-кольцевой карбоциклил и конденсированный 2-кольцевой гетероциклил замещены заместителем, выбранным из группы, состоящей из RE, RF, RG, RH, RI, RJ и RK. В других таких вариантах осуществления, конденсированный 2-кольцевой карбоциклил и конденсированный 2-кольцевой гетероциклил замещены двумя заместителями, независимо выбранными из группы, состоящей из RE, RF, RG, RH, RI, RJ и RK. В дополнительных таких вариантах осуществления, конденсированный 2-кольцевой карбоциклил и конденсированный 2-кольцевой гетероциклил замещены тремя заместителями, независимо выбранными из группы, состоящей из RE, RF, RG, RH, RI, RJ и RK. В дополнительных таких вариантах осуществления конденсированный 2-кольцевой карбоциклил и конденсированный 2-кольцевой гетероциклил замещены одним, двумя или тремя заместителями, независимо выбранными из группы, состоящей из RE, RF, RG, RH, RI, RJ и RK.
[00190] В некоторых вариантах осуществления, R6 представляет собой конденсированный 2-кольцевой карбоциклил, необязательно замещенный одним или более заместителями, независимо выбранными из группы, состоящей из RE, RF, RG, RH, RI, RJ и RK. В некоторых таких вариантах осуществления, конденсированный 2-кольцевой карбоциклил не замещен. В других таких вариантах осуществления, конденсированный 2-кольцевой карбоциклил замещен заместителем, выбранным из группы, состоящей из RE, RF, RG, RH, RI, RJ и RK. В других таких вариантах осуществления конденсированный 2-кольцевой карбоциклил замещен двумя заместителями, независимо выбранными из группы, состоящей из RE, RF, RG, RH, RI, RJ и RK. В дополнительных таких вариантах осуществления, конденсированный 2-кольцевой карбоциклил замещен тремя заместителями, независимо выбранными из группы, состоящей из RE, RF, RG, RH, RI, RJ и RK. В дополнительных таких вариантах осуществления, конденсированный 2-кольцевой карбоциклил замещен одним, двумя или тремя заместителями, независимо выбранными из группы, состоящей из RE, RF, RG, RH, RI, RJ и RK.
[00191] В некоторых вариантах осуществления, R6 представляет собой конденсированный 2-кольцевой гетероциклил, необязательно замещенный одним или более заместителями, независимо выбранными из группы, состоящей из RE, RF, RG, RH, RI, RJ и RK. В некоторых таких вариантах осуществления, конденсированный 2-кольцевой гетероциклил не замещен. В других таких вариантах осуществления, конденсированный 2-кольцевой гетероциклил замещен заместителем, выбранным из группы, состоящей из RE, RF, RG, RH, RI, RJ и RK. В других таких вариантах осуществления, конденсированный 2-кольцевой гетероциклил замещен двумя заместителями, независимо выбранными из группы, состоящей из RE, RF, RG, RH, RI, RJ и RK. В дополнительных таких вариантах осуществления, конденсированный 2-кольцевой гетероциклил замещен тремя заместителями, независимо выбранными из группы, состоящей из RE, RF, RG, RH, RI, RJ, и RK. В дополнительных таких вариантах осуществления, конденсированный 2-кольцевой гетероциклил замещен одним, двумя или тремя заместителями, независимо выбранными из группы, состоящей из RE, RF, RG, RH, RI, RJ, и RK.
[00192] В некоторых из приведенных выше вариантов осуществления, необязательно замещенный С5-С6-карбоциклил выбран из группы, состоящей из циклопентила, циклопентенила, циклопентадиенила, циклогексила, циклогексенила, циклогексадиенила и фенила. В некоторых таких вариантах осуществления, необязательно замещенный С5-С6-карбоциклил представляет собой фенил.
[00193] В некоторых из приведенных выше вариантов осуществления, необязательно замещенный С5-С6-карбоциклил представляет собой С5-карбоциклил. Примеры С5-карбоциклилов включают циклопентил, циклопентенил и циклопентадиенил.
[00194] В другом из представленных выше вариантов осуществления, необязательно замещенный С5-С6-карбоциклил представляет собой С6-карбоциклил. Примеры С6-карбоциклилов включают циклогексил, циклогексенил, циклогексадиенил и фенил.
[00195] В некоторых из приведенных выше вариантов осуществления, необязательно замещенный 5-6-членный-гетероциклил выбран из группы, состоящей из фуранила, дигидрофуранила, тетрагидрофуранила, тиофенила (тиофуранила), дигидротиофенила, тетрагидротиофенила, пирролила, пирролинила, пирролидинила, оксазолила, дигидрооксазолила, изоксазолила, дигидроизоксазолила, оксазолидинила, изоксазолидинила, тиазолила, изотиазолила, тиазолинила, изотиазолинила, тиазолидинила, изотиазолидинила, имидазолила, имидазолидинила, пиразолила, пиразолинила, пиразолидинила, оксатиолила, оксатиоланила, триазолила, оксадиазолила, фуразанила, тетразолила, оксатриазолила, диоксазолила, оксатиазолила, оксатиазолидинила, дигидрооксадиазолила, диоксазолидинила, пиранила, дигидропиранила, тетрагидропиранила, пиридинила, дигидропиридинила, тетрагидропиридинила, пиперидинила, диазинила, пиразинила, пиридазинила, пиримидинила, дигидропиразинила, тетрагидропиразинила, пиперазинила, триазинила, дигидротриазинила, тетрагидротриазинила, триазинанила, оксазинила, дигидрооксазинила, морфолинила, оксатиазинила, дигидрооксатиазинила, оксатиазинанила, оксадиазинила, дигидрооксадиазинила, оксадиазинанила, тиопиранила, дигидротиопиранила и тетрагидротиопиранила.
[00196] В некоторых из приведенных выше вариантов осуществления, необязательно замещенный 5-6-членный -гетероциклил представляет собой 5-членный гетероциклил. Примеры такого 5-членного гетероциклила включают фуранил, дигидрофуранил, тетрагидрофуранил, тиофенил (тиофуранил), дигидротиофенил, тетрагидротиофенил, пирролил, пирролинил, пирролидинил, оксазолил, дигидрооксазолил, изоксазолил, дигидроизоксазолил, оксазолидинил, изоксазолидинил, тиазолил, изотиазолил, тиазолинил, изотиазолинил, тиазолидинил, изотиазолидинил, имидазолил, имидазолидинил, пиразолил, пиразолинил, пиразолидинил, оксатиолил, оксатиоланил, триазолил, оксадиазолил, фуразанил, тетразолил, оксатриазолил, диоксазолил, оксатиазолил, оксатиазолидинил, дигидрооксадиазолил и диоксазолидинил.
[00197] В других представленных выше вариантах осуществления, необязательно замещенный 5-6-членный гетероциклил представляет собой 6-членный гетероциклил. Примеры 6-членных гетероциклилов включают пиранил, дигидропиранил, тетрагидропиранил, пиридинил, дигидропиридинил, тетрагидропиридинил, пиперидинил, диазинил, пиразинил, пиридазинил, пиримидинил, дигидропиразинил, тетрагидропиразинил, пиперазинил, триазинил, дигидротриазинил, тетрагидротриазинил, триазинанил, оксазинил, дигидрооксазинил, морфолинил, оксатиазинил, дигидрооксатиазинил, оксатиазинанил, оксадиазинил, дигидрооксадиазинил, оксадиазинанил, тиопиранил, дигидротиопиранил и тетрагидротиопиранил.
[00198] В некоторых из приведенных выше вариантов осуществления, необязательно замещенный конденсированный 2-кольцевой карбоциклил выбран из группы, состоящей из нафталенила, дигидронафталенила, тетрагидронафталенила, гексагидронафталенила, октагидронафталенила, декагидронафталенила, инденила, дигидроинденила, гексагидроинденила, октагидроинденила, пенталенила, октагидропенталенила и гексагидропенталенила. В некоторых таких вариантах осуществления, необязательно замещенный конденсированный 2-кольцевой карбоциклил выбран из группы, состоящей из нафталенила и дигидроинденила. В некоторых таких вариантах осуществления, необязательно замещенный конденсированный 2-кольцевой карбоциклил представляет собой нафталенил. В других таких вариантах осуществления, необязательно замещенный конденсированный 2-кольцевой карбоциклил представляет собой дигидроинденил. В дополнительных таких вариантах осуществления, необязательно замещенный конденсированный 2-кольцевой карбоциклил представляет собой инденил.
[00199] В некоторых из приведенных выше вариантов осуществления, необязательно замещенный конденсированный 2-кольцевой гетероциклил выбран из группы, состоящей из



















X1, X2 и X3 независимо выбраны из группы, состоящей из N и С(Н);
X4 выбран из группы, состоящей из N(H), О и S;
X5, X6 и X7 независимо выбраны из группы, состоящей из N и С(Н);
X8 выбран из группы, состоящей из N(H), О и S;
X9 выбран из группы, состоящей из N(H), О и S;
X10, X11, X12 и X13 независимо выбраны из группы, состоящей из N и С(Н);
X14 выбран из группы, состоящей из N(H), О и S;
X15, X16, X17 и X18 независимо выбраны из группы, состоящей из N и С(Н);
один или более из X19, X20 и X21 представляет собой N, а остальной (остальные) представляет/представляют собой С(Н);
один или более из X22, X23, X24 и X25 представляет собой N, а остальной (остальные) представляет/представляют собой С(Н);
один или более из X26, X27 и X28 представляет собой N, а остальной (остальные) представляет/представляют собой С(Н);
один или более из X29, X30, X31 и X32 представляет собой N, а остальной (остальные) представляет/представляют собой С(Н);
один или более из X33, X34 и X35 представляет собой N, а остальной (остальные) представляет/представляют собой С(Н);
один или более из X36, X37, X38 и X39 представляет собой N, а остальной (остальные) представляет/представляют собой С(Н);
X40, X41 и X42 независимо выбраны из группы, состоящей из N и С(Н);
один из X43, X44 и X45 выбран из группы, состоящей из N(H), О и S, а остальные два представляют собой C(H)2;
один из X46 и X47 выбран из группы, состоящей из N(H), О и S, а другой представляет собой С(Н)2;
X48, X49, X50 и X51 независимо выбраны из группы, состоящей из N и С(Н);
X52, X53 и X54 независимо выбраны из группы, состоящей из N и С(Н);
X55 выбран из группы, состоящей из N(H), О и S;
X56, X57 и X58 независимо выбраны из группы, состоящей из N и С(Н);
X59 выбран из группы, состоящей из N(H), О и S;
X60 выбран из группы, состоящей из N(H), О и S;
X61, X62, X63 и X64 независимо выбраны из группы, состоящей из N и С(Н);
X65 выбран из группы, состоящей из N(H), О и S;
X66, X67, X68 и X69 независимо выбраны из группы, состоящей из N и С(Н);
один или более из X70, X71 и X72 представляет собой N, а остальной (остальные) представляет/представляют собой С(Н);
один или более из X73, X74, X75 и X76 представляет собой N, а остальной (остальные) представляет/представляют собой С(Н); и
один из X77 и X78 представляет собой N(H), а оставшийся представляет собой С(Н)2.
[00200] В некоторых из приведенных выше вариантов осуществления, необязательно замещенный конденсированный 2-кольцевой гетероциклил выбран из группы, состоящей из

















[00201] В некоторых из приведенных выше вариантов осуществления, необязательно замещенный конденсированный 2-кольцевой гетероциклил выбран из группы, состоящей из:











[00202] В некоторых из приведенных выше вариантов осуществления, X1, X2 и Х3 представляют собой С(Н).
[00203] В некоторых из приведенных выше вариантов осуществления, X5, X6 и Х7 представляют собой С(Н).
[00204] В некоторых из приведенных выше вариантов осуществления, X10, Х11, X12 и Х13 представляют собой С(Н).
[00205] В некоторых из приведенных выше вариантов осуществления, X15, X16, X17 и Х18 представляют собой С(Н).
[00206] В некоторых из приведенных выше вариантов осуществления, один из X19, X20 и X21 представляет собой N.
[00207] В некоторых из приведенных выше вариантов осуществления, один из X22, X23, X24 и X25 представляет собой N.
[00208] В некоторых из приведенных выше вариантов осуществления, один из X26, X27 и X28 представляет собой N и один из X29, X30, X31 и X32 представляет собой N.
[00209] В некоторых из приведенных выше вариантов осуществления, X40, X41 и Х42 представляют собой С(Н).
[00210] В некоторых из приведенных выше вариантов осуществления, X48, X49, Х50 и X51 представляют собой С(Н).
[00211] В некоторых из приведенных выше вариантов осуществления, X52, X53 и Х54 представляют собой С(Н).
[00212] В некоторых из приведенных выше вариантов осуществления, X56, X57 и Х58 представляют собой С(Н).
[00213] В некоторых из приведенных выше вариантов осуществления, X61, X62, X63 и Х64 представляют собой С(Н).
[00214] В некоторых из приведенных выше вариантов осуществления, X66, X67, X68 и Х69 представляют собой С(Н).
[00215] В некоторых из приведенных выше вариантов осуществления, один или более из X70, X71 и X72 представляет собой N, а остальной (остальные) представляет/представляют собой С(Н).
[00216] В некоторых из приведенных выше вариантов осуществления, один или более из X73, X74, X75 и X76 представляет собой N, а остальной (остальные) представляет/представляют собой С(Н).
В9. Заместитель RE.
[00217] Каждый RE независимо выбран из группы, состоящей из гало, нитро, гидрокси, оксо, карбокси, циано, амино, имино, азидо, и альдегидо, где амино необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила, алкенила и алкинила.
[00218] В некоторых вариантах осуществления, каждый RE независимо выбран из группы, состоящей из гало, нитро, гидрокси, оксо, карбокси, амино, имино и альдегидо, где амино необязательно замещен одним или двумя независимо выбранными алкилами.
[00219] В некоторых вариантах осуществления, каждый RE независимо выбран из группы, состоящей из гало, нитро, гидрокси, оксо, карбокси, амино, имино, альдегидо и алкиламино.
[00220] В некоторых вариантах осуществления, каждый RE независимо выбран из группы, состоящей из хлора, фтора, нитро, гидрокси, оксо, карбокси, амино, имино, альдегидо и алкиламино.
[00221] В некоторых вариантах осуществления, каждый RE независимо выбран из группы, состоящей из гало, нитро, гидрокси, оксо, карбокси, циано, амино, имино и азидо. В некоторых таких вариантах осуществления, каждый RE представляет собой гало. В других таких вариантах осуществления, каждый RE представляет собой нитро. В других таких вариантах осуществления, каждый RE представляет собой гидрокси. В других таких вариантах осуществления, каждый RE представляет собой оксо. В других таких вариантах осуществления, каждый RE представляет собой карбокси. В других таких вариантах осуществления, каждый RE представляет собой циано. В других таких вариантах осуществления, каждый RE представляет собой амино. В дополнительных таких вариантах осуществления, каждый RE представляет собой имино. Еще в дополнительных вариантах осуществления, каждый RE представляет собой азидо.
[00222] В некоторых вариантах осуществления, каждый RE независимо выбран из группы, состоящей из гало, нитро, гидрокси, оксо, карбокси, циано, амино и имино.
В10. Заместитель RF.
[00223] Каждый RF независимо выбран из группы, состоящей из алкила, алкенила и алкинила, где:
каждый такой заместитель необязательно замещен одним или более заместителями, независимо выбранными из группы, состоящей из карбокси, гидрокси, гало, амино, имино, нитро, азидо, оксо, аминосульфонила, алкилсульфонила, алкилоксикарбонила, алкенилоксикарбонила, алкинилоксикарбонила, алкилкарбонилокси, алкенилкарбонилокси, алкинилкарбонилокси, алкилокси, алкенилокси, алкинилокси, карбоциклила, гетероциклила, циано и аминокарбонила, где:
амино, имино, аминосульфонил, аминокарбонил, карбоциклил и гетероциклил необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из алкила, алкенила, алкинила, алкилсульфонила, алкенилсульфонила, алкинилсульфонила, алкилсульфониламино, гидрокси и алкилокси,
где:
амино часть алкилсульфониламино необязательно замещена заместителем, выбранным из группы, состоящей из алкила, алкенила и алкинила.
[00224] В некоторых вариантах осуществления, каждый RF независимо выбран из группы, состоящей из алкила, алкенила и алкинила, где:
каждый такой заместитель необязательно замещен одним или более заместителями, независимо выбранными из группы, состоящей из карбокси, гидрокси, гало, амино, имино, нитро, азидо, оксо, аминосульфонила, алкилсульфонила, алкилоксикарбонила, алкенилоксикарбонила, алкинилоксикарбонила, алкилкарбонилокси, алкенилкарбонилокси, алкинилкарбонилокси, алкилокси, алкенилокси, алкинилокси, карбоциклила, гетероциклила, циано и аминокарбонила, где:
амино, имино, аминосульфонил и аминокарбонил необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из алкила, алкенила, алкинила, алкилсульфонила, алкенилсульфонила, алкинилсульфонила и алкилсульфониламино,
где:
амино часть алкилсульфониламино необязательно замещена заместителем, выбранным из группы, состоящей из алкила, алкенила и алкинила.
[00225] В некоторых из приведенных выше вариантов осуществления, каждый RF независимо выбран из группы, состоящей из алкила, алкинила и алкинила, где такие заместители являются незамещенными.
[00226] В некоторых вариантах осуществления, каждый RF независимо выбран из группы, состоящей из алкила, алкенила и алкинила, где:
каждый такой заместитель необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из карбокси, гидрокеи, гало, амино, имино, нитро, оксо, аминосульфонила, алкилсульфонила, алкилоксикарбонила, алкилкарбонилокси, алкилокси, карбоциклила, гетероциклила, циано и аминокарбонила, где:
амино, имино, аминосульфонил и аминокарбонил необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из алкила, алкилсульфонила и алкилсульфониламино,
где:
амино часть алкилсульфониламино необязательно замещена алкилом.
[00227] В некоторых вариантах осуществления, каждый RF представляет собой независимо выбранный алкил, необязательно замещенный заместителем, выбранным из группы, состоящей из карбокси, гидрокси, гало, амино, имино, нитро, оксо, аминосульфонила, алкилсульфонила, алкилоксикарбонила, алкилкарбонилокси, алкилокси, карбоциклила, гетероциклила, циано и аминокарбонила, где:
амино, имино, аминосульфонил и аминокарбонил необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из алкила, алкилсульфонила и алкилсульфониламино, где:
амино часть алкилсульфониламино необязательно замещена алкилом.
[00228] В некоторых вариантах осуществления, каждый RF представляет собой независимо выбранный алкил, необязательно замещенный заместителем, выбранным из группы, состоящей из карбокси, гало, амино, имино и аминосульфонила, где:
амино, имино и аминосульфонил необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из алкила, алкилсульфонила и алкилсульфониламино.
[00229] В некоторых вариантах осуществления, каждый RF представляет собой независимо выбранный алкил, необязательно замещенный амино, где амино необязательно замещен алкилсульфонилом.
[00230] В некоторых вариантах осуществления, каждый RF представляет собой независимо выбранный алкил, замещенный амино, где амино замещен алкилсульфонилом. В некоторых таких вариантах осуществления, каждый RF представляет собой метилсульфониламинометил.
[00231] В некоторых вариантах осуществления, каждый RF независимо выбран из группы, состоящей из алкила, алкенила и алкинила, где:
каждый такой заместитель необязательно замещен одним, двумя или тремя заместителями, независимо выбранными из группы, состоящей из карбокси, гидрокси, гало, амино, имино, нитро, азидо, оксо, аминосульфонила, алкилсульфонила, алкилоксикарбонила, алкенилоксикарбонила, алкинилоксикарбонила, алкилкарбонилокси, алкенилкарбонилокси, алкинилкарбонилокси, алкилокси, алкенилокси, алкинилокеи, карбоциклила, гетероциклила, циано и аминокарбонила.
[00232] В некоторых вариантах осуществления, каждый RF представляет собой независимо выбранный алкил, замещенный одним или более заместителями, независимо выбранными из группы, состоящей из карбокси, гидрокси, гало, амино, имино, нитро, азидо, оксо, аминосульфонила, алкилсульфонила, алкилоксикарбонила, алкенилоксикарбонила, алкинилоксикарбонила, алкилкарбонилокси, алкенилкарбонилокси, алкинилкарбонилокси, алкилокси, алкенилокси, алкинилокеи, карбоциклила, гетероциклила, циано и аминокарбонила.
В11. Заместитель RG.
[00233] Каждый RG независимо выбран из группы, состоящей из карбоциклила и гетероциклила, где:
каждый такой заместитель необязательно замещен одним или более заместителями, независимо выбранными из группы, состоящей из алкила, алкенила, алкинила, карбокси, гидрокси, гало, амино, нитро, азидо, оксо, аминосульфонила, алкилоксикарбонила, алкенилоксикарбонила, алкинилоксикарбонила, алкилкарбонилокси, алкенилкарбонилокси, алкинилкарбонилокси, алкилокси, алкенилокси, алкинилокси, карбоциклила, гетероциклила, циано и аминокарбонила, где:
амино, аминосульфонил и аминокарбонил необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из алкила, алкенила, алкинила, алкилсульфонила, алкенилсульфонила и алкинилсульфонила.
[00234] В некоторых из приведенных выше вариантов осуществления, каждый RG независимо выбран из группы, состоящей из карбоциклила и гетероциклила, где такие заместители являются незамещенными.
[00235] В некоторых вариантах осуществления, каждый RG независимо выбран из группы, состоящей из карбоциклила и гетероциклила, где:
каждый такой заместитель необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила, карбокси, гидрокси, гало, амино, нитро, оксо, аминосульфонила, алкилоксикарбонила, алкилкарбонилокси, алкилокси, карбоциклила, гетероциклила, циано и аминокарбонила, где:
амино, аминосульфонил и аминокарбонил необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из алкила и алкилсульфонила.
[00236] В некоторых из приведенных выше вариантов осуществления, карбоциклил представляет собой С3-С6-карбоциклил.
[00237] В некоторых из приведенных выше вариантов осуществления, гетероциклил представляет собой 5-6-членный гетероциклил.
В12. Заместитель RH.
[00238] Каждый RH независимо выбран из группы, состоящей из алкилокси, алкенилокси, алкинилокси, алкилсульфонилокси, алкенилсульфонилокси и алкинилсульфонилокси, где:
каждый такой заместитель необязательно замещен одним или более заместителями, независимо выбранными из группы, состоящей из карбокси, гидрокси, гало, амино, нитро, азидо, оксо, аминосульфонила, алкилоксикарбонила, алкенилоксикарбонила, алкинилоксикарбонила, алкилкарбонилокси, алкенилкарбонилокси, алкинилкарбонилокси, алкилокси, алкенилокси, алкинилокси, карбоциклила, гетероциклила, циано и аминокарбонила, где:
амино, аминосульфонил и аминокарбонил необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из алкила, алкенила, алкинила, алкилсульфонила, алкенилсульфонила и алкинилсульфонила.
[00239] В некоторых из приведенных выше вариантов осуществления, каждый RH независимо выбран из группы, состоящей из алкилокси, алкенилокси, алкинилокси, алкилсульфонилокси, алкенилсульфонилокси и алкинилсульфонилокси, где такие заместители являются незамещенными.
[00240] В некоторых вариантах осуществления, каждый RH независимо выбран из группы, состоящей из алкилокси и алкилсульфонилокси, где:
каждый такой заместитель необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из карбокси, гидрокси, гало, амино, нитро, оксо, аминосульфонила, алкилоксикарбонила, алкилкарбонилокси, алкилокси, карбоциклила, гетероциклила, циано и аминокарбонила, где:
амино, аминосульфонил и аминокарбонил необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из алкила и алкилсульфонила.
[00241] В некоторых вариантах осуществления, каждый RH независимо выбран из группы, состоящей из алкилокси и алкилсульфонилокси, где:
каждый такой заместитель необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из карбокси, гидрокси, гало, амино, нитро, оксо, аминосульфонила, алкилоксикарбонила, алкилкарбонилокси, алкилокси, циано и аминокарбонила, где:
амино, аминосульфонил и аминокарбонил необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из алкила и алкилсульфонила.
[00242] В некоторых вариантах осуществления, каждый RH независимо выбран из группы, состоящей из алкилокси и алкилсульфонилокси, где:
каждый такой заместитель необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из карбокси, гидрокси, гало, амино, нитро, оксо, аминосульфонила, алкилоксикарбонила, алкилкарбонилокси, алкилокси, циано и аминокарбонила.
[00243] В некоторых вариантах осуществления, каждый RH представляет собой независимо выбранный алкилокси.
[00244] В некоторых вариантах осуществления, каждый RH представляет собой независимо выбранный алкилсульфонилокси.
В13. Заместитель RI.
[00245] Каждый RI независимо выбран из группы, состоящей из алкилкарбонила, алкенилкарбонила, алкинилкарбонила, аминокарбонила, алкилоксикарбонила, карбоциклилкарбонила и гетероциклилкарбонила, где:
(a) алкилкарбонил, алкенилкарбонил и алкинилкарбонил необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из карбокси, гидрокси, гало, амино, нитро, азидо, оксо, аминосульфонила, алкилоксикарбонила, алкенилоксикарбонила, алкинилоксикарбонила, алкилкарбонилокси, алкенилкарбонилокси, алкинилкарбонилокси, алкилокси, алкенилокси, алкинилокси, карбоциклила, гетероциклила, циано и аминокарбонила, и
(b) аминокарбонил необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила, алкенила, алкинила, алкилоксиалкила, карбоциклила, гетероциклила, алкилсульфонила и алкилсульфониламино, где:
карбоциклил и гетероциклил необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из гало, алкила и оксо.
[00246] В некоторых вариантах осуществления, каждый RI независимо выбран из группы, состоящей из алкилкарбонила, алкенилкарбонила, алкинилкарбонила, аминокарбонила, алкилоксикарбонила, карбоциклилкарбонила и гетероциклилкарбонила, где такие заместители являются незамещенными.
[00247] В некоторых вариантах осуществления, каждый RI независимо выбран из группы, состоящей из алкилкарбонила, аминокарбонила, алкилоксикарбонила, карбоциклилкарбонила и гетероциклилкарбонила, где:
(a) алкилкарбонил необязательно замещен заместителем, выбранным из группы, состоящей из карбокси, гидрокси, гало, амино, нитро, оксо, аминосульфонила, алкилоксикарбонила, алкилкарбонилокси, алкилокси и аминокарбонила, и
(b) аминокарбонил необязательно замещен заместителем, выбранным из группы, состоящей из алкила, алкилоксиалкила, алкилсульфонила и алкилсульфониламино.
[00248] В некоторых вариантах осуществления, каждый RI независимо выбран из группы, состоящей из алкилкарбонила и аминокарбонила, где:
аминокарбонил необязательно замещен заместителем, выбранным из группы, состоящей из алкила, алкилоксиалкила, алкилсульфонила и алкилсульфониламино.
[00249] В некоторых вариантах осуществления, каждый RI независимо выбран из группы, состоящей из алкилкарбонила, алкенилкарбонила, алкинилкарбонила и аминокарбонила, где:
(a) алкилкарбонил, алкенилкарбонил и алкинилкарбонил необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из карбокси, гидрокси, гало, амино, нитро, азидо, оксо, аминосульфонила, алкилоксикарбонила, алкенилоксикарбонила, алкинилоксикарбонила, алкилкарбонилокси, алкенилкарбонилокси, алкинилкарбонилокси, алкилокси, алкенилокси, алкинилокси, карбоциклила, гетероциклила, циано и аминокарбонила, и
(b) аминокарбонил необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила, алкенила, алкинила и алкилсульфониламино.
[00250] В некоторых из приведенных выше вариантов осуществления, каждый RI независимо выбран из группы, состоящей из алкилкарбонила, алкенилкарбонила, алкинилкарбонила и аминокарбонила, где такие заместители являются незамещенными.
[00251] В некоторых вариантах осуществления, каждый RI независимо выбран из группы, состоящей из алкилкарбонила и аминокарбонила, где:
(a) алкилкарбонил необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из карбокси, гидрокси, гало, амино, нитро, азидо, оксо, аминосульфонила, алкилоксикарбонила, алкилкарбонилокси, алкилокси, карбоциклила, гетероциклила, циано и аминокарбонила, и
(b) аминокарбонил необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила и алкилсульфониламино.
[00252] В некоторых вариантах осуществления, каждый RI независимо выбран из группы, состоящей из алкилкарбонила и аминокарбонила, где:
(а) алкилкарбонил необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из карбокси, гидрокси, гало, амино, нитро, оксо, аминосульфонила, алкилоксикарбонила, алкилкарбонилокси, алкилокси, циано и аминокарбонила, и
(b) аминокарбонил необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила и алкилсульфониламино.
[00253] В некоторых вариантах осуществления, каждый RI независимо выбран из группы, состоящей из алкилкарбонила и аминокарбонила, где:
алкилкарбонил необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из карбокси, гидрокси, гало, амино, нитро, азидо, оксо, аминосульфонила, алкилоксикарбонила, алкилкарбонилокси, алкилокси, карбоциклила, гетероциклила, циано и аминокарбонила.
[00254] В некоторых вариантах осуществления, каждый RI представляет собой независимо выбранный алкилкарбонил.
[00255] В некоторых вариантах осуществления, каждый RI представляет собой независимо выбранный аминокарбонил.
В14. Заместитель RJ.
[00256] Каждый RJ независимо выбран из группы, состоящей из карбоциклилсульфониламино, гетероциклилсульфониламино, алкилкарбониламино, алкенилкарбониламино, алкинилкарбониламино, алкилоксикарбониламино, алкенилоксикарбониламино, алкинилоксикарбониламино, алкилсульфониламино, алкенилсульфониламино, алкинилсульфониламино, аминокарбониламино, алкилоксикарбониламиноимино, алкилсульфониламиноимино, алкенилсульфониламиноимино и алкинилсульфониламиноимино, где:
(a) амино часть таких заместителей необязательно замещена заместителем, независимо выбранным из группы, состоящей из карбоциклилалкила, гетероциклилалкила, алкилкарбонилокси, аминокарбонилалкила, алкила, алкенила, алкинила, алкилкарбонила, алкенилкарбонила, алкинилкарбонила, алкилоксикарбонила, алкилокеиалкилоксикарбонила, алкилкарбонилоксиалкила и алкилсульфонила, где:
(1) карбоциклильная часть карбоциклилалкила и гетероциклильная часть гетероциклилалкила необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из алкила, алкенила, алкинила, карбокси, гидрокси, алкилокси, алкенилокси, алкинилокси, гало, нитро, циано, азидо, оксо и амино, и
(2) амино часть аминокарбонилалкила необязательно замещена одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила, алкенила и алкинила,
(b) алкильная, алкенильная и алкинильная часть таких заместителей необязательно замещена одним или более заместителями, независимо выбранными из группы, состоящей из карбокси, гало, оксо, амино, алкилоксикарбонила, алкилкарбонилокси, гидрокси, алкилокси, карбоциклила, гетероциклила и циано, где:
амино необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила, алкенила, алкинила, алкилокси, алкенилокси и алкинилокси, где:
алкил необязательно замещен одним или более гидрокси;
(с) карбоциклильная и гетероциклильная части таких заместителей необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из алкила, алкенила, алкинила, карбокси, гидрокси, алкилокси, алкенилокси, алкинилокси, гало, нитро, циано, азидо и амино, где:
амино необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила, алкенила и алкинила.
[00257] В некоторых вариантах осуществления, каждый RJ независимо выбран из группы, состоящей из карбоциклилсульфониламино, гетероциклилсульфониламино, алкилкарбониламино, алкенилкарбониламино, алкинилкарбониламино, алкилоксикарбониламино, алкенилоксикарбониламино, алкинилоксикарбониламино, алкилсульфониламино, алкенилсульфониламино, алкинилсульфониламино, аминокарбониламино, алкилсульфониламиноимино, алкенилсульфониламиноимино и алкинилсульфониламиноимино, где:
(a) амино часть таких заместителей необязательно замещена заместителем, независимо выбранным из группы, состоящей из карбоциклилалкила, гетероциклилалкила, алкилкарбонилокси, аминокарбонилалкила, алкила, алкенила, алкинила, алкилкарбонила, алкенилкарбонила, алкинилкарбонила, алкилоксикарбонила, алкилоксиалкилоксикарбонила, алкилкарбонилоксиалкила и алкилсульфонила, где:
(1) карбоциклильная часть карбоциклилалкила и гетероциклильная часть гетероциклилалкила необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из алкила, алкенила, алкинила, карбокси, гидрокси, алкилокси, алкенилокси, алкинилокси, гало, нитро, циано, азидо, оксо и амино, и
(2) амино часть аминокарбонилалкила необязательно замещена одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила, алкенила и алкинила,
(b) алкильная, алкенильная и алкинильная часть таких заместителей необязательно замещена одним или более заместителями, независимо выбранными из группы, состоящей из карбокси, гало, оксо, амино, алкилоксикарбонила, алкилкарбонилокси, гидрокси, алкилокси, карбоциклила, гетероциклила и циано, где:
амино необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила, алкенила, алкинила, алкилокси, алкенилокси и алкинилокси, где:
алкил необязательно замещен одним или более гидрокси;
(c) карбоциклильная и гетероциклильная части таких заместителей необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из алкила, алкенила, алкинила, карбокси, гидрокси, алкилокси, алкенилокси, алкинилокси, гало, нитро, циано, азидо и амино, где:
амино необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила, алкенила и алкинила; и
[00258] В некоторых из приведенных выше вариантов осуществления, каждый RJ независимо выбран из группы, состоящей из карбоциклилсульфониламино, гетероциклилсульфониламино, алкилкарбониламино, алкенилкарбониламино, алкинилкарбониламино, алкилоксикарбониламино, алкенилоксикарбониламино, алкинилоксикарбониламино, алкилсульфониламино, алкенилсульфониламино, алкинилсульфониламино, аминокарбониламино, алкилсульфониламиноимино, алкенилсульфониламиноимино и алкинилсульфониламиноимино, где такие заместители являются незамещенными.
[00259] В некоторых вариантах осуществления, каждый RJ независимо выбран из группы, состоящей из карбоциклилсульфониламино, гетероциклилсульфониламино, алкилкарбониламино, алкилоксикарбониламино, алкилсульфониламино, аминокарбониламино и алкилсульфониламиноимино, где:
(a) амино часть таких заместителей необязательно замещена заместителем, независимо выбранным из группы, состоящей из карбоциклилалкила, гетероциклилалкила, алкилкарбонилокси, аминокарбонилалкила, алкила, алкилкарбонила, алкилоксикарбонила, алкилоксиалкилоксикарбонила, алкилкарбонилоксиалкила и алкилсульфонила, где:
(1) карбоциклильная часть карбоциклилалкила и гетероциклильная часть гетероциклилалкила необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из алкила, карбокси, гидрокси, алкилокси, гало, нитро, циано, оксо и амино, и
(2) амино часть аминокарбонилалкила необязательно замещена одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила, алкенила и алкинила,
(b) алкильная часть таких заместителей необязательно замещена одним или двумя заместителями, независимо выбранными из группы, состоящей из карбокси, гало, оксо, амино, алкилоксикарбонила, алкилкарбонилокси, гидрокси, алкилокси, карбоциклила, гетероциклила и циано, где:
амино необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила и алкилокси, где:
алкил необязательно замещен одним или более гидрокси;
(c) карбоциклильная и гетероциклильная части таких заместитеей необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из алкила, карбокси, гидрокси, алкилокси, гало, нитро, циано и амино, где:
амино необязательно замещен одним или двумя независимо выбранным алкильными заместителями.
[00260] В некоторых вариантах осуществления, каждый RJ независимо выбран из группы, состоящей из карбоциклилсульфониламино, гетероциклилсульфониламино, алкилсульфониламино и алкилсульфониламиноимино, где:
(а) амино часть таких заместителей необязательно замещена заместителем, независимо выбранным из группы, состоящей из карбоциклилалкила, гетероциклилалкила, алкилкарбонилокси, аминокарбонилалкила, алкила, алкилкарбонила, алкилоксикарбонила, алкилоксиалкилоксикарбонила, алкилкарбонилоксиалкила и алкилсульфонила, где:
(1) карбоциклильная часть карбоциклилалкила и гетероциклильная часть гетероциклилалкила необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из алкила, карбокси, гидрокси, алкилокси, гало, нитро, циано, оксо и амино, и
(2) амино часть аминокарбонилалкила необязательно замещена одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила, алкенила и алкинила,
(b) алкильная часть таких заместителей необязательно замещена одним или двумя заместителями, независимо выбранными из группы, состоящей из карбокси, гало, оксо, амино, алкилоксикарбонила, алкилкарбонилокси, гидрокси, алкилокси, карбоциклила, гетероциклила и циано, где:
амино необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила и алкилокси, где:
алкил необязательно замещен одним или более гидрокси;
(c) карбоциклильная и гетероциклильная части таких заместителей необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из алкила, карбокси, гидрокси, алкилокси, гало, нитро, циано и амино, где:
амино необязательно замещен одним или двумя независимо выбранными алкильными заместителями.
[00261] В некоторых вариантах осуществления, каждый RJ независимо выбран из группы, состоящей из карбоциклилсульфониламино, гетероциклилсульфониламино, алкилсульфониламино и алкилсульфониламиноимино, где:
амино часть таких заместителей необязательно замещена заместителем, независимо выбранным из группы, состоящей из карбоциклилалкила, гетероциклилалкила, алкилкарбонилокси, аминокарбонилалкила, алкила, алкилкарбонила, алкилоксикарбонила, алкилоксиалкилоксикарбонила, алкилкарбонилоксиалкила и алкилсульфонила, где:
(1) карбоциклильная часть карбоциклилалкила и гетероциклильная часть гетероциклилалкила необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из алкила, карбокси, гидрокси, алкилокси, гало, нитро, циано, оксо и амино, и
(2) амино часть аминокарбонилалкила необязательно замещена одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила, алкенила и алкинила.
[00262] В некоторых вариантах осуществления, каждый RJ независимо выбран из группы, состоящей из карбоциклилсульфониламино, гетероциклилсульфониламино, алкилсульфониламино и алкилсульфониламиноимино, где:
алкильная часть алкилсульфониламино и алкилсульфониламиноимино необязательно замещена одним или двумя заместителями, независимо выбранными из группы, состоящей из карбокси, гало, оксо, амино, алкилоксикарбонила, алкилкарбонилокси, гидрокси, алкилокси, карбоциклила, гетероциклила и циано, где:
амино необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила и алкилокси, где:
алкил необязательно замещен одним или более гидрокси.
[00263] В некоторых вариантах осуществления, каждый RJ независимо выбран из группы, состоящей из карбоциклилсульфониламино, гетероциклилсульфониламино, алкилсульфониламино и алкилсульфониламиноимино, где:
карбоциклильная и гетероциклильная части таких заместителей необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из алкила, карбокси, гидрокси, алкилокси, гало, нитро, циано и амино.
[00264] В некоторых вариантах осуществления, каждый RJ независимо выбран из группы, состоящей из карбоциклилсульфониламино и гетероциклилсульфониламино, где:
карбоциклильная и гетероциклильная части таких заместителей необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из алкила, карбокси, гидрокси, алкилокси, гало, нитро, циано и амино.
[00265] В некоторых вариантах осуществления, каждый RJ независимо выбран из группы, состоящей из алкилсульфониламино, алкенилсульфониламино, алкинилсульфониламино и алкилсульфониламиноимино, где:
(a) амино часть таких заместителей необязательно замещена заместителем, независимо выбранным из группы, состоящей из карбоциклилалкила, гетероциклилалкила, алкилкарбонилокси, аминокарбонилалкила, алкила, алкилкарбонила, алкилоксикарбонила, алкилоксиалкилоксикарбонила, алкилкарбонилоксиалкила и алкилсульфонила, где:
(1) карбоциклильная часть карбоциклилалкила и гетероциклильная часть гетероциклилалкила необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из алкила, карбокси, гидрокси, алкилокси, гало, нитро, циано, оксо и амино, и
(2) амино часть аминокарбонилалкила необязательно замещена одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила, алкенила и алкинила,
(b) алкильная, алкенильная и алкинильная часть таких заместителей необязательно замещена одним или двумя заместителями, независимо выбранными из группы, состоящей из карбокси, гало, оксо, амино, алкилоксикарбонила, алкилкарбонилокси, гидрокси, алкилокси, карбоциклила, гетероциклила и циано, где:
амино необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила и алкилокси, где:
алкил необязательно замещен одним или более гидрокси.
[00266] В некоторых вариантах осуществления, каждый RJ представляет собой независимо выбранный алкилсульфониламино, где:
(a) амино часть алкилсульфониламино необязательно замещена заместителем, независимо выбранным из группы, состоящей из карбоциклилалкила, гетероциклилалкила, алкилкарбонилокси, аминокарбонилалкила, алкила, алкилкарбонила, алкилоксикарбонила, алкилоксиалкилоксикарбонила, алкилкарбонилоксиалкила и алкилсульфонила, где:
(1) карбоциклильная часть карбоциклилалкила и гетероциклильная часть гетероциклилалкила необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из алкила, карбокси, гидрокси, алкилокси, гало, нитро, циано, оксо и амино, и
(2) амино часть аминокарбонилалкила необязательно замещена одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила, алкенила и алкинила,
(b) алкильная часть алкилсульфониламино необязательно замещена одним или двумя заместителями, независимо выбранными из группы, состоящей из карбокси, гало, оксо, амино, алкилоксикарбонила, алкилкарбонилокси, гидрокси, алкилокси, карбоциклила, гетероциклила и циано, где:
амино необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила и алкилокси, где:
алкил необязательно замещен одним или более гидрокси.
[00267] В некоторых вариантах осуществления, каждый RJ представляет собой независимо выбранный алкилсульфониламино, где:
амино часть алкилсульфониламино необязательно замещена заместителем, независимо выбранным из группы, состоящей из карбоциклилалкила, гетероциклилалкила, алкилкарбонилокси, аминокарбонилалкила, алкила, алкилкарбонила, алкилоксикарбонила, алкилоксиалкилоксикарбонила, алкилкарбонилоксиалкила и алкилсульфонила, где:
(1) карбоциклильная часть карбоциклилалкила и гетероциклильная часть гетероциклилалкила необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из алкила, карбокси, гидрокси, алкилокси, гало, нитро, циано, оксо и амино, и
(2) амино часть аминокарбонилалкила необязательно замещена одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила, алкенила и алкинила.
[00268] В некоторых вариантах осуществления, каждый RJ представляет собой независимо выбранный алкилсульфониламино, где:
амино часть алкилсульфониламино необязательно замещена заместителем, независимо выбранным из группы, состоящей из карбоциклилалкила, гетероциклилалкила, алкилкарбонилокси, аминокарбонилалкила, алкила, алкилкарбонила, алкилоксикарбонила, алкилоксиалкилоксикарбонила, алкилкарбонилоксиалкила и алкилсульфонила.
[00269] В некоторых вариантах осуществления, каждый RJ представляет собой независимо выбранный алкилсульфониламино, где:
алкильная часть алкилсульфониламино необязательно замещена одним или двумя заместителями, независимо выбранными из группы, состоящей из карбокси, гало, оксо, амино, алкилоксикарбонила, алкилкарбонилокси, гидрокси, алкилокси, карбоциклила, гетероциклила и циано, где:
амино необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила и алкилокси, где:
алкил необязательно замещен одним или более гидрокси.
[00270] В некоторых вариантах осуществления, каждый RJ представляет собой независимо выбранный алкилсульфониламино, где:
алкильная часть алкилсульфониламино необязательно замещена одним или двумя заместителями, независимо выбранными из группы, состоящей из карбокси, гало, оксо, амино, алкилоксикарбонила, алкилкарбонилокси, гидрокси, алкилокси, карбоциклила, гетероциклила и циано.
[00271] В некоторых вариантах осуществления, каждый RJ представляет собой независимо выбранный алкилсульфониламино. В некоторых таких вариантах осуществления, каждый RJпредставляет собой метилсульфониламино.
[00272] В некоторых вариантах осуществления, каждый RJ представляет собой независимо выбранный алкилсульфониламиноимино, где:
(a) амино часть алкилсульфониламиноимино необязательно замещена заместителем, независимо выбранным из группы, состоящей из карбоциклилалкила, гетероциклилалкила, алкилкарбонилокси, аминокарбонилалкила, алкила, алкилкарбонила, алкилоксикарбонила, алкилоксиалкилоксикарбонила, алкилкарбонилоксиалкила и алкилсульфонила, где:
(1) карбоциклильная часть карбоциклилалкила и гетероциклильная часть гетероциклилалкила необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из алкила, карбокси, гидрокси, алкилокси, гало, нитро, циано, оксо и амино, и
(2) амино часть аминокарбонилалкила необязательно замещена одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила, алкенила и алкинила,
(b) алкильная часть алкилсульфониламиноимино необязательно замещена одним или двумя заместителями, независимо выбранными из группы, состоящей из карбокси, гало, оксо, амино, алкилоксикарбонила, алкилкарбонилокси, гидрокси, алкилокси, карбоциклила, гетероциклила и циано, где:
амино необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила и алкилокси, где:
алкил необязательно замещен одним или более гидрокси.
[00273] В некоторых вариантах осуществления, каждый RJ представляет собой независимо выбранный алкилсульфониламиноимино, где:
амино часть алкилсульфониламиноимино необязательно замещена заместителем, независимо выбранным из группы, состоящей из карбоциклилалкила, гетероциклилалкила, алкилкарбонилокси, аминокарбонилалкила, алкила, алкилкарбонила, алкилоксикарбонила, алкилоксиалкилоксикарбонила, алкилкарбонилоксиалкила и алкилсульфонила, где:
(1) карбоциклильная часть карбоциклилалкила и гетероциклильная часть гетероциклилалкила необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из алкила, карбокси, гидрокси, алкилокси, гало, нитро, циано, оксо и амино, и
(2) амино часть аминокарбонилалкила необязательно замещена одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила, алкенила и алкинила.
[00274] В некоторых вариантах осуществления, каждый RJ представляет собой независимо выбранный алкилсульфониламиноимино, где:
амино часть алкилсульфониламиноимино необязательно замещена заместителем, независимо выбранным из группы, состоящей из карбоциклилалкила, гетероциклилалкила, алкилкарбонилокси, аминокарбонилалкила, алкила, алкилкарбонила, алкилоксикарбонила, алкилоксиалкилоксикарбонила, алкилкарбонилоксиалкила и алкилсульфонила.
[00275] В некоторых вариантах осуществления, каждый RJ представляет собой независимо выбранный алкилсульфониламиноимино, где:
алкильная часть алкилсульфониламиноимино необязательно замещена одним или двумя заместителями, независимо выбранными из группы, состоящей из карбокси, гало, оксо, амино, алкилоксикарбонила, алкилкарбонилокси, гидрокси, алкилокси, карбоциклила, гетероциклила и циано, где:
амино необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила и алкилокси, где:
алкил необязательно замещен одним или более гидрокси.
[00276] В некоторых вариантах осуществления, каждый RJ представляет собой независимо выбранный алкилсульфониламиноимино, где:
алкильная часть алкилсульфониламиноимино необязательно замещена одним или двумя заместителями, независимо выбранными из группы, состоящей из карбокси, гало, оксо, амино, алкилоксикарбонила, алкилкарбонилокси, гидрокси, алкилокси, карбоциклила, гетероциклила и циано.
[00277] В некоторых вариантах осуществления, каждый RJ представляет собой независимо выбранный алкилсульфониламиноимино. В некоторых таких вариантах осуществления, каждый RJпредставляет собой метилсульфониламиноимино.
[00278] В некоторых вариантах осуществления, каждый RJ независимо выбран из группы, состоящей из алкилкарбониламино и алкилоксикарбониламино, где:
алкильная часть таких заместителей необязательно замещена одним или двумя заместителями, независимо выбранными из группы, состоящей из карбокси, гало, оксо, амино, алкилоксикарбонила, алкилкарбонилокси, гидрокси, алкилокси, карбоциклила, гетероциклила и циано.
В15. Заместитель RK.
[00279] Каждый RK независимо выбран из группы, состоящей из аминосульфонила, алкилсульфонила, алкенилсульфонила и алкинилсульфонила, где:
(a) алкилсульфонил, алкенилсульфонил и алкинилсульфонил необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из карбокси, гидрокси, гало, амино, нитро, азидо, оксо, аминосульфонила, алкилоксикарбонила, алкенилоксикарбонила, алкинилоксикарбонила, алкилкарбонилокси, алкенилкарбонилокси, алкинилкарбонилокси, алкилокси, алкенилокси, алкинилокси, карбоциклила, гетероциклила, циано и аминокарбонила, где:
амино, аминосульфонил и аминокарбонил необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из алкила, алкенила и алкинила; и
(b) аминосульфонил необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила, алкенила и алкинила.
[00280] В некоторых из приведенных выше вариантов осуществления, каждый RK независимо выбран из группы, состоящей из аминосульфонила, алкилсульфонила, алкенилсульфонила и алкинилсульфонила, где такие заместители являются незамещенными.
[00281] В некоторых вариантах осуществления, каждый RK независимо выбран из группы, состоящей из аминосульфонила и алкилсульфонила, где:
(a) алкилсульфонил необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из карбокси, гидрокси, гало, амино, нитро, оксо, аминосульфонила, алкилоксикарбонила, алкилкарбонилокси, алкилокси, карбоциклила, гетероциклила, циано и аминокарбонила; и
(b) аминосульфонил необязательно замещен одним или двумя независимо выбранными алкильнымизаместителями.
[00282] В некоторых вариантах осуществления, каждый RK независимо выбран из группы, состоящей из аминосульфонила и алкилсульфонила.
С. Варианты модификации соединений формулы I.
[00283] Различные варианты модификации заместителей R1, R2, R3, R4, R5, L, RA, RB, RC, RD, R6, RE, RF, RG, RH, RI, RJ и RK были рассмотрены выше. Эти варианты модификации заместителей могут быть объединены с получением различных вариантов воплощения соединений формулы I. Все варианты воплощения соединений формулы I, образованные путем объединения вариантов модификации заместителей, рассмотренных выше, входят в объем изобретения Заявителей, и некоторые иллюстративные варианты воплощения соединений формулы I представлены ниже.
[00284] В некоторых вариантах осуществления, в соединениях формулы I:

R1 выбран из группы, состоящей из водорода и метила;
R2 выбран из группы, состоящей из водорода и галогена;
R3 выбран из группы, состоящей из водорода и галогена;
R4 выбран из группы, состоящей из C1-C4-алкила, С3-С6-карбоциклила и 5-6-членного гетероциклила,где:
(a) C1-C4-алкил необязательно замещен заместителями, вплоть до трех, независимо выбранными из группы, состоящей из гало, оксо, гидрокси, алкилокси и триметилсилила, и
(b) С3-С6-карбоциклил и 5-6-членный гетероциклил необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из алкила, гало и алкилсульфониламино;
R5 выбран из группы, состоящей из водорода, гидрокси, алкилокси и гало;
L выбран из группы, состоящей из C(RA)=C(RB), этилена и циклопропил-1,2-ена;
один из RA и RB представляет собой водород, а другой выбран из группы, состоящей из водорода, метила, метокси и гало;
R6 выбран из группы, состоящей из С5-С6-карбоциклила и 5-6-членного гетероциклила, где каждый такой заместитель замещен одним, двумя или тремя заместителями, независимо выбранными из группы, состоящей из RE, RF и RJ;
каждый RE независимо выбран из группы, состоящей из хлора, фтора, нитро, гидрокси, оксо, карбокси, амино, имино, альдегидо и алкиламино;
каждый RF представляет собой независимо выбранный алкил, необязательно замещенный заместителем, выбранным из группы, состоящей из карбокси, гало, амино, имино и аминосульфонила, где:
амино, имино и аминосульфонил необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из алкила, алкилсульфонила и алкилсульфониламино;
каждый RI независимо выбран из группы, состоящей из алкилкарбонила и аминокарбонила, где:
аминокарбонил необязательно замещен заместителем, выбранным из группы, состоящей из алкила, алкилоксиалкила, алкилсульфонила и алкилсульфониламино; и
каждый RJ независимо выбран из группы, состоящей из алкилсульфониламино, алкенилсульфониламино, алкинилсульфониламино и алкилсульфониламиноимино, где:
(а) амино часть таких заместителей необязательно замещена заместителем, независимо выбранным из группы, состоящей из карбоциклилалкила, гетероциклилалкила, алкилкарбонилокси, аминокарбонилалкила, алкила, алкилкарбонила, алкилоксикарбонила, алкилоксиалкилоксикарбонила, алкилкарбонилоксиалкила и алкилсульфонила, где:
(1) карбоциклильная часть карбоциклилалкила и гетероциклильная часть гетероциклилалкила необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из алкила, карбокси, гидрокси, алкилокси, гало, нитро, циано, оксо и амино, и
(2) амино часть аминокарбонилалкила необязательно замещена одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила, алкенила и алкинила,
(b) алкильная, алкенильная и алкинильная часть таких заместителей необязательно замещена одним или двумя заместителями, независимо выбранными из группы, состоящей из карбокси, гало, оксо, амино, алкилоксикарбонила, алкилкарбонилокси, гидрокси, алкилокси, карбоциклила, гетероциклила и циано, где:
амино необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из алкила и алкилокси, где алкил необязательно замещен одним или более гидрокси.
[00285] Примеры соединений формулы I (и их солей) приведены в Таблицах 1-7, представленных ниже. Примеры синтеза, приведенные ниже предоставляют пошаговые инструкции по получению некоторых из этих соединений. Остальные соединения получали, используя общее рассмотрение способа получения, конкретные примеры синтеза, приведенные ниже, и/или обсуждение по всему тексту этой заявки.
ТАБЛИЦА 7

D. Изомеры.
[00286] Настоящее изобретение частично относится ко всем изомерам соединений формулы I (и их солям) (т.е., структурным и стереоизомерам). Структурные изомеры включают цепь и положение изомеров. Стереоизомеры включают E/Z изомеры (т.е., изомеры относительно одной или более двойных связей), энантиомеры (т.е., стереоизомеры, которые имеют противоположные конфигурации при всех етереогенных центрах), и диастереоизомеры (т.е., стереоизомеры, которые имеют одинаковую конфигурацию при одном или более етереогенных цетрах, но отличную при других етереогенных центрах).
Е. Соли.
[00287] Настоящее изобретение также относится, частично, ко всем солям соединений формулы I. Соль соединения может быть предпочтительной благодаря одному или более свойствам соли, например, таким как повышенная фармацевтическая стабильность при различных температурах и влажности, или желаемая растворимость в воде или других растворителях. В тех случаях, когда соль предназначена для введения пациенту (в отличие, например, от применения в контексте in vitro), соль предпочтительно является фармацевтически приемлемой и/или физиологически совместимой. Термин «фармацевтически приемлемая» используется в качестве прилагательного в этой патентной заявке для обозначения того, что определяемое существительное подходит для применения в качестве фармацевтического продукта или в качестве части фармацевтического продукта. Фармацевтически приемлемые соли включают соли, обычно используемые для образования солей щелочных металлов и для образования аддитивных солей свободных кислот или свободных оснований. В основном, эти соли обычно могут быть получены общепринятыми способами, посредством взаимодействия, например, соответствующей кислоты или основания с соединением по изобретению.
[00288] Фармацевтически приемлемые кислотно-аддитивные соли соединений формулы I могут быть получены из неорганической или органической кислоты. Примеры во многих случаях подходящих неорганических кислот включают соляную, бромистоводородную, йодистоводородную, азотную, угольную, серную и фосфорную кислоту. Подходящие органические кислоты в основном включают, например, алифатические, циклоалифатические, ароматические, аралифатические, гетероциклические, карбоновые и сульфоновые классы органических кислот. Конкретные примеры во многих случаях подходящих солей органических кислот включают ацетат, трифторацетат, формиат, пропионат, сукцинат, гликолят, глюконат, диглюконат, лактат, малат, винную кислоту, цитрат, аскорбат, глюкуронат, малеат, фумарат, пируват, аспартат, глютамат, бензоат, аминобензойную кислоту, мезилат, стеарат, салицилат, р-гидроксибензоат, фенилацетат, соль миндальной кислоты, эмбонат (памоат), этансульфонат, бензолсульфонат, пантотенат, 2-гидроксиэтансульфонат, сульфанилат, циклогексиламиносульфонат, альгиновую кислоту, бета-гидроксимасляную кислоту, галактарат, галактуронат, адипат, альгинат, бисульфат, бутират, камфорат, камфорсульфонат, циклопентанпропионат, додецилсульфат, гликогептаноат, глицерофосфат, гептаноат, гексаноат, никотинат, оксалат, пальмоат, пектинат, 2-нафталсульфонат, 3-фенилпропионат, пикрат, пивалат, тиоцианат, тозилат и ундеканоат.
[00289] Фармацевтически приемлемые основные аддитивные соли соединений формулы I включают, например, соли металлов и органические соли. Предпочтительные соли металлов включают соли щелочных металлов (группа Ia), соли щелочноземельных металлов (группа IIa) и другие физиологически приемлемые соли металлов. Такие соли могут быть получены с алюминием, кальцием, литием, магнием, калием, натрием и цинком. Предпочтительные органические соли могут быть получены с аминами, такими как трометамин, диэтиламин, N,N'-дибензилэтилендиамин, хлоропрокаин, холин, диэтаноламин, этилендиамин, меглумин (N-метилглюкамин), и прокаин. Основные азот-содержащие группы могут быть кватернизированы такими агентами, как низшие алкил (C1-С6) галиды {например, метил, этил, пропил и бутил хлориды, бромиды и йодиды), диалкилсульфаты (например, диметил, диэтил, дибутил и диамилсульфаты), галиды с длинной цепью (например, децил, лаурил, мириетил и стеарил хлориды, бромиды и йодиды), арилалкил галиды (например, бензил и фенэтил бромиды), и другие.
[00290] В некоторых вариантах осуществления, соль представляет собой натриевую соль (E)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидро-пиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида.
[00291] В некоторых вариантах осуществления, соль представляет собой динатриевую соль (E)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида.
[00292] В некоторых вариантах осуществления, соль представляет собой калиевую соль (E)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида.
[00293] В некоторых вариантах осуществления, соль представляет собой монокалиевую соль (E)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида.
F. Чистота.
[00294] Соединения формулы I (и их соли) любого уровня чистоты (в том числе чистые и по существу чистые) входят в объем настоящего изобретения. Термин «по существу чистый» в отношении соединения/соли/изомера, означает, что препарат/композиция, содержащая соединение/соль/изомер содержит примерно более 85% по массе соединения/соли/изомера, предпочтительно примерно более 90% по массе соединения/соли/изомера, предпочтительно примерно более 95% по массе соединения/соли/изомера, предпочтительно примерно более 97% по массе соединения/соли/изомера, и предпочтительно примерно более 99% по массе соединения/соли/изомера.
G. Кристаллические формы некоторых конкретных соединений и солей по настоящему изобретению.
G1. Кристаллические формы (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансулъфонамида, динатриевая соль.
[00295] Настоящее изобретение также относится, частично, к кристаллическим формам динатриевой соли (E)-N-(4-(3 -трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, а именно девятиводным и четырехводным кристаллическим формам, рассмотренным ниже.
[00296] Настоящее изобретение относится, частично, к девятиводной кристаллической динатриевой соли. Кристаллографические параметры элементарной ячейки девятиводной кристаллической динатриевой соли были определены как следующие: а равно 8,9Å, b равно 9,4Å и с равно 20,7Å (более точно, а равно 8,926(2)Å, b равно 9,415(2)Å, и с равно 20,674(5)Å); углы ячейки составляют: α - 94,8°, β - 93,3°, и γ - 107,0° (более точно, α равен 94,796(4)°, β равен 93,345(4)0, и γ равен 107,013(4)°); и объем ячейки составляет 1649Å3 (более точно, 1649,3(7)Å3). Эта соль кристаллизуется в пространственной группе Р-1.
[00297] В некоторых вариантах осуществления, девятиводная динатриевая соль имеет порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 4,3±0,2, 10,4±0,2, 10,9±0,2, 11,6±0,2, 12,9±0,2, 14,7±0,2, 16,4±0,2, 17,8±0,2, 19,4±0,2, 19,8±0,2, 20,8±0,2, 21,9±0,2 и 23,5±0,2 градусов 2θ. В некоторых таких вариантах осуществления, девятиводная динатриевая соль имеет порошковую рентгенограмму, содержащую три или более пиков, выбранных из группы, состоящей из 4,3±0,2, 10,4±0,2, 10,9±0,2, 11,6±0,2, 12,9±0,2, 14,7±0,2, 16,4±0,2, 17,8±0,2, 19,4±0,2, 19,8±0,2, 20,8±0,2, 21,9±0,2 и 23,5±0,2 градусов 2θ. В других таких вариантах осуществления, девятиводная динатриевая соль имеет порошковую рентгенограмму, содержащую пять или более пиков, выбранных из группы, состоящей из 4,3±0,2, 10,4±0,2, 10,9±0,2, 11,6±0,2, 12,9±0,2, 14,7±0,2, 16,4±0,2, 17,8±0,2, 19,4±0,2, 19,8±0,2, 20,8±0,2, 21,9±0,2 и 23,5±0,2 градусов 2θ.
[00298] В некоторых вариантах осуществления, девятиводная динатриевая соль имеет порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 4,3±0,2, 10,4±0,2, 10,9±0,2, 11,6±0,2, 12,9±0,2, 14,7±0,2, 14,9±0,2, 16,4±0,2, 17,8±0,2, 19,4±0,2, 19,7±0,2, 19,8±0,2, 20,8±0,2, 20,9±0,2, 21,9±0,2, 22,1±0,2 и 23,5±0,2 градусов 2θ. В некоторых таких вариантах осуществления, девятиводная динатриевая соль имеет порошковую рентгенограмму, содержащую три или более пиков, выбранных из группы, состоящей из 4,3±0,2, 10,4±0,2, 10,9±0,2, 11,6±0,2, 12,9±0,2, 14,7±0,2, 14,9±0,2, 16,4±0,2, 17,8±0,2, 19,4±0,2, 19,7±0,2, 19,8±0,2, 20,8±0,2, 20,9±0,2, 21,9±0,2, 22,1±0,2 и 23,5±0,2 градусов 2θ. В других таких вариантах осуществления, девятиводная динатриевая соль имеет порошковую рентгенограмму, содержащую пять или более пиков, выбранных из группы, состоящей из 4,3±0,2, 10,4±0,2, 10,9±0,2, 11,6±0,2, 12,9±0,2, 14,7±0,2, 14,9±0,2, 16,4±0,2, 17,8±0,2, 19,4±0,2, 19,7±0,2, 19,8±0,2, 20,8±0,2, 20,9±0,2, 21,9±0,2, 22,1±0,2 и 23,5±0,2 градусов 2θ.
[00299] В некоторых вариантах осуществления, девятиводная динатриевая соль имеет порошковую рентгенограмму, по существу, как показано на Фигуре 1. Величины 29 для пиков на Фигуре 1 (и их интенсивности) представляют собой следующее: 4,31 (100), 10,36 (12), 10,91 (23), 11,61 (52), 12,93 (24), 14,73 (65), 14,89 (20), 16,44 (41), 17,80 (38), 19,44 (26), 19,67 (37), 19,83 (59), 20,75 (69), 20,89 (21), 21,92 (43), 22,13 (40) и 22,42 (24).
[00300] Настоящее изобретение также относится, частично, к способу получения девятиводной динатриевой соли. Ее получали в водной среде. Водный NaOH (1M, 1,18 мл) добавляли к (E)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамиду (соединение IB-L1-1.1) (27,82 мг) (молярное соотношение 1:20 кислота:основание). Полученную в результате суспензию уравновешивали в окружающих условиях. Девятиводная динатриевая соль образуется спустя семь дней в процессе, опосредованном растворением. Альтернативно, девятиводную динатриевую соль получали путем суспендирования 278,8 мг соединения IB-L1-1.1 в 1,25 мл THF при нагревании примерно до 50°С. Добавляли водный NaOH (1 н, 1,5 мл, 2,2 молярного эквивалента). Твердое вещество растворялось полностью с образованием прозрачного раствора, который естественным путем охлаждался до окружающих температур. Эта соль кристаллизовалась спонтанно. Молекулярную структуру определяли с помощью монокристальной дифрактометрии.
[00301] Настоящее изобретение относится, частично, к четырехводной кристаллической динатриевой соли.
[00302] В некоторых вариантах осуществления, четырехводная динатриевая соль имеет порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 4,8±0,2, 12,1±0,2, 14,0±0,2, 17,0±0,2, 17,5±0,2, 20,9±0,2, 21,6±0,2, 25,0±0,2 и 29,5±0,2 градусов 2θ. В некоторых таких вариантах осуществления, четырехводная динатриевая соль имеет порошковую рентгенограмму, содержащую три или более пиков, выбранных из группы, состоящей из 4,8±0,2, 12,1±0,2, 14,0±0,2, 17,0±0,2, 17,5±0,2, 20,9±0,2, 21,6±0,2, 25,0±0,2 и 29,5±0,2 градусов 2θ. В других таких вариантах осуществления, четырехводная динатриевая соль имеет порошковую рентгенограмму, содержащую пять или более пиков, выбранных из группы, состоящей из 4,8±0,2, 12,1±0,2, 14,0±0,2, 17,0±0,2, 17,5±0,2, 20,9±0,2, 21,6±0,2, 25,0±0,2 и 29,5±0,2 градусов 2θ.
[00303] В некоторых вариантах осуществления, четырехводная динатриевая соль имеет порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 4,8±0,2, 12,1±0,2, 14,0±0,2, 14,4±0,2, 17,0±0,2, 17,5±0,2, 20,9±0,2, 21,6±0,2, 25,0±0,2, 29,5±0,2 и 34,2±0,2 градусов 2θ. В некоторых таких вариантах осуществления, четырехводная динатриевая соль имеет порошковую рентгенограмму, содержащую три или более пиков, выбранных из группы, состоящей из 4,8±0,2, 12,1±0,2, 14,0±0,2, 14,4±0,2, 17,0±0,2, 17,5±0,2, 20,9±0,2, 21,6±0,2, 25,0±0,2, 29,5±0,2 и 34,2±0,2 градусов 2θ. В других таких вариантах осуществления, четырехводная динатриевая соль имеет порошковую рентгенограмму, содержащую пять или более пиков, выбранных из группы, состоящей из 4,8±0,2, 12,1±0,2, 14,0±0,2, 14,4±0,2, 17,0±0,2, 17,5±0,2, 20,9±0,2, 21,6±0,2, 25,0±0,2, 29,5±0,2 и 34,2±0,2 градусов 2θ.
[00304] В некоторых вариантах осуществления, четырехводная динатриевая соль имеет порошковую рентгенограмму, по существу, как показано на Фигуре 2. Величины 2θ для пиков на Фигуре 2 (и их интенсивности) представляют собой следующее: 4,81 (100), 12,07 (7), 14,01 (27), 14,41 (8), 16,96 (18), 17,53 (11), 20,87 (18), 21,58 (22), 24,99 (11), 29,47 (9) и 34,20 (9).
[00305] Настоящее изобретение также относится, частично, к способу получения четырехводной динатриевой соли путем суспендирования девятиводной динатриевой соли в органическом растворителе (например, этаноле, 1-пропаноле или 2-пропаноле).
G2. Кристаллическая форма дикалиевой соли (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида.
[00306] Настоящее изобретение также относится, частично, к кристаллической четырехводной дикалиевой соли (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида.
[00307] Кристаллографические параметры элементарной ячейки четырехводной дикалиевой соли были определены следующими: а равно 14,5Å, b равно 10,8Å, и с равно 35,8Å (более точно, а равно 14,454(14)Å, b равно 10,763(14)Å, и с равно 35,75(4)Å); угол ячейки составляет: β - 98,8° (более точно, β равно 98,82(3)°); и объем ячейки составляет 5499Å3 (более точно, 5499(11)Å3). Эта соль кристаллизуется в пространственной группе С2/с.
[00308] В некоторых вариантах осуществления, четырехводная дикалиевая соль имеет порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 5,0±0,2, 11,9±0,2, 12,4±0,2, 13,7±0,2, 15,0±0,2, 16,5±0,2, 17,1±0,2, 20,8±0,2, 21,3±0,2, 22,2±0,2, 24,0±0,2, 26,4±0,2 и 29,3±0,2 градусов 2θ. В некоторых таких вариантах осуществления, четырехводная дикалиевая соль имеет порошковую рентгенограмму, содержащую три или более пиков, выбранных из группы, состоящей из 5,0±0,2, 11,9±0,2, 12,4±0,2, 13,7±0,2, 15,0±0,2, 16,5±0,2, 17,1±0,2, 20,8±0,2, 21,3±0,2, 22,2±0,2, 24,0±0,2, 26,4±0,2 и 29,3±0,2 градусов 2θ. В других таких вариантах осуществления, четырехводная дикалиевая соль имеет порошковую рентгенограмму, содержащую пять или более пиков, выбранных из группы, состоящей из 5,0±0,2, 11,9±0,2, 12,4±0,2, 13,7±0,2, 15,0±0,2, 16,5±0,2, 17,1±0,2, 20,8±0,2, 21,3±0,2, 22,2±0,2, 24,0±0,2, 26,4±0,2 и 29,3±0,2 градусов 2θ.
[00309] В некоторых вариантах осуществления, четырехводная дикалиевая соль имеет порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 5,0±0,2, 11,9±0,2, 12,4±0,2, 12,6±0,2, 13,7±0,2, 15,0±0,2, 16,5±0,2, 16,7±0,2, 17,1±0,2, 20,7±0,2, 20,8±0,2, 21,3±0,2, 22,2±0,2, 22,4±0,2, 24,0±0,2, 26,4±0,2 и 29,3±0,2 градусов 2θ. В некоторых таких вариантах осуществления, четырехводная дикалиевая соль имеет порошковую рентгенограмму, содержащую три или более пиков, выбранных из группы, состоящей из 5,9±0,2, 11,9±0,2, 12,4±0,2, 12,6±0,2, 13,7±0,2, 15,0±0,2, 16,5±0,2, 16,7±0,2, 17,1±0,2, 20,7±0,2, 20,8±0,2, 21,3±0,2, 22,2±0,2, 22,4±0,2, 24,0±0,2, 26,4±0,2 и 29,3±0,2 градусов 2θ. В других таких вариантах осуществления, четырехводная дикалиевая соль имеет порошковую рентгенограмму, содержащую пять или более пиков, выбранных из группы, состоящей из 5,0±0,2, 11,9±0,2, 12,4±0,2, 12,6±0,2, 13,7±0,2, 15,0±0,2, 16,5±0,2, 16,7±0,2, 17,1±0,2, 20,7±0,2, 29,8±0,2, 21,3±0,2, 22,2±0,2, 22,4±0,2, 24,9±0,2, 26,4±0,2 и 29,3±0,2 градусов 2θ.
[00310] В некоторых вариантах осуществления, четырехводная дикалиевая соль имеет порошковую рентгенограмму, по существу, как показано на Фигуре 4. Величины 2θ для пиков на Фигуре 4 (и их интенсивности) представляют собой следующее: 5,99 (199), 11,86 (34), 12,39 (32), 12,64 (19), 13,79 (23), 15,93 (21), 16,47 (24), 16,66 (24), 17,12 (28), 29,75 (29), 29,81 (33), 21,34 (22), 22,15 (46), 22,38 (31), 24,92 (24), 26,44 (24) и 29,32 (21).
[00311] Настоящее изобретение также относится, частично, к способу получения четырехводной дикалиевой соли путем суспендирования соединения IB-L1-1.1 (261,13 мг) в 1,25 мл THF при нагревании примерно до 59°С. Добавляли KOH (1 н, 1,3 мл, 2,2 молярного эквивалента). Твердое вещество полностью растворялось с образованием прозрачного раствора, который естественным путем охлаждался до окружающих температур. Кристаллизация происходила во время медленного процесса испарения.
G3. Кристаллические формы (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида монокалиевой соли.
[00312] Настоящее изобретение также относится, частично, к кристаллическим формам монокалиевой соли (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, а именно трехводным и двуводным кристаллическим формам, рассмотренным ниже.
[00313] Настоящее изобретение относится, частично, к трехводной монокалиевой соли. Кристаллографические параметры элементарной ячейки трехводной кристаллической монокалиевой соли были определены следующими: а равно 9,0Å, b равно 8,3Å, и с равно 18,6Å (более точно, а равно 9,9393(16)Å, b равно 8,3332(15)Å, и с равно 18,582(3)Å); углы ячейки составляют: α - 89,5°, β - 85,1°, и γ - 80.5° (более точно, α равен 80,511(2)°, β равен 85,134(3)°, и у равен 89,531(2)°); и объем ячейки составляет 1359Å3 (более точно, 1359,3(4)Å3). Эта соль кристаллизуется в пространственной группе Р-1.
[00314] В некоторых вариантах осуществления, трехводная монокалиевая соль имеет порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 4,8±0,2, 19,8±0,2, 11,3±0,2, 13,4±0,2, 15,3±0,2, 16,9±0,2, 21,2±0,2, 21,7±0,2, 22,1±0,2, 22,5±0,2 и 23,0±0,2 градусов 2θ. В некоторых таких вариантах осуществления, трехводная монокалиевая соль имеет порошковую рентгенограмму, содержащую три или более пиков, выбранных из группы, состоящей из 4,8±0,2, 10,8±0,2, 11,3±0,2, 13,4±0,2, 15,3±0,2, 16,9±0,2, 21,2±0,2, 21,7±0,2, 22,1±0,2, 22,5±0,2 и 23,0±0,2 градусов 2θ. В других таких вариантах осуществления, трехводная монокалиевая соль имеет порошковую рентгенограмму, содержащую пять или более пиков, выбранных из группы, состоящей из 4,8±0,2, 10,8±0,2, 11,3±0,2, 13,4±0,2, 15,3±0,2, 16,9±0,2, 21,2±0,2, 21,7±0,2, 22,1±0,2, 22,5±0,2 и 23,0±0,2 градусов 2θ.
[00315] В некоторых вариантах осуществления, трехводная монокалиевая соль имеет порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 4,8±0,2, 10,8±0,2, 11,3±0,2, 13,4±0,2, 13,6±0,2, 15,3±0,2, 16,9±0,2, 21,2±0,2, 21,7±0,2, 21,7±0,2, 22,1±0,2, 22,5±0,2, 22,6±0,2 и 23,0±0,2 градусов 2θ. В некоторых таких вариантах осуществления, трехводная монокалиевая соль имеет порошковую рентгенограмму, содержащую три или более пиков, выбранных из группы, состоящей из 4,8±0,2, 10,8±0,2, 11,3±0,2, 13,4±0,2, 13,6±0,2, 15,3±0,2, 16,9±0,2, 21,2±0,2, 21,7±0,2, 21,7±0,2, 22,1±0,2, 22,5±0,2, 22,6±0,2 и 23,0±0,2 градусов 2θ. В других таких вариантах осуществления, трехводная монокалиевая соль имеет порошковую рентгенограмму, содержащую пять или более пиков, выбранных из группы, состоящей из 4,8±0,2, 10,8±0,2, 11,3±0,2, 13,4±0,2, 13,6±0,2, 15,3±0,2, 16,9±0,2, 21,2±0,2, 21,7±0,2, 21,7±0,2, 22,1±0,2, 22,5±0,2, 22,6±0,2 и 23,0±0,2 градусов 2θ.
[00316] В некоторых вариантах осуществления, трехводная монокалиевая соль имеет порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 4,8±0,2, 10,8±0,2, 11,3±0,2, 13,4±0,2, 13,6±0,2, 15,3±0,2, 16,9±0,2, 21,2±0,2, 21,7±0,2, 21,7±0,2, 22,1±0,2, 22,5±0,2, 22,6±0,2 и 23,0±0,2 градусов 2θ. В некоторых таких вариантах осуществления, трехводная монокалиевая соль имеет порошковую рентгенограмму, содержащую три или более пиков, выбранных из группы, состоящей из 4,8±0,2, 10,8±0,2, 11,3±0,2, 13,4±0,2, 15,3±0,2, 16,9±0,2, 21,2±0,2, 21,7±0,2, 22,1±0,2, 22,5±0,2 и 23,0±0,2 градусов 2θ. В других таких вариантах осуществления, трехводная монокалиевая соль имеет порошковую рентгенограмму, содержащую пять или более пиков, выбранных из группы, состоящей из 4,8±0,2, 10,8±0,2, 11,3±0,2, 13,4±0,2, 15,3±0,2, 16,9±0,2, 21,2±0,2, 21,7±0,2, 22,1±0,2, 22,5±0,2 и 23,0±0,2 градусов 2θ.
[00317] В некоторых вариантах осуществления, трехводная монокалиевая соль имеет порошковую рентгенограмму, по существу, как показано на Фигуре 5. Величины 2θ для пиков на Фигуре 5 (и их интенсивности) представляют собой следующее: 4,83 (60), 10,79 (100), 11,31 (22), 13,42 (41), 13,59 (18), 15,32 (21), 16,90 (38), 21,24 (22), 21,68 (20), 21,68 (21), 22,15 (22), 22,55 (29), 22,63 (23) и 23,02 (27).
[00318] Настоящее изобретение также относится, частично, к способу получения трехводной монокалиевой соли. Ее получают путем суспендирования соединения IB-L1-1.1 (108,81 мг) в 0,4 мл THF при нагревании примерно до 50°С. Добавляли водный раствор KOH (1 н, 0,278 мл, 1,2 молярного эквивалента). Твердое вещество растворялось полностью с образованием прозрачного раствора. В раствор добавляли дополнительно 1,6 мл THF, который затем естественным путем охлаждали до окружающих температур, и наблюдали кристаллизацию. Альтернативно, трехводную монокалиевую соль получали путем суспендирования соединения IB-L1-1.1 (343,89 мг) в 1,0 мл THF при нагревании до 50°С. Добавляли водный KOH (1 н, 0,878 мл, 1,2 молярного эквивалента). Твердое вещество растворялось полностью с образованием прозрачного раствора. К раствору добавляли по каплям этанол до общего объема 4,0 мл. Этот раствор затем охлаждали естественным путем до окружающей температуры и наблюдали кристаллизацию.
[00319] Настоящее изобретение относится, частично, к двуводной монокалиевой соли.
[00320] В некоторых вариантах осуществления, двуводная монокалиевая соль имеет порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 7,7±0,2, 8,8±0,2, 16,1±0,2 и 19,7±0,2 градусов 2θ. В некоторых таких вариантах осуществления, двуводная монокалиевая соль имеет порошковую рентгенограмму, содержащую три или более пиков, выбранных из группы, состоящей из градусов 2θ.
[00321] В некоторых вариантах осуществления, двуводная монокалиевая соль имеет порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 7,7±0,2, 8,8±0,2, 12,4±0,2, 14,0±0,2, 16,1±0,2, 17,7±0,2, 19,2±0,2, 19,7±0,2, 23,1±0,2 и 29,2±0,2 градусов 2θ. В некоторых таких вариантах осуществления, двуводная монокалиевая соль имеет порошковую рентгенограмму, содержащую три или более пиков, выбранных из группы, состоящей из 7,7±0,2, 8,8±0,2, 12,4±0,2, 14,0±0,2, 16,1±0,2, 17,7±0,2, 19,2±0,2, 19,7±0,2, 23,1±0,2 и 29,2±0,2 градусов 2θ. В других таких вариантах осуществления, двуводная монокалиевая соль имеет порошковую рентгенограмму, содержащую пять или более пиков, выбранных из группы, состоящей из 7,7±0,2, 8,8±0,2, 12,4±0,2, 14,0±0,2, 16,1±0,2, 17,7±0,2, 19,2±0,2, 19,7±0,2, 23,1±0,2 и 29,2±0,2 градусов 2θ.
[00322] В некоторых вариантах осуществления, двуводная монокалиевая соль имеет порошковую рентгенограмму, по существу, как показано на Фигуре 6. Величины 2θ для пиков на Фигуре 6 (и их интенсивности) представляют собой следующее: 7,68 (19), 8,83 (100), 12,40 (7), 13,97 (10), 16,12 (25), 17,75 (9), 19,22 (12), 19,73 (40), 23,05 (9) и 29,21 (7).
[00323] Настоящее изобретение также относится, частично, к способу получения двуводной монокалиевой соли. Ее получали путем суспендирования трехводной монокалиевой соли в среде с низкой водной активностью, такой как смесь этанол/Н2О (50/1 об/об). Альтернативно, двуводную монокалиевую соль получали путем растворения твердого трехводного калия (1,8 г) в 36 мл IPA и 4 мл воды при 80°С. Полученный в результате раствор охлаждали до 55°С за 1 ч. Этот раствор затем кристаллизовали с использованием 7,5 мг кристаллов дигидрата при 55°С и поддерживали при 55°С в течение 1 ч. Затем добавляли гептан (36 мл) на протяжении 3 ч. Реакционную смесь охлаждали до 0°С, и фильтрование давало вещество, содержащее кристаллы как ди-, так и тригидрата. Твердое вещество затем ресуспендировали в 20 мл 10:1 об/об EtOH/H2O при 50°С в течение 3 ч и охлаждали до 25°С за 5 ч. Суспензию затем перемешивали при 25°С в течение дополнительных 3 дней и охлаждали до 0°С за 3 ч и удерживали при этой температуре в течение 2 ч. Полученные в результате кристаллы фильтровали и сушили на воздухе на делительной воронке в течение 1 ч с получением дигидрата. Двуводную монокалиевую соль также получали путем суспендирования смеси кристаллов дигидрата и тригидрата в 10:1 об/об EtOH/H2O при 80°С в течение 2 дней. Содержание калия подтверждали с помощью ионной хроматографии.
G4. Кристаллическая форма 1/7 калиевой соли (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансулъфонамида.
[00324] Настоящее изобретение также относится, частично, к кристаллической форме 1/7 калиевой соли (E)-N-(4-(3 -трет-бутил-5 -(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида.
[00325] В некоторых вариантах осуществления, 1/7 калиевая соль имеет порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 7,7±0,2, 8,3±0,2, 10,1±0,2, 10,6±0,2, 11,4±0,2, 12,0±0,2, 13,4±0,2, 15,6±0,2, 16,3±0,2, 16,7±0,2, 17,2±0,2, 18,3±0,2, 18,8±0,2, 19,4±0,2, 19,9±0,2, 20,2±0,2, 20,5±0,2, 21,2±0,2, 22,1±0,2 и 22,9±0,2 градусов 2θ. В некоторых таких вариантах осуществления, 1/7 калиевая соль имеет порошковую рентгенограмму, содержащую три или более пиков, выбранных из группы, состоящей из 7,7±0,2, 8,3±0,2, 10,1±0,2, 10,6±0,2, 11,4±0,2, 12,0±0,2, 13,4±0,2, 15,6±0,2, 16,3±0,2, 16,7±0,2, 17,2±0,2, 18,3±0,2, 18,8±0,2, 19,4±0,2, 19,9±0,2, 20,2±0,2, 20,5±0,2, 21,2±0,2, 22,1±0,2 и 22,9±0,2 градусов 2θ. В других таких вариантах осуществления, 1/7 калиевая соль имеет порошковую рентгенограмму, содержащую пять или более пиков, выбранных из группы, состоящей из 7,7±0,2, 8,3±0,2, 10,1±0,2, 10,6±0,2, 11,4±0,2, 12,0±0,2, 13,4±0,2, 15,6±0,2, 16,3±0,2, 16,7±0,2, 17,2±0,2, 18,3±0,2, 18,8±0,2, 19,4±0,2, 19,9±0,2, 20,2±0,2, 20,5±0,2, 21,2±0,2, 22,1±0,2 и 22,9±0,2 градусов 2θ.
[00326] В некоторых вариантах осуществления, 1/7 калиевая соль имеет порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 7,7±0,2, 8,3±0,2, 10,1±0,2, 10,6±0,2, 11,4±0,2, 12,0±0,2, 13,4±0,2, 15,6±0,2, 16,3±0,2, 16,7±0,2, 17,2±0,2, 18,3±0,2, 18,8±0,2, 19,4±0,2, 19,9±0,2, 20,2±0,2, 20,5±0,2, 20,8±0,2, 21,2±0,2, 22,1±0,2, 22,9±0,2, 24,3±0,2, 24,9±0,2 и 25,1±0,2 градусов 2θ. В некоторых таких вариантах осуществления, 1/7 калиевая соль имеет порошковую рентгенограмму, содержащую три или более пиков, выбранных из группы, состоящей из 7,7±0,2, 8,3±0,2, 10,1±0,2, 10,6±0,2, 11,4±0,2, 12,0±0,2, 13,4±0,2, 15,6±0,2, 16,3±0,2, 16,7±0,2, 17,2±0,2, 18,3±0,2, 18,8±0,2, 19,4±0,2, 19,9±0,2, 20,2±0,2, 20,5±0,2, 20,8±0,2, 21,2±0,2, 22,1±0,2, 22,9±0,2, 24,3±0,2, 24,9±0,2 и 25,1±0,2 градусов 2θ. В других таких вариантах осуществления, 1/7 калиевая соль имеет порошковую рентгенограмму, содержащую пять или более пиков, выбранных из группы, состоящей из 7,7±0,2, 8,3±0,2, 10,1±0,2, 10,6±0,2, 11,4±0,2, 12,0±0,2, 13,4±0,2, 15,6±0,2, 16,3±0,2, 16,7±0,2, 17,2±0,2, 18,3±0,2, 18,8±0,2, 19,4±0,2, 19,9±0,2, 20,2±0,2, 20,5±0,2, 20,8±0,2, 21,2±0,2, 22,1±0,2, 22,9±0,2, 24,3±0,2, 24,9±0,2 и 25,1±0,2 градусов 2θ.
[00327] В некоторых вариантах осуществления, 1/7 калиевая соль имеет порошковую рентгенограмму, по существу, как показано на Фигуре 8. Величины 29 для пиков на Фигуре 8 (и их интенсивности) представляют собой следующее: 7,71 (19), 8,33 (34), 10,10 (100), 10,66 (29), 11,39 (27), 12,04 (22), 13,39 (39), 15,56 (41), 16,27 (62), 16,69 (70), 17,22 (59), 18,31 (18), 18,78 (47), 19,44 (36), 19,89 (28), 20,19 (33), 20,54 (87), 20,80 (33), 21,15 (47), 22,05 (24), 22,82 (67), 24,32 (22), 24,87 (22) и 25,07 (33).
[00328] Настоящее изобретение также относится, частично, к способу получения 1/7 калиевой соли. Ее получали путем суспендирования соединения IB-L1-1.1 (2 г) в 6 мл THF при 50°С. Добавляли один молярный эквивалент КОН, растворенного в 4,3 мл воды, и реакционную смесь нагревали до 65°С до растворения всех твердых частиц. Затем раствор охлаждали до окружающих температур за 2 ч и имела место спонтанная кристаллизация. Затем суспензию охлаждали до 5°С и держали при этой температуре в течение 2 ч. Бледно желтые кристаллы фильтровали и сушили на воздухе 24 ч в окружающих условиях. Содержание калия определяли с помощью ионной хроматографии.
G5. Кристаллическая форма четырехводной монодиэтиламинной соли (E)-N-(4-(2-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансулъфонамида.
[00329] Настоящее изобретение также относится, частично, к кристаллической четырехводной монодиэтиламинной соли (E)-N-(4-(3 -трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида.
[00330] В некоторых вариантах осуществления, четырехводная монодиэтиламинная соль имеет порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 9,5±0,2, 10,0±0,2, 11,8±0,2, 12,1±0,2, 14,4±0,2, 16,8±0,2, 17,6±0,2, 19,8±0,2, 20,8±0,2, 21,4±0,2, 21,8±0,2 и 29,8±0,2 градусов 2θ. В некоторых таких вариантах осуществления, четырехводная монодиэтиламинная соль имеет порошковую рентгенограмму, содержащую три или более пиков, выбранных из группы, состоящей из 9,5±0,2, 10,0±0,2, 11,8±0,2, 12,1±0,2, 14,4±0,2, 16,8±0,2, 17,6±0,2, 19,8±0,2, 20,8±0,2, 21,4±0,2, 21,8±0,2 и 29,8±0,2 градусов 2θ. В других таких вариантах осуществления, четырехводная монодиэтиламинная соль имеет порошковую рентгенограмму, содержащую пять или более пиков, выбранных из группы, состоящей из 9,5±0,2, 10,0±0,2, 11,8±0,2, 12,1±0,2, 14,4±0,2, 16,8±0,2, 17,6±0,2, 19,8±0,2, 20,8±0,2, 21,4±0,2, 21,8±0,2 и 29,8±0,2 градусов 2θ.
[00331] В некоторых вариантах осуществления, четырехводная монодиэтиламинная соль имеет порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 9,5±0,2, 10,0±0,2, 11,8±0,2, 12,1±0,2, 14,4±0,2, 16,8±0,2, 17,6±0,2, 19,4±0,2, 19,8±0,2, 20,8±0,2, 21,4±0,2, 21,8±0,2, 21,9±0,2 и 29,8±0,2 градусов 2θ. В некоторых таких вариантах осуществления, четырехводная монодиэтиламинная соль имеет порошковую рентгенограмму, содержащую три или более пиков, выбранных из группы, состоящей из 9,5±0,2, 10,0±0,2, 11,8±0,2, 12,1±0,2, 14,4±0,2, 16,8±0,2, 17,6±0,2, 19,4±0,2, 19,8±0,2, 20,8±0,2, 21,4±0,2, 21,8±0,2, 21,9±0,2 и 29,8±0,2 градусов 2θ. В других таких вариантах осуществления, четырехводная монодиэтиламинная соль имеет порошковую рентгенограмму, содержащую пять или более пиков, выбранных из группы, состоящей из 9,5±0,2, 10,0±0,2, 11,8±0,2, 12,1±0,2, 14,4±0,2, 16,8±0,2, 17,6±0,2, 19,4±0,2, 19,8±0,2, 20,8±0,2, 21,4±0,2, 21,8±0,2, 21,9±0,2 и 29,8±0,2 градусов 2θ.
[00332] В некоторых вариантах осуществления, четырехводная монодиэтиламинная соль имеет порошковую рентгенограмму, по существу, как показано на Фигуре 9. Величины 2θ для пиков на Фигуре 9 (и их интенсивности) представляют собой следующее: 9,45 (100), 9,97 (31), 11,85 (67), 12,09 (16), 14,38 (22), 16,80 (9), 17,59 (10), 19,39 (8), 19,83 (21), 20,85 (25), 21,37 (12), 21,75 (34), 21,87 (8) и 29,78 (7).
[00333] Настоящее изобретение также относится, частично, к способу получения четырехводной монодиэтиламинной соли. Ее получали в водной среде. Соединение IB-L1-1.1 медленно добавляли к 500 мкл 1 М диэтиламина, до тех пор, пока твердое вещество может растворяться в растворе. Затем раствор медленно упаривали при окружающих температурах, и соль кристаллизовалась спустя 2 дня. Альтернативно, четырехводную монодиэтиламинную соль получали путем суспендирования 64,15 мг соединения IB-L1-1.1 в 400 мкл 1М диэтиленамина при нагревании до 50°С. Добавляли около 5 капель THF (~20 мкл). Твердое вещество полностью растворялось после добавления с образованием прозрачного раствора. Этот раствор затем упаривали при окружающей температуре, и соль кристаллизовалась спустя 4 дня. Стехиометрию этой соли подтверждали с помощью1Н ЯМР в растворе.
G6. Кристаллические формы (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансулъфонамида (соединение IB-L1-1.1).
[00334] Настоящее изобретение также относится, частично, к кристаллическим формам (E)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида (соединение IB-L1-1.1), а именно к настоящим полиморфам (образцу А, образцу В, образцу С и образцу D) и гидратным (образец АН, образец ВН, образец СН, и образец DH) кристаллическим формам, рассмотренным ниже.
G6A. Настоящие полиморфы IB-L1-1.1.
[00335] Настоящее изобретение относится, частично, образцу А кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида.
[00336] В некоторых вариантах осуществления, образец А полиморфа имеет порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 5,8±0,2, 9,9±0,2, 11,8±0,2, 12,4±0,2, 14,5±0,2, 18,8±0,2, 22,7±0,2 и 29,2±0,2 градусов 2θ. В некоторых таких вариантах осуществления, образец А полиморфа имеет порошковую рентгенограмму, содержащую три или более пиков, выбранных из группы, состоящей из 5,8±0,2, 9,9±0,2, 11,8±0,2, 12,4±0,2, 14,5±0,2, 18,8±0,2, 22,7±0,2 и 29,2±0,2 градусов 2θ. В других таких вариантах осуществления, образец А полиморфа имеет порошковую рентгенограмму, содержащую пять или более пиков, выбранных из группы, состоящей из 5,8±0,2, 9,9±0,2, 11,8±0,2, 12,4±0,2, 14,5±0,2, 18,8±0,2, 22,7±0,2 и 29,2±0,2 градусов 2θ.
[00337] В некоторых вариантах осуществления, образец А полиморфа имеет порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 5,8±0,2, 9,9±0,2, 11,8±0,2, 12,4±0,2, 14,0±0,2, 14,5±0,2, 15,3±0,2, 18,5±0,2, 18,8±0,2, 22,2±0,2, 22,7±0,2, 23,8±0,2, 26,0±0,2 и 29,2±0,2 градусов 2θ. В некоторых таких вариантах осуществления, образец А полиморфа имеет порошковую рентгенограмму, содержащую три или более пиков, выбранных из группы, состоящей из 5,8±0,2, 9,9±0,2, 11,8±0,2, 12,4±0,2, 14,0±0,2, 14,5±0,2, 15,3±0,2, 18,5±0,2, 18,8±0,2, 22,2±0,2, 22,7±0,2, 23,8±0,2, 26,0±0,2 и 29,2±0,2 градусов 2θ. В других таких вариантах осуществления, образец А полиморфа имеет порошковую рентгенограмму, содержащую пять или более пиков, выбранных из группы, состоящей из 5,8±0,2, 9,9±0,2, 11,8±0,2, 12,4±0,2, 14,9±0,2, 14,5±0,2, 15,3±0,2, 18,5±0,2, 18,8±0,2, 22,2±0,2, 22,7±0,2, 23,8±0,2, 26,9±0,2 и 29,2±0,2 градусов 2θ.
[00338] В некоторых вариантах осуществления, образец А полиморфа имеет порошковую рентгенограмму, по существу, как показано на Фигуре 11. Величины 2θ для пиков на Фигуре 11 (и их интенсивности) представляют собой следующее: 5,85 (28), 9,88 (51), 11,79 (73), 12,38 (56), 14,93 (38), 14,45 (199), 15,27 (29), 18,52 (39), 18,89 (47), 22,24 (49), 22,72 (77), 23,76 (39), 25,98 (22) и 29,21 (64).
[00339] Настоящее изобретение также относится, частично, к способу получения образца А полиморфа. Образец А полиморфа получали как описано ниже в Примере Е.
[00340] Настоящее изобретение относится, частично, образцу В кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида.
[00341] В некоторых вариантах осуществления, образец В полиморфа имеет порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 11,5±0,2, 13,3±0,2, 15,4±0,2, 16,4±0,2, 17,1±0,2, 18,6±0,2, 19,4±0,2, 29,4±0,2, 21,6±0,2, 22,4±0,2, 24,9±0,2, 26,8±0,2 и 29,9±0,2 градусов 2θ. В некоторых таких вариантах осуществления, образец В полиморфа имеет порошковую рентгенограмму, содержащую три или более пиков, выбранных из группы, состоящей из 11,5±0,2, 13,3±0,2, 15,4±0,2, 16,4±0,2, 17,1±0,2, 18,6±0,2, 19,4±0,2, 29,4±0,2, 21,6±0,2, 22,4±0,2, 24,9±0,2, 26,8±0,2 и 29,9±0,2 градусов 2θ. В других таких вариантах осуществления, образец В полиморфа имеет порошковую рентгенограмму, содержащую пять или более пиков, выбранных из группы, состоящей из 11,5±0,2, 13,3±0,2, 15,4±0,2, 16,4±0,2, 17,1±0,2, 18,6±0,2, 19,4±0,2, 29,4±0,2, 21,6±0,2, 22,4±0,2, 24,9±0,2, 26,8±0,2 и 29,9±0,2 градусов 2θ.
[00342] В некоторых вариантах осуществления, образец В полиморфа имеет порошковую рентгенограмму, по существу, как показано на Фигуре 13. Величины 2θ для пиков на Фигуре 13 (и их интенсивности) представляют собой следующее: 11,52 (71), 13,39 (87), 15,37 (199), 16,42 (69), 17,13 (69), 18,69 (97), 19,37 (56), 29,49 (62), 21,55 (55), 22,41 (39), 23,99 (33), 26,81 (31) и 28,98 (59).
[00343] Настоящее изобретение относится, частично, образцу С кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида.
[00344] В некоторых вариантах осуществления, образец С полиморфа имеет порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 7,7±0,2, 19,1±0,2, 19,6±0,2, 12,9±0,2, 13,4±0,2, 16,2±0,2, 19,4±0,2, 29,5±0,2, 21,4±0,2, 22,9±0,2, 22,6±0,2, 24,3±0,2 и 27,6±0,2 градусов 2θ. В некоторых таких вариантах осуществления, образец С полиморфа имеет порошковую рентгенограмму, содержащую три или более пиков, выбранных из группы, состоящей из 7,7±0,2, 19,1±0,2, 19,6±0,2, 12,9±0,2, 13,4±0,2, 16,2±0,2, 19,4±0,2, 29,5±0,2, 21,4±0,2, 22,9±0,2, 22,6±0,2, 24,3±0,2 и 27,6±0,2 градусов 2θ. В других таких вариантах осуществления, образец С полиморфа имеет порошковую рентгенограмму, содержащую пять или более пиков, выбранных из группы, состоящей из 7,7±0,2, 19,1±0,2, 19,6±0,2, 12,9±0,2, 13,4±0,2, 16,2±0,2, 19,4±0,2, 29,5±0,2, 21,4±0,2, 22,0±0,2, 22,6±0,2, 24,3±0,2 и 27,6±0,2 градусов 2θ.
[00345] В некоторых вариантах осуществления, образец С полиморфа имеет порошковую рентгенограмму, по существу, как показано на Фигуре 14. Величины 2θ для пиков на Фигуре 14 (и их интенсивности) представляют собой следующее: 7,69 (27), 10,13 (27), 10,64 (49), 12,01 (31), 13,39 (33), 16,25 (91), 19,44 (46), 20,49 (100), 21,40 (35), 22,03 (37), 22,60 (30), 24,32 (23) и 27,55 (27).
[00346] Настоящее изобретение относится, частично, к образцу D кристаллического (E)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1 (2Н)-ил)-2-метоксистирил)фенил)метансульфонамида.
[00347] В некоторых вариантах осуществления, образец D полиморфа имеет порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 5,8±0,2, 10,7±0,2, 11,2±0,2, 15,2±0,2, 16,1±0,2, 16,9±0,2, 19,9±0,2, 22,1±0,2, 24,7±0,2 и 26,0±0,2 градусов 2θ. В некоторых таких вариантах осуществления, образец D полиморфа имеет порошковую рентгенограмму, содержащую три или более пиков, выбранных из группы, состоящей из 5,8±0,2, 10,7±0,2, 11,2±0,2, 15,2±0,2, 16,1±0,2, 16,9±0,2, 19,9±0,2, 22,1±0,2, 24,7±0,2 и 26,0±0,2 градусов 2θ. В других таких вариантах осуществления, образец D полиморфа имеет порошковую рентгенограмму, содержащую пять или более пиков, выбранных из группы, состоящей из 5,8±0,2, 10,7±0,2, 11,2±0,2, 15,2±0,2, 16,1±0,2, 16,9±0,2, 19,9±0,2, 22,1±0,2, 24,7±0,2 и 26,0±0,2 градусов 2θ.
[00348] В некоторых вариантах осуществления, образец D полиморфа имеет порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 5,8±0,2, 10,7±0,2, 11,2±0,2, 15,2±0,2, 16,1±0,2, 16,9±0,2, 17,1±0,2, 19,9±0,2, 20,1±0,2, 22,1±0,2, 24,7±0,2 и 26,0±0,2 градусов 2θ. В некоторых таких вариантах осуществления, образец D полиморфа имеет порошковую рентгенограмму, содержащую три или более пиков, выбранных из группы, состоящей из 5,8±0,2, 10,7±0,2, 11,2±0,2, 15,2±0,2, 16,1±0,2, 16,9±0,2, 17,1±0,2, 19,9±0,2, 20,1±0,2, 22,1±0,2, 24,7±0,2 и 26,0±0,2 градусов 2θ. В других таких вариантах осуществления, образец D полиморфа имеет порошковую рентгенограмму, содержащую пять или более пиков, выбранных из группы, состоящей из 5,8±0,2, 10,7±0,2, 11,2±0,2, 15,2±0,2, 16,1±0,2, 16,9±0,2, 17,1±0,2, 19,9±0,2, 20,1±0,2, 22,1±0,2, 24,7±0,2 и 26,0±0,2 градусов 2θ.
[00349] В некоторых вариантах осуществления, образец D полиморфа имеет порошковую рентгенограмму, по существу, как показано на Фигуре 15. Величины 2θ для пиков на Фигуре 15 (и их интенсивности) представляют собой следующее: 5,81 (24), 10,70 (91), 11,23 (60), 15,17 (28), 16,10 (48), 16,89 (100), 17,10 (42), 19,88 (81), 20,12 (100), 22,12 (59), 24,72 (37) и 25,91 (24).
[00350] Настоящее изобретение также относится, частично, к способу получения образца В, С и D полиморфов, путем нагревания образца А полиморфа примерно до 160, примерно до 225 и примерно до 268°С, соответственно, используя DSC.
G6B. Гидраты IB-L1-1.1.
[00351] Настоящее изобретение также относится, частично, к гидратам соединения IB-L1-1.1, а именно к гидратам А, В, С, D и Е, рассмотренным ниже.
[00352] Настоящее изобретение относится, частично, к образцу А гидрата (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидро- пиримидин- 1(2Н)-ил)-2-метоксиетирил)фенил)метансульфонамида.
[00353] В некоторых вариантах осуществления, образец А гидрата имеет порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 5,1±0,2, 7,9±0,2, 9,5±0,2, 10,3±0,2, 13,7±0,2, 16,5±0,2, 17,1±0,2, 17,5±0,2, 18,8±0,2, 19,2±0,2, 20,7±0,2, 21,3±0,2, 21,6±0,2, 25,8±0,2, 26,8±0,2 и 28,4±0,2 градусов 2θ. В некоторых таких вариантах осуществления, образец А гидрата имеет порошковую рентгенограмму, содержащую три или более пиков, выбранных из группы, состоящей из 5,1±0,2, 7,9±0,2, 9,5±0,2, 10,3±0,2, 13,7±0,2, 16,5±0,2, 17,1±0,2, 17,5±0,2, 18,8±0,2, 19,2±0,2, 20,7±0,2, 21,3±0,2, 21,6±0,2, 25,8±0,2, 26,8±0,2 и 28,4±0,2 градусов 2θ. В других таких вариантах осуществления, образец А гидрата имеет порошковую рентгенограмму, содержащую пять или более пиков, выбранных из группы, состоящей из 5,1±0,2, 7,9±0,2, 9,5±0,2, 10,3±0,2, 13,7±0,2, 16,5±0,2, 17,1±0,2, 17,5±0,2, 18,8±0,2, 19,2±0,2, 20,7±0,2, 21,3±0,2, 21,6±0,2, 25,8±0,2, 26,8±0,2 и 28,4±0,2 градусов 2θ.
[00354] В некоторых вариантах осуществления, образец А гидрата имеет порошковую рентгенограмму, по существу, как показано на Фигуре 16. Величины 2θ для пиков на Фигуре 16 (и их интенсивности) представляют собой следующее: 5,13 (13), 7,87 (80), 9,45 (100), 10,29 (60), 13,7 (28), 16,54 (30), 17,07 (17), 17,51 (40), 18,80 (99), 19,18 (74), 20,69 (21), 21,25 (21), 21,63 (23), 25,85 (32), 26,81 (20) и 28,35 (27).
[00355] Настоящее изобретение также относится, частично, к способу получения образца А гидрата путем суспендирования образца А полиморфа (рассмотренного выше) в этилацетате. Восстановленный образец А гидрата содержит ~1 молекулу воды на молекулу соединения IB-L1-1.1.
[00356] Настоящее изобретение также относится, частично, к образцу В гидрата (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидро- пиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида.
[00357] В некоторых вариантах осуществления, образец В гидрата имеет порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 6,3±0,2, 7,7±0,2, 10,4±0,2, 12,7±0,2, 13,3±0,2, 14,9±0,2, 15,4±0,2, 16,4±0,2, 18,6±0,2, 18,9±0,2, 19,4±0,2, 22,5±0,2, 23,5±0,2, 24,0±0,2, 26,8±0,2 и 29,0±0,2 градусов 2θ. В некоторых таких вариантах осуществления, образец В гидрата имеет порошковую рентгенограмму, содержащую три или более пиков, выбранных из группы, состоящей из 6,3±0,2, 7,7±0,2, 10,4±0,2, 12,7±0,2, 13,3±0,2, 14,9±0,2, 15,4±0,2, 16,4±0,2, 18,6±0,2, 18,9±0,2, 19,4±0,2, 22,5±0,2, 23,5±0,2, 24,0±0,2, 26,8±0,2 и 29,0±0,2 градусов 2θ. В других таких вариантах осуществления, образец В гидрата имеет порошковую рентгенограмму, содержащую пять или более пиков, выбранных из группы, состоящей из 6,3±0,2, 7,7±0,2, 10,4±0,2, 12,7±0,2, 13,3±0,2, 14,9±0,2, 15,4±0,2, 16,4±0,2, 18,6±0,2, 18,9±0,2, 19,4±0,2, 22,5±0,2, 23,5±0,2, 24,0±0,2, 26,8±0,2 и 29,0±0,2 градусов 2θ.
[00358] В некоторых вариантах осуществления, образец В гидрата имеет порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 6,3±0,2, 7,7±0,2, 10,4±0,2, 12,7±0,2, 13,3±0,2, 13,5±0,2, 14,9±0,2, 15,4±0,2, 16,4±0,2, 18,5±0,2, 18,6±0,2, 18,9±0,2, 19,4±0,2, 22,5±0,2, 23,5±0,2, 24,0±0,2, 26,8±0,2 и 29,0±0,2 градусов 2θ. В некоторых таких вариантах осуществления, образец В гидрата имеет порошковую рентгенограмму, содержащую три или более пиков, выбранных из группы, состоящей из 6,3±0,2, 7,7±0,2, 10,4±0,2, 12,7±0,2, 13,3±0,2, 13,5±0,2, 14,9±0,2, 15,4±0,2, 16,4±0,2, 18,5±0,2, 18,6±0,2, 18,9±0,2, 19,4±0,2, 22,5±0,2, 23,5±0,2, 24,0±0,2, 26,8±0,2 и 29,0±0,2 градусов 2θ. В других таких вариантах осуществления, образец В гидрата имеет порошковую рентгенограмму, содержащую пять или более пиков, выбранных из группы, состоящей из 6,3±0,2, 7,7±0,2, 10,4±0,2, 12,7±0,2, 13,3±0,2, 13,5±0,2, 14,9±0,2, 15,4±0,2, 16,4±0,2, 18,5±0,2, 18,6±0,2, 18,9±0,2, 19,4±0,2, 22,5±0,2, 23,5±0,2, 24,0±0,2, 26,8±0,2 и 29,0±0,2 градусов 2θ.
[00359] В некоторых вариантах осуществления, образец В гидрата имеет порошковую рентгенограмму, по существу, как показано на Фигуре 18. Величины 2θ для пиков на Фигуре 18 (и их интенсивности) представляют собой следующее: 6,31 (7), 7,72 (14), 19,45 (24), 12,67 (26), 13,30 (88), 13,50 (44), 14,89 (70), 15,40 (100), 16,43 (43), 18,46 (47), 18,63 (86), 18,91 (26), 19,42 (33), 22,52 (47), 23,52 (44), 24,02 (20), 26,82 (40) и 28,97 (49).
[00360] Настоящее изобретение также относится, частично, к способу получения образца В гидрата путем суспендирования образца А полиморфа (рассмотренного выше) в ацетонитриле/воде (9/1 об/об). Восстановленный образец В гидрата содержит ~0,7 молекул воды на молекулу соединения IB-L1-1.1.
[00361] Настоящее изобретение также относится, частично, к образцу С гидрата (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида.
[00362] В некоторых вариантах осуществления, образец С гидрата имеет порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 10,5±0,2, 13,3±0,2, 14,9±0,2, 15,4±0,2, 16,4±0,2, 18,6±0,2, 19,0±0,2, 19,4±0,2, 22,5±0,2, 23,5±0,2, 26,9±0,2 и 29,0±0,2 градусов 2θ. В некоторых таких вариантах осуществления, образец С гидрата имеет порошковую рентгенограмму, содержащую три или более пиков, выбранных из группы, состоящей из 10,5±0,2, 13,3±0,2, 14,9±0,2, 15,4±0,2, 16,4±0,2, 18,6±0,2, 19,0±0,2, 19,4±0,2, 22,5±0,2, 23,5±0,2, 26,9±0,2 и 29,0±0,2 градусов 2θ. В других таких вариантах осуществления, образец С гидрата имеет порошковую рентгенограмму, содержащую пять или более пиков, выбранных из группы, состоящей из 10,5±0,2, 13,3±0,2, 14,9±0,2, 15,4±0,2, 16,4±0,2, 18,6±0,2, 19,0±0,2, 19,4±0,2, 22,5±0,2, 23,5±0,2, 26,9±0,2 и 29,0±0,2 градусов 2θ.
[00363] В некоторых вариантах осуществления, образец С гидрата имеет порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 10,5±0,2, 13,3±0,2, 13,5±0,2, 14,9±0,2, 15,4±0,2, 16,4±0,2, 18,6±0,2, 19,0±0,2, 19,4±0,2, 22,5±0,2, 23,5±0,2, 26,9±0,2 и 29,0±0,2 градусов 2θ. В некоторых таких вариантах осуществления, образец С гидрата имеет порошковую рентгенограмму, содержащую три или более пиков, выбранных из группы, состоящей из 10,5±0,2, 13,3±0,2, 13,5±0,2, 14,9±0,2, 15,4±0,2, 16,4±0,2, 18,6±0,2, 19,0±0,2, 19,4±0,2, 22,5±0,2, 23,5±0,2, 26,9±0,2 и 29,0±0,2 градусов 2θ. В других таких вариантах осуществления, образец С гидрата имеет порошковую рентгенограмму, содержащую пять или более пиков, выбранных из группы, состоящей из 10,5±0,2, 13,3±0,2, 13,5±0,2, 14,9±0,2, 15,4±0,2, 16,4±0,2, 18,6±0,2, 19,0±0,2, 19,4±0,2, 22,5±0,2, 23,5±0,2, 26,9±0,2 и 29,0±0,2 градусов 2θ.
[00364] В некоторых вариантах осуществления, образец С гидрата имеет порошковую рентгенограмму, по существу, как показано на Фигуре 20. Величины 2θ для пиков на Фигуре 20 (и их интенсивности) представляют собой следующее: 10,47 (21), 13,31 (56), 13,49 (31), 14,91 (28), 15,40 (86), 16,43 (48), 18,61 (100), 18,96 (20), 19,44 (19), 22,55 (26), 23,54 (39), 26,84 (29) и 28,99 (54).
[00365] Настоящее изобретение также относится, частично, к способу получения образца С гидрата путем суспендирования образца А полиморфа (рассмотренного выше) в воде. Восстановленный образец С гидрата содержит ~1 молекулу воды на молекулу соединения IB-L1-1.1.
[00366] Настоящее изобретение также относится, частично, к образцу D гидрата (E)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида.
[00367] Кристаллографические параметры элементарной ячейки образца D гидратной соли были определены следующими: а равно 17,8Å, b равно 9,6Å, и с равно 27,0Å (более точно, а равно 17,783(2)Å, b равно 9,5651(12)Å, и с равно 27,014(4)Å); угол ячейки составляет: β - 93,3° (более точно, β равен 93,256(2)°); и объем ячейки составляет 4588Å3 (более точно, 4587,5(10)Å3). Эта соль кристаллизуется в пространственной группе С2/с.
[00368] В некоторых вариантах осуществления, образец D гидрата имеет порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 6,6±0,2, 10,0±0,2, 10,5±0,2, 11,1±0,2, 11,6±0,2, 12,2±0,2, 14,2±0,2, 16,6±0,2, 17,1±0,2, 17,7±0,2, 18,5±0,2, 18,8±0,2, 19,3±0,2, 21,4±0,2, 22,7±0,2, 23,1±0,2, 23,6±0,2, 24,6±0,2, 25,2±0,2, 27,2±0,2, 29,1±0,2 и 31,0±0,2 градусов 2θ. В некоторых таких вариантах осуществления, образец D гидрата имеет порошковую рентгенограмму, содержащую три или более пиков, выбранных из группы, состоящей из 6,6±0,2, 10,0±0,2, 10,5±0,2, 11,1±0,2, 11,6±0,2, 12,2±0,2, 14,2±0,2, 16,6±0,2, 17,1±0,2, 17,7±0,2, 18,5±0,2, 18,8±0,2, 19,3±0,2, 21,4±0,2, 22,7±0,2, 23,1±0,2, 23,6±0,2, 24,6±0,2, 25,2±0,2, 27,2±0,2, 29,1±0,2 и 31,0±0,2 градусов 2θ. В других таких вариантах осуществления, образец D гидрата имеет порошковую рентгенограмму, содержащую пять или более пиков, выбранных из группы, состоящей из 6,6±0,2, 10,0±0,2, 10,5±0,2, 11,1±0,2, 11,6±0,2, 12,2±0,2, 14,2±0,2, 16,6±0,2, 17,1±0,2, 17,7±0,2, 18,5±0,2, 18,8±0,2, 19,3±0,2, 21,4±0,2, 22,7±0,2, 23,1±0,2, 23,6±0,2, 24,6±0,2, 25,2±0,2, 27,2±0,2, 29,1±0,2 и 31,0±0,2 градусов 2θ.
[00369] В некоторых вариантах осуществления, образец D гидрата имеет порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 6,6±9,2, 10,0±0,2, 10,5±0,2, 11,1±0,2, 11,6±0,2, 12,2±0,2, 12,5±0,2, 14,2±0,2, 16,6±0,2, 17,1±0,2, 17,7±0,2, 18,5±0,2, 18,8±0,2, 19,3±0,2, 21,4±0,2, 22,7±0,2, 22,8±0,2, 23,1±0,2, 23,6±0,2, 24,6±0,2, 24,9±0,2, 25,2±0,2, 27,2±0,2, 29,1±0,2 и 31,0±0,2 градусов 2θ. В некоторых таких вариантах осуществления, образец D гидрата имеет порошковую рентгенограмму, содержащую три или более пиков, выбранных из группы, состоящей из 6,6±0,2, 10,0±0,2, 10,5±0,2, 11,1±0,2, 11,6±0,2, 12,2±0,2, 12,5±0,2, 14,2±0,2, 16,6±0,2, 17,1±0,2, 17,7±0,2, 18,5±0,2, 18,8±0,2, 19,3±0,2, 21,4±0,2, 22,7±0,2, 22,8±0,2, 23,1±0,2, 23,6±0,2, 24,6±0,2, 24,9±0,2, 25,2±0,2, 27,2±0,2, 29,1±0,2 и 31,0±0,2 градусов 2θ. В других таких вариантах осуществления, образец D гидрата имеет порошковую рентгенограмму, содержащую пять или более пиков, выбранных из группы, состоящей из 6,6±0,2, 10,0±0,2, 10,5±0,2, 11,1±0,2, 11,6±0,2, 12,2±0,2, 12,5±0,2, 14,2±0,2, 16,6±0,2, 17,1±0,2, 17,7±0,2, 18,5±0,2, 18,8±0,2, 19,3±0,2, 21,4±0,2, 22,7±0,2, 22,8±0,2, 23,1±0,2, 23,6±0,2, 24,6±0,2, 24,9±0,2, 25,2±0,2, 27,2±0,2, 29,1±0,2 и 31,0±0,2 градусов 2θ.
[00370] В некоторых вариантах осуществления, образец D гидрата имеет порошковую рентгенограмму, по существу, как показано на Фигуре 22. Величины 2θ для пиков на Фигуре 22 (и их интенсивности) представляют собой следующее: 6,55 (10), 9,96 (12), 10,51 (37), 11,09 (31), 11,62 (100), 12,24 (44), 12,54 (40), 14,22 (15), 16,62 (68), 17,07 (22), 17,77 (21), 18,52 (82), 18,84 (47), 19,30 (63), 21,45 (34), 22,67 (30), 22,80 (34), 23,08 (20), 23,57 (58), 24,63 (73), 24,88 (26), 25,24 (21), 27,23 (36), 29,06 (41) и 31,04 (21).
[00371] Настоящее изобретение также относится, частично, к способу получения образца D гидрата. Он может быть получен путем суспендирования образца А полиморфа (рассмотренного выше) в этаноле. Альтернативно, он может быть получен путем суспендирования соединения IB-L1-1.1 (103,03 мг) в 400 мкл THF при нагревании примерно до 55°С. Добавляли водный NaOH (1M, 264 мкл, 1,2 молярного эквивалента). Твердое вещество растворялось полностью с образованием прозрачного раствора. К этому раствору добавляли этанол (1,6 мл). Раствор оставляли охлаждаться естественным путем до окружающих температур. Кристаллы формировались во время медленного процесса испарения. Хотя, судя по всему, кристаллическая решетка может разместить вплоть до 0,5 молекул воды на молекулу соединения IB-L1-1.1, восстановленный образец D гидрата содержал ~0,2 молекулы воды на молекулу соединения IB-L1-1.1.
[00372] Настоящее изобретение также относится, частично, к образцу Е гидрата (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида.
[00373] Кристаллографические параметры элементарной ячейки образца Е гидрата кристаллической динатриевой соли были определены следующими: а равно 9,5Å, b равно 14,5Å и с равно 17,3Å (более точно, а равно 9,462(2)Å, b равно 14,462(3)Å и с равно 17,281(4)Å); углы ячейки составляют: α - 84,9°, β - 80,8° и γ - 81,8° (более точно, α равен 84,863(4)°, β равен 80,760(4)° и γ равен 81,751(4)°); и объем ячейки составляет 2304Å3 (более точно, 2304,4(9)Å3). Эта соль кристаллизуется в пространственной группе Р-1.
[00374] В некоторых вариантах осуществления, образец Е гидрата имеет порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 6,2±0,2, 7,8±0,2, 10,2±0,2, 10,7±0,2, 12,1±0,2, 16,3±0,2, 19,7±0,2, 20,9±0,2, 21,8±0,2, 24,5±0,2 и 28,0±0,2 градусов 2θ. В некоторых таких вариантах осуществления, образец Е гидрата имеет порошковую рентгенограмму, содержащую три или более пиков, выбранных из группы, состоящей из 6,2±0,2, 7,8±0,2, 10,2±0,2, 10,7±0,2, 12,1±0,2, 16,3±0,2, 19,7±0,2, 20,9±0,2, 21,8±0,2, 24,5±0,2 и 28,0±0,2 градусов 2θ. В других таких вариантах осуществления, образец Е гидрата имеет порошковую рентгенограмму, содержащую пять или более пиков, выбранных из группы, состоящей из 6,2±0,2, 7,8±0,2, 10,2±0,2, 10,7±0,2, 12,1±0,2, 16,3±0,2, 19,7±0,2, 20,9±0,2, 21,8±0,2, 24,5±0,2 и 28,0±0,2 градусов 2θ.
[00375] В некоторых вариантах осуществления, образец Е гидрата имеет порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 6,2±0,2, 7,8±0,2, 10,2±0,2, 10,4±0,2, 10,7±0,2, 12,1±0,2, 16,3±0,2, 19,7±0,2, 20,9±0,2, 21,8±0,2, 24,5±0,2 и 28,0±0,2 градусов 2θ. В некоторых таких вариантах осуществления, образец Е гидрата имеет порошковую рентгенограмму, содержащую три или более пиков, выбранных из группы, состоящей из 6,2±0,2, 7,8±0,2, 10,2±0,2, 10,4±0,2, 10,7±0,2, 12,1±0,2, 16,3±0,2, 19,7±0,2, 20,9±0,2, 21,8±0,2, 24,5±0,2 и 28,0±0,2 градусов 2θ. В других таких вариантах осуществления, образец Е гидрата имеет порошковую рентгенограмму, содержащую пять или более пиков, выбранных из группы, состоящей из 6,2±0,2, 7,8±0,2, 10,2±0,2, 10,4±0,2, 10,7±0,2, 12,1±0,2, 16,3±0,2, 19,7±0,2, 20,9±0,2, 21,8±0,2, 24,5±0,2 и 28,0±0,2 градусов 2θ.
[00376] В некоторых вариантах осуществления, образец Е гидрата имеет порошковую рентгенограмму, по существу, как показано на Фигуре 23. Величины 2θ для пиков на Фигуре 23 (и их интенсивности) представляют собой следующее: 6,19 (6), 7,81 (18), 19,17 (13), 10,49 (14), 10,68 (39), 12,06 (20), 16,29 (78), 19,72 (32), 20,88 (100), 21,77 (27), 24,52 (25) и 28,01 (27).
[00377] Настоящее изобретение также относится, частично, к способу получения образца Е гидрата. Его получают путем суспендирования соединения IB-L1-1.1 (56,76 мг) в 200 мкл THF при нагревании. Добавляли водный NaOH (1M, 146 мкл, 1,2 молярного эквивалента), который давал прозрачный раствор. К этому раствору добавляли этанол (800 мкл). Этот раствор оставляли охлаждаться естественным путем до окружающих температур. Кристаллы формировались во время процесса медленного испарения. Хотя, судя по всему, кристаллическая решетка может разместить вплоть до одной молекулы воды на молекулу соединения IB-L1-1.1, восстановленный образец Е гидрата содержал ~0,25 молекул воды на молекулу соединения IB-L1-1.1.
Н. Композиции.
[00378] Настоящее изобретение также относится, частично, к композициям, содержащим одно или более соединений и/или солей по изобретению (в том числе кристаллических соединений и солей рассмотренных выше в разделе G). В некоторых вариантах осуществления, композиции содержат одну или более по существу фазово-чистых кристаллических форм (соединений/солей/сольватов/гидратов) рассмотрены выше в разделе G. Эти композиции могут представлять собой фармацевтические композиции.
[00379] В некоторых вариантах осуществления, композиции дополнительно содержат один или более дополнительных терапевтических агентов. Такие терапевтические агенты могут, но не обязательно должны быть, дополнительными ингибиторами HCV.
[00380] Предпочтительная композиция зависит от способа введения и обычно содержит один или более общепринятых фармацевтически приемлемых носителей, адъювантов и/или наполнителей (все вместе называются «эксципиентами»). Технология получения лекарственных средств в основном рассмотрена, например, Hoover, J., Remington's Pharmaceutical Sciences (Mack Publishing Co., 1975) и Ansel's Pharmaceutical Dosage Forms and Drug Delivery Systems (Lippincott Williams & Wilkins, 2005).
[00381] Твердые лекарственные формы для перорального введения включают, например, капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых лекарственных формах соединения или соли обычно объединяют с одним или более эксципиентами. При введении per os, соединения или соли могут быть смешаны, например, с лактозой, сахарозой, порошкообразным крахмалом, сложными эфирами целлюлозы и алкановых кислот, сложными алкилэфирами целлюлозы, тальком, стеариновой кислотой, стеаратом магния, оксидом магния, натриевыми и кальциевыми солями фосфорной и серной кислот, желатином, акациевой камедью, альгинатом натрия, поливинилпирролидоном и/или поливиниловым спиртом, а затем таблетированы или инкапсулированы для удобства применения. Такие капсулы или таблетки могут содержать составы с контролируемым высвобождением, которое может обеспечиваться, например, дисперсией соединения или соли в гидроксипропилметилцеллюлозе. В случае капсул, таблеток и пилюль, лекарственные формы также могут содержать буферные агенты, такие как цитрат натрия или карбонат или бикарбонат магния или кальция. Таблетки и пилюли дополнительно могут быть получены с кишечнорастворимыми покрытиями.
[00382] Жидкие лекарственные формы для перорального введения включают, например, фармацевтически приемлемые эмульсии (в том числе, как эмульсии масло-в-воде, так и эмульсии вода-в-масле), растворы (в том числе, как водные растворы, так и неводные растворы), суспензии (в том числе, как водные, так и неводные суспензии), сиропы и эликсиры, содержащие инертные разбавители, обычно применяемые в этой области (например, воду). Такие композиции также могут содержать, например, увлажняющие, эмульгирующие, суспендирующие, вкусо-ароматические (например, подстастители) и/или ароматизирующие добавки.
[00383] Парентеральное введение включает подкожные инъекции, внутривенные инъекции, внутримышечные инъекции, внутригрудинные инъекции и инфузию. Инъецируемые препараты (например, стерильные инъецируемые водные или масляные суспензии) могут быть получены в соответствии с известным уровнем техники, используя подходящие диспергирующие, увлажняющие агенты и/или суспендирующие агенты. Подходящие наполнители и растворители включают, например, воду 1,3-бутандиол, раствор Рингера, изотонический раствор хлорида натрия, легкие нелетучие масла (например, синтетические моно- или диглицериды), жирные кислоты (например, олеиновую кислоту), диметилацетамид, поверхностно-активные вещества (например, ионные и неионные детергенты), и/или полиэтиленгликоли.
[00384] Составы для парентерального введения, например, могут быть получены из стерильных порошков или гранул, содержащих один или более из упомянутых эксципиентов для применения в составах для перорального применения. Соединение или соль по настоящему изобретению можно растворить в воде, полиэтиленгликоле, пропиленгликоле, этаноле, кукурузном масле, хлопковом масле, арахисовом масле, кунжутном масле, бензиловом спирте, хлориде натрия и/или различных буферах. При необходимости, рН можно установить с использованием подходящей кислоты, основания или буфера.
[00385] Суппозитории для ректального введения могут быть получены, например, путем перемешивания соединения или соли по настоящему изобретению с подходящим нераздражающим эксципиентом, который является твердым при обычных температурах, но жидким при ректальной температуре, и будет, следовательно, плавиться в прямой кишке с высвобождением лекарственного средства. Подходящие эксципиенты включают, например, масло какао, синтетические моно-, ди-, или триглицериды, жирные кислоты и/или полиэтиленгликоли.
[00386] Местное применение включает использование чрескожного введения, такого как чрескожные пластыри или устройства для ионтофореза.
[00387] Также могут быть использованы другие эксципиенты и способы введения, известные в фармацевтической области.
[00388] Заявителями было установлено, что некоторые соединения I-L1, в которых R6 и фенилурацил находятся в транс-положении относительно двойной связи, при нахождении в растворе, имеют тенденцию к превращению в соответствующий цис-изомер под воздействием света; следовательно, может быть желательным хранить такие растворы в условиях, при которых уменьшается воздействие света (например, в сосуде из желтого стекла или в темном месте).
[00389] Предпочтительная суммарная суточная доза соединения или соли (введенная в однократной или дробных дозах) обычно составляет примерно от 0,001 примерно до 100 мг/кг, более предпочтительно, примерно от 0,001 примерно до 30 мг/кг, и еще более предпочтительно примерно от 0,01 примерно до 10 мг/кг (т.е., мг соединения или соли на кг массы тела). Единичная доза композиций может содержать такие количества или их доли для получения суточной дозы. Во многих случаях, введение соединения или соли будет повторяться большое количество раз. Многократные суточные дозы обычно могут быть использованы для повышения общей суточной дозы, при необходимости.
[00390] Факторы, влияющие на предпочтительный режим дозирования, включают в себя тип, возраст, массу тела, пол, рацион питания и состояние пациента; тяжесть патологического состояния; путь введения; фармакологические факторы, такие как активность, эффективность, фармакокинетический и токсикологический профили конкретного применяемого соединения или соли; используется ли система доставки лекарственного средства; и вводится ли соединение или соль как часть комбинации лекарственных средств. Таким образом, фактически используемый режим дозирования может варьировать в широких пределах, и, следовательно, может быть получен из предпочтительного режима дозирования, изложенного выше.
I. Наборы.
[00391] Настоящее изобретение также относится, частично, к набору, содержащему одно или более соединений и/или солей по изобретению. Набор необязательно может содержать один или более дополнительных терапевтических агентов и/или инструкции, например, по применению этого набора.
J. Способы применения.
[00392] Настоящее изобретение также относится, частично, к способу ингибирования репликации РНК-вируса. Этот способ включает в себя воздействие на вирус одним или более соединениями и/или солями по настоящему изобретению. В некоторых вариантах осуществления, репликацию РНК-вируса ингибируют in vitro. В других вариантах осуществления, репликацию РНК-вируса ингибируют in vivo. В некоторых вариантах осуществления, РНК-вирус, репликацию которого ингибируют, представляет собой односпиральный положительно полярный РНК-вирус. В некоторых таких вариантах осуществления, РНК-вирус, репликацию которого подавляют, представляет собой вирус семейства Flaviviridae. В некоторых таких вариантах осуществления, РНК-вирус, репликацию которого подавляют, представляет собой HCV.
[00393] Настоящее изобретение также относится, в части, к способу ингибирования РНК полимеразы HCV. Этот способ включает в себя воздействие на полимеразу одним или более соединениями и/или солями по настоящему изобретению. В некоторых вариантах осуществления, активность РНК полимеразы HCV ингибируют in vitro. В других вариантах осуществления, активность РНК полимеразы HCV ингибируют in vivo.
[00394] Термин «ингибирование» означает снижение уровня репликации РНК-вируса/активности полимеразы HCV либо in vitro, либо in vivo. Например, если соединение/соль по настоящему изобретению снижает уровень репликации РНК-вируса по меньшей мере примерно на 10% по сравнению с уровнем репликации РНК-вируса до воздействия на вирус соединением/солью, тогда соединение/соль ингибирует репликацию РНК вируса. В некоторых вариантах осуществления, соединение/соль может ингибировать репликацию РНК-вируса по меньшей мере примерно на 20%, по меньшей мере примерно на 30%, по меньшей мере примерно на 40%, по меньшей мере примерно на 50%, по меньшей мере примерно на 60%, по меньшей мере примерно на 70%, по меньшей мере примерно на 80%, по меньшей мере примерно на 90%, или по меньшей мере примерно на 95%.
[00395] Настоящее изобретение относится, частично, к способу лечения заболевания, которое можно вылечить путем ингибирования РНК полимеразы HCV. Таким образом, настоящее изобретение также относится, частично, к способу лечения гепатита С у животного, нуждающегося в таком лечении. Эти способы включают в себя введение животному одного или более соединений и/или солей по настоящему изобретению, и, необязательно, один или более дополнительных фармацевтических агентов. В некоторых вариантах осуществления, животному вводят терапевтически эффективное количество соединения(й) и/или соли(солей). «Лечение» означает облегчение, подавление, эрадикацию, профилактику, снижение риска и/или задержку появления заболевания, подвергаемого лечению. Заявители особенно имеют в виду, что термин «лечение» охватывает введение соединений и/или солей по настоящему изобретению, HCV-негативному пациенту, который является кандидатом на трансплантацию органа. Способы лечения в частности подходят для применения у людей, но могут быть использованы у других животных, в частности, млекопитающих. «Терапевтически-эффективным количеством» или «эффективным количеством» является количество, при котором будет достигаться цель лечения целевого состояния.
[00396] В некоторых вариантах осуществления, эти способы включают в себя комбинированную терапию, где соединение(я) и/или соль(и) по изобретению вводят совместно со вторым (или даже третьим, четвертым, и т.д.) соединением, например, таким как другое терапевтическое средство, используемое для лечения гепатита С (например, интерферона или комбинации интерферон/рибавирин, или ингибитора HCV, например, такого, как ингибитор HCV полимеразы или ингибитор HCV протеазы). Соединение(я) и/или соль(и) по настоящему изобретению также могут быть введены совместно с терапевтическими средствами, отличными от терапевтических средств, используемых для лечения гепатита С (например, средствами против ВИЧ). В этих вариантах осуществления совместного введения, соединение(я) и/или соль(и) по настоящему изобретению и второе, и т.д., терапевтическое средство(а) можно вводить по существу одновременно (например, в пределах примерно 5 минут друг от друга), последовательно, или и тем, и другим способом. Предполагается, что такие комбинированные способы лечения могут включать введение одного терапевтического средства большое количество раз между введениями другого. Период времени между введением каждого средства может находиться в диапазоне от нескольких секунд (или менее) до нескольких часов или дней, и будет зависеть, например, от свойств каждой композиции и активного ингредиента (например, эффективности, растворимости, биодоступности, периода полужизни и кинетического профиля), а также состояния пациента. Соединение(я) и/или соль(и) по настоящему изобретению и второе, и т.д. терапевтическое средство можно также вводить в одной композиции.
[00397] Настоящее изобретение также относится, частично, к применению одного или более соединений и/или солей по настоящему изобретению, и, необязательно, одного или более дополнительных терапевтических средств для получения лекарственного средства. В некоторых вариантах осуществления, лекарственное средство предназначено для совместного введения с одним или более дополнительными терапевтическими агентами.
[00398] В некоторых вариантах осуществления, лекарственное средство предназначено для ингибирования репликации РНК-вируса.
[00399] В некоторых вариантах осуществления, лекарственное средство предназначено для лечения гепатита С.
[00400] Настоящее изобретение также относится, частично, к одному или более соединениям и/или солям по настоящему изобретению, и, необязательно, одному или более дополнительным терапевтическим средствам, для использования в качестве лекарственного средства. В некоторых вариантах осуществления, лекарственное средство предназначено для ингибирования репликации РНК-вируса. В других вариантах осуществления, лекарственное средство предназначено для лечения гепатита С.
K. Промежуточные соединения.
[00401] Настоящее изобретение также относится, частично, к промежуточным соединениям, которые соответствуют по структуре формуле II, которые могут быть использованы для получения соединений формулы I (и их солей), (хотя некоторые промежуточные соединения также могут быть использованы, также как и соединения формулы I, в качестве ингибиторов HCV, и специалист в данной области может определить такую способность соединений формулы II путем использования, например, способов, рассмотренных ниже):

[00402] В формуле II:

X2 представляет собой гало.
[00403] Различные варианты воплощения для

[00404] Различные варианты воплощения для

[00405] В некоторых вариантах осуществления, соединения формулы II соответствуют по структуре формуле IIA:

[00406] В других вариантах осуществления, соединения формулы II соответствуют по структуре формуле IIB:

[00407] В некоторых вариантах воплощения соединений формулы II:
R41 выбран из группы, состоящей из водорода, метила и азот-защищающей группы;
R2 выбран из группы, состоящей из водорода и галогена;
R3 выбран из группы, состоящей из водорода и галогена;
R4 выбран из группы, состоящей из C1-C4-алкила, С3-С6-карбоциклила и 5-6-членного гетероциклила, где:
(a) С1-С4-алкил необязательно замещен заместителями, вплоть до трех, независимо выбранными из группы, состоящей из гало, оксо, гидрокеи, алкилокси и триметилсилила, и
(b) С3-С6-карбоциклил и 5-6-членный гетероциклил необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из алкила, гало и алкилсульфониламино;
R5 выбран из группы, состоящей из водорода, гидрокеи, алкилокси и гало; и
X2 выбран из группы, состоящей из хлора, брома и йода.
[00408] В некоторых вариантах воплощения соединений формулы II:

R1 представляет собой водород;
R2 выбран из группы, состоящей из водорода и галогена;
R3 представляет собой водород;
R4 представляет собой трет-бутил;
R5 выбран из группы, состоящей из водорода, гидрокеи и метокси; и
X2 выбран из группы, состоящей из брома и йода.
[00409] В некоторых вариантах воплощения соединений формулы II:
R1 выбран из группы, состоящей из водорода и метила;
R2 выбран из группы, состоящей из водорода и метила;
R3 выбран из группы, состоящей из водорода и метила;
R4 представляет собой трет-бутил;
R5 выбран из группы, состоящей из гидрокси и метокси; и
X2 выбран из группы, состоящей из хлора, брома и йода.
[00410] В некоторых вариантах воплощения соединений формулы II:

R1 представляет собой водород;
R2 представляет собой водород;
R3 представляет собой водород;
R4 представляет собой трет-бутил;
R5 выбран из группы, состоящей из гидрокси и метокси; и
X2 выбран из группы, состоящей из хлора, брома и йода.
[00411] В некоторых вариантах осуществления, соединение формулы II выбрано из группы, состоящей из



[00412] Приведенное ниже описание предоставляет инструкции по получению промежуточных соединений формулы II (и их солей).
L. Исходные соединения.
[00413] Настоящее изобретение также относится, частично, к исходным соединениям, которые соответствуют по структуре формуле III, которые могут быть использованы для получения соединений формул II и I (и их солей):

[00414] В формуле III,



[00415] В некоторых вариантах воплощения соединений формулы III:
R1 выбран из группы, состоящей из водорода, метила и азот-защищающей группы;
R2 выбран из группы, состоящей из водорода и галогена; и
R3 выбран из группы, состоящей из водорода и галогена.
[00416] В некоторых вариантах воплощения соединений формулы III:

R1 выбран из группы, состоящей из водорода;
R2 выбран из группы, состоящей из водорода и галогена; и
R3 выбран из группы, состоящей из водорода.
[00417] В некоторых вариантах воплощения соединений формулы III:
R1 выбран из группы, состоящей из водорода и метила;
R2 выбран из группы, состоящей из водорода и метила; и
R3 выбран из группы, состоящей из водорода и метила.
[00418] В некоторых вариантах осуществления, соединение формулы III представляет собой урацил.
[00419] Настоящее изобретение также относится, частично, к исходным соединениям, которые соответствуют по структуре формуле IV, которые могут быть использованы для получения соединений формул II и I (и их солей):

[00420] В формуле IV:
R4, R5, и X2 рассмотрены выше для соединений формулы I и II; и
X1 представляет собой гало.
[00421] Различные варианты воплощения для R4, R5, и X2 (а также их сочетаний), рассмотренные выше, применимы для соединений формулы IV. Что касается X1, в некоторых вариантах осуществления, X1 выбран из группы, состоящей из хлора, брома и йода. В других вариантах осуществления, X1 выбран из группы, состоящей из хлора и брома. Еще в одних вариантах осуществления, X1 выбран из группы, состоящей из хлора и йода. В других вариантах осуществления, X1 выбран из группы, состоящей из йода и брома. В дополнительных вариантах осуществления, X1 представляет собой фтор. Еще в дополнительных вариантах осуществления, X1 представляет собой хлор. Еще в дополнительных вариантах осуществления, X1 представляет собой бром. И еще в дополнительных вариантах осуществления, X1 представляет собой йод. Что касается X1 и X2, в некоторых вариантах осуществления, X1 и X2 являются идентичными.
[00422] Различные варианты воплощения для R4, R5, X1, и X2 рассмотренные выше, могут быть объединены с получением различных вариантов воплощения соединений формулы IV, и все варианты воплощения соединений формулы III, полученные таким образом, входят в объем представленного Заявителями изобретения. Некоторые варианты воплощения соединений формулы IV (и их солей), приведенные в качестве примера, рассмотрены ниже.
[00423] В некоторых вариантах воплощения соединений формулы IV:
R4 выбран из группы, состоящей из C1-C4-алкила, С3-С6-карбоциклила и 5-6-членного гетероциклила,где:
(a) С1-С4-алкил необязательно замещен заместителями, вплоть до трех, независимо выбранными из группы, состоящей из гало, оксо, гидрокси, алкилокси и триметилсилила, и
(b) С3-С6-карбоциклил и 5-6-членный гетероциклил необязательно замещены одним или более заместителями, независимо выбранными из группы, состоящей из алкила, гало и алкилеульфониламино;
R5 выбран из группы, состоящей из водорода, гидрокси и алкилокси;
X1 выбран из группы, состоящей из хлора, брома и йода; и
X2 выбран из группы, состоящей из хлора, брома и йода.
[00424] В некоторых вариантах воплощения соединений формулы IV:
R4 выбран из группы, состоящей из трет-бутила;
R5 выбран из группы, состоящей из водорода, гидрокси и метокси;
X1 выбран из группы, состоящей из брома и йода; и
X2 выбран из группы, состоящей из брома и йода.
[00425] В некоторых вариантах воплощения соединений формулы IV:
R4 выбран из группы, состоящей из трет-бутила;
R5 выбран из группы, состоящей из гидрокси и метокси;
X1 выбран из группы, состоящей из хлора, брома и йода; и
X2 выбран из группы, состоящей из хлора, брома и йода.
[00426] В некоторых вариантах воплощения соединений формулы IV:
R4 представляет собой трет-бутил;
R5 выбран из группы, состоящей из гидрокси и метокси;
X1 выбран из группы, состоящей из хлора, брома и йода; и
X2 выбран из группы, состоящей из хлора, брома и йода.
[00427] В некоторых вариантах осуществления, соединение формулы IV выбрано из группы, состоящей из



[00428] Приведенное ниже описание предоставляет инструкции по получению исходных соединений формулы IV (и их солей).
L. Способы получения.
[00429] Настоящее изобретение также относится, в частности, к способу получения соединений формулы II. Способ включает реакцию соединения формулы III с соединением формулы IV в присутствии (i) в качестве катализатора соли меди (1) и (ii) азотсодержащего гетероарильного лиганда:

[00430] В указанном выше процессе R1, R2, R3, R4, R5, X1, и X2 имеют указанные выше значения.
[00431] Заявители установили, что процесс в основном заключается в замещении водорода у атома азота N1 урацилового производного III с получением промежуточного соединения II. Когда X2промежуточного соединения II представляет собой хлор, бром или йод, тогда соединение II пригодно для последующей реакции (например, реакции сочетания Сузуки с соответствующей бороновой кислотой или боронатным эфиром) с получением соединения формулы I. Другими словами, когда X2 в промежуточном соединении II представляет собой хлор, бром или йод, то указанный выше процесс пригоден для получения соединений формулы I.
[00432] В ряде воплощений изобретения соединение III представляет собой урацил и соединение IV соответствует по структуре соединению, выбранному из группы, состоящей из соединения IV-I, IV-Br и IV-Cl, при этом в случае соединений IV-I и IV-Br выход обычно лучше, чем в случае соединения IV-Cl.
[00433] Пригодные медные катализаторы Cu(1) включают, например, CuI, CuBr, CuCl, Cu2O и СН3С(O)OCu. В ряде воплощений изобретения катализатор выбирают из группы, состоящей из CuI и CuBr. В одном из таких воплощений изобретения катализатор представляет собой CuI. В другом из таких воплощений изобретения катализатор представляет собой CuBr.
[00434] В ряде воплощений изобретения процесс ведут в присутствии основания. В одном из таких воплощений изобретения основание является неорганическим основанием. Пригодные неорганические основания включают, например, соли натрия, калия и цезия (например, K2CO3, K3PO4, Cs2CO3, Na2CO3). В ряде воплощений изобретения основание выбирают из группы, состоящей из соли калия или соли цезия. В одном из таких воплощений изобретения соль выбирают из группы, состоящей из K3PO4 и Cs2CO3. В ряде воплощений изобретения основание включает соль калия. В одном из таких воплощений изобретения соль калия представляет собой K2CO3. В другом из таких воплощений соль калия представляет собой K3PO4. В ряде воплощений изобретения основание включает соль цезия. В одном из таких воплощений соль цезия представляет собой Cs2CO3.
[00435] Обычно процесс ведут в присутствии растворителя. Пригодные растворители включают, например, диметилсульфоксид (ДМСО), диметилформамид (ДФА) и ацетонитрил (MeCN). В некоторых воплощениях изобретения растворитель представляет собой ДМСО.
[00436] Обычно процесс ведут при температуре приблизительно от 40 приблизительно до 130°С.
[00437] В одних воплощениях изобретения азотсодержащий гетероарильный лиганд включает 8-гидроксихинолин. В других воплощениях изобретения лиганд включает 2-(2-пиридил)-бензимидазол. Еще в других воплощениях изобретения лиганд включает пиколинамидное соединение, соответствующее по структуре формуле V:
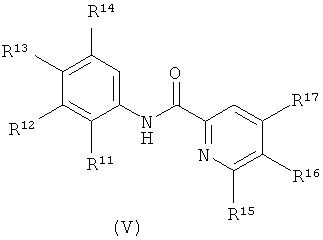
[00438] В формуле V R11, R12, R13, R14, R15, R16 и R17 независимо выбраны из группы, состоящей из водорода, C1-4-перфторалкила, C1-4-алкокси, C1-4-галоалкила, хлора или циано. В некоторых воплощениях изобретения R11, R12, R13, R14, R15, R16 и R17 независимо выбраны из группы, состоящей из водорода, метила, метокси, трифторметила, хлора или циано. В одних воплощениях изобретения лиганд фомулы V включает N-(4-цианофеил)пиколинамид. В других воплощениях изобретения лиганд фомулы V включает N-(2-цианофенил)пиколинамид.
[00439] В ряде воплощений изобретения способ включает (а) получение соединения формулы IV; и (b) реакцию соединения формулы Ш с соединением формулы IV в присутствии (i) в качестве катализатора соли меди (1) и (ii) азотсодержащего гетероарильного лиганда необязательно в присутствии неорганического основания.
[00440] Соединение формулы IV-I может быть получено, например, превращением 2-трет-бутилфенола в 2-трет-бутил-4,6-дийодфенол (например, путем его взаимодействия с NaI и NaOCl), и затем превращением 2-трет-бутил-4,6-дииодфенола в 1-трет-бутил-3,5-дийод-2-анизол (например, обработкой его CH3I в присутствии основания, такого как, например, NaOH).

[00441] Соединение формулы IV-Br может быть получено, например, превращением 2-трет-бутилфенола в 2,4-дибром-6-трет-бутилфенол (например, путем его взаимодействия с 1,3-дибром-5,5-диметилимидазолидин-2,4-дионом) и затем превращением 2,4-дибром-6-трет-бутилфенола в 1,5-дибром-3-трет-бутил-2-анизол (например, его обработкой СНз1 в присутствии KOtBu).
[00442] Дополнительная информация о получении соединений формулы I и II (и их солей) имеется в приведенных ниже общих пояснениях и/или в приведенных ниже конкретных примерах синтеза. В приведенных ниже общих пояснениях R1, R2, R3, R4, R5, L, RA, RB, RC, RD, R6, RE, RF, RG, RH, RI, RJ, RK, X1 и X2 имеют, если не указано иначе, указанные выше значения.
Схема 1

[00443] Соединение (1-1), где R7 представляет, например, водород или -CO2Me, и R8 представляет, например, водород или т-бутил, может быть обработано азотной кислотой в растворителе, таком как, например, уксусная кислота или вода, при температуре приблизительно от 0 приблизительно до 35°С в течение примерно от 1 до примерно 5 часов с получением соединения (1-2). Затем соединение (1-2) может быть восстановлено в известных для специалиста условиях с получением соответствующего анилина (1-3). Типичные условия для такого восстановления включают использование водорода при давлении примерно от 1 до примерно 5 атмосфер в присутствии катализатора, такого как, например, палладий или платина на угле, в растворителе, таком как, например, тетрагидрофуран, этилацетат, этанол или гексан при температуре окружающей среды или около нее в течение примерно 1-12 часов. В зависимости от наличия функциональных групп, более оптимальной может быть иная процедура восстановления, например, использование железных опилок в присутствии слабой кислоты, такой как, например, хлорид аммония или разбавленная соляная кислота, при температуре дефлегмации в смеси растворителей, содержащей, например, метанол, воду и/или тетрагидрофуран, в течение, примерно, 1-12 часов. Другие условия восстановления включают использование борогидрида натрия в смеси растворителей, такой как, например, вода и тетрагидрофуран. Еще другие условия восстановления включают использование хлорида олова (II) в присутствии соляной кислоты в таких растворителях, как, например, вода и метанол или их смесь.
[00444] Соединение (1-2) перед восстановлением может быть модифицировано. Например, обработка соединения (1-2), где R7 представляет собой водород, хлористым йодом в смеси метанол - вода при температуре окружающей среды в течение примерно 8-24 часов дает соединение (1-4), где X1 представляет собой йод. Альтернативно, соединение (1-2) может быть обработано пербромидом пиридингидробромида в растворителе, таком как, например, уксусная кислота при температуре окружающей среды или вблизи нее в течение примерно 2-16 часов с получением соединения (1-4), где X1 представляет бром. Модификации могут быть осуществлены по фенольному фрагменту соединения (1-4). Например, фенол может быть алкилирован галоидными алкилами (например, метил йодидом), алкилсульфатами (например, метилсульфатом), галоидными алкенилами (например, аллилбромидом), галоидными алкинилами (например, пропаргилбромидом) в присутствии основания, такого как, например, карбонат калия в ацетоне, гидрид натрия в диметилформамиде или т-бутилат калия в тетрагидрофуране, при температуре от примерно 0 до примерно 35°С в течение примерно 1-24 часов с получением соединения (1-5), где R9 представляет, например, алкил, алкенил или алкинил. Альтернативно, алкилирование можно осуществить, используя такой реагент, как (триметилсилил) диазометан в растворителе, таком как, например, метанол или т-бутил метиловый эфир или их смесь, в запаянной трубке при комнатной температуре или около нее в течение примерно 8-24 часов. Соединение (1-5) может быть в дальнейшем восстановлено до соединения (1-6), используя железные опилки или хлорид олова (II) в описанных выше условиях. Альтернативный процесс восстановления использует гидрогенизацию при давлении приблизительно 1 атмосфера в присутствии катализатора, такого как 5% платина на сульфиде углерода, в растворителе, таком как метанол. Защита полученного анилинового соединения (1-6), например, т-бутилкарбаматом может быть осуществлена путем его обработки ди-трет-бутилдикарбонатом в растворителе, таком как, например, тетрагидрофуран или диоксан при температуре приблизительно от 50 до приблизительно 65°С в течение примерно 1-8 часов с получением соединения (1-7).
[00445] Модификации могут быть осуществлены по фенольному фрагменту соединения (1-2). Специалист в данной области может осуществить алкилирование фенольной части соединения (1-2) используя, например, описанные выше условия с получением соединения (1-8). Соединение (1-8) превращают в соединение (1-9) используя, например, одно или более из описанных выше подходящих условий.
[00446] Другая модификация фенольной группы в соединении (1-2) заключается в сульфонилировании до конечного соединения (1-8), где R9 представляет алкилсульфонил, карбоциклилсульфонил или галоидалкилсульфонил. Такое соединение может быть получено обработкой соединения (1-2) сульфохлоридом, таким как, например, метансульфохлорид, циклогексансульфохлорид, бензолсульфохлорид или 3-хлорпропансульфохлорид в присутствии основания, такого как, например, триэтиламин, диизопропилэтиламин или пиридин, в растворителе, таком как, например, дихлорметан при температуре окружающей среды или около нее в течение примерно от 1 до 24 часов. Специалист в данной области может осуществить превращение соединения (1-8) в соединение (1-9), используя подходящие условия восстановления.
Схема 2
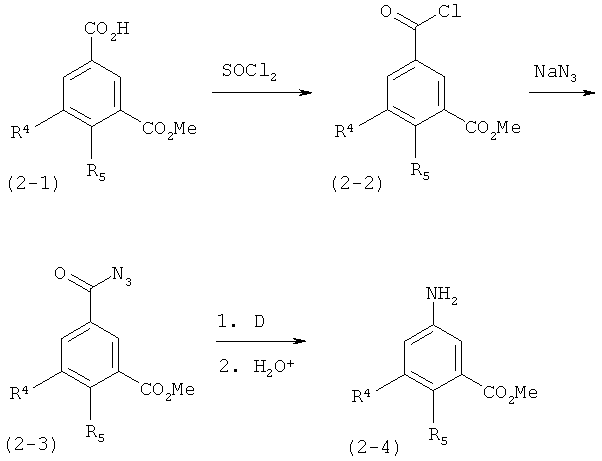
[00447] Анилин (2-4) может быть получен, используя перегруппировку Курциуса. Для этого соединение (2-1), где R4 не является амино, обрабатывают каталитическим количеством диметилформамида при нагревании с обратным холодильником в тионилхлориде в течение примерно от 1 примерно до 4 часов с получением хлорангидрида (2-2). Соединение (2-2) также может быть получено обработкой при температуре флегмы тионилхлоридом в растворителях, таких как, например, хлороформ или толуол. Соединение (2-2) можно также подвергать взаимодействию с водным раствором азида натрия в среде растворителя, такого как, например, ацетон, в течение примерно 1-8 часов с получением ацилазида (2-3). Затем соединение (2-3) может быть подвергнуто перегруппировке Курциуса в растворителях, таких как диоксан или толуол, при нагревании с обратным холодильником. Промежуточный изоцианат подвергают гидролизу водной кислотой, такой как разбавленная соляная кислота в среде растворителя, такого как диметоксиэтан, с получением соединения (2-4).
Схема 3

[00448] Соединение (3-1), где R10 представляет, например, водород, бром, йод или -CO2Me, может быть обработано акриловой кислотой при температуре окружающей среды или около нее в среде растворителя, такого как, например, толуол с последующим нагреванием с обратным холодильником в течение примерно от 15 примерно до 48 часов с получением соединения (3-2). При использовании избытка акриловой кислоты получают соединение (3-3). Соединение (3-2) или (3-3) можно обработать мочевиной в растворителе, таком как, например, уксусная кислота приблизительно при 100-120°С в течение примерно от 2 примерно до 48 часов с получением соединения (3-4).
Схема 4

[00449] Соединение (4-2) можно получить из соединения (3-1) путем его растворения в растворителях, таких как, например, диметилформамид или диметилацетамид, с последующим добавлением бензольного раствора (Е)-3-метоксиакрилоилизоцианата (полученного как описано в Santana, L.; et al. J. Heterocyclic Chem. 1999, 36, 293-295.) при температуре примерно от -40 примерно до -15°С в инертной атмосфере, и затем нагреванием до температуры окружающей среды в течение примерно от 30 мин примерно до 4 часов. Соединение (4-2) может быть обработано кислотой, такой как, например, серная кислота, в смеси этанол-вода при диапазоне температур примерно от 90 примерно до 110°С в течение примерно 1-8 часов с получением соединения (4-3). Альтернативно, можно осуществить циклизацию соединения (4-2) до урацила (4-3) в основной среде, как описано Ueno, Y.; et al. J. Org. Chem. 70:7925-7935 (2005).
Схема 5

[00450] Соединение (9-1) может быть обработано тионилхлоридом при нагревании с обратным холодильником в течение примерно от 1 примерно до 4 часов с получением хлорангидрида (9-2). Обработка тионилхлоридом при температуре флегмы в растворителях, таких как, например, хлороформ или толуол также приводит к образованию соединения (9-2). Соединение (2) превращают в соответствующий альдегид (9-3) восстановлением с помощью литий три-т-бутоксиалюминий гидрида в растворителе, таком как, например, тетрагидрофуран, примерно при -78°С в течение примерно 1-8 часов. Восстановление можно также осуществить, используя обработку хлоридом индия и гидридом трибутилолова в присутствии трифенилфосфина в растворителе, таком как тетрагидрофуран или толуол при температуре примерно от - 40 примерно до 0°С. Соединение (9-3) может быть обработано соединением (9-4) в присутствии основания, такого как т-бутилат калия, в растворителе, таком как дихлорметан, при комнатной температуре или вблизи нее в течение примерно от 1 до примерно 8 часов с получением соединения (9-5).
Схема 6

[00451] Соединение (10-1), где X1 представляет собой галоген (например, бром, йод) можно подвергнуть реакции сочетания Сузуки с винилбороной кислотой (10-2) с получением соединения (10-3). Обычно реакция требует использования основания и катализатора. Примеры оснований включают, например, карбонат калия, фосфат калия, т-бутилат калия, карбонат натрия, карбонат цезия и фторид цезия. Примеры катализаторов включают, например, трис(дибензилидинацетон)дипалладий (0), ацетат палладия, бис(трифенилфосфин)палладий (II) хлорид, тетракис(трифенилфосфин)палладий, дихлор[1,1'-бис(ди-трет-бутилфосфин)ферроцен] палладий (II) или аддукт дихлор[1,1'-бис(дифенилфосфин)ферроцен] палладий (II)/дихлорметан. Реакцию можно проводить в растворителе, таком как, например, вода, диоксан, диметокеиэтан, диметилформамид, толуол, этанол, тетрагидрофуран и т.д. или их смесь. Реакцию можно проводить при окружающей температуре или выше.
Схема 7

[00452] Соединение (11-1) можно превратить в соединение (11-2) обработкой диазометаном в растворителе, таком как, например, тетрагидрофуран, в присутствии ацетата палладия при комнатной температуре или около нее в течение примерно от 30 мин до примерно 4 часов.
Схема 8

[00453] Соединение (11-1) подвергают восстанавлению с получением соединения (14-2). Типичные условия восстановления включают использование водорода при давлении примерно от 1 примерно до 5 атмосфер в присутствии катализатора, такого как, например, палладий или платина на угле, в растворителе, таком как, например, тетрагидрофуран, этилацетат, этанол или гексан при температуре окружающей среды или вблизи нее в течение примерно от 1 примерно до 12 часов.
Схема 9

[00454] Соединение (15-1) может быть превращено в соединение (15-2) в две стадии. Начальная стадия включает восстановление ароматической нитрогруппы железными опилками в присутствии слабой кислоты, такой как, например, хлорид аммония или разбавленная соляная кислота, при температуре от примерно от 60 до примерно 80°С в смеси растворителей, содержащей, например, метанол, воду и тетрагидрофуран, в течение, примерно от 1 примерно до 12 часов. Вторая стадия представляет собой выдерживание полученного на первой стадии анилина с метансульфонилхлоридом в присутствии основания, такого как пиридин, в растворителе, таком как дихлорметан, при температуре окружающей среды или около нее.
Схема 10

[00455] Соединение (17-1) может быть обработано метансульфонилхлоридом в присутствии основания, такого как, например, пиридин, в растворителе, таком как, например, дихлорметан, с получением мезилатного соединения (17-2). Выдерживание соединения (17-3) с комплексом боран-диметилсульфид в растворителе, таком как, например, тетрагидрофуран, примерно при 0-10°С приводит к получению соединения (17-4). Соединения (17-2) и (17-4) могут быть связаны с ацетальдегидом в тетрагидрофуране при нагревании с обратным холодильником. Последующая обработка водой при комнатной температуре приводит к получению соединения (17-5).
Схема 11

[00456] Карбоновая кислота (18-1) может быть восстановлена боран-тетрагидрофурановым комплексом при нагревании с получением спирта (18-2). Соединение (18-2) может быть превращено в соответствующий бромид (18-3) с помощью N-бромсукцинимида и трифенилфосфина в среде растворителя, такого как, например, дихлорметан, при комнатной температуре в течение нескольких часов. Обработка соединения (18-3) триэтилфосфитом примерно при 120°С в течение примерно от 1 до примерно 3 часов дает соединение (18-4). Соединение (18-4) может быть использовано, например, для получения соединения (9-5) как описано в Схеме 5.
Схема 12

[00457] Бензальдегид (19-1) может быть обработан диэтилфосфонатом в присутствии основания, такого как, например, метилат натрия, в растворителе, таком как, например, метанол, при комнатной температуре с получением соединения (19-2). Соединение (19-2) может быть обработано N-хлорсукцинимидом и трифенилфосфином в дихлорметане при комнатной температуре с получением соединения (19-3). Соединение (19-2) можно также ввести в реакцию с (диэтиламино)трифторидом серы (DAST) с получением соединения (19-4).
[00458] Соединение (19-1) может также быть обработано п-толуолсульфоновой кислотой и триметилортоформиатом в метаноле примерно при 50°C с получением ацеталя (19-5). Соединение (19-5) может также быть превращено в соединение (19-6) выдерживанием с триэтилфосфитом и диэтилэфиратом трехфтористого бора при температуре примерно от -20°С до примерно температуры окружающей среды.
[00459] Соединения (19-3), (19-4) и (19-6) могут быть использованы, например, для получения соединения (9-5), как описано в Схеме 5.
Схема 13

[00460] Фенол (20-1), где R4 является отличным от амино, обрабатывают источником электрофильного галида, таким как, например, монохлорид йода, с получением дигалогенированного соединения (20-2), где X1 и X2 независимо представляют бром или йод. Соединение (20-2) превращают в соединение (20-3) взаимодействием алкилирующего агента, такого как, например, метилсульфат, с основанием, таким как, например, карбонат калия, при нагревании с обратным холодильником в ацетоне. Альтернативно, метилйодид в присутствии основания, такого как, например, т-бутилат калия, в растворителе, таком как, например, тетрагидрофуран или диметилформамид, также дает соединение (20-3). Еще в одной альтернативе соединение (20-2) может быть прометилировано (триметилсилил)диазометаном в растворителе, таком как, например, т-бутилметиловый эфир. Соединение (20-3) можно ввести в реакцию с урацилом, лигандом (20-4), йодидом меди (I) и фосфатом калия в диметилеульфоксиде при температуре примерно от 40°С примерно до 100°C с получением соединения (20-5).
[00461] Например, когда в соединении (20-3) R4 представляет собой трет-бутил, X1 представляет собой йод и X2 представляет собой йод или бром, соединение (20-3) можно смешивать с урацилом и соединением (20-4) в присутствии CuI и K2PO4 в ДМСО в течение примерно 15-24 часов примерно при 60°C с получением соединения (20-5). Вместо лиганда (20-4) для изготовления (20-5) можно использовать 8-гидроксихинолин и 2-(2-пиридил)-бензимидазол.
Схема 14
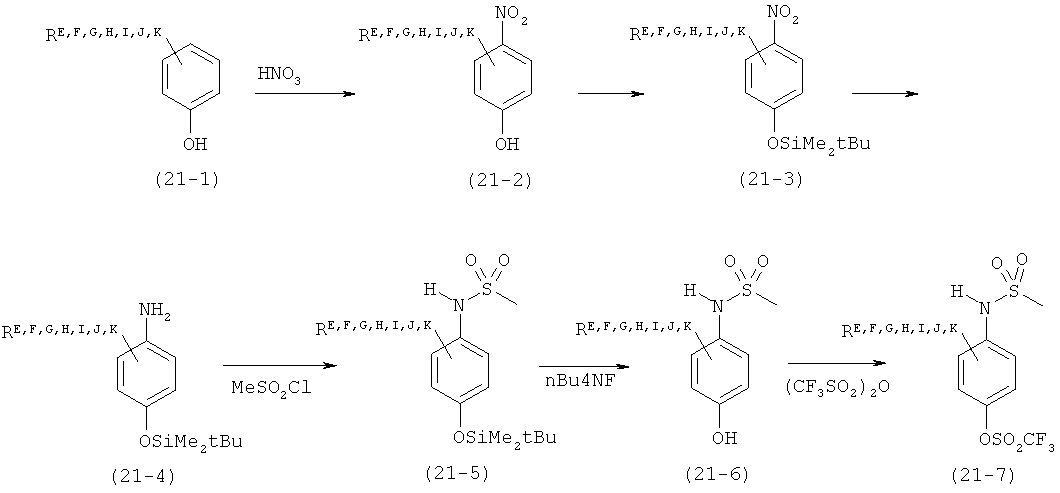
[00462] Можно осуществить нитрование соединения (21-1) азотной кислотой в уксусной кислоте при температуре примерно от 10 примерно до 15°C с получением соединения (21-2). Фенольная часть соединения (21-2) может быть защищена силиловым эфиром, например, т-бутилдиметилсилиловым эфиром, путем обработки силилхлоридом, таким как, например, т-бутилдиметилсилилхлорид, и имидазолом в растворителе, таком как, например, диметилформамид при температуре окружающей среды с получением соединения (21-3). Затем соединение (21-3) может быть восстановлено в известных для специалиста условиях с получением соответствующего анилина (21-4).
[00463] Типичные условия такого восстановления включают использование водорода при давлении примерно 1 - 5 атмосфер в присутствии катализатора, такого как, например, палладий или платина на угле в растворителе, таком как, например, тетрагидрофуран, этилацетат, этанол, метанол или гексан, при температуре окружающей среды, или вблизи нее, в течение примерно 1-12 часов. В зависимости от наличия функциональных групп, более подходящими могут быть другие условия восстановления, такие как, например, использование железных опилок в присутствии слабой кислоты, такой как, например, хлорид аммония или разбавленная соляная кислота, при нагревании с обратным холодильником в смеси растворителей, содержащей, например, метанол, воду и тетрагидрофуран, в течение примерно 1-12 часов.
[00464] Затем можно осуществить сульфонилирование анилина (21-4) метансульфонилхлоридом в присутствии пиридина в растворителе, таком как, например, дихлорметан. Исходные материалы и реагенты смешивают примерно при 0°С и затем дают постепенно нагреться до температуры окружающей среды с получением соединения (21-5). Защитную силилэфирную группу удаляют в хорошо известных для специалиста условиях. Например, тетрабутиламмонийфторид в тетрагидрофуране при комнатной температуре превращает соединение (21-5) в соединение (21-6). Фенольную группу соединения (21-6) можно сульфонилировать ангидридом трифторметансульфоновой кислоты в присутствии основания, такого как, например, пиридин, в растворителе, таком как, например, дихлорметан, при комнатной температуре с получением соединения (21-7). Соединение (21-7) можно использовать, как описано в Схеме 12, для получения соединения (12-3).
Схема 15

[00465] Соединение (22-1) может быть превращено в соединение (22-2) в две стадии. Сначала можно осуществить гидролиз соединения (22-1) с помощью основания, такого как, например, гидроксид натрия, гидроксид лития или гидроксид калия, в растворителе, таком как, например, метанол, этанол или тетрагидрофуран или их смеси. Полученную реакционную смесь перемешивают в течение примерно 6-48 часов при температуре окружающей среды. Затем, полученную карбоновую кислоту нагревают с обратным холодильником в тионилхлориде с каталитическим количеством диметилформамида, или без него, примерно от 1 примерно до 4 часов до получения хлорангидрида (22-2). Обработка тионилхлоридом при нагревании с обратным холодильником в растворителях, таких как, например, хлороформ или толуол, также приводит к получению соединения (22-2). Обработка карбоновой кислоты оксалилхлоридом в дихлорметане с каталитическим количеством диметилформамида также дает соединение (22-2).
[00466] Соединение (22-2) может быть обработано амином или соответствующей солью в растворителе, таком как, например, диоксан, диметилформамид, диметилацетамид или дихлорметан, необязательно в присутствии основания, такого как, например, пиридин, триэтиламин или диизопропилэтиламин при температуре от температуры окружающей среды, или близкой к ней, примерно до 100°С в течение примерно 1-24 часов с получением соединения (22-4), где R11 и R12независимо представляют собой водород или R17, или взятые вместе с азотом, с которым они связаны, образуют 5-6-членный гетероциклил или конденсированный из 2-х колец гетероциклил.
[00467] Соединение (22-2) может быть превращено в соответствующий альдегид (22-3) путем восстановления с помощью литий три-т-бутоксиалюминий гидрида в растворителе, таком как, например, тетрагидрофуран, примерно при температур от -60°С примерно до -78°С.
Схема 16

[00468] Соединение (22-3) может быть превращено в соединение (23-2), где R11 и R12 независимо предствляют собой водород или RF, или взятые вместе с азотом, с которым они связаны, образуют 5-6-членный гетероциклил или конденсированный из 2-х колец гетероциклил, обработкой амином, N(R11)(R12), в присутствии восстановителя, такого как, например, триацетоксиборогидрид натрия или цианоборогидрид натрия, в растворителе, таком как, например, метанол, этанол, дихлорметан, диметилацетамид или диметилформамид, в течение примерно от 1 примерно до 24 часов. Часто реакция лучше протекает при кислом значении рН, которое может поддерживаться добавлением уксусной кислоты или хлористоводородной кислоты.
[00469] Соединение (22-3) может также быть превращено в соединение (23-3) восстановлением с помощью литий три-т-бутоксиалюминий гидрида в растворителе, таком как тетрагидрофуран, при комнатной температуре.
Схема 17

[00470] Соединение (23-3) может быть превращено в соединение формулы (24-2) обработкой тионилхлоридом в дихлорметане при комнатной температуре. Соединение (24-2) может быть обработано алкоксидом натрия R13ONa в нагретом растворе соответствующего спирта с получением соединение (24-3), где R13 представляет собой водород или RF.
Схема 18

[00471] Можно осуществить бромирование соединения (25-1) обработкой, например, пербромидом пиридингидробромида в растворителе, таком как, например, уксусная кислота при температуре окружающей среды, или близкой к ней, в течение примерно 1-8 часов с получением соединения (25-2). Аминогруппа соединения (25-2) может быть удалена выдерживанием с т-бутилнитритом в растворителе, таком как, например, диметилформамид, сначала при температуре окружающей среды с последующим увеличением температуры примерно до 50-65°C с получением соединения (25-3). Можно добавить дополнительные аликвоты т-бутилнитрита при температуре окружающей среды с последующим нагреванием до полного превращения. Соединение (25-3) может быть восстановлено до соединения (25-4), например, обработкой железом и хлоридом амония.
ПРИМЕРЫ
[00472] Следующие примеры являются всего лишь пояснительными, а не ограничивающими это описание каким-либо образом.
[00473] Пример А. Получение (Е)-N-(3-трет-бутил-5-йод-4-метоксифенилкарбамоил)-3-метокси акриламида.

[00474] Часть А. Получение 2-трет-бутил-4-нитрофенола.
[00475] К интенсивно перемешанному раствору 2-трет-бутилфенола (10 г, 66,6 ммоль) в гептане (67 мл) добавляли быстрыми каплями раствор 70% азотной кислоты (4,25 мл, 66,6 ммоль) разбавленной водой (4,25 мл). Полученную в результате темнокрасную/коричневую смесь интенсивно перемешивали в течение 2 ч. Суспендированное твердое вещество собирали путем фильтрации, промывали гексаном (300 мл), водой (200 мл) и еще раз гексаном (200 мл) с получением порошка цвета какао, который сушили до постоянной массы (4,65 г, 35,6%).
[00476] Часть В. Получение 2-трет-бутил-6-йод-4-нитрофенола.
[00477] К продукту из Части А (4,5 г, 23,05 ммоль), растворенному в МеОН (120 мл) и воде (30 мл), добавляли по каплям монохлорид йода (1,155 мл, 23,05 ммоль) за период времени 10 мин. Смесь перемешивали в течение 2 ч и разбавляли в 1 л воды, и оставляли стоять в течение ночи. Твердое вещество собирали фильтрацией и промывали 3×50 мл водой, и сушили под вакуумом в течение ночи с получением твердого вещества желтовато-коричневого цвета (7,14 г, 96%).
[00478] Часть С.Получение 1-трет-бутил-3-йод-2-метокси-5-нитробензола. К охлажденному на ледяной бане раствору продукта из Части В (5,5 г, 17,13 ммоль) в МТВЕ (15 мл) в 50 мл сосуде высокого давления добавляли 2,0 М TMS диазометан (12,85 мл, 25,7 ммоль) с последующим добавлением по каплям метанола (1,0 мл), получая в результате спокойное выделение пузырьков газа. Сосуд герметично закрывали и перемешивали при комнатной температуре в течение 16 ч, охлаждали и давление сбрасывали. Раствор распределяли между EtOAc и водой. Органический слой промывали 1,0 М HCl, насыщенным раствором карбоната калия и насыщенным NaCl. Органический слой сушили над сульфатом натрия, фильтровали и концентрировали с получением красного масла, которое использовали без очистки (5,4 г, 84%).
[00479] Часть D. Получение 3-трет-бутил-5-йод-4-метоксианилина
[00480] Смесь продукта из Части С (5,80 г, 17,31 ммоль), хлорида аммония (1,389 г, 26,0 ммоль), и железа (4,83 г, 87 ммоль) в THF/MeOH/воде (всего 200 мл, 2/2/1) нагревали с обратным холодильником в течение 2 ч, охлаждали и фильтровали через целит. Фильтрат упаривали, и остаток разделяли между водой и EtOAc. Органический слой промывали насыщенным солевым раствором, сушили сульфатом натрия, фильтровали и упаривали с получением коричневого масла (5,28 г, 100% выход).
[00481] Часть Е. Получение (Е)-N-(3-трет-бутил-5-йод-4-метокеифенилкарбамоил)-3-метокси акриламида.
[00482] К раствору продукта из Части D (3,05 г, 10 ммоль) в DMF (50 мл) при -20°С в атмосфере N2 добавляли быстрыми каплями 0,4 М раствор в бензоле (Е)-3-метоксиакрилоилизоцианата (50,0 мл, 20,00 ммоль, полученного способом Santana et al., J. Heterocyclic Chem. 36:293 (1999). Раствор перемешивали в течение 15 мин при -20°С, нагревали до комнатной температуры в течение 45 мин и разбавляли в EtOAc. EtOAc слой промывали 4×300 мл водой, 2×100 мл солевым раствором, сушили (Na2SO4) и концентрировали до твердого вещества коричневого цвета. Остаток растирали в порошок в Et2O/гексане с получением мелкого порошка, который собирали фильтрацией и сушили с получением желтовато-коричневого порошка (2,46 г, 57%).
[00483] Пример В. Получение 1-(3-трет-бутил-5-йод-4-метоксифенил)дигидропиримидин-2,4(1Н,3Н)-диона.

[00484] К суспензии продукта из Примера А (2,46 г, 5,69 ммоль) в этаноле (50 мл) добавляли раствор 5,5 мл H2SO4 в 50 мл воды, и смесь нагревали при 110°С в течение 2,5 ч с получением прозрачного раствора. Раствор охлаждали и разбавляли 50 мл воды при перемешивании, с получением беловатого твердого вещества, которое собирали фильтрованием, промывали водой и сушили (2,06 г, 90%).
[00485] Пример С.Получение 1-(3-трет-бутил-5-йод-4-метоксифенил)пиримидин-2,4(1Н,3Н)-диона.

[00486] Часть А. Получение 2-трет-бутил-4,6-дийодфенола.
[00487] Раствор 2-трет-бутилфенола (20,0 г, 133 ммоль) в метаноле (266 мл) обрабатывали гранулами гидроксида натрия (6,39 г, 160 ммоль). Смесь перемешивали до растворения всего гидроксида натрия и затем охлаждали на бане с ледяной солью до -2°С. Добавляли йодид натрия (15,0 г, 100 ммоль), а затем по каплям добавляли 10% раствор гипохлорита натрия (45 мл, 73,3 ммоль) с такой скоростью, чтобы температура раствора не поднималась выше 1,3°С. Эту последовательность событий повторяли (3x) пока не будет добавлено все 60 г (400 ммоль) йодида натрия, и раствор гипохлорита натрия добавляли до тех пор, пока цвет раствора не изменялся со светлого желто-зеленого цвета до цвета слабого чая со льдом. Для этого требуется почти 16 мл из 180 мл всего отмеренного раствора гипохлорита натрия. Продолжая охлаждение примерно при 2°С, раствор пятиводного тиосульфата натрия (20 г) в воде (100 мл) добавляли по каплям на протяжении 20 мин. После добавления, раствор подкисляли до рН 3 путем добавления по каплям концентрированной соляной кислоты (приблизительно 35 мл требовалось из 40 мл, помещенных в дополнительную воронку). Осадок собирали фильтрованием и промывали с использованием >1 литра воды. Твердое вещество оранжево-желтого цвета отсасывали досуха, и сушили в вакуумной печи при 50°С в течение 18 ч. Эти процедуры давали продукт (49,61 г, 93%) в виде твердого вещества желтовато-коричневого цвета.
[00488] Часть В. Получение 1-трет-бутил-3,5-дийод-2-метоксибензола.
[00489] Раствор продукта из Части А (20,0 г, 49,7 ммоль) в ацетоне (140 мл) обрабатывали метилйодидом (3,9 мл, 8,83 г, 62,2 ммоль) и 50% (масс/масс) раствором гидроксида натрия (3,02 мл, 4,58 г, 57,2 ммоль) с последующим перемешиванием при окружающей температуре в течение 48 ч. Смесь концентрировали в вакууме до объема приблизительно 50-60 мл, с последующим разбавлением гептаном (80 мл) и водой (50 мл). Слои отделяли, и органический слой экстрагировали насыщенным раствором хлорида натрия. Высушивание (Na2SO4) и концентрирование в вакууме давало продукт (20,59 г, 99%) в виде светло-желтого масла.
[00490] Часть С. Получение 1-(3-трет-бутил-5-йод-4-метоксифенил)пиримидин-2,4(1Н,3Н)-диона.
[00491] Суспензию продукта из Части В (12,04 г, 28,9 ммоль), урацила (3,89 г, 34,7 ммоль), N-(2-цианофенил)пиколинамида (1,29 г, 5,79 ммоль) и трехосновного фосфата калия (12,9 г, 60,8 ммоль) в DMSO (181 мл) дегазировали путем барботирования азота в течение 1 ч. Затем смесь обрабатывали йодидом меди (I) (551 мг, 2,89 ммоль) и дегазирование продолжали еще в течение 10 мин. Затем смесь нагревали при 60°С в течение 18 ч. Затем смесь выливали в воду (600 мл) и подкисляли до рН 3 путем добавления 4 н раствора соляной кислоты. Смесь разбавляли этилацетатом, и органический слой экстрагировали водой (3х), насыщенным раствором хлорида аммония (1х) и насыщенным раствором хлорида натрия. Раствор сушили и обрабатывали (3-меркаптопропил) силикагелем, с последующим перемешиванием в течение 2 ч. Смесь фильтровали и концентрировали в вакууме. Полученное твердое вещество растирали в порошок с эфиром-этилацетатом (>10:1) и собирали фильтрованием и промывали эфиром. После высушивания в вакуумной печи при 50°С в течение 2 ч, эти процедуры давали продукт (2,75 г) в виде твердого вещества белого цвета. Маточные растворы концентрировали в вакууме с получением твердого вещества янтарно-желтого цвета. Это вещество хроматографировали на картридже с силикагелем Flash 65, элюируя 20-100% этилацетатом в гексане. Эти процедуры давали почти белое твердое вещество, которое растирали в порошок с эфиром-гексаном и собирали фильтрованием. После высушивания в вакуумной печи в течение 3 ч, эти процедуры давали еще 4,31 г продукта в виде твердого вещества белого цвета. Суммарный выход: 7,06 г (61%).
[00492] Пример D. Получение 1-(3-трет-Бутил-5-йод-4-метоксифенил)пиримидин-2,4(1Н,3Н)-диона.

[00493] Часть А. Получение 2-трет-бутил-4,6-дийодфенола.
[00494] 2-тиреот-бутилфенол (99,95 г, 665,36 ммоль) растворяли в 1250 мл метанола и превращали в соответствующий феноксид с использованием 31,96 г (799,0 ммоль, 1,2 экв.) гидроксида натрия, путем перемешивания гранул гидроксида натрия при комнатной температуре, а затем охлаждения реакционной смеси на бане лед/соль. Йодид натрия (299,34 г, 1997,07 ммоль, 3,0 экв.) и 8,3% раствор гипохлорита натрия (1265,83 г, 1411,39 ммоль, 2,1 экв.) добавляли к холодному реакционному раствору четырьмя равными частями, раствор гипохлорита натрия добавляли, поддерживая реакционную смесь при <0°С. 500 мл 20% (масс/масс) раствора тиосульфата натрия добавляли на протяжении периода времени 18 минут, с повышением температуры от -0,6°С до 2,5°С. рН реакционной смеси доводили приблизительно до 3, путем добавления 197,5 мл конц. HCl за период времени 97 мин с температурой реакции, идущей от 1,2°С до 4,1°С. Полученную в результате густую суспензию фильтровали и отфильтрованный осадок промывали ~2 л воды. Отфильтрованный осадок оставляли на воронке Бюхнера под вакуумом в течение ночи (приблизительно 15 ч) с получением на выходе 289,33 г (потенциально возможный скорректированный выход =254,61 г) названного продукта.
[00495] Часть В. Получение 1-трет-бутил-3,5-дийод-2-метоксибензола.
[00496] Продукт из Части А (93% проба, 21,6 г, 50 ммоль) растворяли в 140 мл ацетона. Добавляли метилйодид (4,2 мл, 67,5 ммоль, 1,35 экв.), с последующим добавлением 50% водного гидроксида натрия (5,0 г, 62,5 ммоль, 1,25 экв.). Реакционную смесь перемешивали в течение ночи, затем концентрировали приблизительно до 50-60 мл. Добавляли 80 мл гептана с последующим добавлением 50 мл воды, и слои встряхивали и отделяли, и водный слой подвергали обратной экстракции 20 мл гептана. Органические слои объединяли и промывали дважды, 50 мл каждый, 10% водным NaCl с получением 91,1 грамм раствора гептана, анализ которого дал 19,1 г названного соединения.
[00497] Часть С. Получение 1-(3-отреот-бутил-5-йод-4-метоксифенил)пиримидин-2,4(1Н,3Н)- диона.
[00498] Урацил (33,3 г, 297 ммоль, 1,2 экв.), K3PO4 (106 г, 500 ммоль, 2,1 экв.), CuI (4,6 г, 24,2 ммоль, 0,1 экв.), и N-(2-цианофенил)пиколинамид (6,4 г, 28,7 ммоль, 0,12 экв.) помещали в колбу с инертным аргоном. Разведенный в MeCN 1-трет-бутил-3,5-дийодо-2-метоксибензол растворяют в 1 л DMSO при барботировании аргоном и добавляли к твердому остатку. Реакционную смесь нагревали до 60°С в течение 16 ч. После охлаждения, реакционную смесь разбавляли 2 л EtOAc и промывали 2,6 л воды (обратная экстракция 3×1 л EtOAc). Объединенные органические слои промывали 2×1 л 0,25 М (CuOAc)2 затем 2×830 мл 15% NH4Cl затем 800 мл солевого раствора. Органический слой затем концентрировали и промывали 1 л гептана, затем растирали в порошок при нагревании с обратным холодильником 85:15 (об/об) гептан:iPrOAc в течение 4 ч. После охлаждения, продукт собирали фильтрацией и промывали дополнительными 330 мл 85:15 об/об гептан:EtOAc с выходом после высушивания 66,9 г (70% выход) продукта в виде твердого вещества белого цвета.
[00499] Пример Е. Получение (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида.

[00500] В трех-горлую круглодонную колбу загружали бороновую кислоту (96% концентрации) (3,75 г, 15,6 ммоль, 1,2 экв.), продукт из Примера D (5,0 г, 12,5 ммоль), Cytec лиганд (175 мг, 5 мол%), Pd2(dba)3 (46 мг, 0,4 мол%) и фосфат калия (5,25 г, 25,0 ммоль, 2 экв.). Твердое вещество в течение 10 мин продували азотом и загружали в колбу. Через 75 мл раствора 4:1 THF: вода в течение 10 мин барботировали азот и загружали в колбу. Реакционную смесь перемешивали до растворения твердого вещества с последующим нагреванием смеси при 50°С в темноте в течение ночи. Результаты ВЭЖХ показали, что после перемешивания в течение ночи реакция прошла не полностью (~2% непрореагировавшего йодоурацила). Реакционную смесь разбавляли 375 мл дихлорметана (DCM) и 250 мл 10% лимонной кислоты. Смесь встряхивали в делительной воронке и разделяли слои. Дихлорметановый слой промывали раствором 0,6 г L-цистеина в 250 мл 5% NaHCO3 30 мин, в течение которых дихлорметановый слой менял цвет от оранжевого до желтого. Повторяли обработку дихлорметанового слоя 0,6 г L-цистеина в 250 мл 5% NaHCO3 в течение 30 мин с последующим промыванием 250 мл 5% NaHCO3 и 250 мл 10% NaCl. Дихлорметановый слой обрабатывали 2 г кремнеземтиомочевины в течение 30 мин. Добавляли 1 г угля, перемешивали 5 мин до обесцвечивания и фильтровали через фильтр hy-flo. Отфильтрованный осадок промывали DCM. DCM раствор затем отпаривали с получением 6,74 г светлого желтого твердого остатка. Твердый остаток имел чистоту ~92%. Твердый остаток нагревали в смеси 192 мл DCM и 9 мл МеОН. Он никогда полностью не растворялся. Охлаждали до комнатной температуры при перемешивании. Добавляли 80 мл гептана, и большее количество продукта начинало кристаллизоваться. Суспензию перемешивают с субботы до понедельника. Порциями по 50 мл добавляли суммарно 230 мл гептана. Продукт отфильтровывали. Фильтрат измеряли при 1,21 мг/мл при 210 нм и 1,35 при 220 нм, что равно потере 522-582 мг в жидкости или потере 9-10% по сравнению с теоретической. Отфильтрованный осадок промывали 50 мл смеси 27 мл гептана: 22 мл DCM: 1 мл МеОН. Промывочный раствор содержал 0,5 мг/мл продукта или 25 мг (0,4% по сравнению с теоретическим). Выход продукта составил 5,22 г (88,9%) с чистотой 99,2%РА. При кристаллизации происходит удаление йодоурацила. Образцы были представлены в твердом состоянии для анализа и аналитическом для определения Pd. ЯМР не показал наличия каких-либо остатков растворителя.
[00501] Пример 1. Получение (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксотетрагидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида (соединение IA-L1-1.9).

[00502] Часть А. Получение метил 3-трет-бутил-2-гидрокси-5-нитробензоата.
[00503] Метил 3,5-ди-трет-бутил-2-гидроксибензоат (28,66 г, 108,4 ммоль) растворяли при перемешивании в 430 мл ледяной уксусной кислоты и полученную в результате смесь обрабатывали по каплям дымящей азотной кислотой (90%, 179,26 мл). После завершения добавления полученную в результате смесь перемешивали в течение 2,5 ч. Реакционную смесь выливали в 2,0 л дробленого льда и оставляли стоять 30 мин. После этого, добавляли 1,0 л воды и эту смесь воды и льда оставляли плавиться. Смесь затем фильтровали, промывали водой и сушили с получением названного соединения (24,57 г, 89%).
[00504] Часть В. Получение метил 3-трет-бутил-2-метокси-5-нитробензоата.
[00505] Добавляли вместе метил 3-трет-бутил-2-гидрокси-5-нитробензоат (11,41 г, 45,0 ммоль), карбонат калия (9,34 г, 67,6 ммоль), ацетон (200 мл), и диметилсульфат (6,46 г, 67,6 ммоль). Полученную в результате смесь затем нагревали с обратным холодильником в течение 16 ч. Смесь затем фильтровали и твердое вещество промывали этилацетатом. Полученную в результате органическую жидкость затем концентрировали под вакуумом до масла и перерастворяли в этилацетате (600 мл). Органический раствор затем промывали водой, сушили, фильтровали и концентрировали под вакуумом до масла, которое затем подвергали очистке посредством колоночной хроматографии (градиент 5% - 40% EtOAc/гексан)с получением на выходе названного соединения в виде масла (10,42, 87%).
[00506] Часть С. Получение метил 5-амино-3-трет-бутил-2-метоксибензоата.
[00507] Добавляли вместе метил 3-трет-бутил-2-метокси-5-нитробензоат (10,42 г, 39,0 ммоль), железные опилки (325 меш, 10,89 г, 195 ммоль), хлорид аммония (3,13 г, 58,5 ммоль), воду (30 мл), и метанол (150 мл). Полученную в результате смесь затем нагревали с обратным холодильником в течение 1 ч. Смесь затем охлаждали до комнатной температуры, фильтровали через целит, и целит промывали метанолом. Фильтрат затем концентрировали под вакуумом и растворяли в этилацетате (600 мл). Полученный в результате раствор затем промывали водой и солевым раствором. Органический экстракт затем сушили, фильтровали и концентрировали под вакуумом с получением на выходе названного соединения в виде масла (9,25 г, 100%).
[00508] Часть D. Получение 3-(3-трет-бутил-4-метокси-5-(метоксикарбонил)фениламино) пропановой кислоты.
[00509] Продукт из Части С (16,44 г, 69,3 ммоль) растворяли в толуоле (200 мл). Эту смесь нагревали с обратным холодильником и добавляли акриловую кислоту на протяжении периода времени (1 мл акриловой кислоты добавляли каждые 3 ч, всего 5,23 мл, 76,2 ммоль). Смесь затем нагревали с обратным холодильником в течение 24 ч. Смесь затем охлаждали и концентрировали под вакуумом до сухости с получением на выходе масла в качестве неочищенного названного соединения, которое использовали непосредственно в следующей реакции.
[00510] Часть Е. Получение метил 3-трет-бутил-5-(2,4-диоксотетрагидропиримидин-1(2Н)-ил)-2-метоксибензоата.
[00511] Добавляли вместе продукт из Части D (21,43 г, 69,3 ммоль), мочевину (10,4 г, 173 ммоль) и уксусную кислоту (ледяную, 200 мл). Смесь затем нагревали до 120°С в течение 18,5 ч с последующим концентрированием под вакуумом с получением масла. К этому маслу добавляли метанол (13 мл), и этилацетат (350 мл). Полученную в результате смесь оставляли стоять в течение 24-48 ч, за счет чего образовывался осадок. Полученное в результате твердое вещество отфильтровывали и промывали небольшим количеством метанола (10 мл) и затем сушили на воздухе с получением на выходе названного соединения в виде твердого вещества (15,26 г, 66%).
[00512] Часть F. Получение 3-трет-бутил-5-(2,4-диоксотетрагидропиримидин-1(2Н)-ил)-2-метокси бензойной кислоты.
[00513] Добавляли вместе продукт из Части D (4,52 г, 13,52 ммоль), метанол (70 мл), и тетрагидрофуран (70 мл). Смесь затем интенсивно перемешивали до получения в результате гомогенного раствора. После достижения гомогенности добавляли раствор водного гидроксида натрия (1,0М, 68 мл). Смесь затем перемешивали в течение 12 ч, смесь затем концентрировали под вакуумом для удаления органического растворителя, с последующим добавлением водного раствора соляной кислоты (1,0М, 80 мл), что в результате приводило к образованию твердого вещества. Смесь затем концентрировали под вакуумом. К этому веществу добавляли соляную кислоту (12М, 100 мл) и полученное в результате вещество нагревали до 100°С в течение 1,5 ч. Реакционную смесь затем охлаждали и добавляли воду. Полученное в результате твердое вещество фильтровали, промывали водой, и сушили с получением на выходе названного соединения в виде твердого вещества (3,55 г, 82%).
[00514] Часть G. Получение 3-трет-бутил-5-(2,4-диоксотетрагидропиримидин-1(2Н)-ил)-2-метокси-бензальдегида.
[00515] Продукт, полученный в Части F (4,07 г, 12,71 ммоль) и тионилхлорид (40,82 мл, 559 ммоль) объединяли, и смесь нагревали с обратным холодильником в течение 2 ч, с последующим концентрированием под вакуумом с получением твердого продукта светло желтого цвета. Твердое вещество растворяли в тетрагидрофуране (125 мл), этот раствор охлаждали до -78°С и медленно добавляли LiAlH(OtBu)3 (1М, 14 мл) на протяжении 10 мин, поддерживая температуру -78°С. Смесь перемешивали при -78°С в течение 2 ч, и реакцию гасили соляной кислотой (водн., 1М, 25 мл) при -78°С. Смесь нагревали до комнатной температуры и добавляли этилацетат. Слои отделяли и водный слой промывали этилацетатом. Органические экстракты объединяли и промывали полу-насыщенным раствором бикарбоната натрия. Органический слой сушили, фильтровали и концентрировали под вакуумом с получением на выходе названного соединения в виде твердого вещества (3,73 г, 96%).
[00516] Часть Н. Получение 1-(3-трет-бутил-4-метокси-5-(4-нитростирил)фенил)дигидро-пиримидин-2,4(1Н,3Н)-диона.
[00517] Продукт, полученный в Части G (1,00 г, 3,29 ммоль) и диэтил 4-нитробензил-фосфонат (0,853 г, 3,12 ммоль) растворяли в дихлорметане (50 мл). Твердый трет-бутоксид калия (0,737 г, 6,57 ммоль) добавляли порциями при комнатной температуре. Полученный в результате темно-красный раствор перемешивали в течение 1,5 ч при комнатной температуре. Добавляли раствор 1 н водной HCl (50 мл) и смесь перемешивали 30 мин, и затем разбавляли дихлорметаном (50 мл). Полученный в результате органический слой отделяли и сушили. Это вещество очищали с помощью колоночной хроматографии на силикагеле, используя 99/1 дихлорметан/метанол в качестве элюента с получением названного соединения в виде твердого вещества (1,12 г, 80%).
[00518] Часть I. Получение (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксотетрагидро-пиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида.
[00519] Продукт, полученный в Части Н (1,1 г, 2.60 ммоль), железо (0,725 г, 12,99 ммоль), и хлорид аммония (0,208 г, 3,90 ммоль) добавляли к смеси тетрагидрофурана (40 мл), этанола (40 мл) и воды (12 мл). Суспензию нагревали до 90°С в течение 45 мин, и затем охлаждали до окружающей температуры. Этот раствор фильтровали через слой целита (10 г), промывали этанолом (20 мл), и фильтрат концентрировали под вакуумом до твердого вещества. Полученное в результате твердое вещество растворяли в этилацетате (100 мл), и этот раствор промывали водой (50 мл) и сушили над Na2SO4. Высушивающее вещество отфильтровывали, и растворитель удаляли под вакуумом с получением анилинового аддукта в виде твердого вещества желтого цвета (830 мг).
[00520] Твердое вещество (830 мг, 2,109 ммоль) растворяли в дихлорметане (50 мл), и добавляли пиридин (0,512 мл, 6,33 ммоль) и метансульфонилхлорид (0,181 мл, 2,32 ммоль) и полученный в результате раствор перемешивали при комнатной температуре 16 ч. Добавляли дихлорметан (100 мл) с последующей экстракцией раствором 1 н водн. HCl (2×50 мл). Органический слой сушили, концентрировали под вакуумом и очищали с помощью колоночной хроматографии на силикагеле, используя 98/2 CH2Cl2/MeOH с получением названного соединения в виде твердого вещества (480 мг, 39%, две стадии). Температура плавления = 260-261°С (транс-изомер)1Н ЯМР (500 MHz, DMSO-d6): δ ppm 1.37 (s, 9H), 2.71 (t, J=6.7Hz, 2H), 3.01 (s, 3H), 3.75 (s, 3H), 3.79 (t, J=6.6Hz, 2H), 7.13 (d, J=16.5Hz, 1H), 7.15 (d, J=2.4Hz, 2H), 7.23 (d, J=8.5Hz, 2H), 7.25 (d, J=16.5 Hz, 1H), 7.51 (d, J=2.4Hz, 1H), 7.61 (d, J=8.6Hz, 2H), 9.80 (bs, 1H), 10.30 (s, 1H). (транс-изомер).
[00521] Пример 2. Получение (2)-N-(4-(2-(3-трет-бутил-5-(2,4-диоксотетрагидропиримидин-1(2Н)-ил)-2-метоксифенил)-1-хлорвинил)фенил)метансульфонамида (соединение IA-L1-1.3).

[00522] Часть А. Получение диэтилгидрокси(4-нитрофенил)метилфосфоната.
[00523] Названное соединение получали, как описано у Taylor, WP, et. AI, Bioorg. Med. Chem. 4:1515-1520 (1996). 4-Нитробензальдегид (3,0 г, 19,85 ммоль) и диэтил фосфонат (2,74 г, 19,85 ммоль) объединяли и обрабатывали 0,5 н раствором метоксида натрия в метаноле (0,993 мл, 0,496 ммоль). Полученный в результате красно-оранжевый раствор перемешивали 12 ч при комнатной температуре. Реакционную смесь экстрагировали дихлорметаном (20 мл), после этого полунасыщенным хлоридом аммония (20 мл). Органический слой отделяли, сушили и концентрировали под вакуумом с получением названного соединения в виде полутвердого вещества (5,1 г, 89%).
[00524] Часть В. Получение диэтилхлор(4-нитрофенил)метилфосфоната.
[00525] Продукт, полученный в Части А (500 мг, 1,729 ммоль) растворяли в дихлорметане (10 мл) и обрабатывали трифенилфосфином (998 мг, 3,80 ммоль), после этого N-хлорсукцинимидом (462 мг, 3,46 ммоль). Смесь перемешивали при комнатной температуре в течение 18 ч. Раствор концентрировали под вакуумом и остаток очищали с помощью колоночной хроматографии, используя силикагель, элюируя смесью 1/1 гексана/этилацетата с получением названного соединения в виде масла (262 мг, 49%).
[00526] Часть С. Получение (2)-N-(4-(2-(3-трет-бутил-5-(2,4-диоксотетрагидропиримидин-1(2Н)-ил)-2-метоксифенил)-1-хлорвинил)фенил)метансульфонамида.
[00527] Продукт, полученный в Примере 1, Части G (100 мг, 0,329 ммоль) обрабатывали продуктом, полученным из Части В, используя процедуры, описанные в Примере 1, Части Н и Примере 1, Части I с получением 39 мг названного соединения.1Н ЯМР (300 MHz, DMSO-d6): δ ppm 1.36 (s, 9H), 2.71 (t, J=6.8Hz, 2H), 3.06 (s, 3H), 3.71 (s, 3H), 3.78 (t, J=6.8Hz, 2H), 7.23 (d, J=2.6 Hz, 1H), 7.27 (s, 1H), 7.28 (d, J=8.6Hz, 2H), 7.48 (d, J=2.6 Hz, 1H), 7.78 d, J=8.8 Hz, 1H), 10.05 (s, 1H), 10.34 (s, 1H).
[00528] Пример 3. Получение (Е)-1-(3-трет-бутил-5-(4-фторстирил)-4-метоксифенил) дигидропиримидин-2,4(1Н,3Н)-диона (соединение IA-L1-1.12).
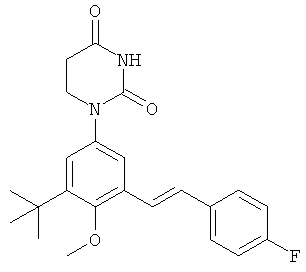
[00529] Названное соединение получали в соответствии с процедурами, описанными в Примере 1, Части Н и Примере 1, Части I, используя продукт, полученный в Примере 1, Части G (50 мг, 0,164 ммоль) и диэтил 4-фторбензилфосфонат (40,5 мг, 0,164 ммоль). Названное соединение получали в виде твердого вещества (30 мг, 46%).1Н ЯМР (300 MHz, DMSO-d6): δ ppm 1.37 (s, 9H), 2.72 (t, J=6.6Hz, 2H), 3.76 (s, 3H), 3.79 (t,=6.6Hz, 2H), 7.21 (m, 4H), 7.30 (d, J=16.3Hz, 1H), 7.53 (d, J=2.6Hz, 1H), 7.73 (m, 2H), 10.35 (s, 1H).
[00530] Пример 4. Получение (Z)-N-(4-(2-(3-трет-бутил-5-(2,4-диоксотетрагидропиримидин-1(2Н)-ил)-2-метоксифенил)-1-фторвинил)фенил)метансульфонамида (соединение IA-L1-1.4).

[00531] Часть А. Получение диэтилфтор(4-нитрофенил)метилфосфоната.
[00532] Названное соединение получали, как описано у Taylor, WP, et. Al, Bioorg. Med. Chem. 4:1515-1520 (1996). Продукт из Примера 2, Части А (500 мг, 1,729 ммоль) растворяли в дихлорметане (10 мл) и обрабатывали добавлением по каплям трифторида (диэтиламино)серы (DAST) (2,5 мл, 18,9 ммоль). Смесь перемешивали при комнатной температуре в течение 18 ч. Добавляли раствор полунасыщенного одноосновного фосфата натрия (20 мл), с последующим добавлением дихлорметана (20 мл) и отделением полученной в результате органической фазы. Этот органический раствор сушили и концентрировали под вакуумом, и затем подвергали колоночной хроматографии, используя силикагель, элюируя 1/1 смесью гексана/этилацетата с получением названного соединения в виде масла (215 мг, 43%).
[00533] Часть В. Получение (Z)-N-(4-(2-(3-трет-бутил-5-(2,4-диоксотетрагидропиримидин-1(2Н)-ил)-2-метоксифенил)-1-фторвинил)фенил)метансульфонамида.
[00534] Продукт, полученный, как описано в Части А (100 мг, 0,329 ммоль) обрабатывали продуктом, полученным в Примере 1, Части G (96 мг, 0,329 ммоль) в соответствии с процедурами, описанными в Примере 1, Части Н и Примере 1, Части I с получением 53 мг названного соединения в виде 1/1 смеси цис/транс изомеров. Хроматографическое разделение с помощью ВЭЖХ с обращенной фазой, с использованием 40-100% градиента ацетонитрила в 0,1% водной трифторуксусной кислоте давало названное соединение в виде твердого вещества (20 мг).1Н ЯМР (300 MHz, DMSO-d6): δ ppm 1.37 (s, 9H), 2.71 (t, J=6.8Hz, 2H), 3.06 (s, 3H), 3.77 (s, 3H), 3.78 (m, 2H), 6.62 (d, J=40.4Hz, 1H), 7.18 (d, J=2.6Hz, 1H), 7.30 (d, J=8.4Hz, 2H), 7.55 (d, J=2.6Hz, 1H), 7.75 (d, J=8.8Hz, 2H), 10.08 (s, 1H), 10.33 (s, 1H).
[00535] Пример 5. Получение (Е)-N-(4-(2-(3-трет-бутил-5-(2,4-диоксотетрагидропиримидин-1(2Н)-ил)-2-метоксифенил)-1-фторвинил)фенил)метансульфонамида (соединение IA-L1-1.5).

[00536] Хроматографическое разделение с помощью ВЭЖХ с обращенной фазой 1/1 смеси цис/транс изомерного вещества (53 мг) из Примера 4, Части А, используя 40-100% градиент ацетонитрила в 0,1% водной трифторуксусной кислоте, давало названное соединение в виде твердого вещества (16,5 мг).1Н ЯМР (300 MHz, DMSO-d6): δ ppm 1.33 (s, 9H), 2.60 (t, J=6.6Hz, 2H), 3.01 (s, 3H), 3.57 (t, J=6.6Hz, 2H) 3.79 (s, 3H), 6.46 (d, J=21.3Hz, 1H), 6.87 (d, J=2.2Hz, 1H), 7.14 (m, 3H), 7.36 (d, J=8.8Hz, 2H), 10.02 (s, 1H), 10.24 (s, 1H).
[00537] Пример 6. Получение (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксотетрагидропиримидин-1(2Н)-ил)-2-метоксистирил)-2-фторфенил)метансульфонамида (соединение IA-L1-1.26)

[00538] Часть А. Получение 4-(бромметил)-2-фтор-1-нитробензола.
[00539] (3-фтор-4-нитрофенол)метанол (1,24 г, 7,25 ммоль) растворяли в дихлорметане (25 мл) и обрабатывали трифенилфосфином (2,281 г, 8,70 ммоль) после этого N-бромсукцинимидом (1,548 г, 8,70 ммоль). Смесь перемешивали при комнатной температуре в течение 2 ч. Добавляли воду (50 мл) и дихлорметан (40 мл), и органический слой отделяли и сушили. Этот раствор концентрировали под вакуумом и очищали с помощью колоночной хроматографии, используя силикагель, элюируя 5/1 смесью гексана/этилацетата с получением названного соединения в виде твердого вещества (1,27 г, 75%).
[00540] Часть В. Получение диэтил 3-фтор-4-нитробензилфоефоната.
[00541] Продукт, полученный в Части А (1,27 г, 5,43 ммоль) добавляли к триэтилфосфину (8 мл, 54,3 ммоль), и этот раствор нагревали до 120°С в течение 1 ч. После охлаждения, избыток триэтилфосфина удаляли нагреванием под вакуумом и остаток подвергали колоночной хроматографии на силикагеле, используя 99/1 дихлорметан/метанол в качестве элюента с получением неочищенного названного соединения в виде масла (800 мг).
[00542] Часть С. Получение (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксотетрагидропиримидин-1(2Н)-ил)-2-метоксистирил)-2-фторфенил)метансульфонамида.
[00543] Продукт, описанный в Примере 1, Части G (533 мг, 1,751 ммоль) обрабатывали продуктом, описанным в Части В (510 мг, 1,751 ммоль) в соответствии с процедурами, описанными в Примере 1, Части Н и Примере 1, Части I с получением 80 мг названного соединения. 'Н ЯМР (300 MHz, DMSO-d6): δ ppm 1.37 (s, 9H), 2.71 (t, J=6.5Hz, 2H), 3.05 (s, 3H), 3.76 (s, 3H), 3.79 (t, J=6.6Hz, 2H), 7.18 (m, 2H), 7.36 (d, J=16.5Hz, 1H), 7.39 (m, 1H), 7.44 (m, 1H), 7.52 (d, J=2.6Hz, 1H), 7.63 (m, 1H). 9.65 (s, 1H), 10.35 (s, 1H).
[00544] Пример 7. Получение N-(4-(2-(3-трет-бутил-5-(2,4-диоксотетрагидропиримидин-1(2Н)-ил)-2-метоксифенил)циклопропил)фенил)метансульфонамида (соединение IA-L8-1.1).

[00545] Продукт, полученный, как описано в Примере 1, Части I (30 мг, 0,064 ммоль) растворяли в тетрагидрофуране (2 мл) и обрабатывали 0,95 мл 0,67М эфирного раствора диазометана (0,636 ммоль), после чего ацетатом палладия (0,7 мг, 0,0031 ммоль). Смесь перемешивали в течение 30 мин при комнатной температуре с последующим удалением твердого вещества фильтрованием и концентрированием фильтрата. Фильтрат очищали с помощью колоночной хроматографии на силикагеле, используя 98/2 дихлорметан/метанол в качестве элюента с получением названного соединения в виде твердого вещества (21,6 мг, 70%). Температура плавления 265-266°С.1Н ЯМР (300 MHz, DMSO-d6): δ ppm 1.33 (s, 9H) 1.50 (m, 2H), 2.13 (m, 1H), 2.27 (m, 1H), 2.69 (t, J=6.6Hz, 2H), 2.94 (s, 3H), 3.63 (s, 3H), 3.74 (t, J=6.6Hz, 2H),6.84 (d, J=2.6Hz, 1H), 7.04 (d, J=2.6Hz, 1H), 7.14 (d, J=8.8Hz, 2H), 7.20 (d, J=8.8Hz, 2H), 9.60 (s, 1H),10.29 (s, 1H).
[00546] Пример 8. Получение N-(4-(3-трет-бутил-5-(2,4-диоксотетрагидропиримидин-1(2Н)-ил)-2-метоксифенэтил)фенил)метансульфонамида (соединение IA-L5-2-1.1).

[00547] Продукт, полученный, как описано в Примере 1, Части I (415 мг, 0,88 ммоль) растворяли в метаноле (30 мл) и обрабатывали 50 мг 10% палладия на угле. Суспензию перемешивали в течение 48 ч при комнатной температуре под давлением 1 атм водорода. Реакционную смесь фильтровали через целит и концентрировали в вакууме с получением названного соединения в виде твердого вещества (230 мг, 55%). Температура плавления 233-234°С.1Н ЯМР (300 MHz, DMSO-d6): δ ppm 1.34 (s, 9H), 2.68 (t, J=6.8Hz, 2H), 2.86 (s, 4H), 2.93 (s, 3H), 3.70 (m, 2H), 3.74 (s, 3H), 7.11 (m, 4H), 7.23 (m, 2H),9.59(s, 1H), 10.29 (s,).
[00548] Пример 9. Получение (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксотетрагидропиримидин-1(2Н)-ил)стирил)фенил)метансульфонамида (соединение IA-L1-1.16)
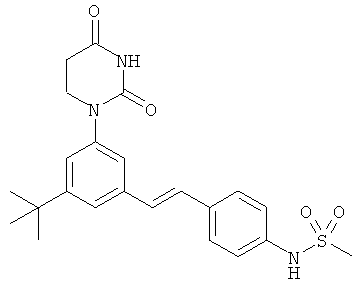
[00549] Часть А. Получение метил 3-трет-бутил-5-(хлоркарбонил)бензоата.
[00550] Смесь 3-трет-бутил-5-(метоксикарбонил)бензойной кислоты (9,18 г, 38,9 ммоль, полученной по методу Carter et. al., WO2005021500A1), тионилхлорида (75 мл) и 1 капли DMF в толуоле (200 мл) нагревали с обратным холодильником в течение 2 ч, охлаждали и концентрировали. Остаток азеотропировали толуолом (3×50 мл) и сушили под высоким вакуумом с получением названного соединения в виде беловатого воскообразного твердого вещества (9,9 г, количественный выход).
[00551] Часть В. Получение метил 3-(азидокарбонил)-5-трет-бутилбензоата.
[00552] К продукту Части А (9,9 г, 38,9 ммоль) в ацетоне (200 мл) добавляли быстрыми каплями раствор азида натрия (10,12 г, 156 ммоль) растворенного в воде (20 мл). Смесь перемешивали в течение 2 ч и разбавляли EtOAc. Органический слой промывали H2O, насыщенным солевым раствором, сушили (Na2SO4), фильтровали и концентрировали с получением названного соединения в виде твердого вещества белого цвета (9,9 г, 97%).
[00553] Часть С. Получение метил 3-амино-5-трет-бутилбензоата.
[00554] Продукт из Части В (9,9 г, 37,9 ммоль) в толуоле (100 мл) нагревали с обратным холодильником в течение 1 ч и концентрировали с получением промежуточного изоцианата, который растворяли в DME (60 мл), обрабатывали 8% HCl (150 мл) и перемешивали в течение 16 ч. Смесь концентрировали и остаток растворяли в воде, нейтрализовали твердым бикарбонатом натрия и экстрагировали 3×100 мл EtOAc. Органические фазы объединяли, промывали насыщенным NaCl, сушили (Na2SO4), фильтровали и концентрировали. Сырой продукт хроматографировали на силикагеле, элюируя 2:1 гексаном/EtOAc с получением названного соединения в виде масла (2,7 г, 35%).
[00555] Часть D. Получение метил 3-трет-бутил-5-(2,4-диоксотетрагидропиримидин-1(2Н)-ил)-2-метоксибензоата.
[00556] Смесь продукта Части С (2,34 г, 11,29 ммоль) и акриловой кислоты (2,32 мл, 33,9 ммоль) в толуоле (60 мл) нагревали с обратным холодильником в атмосфере азота в течение 24 ч, охлаждали и концентрировали. Полученный в результате остаток затем обрабатывали мочевиной (2,03 г, 33,9 ммоль) в уксусной кислоте (35 мл) и нагревали при 120°С в течение 24 ч, охлаждали и концентрировали. Остаток азеотропировали 3×50 мл толуолом и растворяли в 100 мл EtOAc. Органический слой промывали разбавленным водным NaHCO3, H2O, насыщенным солевым раствором, сушили (Na2SO4), фильтровали и концентрировали с получением названного соединения в виде твердого вещества белого цвета (2,1 г, 61%).
[00557] Часть Е. Получение 3-трет-бутил-5-(2,4-диоксотетрагидропиримидин-1(2Н)-ил)бензойной кислоты.
[00558] Смесь продукта из Части D (1,8 г, 5,91 ммоль) и 1М NaOH (29,6 мл, 29,6 ммоль) в МеОН (15 мл) и THF (15 мл) перемешивали в течение 24 ч и концентрировали. Остаток обрабатывали 50 мл 1М HCl и экстрагировали в EtOAc. EtOAc слой промывали Н2О, насыщенным солевым раствором, сушили (Na2SO4), фильтровали и концентрировали с получением твердого вещества белого цвета. Эту промежуточную мочевину объединяли с 20 мл концентрированной HCl и нагревали при 100°С в течение 1 ч, охлаждали и разбавляли 75 мл ледяной воды с получением белого порошка, который собирали фильтрацией и сушили до постоянной массы с получением названного соединения (1,6 г, 93%).
[00559] Часть F. Получение (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксотетрагидропиримидин-1(2Н)-ил) стирил)фенил)метансульфонамида.
[00560] Продукт, описанный в Части Е обрабатывали тионилхлоридом и литий три-трет- бутоксиалюминий гидридом в соответствии с процедурами, описанными в Примере 1, Части G с получением 3-трет-бутил-5-(2,4-диоксотетрагидропиримидин-1(2Н)-ил)бензальдегида. Этот альдегид обрабатывали диэтил 4-нитробензилфосфонатом в соответствии с процедурами, описанными в Примере 1, Части Н и Примере 1, Части I с получением названного соединения (85 мг).1Н ЯМР (300 MHz, DMSO-d6): δ ppm 1.32 (s, 9 Н) 2.72 (t, J=6.43 Hz, 2 Н) 3.01 (s, 3 Н) 3.82 (t, J=6.62 Hz, 2 Н) 7.18-7.25 (m, 5 Н) 7.39 (s, 1 Н) 7.46 (s, 1 Н) 7.58 (d, J=8.46 Hz, 2 Н) 9.84 (s, 1 Н) 10.37 (s, 1 Н).
[00561] Пример 10. Получение (Z)-N-(4-(2-(3-трет-бутил-5-(2,4-диоксотетрагидропиримидин-1(2Н)-ил)-2-метоксифенил)-1-метоксивинил)фенил)метансульфонамида (соединение IA-L1-1.17).

[00562] Часть А. Получение 1-(диметоксиметил)-4-нитробензола.
[00563] В колбу, снабженную магнитной мешалкой и колонкой Vigreux помещали 4-нитро-бензальдегид (5,0 г, 33,1 ммоль), пиридиний p-толуолсульфат (1,66 г, 6,62 ммоль), триметоксиметан (3,51 г, 33,1 ммоль) и метанол (100 мл). Смесь нагревали при 50°С в течение 12 ч и концентрировали в вакууме. Остаток перерастворяли в EtOAc и промывали водн. NaOH (1M), H2O и солевым раствором. Смесь сушили (Na2SO4), фильтровали и концентрировали в вакууме с получением на выходе названного соединения в виде прозрачного светло-желтного масляного продукта (6,36 г, 97%).
[00564] Часть В. Получение диэтилметокси(4-нитрофенил)метилфосфоната.
[00565] Продукт из Части А (3,0 г, 15,2 ммоль) и триэтилфосфит (2,53 г, 15,2 ммоль) растворяли в дихлорметане (30 мл) в атмосфере азота, охлаждали до -20°С и обрабатывали по каплям добавлением эфирата трехфтористого бора (2,27 г, 16 ммоль). Смесь оставляли медленно нагреваться до комнатной температуры в течение ночи при перемешивании. Добавляли воду и полученную в результате смесь перемешивали 5 мин, отделяли, и органический слой сушили (Na2SO4), фильтровали и концентрировали в вакууме с получением твердого остатка. Этот остаток очищали на силикагеле (100% EtOAc до 3% СН3ОН/EtOAc)с получением на выходе названного соединения в виде светло-желтого масляного продукта (3,78 г, 82%).
[00566] Часть С. Получение (Z)-N-(4-(2-(3-трет-бутил-5-(2,4-диоксотетрагидропиримидин-1(2Н)-ил)-2-метоксифенил)-1-метоксивинил)фенил)метансульфонамида.
[00567] Продукт, полученный в соответствии с процедурой, описанной в Примере 1, Части G (400 мг, 1,314 ммоль) обрабатывали продуктом, полученным в Части В (399 мг, 1,314 ммоль) в соответствии с процедурами, описанными в Примере 1, Части Н и Примере 1, Части I с получением названного соединения (17 мг, 6%).1Н ЯМР (300 MHz, DMSO-d6): δ ppm 1.36 (s, 9 H) 2.71 (t, J=6.62 Hz, 2 H) 3.05 (s, 3 H) 3.58 (s, 3 H) 3.75 (s, 3 H) 3.76-3.81 (m, 2 H) 6.25 (s, 1 H) 7.11 (d, J=2.57 Hz, 1 H) 7.27 (d, J=8.46 Hz, 2 H) 7.60 (d, J=8.82 Hz, 2 H) 7.67 (d, J=2.57 Hz, 1 H) 9.96 (s, 1 H) 10.32 (s, 1 H).
[00568] Пример 11. Получение (Е)-1-(3-трет-бутил -4-метокси-5-стирилфенил)дигидро-пиримидин-2,4(1Н,3Н)-диона (соединение IA-L1-1.18).

[00569] Продукт, полученный в соответствии с процедурой, описанной в Примере 1, Части G (50 мг, 0,164 ммоль) обрабатывали диэтилбензилфосфонатом (0,034 мл, 0,164 ммолье) в соответствии с процедурой, описанной в Примере 1, Части Н с получением названного соединения (13 мг, 19%).1Н ЯМР (300 MHz, DMSO-d6): δ ppm 1.37 (s, 9 H) 2.72 (t, J=6.62 Hz, 2 H) 3.76 (s, 3 H) 3.80 (t, J=6.80 Hz, 2 H) 7.16-7.18 (m, 1 H) 7.21-7.23 (m, 1 H) 7.29-7.33 (m, 2 H) 7.36-7.43 (m, 2 H) 7.54 (d, J=2.57 Hz, 1 H) 7.64 (d, J=7.35 Hz, 2 H) 10.35 (s, 1 H).
[00570] Пример 12. Получение (Е)-1-(3-трет-бутил-4-метокси-5-(4-метоксистирил)фенил) дигидропиримидин-2,4(1Н,3Н)-диона (соединение IA-L1-1.14).

[00571] Продукт, полученный в соответствии с процедурой, описанной в Примере 1, Части G (50 мг, 0,164 ммоль) обрабатывали диэтил 4-метоксибензилфосфонатом (0,028 мл, 0,164 ммоль) в соответствии с процедурой, описанной в Примере 1, Части Н с получением названного соединения (4 мг, 4%).1Н ЯМР (300 MHz, DMSO-d6): δ ppm 1.37 (s, 9 H) 2.71 (t, J=6.62 Hz, 2 H) 3.70-3.81 (m, 8 H) 6.96 (d, J=8.82 Hz, 2 H) 7.13 (d, J=2.21 Hz, 1 H) 7.15 (d, J=2.57 Hz, 2 H) 7.50 (d, J=2.57 Hz, 1 H) 7.58 (d, J=8.46 Hz, 2 H) 10.34 (s, 1 H).
[00572] Пример 13А. Получение (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида (соединение IB-L1-1.1).

[00573] Часть А. Получение (Е)-метил 3-трет-бутил-2-метокси-5-(3-(3-метоксиакрилоил)уреид) бензоата.
[00574] Продукт, полученный как описано в Примере 1, Части С (2,0 г, 8,43 ммоль) растворяли в 30 мл N,N-диметилацетамида и охлаждали до -25°С.Добавляли по каплям 0,5 молярный раствор Е-3-метоксиакрилоилизоцианата в бензоле (21,9 мл, 10,96 ммоль), и полученный в результате раствор перемешивали при окружающей температуре в течение 4 ч, и затем выливали воду. Этот продукт экстрагировали в дихлорметан, промывали солевым раствором, сушили над сульфатом натрия, фильтровали и упаривали под вакуумом с получением названного соединения.
[00575] Часть В. Получение метил 3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксибензоата.
[00576] Продукт из Части А (3,1 г, 8,51 ммоль) растворяли в этаноле (60 мл). К этому раствору добавляли смесь концентрированной серной кислоты (6 мл) и воды (60 мл). Гетерогенную смесь нагревали при 100°С в течение 3 ч. Этанол удаляли под вакуумом, и затем водный раствор экстрагировали дихлорметаном и упаривали до сухости. Этот остаток очищали с помощью колоночной хроматографии на силикагеле, элюируя 1% метанолом/дихлорметаном с получением на выходе названного соединения (1,23 г, 44%).
[00577] Часть С. Получение 3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метокси бензойной кислоты.
[00578] Продукт из Части В (1,23 г, 3,7 ммоль) помещали в этанол (5 мл) и 1М раствор гидроксида натрия (10 мл) и перемешивали при окружающей температуре в течение 18 ч. Этот раствор подкисляли 1М HCl и полученное в результате твердое вещество фильтровали и сушили с получением названного соединения (0,945 г, 80%).
[00579] Часть D. Получение 3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метокси бензальдегида.
[00580] Продукт из Части С (0,945 г, 2,97 ммоль) помещали в тионилхлорид (4,5 мл) и смесь нагревали при 80°С в течение 40 мин. После упаривания до сухости, хлорангидрид растворяли в сухом THF (8 мл) и охлаждали до -78°С. Добавляли по каплям 1 М раствор литий три-трет-бутоксиалюминий гидрида в THF (3,0 мл, 3,0 ммоль). Через 45 мин холодную реакционную смесь гасили 1М HCl (5 мл), экстрагировали в этилацетат, и очищали с помощью колоночной хроматографии на силикагеле, элюируя дихлорметаном после чего 1% метанолом/дихлорметаном с получением названного соединения (0,635 г, 71%).
[00581] Часть Е. Получение (Е)-1-(3-трет-бутил-4-метокси-5-(4-нитростирил)фенил)пиримидин-2,4(1Н,3Н)-диона.
[00582] Продукт Части D (0,634 г, 2,1 ммоль) и диэтил 4-нитробензилфосфонат (0,573 г, 2,1 ммоль) объединяли в дихлорметане (25 мл) при окружающей температуре. Добавляли порциями трет-бутоксид калия (0,494 г, 4,4 ммоль) и полученную в результате красную/коричневую гетерогенную смесь перемешивали в течение 1,5 ч. Эту смесь гасили 1М HCl (15 мл), выливали в воду и экстрагировали в этилацетат, и сырой продукт очищали с помощью колоночной хроматографии на силикагеле, элюируя 1% метанолом/дихлорметаном с получением названного соединения (0,735 г, 83%).
[00583] Часть F. Получение (Е)-1-(3-(4-аминостирил)-5-трет-бутил-4-метоксифенил)пиримидин-2,4(1Н,3Н)-диона.
[00584] Продукт из Части Е (0,735 г, 1,74 ммоль), хлорид аммония (0,14 г, 2,62 ммоль), и железо (0,487 г, 8,72 ммоль) объединяли в растворе этанола (10 мл), воды (5 мл), и THF (10 мл) и нагревали при 75°С в течение 1 ч. Смесь фильтровали через диатомит, хорошо промывали THF и концентрировали с получением названного соединения.
[00585] Часть G. Получение (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида.
[00586] Продукт из Части F (0,683 г, 1,75 ммоль) и пиридин (0,564 мл, 6,98 ммоль) объединяли в дихлорметане (15 мл) при окружающей температуре. Метансульфонилхлорид (0,163 мл, 2,1 ммоль) добавляли по каплям, и раствор перемешивали в течение 18 ч. Смесь выливали в 1М HCl и экстрагировали в дихлорметан, концентрировали, и очищали с помощью колоночной хроматографии на силикагеле, элюируя 1%, 2% метанолом/дихлорметаном. Растирание с дихлорметаном давало твердое вещество, которое фильтровали и сушили с получением названного соединения в виде бесцветного порошка (0,465 г, 57%).1Н ЯМР (300 MHz, DMSO-D6) δ ppm 1.38 (s, 9 H), 3.01 (s, 3 H), 3.79 (s, 3 H) 5.65 (d, J=7.72 Hz, 1 H), 7.17-7.28 (m, 5 H), 7.58-7.70 (m, 3 H), 7.75 (d, J=7.72 Hz, 1 H), 9.86 (s, 1 H), 11.42(s, 1 H).
[00587] Пример 13 В. Получение (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида (соединение IB-L1-1.1).

[00588] Часть А. Получение N-(4-этинилфенил)метансульфонамида.
[00589] В 2 л, 3-горловую круглодонную колбу, снабженную верхнеприводной мешалкой, добавляли 4-этиниланилин (30 г, 256 ммоль) и пиридин (42,5 мл, 525 ммоль) в дихлорметане (512 мл) с получением оранжевого раствора. Смесь охлаждали до 5°С и добавляли по каплям метансульфонилхлорид (19,96 мл, 256 ммоль) на протяжении 15 мин. Реакционный раствор перемешивали при 5°С в течение 2 ч и промывали 1М водным HCl (3×250 мл). Дихлорметановый слой затем промывали последовательно насыщенным водным NaHCO3, водой, и насыщенным водным NaCl. Дихлорметановый слой сушили над сульфатом натрия и обрабатывали одновременно обесцвечивающим древесным углем в течение 30 мин, этот раствор затем фильтровали через целит и фильтрат концентрировали. Розовое/оранжевое твердое вещество растворяли в минимальном количестве горячего этилацетата (50-75 мл) и медленно разбавляли гексаном (500-600 мл) с получением оранжевых кристаллов, которые собирали фильтрованием и сушили с получением названного соединения (40,0 г, 80%).
[00590] Часть В. Получение (Е)-4-(метилсульфонамид)стирилбороновой кислоты.
[00591] (Ссылка: Org. Prep.Proc. Int., 2004, 36, 573-579) В колбу добавляли комплекс боран-метилсульфид (8,03 мл, 85 ммоль), затем тетрагидрофуран (16 мл), и эту смесь затем охлаждали до 0°С. Затем к охлаждаемому льдом раствору добавляли по каплям (1R)-(+)-альфа-пинен (26,2 мл, 169 ммоль) (за 10 мин). Смесь затем перемешивали при 0°С в течение 1 ч с последующим перемешиванием 2 ч при комнатной температуре. Полученную в результате густую белую суспензию охлаждали до -40°С и сушили на бане лед/ацетон, с последующим добавлением по каплям на протяжении 30 мин продукта из Части А (15,0 г, 77 ммоль), растворенного в 60 мл THF. После завершения добавления, смесь перемешивали в течение дополнительного часа при -35°С, затем 1 ч при комнатной температуре. Светло-желтый раствор затем охлаждали до 0°С и добавляли ацетальдегид (61,4 мл, 1088 ммоль), затем смесь нагревали с обратным холодильником при 50°С в течение 18 ч. Затем растворитель удаляли под вакуумом с получением концентрированного раствора оранжевого цвета, к которому добавляли воду (115 мл), и эту гетерогенную смесь перемешивали в течение 3 ч при комнатной температуре. Образовавшееся светло-желтое твердое вещество собирали и промывали водой (250 мл), затем сушили в вакуумной печи в течение ночи. Полученное в результате вещество затем растворяли в кипящем ацетоне (190 мл), что давало гомогенный раствор желтого цвета, с последующим устранением нагревания раствора и добавлением гексана (365 мл) на протяжении периода времени 5 мин. В растворе образовывалось твердое вещество белого цвета, и смесь перемешивали до охлаждения раствора до комнатной температуры, затем белое твердое вещество собирали и сушили в вакуумной печи в течение 1 часа с получением названного соединения (12,1 г, 85%).
[00592] Часть С. Получение 2-трет-бутил-4-нитрофенола.
[00593] К интенсивно перемешанному раствору 2-трет-бутилфенола (10 г, 66,6 ммоль) в гептане (67 мл) добавляли быстрыми каплями раствор 70% азотной кислоты (4,25 мл, 66,6 ммоль) разбавленной водой (4,25 мл). Полученную в результате темно-красную/коричневую смесь интенсивно перемешивали в течение 2 ч. Суспендированное твердое вещество собирали фильтрацией, промывали гексаном (300 мл), водой (200 мл) и еще один раз гексаном (200 мл) с получением порошка цвета какао, который сушили до постоянной массы (4,65 г, 35,6%).
[00594] Часть D. Получение 2-бром-6-трет-бутил-4-нитрофенола.
[00595] Раствор продукта из Части С (1,0 г, 5,12 ммоль) в ледяной уксусной кислоте (10,25 мл) обрабатывали порциями пиридин гидробромид пербромидом (1,80 г, 5,63 ммоль) с последующим перемешиванием при комнатной температуре в течение 2 ч. Дополнительное количество пиридиния гидробромида пербромида (3,6 г) добавляли двумя порциями и после еще 3 ч перемешивания реакцию завершали. Смесь выливали в ледяную воду, и эту смесь обрабатывали небольшим количеством сульфита натрия. Полученное в результате твердое вещество фильтровали и сушили под вакуумом с получением названного соединения в виде твердого вещества коричневого цвета (1,40 г, 100%).
[00596] Часть Е. Получение 1-бром-3-трет-бутил-2-метокси-5-нитробензола.
[00597] Раствор продукта из Части D (1,40 г, 5,11 ммоль) в 10:1 т-бутилметиловом эфире-метаноле (25,5 мл) обрабатывали 2,0М триметилсилилдиазометаном в эфире (5,1 мл, 10,21 ммоль), с последующим перемешиванием при комнатной температуре в течение 18 ч. Смесь концентрировали под вакуумом с получением желтого масла, которое очищали с помощью колоночной хроматографии на силикагеле, элюируя EtOAc/гексаном с получением названного соединения в виде желтого масла (1,36 г, 92%).
[00598] Часть F. Получение трет-бутил 3-бром-5-трет-бутил-4-метоксифенилкарбамата.
[00599] Раствор продукта из Части Е (960 мг, 3,33 ммоль) в метаноле (17 мл) обрабатывали 5% платиной на сульфидированном углероде (100 мг), с последующий гидрогенизацией под давлением из баллонной шины в течение 3 ч, и затем фильтровали через целит и концентрировали под вакуумом с получением 3-бром-5-трет-бутил-4-метоксианилина в виде желтого масла (860 мг, 3,33 ммоль, 100%). Раствор этого вещества в THF (17 мл) обрабатывали ди-трет-бутил дикарбонатом (800 мг, 3,66 ммоль) с последующим нагреванием с обратным холодильником в течение 2 ч. Концентрирование под вакуумом давало твердое вещество бежевого цвета, которое очищали с помощью колоночной хроматографии на силикагеле, элюируя EtOAc/гексаном. Твердое вещество растирали в порошок с гексаном, собирали фильтрованием, и сушили под вакуумом с получением названного соединения в виде почти белого твердого вещества (890 мг, 75%).
[00600] Часть G. Получение (Е)-N-(3-бром-5-трет-бутил-4-метоксифенилкарбамоил)-3-метоксиакриламида.
[00601] Продукт из Части F (2,0 г, 5,58 ммоль) растворяли в дихлорметане (10 мл) и добавляли трифторуксусную кислоту (5 мл). Этот раствор перемешивали при комнатной температуре в течение 1 ч с последующим концентрированием под вакуумом и добавлением 10% водного бикарбоната натрия (50 мл), с последующей экстракцией этилацетатом (3×50 мл). Объединенные органические экстракты сушили и концентрировали с получением остатка, который растворяли в 10 мл N,N- диметилацетамида и охлаждали до -25°С. Добавляли по каплям 0,5 молярный раствор Е-3-метоксиакрилоилизоцианата в бензоле (20,3 мл, 11,16 ммоль) и полученный в результате раствор перемешивали при окружающей температуре в течение 4 ч, и затем выливали в воду. Этот продукт экстрагировали в дихлорметан, промывали солевым раствором, сушили над сульфатом натрия, фильтровали и упаривали под вакуумом с получением названного соединения.
[00602] Часть Н. Получение 1-(3-бром-5-трет-бутил-4-метоксифенил)пиримидин-2,4(1Н,3Н)-диона.
[00603] Продукт из Части G (2,15 г, 5,58 ммоль) растворяли в этаноле (10 мл). К этому раствору добавляли смесь концентрированной серной кислоты (1 мл) и воды (10 мл). Эту гетерогенную смесь нагревали при 100°С в течение 2 ч. Этанол удаляли под вакуумом, и затем водный раствор экстрагировали дихлорметаном и упаривали до сухости. Этот остаток очищали с помощью колоночной хроматографии на силикагеле, элюируя 1% метанолом/дихлорметаном с получением на выходе названного соединения (1,35 г, 69%).
[00604] Часть I. Получение (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида.
[00605] Продукт из Части Н (8,0 г, 22,65 ммоль), продукт из Части В (5,90 г, 24,46 ммоль), 1,1'-бис(ди-трет-бутилфосфино)ферроцен палладий дихлорид (0,738 г, 1,132 ммоль), и фосфат калия (9,62 г, 45,3 ммоль) растворяли в смеси тетрагидрофурана (128 мл) и воды (32 мл). Газообразный азот барботировали через полученную в результате смесь в течение 10 мин с последующим нагреванием этого раствора при 50°С в течение 5 ч в темноте. Реакционную смесь оставляли охлаждаться до комнатной температуры с последующим добавлением насыщенного водного хлорида аммония (50 мл), воды (200 мл), и этот раствор экстрагировали дихлорметаном (600 мл). К органическому экстракту добавляли сульфат магния и 3-меркаптопропил-активированный силикагель (20 г), и полученный в результате раствор перемешивали в темноте в течение 18 ч. Твердые вещества затем удаляли фильтрованием и фильтрат концентрировали под вакуумом и подвергали колоночной хроматографии на силикагеле, используя градиент 99/1 - 99/2 дихлорметан/метанол с получением названного соединения (7,4 г, 70%).1Н ЯМР (300 MHz, DMSO-D6) δ ppm 1.38 (s, 9 H), 3.01 (s, 3 Н), 3.79 (s, 3 Н) 5.65 (d, J=7.72 Hz, 1 Н), 7.17-7.28 (m, 5 Н), 7.58-7.70 (m, 3 Н), 7.75 (d, J=7.72 Hz, 1 Н), 9.86 (s, 1 Н), 11.42(s, 1 Н).
[00606] Пример 14. Получение (Е)-N-(4-(3-трет-бутил-5-(5-фтор-2,4-диоксо-3,4-дигидро-пиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида (соединение IB-L1-1.2).

[00607] Часть А. Получение метил 3-трет-бутил-5-(5-фтор-6-метокси-2,4-диоксотетрагидро-пиримидин-1(2Н)-ил)-2-метоксибензоата.
[00608] Процедуру фторирования проводили, как описано у Lal, GS, et al. J. Org Chem., 60:7340-7342 (1995). Продукт из Примера 13А, Части В (0,42 г, 1,26 ммоль) и Selectfluor™ (0,672 г, 1,9 ммоль) объединяли в смеси ацетонитрила (8 мл) и метанола (1 мл) и нагревали при 90°С в атмосфере N2 в течение 5 ч. Раствор разбавляли водой, экстрагировали в этилацетат, промывали раствором бикарбоната натрия, концентрировали и очищали с помощью колоночной хроматографии на силикагеле с получением названного соединения (0,138 г, 29%).
[00609] Часть В. Получение метил 3-трет-бутил-5-(5-фтор-2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксибензоата.
[00610] Продукт из Части А (0,134 г, 0,35 ммоль) и триэтиламин (1 мл) объединяли в метаноле (4 мл) и перемешивали при окружающей температуре в течение 18 ч. Раствор гасили 1М HCl, экстрагировали в дихлорметан и концентрировали с получением названного соединения (0,113 г, 92%).
[00611] Часть С. Получение 3-трет-бутил-5-(5-фтор-2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксибензойной кислоты.
[00612] Продукт из Части В (0,113 г, 0,32 ммоль) обрабатывали, как описано в Примере 13А, Части C с получением названного соединения (0,088 г, 81%).
[00613] Часть D. Получение 3-трет-бутил-5-(5-фтор-2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксибензальдегида.
[00614] Продукт из Части С (0,088 г, 0,26 ммоль) обрабатывали, как описано в Примере 13А, Части D с получением названного соединения (0,075 г, 90%).
[00615] Часть Е. Получение (Е)-1-(3-трет-бутил-4-метокси-5-(4-нитростирил)фенил)-5-фторпиримидин-2,4(1Н,3Н)-диона.
[00616] Продукт Части D (0,075 г, 0,23 ммоль) обрабатывали, как описано в Примере 13А, Части Е с получением 0,077 г (75%).
[00617] Часть F. Получение (Е)-1-(3-(4-аминостирил)-5-трет-бутил-4-метоксифенил)-5- фторпиримидин-2,4(1Н,3Н)-диона.
[00618] Продукт Части Е (0,077 г, 0,18 ммоль) обрабатывали, как описано в Примере 13А, Части F с получением названного соединения (0,071 г, 94%).
[00619] Часть G. Получение (Е)-N-(4-(3-трет-бутил-5-(5-фтор-2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида.
[00620] Продукт Части F (0,071 г, 0,17 ммоль) обрабатывали, как описано в Примере 13А, Части G с получением названного соединения (0,048 г, 57%).1Н ЯМР (300 MHz, DMSO-D6): δ ppm 1.38 (s, 9 Н), 3.01 (s, 3 Н), 3.79 (s, 3 Н) 7.19-7.27 (m, 5 Н), 7.62 (d, J=8.82 Hz, 2 Н), 7.66 (d, J=2.57 Hz, 1 Н), 8.25 (d, J=6.99 Hz, 1H).
[00621] Пример 15. Получение (Е)-N-(4-(3-бром-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида (соединение IB-L1-1.52).

[00622] Часть А. Получение 2-бром-4,6-дийодфенола.
[00623] В 1 л круглодонную колбу помещали 2-бромфенол (8,65 г, 50 ммоль) и метанол (100 мл) с получением бесцветного раствора. Добавляли гидроксид натрия (2,40 г, 60,0 ммоль) и перемешивали до полного растворения гранул гидроксида. Раствор охлаждали на ледяной бане и добавляли йодид натрия (5,6 г, 37,4 ммоль) с последующим добавлением по каплям гипохлорита натрия (17 мл, 27,5 ммоль) с получением прозрачного коричневого/красного раствора, и постепенного осаждения густого белого твердого вещества. Добавление йодида натрия и раствора гипохлорита натрия повторяли 3 раза с получением оранжевой смеси, которую перемешивали в течение 2 ч, обрабатывали раствором тиосульфата натрия в воде (20 г в 100 мл), перемешивали в течение 15 мин и обрабатывали по каплям концентрированной HCl до постоянного рН 1. Смесь перемешивали в течение 15 мин и фильтровали для сбора твердого вещества белого цвета, которое промывали многократно водой и сушили до постоянной массы (14,7 г, 69%).
[00624] Часть В. Получение 1-бром-3,5-дийод-2-метоксибензола.
[00625] В 500 мл круглодонную колбу помещали продукт из Части А (14,7 г, 34,6 ммоль), йодметан (2,70 мл, 43,3 ммоль), и гидроксид натрия (2,101 мл, 39,8 ммоль) в ацетоне (96 мл) с получением желтовато-коричневого раствора. Смесь перемешивали в течение 24 ч и концентрировали. Остаток растворяли в этилацетате, промывали водой и насыщенным хлоридом натрия, сушили над сульфатом натрия, фильтровали и концентрировали с получением твердого вещества белого цвета. Твердое вещество перекристаллизовывали из горячего гексана с получением твердого вещества белого цвета, которое собирали фильтрованием (12,3 г, 81%).
[00626] Часть С. Получение 1-(3-бром-5-йод-4-метоксифенил)пиримидин-2,4(1Н,3Н)-диона.
[00627] В 250 мл круглодонную колбу помещали продукт из Части В (8,09 г, 18,44 ммоль), пиримидин-2,4(1Н,3Н)-дион (2,273 г, 20,28 ммоль), N-(2-цианофенил)пиколинамид (0,823 г, 3,69 ммоль), йодид меди (I) (0,351 г, 1,844 ммоль) и фосфат калия (8,22 г, 38,7 ммоль) в DMSO (70 мл). Смесь герметично закрывали, барботировали азотом в течение 15 мин и нагревали при 60°С в течение 16 ч. Смесь разделяли этилацетатом и водой. Органический слой промывали 1М HCl, водой, солевым раствором, сушили сульфатом натрия, и фильтровали. Фильтрат обрабатывали 3-меркаптопропил-функционализированным силикагелем (Aldrich catalog #538086), фильтровали через целит и упаривали с получением беловатого твердого вещества (3,92 г, 50%).
[00628] Часть D. Получение (Е)-N-(4-(3-бром-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида.
[00629] В 100 мл круглодонную колбу добавляли продукт из Части С (846 мг, 2,0 ммоль), продукт из Примера 13 В, Части В (482 мг, 2,000 ммоль), фосфат калия (892 мг, 4,20 ммоль), 1,3,5,7-тетраметил-6-фенил-2,4,8-триокса-6-фосфаадамант (PA-Ph) (CAS 97739-46-3) (17,54 мг, 0,060 ммоль) и трис(дибензилиденацетон)дипалладий(0) (18,31 мг, 0,020 ммоль) в THF (12,0 мл) и воде (4,0 мл). Колбу герметично закрывали, и смесь барботировали азотом в течение 5 мин и перемешивали при окружающей температуре в течение 72 ч. Смесь разделяли этилацетатом и 1М HCl. Органический слой промывали насыщенным бикарбонатом натрия, солевым раствором, сушили сульфатом натрия и фильтровали. Фильтрат обрабатывали 3-меркаптопропил-функционализированным силикагелем, фильтровали и упаривали. Остаток растирали с минимальным количеством метанола/CH2Cl2 с получением названного соединения в виде твердого вещества белого цвета (595 мг, 60%).1Н ЯМР (300 MHz, DMSO-d6) δ ppm 3.03 (s, 3 Н) 3.82 (s, 3 Н) 5.69 (dd, J=7.72, 1.50 Hz, 1 Н) 7.24 (d, J=8.46 Hz, 2 Н) 7.35 (m, 2 Н) 7.61 (d, J=8.46 Hz, 2 Н) 7.69 (d, J=2.21 Hz, 1 Н) 7.78 (d, J=8.09 Hz, 1 Н) 7.87 (d, J=2.21 Hz, 1 Н) 9.90 (s, 1 Н) 11.50 (s, 1 Н). MS (ESI-) m/z 490,492 (M-H)+.
[00630] Пример 16. Получение (Е)-N-(4-(5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метокси-3-(тиофен-2-ил)стирил)фенил)метансульфонамида (соединение IB-L1-1.48).

[00631] В 5 мл микроволновую трубку добавляли продукт из Примера 15, Части D (40 мг, 0,081 ммоль), тиофен-2-илбороновую кислоту (10,40 мг, 0,081 ммоль), 1,1'-бис(ди-трет-бутилфосфино)ферроцен палладий дихлорид (2,65 мг, 4,.06 мкмоль) и фосфат калия (34,5 мг, 0,162 ммоль) в THF (3,0 мл) и воде (1,0 мл). Сосуд герметично закрывали, и смесь барботировали азотом в течение 5 мин и нагревали при 50°С в течение 3 ч. Смесь разделяли этилацетатом и 1М HCl. Органический слой промывали насыщенным бикарбонатом натрия, солевым раствором, сушили сульфатом натрия и фильтровали. Фильтрат обрабатывали 3-меркаптопропил-функционализированным силикагелем, фильтровали через целит и упаривали. Остаток очищали с помощью хроматографии с обращенной фазой с получением названного соединения в виде твердого вещества белого цвета (20 мг, 50%).1Н ЯМР (300 MHz, DMSO-d6) δ ppm 3.03 (s, 3 H) 3.70 (s, 3 H) 5.70 (dd, J=7.72, 2.21 Hz, 1 H) 7.18 (dd, J=5.43, 4.05 Hz, 1 H) 7.25 (d, J=8.82 Hz, 2 H) 7.35 (s, 2 H) 7.63 (d, J=8.82 Hz, 2 H) 7.68 (m, 2 H) 7.77 (m, 2 H) 7.83 (d, J=7.72 Hz, 1 H) 9.89 (s, 1 H) 11.49 (d, J=2.21 Hz, 1 H). MS (ESI+) m/z 496 (M+H)+.
[00632] Пример 17. Получение (Е)-N-(4-(5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-3-(фуран-2-ил)-2-метоксистирил)фенил)метансульфонамида (соединение IB-L1-L46).
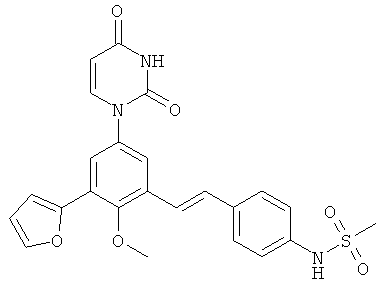
[00633] Названное соединение получали в соответствии с процедурой Примера 16 заменяя фуран-2-илбороновую кислоту на тиофен-2-илбороновую кислоту с получением твердого вещества белого цвета (22 мг, 56%).1Н ЯМР (300 MHz, DMSO-d6) δ ppm 3.03 (s, 3 H) 3.76 (s, 3 H) 5.69 (d, J=7.72 Hz, 1 H) 6.69 (dd, J=3.31, 1.84 Hz, 1 H) 7.08 (d, J=2.57 Hz, 1 H) 7.25 (d, J=8.46 Hz, 2 H) 7.36 (m, 2 H) 7.63 (d, J=8.82 Hz, 2 H) 7.67 (d, J=2.57 Hz, 1 H) 7.77 (d, J=2.57 Hz, 1 H) 7.82 (m, J=7.72 Hz, 2 H) 9.88 (s, 1 H) 11.48 (s, 1 H). MS (ESI+) m/z 497 (M+NH4)+.
[00634] Пример 18. Получение (Е)-N-(4-(5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метокеи-3-(пиридин-4-ил)стирил)фенил)метансульфонамида (соединение IB-L1-1.55).

[00635] Названное соединение получали в соответствии с процедурой Примера 16, заменяя 4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин на тиофен-2-илбороновую кислоту с получением твердого вещества белого цвета (15 мг, 38%).1Н ЯМР (300 MHz, DMSO-d6) δ ppm 3.03 (s, 3 H) 3.49 (s, 3 H) 5.72 (dd, J=7.72, 2.21 Hz, 1 H) 7.25 (d, J=8.46 Hz, 2 H) 7.38 (d, J=4.41 Hz, 2 H) 7.51 (d, J=2.57 Hz, 1 H) 7.63 (d, J=8.82 Hz, 2 H) 7.80 (d, J=5.88 Hz, 2 H) 7.85 (d, J=7.72 Hz, 1 H) 7.97 (d, J=2.57 Hz, 1 H) 8.77 (d, J=6.25 Hz, 2 H) 9.90 (s, 1 H) 11.51 (d, J=2.21 Hz, 1 H). MS (ESI+) m/z 491 (M+H)+.
[00636] Пример 19. Получение (Е)-N-(4-(5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метокси-3-(пиридин-3-ил)стирил)фенил)метансульфонамида (соединение IB-L1-1.53).

[00637] Названное соединение получали в соответствии с процедурой Примера 16, заменяя 3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридин на тиофен-2-илбороновую кислоту с получением твердого вещества белого цвета (19 мг, 48%).1Н ЯМР (300 MHz, DMSO-d6) δ ppm 3.02 (s, 3 H) 3.45 (s, 3 H) 5.71 (dd, J=8.09, 2.21 Hz, 1 H) 7.24 (d, J=8.46 Hz, 2 H) 7.37 (d, J=2.94 Hz, 2 H) 7.47 (d, J=2.57 Hz, 1 H) 7.63 (m, 3 H) 7.85 (d, J=7.72 Hz, 1 H) 7.93 (d, J=2.57 Hz, 1 H) 8.15 (m, 1 H) 8.68 (dd, J=4.80 Hz, 1.47 Hz, 1 H) 8.86 (d, J=1.84 Hz, 1 H) 9.89 (s, 1 H) 11.50 (d, J=2.21 Hz, 1 H). MS (ESI+) m/z 491 (M+H)+.
[00638] Пример 20. Получение (Е)-N-(4-(5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метокси-3-(тиофен-3-ил)стирил)фенил)метансульфонамида (соединение IB-L1-1.47).

[00639] Названное соединение получали в соответствии с процедурой Примера 16, заменяя тиофен-3-илбороновую кислоту на тиофен-2-илбороновую кислоту с получением твердого вещества белого цвета (19 мг, 38%).1Н ЯМР (300 MHz, DMSO-d6) δ ppm 3.02 (s, 3 H) 3.55 (s, 3 H) 5.69 (d, J=8.09 Hz, 1 H) 7.24 (d, J=8.46 Hz, 2 H) 7.36 (s, 2 H) 7.55 (m, 2 H) 7.61 (d, J=8.46 Hz, 2 H) 7.67 (dd, J=5.15, 2.94 Hz, 1 H) 7.78 (d, J=2.57 Hz, 1 H) 7.83 (d, J=7.72 Hz, 1 H) 7.93 (dd, J=2.57, 0.96 Hz, 1 H) 9.88 (s, 1 H) 11.48 (s, 1 H). MS (ESI-) m/z 494 (M-H)+.
[00640] Пример 21. Получение (Е)-N-(4-(5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-3-(фуран-3-ил)-2-метоксистирил)фенил)метансульфонамида (соединение IB-L1-1.50).

[00641] Названное соединение получали в соответствии с процедурой Примера 16, заменяя фуран-3-илбороновую кислоту на тиофен-2-илбороновую кислоту с получением твердого вещества белого цвета (14 мг, 29%).1Н ЯМР (300 MHz, DMSO-d6) δ ppm 3.02 (s, 3 H) 3.69 (s, 3 H) 5.69 (d, J=8.09 Hz, 1 H) 7.05 (dd, J=2.57, 0.90 Hz, 1 H) 7.24 (d, J=8.82 Hz, 2 H) 7.34 (s, 2 H) 7.61 (m, 3 H) 7.74 (d, J=2.57 Hz, 1 H) 7.80 (m, 2 H) 8.25 (s, 1 H) 9.88 (s, 1 H) 11.49 (s, 1 H). MS (ESI-) m/z 478 (M-H)+.
[00642] Пример 22. Получение (Е)-N-(4-(5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-3-(1-гидрокси-2-метилпропан-2-ил)-2-метоксистирил)фенил)метансульфонамида (соединение IB-L1-1.45).

[00643] Часть А. Получение 2-(2-гидрокси-3,5-дийодфенил)уксусной кислоты.
[00644] В 250 мл круглодонную колбу добавляли 2-(2-гидроксифенил)уксусную кислоту (Aldrich, 3,04 г, 20 ммоль) в ацетонитрил (50 мл) с получением бесцветного раствора. N-йодсукцинимид (9,00 г, 40,0 ммоль) добавляли порциями за период времени 15 мин с получением красного/коричневого прозрачного раствора, который перемешивали в течение 16 ч. Смесь концентрировали, и полученное в результате твердое вещество растирали в 75 мл воды и фильтровали для сбора оранжевого твердого вещества, которое сушили под вакуумом. Это неочищенное твердое вещество перекристаллизовывали из толуола с получением светлого оранжевого порошка (6,0 г, 74%).
[00645] Часть В. Получение метил 2-(3,5-дийод-2-метоксифенил)ацетата.
[00646] В 250 мл круглодонную колбу добавляли продукт из Части А (6 г, 14,85 ммоль), карбонат калия (6,16 г, 44,6 ммоль), и диметилсульфат (4,12 г, 32,7 ммоль) в ацетоне (49,5 мл) с получением коричневой суспензии. Эту суспензию нагревали с обратным холодильником в течение 16 ч, охлаждали, концентрировали, и остаток распределяли между EtOAc и водой. EtOAc слой промывали солевым раствором, сушили (Na2SO4) и концентрировали до коричневого масла, которое хроматографировали на картридже с диоксидом кремния 40 г, элюируя 3:1 гексаном/EtOAc с получением желтого масла (6,0 г, 94%).
[00647] Часть С. Получение метил 2-(3,5-дийод-2-метоксифенил)-2-метилпропаноата.
[00648] В 100 мл круглодонную колбу в атмосфере азота добавляли продукт из Части В (1,728 г, 4 ммоль) в безводном THF (20 мл) и НМРА (2 мл) с получением бесцветного раствора. Добавляли метилйодид (1,251 мл, 20,00 ммоль), и этот раствор охлаждали до -40°С. Добавляли по каплям т-бутоксид калия (12,00 мл, 12,00 ммоль), и смесь перемешивали при температуре от -40 до -20°С в течение 30 мин и гасили 1М HCl до рН 1. Смесь экстрагировали 3×40 мл EtOAc. Экстракты объединяли, промывали солевым раствором, сушили (Na2SO4) и концентрировали. Сырой продукт подвергали флэш-хроматографии на картридже с диоксидом кремния 40 г ISCO, элюируя 9:1 гексаном/EtOAc с получением бис-метилированного продукта в виде желтого масла (1,63 г, 89%).
[00649] Часть D. Получение 2-(3,5-дийод-2-метоксифенил)-2-метилпропановой кислоты.
[00650] Суспензию продукта из Части С (2,63 г, 5,72 ммоль) в МеОН (40 мл) и THF (40 мл) обрабатывали 4,0 М гидроксидом натрия (28 мл, 112 ммоль) и нагревали при 80°С в течение 48 ч. Органический растворитель упаривали и оставшийся водный раствор подкисляли 1М HCl, получая твердое вещество, которое собирали фильтрацией, промывали водой и сушили с получением желаемой карбоновой кислоты (2,46 г, 96%).
[00651] Часть Е. Получение 2-(3,5-дийод-2-метоксифенил)-2-метилпропан-1-ола.
[00652] Раствор продукта из Части D (1,00 г, 2,242 ммоль) в THF (40 мл) обрабатывали по каплям комплексом боран THF 1,0М (20 мл, 20 ммоль) и затем нагревали при 50°С в течение 24 ч. Смесь обрабатывали метанолом (20 мл), нагревали с обратным холодильником в течение 30 мин и концентрировали. Полученный в результате остаток промывали водой, солевым раствором, сушили сульфатом натрия, фильтровали и упаривали. Остаток хроматографировали на силикагеле, элюируя гексаном/EtOAc (4:1) с получением желаемого продукта (810 мг, 84%).
[00653] Часть F. Получение трет-бутил(2-(3,5-дийод-2-метоксифенил)-2-метилпропокси)-диметилсилана.
[00654] Раствор продукта из Части Е (432 мг, 1,000 ммоль) в DMF (5 мл) обрабатывали трет-бутилдиметилхлорсиланом (301 мг, 2,000 ммоль), и имидазолом (204 мг, 3,00 ммоль) и перемешивали в течение 2 ч. Смесь распределяли между 1М HCl и этилацетатом. Органический слой промывали насыщенным бикарбонатом натрия, солевым раствором, сушили сульфатом натрия, фильтровали и упаривали. Остаток хроматографировали на силикагеле, элюируя гексаном/EtOAc (9:1) с получением желаемого продукта (522 мг, 96%).
[00655] Часть G. Получение 1-(3-(1-(трет-бутилдиметилсилилокси)-2-метилпропан-2-ил)-5-йод-4-метоксифенил)пиримидин-2,4(1 Н,ЗН)-диона.
[00656] В 50 мл круглодонную колбу добавляли продукт из Части F (520 мг, 0,952 ммоль), пиримидин-2,4(1Н,3Н)-дион (117 мг, 1,047 ммоль), N-(2-цианофенил)пиколинамид (42,5 мг, 0,190 ммоль), йодид меди (I) (18,13 мг, 0,095 ммоль) и фосфат калия (424 мг, 1,999 ммоль) в DMSO (5 мл). Сосуд герметично закрывали, барботировали азотом и затем нагревали при 60°С в течение 24 ч. Смесь распределяли между 1М HCl и этилацетатом. Органический слой промывали насыщенным бикарбонатом натрия, солевым раствором, сушили сульфатом натрия, и фильтровали. Фильтрат обрабатывали 3-меркаптопропил-функционализированным силикагелем, фильтровали и упаривали. Остаток хроматографировали на силикагеле, элюируя гексаном/EtOAc (3:2) с получением продукта в виде твердого вещества (285 мг, 65%).
[00657] Часть Н. Получение (Е)-N-(4-(3-(1-(трет-бутилдиметилсилилокси)-2-метилпропан-2-ил)-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида.
[00658] В 5 мл микроволновую трубку добавляли продукт из Части G (53 мг, 0,1 ммоль), продукт из Примера 13 В, Части В (24 мг, 0,1 ммоль), фосфат калия (44,0 мг, 0,2 ммоль), PA-Ph (CAS 97739-46-3) (0,87 мг, 3,0 мкмоль) и трис(дибензилиденацетон)палладий(0) (0,9 мг, 1 мкмоль) в THF (3,0 мл) и воде (1,0 мл). Сосуд герметично закрывали, и смесь барботировали азотом в течение 5 мин и затем нагревали при 50°С в течение 2 ч. Смесь распределяли между 1М HCl и этилацетатом. Органический слой промывали насыщенным бикарбонатом натрия, солевым раствором, сушили сульфатом натрия и фильтровали. Фильтрат обрабатывали 3-меркаптопропил-функционализированным силикагелем, фильтровали и упаривали. Остаток хроматографировали на силикагеле, элюируя гексаном/EtOAc (1:1) с получением твердого вещества (50 мг, 83%).
[00659] Часть I. Получение (Е)-N-(4-(5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-3-(1-гидрокси-2-метилпропан-2-ил)-2-метоксистирил)фенил)метансульфонамида.
[00660] Раствор продукта из Части Н (120 мг, 0,20 ммоль) в THF (5,0 мл) обрабатывали 1М TBAF (0,800 мл, 0,800 ммоль) в THF и перемешивали в течение 16 ч. Смесь разделяли водой и этилацетатом. Органический слой промывали (3 Х солевым раствором), сушили сульфатом натрия, фильтровали и упаривали. Остаток хроматографировали на силикагеле, элюируя 4% метанолом в CH2Cl2 с получением твердого вещества (85 мг, 88%).1Н ЯМР (300 MHz, DMSO-d6) δ ppm 1.30 (s, 6 Н) 3.01 (s, 3 Н) 3.62 (d, J=5.52 Hz, 2 Н) 3.77 (s, 3 Н) 4.67 (t, J=5.33 Hz, 1 Н) 5.66 (d, J=8.09 Hz, 1 Н) 7.21 (m, 5 Н) 7.62 (m, 3 Н) 7.72 (d, J=8.09 Hz, 1 Н) 9.85 (s, 1 Н) 11.42 (s, 1 H). MS (ESI+) m/z 503 (M+NH4)+.
[00661] Пример 23. Получение (Е)-N-(4-(5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-3-йод-2-метоксистирил)фенил)метансульфонамида (соединение IB-L1-1.51).

[00662] Часть А. Получение 1,3,5-трийод-2-метоксибензола.
[00663] В 250 мл сосуд высокого давления добавляли 2,4,6-трийодфенол (5 г, 10,60 ммоль) в МТВЕ (60 мл) с получением желтого раствора. Раствор охлаждали на ледяной бане и добавляли быстрыми каплями 2,0М триметилсилилдиазометан (7,95 мл, 15,90 ммоль) с последующим добавлением по каплям метанола (6 мл), получая в результате спокойное выделение пузырьков газа. Сосуд герметично закрывали и перемешивали при комнатной температуре в течение 4 ч. Реакционный раствор распределяли между EtOAc и водой и органический слой промывали 1М HCl, насыщенным NaHCO3, и насыщенным NaCl. EtOAc слой сушили (MgSO4), фильтровали и концентрировали с получением твердого вещества желтовато-коричневого цвета, которое использовали без очистки (4,8 г, 94%).
[00664] Часть В. Получение 1-(3,5-дийод-4-метоксифенил)пиримидин-2,4(1Н,3Н)-диона.
[00665] В 100 мл круглодонную колбу в атмосфере N2 добавляли продукт из Части А (3,5 г, 7,2 ммоль), 1Н-пиримидин-2,4-дион (0,97 г, 8,64 ммоль), и трехосновный фосфат калия (3,2 г, 15,0 ммоль) в DMSO (50 мл) с получением бесцветной суспензии. Добавляли N-(2-цианофенил)пиколинамид (320 мг, 1,44 ммоль) и смесь барботировали N2 в течение 5 мин. Добавляли йодид меди (I) (137 мг, 0,72 ммоль), и эту смесь барботировали еще раз в течение 10 мин, помещали в атмосферу N2 и нагревали при 60°С в течение 18 ч. Смесь охлаждали и распределяли между EtOAc и водой, доводя рН до 1, используя HCl. Водный слой экстрагировали 2Х EtOAc. Органические экстракты объединяли, промывали водой, насыщенным NaHCO3, и насыщенным NaCl, сушили (Na2SO4), обрабатывали 3-меркаптопропил-функционализированным диоксидом кремния, фильтровали и концентрировали. Полученное в результате твердое вещество растирали в 2:1 гексане/EtOAc с получением беловатого порошка (2,2 г, 62%).
[00666] Часть С. Получение (Е)-N-(4-(5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-3-йод-2-метоксистирил)фенил)метансульфонамида.
[00667] В 5 мл микроволновой трубке перемешивали продукт из Части В (141 мг, 0,30 ммоль), продукт из Примера 13 В, Части В (72,3 мг, 0,300 ммоль), комплекс 1,1'-бис(дифенилфосфино)ферроцен-палладий(II)дихлорид CH2Cl2 (12,25 мг, 0,015 ммоль) и фосфат калия (70,0 мг, 0,330 ммоль) в THF (3,0 мл) и воде (1.0 мл). Смесь барботировали азотом в течение 5 мин и нагревали при 50°С в течение 2 ч. Смесь разделяли этилацетатом и 1М HCl. Органический слой промывали насыщенным бикарбонатом натрия, солевым раствором, сушили сульфатом натрия и фильтровали. Фильтрат обрабатывали 3-меркаптопропил-функционализированным силикагелем, фильтровали и упаривали. Остаток хроматографировали на диоксиде кремния, элюируя 5% метанолом в CH2Cl2 с получением твердого вещества (47 мг, 29%).1H ЯМР (300 MHz, DMSO-d6) δ ppm 3.02 (s, 3 H) 3.77 (s, 3 H) 5.67 (d, J=7.72 Hz, 1 H) 7.28 (m, 4 H) 7.60 (d, J=8.82 Hz, 2 H) 7.76 (d, J=8.09 Hz, 1 H) 7.81 (d, J=2.57 Hz, 1 H) 7.86 (d, J=2.21 Hz, 1 H) 9.90 (s, 1 H) 11.48 (s, 1 H). MS (ESI-) m/z 538 (M-H)+.
[00668] Пример 24. Получение (Е)-N-(4-(5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метокси-3-(метилсульфонил)стирил)фенил)метансульфонамида (соединение IB-L1-1.49).

[00669] Часть А. Получение 4-нитробензол-2-диазо-1-оксида.
[00670] В 250 мл круглодонную колбу добавляли 2-амино-4-нитрофенол (6,165 г, 40,0 ммоль) в 48% тетрафторборной кислоте (15 мл). Добавляли по каплям нитрит натрия (2,76 г, 40,0 ммоль) в воду (6 мл) при 0°С, и смесь перемешивали при комнатной температуре в течение 30 мин. Твердое вещество собирали фильтрацией, промывали тетрафторборной кислотой и водой. Твердое вещество суспендировали в ацетоне (50 мл), фильтровали и сушили с получением твердого вещества (3,31 г, 50%).
[00671] Часть В. Получение 2-(метилтио)-4-нитрофенола.
[00672] В 1 л лабораторный стакан добавляли продукт из Части А (2,70 г, 16,35 ммоль) в ледяной воде (250 г) с получением коричневой суспензии. Добавляли медь (0,520 г, 8,18 ммоль), с последующим медленным добавлением тиометоксида натрия (2,292 г, 32,7 ммоль) в воде (50 мл). Смесь перемешивали при комнатной температуре в течение 24 ч. Смесь фильтровали, и фильтрат подкисляли 1М HCl, получая твердое вещество, которое собирали фильтрованием, и сушили (2,53 г, 84%).
[00673] Часть С. Получение 2-(метилсульфонил)-4-нитрофенола.
[00674] В 250 мл круглодонную колбу добавляли продукт из Части В (1,111 г, 6,00 ммоль) в МеОН (20 мл) с получением коричневой суспензии. Медленно добавляли оксон (7,746 г, 12,60 ммоль) в воде (20 мл) при 0°С. Смесь нагревали до комнатной температуры, перемешивали в течение 1 ч и разделяли этилацетатом и 1М HCl. Органический слой промывали солевым раствором, сушили сульфатом натрия, фильтровали и упаривали. Остаток хроматографировали на силикагеле, элюируя 1% - 5% метанолом в CH2Cl2 с получением твердого вещества (0,472 г, 36%).
[00675] Часть D. Получение 2-йод-6-(метилсульфонил)-4-нитрофенола.
[00676] В 50 мл круглодонную колбу добавляли продукт из Части С (470 мг, 2,164 ммоль) в МеОН (10 мл) и воду (2,5 мл). Добавляли по каплям монохлорид йода (0,130 мл, 2,60 ммоль) в CH2Cl2 (2.0 мл), и смесь перемешивали при комнатной температуре, выливали в воду (200 мл) и перемешивали в течение 10 мин. Полученное в результате твердое вещество собирали фильтрованием и сушили (636 мг, 86%).
[00677] Часть Е. Получение 1-йод-2-метокси-3-(метилсульфонил)-5-нитробензола.
[00678] В 50 мл сосуд высокого давления добавляли продукт из Части D (630 мг, 1,836 ммоль) в МТВЕ (6 мл) с получением желтого раствора. Смесь охлаждали на ледяной бане и добавляли быстрыми каплями 2М триметилсилил-диазометан (1,377 мл, 2,75 ммоль) с последующим добавлением по каплям МеОН (0,4 мл), получая в результате спокойное выделение пузырьков газа. Сосуд герметично закрывали и перемешивали при комнатной температуре в течение 1 ч. Смесь разделяли этилацетатом и 1М HCl. Органический слой промывали насыщенным бикарбонатом натрия, солевым раствором, сушили сульфатом натрия, фильтровали и упаривали с получением беловатого твердого вещества (655 мг, 100%).
[00679] Часть F. Получение 3-йод-4-метокси-5-(метилсульфонил)анилина.
[00680] В 250 мл круглодонную колбу добавляли продукт из Части Е (0,650 г, 1,820 ммоль), хлорид аммония (0,146 г, 2,73 ммоль), и железо (0,508 г, 9,10 ммоль) в THF/MeOH/воде (50 мл, 2/2/1). Смесь нагревали с обратным холодильником в течение 2 ч, охлаждали и фильтровали. Фильтрат упаривали, и остаток разделяли этилацетатом и водой. Органический слой промывали солевым раствором, сушили сульфатом натрия, фильтровали и упаривали с получением твердого вещества (590 мг, 99%).
[00681] Часть G. Получение (Е)-N-(3-йод-4-метокси-5-(метилсульфонил)фенилкарбамоил)-3-метоксиакриламида.
[00682] В 100 мл круглодонную колбу добавляли продукт из Части F (500 мг, 1,528 ммоль) в DMF (15,0 мл). Раствор охлаждали в атмосфере азота до -20°С и добавляли по каплям (Е)-3-метоксиакрилоилизоцианат (15,28 мл, 6,11 ммоль; полученный, как описано Santana, L.; et al. J. Heterocyclic Chem. 1999, 36, 293-295). Смесь перемешивали при этой температуре в течение 15 мин, затем нагревали до комнатной температуры и перемешивали в течение 45 мин. Смесь разбавляли этилацетатом и промывали водой (3×50 мл), солевым раствором (3×50 мл), сушили сульфатом натрия, фильтровали и упаривали. Остаток растирали с этилацетатом/гексаном с получением твердого вещества (425 мг, 61%).
[00683] Часть Н. Получение 1-(3-йод-4-метокси-5-(метилсульфонил)фенил)пиримидин-2,4(1Н,3Н)-диона.
[00684] В 100 мл круглодонную колбу добавляли продукт из Части G (420 мг, 0,925 ммоль) в этанол (10 мл) с получением суспензии. Добавляли концентрированную серную кислоту (1 мл, 18,76 ммоль) в воду (10 мл), и смесь нагревали при 110°С в течение 2 ч. Реакционную смесь охлаждали, разбавляли водой (50 мл) и перемешивали в течение 10 мин. Твердое вещество собирали фильтрацией, промывали водой и сушили с получением твердого вещества белого цвета (325 мг, 83%).
[00685] Часть I. Получение (Е)-N-(4-(5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метокси-3-(метилсульфонил)стирил)фенил)метансульфонамида.
[00686] В 5 мл микроволновую трубку добавляли продукт из Части Н (63,3 мг, 0,15 ммоль), продукт из Примера 13 В, Части В (36,2 мг, 0,150 ммоль), фосфат калия (66,9 мг, 0,315 ммоль), РА-Ph (CAS 97739-46-3) (1,315 мг, 4,50 мкмоль) и трис(дибензилиденацетон)дипалладий(0) (1,374 мг, 1,500 мкмоль) в THF (3,0 мл) и воде (1,0 мл). Сосуд герметично закрывали, и смесь барботировали азотом в течение 5 мин и нагревали при 50°С в течение 2 ч. Смесь разделяли этилацетатом и 1М HCl. Органический слой промывали насыщенным бикарбонатом натрия, солевым раствором, сушили сульфатом натрия и фильтровали. Фильтрат обрабатывали 3-меркаптопропил-функционализированным силикагелем, фильтровали и упаривали. Остаток растирали с метанолом/CH2Cl2 с получением твердого вещества (62 мг, 84%).1Н ЯМР (300 MHz, DMSO-d6) δ ppm 3.03 (s, 3 Н) 3.37 (s, 3 Н) 3.94 (s, 3 Н) 5.72 (d, J=7.72 Hz, 1 Н) 7.26 (m, 3 Н) 7.45 (m, 1 Н) 7.65 (d, J=8.46 Hz, 2 Н) 7.77 (d, J=2.57 Hz, 1 Н) 7.81 (d, J=8.09 Hz, 1 Н) 8.21 (d, J=2.57 Hz, 1 Н) 9.93 (s, 1 Н) 11.52 (s, 1 Н). MS (ESI+) m/z 509 (M+NH4)+.
[00687] Пример 25. Получение (E)-метил 2-(3-отреот-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-2-метоксистирил)-5-(метилсульфонамид)бензоата (соединение IB-L1-1.7).

[00688] Часть А. Получение метил 2-((диэтоксифосфорил)метил)-5-нитробензоата.
[00689] К раствору метил 2-метил-5-нитробензоата (0,40 г, 2,05 ммоль) в CCl4 (20 мл) добавляли N-бромсукцинимид (365 мг, 2,05 ммоль) и 2,2'-азобисизобутиронитрил (34 мг, 0,21 ммоль). Полученную в результате смесь перемешивали при нагревании с обратным холодильником в течение 18 ч, охлаждали до комнатной температуры и распределяли между EtOAc (50 мл) и Н2О (50 мл). Органический слой сушили над Na2S04, фильтровали и концентрировали в вакууме. Сырой продукт очищали с помощью колоночной хроматографии на силикагеле, используя 1:3 EtOAc:гексан в качестве элюента с получением этого бромида в виде масла (345 мг, 61%). Это масло помещали в триэтилфосфит (5 мл) и нагревали при перемешивании при 120°С в течение 3 ч. Смесь оставляли охлаждаться до комнатной температуры, и сырой продукт очищали с помощью колоночной хроматографии на силикагеле, используя 5% МеОН в CH2Cl2 в качестве элюента. Названное соединение получали в виде масла (313 мг, 75%).
[00690] Часть В. Получение (Е)-метил 2-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)-5-нитробензоата.
[00691] К раствору продукта из Части А (360 мг, 1,09 ммоль) и продукта из Примера 13А, Части D (329 мг, 1,09 ммоль) в безводном CH2Cl2 (10 мл) добавляли трет-бутоксид калия (305 мг, 2,72 ммоль). Полученный в результате темный красный раствор перемешивали при комнатной температуре в течение 1 ч, и затем выливали в 1 н водн. HCl (10 мл). Полученную в результате смесь экстрагировали CH2Cl2 (10 мл), сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением твердого вещества. Раствор этого твердого вещества в тионилхлориде (2,3 мл) нагревали при 85°С в течение 30 мин, и тионилхлорид удаляли в вакууме. Остаток перемешивали в смеси 2:1 CH2Cl2 и МеОН (3 мл) в течение 30 мин, и упаривали в вакууме до сухости. Сырой продукт очищали с помощью колоночной хроматографии на силикагеле, используя 3% МеОН в CH2Cl2 в качестве элюента, с получением названного соединения (350 мг, 69%).
[00692] Часть С. Получение (E)-метил 2-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-2-метоксистирил)-5-(метилсульфонамид)бензоата.
[00693] К раствору продукта из Части В (465 мг, 0,97 ммоль) в смеси 2:2:1 THF:MeOH:H2O (10 мл) добавляли железные опилки (271 мг, 4,85 ммоль), и хлорид аммония (78 мг, 1,46 ммоль). Смесь нагревали при 80°С в течение 45 мин, фильтровали через целит, и концентрировали до сухости в вакууме. Остаток объединяли с метансульфонилхлоридом (0,16 мл, 2,0 ммоль) и триэтиламином (0,392 мл, 4,85 ммоль) в безводном CH2Cl2 (10 мл) и полученную в результате смесь перемешивали при комнатной температуре в течение 3 ч. Смесь распределяли между 1 н HCl (20 мл) и CH2Cl2 (20 мл), и органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме. Сырой продукт очищали с помощью колоночной хроматографии на силикагеле, используя 3% МеОН в CH2Cl2 в качестве элюента с получением названного соединения (270 мг, 53%).1Н ЯМР (300 MHz, DMSO-d6) δ 11.42 (s, 1 Н) 10.07 (s, 1 Н) 7.90 (d, J=8.82 Hz, 1 Н) 7.66-7.79 (m, 3 Н) 7.52 (d, J=2.57 Hz, 1 Н) 7.44 (dd, J=8.64, 2.39 Hz, 1 Н) 7.14-7.26 (m, 2 Н) 5.65 (dd, J=7.72, 1.84 Hz, 1 Н) 3.86 (s, 3 Н) 3.79 (s, 3H) 3.04 (s, 3H) 1.38 (s, 9H).
[00694] Пример 26. Получение (E)-2-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-2-метоксистирил)-5-(метилсульфонамид)бензойной кислоты (соединение IB-L1-1.4).

[00695] Раствор продукта из Примера 25 (55 мг, 0,104 ммоль) в THF (1 мл) и 1 н водн. NaOH (1 мл) перемешивали в темноте при комнатной температуре в течение 1,5 ч. Добавляли 1 н водный HCl до рН 3, и полученную в результате смесь экстрагировали EtOAc (2×2 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали с получением названного соединения (53 мг, 99%).1Н ЯМР (300 MHz, DMSO-d6) δ 13.22 (br s, 1 Н) 11.40 (d, J=2.21 Hz, 1 Н) 10.02 (s, 1 Н) 7.72-7.91 (m, 3 Н) 7.68 (d, J=2.57 Hz, 1 H) 7.49 (d, J=2.57 Hz, 1 H) 7.42 (dd, J=8.64, 2.39 Hz, 1 H) 7.21 (d, J=2.57 Hz, 1 H) 7.16 (d, J=16.18 Hz, 1 H) 5.64 (dd, J=7.72, 2.21 Hz, 1 H) 3.79 (s, 3 H) 3.04 (s, 3H) 1.38 (s, 9H).
[00696] Пример 27. Получение (E)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-2-метоксистирил)-3-(морфолин-4-карбонил)фенил)метансульфонамида (соединение IB-L1-1.23).
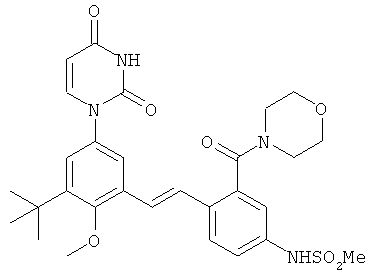
[00697] Часть А. Получение (E)-2-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-2-метоксистирил)-5-(метилсульфонамид)бензоилхлорида.
[00698] Раствор продукта из Примера 26 (257 мг, 0,50 ммоль) в тионилхлориде (1,5 мл) нагревали при 85°С в течение 40 мин и затем концентрировали и сушили в вакууме с получением названного соединения в виде твердого вещества (0,27 г).
[00699] Часть В. Получение (E)-N-(4-(3-тереот-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-2-метоксистирил)-3-(морфолин-4-карбонил)фенил)метансульфонамида.
[00700] К раствору продукта из Части А (24 мг, 0,045 ммоль) в безводном CH2Cl2 (1 мл) добавляли морфолин (0,02 мл, 0,226 ммоль). Смесь перемешивали при комнатной температуре в течение 2 ч, и затем распределяли между 1 н водн. HCl (5 мл) и EtOAc (2×5 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме. Сырой продукт очищали с помощью колоночной хроматографии на силикагеле, используя 4% МеОН в CH2Cl2 в качестве элюента, с получением названного соединения (19 мг, 71%).1Н ЯМР (300 MHz, DMSO-d6) δ ppm 11.41 (d, J=1.84 Hz, 1 Н) 10.04 (s, 1 Н) 7.85 (d, J=8.46 Hz, 1 Н) 7.75 (d, J=8.09 Hz, 1 Н) 7.52 (d, J=2.57 Hz, 1 Н) 6.99-7.34 (m, 5 Н) 5.65 (dd, J=7.72, 1.84 Hz, 1 Н) 3.76 (s, 3 Н) 3.56-3.71 (m, 4 Н) 3.40-3.51 (m, 2H) 3.11-3.22 (m, 2 Н) 3.06 (s, 3 Н) 1.38 (s, 9 Н).
[00701] Пример 28. Получение (E)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-2-метоксистирил)-3-(гидроксиметил)фенил)метансульфонамида (соединение IB-L1-1.10).

[00702] К раствору продукта из Примера 27, Части А (375 мг, 0,705 ммоль) в безводном THF (5 мл) при 0°С в атмосфере газообразного N2 добавляли по каплям 1,0 М раствор литий трет-бутоксиалюминий гидрида (1,8 мл, 1,8 ммоль). Полученную в результате смесь перемешивали при 0°С в течение 30 мин, и затем оставляли нагреваться до комнатной температуры и перемешивали в течение 1 ч. Смесь распределяли между 1 н водн. HCl (10 мл) и EtOAc (2×10 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме. Сырой продукт очищали с помощью колоночной хроматографии на силикагеле, используя 3% МеОН в CH2Cl2 в качестве элюента, с получением названного соединения (220 мг, 63%).1Н ЯМР (300 MHz, DMSO-d6) δ ppm 11.41 (s, 1 Н) 9.82 (s, 1 Н) 7.73 (t, J=8.27 Hz, 2 Н) 7.66 (d, J=2.57 Hz, 1 Н) 7.31-7.39 (m, 2 Н) 7.20 (d, J=2.57 Hz, 1 Н) 7.12-7.19 (m, 2 Н) 5.65 (d, J=8.09 Hz, 1 Н) 5.28 (t, J=5.52 Hz, 1 H) 4.65 (d, J=5.52 Hz, 2 H) 3.79 (s, 3 H) 3.00 (s, 3 H) 1.38 (s, 9 H).
[00703] Пример 29. Получение (E)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-2-метоксистирил)-3-(метоксиметил)фенил)метансульфонамида (соединение IB-L1-1.13).

[00704] К раствору продукта из Примера 28 (32 мг, 0,064 ммоль) в безводном CH2Cl2 (1 мл) добавляли тионилхлорид (23 мкл, 0,32 ммоль), и полученную в результате смесь перемешивали при комнатной температуре в течение 30 мин. Смесь распределяли между насыщенным водн. NaHCO3 (5 мл) и CH2Cl2 (5 мл), и органический слой сушили над Na2SO4, фильтровали и концентрировали. Остаток растворяли в МеОН (1 мл), и добавляли раствор 25% NaOMe в МеОН (58 мкл, 0,254 ммоль). Полученную в результате смесь перемешивали при 50°С в течение 2 ч. Смесь распределяли между 1 н водн. HCl (10 мл) и EtOAc (2×10 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме. Сырой продукт очищали с помощью колоночной хроматографии на силикагеле, используя 3% МеОН в CH2Cl2 в качестве элюента, с получением названного соединения (15 мг, 46%).1Н ЯМР (300 MHz, DMSO-d6) δ 11.43 (s, 1 H) 9.86 (s, 1 H) 7.62-7.87 (m, 3 H) 7.12-7.39 (m, 5 H) 5.66 (d, J=7.72 Hz, 1 H) 4.58 (s, 2 H) 3.78 (s, 3 H) 3.35 (s, 3 H) 3.00 (s, 3 H) 1.38 (s, 9H).
[00705] Пример 30. Получение (E)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-2-метоксистирил)-3-((изопентиламино)метил)фенил)метансульфонамида (соединение IB-L1-1.31).

[00706] Часть А. Получение (E)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-2-метоксистирил)-3-формилфенил)метансульфонамида.
[00707] К раствору продукта из Примера 28 (0,60 г, 1,20 ммоль) в безводном DMA (15 мл) добавляли 2-йодоксибензойную кислоту (336 мг, 1,20 ммоль). Смесь перемешивали при комнатной температуре в течение 1 ч, и затем распределяли между EtOAc (20 мл) и H2O (2×20 мл). Органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме. Сырой продукт очищали с помощью колоночной хроматографии на силикагеле, используя 2% МеОН в CH2Cl2 в качестве элюента, с получением названного соединения в виде бесцветного твердого вещества (395 мг, 66%).1Н ЯМР (300 MHz, DMSO-d6) δ ppm 11.43 (d, J=2.21 Hz, 1 H) 10.45 (s, 1 H) 10.15 (s, 1 H) 8.06 (d, J=16.18 Hz, 1 H) 7.97 (d, J=8.82 Hz, 1 H) 7.73-7.78 (m, 2 H) 7.69 (d, J=2.57 Hz, 1 H) 7.51 (dd, J=8.64, 2.39 Hz, 1 H) 7.30 (d, J=16.18 Hz, 1 H) 7.26 (d, J=2.57 Hz, 1 H) 5.66 (dd, J=7.72, 2.21 Hz, 1 H) 3.81 (s, 3 H) 3.07 (s, 3 H) 1.39 (s, 9 H).
[00708] Часть В. Получение (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)-3-((изопентиламино)метил)фенил)метансульфонамида.
[00709] К раствору продукта из Части А (50 мг, 0,10 ммоль) и 3-метилбутан-1-амина (12 мкл, 0,10 ммоль) в безводном THF (3 мл) добавляли триацетоксиборгидрид натрия (32 мг, 0,15 ммоль) и АсОН (9 мкл, 0,15 ммоль). Полученную в результате смесь перемешивали при комнатной температуре в течение 4 ч, и затем распределяли между H2O (10 мл) и EtOAc (2×10 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме. Сырой продукт очищали с помощью колоночной хроматографии на силикагеле, используя 3% МеОН в CH2Cl2 в качестве элюента с получением названного соединения (37 мг, 65%).1Н ЯМР (300 MHz, DMSO-d6) δ 11.45 (d, J=1.84 Hz, 1 H) 10.04 (s, 1 H) 8.80-8.87 (m, 1 H) 7.88 (d, J=8.46 Hz, 1 H) 7.71-7.77 (m, 2 H) 7.41-7.48 (m, 1 H) 7.37 (d, J=2.21 Hz, 1 H) 7.21-7.29 (m, 3 H) 5.67 (dd, J=7.91, 2.02 Hz, 1 H) 4.30-4.38 (m, 2 H) 3.80 (s, 3 H) 3.10 (s, 3 H) 2.95-3.04 (m, 2 H) 1.49-1.67 (m, 3 H) 1.38 (s, 9 H) 0.86 (d, J=6.25 Hz, 6 H).
[00710] Пример 31. Получение N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-2-метоксистирил)-3-((E)-(метоксиимино)метил)фенил)метансульфонамида (соединение IB-L1-1.19).

[00711] К раствору продукта из Примера 30, Часть А (35 мг, 0,070 ммоль) в EtOH (2 мл) добавляли 0-метоксиламин гидрохлорид (29 мг, 0,35 ммоль) и бикарбонат натрия (30 мг, 0,35 ммоль). Полученную в результате смесь перемешивали при 70°С в течение 2 ч. К смеси добавляли 1 н водн. HCl (1 мл) с получением бесцветного осадка, который фильтровали и сушили с получением названного соединения в виде бесцветного твердого вещества (24 мг, 64%).1Н ЯМР (300 MHz, DMSO-d6) δ ppm 11.43 (d, J=2.21 Hz, 1 Н) 9.94 (s, 1 Н) 8.74 (s, 1 Н) 7.79-7.85 (m, 2 Н) 7.76 (d, J=7.72 Hz, 1 Н) 7.57-7.65 (m, 2 Н) 7.32 (dd, J=8.64, 2.39 Hz, 1 Н) 7.23 (d, J=2.57 Hz, 1 Н) 7.18 (d, J=16.18 Hz, 1 Н) 5.66 (dd, J=7.72, 2.21 Hz, 1 Н) 3.93 (s, 3 Н) 3.79 (s, 3 Н) 3.03 (s, 3 Н) 1.38 (s, 9 Н).
[00712] Пример 32. Получение (E)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-2-метоксистирил)-3-(оксазол-2-ил)фенил)метансульфонамида (соединение IB-L1-1.26).

[00713] К раствору продукта из Примера 27, Части А (80 мг, 0,15 ммоль) в тетраметиленсульфоне (1,5 мл) добавляли 1H-1,2,3-триазол (10 мкл, 0,17 ммоль) и карбонат калия (73 мг, 0,53 ммоль). Смесь нагревали в течение 35 мин при 130°С в микроволновом реакторе. После охлаждения до комнатной температуры, смесь распределяли между 1 н водным HCl (10 мл) и EtOAc (2×10 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме. Сырой продукт очищали с помощью колоночной хроматографии на силикагеле, используя 3% МеОН в CH2Cl2 в качестве элюента с получением названного соединения (37 мг, 46%).1Н ЯМР (300 MHz, DMSO-d6) δ 11.41 (d, J=1.84 Hz, 1 Н) 10.10 (s, 1 Н) 8.29 (d, J=1.10 Hz, 1 Н) 8.05 (d, J=16.18 Hz, 1 Н) 7.95 (d, J=8.82 Hz, 1 Н) 7.82 (d, J=2.21 Hz, 1 Н) 7.74 (d, J=8.09 Hz, 1 Н) 7.51 (d, J=2.57 Hz, 1 Н) 7.46 (d, J=0.74 Hz, 1 Н) 7.39 (dd, J=8.64, 2.39 Hz, 1 Н) 7.20-7.30 (m, 2 Н) 5.65 (dd, J=7.91, 2.02 Hz, 1 Н) 3.80 (s, 3 Н) 3.07 (s, 3H) 1.38 (s, 9H).
[00714] Пример 33. Получение (E)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-2-метоксистирил)-3-(1H-имидазол-2-ил)фенил)метансульфонамида (соединение IB-L1-1.16).

[00715] К раствору продукта из Примера 30, Части А (50 мг, 0,10 ммоль) в EtOH (2 мл) добавляли глиокеаль (57 мкл, 0,50 ммоль) и концентрированный водный NH4OH (70 мкл, 0,50 ммоль). Полученную в результате смесь перемешивали при комнатной температуре в течение 16 ч. В смесь добавляли 1 н водн. HCl до рН=7, и смесь распределяли между H2O (10 мл) и EtOAc (2×10 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме. Сырой продукт очищали с помощью колоночной хроматографии на силикагеле, используя 5% МеОН в CH2Cl2 в качестве элюента, с получением названного соединения (27 мг, 50%).1Н ЯМР (300 MHz, DMSO-d6) δ 12.39 (s, 1 Н) 11.40 (d, J=1.84 Hz, 1 Н) 9.98 (s, 1 Н) 7.89 (d, J=8.82 Hz, 1 Н) 7.66-7.76 (m, 2 Н) 7.38 (t, J=2.21 Hz, 2 Н) 7.23-7.31 (m, 2 Н) 7.06-7.21 (m, 3 Н) 5.63 (dd, J=8.09, 1.84 Hz, 1 H) 3.78 (s, 3 H) 3.07 (s, 3 H) 1.37 (s, 9 H).
[00716] Пример 34. Получение (Е)-трет-бутил 2-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-2-метоксистирил)-5-(метилсульфонамид)фенилкарбамата (соединение IB-L1-1.32).
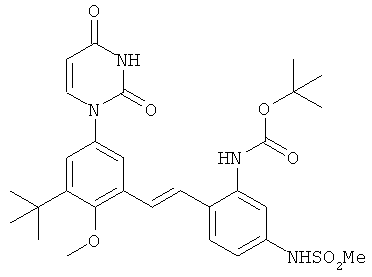
[00717] К раствору продукта из Примера 26 (75 мг, 0,146 ммоль) в трет-бутаноле (4 мл) добавляли дифенилфосфорилазид (47 мкл 0,219 ммоль) и триэтиламин (31 мкл, 0,219 ммоль). Полученную в результате смесь перемешивали при 80°С в течение 18 ч. Охлажденную смесь распределяли между Н2О (10 мл) и EtOAc (2×10 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме. Сырой продукт очищали с помощью колоночной хроматографии на силикагеле, используя 3% МеОН в CH2Cl2 в качестве элюента, с получением названного соединения (16 мг, 19%).1Н ЯМР (300 MHz, DMSO-d6) δ 11.45 (d, J=1.84 Hz, 1 H) 9.86 (s, 1 H) 9.03 (s, 1 H) 7.75 (d, J=7.72 Hz, 2 H) 7.55 (d, J=2.57 Hz, 1 H) 7.10-7.33 (m, 4 H) 7.04 (dd, J=8.64, 2.39 Hz, 1 H) 5.66 (dd, J=7.91, 2.02 Hz, 1 H) 3.78 (s, 3 H) 3.02 (s, 3 H) 1.45 (s, 9 H) 1.38 (s, 9 H).
[00718] Пример 35. Получение (E)-N-(3-амино-4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-2-метоксистирил)фенил)метансульфонамида (соединение IB-L1-1.28).

[00719] Процедура, описанная для получения Примера 34 давала названное соединение, которое очищали с помощью колоночной хроматографии на силикагеле, используя 5% метанол в CH2Cl2 в качестве элюента (6 мг, 9%).1Н ЯМР (300 MHz, DMSO-d6) δ 11.44 (d, J=2.21 Hz, 1 H) 9.55 (s, 1 H) 7.77 (d, J=2.57 Hz, 1 H) 7.75 (d, J=8.09 Hz, 1 H) 7.45 (d, J=8.46 Hz, 1 H) 7.33 (d, J=15.81 Hz, 1 H) 7.15 (d, J=2.57 Hz, 1 H) 7.00 (d, J=16.18 Hz, 1 H) 6.56 (d, J=2.21 Hz, 1 H) 6.44 (dd, J=8.46, 2.21 Hz, 1 H) 5.66 (dd, J=7.91, 2.02 Hz, 1 H) 5.56 (s, 2 H) 3.78 (s, 3 H) 2.97 (s, 3 H) 1.37 (s, 9 H).
[00720] Пример 36. Получение (E)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-2-метоксистирил)-2-фторфенил)метансульфонамида (соединение IB-L1-1.5).

[00721] Часть А. Получение (3-фтор-4-нитрофенил)метанола.
[00722] К раствору 3-фтор-4-нитробензойной кислоты (2,0 г, 10,8 ммоль) в THF (50 мл) при 0°С добавляли по каплям комплекс ВН3·Me2S (2,215 мл, 22,15 ммоль). Смесь перемешивали при 0°С в течение 3 ч, и затем перемешивали при 65°С в течение 18 ч. К охлажденной смеси добавляли лед (50 г), с последующим добавлением 1 н водн. HCl (100 мл), и полученную в результате смесь экстрагировали EtOAc (200 мл). Органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением названного соединения в виде твердого вещества белого цвета (1,79 г, 97%).
[00723] Часть В. Получение 4-(бромметил)-2-фтор-1-нитробензола.
[00724] Раствор продукта из Части А (1,79 г, 10,46 ммоль), N-бромсукцинимида (2,234 г, 12,55 ммоль) и трифенилфосфина (3,29 г, 12,55 ммоль) в CH2Cl2 (100 мл) и THF (50 мл) перемешивали при комнатной температуре в течение 3 ч. Смесь распределяли между H2O (200 мл) и EtOAc (400 мл), и органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме. Сырой продукт очищали с помощью колоночной хроматографии на силикагеле, используя 1:1 EtOAc:гексан в качестве элюента с получением названного соединения (1,14 г, 47%).
[00725] Часть С. Получение диэтил 3-фтор-4-нитробензилфосфоната.
[00726] Продукт из Части В (1,25 г, 5,34 ммоль) подвергали условиям, описанным для Примера 6, Части В с получением названного продукта (0,75 г, 48%).
[00727] Часть D. Получение (E)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-2-метоксистирил)-2-фторфенил)метансульфонамида.
[00728] Продукт из Части С (0,193 г, 0,662 ммоль) подвергали условиям, описанным для Примера 13А, Части Е, Части F, и Части G с получением названного продукта в виде бесцветного твердого вещества (15 мг, 5%).1Н ЯМР (300 MHz, DMSO-d6) δ 11.43 (s, 1H), 9.67 (s, 1H), 7.76 (d, J=8.1Hz, 1H), 7.62 (m, 2H), 7.41 (m, 2H), 7.38 (m, 1H), 7.23 (m, 2H), 5.66 (dd, J=8.0, 2.0 Hz, 1H), 3.80 (s, 3H), 3.05 (s, 3H), 1.38 (s, 9H).
[00729] Пример 37. Получение (E)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-2-метоксистирил)-2-фтор-5-метилфенил)метансульфонамида (соединение IB-L1-1.15).

[00730] Часть А. Получение N-(4-бром-2-фтор-5-метилфенил)метансульфонамида.
[00731] К раствору 4-бром-2-фтор-5-метиланилина (2,04 г, 10,0 ммоль) в безводном CH2Cl2 (20 мл) и пиридине (3,23 мл, 40,0 ммоль) добавляли метансульфонилхлорид (0,86 мл, 11,0 ммоль), и полученную в результате смесь перемешивали при комнатной температуре в течение 2 ч. Растворитель удаляли в вакууме, и остаток распределяли между EtOAc и 1М водн. HCl. Органический слой промывали насыщенным водным NaHCO3, солевым раствором и затем сушили над Na2SO4. Высушивающее вещество отфильтровывали, и фильтрат концентрировали с получением названного соединения в виде твердого вещества (2,80 г, 99%).
[00732] Часть В. Получение N-(4-этинил-2-фтор-5-метилфенил)метансульфонамида.
[00733] Смесь продукта из Части А (3,0 г, 10,63 ммоль), трифенилфосфина (0,279 г, 1,06 ммоль), триметилсилилацетата (6,0 мл, 42,5 ммоль) и ацетата палладия(II) (0,12 г, 0,53 ммоль) в триэтиламине (30 мл) и толуоле (15 мл) в атмосфере N2 нагревали при 80°С в течение 5 ч. Смесь оставляли охлаждаться до комнатной температуры, и распределяли между EtOAc и 1М водн. HCl. Органический слой промывали насыщенным NaHCOa и солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в вакууме. Сырой продукт очищали с помощью колоночной хроматографии на силикагеле, используя градиент растворителей 10% - 35% EtOAc в гексане с получением масла (3,0 г, 94%). К раствору этого масла (3,0 г, 10,0 ммоль) в МеОН (50 мл) добавляли 1М водн. NaOH (21 мл, 21,0 ммоль), и полученную в результате смесь перемешивали при комнатной температуре в течение 45 мин. Смесь распределяли между EtOAc и 1М водн. HCl, и органический слой промывали солевым раствором и сушили над Na2SO4. Высушивающее вещество отфильтровывали, и фильтрат концентрировали в вакууме с получением названного соединения в виде твердого вещества (2,3 г, колич.).
[00734] Часть С. Получение (E)-5-фтор-2-метил-4-(метилсульфонамид)стирилбороновой кислоты.
[00735] Продукт из Части В (0,20 г, 0,88 ммоль) подвергали условиям, описанным для получения Примера 13 В, Части В с получением названного соединения (42 мг, 17%).
[00736] Часть D. Получение (E)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-2-метоксистирил)-2-фтор-5-метилфенил)метансульфонамида.
[00737] Продукт из Части С (40 мг, 0,15 ммоль) подвергали условиям, описанным для получения Примера 13 В, Части I с получением названного соединения (51 мг, 83%).1Н ЯМР (300 MHz, DMSO-d6) δ 11.42 (d, J=2.21 Hz, 1 Н) 9.59 (s, 1 Н) 7.70-7.78 (m, 2 Н) 7.66 (d, J=11.77 Hz, 1 Н) 7.20-7.32 (m, 3 Н) 5.65 (dd, J=7.72, 2.21 Hz, 1 Н) 3.79 (s, 3 Н) 3.05 (s, 3 Н) 2.38 (s, 3 Н) 1.38 (s, 9 Н).
[00738] Пример 38. Получение метил 2-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-2-метоксифенэтил)-5-(метилсульфонамид)бензоата (соединение IB-L5-2-L1).

[00739] К раствору продукта из Примера 25(40 мг, 0,076 ммоль) в МеОН (2 мл) и THF (2 мл) добавляли 10% Pd/C (20 мг), и полученную в результате смесь перемешивали при комнатной температуре под давлением 1 атм Н2 в течение 16 ч. Смесь фильтровали через целит и концентрировали в вакууме с получением твердого вещества (27,5 мг, 68%).1Н ЯМР (300 MHz, DMSO-d6) δ 11.39 (s, 1 Н) 9.88 (s, 1 Н) 7.61-7.71 (m, 2 Н) 7.28-7.36 (m, 2 Н) 7.20 (d, J=2.57 Hz, 1 H) 7.13 (d, J=2.94 Hz, 1 H) 5.64 (d, J=7.72 Hz, 1 H) 3.83 (s, 3 H) 3.75 (s, 3 H) 3.14 (dd, J=10.30, 5.88 Hz, 2 H) 2.96 (s, 3 H) 2.83-2.92 (m, 2 H) 1.34 (s, 9 H).
[00740] Пример 39. Получение N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-2-метоксифенэтил)фенил)метансульфонамида (соединение IB-L5-2-1.2).
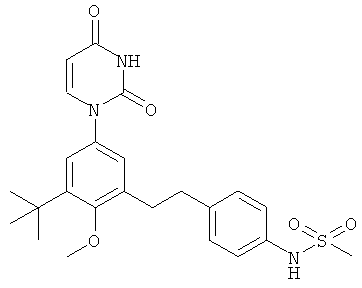
[00741] Продукт из Примера 13В, Части М (200 мг, 0,426 ммоль) растворяли в МеОН (10 мл) с последующим добавлением 10% палладия на активированном угле (50 мг). Полученную в результате смесь вакуумировали и присоединяли водородную шину, затем перемешивали при комнатной температуре в течение 48 ч. Смесь затем фильтровали через целит и фильтрат концентрировали под вакуумом до масла, которое растворяли в этаноле (4 мл), затем добавляли 1 н раствор водного гидроксида натрия (3,8 мл, 3,8 ммоль), и этот раствор перемешивали при комнатной температуре в течение 18 ч. Этанол затем удаляли под вакуумом и добавляли 1 н раствор водной соляной кислоты (4 мл) для подкисления смеси с последующей экстракцией с использованием EtOAc (2×10 мл). Органические экстракты объединяли, сушили и очищали с помощью колоночной хроматографии на силикагеле, используя 5% МеОН в CH2Cl2 в качестве элюента с получением названного соединения в виде бесцветного твердого вещества (82 мг, 41%).1Н ЯМР (300 MHz, DMSO-d6) δ 11.39 (s, 1H), 9.60 (s, 1H), 7.65 (d, J=8.1Hz, 1H), 7.23 (m, 3H), 7.17 (m, 3H), 5.64 (d, J=7.7Hz, 1H), 3.77 (s, 3H), 2.93 (s, 3H), 2.88 (br s, 4H), 1.35 (s, 9H).
[00742] Пример 40. Получение (E)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-2-этоксистирил)фенил)метансульфонамида (соединение IB-L1-1.30).

[00743] Часть А. Получение 2-трет-бутил-4-йодфенола.
[00744] В 250 мл круглодонную колбу добавляли 2-трет-бутилфенол (3,76 г, 25 ммоль) в МеОН (50,0 мл) с получением бесцветного раствора. Добавляли гидроксид натрия (1,200 г, 30,0 ммоль), и смесь перемешивали до полного растворения гидроксида. Раствор охлаждали до 0°С и обрабатывали йодидом натрия (1,75 г, 11,6 ммоль) с последующим добавлением по каплям 10% раствора гипохлорита натрия (7,2 мл, 11,6 ммоль). Добавление йодида натрия с последующим добавлением гипохлорита натрия повторяли дважды, и смесь перемешивали при 0°С в течение 30 мин. Смесь обрабатывали 10% масс/масс раствором тиосульфата натрия, перемешивали в течение 30 мин и обрабатывали по каплям концентрированной HCl до постоянного рН 1. Смесь экстрагировали 3Х EtOAc. Экстракты объединяли, промывали солевым раствором, сушили (MgSO4), фильтровали и концентрировали. Неочищенное масло подвергали флэш-хроматографии на картридже с диоксидом кремния Isco 80 г, элюируя гексаном до >4:1 гексан/EtOAc с получением желтого масла (5,2 г, 75%).
[00745] Часть В. Получение 2-бром-6-трет-бутил-4-йодфенола.
[00746] В 250 мл круглодонную колбу добавляли продукт из Части А (4,8 г, 17,38 ммоль) и 1,3-дибром-5,5-диметилгидантоин (2,61 г, 9,13 ммоль) в хлороформе (87 мл) с получением оранжевого раствора. Реакционную смесь перемешивали в течение 2 ч, получая в результате черный раствор, который промывали водой, солевым раствором, сушили (Na2SO4) и концентрировали. Черное масло подвергали флэш-хроматографии на картридже с диоксидом кремния 120 г Isco, с получением розоватого твердого вещества (4,84 г, 78%).
[00747] Часть С. Получение 1-бром-3-трет-бутил-2-этокси-5-йодбензола.
[00748] В 50 мл круглодонную колбу добавляли продукт из Части В (888 мг, 2,5 ммоль), этилйодид (409 мг, 2,63 ммоль), и карбонат калия (415 мг, 3,00 ммоль) в ацетоне (12 мл) с получением зеленой суспензии. Смесь нагревали с обратным холодильником в течение 16 ч, охлаждали и концентрировали. Остаток разделяли между водой и EtOAc. Органический слой промывали дважды солевым раствором, сушили над Na2S04, фильтровали и концентрировали до красного масла. Это масло подвергали флэш-хроматографии на картридже с диоксидом кремния Isco 40 г, элюируя гексаном с получением прозрачного масла (820 мг, 86%).
[00749] Часть D. Получение 1-(3-бром-5-трет-бутил-4-этоксифенил)пиримидин-2,4(1Н,3Н)-диона.
[00750] В 20 мл микроволновую трубку под струей азота добавляли продукт из Части С (0,4 г, 1,044 ммоль), 1 Н-пиримидин-2,4-дион (0,140 г, 1,253 ммоль), и трехосновный фосфат калия (0,465 г, 2,193 ммоль) в DMSO (5 мл) с получением бесцветной суспензии. Добавляли N-(2-цианофенил)пиколинамид (0,047 г, 0,209 ммоль), и смесь барботировали азотом в течение 10 мин. Добавляли йодид меди (I) (0,020 г, 0,104 ммоль), и эту смесь барботировали еще раз в течение 10 мин, помещали в атмосферу азота и нагревали при 60°С в течение 18 ч. Смесь охлаждали и распределяли между EtOAc и водой, доводя рН до 1, используя HCl. Водный слой экстрагировали 2Х EtOAc. Органические экстракты объединяли, промывали водой, насыщенным NaHCO3, и насыщенным NaCl. Органический слой сушили (Na2SO4), перемешивали с 3-меркаптопропил-функционализированным диоксидом кремия в течение 1 ч, фильтровали и концентрировали. Сырой продукт очищали с помощью хроматографии картридже с диоксидом кремния Isco 12 г, элюируя 2% МеОН в CH2Cl2 с получением белого порошка (266 мг, 69%).
[00751] Часть Е. Получение (E)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-2-этоксистирил)фенил)метансульфонамида.
[00752] Смесь продукта из Части D (55,1 мг, 0,15 ммоль), продукта из Примера 13 В, Части В (36,2 мг, 0,150 ммоль), трехосновного фосфата калия (63,7 мг, 0,300 ммоль) и 1,1'-бис(ди-трет-бутилфосфино)ферроцен палладия дихлорида (4,89 мг, 7,50 мкмоль) в THF (3 мл) и воде (1 мл) барботировали в течение 10 мин азотом, и затем герметично закрывали и нагревали при 50°С в течение 4 ч. Смесь охлаждали до комнатной температуры и разбавляли в EtOAc. EtOAc слой промывали 1М HCl, насыщенным NaHCO3, насыщенным NaCl, сушили (Na2SO4) и одновременно обрабатывали меркаптопропилсиликагелем, фильтровали и концентрировали. Сырой продукт очищали с помощью колоночной хроматографии на силикагеле, используя 2% МеОН в CH2Cl2 в качестве элюента с получением названного соединения в виде твердого вещества (40 мг, 55%) Температура плавления 265-266°С.1Н ЯМР (300 MHz, DMSO-d6) δ 11.42 (s, 1 H) 9.87 (s, 1 H) 7.76 (d, J=8.09 Hz, 1 H) 7.55-7.66 (m, 3 H) 7.17-7.27 (m, 5 H) 5.65 (dd, J=7.72, 1.47 Hz, 1 H) 3.89 (q, J=6.74 Hz, 2 H) 3.02 (s, 3 H) 1.45 (t, J=6.99 Hz, 3 H) 1.39 (s, 9 H).
[00753] С использованием представленного выше описания были получены следующие соединения:
[00754] (E)-N-(4-(1-(3-трет-бутил-5-(2,4-диоксотетрагидропиримидин-1(2Н)-ил)-2-метоксифенил)проп-1-ен-2-ил)фенил)метансульфонамид (соединение IA-L1-1.6).1Н ЯМР (300 MHz, DMSO-d6) δ 2.14 (s, 3 H) 2.70 (t, J=6.62 Hz, 2 H) 3.01 (s, 3 H) 3.68 (s, 3 H) 3.78 (t, J=6.62 Hz, 2 H) 6.82 (s, 1 H) 7.10-7.17 (m, 2 H) 7.23 (d, J=8.46 Hz, 2 H) 7.59 (d, J=8.46 Hz, 2 H) 9.78 (s, 1 H) 10.32 (s, 1 H). (Z)-N-(4-(3-трет-бутил-5-(2,4-диоксотетрагидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил) метансульфонамид (соединение IA-L1-1.10).1Н ЯМР (300 MHz, DMSO-d6) δ 10.23 (s, 1 H) 9.74 (s, 1 H) 7.23 (d, J=8.46 Hz, 2 H) 7.13 (d, J=2.57 Hz, 1 H) 7.06 (d, J=8.82 Hz, 2 H) 6.92 (d, J=2.57 Hz, 1 H) 6.54-6.67 (m, 2 H) 3.78 (s, 3 H) 3.57 (t, J=6.62 Hz, 2 H) 2.96 (s, 3 H) 2.60 (t, J=6.80 Hz, 2 H) 1.34 (s, 9 H).
[00756] (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксотетрагидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)-N-(метилсульфонил)ацетамид (соединение IA-L1-1.11).1Н ЯМР (300 MHz, DMSO-d6) δ 10.36 (s, 1 H) 7.77 (d, J=8.46 Hz, 2 H) 7.56 (d, J=2.21 Hz, 1 H) 7.39-7.50 (m, 3 H) 7.25 (d, J=16.55 Hz, 1 H) 7.19 (d, J=2.57 Hz, 1 H) 3.74-3.85 (m, 5 H) 3.54 (s, 3 H) 2.72 (t, J=6.62 Hz, 2 H) 1.94 (s, 3 H) 1.38 (s, 9 H).
[00757] (E)-1-(3-(4-аминостирил)-5-трет-бутил-4-метоксифенил)дигидропиримидин-2,4(1H,3H)-дион (соединение IA-L1-1.13).1Н ЯМР (300 MHz, DMSO-d6) δ 1.36 (s, 9 H) 2.70 (t, J=6.62 Hz, 2 H) 3.74 (s, 3 H) 3.77 (t, J=6.62 Hz, 2 H) 5.34 (s, 1 H) 6.57 (d, J=8.46 Hz, 2 H) 6.98 (s, 1 H) 7.07 (d, J=2.21 Hz, 1 H) 7.17 (s, 2 H) 7.30 (d, J=8.09 Hz, 2 H) 7.45 (d, J=2.21 Hz, 1 H) 10.32 (s, 1 H).
[00758] (Z)-N-(4-(3-трет-бутил-5-(2,4-диоксотетрагидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил) метансульфонамид (соединение IA-L1-1.20).1Н ЯМР (500 MHz, DMSO-d6): δ ppm 1.37 (s, 9H), 2.71 (t, J=6.7Hz, 2H), 3.01 (s, 3Н), 3.75 (s, 3H), 3.79 (t, J=6.6Hz, 2H), 7.13 (d, J=16.5Hz, 1H), 7.15 (d, J=2.4Hz, 2H), 7.23 (d, J=8.5Hz, 2H), 7.25 (d, J=16.5 Hz, 1H), 7.51 (d, J=2.4Hz, 1H), 7.61 (d, J=8.6Hz, 2H), 9.80(bs, 1H), 10.30 (s, 1H).
[00759] N-(4-(2-(3-трет-бутил-5-(2,4-диоксотетрагидропиримидин-1(2Н)-ил)-2-метоксифенил)-1-фторвинил)фенил)метансульфонамид (соединение IA-L1-1.21). (рацемическая смесь (1:1) соединений IA-L1-1.4 и IA-L1-1.5).
[00760] (E)-1-(3-трет-бутил-4-метокси-5-(4-нитростирил)фенил)дигидропиримидин-2,4(1Н,3Н)-дион (соединение IA-L1-1.22).
[00761] 1-{3-трет-бутил-5-[(Z)-2-хлор-2-(4-нитро-фенил)-винил]-4-метокси-фенил}-дигидро-пиримидин-2,4-дион (соединение IA-L1-1.23).
[00762] 1-{3-трет-бутил-4-метокси-5-[(Е)-2-(4-нитро-фенил)-пропенил]-фенил}-дигидро-пиримидин-2,4-дион (соединение IA-L1-1.24).
[00763] 1-{3-трет-бутил-5-[(Е)-2-(4-нитро-фенил)-винил]-фенил}-дигидро-пиримидин-2,4-дион (соединение IA-L1-1.25).1Н ЯМР (300 MHz, DMSO-D6) δ ppm 1.33 (s, 9 H) 2.70-2.77 (m, 2 H) 3.84 (t, J=6.80 Hz, 2 H) 7.33 (s, 1 H) 7.49 (d, J=4.04 Hz, 2 H) 7.56 (d, J=5.88 Hz, 2 H) 7.89 (d, J=8.82 Hz, 2 H) 8.25 (d, J=8.82 Hz, 2 H) 10.40 (s, 1 H)
[00764] N-(4-{(Е)-2-[3-трет-бутил-5-(диоксо-тетрагидро-пиримидин-1-ил)-2-метокси-фенил]-винил}-3-метокси-фенил)-метансульфонамид (соединение IA-L1-1.27).1H ЯМР (300 MHz, DMSO-D6) δ ppm 10.33 (s, 1 H) 9.86 (s, 1 H) 7.64 (d, J=8.46 Hz, 1 H) 7.45 (d, J=2.21 Hz, 1 H) 7.26 (s, 2 H) 7.12 (d, J=2.21 Hz, 1 H) 6.89 (s, 1 H) 6.85 (dd, J=8.46, 1.84 Hz, 1 H) 3.84 (s, 3 H) 3.78 (t, J=6.80 Hz, 2 H) 3.74 (s, 3 H) 3.04 (s, 3 H) 2.71 (t, J=6.62 Hz, 2 H) 1.37 (s, 9 H)
[00765] N-(4-{(Е)-2-[3-трет-Бутил-5-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-2-метокси-фенил]-винил}-3-формил-фенил)-метансульфонамид (соединение IB-L1-1.6).1H ЯМР (300 MHz, DMSO-D6) δ ppm 1.39 (s, 9 H) 3.07 (s, 3 H) 3.81 (s, 3 H) 5.66 (dd, J=7.72, 2.21 Hz, 1 H) 7.26 (d, J=2.57 Hz, 1 H) 7.30 (d, J=16.18 Hz, 1 H) 7.51 (dd, J=8.64, 2.39 Hz, 1 H) 7.69 (d, J=2.57 Hz, 1 H) 7.73-7.78 (m, 2 H) 7.97 (d, J=8.82 Hz, 1 H) 8.06 (d, J=16.18 Hz, 1 H) 10.15 (s, 1 H) 10.45 (s, 1 H) 11.43 (d, J=2.21 Hz, 1 H)
[00766] N-[4-{(Е)-2-[3-трет-бутил-5-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-2-метокси-фенил]-винил}-3-(гидроксиимино-метил)-фенил]-метансульфонамид (соединение IB-L1-1.8).1Н ЯМР (300 MHz, DMSO-d6) δ 1.38 (s, 9 H) 3.03 (s, 3 H) 3.79 (s, 3 H) 5.66 (dd, J=7.91, 2.02 Hz, 1 H) 7.16 (d, J=15.81 Hz, 1 H) 7.22 (d, J=2.57 Hz, 1 H) 7.26 (dd, J=8.64, 2.39 Hz, 1 H) 7.59 (d, J=16.18 Hz, 1 H) 7.63 (d, J=2.21 Hz, 1 H) 7.73-7.83 (m, 3 H) 8.64 (s, 1 H) 9.96 (s, 1 H) 11.42 (d, J=2.21 Hz, 1 H) 11.50 (s, 1 H).
[00767] 2-{(Е)-2-[3-трет-бутил-5-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-2-метокси-фенил]-винил}-5-метансульфониламино-N-(2-метокси-этил)-бензамид (соединение IB-L1-1.9).1H ЯМР (300 MHz, DMSO-D6) δ 1.38 (s, 9 H) 3.05 (s, 3 H) 3.20 (s, 3 H) 3.37-3.49 (m, 4 H) 3.78 (s, 3 H) 5.64 (d, J=7.72 Hz, 1 H) 7.15 (d, J=2.57 Hz, 1 H) 7.20 (d, J=2.57 Hz, 1 H) 7.24 (s, 2 H) 7.28 (dd, J=8.46, 2.21 Hz, 1 H) 7.42 (d, J=2.57 Hz, 1 H) 7.73 (d, J=7.72 Hz, 1 H) 7.87 (d, J=8.82 Hz, 1 H) 8.49 (t, J=5.15 Hz, 1 H) 9.99 (s, 1 H) 11.42 (s, 1 H).
[00768] Этиловый эфир 2-{(Е)-2-[3-трет-бутил-5-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-2-метокси-фенил]-винил}-5-метансульфониламино-бензойной кислоты (соединение IB-L1-1.11).1Н ЯМР (300 MHz, DMSO-d6) δ 1.31 (t, J=7.17 Hz, 3 H) 1.38 (s, 9 H) 3.05 (s, 3 H) 3.79 (s, 3 H) 4.33 (q, J=7.23 Hz, 2 H) 5.65 (dd, J=7.72, 2.21 Hz, 1 H) 7.15-7.25 (m, 2 H) 7.46 (dd, J=8.64, 2.39 Hz, 1 H) 7.52 (d, J=2.57 Hz, 1 H) 7.68 (d, J=2.57 Hz, 1 H) 7.71-7.81 (m, 2 H) 7.90 (d, J=8.46 Hz, 1 H) 10.06 (s, 1 H) 11.42 (d, J=1.84 Hz, 1 H).
[00769] N-(4-{(Е)-2-[3-трет-бутил-2-хлор-5-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-фенил]-винил}-фенил)-метансульфонамид (соединение IB-L1-1.12).1Н ЯМР (300 MHz, DMSO-d6) δ ppm 1.49 (s, 9 H) 3.02 (s, 3 H) 5.69 (d, J=7.72 Hz, 1 H) 7.22 (m, 3 H) 7.41 (d, J=2.21 Hz, 1 H) 7.51 (d, J=16.18 Hz, 1 H) 7.59 (d, J=8.82 Hz, 2 H) 7.78 (d, J=2.21 Hz, 1 H) 7.80 (d, J=8.09 Hz, 1 H) 9.90 (s, 1 H) 11.47 (s, 1 H).
[00770] 2-{(Е)-2-[3-трет-бутил-5-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-2-метокси-фенил]-винил}-5-метансульфониламино-N,N-диметил-бензамид (соединение IB-L1-1.14).1Н ЯМР (300 MHz, DMSO-d6) δ 1.37 (s, 9 H) 2.76 (s, 3 H) 3.03 (s, 3 H) 3.05 (s, 3 H) 3.76 (s, 3 H) 5.64 (dd, J=7.91, 1.65 Hz, 1 H) 6.95 (d, J=16.55 Hz, 1 H) 7.02 (d, J=2.21 Hz, 1 H) 7.17-7.25 (m, 2 H) 7.27 (dd, J=8.64, 2.39 Hz, 1 H) 7.48 (d, J=2.57 Hz, 1 H) 7.74 (d, J=8.09 Hz, 1 H) 7.82 (d, J=8.82 Hz, 1 H) 10.03 (s, 1 H) 11.39-11.43 (m, 1 H).
(00771] 2-{(Е)-2-[3-трет-бутил-5-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-2-метокси-фенил]-винил}-5-метансульфониламино-N-метил-бензамид (соединение IB-L1-1.17).1Н ЯМР (300 MHz, DMSO-d6) δ 1.38 (s, 9 H) 2.77 (d, J=4.41 Hz, 3 H) 3.06 (s, 3 H) 3.77 (s, 3 H) 5.64 (dd, J=7.72, 1.84 Hz, 1 H) 7.16-7.33 (m, 5 H) 7.43 (d, J=2.21 Hz, 1 H) 7.73 (d, J=7.72 Hz, 1 H) 7.84 (d, J=8.46 Hz, 1 H) 8.37 (q, J=4.41 Hz, 1 H) 10.00 (s, 1 H) 11.40 (d, J=1.84 Hz, 1 H).
[00772] 2-{(Е)-2-[3-трет-бутил-5-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-2-метокси-фенил]-винил}-N-(1,1-диоксо-тетрагидро-1лямбда*6*-тиофен-3-ил)-5-метансульфониламино-N-метил-бензамид (соединение IB-L1-1.18).1Н ЯМР (300 MHz, DMSO-d6) δ 1.37 (s, 9 H) 2.17-2.47 (m, 2 H) 2.70 (s, 3 H) 3.06 (s, 3 H) 3.15-3.31 (m, 2 H) 3.36-3.51 (m, 2 H) 3.77 (s, 3 H) 5.37 (dt, J=17.74, 8.96 Hz, 1 H) 5.65 (dd, J=7.91, 2.02 Hz, 1 H) 6.93 (d, J=16.18 Hz, 1 H) 7.05 (d, J=2.21 Hz, 1 H) 7.19-7.35 (m, 3 H) 7.50 (d, J=2.57 Hz, 1 H) 7.76 (d, J=8.09 Hz, 1 H) 7.87 (d, J=8.82 Hz, 1 H) 10.04 (s, 1 H) 11.38 (d, J=2.21 Hz, 1 H).
[00773] N-(4-{(E)-2-[3-трет-бутил-5-(5-хлор-2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-2-метокси-фенил]-винил}-фенил)-метансульфонамид (соединение IB-L1-1.20).1Н ЯМР (300 MHz, DMSO-D6) δ ppm 11.31 (s, 1 H) 9.77 (s, 1 H) 7.53 (d, J=8.09 Hz, 1 H) 7.23 (d, J=8.46 Hz, 2 H) 7.17 (d, J=2.57 Hz, 1 H) 7.06 (d, J=8.82 Hz, 2 H) 7.01 (d, J=2.57 Hz, 1 H) 6.53-6.71 (m, 2 H) 5.56 (d, J=7.72 Hz, 1 H) 3.81 (s, 3 H) 2.96 (s, 3 H) 1.35 (s, 9 H)
[00774] 2-{(Е)-2-[3-трет-бутил-5-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-2-метокси-фенил]-винил}-5-метансульфониламино-бензамид (соединение IB-L1-1.21).1H ЯМР (300 MHz, DMSO-d6) δ 1.38 (s, 9 H) 3.07 (s, 3 H) 3.78 (s, 3 H) 5.64 (d, J=7.72 Hz, 1 H) 7.18-7.34 (m, 5 H) 7.43 (d, J=2.21 Hz, 1 H) 7.54 (s, 1 H) 7.73 (d, J=7.72 Hz, 1 H) 7.84 (d, J=8.46 Hz, 1 H) 7.93 (s, 1 H).
[00775] N-(3-(азетидин-1-карбонил)-4-{(Е)-2-[3-трет-бутил-5-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-2-метокси-фенил]-винил}-фенил)-метансульфонамид (соединение (соединение IB-L1-1.22).1Н ЯМР (300 MHz, DMSO-d6) δ 1.38 (s, 9 H) 3.07 (s, 3 H) 3.78 (s, 3 H) 5.64 (d, J=7.72 Hz, 1 H) 7.18-7.34 (m, 5 H) 7.43 (d, J=2.21 Hz, 1 H) 7.54 (s, 1 H) 7.73 (d, J=7.72 Hz, 1 H) 7.84 (d, J=8.46 Hz, 1 H) 7.93 (s, 1 H).
[00776] 2-{(Е)-2-[3-трет-бутил-5-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-2-метокси-фенил]-винил}-5-метансульфониламино-N-(2-метокси-этил)-N-метил-бензамид (соединение IB-L1-1.24).1Н ЯМР (300 MHz, DMSO-d6) δ 1.40 (s, 9 Н) 2.81 (s, 3 Н) 3.07 (s, 3 Н) 3.23 (s, 3 Н) 3.29 (t, J=5.33 Hz, 1 Н) 3.39 (t, J=4.96 Hz, 1 Н) 3.62 (t, J=4.78 Hz, 2 Н) 3.82 (s, 3 Н) 5.68 (d, J=8.09 Hz, 1 Н) 6.96-7.07 (m, 1 Н) 7.09-7.17 (m, 1 Н) 7.23-7.38 (m, 3 Н) 7.49 (dd, J=16.55, 2.57 Hz, 1 Н) 7.71-7.76 (m, 1 Н) 7.83-7.94 (m, 1 Н).
[00777] N-(4-{(Е)-2-[3-трет-бутил-5-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-2-метокси-фенил]-винил}-3-изопропоксиметил-фенил)-метансульфонамид (соединение IB-L1-1.25).1Н ЯМР (300 MHz, DMSO-d6) δ 1.16 (d, J=5.88 Hz, 6 Н) 1.38 (s, 9 Н) 3.01 (s, 3 Н) 3.69 (dt, J=12.13, 6.07 Hz, 1 Н) 3.79 (s, 3 Н) 4.59 (s, 2 Н) 5.65 (dd, J=7.91, 2.02 Hz, 1 Н) 7.13-7.29 (m, 4 Н) 7.32-7.40 (m, 1 H) 7.59 (d, J=2.57 Hz, 1 H) 7.75 (d, J=8.09 Hz, 2 H) 9.86 (s, 1 H) 11.43 (d, J=1.84 Hz, 1 H).
[00778] N-[4-{(Е)-2-[3-трет-бутил-5-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-2-метокси-фенил]-винил}-3-(пирролидин-1-карбонил)-фенил]-метансульфонамид (соединение IB-L1-1.27).1H ЯМР (300 MHz, DMSO-d6) δ 1.37 (s, 9 H) 1.73-1.89 (m, 4 H) 3.03-3.12 (m, 5 H) 3.51 (t, J=6.80 Hz, 2 H) 3.76 (s, 3 H) 5.64 (dd, J=7.91, 2.02 Hz, 1 H) 6.99-7.06 (m, 1 H) 7.08 (d, J=2.21 Hz, 1 H) 7.19-7.31 (m, 3 H) 7.46 (d, J=2.57 Hz, 1 H) 7.75 (d, J=8.09 Hz, 1 H) 7.82 (d, J=8.82 Hz, 1 H) 10.01 (s, 1 H) 11.41 (d, J=2.21 Hz, 1 H).
[00779] N-[4-{(Е)-2-[3 -трет-бутил-5-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-2-метокси-фенил]-винил}-3-(3-гидрокси-азетидин-1-илметил)-фенил]-метансульфонамид (соединение IB-L1-1.29).1Н ЯМР (300 MHz, DMSO-d6) δ 1.38 (s, 9 H) 2.78-2.85 (m, 2 H) 2.99 (s, 3 H) 3.50-3.58 (m, 2 H) 3.71 (s, 2 H) 3.79 (s, 3 H) 4.19 (td, J=12.41, 6.07 Hz, 1 H) 5.29 (d, J=6.25 Hz, 1 H) 5.66 (d, J=8.09 Hz, 1 H) 7.10-7.18 (m, 2 H) 7.20 (t, J=2.21 Hz, 2 H) 7.35-7.42 (m, 1 H) 7.63 (d, J=2.57 Hz, 1 H) 7.69 (d, J=8.46 Hz, 1 H) 7.76 (d, J=7.72 Hz, 1 H) 9.78 (s, 1 H) 11.42 (s, 1 H).
[00780] N-(4-{(Е)-2-[3-трет-бутил-5-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-2-метокси-фенил]-винил}-3-пирролидин-1-илметил-фенил)-метансульфонамид (соединение IB-L1-1.33).1H ЯМР (500 MHz, DMSO-d6) δ 1.40 (s, 9 H) 1.72-1.95 (m, 4 H) 2.84 (s, 2 H) 2.88-2.98 (m, 2 H) 3.01 (s, 3 H) 3.81 (s, 3 H) 3.86-4.23 (m, 2 H) 5.63 (d, J=7.81 Hz, 1 H) 7.17 (d, J=15.63 Hz, 1 H) 7.21-7.28 (m, 2 H) 7.32-7.38 (m, 1 H) 7.47 (d, J=16.11 Hz, 1 H) 7.53-7.59 (m, 1 H) 7.61 (d, J=7.81 Hz, 1 H) 7.70 (d, J=6.35 Hz, 1 H) 9.42 (s, 1 H) 10.88 (s, 1 H).
[00781] N-(4-{(Z)-2-[3-трет-бутил-5-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-2-метокси-фенил]-винил}-фенил)-метансульфонамид (соединение IB-L1-1.341H ЯМР (300 MHz, DMSO-D6) δ ppm 11.31 (s, 1 H) 9.77 (s, 1 H) 7.53 (d, J=8.09 Hz, 1 H) 7.23 (d, J=8.46 Hz, 2 H) 7.17 (d, J=2.57 Hz, 1 H) 7.06 (d, J=8.82 Hz, 2 H) 7.01 (d, J=2.57 Hz, 1 H) 6.53-6.71 (m, 2 H) 5.56 (d, J=7.72 Hz, 1 H) 3.81 (s, 3 H) 2.96 (s,3H) 1.35 (s, 9H)
[00782] N-(4-(3-трет-бутил-5-(2,4-диоксотетрагидропиримидин-1(2Н)-ил)фенэтил)фенил)метан сульфонамид (соединение IA-L5-2-1.2).1Н ЯМР (300 MHz, DMSO-d6) δ 1.25 (s, 9 H) 2.69 (t, J=6.62 Hz, 2 H) 2.83 (s, 4 H) 2.91 (s, 3 H) 3.75 (t, J=6.62 Hz, 2 H) 6.99-7.21 (m, 7 H) 9.60 (s, 1 H) 10.31 (s, 1 H).
[00783] метил 2-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксифенэтил)-5-(метилсульфонамид)бензоат (соединение IB-L5-2-1.1).1Н ЯМР (300 MHz, DMSO-d6) δ 1.34 (s, 9 H) 2.83-2.92 (m, 2 H) 2.96 (s, 3 H) 3.14 (dd, J=10.30, 5.88 Hz, 2 H) 3.75 (s, 3 H) 3.83 (s, 3 H) 5.64 (d, J=7.72 Hz, 1 H) 7.13 (d, J=2.94 Hz, 1 H) 7.20 (d, J=2.57 Hz, 1 H) 7.28-7.36 (m, 2 H) 7.61-7.71 (m, 2 H) 9.88 (s, 1 H) 11.39 (s, 1 H)
[00784] N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксифенэтил)фенил) метансульфонамид (соединение IB-L5-2-1.2).1Н ЯМР (300 MHz, DMSO-d6): δ 11.39 (s, 1H), 9.60 (s, 1H), 7.65 (d, J=8.1Hz, 1H), 7.23 (m, 3H), 7.17 (m, 3H), 5.64 (d, J=7.7Hz, 1H), 3.77 (s, 3H), 2.93 (s, 3H), 2.88 (bs, 4H), 1.35 (s, 9H)
[00785] Следующие соединения могут быть получены с использованием представленного выше описания:
[00786] Исследование ингибирования HCV полимеразы
[00787] Либо двухкратные серийные разведения (исследование парциального ингибирования), либо более узкий интервал разведении, перекрывающий IC50 ингибитора (исследование прочности связывания) ингибиторов инкубировали с 20 мМ Трис-Cl рН 7,4, 2 мМ MnCl2, 1 мМ дитиотреитолом, 1 мМ этилендиаминтетрауксусной кислотой (EDTA), 60-125 мкМ GTP и 20-50 нМ Δ21 NS5B (HCV штамм 1 В (ВК, Genbank регистрационный номер М58335, или Н77, Genbank регистрационный номер AF011751)) в течение 15 мин при комнатной температуре. Реакцию инициировали добавлением 20 мкМ СТР, 20 мкМ АТР, 1 мкМ3H-UTP (10 мКю/мкмоль), 5 нМ матричной РНК и 0,1 Ед/мкл ингибитора РНазы (RNasin, Promega), и оставляли для протекания реакции в течение 2-4 ч при комнатной температуре. Объем реакции составил 50 мкл. Реакцию заканчивали путем добавления 1 объема 4 мМ спермина в 10 мМ Трис-Cl рН 8,0, 1 мМ EDTA. После инкубирования по меньшей мере в течение 15 мин при комнатной температуре, осажденную РНК собирали фильтрованием через GF/B фильтр (Millipore) в 96 луночном формате. Фильтровальную пластинку промывали три раза 200 мкл каждого из 2 мМ спермина, 10 мМ Трис-Cl рН 8,0, 1 мМ EDTA, и 2 раза этанолом. После сушки на воздухе в каждую лунку добавляли, 30 мкл сцинтилляционной смеси Microscint 20 (Packard), и удержанное число импульсов в минуту определяли с помощью сцинтилляционного счета. Значения IC50 рассчитывали с помощью уравнения нелинейной регрессии с двумя независимыми переменными, используя неингибированный контрольный образец и полностью ингибированный контрольный образец для определения минимума и максимума для этой кривой. Исследования прочности связывания проводили на тех соединениях, которые демонстрируют значения IC50 менее 0,005 мкМ в исследовании парциального ингибирования для более точного измерения значений IC50. Удержанное число импульсов в минуту наносили на график в зависимости от концентрации ингибитора и аппроксимировали к уравнению 1, используя нелинейную регрессию (ссылка 1) для получения значений IC50:
Удержанное число импульсов в минуту=A[sqrt{(IC50+It-Et)^2+4*IC50*Et}-(IC50+It-Et)] (уравнение 1)
где A=Vmax[S]/2(Km+[S]); It=суммарная концентрация ингибитора и Е1=суммарная активная концентрация фермента.
[00788] Ссылка: Morrison, J. F. и S. R. Stone. 1985. Approaches to the study and analysis of the inhibition of enzymes by slow- and tight-binding inhibitors. Comments Mol. Cell. Biophys. 2: 347-368.
[00789] Последовательность используемой матричной РНК представляла собой: 5'-GGGCGAAUUG GGCCCUCUAG AUGCAUGCUC GAGCGGCCGC CAGUGUGAUG GAUAUCUGCA GAAUUCGCCC UUGGUGGCUC CAUCUUAGCC CUAGUCACGG CUAGCUGUGA AAGGUCCGUG AGCCGCUUGA CUGCAGAGAG UGCUGAUACU GGCCUCUCUG CAGAUCAAGUC-3'
[00790] При тестировании указанным выше способом, соединения по настоящему изобретению ингибировали HCV полимеразу 1А и/или 1В. Обозначения в приведенной ниже Таблице представляют собой следующее: А -- IC50≤0,01 мкМ; В - 0,1 мкМ≥IC50>0,01 мкМ; С - 1 мкМ≥IC50>0,1 мкМ; и D -- IC50>1 мкМ; ND - не определено.
[00791] Исследование репликона HCV полимеразы
[00792] Для характеристики соединения в клеточной культуре использовали две стабильные клеточке линии, несущие субгеномные репликоны: один получен из генотипа 1а-Н77 и один получен из генотипа Ib-Con1 (получен от Apath, LLC, St. Louis, МО). Все конструкты репликона представляли собой бицистронные субгеномные репликоны, аналогичне тем, которые описаны Bartenschlager и соавторами (Lohmann et al., Replication of Subgenomic Hepatitis С Virus RNAs in a Hepatoma Cell Line, science 285:110-3(1999)). Конструкт репликона генотипа 1a содержит NS3-NS5B кодирующую область, происходящую из Н77 штамма HCV (1a-H77) (Blight et al., Efficient Replication of Hepatitis С Virus Genotype 1a RNAs in Cell Culture, J. virol. 77:3181-90 (2003)). Этот репликон также имеет репотерную люциферазу светлячка и селектируемый маркер неомицин фосфотрансферазу (Neo). Эти две кодирующие области, разделенные FMDV 2а протеазой, содержат первый цистрон бицистронного конструкта репликона со вторым цистроном, содержащим NS3-NS5B кодирующую область с дополнительными адаптивными мутациями Е1202 G, K1691R, K2040R и S2204I. Ib-Con1 конструкт репликона идентичен 1a-H77 репликону, за исключением того, что NS3-NS5B кодирующая область была получена из штамма Ib-Con1, и адаптивными мутациями являются Е1202 G, T1280I и S2204I. Репликон-содержащие клеточные линии подращивали в модифицированной по Дульбекко среде Игла (DMEM), содержащей 10% (об/об) эмбриональной сыворотки теленка (FBS), 100 МЕ/мл пенициллина, 100 мг/мл стрептомицина (Invitrogen), и 200 мг/мл G418 (Invitrogen).
[00793] Ингибирующие действия соединений на репликацию HCV определяли путем измерения активности репортерного гена люциферазы. Вкратце, репликон-содержащие клетки высевали в 96-луночные планшеты с плотностью 5000 клеток на лунку в 100 мкл DMEM, содержащей 5% FBS. 16-24 ч позже, соединения разбавляли в диметилсульфоксиде (DMSO) для получения 200х маточного раствора в сериях восьми полулогарифмических разведении. Серии разведении затем дополнительно разбавляли в 100 раз в среде, содержащей 5% FBS. Добавляли среду с ингибитором на ночь в планшеты для клеточных культур, уже содержащие 100 мкл DMEM с 5% FBS. В исследованиях, в которых измеряют ингибирующую активность в присутствии плазмы человека, ночную среду из планшетов для клеточных культур заменяли на DMEM, содержащую 40% плазму человека и 5% FBS. Клетки инкубировали в течение трех дней в термостатах для клеточных культур, а затем подвергали лизису для экстракции РНК. Для люциферазного исследования в каждую лунку добавляли 30 мкл пассивного буфера для лизиса (Passive Lysis buffer) (Promega), и затем планшеты инкубировали в течение 15 мин с раскачиванием для лизиса клеток. Раствор люциферина (50-100 мкл, Promega) добавляли в каждую лунку и активность люциферазы измеряли с помощью люминометра Victor II (Perkin-Elmer). Процент ингибирования HCV РНК репликации рассчитывали для каждой концентрации соединения и значение ЕС50 рассчитывали, используя кривую нелинейной регрессии, аппроксимированную к 4-параметрическому логарифмическому уравнению и программное обеспечение GraphPad Prism 4.
[00794] При тестировании указанным выше способом, соединения по настоящему изобретению ингибируют HCV полимеразу 1А и/или 1В. Обозначения в приведенной ниже Таблице, представляют собой следующее: А -- ЕС50≤0,01 мкМ; В - 0,1 мкМ≥EC50>0,01 мкМ; С - 1 мкМ≥ЕС50>0,1 мкМ; и D -- ЕС50>1 мкМ; ND - не определено.
***********
[00795] Все ссылки (пантентные и непатентные), процитированные выше, включены в качестве ссылки в настоящую патентную заявку. Описание этих ссылок предназначено только лишь для обобщения притязаний, сделанных их авторами. Не признается тот факт, что какая-либо ссылка (или часть какой-либо ссылки) является релевантной предшествующему уровню техники (или уровню техники вообще). Заявители сохраняют за собой право оспаривать правильность и релевантность процитированных ссылок.
Реферат
Изобретение относится к соединениям структурной формулы I, их фармацевтически приемлемым солям и кристаллическим формам, которые обладают свойствами ингибитора HCV полимеразы. В формуле Iвыбрана из группы, состоящей из одинарной углерод-углеродной связи и двойной углерод-углеродной связи; Rпредставляет собой водород; Rвыбран из группы, состоящей из водорода и гало; Rпредставляет собой водород; Rвыбран из группы, состоящей из гало, C-Cалкила, C-Cалкилсульфонила и 5-6-членного гетероарила, содержащего гетероатом, выбранный из N, O и S, где алкил необязательно замещен одним или более гидрокси; Rвыбран из группы, состоящей из водорода, гидрокси, C-Cалкилокси и гало; L выбран из группы, состоящей из C(R)=C(R), этилена и циклопропил-1,2-ена; Rи Rнезависимо выбраны из группы, состоящей из водорода, C-Cалкила, C-Cалкилокси и гало; Rпредставляет собой Сарил, необязательно замещенный одним или более заместителями, независимо выбранными из группы, состоящей из R, R, R, R, Rи R; значения заместителей R, R, R, R, Rи Rприведены в формуле изобретения. Изобретение также относится к фармацевтической композиции, содержащей указанные соединения, к применению соединений для ингибирования РНК-полимеразы HCV и лечения гепатита С и к способу получения указанных соединений. 18 н. и 22 з.п. ф-лы, 23 ил., 7 табл., 40 пр.
Формула
соединение соответствует по структуре формуле I:


R1 представляет собой водород;
R2 выбран из группы, состоящей из водорода и гало;
R3 представляет собой водород;
R4 выбран из группы, состоящей из гало, C1-C6алкила, C1-C6алкилсульфонила и 5-6-членного гетероарила, содержащего гетероатом, выбранный из N, O и S, где алкил необязательно замещен одним или более гидрокси;
R5 выбран из группы, состоящей из водорода, гидрокси, C1-C6алкилокси и гало;
L выбран из группы, состоящей из C(RA)=C(RB), этилена и циклопропил-1,2-ена;
RA и RB независимо выбраны из группы, состоящей из водорода, C1-C6алкила, C1-C6алкилокси и гало;
R6 представляет собой С6арил, необязательно замещенный одним или более заместителями, независимо выбранными из группы, состоящей из RE, RF, RG, RH, RI и RJ;
каждый RE независимо выбран из группы, состоящей из гало, нитро, карбокси, амино и альдегидо;
каждый RF представляет собой C1-С6алкил, необязательно замещенный одним или более заместителями, независимо выбранными из группы, состоящей из карбокси, гидрокси, амино, имино, C1-С6алкилокси и 4-5-членного гетероциклила, содержащего один атом N в качестве гетероатома, где:
амино, имино и гетероциклил необязательно замещены одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-С6алкила, гидрокси и C1-С6алкилокси;
каждый RG представляет собой 5-членный гетероарил, содержащий 1-2 гетероатома, независимо выбранные из группы, состоящей из N и О;
каждый RH представляет собой C1-С6алкилокси;
каждый RI независимо выбран из группы, состоящей из аминокарбонила, C1-С6алкилоксикарбонила и 4-6-членного гетероциклилкарбонила, содержащего 1-2 гетероатома, независимо выбранные из группы, состоящей из N и О, где:
аминокарбонил необязательно замещен одним или двумя заместителями, независимо выбранными из группы, состоящей из C1-С6алкила, С1-С6алкилоксиС1-С6алкила и 5-членного гетероциклила, содержащего атом S в качестве гетероатома, где гетероциклил необязательно замещен одним или двумя оксо; и
каждый RJ независимо выбран из группы, состоящей из C1-С6алкилоксикарбониламино и C1-С6алкилсульфониламино, где амино часть таких заместителей необязательно замещена C1-С6алкилкарбонилом.

RA представляет собой водород; и
RB представляет собой водород.

R2 представляет собой водород;
R4 представляет собой C1-С6алкил; и
R5 представляет собой C1-С6алкокси.

R2 представляет собой водород;
R4 представляет собой трет-бутил; и
R5 представляет собой метокси.

R2 представляет собой водород;
R4 представляет собой трет-бутил; и
R5 представляет собой метокси;
R6 представляет собой фенил, замещенный RJ, где каждый RJ представляет собой метилсульфониламино.

R2 представляет собой водород
R4 представляет собой трет-бутил; и
R5 представляет собой метокси;
L представляет собой C(RA)=C(RB);
RA представляет собой водород; и
RB представляет собой водород, и
R6 представляет собой фенил, замещенный RJ, где RJ представляет собой метилсульфониламино.
(Е)-N-(4-(3-трет-бутил-5-(2,4-диоксотетрагидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамид;
(Z)-N-(4-(2-(3-трет-бутил-5-(2,4-диоксотетрагидропиримидин-1(2Н)-ил)метоксифенил)-1-хлорвинил)фенил)метансульфонамид;
(Е)-1-(3-трет-бутил-5-(4-фторстирил)-4-метоксифенил)дигидропиримидин-2,4(1Н,3Н)-дион;
(Z)-N-(4-(2-(3-трет-бутил-5-(2,4-диоксотетрагидропиримидин-1(2Н)-ил)метоксифенил)-1-фторвинил)фенил)метансульфонамид;
(Е)-(4-(2-(3-трет-бутил-5-(2,4-диоксотетрагидропиримидин-1(2Н)-ил)-2-метоксифенил)-1-фторвинил)фенил)метансульфонамид;
(E)-N-(4-(3-трет-бутил-5-(2,4-диоксотетрагидропиримидин-1(2Н)-ил)-2-метоксистирил)-2-фторфенил)метансульфонамид;
N-(4-(2-(3-трет-бутил-5-(2,4-диоксотетрагидропиримидин-1(2Н)-ил)-2-метоксифенил)циклопропил)фенил)метансульфонамид;
N-(4-(3-трет-бутил-5-(2,4-диоксотетрагидропиримидин-1(2H)-ил)-2-метоксифенэтил)фенил)метансульфонамид;
(E)-N-(4-(3-трет-бутил-5-(2,4-диоксотетрагидропиримидин-1(2Н)-ил)стирил)фенил)метансульфонамид;
(Z)-N-(4-(2-(3-трет-бутил-5-(2,4-диоксотетрагидропиримидин-1(2Н)-ил)-2-метоксифенил)-1-метоксивинил)фенил)метансульфонамид;
(Е)-1-(3-трет-бутил-4-метокси-5-стирилфенил)дигидропиримидин-2,4(1Н,3Н)-дион;
(Е)-1-(3-трет-бутил-4-метокси-5-(4-метоксистирил)фенил)дигидропиримидин-2,4(1Н,3Н)-дион;
(Е)-N-(4-(3-трет-бутил-5-(5-фтор-2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамид;
(Е)-N-(4-(3-бромо-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамид;
(E)-N-(4-(5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метокси-3-(тиофен-2-ил)стирил)фенил)метансульфонамид;
(Е)-N-(4-(5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-3-(фуран-2-ил)-2-метоксистирил)фенил)метансульфонамид;
(Е)-N-(4-(5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метокси-3-(пиридин-4-ил)стирил)фенил)метансульфонамид;
(Е)-N-(4-(5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метокси-3-(пиридин-3-ил)стирил)фенил)метансульфонамид;
(Е)-N-(4-(5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метокси-3-(тиофен-3-ил)стирил)фенил)метансульфонамид;
(Е)-N-(4-(5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-3-(фуран-3-ил)-2-метоксистирил)фенил)метансульфонамид;
(Е)-N-(4-(5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-3-(1-гидрокси-2-метилпропан-2-ил)-2-метоксистирил)фенил)метансульфонамид;
(E)-N-(4-(5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-3-йодо-2-метоксистирил)фенил)метансульфонамид;
(Е)-N-(4-(5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метокси-3-(метилсульфонил)стирил)фенил)метансульфонамид;
(E)-метил-2-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-2-метоксистирил)-5-(метилсульфонамидо)бензоат;
(E)-2-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-2-метоксистирил)-5-(метилсульфонамидо)бензойная кислота;
(E)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-2-метоксистирил)-3-(морфолин-4-карбонил)фенил)метансульфонамид;
(E)-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-2-метоксистирил)-3-(гидроксиметил)фенил)метансульфонамид;
(E)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-2-метоксистирил)-3-(метоксиметил)фенил)метансульфонамид;
(E)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-2-метоксистирил)-3-((изопентиламино)метил)фенил)метансульфонамид;
N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-2-метоксистирил)-3-((Е)-(метоксиимино)метил)фенил)метансульфонамид;
(E)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-2-метоксистирил)-3-(оксазол-2-ил)фенил)метансульфонамид;
(E)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-2-метоксистирил)-3-(1Н-имидазол-2-ил)фенил)метансульфонамид;
(E)-трет-бутил-2-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-2-метоксистирил)-5-(метилсульфонамидо)фенилкарбамат;
(E)-(3-амино-4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-2-метоксистирил)фенил)метансульфонамид;
(E)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-2-метоксистирил)-2-фторофенил)метансульфонамид;
(E)-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-2-метоксистирил)-2-фторо-5-метилфенил)метансульфонамид;
метил-2-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-2-метоксифенэтил)-5-(метилсульфонамидо)бензоат;
N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-2-метоксифенэтил)фенил)метансульфонамид;
(E)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2H)-ил)-2-этоксистирил)фенил)метансульфонамид;
(E)-N-(4-(1-(3-трет-бутил-5-(2,4-диоксотетрагидропиримидин-1(2H)-ил)-2-метоксифенил)проп-1-ен-2-ил)фенил)метансульфонамид;
(Z)-N-(4-(3-трет-бутил-5-(2,4-диоксотетрагидропиримидин-1(2H)-ил)-2-метоксистирил)фенил)метансульфонамид;
(Е)-N-(4-(3-трет-бутил-5-(2,4-диоксотетрагидропиримидин-1(2H)-ил)-2-метоксистирил)фенил)-N-(метилсульфонил)ацетамид;
(Е)-1-(3-(4-аминостирил)-5-трет-бутил-4-метоксифенил)дигидропиримидин-2,4(1Н,3Н)-дион;
(Z)-N-(4-(3-трет-бутил-5-(2,4-диоксотетрагидропиримидин-1(2H)-ил)-2-метоксистирил)фенил)метансульфонамид;
N-(4-(2-(3-трет-бутил-5-(2,4-диоксодигидропиримидин-1(2H)-ил)-2-метоксифенил)-1-фтор-винил)фенил)метансульфонамид;
(Е)-1-(3-трет-бутил-4-метокси-5-(4-нитростирил)фенил)дигидропиримидин-2,4(1Н,3Н)-дион;
1-{3-трет-бутил-5-[(Z)-2-хлор-(4-нитрофенил)-винил]-4-метокси-фенил}-дигидропиримидин-2,4-дион;
1-{3-трет-бутил-4-метокси-5-[(Е)-2-(4-нитрофенил)-пропенил]-фенил}-дигидропиримидин-2,4-дион;
1-{3-трет-бутил-5-[(Е)-2-(4-нитрофенил)-винил]-фенил}-дигидропиримидин-2,4-дион;
N-(4-{(E)-2-[3-трет-бутил-5-(диоксотетрагидропиримидин-1-ил)-2-метокси-фенил]-винил}-3-метоксифенил)метансульфонамид;
N-(4-{(Е)-2-[3-трет-бутил-5-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-2-метокси-фенил]-винил}-3-формилфенил)метансульфонамид;
N-[4-{(Е)-2-[3-трет-бутил-5-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-2-метоксифенил]-винил}-3-(гидроксииминометил)-фенил]метансульфонамид;
2-{(Е)-2-[3-трет-бутил-5-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-2-метокси-фенил]-винил}-5-метансульфониламино-N-(2-метокси-этил)бензамид;
2-{(Е)-2-[3-трет-бутил-5-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-2-метокси-фенил]-винил}-5-метансульфониламино-этиловый эфир бензойной кислоты;
N-(4-{(Е)-2-[3-трет-бутил-2-хлор-5-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-фенил]-винил}фенил)метансульфонамид;
2-{(Е)-2-[3-трет-бутил-5-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-2-метокси-фенил]-винил}-5-метансульфониламино-N,N-диметил-бензамид;
2-{(Е)-2-[3-трет-бутил-5-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-2-метокси-фенил]-винил}-5-метансульфониламино-N-метил-бензамид;
2-{(Е)-2-[3-трет-бутил-5-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-2-метокси-фенил]-винил}-N-(1,1-диоксо-тетрагидротиофен-3-ил)-5-метансульфониламино-N-метил-бензамид;
N-(4-{(Е)-2-[3-трет-бутил-2-хлор-5-(5-хлор-2H-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-2-метокси-фенил]-винил}фенил)метансульфонамид;
2-{(Е)-2-[3-трет-бутил-5-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-2-метокси-фенил]-винил}-5-метансульфониламино-бензамид;
N-(3-(азетидин-1-карбонил)-4-{(Е)-2-[3-трет-бутил-5-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-2-метокси-фенил]-винил}фенил)метансульфонамид;
2-{(Е)-2-[3-трет-бутил-5-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-2-метокси-фенил]-винил}-5-метансульфониламино-N-(2-метокси-этил)-N-метил-бензамид;
N-(4-{(Е)-2-[3-трет-бутил-5-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-2-метокси-фенил]-винил}-3-изопропоксиметил-фенил)метансульфонамид;
N-(4-{(Е)-2-[3-трет-бутил-5-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-2-метокси-фенил]-винил}-3-пирролидин-1-карбонил)фенил)метансульфонамид;
N-(4-{(Е)-2-[3-трет-бутил-5-(2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-ил)-2-метокси-фенил]-винил}-3-(3-гидрокси-азетидин-1-илметил)фенил)метансульфонамид;
N-(4-{(E)-2-[3-трет-бутил-5-(2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-2-метокси-фенил]-винил}-3-пирролидин-1-илметил-фенил)метансульфонамид;
N-(4-{(Z)-2-[3-трет-бутил-5-(2,4-диоксо-3,4-дигидро-2H-пиримидин-1-ил)-2-метокси-фенил]-винил}фенил)метансульфонамид; и
N-(4-(3-трет-бутил-5-(2,4-диоксотетрагидропиримидин-1(2H)-ил)фенэтил)фенил)метансульфонамид.
кристаллической девятиводной динатриевой соли кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида,
кристаллической четырехводной динатриевой соли кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида,
кристаллической четырехводной дикалиевой соли кристаллического (E)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида,
кристаллической трехводной монокалиевой соли кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида,
кристаллической двуводной монокалиевой соли кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида,
кристаллической 1/7 калиевой соли кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида,
кристаллической четырехводной монодиэтиламиновой соли кристаллического (E)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида и
кристаллического образца А гидрата (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида.
девятиводной динатриевой соли кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющей порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 4,3±0,2, 10,4±0,2, 10,9±0,2, 11,6±0,2, 12,9±0,2, 14,7±0,2, 16,4±0,2, 17,8±0,2, 19,4±0,2, 19,8±0,2, 20,8±0,2, 21,9±0,2 и 23,5±0,2 градусов 2θ;
девятиводной динатриевой соли кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющей порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 4,3±0,2, 10,4±0,2, 10,9±0,2, 11,6±0,2, 12,9±0,2, 14,7±0,2, 14,9±0,2, 16,4±0,2, 17,8±0,2, 19,4±0,2, 19,7±0,2, 19,8±0,2, 20,8±0,2, 20,9±0,2, 21,9±0,2, 22,1±0,2 и 23,5±0,2 градусов 2θ;
девятиводной динатриевой соли кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющей порошковую рентгенограмму, по существу представленную на Фигуре 1;
девятиводной динатриевой соли кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющей параметры элементарной ячейки, где а равно 8,9Å, b равно 9,4Å и с равно 20,7Å;
четырехводной динатриевой соли кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющей порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 4,8±0,2, 12,1±0,2, 14,0±0,2, 17,0±0,2, 17,5±0,2, 20,9±0,2, 21,6±0,2, 25,0±0,2 и 29,5±0,2 градусов 2θ;
четырехводной динатриевой соли кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющей порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 4,8±0,2, 12,1±0,2, 14,0±0,2, 14,4±0,2, 17,0±0,2, 17,5±0,2, 20,9±0,2, 21,6±0,2, 25,0±0,2, 29,5±0,2 и 34,2±0,2 градусов 2θ;
четырехводной динатриевой соли кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющей порошковую рентгенограмму, по существу представленную на Фигуре 2;
четырехводной дикалиевой соли кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющей порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 5,0±0,2, 11,9±0,2, 12,4±0,2, 13,7±0,2, 15,0±0,2, 16,5±0,2, 17,1±0,2, 20,8±0,2, 21,3±0,2, 22,2±0,2, 24,0±0,2, 26,4±0,2 и 29,3±0,2 градусов 2θ;
четырехводной дикалиевой соли кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющей порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 5,0±0,2, 11,9±0,2, 12,4±0,2, 12,6±0,2, 13,7±0,2, 15,0±0,2, 16,5±0,2, 16,7±0,2, 17,1±0,2, 20,7±0,2, 20,8±0,2, 21,3±0,2, 22,2±0,2, 22,4±0,2, 24,0±0,2, 26,4±0,2 и 29,3±0,2 градусов 2θ;
четырехводной дикалиевой соли кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющей порошковую рентгенограмму, по существу представленную на Фигуре 4;
четырехводной дикалиевой соли кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющей параметры элементарной ячейки, где а равно 14,5Å, b равно 10,8Å и с равно 35,8Å;
трехводной монокалиевой соли кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющей порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 4,8±0,2, 10,8±0,2, 11,3±0,2, 13,4±0,2, 15,3±0,2, 16,9±0,2, 21,2±0,2, 21,7±0,2, 22,1±0,2, 22,5±0,2 и 23,0±0,2 градусов 2θ;
трехводной монокалиевой соли кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющей порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 4,8±0,2, 10,8±0,2, 11,3±0,2, 13,4±0,2, 13,6±0,2, 15,3±0,2, 16,9±0,2, 21,2±0,2, 21,7±0,2, 22,1±0,2, 22,5±0,2, 22,6±0,2, и 23,0±0,2 градусов 2θ;
трехводной монокалиевой соли кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил) фенил)метансульфонамида, имеющей порошковую рентгенограмму, содержащую пять или более пиков, выбранных из группы, состоящей из 4,8±0,2, 10,8±0,2, 11,3±0,2, 13,4±0,2, 15,3±0,2, 16,9±0,2, 21,2±0,2, 21,7±0,2, 22,1±0,2, 22,5±0,2 и 23,0±0,2 градусов 2θ;
трехводной монокалиевой соли кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющей параметры элементарной ячейки, где а равно 9,0Å, b равно 8,3Å и с равно 18,6Å;
двухводной монокалиевой соли кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющей порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 7,7±0,2, 8,8±0,2, 16,1±0,2 и 19,7±0,2 градусов 2θ;
двуводной монокалиевой соли кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющей порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 7,7±0,2, 8,8±0,2, 12,4±0,2, 14,0±0,2, 16,1±0,2, 17,7±0,2, 19,2±0,2, 19,7±0,2, 23,1±0,2 и 29,2±0,2 градусов 2θ;
двуводной монокалиевой соли кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющей порошковую рентгенограмму, по существу представленную на Фигуре 6;
1/7 калиевой соли кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющей порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 7,7±0,2, 8,3±0,2, 10,1±0,2, 10,6±0,2, 11,4±0,2, 12,0±0,2, 13,4±0,2, 15,6±0,2, 16,3±0,2, 16,7±0,2, 17,2±0,2, 18,3±0,2, 18,8±0,2, 19,4±0,2, 19,9±0,2, 20,2±0,2, 20,5±0,2, 21,2±0,2, 22,1±0,2 и 22,9±0,2 градусов 2θ;
1/7 калиевой соли кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющей порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 7,7±0,2, 8,3±0,2, 10,1±0,2, 10,6±0,2, 11,4±0,2, 12,0±0,2, 13,4±0,2, 15,6±0,2, 16,3±0,2, 16,7±0,2, 17,2±0,2, 18,3±0,2, 18,8±0,2, 19,4±0,2, 19,9±0,2, 20,2±0,2, 20,5±0,2, 20,8±0,2, 21,2±0,2, 22,1±0,2, 22,9±0,2, 24,3±0,2, 24,9±0,2 и 25,1±0,2 градусов 2θ;
1/7 калиевой соли кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющей порошковую рентгенограмму, по существу представленную на Фигуре 8;
четырехводной монодиэтиламинной соли кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющей порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 9,5±0,2, 10,0±0,2, 11,8±0,2, 12,1±0,2, 14,4±0,2, 16,8±0,2, 17,6±0,2, 19,8±0,2, 20,8±0,2, 21,4±0,2, 21,8±0,2 и 29,8±0,2 градусов 2θ;
четырехводной монодиэтиламинной соли кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющей порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 9,5±0,2, 10,0±0,2, 11,8±0,2, 12,1±0,2, 14,4±0,2, 16,8±0,2, 17,6±0,2, 19,4±0,2, 19,8±0,2, 20,8±0,2, 21,4±0,2, 21,8±0,2, 21,9±0,2 и 29,8±0,2 градусов 2θ;
четырехводной монодиэтиламинной соли кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющей порошковую рентгенограмму, по существу представленную на Фигуре 9;
образца А кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющего порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 5,8±0,2, 9,9±0,2, 11,8±0,2, 12,4±0,2, 14,5±0,2, 18,8±0,2, 22,7±0,2 и 29,2±0,2 градусов 2θ;
образца А кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющего порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 5,8±0,2, 9,9±0,2, 11,8±0,2, 12,4±0,2, 14,0±0,2, 14,5±0,2, 15,3±0,2, 18,5±0,2, 18,8±0,2, 22,2±0,2, 22,7±0,2, 23,8±0,2, 26,0±0,2 и 29,2±0,2 градусов 2θ.
образца А кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющего порошковую рентгенограмму, по существу представленную на Фигуре 11;
образца В кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющего порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 11,5±0,2, 13,3±0,2, 15,4±0,2, 16,4±0,2, 17,1±0,2, 18,6±0,2, 19,4±0,2, 20,4±0,2, 21,6±0,2, 22,4±0,2, 24,0±0,2, 26,8±0,2 и 29,0±0,2 градусов 2θ;
образца В кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющего порошковую рентгенограмму, по существу представленную на Фигуре 13;
образца С кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющего порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 7,7±0,2, 10,1±0,2, 10,6±0,2, 12,0±0,2, 13,4±0,2, 16,2±0,2, 19,4±0,2, 20,5±0,2, 21,4±0,2, 22,0±0,2, 22,6±0,2, 24,3±0,2 и 27,6±0,2 градусов 2θ;
образца С кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющего порошковую рентгенограмму, по существу представленную на Фигуре 14;
образца D кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющего порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 5,8±0,2, 10,7±0,2, 11,2±0,2, 15,2±0,2, 16,1±0,2, 16,9±0,2, 19,9±0,2, 22,1±0,2, 24,7±0,2 и 26,0±0,2 градусов 2θ;
образца D кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющего порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 5,8±0,2, 10,7±0,2, 11,2±0,2, 15,2±0,2, 16,1±0,2, 16,9±0,2, 17,1±0,2, 19,9±0,2, 20,1±0,2, 22,1±0,2, 24,7±0,2 и 26,0±0,2 градусов 2θ;
образца D кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющего порошковую рентгенограмму, по существу представленную на Фигуре 15;
образца А гидрата кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющего порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 5,1±0,2, 7,9±0,2, 9,5±0,2, 10,3±0,2, 13,7±0,2, 16,5±0,2, 17,1±0,2, 17,5±0,2, 18,8±0,2, 19,2±0,2, 20,7±0,2, 21,3±0,2, 21,6±0,2, 25,8±0,2, 26,8±0,2 и 28,4±0,2 градусов 2θ;
образца А гидрата кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющего порошковую рентгенограмму, по существу представленную на Фигуре 16;
образца А гидрата кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющего порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 6,3±0,2, 7,7±0,2, 10,4±0,2, 12,7±0,2, 13,3±0,2, 14,9±0,2, 15,4±0,2, 16,4±0,2, 18,6±0,2, 18,9±0,2, 19,4±0,2, 22,5±0,2, 23,5±0,2, 24,0±0,2, 26,8±0,2 и 29,0±0,2 градусов 2θ;
образца В гидрата кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющего порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 6,3±0,2, 7,7±0,2, 10,4±0,2, 12,7±0,2, 13,3±0,2, 13,5±0,2, 14,9±0,2, 15,4±0,2, 16,4±0,2, 18,5±0,2, 18,6±0,2, 18,9±0,2, 19,4±0,2, 22,5±0,2, 23,5±0,2, 24,0±0,2, 26,8±0,2, и 29,0±0,2 градусов 2θ;
образца В гидрата кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющего порошковую рентгенограмму, по существу как показано на Фигуре 18;
образца С гидрата кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющего порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 10,5±0,2, 13,3±0,2, 13,5±0,2, 14,9±0,2, 15,4±0,2, 16,4±0,2, 18,6±0,2, 19,0±0,2, 19,4±0,2, 22,5±0,2, 23,5±0,2, 26,9±0,2 и 29,0±0,2 градусов 2θ;
образца С гидрата кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющего порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 10,5±0,2, 13,3±0,2, 13,5±0,2, 14,9±0,2, 15,4±0,2, 16,4±0,2, 18,6±0,2, 19,0±0,2, 19,4±0,2, 22,5±0,2, 23,5±0,2, 26,9±0,2 и 29,0±0,2 градусов 2θ;
образца С кристаллического гидрата (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющего порошковую рентгенограмму, по существу как показано на Фигуре 20;
образца D гидрата кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющего порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 6,6±0,2, 10,0±0,2, 10,5±0,2, 11,1±0,2, 11,6±0,2, 12,2±0,2, 14,2±0,2, 16,6±0,2, 17,1±0,2, 17,7±0,2, 18,5±0,2, 18,8±0,2, 19,3±0,2, 21,4±0,2, 22,7±0,2, 23,1±0,2, 23,6±0,2, 24,6±0,2, 25,2±0,2, 27,2±0,2, 29,1±0,2 и 31,0±0,2 градусов 2θ;
образца D гидрата кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющего порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 6,6±0,2, 10,0±0,2, 10,5±0,2, 11,1±0,2, 11,6±0,2, 12,2±0,2, 12,5±0,2, 14,2±0,2, 16,6±0,2, 17,1±0,2, 17,7±0,2, 18,5±0,2, 18,8±0,2, 19,3±0,2, 21,4±0,2, 22,7±0,2, 22,8±0,2, 23,1±0,2, 23,6±0,2, 24,6±0,2, 24,9±0,2, 25,2±0,2, 27,2±0,2, 29,1±0,2 и 31,0±0,2 градусов 2θ;
образца D гидрата кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющего порошковую рентгенограмму, по существу представленную на Фигуре 22;
образца D кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющего параметры элементарной ячейки, где а равно 17,8Å, b равно 9,6Å и с равно 27,0Å;
образца Е гидрата кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющего порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 6,2±0,2, 7,8±0,2, 10,2±0,2, 10,7±0,2, 12,1±0,2, 16,3±0,2, 19,7±0,2, 20,9±0,2, 21,8±0,2, 24,5±0,2 и 28,0±0,2 градусов 2θ;
образца Е гидрата кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющего порошковую рентгенограмму, содержащую один или более пиков, выбранных из группы, состоящей из 6,2±0,2, 7,8±0,2, 10,2±0,2, 10,4±0,2, 10,7±0,2, 12,1±0,2, 16,3±0,2, 19,7±0,2, 20,9±0,2, 21,8±0,2, 24,5±0,2 и 28,0±0,2 градусов 2θ;
образца Е гидрата кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющего порошковую рентгенограмму, по существу представленную на Фигуре 23; и
образца Е гидрата кристаллического (Е)-N-(4-(3-трет-бутил-5-(2,4-диоксо-3,4-дигидропиримидин-1(2Н)-ил)-2-метоксистирил)фенил)метансульфонамида, имеющего параметры элементарной ячейки, где а равно 9,5Å, b равно 14,5Å и с равно 17,3Å.
и один или более наполнителей.

с последующим получением соединения формулы I из соединения формулы II путем замещения X2на L-R6,
где R1, R2, R3, R4 и R5 определены в пункте 1 и X1 и X2 каждый независимо обозначает гало.

где R11, R12, R13, R14, R15, R16 и R17 независимо выбраны из группы, состоящей из водорода, C1-4-перфторалкила, C1-4-алкилокси, C1-4-галоалкила, хлора и циано.









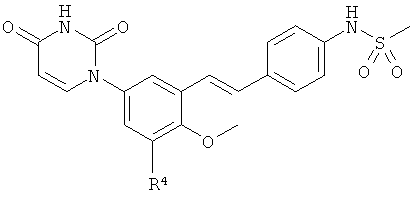


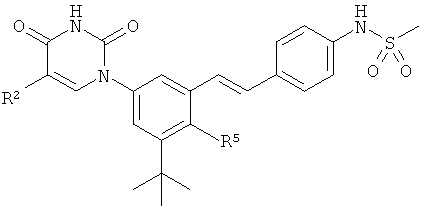






Комментарии