Способ обогащения минералов с использованием биореагента, выделенного из грамположительных бактерий - RU2744124C1
Код документа: RU2744124C1
Чертежи
Описание
Область техники, к которой относится изобретение
[0001] Настоящее изобретение в основном предназначено для горнодобывающей промышленности и включает способ обогащения минералов с использованием биореагента, выделенного из грамположительных бактерий (Rhodococcus opacus и Rhodococcus erytrhopolis).
Уровень техники
[0002] Одним из основных процессов концентрирования минералов, используемых в горнодобывающей промышленности, является пенная флотация. Биофлотация определяется как процесс разделения, при котором представляющий интерес минерал избирательно подвергается флотации или депрессии с использованием реагентов биологического происхождения, известных как биореагенты.
[0003] В последние годы биофлотация интенсивно изучалась как привлекательная альтернатива для замены обычных реагентов на такие, которые не наносят вреда окружающей среде. Биореагенты характеризуются низкой токсичностью и легкостью разложения при утилизации, а сырье для их производства является дешевым, регенерируемым и легко доступным. Кроме того, биореагенты можно использовать в переработке руды с низким содержанием металлов и хвостов добычи, что позволяет эксплуатировать экономически невыгодные месторождения.
[0004] С другой стороны, несмотря на наличие доказательств того, что биофлотация представляет собой процесс, который обеспечивает хорошее извлечение и селективность, существуют факторы, которые препятствуют развитию данной методологии, в том числе небольшой технологический прогресс и незначительное знание механизмов, кинетики и термодинамики процесса.
[0005] Биореагенты представляют собой гетерогенную смесь различных соединений, которые трудно охарактеризовать, что затрудняет понимание специфических механизмов, вовлеченных в процесс пенной флотации, где биореагенты способны избирательно модифицировать поверхность представляющего интерес минерала. Кроме того, важно отметить, что в теоретических моделях, используемых для исследования процесса адгезии минерала/бактерий, не учитываются биологические факторы. Включение этих факторов имеет большое значение для полного понимания процессов, которые происходят во время биофлотации.
[0006] Использование микроорганизмов и/или продуктов их метаболизма в качестве реагентов, в частности, собирателей, пенообразующих реагентов и модификаторов в операциях по переработке минералов, стало очень привлекательным, поскольку оно обладает большим технологическим потенциалом, является экологически безопасным и обладает селективностью в обработке минеральных частиц. Такие микроорганизмы и/или продукты их метаболизма могут модифицировать поверхность минералов, прямо или опосредованно. Прямой механизм включает прямую адгезию микробных клеток к минеральным частицам, в то время как опосредованный механизм относится к продуктам метаболизма или растворимым клеточным фракциям, которые функционируют в качестве активных реагентов на поверхности. Оба взаимодействия приводят к изменениям химических свойств поверхности, делая ее гидрофильной или гидрофобной в зависимости от природы соответствующего биореагента и минерала.
[0007] Основная функция микроорганизмов и/или продуктов их метаболизма при использовании в качестве биореагента в переработке минералов связана с наличием неполярных функциональных групп (углеводородных цепей) и полярных групп (карбоксилов, фосфатов, гидроксилов) на их клеточной поверхности или внутри клетки, и/или наличием внеклеточных соединений, продуцированных микроорганизмами, которые могут модифицировать свойства поверхности раздела и тем самым изменять амфипатические свойства поверхности минералов.
[0008] Бактерии Rhodococcus erythropolis и Rhodococcus opacus являются грамположительными, непатогенными и широко распространены в природе, происходя из самых разнообразных источников.
[0009] Например, в документе CN102489415 описано применение бактерий Rhodococcus erythropolis в качестве собирателя в процессе пенной флотации системы, содержащей гематит. Данный документ отличается от настоящего изобретения тем, что в качестве собирателя в нем используется сама бактерия (биомасса), а не биореагент, извлеченный из бактерии.
[00010] В документе CN102911904 описано применение бактерий в качестве собирателей в процессе флотации руды, содержащей тугоплавкий гематит. Как и в CN102489415, этот документ отличается от настоящего изобретения тем, что в качестве собирателя используется сама бактерия (биомасса), а не биореагент, извлеченный из бактерии.
[00011] В публикации «Biosurfactant production by Rhodococcus erythropolis and its application to oil removal», опубликованной 29.10.2010 сотрудниками Федерального университета Рио-де-Жанейро, упоминается биосурфактант, выделенный из бактерии Rhodococcus erythropolis, используемый для обработки загрязненной нефтью почвы. Настоящее изобретение отличается от указанного документа тем, что речь идет о флотации минералов, а не об обработке загрязненной нефтью почвы.
[00012] В публикации «Flocculation and flotation response of Rhodococcus erythropolis to pure minerals in hematite ores», опубликованной 27.02.2013 сотрудниками Университета науки и технологий Пекина, описывается применение бактерии Rhodococcus erythropolis в качестве собирателя в способе флотации системы, содержащей гематит. Как CN102489415, так и CN102911904, данный документ отличается от настоящего изобретения тем, что в качестве собирателя используется сама бактерия (биомасса), а не биореагент, выделенный из бактерии.
[00013] В публикации «Flotation of serpentinite and quartz using biosurfactants», опубликованной 06.05.2012 сотрудниками Вроцлавского технологического университета (Польша), упоминается биосурфактант, выделенный из бактерий Bacillus circulans и Streptomyces sp., который используется во флотации кварца и серпентина. Настоящее изобретение отличается от указанного документа тем, что используются другие бактерии, а также другие минералы, которые требуется извлечь в процессе пенной флотации.
[00014] Как будет дополнительно подробно описано ниже, настоящее изобретение обеспечивает способ обогащения минералов с использованием биореагентов, выделенных из бактерий Rhodococcus opacus и Rhodococcus erytrhopolis.
Сущность изобретения
[00015] Основной целью настоящего изобретения является обеспечение способа обогащения минералов с использованием биореагентов, выделенных из бактерий Rhodococcus opacus и Rhodococcus erytrhopolis.
[00016] Таким образом, оценивали способ выделения метаболитов, в частности, белковых соединений, из бактерий Rhodococcus opacus и Rhodococcus erytrhopolis, с целью их применения в качестве биореагентов-собирателей во флотации минералов, поскольку белки имеют тенденцию обеспечивать гидрофобный характер поверхностей минералов, тем самым способствуя процессу флотации.
[00017] Таким образом, оценивали плавучесть минералов с использованием биореагента, выделенного из бактерий рода Rhodococcus для определения его потенциала применения в качестве альтернативы синтетическим реагентам, а также альтернативы применению самих микроорганизмов (биомассы).
Краткое описание фигур
[00018] Подробное описание, приведенное ниже, относится к фигурам и их соответствующим ссылочным номерам:
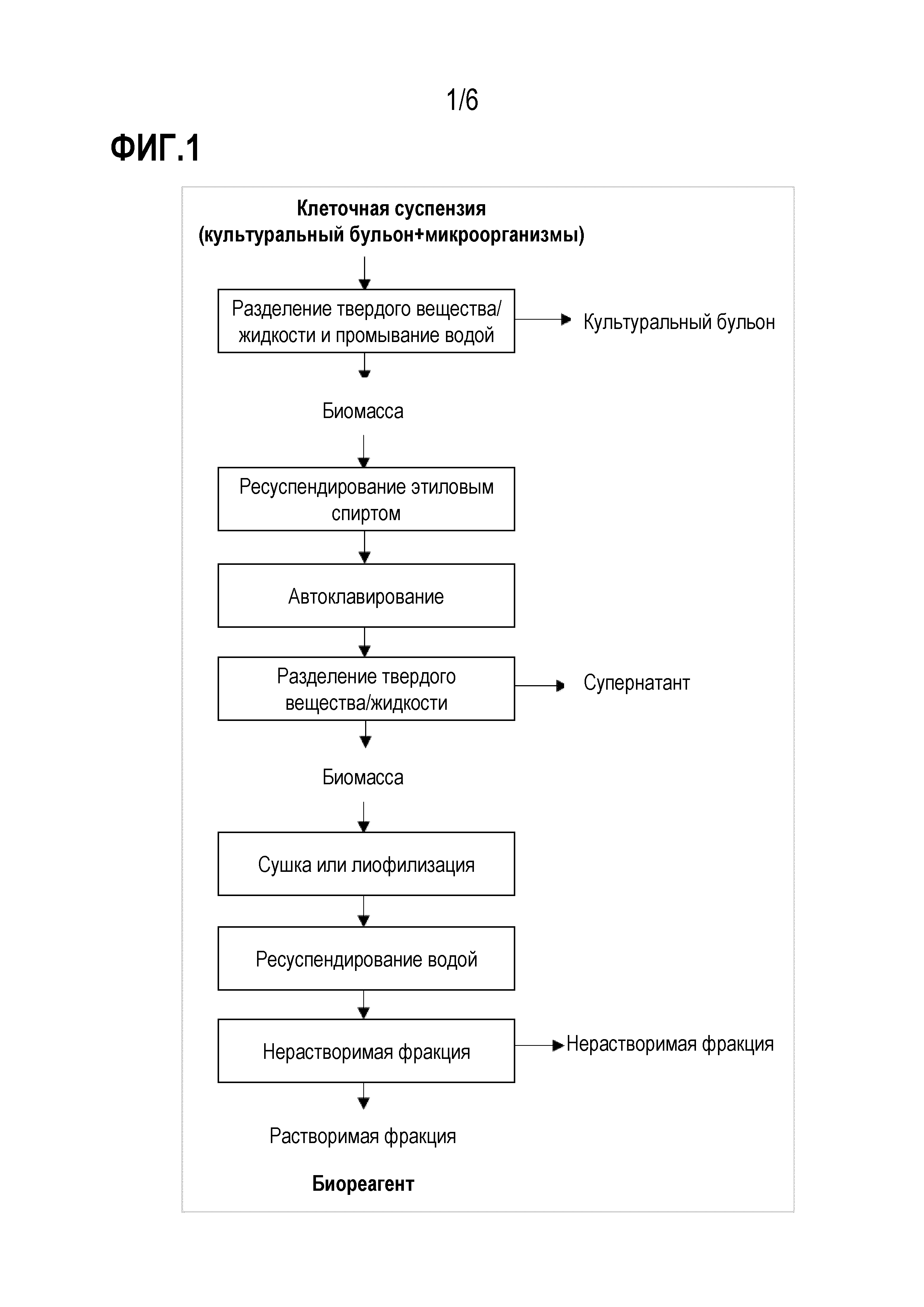
На фиг. 1 представлена схема последовательности операций способа выделения биореагента из микроорганизмов.
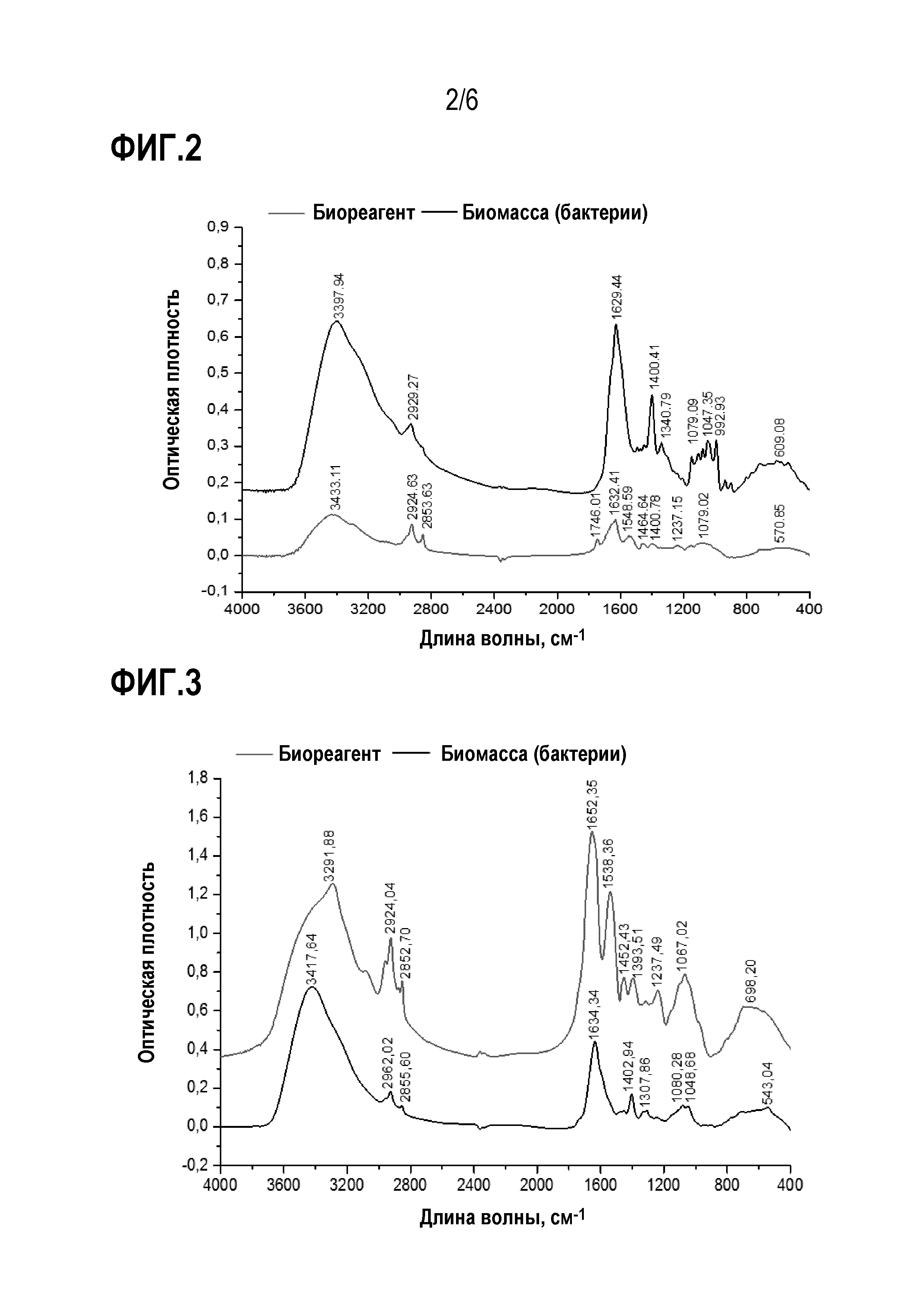
На фиг. 2 показан инфракрасный спектр бактерии R. opacus (синяя линия) и сырого биореагента (черная линия).
На фиг.3 показан инфракрасный спектр бактерии R. erythropolis (синяя линия) и сырого биореагента (черная линия).
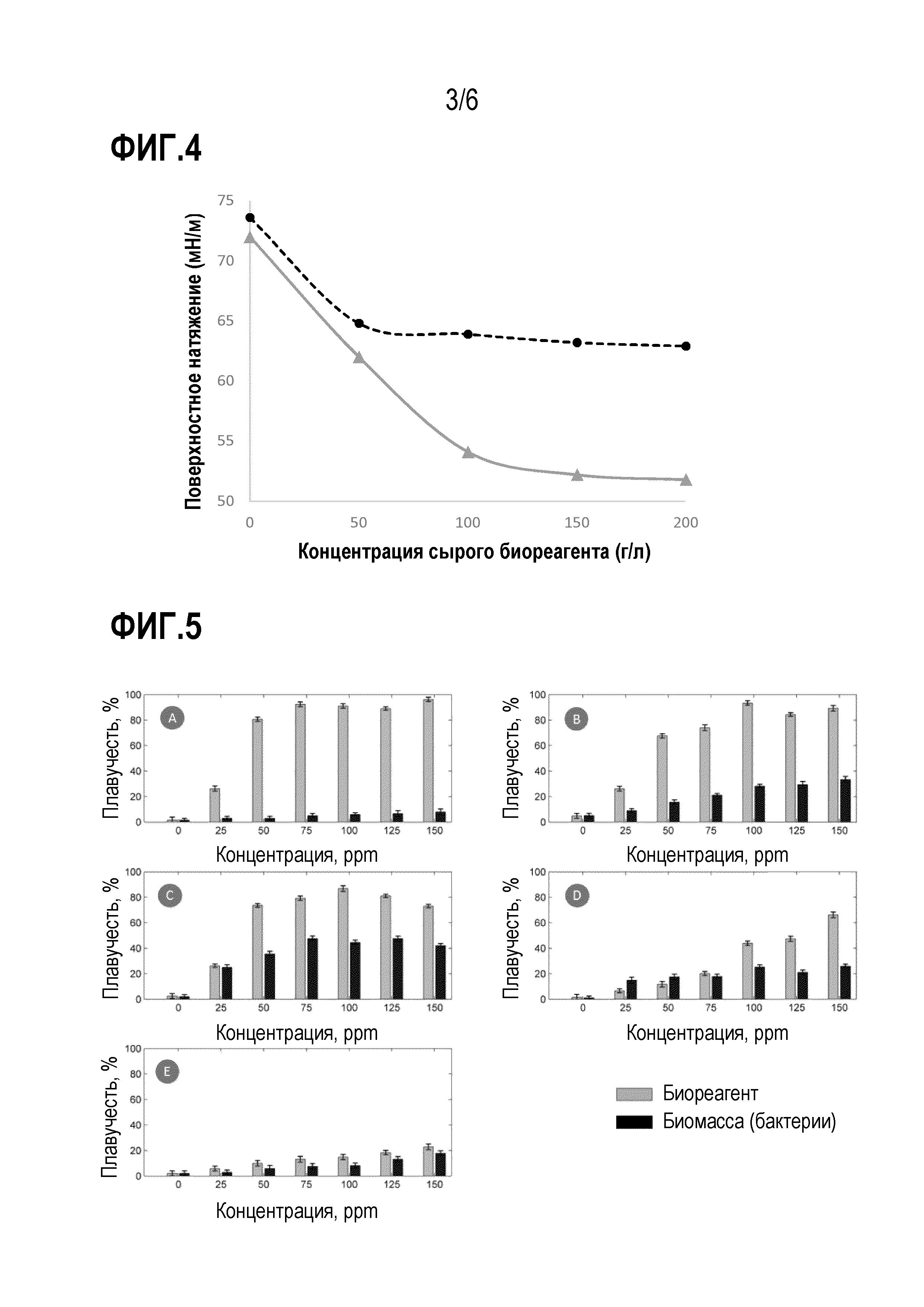
На фиг.4 представлен график, показывающий влияние концентрации биореагента на поверхностное натяжение деионизированной воды при 20°C и нейтральном pH: сплошная линия, биореагент, выделенный из бактерий R. opacus, и пунктирная линия, биореагент, выделенный из бактерий R. erythropolis.
На фиг. 5 представлены столбчатые графики, на которых сравнивается плавучесть гематита с использованием бактерий (биомассы) и биореагента: (a) pH3, (b) pH5, (c) pH7, (d) pH9, (e) pH11.
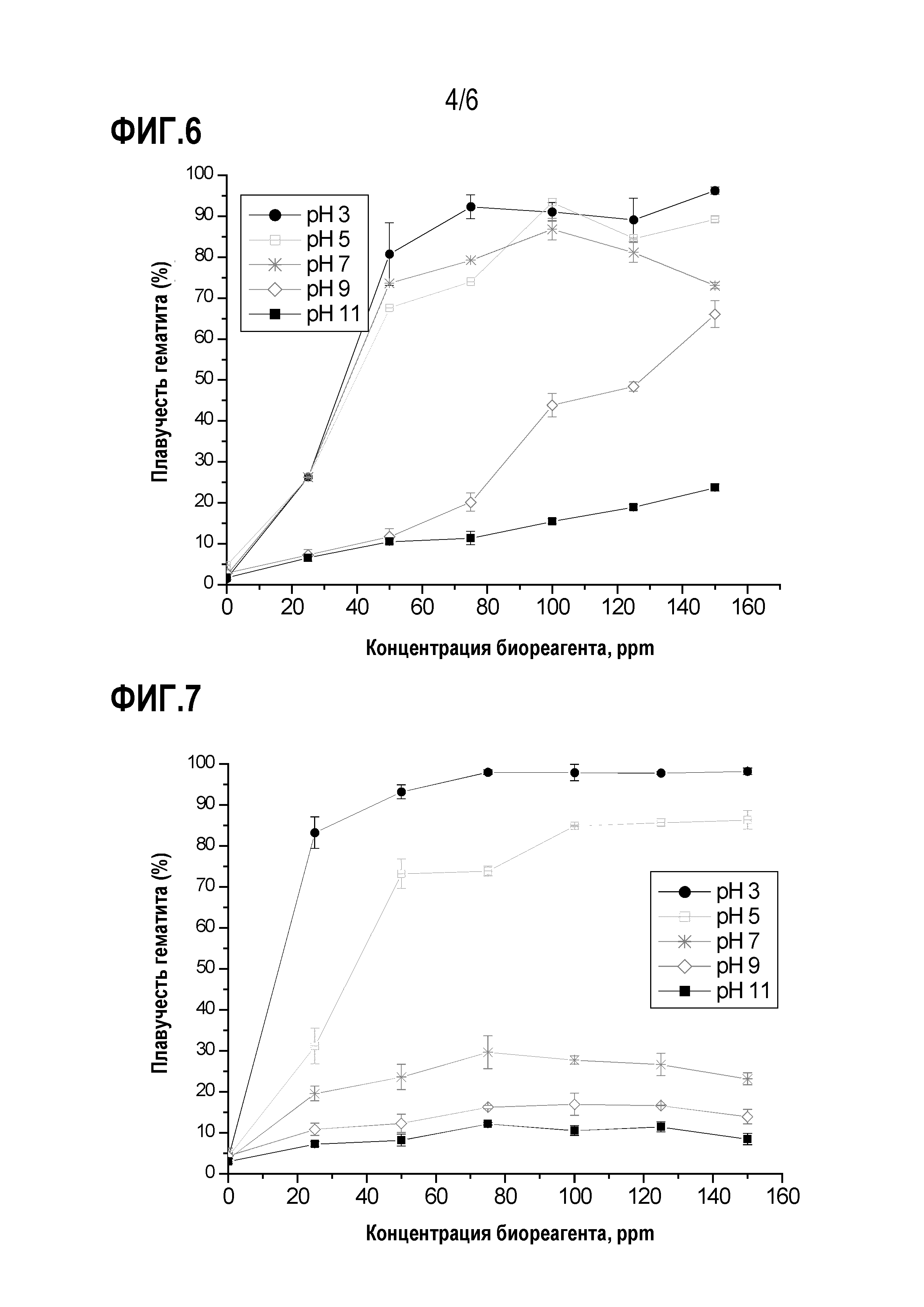
На фиг. 6 представлен график, показывающий плавучесть гематита при различных концентрациях биореагента, выделенного из бактерии R. opacus.
На фиг. 7 представлен график, показывающий плавучесть гематита при различных концентрациях биореагента, выделенного из бактерии R. erythropolis.
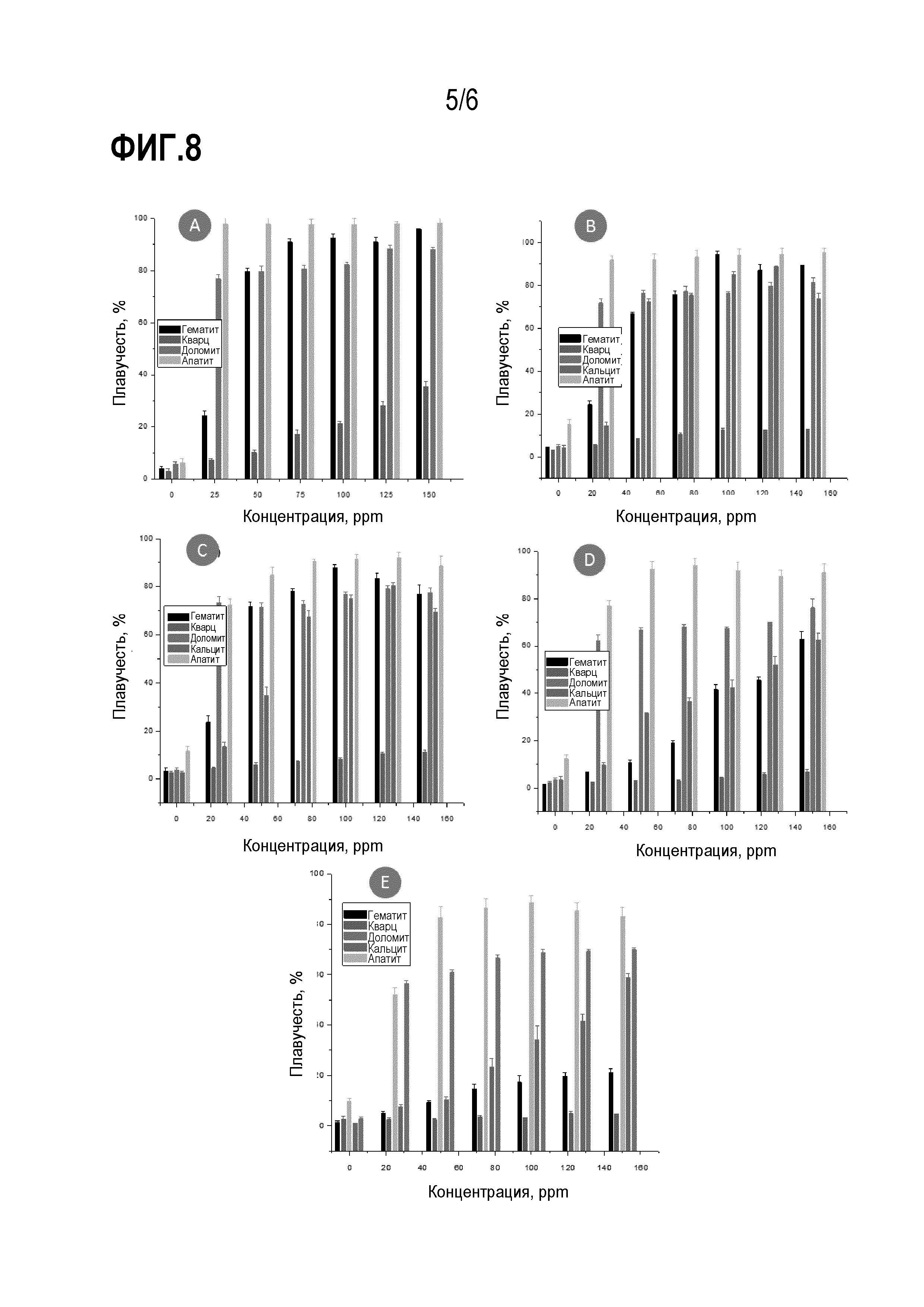
На фиг. 8 представлены столбчатые графики, на которых сравнивается плавучесть гематита, кварца, доломита, кальцита и апатита с использованием биореагента, выделенного из бактерий R. opacus: (a) pH3, (b) pH5, (c) pH7, (d) pH9, (e) pH11.
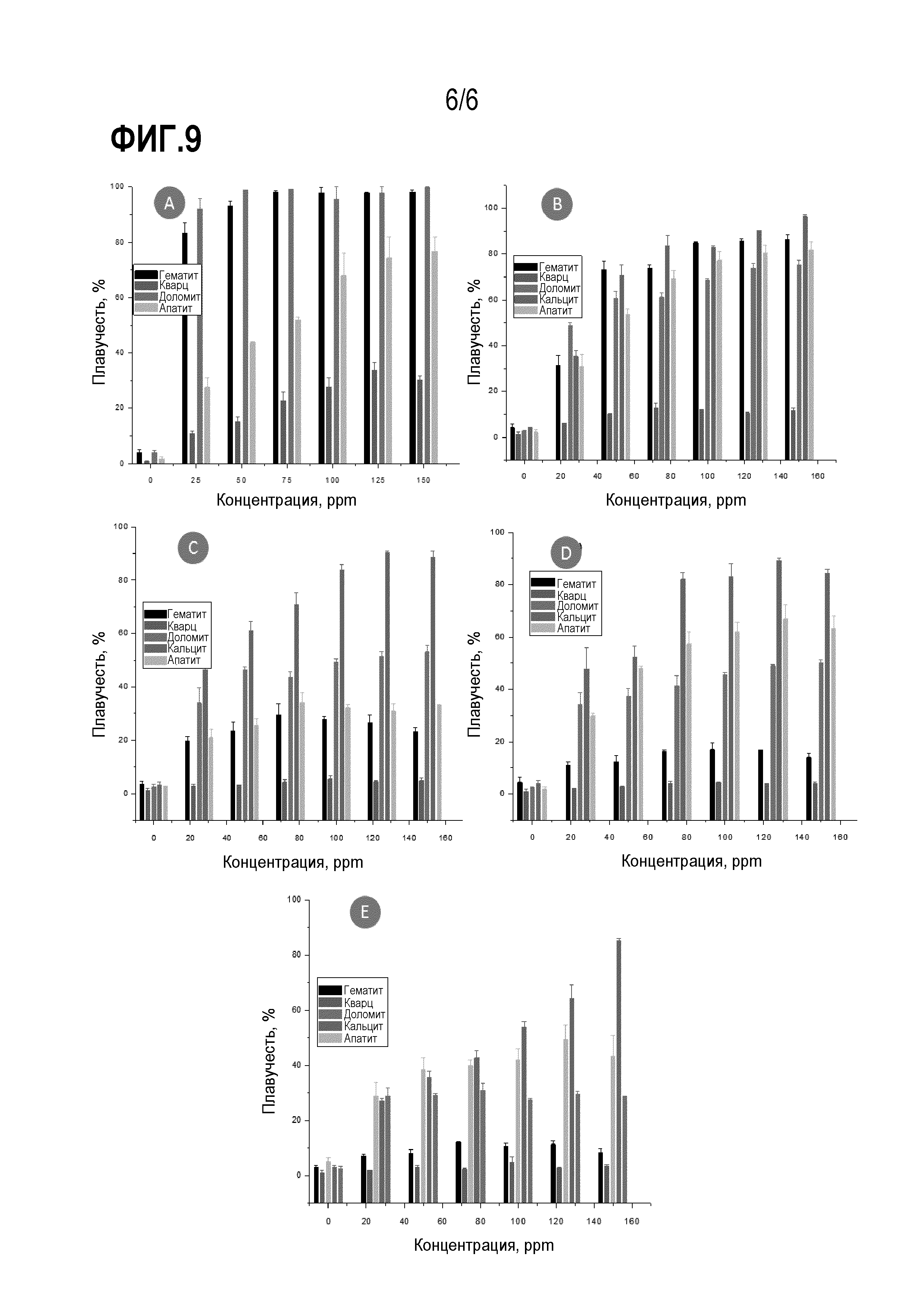
На фиг. 9 представлены столбчатые графики, на которых сравнивается плавучесть гематита, кварца, доломита, кальцита и апатита с использованием биореагента, выделенного из бактерий R. erythropolis: (a) pH3, (b) pH5, (c) pH7, (d) pH9, (e) pH11.
Подробное описание изобретения
[00019] Прежде всего, следует подчеркнуть, что последующее описание начинается с предпочтительного варианта осуществления изобретения. Однако, как будет очевидно любому специалисту в данной области, изобретение не ограничивается этим конкретным вариантом осуществления.
[00020] Настоящее изобретение представляет способ обогащения минералов с использованием биореагентов, выделенных из бактерий Rhodococcus opacus и Rhodococcus erytrhopolis, где указанный способ включает стадии: i) дробление руды и приготовление пульпы;ii) добавление реагента и кондиционирование; iii) флотация.
[00021] Как хорошо известно специалистам в данной области, культуральные бульоны, используемые для инокуляции бактерий в настоящем изобретении, должны предпочтительно содержать источники питательных веществ, белков и углеводов. Бульон можно приготовить с использованием коммерчески доступных реагентов, или он может быть частично или полностью замещен ингредиентами из других производственных цепочек, например, отходами пищевой промышленности. Культивирование микроорганизмов может иметь место во вращающейся сушильной камере, или для крупномасштабных процессов можно использовать ферментеры или биореакторы. Необходимо контролировать температуру и наличие загрязняющих веществ.
[00022] Согласно настоящему изобретению экстракцию биореагента из бактерий Rhodococcus (opacus, erytrhopolis) проводят процессом экстракции растворителем, предпочтительно экстракцией горячим этиловым спиртом (100-140°C).
[00023] На фиг.1 приведена схема последовательности операций способа выделения биореагента из микроорганизмов, и она включает следующие стадии (i) разделение твердого вещества/жидкости и промывание водой; (ii) ресуспендирование этиловым спиртом; (iii) автоклавирование; (iv) повторное разделение твердого вещества/жидкости; (v) сушка или лиофилизация биомассы; (vi) ресуспендирование водой; (vii) повторное разделение твердого вещества/жидкости.
[00024] Стадии разделения твердого вещества/жидкости предпочтительно можно выполнить центрифугированием или фильтрованием с использованием мембраны с размером пор 25 мкм. Автоклавирование предпочтительно проводить под давлением от 0,5 до 1,5 бар и при температуре от 100 до 140°C.
[00025] Соотношение этилового спирта и воды, используемое в процессе экстракции и растворения растворимой фракции, соответственно, можно изменять в зависимости от процесса культивирования микроорганизмов. Факторами, которые могут привести к необходимости изменений процесса, являются следующие: состав культурального бульона (может быть заменен, например, отходами пищевой промышленности), оборудование и условия культивирования (использование, например, биоферментеров, инокуляцию иммобилизованных клеток).
[00026] Согласно настоящему изобретению экстракция биореагента из бактерий Rhodococcus (opacus, erytrhopolis) может включать стадию очистки.
[00027] Полученный биореагент предпочтительно хранить максимум в течение 5 суток при 4°С для последующего использования в способе пенной флотации. Используемый способ экстракции позволяет выделять компоненты, связанные как с внутриклеточными соединениями, так и с теми, которые присутствуют в клеточной стенке микроорганизма. Эти вещества ответственны за придание гидрофобности поверхности минералов.
[00028] Биореагенты, экстрагированные из грамположительных бактерий, относящихся к роду Rhodococcus (виды opacus, erytrhopolis) по данному изобретению, можно использовать для флотации любого минерала железа, предпочтительно гематита. Также возможно подвергнуть флотации минеральные системы, предпочтительно гематит-кварцевую систему. Однако также возможна флотация руд, содержащих другие представляющие интерес минералы, такие как кальцит, доломит и апатит, с использованием способа по настоящему изобретению.
[00029] Согласно настоящему изобретению реагент, добавляемый на стадии флотации, может содержать только биореагент, экстрагированный из бактерий Rhodococcus (opacus, erytrhopolis), в диапазоне концентраций от 25 до 200 мг/л, или его можно использовать в сочетании с любым из следующих реагентов, которые представляют депрессор, собиратель и пенообразующий реагент.
[00030] Согласно настоящему изобретению стадию кондиционирования можно выполнить в диапазоне значений рН от 3 до 7 для гематит-кварцевой системы.
[00031] Также согласно настоящему изобретению стадию флотации можно выполнить в трубках Халлимонда, флотационных камерах или флотационных колонках.
[00032] Согласно настоящему изобретению стадия флотации предпочтительно состоит из прямой флотации металла/элемента, представляющего интерес.
[00033] Также согласно настоящему изобретению стадия флотации может выполняться в диапазоне значений рН от 3 до 7 для гематит-кварцевой системы.
[00034] Результаты тестирования пенной флотации, проведенных с биореагентами по настоящему изобретению, как показано в примерах 4, 5 и 6, свидетельствуют о потенциальном использовании биореагентов в качестве альтернативы синтетическим реагентам в способах флотации минералов. Применение биореагентов, в дополнение к ускорению способа флотации, увеличивает, например, извлечение гематита. На фиг.5 показан ряд столбчатых графиков, на которых приведено сравнение плавучести гематита с использованием бактерии R. opacus и биореагента, выделенного из на нее, при различных значениях pH: (a) pH3, (b) pH5, (c) pH7, (d) pH9, (e) pH11.
[00035] Максимальная плавучесть гематита, полученная с использованием бактерии (биомассы), составляет 43% при нейтральном рН (фиг. 5(с)), в то время как максимальное извлечение с использованием биореагента при кислом рН (фиг. 5(а) и 5(b)) составляет 95%. Высокая эффективность биореагента даже в кислой среде характерна для большинства биореагентов, которые обладают стабильностью даже в средах с экстремальными значениями температуры, pH и условиями солености. Результаты показали высокое сродство биореагента по данному изобретению к частицам гематита и относительно низкий расход реагента по сравнению с использованием бактерий (биомассы).
Пример 1
[00036] Проведено тестирование экстракции биореагента из микроорганизмов. Используемые бактерии рода Rhodococcus (виды opacus, erytrhopolis) получали из Бразильской коллекции экологических и промышленных микроорганизмов (CBMAI-UNICAMP).
[00037] Культуральный бульон, используемый для культивирования бактерий Rhodococcus opacus, состоял из 10 г/дм3 глюкозы, 5 г/дм3 пептона, 3 г/дм3 солодового экстракта, 3 г/дм3 дрожжевого экстракта и 2 г/дм3 CaCO3. Культуральный бульон, используемый для Rhodococcus erythropolis, состоял из 17 г/дм3 казеинового экстракта, 3 г/дм3 соевой муки, 5 г/дм3 NaCl, 2,5 г/дм3 глюкозы и 2,5 г/дм3 дикалийфосфата. Бактерии инкубировали в орбитальном шейкере при 125 об/мин в течение 7 суток.
[00038] После периода культивирования биомассу из культурального бульона (клеточной суспензии) отделяли центрифугированием при 4000 об/мин (фиг.1). Биомассу промывали деионизированной водой и снова центрифугировали для удаления оставшегося культурального бульона. Промывание повторяли дважды.
[00039] Биомассу ресуспендировали с использованием 500 мл этилового спирта квалификации PA на литр клеточной суспензии, которая обеспечивала начальный процесс центрифугирования. Для экстракции биореагента раствор, содержащий биомассу и этиловый спирт, автоклавировали под давлением 1 бар при температуре 121°С в течение 20 мин.
[00040] После экстракции проводили еще одну стадию центрифугирования для отделения биомассы от экстрагирующего раствора. Супернатант удаляли, и биомассу высушивали в сушилке при 50°С в течение 24 ч.
[00041] Высушенную биомассу ресуспендировали в деионизированной воде в соотношении 125 мл воды на каждый литр культурального бульона (клеточной суспензии, которая обеспечивала процесс экстракции). Смесь центрифугировали и нерастворимую в воде фракцию удаляли, в то время как растворимую фракцию хранили при 4°С максимум в течение 5 суток для последующего использования в микрофлотации и определении характеристик.
Пример 2
[00042] Для идентификации функциональных групп, присутствующих в биореагентах, полученных в примере 1, проводили анализ инфракрасной спектроскопией (FT-IR) с использованием спектрометра Nicolet FTIR 2000 и таблетки KBr в качестве эталона. Образцы высушивали при 50°С и гомогенизировали с KBr.
[00043] Для сравнения характеристик биореагентов с характеристиками самих микроорганизмов (биомассы), анализы проводили в тех же условиях, описанных выше, для бактерий R. opacus и R. erythropolis, как показано на фиг.2 и фиг.3.
[00044] Инфракрасные спектры бактерий (биомассы) показывают, что область ниже 1500 см-1 имеет большое количество пиков поглощения за счет различных связей C-C, C-O и C-N, которые могут иметь место; данная область уникальна для каждого соединения. Кроме того, был обнаружен интенсивный пик в области между 1750 см-1 и 1620 см-1, характерный для ароматических соединений, альдегидов, кетонов и сложных эфиров. Миколиновые кислоты, которые образуют часть клеточной оболочки и отвечают за гидрофобность бактерий, могут соответствовать пикам алканов, кетонов и альдегидов. Наличие аминогрупп и ароматических групп, которые могут быть частью ароматических аминокислот, указывает на белковые вещества, которые играют определяющую роль в процессах флотации и флокуляции.
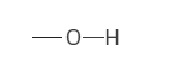
[00045] В отношении биореагента, то возможные функциональные группы, обнаруженные в анализах FT-IR, показаны в таблице 1. Спиртовые, алкановые, алкеновые и кетоновые группы, обнаруженные в областях между 3417-3398 см-1, 2929-2855 см-1 и 1634-1629 см-1, соответственно, могут указывать на присутствие миколовой кислоты. Идентификация ароматических, а также аминогрупп при длинах волн 1400 см-1, 1548 см-1 и 3350 см-1 может указывать на присутствие полярных аминокислот, таких как тирозин.
[00046] Согласно литературным данным, белки, присутствующие в бактериях и их биологических продуктах, могут быть ответственными за процессы флокуляции и флотации за счет их амфифильных свойств.
Пример 3
[00047] Для установления еще одной важной характеристики биореагентов, полученных в примере 1, оценивали влияние биореагентов на поверхностное натяжение дистиллированной воды при нейтральном рН, варьируя концентрацию биореагента от 0 до 250 ppm. Измерения поверхностного натяжения проводили кольцевым методом на цифровом тензиометре Kruss K10. Для оценки критической мицеллярной концентрации (CMC) строили две касательные в точках минимального и максимального поверхностного натяжения, точки пересечения этих линий указывают CMC. Для биореагента из бактерии R. opacus (RoBR) CMC составляла 92 ppm, а для биореагента, экстрагированного из бактерии R. erythropolis (ReBR) - 62 ppm.
[00048] На фиг.4 показано поверхностное натяжение в зависимости от концентрации биореагента. Поверхностное натяжение снижалось до 50,5 мН/м при использовании RoBR и до 62 мН/м при использовании ReBR. Биореагенты могут состоять из полимерных веществ, которые не обязательно снижают поверхностное натяжение, но могут быть эффективными в снижении межфазного натяжения между несмешивающимися жидкостями и образовании стабильных эмульсий.
Пример 4
[00049] Для установления плавучести гематита проводили микрофлотационные испытания по настоящему изобретению с использованием модифицированной трубки Халлимонда с 10-3 моль/л NaCl в качестве индифферентного электролита, воздушным потоком 35 дм3/мин, размером частиц фракции +75-150 мкм, временем кондиционирования 2 мин и временем флотации 1 мин. Концентрация биореагентов варьировала от 25 до 150 ppm, и рН - от 3 до 11. Плавучесть рассчитывали как отношение флотированной массы к общей массе минерала.
[00050] На фиг. 6 и 7 показана плавучесть гематита с использованием RoBR и ReBR, соответственно. Оба биореагента вели себя одинаково: максимальная плавучесть (примерно 90%) гематита достигается при рН 3 при концентрации биореагента 75 промилле. Однако было установлено, что в присутствии RoBR гематит может флотировать при кислом и нейтральном pH, в то время как в присутствии ReBR флотация гематита имела место только при кислом pH. С учетом литературных данных предполагается, что большинство нетоксичных биореагентов являются анионными веществами. Кроме того, изоэлектрическая точка гематита составляет примерно 5,1. Таким образом, можно соотнести рН среды с адсорбцией биореагента на поверхности минерала. В кислой среде между поверхностью минерала и анионным биореагентом будет электростатическое притяжение, что приведет к максимальной адсорбции и, следовательно, к максимальному извлечению гематита. С другой стороны, в щелочной среде адсорбция биореагента на поверхности минерала будет минимальной за счет электростатического отталкивания.
Пример 5
[00051] Для установления областей плавучести кальцита, доломита, апатита, кварца и гематита проводили испытания в тех же условиях, которые описаны в примере 4. Испытания проводили с чистыми минералами.
[00052] На фиг. 8 и 9 приведен ряд столбчатых графиков, на которых сравнивается плавучесть различных минералов, указанных выше, с использованием обоих биореагентов (ReBR и RoBR). Можно наблюдать несколько областей (окон) селективности для исследованных минералов, например:
а) В отношении руды, состоящей из минералов гематита и кварца, установлено, что при рН 3, 5 и 7 можно проводить прямую флотацию гематита с использованием от 50 до 150 ppm RoBR. Для ReBR такое заключение верно только для pH 3 и 5. При pH 3 концентрация биореагента может быть даже ниже 25 ppm.
b) В отношении минерала, состоящего из минералов апатита и кальцита, установлено, что при значениях pH 5, 7 и 9 можно проводить прямую флотацию апатита с использованием 25 ppm RoBR; и при pH 11 с использованием 50 ppm RoBR. При использовании ReBR разделение между апатитом и кальцитом можно выполнить при pH 7 путем прямой флотации кальцита с использованием концентрации от 100 до 150 ppm.
c) В отношении минерала, состоящего из минералов апатита и доломита, установлено, что при значениях pH 3 можно осуществлять прямую флотацию доломита, когда ReBR присутствует в концентрации 25 ppm.
Пример 6
[00053] Гематит-кварцевую систему исследовали с использованием той же процедуры и условий флотации, описанных в примере 5. Значение рН поддерживали на уровне 3, и испытывали три различных соотношения гематит-кварц (25H-75Q; 50H-50Q; 75H-25Q) и две концентрации ReBR (50 мг/л и 100 мг/л). Результаты представлены в таблице 2.
[00054] Результаты показали, что металлургическое извлечение было одинаковым для обеих тестированных концентраций биореагентов при сравнении одних и тех же минеральных систем. Для соотношения 25% гематита-75% кварца разница в металлургическом извлечении составляла 1% (55,5 и 56,5% извлечение для биореагента в концентрации 50 и 100 мг/л, соответственно). Для соотношения 50% гематита-50% кварца извлечение Fe составляло 83,6 и 85,5% при использовании биореагента в концентрации 50 и 100 мг/л соответственно. Для соотношения 75% гематита-25% кварца металлургическое извлечение составило 89,7 и 91,3% для концентрации биореагента 50 и 100 мг/л соответственно.
[00055] Такое же поведение можно наблюдать при сравнении массового извлечения и содержания железа в (флотационном) концентрате. Использование двойной концентрации биореагента (100 мг/л) показало небольшое влияние на результаты вышеуказанного процесса флотации. Этот эффект можно объяснить эффективностью RoBR во время процесса биофлотации.
Реферат
Предложенное изобретение в основном предназначено для горнодобывающей промышленности. Способ обогащения минералов включает стадии: А - дробления руды и приготовления пульпы; B - добавления реагентов и кондиционирования; C - пленочной флотации. В способе используют биореагент, выделенный из бактерии Rhodococcus (opacus, erytrhopolis), которая подвергнута культивированию бактерии. Минералы включают гематит, кальцит, доломит и апатит, обеспечивающий выделение интересующего металла/элемента из руды, содержащей любой из вышеуказанных минералов. Экстракцию биореагента из клеточной стенки бактерии Rhodococcus (opacus, erytrhopolis) проводят процессом экстракции растворителем, предпочтительно экстракцией горячим этиловым спиртом (100-140°C). Технический результат – получение массового извлечения и содержания железа во флотационном концентрате. 9 з.п. ф-лы, 6 пр., 2 табл., 9 ил.
Формула
Документы, цитированные в отчёте о поиске
Способ пенной флотации руд металлов
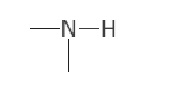

Комментарии