Кристаллическая форма (s)-n-(5-((r)-2-(2,5-дифторфенил)-пиролидин-1-ил)-пиразоло[1,5-a]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамида гидросульфата - RU2017120846A
Код документа: RU2017120846A
Формула
1. Кристаллическая форма (I-HS), имеющая формулу:
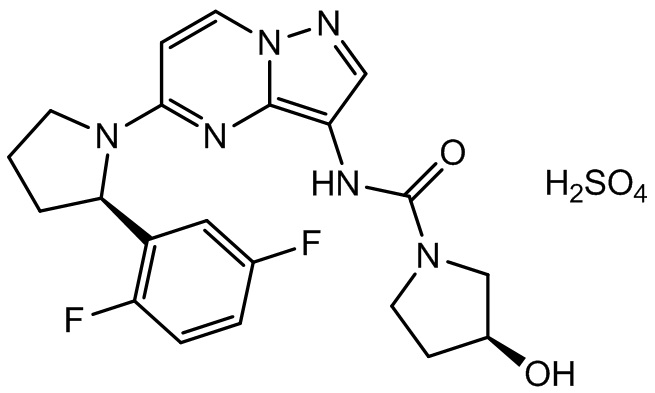
I-HS.
2. Кристаллическая форма по п. 1, которая имеет дифракционные пики XRPD (градусы 2θ) при 18,4 ± 0,2, 20,7 ± 0,2, 23,1 ± 0,2 и 24,0 ± 0,2.
3. Кристаллическая форма по п. 1, которая имеет дифракционные пики XRPD (градусы 2θ) при 10,7 ± 0,2, 18,4 ± 0,2, 20,7 ± 0,2, 23,1 ± 0,2 и 24,0 ± 0,2.
4. Кристаллическая форма по п. 1, которая имеет дифракционные пики XRPD (градусы 2θ) при 10,7 ± 0,2, 18,4 ± 0,2, 19,2 ± 0,2, 20,2 ± 0,2, 20,7 ± 0,2, 21,5 ± 0,2, 23,1 ± 0,2 и 24,0 ± 0,2.
5. Кристаллическая форма по п. 1, которая имеет дифракционные пики XRPD (градусы 2θ) при 10,7 ± 0,2, 15,3 ± 0,2, 16,5 ± 0,2, 18,4 ± 0,2, 19,2 ± 0,2, 19,9 ± 0,2, 20,2 ± 0,2, 20,7 ± 0,2, 21,5 ± 0,2, 22,1 ± 0,2, 23,1 ± 0,2, 24,0 ± 0,2,24,4±0,2, 25,6±0,2, 26,5±0,2, 27,6±0,2, 28,2±0,2, 28,7±0,2, 30,8±0,2 и 38,5±0,2.
6. Кристаллическая форма по п. 1, которая кристаллическая форма имеет структуру XRPD по существу, как показано на фиг. 29.
7. Кристаллическая форма по п. 1, которая проявляет начало до максимум от около 193 до около 205ºС по данным дифференциальной сканирующей калориметрии.
8. Кристаллическая форма по п. 1, которая имеет теплоту плавления около 2,415 мВт, что измеряется дифференциальной сканирующей калориметрией.
9. Кристаллическая форма по п. 1, которая имеет DSC-термограмму, как показано на фиг. 26.
10. Кристаллическая форма по п. 1, которая является негигроскопичной.
11. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и кристаллическую форму по любому из пп. 1-10.
12. Фармацевтическая композиция, полученная смешиванием кристаллической формы по любому из пп. 1-10 и фармацевтически приемлемый носитель.
13. Способ получения фармацевтической композиции, включающий смешивание кристаллической формы по любому из пп. 1-10 и фармацевтически приемлемого носителя.
14. Способ лечения расстройства, выбранного из группы, включающей злокачественную опухоль, боль, воспаление, нейродегенеративное заболевание или инфекцию Trypanosoma cruzi, включающий введение объекту, нуждающемуся в этом, терапевтически эффективного количества кристаллической формы по любому из пп. 1-10.
15. Способ лечения злокачественной опухоли, опосредованного Trk-киназой у нуждающегося в этом объекта, причем указанный способ включает введение объекту терапевтически эффективного количества кристаллической формы по любому из пп. 1-10.
16. Способ по п. 15, где злокачественная опухоль опосредуется TrkA.
17. Способ по п. 15, где злокачественная опухоль опосредуется TrkB.
18. Способ по п. 15, где злокачественная опухоль опосредуется TrkA и TrkB.
19. Способ лечения пациента, диагностированного или идентифицированного как имеющего Trk-ассоциированную злокачественную опухоль, включающую введение объекту терапевтически эффективного количества кристаллической формы по любому из пп. 1-10.
20. Способ лечения злокачественной опухоли у объекта, нуждающегося в этом, включающий:
(А) определения, связана ли злокачественная опухоль с одной или несколькими из числа сверхэкспрессии, активации, амплификации и мутации Trk-киназы; и
(b) если определено, что злокачественная опухоль ассоциирована с одной или несколькими из числа сверхэкспрессии, активации, амплификации и мутации Trk-киназы, введение объекту терапевтически эффективного количества кристаллической формы по любому из пп. 1-10.
21. Способ лечения злокачественной опухоли у объекта, нуждающегося в этом, включающий:
(а) определение, опосредуется ли злокачественная опухоль Trk-киназой; и
(b) если определено, что рак опосредуется Trk-киназой, введение объекту терапевтически эффективного количества кристаллической формы по любому из пп. 1-10.
22. Способ лечения объекта, включающий:
(а) проведение анализа на образце, полученном у объекта для того, чтобы определить, имеет ли объект нарушение регуляции гена NTRK, белка Trk или его экспрессии или уровня; и
(b) введение объекту, определенно имеющему нарушение регуляции гена NTRK, белка Trk или экспрессии или активности, или уровня того же терапевтически эффективного количества кристаллической формы по любому из пп. 1-10.
23. Способ по п. 19 или 22, в котором нарушение регуляции гена NTRK, белка Trk или их экспрессии или уровня является трансляцией хромосомы, которая приводит к трансляции химерного белка Trk.
24. Способ по п. 23, в котором химерный белок Trk выбирают из группы, включающей TP53-TrkA, LMNA-TrkA, CD74-TrkA, TFG-TrkA, TPM3-TrkA, NFASC-TrkA, BCAN-TrkA, MPRIP-TrkA, TPR-TrkA, RFWD2-TrkA, IRF2BP2-TrkA, SQSTM1-TrkA, SSBP2-TrkA, RABGAP1L-TrkA, C18ORF8-TrkA, RNF213-TrkA, TBC1D22A-TrkA, C20ORF112-TrkA, DNER-TrkA, ARHGEF2-TrkA, CHTOP -TrkA, PPL-TrkA, PLEKHA6-TrkA, PEAR1-TrkA, MRRL24-TrkA, MDM4-TrkA, LRRC71-TrkA, GRIPAP1-TrkA, EPS15-TrkA, DYNC2H1-TrkA, CEL-TrkA, EPHB2-TrkA, TGF-TrkA, NACC2-TrkB, QKI-TrkB, AFAP1-TrkB, PAN3-TrkB, SQSTM1-TrkB, TRIM24-TrkB, VCL-TrkB, AGBL4-TrkB, DAB2IP-TrkB, ETV6-TrkC, BTBD1-TrkC, LYN-TrkC, RBPMS -TrkC, EML4-TrkC, HOMER2-TrkC, TFG-TrkC, FAT1-TrkC и TEL-TrkC.
25. Способ по п. 19 или 23, в котором нарушение регуляции гена NTRK, белка Trk или их экспрессии или активности представляет собой одну или несколько точечных мутаций в гене.
26. Способ по п. 25, в котором ген NTRK представляет собой ген NTRK1, и одна или несколько точечных мутаций в гене NTRK1 приводят к трансляции белка TrkA, имеющего замены, которые представляют собой одно или несколько из следующих положений аминокислот: 33, 336, 337, 324, 420, 444, 517, 538, 649, 682, 683, 702 и 1879.
27. Способ по п. 26, в котором одна или несколько точечных мутаций в гене NTRK1 приводят к трансляции белка TrkA, имеющего одну или несколько из следующих аминокислотных замен: R33W, A336E, A337T, R324Q, R324W, V420M, R444Q, R444W, G517R, G517V, K538A, R649W, R649L, R682S, V683G, R702C и C1879T.
28. Способ получения кристаллической формы (I-HS) по п. 1, включающий:
(а) добавление концентрированной серной кислоты к раствору (S)-N-(5-((R)-2-(2,5-дифторфенил)пирролидин-1-ил)-пиразоло[1,5-a]пиримидина-3-ил)-3-гидроксипирролидин-1-карбоксамида в EtOH с образованием гидросульфатной соли (S)-N-(5-((R)-2-(2,5-дифторфенил) пирролидин-1-ил)пиразоло[1,5-а]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамида;
(b) добавление гептана к раствору на стадии (а) для образования суспензии;
(с) фильтрование суспензии с целью выделения гидросульфата (S)-N-(5-((R)-2-(2,5-дифторфенил) пирролидин-1-ил)-пиразоло[1,5-a]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамида;
(d) смешивание указанного (S)-N-(5 -((R)-2-(2,5-дифторфенил) пирролидин-1-ил)-пиразоло[1,5-a]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамида с 5:95 масс./масс. раствором воды/2-бутанона;
(e) нагревание смеси со стадии (d) при 65-70°С при перемешивании до тех пор, пока массовый процент этанола не будет составлять около 0,5%, для образования суспензии кристаллической формы (S)-N-(5 -((R)-2-(2,5-дифторфенил)пирролидин-1-ил)-пиразоло[1,5-a]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамида; и
(f) выделение кристаллической формы (S)-N-(5 -((R)-2-(2,5-дифторфенил) пирролидин-1-ил)-пиразоло[1,5-a]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамида путем фильтрования.
29. Способ по п. 28, дополнительно включающий:
(b1) затравку раствора со стадии (а) с (S)-N-(5 -((R)-2-(2,5-дифторфенил) пирролидин-1-ил)-пиразоло[1,5-a]пиримидин-3-ил)-3-гидроксипирролидин-1-карбоксамидом при комнатной температуре и перемешивание раствора до образования суспензии.

Комментарии