Пролекарства карбидопа и l-dopa и их применение для лечения болезни паркинсона - RU2017117413A
Код документа: RU2017117413A
Формула
1. Фармацевтическая комбинация, содержащая первое соединение, соответствующее по структуре формуле (I):
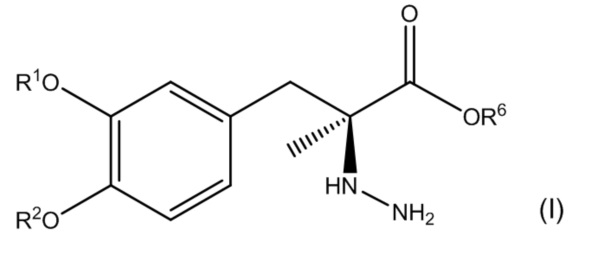
или его фармацевтически приемлемую соль, где каждый из R1 и R2 независимо выбран из группы, состоящей из водорода, -P(O)(OH)2 и -R5-O-P(O)(OH)2; R5 представляет собой C1-C4-алкил; R6 представляет собой водород или C1-C4-алкил; и при этом по меньшей мере один из R1 и R2 представляет собой -P(O)(OH)2 или -R5-O-P(O)(OH)2; и
второе соединение, соответствующее по структуре формуле (II):

или его фармацевтически приемлемую соль, где каждый из R3 и R4 независимо выбран из группы, состоящей из водорода, -P(O)(OH)2 и -R5-O-P(O)(OH)2; R5 представляет собой C1-C4-алкил; R6 представляет собой водород или C1-C4-алкил; и при этом по меньшей мере один из R3 и R4 представляет собой -P(O)(OH)2 или -R5-O-P(O)(OH)2.
2. Фармацевтическая комбинация по п. 1, где первое соединение представляет собой:

3. Фармацевтическая комбинация по п. 1 или 2, где второе соединение представляет собой:
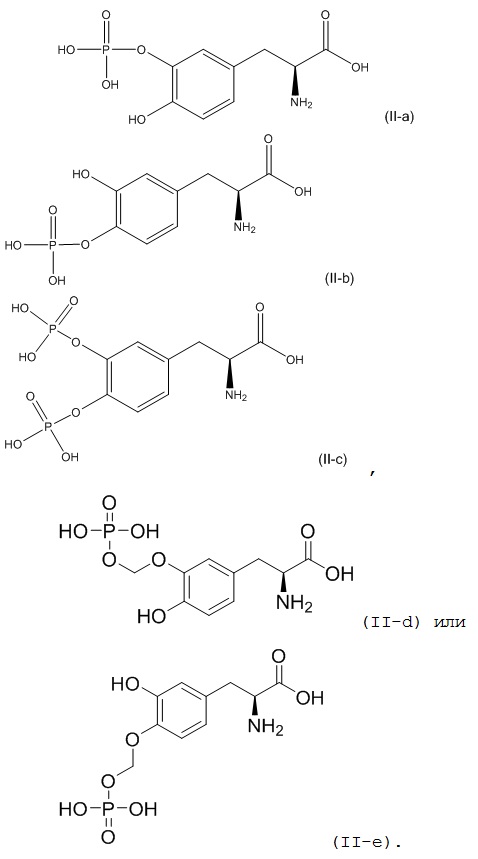
4. Фармацевтическая комбинация по любому из пп. 1-3, где первое соединение или его фармацевтически приемлемая соль и второе соединение или его фармацевтически приемлемая соль присутствуют в отдельных фармацевтических композициях, или оба присутствуют в одной и той же фармацевтической композиции.
5. Фармацевтическая комбинация по любому из пп. 1-4, где массовое отношение первого соединения или его фармацевтически приемлемой соли к второму соединению или его фармацевтически приемлемой соли составляет от приблизительно 1:1 до приблизительно 1:50, предпочтительно, от приблизительно 1:2 до приблизительно 1:15, предпочтительно, от приблизительно 1:4 до приблизительно 1:10 и, более предпочтительно, приблизительно 1:4.
6. Фармацевтическая комбинация по любому из пп. 1-5, где первое соединение или его фармацевтически приемлемая соль обладает растворимостью по меньшей мере приблизительно 200 мг/мл в водном растворе при приблизительно нейтральном pH, и второе соединение или его фармацевтически приемлемая соль обладает растворимостью по меньшей мере приблизительно 400 мг/мл в водном растворе при приблизительно нейтральном pH.
7. Фармацевтическая комбинация по любому из пп. 1-6, где комбинация представляет собой водную комбинацию, подходящую для внутрижелудочного, подкожного, внутримышечного введения, введения в тощую кишку, перорального, интраназального или внутривенного введения.
8. Фармацевтическая комбинация по любому из пп. 1-7, где комбинация представляет собой водную комбинацию, подходящую для подкожного введения.
9. Фармацевтическая комбинация по любому из пп. 1-8, где первое соединение представляет собой соединение, соответствующее по структуре формуле (I-a):
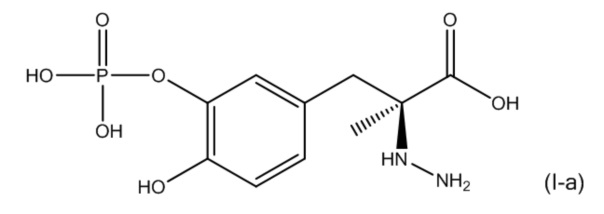
или его фармацевтически приемлемую соль; и второе соединение представляет собой соединение, соответствующее по структуре формуле (II-a):

или его фармацевтически приемлемую соль.
10. Фармацевтическая комбинация по любому из пп. 1-9, где первое соединение представляет собой соединение, соответствующее по структуре формуле (I-b):
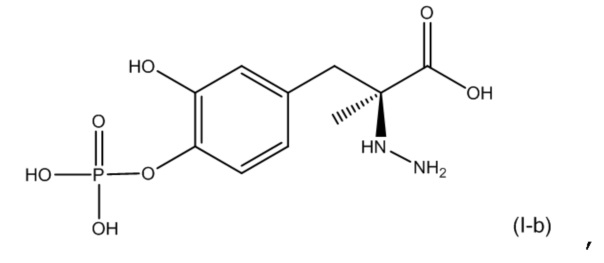
или его фармацевтически приемлемую соль; и второе соединение представляет собой соединение, соответствующее по структуре формуле (II-a):

или его фармацевтически приемлемую соль.
11. Фармацевтическая комбинация по любому из пп. 1-10, где первое соединение представляет собой соединение, соответствующее по структуре формуле (I-c)
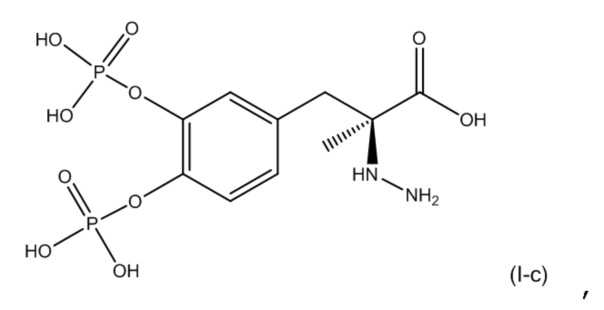
или его фармацевтически приемлемую соль; и второе соединение представляет собой соединение, соответствующее по структуре формуле (II-a):
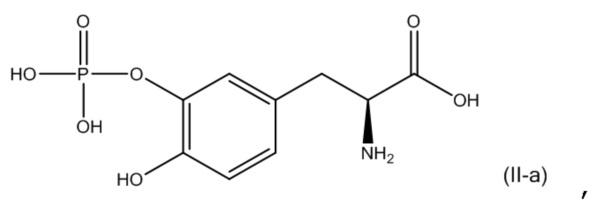
или его фармацевтически приемлемую соль.
12. Фармацевтическая комбинация по любому из пп. 1-11, где первое соединение представляет собой соединение, соответствующее по структуре формуле (I-a):

или его фармацевтически приемлемую соль; и второе соединение представляет собой соединение, соответствующее по структуре формуле (II-b):

или его фармацевтически приемлемую соль.
13. Фармацевтическая комбинация по любому из предшествующих вариантов осуществления, где первое соединение представляет собой соединение, соответствующее по структуре формуле (I-b):
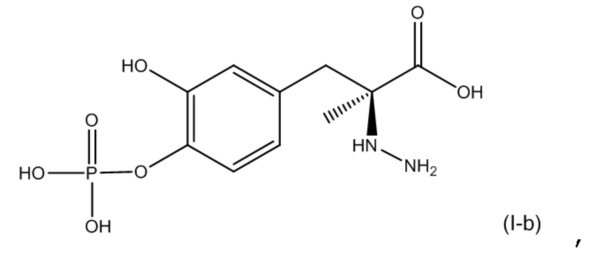
или его фармацевтически приемлемую соль; и второе соединение представляет собой соединение, соответствующее по структуре формуле (II-b):

или a его фармацевтически приемлемую соль.
14. Фармацевтическая комбинация по любому из пп. 1-13, где первое соединение представляет собой соединение, соответствующее по структуре формуле (I-c):
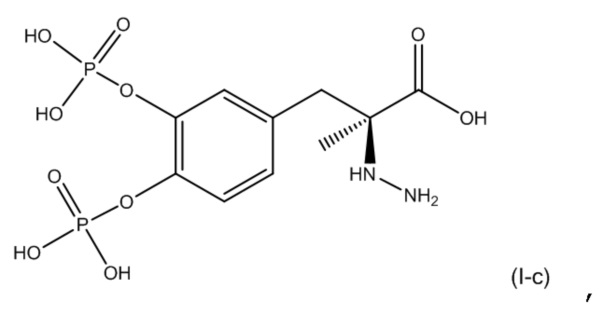
или его фармацевтически приемлемую соль; и второе соединение представляет собой соединение, соответствующее по структуре формуле (II-b):
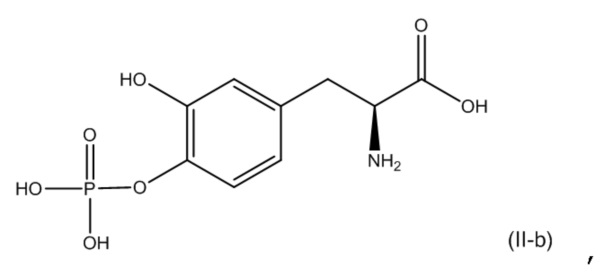
или его фармацевтически приемлемую соль.
15. Фармацевтическая комбинация по любому из пп. 1-14, где первое соединение представляет собой соединение, соответствующее по структуре формуле (I-a):

или его фармацевтически приемлемую соль; и второе соединение представляет собой соединение, соответствующее по структуре формуле (II-c):
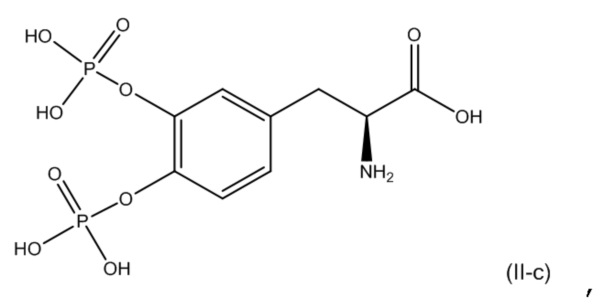
или его фармацевтически приемлемую соль.
16. Фармацевтическая комбинация по любому из пп. 1-15, где первое соединение представляет собой соединение, соответствующее по структуре формуле (I-b):

или его фармацевтически приемлемую соль; и второе соединение представляет собой a соединение, соответствующее по структуре формуле (II-c):
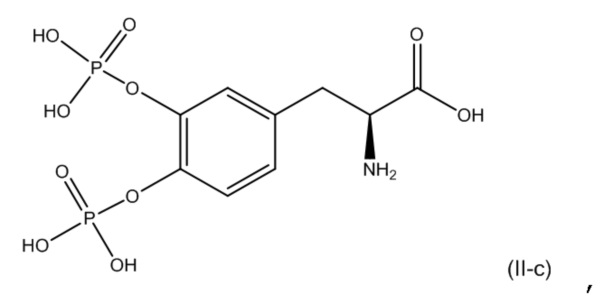
или его фармацевтически приемлемую соль.
17. Фармацевтическая комбинация по любому из пп. 1-16, где первое соединение представляет собой соединение, соответствующее по структуре формуле (I-c):
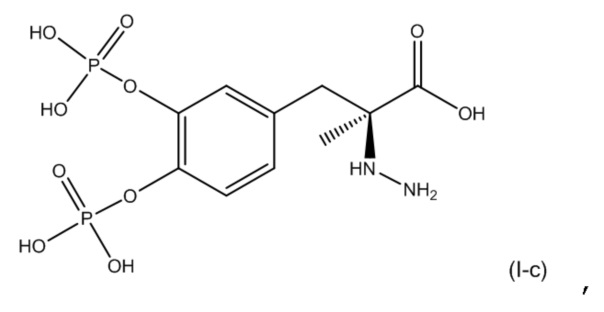
или его фармацевтически приемлемую соль; и второе соединение представляет собой соединение, соответствующее по структуре формуле (II-c):

или его фармацевтически приемлемую соль.
18. Способ лечения болезни Паркинсона у нуждающегося в этом субъекта и/или способ обеспечения терапии спасения для субъекта, страдающего болезнью Паркинсона, где способ включает в себя введение субъекту терапевтически эффективного количества фармацевтической комбинации по любому из пп. 1-17.
19. Способ по п. 18, где первое соединение и второе соединение вводят субъекту в отдельных фармацевтических композициях, или первое соединение и второе соединение вводят субъекту в одной и той же фармацевтической композиции, содержащей первое соединение и второе соединение.
20. Способ по п. 18 или 19, где способ включает в себя внутрижелудочное, подкожное введение, введение в тощую кишку, пероральное, интраназальное, внутримышечное или внутривенное введение первого соединения и второго соединения.
21. Способ по любому из пп. 18-20, где способ включает в себя подкожное введение первого соединения и второго соединения.
22. Способ по любому из пп. 18-21, где способ включает в себя по существу непрерывное введение первого соединения и второго соединения в течение периода по меньшей мере приблизительно 12 часов.
23. Способ по любому из пп. 18-22, где массовое отношение вводимого первого соединения и вводимого второго соединения составляет от приблизительно 1:1 до приблизительно 1:50.
24. Способ по любому из пп. 18-23, где массовое отношение вводимого первого соединения и вводимого второго соединения составляет от приблизительно 1:2 до приблизительно 1:15.
25. Способ по любому из пп. 18-24, где массовое отношение вводимого первого соединения и вводимого второго соединения составляет от приблизительно 1:4 до приблизительно 1:10.
26. Способ по любому из пп. 18-25, где массовое отношение вводимого первого соединения и вводимого второго соединения составляет приблизительно 1:4.
27. Способ по любому из пп. 18-26, где массовое отношение вводимого первого соединения и вводимого второго соединения составляет приблизительно 1:7,5.
28. Способ по любому из пп. 18-27, где массовое отношение вводимого первого соединения и вводимого второго соединения составляет приблизительно 1:10.
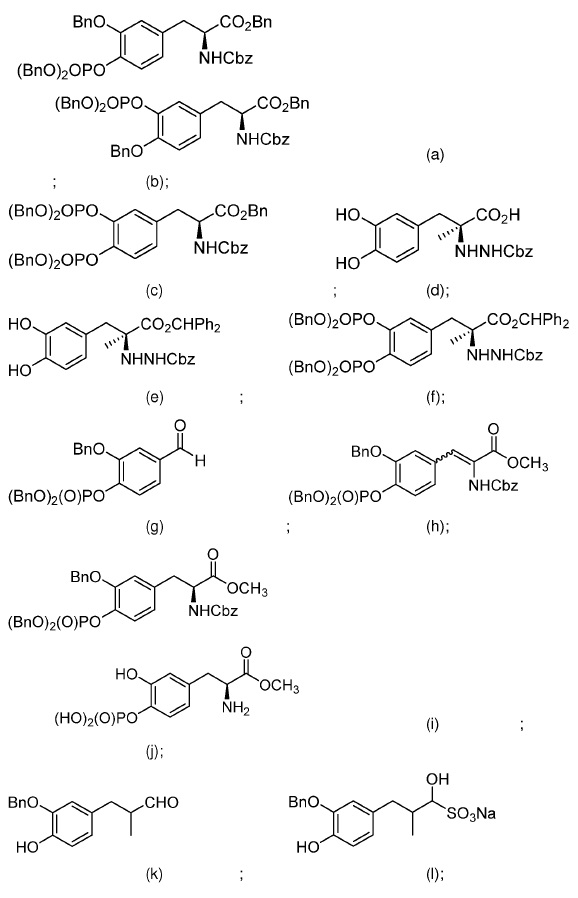
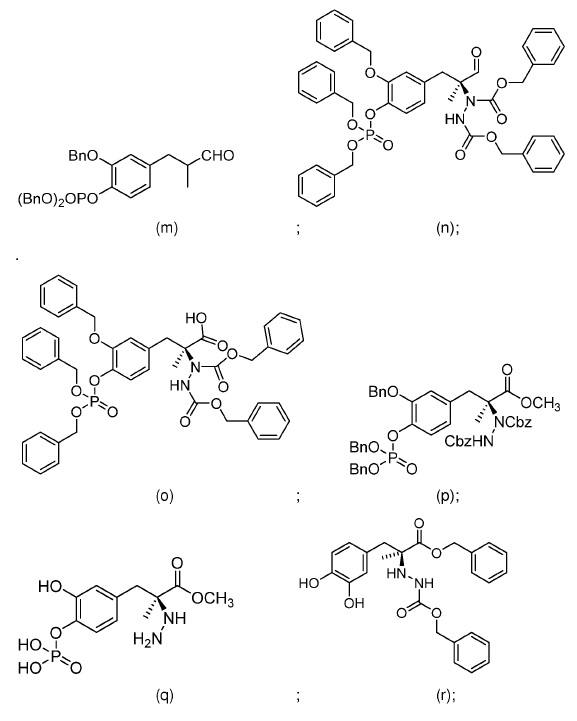
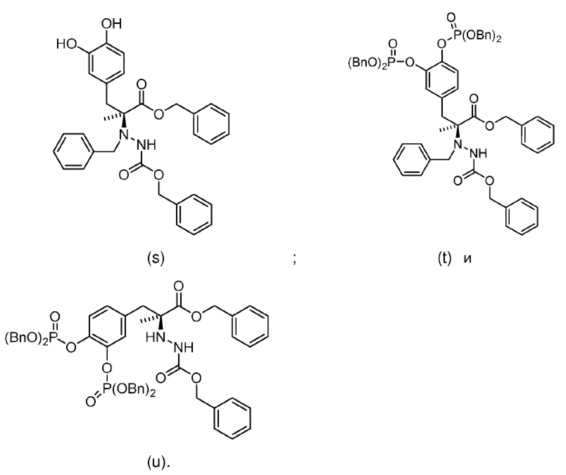
29. Способ по любому из пп. 18-28, где первое соединение выбрано из группы, состоящей из:

и второе соединение выбрано из группы, состоящей из:

30. Способ по любому из пп. 18-29, дополнительно включающий в себя введение субъекту другого средства против болезни Паркинсона.
31. Способ по любому из пп. 18-30, где фармацевтическая комбинация представляет собой водную комбинацию.
32. Способ по п. 31, где водную фармацевтическую комбинацию вводят посредством внутрижелудочного, подкожного, внутримышечного, интраназального введения, введения в тощую кишку, перорального или внутривенного введения.
33. Способ по п. 31 или 32, где водную фармацевтическую комбинацию вводят посредством подкожного введения.
34. Соединение, соответствующее по структуре формуле (I):

или его фармацевтически приемлемая соль, где каждый из R1 и R2 независимо выбран из группы, состоящей из водорода, -P(O)(OH)2 и -R5-O-P(O)(OH)2; R5 представляет собой C1-C4-алкил; R6 представляет собой водород или C1-C4-алкил; и при этом по меньшей мере один из R1 и R2 представляет собой -P(O)(OH)2 или -R5-O-P(O)(OH)2.
35. Соединение или фармацевтически приемлемая соль по п. 34, где каждый из R1 и R2 независимо выбран из группы, состоящей из водорода, -P(O)(OH)2, и -R5-O-P(O)(OH)2; R5 представляет собой C1-C2-алкил; R6 представляет собой водород; и при этом по меньшей мере один из R1 и R2 представляет собой -P(O)(OH)2 или -R5-O-P(O)(OH)2.
36. Соединение или фармацевтически приемлемая соль по п. 34 или 35, где каждый из R1 и R2 независимо представляет собой водород или -P(O)(OH)2; R6 представляет собой водород; и один из R1 и R2 представляет собой -P(O)(OH)2.
37. Соединение или фармацевтически приемлемая соль по п. 34 или 35, где каждый из R1 и R2 независимо представляет собой водород или -R5-O-P(O)(OH)2; R5 представляет собой C1-C2-алкил; R6 представляет собой водород; и при этом один из R1 и R2 представляет собой -R5-O-P(O)(OH)2.
38. Соединение или фармацевтически приемлемая соль по п. 34, где каждый из R1 и R2 независимо представляет собой водород, -P(O)(OH)2или -R5-O-P(O)(OH)2; R5 представляет собой C1-C2-алкил; R6 представляет собой C1-C2-алкил; и при этом один из R1 и R2 представляет собой -P(O)(OH)2 или -R5-O-P(O)(OH)2.
39. Соединение или соль по любому из пп. 34-36, где соединение соответствует по структуре формуле (I-a):

40. Соединение или соль по любому из пп. 34-36, где соединение соответствует по структуре формуле (I-b):

41. Соединение или соль по любому из пп. 34-36, где соединение соответствует по структуре формуле (I-c):

42. Соединение или соль по любому из пп. 34, 35 или 37, где соединение соответствует по структуре формуле (I-d):
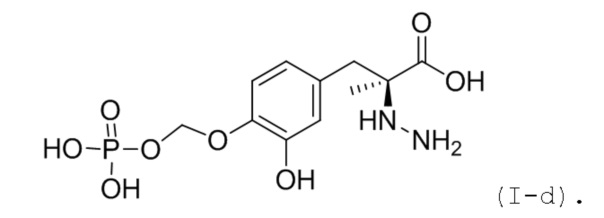
43. Соединение или соль по любому из пп. 34, 35 или 37, где соединение соответствует по структуре формуле (I-e):

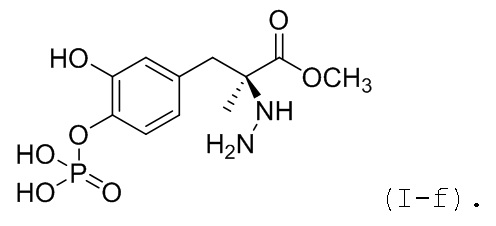
44. Соединение или соль по любому из пп. 34 или 38, где соединение соответствует по структуре формуле (I-f):
45. Соединение, соответствующее по структуре формуле (II):

или его фармацевтически приемлемая соль, где каждый из R3 и R4 независимо выбран из группы, состоящей из водорода, -P(O)(OH)2 и -R5-O-P(O)(OH)2; R5 представляет собой C1-C4-алкил; R6 представляет собой водород или C1-C4-алкил; и при этом по меньшей мере один из R3 и R4 представляет собой -P(O)(OH)2 или -R5-O-P(O)(OH)2.
46. Соединение или соль по п. 45, где каждый из R3 и R4 независимо представляет собой водород или -R5-O-P(O)(OH)2; R5 представляет собой C1-C2-алкил; R6 представляет собой водород; и при этом один из R3 и R4 представляет собой-R5-O-P(O)(OH)2.
47. Соединение или соль по п. 45 или 46, где соединение соответствует по структуре формуле (II-d):
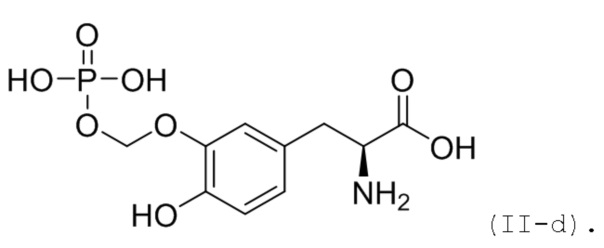
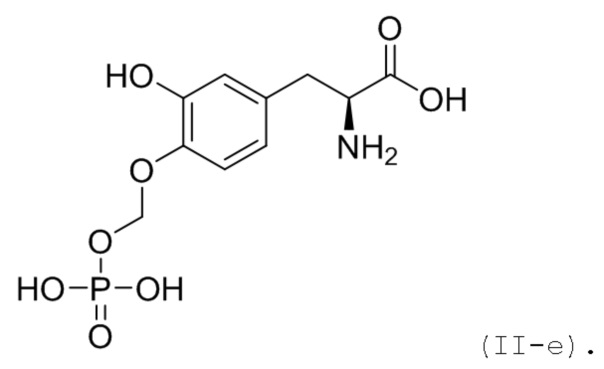
48. Соединение или соль по п. 45 или 46, где соединение соответствует по структуре формуле (II-e):
49. Фармацевтическая композиция, содержащая первое соединение, соответствующее по структуре формуле (I):

или его фармацевтически приемлемую соль, где каждый из R1 и R2 независимо выбран из группы, состоящей из водорода, -P(O)(OH)2, и -R5-O-P(O)(OH)2; R5 представляет собой C1-C4-алкил; R6 представляет собой водород или C1-C4-алкил; и при этом по меньшей мере один из R1 и R2 представляет собой -P(O)(OH)2 или -R5-O-P(O)(OH)2; и фармацевтически приемлемый носитель.
50. Фармацевтическая композиция по п. 49, где первое соединение соответствует по структуре формуле (I-a):

51. Фармацевтическая композиция по п. 49, где первое соединение соответствует по структуре формуле (I-b):
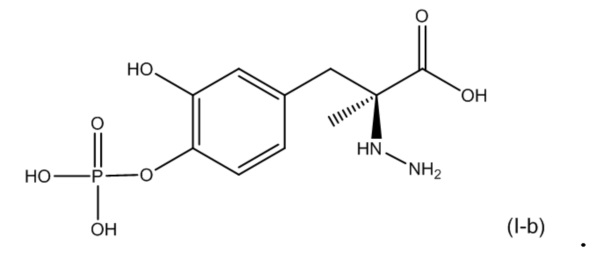
52. Фармацевтическая композиция по п. 49, где первое соединение соответствует по структуре формуле (I-c):
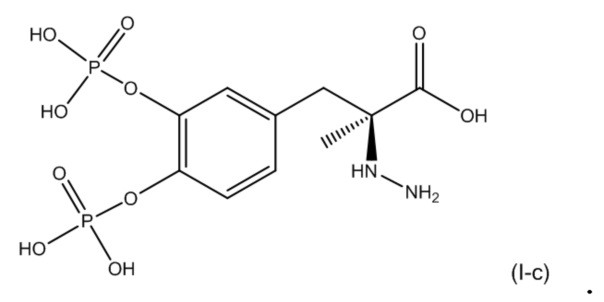
53. Фармацевтическая композиция по любому из пп. 49-52, где композиция дополнительно содержит второе соединение, соответствующее по структуре формуле (II):

или его фармацевтически приемлемую соль, где каждый из R3 и R4 независимо выбран из группы, состоящей из водорода, -P(O)(OH)2 и -R5-O-P(O)(OH)2; R5 представляет собой C1-C4-алкил; R6 представляет собой водород или C1-C4-алкил; и при этом по меньшей мере один из R3 и R4 представляет собой -P(O)(OH)2 или -R5-O-P(O)(OH)2.
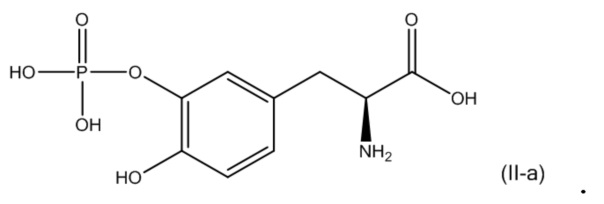
54. Фармацевтическая композиция из п. 53, где второе соединение соответствует по структуре формуле (II-a):
55. Фармацевтическая композиция по п. 53, где второе соединение соответствует по структуре формуле (II-b):

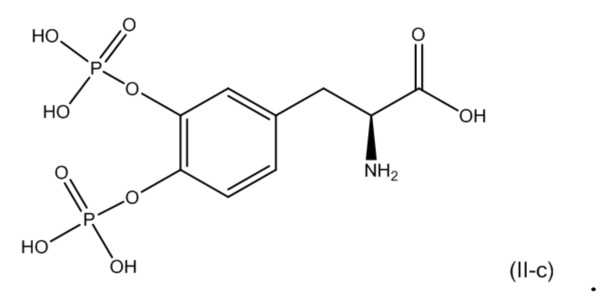
56. Фармацевтическая композиция по п. 53, где второе соединение соответствует по структуре формуле (II-c):
57. Фармацевтическая композиция по любому из пп. 37-44, где массовое отношение первого соединения и второго соединения составляет от приблизительно 1:1 до приблизительно 1:50, предпочтительно, от приблизительно 1:2 до приблизительно 1:15, даже более предпочтительно, от приблизительно 1:4 до приблизительно 1:10.
58. Фармацевтическая композиция по любому из пп. 49-57, где массовое отношение первого соединения и второго соединения составляет приблизительно 1:4.
59. Фармацевтическая композиция по любому из пп. 49-57, где массовое отношение первого соединения и второго соединения составляет приблизительно 1:7,5.
60. Фармацевтическая композиция по любому из пп. 49-57, где массовое отношение первого соединения и второго соединения составляет приблизительно 1:10.
61. Фармацевтическая композиция по любому из пп. 49-60, где композиция дополнительно содержит воду и является подходящей для инфузии.
62. Набор, содержащий фармацевтическую комбинацию по любому из пп. 1-17.
63. Набор, содержащий фармацевтическую композицию по любому из пп. 49-61.
64. Соединение, выбранное из группы, состоящей из:
65. Кристаллический полиморф 4ʹ-монофосфата L-dopa, идентифицированный посредством порошковой рентгенодифракции где кристаллический полиморф представляет собой:
кристаллический ангидрат 4ʹ-монофосфата L-dopa (i), для которого показан по меньшей мере один характерный пик в паттерне порошковой рентгенодифракции при значениях два тета 10,261±0,20, 12,053±0,20, 13,759±0,20, 14,932±0,20, 16,147±0,20, 16,718±0,20, 17,34±0,20, 19,254±0,20, 20,654±0,20, 22,078±0,20, 23,599±0,20, 24,198±0,20, 25,898±0,20, 26,338±0,20 и 27,117±0,20; или
кристаллический ангидрат 4ʹ-монофосфата L-dopa (ii), для которого показан по меньшей мере один характерный пик в паттерне порошковой рентгенодифракции при значениях два тета 8,468±0,20, 10,234±0,20, 11,821±0,20, 13,084±0,20, 13,503±0,20, 15,48±0,20, 15,848±0,20, 16,513±0,20, 18,447±0,20, 19,346±0,20, 20,239±0,20, 21,139±0,20, 24,221±0,20, 24,865±0,20, 25,647±0,20.
66. Кристаллический 3ʹ-монофосфат L-dopa, для которого показан по меньшей мере один характерный пик в паттерне порошковой рентгенодифракции при значениях два тета 8,662±0,20, 11,286±0,20, 15,079±0,20, 15,678±0,20, 16,786±0,20, 17,288±0,20, 18,438±0,20, 19,682±0,20, 20,946±0,20, 22,188±0,20, 22,671±0,20, 23,088±0,20, 24,144±0,20, 24,744±0,20 и 25,383±0,20.
67. Кристаллический тригидрат 3ʹ4-дифосфата L-dopa, для которого показан по меньшей мере один характерный пик в паттерне порошковой рентгенодифракции при значениях два тета 7,118±0,20, 10,342±0,20, 11,355±0,20, 12,161±0,20, 14,201±0,20, 17,36±0,20, 17,632±0,20, 19,196±0,20, 19,444±0,20, 20,83±0,20, 21,504±0,20, 22,491±0,20, 23,085±0,20, 24,487±0,20 и 25,11±0,20.
68. Кристаллический полиморф 4ʹ-монофосфатаа карбидопа, идентифицированный посредством порошковой рентгенодифракции, где кристаллический полиморф представляет собой:
кристаллический тригидрат 4ʹ-монофосфата карбидопа, для которого показан по меньшей мере один характерный пик в паттерне порошковой рентгенодифракции при значениях два тета 7,484±0,20, 10,05±0,20, 11,971±0,20, 13,085±0,20, 14,923±0,20, 16,095±0,20, 16,85±0,20, 17,359±0,20, 17,635±0,20, 19,269±0,20, 19,544±0,20, 21,842±0,20, 22,578±0,20, 22,921±0,20 и 23,822±0,20;
кристаллический дигидрат 4ʹ-монофосфата карбидопа, для которого показан по меньшей мере один характерный пик в паттерне порошковой рентгенодифракции при значениях два тета 7,925±0,20, 10,28±0,20, 12,344±0,20, 15,002±0,20, 15,841±0,20, 16,158±0,20, 17,565±0,20, 18,506±0,20, 19,058±0,20, 19,473±0,20, 19,702±0,20, 20,188±0,20, 20,668±0,20, 22,37±0,20 и 24,167±0,20; или
кристаллический дегидрат 4ʹ-монофосфата карбидопа, для которого показан по меньшей мере один характерный пик в паттерне порошковой рентгенодифракции при значениях два тета 9,492±0,20, 10,528±0,20, 15,356±0,20, 15,907±0,20, 16,165±0,20, 17,933±0,20, 18,737±0,20, 19,429±0,20, 21,176±0,20 и 22,626±0,20.
69. Кристаллический полиморф 3ʹ-монофосфата карбидопа, идентифицированный посредством порошковой рентгенодифракции, где кристаллический полиморф представляет собой:
кристаллический 3ʹ-монофосфат карбидопа (i), для которого показан по меньшей мере один характерный пик в паттерне порошковой рентгенодифракции при значениях два тета 9,171±0,20, 13,539±0,20, 14,23±0,20, 15,589±0,20, 15,979±0,20, 18,394±0,20, 18,832±0,20, 19,315±0,20, 22,143±0,20 и 22,81±0,20; или
кристаллический 3ʹ-монофосфат карбидопа (ii), для которого показан по меньшей мере один характерный пик в паттерне порошковой рентгенодифракции при значениях два тета 4,433±0,20, 8,917±0,20, 9,654±0,20, 13,192±0,20, 15,288±0,20, 15,747±0,20, 17,886±0,20, 19,291±0,20, 20,554±0,20 и 21,797.
70. Кристаллическая натриевая соль 3ʹ4-дифосфата карбидопа, для которой показан по меньшей мере один характерный пик в паттерне порошковой рентгенодифракции при значениях два тета 5,852±0,20, 6,861±0,20, 7,338±0,20, 11,159±0,20, 11,729±0,20, 12,953±0,20, 13,714±0,20, 14,381±0,20, 14,686±0,20, 15,479±0,20, 16,676±0,20, 17,179±0,20, 17,592±0,20, 18,861±0,20 и 20,305±0,20.

Комментарии