Способ каталитического оксихлорирования этана до винилхлорида - RU2133729C1
Код документа: RU2133729C1
Чертежи

Описание
Настоящее изобретение относится к каталитическому способу получения винилхлоридного мономера (ВХМ) из этана путем оксихлорирования последнего.
В большинстве промышленных способах получения ВХМ в качестве сырья используются этилен и хлор. В общем случае этилен хлорируется при контактировании с хлором и катализатором до 1,2-дихлорэтана. Дихлорэтан затем подвергается дегидрохлорированию при повышенной температуре с образованием ВХМ и хлористого водорода. Использование этилена в качестве исходного материала составляет существенную статью в стоимости получаемого ВХМ. В целом, значительное снижение стоимости может быть достигнуто только за счет экономии, так как известные способы работают почти при максимальной эффективности.
Другим недостатком использования этилена в качестве исходного сырья является то, что дегидрохлорирование промежуточного 1,2-дихлорэтана приводит к выделению хлористого водорода. Утилизация последнего обычно достигается каталитическим оксихлорированием этилена на дополнительной стадии с получением 1,2-дихлорэтана.
С другой стороны, известен способ получения ВХМ, который включает использование в качестве сырья этана. Использование альтернативных углеводородных исходных веществ, из которых этан является преимущественным, непосредственно решает проблему высокой стоимости этилена путем его замены на более дешевое сырье. Кроме того, химия получения ВХМ с использованием альтернативных углеводородов может дать ряд преимуществ. Например, производство ВХМ может быть осуществлено одностадийно.
Известны три химических метода превращения этана в ВХМ. К ним относятся газофазное
хлорирование, каталитическое окисление и
оксихлорирование. Из них наиболее привлекательным является способ, основанный на оксихлорировании:
C2H6 + Cl + O2
---> C2H3Cl +
др. продукты + H2O.
Источником хлора могут служить Cl2, HCl или хлорированные углеводороды. Если в качестве источника хлора используется хлористый водород, то появляется возможность использовать один из промежуточных продуктов производства ВХМ из этилена.
Производство ВХМ из этана не имеет коммерческого успеха. Был сделан ряд попыток осуществить этот способ в промышленности, но использовавшиеся способы имели серьезные недостатки, которые, составляя некоторые неудобства в лаборатории, при осуществлении процесса в промышленном масштабе становились неприемлемыми.
Предложен ряд катализаторов для проведения каталитического оксихлорирования этана.
Наиболее перспективными катализаторами, как оказалось, являются катализаторы кипящего слоя на основе меди. В брит. патенте 1492945 (BP) описываются такие катализаторы, содержащие хлориды меди, калия и цезия, нанесенные вместе с хлоридом церия при упаривании на носитель на основе двуокиси алюминия. Однако из патента не вытекает с очевидностью, что конкретная рецептура, используемая в патенте BP, приводит к положительным результатам, так как используемый в качестве сырья этап разбавляется более чем на 50% азотом, что не выполнимо при промышленном применении, а также не представлены все результаты. На большинство побочных продуктов реакции оксихлорирования не обращалось внимания. Кроме того, использовалось повышенная температура (530oC).
В патенте SU 567714 также раскрывается медно/калиевый катализатор для оксихлорирования этана. Однако описывается одна конкретная использованная рецептура, которая эффективна при температуре свыше 550oC, и до 62.4% прореагировавшего этана не согласуются с указанным там спектром продуктов.
В брит. патенте 2009164 (фирма Монсанто) описывается, наряду с другими, медно/калиевый катализатор. Однако используемая точная рецептура, как оказалось, не эффективна при температуре ниже 500oC. Более того, представленные результаты неинформативны, так как может показаться, что образование этилена или игнорируется или ошибочно принимается за образование ВХМ. Конверсия до ВХМ не приводится.
Из представленного выше описания предшествующего уровня видно, что селективность реакции оксихлорирования до ВХМ не является 100%-ной. Этот факт остается в значительной степени источником неэффективности процесса оксихлорирования.
Заметное количество побочных продуктов реакции оксихлорирования составляют продукты сгорания, которые образуются в результате окисления углеводородов, например, этана, с образованием главным образом CO2. Эти продукты составляют потери сырьевых материалов. Однако они практически не рассматриваются в работах предшествующего уровня. Не предпринималось усилий по уменьшению образования таких побочных продуктов, за исключением попыток, связанных с изменением рецептуры катализатора, который, как это видно из рассмотрения работ предшествующего уровня, имеет свои ограничения.
Еще одна причина неэффективности оксихлорирования этана обусловлена образованием побочных продуктов, которые не являются продуктами сгорания. Такие побочные продукты составляют преимущественно хлорированные углеводороды и, в некоторых случаях, могут быть превращены в ВХМ. Однако такие побочные продукты также исключались из рассмотрения в работах предшествующего уровня.
Например, в брит. патенте 1256245 (Princeton Chemical Research Inc.) "другие хлорированные материалы" образовывались на уровне приблизительно одной десятой от выхода винилхлорида. В Брит. патенте 1256245 нет никаких предложений относительно того, что делать с такими побочными продуктами. Однако можно увидеть, что эти побочные продукты составляют заметную часть от общего выхода реакции.
В патенте США 3879481 (Lummus Co.) подтверждается образование хлорированных побочных продуктов в виде хлорированных углеводородов, таких как трихлорэтан, трихлорэтилен, тетрахлорэт и аналогичных соединений. Предполагается, что такие побочные продукты сгорают, что приводит к потере их ценности в качестве сырья. Даже если получаемый хлористый водород можно выделить, углерод, содержащийся в побочных продуктах, теряется.
Установлено, что есть возможность значительно повысить эффективность реакции оксихлорирования путем решения проблем, которые ранее исключались из рассмотрения.
В соответствии с настоящим изобретением предлагается способ каталитического оксихлорирования этана до ВХМ, который включает смешение этана и хлора в реакторе оксихлорирования в присутствии катализатора оксихлорирования, причем условия реакции выбираются так, чтобы уменьшить влияние оксихлоридной формы катализатора, отделение образующегося ВХМ от получаемых продуктов и рециркулирование побочных продуктов реакции в реактор.
Образование продуктов сгорания при проведении реакции оксихлорирования промотируется оксихлоридной формой катализатора. Установлено, что при выборе реакционных условий, при которых уменьшается концентрация этой формы и, следовательно, снижается ее влияние, уменьшается количество продуктов сгорания, образующихся в ходе реакции.
Влияние оксихлоридной формы катализатора может быть уменьшено, например, при увеличении температуры реакции. Однако это решение невыгодно, так как, например, потребуется большое количество энергии для обогрева реактора, что приведет к увеличению стоимости производства.
Предпочтительно, влияние оксихлоридной формы катализатора уменьшается при создании условий для его быстрого взаимодействия с реагентами.
Установлено, что некоторые источники хлора реагируют с оксихлоридной формой катализатора очень быстро, следовательно уменьшается количество продуктов сгорания, образующихся в ходе реакции. Таким образом, предпочтительно, чтобы влияние оксихлоридной формы катализатора уменьшалось путем использования подходящего источника хлора в количестве, превышающем необходимое стехиометрическое по хлору количество.
Предпочтительным источником хлора является HCl.
Хлористый водород в реакциях оксихлорирования может быть единственным источником хлора. С другой стороны, он может подаваться вместе со вторым источником хлора, таким, как хлорированный углеводород или сам хлор. Вся потребность в хлоре может также обеспечиваться вторым источником хлора.
В общем случае, чем больше избыток подаваемого хлористого водорода над стехиометрическим количеством, тем выше положительное влияние на селективность реакции оксихлорирования. В тех случаях, когда нет необходимости в хлористом водороде, поскольку все необходимое количество хлора обеспечивается за счет альтернативной формы, любое добавленное количество хлористого водорода будет оказывать на реакцию положительное влияние.
Мольное отношение HCl к используемому в реакции этану предпочтительно находится в интервале от 0.1 до 10, предпочтительно в интервале от 0.5 до 3.
Так как в реакции расходуется не весь хлористый водород, он будет выходить из реактора вместе с продуктами реакции. Предпочтительно избыток хлористого водорода возвращать в реактор.
Выделение хлористого водорода и его возврат в реактор можно осуществлять любым известным в данной области способом.
Реакторы и средства для смешивания этана и источника хлора хорошо известны в данной области. Например, условия такой реакции описаны в работах предшествующего уровня, которые упоминались ранее.
Предпочтительно, однако чтобы катализатор содержал соль меди и соль щелочного металла, нанесенные на инертный носитель. Предпочтительно, чтобы медь и щелочной металл присутствовали в атомарном отношении 2:8.
В качестве щелочного металла может быть использован литий, калий, натрия или рубидий. Однако предпочтительно использовать калий.
Указанное атомарное отношение меди и калия соответствует 1,3 и 3,4 мас. %.
В качестве вспомогательного компонента может быть использована соль лантанида. Предпочтительным лантанидом является церий, который может использоваться при атомарном отношении 0,1-5. Предпочтительно, чтобы использовалось 0,74 мас.% церия, что соответствует атомарному отношению 0,5.
С другой стороны, в качестве вспомогательного компонента также могут быть использованы щелочноземельные металлы. Предпочтительными щелочноземельными металлами являются магний и кальций.
Инертный носитель для катализатора может быть выбран из числа известных в данной области носителей, которые легко доступны. Например, можно использовать такие носители, как окись алюминия, силикагель, алюмосиликат, магний силикат, боксит, двуокись магния, карбид кремния, оксид титана, силикат циркония и другие подобные носители.
Предпочтительным носителем является окись алюминия. Предпочтительной является окись алюминия, имеющая низкое значение величины удельной поверхности. Предпочтительно это значение составляет менее 5 м2/г и более предпочтительно - 1 м2/г.
Катализатор может быть использован в виде неподвижного слоя или в виде псевдоожиженного слоя. Псевдоожижение сопровождается диспергированием катализатора на частицы, которые преимущественно имеют средний размер около 90 микрон.
Соли металлов, используемые в катализаторе, представляют собой предпочтительно хлориды металлов. Однако также могут использоваться нитраты, карбонаты и гидроксиды, которые в условиях реакции оксихлорирования будут превращаться в хлориды, оксиды или оксихлориды.
Исходный этан, используемый в реакциях оксихлорирования, может иметь высокую степень чистоты или может содержать заметные количества других углеводородов, таких, как этилен или метан, что обычно для этана промышленного или технического происхождения.
Кислород может подаваться в виде газообразного кислорода или в виде обогащенного кислородом воздуха, или в виде их смеси.
Соотношения, в которых смешиваются различные компоненты реакционной смеси, может быть определено эмпирическим путем. Предпочтительно отношение этана к кислороду находится в интервале от 1:0,25 до 1:1,4, и более предпочтительно от 1:0,75 до 1:1. Отношение этана к хлору предпочтительно составляет от 1:0,5 до 1:5. Все соотношения представляют собой мольные отношения.
Катализатор настоящего изобретения может работать в температурном интервале от 400 до 550oC. Предпочтительным интервалом рабочих температур, однако, является интервал от 440 до 500oC, и более предпочтительно от 450 до 470oC.
Катализатор может работать при давлении в интервале от 0 до 30 бар (29,62 атм), предпочтительно в интервале от 1 до 10 бар (0,99-9,9 атм).
Время контакта реагентов с катализатором предпочтительно составляет от 1 до 60 сек, и более предпочтительно от 5 до 25 сек.
Установлено, что рециркулирование побочных продуктов реакции оксихлорирования в реактор приводит к уменьшению потерь сырья. В предпочтительном варианте настоящего способа действительно возможно уменьшение потерь сырья до нуля, за исключением той части, которая теряется в виде продуктов сгорания и которая теряется при продувке. Это обусловлено тем, что побочные продукты - хлорированные углеводороды могут быть превращены в ВХМ при последующем осуществлении процесса оксихлорирования.
Хлорированные побочные продукты, образовавшиеся при оксихлорировании этана до ВХМ, обычно делятся на насыщенные, ненасыщенные соединения и продукты сгорания.
Насыщенные соединения включают хлористый этил, 1, 1-дихлорэтан, 1,2-дихлорэтан и 1,1,2-трихлорэтан. К продуктам сгорания относятся четыреххлористый углерод, хлороформ и дихлорметан. Ненасыщенные соединения представляют собой 1,1-дихлорэтилен, цис-1, 2-дихлорэтилен, транс-1, 2-дихлорэтилен, трихлорэтилен и перхлорэтилен.
Считается возможным рециркулировать хлорированные побочные продукты непосредственно в реакторе оксихлорирования. Хотя это обеспечило бы некоторый положительный эффект, общая конверсия побочных продуктов в ВХМ была бы низкой.
Это обусловлено тем, что в реакциях, которые имеют место при проведении реакции оксихлорирования, невозможно превращение ненасыщенных хлорированных углеводородов в ВХМ. Кроме того, многие насыщенные хлорированные углеводороды будут превращаться в ненасыщенные хлорированные углеводороды в результате дегидрохлорирования, и, поэтому, не могут быть превращены в ВХМ.
Поэтому предпочтительно ненасыщенные хлорированные углеводороды превращать в насыщенные формы на стадии гидрирования.
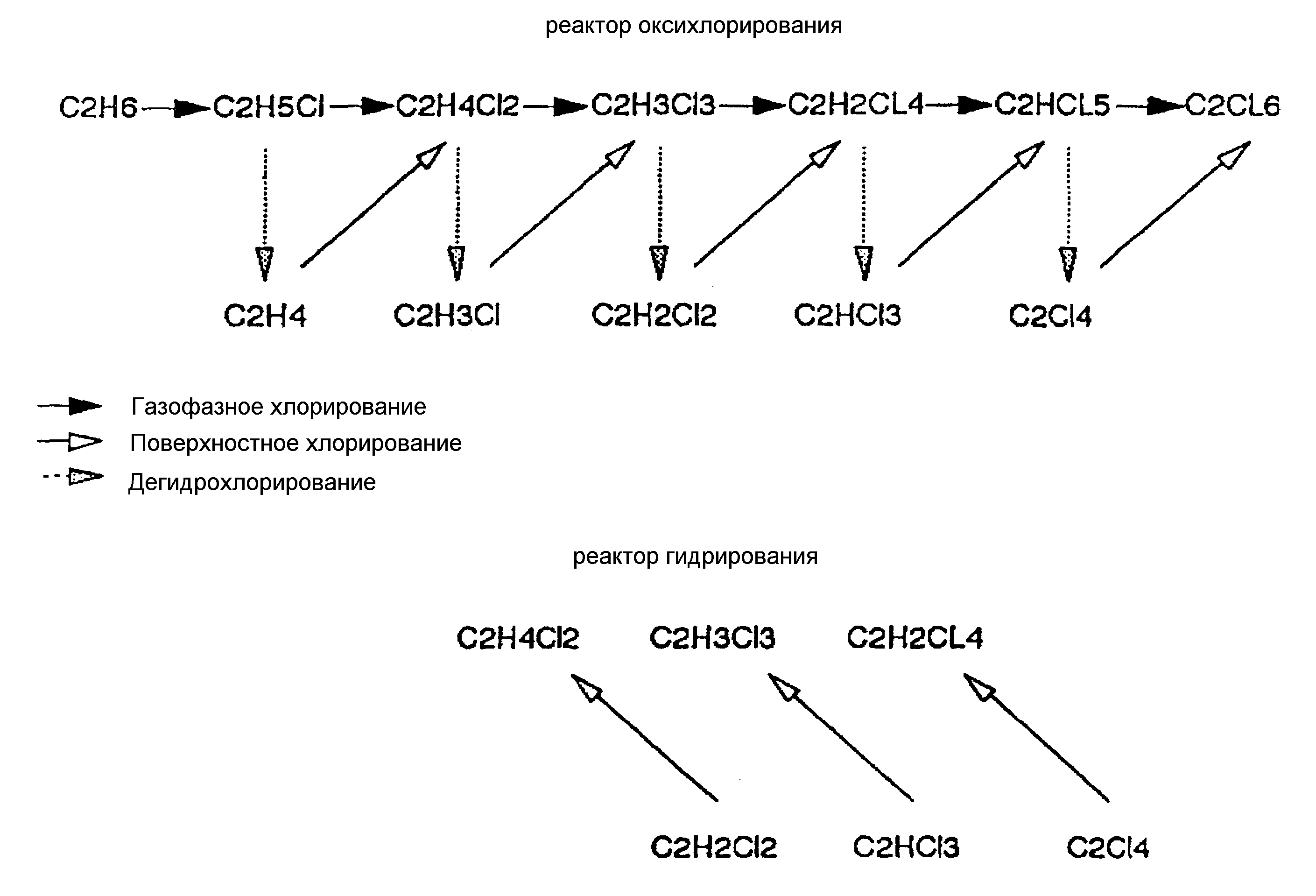
Насыщенные хлорированные углеводороды превращаются путем дегидрохлорирования и, если это необходимо, путем дополнительного гидрирования, в ненасыщенные углеводороды и, в конечном итоге, в ВМХ. На чертеже показаны реакции, которые протекают в реакторах оксихлорирования и гидрирования, используемых в настоящем изобретении.
При рециркулировании ненасыщенных побочных продуктов черед стадию гидрирования все хлорированные углеводородные побочные продукты реакции оксихлорирования могут быть выделены и их ценность в качестве источника сырья не теряется.
На стадии гидрирования хлорированные побочные продукты пропускают вместе с водородом через слой катализатора при повышенных температуре и давлении. Приемлемыми катализаторами являются платина, палладий и родий, которые работают предпочтительно при температуре от 20 до 250oC, преимущественно от 50 до 150oC, в реакторе с подвижным слоем. Предпочтительно, чтобы использовался большой избыток водорода. Однако любой приемлемый катализатор, известный в данной области, может рассматриваться в качестве катализатора для способа настоящего изобретения при соответствующих рабочих условиях.
Ненасыщенные хлорированные углеводороды могут подаваться в реактор гидрирования в практически чистом виде. Однако в предпочтительном выполнении настоящего изобретения они подаются в неочищенной форме вместе с насыщенными хлорированными углеводородными побочными продуктами и продуктами сгорания из реактора оксихлорирования. Это исключает необходимость стадии разделения для отделения насыщенных побочных продуктов от ненасыщенных побочных продуктов и продуктов сгорания.
Насыщенные углеводороды к такой обработке практически не чувствительны, хотя при некоторых условиях они подвергаются гидродехлорированию, которое приводит к образованию этана. Продукты сгорания также повергаются гидро-дехлорированию с образованием метана и хлористого водорода.
Предпочтительно сырьевые побочные продукты содержат компоненты, перечисленные выше, в указанных мольных отношениях: - Мин. Макс.
1,1-дихлорэтилен - 0; 10
цис-1,2-дихлорэтилен - 0; 10
транс-1,2-дихлорэтилен - 0; 20
трихлорэтилен - 0; 10
перхлорэтилен
- 0; 10
хлористый этил - 0; 20
1,1-дихлорэтан - 0; 10
1,2-дихлорэтан - 0; 90
1,1,2-трихлорэтан - 0; 30
четыреххлористый углерод - 0; 20
хлороформ
- 0; 20
дихлорметан - 0; 10
сим-тетрахлорэтан - 0; 5
Сырье также может содержать относительно небольшие количества других материалов, таких как хлорированные бутаны,
хлорированные
бутадиены и другие хлорированные материалы, а также такие углеводороды как этан и этилен.
Изобретение иллюстрируется представленными ниже примерами со ссылкой на чертеж, на котором приведена схема реакций, протекающих в реакторах оксихлорирования и гидрирования.
Примеры 1 и 2.
Путем упаривания водного раствора хлоридов металлов готовят катализатор, содержащий 1,3% меди и 3,4% калия на носителе - двуокиси алюминия. К 250 см3 деионизированной воды добавляют 20 г CuCl2•H2O и 35 г KCl. Полученный раствор порциями добавляют к 500 г носителя катализатора (тип SAHT-99, Production Chemicals LTD). Полученную пасту катализатора сушат при нагревании при 120oC в течение 24 ч, а затем перед использованием просеивают для разрушения агломератов. Установлено, что после приготовления катализатор имеет удельную поверхность 1 м2/г и средний размер частиц 90 микрон.
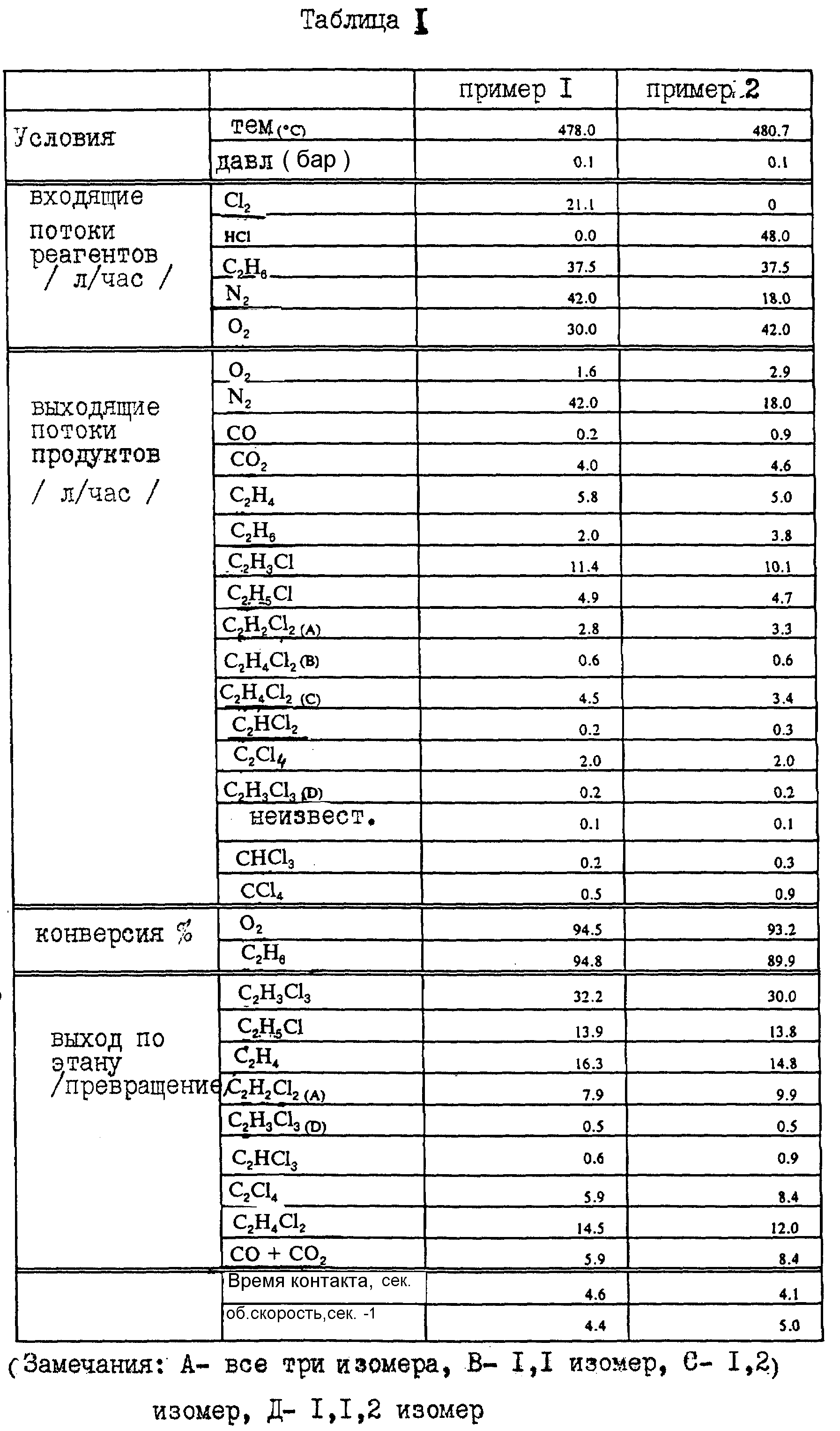
Загрузку катализатора 400 см3 помещают в реактор с кипящим слоем с диаметром 50,8 мм, получая кипящий слой длиной приблизительно 40 см. Конверсию и селективность катализатора определяют с помощью газового хроматографа, установленного на линии. Реактор нагревают электрическим током до желаемой рабочей температуры и заполняют газовой смесью этана, хлора, азота и кислорода. Получают результаты, представленные в табл. 1, пример 1. Эксперимент затем повторяют, за исключением того, что хлор заменяют хлористым водородом и используют более высокий расход кислорода для обеспечения необходимого повышенного стехиометрического количества кислорода. Результаты представлены в табл. 1, пример 2. Использование хлористого водорода вместо хлора приводит к более высокой скорости сгорания и меньшей скорости превращения этана при несколько более низкой скорости превращения кислорода.
Пример 3-5.
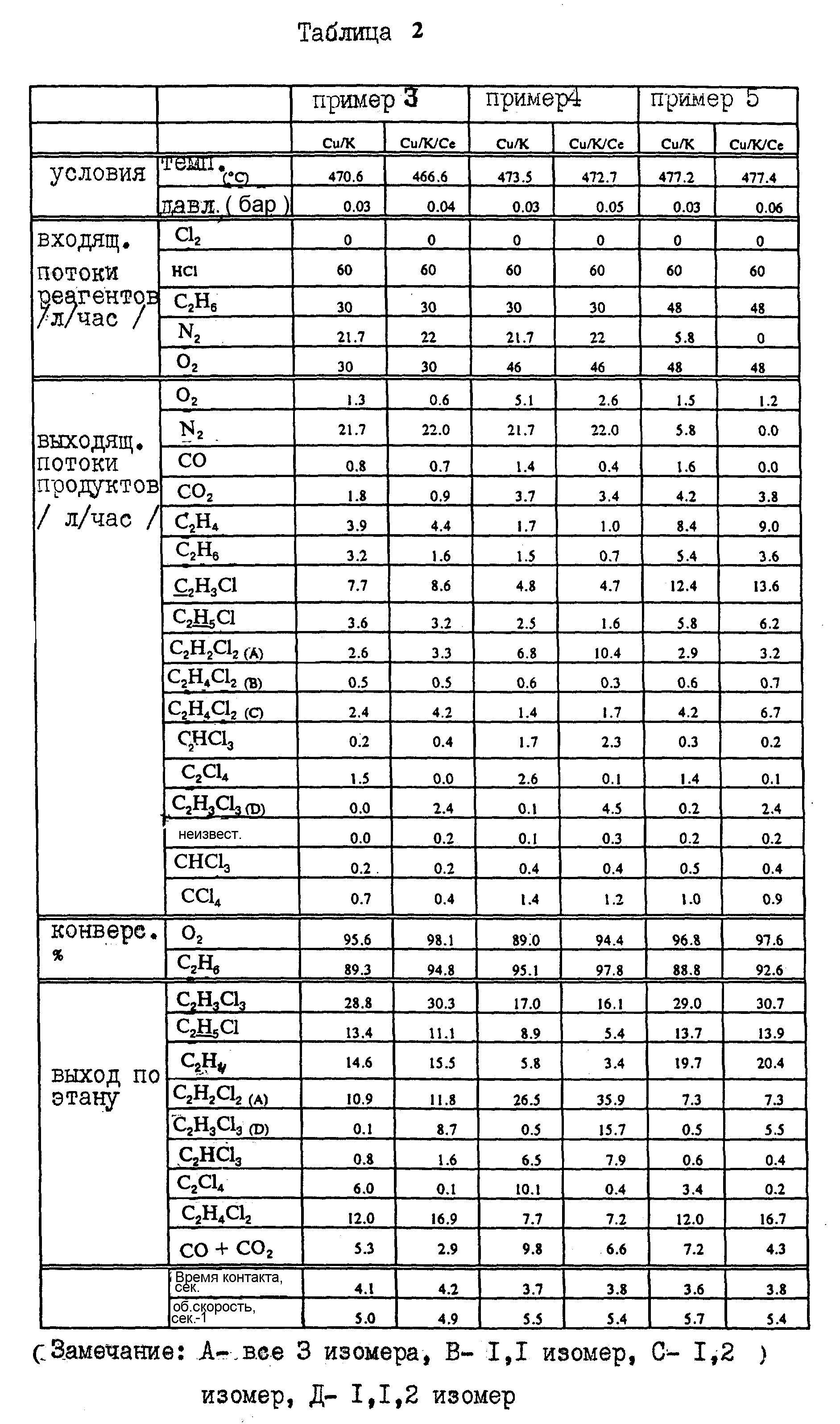
Готовят еще одну загрузку катализатора, описанного выше. Кроме того, по аналогичной методике готовят образец катализатора, содержащего медь, калий и церий, добавляя хлорид церия и получая содержание металла 0,74 мас.%. На Cu/K-катализатор подается смесь этана, хлористого водорода, кислорода и азота. Этот эксперимент затем повторяют, причем используют Cu/K-Ce-катализатор. Результаты обоих опытов представлены в табл. 2, пример 3. Сравнение конверсии и селективности этих двух каталитических рецептур повторяют при двух вариантах других условий при различных соотношениях подачи сырья (табл. 2, примеры 4 и 5). При всех трех вариантах условий реакции введение церия в каталитические рецептуры приводит к значительному положительному эффекту: скорость сгорания уменьшается и скорость превращения этана увеличивается.
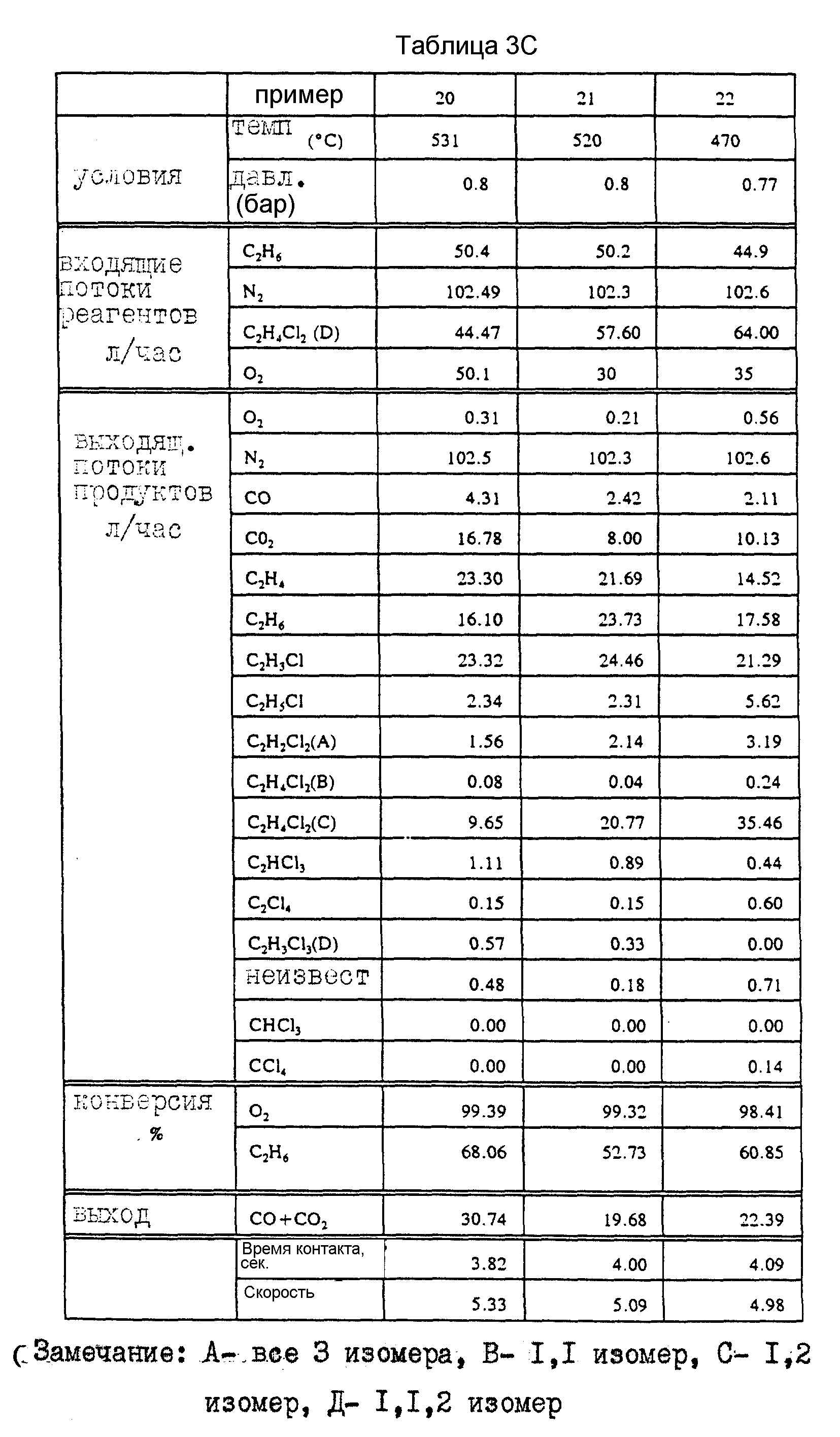
Примеры 6-22.
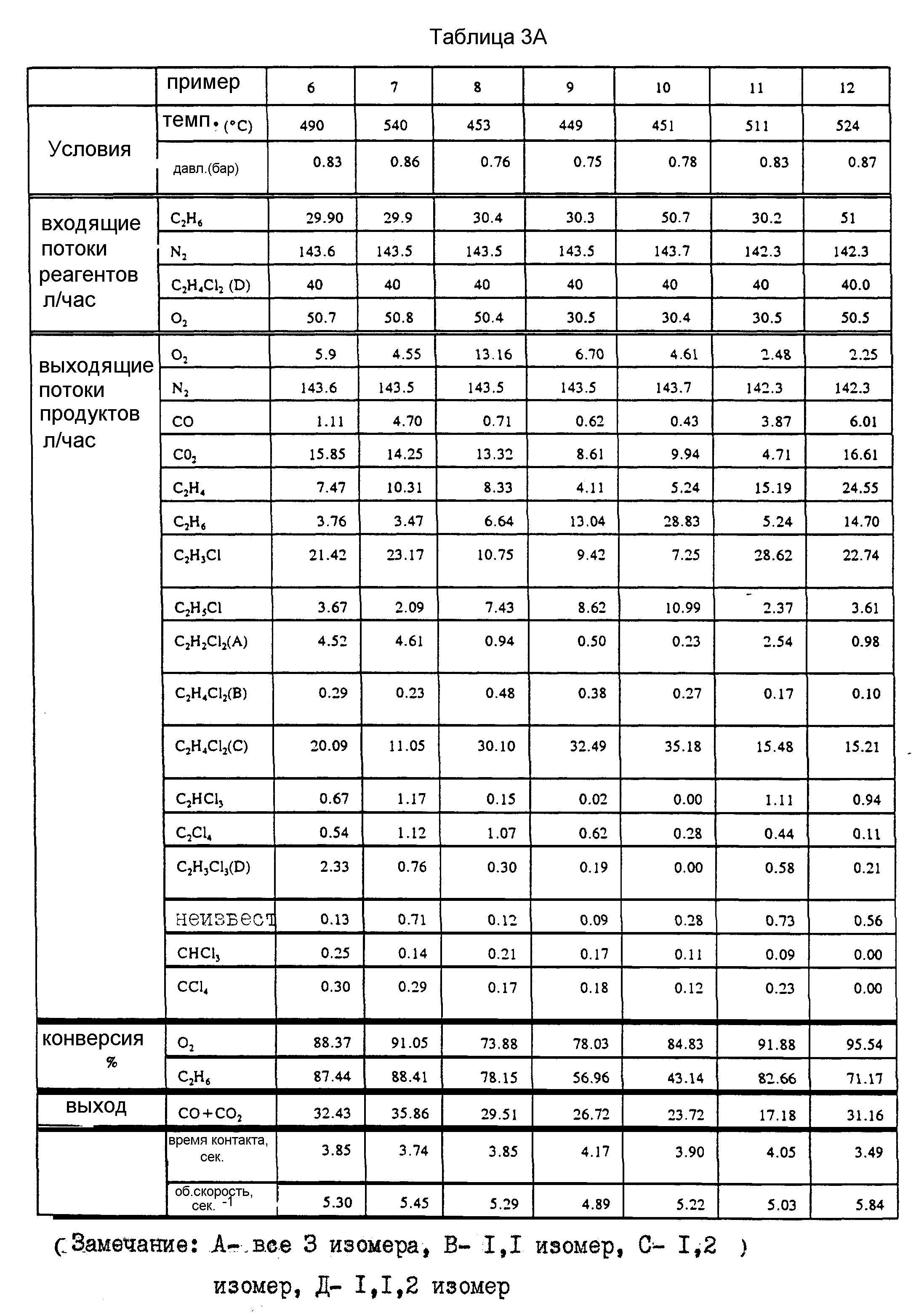
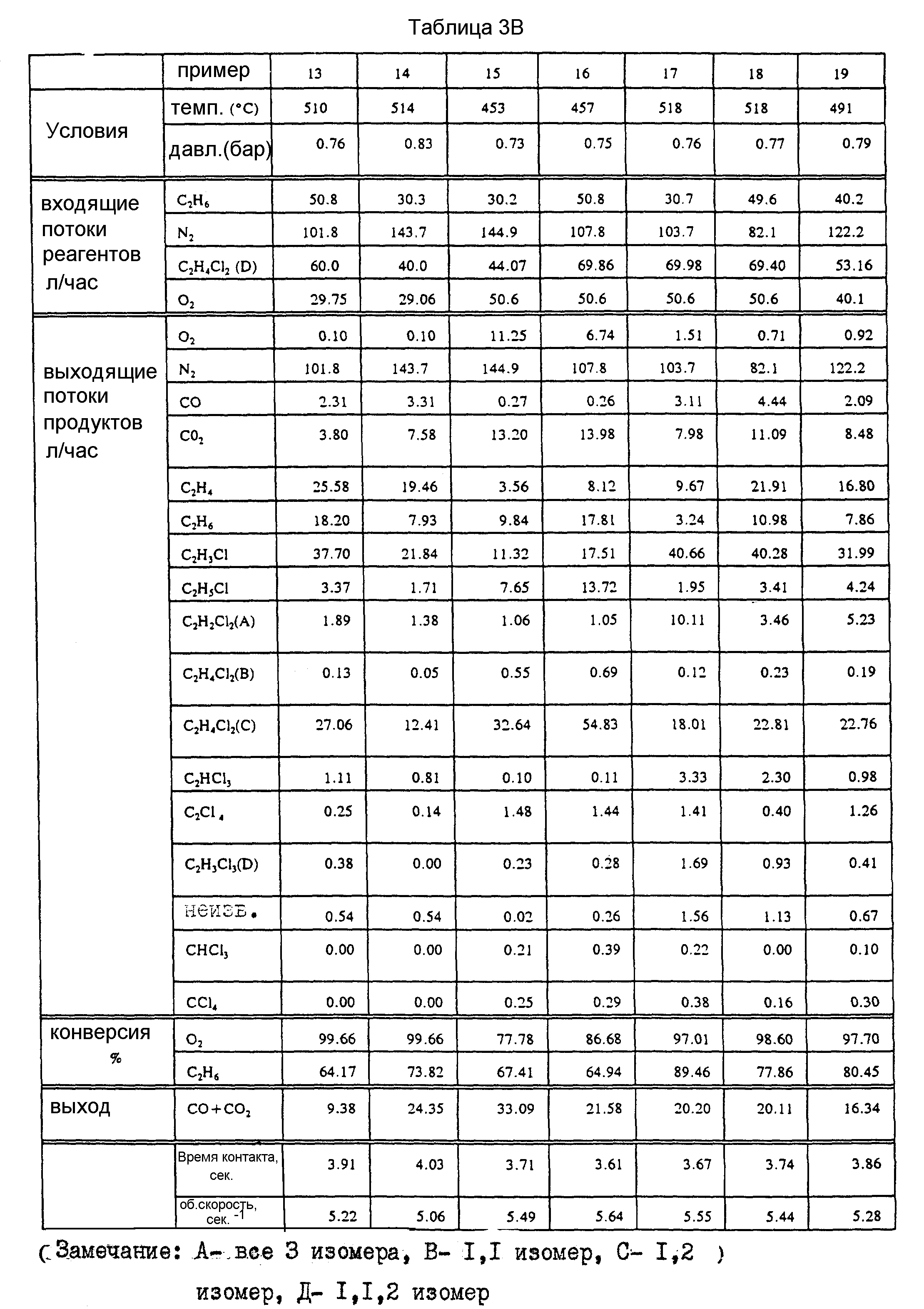
При использовании Cu/K/Ce-катализатора, полученного по методике, описанной в пример 2, в реактор подают смесь этана, кислорода, 1,2-дихлорэтана и азота. В табл. 3 представлены результаты серии экспериментов при различных температурах и соотношениях подаваемого сырья и указан интервал конверсии по этану и кислороду, а также данные по селективности реакции. Наиболее хорошие результаты достигаются при высокой температуре при использовании более низкой скорости подачи кислорода (пример 13).
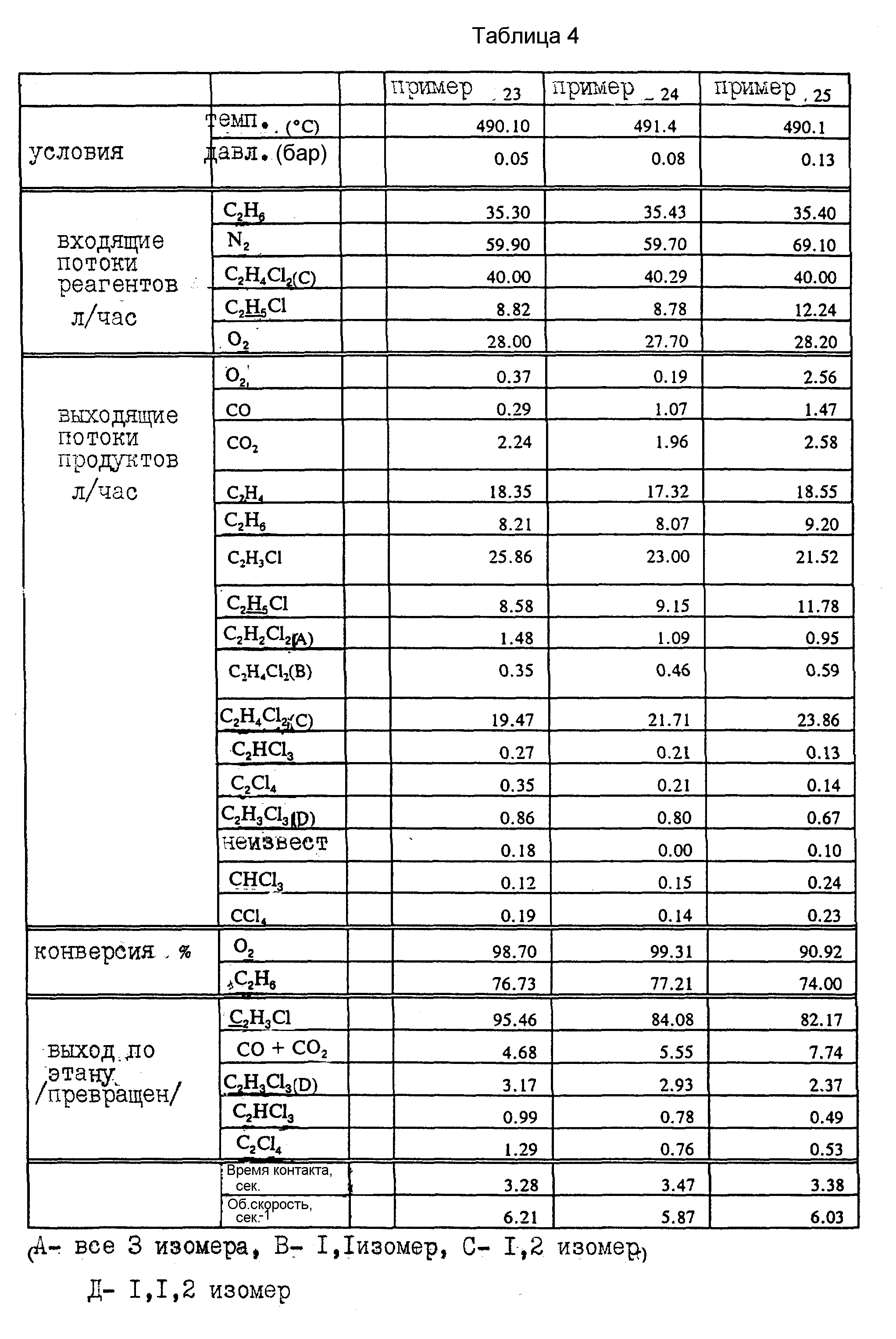
Примеры 23-25.
Снова используют Cu/K/Ce-рецептуру, описанную в примере 2. В реактор подают смесь этана, кислорода, 1,2-дихлорэтана, хлористого этила и азота: результаты представлены в примере 23, табл. 4. Опыт повторяют, но на этот раз в реактор загружают половину обычной загрузки катализатора и половину чистого носителя для катализатора. Катализатор переводят в псевдоожиженное состояние с помощью азота и выдерживают при 470oC в течение 8 ч, а затем подают смесь этана, кислорода, 1,2-дихлорэтана, хлористого этила и азота. Полученные результаты представлены в табл. 4, пример 24. Методику повторяют, за исключением того, что используют катализатор, который содержит только 25% от начальной загрузки катализатора и 75% чистого носителя. Результаты представлены в табл. 4, пример 25.
Результаты этой серии опытов показывают, что влияние на конверсию сырья и селективность можно измерить только при концентрациях металла в катализаторе между 25 и 50% от начальной концентрации.
Пример 26.
Путем упаривания водного раствора хлоридов металлов готовят катализатор, содержащий 1,3% меди и 3,4% калия на носителе - двуокиси алюминия. К 250 см3 деионизированной воды добавляют 20 г CuCl2•H2O и 35 г KCl. Полученный раствор порциями добавляют к 500 г носителя катализатора (Тип SAHT-99, Production Chemicals LTD). Полученную пасту катализатора сушат при 120oC в течение 24 ч, а затем перед использованием просеивают для разрушения агломератов. Установлено, что после приготовления катализатор имеет удельную поверхность 1 м2/г и средний размер частиц 90 микрон.
Загрузку катализатора 400 см3 помещают в реактор с кипящим слоем диаметром 50,8 мм, получая кипящий слой высотой приблизительно 40 см. Конверсию и селективность катализатора определяют с помощью газового хроматографа, установленного на линии. Реактор нагревают электрическим током до желаемой рабочей температуры и заполняют газовой смесью этана, хлора, азота и кислорода. Данные по сырью и полученные результаты представлены в табл. 5, пример 26.
Пример 27.
Используют тот же катализатор и рабочие условия, что и примере 26. Отличия состоят в том, что повышают скорость подачи хлористого водорода и не подают азот. Результаты представлены в табл. 5.
В примере 27 подаваемый избыток хлористого водорода не принимает участие в реакции оксихлорирования, так как весь кислород уже потребляется при более низкой скорости подачи хлористого водорода, что показано в примере 26. Из результатов, представленных в таблице, можно увидеть, что при увеличении скорости подачи хлористого водорода в реактор выход продуктов сгорания (главным образом CO2) уменьшается с 8,44 до 7,27% из расчета на прореагировавший этан.
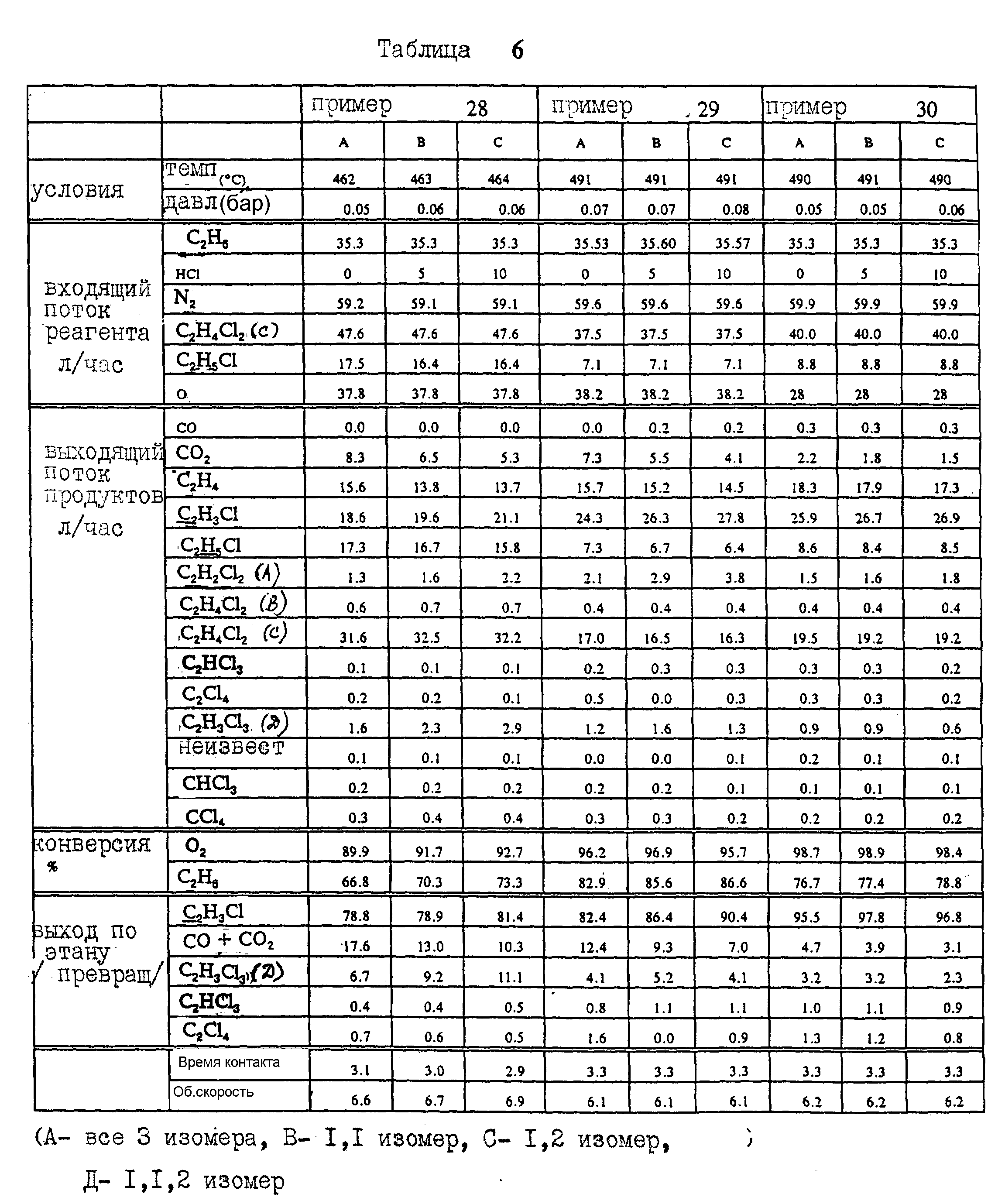
Пример 28.
Используют катализатор того же состава, что и в примере 26, и смешанное хлоруглеводородное сырье. Влияние увеличения скорости подачи хлористого водорода показано в табл. 6, примеры 28A-28C.
Пример 29.
Используют катализатор того же состава, что и в примере 20, и смешанное хлоруглеводородное сырье. Влияние увеличения скорости подачи хлористого водорода, но при более высокой температуре, чем в примере 28, показано в табл. 6, примеры 29A-29C.
Пример 30.
Снова используют катализатор того же состава, что и в Примере 20, и смешанное хлоруглеводородное сырье. Влияние повышенной скорости подачи хлористого водорода, но при более высокой температуре, чем в примере 28, и более низкой скорости подачи кислорода, представлено в табл. 6, примеры 30A-30C.
Из табл. 6, видно, что при трех комбинациях температуры и скорости подачи кислорода увеличение скорости подачи хлористого водорода приводит к понижению скорости сгорания этана. Более того, эффективность, с которой происходит превращение этана в реакторе, при увеличении скорости подачи хлористого водорода в реактор также увеличивается.
Пример 31.
В реактор с кипящим слоем
подаются следующие компоненты:
Сырье:
Этан - 1,0
Кислород - 0,85
Продукты прямого хлорирования:
ЭДХ - 0,35 (0,35 подачи хлора)
Оксиды углерода - 1,
1
Гидрированный рецикл
Хлористый этил - 0,37
ЭДХ - 0,78
1,1-Дихлорэтан - 0,02
1,1,2-Трихлорэтан - 0,04
сим-Тетрахлорэтан - 0,01
Четыреххлористый углерод - 0,03
Рецикл
хлористого водорода
Хлористый водород - 0,1
Указанные выше мольные соотношения представляют собой стационарные рабочие скорости
подачи реагентов в реактор. Хлор вступает в процесс в
виде элементарного хлора, подаваемого непосредственно в реакторах хлорирования.
Этан смешивается с рециклом хлористого водорода и подается в реактор ниже тарелки, поддерживающей катализатор. В воздушной камере он смешивается с испарившимся рециклом гидрирования и продуктами прямого хлорирования. Объединенные потоки имеют температуру 150oC и давление 5,5 бар (5,43 атм).
Смесь проходит через поддерживающую сетку для приведения в псевдоожиженное состояние катализатора, который работает при
температуре 450oC. Кислородное сырье подается
через газовый распределитель, который находится непосредственно над поддерживающей сеткой. Время пребывания в реакционной зоне составляет 12
сек и реакционная температура поддерживается постоянной за
счет отвода теплоты реакции с помощью теплообменных змеевиков, погруженных в слой и охлажденных циркулирующей горячей солью. Спектр
получаемых продуктов из расчета на сырье, указанное выше,
соответствует следующему:
Продукты
Этан - 0,24
Этилен - 0,35
ВХМ - 0,70
Кислород - 0,08
ЭДХ - 0,35
Оксиды углерода - 1,24
Хлористый этил - 0,37
ЭДХ - 0,78
Дихлорэтилены - 0,05
Трихлорэтилен - 0,01
1,1,2-трихлоэтан - 0,02
Перхлорэтилен - 0,01
Четыреххлористый углерод
- 0,03
Хлористый водород - 0,1
Вода - 1,31
Установлено, что когда содержание хлористого водорода в газах, выходящих
из реактора оксихлорирования этана опускается до очень
маленького уровня (почти полное завершение реакции), то количество этана, которое превращается в продукты сгорания резко увеличивается. При
сохранении избытка хлористого водорода реакция горения может
быть уменьшена с 20% (отсутствие HCl в отходящих газах) до 3% (10% HCl в отходящих газах). Также установлено, что есть возможность снизить
рабочую температуру в реакторе до 450oC, при
сохранении приемлемыми конверсии сырья и селективности, за счет увеличения времени пребывания в реакционной зоне от 2 до 12 сек. Это является
весьма существенным, так как известные промышленные
металлы при температурах выше 470oC в значительной степени подвержены коррозии/эрозии.
Реакционная смесь, описанная выше, разделяется на водный поток безводного хлористого водорода, поток сухих легких компонентов (все компоненты легче ВХМ), поток чистого ВХМ и поток тяжелых побочных продуктов.
Вода удаляется из продуктов реакции при проведении первой частичной конденсации, которая приводит к получению водной фазы HCl, фазы влажной органической жидкости и влажной паровой фазы. Водная фаза смешивается с раствором хлорида кальция и затем перегоняется с получением головного безводного хлористого водорода, который рециркулируют в реактор. Основной продукт отбирается в виде бокового парового потока, который конденсируется с образованием незагрязненного водного потока. Поток хлорида кальция рециркулируют в сырьевую колонну. Влажная жидкая фаза подвергается азеотропной сушке в перегонной колонне. Влажный верхний продукт рециркулируют на стадию разделения фаз, тогда как сухой основной продукт подается насосом на разделение перегонкой. Влажные пары сушатся путем контактирования в противотоке с 20%-ным раствором (вес/вес) HCl, охлажденным до -20oC. Для сохранения материального баланса осуществляется продукт этого потока на колонну с хлоридом кальция.
Сжатые паровые продукты и поток высушенных органических жидкостей подаются вместе на ректификационную колонну (колонна легких компонентов), в которой этан используется в качестве легкого погона, а ВХМ - в качестве тяжелого. После теплообмена в сырьевой колонне паровой продукт взаимодействует с хлором с образованием ЭДХ из этилена, присутствующего в сырье. Это может быть осуществлено в паровой фазе с кипящим слоем, с неподвижным слоем или в обычном жидкофазном реакторе.
Парофазный с кипящим слоем хлоратор прямого хлорирования является предпочтительным для проведения этой реакции, так как теплота реакции может быть отведена с потоком и нет загрязнения продукта, например, из-за железа, который воздействует на окружающую среду. Реактор работает при давлении 6 бар (5,92 атм) и температуре 200oC. Отходящий газ рециркулируют в реактор оксихлорирования, но проводится небольшая продувка потока для того, чтобы сбалансировать содержание оксидов углерода. ЭДХ удаляется из потока продувки за счет поглощения слоем угля. Содержащий незначительное количество примесей газ сжигается.
Основной поток из колонны легких компонентов перегоняется (колонна ВХМ) для выделения ВХМ в виде головного продукта. Основной продукт реагирует с водородом в реакторе с подвижным слоем. В этом реакторе любые олефиновые соединения (например, дихлорэтилены, трихлорэтилен и перхлорэтилен) превращаются в насыщенные аналоги. Реакция протекает адиабатически при давлении 10 бар (9,87 атм) и при температуре 75oC при 10-кратном избытке водорода. Поток насыщенных соединений затем испаряется и рециркулируется в реактор оксихлорирования, где насыщенные соединения подвергаются дегидрохлорированию. По этому механизму все соединения, кроме четыреххлористого углерода, постепенно превращаются в ВХМ.
Реферат
Изобретение относится к получению мономера - винилхлорида из этана. Способ основан на реакции оксихлорирования путем взаимодействия этана кислорода и источника хлора в реакторе для оксихлорирования в присутствии катализатора оксихлорирования. Катализатор включает соль меди и соль щелочного металла, нанесенных на инертный носитель. Предпочтительно катализатор содержит медь, калий и церий из расчета 1,3:3,4:0,74 мас.%. Процесс проводят в избытке газообразного хлористого водорода при 400-550°С. Затем отделяют винилхлорид из продуктов реакции, а побочные ненасыщенные хлорсодержащие продукты гидрируют в присутствии катализатора гидрирования при 20-250°С и рециркулируют в реактор оксихлорирования. Процесс характеризуется высокой конверсией и значительным сокращением отходов. 8 з.п. ф-лы, 1 ил., 6 табл.

Комментарии