Способ превращения цис-транс-смеси замещенных бензилиденаминов в чистый цис-изомер - RU2297999C2
Код документа: RU2297999C2
Описание
Предпосылки изобретения
Настоящее изобретение относится к способу получения чистого цис-изомера из смеси цис-транс-изомеров замещенных бензилиденаминов.
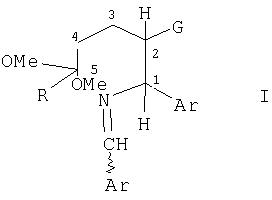
Замещенные бензилиденамины в соответствии с данным изобретением, более конкретно представленные нижеприведенной формулой I, представляют собой полезные промежуточные соединения при получении бензамидпиперидиновых соединений, проявляющих активность в качестве антагонистов рецептора NK-1. Данный синтез цис-изомера представляет собой новый стереоспецифический способ получения более биологически активного цис-бензамидпиперидина с высоким выходом.
Стереоселективный способ получения цис-обогащенного бензамидпиперидина описан в WO 01/77100, представляющем собой патентную заявку США под серийным номером 09/811218, поданную 16 марта 2001 г. и приводимую здесь во всей своей полноте в качестве ссылки. Разделение обогащенной изомерами смеси на желательный чистый изомер требует осуществления дополнительных стадий, сопровождаемых потерей ценного продукта. Настоящее изобретение предлагает альтернативный и более прямой способ получения цис-стереохимического состава.
Сущность изобретения
Настоящее изобретение относится к способу получения чистого цис-изомера из смеси цис-транс-изомеров формулы

в которой R представляет собой C1-5 алкил, и Ar представляет собой фенил или нафтил, необязательно моно- или дизамещенный C1-5 алкилом, C1-5 алкокси, галогеном, трифторметилом, сложным эфиром или амидо; где указанная формула I включает хиральный атом углерода C1 и смежный хиральный атом углерода С2; и где С2 присоединен к атому водорода и к сильной электрон-акцепторной группе G, выбранной из группы, включающей нитро, нитрозо, нитрил, цианато, изоцианато, нитрозамещенный арил, сульфонил и карбонил; и где по меньшей мере один атом или группа, присоединенная к C1, отличается от атомов или групп, присоединенных к C2; включающему следующие стадии:
а. диспергирование смеси цис- и транс-изомеров формулы I в инертном растворителе, в котором указанный цис-изомер по существу менее растворим, чем указанный транс-изомер;
b. нагревание указанной дисперсии до полного растворения указанного транс-изомера и растворения по меньшей мере 10% мас. цис-изомера;
с. поддерживание указанной стадии нагревания для обеспечения возможности взаимного превращения указанных цис- и трансизомеров;
d. охлаждение указанной смеси, тем самым обеспечивая кристаллизацию цис-изомера;
е. отделение указанного кристаллического цис-изомера от указанного растворителя.
Данный способ включает последовательность стадий, начиная с диспергирования смеси изомеров в выбранном растворителе, в котором цис-изомер имеет более низкую растворимость, чем трансизомер. Исходную дисперсию затем нагревают и поддерживают при подходящей температуре в течение периода времени, достаточного для обеспечения равновесия раствора, посредством чего изомеры являются взаимопревращаемыми.
Дисперсию нагревают и поддерживают нагреванием в течение длительного периода времени для того, чтобы растворить по меньшей мере около 10% мас. цис-изомера и обеспечить равновесие взаимопревращения цис- и транс-изомеров. В соответствии с предпочтительным вариантом транс-изомер растворяют полностью и по меньшей мере часть цис-изомера растворяется во время стадий нагревания. Согласно предпочтительному варианту во время стадии нагревания соотношение равновесия цис- и транс-изомеров в растворе составляет 3:1.
При охлаждении раствора менее растворимый цис-изомер выделяется в чистую кристаллическую форму.
Исходная смесь цис- и транс-изомеров на вышеуказанной стадии (а) имеет весовое соотношение цис- и транс-изомеров от приблизительно 60:40 до приблизительно 40:60. В предпочтительном варианте соотношение составляет 50:50.
Подходящими растворителями являются такие растворители, в которых транс-изомеры растворяются полностью при температуре около 30°С. Цис-изомер в таком же растворителе выпадает в осадок в виде кристаллического твердого вещества при температуре от приблизительно 30 до приблизительно 40°С.
Подходящие растворители выбирают из группы, состоящей из спирта, имеющего формулу R1ОН, смеси спиртов, имеющих формулу R1ОН, и смеси одного или нескольких спиртов формулы R1ОН с водой, где R1представляет собой С1-С5 алкил.
Предпочтительным растворителем является метиловый спирт.
После диспергирования смеси цис-транс-изомеров в растворителе полученную смесь нагревают до температуры от приблизительно 40 до приблизительно 55°С и выдерживают в течение по меньшей мере 4 часов. Предпочтительно смесь нагревают до температуры от приблизительно 40 до приблизительно 45°С в течение приблизительно 7 часов.
На следующей стадии смеси позволяют медленно охладиться, тем самым вызывая отделение менее растворимого цис-изомера в виде кристаллического твердого вещества. Как правило, смесь охлаждают до температуры от приблизительно 0 до приблизительно 35°С в течение приблизительно 96 часов; предпочтительно, смесь охлаждают до приблизительно 25°С в течение приблизительно 72 часов.
Наконец, смесь охлаждают до температуры от приблизительно 0 до приблизительно 5°С в течение приблизительно 1 часа. На данной стадии твердые вещества включают чистые цис-изомеры.
Что касается формулы I, оба атома углерода С1 и С2 являются асимметрическими атомами углерода, каждый из которых образует стереоцентр в молекуле I.
Соединения формулы I содержат две пары энантиомеров. Между двумя парами энантиомеры являются диастереоизомерическими и, как ожидается, как правило имеют различные физические свойства, такие как растворимость в типичных растворителях.
Цис- и транс-изомеры в соответствии с настоящим изобретением имеют конфигурационную связь нитрогруппы и арилгруппы на С2 и С1.
Взаимопревращение цис- и транс-изомеров в соответствии с настоящим изобретением объясняется присутствием переходного настоящим изобретением объясняется присутствием переходного соединения, в котором углерод С2 является ахиральным. Ахиральный атом углерода С2 образуется в результате расщепления связи при атоме углерода С2. Предпочтительно, происходит расщепление связи С2-Н, при этом протон Н+ отделяется, оставляя при С2 резонансный стабилизированный карбанион. Репротонирование эпимеризует переходное состояние назад в цис- или транс-изомер.
Расщепление протона около атома углерода С2 облегчается присутствием электроноакцепторной группы G, присоединенной к С2. Подходящие электроноакцепторные группы выбраны из группы, включающей нитро, нитрозо, нитрил, цианато, изоцианато, нитрозамещенный арил, сульфонил и карбонил. Предпочтительно, электроноакцепторная группа, присоединенная к С2, представляет собой нитрогруппу.
В соответствии с настоящим изобретением предпочтительной является цис-конфигурация, и равновесие раствора на стадии взаимопревращения поддерживают при помощи нагревания при соотношении цис-транс 3:1. Вследствие кристаллизации цис-изомера и сдвига равновесия в результате взаимного превращения трансизомер полностью превращается в цис-изомер.
Подробное описание изобретения
Данное изобретение относится к новому способу получения чистого изомера в результате взаимного превращения смеси цис- и транс-изомеров соединения формулы I и последующего отделения менее растворимого, более кристаллического цис-изомера.
Согласно настоящему способу, смесь изомеров вначале диспергируют в инертном растворителе, а затем частично или полностью растворяют путем нагревания. Между растворенными изомерами, способными к взаимному превращению при помощи ахирального стереоцентра, достигается равновесие. В результате соответствующего выбора растворителя и соответствующих условий нагревания и охлаждения смесь изомеров полностью превращается в цис-конфигурацию.

Стереохимические термины, используемые в данном описании и прилагаемой формуле изобретения, имеют следующие значения.
Асимметрический атом представляет собой атом, связанный с четырьмя различными атомами или группами. Расположение асимметрического атома называют «хиральным центром» или «стереоцентром», а молекулу, содержащую один или несколько хиральных центров, называют «хиральной молекулой». Хиральные молекулы не являются идентичными в их зеркальном отражении и не могут быть совмещены.
Изомеры представляют собой соединения, имеющие одинаковую молекулярную формулу, но отличающиеся по своей природе, последовательности соединения своих атомов или по расположению атомов в пространстве. Стереоизомеры представляют собой изомеры, отличающиеся только расположением атомов в пространстве. Энантиомеры представляют собой стереоизомеры, которые являются зеркальным отображением друг друга и не могут быть совмещены. Диастереомеры представляют собой стереоизомеры, которые не являются зеркальным отображением друг друга. Рацемат представляет собой смесь энантиомеров, присутствующих вместе в одинаковых количествах.
Цис- и транс-изомеры содержат атомы или группы, выступающие с одной и той же стороны (цис) или с противоположных сторон (транс) плоскости сравнения. В диастереоизомерах, содержащих два асимметрических атома углерода, плоскость сравнения выступает через оба асимметрических атома.
Эпимеризация представляет собой обратимое превращение одного диастереоизомера в другой диастереоизомер.
Превращение представляет собой необратимое превращение одного стереоизомера в другой.
В настоящем изобретении структура цис- и транс-изомеров относится к конфигурации вокруг стереоцентров, расположенных около C1 и С2 в формуле I. Конкретно, описываемая здесь цис- и транс-конфигурация относится к пространственной взаимосвязи между связью C1-Ar и связью C2-G.
На начальной стадии настоящего изобретения смесь изомеров диспергируют в растворителе, в котором цис-изомер имеет более низкую растворимость, чем транс-изомеры.
Дисперсию нагревают в течение длительного периода времени, чтобы растворить все транс-изомеры и по меньшей мере часть цис-изомеров. Устанавливают равновесие раствора цис- и трансизомеров, вначале имеющее соотношение примерно 1:1. Во время периода нагревания цис- и транс-изомеры подвергаются взаимному превращению, и равновесие раствора сдвигается, что приводит к соотношению цис к транс, составляющему от приблизительно 4:1 до приблизительно 3:1. В предпочтительном варианте соотношение равновесия цис- и транс-изомеров в растворе равно 3:1.
Во время стадии охлаждения более кристаллические, менее растворимые цис-изомеры выпадают из раствора в осадок. В результате дальнейшего взаимного превращения транс-изомеров в цис-изомеры соотношение равновесия в растворе вновь достигает 3:1. Процесс медленного охлаждения продолжают до тех пор, пока твердые вещества по существу все не превратятся в цис-изомеры.
Взаимное превращение цис- и транс-изомеров происходит через планарное переходное соединение, образуемое в результате расщепления связи около С2. Как правило, образованию промежуточных переходных соединений способствует стабилизация резонансных структур.
Согласно предпочтительному варианту осуществления настоящего изобретения, расщепление связи происходит между атомом углерода С2 и атомом водорода, к которому он присоединен, что приводит к отделению протона (Н+) и превращению атома углерода С2 в планарный, ахиральный карбанион, имеющий резонансные структуры

Резонансная стабилизация в соответствии с формулой IRспособствует образованию планарного карбаниона. Удаление атома Н в виде протона Н+ около атома углерода С2 облегчается соседней нитрогруппой, придающей атому водорода высокую лабильность.
Не придерживаясь никакой теории, авторы полагают, что взаимное превращение изомеров лучше всего объясняется химическим превращением около хирального атома водорода С2 в переходном состоянии IR. Конкретно, репротонирование около С2 приводит к образованию цис- или транс-связи между нитрогруппой около С2 и арилгруппой около С1. Поэтому, как показано на схеме 1, цис- и транс-изомеры формулы I существуют при равновесии раствора.
Как правило, стадию нагревания в соответствии с настоящим изобретением осуществляют при температуре от приблизительно 40 до приблизительно 55°С и поддерживают в течение по меньшей мере 4 часов. Стадию охлаждения осуществляют при температуре от приблизительно 0 до приблизительно 35°С в течение приблизительно 96 часов. Согласно предпочтительному варианту, репротонирование около С2 способствует цис-конфигурации, поэтому равновесное содержание цис/транс в растворе составляет 3:1. Предпочтительно соотношение цис-транс 3:1 сохраняют, выдерживая раствор при температуре от приблизительно 40 до приблизительно 45°С в течение по меньшей мере приблизительно 7 часов, при этом растворителем является метиловый спирт. Затем смесь охлаждают предпочтительно от 40°С до приблизительно 35°С в течение приблизительно 10 часов, а затем предпочтительно от 35°С до приблизительно 30°С в течение приблизительно 4 часов. Охлаждение продолжают предпочтительно от 30°С до приблизительно 25°С в течение приблизительно 48 часов. Наконец, смесь охлаждают до температуры приблизительно 0-5°С в течение приблизительно 1 часа. На данном этапе твердые вещества полностью превращаются в цис-конфигурацию.
СХЕМА 1
Равновесие раствора цис- и транс-изомеров формулы I

Соединения формулы I включают замещенный этан, содержащий атом углерода С1 и атом углерода С2, в которой С1представляет собой асимметрический атом углерода, соединенный простыми связями с 4 различными заместителями. Четырьмя заместителями являются -Н, -Ar, -N=CH-Ar и С2. С2 представляет собой второй асимметрический атом углерода, соединенный простыми связями с -Н, -NO2, C1и -(CH2)2 C(OMe)2R. В соответствии с установленными химическими принципами, хорошо известными специалистам в данной области техники, соединения, содержащие n асимметрических атомов, включают ряд стереоизомеров, не превышающих 2n. Как показано ниже соединения формулы 1 включают 22 или 4 стереоизомера Ia, b, c и d.

Соединения Ia-Id имеют одинаковую молекулярную формулу (т.е. каждое соединение имеет одинаковые заместители на С1 и С2, но все 4 заместителя отличаются расположением заместителей на С1 и С2).
Соединения, представленные формулами Ia и Ib, представляют собой пару энантиомеров, в которой каждое соединение является зеркальным отображением другого соединения и в которой Ia и Ib не могут быть совмещены. Соединения Ic и Id представляют собой вторую пару энантиомеров, в которой каждое соединение является зеркальным отображением другого соединения и в которой Ic и Id не могут быть совмещены.
Соединения, представленные формулами Ia и Ic, не являются зеркальными отображениями друг друга и поэтому являются диастереоизомерными; подобным образом соединения Ia и Id, Ib и Ic, а также Ib и Id являются диастереоизомерными. Диастереоизомеры, как правило, имеют различные свойства, такие как температура кипения, температура плавления и растворимость.
Что касается вышеприведенного, соединения в соответствии с настоящим изобретением имеют как цис-конфигурацию, как иллюстрирует соединение Ia и его энантиомер Ib, так и транс-конфигурацию, как иллюстрирует соединение Ic и его энантиомер Id.
Схема 2 иллюстрирует методику получения соединений формулы I при соотношении цис- и транс 1:1, как раскрыто в WO 01/77100.
Согласно схеме 2, нитрометан добавляют к алкилвинилкетону, получая соответствующий 1-нитро 4-оксоалкан, который подвергают взаимодействию на следующей стадии с двумя эквивалентами ароматического альдегида PhCHO в присутствии триметилортоформиата, ацетата аммония в качестве источника амина, получая соединение формулы I с соотношением цис и транс, равным приблизительно 1:1.

Как раскрывается в WO 01/77100, соединения формулы I в виде смеси цис- и транс-изомеров, включая рацемат, могут быть использованы в качестве промежуточных соединений для синтеза некоторых, цис-обогащенных бензамидпиперидиновых соединений, проявляющих фармацевтическую активность при лечении и профилактике нарушений центральной нервной системы. Представительным бензамидпиперидиновым соединением является соединение, имеющее формулу VI.

в которой фенильный заместитель на атоме 2 пиперидинового кольца и аминозаместитель на атоме 3 кольца имеют цис-конфигурацию и в которой алкилгруппа на атоме 6 кольца имеет транс-конфигурацию относительно фенильной группы на атоме 2, и Ar1 выбран из моно- или дизамещенного арила или гетероарила.
Примеры конкретных соединений формулы VI включают следующие соединения:
7-[(6-изобутил-2-фенилпиперидин-3-иламино)метил]-6-метокси-1-метил-3,4-дигидро-1Н-хинолин-2-он;
6-метокси-3-метил-5-[(6-метил-2-фенилпиперидин-3-иламино)метил]-1,1а,3, 7b-тетрагидро-3-аза-циклопропа[а]нафтален-2-он;
[1-(2-диметиламиноэтил)-2-фенилпиперидин-3-ил]-2-метокси-5-трифторметоксибензил)амин;
6-метокси-1-метил-7-[(2-фенилоктагидроциклопента[b]пиррол-3-иламино)метил]-3,4-дигидро-1Н-хинолин-2-он;
(2-метокси-5-трифторметоксибензил)-(1-[1,2, 4]оксадиазол-3-илметил-2-фенилпиперидин-3-ил)амин;
7-{[(1-(имидазол-1-илацетил)-2-фенилпиперидин-3-иламино]метил}-6-метокси-1-метил-3,4-дигидро-1Н-хинолин-2-он;
6-метокси-3-метил-5-[(6-метил-2-фенилпиперидин-3-иламино)метил]-1,1а,3,7b-тетрагидро-3-аза-циклопропа[а]нафтален-2-он;
6-метокси-1-метил-7-[(6-этил-2-фенилпиперидин-3-иламино)метил]-3,4, -,дигидро-1Н-1,1а,3,7b-тетрагидро-3-аза-циклопропа[а]-нафтален-2-он;
6-метокси-1-метил-3,3-циклопропил-7-[(6-этил-2-фенилпиперидин-3-иламино)метил]-1,3-дигидроиндол-2-он;
5-[(6-этил-2-фенилпиперидин-3-иламино)метил]-6-метокси-3-метил-1,1а,3,7b-тетрагидро-3-аза-циклопропа[а]нафтален-2-он
и их фармацевтически приемлемые соли.
В соответствии с вышеприведенной ссылкой, когда смесь рацемических диастереомеров формулы I является промежуточной для получения соединения VI, то, как показано на схеме 3, стереоселективное восстановление на следующей стадии приводит к получению цис-обогащенного соединения VI.

В соответствии со схемой 3, соединения формулы I превращают в циклический имин III с последующим восстановлением до замещенного пиперидина IV, применяя источник водорода, такой как гидрид лития-алюминия, в присутствии кислоты Льюиса, такой как триметилалюминий, при температуре около -78°С. В получаемом пиперидине IV этилгруппа в положении 6 кольца желательно имеет транс-конфигурацию относительно арилгруппы в положении 2. Соединения формулы IV превращают в оксим в положении 3, который затем восстанавливают стереоспецифическим способом с применением водорода и никеля Ренея, с получением цис-обогащенной конфигурации относительно группы Ar в положении 2. Конфигурация цис сохраняется на протяжении конечных стадий до получения цис-обогащенных соединений формулы VI. Данный способ, в котором применяют 1:1 смесь цис/транс-изомеров формулы I, имеет серьезный недостаток, заключающийся в том, что он требует осуществления нескольких стадий и очисток, что сопровождается потерей выхода для получения соединений формулы VI. Авторы настоящего изобретения признают необходимость получения чистых цис-изомеров формулы V, которые, в свою очередь, обеспечивают соединения формулы VI, имеющие желаемый стереохимический состав, более прямым и менее дорогостоящим способом. Чистый изомер формулы I позволяет использовать новый способ, требующий осуществления меньшего количества стадий для получения и сохранения желаемого цис-стереохимического состава.
Схема 4 иллюстрирует альтернативный способ получения цис-изомеров формулы VI c применением чистых цис-соединений I, получаемых в соответствии с настоящим изобретением. Указанный новый способ, основанный на последовательности реакций, описанных в WO01/77100, позволяет получать соединение VI непосредственно в виде чистых цис-изомеров с повышенным выходом и при осуществлении меньшего количества стадий.
Согласно схеме 4, циклизация цис-изомера I c последующей защитой азота дает цис-енамин IIa. Последующие стадии восстановления и снятия защиты позволяют получать соединения формулы V желаемого цис-нитрофенил стереохимического состава.

В предпочтительном варианте осуществления данного изобретения соединение формулы I представляет собой бензилиден-(5,5-диметокси-2-нитро-1-фенилгептил)амин.
Соединения формулы VI и промежуточные соединения, показанные на вышеприведенных реакционных схемах, могут быть выделены и очищены известными способами, такими как перекристаллизация или хроматографическое разделение.
Соединения формулы VI и их фармацевтически приемлемые соли могут быть введены млекопитающим оральным, парентеральным (таким как подкожное, внутривенное, внутримышечное, интрастенальное и инфузионное), ректальным, интраназальным или местным способами. В целом, наиболее желательно введение указанных соединений в дозах от приблизительно 0,01 до приблизительно 1500 мг в сутки, в виде разовых или разделенных доз (т.е. от 1 до 4 доз в сутки), несмотря на неизбежные изменения в зависимости от вида, массы и состояния подвергаемого лечению объекта и конкретного выбранного способа введения. Однако наиболее предпочтительным является уровень дозировки в интервале от приблизительно 0,5 до приблизительно 500 мг на кг массы тела в сутки. Тем не менее, могут иметь место изменения в зависимости от вида подвергаемого лечению животного и его индивидуальной реакции на указанный лекарственный препарат, а также от вида выбранного фармацевтического препарата, времени и интервала, с которым осуществляется такое введение. В некоторых случаях дозы ниже нижнего предела вышеуказанного интервала могут оказаться более чем достаточными, в то время как в других случаях могут быть использованы более высокие дозы без какого-либо нежелательного побочного действия, при условии, что такие более высокие дозы вначале делят на несколько небольших доз, вводимых в течение суток.
Соединения формулы VI могут быть введены как таковые либо в сочетании с фармацевтически приемлемыми носителями или разбавителями любым из вышеуказанных способов, при этом такое введение может быть осуществлено в виде разовых или многократных доз. Более конкретно, новые терапевтические агенты в соответствии с данным изобретением могут быть введены в виде самых различных лекарственных форм, т.е. они могут быть объединены с различными фармацевтически приемлемыми инертными носителями в виде таблеток, капсул, пастилок, лепешек, твердых леденцов, порошков, аэрозолей, кремов, бальзамов, суппозиториев, желе, гелей, паст, лосьонов, мазей, водных суспензий, растворов для инъекций, эликсиров, сиропов и т.п. Такие носители включают твердые разбавители или наполнители, стерильные водные среды, различные нетоксичные органические растворители и т.д. Более того, фармацевтические композиции для перорального применения могут быть соответствующим образом подслащены и/или ароматизированы. В целом, терапевтически эффективные соединения в соответствии с данным изобретением присутствуют в таких лекарственных формах в количестве от приблизительно 5,0 до приблизительно 70% мас.
Для перорального введения таблетки, содержащие различные эксципиенты, такие как микрокристаллическая целлюлоза, цитрат натрия, карбонат кальция, дифосфат кальция и глицин, могут быть использованы наряду с различными дезинтегрантами, такими как крахмал (предпочтительно, кукурузный, картофельный или тапиоковый крахмал), альгиновая кислота и некоторые сложные силикаты, вместе с гранулирующими связующими, такими как поливинилпирролидон, сахароза, желатин и акация. Кроме того, для целей таблетирования очень часто применяют лубриканты, такие как стеарат магния, лаурилсульфат натрия и тальк. В качестве наполнителей в желатиновых капсулах также могут быть использованы твердые композиции подобного типа; предпочтительные материалы, предназначенные для данной цели, также включают лактозу или молочный сахар, а также высокомолекулярные полиэтиленгликоли. Если водные суспензии и/или эликсиры предназначены для перорального введения, то активные ингредиенты могут быть объединены с различными подслащивающими или ароматизирующими агентами, красящими веществами или пигментами и, при желании, эмульгирующими и/или суспендирующими агентами вместе с такими разбавителями, как вода, этанол, пропиленгликоль, глицерин и их различные сочетания.
Для парентерального введения могут быть использованы растворы соединения формулы VI либо в сезамовом или арахисовом масле либо в водном пропиленгликоле. При необходимости, водные растворы должны быть соответствующим образом забуферены (рН предпочтительно выше 8), а жидкий разбавитель должен быть вначале превращен в изотонический. Такие водные растворы являются подходящими для внутривенных инъекций. Маслянистые растворы являются подходящими для интраартикулярных, внутримышечных и подкожных инъекций. Все указанные растворы могут быть легко изготовлены в стерильных условиях с применением стандартных фармацевтических способов, хорошо известных специалистам в данной области техники.
Кроме того, при лечении воспалительных состояний кожи соединения формулы VI могут быть введены местным способом в виде кремов, желе, гелей, паст, накладок, мазей и т.п. в соответствии со стандартной фармацевтической практикой.
Активность соединений формулы VI в качестве антагонистов вещества Р определяется их способностью ингибировать связывание вещества Р на его рецепторных участках в клетках IM-9 при помощи радиоактивных лигандов. Антагонистическая активность описываемых здесь соединений на вещество Р определяют, применяя стандартный способ анализа, описанный D.G. Payan et al. The Journal of Immunology, 133, 3260 (1984). Данный способ по существу включает определение содержания отдельного соединения, необходимого для снижения на 50% количества меченных радиоактивным изотопом лигандов вещества Р на их рецепторных участках, в указанных выделенных коровьих тканях или клетках IM-9 и получение в результате величин характеристик IC50 для каждого исследуемого соединения. Более конкретно, ингибирование [3 H]SP связывания с клетками IM-9 человека соединениями определяют в буфере для анализа (50 мМ Трис-HCl (рН 7,4), 1 мМ MnCl2, 0,02% бычьего сывороточного альбумина, бацитрацин (40 мкг/мл), лейпептин (4 мкг/мл), химостатин (2 мкг/мл) и фосфорамидон (30 мг/мл)). Реакцию инициируют, добавляя клетки к буферу для анализа, содержащему 0,56 нМ [3H]SP и различное количество соединений (общий объем 0,5 мл), и инкубируя их в течение 120 минут при температуре 4°С. Инкубацию прекращают фильтрацией через фильтры GF/B (предварительно замочены в 0,1% полиэтиленамине в течение 2 часов). Неспецифическое связывание определяют как радиоактивность, остающуюся в присутствии 1 мкМ SP. Фильтры помещают в трубки, осуществляя подсчет при помощи жидкостного сцинтилляционного счетчика.
Соединения формулы VI подвергают исследованиям, при этом по меньшей мере один стереоизомер каждого такого соединения проявляет связующую аффинность, измеряемую в виде Кj и составляющую по меньшей мере 600 нМ.
Активность соединений формулы VI против генерализованного тревожного состояния может быть определена путем ингибирования индуцированного GR73632 теста на постукивание у песчанок. Более конкретно, песчанок слегка анестезируют эфиром и обнажают поверхность скальпа. GR73632 или носитель (PBS, 5 мкл) вводят непосредственно в боковые желудочки головного мозга при помощи иглы № 25, вставляемой на 4,5 мм ниже брегмы (после предварительной обработки антагонистом, 0,1-32,0 мг/кг, s.c. или р.о. (подкожно или перорально)). После инъекции песчанок по отдельности помещают в литровые мензурки и наблюдают за повторными постукиваниями их задней лапы. Некоторые соединения, полученные в соответствии со схемой 4, были подвергнуты исследованиям в соответствии с вышеописанными способами. В результате было установлено, что соединения формулы VI обладают хорошей антагонистической активностью относительно вещества Р, особенно хорошей активностью против нарушений ЦНС, при этом уровень побочного действия снижается.
Настоящее изобретение иллюстрируется следующими примерами. Однако подразумевается, что данное изобретение не ограничено конкретными подробностями приведенных примеров. Температуры плавления не подвергались коррекции. Спектры протонного ядерно-магнитного резонанса (1H ЯМР) и спектры13С ядерно-магнитного резонанса измеряют в растворах в дейтерохлороформе (CDCl3) или в CD3OD, или в CD3SOCD3, и пиковые значения указаны в миллионных долях (м.д.) по нисходящей от тетраметилсилана (TMS). Формы пиков обозначены следующим образом: c - синглет, д - дублет, т - триплет, к - квартет, м - мультиплет, уш - уширенный.
Получение 1
6-нитрогексан-3-он
К раствору этилвинилкетона (11,78 мл, 119 ммол, 1 экв.) и нитрометана (19,3 мл, 357 ммол, 3 экв.) в MeOH (30 мл, 3 об.) при температуре -30°С добавляют раствор метилата натрия в МеОН (4,6 М, 6,46 мл, 29,7 ммол, 0,25 экв.). Затем реакционную смесь нагревают до -10°С в течение 1,5 часов, гасят наполовину насыщенным раствором хлорида аммония (100 мл), а затем экстрагируют дихлорметаном (3×100 мл). Объединенную органическую фазу сушат над сульфатом натрия, концентрируют и затем отгоняют от толуола (2×100 мл) и МеОН (100 мл), получая, как показывает1H ЯМР, 15,2 г приблизительно 95% чистого 6-нитрогексан-3-она.
1H ЯМР (CDCl3) δ 4,32 (т, 2H, J=6,6 Гц), 2,46 (т, 2H, J=6,6 Гц), 2,32 (м, 2H), 2,12 (м, 2H), 0,92 (т, 3H, J=7,5 Гц).
Получение 2
7-нитрогептан-4-он
К раствору 1-гексен-3-она и нитрометана в МеОН при температуре -30°С добавляют раствор метилата натрия в МеОН. Затем реакционную смесь нагревают до -10°С в течение 1,5 часов, гасят наполовину насыщенным раствором хлорида аммония и затем экстрагируют дихлорметаном. Объединенную органическую фазу сушат над сульфатом натрия, концентрируют, а затем отгоняют от толуола и МеОН, получая 7-нитрогептан-4-он.
Пример 1
Цис-бензилиден-(5,5-диметокси-2-нитро-1-фенилгептил)амин
К раствору 6-нитрогексан-3-она (13,9 г, 95,7 ммол, 1 экв.) из примера получения 1 в МеОН (28 мл, 2 об.) и триметилортоформиата (28 мл, 2 об.) добавляют камфарсульфоновую кислоту (CSA, 1,11 г, 4,78 ммол, 0,05 экв.), и полученный раствор перемешивают при комнатной температуре в течение 30 минут. Затем добавляют раствор ацетата аммония (36,9 г, 478 ммол, 5 экв.) в МеОН (120 мл) и бензальдегида (19,5 мл, 191 ммол, 2 экв.), и раствор перемешивают при комнатной температуре. Приблизительно через 6 часов появляются кристаллы. Как показывает1H ЯMР, твердая фаза представляет собой 1:1смесь цис/транс-бензилиден-(5,5-диметокси-2-нитро-1-фенилгептил)амина. Затем реакционную смесь нагревают при 40°С в течение 7 часов. Вся твердая фаза представляет собой цис-бензилиден-(5,5-диметокси-2-нитро-1-фенилгептил)амин. Однако в фильтрате все еще присутствует смесь цис- и транс-соединений. Реакционную смесь охлаждают до 35°С и перемешивают в течение ночи, а затем охлаждают до 30°С в течение 4 часов и, наконец, до комнатной температуры. После перемешивания в течение выходных дней реакционную смесь охлаждают до 0°С. Продукт собирают фильтрацией, получая 24,3 г (66%) бензилиден-(5,5-диметокси-2-нитро-1-фенилгептил)амина только с цис-нитрофениловым стереохимическим составом. Вышеописанные стадии представлены в приведенной ниже таблице 1.
1Н ЯМР (CDCl3) δ 8,2 (с, 1Н), 7,72 (м, 1Н), 7,35 (м, 8Н), 5,03 (м, 1Н), 4,65 (д, 1Н, J=10 Гц), 3,04 (с, 3Н), 2,98 (с, 3Н), 1,50 (м, 4Н), 1,42 (м, 2Н), 0,65 (т, 3Н, J=7,5 Гц).
Пример 2
К раствору 7-нитрогептан-4-она из примера получения 2 в МеОН и триметилортоформиата добавляют камфарсульфоновую кислоту и полученный раствор перемешивают при комнатной температуре в течение 30 минут. Добавляют раствор ацетата аммония в МеОН и бензальдегид и раствор перемешивают при комнатной температуре в течение 6 часов. Затем реакционную смесь нагревают при 40°С в течение 7 часов. Реакционную смесь охлаждают до 35°С и перемешивают в течение ночи, затем охлаждают до 30°С в течение 4 часов и, наконец, до комнатной температуры. После перемешивания в течение выходных дней реакционную смесь охлаждают до 0°С. Продукт собирают фильтрацией, получая бензилиден-(5,5-диметокси-2-нитро-1-фенилоктил)амин с только цис-нитрофениловым стереохимическим составом.
Пример 3
К раствору 6-нитрогексан-3-она из примера получения 1 в МеОН (28 мл, 2 об.) и триметилортоформита добавляют камфарсульфоновую кислоту и полученный раствор перемешивают при комнатной температуре в течение 30 минут. Добавляют раствор ацетата аммония в МеОН и 4-хлорбензальдегид и раствор перемешивают при комнатной температуре в течение 6 часов. Затем реакционную смесь нагревают при 40°С в течение 7 часов. Реакционную смесь охлаждают до 35°С и перемешивают в течение ночи, затем охлаждают до 30°С в течение 4 часов и, наконец, до комнатной температуры. После перемешивания в течение выходных дней реакционную смесь охлаждают до 0°С. Продукт собирают фильтрацией, получая (4-хлорбензилиден)-[1-(4-хлорфенил)-5, 5-диметокси-2-нитрогептил]амина только с цис-нитрофениловым стереохимическим составом.
Пример 4
К раствору 6-нитрогексан-3-она из примера получения 1 в МеОН и триметилортоформиата добавляют камфарсульфоновую кислоту и полученный раствор перемешивают при комнатной температуре в течение 30 минут. Добавляют раствор ацетата аммония в МеОН и бензальдегида и раствор перемешивают при комнатной температуре в течение ночи. Затем реакционную смесь подвергают кипячению с обратным холодильником в течение 3-4 часов. Реакционную смесь охлаждают до 50°С в течение 8 часов, затем охлаждают до 30°С в течение 8 часов и, наконец, до комнатной температуры в течение 8 часов. После перемешивания в течение выходных дней реакционную смесь охлаждают до 0°С в течение часа. Продукт собирают фильтрацией, получая бензилиден-(5,5-диметокси-2-нитро-1-фенилгептил)амин только с цис-нитрофениловым стереохимическим составом.
Пример 5
К раствору 6-нитрогексан-3-она из примера получения 1 в изопропаноле и триметилортоформиате добавляют камфарсульфоновую кислоту и полученный раствор перемешивают при комнатной температуре в течение 30 минут. Добавляют раствор ацетата аммония в изопропаноле и бензальдегид и раствор перемешивают при комнатной температуре в течение 6 часов. Затем реакционную смесь нагревают до 40°С в течение 7 часов. Реакционную смесь охлаждают до 35°С и перемешивают в течение ночи, затем охлаждают до 30°С в течение 4 часов и, наконец, до комнатной температуры. После перемешивания в течение выходных дней реакционную смесь охлаждают до 0°С. Продукт собирают фильтрацией, получая бензилиден-(5, 5-диметокси-2-нитро-1-фенилгептил)амин только с цис-нитрофениловым стереохимическим составом.
ВЗАИМНОЕ ПРЕВРАЩЕНИЕ ЦИС-ТРАНС В ЧИСТЫЙ ЦИС
Реферат
Изобретение относится к способу получения чистого цис-изомера из смеси цис-транс-изомеров формулы (I), в которой Ar представляет собой фенил или нафтил, необязательно моно- или дизамещенный C1-5 алкилом, C1-5 алкокси, галогеном, трифторметилом, сложным эфиром или амидо, R представляет собой С1-5 алкил, где указанная формула I включает хиральный атом углерода C1 и смежный хиральный атом углерода С2 и где С2 присоединен к атому водорода и к сильной электрон-акцепторной группе G, выбранной из группы, включающей нитро, нитрозо, нитрил, цианато, изоцианато, нитрозамещенный арил, сульфонил и карбонил и где, по меньшей мере, один атом или группа, присоединенная к C1, отличается от атомов или групп, присоединенных к С2, который может быть использован в качестве промежуточного соединения при синтезе цис-изомеров бензамидпиперидиновых соединений, проявляющих активность в качестве антагонистов NK-1 рецептора. Способ включает стадии диспергирования смеси цис- и транс-изомеров формулы I в инертном растворителе, в котором указанный цис-изомер по существу менее растворим, чем указанный трансизомер, нагревания указанной дисперсии до полного растворения указанного транс-изомера и растворения, по меньшей мере, 10% мас. цис-изомера, поддерживания указанной стадии нагревания для обеспечения возможности взаимного превращения указанных цис- и транс-изомеров, охлаждения указанной смеси, тем самым, обеспечивая кристаллизацию цис-изомера, и отделения указанного кристаллического цис-изомера от указанного растворителя. 8 з.п. ф-лы, 1 табл., 1 ил.
Формула


Комментарии