2-амино-3-метил-гекс-5-еновая кислота и ее применение в производстве пептидов, таких как бацитрацины - RU2611006C2
Код документа: RU2611006C2
Чертежи




Описание
Область изобретения
Настоящее изобретение относится к новым аминокислотным соединениям.
Предшествующий уровень техники
Большинство белков состоит из 20 разных α-аминокислот: аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутамата, фенилаланина, глицина, гистидина, изолейцина, лизина, лейцина, метионина, пролина, серина, треонина, триптофана, тирозина и валина.
Однако существует много биологически активных пептидов, содержащих другие аминокислоты, такие как: гомоцистеин, орнитин, 4-гидроксипролин, 5-гидроксилизин, селеноцистеин, формилметионин, фосфосерин, ацетилсерин, метиларгинин и т.д.
Аминокислоты в D-конфигурации часто встречаются в нерибосомально синтезируемых бактериальных пептидах и редко в рибосомально синтезируемых белках. Например, аминокислотные остатки в положениях 4, 7, 9 и 11 в нерибосомально синтезируемых бацитрацинах обычно находятся в D-конфигурации (Glu, Orn, Phe и Asp).
Бацитрацины представляют собой пептидные антибиотики, продуцируемые в естественных условиях Bacillus subtilis и Bacillus licheniformis. Идентифицированы различные бацитрацины, среди которых бацитрацин А имеет первостепенное значение и является высокоактивным (Epperson and Ming, Biochemistry, vol.39, №14, 2000, page 4037-45). Первичная структура бацитрацина А представляет собой последовательность NH2-L-Ile1-L-тиазолин2-L-Leu3-D-Glu4-L-Ile5-L-Lys6-D-Orn7-L-Ile8-D-Phe9-L-His10-D-Asp11-L-Asn12-COOH, которая циклизуется через ε-аминогруппу L-Lys6 и R-карбоксильную группу L-Asn12.
Предшествующий уровень техники
Некоторые нерибосомально синтезируемые пептиды содержат необычные аминокислоты. Например, циклоспорин А содержит 2(S)-амино-3(R)-гидрокси-4(R)-метил-6(Е)-октановую кислоту, которая важна для связывания с внутриклеточным рецептором циклофилина и ввиду этого для его иммуносупрессорной активности (Offenzeller et al., Journal of Biological Chemistry, vol.268, №35, 1993).
Некоторые редко встречающиеся аминокислоты похожи по структуре на изолейцин:
- 2-амино-5-метил-5-гексеновая кислота, новый аналог метионина, была выделена из ферментационного бульона стрептомицетов (Takeuchi et al., Journal of Antibiotics, vol.32, №11, page 1118-1124, 1979);
- 4-метилен-норлейцин и 2-аминогепт-6-еновая кислота представляют собой соединения формулы: C7H13NO2;
- 4-метил-норлейцин представляет собой производное изолейцина, которое может быть введено в рекомбинантный белок (Muramatsu et al., J. Pharm. Biomed. Anal., vol.31, №5, 2003, page 979-987);
- 2-амино-3-метил-4-пентеновая кислота представляет собой ненасыщенный аналог изолейцина, который может быть введен в белки (Mock et al., Chembiochem., vol.7, №1, 2006, page 83-87);
- ненасыщенные норлейцины Amanita solitaria (мухомор одинокий). Химические и фармакологические исследования (Chilton et al., Lloydia, vol.36, №2, 1973, page 69-73);
- бета-метилнорлейцин, антиметаболит, продуцируемый Serratia marcescens (Sugiura et al., J. Antibiot., vol.34, №10, 1981, page 1278-82);
- в US 6168912 описываются различные аллильные производные аминокислот для применения в многомерной комбинаторной химической библиотеке;
- аллилглицин и кротилглицин описаны Kunz и соавт. в Journal of Bacteriology, vol.148, №1, 1981.
Сущность изобретения
Изобретение относится к соединению 2-амино-3-метил-гекс-6-еновой кислоте.
Хотя авторы изобретения используют название 2-амино-3-метил-гекс-5-еновая кислота, оно относится к этому же соединению, называемому 2-амино-3-метил-5-гексеновая кислота.
Структура этого аминокислотного соединения в его свободной форме представлена формулой I:
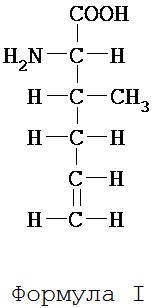

Формулу I не следует интерпретировать как проекцию Фишера, а скорее рассматривать как соединение без указания стереохимии.
Аминокислота формулы I содержит два хиральных атома углерода. Настоящее изобретение охватывает четыре стереоизомера 2-амино-3-метил-гекс-5-еновой кислоты:
(2S,3S)-2-амино-3-метил-гекс-5-еновую кислоту,
(2R,3S)-2-амино-3-метил-гекс-5-еновую кислоту,
(2S,3R)-2-амино-3-метил-гекс-5-еновую кислоту и
(2R,3R)-2-амино-3-метил-гекс-5-еновую кислоту.
Кроме того, настоящее изобретение охватывает соли и ионы 2-амино-3-метил-гекс-5-еновой кислоты.
Кроме того, настоящее изобретение охватывает амино-защищенные и карбокси-защищенные производные 2-амино-3-метил-гекс-5-еновой кислоты.
Авторы изобретения предлагают и используют название 5-метилен-изолейцин для 2-амино-3-метил-гекс-5-еновой кислоты. Соответственно, боковая цепь 5-метилен-изолейцина имеет структуру -СН(СН3)СН2СН=СН2, которая может быть представлена как:


Изобретение также относится к применению 5-метилен-изолейцина для получения бацитрацинов и к способу получения 5-метилен-изолейцина.
5-Метилен-изолейцин может быть использован для получения бацитрацина J1, бацитрацина J2, бацитрацина J3, бацитрацина К1, бацитрацина К2, бацитрацина К3 и бацитрацина L.
Эти аспекты изобретения могут быть обеспечены признаками, изложенными в следующем далее описании изобретения и/или в прилагаемой формуле изобретения.
Подробное описание изобретения
Некоторые очень активные бацитрацины содержат необычную аминокислотную боковую цепь, имеющую следующую структуру:


Авторы изобретения предложили и используют названия бацитрацин J, К или L для бацитрацинов, содержащих приведенную выше структуру. Структуры этих бацитрацинов представлены на Фиг.1A-G.
Определения
"Бацитрацины" представляют собой пептидные соединения, содержащие следующую структуру (с нумерацией аминокислотных остатков в виде верхнего индекса):

где Х представляет собой

и где R представляет собой боковую цепь остатка аминокислоты
изолейцина, валина или 5-метилен-изолейцина;
и где
Y и Z независимо представляют собой остаток аминокислоты
изолейцина, валина или 5-метилен-изолейцина;
и где
Thz представляет собой тиазолиновое кольцо

соединенное через положение 2’ с Х и через положение 4’ с α-углеродным атомом в Leu;
и где
Leu представляет собой остаток аминокислоты лейцина,
Glu представляет собой остаток глутаминовой аминокислоты,
Lys представляет собой остаток аминокислоты лизина, образующий пептидную связь с Y и Orn, в то время как его ε-аминогруппа соединена с α-карбоксильной группой аспарагина пептидной связью,
Orn представляет собой остаток аминокислоты орнитина,
Phe представляет собой остаток аминокислоты фенилаланина,
His представляет собой остаток аминокислоты гистидина,
Asp представляет собой остаток аспарагиновой аминокислоты,
Asn представляет собой остаток аминокислоты аспарагина, образующий пептидную связь с Asp, в то время как его α-карбоксильная группа соединена с ε-аминогруппой лизина пептидной связью.
Когда термин "бацитрацины" используется в данной заявке, это означает, что он охватывает любое соединение, имеющее приведенную выше первичную структуру, независимо от способа получения. Таким образом, термин "бацитрацины" включает в себя антибиотические соединения, продуцируемые в естественных условиях Bacillus licheniformis, но также продуцируемые in vitro (синтетические) соединения и полусинтетические соединения, имеющие приведенную выше первичную структуру. Также подразумевается, что термин "бацитрацины" охватывает любое соединение, имеющее приведенную выше первичную структуру, независимо от заряда, который изменяется с рН. Также подразумевается, что термин "бацитрацины" охватывает любое соединение, имеющее приведенную выше первичную структуру, независимо от стереохимии. Также подразумевается, что термин "бацитрацины" охватывает соли и гидраты соединений, имеющих приведенную выше первичную структуру.
Подразумевается, что фраза "бацитрацины, содержащие по меньшей мере один остаток 5-метилен-изолейцина", охватывает любой бацитрацин, содержащий структуру, которая могла бы образоваться, если остаток(ки) изолейцина или валина был(и) замещен(ы) остатком(ами) 5-метилен-изолейцина в положении 1, и/или 5, и/или 8.
Когда N-концевая аминогруппа и/или тиазолиновое кольцо бацитрацинов находится в окисленном состоянии, значительная доля антибактериальной активности теряется. Например, низкоактивное соединение бацитрацин F содержит кето-тиазольную группировку вместо амино-тиазолиновой группировки (Craig et al., J. Org. Chem., vol.22, 1957, page 1345-1353).
"Аминокислота" представляет собой любое соединение, содержащее как амино-, так и карбоксильную группу. Большинство белков построены в виде линейных полимеров из 20 разных стандартных α-аминокислот в L-конфигурации: аланина, аргинина, аспарагина, аспарагиновой кислоты, цистеина, глутамина, глутамата, фенилаланина, глицина, гистидина, изолейцина, лизина, лейцина, метионина, пролина, серина, треонина, триптофана, тирозина и валина.
Термин "аминокислотный остаток" относится к звену в пептиде и включает в себя:
-NH-CHR-COOH (С-концевой остаток),
или
NH2-CHR-CO- (N-концевой остаток), или
-NH-CHR-CO- (внутренний остаток),
где R представляет собой
-Н в глицине,
-СН3 в аланине,
-ОН в серине,
-CH2SH в цистеине,
-СН(СН3)СН2СН3 в изолейцине,
-СН2СН(СН3)2 в лейцине,
-СН(СН3)2 в валине
и т.д.
"Аминокислотная боковая цепь" представляет собой группу R "аминокислотного остатка". Например, группа R представляет собой
-СН(СН3)СН2СН3 в изолейцине,
-СН2СН(СН3)2 в лейцине,
-СН(СН3)2 в валине.
"Антибактериальная активность" представляет собой любой вид активности, которая:
ингибирует рост, метаболизм или размножение бактерий, или
повышает смертность бактерий, или
снижает патогенность бактерий.
Нумерация "положений" аминокислотных остатков в бацитрацинах начинается от N-концевого остатка, которым может быть изолейцин, валин или 5-метилен-изолейцин в положении 1 (левый конец на всех рисунках, изображающих бацитрацины в этой заявке). Следовательно, Lys находится в положении номер 6, a Asn находится в положении номер 12.
В бацитрацинах "положение 1" является особенным, потому что этот аминокислотный остаток частично входит в состав тиазолинового кольца. Таким образом, аминокислотный остаток в положении 1 в бацитрацинах не содержит обычной N-концевой единицы:

но вместо этого содержит:

"Композиция" представляет собой любую смесь, содержащую больше двух разных соединений. Например, смесь двух активных фармацевтических ингредиентов или смесь активного фармацевтического ингредиента и одного или более фармацевтических эксципиентов.
"Фармацевтическая композиция" представляет собой любую композицию, подходящую для применения in vivo. Следовательно, такие композиции могут быть нанесены на кожу, введены подкожно, внутривенно, парентерально, перорально и т.д.
5-Метилен-изолейцин содержит два хиральных атома углерода, которые могут независимо находиться в R- или S-конфигурации.
Бацитрацины, содержащие по меньшей мере один остаток 5-метилен-изолейцина в положении 1, 5 или 8, могут быть использованы для ингибирования нежелательного бактериального роста как in vitro, так и in vivo. Таким образом, эти соединения могут обладать терапевтическим эффектом при введении животному или человеку, имеющему бактериальную инфекцию.
Изобретение относится к соединению 5-метилен-изолейцину, которое может быть использовано для получения новых бацитрацинов, например в результате in vitro синтеза бацитрацина J1-3, К1-3 или L.
Бацитрацины с антибактериальной активностью могут быть получены в результате замены изолейцина или валина на 5-метилен-изолейцин в способах, описанных Lee и соавт. в J. Org. Chem., vol.61, №12, 1996, page 3983-3986 или WO 199747313.
Краткое описание графических материалов
На Фиг.1А показана структура бацитрацина с остатком 5-метилен-изолейцина в положении 5 (соответствует бацитрацину J1).
На Фиг.1В показана структура бацитрацина с остатком 5-метилен-изолейцина в положении 8 (соответствует бацитрацину J2).
На Фиг.1C показана структура бацитрацина с остатком 5-метилен-изолейцина в положении 1 (соответствует бацитрацину J3).
На Фиг.1D показана структура бацитрацина с остатком 5-метилен-изолейцина в положениях 5 и 8 (соответствует бацитрацину К1).
На Фиг.1Е показана структура бацитрацина с остатком 5-метилен-изолейцина в положениях 1 и 5 (соответствует бацитрацину К2).
На Фиг.1F показана структура бацитрацина с остатком 5-метилен-изолейцина в положениях 1 и 8 (соответствует бацитрацину К3).
На Фиг.1G показана структура бацитрацина с остатком 5-метилен-изолейцина в положениях 1, 5 и 8 (соответствует бацитрацину L).
На Фиг.2 показан путь продуцирования 5-метилен-изолейцина, как изложено в разделе Примеры.
Объем притязаний изобретения определяется формулой изобретения, а не приведенными далее иллюстративными примерами.
Примеры
Пример 1
Метиловый эфир (2S,3R)-2-(1,3-диоксо-1,3-дигидро-изоиндол-2-ил)-3-метил-гекс-5-еновой кислоты и метиловый эфир (2S,3S)-2-(1,3-диоксо-1,3-дигидро-изоиндол-2-ил)-3-метил-гекс-5-еновой кислоты
Бромид винилмагния в THF (1,0 М; 83,64 мл; 83,64 ммоль) добавляют к предварительно охлажденной (-10°С) смеси метилового эфира (2S,3S)- и (2S,3R)-4-йод-N-фталоилвалина (26,96 г; 69,68 ммоль), CuCl2 (0,47 г; 3,5 ммоль), безводного LiCl (0,29 г; 7,0 ммоль) в THF (100 мл). Реакционную смесь перемешивают в течение ночи при этой температуре. Реакционную смесь добавляют к насыщенному раствору хлорида аммония (водн.) (300 мл). Фазы разделяют и водную фазу экстрагируют диэтиловым эфиром (3×100 мл). Объединенные органические фазы промывают насыщенным рассолом (100 мл), сушат (MgSO4) и растворители удаляют при пониженном давлении. Выделяют 10 г смеси продуктов. (2S,3S)- и (2S,3R)-продукты разделяют колоночной хроматографией.
Пример 2
(2S,3R)-2-Амино-3-метил-гекс-5-еновая кислота
Метиловый эфир (2S,3R)-2-(1,3-диоксо-1,3-дигидро-изоиндол-2-ил)-3-метил-гекс-5-еновой кислоты (2,01 г; 7,00 ммоль) растворяют в смеси 6 н. соляной кислоты и ледяной уксусной кислоты (2:1; 62,5 мл) и раствор нагревают при температуре дефлегмации в течение 4 ч. Раствор охлаждают до комнатной температуры и концентрируют при пониженном давлении. Продукт переносят в воду и раствор фильтруют. Фильтрат концентрируют при пониженном давлении и остаток растворяют в воде, затем раствор наносят на колонку с катионообменной смолой amberlite IR 120 (в NH4+-форме). Колонку промывают водой (2,5 л), затем элюируют водным раствором аммиака (2,5 л). Элюат кипятят до тех пор, пока не перестает регистрироваться аммиак, затем концентрируют при пониженном давлении, получая указанное в заголовке соединение (0,5 г; 3,50 ммоль).
Пример 3
(2S,3S)-2-Амино-3-метил-гекс-5-еновая кислота
Метиловый эфир (2S,3S)-2-(1,3-диоксо-1,3-дигидро-изоиндол-2-ил)-3-метил-гекс-5-еновой кислоты (2,01 г; 7,00 ммоль) растворяют в смеси 6 н. соляной кислоты и ледяной уксусной кислоты (2:1; 62,5 мл) и раствор нагревают при температуре дефлегмации в течение 4 ч. Раствор охлаждают до комнатной температуры и концентрируют при пониженном давлении. Продукт переносят в воду и раствор фильтруют. Фильтрат концентрируют при пониженном давлении и остаток растворяют в воде, затем раствор наносят на колонку с катионообменной смолой amberlite IR 120 (в NH4+-форме). Колонку промывают водой (2,5 л), затем элюируют водным раствором аммиака (2,5 л). Элюат кипятят до тех пор, пока не перестает регистрироваться аммиак, затем концентрируют при пониженном давлении, получая указанное в заголовке соединение (0,5 г; 3,50 ммоль).
Пример 4
Метиловый эфир (2R,3R)-2-(1,3-диоксо-1,3-дигидро-изоиндол-2-ил)-3-метил-гекс-5-еновой кислоты и метиловый эфир (2R,3S)-2-(1,3-диоксо-1,3-дигидро-изоиндол-2-ил)-3-метил-гекс-5-еновой кислоты
Бромид винилмагния в THF (1,0 М; 83,64 мл; 83,64 ммоль) добавляют к предварительно охлажденной (-10°С) смеси метилового эфира (2S,3S)- и (2S,3R)-4-йод-N-фталоилвалина (26,96 г; 69,68 ммоль), CuCl2 (0,47 г; 3,5 ммоль), безводного LiCl (0,29 г; 7,0 ммоль) в THF (100 мл). Реакционную смесь перемешивают в течение ночи при этой температуре. Реакционную смесь добавляют к насыщенному раствору хлорида аммония (водн.) (300 мл). Фазы разделяют и водную фазу экстрагируют диэтиловым эфиром (3×100 мл). Объединенные органические фазы промывают насыщенным рассолом (100 мл), сушат (MgSO4) и растворители удаляют при пониженном давлении. Выделяют 10 г смеси продуктов. (2R,3S)- и (2R,3R)-продукты разделяют колоночной хроматографией.
Пример 5
(2R,3R)-2-Амино-3-метил-гекс-5-еновая кислота
Метиловый эфир (2R,3R)-2-(1,3-диоксо-1,3-дигидро-изоиндол-2-ил)-3-метил-гекс-5-еновой кислоты (2,01 г; 7,00 ммоль) растворяют в смеси 6 н. соляной кислоты и ледяной уксусной кислоты (2:1; 62,5 мл) и раствор нагревают при температуре дефлегмации в течение 4 ч. Раствор охлаждают до комнатной температуры и концентрируют при пониженном давлении. Продукт переносят в воду и раствор фильтруют. Фильтрат концентрируют при пониженном давлении и остаток растворяют в воде, затем раствор наносят на колонку с катионообменной смолой amberlite IR 120 (в NH4+-форме). Колонку промывают водой (2,5 л), затем элюируют водным раствором аммиака (2,5 л). Элюат кипятят до тех пор, пока не перестает регистрироваться аммиак, затем концентрируют при пониженном давлении, получая указанное в заголовке соединение (0,5 г; 3,50 ммоль).
Пример 6
(2R,3S)-2-Амино-3-метил-гекс-5-еновая кислота
Метиловый эфир (2R,3S)-2-(1,3-диоксо-1,3-дигидро-изоиндол-2-ил)-3-метил-гекс-5-еновой кислоты (2,01 г; 7,00 ммоль) растворяют в смеси 6 н. соляной кислоты и ледяной уксусной кислоты (2:1; 62,5 мл) и раствор нагревают при температуре дефлегмации в течение 4 ч. Раствор охлаждают до комнатной температуры и концентрируют при пониженном давлении. Продукт переносят в воду и раствор фильтруют. Фильтрат концентрируют при пониженном давлении и остаток растворяют в воде, затем раствор наносят на колонку с катионообменной смолой amberlite IR 120 (в NH4+-форме). Колонку промывают водой (2,5 л), затем элюируют водным раствором аммиака (2,5 л). Элюат кипятят до тех пор, пока не перестает регистрироваться аммиак, затем концентрируют при пониженном давлении, получая указанное в заголовке соединение (0,5 г; 3,50 ммоль).
Реферат
Изобретение относится к 2-амино-3-метил-гекс-5-еновой кислоте, которая может найти применение для получения пептидов, таких как бацитрацины, обладающих антибактериальной активностью. Изобретение относится также к способу получения 2-амино-3-метил-гекс-5-еновой кислоты и ее применению для синтеза бацитрацинов. 3 н. и 5 з.п. ф-лы, 2 ил., 6 пр.

Комментарии