Способ синтеза производных амино-метилтетралина - RU2512285C2
Код документа: RU2512285C2
Описание
Настоящее изобретение относится к способам получения замещенных индановых и тетралиновых соединений, которые являются полезными для улучшения когнитивной памяти у пациентов и для лечения различных заболеваний центральной нервной системы.
Действия 5-гидрокситриптамина (5-НТ) в качестве основного модуляторного нейротрансмиттера в головном мозге опосредованы несколькими семействами рецепторов: 5-HT1, 5-HT2, 5-НТ3, 5-HT4, 5-HT5, 5-HT6 и 5-HT7. Высокий уровень мРНК рецептора 5-HT6 в головном мозге дает основание утверждать, что рецептор 5-HT6 может быть вовлечен в патологию и лечение расстройств центральной нервной системы. В частности, идентифицированы 5-HT2-селективные и 5-HT6-селективные лиганды, потенциально полезные в лечении некоторых расстройств ЦНС, таких как болезнь Паркинсона, болезнь Гентингтона, тревожность, депрессия, маниакальная депрессия, психозы, эпилепсия, обсессивно-компульсивные расстройства, аффективные расстройства, мигрень, болезнь Альцгеймера (улучшение когнитивной памяти), нарушения сна, расстройства приема пищи, такие как анорексия, булимия и ожирение, острые тревожные состояния с реакцией паники, акатизия, синдром дефицита внимания и гиперактивности (СДВГ), синдром дефицита внимания (СДВ), абстиненция, обусловленная лекарственной и наркотической зависимостью, например, от кокаина, этанола, никотина и бензодиазепинов, шизофрения, а также расстройств, ассоциированных с травмой позвоночника и/или травмой головы, таких как гидроцефалия. Ожидается, что такие соединения также будут полезны в лечении некоторых желудочно-кишечных (ЖК) расстройств, таких как функциональное расстройство кишечника. См., например, B.L.Roth et al., J. Pharmacol. Exp. Ther., 1994, 268, pages 1403-14120, D.R.Sibley et al., Mol. Pharmacol., 1993, 43, 320-327, A.J.Sleight et al., Neurotransmission, 1995, 11, 1-5 и А.J.Sleight et al., Serotonin ID Research Alert, 1997,2(3), 115-8.
Поскольку в настоящее время известно лишь небольшое количество 5-НТ6- и 5-HT2A-модуляторов, продолжает существовать необходимость в соединениях, которые являются полезными в модулировании рецептора 5-НТ6, рецептора 5-НТ2А или обоих рецепторов.
В изобретении предложен способ получения соединений Формулы k1 или k2

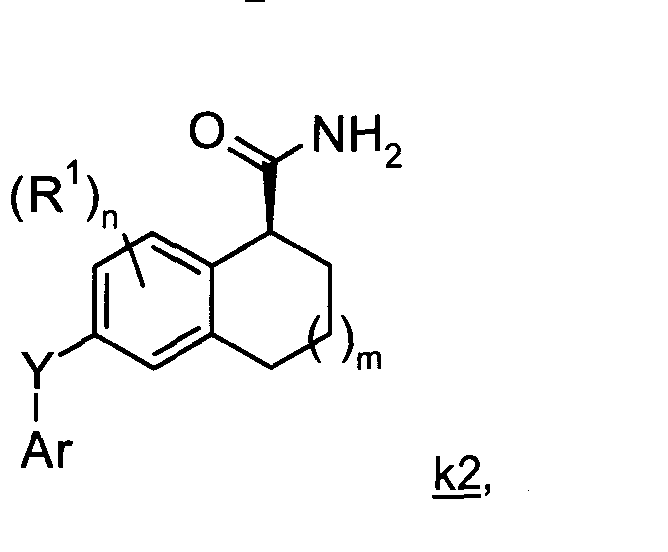
где m имеет значение 0 или 1;n имеет значение от 0 до 3;
Ar представляет собой арил или гетероарил, каждый из которых может быть
возможно замещенным и иметь в качестве заместителей
галогено, С1-6алкил, C1-6алкокси, циано, гидрокси, C1-6алкилсульфонил или
галогено-С1-6алкил;
Y представляет собой -O-, -S(O)p- или -N-Ra, где p имеет значение от 0 до 2 и Ra
представляет собой атом водорода или C1-6алкил; и R1 представляет собой галогено; С1-6алкил, С1-6алкокси или галогено-С1-6алкил;
включающий восстановление дигидронафталинового амида Формулы i

газообразным водородом в присутствии рутениевого катализатора Формулы j1 или j2


где D представляет собой возможно хиральный диамин;
каждый из Е и Е' представляют собой галогено, или Е представляет собой атом
водорода и Е' представляет собой BH4;
L представляет собой хиральный дифосфиновый лиганд; и
Z представляет собой галогено или Rb-CO2-(карбоксилат), где Rb представляет собой: С1-6алкил, галогено-С1-6алкил, C1-6алкокси, арил, возможно имеющий в качестве заместителей атом галогена, или гетероарил возможно имеющий в качестве заместителей атом галогена.
Данный способ является полезным для получения соединений, которые являются эффективными модуляторами рецептора 5-HT6. Также раскрыты соединения, полезные в качестве промежуточных соединений для способа согласно изобретению.
Если не указано иное, следующие термины, используемые в данной заявке, включая описание изобретения и формулу изобретения, имеют определения, приведенные ниже. Следует отметить, что в описании изобретения и прилагаемой формуле изобретения формы единственного числа включают формы множественного числа соответствующих объектов, если из контекста ясно не следует обратное.
"Алкил" означает одновалентную насыщенную углеводородную группировку с нормальной или разветвленной цепью, состоящую только из атомов углерода и водорода и содержащую от одного до двенадцати атомов углерода.
"Низший алкил" означает алкильную группу, содержащую от одного до шести атомов углерода, то есть С1-С6алкил. Примеры алкильных групп включают метил, этил, пропил, изопропил, изобутил, втор-бутил, трет-бутил, пентил, н-гексил, октил, додецил и тому подобное, но не ограничены ими.
"Алкилен" означает двухвалентный насыщенный углеводородный радикал с нормальной цепью, содержащий от одного до шести атомов углерода, или двухвалентный насыщенный углеводородный радикал с разветвленной цепью, содержащий от трех до шести атомов углерода, например метилен, этилен, 2,2-диметилэтилен, пропилен, 2-метилпропилен, бутилен, пентилен и тому подобное.
"Алкокси" означает группировку формулы -OR, где R представляет собой алкильную группировку, такую, как определено в данном описании. Примеры алкокси-группировок включают метокси, этокси, изопропокси и тому подобное, но не ограничены ими.
"Алкилсульфонил" означает группировку формулы -R'-R”, где R' представляет собой -SO2- и R” представляет собой алкил, такой, как определено в данном описании.
"Алкиламино" означает группировку формулы -NR-R', где R представляет собой атом водорода или алкил и R' представляет собой алкил, такой, как определено в данном описании.
"Арил" означает одновалентную циклическую ароматическую углеводородную группировку, состоящую из моно-, би- или трициклического ароматического кольца. Арильная группа может быть возможно замещенной в соответствии с тем, как определено в данном описании. Примеры арильных группировок включают возможно замещенные фенил, нафтил, фенантрил, флуоренил, инденил, пенталенил, азуленил, оксидифенил, бифенил, метилендифенил, аминодифенил, дифенилсульфидил, дифенилсульфонил, дифенилизопропилиденил, бензодиоксанил, бензофуранил, бензодиоксилил, бензопиранил, бензоксазинил, бензоксазинонил, бензопиперадинил, бензопиперазинил, бензопирролидинил, бензоморфолинил, метилендиоксифенил, этилендиоксифенил и тому подобное, включая их частично гидрогенизированные производные, но не ограничены ими. Предпочтительными арилами являются фенил и нафтил, более предпочтительно фенил, которые могут быть возможно замещенными, как определено ниже.
"Циклоалкил" означает одновалентную насыщенную карбоциклическую группировку, состоящую из моно- или бициклических колец. Циклоалкил может быть возможно замещенным и иметь один или более заместителей, каждый из которых независимо представляет собой гидрокси, алкил, алкокси, галогено, галогеноалкил, амино, моноалкиламино или диалкиламино, если особо не указано иное. Примеры циклоалкильных группировок включают циклопропил, циклобутил, цикпопентил, циклогексил, цикпогептил и тому подобное, включая их частично ненасыщенные производные, но не ограничены ими.
"Циклоалкилалкил" означает группировку формулы -R'-R”, где R” представляет собой алкилен и R” представляет собой циклоалкил, такие, как определено в данном описании.
"Гетероалкил" означает алкильный радикал, такой, как определено в данном описании, у которого один, два или три атома водорода заменены заместителем, независимо выбранным из группы, состоящей из -ORa, -NRbRc и -S(O)nRd (где n представляет собой целое число от 0 до 2), при условии, что присоединение данного гетероалкильного радикала происходит через атом углерода, где Raпредставляет собой атом водорода, ацил, алкил, циклоалкил или циклоалкилалкил; Rb и Rc независимо друг от друга представляют собой атом водорода, ацил, алкил, циклоалкил или циклоалкилалкил; и, когда n имеет значение 0, Rd представляет собой атом водорода, алкил, циклоалкил или циклоалкилалкил, и, когда n имеет значение 1 или 2, Rd представляет собой алкил, циклоалкил, циклоалкилалкил, амино, ациламино, моноалкиламино или диалкиламино. Типичные примеры включают 2-гидроксиэтил, 3-гидроксипропил, 2-гидрокси-1-гидроксиметилэтил, 2,3-дигидроксипропил, 1-гидроксиметилэтил, 3-гидроксибутил, 2,3-дигидроксибутил, 2-гидрокси-1-метилпропил, 2-аминоэтил, 3-аминопропил, 2-метилсульфонилэтил, аминосульфонилметил, аминосульфонилэтил, аминосульфонилпропил, метиламиносульфонилметил, метиламиносульфонилэтил, метиламиносульфонилпропил и тому подобное, но не ограничены ими.
"Гетероарил" означает моноциклический или бициклический радикал, содержащий от 5 до 12 кольцевых атомов и имеющий по меньшей мере одно ароматическое кольцо, содержащее один, два, или три кольцевых гетероатома, выбранные из N, О или S, а в качестве остальных кольцевых атомов С, при условии, что точка присоединения данного гетероарильного радикала находится на ароматическом кольце. Гетероарильное кольцо может быть возможно замещенным в соответствии с тем, как определено в данном описании. Примеры гетероарильных группировок включают возможно замещенные имидазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, оксадиазолил, тиадиазолил, пиразинил, тиенил, бензотиенил, тиофенил, фуранил, пиранил, пиридил, пирролил, пиразолил, пиримидил, хинолинил, изохинолинил, бензофурил, бензотиофенил, бензотиопиранил, бензимидазолил, бензооксазолил, бензооксадиазолил, бензотиазолил, бензотиадиазолил, бензопиранил, индолил, изоиндолил, триазолил, триазинил, хиноксалинил, пуринил, хиназолинил, хинолизинил, нафтиридинил, птеридинил, карбазолил, азепинил, диазепинил, акридинил и тому подобное, включая их частично гидрогенизированные производные, но не ограничены ими.
Термины "галогено", "галоген" и "галогенид", которые могут быть использованы взаимозаменяемо, относятся к заместителям фтор, хлор, бром или иод.
"Галогеноалкил" означает алкил, такой, как определено в данном описании, у которого один или более атомов водорода заменены одинаковыми или разными атомами галогена. Типичные галогеноалкилы включают -CH2Cl, -CH2CF3, -CH2CCl3, перфторалкил (например, -CF3) и тому подобное.
"Галогеноалкокси" означает группировку формулы -OR, где R представляет собой галогеноалкильную группировку, такую, как определено в данном описании. Типичным галогеноалкокси является дифторметокси.
"Гидроксиалкил" означает алкильную группировку, такую, как определено в данном описании, имеющую в качестве заместителей одну или более чем одну гидроксильную группу, предпочтительно одну, две или три гидроксильные группы, при условии, что один атом углерода не имеет более одной гидроксильной группы. Типичные примеры включают гидроксиметил, 2-гидроксиэтил, 2-гидроксипропил, 3-гидроксипропил, 1-(гидроксиметил)-2-метилпропил, 2-гидроксибутил, 3-гидроксибутил, 4-гидроксибутил, 2,3-дигидроксипропил, 2-гидрокси-1-гидроксиметилэтил, 2,3-дигидроксибутил, 3,4-дигидроксибутил и 2-(гидроксиметил)-3-гидроксипропил, но не ограничены ими.
"Полярный апротонный растворитель" означает растворитель, содержащий молекулы, имеющие полярные группы, но без подвижных протонов. Типичные полярные апротонные растворители включают, без ограничения, диметил формамид, ацетонитрил, диметилсульфоксид, N,N-диметил ацетамид, N-метил пирролидинон, тетрагидрофуран, диоксан, этилацетат, тетрагидропиран, пиридин, ацетон, 2-пропанон, 2-бутанон, диметиловый эфир этиленгликоля, метиленхлорид, хлороформ и тому подобное.
"Мочевина" или "уреидо" означает группу формулы -NR'-C(O)-NR"R'", где каждый из R', R” и R''' независимо представляет собой атом водорода или алкил.
"Карбокси" означает группу формулы -O-С(O)-ОН.
Термин "возможно замещенный", когда его используют в сочетании с "арилом", фенилом", "гетероарилом", "циклоалкилом" или "анилином", означает арил, фенил, гетероарил, циклогексил или анилин, каждый из которых возможно имеет 1-4 заместителя, предпочтительно один или два заместителя, независимо выбранные из алкила, циклоалкила, циклоалкилалкила, гетероалкила, гидроксиалкила, галогено, нитро, циано, гидрокси, алкокси, амино, ациламино, моно-алкиламино, ди-алкиламино, галогеноалкила, галогеноалкокси, гетероалкила, -COR (где R представляет собой атом водорода, алкил, фенил или фенилалкил), -(CR'R”)n-COOR (где n представляет собой целое число от 0 до 5, R' и R” независимо представляют собой атом водорода или алкил и R представляет собой атом водорода, алкил, циклоалкил, циклоалкилалкил, фенил или фенилалкил) или -(CR'R”)n-CONRaRb (где n представляет собой целое число от 0 до 5, R' и R” независимо представляют собой атом водорода или алкил и Ra и Rb независимо друг от друга представляют собой атом водорода, алкил, циклоалкил, циклоалкилалкил, фенил или фенилалкил). Некоторые предпочтительные возможные заместители "арила", фенила", "гетероарила" или "циклоалкила" включают алкил, галогено, галогеноалкил, алкокси, циано, амино и алкилсульфонил. Более предпочтительными заместителями являются метил, атом фтора, атом хлора, трифторметил, метокси, амино и метансульфонил.
Термин "уходящая группа" имеет значение, которое обычно связано с ним в химии органического синтеза, то есть означает атом или группу, замещаемые в условиях реакции замещения. Примеры уходящих групп включают атом галогена, алкан- или ариленсульфонилокси, такой как метансульфонилокси, этансульфонилокси, тиометил, бензолсульфонилокси, тозилокси и тиенилокси, дигалогенофосфиноилокси, возможно замещенный бензилокси, изопропилокси, ацилокси и тому подобное, но не ограничены ими. Предпочтительными примерами уходящей группы являются галогено, H2N- или СН3СОО-. Особенно предпочтительными являются хлорид, H2N- или СН3СОО-.
"Модулятор" означает молекулу, которая взаимодействует с мишенью. Эти взаимодействия включают взаимодействие агониста, антагониста, таких, как определено в данном описании, и тому подобное, но не ограничены ими.
Термин "возможный" или "возможно" означает, что последующее описанное событие или условие может не обязательно иметь место, и что данное описание включает случаи, когда это событие или условие имеет место, и случаи, когда оно не имеет места.
"Заболевание" и "болезненное состояние" означают любое заболевание, состояние, симптом, расстройство или показание.
Подразумевается, что значение термина "раствор" в контексте данного описания включает жидкости, где реагент или реактант присутствует в растворителе в растворенной форме (как растворенное вещество) или присутствует в виде частиц, в нерастворенной форме, или в той и другой форме. Соответственно, предполагается, что в "растворе" растворенное вещество может быть растворено не полностью и твердое растворенное вещество может присутствовать в форме дисперсии или суспензии. Соответственно, подразумевается, что "раствор" конкретного реагента или реактанта включает суспензии и дисперсии, а также растворы такого реагента или реактанта. Термины "раствор" и "суспензия" в данном описании могут быть использованы взаимозаменяемо.
Подразумевается, что значение термина "растворитель" в контексте данного описания включает жидкости, которые полностью растворяют реагент или реактант, помещенный в растворитель, а также жидкости, которые лишь частично растворяют реагент или реактант или которые действуют как диспергаторы в отношении реагента или реактанта. Соответственно, подразумевается, что, когда в "растворителе" проводят конкретную реакцию, некоторые или все присутствующие реагенты или реактанты могут не находиться в растворенной форме.
Термин "субъект" означает млекопитающих и немлекопитающих. Млекопитающее означает любого представителя класса млекопитающих, включая без ограничения человека; приматов, не относящихся к человеку, таких как шимпанзе и другие виды обезьян и мартышек; сельскохозяйственных животных, таких как крупный рогатый скот, лошади, овцы, козы и свиньи; домашних животных, таких как кролики, собаки и кошки; лабораторных животных, включая грызунов, таких как крысы, мыши и морские свинки; и тому подобное. Примеры немлекопитающих включают птиц и тому подобное, но не ограничены ими. Термин "субъект" не указывает на конкретный возраст или пол.
Термины "такой, как определено выше" и "такой, как определено в данном описании", когда они относятся к переменной, включают посредством ссылки более широкое определение данной переменной, а также предпочтительные, более предпочтительные и наиболее предпочтительные определения, если таковые имеются.
"Лечение" или "терапия" болезненного состояния включает:
предупреждение болезненного состояния, то есть осуществление воздействия, не позволяющего клиническим симптомам болезненного состояния развиваться у субъекта, который может быть подвержен болезненному состоянию или предрасположен к нему, но еще не испытывает или не проявляет симптомов болезненного состояния;
ингибирование болезненного состояния, то есть остановку развития болезненного состояния или его клинических симптомов; или
облегчение болезненного состояния, то есть осуществление временной или постоянной ремиссии болезненного состояния или его клинических симптомов.
Термины "обработка", "приведение в контакт" и "взаимодействие", когда они относятся к химической реакции, означают добавление или смешивание двух или более реагентов в подходящих условиях с получением указанного и/или желаемого продукта. Следует принимать во внимание то, что реакция, которая дает указанный и/или желаемый продукт, может не обязательно являться результатом непосредственного объединения двух реагентов, которые были первоначально добавлены, то есть может существовать одно или более чем одно промежуточное соединение, которое образуется в данной смеси, что, в конечном счете, приводит к образованию указанного и/или желаемого продукта.
В общем случае, номенклатура, используемая в данной заявке, основана на AUTONOM™ v.4.0, компьютеризованной системе Beilstein Institute для генерирования систематической номенклатуры IUPAC. Химические структуры, приведенные в данном описании, были получены с использованием ISIS® версия 2.2. Любая открытая валентность, присутствующая у атома углерода, кислорода или азота в структурах, приведенных в данном описании, указывает на присутствие атома водорода. В тех случаях, когда в структуре присутствует хиральный центр, но не показана характерная стереохимия, структура включает оба стереоизомера, ассоциированные с данным хиральным центром.
В заявке на патент США №11/315706, поданной 21 декабря 2005 г. и опубликованной как US 20060167255, и в заявке на патент США №11/280712, поданной 20 июня 2007 г. и опубликованной как US 20080015256, описания которых включены в данную заявку посредством ссылки, раскрыты соединения, эффективные в качестве модуляторов рецепторов 5-НТ6 и 5-HT2A, и применения данных соединений в лечении заболеваний ЦНС. В данном изобретении предложены способы, полезные для получения таких соединений, и химические промежуточные соединения, полезные для таких способов.
Для более полного понимания способ по изобретению описан посредством ссылки на Схему А, приведенную ниже, где R представляют собой C1-6алкил и могут быть одинаковыми или разными в каждом случае;
Х представляют собой уходящую группу и могут быть одинаковыми или разными в каждом случае;
m имеет значение 0 или 1;
n имеет значение от 0 до 3;
Ar представляет собой: арил или гетероарил, каждый из которых может быть возможно замещенным и иметь в качестве заместителей галогено, C1-6алкил, C1-6алкокси, циано, гидрокси, С1-6алкилсульфонил или галогено-С1-6алкил;
Y представляет собой -O-; -S(O)p- или -N-Ra, где р имеет значение от 0 до 2 и Ra представляет собой атом водорода или С1-6алкил;
D представляет собой возможно хиральный диамин;
каждый из Е и Е' представляет собой галогено, или Е представляет собой атом водорода и Е' представляет собой ВН4;
L представляет собой хиральный дифосфиновый лиганд, такой, как описано дополнительно ниже;
Z представляет собой галогено или Rb-CO2-(карбоксилат), где Rb представляет собой C1-6алкил, галогено-С1-6алкил, С1-6алкокси, арил, возможно имеющий в качестве заместителей атом галогена, или гетероарил, возможно имеющий в качестве заместителей атом галогена;
R1 представляет собой галогено, C1-6алкил, C1-6алкокси или галогено-С1-6алкил; и R2 представляет собой -C(O)-Rc или -SO2-Rc, где Rc представляет собой C1-6алкил
или -NRdRe, где каждый из Rd и Re независимо представляет собой атом водорода или С1-6алкил.
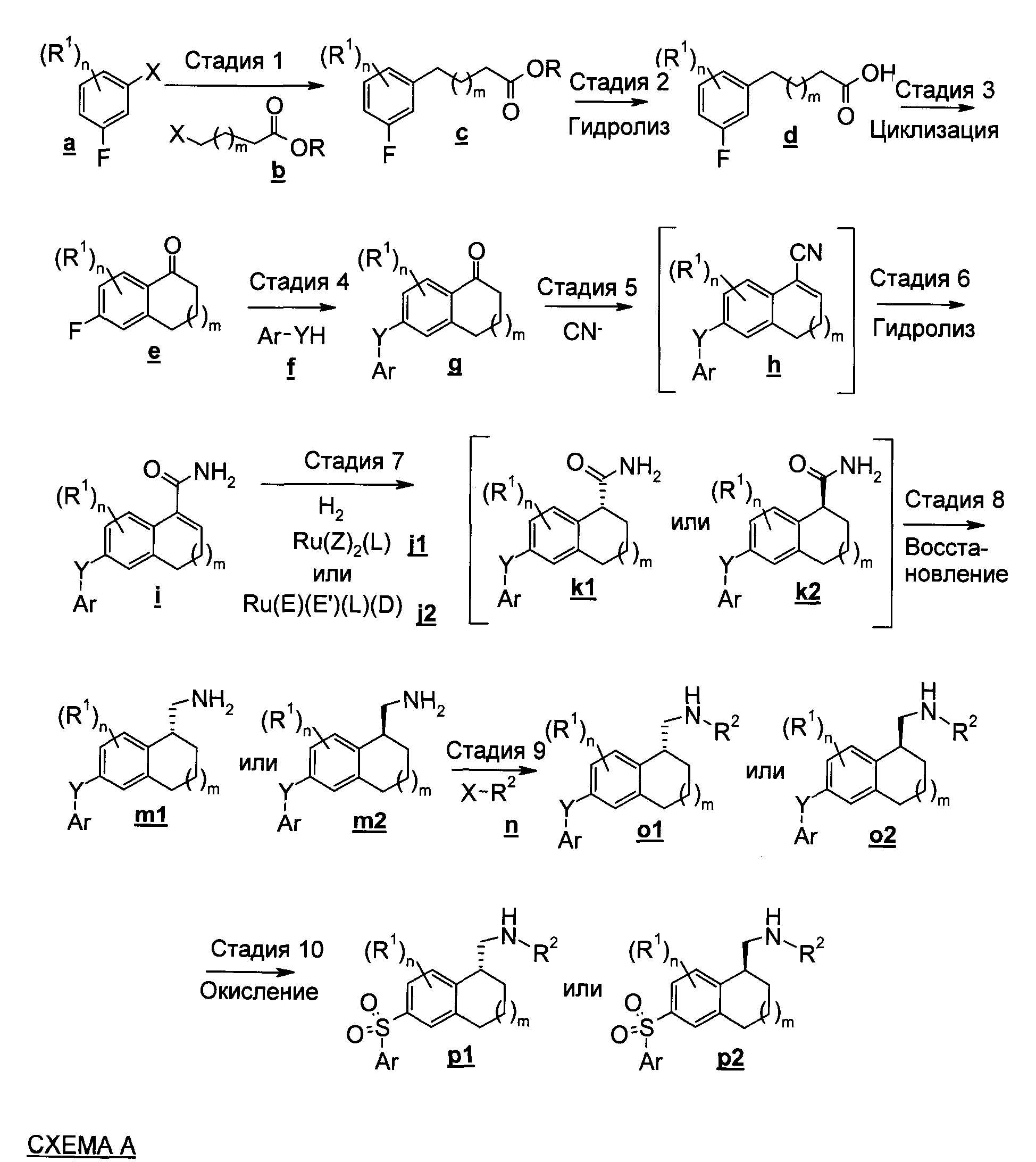
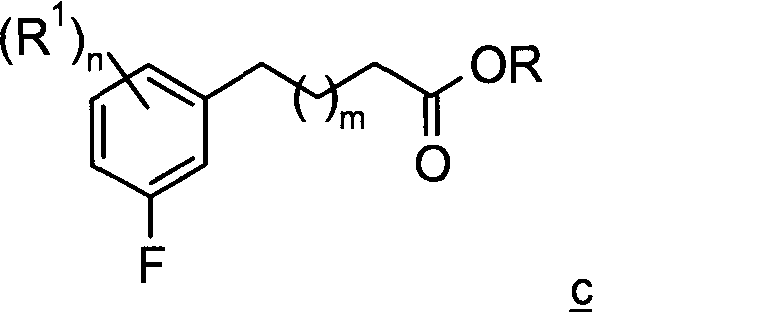
На стадии 1 Схемы А фторфенильное соединение а подвергают взаимодействию со сложноэфирным соединением b с получением фенил-алкил-карбоновой кислоты эфира с. Согласно вариантам воплощения изобретения, где m=0, сложноэфирное соединение b представляет собой пропионат, согласно вариантам воплощения изобретения, где m=1, соединение b представляет собой бутират. R представляет собой предпочтительно метил или этил. Реакция алкилирования на стадии 1 может быть выполнена, например, в полярном апротонном растворителе, например в растворе, содержащем NMP (N-метилпирролидинон). Данная реакция может быть выполнена в присутствии цинка и иода с образованием промежуточного цинката (не показано). Кроме того, реакция может быть выполнена в присутствии фосфинилNi(II)-катализатора, такого как бис(трифенилфосфин)Ni(II) хлорид.
На стадии 2 сложноэфирное соединение с подвергают гидролизу с получением фенил-алкил-карбоновой кислоты d. Данный гидролиз можно проводить, например, в водных условиях в присутствии основания, такого как NaOH, с получением соответствующего карбоксилата (не показано), который затем может быть обработан кислотой с получением соответствующей карбоновой кислоты d.
На стадии 3 выполняют реакцию циклизации. Соединение d подвергают внутренней циклизации в водном растворе кислоты с получением циклического кетона е. Согласно многим вариантам воплощения изобретения реакция на стадии 3 может быть эффективно выполнена в концентрированной H2SO4. Когда m=0, циклизация на стадии 3 приводит к образованию инданового соединения (не показано), когда m=1 циклизация приводит к образованию тетралинового соединения, как показано на схеме.
На стадии 4 тетралоновое соединение е подвергают взаимодействию с нуклеофильным арильным соединением f с получением арил-замещенного тетралона а. Соединение f может включать, например, анилиновое соединение, фенольное соединение или тиофенольное соединение. Реакцию на стадии 4 можно проводить в полярном апротонном растворителе с использованием NMP или аналогичного растворителя.
На стадии 5 циклический кетон g обрабатывают цианидом с получением дигидронафталин-карбонитрильного соединения h. Реакцию на стадии 5 можно проводить в неполярном растворителе, таком как толуол. В качестве источника цианата на стадии 5 может быть использован триметилсилилцианид (TMSCN). Данная реакция может быть выполнена в присутствии AlCl3. Согласно некоторым вариантам воплощения изобретения нет необходимости в выделении карбонитрильного соединения h, и, соответственно, соединение h на схеме заключено в квадратные скобки.
На стадии 6 дигидронафталин-карбонитрильное соединение h гидролизуют с получением соответствующего дигидронафталинового амида i. Гидролиз может быть выполнен с использованием серной кислоты в водных условиях. Как указано выше, согласно некоторым вариантам воплощения изобретения нет необходимости в выделении нитрильного соединения h, и поэтому стадии 5 и 6 можно проводить в одном и том же реакционном сосуде.
На стадии 7 дигидронафталиновый амид i восстанавливают, используя хиральный рутениевый катализатор j1 или j2, в присутствии газообразного водорода с получением тетралинового амида k1 или k2, в зависимости от конфигурации катализатора j1 или j2. На данной стадии может быть использовано несколько хиральных рутениевых катализаторов j1, j2, которые подробно описаны ниже. Использование в реакции восстановления на стадии 7 (S)-энантиомерного катализатора j1 или j2 приводит, главным образом, к получению в качестве продукта (R)-соеди нения k1, тогда как использование (R)-энантиомерного катализатора j1 или j2 приводит, главным образом, к получению (S)-соединения k2. Согласно многим вариантам воплощения изобретения (S)-энантиомерный катализатор j1 или j2 используют для получения (R)-энантиомерного продукта k1.
Одним из предпочтительных катализаторов j1 для получения (R)-энантиомера k1 является [Ru(ОАс)2(S)3,3'-дифенил-6,6'-диметоксибифенил-2,2'-диил)-бис-дифенилфосфин], также известный как [Ru(OAc)2(S)-MeOBIPHEP)]. Восстановление на стадии 7 можно проводить с использованием полярного апротонного растворителя, такого как тетрагидрофуран (ТГФ). Согласно некоторым вариантам воплощения изобретения нет необходимости в выделении амидного соединения k1 или k2, и стадию 8 можно проводить в том же самом реакционном сосуде, который использовали на стадии 6.
На стадии 8 проводят дополнительное восстановление с целью превращения хирального тетралинового амида k1 или k2 в соответствующее хиральное метиламино-тетралиновое соединение m1 или m2. Восстановление на стадии 8 можно проводить, например, с использованием боргидрида в полярном апротонном растворителе, таком как ТГФ. Восстановленный продукт m1 или m2 сохраняет конфигурацию соответствующего соединения k1 или k2.
На стадии 9 аминометил-тетралиновое соединение m1 или m2 обрабатывают реагентом n с получением тетралинового соединения о1 или о2. Реагент n может включать, например, ацилгалогенид, такой как уксусной кислоты хлорангидрид или хлорангидрид другой C1-6карбоновой кислоты, мочевину, ацил ангидрид, такой как уксусный ангидрид или ангидрид другой C1-6карбоновой кислоты, или сульфонилгалогенид, такой как метансульфохлорид. Реакцию на стадии 9 можно проводить в таких растворителях, как вода или NMP. Продукт о1 или о2 сохраняет конфигурацию соответствующего соединения m1 или m2.
Согласно вариантам воплощениям изобретения, где Y представляет собой серу, возможно выполнение окисления на стадии 10. С этой целью соединение o1 или о2 обрабатывают пероксикислотой, перекисью водорода или аналогичным окисляющим агентом с получением сульфонильного соединения p1 или р2. Продукт p1 или p2 сохраняет конфигурацию соответствующего соединения о1 или о2.
Соответственно, в изобретении предложен способ получения тетралинового или инданового амида Формулы k1 или k2


где
m имеет значение 0 или 1;
n имеет значение от 0 до 3;
Ar представляет собой арил или гетероарил, каждый из которых может быть возможно замещенным и иметь в качестве заместителей галогено, С1-6алкил, C1-6алкокси, циано, гидрокси, С1-6алкилсульфонил или галогено-С1-6алкил;
Y представляет собой -O-; -S(O)p- или -NRa-, где р имеет значение от 0 до 2 и Ra представляет собой атом водорода или С1-6алкил; и R1 представляет собой галогено, С1-6алкил, С1-6алкокси или галогено-С1-6алкил;
включающий
восстановление дигидронафталинового амида Формулы i

газообразным водородом в присутствии рутениевого катализатора Формулы j1 или j2


где D представляет собой возможно хиральный диамин;
каждый из Е и Е' представляет собой галогено, или Е представляет собой атом водорода и Е' представляет собой BH4;
L представляет собой хиральный дифосфиновый лиганд; и Z представляет собой галогено или Rb-CO2-(карбоксилат), где Rb представляет собой: C1-6алкил, галогено-C1-6алкил, C1-6алкокси, арил, возможно имеющий в качестве заместителей атом галогена, или гетероарил, возможно имеющий в качестве заместителей атом галогена.
Согласно некоторым вариантам воплощения изобретения m имеет значение 1.
Согласно некоторым вариантам воплощения m имеет значение 0.
Согласно некоторым вариантам воплощения n имеет значение 0 или 1.
Согласно некоторым вариантам воплощения n имеет значение 0.
Согласно некоторым вариантам воплощения n имеет значение 1.
Согласно некоторым вариантам воплощения Ar представляет собой фенил, возможно имеющий в качестве заместителей атом галогена, C1-6алкил, С1-6алкокси, циано, гидрокси, C1-6алкилсульфонил или галогено-С1-6алкил.
Согласно некоторым вариантам воплощения Ar представляет собой фенил, возможно имеющий в качестве заместителей атом фтора, метил, метокси, циано, гидрокси, метансульфонил или трифторметил.
Согласно некоторым вариантам воплощения Ar представляет собой фенил, возможно имеющий в качестве заместителей атом фтора.
Согласно некоторым вариантам воплощения Ar представляет собой гетероарил, выбранный из индолила, пирролила, пиразолила, имидазолила и бензимидазолила, каждый из которых возможно имеет в качестве заместителей атом галогена, предпочтительно атом фтора.
Согласно некоторым вариантам воплощения Ar представляет собой гетероарил, выбранный из индол-3-ила, 5-фтор-индол-3-ила, пиррол-3-ила, 1-метил-пиррол-3-ила, пиразол-4-ила, 1-метил-имидазол-2-ила и 5-фтор-бензимидазол-7-ила.
Согласно некоторым вариантам воплощения Y представляет собой S.
Согласно некоторым вариантам воплощения Z представляет собой ацетат (СН3СОО-).
Согласно некоторым вариантам воплощения катализатор представляет собой j1.
Согласно некоторым вариантам воплощения катализатор представляет собой j2.
Согласно некоторым вариантам воплощения хиральный дифосфин L выбран из группы, состоящей из (R)- или (S)-энантиомеров:
MeOBIPHEP;
(2-Фурил)-MeOBIPHEP;
pTol-MeOBIPHEP;
3,5-Ме,4-МеО-MeOBIPHEP;
3,5-iPr,4-MeO-MeOBIPHEP;
3,5-tBu-MeOBIPHEP;
3,5-tBu,4-MeO-MeOBIPHEP;
3,5-TMS-MeOBIPHEP;
TriMeOBIPHEP;
iPr-MeOBIPHEP;
Cy-MeOBIPHEP;
БензоилOBIPHEP;
BITIANP;
BIPHEMP;
(2-Фурил)-BIPHEMP;
Et-Duphos;
BICP и
PPF-P(tBu)2.
Согласно некоторым вариантам воплощения хиральный дифосфин L выбран из группы, состоящей из (R)- или (S)-энантиомеров:
пара-Фенил-MeOBIPHEP;
2-(Тиенил)-MeOBIPHEP;
2-(Нафтил)-MeOBIPHEP;
(6-МеО-2-Нафтил)-MeOBIPHEP;
3,5-Xyl-MeOBIPHEP;
3,5-Xyl-4-МеО-MeOBIPHEP;
pAn-MeOBIPHEP;
iPrOBIPHEP;
BnOBIPHEP;
трет-БутилCOOBIPHEP;
3,5-Xyl-BIPHEMP;
pTol-BIPHEMP;
BINAP;
PHANEPHOS;
TMBTP и
(R,R,S,S)-Mandyphos.
Согласно некоторым вариантам воплощения хиральный дифосфин L представляет собой (S)-MeOBIPHEP.
Согласно некоторым вариантам воплощения хиральный дифосфин L представляет собой (R)-MeOBIPHEP.
Согласно некоторым вариантам воплощения L представляет собой 6,6'-диметоксибифенил-2,2'-диил)бис(дифенилфосфин (MeOBIPHEP).
Согласно некоторым вариантам воплощения L представляет собой (S)-3,5-Xyl-MeOBIPHEP.
Согласно некоторым вариантам воплощения D представляет собой 1,2-бис-дифенил-этилендиамин (DPEN).
Согласно некоторым вариантам воплощения катализатор j1 представляет собой [Ru(ОАс)2((S)-(6,6'-Диметоксибифенил-2,2'-диил)бис(дифенилфосфин))] и получаемый тетралиновый или индановый амид представляет собой соединение Формулы k1.
Согласно некоторым вариантам воплощения катализатор j2 представляет собой [Ru(OAc)2((S)-3,5-Xyl-MeOBIPHEP)((R,R)-DPEN)] и получаемый тетралиновый или индановый амид представляет собой соединение Формулы k1.
Согласно некоторым вариантам воплощения катализатор j2 представляет собой [Ru(OAc)2((S)-MeOBIPHEP)].
Согласно некоторым вариантам воплощения катализатор j2 представляет собой [Ru(OAc)2((R)-MeOBIPHEP)].
Способ по настоящему изобретению дополнительно включает восстановление соединения Формулы k1 или k2


с получением соединения Формулы m1 или m2


где m, n, Y, Ar и R1 являются такими, как определено в данном описании.
Согласно некоторым вариантам воплощения соединение Формулы k1 восстанавливают с получением соединения Формулы m1.
Согласно некоторым вариантам воплощения соединение Формулы k2 восстанавливают с получением соединения Формулы m2.
Согласно некоторым вариантам воплощения восстановление соединения Формулы k1 или k2 выполняют с использованием боргидрида.
Способ по настоящему изобретению может дополнительно включать взаимодействие соединения Формулы m1 или m2


с реагентом Формулы n

с получением соединения Формулы о1 или о2


где X представляет собой уходящую группу;
R2 представляет собой -С(O)-Rc или -SO2-Rc, где Rc представляет собой С1-6алкил или -NRdRe, где каждый из Rd и Re независимо представляет собой атом водорода или C1-6алкил; и
m, n, Y, Ar и R1 являются такими, как определено в данном описании.
Согласно некоторым вариантам воплощения соединение Формулы m1 подвергают взаимодействию с соединением Формулы n с получением соединения Формулы о1.
Согласно некоторым вариантам воплощения соединение Формулы m2 подвергают взаимодействию с соединением Формулы n с получением соединения Формулы о2.
Согласно некоторым вариантам воплощения уходящая группа Х представляет собой атом галогена.
Согласно некоторым вариантам воплощения соединение Формулы n представляет собой ацетилхлорид.
Согласно некоторым вариантам воплощения соединение Формулы n представляет собой мочевину.
Согласно некоторым вариантам воплощения соединение Формулы n представляет собой уксусный ангидрид.
Согласно некоторым вариантам воплощения соединение Формулы n представляет собой метансульфохлорид.
Способ по изобретению может дополнительно включать гидролиз дигидронафталин-карбонитрильного соединения h

с получением соединения Формулы i

где m, n, Y, Ar и R1 являются такими, как определено в данном описании.
Согласно другим вариантам воплощения способ по изобретению может включать обработку соединения Формулы g

цианатом и последующую обработку серной кислотой с получением соединения Формулы i
где m, n, Y, Ar и R1 являются такими, как определено в данном описании.
Способ по изобретению может дополнительно включать взаимодействие соединения Формулы g

с цианатом с получением соединения Формулы h

где m, n, Y, Ar и R1 являются такими, как определено в данном описании.
5 Способ по изобретению может дополнительно включать взаимодействие соединения Формулы е

с соединением Формулы f

с получением соединения Формулы g

где m, n, Y, Ar и R1 являются такими, как определено в данном описании.
Способ по изобретению может дополнительно включать циклизацию соединения Формулы d

с получением соединения Формулы е

где m, n и R1 являются такими, как определено в данном описании.
Способ по изобретению может дополнительно включать гидролиз соединения Формулы с
с получением соединения Формулы d

где m, n, R и R1 являются такими, как определено в данном описании.
Способ по изобретению может дополнительно включать взаимодействие соединения Формулы а

с соединением Формулы b

с получением соединения Формулы с

где m, n, X, R и R1 являются такими, как определено в данном описании. В изобретении также предложено соединение Формулы k1 или k2


где m имеет значение 0 или 1;
n имеет значение от 0 до 3;
Ar представляет собой арил или гетероарил, каждый из которых может быть возможно замещенным и иметь в качестве заместителей галогено, C1-6алкил, C1-6алкокси, циано, гидрокси, C1-6алкилсульфонил или галогено-С1-6алкил;
Y представляет собой -O-, -S(0)p- или -N-Ra, где р имеет значение от 0 до 2 и Ra представляет собой атом водорода или C1-6алкил; и R1 представляет собой галогено, C1-6алкил, С1-6алкокси или галогено-С1-6алкил.
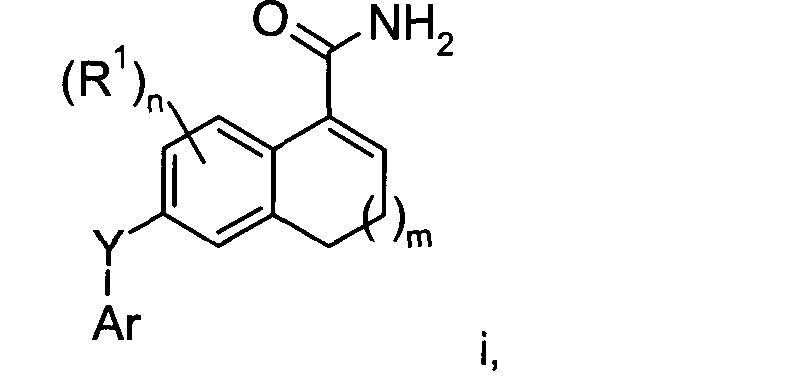
В изобретении также предложено соединение Формулы i

где m имеет значение 0 или 1;
n имеет значение от 0 до 3;
Ar представляет собой арил или гетероарил, каждый из которых может быть возможно замещенным и иметь в качестве заместителей галогено, C1-6алкил, С1-6алкокси, циано, гидрокси, C1-6алкилсульфонил или галогено-C1-6алкил;
Y представляет собой -O-, -S(O)p- или -N-Ra, где р имеет значение от 0 до 2 и Ra представляет собой атом водорода или С1-6алкил; и R1 представляет собой галогено, C1-6алкил, С1-6алкокси или галогено-С1-6алкил.
Путь синтеза некоторых предпочтительных соединений по изобретению проиллюстрирован ниже на Схеме В, где
Х представляет собой уходящую группу;
Р имеет значение от 1 до 3;
R3 представляет собой галогено, С1-6алкил, C1-6алкокси, циано, гидрокси, C1-6алкилсульфонил или галогено-С1-6алкил;
Rf представляет собой С1-6алкил или -NRdRe, где каждый из Rd и Reнезависимо представляет собой атом водорода или C1-6алкил; и
D, Е, L, Z, n, R и R1 являются такими, как определено в данном описании.

На стадии 1 Схеме В бромфторфенильное соединение f1 подвергают взаимодействию с гамма-бром-бутиратным соединением r с получением гамма-фенил-бутиратного соединения s. Данная реакция алкилирования может быть выполнена, например, в полярном апротонном растворителе, например в растворе, содержащем NMP (N-метилпирролидинон). Данную реакцию проводят в присутствии цинка и иода, что приводит к образованию промежуточного цинката (не показано). Кроме того, реакцию выполняют в присутствии фосфинилNi(II)-катализатора, такого как бис(трифенилфосфин)Ni(II) хлорид.
На стадии 2 бутиратное соединение s подвергают гидролизу с получением фенил-бутил-карбоновой кислоты t. Данный гидролиз можно проводить в водных условиях в присутствии NaOH с получением соответствующего карбоксилата (не показано), который затем обрабатывают кислотой с получением соответствующей карбоновой кислоты t.
На стадии 3 выполняют реакцию циклизации. Карбоновую кислоту t подвергают внутренней циклизации в безводных или дегидратирующих условиях с получением циклического кетона u. Согласно многим вариантам воплощения изобретения реакция на стадии 3 может быть выполнена в концентрированной H2SO4.
На стадии 4 тетралоновое соединение u подвергают взаимодействию с тиофенольным соединением v с получением фенил сульфанил циклического кетона w. Реакцию на стадии 4 можно проводить в присутствии амина, такого как триэтиламин, в полярном апротонном растворителе с использованием NMP или аналогичного растворителя.
На стадии 5 циклический кетон w обрабатывают триметилсилилцианатом с получением дигидронафталин-карбонитрильного соединения х. Реакцию на стадии 5 можно проводить в неполярном растворителе, таком как толуол, и предпочтительно в присутствии AlCl3. Согласно некоторым вариантам воплощения изобретения нет необходимости в выделении карбонитрильного соединения x, и, соответственно, соединение x на схеме заключено в квадратные скобки.
На стадии 6 дигидронафталин-карбонитрильное соединение x гидролизуют с получением дигидронафталинового амида y. Гидролиз на данной стадии может быть выполнен с использованием серной кислоты в водных условиях. Как указано выше, согласно некоторым вариантам воплощения изобретения нет необходимости в выделении нитрильного соединения x, и поэтому стадии 5 и 6 можно проводить в одном и том же реакционном сосуде.
На стадии 7 дигидронафталиновый амид у восстанавливают, используя хиральный рутениевый катализатор j1 или j2, в присутствии газообразного водорода, с получением тетралинового амида z. Как указано выше, для асимметрического восстановления на стадии 7 может быть использовано несколько хиральных рутениевых катализаторов j1, j2. Использование в реакции восстановления на стадии (S)-энантиомерного катализатора j1 или j2 приводит, главным образом, к получению (R)-продукта z, как показано на схеме. Использование (R)-энантиомерного катализатора j1 или j2 приводит, главным образом, к получению соответствующего (R)-изомера (не показано). Предпочтительным катализатором j1 для получения соединения z является [Ru(ОАс)2((S)-6,6'-диметоксибифенил-2,2'-диил)бис(дифенилфосфин)], также известный как [Ru(OAc)2((S)-MeOBIPHEP)]. Восстановление на стадии 7 можно проводить с использованием полярного апротонного растворителя, такого как тетрагидрофуран (ТГФ).
На стадии 8 проводят дополнительное восстановление с целью превращения хирального тетралинового амида z в соответствующее хиральное метиламино-тетралиновое соединение аа. Данное восстановление может быть осуществлено с использованием боргидрида в полярном апротонном растворителе, таком как ТГФ. Восстановленный продукт аа сохраняет конфигурацию соединения z. Согласно некоторым вариантам воплощения изобретения нет необходимости в выделении хирального амидного соединения z на стадии 7, и соединения z может быть восстановлено in situ на стадии 8.
На стадии 9 метиламино-тетралиновое соединение аа обрабатывают реагентом bb с получением тетралинового соединения cc. Реагент bb может включать, например, ацилгалогенид, такой как уксусной кислоты хлорангидрид или хлорангидрид другой C1-6карбоновой кислоты, мочевину или ацил ангидрид, такой как уксусный ангидрид или ангидрид другой С1-6карбоновой кислоты. Реакцию на стадии 9 можно проводить в полярном апротонном растворителе, таком как NMP. Соединение cc сохраняет конфигурацию соединения аа.
На стадии 10 соединение cc обрабатывают пероксикислотой, перекисью водорода или аналогичным окисляющим агентом с получением сульфонильного соединения dd. Соединение dd сохраняет конфигурацию соединения cc.
Соответственно, в изобретении предложен способ получения соединения Формулы z

где n имеет значение от 0 до 3;
p имеет значение от 0 до 1;
R1 представляет собой галогено, C1-6алкил, C1-6алкокси или галогено-С1-6алкил; и R3 представляет собой галогено, С1-6алкил, C1-6алкокси, циано, гидрокси, C1-6алкилсульфонил или галогено-С1-6алкил;
включающий восстановление соединения Формулы y

газообразным водородом в присутствии катализатора Формулы ji или j2


где D представляет собой возможно хиральный диамин;
каждый из Е и Е' представляет собой галогено, или Е представляет собой атом водорода и Е' представляет собой BH4;
L представляет собой хиральный дифосфиновый лиганд; и
Z представляет собой галогено или Rb-CO2-(карбоксилат), где R1 представляет собой C1-6алкил, галогено-С1-6алкил, C1-6алкокси, арил, возможно имеющий в качестве заместителей атом галогена, или гетероарил, возможно имеющий в качестве заместителей атом галогена,
Согласно некоторым вариантам воплощения n имеет значение 0 или 1.
Согласно некоторым вариантам воплощения n имеет значение 0.
Согласно некоторым вариантам воплощения n имеет значение 1.
Согласно некоторым вариантам воплощения p имеет значение 0 или 1.
Согласно некоторым вариантам воплощения p имеет значение 0.
Согласно некоторым вариантам воплощения p имеет значение 1.
Согласно некоторым вариантам воплощения R1 представляет собой атом фтора, метил, метокси, циано, гидрокси, метансульфонил или трифторметил.
Согласно некоторым вариантам воплощения R1 представляет собой атом фтора.
Согласно некоторым вариантам воплощения R3 представляет собой атом фтора, метил, метокси, циано, гидрокси, метансульфонил или трифторметил.
Согласно некоторым вариантам воплощения R3 представляет собой атом фтора.
Согласно некоторым вариантам воплощения используют катализатор j1.
Согласно некоторым вариантам воплощения используют катализатор j2.
Согласно некоторым вариантам воплощения Z представляет собой ацетат (СН3СОО-).
Согласно некоторым вариантам воплощения хиральный дифосфин L выбран из группы, состоящей из (S)-энантиомеров:
MeOBIPHEP;
(2-Фурил)-MeOBIPHEP;
pTol-MeOBIPHEP;
3,5-Ме,4-МеО-MeOBIPHEP;
3,5-iPr,4-MeO-MeOBIPHEP;
3,5-tBu-MeOBIPHEP;
3,5-tBu,4-MeO-MeOBIPHEP;
3,5-TMS-MeOBIPHEP;
TriMeOBIPHEP;
iPr-MeOBIPHEP;
Cy-MeOBIPHEP;
БензоилOBIPHEP;
BITIANP;
BIPHEMP;
(2-Фурил)-BIPHEMP;
Et-Duphos;
BICP и
PPF-P(tBu)2.
(Согласно некоторым вариантам воплощения хиральный дифосфин L выбран из группы, состоящей из (S)-энантиомеров:
пара-Фенил-MeOBIPHEP;
2-(Тиенил)-MeOBIPHEP;
2-(Нафтил)-MeOBIPHEP;
(6-МеО-2-Нафтил)-MeOBIPHEP;
3,5-Xyl-MeOBIPHEP;
3,5-Xyl-4-МеО-MeOBIPHEP;
pAn-MeOBIPHEP;
IPrOBIPHEP;
BnOBIPHEP;
трет-БутилCOOBIPHEP;
3,5-Xyl-BIPHEMP;
pTol-BIPHEMP;
BINAP;
PHANEPHOS;
TMBTP и
(R,R,S,S)-Mandyphos.
Согласно некоторым вариантам воплощения хиральный дифосфин L представляет собой (S)-MeOBIPHEP.
Согласно некоторым вариантам воплощения хиральный дифосфин L представляет собой (R)-MeOBIPHEP.
Согласно некоторым вариантам воплощения L представляет собой (S)-(6,6'-диметоксибифенил-2,2'-диил)бис(дифенилфосфин).
Согласно некоторым вариантам воплощения L представляет собой (S)-3,5-Xyl-MeOBIPHEP.
Согласно некоторым вариантам воплощения D представляет собой 1,2-бис-дифенил-этилендиамин (DPEN).
Согласно некоторым вариантам воплощения катализатор j1 представляет собой [Ru(ОАс)2((S)-(6,6'-диметоксибифенил-2,2'-диил)бис(дифенилфосфин))].
Согласно некоторым вариантам воплощения катализатор j2 представляет собой [Ru(OAc)2((S)-3,5-Xyl-MeOBIPHEP)((R,R)-DPEN)] и получаемый тетралиновый амид представляет собой соединение Формулы z.
Согласно некоторым вариантам воплощения катализатор j2 представляет собой [Ru(OAc)2((S)-MeOBIPHEP)].
Согласно некоторым вариантам воплощения катализатор j2 представляет собой [Ru(OAc)2((R)-MeOBIPHEP)].
Способ по настоящему изобретению дополнительно включает восстановление соединения Формулы z

с получением соединения Формулы аа
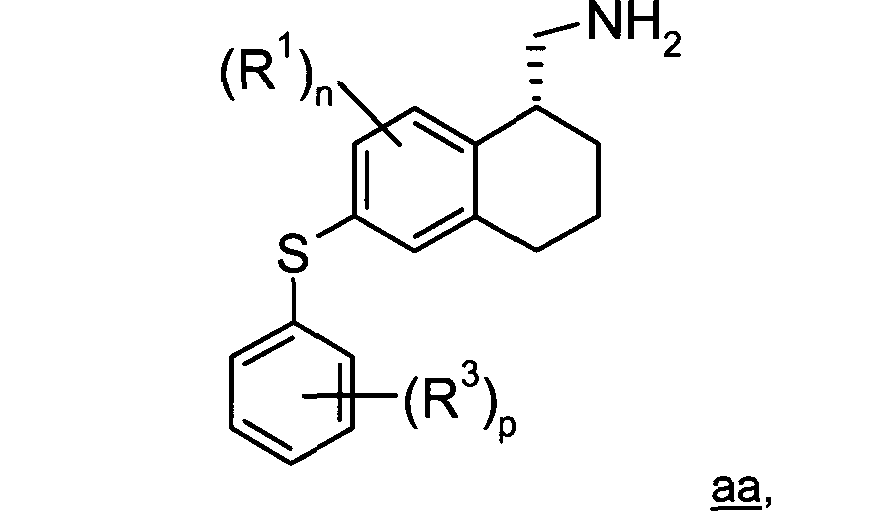
где n, p, R1 и R3 являются такими, как определено в данном описании.
Согласно некоторым вариантам воплощения восстановление соединения Формулы z выполняют с использованием боргидрида.
Способ по настоящему изобретению может дополнительно включает взаимодействие соединения Формулы аа

с реагентом Формулы bb

где
X представляет собой уходящую группу; и
Rf представляет собой C1-6алкил или -NRdRe, где каждый из Rd и Re независимо представляет собой атом водорода или C1-6алкил;
с получением соединения Формулы cc

где n, p, R1 и R3 являются такими, как определено в данном описании.
Согласно некоторым вариантам воплощения уходящая группа Х представляет собой атом галогена.
Согласно некоторым вариантам воплощения соединение Формулы bb представляет собой ацетилхлорид.
Согласно некоторым вариантам воплощения соединение Формулы bb представляет собой мочевину.
Согласно некоторым вариантам воплощения соединение Формулы bb представляет собой уксусный ангидрид.
Согласно некоторым вариантам воплощения Rf представляет собой C1-6алкил.
Согласно некоторым вариантам воплощения Rf представляет собой NRdRe, где каждый из Rd и Re независимо представляет собой атом водорода или C1-6алкил.
Согласно некоторым вариантам воплощения Rf представляет собой -NH2.
Согласно некоторым вариантам воплощения Rf представляет собой метил.
Способ по изобретению может дополнительно включать окисление соединения Формулы cc

с получением соединения Формулы dd

где n, p, R1, R3 и Rf являются такими, как определено в данном описании.
Способ по изобретению может дополнительно включать гидролиз дигидронафталин-карбонитрильного соединения x

с получением соединения Формулы y

где n, p, R1, и R3 являются такими, как определено в данном описании.
Способ по изобретению может дополнительно включать взаимодействие соединения Формулы w

с триметилсилилцианидом с получением соединения Формулы x

где n, p, R1 и R2 являются такими, как определено в данном описании.
Способ по изобретению может дополнительно включать взаимодействие соединения Формулы е

с соединением Формулы v

с получением соединения Формулы w

где n, p, R1 и R2 являются такими, как определено в данном описании.
Способ по изобретению может дополнительно включать циклизацию соединения Формулы t

с получением соединения Формулы u.

где n и R1 являются такими, как определено в данном описании.
Способ по изобретению может дополнительно включать гидролиз соединения Формулы с

с получением соединения Формулы t

где n, R и R1 являются такими, как определено в данном описании.
Способ по изобретению может дополнительно включать взаимодействие соединения Формулы g

с соединением Формулы r

с получением соединения Формулы s

где n, R и R1 являются такими, как определено в данном описании.
В изобретении также предложено соединение Формулы z

где n имеет значение от 0 до 3;
p имеет значение от 1 до 3;
R1 представляет собой галогено, С1-6алкил, С1-6алкокси или галогено-С1-6алкил; и R3 представляет собой галогено, С1-6алкил, С1-6алкокси, циано, гидрокси, C1-6алкилсульфонил или галогено-С1-6алкил.
В изобретении также предложено соединение Формулы y

где
n имеет значение от 0 до 3;
p имеет значение от 1 до 3;
R1 представляет собой галогено, C1-6алкил, C1-6алкокси или галогено-С1-6алкил; и R3 представляет собой галогено, С1-6алкил, C1-6алкокси, циано, гидрокси, C1-6алкилсульфони или галогено-С1-6алкил.
Конкретные детали способов по изобретению описаны ниже в разделе Примеры.
Рутениевые катализаторы, подходящие для применения в способах по изобретению, могут быть представлены Формулой j1

где
Z представляет собой галогено или Rb-СО2, где Rb представляет собой С1-6алкил, галогено-С1-6алкил, C1-6алкокси, арил, возможно имеющий в качестве заместителей атом галогена, или гетероарил, возможно имеющий в качестве заместителей атом галогена; и
L представляет собой хиральный дифосфиновый лиганд.
Катализаторы на основе рутениевых комплексов характеризуется окислительным числом II. Такие рутениевые комплексы возможно включают дополнительные лиганды, нейтральные или анионные. Примерами таких нейтральных лигандов являются, например, олефины, например этилен, пропилен, циклооктен, 1,3-гексадиен, норборнадиен, 1,5-циклооктадиен, бензол, гексаметилбензол, 1,3,5-триметилбензол, пара-цимен, а также такие растворители, как например тетрагидрофуран, диметилформамид, ацетонитрил, бензонитрил, ацетон и метанол. Примерами таких анионных лигандов являются СН3СОО-, CF3COO- или галогениды. Если рутениевый комплекс заряжен, присутствуют некоординирующие анионы, такие как галогениды, BF4-, ClO4-, SbF6-, PF6-, В(фенил)4-, В(3,5-ди-трифторметил-фенил)4-, CF3SO3-, C6H5SO3-.
Катализаторы на основе рутениевых комплексов могут быть получены, например, в соответствии с методиками, описанными в N. Feiken et al., Organometallics 1997, 16, 537; M.P.Fleming et al., US 6545165 (получение и выделение хиральных рутений дикарбоксилат дифосфиновых комплексов); В. Heiser et al., Tetpahearon: Asymmetry 1991, 2, 51 (получение in-situ тех же карбоксилато комплексов); или J.-P. Genet, Acc. Chem. Res. 2003, 36, 908, которые включены в данное описание посредством ссылки. В патенте US 6545165, в частности, проиллюстрировано получение хиральных рутений дикарбоксилат дифосфинов.
Катализаторы на основе рутениевых комплексов могут быть получены in situ, то есть непосредственно перед их использованием и без выделения. Раствор, в котором получают такой катализатор, может уже содержать субстрат для энантиоселективной гидрогенизации, или данный раствор может быть смешан с субстратом непосредственно перед проведением реакции гидрогенизации.
Неожиданно было найдено, что в настоящем изобретении могут быть использованы также рутений-фосфиновые комплексы Формулы j2

где каждый из Е и Е' представляет собой галогено, или Е представляет собой атом водорода и Е' представляет собой BH4; L представляет собой хиральный дифосфиновый лиганд; и D представляет собой возможно хиральный диамин.
Комплексы типа j2 могут быть получены, выделены и характеризованы с использованием методик, аналогичных методикам, описанным в Angew. Chem. Int. Ed. 1998, 37, 1703-1707, и в ссылках, цитированных в данном описании, или могут быть получены "in situ" из необходимых компонентов в соответствии с тем, как описано в вышеприведенных ссылках, и использованы без промежуточного выделения в каталитической асимметрической гидрогенизации. Когда комплексы типа j2 получают "in situ", количество хирального дифосфинового лиганда (L), используемое в реакции, можно изменять в диапазоне от 0,5 до 2,5 эквивалента относительно количества рутения, предпочтительно в диапазоне от 0,8 до 1,2 эквивалента. Аналогично количество хирального диамина можно изменять в диапазоне от 0,5 до 2,5 эквивалента по отношению к количеству рутениевого комплекса, предпочтительно в диапазоне 1 до 2 эквивалентов.
Данная реакция может быть выполнена в присутствии хиральных диаминов, показанных ниже.






Другими подходящими хиральнымим диаминами являются пропан- и бутан-диамины. Особенно предпочтительным хиральным диамином является DPEN (V), (R,R) или (S,S)-1,2-дифенил-этилендиамин. Данные хиральные диамины имеются в продаже или могут быть получены в соответствии с известными методиками.
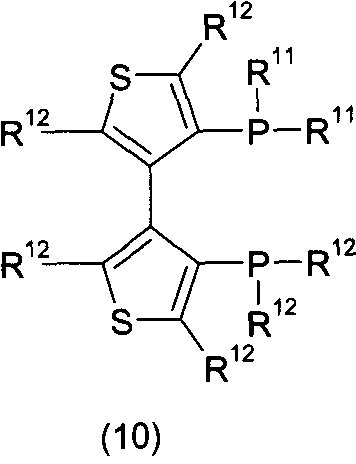
Согласно некоторым вариантам воплощения хиральный дифосфиновый лиганд L катализатора j1, j2 может быть представлен одной из Формул (3), (4), (5), (6), (7), (8), (9), (10), (11), (12) или (13):




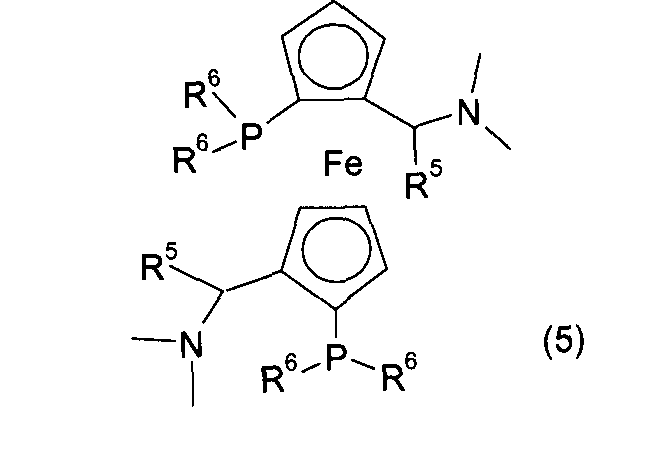





где R4 представляет собой C1-6алкил;
R5 представляет собой C1-6алкил;
R6 независимо в каждом случае представляет собой арил, гетероарил, С3-6циклоалкил или С1-6алкил;
R7 представляет собой -N(С1-6алкил)2 или пиперидинил;
R8 представляет собой C1-6алкил, C1-6алкокси, гидрокси или С1-6алкил-С(O)O-, или два заместителя R8 могут быть связаны мостиковой связью -O(СН2)n-O-, где n имеет значение от 2 до 5;
каждый из R9 и R10 независимо представляет собой атом водорода, C1-6алкил, C1-6алкокси или ди(С1-6алкил)амино; или R8 и R9, которые присоединены к одной и той же фенильной группе, или R9 и R10, которые присоединены к одной и той же фенильной группе, или два R8вместе представляют собой -А-(СН2)n-Е-, где А представляет собой -О- или -С(O)O-, Е представляет собой -О- или -N(С1-6алкил)- и n представляет собой целое число от 1 до 6, или группу CF2; или
R8 и R9 или R9 и R10 вместе с атом углерода, к которому они присоединены, могут образовывать нафтильное, тетрагидронафтильное или дибензофурановое кольцо;
каждый из R11 и R12 независимо представляет собой С1-6алкил, С3-6циклоалкил, фенил, нафтил или гетероарил, имеющий от 0 до 3 заместителей, независимо выбранных из группы, состоящей из C1-6алкила, С1-6алкокси, ди(С1-6алкил)амино, морфолино, фенила и три(С1-6алкил)силила;
если R11 представляет собой фенил, он имеет от 0 до 3 заместителей, таких, как описано выше.
Согласно некоторым вариантам воплощения хиральный дифосфиновый лиганд L представлен Формулой (7), (9), (10) или (12) и Z представляет собой СН3СОО, CF3COO или галогенид.
Согласно некоторым вариантам воплощения хиральный дифосфин L выбран из группы, состоящей из (R)- или (S)-энантиомеров:
MeOBIPHEP;
(2-Фурил)-MeOBIPHEP;
pTol-MeOBIPHEP;
3,5-Me,4-MeO-MeOBIPHEP;
3,5-iPr,4-MeO-MeOBIPHEP;
3,5-tBu-MeOBIPHEP;
3,5-tBu,4-MeO-MeOBIPHEP;
3,5-TMS-MeOBIPHEP;
TriMeOBIPHEP;
iPr-MeOBIPHEP;
Cy-MeOBIPHEP;
БeнзouлOBIPHEP;
BITIANP;
BIPHEMP;
(2-Фурил)-BIPHEMP;
(R,R)-Et-Duphos;
(all-S)-BICP и ((S,R)-PPF-P(tBu)2).
Согласно некоторым вариантам воплощения хиральный дифосфин L выбран из группы, состоящей из (R)- или (S)-энантиомеров:
пара-Фенил-MeOBIPHEP;
2-(Тиенил)-MeOBIPHEP;
2-(Нафтил)-MeOBIPHEP;
(6-МеО-2-(Нафтил)-MeOBIPHEP;
3,5-Xyl-MeOBIPHEP;
3,5-Xyl-4-МеО-MeOBIPHEP;
pAn-MeOBIPHEP;
iPrOBIPHEP;
BnOBIPHEP;
трет-БутилСООВIРНЕР;
3,5-Xyl-BIPHEMP;
pTol-BIPHEMP;
BINAP;
PHANEPHOS;
TMBTP и (R,R,S,S)-Mandyphos.
Более предпочтительно хиральный дифосфин выбран из MeOBIPHEP;
pTol-MeOBIPHEP;
3,5-iPr,4-MeO-MeOBIPHEP и
3,5-tBu,4-MeO-MeOBIPHEP.
Согласно некоторым вариантам воплощения хиральный дифосфин L представляет собой (S)-MeOBIPHEP.
Согласно некоторым вариантам воплощения хиральный дифосфин L представляет собой (R)-MeOBIPHEP.
Определения вышеупомянутых аббревиатур, используемых для обозначения лигандов, а также ссылки на литературные и коммерческие источники, приведены в Таблице 1 ниже.
Гидрогенизацию предпочтительно выполнять в органическом растворителе, который является инертным в реакционных условиях. В качестве таких растворителей могут быть упомянуты, в частности, низшие спирты, такие как, например, метанол, этанол или изопропанол, трифторэтанол, простые эфиры, так как, например, диэтиловый эфир, тетрагидрофуран или диоксан, или смеси таких спиртов с галогенированными углеводородами, такими как метиленхлорид, хлороформ, гексафторбензол и тому подобное, или с простыми эфирами, такими как диэтиловый эфир, тетрагидрофуран или диоксан. Предпочтительными растворителями для данной реакции являются низшие спирты, из которых особенно предпочтительным является метанол, или простые эфиры, из которых особенно предпочтительным является тетрагидрофуран. Данную реакцию выполняют при концентрации приблизительно от 1 до 50%, в идеале приблизительно от 5 до 30%.
Соотношение субстрат/катализатор (соотношение S/C) составляет 100-100000, предпочтительно 500-30000. Гидрогенизацию выполняют при давлении от 1 до 300 бар (1·105-3·107 Па), в идеале при давлении приблизительно от 1 до 50 бар (1·105-5·106 Па), и при температуре от приблизительно 0°С до приблизительно 150°С, в идеале при температуре от 20°С до 100°С.
Асимметрическую гидрогенизацию можно выполнять партиями или непрерывно.
Способы и соединения по изобретению являются полезными для получения соединений, которые, в свою очередь, являются полезными в лечении заболеваний, состояний и расстройств центральной нервной системы, включая болезнь Паркинсона, болезнь Гентингтона, тревожность, депрессию, маниакальную депрессию, психоз, эпилепсию, обсессивно-компульсивные расстройства, аффективные расстройства, мигрень, болезнь Альцгеймера (улучшение когнитивной памяти), нарушения сна, расстройства приема пищи, такие как анорексия, булимия и ожирение, острые тревожные состояния с реакцией паники, акатизию, синдром дефицита внимания и гиперактивности (СДВГ), синдром дефицита внимания (СДВ), абстиненцию, обусловленную лекарственной и наркотической зависимостью, например, от кокаина, этанола, никотина и бензодиазепинов, шизофрению, а также расстройств, ассоциированных с травмой позвоночника и/или травмой головы, таких как гидроцефалия. Данные способы являются в особенности полезными для получения соединений, полезных в лечении нарушений памяти, в улучшении когнитивной функции и в улучшении когнитивной функции у пациентов, страдающих болезнью Альцгеймера.
Следующие примеры приведены, чтобы дать возможность специалистам в данной области техники более ясно понимать и использовать на практике настоящее изобретение. Данные примеры, являются лишь иллюстративными и типичными, и их не следует рассматривать как ограничение объема изобретения.
В примерах могут быть использованы следующие аббревиатуры:
DABN 2,2'-Диамино-1,1'-бинафталин
DACH транс-1,2-Диаминоциклогексан
DAIPEN 1,1-Ди(пара-метоксифенил)-2-изопропилэтилендиамин
DCEN 1,2-Дициклогексан-этилендиамин
ДХМ дихлорметан/метилена хлорид
DMAP 4-диметиламинопиридин
ДМФА N,N-диметилформамид
DPEN 1,2-Дифенил-этилендиамин
DTBEN 1,2-Ди-трет-бутилэтилендиамин
Et2O диэтиловый эфир
EtOAc этилацетат EtOH этанол
GC газовая хроматография
НМРА гексаметилфосфорамид
ЖХВД жидкостная хроматография высокого давления
IPA изопропанол
LDA лития диизопропиламин
mCPBA мета-хлорпербензойная кислота
MeCN ацетонитрил
МеОН метанол
МТВЕ метилтретбутиловый эфир
NMP N-метилпирролидинон
S/C Молярное отношение субстрат/катализатор
TEA триэтиламин
ТГФ тетрагидрофуран
ТСХ тонкослойная хроматография
TMSCN триметилсилил цианат
Пример 1
[(R)-6-(3-Фтор-фенилсульфонил)-1,2,3,4-тетрагидро-нафталин-1-илметил]-мочевина
Методика синтеза, использованная в данном Примере, приведена на Схеме С.

Стадия 1. 4-(3-Фтор-фенил)-масляной кислоты этиловый эфир
Суспензию цинкового порошка (1,44 кг, 1,2 экв., 100 меш) в безводном 1-метил-2 пиролидиноне (7,3 кг) обрабатывали иодом (226 г) в химическом реакторе. Смесь нагревалась до приблизительно 40°С, и окрашивание, обусловленное иодом, исчезало. Смесь интенсивно перемешивали, температура смеси повышалась до приблизительно 60°С, в химический реактор загружали 4-броммасляной кислоты этиловый эфир (4,2 кг), регистрировали разогрев смеси до температуры, превышающей температуру рубашки реактора. Реакцию запускали путем добавления 4-броммасляной кислоты этилового эфира (1 кг) и нагревания рубашки реактора до приблизительно 55°С. Начало реакции регистрировали при температуре приблизительно 55°С. Температуру реакционной смеси постепенно увеличивали от 60 до приблизительно 95°С, медленного добавляя оставшееся количество 4-броммасляной кислоты этилового эфира (3,2 кг). После завершения добавления реакционную смесь нагревали до приблизительно 95°С, пока не завершалась реакция (приблизительно 2% исходного вещества согласно ГХ-анализу). Образование промежуточного цинката (на Схема С не показано) подтверждали путем ГХ-анализа (аликвоту реакционной смеси гасили 4 н. соляной кислотой и экстрагировали МТВЕ). Реакционную смесь охлаждали до приблизительно 25°С, и добавляли бис(трифенилфосфин)никеля (II) хлорид (45,8 г). Затем реакционную смесь нагревали до приблизительно 40°С, и добавляли в течение приблизительно 6 ч 1-бром-3-фторбензол (3,23 кг). Температуру реакционной смеси поддерживали в интервале от 35 до 45°С, контролируя скорость добавления 1-бром-3-фторбензола. Выделение тепла в ходе реакции определяли путем измерения разности температур рубашки химического реактора и содержимого реактора. После завершения добавления реакционную смесь нагревали в течение 24 ч при 40°С. Затем реакционную смесь охлаждали до 15°С, гасили путем добавления воды (4,5 литра), подкисляли путем добавления 6 н. водного раствора соляной кислоты (14 литров) и перемешивали до полного прекращения выделения газа и полного растворения всех солей. Неочищенную реакционную смесь фильтровали через подушку целита. Подушку целита промывали МТВЕ (10 литров), который переносили в экстрактор (extractor ball). Затем в экстрактор вносили дополнительное количество свежего МТВЕ (5 литров), отфильтрованную водную реакционную смесь экстрагировали порциями и отбирали. Органический слой, оставшийся в экстракторе, три раза промывали водой (каждый раз по 5 литров). Органический слой извлекали из реактора и концентрировали под вакуумом, и полученный неочищенный 4-(3-фтор-фенил)-масляной кислоты этиловый эфир (10,5 кг) в виде масла использовали без дополнительной очистки на следующей стадии. Масс-спектр: (М+1)=210;1H-ЯМР (300 МГц): δ м.д. (CDCl3): 1.25 (3Н, t, J=7.16 Гц), 1.94 (2Н, dp), 2.31 (2Н, t, J=7.54 Гц), 2.65 (2Н, t, J=7.54 Гц), 4.12 (2H, q, J=7.16), 6.84-6.96 (2H, m), 7.19-7.26 (2H, m).
Стадия 2. 4-(3-Фтор-фенил)-масляная кислота
Неочищенный 4-(3-фторфенил)масляной кислоты этиловый эфир (10,5 кг), воду (15,8 л) и 50% NaOH (12,0 кг) загружали в химический реактор и перемешивали при 50°С в течение 2 ч. Гидролиз сопровождался умеренным повышением температуры до 55°С. Двухфазная смесь превращалась в однофазную. Завершение гидролиза подтверждали с помощью ЖХ (жидкостной хроматографии). Реакционную смесь охлаждали до 20°С и промывали гексанами (15 кг), содержащими антистатический агент "ASA 3", с целью удаления примеси 3'3-дифторбифенила, образовавшегося на предыдущей стадии. После разделения фаз водный слой подкисляли путем добавления концентрированной HCl (37%, 16,7 кг), поддерживая температуру ниже 40°С. После охлаждения водный слой экстрагировали МТВЕ (15 кг, три раза по 5 кг). Растворитель удаляли путем перегонки под вакуумом, и избыток МТВЕ удаляли путем отгонки с гексаном. Полученную 4-(3-фтор-фенил)-масляную кислоту (8,83 кг) в виде масла выгружали из химического реактора и использовали без дополнительной очистки. Масс-спектр: (М+1)=182;1H-ЯМР (300 МГц): δ м.д. (CDCl3): 1.965 (21-1, p, J=4.9, 2.47 Гц), 2.37 (21-1, t, J=2.47 Гц), 2.66 (2H, t, J=2.45), 6.87 (2H, m), 6.95 (1H, d, J=2.63), 7.22 (1H, m) 11.2 (0.2H, bs).
Стадия 3. 6-Фтор-3.4-дигидро-2Н-нафталин-1-он
В химический реактор, содержащий концентрированную серную кислоту (30 кг), добавляли неочищенную 4-(3-фторфенил)масляную кислоту (8,83 кг) с такой скоростью, чтобы температура содержимого реактора оставалась в диапазоне от 40°С до 60°С (нагревания через рубашку не требовалось). Реакционную смесь перемешивали при 45°С в течение 3 ч, и завершение реакции подтверждали с помощью ЖХ. Реакционную смесь охлаждали, гасили водой (16 л) и затем экстрагировали 35% ТГФ в метиленхлорид е (25,8 кг). Органический слой отделяли и промывали водой (16 л), насыщенным водным раствором NaHCO3 (16,9 кг) и затем смесью вода/солевой раствор (16,1 кг/4,7 кг). Органический слой концентрировали под вакуумом и отгоняли с помощью гексана для удаления воды с получением 6-фтор-3,4-дигидро-2Н-нафталин-1-она в виде масла (5,88 кг). Масс-спектр: (М+1)=165;1H-ЯМР (300 МГц): δ м.д. (CDCl3): 2.14 (21-1, m, J=6.03, 5.75 Гц), 2.64 (2H, dd, J=6.03, 5.75 Гц); 2.94 (21-1, t, J=6.03), 6.9-7.0 (2H, m, J=2.26, 2.64, 6.03 Гц), 8.02-8.07 (1 H, dd, J=6.03).
Стадия 4. 6-(3-Фтор-фенилсульфанил)-3,4-дигидро-2H-нафталин-1-он
Раствор 6-фтор-3,4-дигидро-2H-нафталин-1-она (3,64 кг) и 3-фтортиофенола (2,80 кг), в безводном NMP (7,7 кг) обрабатывали триэтиламином (2,26 кг). После завершения умеренного выделения тепла смесь нагревали в течение 20 ч при 90°С. Затем смесь охлаждали до приблизительно 25°С и разбавляли водой (30 л) и гептаном (10 кг). Данную смесь перемешивали в течение 12 ч и затем фильтровали. Осадок на фильтре промывали водой и сушили при 60°С под вакуумом с получением 6-(3-фторфенилсульфанил)-3,4-дигидро-2Н-нафталин-1-она (5,52 кг). Т.пл.=66,2-66,7°С; Масс-спектр: (М+1)=273;1H-ЯМР (300 МГц): δ м.д. (CDCl3): 2.10 (21-1, m, J=6.03, 6.40 Гц), 2.62 (21-1, dd, J=6.03, 5.75 Гц) 2.87 (2H, t, J=6.03), 7.03 (11-1, tdd, J=1.13, 2.64, 8.29 Гц), 7.08-7.16 (21-1, m), 7.22 (1H, dt, J=1.13, 8.29 Гц), 7.31 (114, q, 8.29 Гц), 7.35 (1Н, dd, J=5.65, 7.91 Гц) 7.92 (1Н, d, J=7.91 Гц).
Стадия 5. 6-(3-Фтор-фенилсульфанил)-3,4-дигидро-нафталин-1-карбоновой кислоты амид
6-(3-Фтор-фенилсульфанил)-3,4-дигидро-2Н-нафталин-1-он (4,78 кг) растворяли в толуоле (50 кг), и полученную смесь подвергали азеотропной дистилляции под вакуумом при температуре в диапазоне от 50 до 55°С, пока не оставалось приблизительно 10 л толуола. Данный раствор охлаждали до 25°С, и добавляли AlCl3 (52 г). Добавляли TMSCN (1,85 кг) с такой скоростью, чтобы температура реакционной смеси оставалась в диапазоне от 20 до 50°С. Завершение реакции определяли с помощью ТСХ (гексаны/EtOAc 4:1). Полученный 6-(3-фтор-фенилсульфанил)-3,4-дигидро-нафталин-1-карбонитрил не выделяли из реакционной смеси. Всю реакционную смесь охлаждали до 5°С, и медленно добавляли серную кислоту (4,06 кг), поддерживая температуру внутри смеси ниже 30°С. Затем реакционную смесь разбавляли уксусной кислотой (24 кг), серной кислотой (18 кг) и водой (2,4 кг). Реакционную смесь нагревали до 105°С в течение трех часов, затем охлаждали до 25°С и гасили водой (48 кг). Полученный продукт отфильтровывали и тщательно промывали водой (28 кг), МТВЕ (10,6 кг) и сушили под вакуумом, используя продувание азотом, с выходом 6-(3-фтор-фенилсульфанил)-3,4-дигидро-нафталин-1 -карбоновой кислоты амида в виде белого твердого вещества (4,59 кг). Т.пл.=167,9-169,7°С; Масс-спектр: (М+1)=300;1H-ЯМР (300 МГц): δ м.д. (ДМСО): 2.31 (2Н, m, J=4.29, 8.29 Гц), 2.72 (1Н, t, J=7.91), 3.64 (0.5Н, s, NH), 6.54 (1H, t, J=4.52 Гц), 7.02-7.12 (3Н, m), 7.22 (~0.5Н, bs, NH), 7.25-7.30 (2Н, m), 7.35-7.42 (2Н, m), 7.52 (1Н, d, J=8.67), 7.67 (1Н, bs, NH).
Стадия 6. (R)-6-(3-Фтор-фенилсульфанил)-1,2,3,4-тетрагидро-нафталин-1-карбоновой кислоты амид
Суспензию 6-(3-фторфенилсульфанил)-3,4-дигидронафталин-1-карбоновой кислоты амида (2,3 кг) и [Ru(OAc)2((S)-MeOBIPHEP)] (1,36 г) в ТГФ (25 кг) гидрогенизировали при 40°С в атмосфере водорода при давлении 160 psi (11 бар (1,1·106 Па)) в течение 36 ч с получением раствора (R)-6-(3-фтор-фенилсульфанил)-1,2,3,4-тетрагидро-нафталин-1-карбоновой кислоты амида в ТГФ, который использовали как есть на следующей стадии. Анализ аликвот ТГФ-раствора давал следующие результаты:
Т.пл.=131,9-132,6°С; Масс-спектр: (М+1)=3021H-ЯМР (300 МГц): δ м.д. (ДМСО): 1.61 (11-1, m), 1.92 (21-1, m), 2.70 (2H, m), 3.63 (1Н, t, J=6.78 Гц), 6.97-7.10 (4Н, m), 7.13-7.22 (3H, m), 7.33-7.40 (1Н, m), 7.50 (1Н, NH); [α]D=4.0 о (МеОН). Хиральный анализ (нормализация по площади): колонка: ChiralCel OD-H(250X4,6 мм); подвижная фаза: гексан/этанол (90/10, изократическая); скорость потока: 0,7 мл/мин; 25°С; УФ: 230 нм: (R)-изомер (98,59)/(S)-изомер (1,41).
Стадия 7. [(R)-6-(3-Фтор-фенилсульфанил)-1,2,3,4-тетрагидро-нафталин-1-ил]-метиламина гидрохлорид
Раствор (R)-6-(3-фторфенилсульфанил)-1,2,3,4-тетрагидронафталин-1-карбоновой кислоты амида (приблизительно 4,63 кг) в ТГФ концентрировали до приблизительно 4 объемов с использованием атмосферной перегонки. К полученному раствору при комнатной температуре добавляли ВН3·ТГФ (1,0 М раствор в ТГФ; 67,5 кг), удаляя водород через пламегаситель. После завершения добавления реакционную смесь нагревали до 55°С и перемешивали в течение 40 ч. Затем реакционную смесь гасили с использованием инверсного добавления к охлажденной (5°С) 10% водной H2SO4 (13 кг) в закаленном сосуде, температуру которого поддерживали ниже 20°С. Затем содержимое закаленного сосуда нагревали до 25°С и перемешивали в течение 12 ч, затем охлаждали до 5°С, и pH реакционной смеси доводили до 9-10 путем добавления водного гидроксида аммония (23,4 кг). Затем реакционную смесь нагревали до 40°С, и слои разделяли. Органическую фазу концентрировали до приблизительно 4 объемов путем атмосферной перегонки, и добавляли изопропилацетат (94,8 кг). Органическую фазу промывали разбавленным солевым раствором (20,9 кг) и подкисляли путем добавления 6 н. HCl в IPA (5,25 кг). Дистилляция оставшегося ТГФ и IPA вызывала преципитацию желаемого продукта. После охлаждения до 0°С продукт выделяли путем фильтрования, промывали изопропилацетатом и сушили под вакуумом при 60°C с получением С-[(R)-6-(3-фтор-фенилсульфанил)-1,2,3,4-тетрагидро-нафталин-1-ил]-метиламина гидрохлорида (4,64 кг). Т.пл.=195,7-196,2°С;1H-ЯМР (300 МГц): 6 м.д. (ДМСО): 1.59-1.99 (3Н, m), 2.6-2.80 (2Н, m), 2.92 (1Н, dd, J=12.81, 12.43), 3.06 (1Н, dd, J=3.77, 12.81 Гц), 3.24 (1Н, m), 6.99-7.12 (3Н, m), 7.19-7.25 (2Н, m), 7.33-7.43 (2Н, m), 8.45 (2Н, bs, NH); [α]D=-0,3° (МеОН). Хиральный анализ (нормализация по площади): колонка: Chiralpak IA (150Х4,6 мм); подвижная фаза: (80/20, изократическая); скорость потока: 1,0 мл/мин; 25°С; УФ: 230 нм: (R)-изомер (99,17)/(S)-изомер (0,83).
Стадия 8. [(R)-6-(3-Фтор-фенилсульфанил)-1,2,3,4-тетрагидро-нафталин-1-илметил]-мочевина
(R)-6-(3-Фторфенилсульфанил)-1,2,3,4-тетрагидронафталин-1-метиламина гидрохлоридную соль (4,6 кг) и мочевину (3,4 кг) суспендировали в свежем NMP (9,5 кг). Добавляли концентрированную HCl (37% водный раствор, 0,15 кг), и данную реакционную смесь нагревали до 100°С в течение трех часов. Когда реакция завершалась (согласно ЖХВД-анализу), реакционную смесь охлаждали до 60°С, и добавляли воду (45 кг). Полученную суспензию интенсивно перемешивали, охлаждая до 20°С, затем смесь выдерживали в течение 24 ч. Полученное твердое вещество отфильтровывали и промывали водой. Влажный осадок с фильтра переносили в толуол (23,6 кг) и нагревали до 80°С, затем промывали водой (дважды по 13,5 л), и реакционную смесь охлаждали до 40°С. После добавления н-гептана [(R)-6-(3-фтор-фенилсульфанил)-1,2,3,4-тетрагидро-нафталин-1-илметил]-мочевина кристаллизовалась (7,8 кг). Данный продукт фильтровали и сушили при пониженном давлении при 50°C с получением 3,78 кг [(R)-6-(3-фтор-фенилсульфанил)-1,2,3,4-тетрагидро-нафталин-1-илметил]-мочевины. Т.пл.=115,1-116,0°С; Масс-спектр: (М+1)=288;1H-ЯМР (300 МГц): δ м.д. (ДМСО): 1.59-1.84 (3Н, m), 2.59-2.78 (2Н, m), 2.86 (1Н, m), 3.10 (1H, ddd, J=6.03, 9.04 Гц), 3.28 (1Н, ddd, J=5.65, 6.03), 3.34 (1Н, s), 5.46 (2H, s, NH), 6.11 (11-1, t, J=6.03 Гц) 6.96-7.09 (3Н, m), 7.17-7.23 (2H, m), 7.26-7.31 (1H, m), 7.32-7.41 (1H, m): [α]D =25.5 о (МеОН). Хиральный анализ (нормализация на площадь): колонка: Chiralpak AS-H (150Х4,6 мм); подвижная фаза: гексан/этанол (80/20, изократическая); скорость потока: 0,7 мл/мин; 25°С; УФ: 230 нм: (R)-изомер (99,03)/(S)-изомер (0,97).
Стадия 9. [(R)-6-(3-Фтор-фенилсульфонил)-1,2,3,4-тетрагидро-нафталин-1-илметил]-мочевина
Суспензию [(R)-6-(3-фторфенилсульфанил)-1,2,3,4-тетрагидронафталин-1 -ил-метил]мочевины (3,76 кг) в метиленхлорид е (71 кг) обрабатывали 98% муравьиной кислотой (1,31 кг) и 30% водным раствором перекиси водорода (6,63 кг). Данную двухфазную реакционную смесь перемешивали в течение 48 ч при 35°С, и затем добавляли воду (12 л). Фазы разделяли, оставляя водный пероксидный слой в химическом реакторе для обработки смесью гидроксид натрия/бисульфит натрия. Органический слой промывали насыщенным водным раствором бикарбоната натрия (30 кг), водой (30 л) и насыщенным водным раствором хлорида натрия (38 кг). Органический слой проверяли на содержание пероксида, затем отгоняли метиленхлорид, и вместо него добавляли метанол. Затем объем метанола уменьшали до приблизительно 9 литров при пониженном давлении, полученный раствор фильтровали в горячем виде, собирая фильтрат в чистый химический реактор, и охлаждали до 25°С. Медленно добавляли воду (4 л) до температуры помутнения раствора, и данную смесь перемешивали в течение трех часов, пока проходила кристаллизация, затем дополнительно добавляли 6 л воды. Полученный продукт отфильтровали и промывали охлажденной фильтрованной смесью метанол-стерильная вода для фильтрования (50:50). Влажный осадок сушили при 40°С в вакуумной печи, используя продувание азотом, до постоянной массы с получением 3,95 кг [(R)-6-(3-фтор-фенилсульфонил)-1,2,3,4-тетрагидро-нафталин-1-илметил]-мочевины. Т.пл.=154,9-156,1°С; Масс-спектр: (М+1)=362;1H-ЯМР (300 МГц): δ м.д. (ДМСО): 1.6-1.82 (3Н, m), 2.67-2.83 (1Н, m), 2.83-2.96 (1Н, m), 3.04-3.14 (1Н, add, J=5.65, 6.03, 8.67 Гц), 3.21-3.3 (1Н, ddd, J=4.90, 6.03, 8.67 Гц), 3.34 (1Н, s), 5.46 (2H, s, NH), 6.10 (1Н, t, J=5.65 Гц), 7.43-7.47 (1Н, m), 7.52-7.59 (1Н, ddt, J=1.13, 2.64, 8.67 Гц), 7.64-7.76 (3Н, m), 7.79-7.85 (2Н, m); [α]D=25,9° (МеОН). Хиральный анализ (нормализация на площадь): колонка: Chiralpak IA (150Х4,6 мм); подвижная фаза: этанол (изократическая); скорость потока: 1,0 мл/мин; 25°С; УФ: 230 нм: (R)-изомер (99,33)/(S)-изомер (0,67).
Пример 2
N-((R)-6-Бензолсульфонил-8-фтор-1,2,3,4-тетрагидро-нафталин-1-илметил)ацетамид
Методика синтеза, использованная в данном Примере, приведена на Схеме D.

Стадия 1. 4-(3,5-Дифтор-фенил)-масляной кислоты пропиловый эфир
Суспензию цинкового порошка (1,37 кг, 1,5 экв.) в безводном 1-метил-2 пиролидиноне (7,38 кг) обрабатывали иодом (210 г). Смесь нагревалась до 20-27°С, и окрашивание, обусловленное иодом, исчезало. Смесь интенсивно перемешивали, температура смеси повышалась до приблизительно 60°С. Постепенно добавляли 4-броммасляной кислоты этиловый эфир (4,07 кг), поднимая температуру реакционной смеси до 88°С (без внешнего нагрева), и затем температуру реакционной смеси поддерживали при 90°С, контролируя скорость добавления оставшегося 4-броммасляной кислоты этилового эфира. После завершения добавления реакционную смесь нагревали до 90°С (пока цинковый порошок не был полностью израсходован). Образование промежуточного цинката (на схеме не показано) подтверждали путем ГХ-анализа, (аликвоту реакционной смеси гасили 4 н. соляной кислотой и экстрагировали МТВЕ). Реакционную смесь охлаждали до 20°С, и добавляли бис(трифенилфосфин)никеля (II) хлорид (80,2 г). Затем реакционную смесь нагревали до 50°С, и в течение 6 ч добавляли 1-бром-3,5-дифторбензол (2,71 кг). Температуру реакционную смеси поддерживали при 50°С, контролируя скорость добавления 1-бром-3,5-дифторбензола. Выделение тепла в ходе реакции определяли путем измерения разности температур рубашки химического реактора и содержимого реактора. После завершения добавления реакционную смесь нагревали в течение 24 ч при 40°С. Затем реакционную смесь охлаждали до 15°С, гасили путем добавления воды (4,8 литра), подкисляли путем добавления 6 н. водного раствора соляной кислоты (14,2 кг) и перемешивали до полного прекращения выделения газа и полного растворения всех солей. Водный слой промывали МТВЕ (8,04 кг), и фазы разделяли. Органический слой промывали водой (9,75 кг). Органический слой отделяли и концентрировали под вакуумом с получением 3,3 кг 4-(3,5-дифтор-фенил)-масляной кислоты пропилового эфира в виде масла (чистота: 76,2% согласно ЖХВД). Масс-спектр: (М+1)=228;1H-ЯМР (300 МГц): δ (CDCl3): 1.26 (3Н, t, J=7.16 Гц), 1.94 (2Н, p, J=7.54 Гц), 2.32 (2Н, t, J=7.54 Гц), 2.64 (2Н, t, J=7.54 Гц), 4.14 (2Н, q, J=7.16 Гц), 6.62 (1Н, tt, J=2.26, 9.04 Гц), 6.70 (2H, m, J=1.88, 2.26, 6.4 Гц).
Стадия. 2 4-(3,5-Дифтор-фенил)-масляная кислота
Смесь неочищенного 4-(3,5-дифтор-фенил)-масляной кислоты пропилового эфира (3,3 кг), воды (4,4 кг) и 50% гидроксида натрия (3,35 кг) перемешивали в течение 1 ч при 50°С. За ходом гидролиза следили с помощью ЖХВД. Полученный раствор промывали гексаном (4,2 кг) с целью удаления органических примесей. Водный слой подкисляли концентрированной HCl (4,73 кг), и экстрагировали МТВЕ (4,23 кг). Данный раствор концентрировали, и остаток МТВЕ удаляли путем замены растворителя на н-гептан (4,0 литра) с получением неочищенной 4-(3,5-дифтор-фенил)-масляной кислоты (2,8 кг) в виде масла.1H-ЯМР (300 МГц): δ (CDCl3): 1.94 (2Н, p, J=7.54 Гц), 2.38 (2Н, t, J=7.54 Гц), 2.65 (2Н, t, J=7.54 Гц), 6.63 (1Н, tt, J=2.26, 9.04 Гц), 6.7 (2Н, m, J=2.26, 6.4 Гц), 11.70 (1Н, bs, COOH).
Стадия 3. 6,8-Дифтор-3,4-дигидро-2Н-нафталин-1-он
Смесь концентрированной серной кислоты (10,21 кг) и неочищенной 4-(3,5-дифтор-фенил)-масляной кислоты (2,8 кг) перемешивали при 45°С до тех пор, пока согласно ЖХВД реакция циклизации не была завершена. Реакционную смесь разбавляли водой (6,15 кг), и полученный продукт экстрагировали смесью ТГФ/метиленхлорид (2,71/7,33 кг). Органический слой промывали последовательно водой (4 литра), насыщенным водным раствором бикарбоната натрия (2,64 кг), водой (3,0 кг) и разбавленным в два раза солевым раствором (8,4 кг). После удаления растворителей получали 1,64 кг (выход: 62%) 6,8-дифтор-3,4-дигидро-2Р-нафталин-1-она в виде светло-желтого твердого вещества (чистота: 92,75% согласно ЖХВД). Т.пл.=58,1-58,8°С; Масс-спектр: (М+1)=183;1H-ЯМР (300 МГц): δ (ДМСО): 2.00 (21-1, p, J=6.4 Гц), 2.57 (21-1, t, J=6.40 Гц), 2.96 (2Н, t, J=6.40 Гц), 7.08-7.20 (21-1, m, J=2.26 Гц).
Стадия 4. 8-Фтор-6-фенилсульфанил-3,4-дигидро-2H-нафталин-1-он
Раствор 6,8-дифтор-3,4-дигидро-2H-нафталин-1-она (1,58 кг) в N,N-диметилацетамиде (4,65 литров) обрабатывали триэтиламином (877 г) и тиофенолом (954,9 г) при 20°С, и данную реакционную смесь перемешивали в течение 19 ч. Затем реакционную смесь обрабатывали гептаном (2,38 л), водой (9,5 л), и осадок отделяли путем фильтрования, полученную суспензию дважды промывали гептаном (каждый раз по 790 мл), три раза водой (каждый раз по 1,0 литру) и пять раз циклогексаном (каждый раз по 1,0 литру). Затем суспензию сушили с получением 8-фтор-6-фенилсульфанил-3,4-дигидро-2H-нафталин-1-она (1,86 кг, выход: 79%; чистота: 96,2% согласно ЖХВД), содержавшего примесь изомера 6-фтор-8-фенилсульфанил-3,4-дигидро-2Н-нафталин-1-он (выход: 3,6%). Т.пл.=111,7-112,7°С; Масс-спектр: (М+1)=273;1H-ЯМР (300 МГц): δ (ДМСО): 1.96 (21-1, p, J=6.4 Гц), 2.53 (2Н, t, J=6.03 Гц), 2.84 (2Н, t, J=6.03 Гц), 6.69 (1Н, dd, J=1.51, 12.06 Гц), 6.91 (1H, d, J=1.13 Гц), 7.5-7.61 (5H, m, Фенил).
Стадия 5. 8-Фтор-6-фенилсульфанил-3,4-дигидро-нафталин-1-карбоновой кислоты амид
8-Фтор-6-фенилсульфанил-3,4-дигидро-2Н-нафталин-1-он (1,855 кг, 6,793 моль), полученный на стадии 4, растворяли в толуоле (3,2 кг), и полученную смесь подвергали дистилляции под вакуумом при 50-55°С, пока не удаляли приблизительно 2 кг толуола. Оставшийся раствор охлаждали до 20°С, и добавляли AlCl3 (37 г). Затем в течение одного часа добавляли TMSCN (96%, 0,7 кг, 1,0 экв.) с такой скоростью, чтобы температура реакционной смеси оставалась в диапазоне 20-50°С. Завершение реакции определяли с помощью ТСХ (гексаны/EtOAc 4:1), подтверждая образование 8-фтор-6-фенилсульфанил-3,4-дигидро-нафталин-1-карбонитрила, который не выделяли.
Затем реакционную смесь охлаждали до 5°С, и медленно добавляли серную кислоту (1,7 кг), поддерживая температуру внутри смеси ниже 30°С.Через 10 мин реакционную смесь разбавляли уксусной кислотой (9,25 кг, 5,0 об.), серной кислотой (6,8 кг, 2,0 об.) и водой (0,93 кг, 0,5 об.). Затем реакционную смесь нагревали до 105°С, контролируя ход реакции с помощью ЖХВД. После завершения реакции (2,0 ч) реакционную смесь охлаждали и добавляли воду (10 об.). Полученный продукт отфильтровывали, дважды промывали водой (каждый раз по 5,5 кг) и затем в течение 1 ч растирали с EtOAc (17 кг) в химическом реакторе при температуре дефлегмации. Полученную суспензию охлаждали, фильтровали и дважды промывали EtOAc (каждый раз по 1,7 кг). Полученный продукт сушили при 35°С под вакуумом с выходом 1,56 кг 8-фтор-6-фенилсульфанил-3,4-дигидро-нафталин-1-карбоновой кислоты амида (77%, чистота: 98,3% согласно ЖХВД). Т.пл.=223,6-225,9°С; Масс-спектр: (М+1)=300;1H-ЯМР (300 МГц): δ (ДМСО): 2.22 (2Н, dt, J=7.54 Гц), 2.64 (2Н, t, J=7.54 Гц), 6.47 (1Н, t, J=4.90 Гц), 6.83 (1Н, dd, J=1.88, 10.93 Гц), 7.0 (1Н, m), 7.08 (1Н, bs, NH), 7.35-7.45 (5H, m, Фенил), 7.55 (1Н, bs, NH).
Стадия 6. ((R)-8-Фтор-6-Фенилсульфанил-1,2,3,4-тетрагидро-нафталин-1-ил)-метиламина гидрохлорид
Суспензию 8-фтор-6-фенилсульфанил-3,4-дигидро-нафталин-1-карбоновой кислоты амида (1,46 кг) в метаноле (23,2 кг) и [Ru(OAc)2((S)-MeOBIPHEP)] (1,83 г) в метаноле (1,5 литров) смешивали и подвергали гидрогенизации при 40°С и давлении 150 psi (10,3 бар (10,3·105 Па)). Завершение реакции контролировали с помощью ЖХВД по образованию (R)-8-фтор-6-фенилсульфанил-1,2,3,4-тетрагидро-нафталин-1-карбоновой кислоты амида, который не выделяли. Полученную реакционную смесь подвергали дистилляции, и метанол заменяли на ТГФ (7,6 кг). Анализ аликвот ТГФ-раствора давал следующие результаты: Т.пл.=167,4-168,2°С; Масс-спектр: (М+1)=302;1H-ЯМР (300 МГц): δ (ДМСО): 1.56-1.84 (21-1, m), 1.91 (2Н, m), 2.66 (2Н, m), 3.67 (1Н, t, J=5.65 Гц), 6.80 (1Н, dd, J=1.88, 10.17 Гц), 6.88 (1Н, bs, NH), 6.92 (1Н, m), 7.32-7.44 (6Н, m, фенил, NH): [α]D=30,5° (МеОН). Хиральный анализ (нормализация по площади): колонка: ChiralCel OD-H (250X 4,6 мм); подвижная фаза: гексан/этанол (85/15, изократическая); скорость потока: 0,7 мл/мин; 25°С; УФ: 230nm.: (R)-изомер (99,32)/(S)-изомер (0,68).
Затем ТГФ-раствор обрабатывали комплексом боргидрид-ТГФ (1,0 М раствор в ТГФ, 22,3 кг), и данную реакционную смесь нагревали до 55°С при давлением 5 psi (34,475·103 Па) в течение 20 ч. Затем реакционную смесь медленно переносили в 10% водный раствор серной кислоты (24,3 кг), поддерживая температуру в диапазоне от 5 до 10°С. Полученный раствор обрабатывали 28% водным раствором гидроксид а аммония (7,05 кг), пока значение pH не становилась равным приблизительно 10, и затем нагревали до 40°С. Полученную двухфазовую смесь разделяли, и органический слой подвергали атмосферной дистилляции с целью удаления растворителя (ТГФ), который затем заменяли изопропилацетатом (12,8 кг). Полученный раствор промывали последовательно водой (4,0 кг) и солевым раствором (5,1 кг). Затем раствор охлаждали до 5°С и обрабатывали 6 н. HCl в изопропаноле (1,69 кг). Данную смесь нагревали и подвергали атмосферной дистилляции, растворитель отгоняли при температуре 90°С, и замещали его изопропилацетатом. Полученное твердое вещество выделяли путем фильтрования, промывали охлажденным изопропилацетатом (3,84 кг) и сушили под вакуумом с выходом С-((R)-8-фтор-6-фенилсульфанил-1,2,3,4-тетрагидро-нафталин-1-ил)-метиламина гидрохлорида (1,38 кг, выход: 87,8%, чистота: 99,5% согласно ЖХВД, энантиомерный избыток: 96,88% согласно хиральной ЖХВД). Т.пл.=232,5-233,8°С; Масс-спектр: (М+1)=288;1Н-ЯМР (300 МГц): δ (ДМСО): 1.55-1.78 (3Н, m), 2.08 (1Н, bd), 2.55-2.80 (2H, m), 2.89 (2Н, bs), 3.31 (1Н, bt), 6.85 (1Н, dd J=1.51, 10.55 Гц), 6.91 (1Н, s), 7.33-7.46 (5H, m), 8.37 (2H, bs, MHz); [α]D=31,8° (МеОН). Хиральный анализ (нормализация по площади): колонка: Chiralpak AD-H (150X 4,6 мм); подвижная фаза гексан/этанол с 0,1% изопропиламином (95/5, изократическая); скорость потока: 0,7 мл/мин; 25°С; УФ: 30 нм: (R)-изомер (98,44)/(S)-изомер (1,56).
Стадия 7. N-((R)-8-Фтор-6-фенилсульфанил-1,2,3,4-тетрагидро-нафталин-1-ил метил)-ацетамид
Смесь С-((R)-8-фтор-6-фенилсульфанил-1,2,3,4-тетрагидро-нафталин-1-ил)-метиламина гидрохлорида (1,36 кг), DMAP (10 г), ацетонитрила (8,6 л), триэтиламина (1,27 л) и уксусного ангидрида (0,41 л) перемешивали при 25°С. Через тридцать минут добавляли воду (17,5 л). Полученную суспензию перемешивали в течение 30 мин при 25°С. Данный продукт выделяли путем фильтрования и промывали 7,5 л воды. После сушки в течение ночи при 50°С получали 1,34 кг N-((R)-8-фтор-6-фенилсульфанил-1,2,3,4-тетрагидро-нафталин-1-илметил)-ацетамида (выход: 97,4%, чистота: 99,66% согласно ЖХВД, энантиомерный избыток: 98,08%). Т.пл.=94,6-95,9°С; Масс-спектр: (М+1)=330;1H-ЯМР (300 МГц): δ (ДМСО): 1.44-1.91 (4Н, m), 1.83 (3H, s), 2.54-2.79 (2H, m), 3.06 (1Н, m), 3.16 (2Н, m), 6.83 (11-1, dd,=1.51, 10.17 Гц), 6.90 (1H, bs), 7.30-7.45 (5Н, m, фенил), 8.01 (1Н, bt, J=5.65 Гц, NH); [α]D=7,4° (МеОН). Хиральный анализ (нормализация по площади): колонка: ChiralpakAD-H (150Х 4,6 мм); подвижная фаза гексан/этанол(88/12, изократическая); скорость потока 0,7 мл/мин; 25°С; УФ: 230 нм.: (R)-изомер (99,04)/(S)-изомер (0,96)
Стадия 8. N-((R)-8-Фтор-6-Фенилсульфонил-1,2,3,4-тетрагидро-нафталин-1-илметил)-ацетамид
N-((R)-8-Фтор-6-фенилсульфанил-1,2,3,4-тетрагидро-нафталин-1-илметил)-ацетамид (1,32 кг) суспендировали в метиленхлориде (8 литров) и обрабатывали 98% раствором муравьиной кислоты (455 г). Полученный раствор в два приема обрабатывали 30% перекисью водорода (2,38 кг). После добавления первой порции перекиси водорода измеряли температуру, и, когда температура стабилизировалась, добавляли вторую порцию. Затем реакционную смесь перемешивали в течение 23 ч. Добавляли еще одну порцию муравьиной кислоты (230 г) и перекиси водорода (1,32 кг), и реакционную смесь перемешивали дополнительно в течение 12 ч. Когда согласно ЖХВД реакция завершалась, добавляли воду (1,8 литра), и фазы разделяли. Метиленхлоридный слой промывали насыщенным раствором бикарбоната натрия (5 кг) и водой (три раза по 5 литров), пока в водном слое не переставали регистрировать пероксид, затем метиленхлоридный слой промывали солевым раствором (6,54 кг) и концентрировали при пониженном давлении. Растворитель заменяли метанолом. Массу оставшегося метанола доводили до массы равной массе исходного соединения (1,3 кг). Полученный раствор фильтровали и затем обрабатывали стерильной водой до температуры помутнения раствор, вызывая кристаллизацию, которая продолжалась в течение 4 ч. Добавляли еще одну порцию стерильной воды для фильтрования до общей массы равной 3,38 кг, и данную смесь перемешивали до тех пор, пока температура смеси не достигла комнатной температура. Полученный продукт фильтровали, промывали смесью метанол/стерильная вода (1:2) и сушили в вакуумной печи при 50°С до постоянной массы с получением N-((R)-8-фтор-6-фенилсульфонил-1,2,3,4-тетрагидро-нафталин-1-илметил)-ацетамида (1,4 кг, чистота: 99,8% согласно ЖХВД, энантиомерный избыток R-изомера: 98,54% согласно хиральному анализу). Т.пл.=152,5-153,8°С; Масс-спектр: (М+1)=362;1H-ЯМР (300 МГц): δ (ДМСО): 1.45-1.93 (4H, m), 1.84 (3H, s), 2.74 (1H, dq, J=6.03, 10.55 Гц), 2.91 (1H, bdt), 3.17 (3H, m), 7.54-7.75 (5H, m, фенил), 8.01 (1H, dd, J=1.88, 7.53 Гц), 8.06 (1H, bt, NH); [α]D=39,7° (МеОН). Хиральный анализ (нормализация по площади): колонка: Chiralpak IA (150Х 4,6 мм); подвижная фаза: гексан/этанол/метанол(20/40/40, изократическая); скорость потока: 0,7 мл/мин; 25°С; УФ: 230 нм: (R)-изомер (99,27)/(S)-изомер (0,73).
Пример 3
[(R)-8-Фтор-6-(3-фтор-бензолсульфонил)-1,2,3,4-тетрагидро-нафталин-1-илметил]-мочевина
Методика синтеза, использованная в данном Примере, приведена на Схеме Е.

Стадия 1. 8-Фтор-6-(3-Фтор-Фенилсульфанил)-3,4-дигидро-2Н-наФталин-1-он
Раствор 6,8-дифтор-3,4-дигидро-2H-нафталин-1-она (50 г) в N,N'-диметилацетамиде (100 мл) обрабатывали триэтиламином (38,2 мл), и затем 3-фтортиофенолом (28,2 мл), поддерживая температуру ниже 20°С. Реакционную смесь оставляли перемешиваться в течение 18 ч при температуре окружающей среды. Затем реакционную смесь разбавляли МТВЕ (70 мл) и охлаждали в ледяной бане. Медленно добавляли воду (300 мл), поддерживая температуру ниже 25°С, и данную смесь выдерживали в течение 1 ч. Полученный продукт собирали путем фильтрования, промывали водой и циклогексаном и сушили с выходом 8-фтор-6-(3-фтор-фенилсульфанил)-3,4-дигидро-2Н-нафталин-1-она в виде бледно-желтого твердого вещества (выход 53,5 г, чистота: 95% согласно ЖХВД). Т.пл.=126,0-126,9°С; Масс-спектр: (М+1)=291;1Н-ЯМР (300 МГц): δ (ДМСО): 1.97 (2Н, pen, J=6.03 Гц), 2.55 (2Н, t, J=6.03 Гц), 2.88 (2Н, t, J=6.03), 6.84 (1Н, dd, J=1.88, 12.06 Гц) 7.01 (1Н, d, J=1.03 Гц), 7.31-7.44 (3H, m), 7.52-7.59 (1Н, dd/d, J=6.03, 6.41 Гц).
Стадия 2. 8-Фтор-6-(3-Фтор-фенилсульфанил)-3,4-дигидро-наФталин-1-карбоновой кислоты амид
8-Фтор-6-(3-фтор-фенилсульфанил)-3,4-дигидро-2H-нафталин-1-он (50 г, 0,17 мол) растворяли в толуоле (100 мл), и полученную смесь подвергали азеотропной дистилляции под вакуумом при температуре в диапазоне от 50 до 55°C до тех пор, пока не удаляли приблизительно 50 мл толуола. Полученную суспензию охлаждали до 25°С, и добавляли AlCl3 (1 г, 2,0% мас./мас.). Затем добавляли TMSCN (96%, 24 мл, 0,17 мол) с такой скоростью, чтобы температура реакционной смеси оставалась в диапазоне от 20 до 50°С. За ходом реакции следили с помощью ТСХ (гексаны/EtOAc 4:1), регистрируя образование 8-фтор-6-(3-фтор-фенилсульфанил)-3,4-дигидро-нафталин-1-карбонитрила (который не выделяли). После завершения реакции реакционную смесь охлаждали до 5°С, и медленно добавляли серную кислоту (25 мл), поддерживая температуру внутри смеси ниже 30°С. Реакционную смесь перемешивали, наблюдая за ходом реакции с помощью ТСХ (гексаны/EtOAc 4:1). После завершения реакции реакционную смесь разбавляли уксусной кислотой (250 мл), серной кислотой (100 мл) и водой (25 мл). Реакционную смесь нагревали до 105°С, чтобы отогнать летучие компоненты. Температуру реакционную смесь поддерживали в диапазоне от 100 до 105°С, за ходом реакции следили с помощью ЖХВД. После завершения реакции реакционную смесь охлаждали до 40°С и гасили водой (500 мл) в течение 1 ч при температуре в диапазоне от 40 до 45°С. Затем реакционную смесь охлаждали до 20°С, фильтровали с использованием воронки со стеклянным фильтром, тщательно промывали водой, растирали с EtOAc (500 мл) при температуре дефлегмации в течение 1 ч, затем медленно охлаждали до 20°С, фильтровали с использованием воронки со стеклянным фильтром и промывали EtOAc. Полученный продукт переносили в сушильный вакуумный шкаф, сушили при 45°С под вакуумом, используя продувание азотом, до постоянной массы с выходом 8-фтор-6-(3-фтор-фенилсульфанил)-3,4-дигидро-нафталин-1-карбоновой кислоты амида в виде желтого твердого вещества (43,1 г, выход: 79%, чистота: 99% согласно ЖХВД). Т.пл.=212,9-213,7°С; Масс-спектр: (М+1)=318;1H-ЯМР (300 МГц): δ (ДМСО): 2.25 (2Н, m, J=7.91/7.16 Гц), 2.68 (2Н, t, J=7.16/7.91 Гц), 6.52 (1Н, t, J=4.7 Гц), 7.01 (11-1, dd, J=1.51,10.55 Гц), 7.11 (1Н, bs, NH) 7.14-7.23 (4H, m), 7.4-7.49 (1Н, m), 7.57 (1H, bs, NH).
Стадия 3. Соль Фосфорной кислоты 3 [(R)-8-Фтор-6-(3-фтор-фенилсульфанил)-1,2,3,4-тетрагидро-нафталин-1-ил]-метиламина
К дегазированному раствору 8-фтор-6-(3-фторфенилсульфанил)-3,4-дигидронафталин-1-карбоксамида (42 г) в тетрагидрофуране (420 мл) добавляли дегазированный раствор [Ru(OAc)2((S)-MeOBIPHEP)] (120 мг) в тетрагидрофуране (50 мл). Данную реакционную смесь обрабатывали газообразным водородом при 40°С и давлении 150 psi (10,3 бар, 10,3·105 Па) в течение 20 ч. Завершение гидрогенизации олефина определяли, наблюдая за ходом реакции с помощью ЖХВД. Из раствора промежуточного (R)-8-фтор-6-(3-фторфенилсульфанил)-1,2,3,4-тетрагидронафталин-1-карбоновой кислоты амида (не выделяли) удаляли при пониженном давлении растворитель, а оставшуюся жидкость обрабатывали BH3-ТГФ (1 М раствор в ТГФ, 660 мл). Химический реактор герметично закрывали, нагревали до 60°С, и перемешивали в течение 36 ч. Реакционную смесь гасили в 10% водном растворе серной кислоты (650 мл) при 5°С. pH раствора доводили до 9,4 путем добавления 28% водного раствора гидроксида аммония, и разделяли слои полученной двухфазной смеси. Органический слой концентрировали до приблизительно 600 мл, обрабатывали фосфорной кислотой (18,3 г) и изопропанолом (60 мл). Оставшийся тетрагидрофуран удаляли путем атмосферной дистилляции и замещали изопропанолом. Полученный раствор охлаждали до 5°С, образовавшуюся суспензию выдерживали и затем фильтровали. Данный продукт сушили при 60°С под вакуумом, используя продувание азотом, с получением 50 г соли фосфорной кислоты [(R)-8-фтор-6-(3-фтор-фенилсульфанил)-1,2,3,4-тетрагидро-нафталин-1-ил]-метиламина (выход: 94%, чистота: 100% согласно ЖХВД). Т.пл.=197,5-199,2°С; Масс-спектр: (М+1)=306;1H-ЯМР (300 МГц): δ (ДМСО): 1.58-1.85 (3Н, m), 2.05-2.16 (1Н, m), 2.58-2.78 (2Н, m), 2.8 (1H, dd, J=12.43 Гц) 2.94 (1Н, dd, J=3.77, 12.81 Гц), 3.21-3.31 (1Н, m), 6.90(1Н, dd, J=1.51, 10.17 Гц), 6.97(1H, s), 7.06-7.17 (3H, m), 7.36-7.44 (1Н, m), 7.92 (5H, bs, NH/H3PO4); [α]D=20,9° (MeOH).
Стадия 4. [(R)-8-Фтор-6-(3-Фтор-Фенилсульфанил)-1,2,3,4-тетрагидро-нафталин-1-илметил]-мочевина
Соль фосфорной кислоты (Р)-8-фтор-6-(3-фторфенилсульфанил)-1,2,3,4-тетрагидронафталин-1-ил-метиламина обрабатывали мочевиной (27,5 г) в безводном N-метилпирролидиноне (140 мл) в течение 18 ч при 100°С. Затем реакционную смесь охлаждали до 70°С, и добавляли по каплям воду (360 мл), позволяя температуре смеси понизиться до комнатной температуры. Полученное твердое вещество собирали и промывали водой. Неочищенный отфильтрованный осадок (46 г) перекристаллизовывали из толуола (160 мл) и н-гептана (60 мл) с получением [(R)-8-фтор-6-(3-фтор-фенилсульфанил)-1,2,3,4-тетрагидро-нафталин-1-илметил]-мочевины (37,27 г, выход: 93,8%, чистота: 99,8% согласно ЖХВД). Т.пл.=130,7-132,4°С; Масс-спектр: (М+1)=349;1H-ЯМР (300 МГц): δ (ДМСО): 1.49-1.99 (4Н, m), 2.57-2.83 (21-1, dt/m), 3.99-3.27 (3Н, m), 5.43 (2Н, bs, NH), 6.20 (1Н, bt, J=6.03), 6.96-7.04 (2H, m), 7.1-7.17 (2Н, m), 7.37-7.47 (1Н, m); [α]D=24,2° (MeOH).
Стадия 5. [(R)-8-Фтор-6-(3-Фтор-бензолсульфонил)-1,2,3,4-тетрагидро-нафталин-1-илметил]-мочевина
(R)-8-Фтор-6-(3-фторфенилсульфанил)-1,2,3,4-тетрагидронафталин-1-илметилмочевину (36 г) в дихлорметане обрабатывали муравьиной кислотой (11,9 г) и 30% водным раствором перекиси водорода при перемешивании в течение 18 ч. Затем реакционную смесь разбавляли метиленхлоридом (1 литр) и водой (200 мл), чтобы растворить образовавшееся твердое вещество. Слои разделяли, и органический слой промывали последовательно насыщенным водным раствором бикарбоната натрия (200 мл) и водой (три раза по 200 мл), пока в органическом слое не оставалось пероксида. Полученный метиленхлоридный слой фильтровали и подвергали дистилляции, чтобы минимизировать объем, и собирали полученное твердое вещество. Данный неочищенный продукт перекристаллизовывали из метанола (720 мл), фильтровали и сушили в вакуумной печи при 50°С, с получением [(R)-8-фтор-6-(3-фтор-бензолсульфонил)-1,2,3,4-тетрагидро-нафталин-1-илметил]-мочевины (37 г; выход: 95%, 99,7% и 99,8% согласно хиральной ЖХВД). Т. пл.=193,5-194,4°С; Масс-спектр: (М+1)=381;1H-ЯМР (300 МГц): δ (ДМСО): 1.46-1.96 (4Н, m), 2.66-2.80 (1Н, ddd, J=6.40, 10.55 Гц), 2.84-2.96 (1Н, dt) 3.00-3.22 (3H, m) 5.40 (2Н, bs, NH2), 6.20 (1H, bt, J=6.40 Гц, NH) 7.57 (1H, dd, J=1.13, 8.29 Гц), 7.62 (1Н, s/m), 7.64-7.74 (21-1, ddd, J=5.27, 5.65, 8.29 Гц), 7.83-7.93 (2Н, ddt, J=1.88, 2.26, 7.54, 8.29 Гц); [α]D=25,7° (МеОН). Хиральный анализ (нормализация по площади): колонка: Chiralpak IA (150Х 4,6 мм); подвижная фаза: этанол (изократическая); скорость потока: 0,7 мл/мин; 25°С; УФ: 247 нм: (R)-изомер (99,94)/(S)-изомер (0,06).
Пример 4
Сравнение хиральных катализаторов:
(R)- и (S)-6-(3-Фтор-фенилсульфанил)-1,2,3,4-тетрагидро-нафталин-1-карбоновой кислоты амид
Методика синтеза, использованная в данном Примере, приведена на Схеме F

В автоклав объемом 6 мл, оснащенный стеклянным вкладышем и якорем магнитной мешалки, помещенный в перчаточную камеру (содержание O2≤2 м.д.), вносили 50 мг (0,167 ммоль) 6-(3-фтор-фенилсульфанил)-3,4-дигидро-нафталин-1-карбоновой кислоты амида, 6,45 мг (0,00668 ммоль) [Ru(трифторацетат)2((S)-pTol-MeOBIPHEP)] (S/C: 25) и 1 мл метанола. Асимметрическую гидрогенизацию проводили в течение 19,5 ч при 40°С в атмосфере водорода при давлении 40 бар (40·105 Па). После охлаждения до комнатной температуры в автоклаве сбрасывали давление, метанольный раствор фильтровали через подушку силикагеля и упаривали под вакуумом с получением (R)-6-(3-фтор-фенилсульфанил)-1,2,3,4-тетрагидро-нафталин-1-карбоновой кислоты амида (количественный выход; соотношение энантиомеров: 99:1; эффективность превращения: >=99,9%).
Энантиомерное соотношение определяли с помощью ЖХВД с использованием колонки Chiralcel-AS-H (25 см×4,6 мм). Элюенты: н-гептан/этанол/гептан с 0,1% диэтиламином (40%/50%/10%). Скорость потока: 1 мл/мин, 40°С, 1 мкл. Вводимый объем: 210 нм. Время удержания: (R)-6-(3-фтор-фенилсульфанил)-1,2,3,4-тетрагидро-нафталин-1-карбоновой кислоты амид: 7,3 мин; 6-(3-фтор-фенилсульфанил)-3,4-дигидро-нафталин-1-карбоновой кислоты амид: 8,3 мин; (S)-6-(3-фтор-фенилсульфанил)-1,2,3,4-тетрагидро-нафталин-1-карбоновой кислоты амид: 9,7 мин.
Вышеописанную методику повторяли с использованием различных хиральных рутениевых катализаторов с целью получения соответствующих (R)- и (S)-изомеров 6-(3-фтор-фенилсульфанил-1,2,3,4-тетрагидро-нафталин-1-карбоновой кислоты амида. Полученные результаты приведены в Таблице 2, в которой указаны название катализатора, время, % превращения и энантиомерное соотношение. Во всех экспериментах использовали 50 мг субстрата и температуру 40°С. Примеры 4.6-4.23 выполняли с использованием соотношения S/C=50.
В вышеописанной методике с некоторыми хиральными рутениевыми катализаторами в качестве растворителя вместо метанола использовали трифторэтанол. Результаты, полученные с использованием в качестве растворителя трифторэтанола, приведены в Таблице 3.
Как следует из Таблиц 2 и 3, асимметрическое восстановление в метаноле проходит более специфично, то есть с большей энантиомерной селективностью, чем в соответствующих реакциях с использованием трифторэтанола. [RuCl((R,R)-Et-Duphos)(пара-цимен)]Cl, худший катализатор в метаноле в смысле выхода и энантиомерной селективности, по существу является нереакционноспособным в трифторэтаноле. [Ru(OAc)2(iPr-MeOBIPHEP)] и [Ru(OAc)2(PPF-P(tBu)2)] обладают высокой энантиомерной селективностью как в отношении (R), так и в отношении (S)-энантиомеров.
Пример 5
Сравнение хиральных катализаторов в кислых условиях:
(R)- и (S)-6-(3-Фтор-фенилсульфанил)-1,2,3,4-тетрагидро-нафталин-1-карбоновой кислоты амид
Раствор катализатора получали в результате взаимодействия раствора 6,45 мг (0,00668 ммоль) [Ru(трифторацетат)2((s)-pTol-MeOBIPHEP)] (S/C: 25) в 0,5 мл метанола с 0,5 мл метанола, содержащего 0,020 ммоль HCl, и перемешивания в течение 2 ч при комнатной температуре, используя автоклав объемом 6 мл, оснащенный стеклянным вкладышем и помещенный в перчаточную камеру (содержание О2≤2 м.д.). Добавляли 50 мг (0,167 ммоль) 6-(3-фтор-фенилсульфанил)-3,4-дигидро-нафталин-1-карбоновой кислоты амида, и проводили асимметрическую гидрогенизацию в течение 18 ч при 40°С в атмосфере водорода при давлении 40 бар (4·106 Па). После охлаждения до комнатной температуры в автоклаве сбрасывали давление, метанольный раствор фильтровали через подушку силикагеля и упаривали под вакуумом с получением (R)-6-(3-фтор-фенилсульфанил)-1,2,3,4-тетрагидро-нафталин-1-карбоновой кислоты амида (количественный выход; соотношение энантиомеров 98,8:1,2; эффективность превращения: >=99,9%).
Данную реакцию повторяли с другими катализаторами в соответствии с вышеописанной методикой, и полученные результаты приведены в Таблице 4. Во всех экспериментах использовали 50 мг субстрата и температуру 40°С.
Пример 6
(R)-6-(3-Фтор-фенилсульфанил)-1,2,3,4-тетрагидро-нафталин-1-карбоновой кислоты амид
В автоклав объемом 35 мл, оснащенный стеклянным вкладышем и якорем магнитной мешалки, помещенный в перчаточную камеру (содержание O2≤2 м.д.), вносили 250 мг (0,835 ммоль) 6-(3-фтор-фенилсульфанил)-3,4-дигидро-нафталин-1-карбоновой кислоты амида, 4,03 мг (0,00418 ммоль) [Ru(трифторацетат)2((S)-pTol-MeOBIPHEP)] (S/C: 200) и 3 мл метанола. Асимметрическую гидрогенизацию проводили в течение 24 ч при 40°С в атмосфере водорода при давлении 40 бар (4·106 Па). После охлаждения до комнатной температуры в автоклаве сбрасывали давление, метанольный раствор упаривали под вакуумом. Остаток растворяли в дихлорметане (4 мл) и фильтровали через подушку силикагеля, которую промывали в сумме 6 мл дихлорметана. В результате упаривания фильтрата и сушки (50°С/10 мбар (103 Па)/2 ч) получали 232 мг (R)-6-(3-фтор-фенилсульфанил)-1,2,3,4-тетрагидро-нафталин-1-карбоновой кислоты амида в виде светло-желтого твердого вещества (соотношение энантиомеров: 99:1;. эффективность превращения: >=99,9%).
Пример 7
(R)-6-(3-Фтор-фенилсульфанил)-1,2,3,4-тетрагидро-нафталин-1-карбоновой кислоты амид
В автоклав объемом 35 мл, оснащенный стеклянным вкладышем и якорем магнитной мешалки, помещенный в перчаточную камеру (содержание O2≤2 м.д.), вносили 0,40 г (1,336 ммоль) 6-(3-фтор-фенилсульфанил)-3,4-дигидро-нафталин-1-карбоновой кислоты амида, 1,29 мг (0,00134 ммоль) [Ru(трифторацетат)2((S)-pTol-MeOBIPHEP)] (S/C: 1000) и 4 мл метанола. Асимметрическую гидрогенизацию проводили в течение 24 ч при 40°С в атмосфере водорода при давлении 40 бар (4·106 Па). После охлаждения до комнатной температуры в автоклаве сбрасывали давление, метанольный раствор упаривали под вакуумом. Полученный продукт выделяли, как описано в Примере 4, и сушили с получением 405 мг (R)-6-(3-фтор-фенилсульфанил)-1,2,3,4-тетрагидро-нафталин-1-карбоновой кислоты амида в виде светло-желтого твердого вещества (соотношение энантиомеров: 99:1; эффективность превращения: >=99,9%).
Данную реакцию повторяли с другими катализаторами в соответствии с вышеописанной методикой, полученные результаты приведены в Таблице 5. Во всех экспериментах использовали 0,40 г субстрата, температуру 40°С, давление водорода в примерах 7.3 и 7.5 составляло 10 бар (106 Па).
Пример 8
(R)-6-(3-Фтор-фенилсульфанил)-1,2,3,4-тетрагидро-нафталин-1-карбоновой кислоты амид
В автоклав объемом 50 мл, оснащенный механической мешалкой и помещенный в перчаточную камеру (содержание О2≤2 м.д.), вносили 4,00 г (13,36 ммоль) 6-(3-фтор-фенилсульфанил)-3,4-дигидро-нафталин-1 -карбоновой кислоты амида, 1,07 мг (0,00134 ммоль) [Ru(OAc)2((S)-MeOBIPHEP)] (S/C: 10000) и 28 мл метанола. Асимметрическую гидрогенизацию проводили в течение 18 ч при 40°С в атмосфере водорода при давлении 9 бар (9·105 Па). После охлаждения до комнатной температуры в автоклаве сбрасывали давление, метанольный раствор упаривали под вакуумом. Полученный продукт выделяли, как описано в Примере 4, и сушили с получением (R)-6-(3-фтор-фенилсульфанил)-1,2,3,4-тетрагидро-нафталин-1-карбоновой кислоты амида в виде желтоватого твердого вещества (количественный выход; соотношение энантиомеров: 99:1; эффективность превращения: >=99,8%).
Данную реакцию повторяли с другими катализаторами в соответствии с вышеописанной методикой, полученные результаты приведены в Таблице 6. В экспериментах 8.1-8.4 использовали 4,00 г субстрата, а в экспериментах 8.5-8.10 2 г субстрата.
Пример 9
(R)-6-(3-Фтор-фенилсульфанил)-1,2,3,4-тетрагидро-нафталин-1-карбоновой кислоты амид
В автоклав объемом 35 мл, оснащенный стеклянным вкладышем и якорем магнитной мешалки, помещенный в перчаточную камеру (содержание O2≤2 м.д.), вносили 0,40 г (1,336 ммоль) 6-(3-фтор-фенилсульфанил)-3,4-дигидро-нафталин-1-карбоновой кислоты амида, 2,36 мг (0,00267 ммоль) [Ru(OAc)2((S)-MeOBIPHEP)] (S/C 500) и 4 мл этанола. Асимметрическую гидрогенизацию проводили в течение приблизительно 16 ч при 40°С в атмосфере водорода при давлении 40 бар (4·106Па). После охлаждения до комнатной температуры в автоклаве сбрасывали давление, этанольный раствор упаривали под вакуумом. Полученный продукт выделяли, как описано в Примере 4, и сушили с получением (R)-6-(3-фтор-фенилсульфанил)-1,2,3,4-тетрагидро-нафталин-1-карбоновой кислоты амида в виде светло-желтого твердого вещества (по существу количественный выход; соотношение энантиомеров: 99:1; эффективность превращения: >=99,9%).
Данную реакцию повторяли в других растворителях в соответствии с вышеописанной методикой, полученные результаты приведены в Таблице 7. Во всех экспериментах использовали 0,40 г субстрата, температуру 40°С, давление водорода составляло 40 бар (4·106 Па).
Пример 10
Исследования связывания радиолигандов
Данный пример иллюстрирует исследования соединения формулы I путем in vitro связывания радиолигандов.
In vitro активность связывания соединений по данному изобретению определяли следующим образом. Двукратные измерения сродства 5-НТ6-лиганда выполняли путем конкурентного связывания [3H]ЛСД (диэтиламида лизергиновой кислоты) на клеточных мембранах, полученных из клеток НЕК293, стабильно экспрессирующих рекомбинантный 5-НТ6-рецептор человека. Двукратные измерения сродства 5-НТ2А-лиганда выполняли путем конкурентного связывания [3]кетансерина (3-(2-(4-(4-фторбензоил)пиперидинол)этил)-2,4(1Н,3Н)-хиназолиндиона) на клеточных мембранах, полученных из клеток СНО-K1, стабильно экспрессирующих рекомбинантный 5-НТ2А-рецептор человека. Мембраны из клеточных линий НЕК 293 приготавливали с использованием методики, описанной Monsma et al., Molecular Pharmacology, Vol.43 pp.320-327 (1993), а из клеточных линий СНО-K1 таким образом, как описано Bonhaus et al., Br J Pharmacol. Jun; 115(4): 622-8 (1995).
При определении сродства к рецептору 5-НТ6 все измерения выполняли в буфере для анализа, содержащем 50 мМ Tris-HCl, 10 мМ MgSO4, 0,5 мМ ЭДТА (этилендиаминтетраацетат), 1 мМ аскорбиновую кислоту, pH 7,4, при 37°С, в реакционном объеме 250 микролитров. При определении сродства к рецептору 5-НТ2А все измерения выполняли в буфере для анализа, содержащем 50 мМ Tris-HCI, 5 мМ аскорбиновую кислоту, 4 мМ CaCl2, pH 7,4, при 32°С, в реакционном объеме 250 микролитров.
Аналитические пробирки, содержащие [3]ЛСД или [3H]кетансерин (5 нМ), конкурирующий лиганд и мембрану, инкубировали в водном термостатированном шейкере в течение 75 минут при 37°С (5-НТ6) или в течение 60 минут при 32°С (5-НТзд), фильтровали в Packard GF-B планшетах (предварительно смоченных 0,3% PEI (полиэтиленимином)) с использованием 96-луночного харвестера клеток Packard, и промывали 3 раза охлажденным до 0°С 50 мМ Tris-HCl. Связывание [3H]ЛСД или [3H]кетансерина определяли по числу радиоактивных распадов в минуту с использованием Packard TopCount.
Вытеснение [3H]ЛСД или [3H]кетансерина из сайтов связывания количественно определяли путем приближения данных зависимости концентрация-связывание к 4-параметрическому логистическому уравнению:

где Hill представляет собой коэффициент Хилла, [лиганд] представляет собой концентрацию конкурирующего радиолиганда и IC50 представляет собой концентрацию радиолиганда, обеспечивающую половину от максимального специфического связывания радиолиганда. Окно специфического связывания представляет собой разницу между параметрами Втах и «базальное».
С использованием методики данного Примера было найдено, что связывание соединений (R)-[6-(3-фтор-бензолсульфонил)-1,2,3,4-тетрагидро-нафталин-1-илметил]-мочевина, [(R)-8-фтор-6-(3-фтор-бензолсульфонил)-1,2,3,4-тетрагидро-нафталин-1-илметил]-мочевина и (R)-N-(6-бензолсульфонил-8-фтор-1,2,3,4-тетрагидро-нафталин-1-илметил)-ацетамид с рецептором 5-НТ6 характеризуется следующими значениями pKi: 10,0, 9,8 и 9,75, соответственно.
Хотя настоящее изобретение описано со ссылкой на его конкретные воплощения, специалистам в данной области техники должно быть понятно, что могут быть сделаны различные изменения и эквивалентные замены без отклонения от истинной сущности и объема изобретения. Кроме того, могут быть сделаны многочисленные модификации с целью адаптации конкретной ситуации, вещества, композиции вещества, способа, стадии или стадий способа к задаче, сущности и объему настоящего изобретения. Подразумевается, что все такие модификации входят в объем формулы изобретения, прилагаемой к данной заявке.
Реферат
Изобретение относится к способу получения соединения Формулыили, где m имеет значение 0 или 1; n имеет значение от 0 до 3; Ar представляет собой: арил или гетероарил, каждый из которых может быть возможно замещенным и иметь в качестве заместителей галогено, Cалкил, Салкокси, циано, гидрокси, Салкилсульфонил или галогено-Cалкил; Y представляет собой -O-; -S(O)- или -N-R, где p имеет значение от 0 до 2 и Rпредставляет собой атом водорода или Cалкил; и Rпредставляет собой галогено, Салкил, Салкокси или галогено-Cалкил. Способ осуществляют путем восстановления дигидронафталинового амида Формулыгазообразным водородом в присутствии рутениевого катализатораили, где D представляет собой возможно хиральный диамин, каждый из Е и Е' представляет собой галогено, или Е представляет собой атом водорода и Е' представляет собой BH; L представляет собой хиральный дифосфин лиганд; Z представляет собой галогено или R-CO- (карбоксилат), где Rпредставляет собой: Салкил, галогено-Cалкил, Cалкокси, арил, возможно имеющий в качестве заместителей атом галогена, или гетероарил, возможно имеющий в качестве заместителей атом галогена. Путем восстановления соединенийимогут быть получены соответствующие соединенияФормули, которые при взаимодействии с реагентом Формулы X-R, где Х представляет собой уходящую группу; Rпредставляет собой -С(O)-Rили -SO-R, где Rпредставляет собой Cалкил или -NRR, каждый из Rи Rнезависимо представляет собой атом водорода или Cалкил, приводят к получению соединений Формулыи. Технический результат - усовершенствованный способ получения производных тетралина. 34 з.п. ф-лы, 6 ил., 7 табл., 10 пр.
Формула


где
m имеет значение 0 или 1;
n имеет значение от 0 до 3;
Ar представляет собой: арил или гетероарил, каждый из которых может быть возможно замещенным и иметь в качестве заместителей галогено, C1-6алкил, С1-6алкокси, циано, гидрокси, С1-6алкилсульфонил или галогено-C1-6алкил;
Y представляет собой -O-; -S(O)p- или -N-Ra, где p имеет значение от 0 до 2 и Ra представляет собой атом водорода или C1-6алкил; и
R1 представляет собой галогено, С1-6алкил, С1-6алкокси или галогено-C1-6алкил;
включающий восстановление дигидронафталинового амида Формулы i

газообразным водородом в присутствии катализатора Формулы j1 или j2


где
D представляет собой возможно хиральный диамин;
каждый из Е и Е' представляет собой галогено, или Е представляет собой атом водорода и Е' представляет собой BH4;
L представляет собой хиральный дифосфин лиганд; и
Z представляет собой галогено или Rb-CO2- (карбоксилат), где Rb представляет собой: С1-6алкил, галогено-C1-6алкил, C1-6алкокси, арил, возможно имеющий в качестве заместителей атом галогена, или гетероарил, возможно имеющий в качестве заместителей атом галогена.
MeOBIPHEP;
BIPHEMP;
ТМВТР;
2-(Нафтил)-MeOBIPHEP;
(6-МеО-2-Нафтил)-MeOBIPHEP;
2-(Тиенил)-MeOBIPHEP;
3,5-tBu-MeOBIPHEP;
PHANEPHOS;
BICP;
TriMeOBIPHEP;
(R,R,S,S)-Mandyphos;
BnOBIPHEP;
БeнзоилBIPHEP;
pTol-BIPHEMP;
трет-БутилCOOBIPHEP;
iPrOBIPHEP;
пара-Фенил-MeOBIPHEP;
pAn-MeOBIPHEP;
pTol-MeOBIPHEP;
3,5-Xyl-MeOBIPHEP;
3,5-Xyl-BIPHEMP;
BINAP;
2-Фурил-MeOBIPHEP;
3,5-Xyl-4-MeO-MeOBIPHEP и
BITIANP.
3,5-Ме,4-МеО-MeOBIPHEP;
3,5-iPr,4-MeO-MeOBIPHEP;
3,5-tBu,4-MeO-MeOBIPHEP;
3,5-TMS-MeOBIPHEP;
iPr-MeOBIPHEP;
Cy-MeOBIPHEP;
(2-Фурил)-BIPHEMP);
Et-Duphos и
PPF-P(tBu)2.


с получением соединения Формулы m1 или m2


где m, n, Y, Ar и R1 являются такими, как определено в п.1.
взаимодействие соединения Формулы m1 или m2


с реагентом Формулы n

с получением соединения Формулы о1 или о2


где
Х представляет собой уходящую группу;
R2 представляет собой -С(O)-Rc или -SO2-Rc, где Rc представляет собой C1-6алкил или -NRdRe, где каждый из Rd и Re независимо представляет собой атом водорода или C1-6алкил; и
m, n, Y, Ar и R1 являются такими, как определено в п.18.

с получением соединения Формулы i
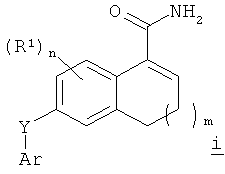
где m, n, Y, Ar и R1 являются такими, как определено в п.19.

цианатом и последующую обработку серной кислотой
с получением соединения Формулы i

где m, n, Y, Ar и R1 являются такими, как определено в любом из пп.19-21.

где
n имеет значение от 0 до 3;
p имеет значение от 0 до 1;
R1 представляет собой галогено, С1-6алкил, C1-6алкокси или галогено-С1-6алкил; и
R3 представляет собой галогено, С1-6алкил, C1-6алкокси, циано, гидрокси, С1-6алкилсульфонил или галогено-С1-6алкил;
включающий
восстановление соединения Формулы y

газообразным водородом в присутствии катализатора Формулы j1 или j2


где
D представляет собой возможно хиральный диамин;
каждый из Е и Е' представляет собой галогено, или Е представляет собой атом водорода и Е' представляет собой BH4;
L представляет собой хиральный дифосфиновый лиганд; и
Z представляет собой галогено или Rb-CO2- (карбоксилат), где Rb представляет собой: C1-6алкил, галогено-С1-6алкил, C1-6алкокси, арил, возможно имеющий в качестве заместителей атом галогена, или гетероарил, возможно имеющий в качестве заместителей атом галогена.
восстановление соединения Формулы z

с получением соединения Формулы aa

где n, p, R1 и R3 являются такими, как определено в п.24.
взаимодействие соединения Формулы aa

с реагентом Формулы bb

где
Х представляет собой уходящую группу; и
Rf представляет собой С1-6алкил или -NRdRe, где каждый из Rd и Re независимо представляет собой атом водорода или С1-6алкил;
с получением соединения Формулы cc

где n, p, R1 и R3 являются такими, как определено в любом из пп.24-29.
окисление соединения Формулы cc

с получением соединения Формулы dd
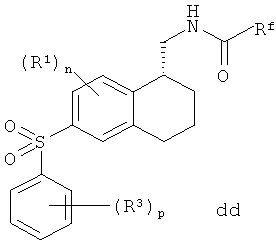
где n, p, R1, R3 и Rf являются такими, как определено в любом из пп.24-30.
гидролиз дигидронафталин-карбонитрильного соединения x

с получением соединения Формулы y

где n, p, R1, и R3 являются такими, как определено в любом из пп.24-33.

с триметилсилилцианидом
с получением соединения Формулы x

где n, p, R1 и R3 являются такими, как определено в любом из пп.24-34.

Комментарии