Новый способ изомеризации конденсированных бициклических структур и получение аналогов витамина d, содержащих эти структуры - RU2560184C2
Код документа: RU2560184C2
Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к новому способу изомеризации конденсированных бициклических структур и способу получения аналогов витамина D, содержащих такие структуры.
Уровень техники
Витамин D представляет собой прогормон, что означает, что он сам не обладает гормональной активностью, но превращается в активный гормон по механизму регулируемого синтеза. Открыты несколько форм витамина D, в том числе D1-D5. С химической точки зрения, различные формы витамина D представляют собой секостероиды, в которых одна из связей в стероидных циклах разорвана. Различные формы витамина D отличаются боковыми цепями. Рецепторы витамина D относятся к суперсемейству ядерных рецепторов стероид/тироидных гормональных рецепторов и экспрессируются клетками в большинстве органов, например в мозгу, сердце, коже, гонадах, простате и молочной железе. Активация рецептора витамина D в кишечнике, костях, почках и в клетках околощитовидной железы способствует поддержанию уровней кальция и фосфора в крови и поддержанию состава костей (Holick et al, American Journal of Clinical Nutrition 81 (6) 1678S-88S). Также известно, что рецептор витамина D участвует в пролиферации и дифференциации клеток. Витамин D также влияет на иммунную систему, поскольку рецепторы витамина D экспрессируются в некоторых типах белых кровяных клеток, в том числе моноцитов и активированных Т и В клеток.
Для того чтобы повысить терапевтический потенциал природного витамина D, синтезированы аналоги с повышенной эффективностью в отношении специфического действия и разработаны некоторые аналоги витамина D, например сеокальцитол, инекальцитол, элокальцитол, экзакальцитол.
Аналоги витамина D в настоящее время известны благодаря их эффективному действию в процессе клеточной пролиферации и клеточной дифференциации, что делает их многообещающими кандидатами в качестве лекарственных средств для лечения раковых больных.
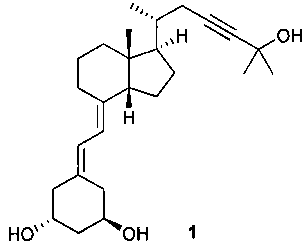
Инекальцитол является международным непатентованным названием (7Е)-19-нор- 9,10-секо-14β-холеста-5,7-диен-23-ин-1α,3β,25-триола (C26H40O3) (WHO Drug Information, Vol 17, No.2, 2003) следующей формулы:
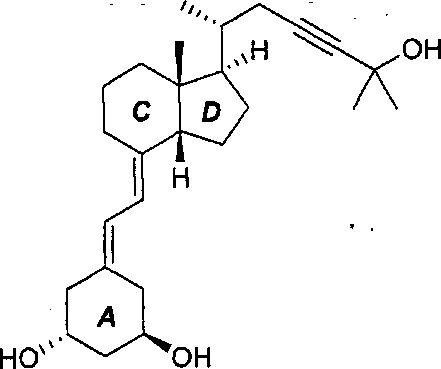
Инекальцитол
Он является синтетическим производным кальцитриола, природного активного метаболита витамина D3. Однако инекальцитол в десять раз более эффективен и в сто раз менее токсичен, чем кальцитриол. Эта характеристика делает инекальцитол эффективным кандидатом в качестве лекарственного средства, в первую очередь для лечения гормонального резистентного рака простаты. В отличие от других аналогов витамина D структура инекальцитола характеризуется цис-C/D кольцевым мостиком. В частности способ получения аналогов витамина D, содержащего цис-C/D цикл, раскрыт в US 6 017 907. Он включает в себя присоединение производного фрагмента цис-C/D к соответствующему производному цикла А, что в случае инекальцитола может быть проиллюстрировано следующей схемой:

Cis C/D кольцевой мостик получают эпимеризацией соответствующего транс C/D цикла. US 6 017 907 показывает, что эпимеризация, которая была предпринята на различных защищенных кетонах, может быть проведена в присутствии NaOMe, MeOH, при комнатной температуре, в течение 24 часов, и всегда приводит к ожидаемой эпимеризации с соотношением, равным приблизительно 3/1 в пользу цис-изомера и с 60- 70% выходом, по следующей схеме:
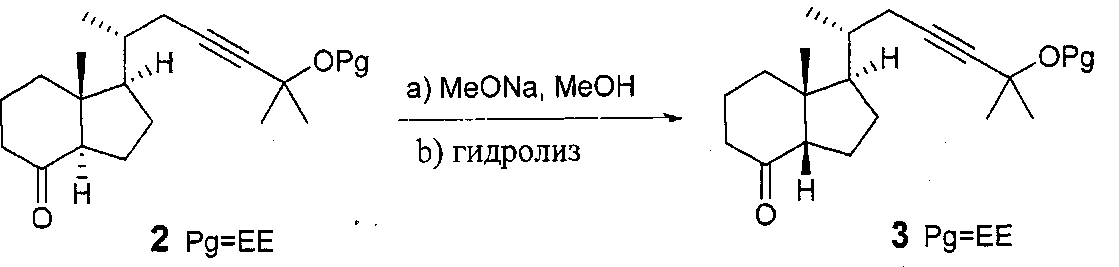
Однако, эта реакция, выполненная в граммовом масштабе, дает возможность получать желаемый чистый цис-томер только после тщательного разделения ВЭЖХ, что является проблематичным при проведении синтеза в увеличенном масштабе и в промышленных процессах. Например, в масштабе 100 г, авторы изобретения получают соотношение цис/транс, равное 78/22, что требует трех последовательных хроматографических очисток для получения чистого цис-соединения (соотношение цис/транс равно 98/02) только с 49% выходом. Они также показали, что в килограммовом масштабе многократные хроматографические разделения приводят к неудовлетворительному диастереомерному соотношению и чистоте цис-C/D кетона: для повышения желаемой чистоты фактически требовалось несколько очисток (95/05), в том числе рециклизация смесей 50/50.
Поэтому в высшей степени необходимо предоставить новый способ изомеризации транс-бициклической конденсированной структуры в соответствующую цис-бициклическую конденсированную структуру с высокой селективностью. В настоящее время к удивлению авторы настоящего изобретения нашли новые экспериментальные условия, дающие вполне удовлетворительные выходы и более высокие скорости изомеризации, удобные производственные условия, соответствующие промышленным масштабам. Это представляет собой важное упрощение способа получения инекальцитола и других предполагаемых аналогов витамина D с цис-C/D кольцевым мостиком.
Раскрытие изобретения
Таким образом, согласно первой цели настоящее изобретение относится к способу получения цис-конденсированного бициклического производного из соответствующего транс-конденсированного бициклического производного, причем указанный способ включает стадию взаимодействия указанного транс-конденсированного бициклического производного с гидридным основанием. Соответствующие основания могут быть выбраны из оснований формулы М-Н, где М представляет собой атом группы IA, например КН или NaH, более предпочтительно NaH.
Предпочтительно основание находится в избытке. Концентрация основания составляет от 1 до 2 эквивалентов от исходного транс-продукта, предпочтительно приблизительно 1,5.
Указанную реакцию можно проводить при температуре, находящейся в диапазоне между комнатной температурой и температурой кипения реакционной смеси. Предпочтительно, реакцию можно проводить при температуре кипения.
Указанную реакцию можно проводить в течение времени, достаточного для достижения удовлетворительного выхода. Длительность может находиться в диапазоне между несколькими минутами и одним днем, более предпочтительно между 1 и 12 часами.
Реакцию обычно проводят в подходящем органическом растворителе, например ТГФ, алкилированный ТГФ, в том числе Ме-ТГФ, толуол, более предпочтительно ТГФ.
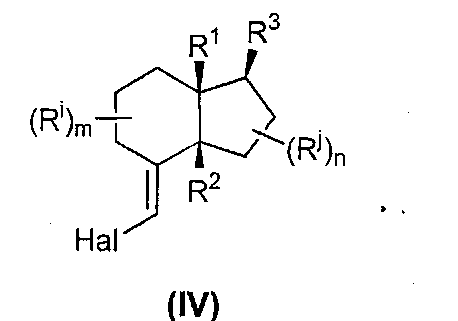
Согласно предпочтительному аспекту указанное конденсированное бициклическое производное выбирают из конденсированных бициклических систем, содержащих циклоалканон, конденсированный с циклоалкилом. Указанные циклоалканон и циклоалкил могут быть выбраны из необязательно замещенного циклогексанона, циклопентанона, циклогексана, циклопентана.
Указанное конденсированное бициклическое производное выбирают из систем, содержащих необязательно замещенный циклогексанон, в частности необязательно замещенный циклогексанон, конденсированный с необязательно замещенным циклопентаном (так называемые «С/D циклы»).
Используемый здесь «необязательно замещенный» относится к необязательным, одному или нескольким заместителям указанного циклоалканона и указанного циклоалкила, независимо выбранным из Н, атома галогена, C1-C6 алкила, C2-C6 алкенила, OR, NRR', CN, NO2, пергалогено(C1-C6)алкила, COR, COOR, CONRR', алкиларила, алкениларила, где R', являющиеся одинаковыми или различными, выбирают из H, алкила, арила.
Согласно другому варианту осуществления указанные транс- и цис-конденсированные бициклические структуры характеризуются соответственно формулами (I) и (II):

в которой:
R1 представляет собой Н или C1-C6 алкильную группу;
R2 представляет собой H или D;
где D представляет собой атом дейтерия;
R3 представляет собой C1-C20 алкил, необязательно содержащий одну или несколько двойных или тройных связей, и/или необязательно прерываемый одним или несколькими гетероатомом(ми), выбранными из O, N, S, Si; предпочтительно R представляет собой линейный или разветвленный C1-C20 алкил, C2-C20 алкенил, C2-C20 алкинил, причем указанный алкил, алкенил, алкинил необязательно замещены одной или несколькими группой(ми), выбранными из ОН или защищенной OH группы. Указанную защитную группу предпочтительно выбирают из кислотолабильных групп, например кеталей: этоксиэтила (ЕЕ), или фторолабильных групп, например триалкилсилильных групп: триметилсилильных (TMS), триэтилсилильных (TES), трет-бутилдиметилсилильных (TBS), триизопропилсилильных (TIPS), трет-бутилдифенилсилильных (TBDPS);
m представляет собой целое число, выбранное из 0, 1, 2, 3;
n представляет собой целое число, выбранное из 0, 1 или 2;
когда они присутствуют, каждый Ri и Rj, которые являются одинаковыми или различными, соответственно представляют от 1 до m или от 1 до n групп, одинаковых или различных, независимо выбранных из атома галогена, C1-C6 алкила, C2-C6 алкенила, OR, NRR', CN, NO2, пергалогено(C1-C6)алкила, COR, COOR, CONRR', алкиларила, алкениларила, где R, R', одинаковые или различные, выбирают из Н, алкила, арила.
Более предпочтительно:
m=n=0;
R1=метил;
R2=H; и/или
R3 представлен формулой:

где X представляет собой H или X представляет собой защитную группу OH функциональной группы и разорванная связь
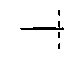
Обычно способ настоящего изобретения также включает стадию гидролиза, проводимую после вышеописанной стадии изомеризации. Указанный гидролиз проводят, используя рутинную процедуру гидролиза, например, проходящую при контакте реакционной смеси с водой.
Способ настоящего изобретения может также включать в себя очистку образующегося цис-конденсированного бициклического производного стандартными процедурами. Поскольку ВЭЖХ больше не требуется, указанную очистку проводят предпочтительно не используя ВЭЖХ, в соответствии с конкретным вариантом осуществления способа настоящего изобретения.
Очистку можно предпочтительно проводить хроматографически, например колоночной хроматографией. Может быть использована колонка любого типа, в том числе стеклянные колонки, хотя предварительно набитые колонки, например колонки Flashsmart, могут быть предпочтительными. Элюирующим растворителем предпочтительно является смесь алкана, сложного эфира или их смесь, например смесь гептана и этилацетата. Предпочтительной смесью является гептан/этилацетат в соотношении от 70:30 до 95:5, предпочтительно приблизительно 90:10.
Элюирующий растворитель может предпочтительно содержать основание, например, TEA.
В соответствии со следующей целью настоящее изобретение также относится к способу получения производного стероида или секостероида, содержащего цис-C/D кольцевой мостик, причем указанный способ включает в себя способ получения цис-конденсированного бициклического производного согласно настоящему изобретению.
Указанный секостероид предпочтительно является аналогом витамина D, более предпочтительно инекальцитолом или его производным, формулы (III).

где R1, R2, R3, R1, Rj, m, b определены так же, как в формуле (I), и 1 представляет собой целое число, которое выбирают из 0, 1, 2, 3 или 4, и каждый из Rk, одинаковый или отличающийся друг от друга, независимо выбирают из атома галогена, C1-C6 алкила C2-С6 алкенила, OR, NRR', CN, NO2, пергалогено (С1-С6)алкила, COR, COOR, CONRR', алкиларила, алкениларила, где R, R', являющиecя одинаковыми или различными, выбирают из Н, алкила, арила.
Способ получения указанного аналога витамина D дополнительно включает в себя:
проведение реакции Виттига;
присоединение полученного соединения к соответствующему производному циклогексана или его предшественнику и необязательно
гидролиз полученного соединения.
Реакцию Виттига, приводящую к получению производного винилгалогенида, обычно проводят с использованием трифенилфосфинового производного, например, илида, например Ph3PCH(Hal)2, где Hal представляет собой атом галогена, например, Вr. Эту реакцию можно проводить в обычных условиях реакции Виттига, а именно при температуре в диапазоне от -80° до -50°C. За этой стадией может следовать одна или несколько стадий очистки, например, хроматографией. Илид может быть получен взаимодействием соответствующего алкилгалогенида с трифенилфосфином (РРh3). Vandewalle et al. (Tetrahedron Lett, 37, 7637-7640, 1996) показали, что на этой стадии не происходит эпимеризации.
Согласно предпочтительному варианту осуществления по реакции Виттига получают следующее соединение:
Стадию присоединения предпочтительно проводят с использованием производного циклогексана или его бициклического предшественника, например соединения формулы (V):
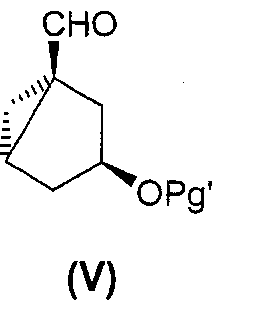
где Pg' представляет собой защитную группу OH-функциональной группы. Получение соединений формулы (V) описано в US6191292.
Присоединение происходит путем металл-галогенного обмена, обычно происходящего в присутствии сильного литиевого основания, например, н-BuLi, s-BuLi или трет-EulA, более предпочтительно трет-BuLi.
Реакция присоединения приводит к образованию соединения формулы (VI):

Необязательный гидролиз соединения формулы (VI) приводит путем перегруппировки к соединению формулы (VII):
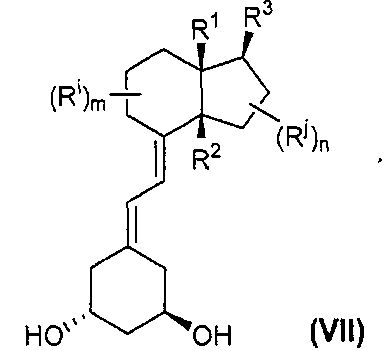
Обычно гидролиз можно проводить путем катализируемого кислотой сольволиза в системе диоксан/вода, в присутствии кислоты, например, TsOH. В этих условиях происходит удаление этоксиэтильной защитной группы, приводящее к получению неочищенного инекальцитола, который очищают кристаллизацией.
Стадии, начинающиеся с соединения формулы (II), ведущие к образованию витамина D или его аналога, известны в данной области, например, из US 6,017,907, и могут быть выполнены специалистами в данной области при использовании или адаптации таких известных способов.
Исходные продукты способа настоящего изобретения являются коммерчески доступными или могут быть получены специалистами в данной области, при использовании или адаптации таких известных способов.
Так, как используют здесь, "производное стероида или секостероида, содержащего цис-C/D кольцевой мостик" относится к производным, включающим следующий остов:

где циклы С и D расположены так, что образуют cis-кольцевой мостик.
Так, как используют здесь, выражение "аналог витамина D" относится к производным витамина D, содержащим цис-C/D кольцевую систему, например, инекальцитол.
Термин "его предшественник", используемый здесь, относится к соединению, которое отличается от указанных или ожидаемых соединений наличием или отсутствием одной или нескольких функциональных групп. Такая функциональная группа(ы) может быть введена, трансформирована и/или удалена обычными реакциями функционализации, известными специалистам в данной области.
Термин "соответствующий", так, как его используют здесь, относится к исходным продуктам, реагенту, промежуточному соединению и/или полученным соединениям, участвующим в реакции, и поэтому они имеют то же самое замещение за исключением веществ, подвергнутым изменениям в указанной реакции.
Для иллюстрации приводятся следующие неограничивающие примеры.
Осуществление изобретения
Пример 1. (1R,3aS,7aR)-1-((2S)-5-(1-этоксиэтокси)-5-метилгекс-3 -ин-2-ил)-7а-метилгексагидро-1Н-инден-4(2Н)-он (3)
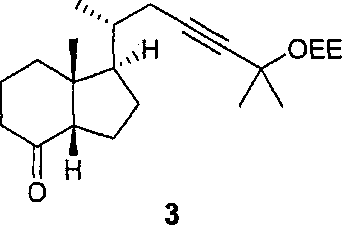
Транс-кетон 2 (1 г) перемешивают при кипячении в ТГФ а присутствии избытка (1,5 экв) NaH в течение 4 часов. Получено соотношение цис/транс, равное 96/4 (определенное по ВЭЖХ). Затем реакционную смесь выливают при комнатной температуре в воду при 10°C. Гидролиз не влияет на соотношение цис/транс. Проводят гель-хроматографию на силикагеле (15 массовых эквивалентов), элюируя смесью гептан/AcOEt+TEA (90/10). Получают 680 мг (68%) ожидаемого цис-продукта с чистотой >99%. Полученные аналитические данные соответствуют структуре 3.
Пример 2
Пример 1 был повторен со следующими масштабно увеличенными количествами:
2.1. Раствор транс-кетона 2 (299 г, 0,851 молей) в ТГФ (1,5 л) медленно добавляют к гидриду натрия 60% (52 г, 2,16 молей) в суспензии в ТГФ (1,5 л). После того как добавление будет закончено, смесь перемешивают в течение 0,5 час при комнатной температуре и кипятят с обратным холодильником в течение 4 часов. Затем раствор охлаждают и добавляют воду (V,5 л). Смесь перемешивают и экстрагируют н-гептаном. Органический слой промывают водой и концентрируют. Неочищенный продукт очищают флэш-хроматографией на силикагеле для получения чистого г/мс-кетона 3 (215 г, выход 75%, соотношение цис/транс равно 97/3). Полученные аналитические данные соответствуют структуре 3.
2.2. Раствор транс-кетона 2 (2,640 кг, 7,57 моля) в ТГФ (13 л) медленно прибавляют к гидриду натрия 60% (464 г, 19,33 моля) в суспензии в ТГФ (14 л). После того как добавление будет закончено, смесь перемешивают в течение 0,5 час при комнатной температуре и кипятят с обратным холодильником в течение 4 часов. Затем раствор охлаждают и добавляют воду (14 л). Смесь перемешивают и экстрагируют н-гептаном. Органический слой промывают водой и концентрируют. Неочищенный продукт очищают флэш-хроматографией на силикагеле для получения чистого цис-кетона 3 (1,850 кг, выход 69%) соотношение цис/транс равно 97/3). Полученные аналитические данные соответствуют структуре 3.
Пример 3. Получение инекальцитола
3.1. Получение винилбромида 4
Раствор бис(триметилсилил)амида калия (484 г, 2,42 моля) в ТГФ (2,2 л) медленно добавляют при -30°С к раствору (бромметил)трифенилфосфоний бромида (1,124 кг, 2,57 моля) в ТГФ (2,2 л). После того как добавление будет закончено, смесь выдерживают в течение 1,5 часа при -30°С и затем нагревают до 0°С. Затем раствор цис-кетона 3 (340 г, 0,975 моля) в ТГФ (0,5 л)добавляют при 0°С и смесь перемешивают в течение 2,5 часа. Затем медленно добавляют воду, поддерживая температуру ниже 20°С. Смесь экстрагируют этилацетатом. Органический слой промывают насыщенным солевым раствором, сушат и концентрируют. Неочищенный продукт очищают флэш-хроматографией на силикагеле для получения чистого винилбромида 4 (200 г, выход 48%).
3.2. Конденсация с альдегидом 5
Раствор трет-бутиллития (1,7 М в пентане, 1,25 л) по каплям добавляют при -70°С к раствору 4 (431 г, 1,01 моля) в ТГФ (3,4 л). После того как добавление будет закончено, смесь перемешивают в течение 1,5 часа при -70°С и к смеси по каплям добавляют раствор альдегида 5 (253 г, 1,05 моля) в ТГФ (0,5 л). Затем раствор выдерживают в течение 1 часа при -70°С и гасят добавлением раствора насыщенного хлорида аммония. Раствор экстрагируют этилацетатом и органические слои затем промывают насыщенным солевым раствором, сушат и концентрируют. Неочищенный остаток очищают флэш-хроматографией на силикагеле для получения чистых соединений 6 (308 г, выход 51%).
3.3. Синтез инекальцитола 1
Раствор n-толуолсульфокислоты (57 г, 0,299 моля) в смеси диоксан/вода (120 мл, 7/3) добавляют к раствору соединения 6 (305 г, 0,505 моля) в смеси диоксан/вода (4 л). Смесь перемешивают при 60°С в течение 4 часов, и затем охлаждают до комнатной температуры. Добавляют этилацетат и раствор промывают насыщенным раствором гидрокарбоната натрия и насыщенным солевым раствором. Органический слой отделяют, сушат и концентрируют. Неочищенный остаток очищают флэш-хроматографией на силикагеле и кристаллизуют из смеси диизопропиловый эфир/этанол для получения чистого инекальцитола 1 (145 г, выход 71%).
Сравнительный пример 1 (по US 6,017,907)
Изомеризацию 370 мг транс-соединения, использованного в примере 1, проводят в присутствии смеси MeONa/MeOH, при комнатной температуре в течение 12 часов. Смесь упаривают при пониженном давлении, остаток очищают на колонке с силикагелем (этилацетат/гексан 2/8) и чистый цис-кетон получают выделением при помощи ВЭЖХ (этилацетат:гексан 2:8) с выходом, равным 65%.
Сравнительный пример 2
Сравнительный пример 1 был повторен со следующими масштабно увеличенными количествами:
Раствор метоксида натрия (30 масс.% в метаноле, 73 мл) по каплям добавляют к раствору транс-кетона 2 (538 г, 1,55 моля) в метаноле (5,4 л) при 10°С. После того как добавление будет закончено, смесь перемешивают в течение 3 часов при 50°C. Затем раствор охлаждают до комнатной температуры и фильтруют на силикагеле (1 кг). Фильтрат концентрируют до получения 522 г неочищенного цис-кетона 3 (соотношение цис/транс равно 80/20). Неочищенный остаток делят на две части и каждую часть очищают флэш-хроматографией на силикагеле (2×2 кг, элюент н-гептан/этилацетат (9/1)). Очистку контролируют при помощи ВЭЖХ.
Фракции, имеющие соотношение цис/транс ≥95/5, объединяют и концентрируют для получения чистого цис-кетона 3 (144 г, выход 27%, соотношение цис/транс равно 97/3). Фракции, имеющие соотношение цис/транс в диапазоне от 85/5 до 95/5, объединяют, концентрируют и вторично подвергают флэш-хроматографии на силикагеле (2 кг, элюент н-гептан/этилацетат (9/1)). Фракции, имеющие соотношение цис/транс ≥95/5, объединяют и концентрируют для получения дополнительного количества чистого цис-кетона 3 (117 г, выход 22%, соотношение цис/транс равно 98/2). Наконец, чистые материалы объединяют для получения 261 г чистого цис-кетона 3 (выход 49%, соотношение цис/транс равно 97/3).
Примечание: Фракции, имеющие соотношение цис/транс ≤85/15, из трех колонок объединяют и концентрируют до получения 217 г неочищенной смеси, главным образом содержащей цис-кетон 3 и транс-кетон 2 (соотношение цис/транс равно 52/48). Эта фракция может быть вновь изомеризована при использовании условий, описанных выше, для получения неочищенной смеси 3 (соотношение цис/транс равно 80/20). Тщательная очистка при использовании нескольких этапов флэш-хроматографии может быть повторена для небольшого увеличения общего выхода синтеза.
Сравнительный пример 3
Изомеризацию транс-соединения в примере 1 проводят в следующих различных условиях. Полученные соотношения представлены в нижеприведенной таблице:
Очевидно, что ни одно из различных использованных оснований не дает более высокого соотношения цис/транс, чем 84/16, тогда как применение гидридного основания ведет к соотношению цис/транс ≥96/4.
Реферат
Изобретение относится к способу получения цис-конденсированного бициклического производного формулы (II) из соответствующего транс-конденсированного бициклического производного формулы (I), который включает стадию взаимодействия указанного транс-конденсированного бициклического производного с гидридным основанием формулы М-Н, где М представляет собой атом IA группы. В общей формуле (I) и (II) Rпредставляет собой Н или C-Салкильную группу; Rпредставляет собой Н или D; где D представляет собой атом дейтерия; Rпредставляет собой С-Салкил, необязательно содержащий одну или несколько двойных или тройных связей, и/или необязательно содержащий один или несколько гетероатомов, выбранных из О, N, S, Si; m представляет собой целое число, выбранное из 0, 1, 2, 3; n представляет собой целое число, выбранное из 0, 1 или 2; когда они присутствуют, каждый Rи R, которые являются одинаковыми или различными, соответственно представляют от 1 до m или от 1 до n групп, одинаковых или различных, независимо выбранных из атома галогена, C-Салкила, С-Салкенила, OR, NRR′, CN, NO, пергалогено (С-С)алкила, COR, COOR, CONRR′, алкиларила, алкениларила, где R, R′, одинаковые или различные, выбирают из Н, алкила, арила. 2 н. и 10 з.п. ф-лы, 6 пр.
Формула
где транс- и цис-конденсированные бициклические структуры представлены соответственно формулами (I) и (II):

в которых:
R1 представляет собой Н или C1-С6 алкильную группу;
R2 представляет собой Н или D;
где D представляет собой атом дейтерия;
R3 представляет собой С1-С20 алкил, необязательно содержащий одну или несколько двойных или тройных связей, и/или необязательно содержащий один или несколько гетероатомов, выбранных из О, N, S, Si;
m представляет собой целое число, выбранное из 0, 1, 2, 3;
n представляет собой целое число, выбранное из 0, 1 или 2;
когда они присутствуют, каждый Ri и Rj, которые являются одинаковыми или различными, соответственно представляют от 1 до m или от 1 до n групп, одинаковых или различных, независимо выбранных из атома галогена, C1-С6 алкила, С2-С6 алкенила, OR, NRR′, CN, NO2, пергалогено (С1-С6)алкила, COR, COOR, CONRR′, алкиларила, алкениларила, где R, R′, одинаковые или различные, выбирают из Н, алкила, арила, и где указанное гидридное основание представлено формулой М-Н, где М представляет собой атом IA группы.

где X представляет собой Н или X представляет собой защитную группу ОН функциональной группы и разорванная связь

где R1, R2, R3, Ri, Rj, m, n определены так же, как в п. 1, и 1 представляет собой целое число, которое выбирают из 0, 1, 2, 3 или 4, и каждый из Rk, одинаковый или отличающийся друг от друга, независимо выбирают из атома галогена, C1-С6 алкила, С2-С6алкенила, OR, NRR′, CN, NO2, пергалогено(С1-С6)алкила, COR, COOR, CONRR, алкиларила, алкениларила, где R, R′, являющиеся одинаковыми или различными, выбирают из Н, алкила, арила.
- проведение реакции Виттига, приводящей к получению производного винилгалогенида;
- присоединение полученного соединения к соответствующему производному циклогексана или к его предшественнику и, необязательно,
- гидролиз полученного соединения.

Комментарии