Производные аминоалканолов, способ получения аминоалканолов и их применение - RU2515213C2
Код документа: RU2515213C2
Чертежи






Описание
Предметом данного изобретения является группа новых производных аминоалканолов, а именно [(фенокси)алкил]аминоалканолы и [(фенокси)ацил]аминоалканолы, способ их получения и их применение для изготовления лекарства, которое используется при профилактике, предупреждении и/или лечении заболеваний или симптомов, имеющих неврологическое происхождение, и для изготовления лекарства с противосудорожной активностью, которое используется при припадках разного происхождения, также возникающих в лимбической системе, при миоклонических или вызванных звуком припадках, при психомоторной эпилепсии, а также облегчении невропатической или воспалительной боли.
Обзор литературы, касающейся биологической активности в группе аминоалканолов, указывает на возможность выбора соединений, обнаруживающих противосудорожные свойства, например из числа лекарственных средств, стабилизирующих электрический потенциал клеток, проявляющих свою собственную электрическую активность. Примером является пропранолол, так как он проявляет полезные свойства при лечении гипертонии и аритмии, а также он обладает свойствами предотвращения некоторых видов припадков [1]. Похожий профиль можно наблюдать у мексилетина, проявляющего защитное действие при припадках, вызванных МЭШ (максимальным электрошоком), ScMet (подкожным введением пентилентетразола) и звуком [2]. Важно, что механизм, ответственный за подавление припадков и у пропранолола, и у мексилетина, главным образом заключается в ингибировании потенциалзависимых натриевых каналов, тогда как при лечении аритмии оба лекарства действуют по-разному: посредством антагонизма β-адренергических рецепторов или через открытие калиевых каналов, соответственно [3]. Однако возможность использования мексилетина при лечении эпилепсии очень низка вследствие того факта, что он понижает судорожный порог при дозе не намного выше ЭД50 (максимальный электрошок МЭШ, мыши, внутрибрюшинное введение), несмотря на ингибирование фокальных эпилептических припадков. Данная активность обуславливает необходимость осуществления теста на тоническое снижение порога (ТТЕ от threshold tonic extension) при предварительных фармакологических анализах для всех веществ подобной структуры, обнаруживающих противосудорожную активность, чтобы исключить эту опасную проконвульсивную активность [4]. Более того, при лечении эпилепсии применение лекарственных средств, подобных пропранололу или мексилетину, также оказывающих активность на сердце, неправомерно. Следовательно, должны быть созданы новые структуры таким образом, чтобы они были активными в центральной нервной системе (ЦНС), не влияя на сердечно-сосудистую систему (ССС).
Поэтому основная задача данного изобретения состояла в создании новых химических соединений, которые полезны при лечении, особенно при лечении или предотвращении заболеваний или симптомов неврологического происхождения. Изобретение относится к группе замещенных производных аминоалканолов, предпочтительно (фенокси)алкил- и [(фенокси)ацетил]аминоалканолам, их фармацевтически приемлемым солям и пролекарствам, пригодным для применения при лечении или предотвращении заболеваний неврологического происхождения. Новые соединения, описанные в данной патентной заявке, проявляют противосудорожную активность на различных моделях припадков, включая припадки, вызванные максимальным электрошоком (МЭШ, мыши, крысы), припадки при гиппокампальном киндлинге (крысы), и содержат некоторые элементы структур (аминоалканольные группировки, ароксиалкильную группу) некоторых известных лекарственных средств, используемых при лечении аритмии (пропранолол, мексилетин), которые проявляют доказанную противосудорожную активность [1, 2]. Общим типичным признаком активности новых веществ, а также упомянутых антиаритмических лекарственных средств является влияние на клетки, проявляющие свою собственную электрическую активность (нервные клетки). Однако антиаритмические лекарственные средства действуют на центральную и периферическую нервную систему, а соединения, представленные в данном изобретении, из-за их липофильности - главным образом в пределах ЦНС.
В настоящем изобретении было достигнуто воплощение этой изложенной задачи и решены проблемы, связанные с профилактикой, предотвращением и/или лечением заболеваний или симптомов неврологического происхождения. Данная определенная цель неожиданно была достигнута с помощью настоящего изобретения.
Предметом данного изобретения является производное аминоалканолов формулы

где R1 представляет собой СН3, Н или Cl,
R2 представляет собой СН3, Н или Cl,
R3 представляет собой СН3, Н или Cl,
n представляет собой целое число от 1 до 5, предпочтительно от 1 до 3,
Х представляет собой

где Z представляет собой аминоалканол
или

где Z представляет собой аминоалканол или аминокислоту, за исключением соединения, выбранного из группы, включающей:
2-[(4-метилфенокси)этил]амино-1-бутанол,
2-[(4-метилфенокси)этил]амино-1-пропанол,
1-[(4-метилфенокси)этил]амино-2-бутанол,
1-[(4-метилфенокси)этил]амино-2-пропанол,
2-[(4-метилфенокси)этил]амино-2-метил-1-пропанол,
2-[(2,6-диметилфенокси)этил]амино-1-бутанол,
R,S-2-[(2,6-диметилфенокси)этил]амино-1-пропанол,
1-[(2,6-диметилфенокси)этил]амино-2-бутанол,
1-[(2,6-диметилфенокси)этил]амино-2-пропанол,
2-[(2,6-диметилфенокси)этил]амино-2-метил-1-пропанол,
R,S-2-[(2,6-диметилфенокси)этил]амино-1-бутанол гидрохлорид,
R-(-)-2-[(2,6-диметилфенокси)этил]амино-1-бутанол гидрохлорид,
S-(+)-2-[(2,6-диметилфенокси)этил]амино-1-бутанол гидрохлорид,
S-(+)-2N-[(2,6-диметилфенокси)этил]-2N-метиламино-1-бутанол,
R,S-1-[(2,6-диметилфенокси)этил]амино-2-пропанол,
R-(-)-1-[(2,6-диметилфенокси)этил]амино-2-пропанол,
S-(+)-1-[(2,6-диметилфенокси)этил]амино-2-пропанол,
R,S-2-[(4-метилфенокси)этил]амино-1-бутанол гидрохлорид,
R-(-)-2-[(4-метилфенокси)этил]амино-1-бутанол гидрохлорид,
S-(+)-2-[(4-метилфенокси)этил]амино-1-бутанол гидрохлорид,
R,S-2-[(4-метилфенокси)этил]амино-1-пропанол гидрохлорид,
R,S-2-[(4-метилфенокси)этил]амино-2-метил-1-пропанол гидрохлорид,
D,L-транс-2-[(4-метилфенокси)этил]амино-1-циклогексанол гидрохлорид,
R,S-1-[(4-хлор-3-метилфенокси)ацетил]амино-2-пропанол,
R,S-1-[(4-хлор-3-метилфенокси)ацетил]амино-2-бутанол,
R-(+)-2-[(4-хлор-3-метилфенокси)ацетил]амино-1-бутанол,
S-(-)-2-[(4-хлор-3-метилфенокси)ацетил]амино-1-бутанол,
R,S-2-[(4-хлор-3-метилфенокси)ацетил]амино-1-фенилэтанол,
R,S-2-[(2-хлор-S-метилфенокси)ацетил]амино-1-пропанол,
R,S-2-[(2-хлор-S-метилфенокси)ацетил]амино-1-бутанол,
R,S-2-[(2-хлор-S-метилфенокси)ацетил]амино-2-метил-1-пропанол,
R,S-2-[(4-хлор-3-метилфенокси)этил]амино-1-бутанол гидрохлорид,
R-(-)-2-[(4-хлор-3-метилфенокси)этил]амино-1-бутанол гидрохлорид,
S-(+)-2-[(4-хлор-3-метилфенокси)этил]амино-1-бутанол гидрохлорид,
R,S-1-[(4-хлор-3-метилфенокси)этил]амино-2-бутанол гидрохлорид,
R,S-2-[(2-хлор-S-метилфенокси)этил]амино-1-пропанол,
R,S-2-[(2-хлор-S-метилфенокси)этил]амино-1-бутанол,
2-[(2-хлор-S-метилфенокси)этил]амино-2-метил-1-пропанол,
R,S-1-[(4-хлор-2-метилфенокси)ацетил]амино-2-пропанол,
R,S-1-[(4-хлор-2-метилфенокси)ацетил]амино-2-бутанол,
R,S-2-[(4-хлор-2-метилфенокси)ацетил]амино-1-бутанол,
R,S-2-[(4-хлор-2-метилфенокси)ацетил]амино-1-фенилэтанол,
метиловый эфир D,L-2N-[(4-хлор-2-метилфенокси)ацетил]аланина,
R,S-1-[(4-хлор-2-метилфенокси)этил]амино-2-пропанол,
R,S-2-[(4-хлор-2-метилфенокси)этил]амино-1-пропанол,
2-[(4-хлор-2-метилфенокси)этил]амино-2-метил-1-пропанол,
R,S-1-[(4-хлор-2-метилфенокси)этил]амино-2-бутанол,
R,S-2-[(4-хлор-2-метилфенокси)этил]амино-1-бутанол,
R,S-2-[(4-хлор-2-метилфенокси)этил]амино-1-фенилэтанол,
D,L-транс-2-[(4-метилфенокси)этил]амино-1-циклогексанол,
R,S-2-[(4-метилфенокси)этил]амино-1-пропанол гидрохлорид,
S-(+)-2-[(2,6-диметилфенокси)этил]амино-1-пропанол гидрохлорид,
2-[(2,6-диметилфенокси)этил]амино-2-метил-1-пропанол гидрохлорид,
2-[(4-метилфенокси)этил]амино-2-метил-1-пропанол гидрохлорид,
R,S-1-[(4-хлор-3-метилфенокси)этил]амино-2-бутанол гидрохлорид,
R-(-)-2-[(4-метилфенокси)этил]амино-1-бутанол гидрохлорид,
S-(+)-2-[(4-метилфенокси)этил]амино-1-бутанол гидрохлорид,
S-(+)-2N-[(2,6-диметилфенокси)этил]-2N-метиламино-1-бутанол гидрохлорид,
S-(+)-1-[(2,6-диметилфенокси)этил]амино-2-пропанол.
Предпочтительно, когда Х представляет собой

Z представляет собой аминоалканол, выбранный из группы, включающей:
2-амино-1-этанол, 3-амино-1-пропанол, 4-амино-1-бутанол, 5-амино-1-пентанол, 1-амино-2-пропанол, 2-амино-1-пропанол, 1-амино-2-бутанол, 2-амино-1-бутанол, 2-амино-1-фенилэтанол, 2-амино-2-метил-1-пропанол, 2-амино-2-метил-1,3-пропандиол, 3-метил-2-амино-1-бутанол, 3-метил-3-амино-1-бутанол, D,L-транс-1,2-циклогексаноламин, транс-1,4-цикпогексаноламин, N-метиламиноэтанол, N-этиламиноэтанол, N-метил-2-амино-1-бутанол, N-метил-2-амино-1-пропанол, N-метил-2-амино-1-фенилэтанол, L-трео-2-амино-1-фенил-1,3-пропандиол.
Предпочтительно, когда Х представляет собой
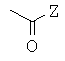
Z представляет собой аминоалканол или аминокислоту, выбранные из группы, включающей:
2-амино-1-этанол, 3-амино-1-пропанол, 4-амино-1-бутанол, 5-амино-1-пентанол, 1-амино-2-пропанол, 2-амино-1-пропанол, 1-амино-2-бутанол, 2-амино-1-бутанол, 2-амино-1-фенилэтанол, 2-амино-2-метил-1-пропанол, 2-амино-2-метил-1,3-пропандиол, 3-метил-2-амино-1-бутанол, 3-метил-3-амино-1-бутанол, D,L-транс-1,2-циклогексаноламин, транс-1,4-циклогексаноламин, N-метиламиноэтанол, N-этиламиноэтанол, N-метил-2-амино-1-бутанол, N-метил-2-амино-1-пропанол, N-метил-2-амино-1-фенилэтанол, L-трео-2-амино-1-фенил-1,3-пропандиол, глицин или глицинамид, или глициновый эфир, аланин или аланинамид, или аланиновый эфир, 2-амино- и 4-аминомасляную кислоту, или соответствующий амид или эфир.
Предпочтительно соединение выбрано из группы, включающей:
R,S-2N-[(2,3-диметилфенокси)этил]амино-1-пропанол (1)
D,5-2N-[(2,3-диметилфенокси)этил]амино-1-бутанол (2)
2N-[(2,3-диметилфенокси)этил]амино-2-метил-1-пропанол (3)
R,S-2N-[(2,3-диметилфенокси)этил]амино-1-фенилэтанол (4)
R,S-1N-[(2,5-диметилфенокси)этил]амино-2-пропанол (5)
R,S-2N-[(2,5-диметилфенокси)этил]амино-1-пропанол (6)
R,S-1N-[(2,5-диметилфенокси)этил]амино-2-бутанол (7)
R,S-2N-[(2,5-диметилфенокси)этил]амино-1-бутанол (8)
R,S-2N-[(2,5-диметилфенокси)этил]амино-1-фенилэтанол (9)
R-(-)-1N-[(2,6-диметилфенокси)этил]амино-2-пропанол (10)
R,S-2N-[(2,6-диметилфенокси)этил]амино-1-пропанол (11)
R,S-2N-[(2,6-диметилфенокси)этил]амино-1-пропанол гидрохлорид (11а)
R-(-)-2N-[(2,6-диметилфенокси)этил]амино-1-пропанол (12)
R-(-)-2N-[(2,6-диметилфенокси)этил]амино-1-пропанол гидрохлорид (12а)
S-(+)-2N-[(2,6-диметилфенокси)этил]амино-1-пропанол (13)
S-(+)-2N-[(2,6-диметилфенокси)этил]амино-1-пропанол гидрохлорид (13а)
R,S-2N-[(2,6-диметилфенокси)этил]-2N-метиламино-1-пропанол гидрохлорид (14)
3N-[(2,6-диметилфенокси)этил]амино-3-метил-1-бутанол гидрохлорид (15)
L-2N-[(2,6-диметилфенокси)этил]амино-3-метил-1-бутанол гидрохлорид (16)
5N-[(2,6-диметилфенокси)этил]амино-1-пентанол гидрохлорид (17)
D,L-транс-2N-[(2,6-диметилфенокси)этил]амино-1-циклогексанол (18)
D,L-транс-2N-[(2,6-диметилфенокси)этил]амино-1-циклогексанол гидрохлорид (18а)
R,S-2N-[(2,6-диметилфенокси)этил]амино-1-фенилэтанол (19)
R-(-)-2N-[(2,6-диметилфенокси)этил]амино-1-фенилэтанол (20)
S-(+)-2N-[(2,6-диметилфенокси)этил]амино-1-фенилэтанол (21)
R,S-2N-[(2,6-диметилфенокси)этил]-2N-метиламино-1-фенилэтанол гидрохлорид (22)
R,S-1N-[(2-хлор-6-метилфенокси)этил]амино-2-пропанол (23)
R,S-2N-[(2-хлор-6-метилфенокси)этил]амино-1-пропанол (24)
R,S-1N-[(2-хлор-6-метилфенокси)этил]амино-2-бутанол (25)
R,S-2N-[(2-хлор-6-метилфенокси)этил]амино-1-бутанол (26)
R,S-2N-[(2-хлор-6-метилфенокси)этил]амино-1-бутанол гидрохлорид (26а)
R-(-)-2N-[(2-хлор-6-метилфенокси)этил]амино-1-бутанол (27)
S-(+)-2N-[(2-хлор-6-метилфенокси)этил]амино-1-бутанол (28)
2N-[(2-хлор-6-метилфенокси)этил]амино-2-метил-1,3-пропандиол (29)
D,L-транс-2N-[(2-хлор-6-метилфенокси)этил]амино-1-циклогексанол (30)
R,S-2N-[(2-хлор-6-метилфенокси)этил]амино-1-фенилэтанол (31)
R,S-1N-[(4-хлор-2-метилфенокси)этил]амино-2-пропанол (32)
R,S-2N-[(4-хлор-2-метилфенокси)этил]амино-1-пропанол (33)
R,S-1N-[(4-хлор-2-метилфенокси)этил]амино-2-бутанол (34)
R,S-2N-[(4-хлор-2-метилфенокси)этил]амино-1-бутанол (35)
2N-[(4-хлор-2-метилфенокси)этил]амино-2-метил-1-пропанол (36)
R,S-2N-[(4-хлор-2-метилфенокси)этил]амино-1-фенилэтанол (37)
R,S-2N-[(2,3,5-триметилфенокси)этил]амино-1-пропанол (38)
R,S-2N-[(2,3,5-триметилфенокси)этил]амино-1-бутанол (39)
R-(-)-2N-[(2,3,5-триметилфенокси)этил]амино-1-бутанол (40)
S-(+)-2N-[(2,3,5-триметилфенокси)этил]амино-1-бутанол (41)
R,S-2N-[(2,3,5-триметилфенокси)этил]амино-1-фенилэтанол гидрохлорид (42)
R-(-)-2N-[(2,4,6-триметилфенокси)этил]амино-1-пропанол (43)
D,L-транс-2N-[(2,4,6-триметилфенокси)этил]амино-1-циклогексанол (44)
R,S-2N-[(2,4,6-триметилфенокси)этил]амино-1-фенилэтанол (45)
R,S-2N-[(2,3-диметилфенокси)пропил]амино-1-пропанол (46)
2N-[(2,3-диметилфенокси)пропил]амино-2-метил-1-пропанол (47)
R,S-2N-[(2,3-диметилфенокси)пропил]амино-1-бутанол (48)
R,S-2N-[(2,3-диметилфенокси)пропил]амино-1-фенилэтанол (49)
R,S-1N-[(2,6-диметилфенокси)пропил]амино-2-пропанол (50)
R,S-2N-[(2,6-диметилфенокси)пропил]амино-1-пропанол (51)
R-(-)-2N-[(2,6-диметилфенокси)пропил]амино-1-пропанол гидрохлорид (52)
2N-[(2,6-диметилфенокси)пропил]амино-2-метил-1-пропанол (53)
R,S-1N-[(2,6-диметилфенокси)пропил]амино-2-бутанол (54)
R,S-2N-[(2,6-диметилфенокси)пропил]амино-1-бутанол гидрохлорид (55)
R,S-2N-[(2,6-диметилфенокси)пропил]амино-1-фенилэтанол (56)
R,S-2N-[(2-хлор-6-метилфенокси)пропил]амино-1-пропанол (57)
R,S-2N-[(2-хлор-6-метилфенокси)пропил]амино-1-бутанол гидрохлорид (58)
R,S-2N-[(2,6-диметилфенокси)ацетил]-2N-метиламино-1-этанол (59)
R,S-2N-[(2,6-диметилфенокси)ацетил]амино-1-пропанол (60)
R-(+)-2N-[(2,6-диметилфенокси)ацетил]амино-1-пропанол (61)
S-(-)-2N-[(2,6-диметилфенокси)ацетил]амино-1-пропанол (62)
R,S-1N-[(2,6-диметилфенокси)ацетил]амино-2-бутанол (63)
транс-4N-[(2,6-диметилфенокси)ацетил]амино-1-цикпогексанол (64)
D-2N-[(2,6-диметилфенокси)ацетил]аминопропионамид (65)
D,L-2N-[(2,6-диметилфенокси)ацетил]аминобутирамид (66)
N-метиламид D,L-2N-[(2,6-диметилфенокси)ацетил]аминопропионовой кислоты (67)
R,S-1N-[(2-хлор-6-метилфенокси)ацетил]амино-2-пропанол (68)
R,S-2N-[(2-хлор-6-метилфенокси)ацетил]амино-1-пропанол (69)
R-(-)-2N-[(2-хлор-6-метилфенокси)ацетил]амино-1-пропанол (70)
S-(+)-2N-[(2-хлор-6-метилфенокси)ацетил]амино-1-пропанол (71)
R,S-1 N-[(2-хлор-6-метилфенокси)ацетил]амино-2-бутанол (72)
R,S-2N-[(2-хлор-6-метилфенокси)ацетил]амино-1-бутанол (73)
D,L-N-[(2-хлор-6-метилфенокси)ацетил]аланин (74)
D-(+)-N-[(2-хлор-6-метилфенокси)ацетил]аланин (75)
L-(-)-N-[(2-хлор-6-метилфенокси)ацетил]аланин (76)
D,L-2N-[(2-хлор-6-метилфенокси)ацетил]аминомасляная кислота (77)
D,L-2N-[(2-хлор-6-метилфенокси)ацетил]аминобутирамид (78)
4N-[(2-хлор-6-метилфенокси)ацетил]аминомасляная кислота (79)
R,S-1N-[(4-хлор-2-метилфенокси)ацетил]амино-2-пропанол (80)
R,S-1N-[(4-хлор-2-метилфенокси)ацетил]амино-2-бутанол (81)
R,S-2N-[(4-хлор-2-метилфенокси)ацетил]амино-1-фенилэтанол (82)
R,S-2N-[(2,4,6-триметилфенокси)ацетил]амино-1-фенилэтанол (83).
Другим предметом данного изобретения является применение производного аминоалканолов формулы

где R1 представляет собой СН3, Н или Cl,
R2 представляет собой СН3, Н или Cl,
R3 представляет собой СН3, Н или Cl,
n представляет собой целое число от 1 до 5, предпочтительно от 1 до 3,
Х представляет собой

или
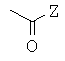
2-[(4-метилфенокси)этил]амино-1-бутанол,
2-[(4-метилфенокси)этил]амино-1-пропанол,
1-[(4-метилфенокси)этил]амино-2-бутанол,
1-[(4-метилфенокси)этил]амино-2-пропанол,
2-[(4-метилфенокси)этил]амино-2-метил-1-пропанол,
2-[(2,6-диметилфенокси)этил]амино-1-бутанол,
R,S-2-[(2,6-диметилфенокси)этил]амино-1-пропанол,
1-[(2,6-диметилфенокси)этил]амино-2-бутанол,
1-[(2,6-диметилфенокси)этил]амино-2-пропанол,
2-[(2,6-диметилфенокси)этил]амино-2-метил-1-пропанол,
для изготовления лекарства или пролекарства, которое применяется при профилактике, предотвращении и/или лечении заболеваний или симптомов неврологического происхождения.
Используемое производное предпочтительно является соединением согласно описанным выше соединениям.
Используемое производное предпочтительно является соединением, выбранным из:
R-(-)-2-[(2,6-диметилфенокси)этил]амино-1-пропанола,
S-(+)-2-[(2,6-диметилфенокси)этил]амино-1-пропанола, предпочтительно R-(-)-2-[(2,6-диметилфенокси)этил]амино-1-пропанол,
R,S-2-[(2-хлор-6-метилфенокси)этил]амино-1-бутанола,
R-(-)-2-[(2-хлор-6-метилфенокси)этил]амино-1-бутанола,
S-(+)-2-[(2-хлор-6-метилфенокси)этил]амино-1-бутанола,
предпочтительно R-(-)-2-[(2-хлор-6-метилфенокси)этил]амино-1-бутанол,
R,S-2-[(2,6-диметилфенокси)ацетил]амино-1-пропанола,
R-(+)-2-[(2,6-диметилфенокси)ацетил]амино-1-пропанола,
S-(-)-2-[(2,6-диметилфенокси)ацетил]амино-1-пропанола,
более предпочтительно R-(+)-2-[(2,6-диметилфенокси)ацетил]амино-1-пропанол.
Заболевание или симптом неврологического происхождения предпочтительно представляет собой эпилепсию, особенно большой эпилептический припадок, психомоторную эпилепсию, фокальные эпилептические припадки, эпилептический статус, миоклонические припадки или припадки различного происхождения (вызванные звуком, светом, химическим раздражителем, нейрональным повреждением, генетического происхождения), а также невропатическую или воспалительную боль.
Предпочтительно, когда изготовленное лекарственное средство является болеутоляющим, противовоспалительным, противосудорожным или противоэпилептическим.
Предпочтительно, когда соединение, выбранное из группы, включающей:
2-[(4-метилфенокси)этил]амино-1-бутанол,
2-[(4-метилфенокси)этил]амино-1-пропанол,
1-[(4-метилфенокси)этил]амино-2-бутанол,
1-[(4-метилфенокси)этил]амино-2-пропанол,
2-[(4-метилфенокси)этил]амино-2-метил-1-пропанол,
2-[(2,6-диметилфенокси)этил]амино-1-бутанол,
R,S-2-[(2,6-диметилфенокси)этил]амино-1-пропанол,
1-[(2,6-диметилфенокси)этил]амино-2-бутанол,
1-[(2,6-диметилфенокси)этил]амино-2-пропанол,
2-[(2,6-диметилфенокси)этил]амино-2-метил-1-пропанол,
используется для изготовления лекарства или пролекарства с противосудорожной активностью, которое применяется в противосудорожной терапии для лечения связанных или несвязанных с эпилепсией припадков, парциальных и генерализованных тонико-клонических припадков (большой эпилептический припадок), тонических судорог, клонических судорог, миоклонических судорог, припадков, возникающих в лимбической системе, психомоторной эпилепсии, фармакорезистентной эпилепсии или эпилепсии другого происхождения, а также облегчения невропатической или воспалительной боли.
Предпочтительно, когда заболевание или симптом представляет собой невропатическую боль, включая боль различной этиологии: диабетическую невропатию, раковую боль, невропатию при СПИДе, повреждение спинного мозга, фантомную боль в ампутированных конечностях или фибромиалгию.
Другим предметом данного изобретения является способ получения производных аминоалканолов, предпочтительно [(фенокси)алкил]аминоалканолов согласно пунктам формулы изобретения 1-4, отличающийся тем, что осуществляют N-алкилирование указанных аминоалканолов с соответствующими (фенокси)алкилбромидами, добавляя 0,010-0,015 моль соответствующего (фенокси)этил или 3-(фенокси)пропилбромида в 100 мл колбу, затем 0,010-0,015 моль соответствующего аминоалканола и избыток безв. К2СО3, затем смесь нагревают с обратным холодильником в толуоле в течение приблизительно 3-15 часов и охлаждают, после чего добавляют силикагель и смесь опять нагревают, гель и выпавший в осадок КВг отфильтровывают и оставшуюся смесь перегоняют до маслянистого остатка, затем добавляют 10-20% HCl и активированный уголь и смесь нагревают, после чего суспензию отфильтровывают и фильтрат подщелачивают 5-20% NaOH, чтобы осадить свободное основание, которое экстрагируют бензолом или толуолом, органическую фазу высушивают (безв. MgSO4) и органический растворитель отгоняют до маслянистого остатка, который кристаллизуют.
Следующим предметом данного изобретения является способ получения аминоалканолов, предпочтительно [(фенокси)ацил]аминоалканолов согласно пунктам формулы изобретения 1-4, отличающийся тем, что осуществляют N-ацетилирование указанных аминоалканолов или гидрохлорида сложных эфиров аминокислот с применением хлорангидрида соответствующей (фенокси)карбоновой кислоты в двухфазной среде (толуол/вода) в присутствии К2СО3, где 0,015-0,025 моль соответствующего аминоалканола в 30 мл толуола помещают в колбу, добавляют избыток К2СО3, растворяют в 50 мл воды, смесь охлаждают и перемешивают, затем к смеси добавляют небольшие количества раствора соответствующего хлорангидрида (фенокси)уксусной кислоты в толуоле и эмульсию перемешивают около 0,5 часа, и затем нагревают, после охлаждения органическую фазу отделяют и высушивают с безв. MgSO4, затем растворитель отгоняют и остаток кристаллизуют до белого осадка соответствующего производного.
Приложенные Фигуры способствуют лучшему пониманию и представлению сущности настоящего изобретения.
Фигура 1 представляет схему синтеза [(фенокси)алкил]аминоалканолов.
Фигура 2 представляет схему синтеза [(фенокси)ацетил]аминоалканолов.
Фигура 3 представляет результаты формалинового теста для R-(-)-2-[(2,6-диметилфенокси)этил]амино-1-пропанола.
Фигура 4 представляет результаты формалинового теста для R,S-2-[(2-хлор-6-метилфенокси)этил]амино-1-бутанола.
Фигура 5 представляет результаты сравнения чувствительности к боли у мышей после введения соединения 26 и известных лекарственных средств.
Фигура 6 представляет результаты для соединения 27.
Ниже представлены примеры воплощений настоящего изобретения, описанного выше.
Пример 1. Классификация соединений по изобретению и основные схемы их синтеза.
Новые соединения по изобретению определены с помощью формулы 1, а также их фармацевтически приемлемые соли и пролекарства. Обычно в изобретении указаны две подгруппы производных аминоалканолов: замещенные [(фенокси)алкил]аминоалканолы (формула 1) и замещенные [(фенокси)ацетил]аминоалканолы (формула 2).
Формула 1
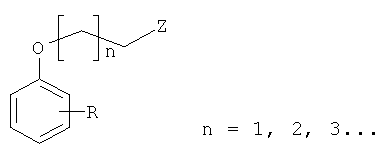
Синтез [(фенокси)алкил]аминоалканолов (Фиг.1).
Реакции синтеза соответствующих [(фенокси)алкил]аминоалканолов осуществляли несколькими способами, т.е.:
1) аминолизом толуолсульфоната соответствующих (фенокси)алканолов [5];
2) N-алкилированием соответствующих аминоалканолов с использованием подходящих (фенокси)алкилбромидов, опубликованных на предфинальной стадии, которая была модифицирована [5];
3) восстановлением соответствующих [(фенокси)ацетамидо]алканолов до соответствующих аминов с использованием LiAlH4 в диэтиловом эфире/N2 [6].
Некоторые соединения получали в форме гидрохлоридов, используя насыщенный раствор HCl в этаноле или используя газ HCl, после чего осуществляли кристаллизацию из смеси этилацетата/EtOH (3:1).
Чтобы получить соединения, являющиеся рацематами или энантиомерами, использовали имеющиеся в продаже аминоалканолы за исключением R,S-1-амино-2-бутанола, R-(-)- и S-(+)-2-амино-1-бутанола, а также D,L-транс-циклогексаноламина [7]. Некоторые необходимые реагенты могут быть получены согласно ранее опубликованным процедурам [5, 7, 8].
Формула 2

Синтез [(фенокси)ацетил]аминоалканолов или [(фенокси)ацетил]аминокислот и некоторых их производных (Фиг.2).
1) N-Ацетилирование соответствующих аминоалканолов или гидрохлорида сложных эфиров аминокислот осуществляют с применением хлорангидрида соответствующей (фенокси)карбоновой кислоты в двухфазной среде (толуол/вода) в присутствии К2СО3 [6]. Продукт реакции получают в ходе отделения органической фазы, промывая 10% NaHCO3, высушивая и выпаривая до остатка, который затем кристаллизуют из смеси н-гептана/толуола (1:2). В случае соответствующих эфиров амидокислот их дополнительно гидролизовали, используя 10% NaHCO3, подкисляли и кристаллизовали (Фиг.2).
Необходимые феноксикарбоновые кислоты получают в ходе O-алкилирования подходящего фенола (например, фенолята натрия) с использованием подходящей галогенкарбоновой кислоты в форме натриевой соли. Использовали имеющиеся в продаже кислоты (в форме сложных эфиров).
2) Альтернативным и подходящим способом является реакция смешанных ангидридов с применением метилхлорформиата с триэтиламином.
3) Другой используемый способ синтеза представляет собой азеотропную дегидратацию аммониевой соли соответствующей (фенокси)карбоновой кислоты с подходящим аминоалканолом.
4) Другой способ, используемый для получения некоторых алканоламидов, представляет собой синтез с применением соответствующих (фенокси)карбоновой кислоты и аминоалканола в присутствии триэтиламина и ВОР ((бензотриазол-1-илокситрис)диметиламинофосфония гексафторфосфата).
5) Чтобы получить некоторые (фенокси)ацетильные производные аминокислот, использовали способ окисления спиртовой группы (из ранее полученных [(фенокси)ацетил]аминоалканолов) (Фиг.2).
Пример 2. Описание синтеза конкретных продуктов
2.1 Синтез 2,3-, 2,5; 2,6-диметил-, 2-хлор-6-метил- и 4-хлор-2-метил-, 2,3,5- и (2,4,6-триметилфенокси)этанола или соответствующего 3-(фенокси)-1-пропанола
Раствор этанолята натрия получали в 750 мл круглодонной колбе (0,5 моль натрия растворяли в этаноле), в которую добавляли 0,5 моль соответствующего фенола. Смесь нагревали с обратным холодильником и в точке кипения добавляли по каплям около 3 часов раствор 2-бром- или 2-хлорэтанола (или 3-хлор-1-пропанола). После чего смесь нагревали в течение еще 2 часов и охлаждали. Выпавшую в осадок белую гущу (NaBr или NaCl) отфильтровывали и фильтрат перегоняли до маслянистого остатка. К остатку добавляли 200 мл воды и 10% раствор NaOH (чтобы освободиться от оставшегося фенола). Затем осуществляли экстракцию бензолом и органическую фазу дополнительно промывали 10% NaOH, водой и высушивали с безводным MgSO4. После перегонки растворителя получали маслянистый остаток. Неочищенный продукт использовали для дальнейшего бромирования.
2.2 Синтез 2,3-, 2,5-, 2,6-диметил-, 2-хлор-6-метил- и 4-хлор-2-метил-, 2,3,5- и (2,4,6-триметилфенокси)алкилбромидов
0,15 моль соответствующего производного (фенокси)этанола или (фенокси)пропанола помещали в 100 мл круглодонную колбу и медленно добавляли 0,05 моль PBr3. Смесь нагревали в течение 1,5 часа с обратным холодильником на водяной бане. Затем смесь помещали в колбу со льдом и нейтрализовали 15% NaHCO3, после чего осуществляли экстракцию бензолом. После сушки органической фазы (безв. MgSO4) растворитель отгоняли и получали маслянистый остаток. Неочищенный продукт использовали для дальнейшего аминолиза.
2.3 Синтез 2,3-, 2,5-, 2,6-диметил-, 2-хлор-6-метил- и 4-хлор-2-метил-, 2,3,5- и [(2,4,6-триметилфенокси)алкил]аминоалканолов
0,012 моль соответствующего (фенокси)этил или 3-(фенокси)пропилбромида помещали в 100 мл круглодонную колбу. Затем 0,012 моль подходящего аминоалканола и избыток безв. K2CO3 добавляли. Смесь нагревали в толуоле с обратным холодильником в течение приблизительно 5 часов и охлаждали. После чего добавляли силикагель и опять смесь нагревали. Гель и выпавший в осадок KBr отфильтровывали и оставшуюся смесь перегоняли в маслянистый остаток. Затем добавляли 10% HCl и активированный уголь и смесь нагревали. После чего суспензию отфильтровывали и фильтрат подщелачивали 10% NaOH, чтобы осадить свободное основание, которое экстрагировали бензолом. Органическую фазу высушивали (безв. MgSO4) и органический растворитель отгоняли до маслянистого остатка, который кристаллизовали.
2.4 Синтез 2,6-диметил; 2,4,6-триметил-, 2-хлор-6-метил- и (4-хлор-2-метилфенокси)уксусной кислоты
Раствор 0,3 моль NaOH в 250 мл воды получали в 750 мл круглодонной колбе. Затем добавляли 0,3 моль соответствующего фенола. Отдельно в колбе получали 0,3 моль хлоруксусной кислоты в 300 мл 10% NaHCO3, смесь добавляли к прежде полученному раствору соответствующего фенолята натрия и нагревали с обратным холодильником в течение 1 часа. Затем добавляли активированный уголь, смесь отфильтровывали от суспензии и после охлаждения фильтрат подкисляли 10% HCl. Выпавшую в осадок кислоту, после фильтрации и сушки, кристаллизовали из смеси гептана/толуола (1:1) и потом получали белый кристаллический осадок.
2.5 Синтез хлорангидридов 2,6-диметил-, 2,4,6-триметил-, 2-хлор-6-метил- и (4-хлор-2-метилфенокси)уксусной кислоты
0,15 моль соответствующей (фенокси)уксусной кислоты помещали в 500 мл круглодонную колбу и добавляли 0,75 моль SOCl2 (d=1,63 г/см3), смесь нагревали с обратным холодильником около 30 минут. После чего избыток тионилхлорида отгоняли при пониженном давлении и к оставшемуся жидкому хлорангидриду добавляли толуол до 100 мл и раствор неочищенного хлорида использовали в реакциях с подходящим аминоалканолом.
2.6 Синтез 2,6-диметил; 2,4,6-триметил-, 2-хлор-6-метил- и [(4-хлор-2-метилфенокси)ацетил]аминоалканолов
0,02 моль соответствующего аминоалканола в 30 мл толуола помещали в колбу Эрленмейера, добавляли избыток K2CO3 и растворяли в 50 мл воды. Смесь охлаждали и включали устройство для электромагнитного перемешивания. К смеси добавляли небольшие количества раствора соответствующего хлорангидрида (фенокси)уксусной кислоты в толуоле, эмульсию перемешивали около 0,5 часа, после чего ее нагревали. После охлаждения органическую фазу отделяли и высушивали с безв. MgSO4. Затем растворитель отгоняли и остаток кристаллизовали до белого осадка соответствующего производного.
Пример 3. Физико-химические данные некоторых производных согласно данному изобретению
Физико-химические параметры (точка плавления Тпл, Rf для обычных элюентов, ИК и1H ЯМР спектры и/или оптическое вращение [α]) были измерены для некоторых полученных соединений с помощью стандартных методов анализа.
R,S-2N-[(2,3-диметилфенокси)этил]амино-1-пропанол (1)
Тпл=76-78°С (толуол/гептан (1/1)); Rf=0,47 (СН3ОН); ИК (KBr, см-1) v: 3735, 3649, 3295, 3127, 2964, 2931, 2886, 2833, 2601, 2361, 2116, 1909, 1587, 1461, 1266, 771;1Н-ЯМР: (δ ppm) 7.01 (dd, J=7.9, J=7.5, 1H, H-5); 6.77 (d, J=7.9, 1H, H-4); 6.74 (d, J=7.5, 1H, H-6); 4.54 (t, J=5.2, 1H, OH); 4.03-3.97 (m, 1H, C






R,S-2N-1(2,3-диметилфенокси)этил]амино-1-бутанол (2)
Тпл=55-56°С (толуол/гептан (1/1)); Rf=0,51 (СН3ОН); ИК (KBr, см-1) v: 3295, 3158, 2964, 2931, 2875, 2837, 1900, 1585, 1470, 1263, 1109, 1062, 762; [%]:



2N-[(2,3-диметилфенокси)этил]амино-2-метил-1-пропанол (3)
Тпл=75-77°С (толуол/гептан (1/1)); Rf=0,44 (СН3ОН); ИК (KBr, см-1) v: 3295, 3154, 2986, 2971, 2926, 2877, 2827, 2756, 2557, 2359, 1584, 1464, 1263, 1068, 768; [%]:



R,S-2N-[(2,3-диметилфенокси)этил]амино-1-фенилэтанол (4)
Тпл=118-120°С (толуол/гептан (1/1)); Rf=0,62 (СН3ОН); ИК (KBr, см-1) v. 3310, 3064, 3033, 2975, 2921, 2899, 2871, 2836, 2735, 2519, 2364, 1892, 1588, 1453, 1266, 1108,


R,S-1N-[(2,5-диметилфенокси)этил]амино-2-пропанол (5)
Тпл=64-66°С (толуол/гептан (1/1)); Rf=0,39 (СН3ОН/этилацетат (1/1)); Rf=0,58 (СН3ОН); ИК (KBr, см-1) v: 3309, 3140, 2968, 2956, 2921, 2833, 2753, 1511, 1441, 1271, 1152, 1045, 803, 443, 408;1H-ЯМР: (δ ppm) 6.98 (d, J=7.4, 1H, H-3); 6.73 (s, 1H, H-6); 6.63 (d, J=7.4, 1H, H-4); 4.44 (d, J=4.3, 1H, ОН); 4.03-3.94 (m, 2H, CH2-O); 3.71-3.64 (m, 1H, HO-C




R,S-2N-[(2,5-диметилфенокси)этил]амино-1-пропанол (6)
Тпл=74-76°С (толуол/гептан (1/1)); Rf=0,36 (СН3ОН/этилацетат (1/1)); ИК (KBr, см-1) v: 3300, 3151, 2970, 2922, 2846, 2601, 1876, 1614,1444, 1263,1045, 804;1H-ЯМР: (δ ppm) 6.98 (d, J=7.4, 1H, H-3); 6.73 (s, 1H, H-6); 6.63 (d, J=7.4, 1H, H-4); 4.53 (t, J=5.0, 1H, ОН); 4.04-3.98 (m, 1H, O-С






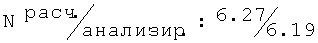


R,S-1N-[(2,5-диметилфенокси)этил]амино-2-бутанол(7)
Тпл=63-65°С (толуол/гептан (1/1)); Rf=0,39 (СН3ОН/этилацетат (1/1)); ИК (KBr, см-1) v: 3267, 3142, 2974, 2964, 2920, 2876, 2847, 2802, 1620, 1587, 1512, 1267, 1131, 800;1H-ЯМР: (δ ppm) 6.97 (d, J=7.4, 1H, H-3); 6.73 (s, 1H, H-6); 6.63 (d, J=7.4, 1H, H-4); 4.41 (bs, 1H, ОН); 4.03-3.95 (m, 2H, O-CH2); 3.42 (bs, 1H, СН); 2.88 (t, J=5.5, 2H, O-CH2-CH2-N); 2.57 (dd, J=11.6, J=4.0, 1H, N-C




R,S-2N-[(2,5-диметилфенокси)этил]амино-1-бутанол(8)
Тпл=66-68°С (толуол/гептан (1/1)); Rf=0,44 (СН3ОН/этилацетат (1/1)); ИК (KBr, см-1) v: 3296, 3151, 2964, 2927, 2876, 2862, 2826, 2733, 2361, 2342, 1458, 1268, 1065, 801, 470;1H-ЯМР: (δ ppm) 6.98 (d, J=7.4, 1H, H-3); 6.73 (s, 1H, Н-6); 6.63 (d, J=7.4, 1H, H-4); 4.40 (t, J=5.4, 1H, OH); 4.03-3.93 (m, 2H, C





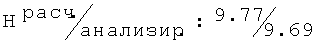
R,S-2N-[(2,5-диметилфенокси)этил]амино-1-фенилэтанол (9)
Тпл=124-126°С (толуол/гептан (1/1)); Rf=0,62 (СН3ОН); ИК (KBr, см-1) v: 3308, 3061, 2973, 2921, 2839, 2740, 2360, 2341, 1584, 1439, 1270, 1132, 803, 701;1H-ЯМР: (δ ppm) 7.39-7.26 (m, 4H, H(Ar)); 7.25-7.20 (m, 1H, H(Ar)); 6.98 (d, J=7.4, 1H, H-3); 6.73 (s, 1H, H-6); 6.63 (d, J=7.4, 1H, H-4); 5.26 (d, J=3.5, 1H, OH); 4.68-4.61 (m, 1H, СН); 3.98 (t, J=5.5, 2H, O-CH2); 2.92 (t, J=5.5, 2H, O-CH2-CH2-N); 2.72 (d, J=6.2, 2H, N-CH2-CH); 2.25 (s, 3Н, 5-СН3); 2.05 (s, 3Н, 2-СН3); 1.89 (bs, 1H, N-H); [%]



R-(-)-1N-[(2,6-диметилфенокси)этил]амино-2-пропанол (10)
Тпл=76-77°С (толуол/гептан (1/1)); C13H21NO2 (223.32) [%]


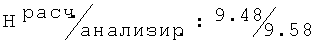
R,S-2N-[(2,6-диметилфенокси)этил]амино-1-пропанол (11)
Тпл=66-68°С (толуол/гептан (1/1)); Rf=0,56 (СН3ОН/этилацетат (1/1)); ИК (KBr, см-1) v: 3291, 3147, 3068, 2982, 2964, 2930, 2843, 2593, 1473, 1201, 1041, 757, 434.
R-(-)-2N-[(2,6-диметилфенокси)этил]амино-1-пропанол (12)
Тпл=84-86°С (толуол/гептан (1/1)); Rf=0,56 (СН3ОН/этилацетат (1/1)); ИК (KBr, см-1) v: 3291, 3147, 2964, 2930, 2844, 1642, 1473, 1201, 1041, 757;1H ЯМР (500,13 МГц, ДМСО-d6): 7.07-6.96 (m, 2H, H-3(Ar), H-5(Ar)); 6.96-6.84 (m, 1H, H-4(Ar)); 4.57 (t, J=5.2, 1H, ОН); 3.85-3.71 (m, 2H, Ar-O-CH2); 3.33-3.19 (m, 2H, C




R-(-)-2N-[(2,6-диметилфенокси)этил]амино-1-пропанол гидрохлорид (12а)
Тпл=107-109°С,1Н ЯМР (500,13 МГц, ДМСО-d6): 9.10 (bs, 2H, NH2+); 7.07-7.00 (m, 2H, Н-3(Ar), Н-5(Ar)); 6.99-6.91 (m, 1H, Н-4(Ar)); 5.42 (bs, 1H, ОН); 4.07 (t, J=5.8, 2H, Ar-O-СН3); 3.74-3.54 (m, 2H, C

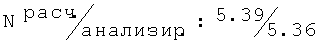


S-(+)-2N-[(2,6-диметилфенокси)этил]амино-1-пропанол (13)
Тпл=83-85°С (толуол/гептан (1/1)); Rf=0,56 (СН3ОН/этилацетат (1/1));1H ЯМР (300 МГц, ДМСО-d6): 7.04-6.88 (m, 3Н, Н-Ar); 5.0-4.2 (bb, 1H, ОН); 3.78 (t, J=5.5, 2H, Ar-O-CH2); 3.32 (dd, J=5.2, J=10.4, 1H,


S-(+)-2N-[(2,6-диметилфенокси)этил]амино-1-пропанол гидрохлорид (13а)
Тпл=107-109°С; [α]58925.1=+8.04°, [α]58924.0=+6.0° (с=2%, СН3ОН); C13H22NO2Cl (259.77).
R,S-2N-[(2,6-диметилфенокси)этил]-2N-метиламино-1-пропанол гидрохлорид (14)
Тпл=130-132°С; Rf=0,63 (СН3ОН/этилацетат (1/1)); ИК (KBr, см-1) v: 3356, 3021, 2967, 2930, 2674, 2647, 2360, 2342, 1475, 1199, 771;1H ЯМР (300 МГц, ДМСО-d6): 11.45 (bs, 1H, NH+); 11.12 (bs, 1H, NH+) 7.04 (d, J=7.5, 2H, H-3, H-5); 6.95 (dd, J=7.5, J=7.5, 1H, H-4); 5.54 (bs, 1H, ОН); 5.48 (bs, 1H, ОН) 4.26-4.12 (m, 2H, C

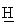



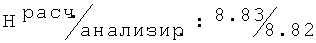
3N-[(2,6-диметилфенокси)этил]амино-3-метил-1-бутанол гидрохлорид (15)
Тпл=170-172°С; Rf=0,69 (СН3ОН/этилацетат (1/1)); ИК (KBr, см-1) v: 3379, 2963, 2874, 2822, 2740, 2463, 2360, 2343, 1597, 1584, 1466, 1200, 1044, 770; C15H26NO2Cl (287.83), [%]:



L-2N-[(2,6-диметилфенокси)этил]амино-3-метил-1-бутанол гидрохлорид (16)
Тпл=162-164°С; Rf=0,75 (СН3ОН/этилацетат (1/1)).
5N-[(2,6-диметилфенокси)этил]амино-1-пентанол гидрохлорид (17)
Тпл=138-140°С; C15H26NO2Cl (287.83).
D,L-транс-2N-[(2,6-диметилфенокси)этил]амино-1-циклогексанол (18)
Тпл=88-90°С; Rf=0,52 (СН3ОН/бензол (1/5));1H ЯМР (500,13 МГц, ДМСО-d6): 7.00 (d, 2H, J=7.5, H-Ar); 6.89 (t, J=7.5, 1H, H-Ar); 4.65 (d, J=5.1, 1H, OH); 3.84-3.75 (m, 2H, CH2-O-Ar); 3.17-3.08 (m, 1H, СН-ОН); 2.95-2.88 (m, 1Н, CHH-N); 2.86-2.78 (m, 1H, CHH-N); 2.36 (bs, 1H, NH); 2.27-2.22 (m, 1H, CH-N); 2.22 (s, 6H, о-Ar-(СН3)2); 1.96-1.87 (m, 1H, С6Н10); 1.86-1.75 (m, 1H, С6Н10); 1.68-1.53 (m, 1H, C6H10); 1.27-1.09 (m, 2H, С6Н10); 1.00-0.87 (m, 3H, С6Н10); 0.98-0.88 (m, 1H, C6H10), C16H25NO2 (263.38); [%]:



D,L-транс-2N-[(2,6-диметилфенокси)этил]амино-1-циклогексанол гидрохлорид (18а)
Тпл=174-176°С; Rf=0,61 (СН3ОН/бензол (1/5));1H ЯМР (500,13 МГц, ДМСО-d6): 9.54 (s, 1H, NHH+); 8.75 (s, 1H, NHH+); 7.04 (d, 2H, J=7.5, H-Ar); 6,94 (t, J=7.5, 1H, H-Ar); 5.68 (d, J=5.1, 1H, OH); 4.10 (t, J=5.7, 2H, Ob-O-Ar); 3.68-3.60 (m, 1H, СН-ОН); 3.42 (t, J=5.7 2H, CH2-N); 3.00-2.92 (m, 1H, N-C-H); 2.26 (s, 6H, о-Ar-(СН3)2); 2.21-2.15 (m, 1H, С6Н10); 1.98-1.91 (m, 1H, С6Н10); 1.76-1.66 (m, 1H, С6Н10); 1.66-1.59 (m, 1H, C6H10); 1.53-1.41 (m, 3H, С6Н10); 1.31-1.13 (m, 3H, С6Н10); C16H26NO2Cl (299.84); [%]:
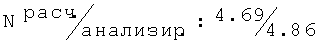


R,S-2N-[(2,6-диметилфенокси)этил]амино-1-фенилэтанол(19)
Тпл=110-111°С (толуол/гептан (1/1)); Rf=0,62 (СН3ОН); C18H23NO2 (285.38).
R-(-)-2N-[(2,6-диметилфенокси)этил]амино-1-фенилэтанол (20)
Тпл=78-80°С (толуол/гептан (1/1)); Rf=0,62 (СН3ОН); C18H23NO2 (285.38); (c=1%, СН3ОН): [α]D22.7=-23.80°; [α]54624.1=+23.0°.
S-(+)-2N-[(2,6-диметилфенокси)этил]амино-1-фенилэтанол (21)
Тпл=78-80°С (толуол/гептан (1/1)); Rf=0,62 (СН3ОН); C18H23NO2 (285.38); (c=1%, СН3ОН): [α]D22.7=+23.31°; [α]54624.1=+22.5°.
R,S-2N-[(2,6-диметилфенокси)этил]-2N-метиламино-1-фенилэтанол гидрохлорид (22)
Тпл=130-132°С; Rf=0,69 (СН3ОН); ИК (KBr, см-1) v: 3220, 3019, 2950, 2806, 2718, 1477, 1465, 1363, 1200, 1092, 909, 701;1H ЯМР (300 МГц, ДМСО-d6): 10.45-10.06 (bs, 1H, NH+); 7.49-7.36 (m, 4Н, H-Ar); 7.34-7.30 (m, 1H, H-Ar); 7.04 (d, J=7.4; 2H, H-3, H-5); 6.95 (t, J=7.4, 1H, H-4); 6.33-6.28 (bs, 1H, ОН); 5.28-5.11 (m, 1H, СН); 4.21-4.10 (m, 2H, O-CH2); 3.80-3.55 (m, 2H, O-CH2-CH2-N); 3.50-3.25 (m, 2H, N-CH



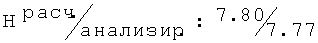
R,S-1N-[(2-хлор-6-метилфенокси)этил]амино-2-пропанол (23)
Тпл=72-73°С (толуол/гептан (1/1)); Rf=0,54 (толуол/ацетон (1/1)); ИК (KBr, см-1) v. 3300, 3121, 3065, 2960, 2917, 2838, 1464, 1438, 1262, 1227;1H-ЯМР: (500,13 MHz, δ ppm, ДМСО-d6) 7.28 (ddq, J=8.0, J=1.6, J=0.8 1H, H-3); 7.18 (ddq, J=7.6, J=1.6, J=0.8, 1H, H-5); 7.03 (dd, J=8.0, J=7.6 1H, H-4); 4.44 (d, J=4.5, 1H, OH); 3.92 (t, J=5.6, 2H, O-СН2); 3.68 (dq, J=4.5, J=6.2 1H, C-H); 2.89 (dt, J=1.1, J=5.6, 2H, CH2-N); 2.28 (J=0.8, 3Н, СН3-Ar); 1.88 (bs, 1H, NH); C12H18NO2Cl (243.74); [%]:



R,S-2N-[(2-хлор-6-метилфенокси)этил]амино-1-пропанол (24)
Тпл=65-66°С (толуол/гептан (1/1)); Rf=0,50 (толуол/ацетон (1/1)); ИК (KBr, см-1) v. 3284, 3133, 3067, 2983, 2962, 2935, 2844, 2594, 1462, 1441, 1261;1H-ЯМР: (500,13 МГц, δ ppm, ДМСО-d6) 7.28 (ddq, J=7.9, J=1.6, J=0.6 1H, H-3); 7.18 (ddq, J=7.5, J=1.6, J=0.8, 1H, H-5); 7.03 (ddq, J=7.9, J=7.5, J=0.4 1H, H-4); 4.52 (dd, J=5.0, J=5.6 1H, OH); 3.97-3.89 (m 2H, ArO-СН2); 3,30 (ddd, J=10.3, J=5.1, J=5.1 1H, C





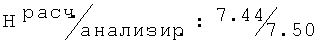
R,S-1N-[(2-хлор-6-метилфенокси)этил]амино-2-бутанол (25)
Тпл=46-48°С (толуол/гептан (1/1)); Rf=0,62 (толуол/ацетон (1/1)); ИК (KBr, см-1) v. 3304, 3178, 2957, 2923, 2836, 2364, 2342, 1458, 1444, 1264, 1226;1H-ЯМР: (500,13 МГц, ДМСО-d6, δ ppm) 7.28 (ddq, J=8.0, J=1.7, J=0.7, 1H, H-3); 7.18 (ddq, J=7.5, J=1.6, J=0.8, 1H, H-5); 7.03 (dd, J=8.0, J=7.5, 1H, H-4); 4.41 (d, J=4.8, 1H, OH); 3.93 (t, J=5.6, 2H, Ar-OCH2); 3.46-3.40 (m, 1H, CH); 2.90 (td, J=5.6, J=1.2, 2H, CH2N); 2.57 (dd, J=11.7, J=4.1, 1H, N-C


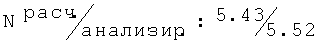


R,S-2N-[(2-хлор-6-метилфенокси)этил]амино-1-бутанол (26)
Тпл=68-69°С (толуол/гептан (1/1)); Rf=0,56 (толуол/ацетон (1/1)); Rf=0,45 (СН3ОН/этилацетат (1/3)); ИК (KBr, см-1) v. 3295, 3126, 3067, 2972, 2933, 2867, 2839, 1462, 1370, 1261, 1220;1H-ЯМР: (500,13 МГц, ДМСО-d6, 6 ppm) 7.28 (ddq, J=8.0, J=1.6, J=0.6, 1H, H-3); 7.18 (ddq, J=7.6, J=1.6, J=0.8, 1H, H-5); 7.03 (dd, J=8.0, J=7.6, J=0.4, 1H, H-4); 4.42 (t, J=5.2, 1H, OH); 3.93 (t, J=5.6, 2H, Ar-OCH2); 3.42-3.37 (m, 1H, C



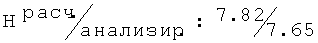
R,S-2N-[(2-хлор-6-метилфенокси)этил]амино-1-бутанол гидрохлорид (26а)
Тпл=108-110°С; Rf=0,68 (СН3ОН); Rf=0,59 (СН3ОН/этилацетат (1/1));1H-ЯМР: (500,13 МГц, ДМСО-d6, δ ppm) 9.16 (bs, 1H, NH+); 8.97 (bs, 1H, Н+); 7.32-7.04 (m, 3Н, Ar); 5.39 (t, J=5.1, 1H, -O-CH2-C




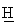




R-(-)-2N-[(2-хлор-6-метилфенокси)этил]амино-1-бутанол (27)
Тпл=66-68°С (толуол/гептан (1/1)); Rf=0,56 (толуол/ацетон (1/1)); Rf=0,45 (СН3ОН/этилацетат (1/3)); ИК (KBr, см-1) v: 3295, 3126, 3067, 2972, 2933, 2867, 2839, 1462, 1370, 1261, 1220;1H-ЯМР: (CDCl3, 300 МГц, δ ppm) 7.26-6.92 (m, 3H, Ar); 4.08-3.97 (m, 2H, Ar-O-С











R-(-)-2N-[(2-хлор-6-метилфенокси)этил]амино-1-бутанол гидрохлорид (27а)
Тпл=113-115°С; Rf=0,60 (СН3ОН/этилацетат (1/1)); C13H21NO2Cl2 (294.22), [%]:



S-(+)-2N-[(2-хлор-6-метилфенокси)этил]амино-1-бутанол (28)
Тпл=66-68°С (толуол/гептан (1/1)); Rf=0,56 (толуол/ацетон (1/1)); Rf=0,45 (СН3ОН/этилацетат (1/3));1H-ЯМР: (ДМСО-d6, 500,13 МГц, δ ppm) 7.28 (dd, J=7.9, J=1.7, 1H, H-3(Ar)); 7.18 (dd, J=7.6, J=1.7, 1H, H-5(Ar)); 7.03 (dd, J=7.9, J=7.6, 1H, H-4(Ar)); 4.47 (bs, 1H, OH); 3.93 (t, J=5.7, 2H, Ar-O-C







S-(+)-2N-[(2-хлор-6-метилфенокси)этил]амино-1-бутанол гидрохлорид (28а)
Тпл=113-115°С; Rf=0,60 (СН3ОН/этилацетат (1/1));1H-ЯМР: (500,13 МГц, ДМСО-d6, δ ppm) 8.96 (bs, 1H, NH2+); 7.32 (dd, J=8, J=1.6, 1H, H-3); 7.22 (dd, J=7.6, J=1.6, 1H, H-5); 7.09 (dd, J=8.0, J=7.6, 1H, H-4); 5.38 (t, J=4.7, 1H, OH); 4.21 (t, J=5.8, 2H, Ar-O-СН2-); 3.78 (ddd, J=12.5, J=4.7, J=3.7, 1H, C





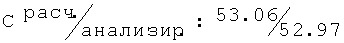
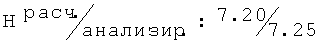
2N-[(2-хлор-6-метилфенокси)этил]амино-2-метил-1,3-пропандиол (29)
Тпл=83-85°С (толуол/гептан (1/1)); Rf=0,52 (СН3ОН/этилацетат (1/1)); ИК (KBr, см-1) v: 3307, 2973, 2928, 2876, 2679, 1446, 1227, 1048, 773; C13H20NO3Cl (273.76), [%]:


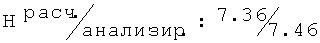
D,L-транс-2N-[(2-хлор-6-метилфенокси)этил]амино-1-циклогексанол (30)
Тпл=73-75°С (толуол/гептан (1/1)); Rf=0,48 (СН3ОН); ИК (KBr, см-1) v. 3298, 3135, 2932, 2855, 2365, 1456, 1261, 1219, 1048, 896, 763;1H-ЯМР: (ДМСО-d6, 500,13 МГц, δ ppm) 7.28 (ddd, J=0.7, J=1.6, J=8.0, 1H, H-3); 7.18 (ddd, J=0.8, J=1.6, J=7.6, 1H, H-5); 7.02 (dd, J=7.8, J=7.6, 1H, H-4); 4.57 (d, J=5.1, 1H, OH); 3.96 (ddd, J=4.8, J=9.4, J=14.6, 1H, C








R,S-2N-[(2-хлор-6-метилфенокси)этил]амино-1-фенилэтанол (31)
Тпл=98-100°С (толуол/гептан (1/1)); Rf=0,60 (СН3ОН); ИК (KBr, см-1) v: 3405, 3308, 3064, 3031, 2937, 2898, 2838, 2737, 2360, 1454, 1261;1H-ЯМР: (ДМСО-d6, 500,13 МГц, δ ppm) 7.42-6.92 (m, 8H, H-Ar); 4.76 (dd, J=3.9, J=8.9, 1H, Ar-CHOH-CH2); 4.07-3.98 (m, 2H, -O-C




R,S-1N-[(4-хлор-2-метилфенокси)этил]амино-2-пропанол (32)
Тпл=74-76°С (толуол/гептан (1/1)); Rf=0,35 (CHCl3/СН3ОН (4/1)); ИК (KBr, см-1) v. 3274, 3119, 2964, 2955, 2920, 2849, 1497, 1253, 1190, 1132, 966, 787;1H-ЯМР: (ДМСО-d6, 500,13 МГц, δ ppm) 7.12 (s, 1H, H-3); 7.08 (d, J=8.0, 1H, H-5); 6.72 (d, J=8.7, 1H, H-6); 4.06 (t, J=5.1, 2H, O-СН2-CH2-NH); 3.89-3.79 (m, 1H, C*




R,S-2N-[(4-хлор-2-метилфенокси)этил]амино-1-пропанол (33)
Тпл=84-86°С (толуол/гептан (1/1)); Rf=0,38 (CHCl3/СН3ОН (4/1)); ИК (KBr, см-1) v: 3294, 3158, 2963, 2919, 2839, 2363, 1496, 1458, 1382, 1295, 1246, 1192, 1133, 1044;1H-ЯМР: (ДМСО-d6, 500,13 МГц, δ ppm) 7.10 (s, 1H, H-3); 7.09 (d, J=8.2, 1H, H-5); 6.72 (d, J=8.9, 1H, H-6); 4.06 (t, J=4.6, 2H, O-CH2-CH2-NH); 3.63 (dd, J=10.6, J=3.8, 1H, C






R,S-1N-[(4-хлор-2-метилфенокси)этил]амино-2-бутанол (34)
Тпл=72-74°С (толуол/гептан (1/1)); Rf=0,45 (CHCl3/CH3OH (4/1)); ИК (KBr, см-1) v: 3272, 3189, 2974, 2930, 2879, 2836, 2797, 2736, 1495, 1483, 1250, 1191, 1136;1H-ЯМР: (ДМСО-d6, 500,13 МГц, δ ppm) 7.11 (s, 1H, H-3); 7.08 (d, J=7.9, 1H, H-5); 6.72 (d, J=8.9, 1H, H-6); 4.05 (t, J=5.13, 2H, O-






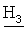


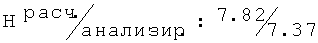
R,S-2N-[(4-хлор-2-метилфенокси)этил]амино-1-бутанол (35)
Тпл=68-70°С (толуол/гептан (1/1)); Rf=0,49 (CHCl3/СН3ОН (4/1)); ИК (KBr, см-1) v: 3257, 3113, 2971, 2932, 2874, 2846, 2826, 2348, 1493, 1374, 1251;1H-ЯМР: (ДМСО-d6, 500,13 МГц, δ ppm) 7.11 (s, 1H, H-3); 7.08 (d, J=7.4, 1H, H-5); 6.72 (d, J=8.9, 1H, H-6); 4.10-3.99 (m, 2H, O-







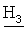
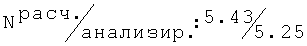


2N-[(4-хлор-2-метилфенокси)этил]амино-2-метил-1-пропанол (36)
Тпл=122-123°С (толуол/гептан (1/1)); Rf=0,46 (СН3ОН); ИК (KBr, см-1) v: 3428, 3273, 3097, 2961, 2932, 2875, 2822, 2759, 1494, 1250, 1072, 796;1H-ЯМР: (ДМСО-d6, 500 МГц, δ ppm) 7.10-7.01 (m, 2H, NH, H-3, H-5 Ar); 6.71 (d, J=8.0, 1H, Н-6 Ar); 4.03 (t, J=5.3, 2H O-C



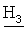




R,S-2N-[(4-хлор-2-метилфенокси)этил]амино-1-фенилэтанол (37)
Тпл=119-121°С (толуол/гептан (1/1)); Rf=0,56 (СН3ОН); ИК (KBr, см-1) v. 3313, 3149, 3061, 3034, 2950, 2935, 2920, 2890, 2836, 2361, 2342, 1497, 1257;1H-ЯМР: (ДМСО-d6, 500,13 МГц, δ ppm) 7.37-7.28 (m, 4H, H-Ar); 7.25-7.20 (m, 1H, H-Ar); 7.19 (d, J=2.3, 1H, H-3); 7.16 (dd, J=8.7, J=2.3, 1H, H-5); 6.92 (d, J=8.7, 1H, H-6); 5.29 (bs, 1H, OH); 4.64 (t, J=6.3, 1H, CH-OH); 4.00 (t, J=5.4, 2H, O-CH2); 2.92 (t, J=5.4, 2H, N-CH2); 2.72 (d, J=6.3, 2H, N-




R,S-2N-[(2,3,5-триметилфенокси)этил]амино-1-пропанол(38)
Тпл=73-75°С (толуол/гептан (1/1)); Rf=0,25 (СН3ОН/бензол (1/5));1H-ЯМР (CDCl3): (δ ppm) 6.62 (s, 1H, Ar-H); 6.54 (s, 1H, Ar-H); 4.05-4.02 (m, 2H, Ar-O-CH2); 3.61 (dd, J=4.1, J=10.5, 1H, C




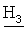



R,S-2N-[(2,3,5-триметилфенокси)этил]амино-1-бутанол (39)
Тпл=61-62°С (толуол/гептан (1/1)); Rf=0,63 (СН3ОН/этилацетат (5/1));1H-ЯМР (ДМСО-d6, 500,13 МГц): (δ ppm) 6.59 (s, 1H, H-4); 6.56 (s, 1H, H-6); 4.45 (b.b., 1H, ОН); 3.95 (t, J=5.3, 2H, Ar-O-СН2); 3.50-3.20 (m, 2H, C






R-(-)-2N-[(2,3,5-триметилфенокси)этил]амино-1-бутанол (40)
Тпл=47-49°С (толуол/гептан (1/1)); Rf=0,37 (СН3ОН/бензол (1/5)).
S-(+)-2N-[(2,3,5-триметилфенокси)этил]амино-1-бутанол (41)
Тпл=47-49°С (толуол/гептан (1/1)); Rf=0,37 (СН3ОН/бензол (1/5));
R,S-2N-[(2,3,5-триметилфенокси)этил]амино-1-фенилэтанол гидрохлорид (42)
Тпл=146-148°С (толуол/гептан (1/1)); Rf=0,36 (СН3ОН/бензол (1/5));1H-ЯМР: (ДМСО-d6, 500 МГц, δ ppm) 9.37 (s (b.b.), 2H, NH2+); 7.48-7.23 (m, 5H, H-Ar); 6.62 (d, J=4.7, 2H, H-Ar); 6.26 (d, J=4.7, 1H, OH); 5.13-5.0 (m, 1H, CH); 4.34-4.19 (m, 2H, O-CH2); 3.40-3.03 (m, 4H, CH2-N); 2.22 (s, 3H, СН3-Ar); 2.15 (s, 3H, СН3-Ar); 2.02 (s, 3H, СН3-Ar), C19H26NO2Cl (335.87), [%]:



R-(-)-2N-[(2,4,6-триметилфенокси)этил]амино-1-пропанол (43)
Тпл=91-92°С; Rf=0,40 (этанол/этилацетат (1/1)); C14H23NO2 (237.33), [%]:


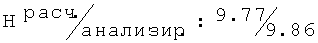
D,L-транс-2N-[(2,4,6-триметилфенокси)этил]амино-1-циклогексанол (44)
Тпл=90-91°С; Rf=0,55 (СН3ОН/бензол (1/5));1H-ЯМР: (ДМСО-d6, 500,13 МГц, δ ppm) 6.80 (s, 2H, H-Ar); 4.63 (d, J=5.1, 1H, ОН); 3.80-3.69 (m, 2H, Ar-O-CH2); 3.15-3.08 (m, 1H, C






R,S-2N-[(2,4,6-триметилфенокси)этил]амино-1-фенилэтанол(45)
Тпл=90-91°С; Rf=0,58 (СН3ОН/бензол (1/5));1H-ЯМР: (ДМСО-d6, 500,13 МГц, δ ррт) 7.40-7.28 (т, 4Н, о.m-Н-Ar); 7.26-7.20 (т, 1H, Н-Ar); 6.80 (s, 2Н, Н-Ar); 5.33 (d, J=2.6, 1H, ОН); 4.66 (d, J=2.6, 1H, C




R,S-2N-[(2,3-диметилфенокси)пропил]амино-1-пропанол (46)
Тпл=88-90°С; Rf=0,24 (СН3ОН); ИК (KBr, см-1) v: 3260, 3110, 2957, 2924, 2824, 2599, 2359, 1593, 1481, 1257, 1091, 768,1H-ЯМР: (ДМСО-d6, 500,13 МГц, δ ppm) 7.00 (dd, J=8.2, J=7.5, 1H, H-5); 6.76 (d, J=8.5, 1H, H-4); 6.73 (d, J=7.5, 1H, H-6); 4.45 (bs, 1H, OH); 3.91 (t, J=6.2, 2Н, СН2-OAr); 3.28-3.18 (m, 2Н, C

2N-[(2,3-диметилфенокси)пропил]амино-2-метил-1-пропанол (47)
Тпл=128-130°С; Rf=0,22 (СН3ОН); ИК (KBr, см-1) V: 3275, 3074, 2963, 2904, 2870, 2814, 2752, 2718, 2662, 2568, 2349, 2147, 1881, 1584, 1469, 1263, 1089; C15H25NO2(251.37) [%]:


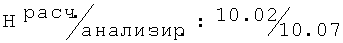
R,S-2N-[(2,3-диметилфенокси)пропил]амино-1-бутанол (48)
Тпл=82-84°С; Rf=0,24 (СН3ОН); ИК (KBr, см-1) v: 3258, 3100, 2964, 2922, 2863, 2815, 1910, 1584, 1464, 1255, 1096, 768; C15H25NO2 (251.37) [%]:



R,S-2N-[(2,3-диметилфенокси)пропил]амино-1-фенилэтанол (49)
Тпл=111-112°С; Rf=0,38 (СН3ОН); ИК (KBr, см-1) v: 3333, 3322, 3063, 3030, 2946, 2922, 2895, 2844, 2754, 1953, 1582, 1256, 1102, 703; C19H25NO2 (299.42) [%]:
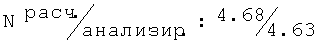


R,S-1N-[(2,6-диметилфенокси)пропил]амино-2-пропанол (50)
Тпл=76-78°С; Rf=0,28 (СН3ОН/этилацетат (1/1)); C14H23NO2 (237.34).
R,S-2N-[(2,6-диметилфенокси)пропил]амино-1-пропанол (51)
Тпл=84-86°С; Rf=0,25 (СН3ОН/этилацетат (1/1)); ИК (KBr, см-1) v: 3307, 3134, 2972, 2948, 2930, 2876, 2838, 2680, 2361, 2341, 1473, 1207, 1053, 782; C14H23NO2 (237.34) [%]:

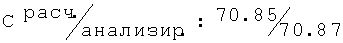

R-(-)-2N-[(2,6-диметилфенокси)пропил]амино-1-пропанол гидрохлорид (52)
Тпл=119-120°С (толуол/гептан (1/1)); C14H24NO2Cl (273.80).
2N-[(2,6-диметилфенокси)пропил]амино-2-метил-1-пропанол (53)
Тпл=73-75°С (толуол/гептан (1/1)); Rf=0,27 (СН3ОН/этилацетат (1/1)); ИК (KBr, см-1) v: 3272, 3071, 2988, 2970, 2942, 2902, 2870, 2817, 2757, 1592, 1477, 1210,1073, 764; C15H25NO2 (251.37), [%]:



R,S-1N-[(2,6-диметилфенокси)пропил]амино-2-бутанол (54)
Тпл=62-64°С (толуол/гептан (1/1)); Rf=0,26 (СН3ОН/этилацетат (1/1)); ИК (KBr, см-1) v: 3259, 3122, 2972, 2960, 2917, 2850, 2820, 2776, 2348, 1911, 1594, 1476, 1461, 1204, 1064;1H-ЯМР: (ДМСО-d6, 500,13 МГц, δ ppm) 7.00 (d, J=7.5, 2H, Н-3, Н-5); 6.88 (dd, J=7.5, J=7.5, 1H, H-4); 4.38 (bs, 1H, OH); 3.77 (t, J=6.2, 2H, CH2-OAr); 3.46-3.37 (m, 1H, CH); 2.78-2.67 (m, 2H, CH2-C







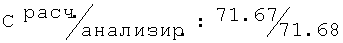
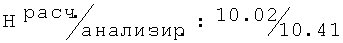
R,S-2N-[(2,6-диметилфенокси)пропил]амино-1-бутанол гидрохлорид (55)
Тпл=125-127°С (толуол/гептан (1/1)); Rf=0,26 (СН3ОН/этилацетат (1/1)); ИК (KBr, см-1) v: 3301, 3020, 2970, 2921, 2845, 2813, 2670, 2504, 2355, 1460, 1202, 761; C15H26NO2Cl (287.82), [%]:


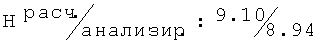
R,S-2N-[(2,6-диметилфенокси)пропил]амино-1-фенилэтанол (56)
Тпл=90-92°С (толуол/гептан (1/1)); Rf=0,39 (СН3ОН/этилацетат (1/1)); ИК (KBr, см-1) v: 3308, 3063, 3031, 2928, 2896, 2837, 2769, 2733, 1454, 1199, 759, 699; C19H25NO2(299.42), [%]:



R,S-2N-[(2-хлор-6-метилфенокси)пропил]амино-1-пропанол (57)
Тпл=74-75°С (толуол/гептан (1/1)); Rf=0,27 (СН3ОН/этилацетат (1/1)); ИК (KBr, см-1) v: 3287, 3109, 2978, 2960, 2937, 2902, 2864, 2842, 1594,1465, 1265, 1083, 1046, 778;1H-ЯМР: (ДМСО-d6, 500,13 МГц, δ ppm) 7.28 (ddd, J=7.9, J=1.7, J=0.6, 1H, Н-3); 7.17 (ddd, J=7.6, J=1.7, J=0.7, 1H, Н-5); 7.02 (ddd, J=7.9, J=7.6, J=0.4, 1H, H-4); 4.52 (bs, 1H, OH); 3.92 (t, J=6.3, 2H, Ar-O-CH2); 3.26 (dd, J=10.4, J=5.6, 1H, C




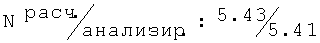


R,S-2N-[(2-хлор-6-метилфенокси)пропил]амино-1-бутанол гидрохлорид (58)
Тпл=116-118°С; Rf=0,36 (СН3ОН/этилацетат (1/1)); ИК (KBr, см-1) v: 3352, 3035, 2968, 2898, 2848, 1463, 1261, 764;1H-ЯМР: (ДМСО-d6, 500,13 МГц, δ ppm) 9.06 (bs, 2H, NH2+); 7.25-6.92 (m, 3H, H-Ar); 4.62 (bs, 1H, ОН); 4.05-4.00 (m, 3H, -C






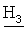



R,S-2N-[(2,6-диметилфенокси)ацетил]-2N-метиламино-1-этанол (59)
Тпл=90-91°С; Rf=0,66 (толуол/ацетон (5/1));1H-ЯМР: (ДМСО-d6, 500,13 МГц, δ ppm) 7.05-6.99 (m, 2H, Н-3(Ar), H-5(Ar)); 6.96-6.89 (m, 1H, H-4(Ar)); 4.83 (t, J=5.3, 0.6H, ОН); 4.64 (t, J=5.5, 0.4H, ОН); 4.53 (s, 1.2H, O-CH2-C=O); 4.45 (s, 0.8H, O-CH2-C=O); 3.56-3.48 (m, 2H, N-CH2); 3.42-3.32 (m, 2H, C


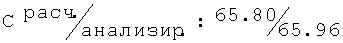

R,S-2N-[(2,6-диметилфенокси)ацетил]амино-1-пропанол (60)
Тпл=95-96°С; Rf=0,76 (СН3ОН/этилацетат (1/1)); C13H19NO3 (237.30).
(R)-(+)-2N-[(2,6-диметилфенокси)ацетил]амино-1-пропанол (61)
Тпл=121-123°С; Rf=0,76 (СН3ОН/этилацетат (1/1)); C13H19NO3 (237.30).
S-(-)-2N-[(2,6-диметилфенокси)ацетил]амино-1-пропанол (62)
Тпл=121-123°С; Rf=0,76 (СН3ОН/этилацетат (1/1)); C13H19NO3 (237.30).
R,S-1N-[(2,6-диметилфенокси)ацетил]амино-2-бутанол (63)
Тпл=96-97°С; C14H21NO3 (251.30).
транс-4N-[(2,6-диметилфенокси)ацетил]амино-1-циклогексанол (64)
Тпл=161-162°С; Rf=0,48 (толуол/ацетон (5/1));1H-ЯМР: (ДМСО-d6, 500,13 МГц, δ ppm) 7.80 (d, J=8.2, 1H, NH); 7.06-6.97 (m, 2H, Н-3(Ar), H-5(Ar)); 6.96-6.90 (m, 1H, H-4(Ar)); 4.49 (d, J=4.4, 1H, OH); 4.16 (s, 2H, O-CH2-C=O); 3.70-3.57 (m, 1H, CH-OH(C6H10)); 3.43-3.33 (m, 1H, C




D-2N-[(2,6-диметилфенокси)ацетил]аминопропионамид (65)
Тпл=177-178°С; Rf=0,77 (СН3ОН/этилацетат (1/1)); ИК (KBr, см-1) v: 3351, 3266, 3182, 3076, 2980, 2970, 2927, 2865, 2805, 1666, 1200, 774; C13H18N2O3 (250.30), [%]:



D,L-2N-[(2,6-диметилфенокси)ацетил]аминобутирамид (66)
Тпл=182-184°С; Rf-0,71 (СН3ОН/этилацетат (1/1)); Rf=0,88 (СН3ОН/этилацетат (1/1)); C14H20N2O3 (264.33), [%]:



N-метиламид D,L-2N-[(2,6-диметилфенокси)ацетил]аминопропионовой кислоты (67)
Тпл=129-131°С; Rf=0,78 (CHCl3/СН3ОН (4/1)); ИК (KBr, см-1) v: 3297, 3116, 3041, 2978, 2956, 2923, 2878, 2854, 1651, 1531, 1198, 764; C14H20N2O3 (264.33), [%]:
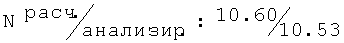


R,S-1N-1(2-хлор-6-метилфенокси)ацетил]амино-2-пропанол (68)
Тпл=102-104°С; Rf=0,82 (СН3ОН/этилацетат (1/1)); ИК (KBr, см-1) v: 3425, 3350, 2961, 2920, 2874, 1654, 1542, 1467, 1262, 1044;1H-ЯМР: (ДМСО-d6, 500,13 МГц, δ ppm) 7.38 (bs, 1H, NH); 7.26-6.97 (m, 3H, H-Ar); 4.43 (s, 2H, O-СН2-СО); 4.08-3.98 (m, 1H, -C






R,S-2N-[(2-хлор-6-метилфенокси)ацетил]амино-1-пропанол (69)
Тпл=88-90°С; Rf=0,87 (СН3ОН/этилацетат (1/1)); ИК (KBr, см-1) v: 3407, 3376, 2973, 2927, 2879, 1651, 1556, 1267;1H-ЯМР: (ДМСО-d6, 500,13 МГц, δ ppm) 7.76 (d, J=8.5, 1H, NH); 7.31 (dd, J=8.0, J=1.8, 1H, H-3); 7.21 (dd, J=7.6, J=1.8, 1H, H-5); 7.07 (dd, J=8.0, J=7.6, 1H, H-4); 4.78 (bs, 1H, OH); 4.35 (d, J=14.0, 1H, C






R-(-)-2N-[(2-хлор-6-метилфенокси)ацетил]амино-1-пропанол (70)
Тпл=111-113°С; Rf=0,82 (СН3ОН/этилацетат (1/1)); ИК (KBr, см-1) v: 3407, 3295, 2974, 2934, 2875, 1655, 1541 1264;1H-ЯМР: (ДМСО-d6, 500,13 МГц, δ ppm) 7.36-6.98 (m, 4H, NH, H-Ar); 4.41 (s, 2H, -O-СН2-СО); 4.24-4.12 (m, 1H, -С





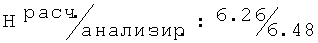
S-(+)-2N-[(2-хлор-6-метилфенокси)ацетил]амино-1-пропанол (71)
Тпл=111-113°С; Rf=0,82 (СН3ОН/этилацетат (1/1)); (с=1%, СН3ОН): [α]54619.5=+3.50°; [α]58919.1=+3.74°.
R,S-1N-[(2-хлор-6-метилфенокси)ацетил]амино-2-бутанол (72)
Тпл=96-97°С; Rf=0,70 (СН3ОН/этилацетат (1/1)); ИК (KBr, см-1) v: 3421, 3337, 2969, 2921, 2878, 1655, 1541, 1458, 1225, 1045;1H-ЯМР: (ДМСО-d6, 500,13 МГц, δ ppm) 7.91 (dd, J=6.1, J=5.2, 1H, NH); 7.32 (dd, J=8.0, J=1.5, 1H, H-3); 7.21 (dd, J=7.6, J=1.5, 1H, H-5); 7.08 (dd, J=8.0, J=7.6, 1H, H-4); 4.73 (d, J=5.3, 1H, OH); 4.34 (s, 2H, O-CH2-C=O); 3.52-3.45 (m, 1H, CH); 3.26 (ddd, J=13.1, J=6.1, J=4.8, 1H, C






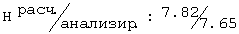
R,S-2N-[(2-хлор-6-1иетилфенокси)ацетил]амино-1-бутанол (73)
Тпл=59-60°С; Rf=0,84 (СН3ОН/этилацетат (1/1)); ИК (KBr, см-1) v: 3278, 3075, 2966, 2934, 2875, 1655, 1547; 1263, 1047;1H-ЯМР: (ДМСО-d6, 500,13 МГц, δ ppm) 7.67 (d, J=8.7, 1H, NH); 7.31 (dd, J=8.2, J=1.7, 1H, H-3); 7.21 (dd, J=7.6, J=1.7, 1H, H-5); 7.08 (dd, J=8.0, J=7.6, 1H, H-4); 4.74 (t, J=5.5, 1H, OH); 4.38 (d, J=14.1, 1H, O-CH-HC=O); 4.31 (d, J=14.1, 1H, O-CHHC=O); 3.80-3.72 (m, 1H, CH); 3.51-3.32 (m, 2H, CH2-OH); 2.30 (s, 3Н, Ar-СН3); 1.62 (qdd, J=18.9, J=7.4, J=5.2, 1H, C



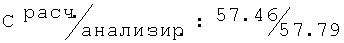
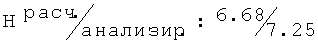
D,L-N-[(2-хлор-6-метилфенокси)ацетил]аланин (74)
Тпл=199-201°С; Rf=0,86 (СН3ОН/этилацетат (1/1)); ИК (KBr, см-1) v: 3364, 2984, 2923, 2750, 2616, 2544, 1859, 1727, 1631, 1421, 1247, 1221;1H-ЯМР: (ДМСО-d6, 500,13 МГц, δ ppm) 7.50 (bs, 1H, CO-NH); 7.25-6.98 (m, 3Н, H-Ar); 4.80-4.70 (m, 1H, NH-CH-СН3); 4.46 (dd, J=14.9, J=20.3, 2H, О-CH2-CO); 2.32 (s, 3Н, СН3-Ar); 1.58 (d, J=7.2, 3Н, СН-С
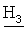



D-(+)-N-[(2-хлор-6-метилфенокси)ацетил]аланин (75)
Тпл=186-188°С; Rf=0,53 (СН3ОН/этилацетат (1/1)); ИК (KBr, см-1) v: 3364, 2984, 2923, 2750, 2616, 2544, 1859, 1727, 1631, 1224;1H-ЯМР: (ДМСО-d6, 500,13 МГц,


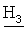



L-(-)-N-[(2-хлор-6-метилфенокси)ацетил]аланин (76)
Тпл=186-188°С; Rf=0,53 (СН3ОН/этилацетат (1/1)); (с=1%, СН3ОН): [α]54619.5=-9.40°; [α]58919.1=-9.10°.
D,L-2N-[(2-хлор-6-метилфенокси)ацетил]аминомасляная кислота (77)
Тпл=172-174°С; Rf=0,62 (СН3ОН/этилацетат (1/1)); ИК (KBr, см-1) v: 3372, 2978, 2925, 2880, 2747, 2548, 1727, 1633, 1241, 1047, 777;1H-ЯМР: (ДМСО-d6, 500,13 МГц, δ ppm) 8.11 (d, J=7.8, 1H, NH); 7.31 (dd, J=7.8, J=1.7, 1H, H-3); 7.21 (dd, J=7.6, J=1.7, 1H, H-5); 7.08 (dd, J=7.8, J=7.6, 1H, H-4); 4.44 (d, J=14.0, 1H, C



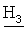



D,L-2N-[(2-хлор-6-метилфенокси)ацетил]аминобутирамид (78)
Тпл=169-171°С; Rf=0,77 (СН3ОН/этилацетат (1/3)); ИК (KBr, см-1) v: 3369, 3262, 3194, 3065, 2968, 2930, 2872, 1650, 1428, 1261;1Н-ЯМР: (ДМСО-d6, 500,13 МГц, δ ppm) 7.45 (bs, 1H, CO-NH); 7.26-6.98 (m, 3H, H-Ar); 6.15 (bs, 1H, СО-N





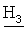



4N-[(2-хлор-6-метилфенокси)ацетил]аминомасляная кислота (79)
Тпл=103-105°С; Rf=0,70 (СН3ОН/этилацетат (1/1)); ИК (KBr, см-1) v: 3394, 2955, 2925, 2729, 2672, 1730, 1646, 1206, 1038; C13H16NO2Cl (285.73), [%]:


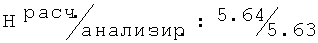
R,S-1N-[(4-хлор-2-метилфенокси)ацетил]амино-2-пропанол (80)
Тпл=76-78°С; Rf=0,86 (СН3ОН); ИК (KBr, см-1) v. 3426, 3330, 2972, 2919, 2875, 1651, 1248, 1192, 1134, 805;1H-ЯМР: (ДМСО-d6, 500,13 МГц, δ ppm) 7.16-7.10 (m, 2H, H-3, Н-5 Ar); 6.97 (bs, 1H, NH); 6.69 (d, J=8.5, 1H, H-6 Ar); 4.49 (s, 2H, O-CH2-CO); 4.02-3.92 (m, 1H, NH-CH2-C



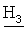



R,S-1N-[(4-хлор-2-метилфенокси)ацетил]амино-2-бутанол (81)
Тпл=78-80°С; Rf=0,88 (СН3ОН); ИК (KBr, см-1) v: 3429, 3326, 2963, 2936, 2917, 2878, 1549, 1245, 803;1H-ЯМР: (ДМСО-d6, 500,13 МГц, δ ppm) 7.13-7.08 (m, 2H, H-3, Н-5 Ar); 7.01 (bs, 1H, NH); 6.6 (d, J=8.5, 1H, H-6 Ar); 4.45 (s, 2H, O-CH2-CO); 3.70-3.54 (m, 2H, NH-C






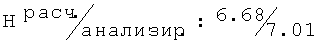
R,S-2N-[(4-хлор-2-метилфенокси)ацетил]амино-1-фенилэтанол (82)
Тпл=111-112°С; Rf=0,90 (СН3ОН); ИК (KBr, см-1) v: 3379, 3288, 3084, 3061, 3027, 2989, 2954, 2925, 2866, 1657, 1548, 1491, 1250;1H-ЯМР: (ДМСО-d6, 500,13 МГц, δ ppm) 7.37-7.10 (m, 7H Ar); 6.9 (bs, 1H, CO-NH); 6.3 (d, J=8.5, 1H, H-6 Ar); 4.88-4.84 (m, 1H, C






R,S-2N-[(2,4,6-триметилфенокси)ацетил]амино-1-фенилэтанол (83)
Тпл=119-120°С; Rf=0,79 (толуол/ацетон (5/1));1H-ЯМР: (500,13 МГц, ДМСО-d6, δ ppm) 7.87 (t, J=5.6, 1H, NH); 7.41-7.30 (m, 4H, H-2(Ar)', H-3(Ar)', H-5(Ar)', H-6(Ar)'); 7.28-7.21 (m, 1H, H-4(Ar)'); 6.81 (s, 2H, H-3(Ar), H-5(Ar)); 5.52 (d, J=4.4, 1H, OH); 4.77-4.72 (m, 1H, CH); 4.12 (s, 2H, O-CH2-C=O); 3.56-3.48 (m, 2H, N-CH2); 3.47-3.41 (m, 1H, NH-C

















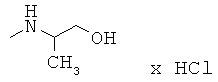

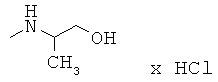

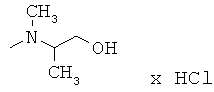

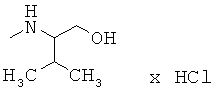




















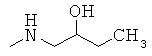







































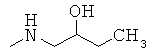











Пример 4. Исследования биологической активности для полученных соединений
Соединения по изобретению подвергали фармакологическим тестам: МЭШ (максимальный электрошок, вызывающий припадки), ScMet (подкожное введение пентилентетразола) и ТОХ (тест на нейротоксичность) на мышах и крысах (внутрибрюшинное (i.р. от intraperitoneal) и пероральное (р.о. от per oral) введение).
Для определения противосудорожной активности проводили скрининговые тесты, используя животные модели припадков. Сначала тесты проводили на мышах (Carworth Farms No. 1), и если результаты подтверждали активность - то потом на крысах (Sprague-Dawley). Тесты основывались на введении животному соединения и после определенного времени вызывании состояния, подобного эпилептическому припадку у человека. Каждое вещество (после растворения в метилцеллюлозе) обычно тестировали при дозах 30, 100 и 300 мг/кг массы тела (м.т.) (мыши) или при 30 и 50 мг/кг м.т. (крысы) при двух возможных способах введения: внутрибрюшинном (i.р.) или пероральном (р.о.). Соответствующие тесты проводили через 0,5 и 4 часа после введения соединения. В случае веществ, обнаруживающих активность при 30 мг/кг м.т. (мыши), тесты также проводили при дозах 10 и 3 мг/кг м.т.
Тест максимального электрошока (МЭШ), вызывающий припадок, представляет собой электрический тест, проверяющий активность к генерализованным тонико-клоническим припадкам (большому эпилептическому припадку) [9]. Согласно литературе большинство активных соединений представляет собой соединения, которые ингибируют потенциалзависимые натриевые каналы [10]. Эта процедура заключается во введении животному упомянутой дозы и через 0,5 или 4 часа присоединении роговичных электродов (после анестизирующих глазных капель: 0,5% тетракаин гидрохлорида в 0,9% NaCl), и включении электрического тока (60 Гц, 0,2 с, 50 мА (мыши) или 150 мА (крысы)). Если тестируемое вещество проявляет противосудорожную активность, то используемый электрический импульс не будет вызывать тонико-клонические припадки у животного. Обычно при дозе 30 мг/кг м.т. испытание проводят на 1 мыши через 0,5 или 4 часа, при дозе 100 мг/кг м.т. - на 3 мышах и при дозе 300 мг/кг - на 1 мыши [11-12].
Тест с подкожным введением метразола (ScMet) представляет собой химический тест, при котором соединения проверяют на активность при абсансных припадках (малый эпилептический припадок). Пентетразол (метразол) рассматривается относительно блокады хлоридного канала в рецепторном комплексе ГАМКА, поэтому при определенной дозе у животных он вызывает резкие мышечные движения, затем - клонические судороги и потом тонические судороги. Процедура заключается во введении исследуемого соединения и через 0,5 или 4 часа подкожном введении пентилентетразола при дозе 85 мг/кг м.т. (мыши) или 70 мг/кг м.т. (крысы) в виде 0,85% раствора в 0,9% NaCl. Исследуемое вещество обнаруживает противосудорожную активность, если доза пентилентетразола не вызывает судорог у животного. Обычно тест осуществляют на одном животном.
Тест на нейротоксичность (ТОХ) осуществляют для того, чтобы исключить вещества, проявляющие нейротоксичность. Его проводят, используя тест вращающегося стержня. Животное помещают на пластиковый стержень (1 дюйм в диаметре), вращающийся со скоростью 6 об/мин. Стержень помещают на уровень, мешающий животному спрыгнуть. Если исследуемое соединение (введенное за 0,5 или 4 часа до испытания) не обнаруживает нейротоксичного эффекта (атаксия, седативный эффект, возбуждение), то животное будет сохранять свое положение на стержне по меньшей мере в течение 1 минуты. Нейротоксичноть подтверждается, если животное не остается на стержне в течение 1 минуты в любом из 3 испытаний [11]. Обычно тест проводят при дозе 30 мг/кг м.т. на 4 мышах (0,5 часа) и на 2 мышах (4 часа), при дозе 100 мг/кг м.т. на 8 мышах (0,5 часа) и 4 мышах (4 часа) и при дозе 300 мг/кг м.т. на 4 мышах (0,5 часа) и 2 мышах (4 часа). Следует отметить, что результаты другого широко используемого теста - chimney test (мышь взбирается на трубу) - совпадают с описанным тестом [13].
Результаты, полученные на мышах
Соединения 1-83 подвергали начальному фармакологическому скринингу. Эти результаты представлены ниже в Таблице 4.
Для большинства активных веществ существуют время достижения максимального эффекта (ТРЕ от time to peak effect), дозы ЭД50 (наименьшая доза, являющаяся эффективной для 50% животных), ТД50 (наименьшая доза, являющаяся нейротоксичной для 50% животных) и индекс защиты (ИЗ) для внутрибрюшинного (i.р.) и перорального (р.о.) введения.
Для некоторых соединений осуществляли как испытание на просудорожную активность (ТТЕ тест), так и тест на активность при фокальных эпилептических припадках (связанных с лимбической системой, испытание при 6 Гц, гиппокампальный киндлинг). Была обнаружена активность при фармакорезистентных припадках (киндлинг ламотриджин-резистентной миндалины, крысы, i.р.). Испытание на ингибирование припадков, вызванных звуком (мыши Frings), проводили для соединений 12 и 26-28. Также осуществляли электрофизиологические тесты в случае припадков, вызванных бикукуллином (БИК), пикротоксином (ПИК) и NMDA (N-метил-D-аспартатом). Отмечено предотвращение (вызванного пилокарпином) эпилептического статуса.
Формалиновый тест показал аналгетическую активность в фазе как невропатической, так и воспалительной боли. Испытания на мутагенную активность (Ames' and Vibrio harveyi) демонстрировали полную безопасность в этом вопросе. Тесты в цитохромах Р450 для предсказания возможных взаимодействий с другими лекарственными средствами показали полную безопасность - неконкурентное ингибирование CYP2D6 (Ки=22,3 мкМ).
В результате выявлено, что соединение 12 является активным в МЭШ для мышей и крыс. Ниже приведены значения ЭД50 и ИЗ для некоторых тестов:
ТРЕТОХ=0,25 ч; ТРЕМЭШ=0,25 ч
ЭД50 (МЭШ, мыши, i.р., 0,25 ч)=5,34 мг/кг м.т.; ИЗ (МЭШ, мыши, i.р.)=5,51
ЭД50 (МЭШ, самки мышей, i.р., 0,25 ч)=22,28 мг/кг м.т.; ИЗ (МЭШ, мыши, i.р.)=1,74
ЭД50 (МЭШ, мыши, р.о., 0,25 ч)=51,19 мг/кг м.т.; ИЗ (МЭШ, мыши, р.о.)=2,82
ЭД50 (МЭШ, крысы, р.о., 0,25 ч)=28,60 мг/кг м.т.; ИЗ (МЭШ, крысы, р.о.)>17,48
ЭД50 (МЭШ, крысы, i.р., 0,25 ч)=7,43 мг/кг м.т.; ИЗ (МЭШ, крысы, i.р.)=6,74
ЭД50 (6 Hz, мыши, i.р., 44 mA, 0,25 ч)=30,02 мг/кг м.т.
ЭД50 (6 Hz, самки мышей, i.р., 44 mA, 0,25 ч)=41,3 мг/кг м.т.
ЭД50 (6 Hz, мыши, i.р., 22 mA, 0,25 ч)=43,81 мг/кг.
ЭД50 (6 Hz, самки мышей, i.р., 22 mA, 0,25 ч)=7,06 мг/кг.
ЭД50 (мыши Frings, 0,25 ч)=5,39 мг/кг м.т.
ЭД50 (киндлинз, крысы, гиппокамп, 0,25 ч)>30 мг/кг м.т.,
ЭД50 (БИК, 0,25 ч)>75 мг/кг м.т.
ЭД50 (ПИК, 0,25 ч)>75 мг/кг м.т.
Соединение 12 блокирует потенциалзависимые натриевые каналы в зависимости от напряжения. В тесте МЭШ оно ингибирует припадки, подавляя постсинаптический возбуждающий ток. При электрическом киндлинге (крысы, гиппокамп) вещество показывает активность через 0,25 часа после введения 60 мг/кг м.т. В метразольном тесте среднее время до первых конвульсий составляло 27,3±0,2 мин для дозы 5 мг/кг м.т. и 27,6 (±0,3) мин для дозы 30 мг/кг м.т. по сравнению с контрольными 30,07 (±1,23) мин. Среднее время от введения до первых мышечных сокращений составляло 33,6 (±1,23) мин для дозы 5 мг/кг м.т. и 32,70 (±1,28) мин для дозы 30 мг/кг м.т. по сравнению с контрольными 34,38 (±0,94) мин. Результаты формалинового теста на Фиг.3 указывают на ингибирование невропатической боли (первая 10 мин. фаза) и воспалительной боли (следующая 30 мин. фаза).
Формалиноый тест также проводили с соединением 26.
Тест проводили с применением формальдегида в качестве вещества, вызывающего боль (невропатическую и воспалительную впоследствии) у мышей, которым вводили формалин в заднюю конечность. В тесте использовали дозу исследуемого вещества эквивалентную ЭД50 (МЭШ, мыши, i.р.), вводили 21,44 мг/кг м.т. мышам, i.р., и через время ТРЕ (МЭШ, мыши, i.р.=0,25 ч) вводили формалин, чтобы измерить время реакции животного на болевой раздражитель (облизывание конечности).
В течение первых 10 минут после введения мышь лижет заднюю конечность (острая фаза), после чего наблюдается короткая пауза в изменении поведения, и затем мышь лижет свою конечность еще 20-30 минут (воспалительная фаза) (Фиг.3 для 12 и Фиг.4 для 26). Острая фаза представляет собой непосредственное влияние на периферический нерв, а воспалительная фаза связана с секрецией медиаторов воспаления из поврежеднных тканей и нервов. С помощью описанной модели проверяют способность вещества ингибировать острые и хронические чрезмерные нейронные разряды в ответ на возбуждение периферических нервов.
Фиг.4 демонстрирует график, на котором изображены рассчитанные результаты среднего (время) для 8 животных в тесте при дозе 21 мг/кг м.т. (что соответствует МЭШ ЭД50 (мыши, i.р.)=21,44 мг/кг м.т.). Как можно заметить, соединение 26 ингибирует острую фазу формалинового теста (приблизительно первые 10 мин после введения формалина) (64% контроля), что означает аналгетическую активность при невропатической боли. Результаты статистически значимы (р<0,01). Уменьшение боли на воспалительной фазе (72% контроля) не является статистически значимым. Для полного объяснения результатов на Фиг.5 представлено сравнение с известными противоэпилептическими препаратами (ПЭП), такими как карбамазепин (КБЗ) и вальпроевая кислота (ВПК), в обычных дозах. Чем меньше % площади под кривой (AUS от area under curve) по сравнению с контролем (метилцеллюлоза, МЦ) и чем короче полоса, тем сильнее анальгетическая активность. Следовательно, можно утверждать, что соединение более эффективно, чем ВПК, в острой фазе и менее активно на воспалительной фазе по сравнению с ВПК и КБЗ.
Сравнение противосудорожной активности в МЭШ у мышей и крыс после внутрибрюшинного i.p. и перорального о.р. введения для изомеров:
R,S, R-(-) и S-(+)-2-[(2,6-диметилфсренокси)этил]амино-1-пропанол
Как можно заметить (Таблица 5), у мышей ЭД50 ниже для R, чем для S энантиомера (5,34 и 8,59 мг/кг м.т., соответственно), с большим индексом защиты (ИЗ) (5,51 и 4,38 мг/кг м.т., соответственно), что указывает на более высокую эффективность и большую безопасность R энантиомера. На крысах (i.p.) R также показывает более высокий ИЗ, чем S (6,74 и 5,51, соответственно). На крысах (р.о.) энантиомер R показывает более выгодную ЭД50 (28,60 и 47,03 мг/кг м.т., соответственно) и более выгодный ИЗ (>17,48 и <10,63, соответственно), чем рацемат. Следовательно, можно утверждать, что среди изомеров R (соединение 12) показывает более полезные фармакологические свойства, чем S (13) и R,S (11).
Все результаты представлены после ТРЕ=0,25 ч (как в МЭШ). Используемые для вычисления ИЗ ТД50 получали из теста вращающегося стержня (ТОХ) на нейротоксичность.
Сравнение активности энантиомеров R-(-)- и S-(+)-[(2-хлор-6-метилфенокси)этил]амино-1-бутанола (соединения 27 и 28, соответственно).
Острая токсичность - минимальная доза вещества (i.р.), вызывающая острую двигательную недостаточность; в исследовании использовали по меньшей мере 12 крыс, за которыми наблюдали в течение 4 часов после введения (График 1, Фиг.6).
Предотвращение эпилептического статуса - животному (самцу белой крысы Sprague Dawley) дают дозу тестируемого соединения. Через 0, 0,25, 0,5, 1, 2 и 4 часа вводят пилокарпин. Вызванные припадки описаны с помощью шкалы Расина. Соединения 27 и 28 были введены i.p. в дозах 25 и 45 мг/кг м.т., соответственно. Они оба проявляют защитное действие в 2 и 3 крысах из 8. Результаты представлены ниже. Средняя потеря массы тела измерена через 24 часа после введения.
Предотвращение эпилептического статуса соединениями 27 и 28.
Как можно заметить (Таблица 6), дозы необходимые для активности в данном тесте различаются для обоих энантиомеров - R оказался более выгодным. Однако в случае припадков при электрическом гиппокампальном киндлинге у крыс, i.p., S оказался более активным. Следовательно, можно сделать вывод, что энантиомер R более эффективен при предотвращении эпилептического статуса, а S - при предотвращении лимбических фокальных эпилептических припадков.
Ниже приведены результаты для соединений 26 и 28.
26 ТРЕТОХ=0,25 ч; ТРЕМЭШ=0,25 ч,
26 ЭД50 (МЭШ, мыши, i.p., 0,25 ч)=21,44 мг/кг м.т.; ИЗ (МЭШ, мыши, i.р.)=2,56,
26 ЭД50 (МЭШ, крысы, р.о., 0,25 ч)=67,69 мг/кг м.т.; ИЗ (МЭШ, крысы, р.о.)>3,55,
26 ЭД50 (МЭШ, крысы, i.p., 0,25 ч)=7,3 мг/кг м.т.; ИЗ (МЭШ, крысы, i.p.)=4,5,
26 ТРЕ (6 Гц, мыши, i.p., 32 мА)=0,5 ч,
28 ЭД50 (киндлинг, крысы, гиппокамп, 0,25 ч)=15,81 мг/кг м.т.,
26 (припадки при ЛТГ-резистентной миндалине) t=0,25 ч; эффективная доза=15 мг/кг м.т.,
26 ЭД50 (вызванные звуком припадки, мыши, 0,25 ч)=6,05 мг/кг м.т.,
26 ЭД50 (ПИК, 0,25 ч)>70 мг/кг м.т.,
26 ЭД50 (БИК, 0,25 ч)>70 мг/кг м.т.,
26 ингибирование невропатической боли (формалиновый тест, 21 мг/кг м.т.)=36%.
Ниже приведены фармакологические данные для оптимального энантиомера R-(+)-2-[(2,6-диметилфенокси)ацетил]амино-1-пропанола (соединение 68):

ЭД50 (МЭШ, мыши, i.p.)=97,93 мг/кг м.т.
ИЗ (МЭШ, мыши, i.p.)=1,43.
Ссылки
1. Fischer W.: Anticonvulsant profile and mechanism of action of propranolol and its two enantiomers. Seizure 11: 285-302 (2002).
2. Alexander G. J., Kopeloff L. M., Alexander R. В., Chatterjie N.: Mexiletine: biphasic action on convulsive seizures in rodents. Neurobehav. Toxicol. Teratol. 8: 231-235 (1986).
3. Chew С.Y. С., Collett J., Singh В. N.: Mexiletine: A Review of its Pharmacological Properties and Therapeutic Efficacy in Arrhythmias. Drugs 17: 161-181 (1979).
4. Orlof M.J., Williams H.L., Pfeiffer С.С.: Timed intervenous infusion of metrazol and strychnine for testing anticonvulsant drugs. Proc. Soc. Exp. Biol. Med. 70: 254-257 (1949).
5. Marona H., Antkiewicz-Michaluk L.: Synthesis and anticonvulsant activity of 1,2-aminoalkanol derivatives. Acta Pol. Pharm. - Drug Res. 55: 487-498 (1998).
6. Waszkielewicz A.M., Cegta M., Marona H.: Preliminary evaluation of anticonvulsant activity of some [4-(benzyloxy)-benzoyl]- and [4-(benzyloxy)-benzyl]-aminoalkanol derivatives. Acta Pol. Pharm. - Drug Res. 64, 147-157 (2007).
7. Pekala E., Gajewczyk L., Marona H.: Synthesis of New N-acyl Derivatives of DL-trans-1,2-Aminocyclohexanol. Acta Pol. Pharm. - Drug Res. 51: 339-342 (1994).
8. Marona H., Pekala E.: Synthesis of Some N-acyl Derivatives of Optically Active trans-2-Amino-l-cyclohexanols. Acta Pol. Pharm. - Drug Res. 53: 111-115 (1996).
9. Swinyard E.A., Woodhead J.H., White, H.S., Franklin M.R.: General principles: experimental selection, quantification, and evaluation of anticonvulsants. Antiepileptic Drugs, Str. 85-102, Wyd. 3. Raven Press, Nowy Jork 1989.
10. Rogawski M.A., Porter R.J.: Antiepileptic Drugs: Pharmacological Mechanisms and Clinical Efficacy with Consideration of Promising Developmental Stage Compounds. Pharmacol. Rev. 42: 223-286 (1990).
11. Stables J. P., Kupferberg H. J.: The NIH Anticonvulsant Drug Development (ADD) Program: preclinical anticonvulsant screening project. Chapter 16. http://www.ninds.nih.gov/funding/research/asp/addadd_review.pdf
12. Kupferberg H.: Animal Models Used in the Screening of Antiepileptic Drugs. Epilepsia 42:7-12 (2001).
13. Czuczwar S.J., Borowicz K.K., Kleinrok Z, Tutka P., Żarnowski Т., Turski W.A.: Influence of Combined Treatment with NMDA and Non-NMDA Receptor Antagonists on Electroconvulsions in Mice. Eur. J. Pharmacol. 281: 327-333 (1995).
Реферат
Изобретение относится к новым производным аминоалканолов, которые могут быть использованы для изготовления лекарства, которое применяется при профилактике, предотвращении и/или лечении заболеваний или симптомов неврологического происхождения, в частности эпилепсии. При этом соединения выбраны из R,S-2N-[(2-хлор-6-метилфенокси)этил]амино-1-бутанола, R,S-2N-[(2-хлор-6-метилфенокси)этил]амино-1-бутанол гидрохлорида, R-(-)-2N-[(2-хлор-6-метилфенокси)этил]амино-1-бутанола, R-(-)-2N-[(2-хлор-6-метилфенокси)этил]амино-1-бутанол гидрохлорида, S-(+)-2N-[(2-хлор-6-метилфенокси)этил]амино-1-бутанола, R,S-2N-[(2,6-диметилфенокси)ацетил]амино-1-пропанола, R-(+)-2N-[(2,6-диметилфенокси)ацетил]амино-1-пропанола, S-(-)-2N-[(2,6-диметилфенокси)ацетил]амино-1-пропанола, R,S-1N-[(2-хлор-6-метилфенокси)ацетил]амино-2-бутанола. Изобретение также относится к способу получения указанных соединений. 4 н. и 3 з.п. ф-лы, 6 ил., 6 табл., 4 пр.
Формула
R,S-2N-[(2-хлор-6-метилфенокси)этил]амино-1-бутанол (26)
R,S-2N-[(2-хлор-6-метилфенокси)этил]амино-1-бутанол гидрохлорид (26а)
R-(-)-2N-[(2-хлор-6-метилфенокси)этил]амино-1-бутанол (27)
R-(-)-2N-[(2-хлор-6-метилфенокси)этил]амино-1-бутанол гидрохлорид (27а)
S-(+)-2N-[(2-хлор-6-метилфенокси)этил]амино-1-бутанол (28)
R,S-2N-[(2,6-диметилфенокси)ацетил]амино-1-пропанол (60)
R-(+)-2N-[(2,6-диметилфенокси)ацетил]амино-1-пропанол (61)
S-(-)-2N-[(2,6-диметилфенокси)ацетил]амино-1-пропанол (62)
R,S-1N-[(2-хлор-6-метилфенокси)ацетил]амино-2-бутанол (72).

Комментарии