где Р и R- см.
выше, с соответственно
выбранным стабилизированным
анионном или илидом формулы VI:
РГ СН -(CH2)R, (VI), где R, и п
см, Bbraie, Р, - триарилфосфин или три- алкилфосфин, или диалкилфосфинат, в
апротонном растворителе при 10-60°С. Полученную смесь делят на индивидуальные
соединения формул I, Л, III и выделяют их в свободном виде, или в виде фйрмацевтически приемлемой
соли, или сложного эфира. При необходимости вьщеленные соединения, где R, - С(О)ОН, этерифицйруют с
Изобретение относится к способу получения новых биологически активных
химических соединений, а именно (4,2,0)бициклооктановых Производных или их фармацевтически приемлемых
нетоксичных солей или фармацевтически приемлемых нетоксичных сложных эфиров, обладающих антигипертензив-
ной активностью; указанное свойство предполагает возможность использования
этих соединений в медицине при лечении сердечнососудистых заболеваний , таких как тромбоз, гипертония
и атеросклероз.
Цель изобретения - получение новых
производных ряда (4,2,0)бицикло октана, обладающих новым видом активности в данном ряду соединений.
Приготовление 1.
Получение спиро бицикло(4,2,0)-
окт-2-ен-7,2 -(1,3)диоксолана и роственных соединений.
Смесь 6,4 г бицикло(4,2,0)окт-2- ен-7-она, 18,62 г этиленгликоля, 100 мл бензола и 25 мг п-тоуолсуль-
фокислоты кипятят с обратным холодильником 4ч, используя ловушку Дина-Старка...для непрерывного удаления
воды. Охлажденную реакционную смесь выливают в 100 мл насыщенного
раствора бикарбоната натрия, полученную смесь экстрагируют тремя порциями по 75 мл диэтилового эфира.
Объединенный органический экстракт промывают 100 мл насыщенного раст--
вора хлористого натрия, а затем су- щат над сульфатом натрия. Растворитель удаляют в вакууме, а остаток
перегоняют в вакууме, получают 7,12 г спиро бицикло(4,2,0)окт-2-ен 7,2-(1,3)диоксолана.
Приготовление 2.
Получение (IS-, 28--, 4R, 7S)-
спиро З-оксатрицикло(5,2,0, )нополучением R, - C(0)OR, или превращают
в соль, или соль превращают в кислоту, или в сложный эфир, или в
другую соль или сложный эфир превращают в кислоту, или Ъ соль, или в
другой сложньы эфир. Некоторые новые соединения проявляют антигипертензив-
ную активность в дозе 16-100 мкг/кг
(крысы) и 4-13 (кошки) при низкой токсичности
. 3 табл.
5
нан-8,2 -(1,3)диоксолана, (IS,
2R, 4S, 78)-спиро 3-оксатрицикло (5,2,0,)нонан-8,2 -(1,3)диоксола- наТ и родственных соединений.
К перемешиваемому раствору 5 г спиро бицикло(4,2,0)окт-2-ен-7,2 -
(1,3)диоксолана, полученного в приготовлении 1, в 40 ш ацетона и 20 мл
воды при прибавляют 4,76 г 11- бромацетамида в течение 1 ч. Эту
смесь перемешивают при комнатной температуре в течение 20 ч. К этому раствору
прибавляют 12,4 г карбоната натрия и полученную в результате
смесь перемешивают при комнатной температуре 3 дня. Смесь насьпцают хлористым
натрием и полученную в результате смесь экстрагируют четыре раза порциями по 150 мл этилового эфира.
5 Объединенный органический экстракт промьшают 100 мл насыщенного раствора
хлористого натрия и сушат над сульфатом натрия. Удаление растворителя в вакууме и хроматографическая
0 очистка остатка на силикагеле при
элюировании смесью этилацетата и гек-
сана приводит к 3,45 г смеси примерно 4:1 (IS, 23, 4R, 73)-спиро З-
оксатрицикло(5,2,0,0 - )нонан-8 ,2 5 (1,3)диоксолана и (IS, 2R, 4S,
7S ) -спиро СЗ-оксатрицикло (5,2,0, ) нонан-8,, 3j диоксолан. Приготовление 3.
Получение З-ОН-1-алкинов.
Q Пропускают быстрой ток ацетилена
через раствор 2М метилмагнийбромида (100 мп) в ТГФ до тех пор, пока не
прекратится выделение метана. Прибавляют 10 г гексаналя при , перемес
шивают 0,5 ч и прибавляют насыщенный раствор хлористого аммония. Органический
продукт выделяют экстракцией эфиром. Эфирный раствор промьшают водой, рассолом, сушат над сульфатом
5
магния и выпаривают, получают жидкость
, которую очищают перегонкой, получают З-оксиокт-1-ин.
Подобным образом получают другие типичные соединения.
Приготовление 4.
Получение 1-циклогексил-2-прапин 1-она и родственных соединений.
A.Готовят раствор хромовой кислоты при растворении 106,88 г трех- окиси хрома в 400 мл воды, а затем
прибавляют 92 мл концентрированной серной кислоты. Этот раствор прибавляют
по каплям в течение 3 ч к охлаждаемому льдом и перемешиваемому раствору 120 г 3-циклогексш1-1-про-
пан-3-ола в 175 мл ацетона. Полу .ченную в результате смесь разбавля-
|ЮТ 500 мл воды и экстрагируют продукт 1 л диэтилового эфира. Эфирный
экстракт промьшают 25 мл насьщенног раствора бисульфита натрия, сушат
над сульфатом натрия. Удаляют диэти ловый эфир перегонкой в атмосфере
азота и полученный в результате остаток очищают перегонкой Кугельрора ,(, 0,1 мм рт. ст.), получают
84,9 г 1-циклогексил-2-пропин-1-она в виде масла: MS м/Z 136 (М). Вычислено, %: С 79,37; Н 8,88.
Найдено, %: С 79,24; Н 8,6.
B.По подобной методике, но заменив
З-циклогексил-1-пропин-З-ол на
1 -октил-3-ол 5 получают 1-октин-З-он
C.Подобным образом, но исходя и других соответствующих соединений,
полученных в соответствии с приготолением 3, получают другие типичные соединения.
Приготовление 5.
Получение (5)-3-циклогексил-1-про
пин-3-ола и родственных соединений. , А. Смесь 1,6 л 0,5 М 9-борабицик-
ло(3,3,1)нонана в тетрагидрофуране и 122,6 г (((.-ттена кипятят с об-
;ратным холодильником в атмосфере азо- та в течение 4 ч, за это время избыток
(-)-сб-пипена удаляют в вакууме остается густое масло. Содержимое
колбы охлаждают до 0°С и прибавляют при перемешивании 80 г 1-циклогексил
2-пропин-1-она, полученного согласно приготовлению 4. Полученной смеси
дают нагреться до 23°С и все перемешивают при этой температуре,16 ч.
Разрушают избыток S-альпинборана, добавляя 44 мл пропионового альдеги
10
5
0
01
5
0
5
0
5
5
-JJ
да, и перемешивают при 23 С в течение
1 ч. Вьщелившийся (-)-(|/-пипен удаляют перегонкой в вакууме. Полученную
в результате смесь разбавляют 400 мл тетрагидрофурана, затем 300 мл ЗН
гидроксида натрия. К этой перемешиваемой смеси прибавляют по каплям 300 m 30%-ного пероксида водорода в
течение 1 ч. Смесь нагревают при 40°С в течение 3 ч. После охлаждения смесь
экстрагируют диэтиловым эфиром и этот экстракт сушат над сульфатом магния.
Выпаривание растворителя и очистка остатка флаш-хроматографией на сили-
кагеле с использованием 5%-ного этил- ацетата-гексана дает 56 г (S)3-циклогексил-
Т-пропин-З-ол, который по данным Ж1Р-анализа показывает 90% е.е.
Перекристаллизация из гексана дает 45 г чистого S-изомера, температура плавления 56-58 С (об) -11,1
(С 0,53; ).
B.Подобным образом, но заменив
-циклогексил-2-пропин-1-он на 1-октин-З-он , полученный, как описано в
приготовлении 4.В. получают (S)-1- октин-3-ол, («)д -39,7 С (С 1, QHClj).
C.Подо.бным образом, но используя другие подходящие соединения, полученные
согласно приготовлению 4.С, . получают другие типичные соединения.
Приготовление 6.
Получение (S)-3-циклогексил-1-
пропин-3-ола и родственных соединений .
А. Смесь 50 г рацемического 3-циклогексил- 1-пропин-З-ола, полученного
согласно приготовлению 3, 53,3 г фта- левого ангидрида и 100 мл пиридина
нагревают при 90 С в течение 4 ч. После охлаждения до эту смесь прибавляют при перемешивании к смеси
350 мл концентрированной соляной кислоты и 900 мл льда. Отделившийся маслянистый
твердый продукт растворяют в 600 мл диэтилового эфира. Этот раствор промывают насыщенным раствором
хлористого натрия и сушат над сульфатом натрия. После выпаривания и
перекристаллизации из смеси ацетона и гексана получают гемифталат, т.пл. .
136-138 С. Суспендируют 38,5 г этого гемн-фталата в 80 мл дихлорметана и
(Прибавляют при перемешивании раствор 16,2 г (-)-о -фенилэтш1амина в 250 мл
дихлорметана в течение 15 мин. Через 1 ч смесь фильтруют и выпаривают фильтрат , получают смесь диастереоизо- мерных солей, .Эту смесь пять раз пе- рекристаллизовывают из ацетонитрила,
получают 7 г чистой диастереоизо- мерной соли, т.пл. 142-143 С, ( -Зб, (С 1, CHCl). Прибавляют
2 г этой соли к перемешиваемой смеси 25 мл 5%-ного бикарбоната натрия и 25 мл диэтилового эфира.. Эфирньй
слой отбрасывают, а водный слой экстрагируют тремя дополнительными порциями диэтилового эфира. Водный
слой подкисляют 4Н НС1 и тщательно экстрагируют диэтиловым эфиром. Эфир
ный экстракт сушат над сульфатом натрия и выпаривают досуха, получают 1,37 г ()-3-циклогексилпроп-1-ин-3-
ола. т.пл. 70-74 с, (uJ) -35,8 (С 1, CHClj).
В. Подобным образом, но исходя из других соединений, полученных согласно
приготовлению 4.В, получают другие родственные соединения.
Приготовление 7.
Получение З-третичнобутилдиметил- силилоксиокт-1-ина и родственных
простых силиловых эфиров.
А. К раствору 2,7б г (0,02 моль)
(8)-3-циклогексил-1-пропин-3-ола (полученного согласно приготовлению 5.А) в 10 МП Н,Ы-диметилформамида
(ДМФ), охлаяоденному до 0°С, прибавляют 2,1 г имидазола, затем 3,1 г
(0,02 моль) третичнобутилдиметилхлор силана. Смесь перемешивают 3 ч. Прибавляют
80 ид воды и 80 мл гексана, отделяют органический слой и объединяют с 2x80 мл. экстрактами водного
слоя гексаном. Растворитель отгоняют в вакууме, сушат над сульфатом натрия
, получают 4,3 г сырого остатка, который хроматографируют на 80 г си-
ликагеля, элюируют смесью этилацета- та и гексана (2:1 по объему), получают
3-третичнобутилдиметилсилилок- си-3-циклогексилпроп-1 -ин.
B.Подобным образом, но заменив З-циклогексил-1-пропин-З-ол на (S)-
1-октин-З-ол, полученньй согласно приготовлению 5.В, получают (8)-3-тре тичнобутилдиметилсилилоксиокт-1-ИИ
.
C.Подобным образом, но исходя из других подходящих соединений, полученных
согласно приготовлению 5.С ил 6.В, получают другие типичные соединения .
Приготовление 8. Получение (З З, 1R, 2S, 3R, 6S)-
спиро 2-(3 -трет.бутилдиметилсилил- окси-3 -циклогексилпрои-1 -инил)-3-
оксибицикло)-(4,2,0)октан-7,2-(1,3) диоксолана, (3 S, IS, 2R, 3S, 6R)-
спиро 2-(3 -трет.бутилдиметилсилил- окси-3 -циклогексилпроп- -инил)-3-
оксибицикло(4,2,0)октан-7,2-(1,3- |диоксолана и родственных соединений
A.К смеси 21 г (8)-3-трет.бутил- диметилсилилокси-3-циклогексил-1-
пропина, полученного согласно приготовлению 7, в 100 мл тетрагидрофу-
рана при 0°С в атмосфере аргона прибавляют в течение 20 мин 60 мл 1,26
н-бутиллития в гексане. Полученный, в результате раствор охлаждают до
и прибавляют раствор 5.5 г спиро ГЗ-оксатрицикло (5,2,0, ) нонан 8,2-(1,3)-диoкcoлaнaJ в 25 мл тет-
рагидрофурана. К зтой перемешиваемой смеси прибавляют при -78°С 2,5 мл
эфирата трехфтористого бора по капля в течение 25 мин. К этой смеси прибавляют
25 мл насьщенного раствора сульфата натрия. Полученную смесь нагревают до комнатной температуры
и тщательно экстрагируют этилацетатом . Этот раствор сушат над сульфатом
натрия и концентрируют в вакууме получают маслянистьй остаток. Отгоняют-
летучие в устройства для перегонки Кульгерора при 95°С (0,1 MMpTiCT)
остается 9,28 г остатка, который затем очищают флаш-хроматографией на
силикагеле, используя 1,8%-ный аце- тон-дихлорметан. Эта процедура дает
5,87 г смеси целевых продуктов в виде масла.
B.Подобным образом, но заменив
3-трет.бутш1диметилсилилокси-3-цикло гексил-1-пропин на другие соответствующие
соединения, полученные, как описано в приготовлениях 5 и 6, получают другие смеси типичных соединений
.
C.Подобным образом, но исходя из других соответствующих соединений,
получают другие типичные смеси соединений .
Приготовление 9.
Получение (3 S, 1R, 2S, 3R, 6S)- спиро- 2-(3 -трет.бутилдиметилсилил-
окси-3 -циклогексилпроп-1 -инил)-3- оксибицикло(4,2,0)-октан-7,2-(1,3)-
диоксолана и (3 S, IS, 2R, 3S. 6R)сииро- 2-(3 -трет.бутилдиметилсилнл-
окси-З -циклогексилпроп-Г -иннл)-3- оксибицикло(4,2,0)октан-7,2-(1,3)-
диoкcoлaнaJ и родственных соединениГт
А. К смеси 500 мг диастереоизо-
мерной смеси указанных вьпле целепых соединений, полученной, как описано
в приготовлении 8, в 15 м.п диэтило- вого эфира прибавляют 472 -мг дико-
бальтоктакарбонила. Полученный в результате раствор перемешивают 1 ч при
23 С. Смесь разбавляют 20 мл диэтило- вого эфира и полученный в результате раствор фильтруют через 10 г си-
ликагеля. Фильтрат концентрируют до масла, которое очищают флаш-хромато-
графией, используя 13%-ный этилаце- тат-гексан, получают два компонента:
А (высокое Rr) и В (низкое Rr). Ра- створяют 350 мг компонента А в 20 мл
смеси ацетон - вода (9:1), куда прибавляют 1,34 г церийаммонийнитрата. Через 2 мин эту смесь разбавляют
50 мл воды. Продукт выделяют экстрак- цией диэтиловым эфиром. После сушки ,
и выпаривания получают 182 мг (3 S, 1R, 2s, 3R, 68)-спиро- 2-(3 -трет.
бутилдиметилсилилокси-3 -циклогексил- проп-1 -инил)-3-оксибицикло(4,2,0)-
октан-7,2-(1,3)диоксолана в виде масла: CIMS м/Z 452 (M+NHp.
Вычислено, %: С 69,08; Н 9,74.
С Н SiO
Найдено, %: С 69,22; Н 9,97.
Подобным образом компонент В превращают
в (З З, IS, 2R, 38, 6К)-спиро- Г2-(3 -трет.бутилдиметилсилилокси-3 -
1Д1клогексилпроп-1 -инил)-3-оксибицик- ло(4,2,0)октан-7,2 -(1 ,,3)диоксолан
в виде масла: C1MS м/Z 452 (М NH )
Вычислено, %: С 69,08; Н 9,74.
С,, Н 8104
Найдено, %: С 69,22; Н 9,97.
В. Подобным образом, но исходя из других диастереоизомерных смесей, получают
другие индивидуальные энантио- меры.
Приготовление 10.
Получение (38, 1R, 2S, 3R, 6S)- спиро ,2- (З -трет, бутилдиметилсилилокси-3
-циклогексилпроп-1 -инил)-3- оксибицикло(4,2,0)октан-7,2-(1 ,3) диоксолана, (З R, 18, 2R, 3S, 6R)-
спирор-(3 -трет.бутилдпметилсилил- окси-З -циКлогексилпроп- -инил)-3-
оксибицикло(4,2,0)октан-7,2 -(1,3)- диоксолана и родственных индивидуальных энантиомеров.
г
Ю 15
20 25 30
5
0
,
А. Смесь 2,25 f (3 S, IR 2S,
3R, б5)-спиро 2(3 -трет.бутилци- .. /,
мeгилcиJП.IIOкcи-J -циклогексилпроп-1 иннл )-3-окспбицикл(1 (4,2 ,0)октан-7,2 -
(1 ,3) диоксоланл , 20 rt-i этшгдиизо- пропиллмина, 0,76 г димет1-1ллмино11и-
ридина и 3,65 г (Р)-(-)-1-нлЛтплэтил- изоцианата перемешивают при 45°С 8 ч.
Этилдиизопропиламин отгоняют в вакууме и растворяют остаток в 100 мл
этилацетата. Этот раствор пpo ШIвaют дважды 25 мл н. соляной кислоты и 25 мл воды. После над сульфатом
натрия отгоняют растворитель, полут гают остаток, которьй затем очищают флаш-хроматографией на силика-
геле с использованием смеси этилаце- тат - дихлорметан - гексан (7,5:22,,5.:
:70). Получают в порядке элюирования:
1.31г (3 S, 1R, 28, 68)-спиро 2-
(3 -трет.бутилдиметилсилилокси-3 - циклогексилпроп-1 -инил)-3-0- (R)-1-
нaфтилэтилкapбaмoилJбициклo(4,2,0)- октан-7,2 -(, 3)диоксолан 7 , т.пл.
57-59 С,, (ci) -25,4 (С 1 , CHCl );
1.32г (3lR, 1R, 28, 3R, 6R)-cпи-
ро Г2-(3 -трет. бутилдиметилси,1пшокси- 3 -циклогексилпроп-1 -ини.гО-З-О-(R)-
1-нaфтилэтилкapбaмoилJ бицикло(4,2,0)- октан-7,2 - (1 , 3)диоксолан), т.пл.
107-109 С, U)j 25,4. Подобным обраГ Ом получают соединения -исходя
из (3 8А, 18, 2R, 38, 6R)-cniipo- f2-(3 -трет.бутилдиметилсилилокси-З -
циклогексилпроп-1 -ипил)-3-(R)-1- нафтилзтилкарбамоил бицпк.по (4,2,0) октан-7,2 -(1,3)диоксолана ;
(3 R, 18, 2R, 38, 6R)-cnnpo 2-(3- трет.бутилдиметилсилилокси-3 -циклогексилпроп-1
-инил)-3 (R)-1-нафтил- этилкарбамоил бицикло(4,2,0)октан- 7,2-(1 ,3)диоксолан , т.пл. 81-83 С,
U)j +25 (С 1, СНСЦ);
(3 s, 18, 2R, 38, 6R)-cHHpo 2-(3-
трет.бутилдиметилсилилокси-З -циклогексилпроп-1 -инил )-3-0- (R)-3-0-(R)-
1-нафтилэтилкарбамоил бипик.ио (4 ,2,0) октан-7 .2 -( 1 , 3)диoкcoлaI J , т. пл.
139-14ГС, (oi) -28,.
К перемеигиваеной смеси 0,3 г .гги-
тийалюминийгидрида в 50 мл тетраг ид- рофурана при прибавляют раствор
1,25 г (38, 1R, 28, 3R, 68)-спиро 2-(3 -трет. бутилдимстилси.чм. кжси-З -
циклогексилпроп-Г -и;нил)-3-0 t( нафтилэтилкарбамоил бидикло (4,2 ,0)-
октан-7,2 -(1,3)диоксолана и 10 мл тетрагидрофурана. Эту смесь гсипятят
с обратным холодильником 1 ч. После охлаждения до 23°С смесь обрабатывают
, последовательно прибавляя по каплям 0,5 мл воды, 0,5 мл 15%-ного раствора гидроксида натрия и 1,5 мл
воды. Полученньш твердьа продукт отделяют фильтрованием и выпаривают фильтрат в вакууме. Остаток растворяют
в 100 мл этилацетат н этот раст вор промыва ют двумя порциями по 20 МП воды, а затем сушат над сульфатом
натрия. После выпаривания получают остаток, который очищают флаш- хроматографией на силикагеле, исполь
зуя этилацетат - гексан (15:85), получают (3 S, 1R, 2S, 3R, бЗ)-спиро 2-
(3 -трет.бутилдиметилсилилокси-3 - циклогексилпроп-1-ишш)-3-оксибицик-
ло(4,2,0)октан-7,2 -(1,3)диоксолан , W)5f .+7,95° (С 0,3, CHClj).
B.Подобным образом получают: (3 R, IS, 2R, 3S, 6R)-cnnpo 2-(3
трет.бутилдиметилсилш1коси-3 -цикло- гексилипроп- l -инил)-3-оксибицикло
(4,2 ,0)октан-7,2-(1,3)диоксолан1, (Щ о (с 0,3, CHCl). (3 R, 1R, 2S, 3R, 63)-спиро 2-(3
трет.бутилдиметилсилилокси-3 -цикло- гексилпроп-1 -инил)-3-оксибицикло
(4,2,0)октан-7,2-(1 ,3)диоксолан 1, (dj)j +56,6 (С 0,4, CHClj).
(3 s, 1S, 2R, 3S, бК)-спироС2-(3- трет.бутилдиметилсилилокси-З -цикло-
гексилпроп-1 -инил)-3 -оксибицикло- (4,2,0)октан-7,2-(1,3)диоксолан, («i)f - 54,0.(С 0,5, CHClj).
C.Подобным образом получают и другие типичные индивидуальные соединения .
Приготовление 11.
/ Получение (З з, 1R, 2S, 3R, 6S)-
2-(3 -окси-3 -циклогексилпроп-1 - инил)-3-оксибицикло(4,2,0)октан-7- она и родственных соединений.
А. Раствор 182 мг (3 S, 1R, 2S, 3R, 6S)-циклогексилпропинилацеталя,
полученного в приготовлении 9.А или 10.А, 1 мл ацетонитрила, 0,2 мл воды
и 0,2 мл 2 н. серной кислоты перемешивают ,16ч при комнатной температуре
. Реакцию закаливают нейтрализацией водным раствором бикарбоната натрия и экстрагируют смесь диэтило-
вым эфиром. Экстракты сушат над сульфатом магния, выпаривают досуха и остаток очищают хроматографией на
короткой колонке с силикагелем, Элю- .ируют смесью этилацетата и гексана
(7:3), получают 94 мг (3 S, 1R, 2S, 3R, 6S)-2-(3 -окси-3 -циклогексилпроп-1
-инил)-3-оксибицикло(4,2,0)- октан-7-она, т.пл. 93-98 с.
В. Подобным образом, но исходя из других соответствующих соединений,
получают другие типичные соединения.
Пример 1. Получение (Z)-
(3 S, 1S, 2S, 3R, б8)(3 -окси- 3 -диклогексилпроп-1 -инил)-3-окси- бицикло(4,2,0)окт-7-илиден бутановой
кислоты и (Е)-(З В, IS, 2S, 3R, 6S)- (З -окси-3 -циклогексилпроп-1 - инил)-3-оксибицикло(4,2,0)окт-7-
илиден бутановой кислоты и родственных соединений формул (I), (II) и (III), в которых R является .
А. Готовят раствор димсила натрия для хранения путем растворения
1,56 г гидрида натрия в 65 мл диме- тилсульфоксида при в атмосфере
азота. К перемешиваемой пасте 2,06 г 3-карбоксипропнлтрифенилфосфонийбро-
мида в 10 мл диметипсульфоксида в атмосфере азота прибавляют 9,4 мл
хранящегося раствора димсила натрия. После 20 мин при 23°С прибавляют
одной порцией раствор 260 мг (З З, 1R, 28, 3R, 68)-2-(з -окси-3 -циклогексилпроп-1
-инил)-3-оксибицикло- (4,2,0)-октан-7-она в 1 мп диметил- сульфоксида. После 4 ч при смесь
выпивают в 15 мл 5%-го раствора карбоната натрия. Эту смесь промывают
двумя порциями по 30 мл этилацетата и затем подкисляют концентрованноц
НС1. Водньй слой экстрагируют три раза порциями по 50 мл диэтилового
эфира. ОбъединенньпЧ экстракт концентрируют до 20 МП и хранят остаток при
в течение 2 ч. Отфильтровывают образовавшийся осадок и отбрасьшают его. Вьшаривание фильтрата дает
430 мг масла. Этот материал очищают флаш-хронатографией на силикагеле,
используя смесь уксусной кислоты - этилацетата - гексана (0,25:75:25),
получают 337 мг масла. Дальнейшей очисткой флаш-хроматографией на силикагеле
с использованием смеси растворителей уксусная кислота - метанол дихлорметан (0,2:5,3:94,5) разделяют
смесь продуктов на индивидуальные со соединения формул (II) и (I) соответственно .
Первой элюируется (E)-(3 s, IS, 28, 3R, 68)(3 -окси-3 -циклогексилпроп-1
-инил)-3-оксибицикло (4,2,0)окт-7-илиден бутановая кислота
, 138 мг, Ю +113 (С 0,5, CHCl).
Вычислено, %: С 72,80; Н 8,73.
Найдено, %: С 72,58; Н 8,44.
Второй элюируется (Z)-(3 s, IS,
2S, 3R, 68).-(3 -окси-3 -цикло- гексилпроп-1 -инил)-3-оксибицикло- (4,2,0)окт-7-илиден бутановая кис-
лота, 138 мг, ((г)д +103 (С 0,4 CHClj).
Вычислено, %: С 72,80; Н 8,73.
Найдено, %: С 73,00; Н 8,51.
B.Подобным образом, но заменив
(З З, 1R, 2S, 3R, 65)-2-(3 -окси-3 - циклогексилпроп-1 -инил)-3-оксиби-
цикло(4,2,0)октан-7-он другими подходящими соединениями, полученными,
как описано в приготовлении 11.А, получают следующие соединения формул (I), (II) и разделяют .их:
(Z)-(3 S, IS, 2S, 3R, 6S) (3--оксиокт-Т -инил)-3-оксибицикло-
(4,2,0)окт-7-илиден бутановую кис- лоту, (и) +114t(CHClj); MS м/Z 352 ( NHp.
Вычислено, %: С 71,82; Н 9,04.
Найдено, %: С 71,94; Н 8,97.
(E)-(3 S, IS, 2S, 3R, 6S) (3 -оксиокт-1 -инил)-3-оксибицикло- (4,2,0)окт-7-илиден бутановую кислоту
, (ii)A +01,2° (CHClJ; MS м/2 352 (М NHj.
Вычислено, %: С 71,80; Н 9,04.
Найдено, %: С 71,81; Н 8,83.
C.Подобным образом получают следующие
типичные соединения формул (I) и (II):
(Z)-(3 S, IS, 28, 3R, 6S)-
(3 -оксигексилпроп-1 -инил)-3- оксибицикло (4,2,0) окт-7-илиден| новую кислоты, MS M/Z 364 (M-f-NH
Вычислено, %: С 72,80; Н 8,73.
Найдено, %: С 72,52; Н 8,72;
(Z)-(3 S, IS, 2S, 3R, 6S) (3 -циклогексилпроп-1 -инил)-3-окси- бицикло(4,2,0)окт-7-илиден пентанову
кислоту, (о;)д +113°(СНС1), MS м/Z 378 (M + ).
Вычислено, %: С 73,30; Н 8,96.
Найдено, %: С 72,43; Н 8,86;
(Z)-(3 S, 1S, 28, 3R, 68)- 5-Г2-(3 -окси-3 -циклогексилпроп-1 - инил)-3-оксибицикло(4,2,0)окт-7-или-
ден пентановую кислоту, MS м/Z 378 (M+NHp.
Вычислено, %: 73,30; Н 8,95.
Найдено, %: С 73,87; Н 9,00;
(E)-(3 S, IS, 2S, 3R, 6S)
(3 -окси-З -циклогексилпроп-1 -инил)- 3-оксибицикло(4,2,0)окт-7-инил -3-
оксибицикло (4,2,0)окт-7-илиден пентановую кислоту, (о/) +97,4 (CHCl) MS м/Z 378 (М +NH|);
(E)-(3 S, IS-- -, 2S, 3R,- 6S)- (3 -ОКСИ-3 -циклогексилпроп-1 -
инил)-3-оксибицикло(4,2,0)окт-7-или- ден7пентановую кислоту, М8 (М + NH).
Вычислено, %: С 73,30; Н 8,95.
Найдено, %: С 73,32; Н 8,98.
(Е)-(38, 18, 28, 3R, 68)-4- 2-(3 -окси-3 -Ц11клогексилпроп-1 - инил)-3-оксибицикло(4,2,0)окт-7-или-
дeнJбутановую кислоту.
Вычислено, %: С 72,80; Н 8,73.
Найдено, %: С 73,05; Н 8,65.
D.Прдо бным образом, используя
соответствующие соединения, полученные , как описано в приготовлении
10.А, получают следующие соединения формулы (III):
(Z)-(38, 1R, 2R, 38, 6R)
(3 -окси-3 -циклогексилпроп-1 -инил)- 3-оксибицикло(4,2,0)oкт-7-илидeнJ-бутановую
кислоту, ()д - -107 (CHClj) .
Вычислено, %: С 72,80; Н 8,73.
Найдено, %: С 72,96; Н 8,82.
(Z)-(3 S, 1R, 3R, 3S, 6R)(3-
окси-3 -циклогексилпроп-1 -инил)-3- оксибицикло(4,2,0)окт-7-илиден пентановую
кислоту, (й)д -96,7 (CHClp) MS м/Z 378 (Мч- NH).
E.Подобным образом получают следующие соединения формулы (III):
(Z)-(38, IS, 28, 3R, 6S) (3 -оксиден-1 -инил)-3-оксибицикло- (4,2,0)окт-7-илиден бутановую кислоту
.
(Z)-(3 S, IS, 28, 3R, 6S)(3- оксиокт-1 -инил)-3-оксибицикло.(4,2 ,0)-
oкт-7-илидeIIJбутановую кислоту: ( л )д -104(CHClj ) ; MS M/Z 352 (М NH; .
Вычислено, %: С 71,82; Н 9,04.
Найдено, %: С 71,85; Н 8,94.
Пример 2. Получение метил- (Z)-(3 S, IS, 2S, 3R, 68)(3- окси-3 -циклогексилпроп-1 -инил)-3-
оксибицикло(4,2,0)-7-илиден1бутирата, родственных соединений и других фарма
цевтически приеплемых сложных эфиров.
А. К раствору 0,5 г (Z)-C3 S, IS,
28, 3R, 6S)(3 -окси-3 -циклогексилпроп-1 -инил)-3-оксиби1ликло(4 ,2,0)
окт-7-илиден бутановой кислоты в 10мл диэтилового.эфира прибавляют избыток
эфирного диазометана до исчезновения желтого окрашивания. Выпаривание растворителя
дает 0,52 г целевого продукта , W) +134 (МеОН)-.
Вычислено, %: С 73,30; Н 8,95.
Найдено, %: С 73,03; Н 9,15.
В. Подо.бным образом, но исходя из
других подходящих соединений формул (I)-(III), получают следующие сложны эфиры:
метил-(2);(38, IS, 2S, 3R, 6S)-4- 2-(з -окси-з -циклогексил- троп-1 -инил)-3-оксибицикло(4,2,0)-
окт-7-илйден бутират, MS м/Z 378 (M-fNH, МН 361.
Вычислено, %: С 73,30; Н 8,95.
Найдено, %: С 73,54; Н 8,82;
метил-(2)-(38, 1R, 2R, 38,
6К)(3 -окси-3 -циклогексил- проп-1 -инил)-3-оксибицикло(4,2,0)- окт-7-илиден бутират, М8 м/Z 378
(, МН+ 361.
Вычислено, %: С 73,30; Н 8,95. .
Найдено, %: С 73,47; Н 8.81.
Пример 3. Получение п-бенз-
амидофенил-(Е)-(38, IS, 28, 3R, 68) (3 -окси-3 циклогексилпроп-1 - инил)-3-оксибицикло(4,2,0)окт-7-Ш1и-
ден бутирата и родственных соедине- НИИ формул (I)-(III), в которых R является
А. Раствор (Z)-(38, IS, 28, 3R, б8)(3 -оксй-З -циклогексил- проп-l -инил)-3-оксибицикло(4,2,0)-
окт-7-илиден бутановой кислоты (35 мг, 0,101 ммоль) в 2,7 мл ацетона обрабатьшают 28,1 мкл (0,202 ммол
триэтиламина. Раствор охлаждают до в атмосфере азота и прибавляют 27,3 мкг (0,202 ммоль) изобутилхлор
карбоната. После 5 мин при прибавляют раствор 109,2 мг (0,51 ммоль . п-бензамидофенола в 1,1 мл сухого
пиридина. После 3 ч при комнатной температуре отгоняют в вакууме расворитель . Остаток экстрагируют ди-
хлорметаном и отфильтровьшают твердый избыток п-бензамидофенола. Посл
отгонки растворителя остаток очищают хроматографией на колонке с использованием 30%-ного ацетона в гек
сане для получения 12 мг целевого соединения. MS м/Z 541 (М).
Вычислено, %: С 75,39; Н 7,26; N 2,59.
C,Hj30,N.
Найдено, %: С 75,28; Н 7,23; N 2,48.
5
0
5
0 5
0
5
Т.пл. 154-155 с (oi) 86,9° (CHClj).
В. Подобным образом, но исходя из других соответствующих соединений
формул (I), (II) или (III), в которых R является , и заменив п-бенз-
амидофенол другими подходящими замещенными фенолами, получают типичные соединения, у которых R, является
СО п-ацетиламинофен1 п-(Е)-(38, 18, 28, 3R, 68)(3 -окси-3 - цикл.огек сил проп-1 -ипил)-3гоксибицик-
ло(4,2,0)окт-7-илиденJ бутират.
Вычислено, %: С 72,62; Н 7,78; N 2,92.
Найдено, %: С 72,25; Н 7,86; N 2,56.
.Пример 4. Получение (Z)- (38, 18, 28, 3R, 68)(3 -oкcи- 3 -циклогексилпроп-1 -инил)-3-окси-
бицикло(4,2,0)окт-7-Ш1иден бутирата натрия.
I Растворяют 58,3 мг 2-этилгексано- ата натрия в 0,2 мл смеси диэтило-
вого эфира и тетрагидрофурана (9:1). Добавляют по каплям дополнительное
количество тетрагидрофурана до тех пор, пока не получат прозрачный раствор
. Растворяют 70 мг (Z)-(38, 18, 28, 3R, б8)(з -окси-3 -цикло- гексйлпроп-1 -инш1)-3-оксибицикло-
(4,2,0)окси-7-илиден бутановой кислоты в 3 мл ацетона, и смешивают с раствором
2-этилгексаноата натрия.Смесь пе1 емешивают 30 мин и вьтари- вают досуха. Прибавляют 6 мл смеси
ДИЭТШ1ОВОГО эфира и тетрагидрофурана (9:1) к сухой массе и кипятят смесь
с обратным холодильником в течение 30 мин. Отфильтровывают твердый продукт
, промывают 2 мп смеси диэтило- вого эфира и тетрагидрофурана (9:1)
и сушат в вакууме, получают 56,0 мг целевого продукта.
Пример 5. Получение (Z)-(38, 18, 28, 3R, 68)(3 -окси-3 -цик- логексилпрЬп-1 -инил)-3-оксибицикло-
(4,2,0)окт-7-илиден бутирата натрия.
Растворяют 80 мг (Z)-(, 18, 2S,
3R, б8)(3 -окси-3 -циклогексилпроп-1 -инил)-3-оксибицикло(4,2,0)
окт-7-илиден бутановой кислоты в 1 мл метанола и прибавляют к этому раствору
18,5 мг бикарбоната натрия, растворенного в 4 МП воды.
Смесь перемешивают при комнатной температуре в течение 1 ч, подвергают
азеотропной сушке с двукратным ко17
личеством бензола и сушат в высоком вакууме в течение 3ч.Перекристаллизо
вывают твердый материал из смеси метанола и диэтилового эфира и сушат в вакууме при комнатной температуре,
получают 75 мг целевого продукта, (tf.) -HZ,44, т.пл.
ПодО)&ным )-(3 S
IS, 2S, 3R, 65)(3 -акс«- -цик- логексилпрои-1 -инил) -3-оксИ би4;икло- (4,2,0)окт-7 илиден бутират калия,
(ei) -110,3 (МеОН), т.пл. 73-83 С.
Пример 6, Получеяие (2Г)-(
1S, 2S, 4R, 68)(3 Окси-3 -цик- логексилпроп-1 -инил)-3-оксибицикло- (4,2,0)окт-7-илиденЗ бутирата кальция.
Смешивают 96 мг (Z)-(3 s, IS, 2S, 3R, 6S)(3 -окси-3 -циклогексил-
проп-1 -инил)-3-оксибицикло(4,2,0)- окт-7-илиденЗ бутановой кислоты и
7,01 мг оксида кальция в 1,5 мл воды и 1,2 мл тетрагидрофурана. Смесь нагревают 30 мин при и фильтруют.
Остаток растворяют в 1,2 мя тетрагид- рофурана и затем арибавлшет 15 мл
эфира. Осадок перемешивают при комнатной температуре, а затем фильтруют
. Твердый продукт промьшают безводным эфиром и сушат в высоком вакууме
при комнатной температуре всю ночь, получают 66 .мг целевого соединения, WU П.. т.пл. 138-143 С.
Подобным образом получают (Z)-(3 S, S, 28, 3R, 68)(3 -окси-3 -цик- логексилпроп-1 -инил)-3-оксибицикло-
К4,2,0)окт-7-илиден} бутират натрия, , (о)д 122,2 (МеОН), т.пЛ. 131- l55°C
Пример 7. Получение этилен- диаминовой соли (Z)-(3 S, IS, 2S, 3R, 6S)-4-Г2-(3 -окси-3 -циклогексилпроп-
1 -инил)-3-оксибицикло(4,2,0)окт-7- илиден бутановой кислоты.
Растворяют 95,3 мг (Z)-(3 S, IS, 2S, 3R, 6S)-4-t2-(3 -окси-3 -цикло-
гексилпроп-1 -инил)-3-окси.бищ1кло- (4,2,0)окт-7-Ш1Иден бутаново кислоты
в 5 мл эфира и к этому раствору прибавляют 7,5 мг этилендиамина, растворенного
в 4 мл эфира. Сразу образуется осадок. Осадок отфильтровывают, промывают эфиром, сушат в высоком
вакууме при комнатной температуре всю ночь, получают 60 мг целевого продукта .
По этой же методике получают дицик логексиламиномую соль (C)-(3 S, IS, 2S, 3R, 6S)(3 -окси-3 -циклогек1
-
, ю
,
15
2Q 25 ЗО
50 55
0015318
с11ЛПром-1 -«иил)-3-ок.сиби11;икло(4 ,2,0) окт-7-илидет бутаноБой кислоты.
Пример 8.Шол-учение тромет- амияовой сиол-(г)-(3 s, IS, 2S, 3R, 6s)-4- 2-(3 -окск-3 -циклогексилпроп-
1 -инил)-3-oкcибицIiклo(4 ,2 ,0)oкт-7- илидeн|-бyтaн0вoй кислоты.
Растворяют 75 мг (Z)-(3 s, IS, 28, 3R, 6s)(3 -окси-3 -циклогексил- проп-1 -инил)-3-оксибицикло(4,2,0)-
окт-7-илиден бутановой кислоты в 1 мл метанола и прибавляют 26,7 мл
трометамина. Реакционную смесь нагревают при 10 ми«, охлаждают до комнатной температуры и прибавляют по
каплям этилацетат до тех пор, пока прозр-ачный раствор не станет мутным.
Смесь перемешивают при комнатной температуре в теяение 4 ч и фильтруют,
промьшдаот этялзцетатом :И сушат в высоком вакууме при комнатной температуре
всю ночь, получают 90 мг целевого продукта, температура плавления 48-51 С, ((6) -83, (МеОН),
MS M/Z 364 (.
Вычислено, %: С 61,83; Н 8,93; N 2,88.
Найдено, %: С 62,12; Н 8,90; N 2,93.
По этой же методике получают ди- этиламиновую соль (Z)-(38, IS, 2S, 3R, 6S)(3 -окси-3 -циклогек-
силпроп-1 -инил)-3-оксибицикло(4,2,0)- окт-7-илиденЛбутановой кислоты.
Пример 9. Получение N-метил- 1-глюкаминовой соли (Z)-(3 s, 18, 2S, 3R, б)(3-циклогексилпроп-
1 -инил)-3-оксибицикло(4,2,0)окт-7- илиденТ. бутановой кислоты.
Растворяют 70 мг (Z)-(3 S, 18, 28, 3R, 6S)(3 -o ccи-3 -циклo- гексилпроп-1 -инил)-3-оксибицикло-
(4,2,0)окт-7-илиден бутановой кислоты в 2 мл метанола и прибавляют к
(Этому раствору 38,7 мг Ы-метил-В- глюкамина. Реакционную смесь перемешивают
30 мин при комнатной температуре . К этому гомогенному раствору прибавляют 10 мл этилацетата. Смесь
перемешивают при комнатной температуре 2 ч. Образовавшиеся кристаллы
отфильтровьшают, промывают эфиром и сушат в высоком вакууме при комнатной
температуре всю ночь, получают 90 мг целевого соединения, температура плавлелия 52-55 0, (в)д
62,8, MS M/Z 364 (Mf NH).
40
Вычислено, %: С 62,09; Н 8,75; N 2,59.
Найдено, %: С 60,34; Н 9,15;
N 2,47.-
Пример 10. Смесь 448 мг (Z)-.(3 S, IS, 2S, 3R, 68)(з -
окси-3 -циклогексилпрОп-1 -инил)3- оксибицикло(4,2,0)oкт-7-илидeнJ бута-
новой кислоты триэтиламиновой соли в 7 мл воды и 6 мл тетрагидрофурана обрабатывают 28 мг оксида кальция
и смесь нагревают 1 ч при . Затем упаривают тетрагидрофуран при пониженном давлении и удаляют воду
в вакууме, получают (Z)-(3 s, IS, 2S 3R, 6S)(з -окси-З -циклогексил- проп-1 -инил)-3-оксибицикло(4,2,0)
окт-7-илиден бутират кальция, который затем очгпцают, как описано в примере 5.
Пример 11. Раствор метил-(2) (3 S, 18, 28, 3R, б8)(3 окси- 3 -циклогексилпроп-1 -инил)-3-оксиби
цикло (4,2,0) окт-7-илиден бутирата (200 мг) в 5 л изопропанола охлаждают
холодильником в течение 3 ч, после этого отгоняют примерно 2 мл растворителя
из колбы. Полученный в результате раствор выпаривают досуха, обрабатывают 5 мл фосфатного буфера
с рН 7, и образовавшийся изопропило- вый сложный эфир экстрагируют этил-
ацетатом. После очистки с помощью флаш-хроматографии на силикагеле при
элюировании 40%-ным этилацётат-гекса ном получают чистый сложный эфир.
При м е р 12. Смесь 448 мг (Z) (38, IS, 2S, 3R, б8)(з -окси- 3 -циклогексилпроп-1 -инил)-3-окси-
бициЛло(4,2,0)окт-7-Ш1иден бутановой кислоты, 152 мг диазабициклоундекана
и 156 мг иодэтана в 5 мл сухого бензола кипятят с обратным холодильнико
6 ч. Затем отгоняют растворитель при пониженном давлении и обрабатывают отаток
водным раствором бикарбоната натрия, экстрагируют этилацетатом. Объединенные экстракты хорошо промывают
водой, сушат над сульфатом магния и вьтаривают, получают этил-(2)- (38, 18, 2S, 3R, 68)(3 -окси-
3 -циклогвксилпроп-1 -инил)-3-оксиби цИкло(4,2,0)окт-7-илиден бутират.
Пример 13. К смеси 0,2 мл 0, 5 Н. водного гидроксида ; лития в 0,5 мл метанола прибавляют 35 мг этил ,(
Z)-(38, 1S, 28, 3R, б8)(3- окси-3 -циклог ексилпроп-1 -инил) -3оксибицикло (4,2,0)окт-7-илиден1 бутирата и смесь перемешивают в атмосфере азота в течение 24 ч. Затем отгоняют
растворитель в вакууме, а остаток обрабатывают эфиром, получают (Z)-(3 8 1G, 28, 3R, 68)(3 -окси-3 -цик-
логексилпроп-1 -инил)-3-оксибицикло- (4,2,0)окт-7-илиден1 бутират лития.
Пример 14. Распределяют между 100 мл дихлорметана и 100 мл 5%-ной водной уксусной кислоты 1,52 г
(Z)-(, 18, 28, 3R, 68)(з - окси-3---циклогексйлпроп-1 -инил)-3- оксибицикло (4,2,0)окт-7-илиден | бутиг
рата кальция и хорошо встряхивают. Отделяют водный слой и экстрагируют
дополнительными 100 мл дихлорметана. Объединенные экстракты сушат над безводным
сульфатом натрия и вьтаривают досуха, получают 1,38 г (Z)-(3 S,18, 23, 3R, 68)(3 -окси-З -цикло-
гексилпроп-1 -инил)-3-оксибицикло- ,(4,2,0)окт-7-илиден1 бутановой кислоты
I .
Пример 15. Ингибирование агрегации тромбоцитов.
Собирают человеческую венозную кровь у непринимавших лекарств здоровых
добровольцев в емкости по 15 мл и антикоагулируют 0,5 мл 11,4%-ным раствором цитрата натрия.
Кровь центрифугируют при комнатной температуре в течение 15 мин при 150 g в центрифуге Сорволл GLC-28
и отсасывают надосадочную обогащенную тромбоцитами плазму (PRP). Обедненную
тромбоцитами плазму (FRP) получают при центрифугировании крови, из которой удалена PRP, при 12800 g
в течение 3 мин в центрифуге Эппен- дорфа при комнатной температуре. Агрегацию
тромбоцитов проводят по методике Борна в агрегатометрах Пэйто- на. Агрегацию тромбоцитов вызьшают до
добавлением 2-5 нмоль ADP в 1 мл PRP содержащей 10 мкл различных концентраций
испытуемых соединений или носителей , инкубированной в кювете аг-
регатометра при 37 С в течение 5 мин при скорости перемешивания 500 об/мин,
Затем для каждого испытуемого соединения Строят кривую процента ингиби-
рования-концентрации на полулогарифмической бумаге и концентрацию, соответствующую
50% ингибирования, выражают как HKjjj для этого соединения. Все испытуемые соединения (1-2 мг)
готовят в виде 0,01 М растворов в
2115
10%-ном этаноле и 59 мМ бикарбоната натрия.
Последующие разбавления сделаны
водой. В табл. 1 систематизированы результаты испытаний - ингибирования агрегации тромбоцитов.
Пример 16. Антигипертекзив- ная активность.
Антигипертепзивные эффекты проста гландиноподобных соединений оценивали на самопроизвольно гипертензив-
ных крысах (SIIR/NCrlBR). Под эфирной анестезией имплантируют феморалЪные
артериальные и венозные канюли и крыс оставляют в лежачем положении. После
выхода из анестезии вводят лид зкаин. Кровяное давление определяют с помощью
феморальной артер.иальной канюли и регистрируют на полиграфе Бекман Р611. Каждое соединение.изучали
на группе из 4 крыс. В начале изучения вводили носитель и с интервалом в 30 мин после этого вводили
внутривенно соединения при увеличе- НИИ дозы от 1 до 3, 10, 30 и 100мкг/к
Фоновое среднее артериальное кровяное давление представляло собой кровяное
давление непосредственно перед
первой дозой соединения, ЕД вычис
ляют по линейной регрессии процента снижения среднего кровяного давления
после каждой дозы соединения,Длительность активности бьша определена на основе восстановления до 90% от
контрольного кровяного давления посл дозы 100 мкг/кг внутривенно.
В табл. 2 даны результаты антиги- пертензивной активности соединений формулы (I)-(III) на крысах.
Пример 17. Антигипертензив- ное действие простагландиноподобных
соединений было оценено на самцах и самках дворовых кошек, которым под пентобарбитальной анестезией бьши
вставлены артериальные и венозные канюли и сделана торактомия для размещения устройства Уолтона - Броди
на правом желудочке миокарда. После хирургической операции животных обследовали
в сердечнососудистом и автономном тесте, который включает введение различных аиtocoids до и
после внутривенного введения каждой из нескольких уровней доз испытуемого
соединения. Регистрировали среднее кровяное давление, миокардичес-
кую силу и скорость сердца, происходящую от кровяного давления. Испытуе
53
22
5 0 5
0
с
мое соединение вводили внутривенно
в количестве 1, 3, 10 и 30 мкг/кг autocoids. Вызовы не вводили после
дозы 30 мкг/кг. Фоновое среднее кровяное давление представляет собой кровяное давление непосредственно
перед каждым введением испытуемого соединения. Определяли ЕД из линейной
регрессии процента снижения среднего кровяного давления у нескольких кошек после каждой дозы соединения.
Результаты антигипертензивного действия на кошках даны в табл. 3.
Пример 18. Токсичность,
4 бабуинам, весящим около 9-14 кг
давали 1 мг/кг испытуемого соединения (Z)-(3S, IS, 2S, 3R, 6S) (З -окси-3 -циклогексилпроп-1 -инил)-
3-оксибицикло(4,2,0)oкт-7-илидeнJ бу- рановой кислоты в раст.воре за один
раз орально. Не наблюдалось никаких токсических эффектов.
Другие соединения предлагаемого изобретения также не оказывают токсического действия.
Формула изобретения
Способ получения (4,2,0)бицикло-
октановых производных обпщх формул I, II или III
№о)
(П
(11)
где п 2 или 3;
R, группа COjR4 или RJ, - водород;
R 7 линейньш Cf-C., -алкнл или цик- J &
логексил;
- группгг v / X, где X - груп
.0
СИ-1 ЫС
.0 СбН5
,1ли их фармацевтически приемлемых нетоксичных солей, или фармацевтически приемлемых нетоксичных сложных
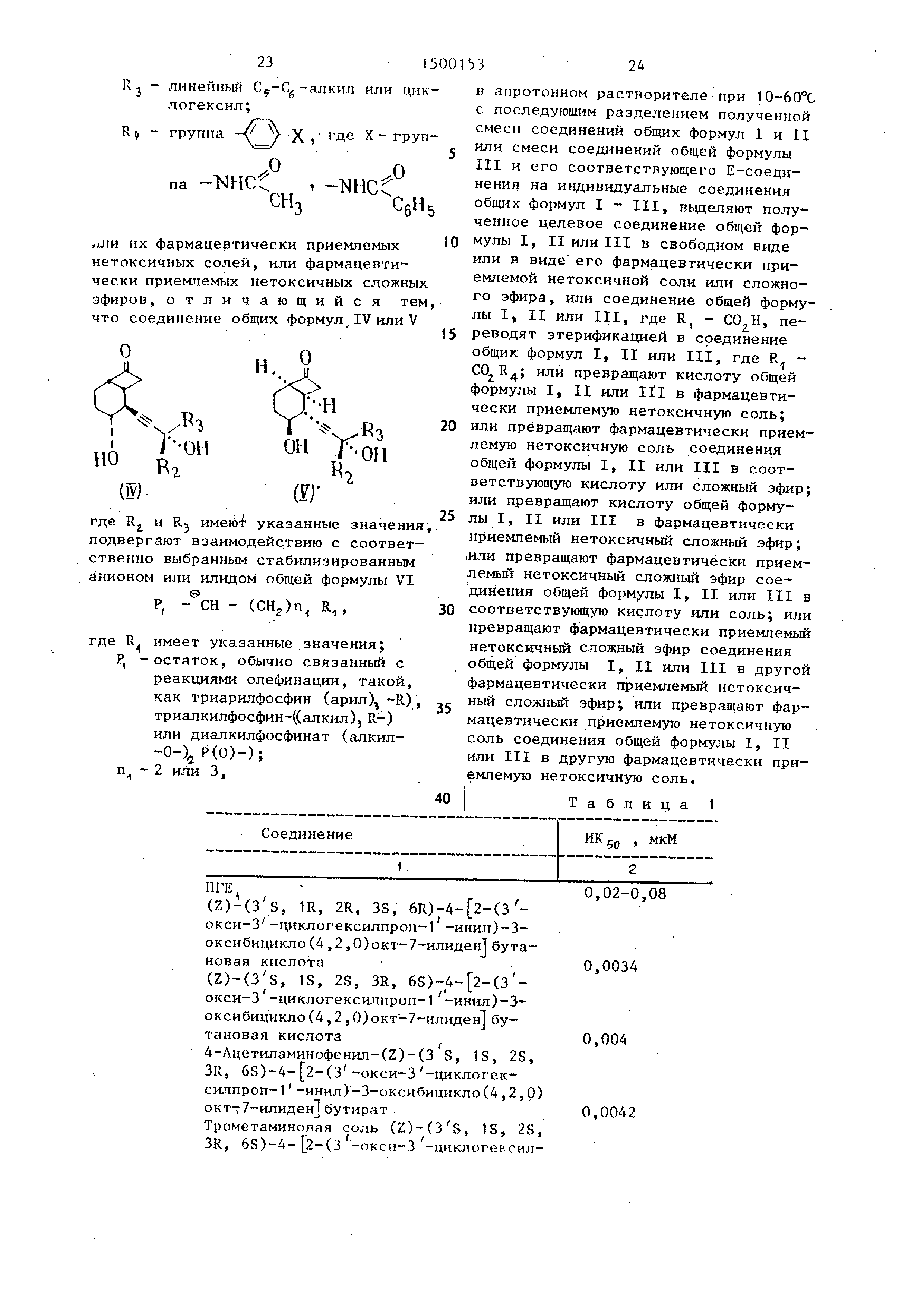
эфиров, отличающийся тем, что соединение общих формул/IV или V
чх«3
О
Ш).
Г-Н
«
Oli ОИ
1.
ш
где R и RJ имею указанные значения
подвергают взаимодействию с соответственно выбранным стабилизированным
анионом или илидом общей формулы VI
е
Р, - СН - ( R, ,
имеет указанные значения; остаток, обычно связанньй с
реакциями олефинации, такой, как триарилфосфин (арил) R). 35 триапкилфосфии-((алкил)) R-)
или диалкилфосфинат (алкил- -О-)Р(О)-); 2 или 3,
40
ПГЕ -
(Z)-(3 S, 1R, 2R, 3S, 6R)(3- окси-З -циклогексилпроп-1 -инил)-3- оксибицикло(4,2,0)oкт-7-илидeнjбута-
новая кислота
(Z)-(3 S, IS, 2S, 3R, б5)(з - окси-3 -циклогексилпроп-1 -инил)-3-
оксибицикло(4,2,0)окт-7-илиден бу- тановая кислота
4-Ацетиламинофенил-(г)-(3 S, IS, 28, 3R, 6S)(З -окси-З -циклогексилпроп-1 -инил)-3-оксибицикло(4,2,р)
окт-7-илиден бутират
Трометаминовая соль (Z)-(3 S, IS, 2S,
3R, 6S)(3 -окси-3 -циклогексил
0
5
0
5
0
в апротонном растворителе при 10-60% с последующим разделением полученной
смеси соединений общих формул I и II или смеси соединений общей формулы
III и его соответствующего Е-соеди- нения на индивидуальные соединения
общих формул I - III, вьщеляют полученное целевое соединение общей формулы
I, II или III в свободном виде или в виде его фармацевтически приемлемой нетоксичной соли или сложного
эфира, или соединение общей формулы I, И или III, где R, - , переводят этерификацией в соединение
общик формул I, II или III, где R - COj, или превращают кислоту общей
формулы I, И или III в фармацевтически приемлемую нетоксичную соль;
или превращают фармацевтически приемлемую нетоксичную соль соединения
общей формулы I, II или III в соответствующую кислоту или сложный эфир;
или превращают кислоту общей формулы I, II или III в фармацевтически
приемлемый нетоксичный сложный эфир; или превращают фармацевтически прием-
лемьп нетоксичный сложный эфир соединения общей формулы I, II или III в
соответствующую кислоту или соль; или превращают фармацевтически приемлемый
нетоксичный сложный эфир соединения общей формулы I, II или III в другой
фармацевтически приемлемый нетоксичный сложньй эфир; или превращают фармацевтически
приемлемую нетоксичную соль соединения общей формулы I, II
или III в другую фармацевтически приемлемую нетоксичную соль,
Т а б л и ц а 1
25
проп-1 -иннл)-3-оксибицикло(4,2,0)- окт-7-илидин| бутановой кислоты 0,011
М-метил-В-глюкаминовая соль (Z)-(3 S, IS, 2S, 3R, 6S)(3 -окси-З -цик- логексилпроп-1 -инкл)-3-оксибицикло-
(4,2,0)окт-7-Ш1иден бутаковой кислоты 0,012 Дициклогексиламиновая соль (Z)-(3 S,
IS, 2S, 3R, б8)(3 -окси-3 - циклогексилпроп-1 -инил)-3-оксиби- цикло(4,2,0)окт-7-илиден1бутановой
кислоты. 0,014
Т иэтаноламиновая соль. (Z)-(3 S, IS,
2S, 3R, б8)(3 -окси-3 -цикло- гексилпроп-1 )-3-oкcибициклo- (4,2,0)окт-7-илиден бутановой кислоты 0,011
Этиленаминовая соль (Z)-(3 S, IS, 2S, 3R, 6S)-4-(2-(3 -окси-З -циклогек-
силпроп-1 -инил)-3-оксибицикло(4,2,0)- окт-7-илидек бутановой кислоты0,0084
(Z)-(3 SA, IS, 2S, ЗЯЛ, 6S)-4- С2-(3 -окси-3 -циклогексилпроп-1 - инил)-3-оксибидикло(4,2,0)акт-7-
илиден бутановая кислота0,012
(Z)-(3 S, IS, 2S, 3R, 6S)(3- .
окси-3 -дик логексилпроп-1 -инил) -3- оксибицикло(4,2,0)окт-7-илиден пен- тановая кислота0,01
(Z)-(3 S, 1S, 2S, 3R, 6S)(3- окси-3 -диклогексилпроп-1 -инил)-3-
оксибидикло(4,2,0)окт-7-илиден бу- тират кальдия0,015
(Z)-(3 S, 1R, 2R, 3S, 6S)-4- L2-(3 -окси-3 -диклогексилпроп-1- инш1)-3-оксибидикло(4,2,0)окт-7-
илидeнJбутановая кислота0,014
(Z)-(3 S, 1R, 2R, 3S, 6R)(3-
окси-3 -диклогексилпроп-1-инил)-3- оксибидикло(4,2,0)окт-7-илиден1пен- тановая кислота0,017
((3 s, 1SA, 2SA, 3RA, 6S)-5- 2-(3 -окси-3 -диклогексилпроп-1 -
инил)-3-оксибидикло(4,2,0)окт-7-или- ден}пентановая кислота0,022
(Z)-(3 S, 1R, 2R, 3S, 6R)-5- 2-(3 -OKси-З -диклогексилпроп-1инил
)-3-оксибидикло(4,2,0)окт-7лиден пентановая кислота0,027
(E)-(, 1S, 2S, 3R, 6S)(3 кси-3 -диклогексилпроп-1 -инил)3-оксибидикло (4,2,0)окт-7-илиден утановая
кислота0,045
етил-(Z)-3 S,1R, 2S, 3S, 6R)
(3 -окси-3 -диклогексилпроп-1 150015326
Продолжение табл.1
27150015328
Продолжение табл,1
I
СоединениеI ИК , мкМ
нил)-3-оксибйцикло(4,2,0)окт-7- лидeнJ бутират0,115
(E)-(3 S, IS, 2S, 3R, 6S)-4- 2-(3 -окси-З -циклогексилпроп-1 - нил)-3-оксибицикло(4,2,0)окт-7-
лиден2бутановая кислота0,1
(E)-(3 S, IS, 2S, 3R, б8)(3-
окси-З -циклогексилпроп-1 -инил)-3- ксибицикло(4,2,0)окт-7-илиден1 пен- тановая кислота0,17
етил-(Z)-(3 S, .18, 2S, 3R, 6S)- (3 -циклогексилпроп-1 - ИНИЛ)-
3-оксибицикло(4,2,0)окт-7-илиден бутират0,35
(Z)-(3 S, IS, 2S, 3R, 6S)(3-
оксиокт-l -инил)-3-оксибицикло) (4,2,0)окт-7-илиден1 бутановая кислота0 ,25
(E)-(3 S, IS, 2S, 3R, 6S)(3- окси-3 -циклогексилпроп-1 -инил)-3- оксибицикло(4,2,0)окт-7-илиден1пен-
тановая кислота0,19 Метил-(Z)-(3 S, IS, 2S, 3R, 6S)-4- L2-(3 -окси-З -циклогексилпроп- -
инил)-3-оксибицикло(4,2,0)окт-7- илиден бутират0,35 (Z)-(3 S,, 1R, 2R, 3S, 6R)(3-.
оксиокт-1 -инил)-3-оксибицикло (4,2,0)окт-7-иЛиденЗбутановая кислота 0,45 (Z)-(3 SA, 1R, 2R, 3S, 6R)
(З -окси-З -циклогексйлбут-1 -инил)- 3-оксибицикло(4,2,0)окт-7-илиден бутановая кислота0,32
(E)-(3 S, 1S, 2S, 3R, 6S)(3- оксиокт-1 -инил)-3-оксибицикло(4,2,0) окт-7-илиден бутановая кислота, 0,85
4-Бензамидофенил-(Е)-(38, 18, 2S, 3R, 68)(з -окси-З -циклогексилпроп-
l -инил)-3-оксйбицикло(4,2,0)окт-7- илиден}бутират0,022 (Z)-(3j8, IS, 2S, 3R, 6S)(3-
окси-3 -циклогексилпроп-1 -инил)-3- оксибицикло(4,2,0)окт-7-илиден}бутират натрия0,0042
(Z)-(3 S, IS, 28, 3R, 6S)-4-f2-(3- окси-3 -циклогексилпроп-1 -инил)-3-
оксибицикло(4,2,0) oкт-.7-илидeнJбyтиpaт калия0,0066
(Z)-(38, 18, 28, 3R, 68)(3 окси-3 -циклогексилпроп- -инил )-3- oкcибициклo(4,2,0)oкт-7-илидeн бутират
магния 0,016
(Z)-(38, 18, 28, 3R, 68)(3- окси-3 -эндобидикло(3,1,0)гекс-6
29150015330
Продолжение табл. 1
Соединение
илбут-1 -инил)-3-оксибицикло(4,2,0 окт-7-илиден бутановая кислота
i(Z)-(3 sA, IS, 2S, 3R, 6S)-4- 2-(3 -окси-3 -циклопентилпроп-l - инил)-3-оксибицикло(4,2,0)окт-7-
илиден бутановая кислота
(E)-(3iS, IS, 2S, 3R, 6S)-4-
2-(3 -окси-З -циклопентилпроп-i - инил)-3-оксибицикло(4,2,0)окт-7- илиден бутановая- кислота
, Таблица 2 СоединениеI ЕД,, , мкг/кг
го
(Z)-(, IS, 2S, 3R, 68)(з -
окси-3 -циклогексилпроп-1 -инил)-3- оксибицикло(4,2,0)окт-7-илиден бутановая кислота (
Z)-(3 S, IS, 2S, 3R, 6S)-4- 2-(3 -окси-3 -циклогексилпроп-1 - инил)-3-оксибицикло(4,2,0)окт-7-
илиден бутановая кислота (Z)-(3 S, IS, 2S, 3R, 6S)(3- ок.си-циклогексилпроп-l -инил)-3-
оксибицикло(4,2,0)окт-7-илиден пен- тановая кислота (г)-(З S, 1R, 2RA, 3S, 6R)-4-
2-(3 -окси-3 -циклогекснлпроп-1 - инил)-3-оксибицикло(4,2,0)окт-7- илиденТбутановая кислота
(Z)-(3 S, IS, 2S, 3R, 6S)-5- 2-(3 -окси-3 -циклогексилпроп-1 - инил)-3-оксибицикло(4,2,0)окт-7-
илиден пентановая кислота Метш1-(2)-(38, IS, 2S, 3R,6S) (3 -окси-3 -циклогексилпроп-1
инил)-3-оксибицикло(4,2,0)окт-7- илиден бутановая кислота (Z)-(3 S, 1S, 2S, 3R, б8)(з -
оксиокт-1 -инил)-3-оксибицикло(4,2, окт-7-илиден бутановая кислота (Z)-(3 S, 1R, 2R, 3S, 6R)(3-
оксиокт-1 -инил)-3-оксибицикло(4,2, окт-7-илиден бутановая кислота
I
л ,,
го
. 150015332
Таблица 3
.. .... Efljj,, мкг/кг
l
(Z)-(3 s, 1R, 2R, 3S, 6R)(3-
ОКСИ-3 .-циклогексилпроп-1 -инш1)-3- оксибицикло(4,2,0)окт-7-илиден бутановая кислота
(Z)-(3|S, 1S, 2S, 3R, 6S)(3 окси-3 -циклогексилпроп-1 -инил)-3оксибицикло
(4,2,0)окт-7-илиден бутановая кислота
(Z)-(, IS, 2S, 3R, 6S)(3- .
окси-3 -циклогексилпроп-1 -инил)-3оксибицикло (4,2,0)окт-7-илиден1пентановая кислота



















Комментарии