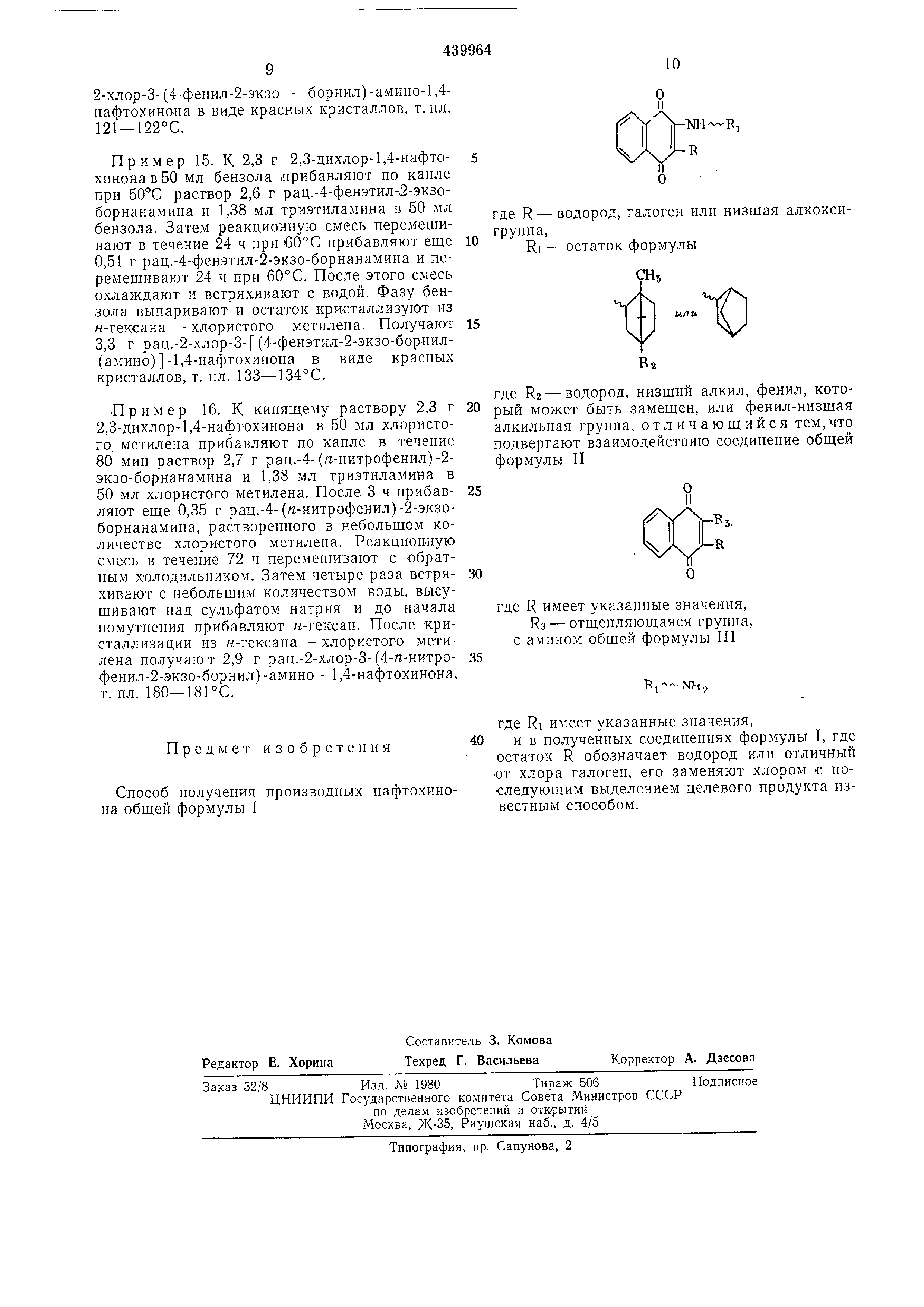
Способ получения производных нафтохинона - SU439964A3
Код документа: SU439964A3
Описание
ствию со спиртом, например метиловым, в присутствии сильпых минеральных кислот.
Способ.получения производных нафтохинона указанной , обладающих высокой ,,0|ИО;йогйче&ой )|щивнос тью, не известен.
CftQpfitH№oяyчeния соединений указанной формулы I заключается в том, что подвергают взаимодействию соединение общей формулы II
где R имеет указанные значения и Кз означает отщепляющуюся группу, с амином общей формулы III
где RI имеет указанные значения, и, если желательно , в соединении указанной формулы I, где остаток R обозначает водород или отличный от хлора галоген, его заменяют хлором.
Выражение «отщепляющаяся группа обозначает ацилоксигруппы, например ацетоксигруппу , пропионоксигруппу, алкоксигруппы, например метоксигруппу, этоксигруппу, арилоксигруппы , например фепилоксигруппу, аралоксигруппы , например бензилоксигруппу, арилсульфонилоксигруппы, например тозилоксигруппу , алкилсульфонилоксигруппы, например мезилоксигруппу, арилтиогруппу, аралкилтиогруппу , оксигруппу, или атом галогена, иапример бром, хлор.
Применяемые в - качестве исходного материала соединения указанной формулы III, где RI обозначает остаток формулы V, являются известными соединениями; их можно получить известными приемами, например путем восстановления соответствующего оксима.
Применяемые в качестве исходного материала соединения указанной формулы III, где RI обозначает остаток формулы IV, являются новыми соединениями за исключением тех, где Ra обозначает в остатке формулы IV водород.
Взаимодействие соединения общей формулы И с амином общей формулы III осуществляется в инертных в условиях реакции органических растворителях, например в спиртах, таких как метанол, этанол, в алифатических углеводородах , в галогенированных алифатических углеводородах, например в хлористом метилене , в ароматических углеводородах, например в бензоле, нитробензоле, диоксане, тетрагидрофуране , диметилформамиде.
Реакцию можно осуществлять при температуре , колеблющейся приблизительно между комнатной и 150°, преимущественно при 60- 100°С.
в процессе взаимодействия целесообразно применять избыток чмина, чтобы связывать
освобождающуюся кислоту. применять также инертное в условиях реакции органическое основание, например третичный органический амин, например триэтиламин, пиридин, чтобы связывать освобождающуюся кислоту. Перевод соединения формулы I, где остаток R обозначает водород или отличный от хлора галоген, в соединение формулы I, где R обозначает хлор, можно осуществлять путем нагревания соединений формулы I в подходящем растворителе с хлоридом лития или путем пропускания газообразного хлора через реакционную смесь. Процесс проводят при температуре 50-
150°С, преимущественно 80-120°С.
В зависимости от исходного материала формулы III можно получать целевые продукты в двух диастереомерных формах и в виде рацематов или в виде активных соединений.
При применении рацемических (рац.) соединений формулы III получают рацемические соединения формулы I. При применении отдельных оптических антиподов формулы III получают соответствующие оптические антиподы
формулы I. При применении эндо-формы или экзо-формы соединений формулы П1 получают эндо-форму или экзо-форму соединений формулы I.
Пример 1. К суспензии 22,7 г 2,3-хлор-1,4нафтохинона в 200 мл абсолютного спирта прибавляют по капле при перемещиванип при комнатной температуре 33,7 г рац.-2-эндо-борнанамина , растворенного в 50 мл абсолютного
спирта. После этого реакционную смесь в течение 4 ч кипятят с обратным холодильником, образуется темио-красный раствор.
Затем реакционную массу выпаривают под уменьщенным давлением, остаток растворяют
в 300 мл хлороформа и раствор промывают водой, 1 н. соляной кислотой и затем опять водой . После высушивания над сульфатом натрия органическую фазу сгущают, обрабатывают активным углем и выпаривают. После кристаллизации из н-гексана получают 30,3 г рац.2- (2-эпдо-борниламино) - 3-хлор - 1,4-нафтохинона , т. пл. ПО-111°с:
Пример 2. 4,54 г 2,3-дихлор-1,4-«афтохинона суспендируют в 30 мл абсолютного бензола и прибавляют 2,226 г триэтиламина. При комнатной температуре прибавляют по капле в течение 35 мин при перемещивании раствор 3,218 г рац-2-эндо-борнанамина в 10 мл абсолютного бензола. После двухчасового перемещивапия отфильтровывают окращенную в темно-красный цвет суспензию от нерастворимого остатка, фильтрат выпаривают и остаток растворяют в хлористом метилене. Раствор промывают водой, 1 н. соляной кислотой и водой,
высушивают над сульфатом натрия, фильтруют и выпаривают. Остаток обрабатывают в гексане активным углем и рац.-2-(2-эндо-борниламино ) - 3-хлор-1,4-нафтохинон кристаллизуют . Получают 2,9 г красных кристаллов,
т. пл. 109-110°С.
Пример 3. Аналогично примерам 1 или 2 получают следующие соединения: из 2,3-дихлор-1 ,4-нафтохино«а и (-1-)-(Ш)-2-эндо-борнамина получают ( + )-2-(Ш)-2-эндо-борниламино -3-хлор-1 ,4-нафтохинон, т. пл. 113- 115°С (из гексана), а + 120° (.01 в спирте);
из 2,3-дихлор-1,4-нафтохинона и (-)-(IR)-2экзо-борнанамина получают (-)-2-(Ш)-2экзо-борниламино -3-хлор - 1,4 - нафтохинон, т. пл. 97-98°С (из гексана), а -175°С (с 0,03 в спирте);
из 2,3-дибром-1,4-нафтохинона и (+)-(Ш)-2эндо-борнанамина получают (-)-2-(Ш)-2-экзо-борниламино -3-хлор-1 ,4-нафтохинон, т. пл. 97-98°С (из гексана), а -175°С (с 0,03 в спирте);
из 2,3-дибром-1,4-нафтохинона и (+)-(Ш)2-эндо-борнанамина получают ( + )-2- (IR)-2эндо-борниламино - З-бром-1,4 - нафтохинон, т. пл. 102-104°С (из гексана - простого петролейного эфира), ос -fi04°C (,1 в спирте);
из 2,3-дибром-1,4-нафтохинона и рац.-2-эндоборнанамипа получают рац.-2-(2-эндо-борниламино )-3-бром-1,4-нафтохинон, т. пл. 82-84°С (из гексана - простого петролейного эфира);
из 1,4-нафтохинона и рац.-2-эндо-борнанамина получают рац.-2-(2-эндо-борниламино)-1,4нафтохинон , т. пл. 181-182°С (из хлороформа - простого петролейного эфира);
из 2,3-дихлор-1,4-нафтохинона и рац.-2-эндонорборнанамина получают рац.-2-хлор-3-(2эндо-норборниламино )-1,4-нафтохинон, т. пл. 100-102С (из хлороформа - простого петролейного эфира);
из 2,3-дихлор-1,4-«афтохинона и рац.-2-экзонорборнанамина получают рац.-2-хлор-3-(2экзо-норборниламино )-1,4-нафтохинон, т. пл. 112-114°С (из хлороформа-простого петролейного эфира);
из 2,3-дихлор-1,4-нафтохинона и рац.-2-экзоборнанамина получают рац.-2-(2-экзо-борниламино )-3-хлор-1,4-нафтохинон, т. пл. 89-91°С (из гексана);
из 1,4-нафтохинона и рац.-2-экзо-борнанамина получают рац.-2-(2-экзо-борниламино)-1,4-нафтохинон , т. пл. 163-164°С (из хлористого метилена - простого петролейного эфира);
из 2,3-дибром-1,4-нафтохинона и ран. 2-экзоборнанамина получают рац.-2-(2-экзп-борниламино )-3-бром-1,4-нафтохинон, т. пл. 85-87°С (из гексана - простого петролейного эфира);
из 2,3-диметокси-1,4-нафтохинона и рац.-2эндо-борнанамина получают рац.-(2-эндо-борниламино )-3-метокси-1,4-нафтохинон;
из 2,3-диметокси-1,4-нафтохинона и рац.-2экзо-борнанамина получают рац.-2-(2-экзоборниламино )-3-метокси-1,4-нафтохинон. ,:
Пример. 4. 192,6 мг 2-хлор-1,4-нафт-о.хинона растворяют в 25 мл абсолютного диоксана
и прибавляют по капле при перемешивании при комнатной температуре 153,3 мг рац.-2эндо-борнанамина , растворенного в 5 мл абсолютного диоксана. Темно-красную реакционную смесь в течение 70 мин кипятят с обратным холодильником. Затем растворитель выпаривают в вакууме, остаток поглощают 30мл хлороформа, промывают 10 мл воды, 5 мл 1 н. соляной кислоты и водой, высущивают над
сульфатом натрия, фильтруют и выпаривают. Остаток (321 мг) разделяют на 10 г силикагеля (0,2-0,5 мм) хлористым метиленом в качестве элюента. Улавливают 14 фракций по 2-3 мл. элюата. Фракции 4-7 содержат желаемый продукт. Эти фракции промывают еще в хлористом метилене водой, затем высущивают над сульфатом натрия, фильтруют и выпаривают . Остаток кристаллизуют из простого изопропилового эфира.
Получают 30,4 мг рац.-2-(2-эндо-борниламино )-3-хлор-1,4-нафтохинона, т. пл. 110-111°С. Пример 5. 11,13 г 2-хлор-З-метокси-1,4нафтохинона суспендируют в 1000 мл абсолютного метанола и в течение 20 мин прибавляют
по капле при перемешивании при 20°С 8,9 г рац.-2-эндо-борнанамина, растворенного в 20 мл абсолютного метанола. После получасового кипения с обратным холодильником темно-красную реакционную массу сгущают под
уменьщенным давлением, остаток растворяют в 200 мл хлороформа, встряхивают со 100 мл 1 н. соляной кислоты и промывают водой до нейтрального состояния. Органическую фазу высущивают над сульфатом натрия, фильтруют и выпаривают. Вещество перекристаллизовывают из н-гексана. Получают 15,05 г рац.-2 (2-эндо-борниламино) - З-хлор-1,4 - нафтохинона , т. пл. ПО-111°С.
Пример 6. К суспензии 1,0 г 2-ацетокси3-хлор-1 ,4-нафтохинона в 20 мл абсолютного спирта прибавляют по капле в течение 5 мин при перемешивании при 20° 1,35 г рац.-2-эндоборнанамина , растворенного в 10 мл абсолютного спирта. Реакционную смесь в течение
20 мин кипятят с обратным холодильником. После выпаривания спиртового раствора остаток хроматографируют на 20 г силикагеля (0,2-0,5 мм) с хлористым метиленом в качестве элюента. При этом улавливают 12 фракций по 5 мл. Фракции 5-8 содержат 300 мг рац.-2-(2-эндо-борниламино)-3 - хлор-1,4-нафтохинона , которыР плавится после кристаллизации из простого изопропилового эфира при 109-111°С.
Пример 7. 208,6 мг 2-хлор-3-окси-1,4-нафтохинона суспендируют в 5 мл абсолютного спирта и прибавляют при перемещивании при комнатной температуре 168,6 мг рац.-2-эндоборнанамина , растворенного, в 3 мл абсолютного спирта. После 60-м.ин перемещивания при. комкатной температуре .темно-красный рас-, твор выпаривают в ва-кууме, к остатку прибавляют простой изоп.ропйловый эфир и нерас-: творимую часть фильтруют на нутче. После
выпаривания -маточного раствора остаток
(90,6 мг) хроматографируют на 3 г силикагеля (0,2-0,5 мм) € хлористым метиленом в качестве элюента. Улавливают 15 фракций по 1 мл. Фракции 5-12 дают после кристаллизации из метанола 55,0 мг рац.-2-(2-эндо-борниламино )-3-хлор-1,4-нафтохинона, т. пл. 109-110°С.
Пример 8. 388,3 мг рац.-2-(эндо-борниламипо )-3-бром-1,4-нафтохинона (полученного по примеру 3) нагревают до 100°С вместе с 848,0 мг хлорида лития в 50 мл абсолютного диметилформамида. .После 24 час реакционную смесь сгущают досуха, остаток поглощают простым эфиром и раствор промывают водой , высушивают над сульфатом натрия, фильтруют и выпаривают. Остаток фильтруют в растворе хлористого метилена над б г силикагеля (0,2-0,5 мм). Полученный после выпаривания элюата продукт кристаллизуется из простого изопропилового эфира. Получают 280 мг рац.-2-(2-эндо-борниламино)-3-хлор1 ,4-нафтохинопа, т. пл. 110-111°С.
Пример 9. Через раствор 1,545 г рац.-2 (2-эндо-борниламино)-1,4-нафтох-инона (полученного по примеру 3) в 25 мл абсолютного диметилформамида в течение 2 мин вводят сухой хлорный газ.
При этом образуется светло-желтый раствор и реакционная смесь легко нагревается. После 90 мин перемешивания при комнатной температуре реакционную массу выпаривают в вакууме и темно-красный остаток поглощают хлороформом. Раствор промывают водой до нейтрального состояния, высушивают над сульфатом натрия, фильтруют и выпаривают. Остаток грубо разделяют на силикагеле (0.2- 0,5 мм) хлористым метиленом и обогащенные фракции еще раз хроматографируют на 15 г силикагеля (0,2-0,5 мм) с хлористым метиленом в качестве элюента. Улавливают 34 фракции по 1 мл. Фракции 16-27 дают после кристаллизации из метанола 122 мг рац.-2-(2-эндобопниламино )-3-хлор-1,4-нафтохинона, т. пл. 109-110°С.
Пример 10. 11,35 г 2.3-дихлор-1,4-нагЬтохинона суспендируют в 100 мл абсолютного спирта и в теченир 15 мин тт.рибавляют при перемещивании 16,73 г рац.-2-эндо-1,4,7,7-тетраметилнорборнанамина , растворенного в 50 мл абсолютного спирта. Темно-красный раствор в течение 2 ч кипятят с обратным холодильником . Затем реакционную массу выпаривают под уменьшенным давлением. Остаток растворяют в 200 мл хлористого метилена, встряхивают , применяя по очереди 100 мл воды, три раза по 50 мл I н. соляной кислоты и три раза по 100 мл воды. После высушивания над сульфатом натрия раствор хлористого метилена сгущают, обрабатывают активным углем и выпаривают. После кристаллизации из н-гексана - хлористого метилена получают 9.95 г рац.-2-хлор-3-ГП,4.7,7 - тетраметил-2-эндо-норбопнил )-амино -1,4-нафтохинона, т. пл. 114- 115°С.
Пример II. 4,42 г 2,3-дихлор-1,4-нафтохипона суспендируют в 50 мл абсолютного спирта и прибавляют 6,5 г рац.-2-экзо-1,4,7,7-тетраметилнорборнанамина в 50 мл абсолютного спирта. Затем в течение 3 ч кипятят с обратным холодильником, образуется темно-красный раствор. После выпаривания остаток растворяют в 100 мл хлористого метилена и встряхивают с водой, 3 н. соляной кислотой и опять с водой. Затем органическую фазу высушивают над сульфатом натрия, фильтруют, сгущают, обрабатывают активным углем и выпаривают . Остаток перекристаллизовывают из «-гексана простого петролейного эфира (40- 45°). Таким образом получают 5,30 г рац.-(2экзо-норборнил - (амино)-1,4 - нафтохинона, т. пл. 127-129°С.
Пример 12. 4,54 г 23-дихлор-1,4-нафтохинона суспендируют в 100 мл хлористого метилена и прибавляют при комнатной температуре 4,45 г триэтиламина. Образуется коричневато-зеленая суспензия. К этой суспензии прибавляют 5,564 г рац.-4-пропил-2-экзо-борнанамин-гидрохлорида и реакционную смесь в течение 24 ч кипятят с обратным холодильником . Затем реакционную смесь перерабатывают . Раствор хлористого метилена встряхивают с водой, 1 н. соляной кислотой и опять с водой, высушивают над сульфатом натрия, фильтруют и выпаривают. Остаток перекристаллизовывают из спирта. Получают 6,54 г сырых кристаллов, т. пл. 109- 111°С. Из маточного раствора получают после перекристаллизации из спирта еще 0,72 г продукта, т. пл. 108-110°С. Общий выход рац.-2-хлор-З (4-пропил-2-экзо-борнил) - амино1-1,4-нафтохинона составляет 7,26 г.
Пример 13. 2,27 г 2,3-дихлор-1,4-нафтохинона суспендируют в 50 мл хлористого метилена и прибавляют при комнатной температуре
2,43 г триэтиламипа. К коричневато-зеленой суспензии прибавляют 3,455 г рац.-4-гептил-2экзо-борнанамин-гидрохлорида и смесь в течение 17 ч кипятят с обратным холодильником. Затем реакционную смесь промывают водой,
1 н. соляной кислотой и еще раз водой, высущивают над сульфатом натрия, фильтруют и выпаривают. После кристаллизации из спирта получают 4,07 г рац.-2-хлор-3-(4-гептил-2-экзо-борнил )-амино -1,4-нафтохинона, т. пл. 80-
82°С.
Пример 14. К раствору 2,3 г 2,3-дихлор1 ,4-нафтохинона в 50 мл хлористого метилена прибавляют но капле при температуре обратного холодильника в течение 80 мин 2,3 г рац.4-фенил-2-экзо-борнанамина и 1,38 мл триэтиламина , растворенного в 50 мл хлористого метилена. После 1 ч прибавляют еще раз 0,458 г рац.-4-фенил-2-экзо-борнанамипа. После нагревания в течение 4 ч с обратным холодильником реакционную смесь охлаждают, три раза встряхивают с водой, высущивают над сульфатом натрия и выпаривают в вакууме. Остаток кристаллизуют из простого эфира- гексана. После перекристаллизации из хлористого метилена - гексана получают 3,7 г рац.2-хлор-3- (4-фенил-2-экзо - борнил)-амино-1,4нафтохинона в виде красных кристаллов, т. пл. 121-122°С.
П р и мер 15. К 2,3 г 2,3-дихлор-1,4-нафтохинонавбО мл бензола лрибавляют по капле при 50°С раствор 2,6 г рац.-4-фенэтил-2-экзоборнанамина и 1,38 мл триэтиламина в 50 мл бензола. Затем реакционную смесь перемешивают в течение 24 ч при 60°С прибавляют еще 0,51 г рац.-4-фенэтил-2-экзо-борнанамина и перемешивают 24 ч при 60°С. После этого смесь охлаждают и встряхивают с водой. Фазу бензола выпаривают и остаток кристаллизуют из н-гексана - хлористого метилена. Получают 3,3 г рац.-2-хлор-3-(4-фенэтил-2-экзо-бор«ил (амино)-1,4-пафтохипона в виде красных кристаллов, т. пл. 133-134°С.
Пример 16. К кипящему раствору 2,3 г 2,3-дихлор-1,4-нафтохинона в 50 мл хлористого метилена прибавляют по капле в течение 80 мин раствор 2,7 г рац.-4-(«-нитрофенил)-2экзо-борнанамина и 1,38 мл триэтиламина в 50 мл хлористого метилена. После 3 ч прибавляют еше 0,35 г рац.-4-(п-нитрофенил)-2-экзоборнанамина , растворенного в небольшом количестве хлористого метилепа. Реакционную смесь в течение 72 ч перемешивают с обратным холодильником. Затем четыре раза встряхивают с небольшим количеством воды, высушивают над сульфатом натрия и до начала помутнения прибавляют н-гексан. После кристаллизации из н-гексана - хлористого метилена получают 2,9 г рац.-2-хлор-3-(4-и-нитрофенил-2-экзо-борнил )-амино - 1,4-нафтохинона, т. пл. 180-181°С.
где R - водород, галоген или низшая алкоксигруппа ,
RI - остаток формулы
где R2 - водород, низший алкил, фенил, который может быть замешен, или фенил-низшая алкильная группа, отличающийся тем,что подвергают взаимодействию соединение общей формулы П
где R имеет указанные значения, Кз - отщепляющаяся группа, с амином общей формулы П1
T,
Предмет изобретения
Способ получения производных нафтохинона общей формулы I
где RI имеет указанные значения, 40 ив полученных соединениях формулы I, где остаток R обозначает водород или отличный от хлора галоген, его заменяют хлором € последующим выделением целевого продукта известным способом.




Реферат

Формула


Комментарии