Получение производных гидрокси-бензилбензола - RU2671493C2
Код документа: RU2671493C2
Чертежи

Описание
Область техники, к которой относится изобретение
Настоящее изобретение относится к способу получения промежуточных соединений ингибиторов SGLT2, включая кристаллические формы и способы кристаллизации промежуточных соединений.
Уровень техники
Натрий-зависимые ("активные") котранспортеры глюкозы (SGLT), включая SGLT1: (расположенный преимущественно в щеточной кайме желудочно-кишечного тракта) и SGLT2 (расположенный преимущественно в почечном проксимальном канальце), подвергались интенсивному изучению. В частности, было обнаружено, что SGLT2 отвечает за большую часть повторного всасывания глюкозы в почках. Ингибирование почечного SGLT в настоящее время рассматривают как эффективный подход к лечению гипергликемии за счет увеличения количества глюкозы, выводимой с мочой (Arakawa K, et al., Br J Pharmacol 132: 578-86, 2001; Oku A, et al., Diabetes 48: 1794-1800, 1999). Потенциал данного терапевтического подхода также подтверждается недавно полученными сведениями о том, что мутации SGLT2 гена наблюдаются в случаях наследственной почечной глюкозурии, доброкачественного синдрома, характеризующегося выведением глюкозы с мочой при нормальных уровнях глюкозы в сыворотке и при отсутствии общей дисфункции почек или другого заболевания (Santer R, et al., J Am Soc Nephrol 14: 2873-82, 2003). Таким образом, соединения, которые ингибируют SGLT, в частности SGLT2, являются перспективными кандидатами для применения в качестве противодиабетических средств (как указано в Washburn WN, Expert Opin Ther Patents 19: 1485-99, 2009). Кроме того, поскольку раковые клетки демонстрируют повышенный уровень поглощения глюкозы, по сравнению с нормальными клетками, ингибирование SGLT предлагалось как способ лечения рака посредством истощения раковых клеток. Например, в некоторых исследованиях предполагалось, что SGLT2 участвует в повторном всасывании глюкозы в метастазах рака легких (Ishikawa N, et al., Jpn J Cancer Res 92: 874-9, 2001). Таким образом, ингибиторы SGLT2 также могут быть применяться в качестве противораковых средств.
Помимо фармацевтической активности, другим фактором успешной разработки указанного лекарственного средства являются параметры, связанные с физической природой самого действующего вещества. Некоторыми из таких параметров являются устойчивость действующего вещества в разных условиях окружающей среды, устойчивость действующего вещества при производстве лекарственной формы и устойчивость действующего вещества в конечных лекарственных композициях. Для обеспечения требуемой устойчивости, фармацевтически действующее вещество, используемое в лекарственном средстве, должно быть как можно более чистым, что приводит к устойчивости в процессе длительного хранения в разных условиях окружающей среды.
Соединения, полученные согласно настоящему изобретению, получали ранее способами, описанными в WO 2001/027128, US 2004/0230045, US 2005/0124555, US 2006/0122126, US 2007/0238866, US 2007/0275907, US 2008/0242596, US 2008/0132563, US 2008/0318874, WO 2008/034859, US 2009/0030006, US 2009/0030198, US 2009/0118201, US 2009/0156516, US 2010/0056618, US 2010/0063141 и WO 2010/147430. Другие соединения, полученные способами по настоящему изобретению, которые ранее получали другими способами, можно найти в WO 2005/003196.
Раскрытие изобретения
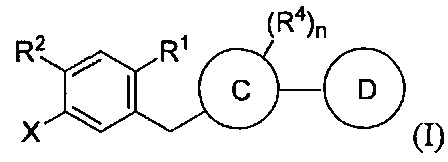
В некоторых вариантах осуществления, в настоящем изобретении описан способ получения соединения формулы I:
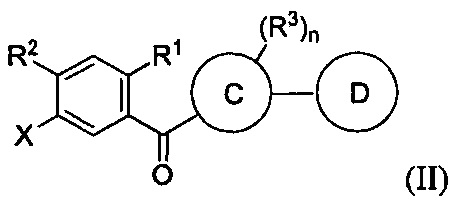
Данный способ включает получение реакционной смеси, содержащей соединение формулы II:
Реакционная смесь также содержит силановый восстановитель, катализатор и растворитель. Реакционная смесь находится в условиях, подходящих для получения соединения формулы I.
Радикал X может представлять собой атом брома или йода. Радикал R1 может представлять собой атом водорода, атом галогена, C1-C3 алкил, C2-C4 алкен, C2-C4 алкин, C3-C6 циклоалкил или -CN. Каждый R2 и R3 может независимо представлять собой атом водорода, атом галогена, гидрокси-группу, C1-C3 алкил, C2-C4 алкенил, C1-C3 алкокси-группу, C1-C3 алкил-гидрокси-группу, C3-C6 циклоалкил, (C1-C3 алкокси)C1-C3 алкил, (C1-C3 галогеналкокси)C1-C3 алкил, (C2-C4 алкенилокси)C1-C3 алкил, (C2-C4 алкинилокси)C1-C3 алкил, (C3-C6 циклоалкокси)C1-C3 алкил, C1-C3 гидроксиалкокси-группу, C3-C6 циклоалкокси-группу, C3-C6 гетероциклоалкокси-группу, (C1-C3 алкокси)C1-C3 алкокси-группу, (C1-C3 галогеналкокси)C1-C3 алкокси-группу, (C2-C4 алкенилокси)C1-C3 алкокси-группу, (C2-C4 алкинилокси)C1-C3 алкокси-группу, (C3-C6 циклоалкокси)C1-C3 алкокси-группу, (C3-C6 гетероциклоалкокси)C1-C3 алкокси-группу, (C3-C6 циклоалкил)C1-C3 алкокси-группу, (C3-C6 циклоалкил)C2-C4 алкенилокси-группу, (C3-C6 циклоалкил)C2-C4 алкинилокси-группу, -C(O)Н, -C(O)ОН или -C(O)O-C1-C3 алкил. По меньшей мере один R3 может представлять собой C1-C3 алкокси-группу, C1-C3 гидроксиалкокси-группу, C3-C6 циклоалкокси-группу, C3-C6 гетероциклоалкокси-группу, (C1-C3 алкокси)C1-C3 алкокси-группу, (C1-C3 галогеналкокси)C1-C3 алкокси-группу, (C2-C4 алкенилокси)C1-C3 алкокси-группу, (C2-C4 алкинилокси)C1-C3 алкокси-группу, (C3-C6 циклоалкокси)C1-C3 алкокси-группу, (C3-C6 гетероциклоалкокси)C1-C3 алкокси-группу, (C3-C6 циклоалкил)C1-C3 алкокси-группу, (C3-C6 циклоалкил)C2-C4 алкенилокси-группу или (C3-C6 циклоалкил)C2-C4 алкинилокси-группу.
Каждый R4 в формуле I может независимо представлять собой атом водорода, атом галогена, -OR4a, C1-C3 алкил, C2-C4 алкенил, C1-C3 алкокси-группу, C1-C3 алкил-гидрокси-группу, C3-C6 циклоалкил, (C1-C3 алкокси)C1-C3 алкил, (C1-C3 галогеналкокси)C1-C3 алкил, (C2-C4 алкенилокси)C1-C3 алкил, (C2-C4 алкинилокси)C1-C3 алкил, (C3-C6 циклоалкокси)C1-C3 алкил, C1-C3 гидроксиалкокси-группу, C3-C6 циклоалкокси-группу, C3-C6 гетероциклоалкокси-группу, (C1-C3 алкокси)C1-C3 алкокси-группу, (C1-C3 галогеналкокси)C1-C3 алкокси-группу, (C2-C4 алкенилокси)C1-C3 алкокси-группу, (C2-C4 алкинилокси)C1-C3 алкокси-группу, (C3-C6 циклоалкокси)C1-C3 алкокси-группу, (C3-C6 гетероциклоалкокси)C1-C3 алкокси-группу, (C3-C6 циклоалкил)C1-C3 алкокси-группу, (C3-C6 циклоалкил)C2-C4 алкенилокси-группу, (C3-C6 циклоалкил)C2-C4 алкинилокси-группу, -C(O)Н, -C(O)ОН или -C(O)O-C1-C3 алкил, где R4a может представлять собой атом водорода или силильную группу. По меньшей мере один R4 в формуле I может представлять собой -OR4a.
Цикл C может представлять собой арил или гетероарил. А цикл D может отсутствовать или представлять собой арил или гетероарил. Подстрочный индекс n может представлять собой целое число от 1 до 4. Алкильные, алкокси-, циклоалкильные, алкенилокси-, алкинилокси-, циклоалкокси-, гидроксиалкокси- или гетероциклоалкокси-группы или их фрагменты в формулах I и II и вышеуказанных радикалах необязательно могут быть частично или полностью фторированными. Один или более атомов водорода в формулах I и II и вышеуказанных радикалах необязательно могут быть замещены на дейтерий.
В некоторых вариантах осуществления, в настоящем изобретении описана кристаллическая форма соединения, имеющего структуру:
В некоторых вариантах осуществления, в настоящем изобретении описана кристаллическая форма изотопно меченого соединения по настоящему изобретению.
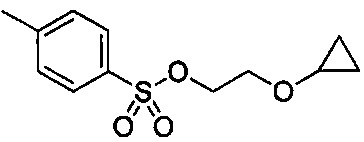
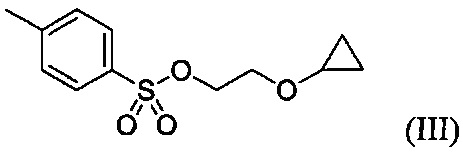
В некоторых вариантах осуществления, в настоящем изобретении описан способ получения соединения формулы III:
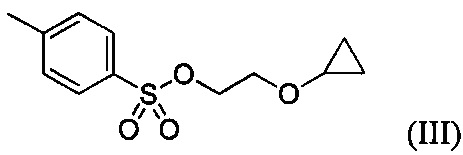
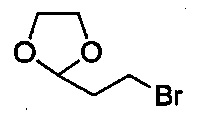
включающий стадию (а) получения первой реакционной смеси, содержащей Mg и соединение, имеющее структуру:
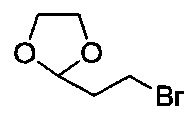
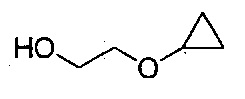
в тетрагидрофурановом растворителе, в условиях, подходящих для получения промежуточного соединения, имеющего структуру:
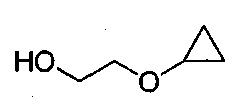
Указанный способ также включает стадию (b) контакта первой реакционной смеси с водой и 2-метилтетрагидрофураном, так что промежуточное соединение со стадии (а) в значительной степени растворяется в 2-метилтетрагидрофуране. Указанный способ также включает стадию (c) получения второй реакционной смеси с 4-метилбензол-1-сульфонилхлоридом (Тозил-Cl) и 2-метилтетрагидрофураном со стадии (b), содержащим промежуточное соединение со стадии (a), в условиях, подходящих для получения соединения формулы III.
В некоторых вариантах осуществления, в настоящем изобретении описан способ получения кристаллической формы соединения, имеющего структуру:
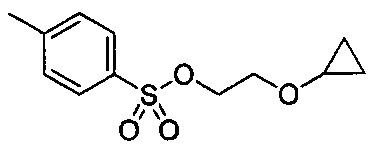
включающий стадию (а) смешивания 2-циклопропоксиэтил-4-метилбензолсульфоната и первого растворителя, который представляет собой полярный протонный растворитель, с образованием раствора, и стадию (b) добавления второго растворителя в полученный раствор с получением смеси, в условиях, подходящих для получения кристаллической формы указанного соединения.
Краткое описание чертежей
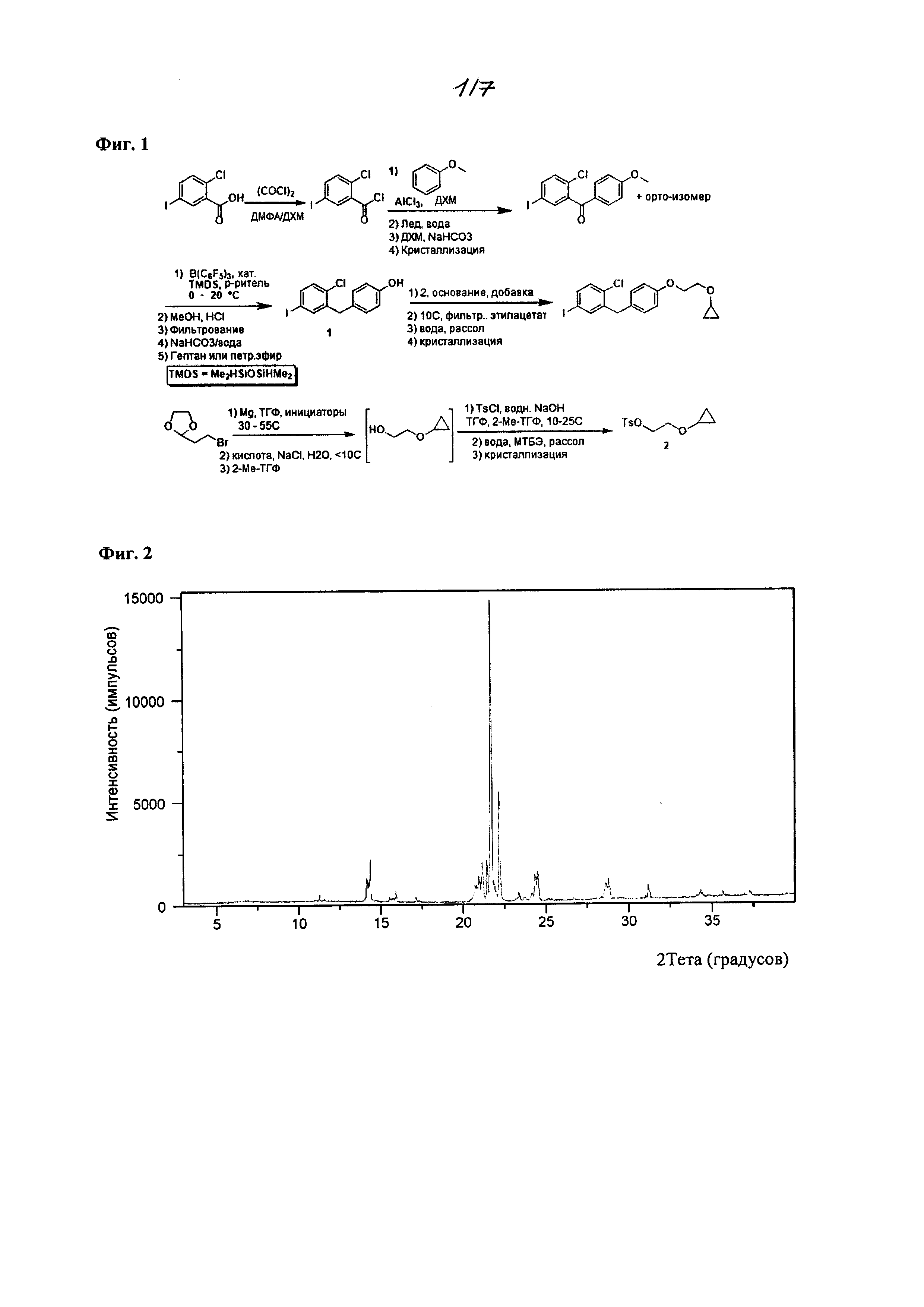
На фиг. 1 изображена схема получения 2-(4-(2-циклопропоксиэтокси)бензил)-1-хлор-4-йодбензола.
На фиг. 2 изображены спектры порошковой рентгеновской дифракции (XRPD) кристаллического 2-циклопропоксиэтил 4-метилбензолсульфоната, полученного из смеси этанол/вода.
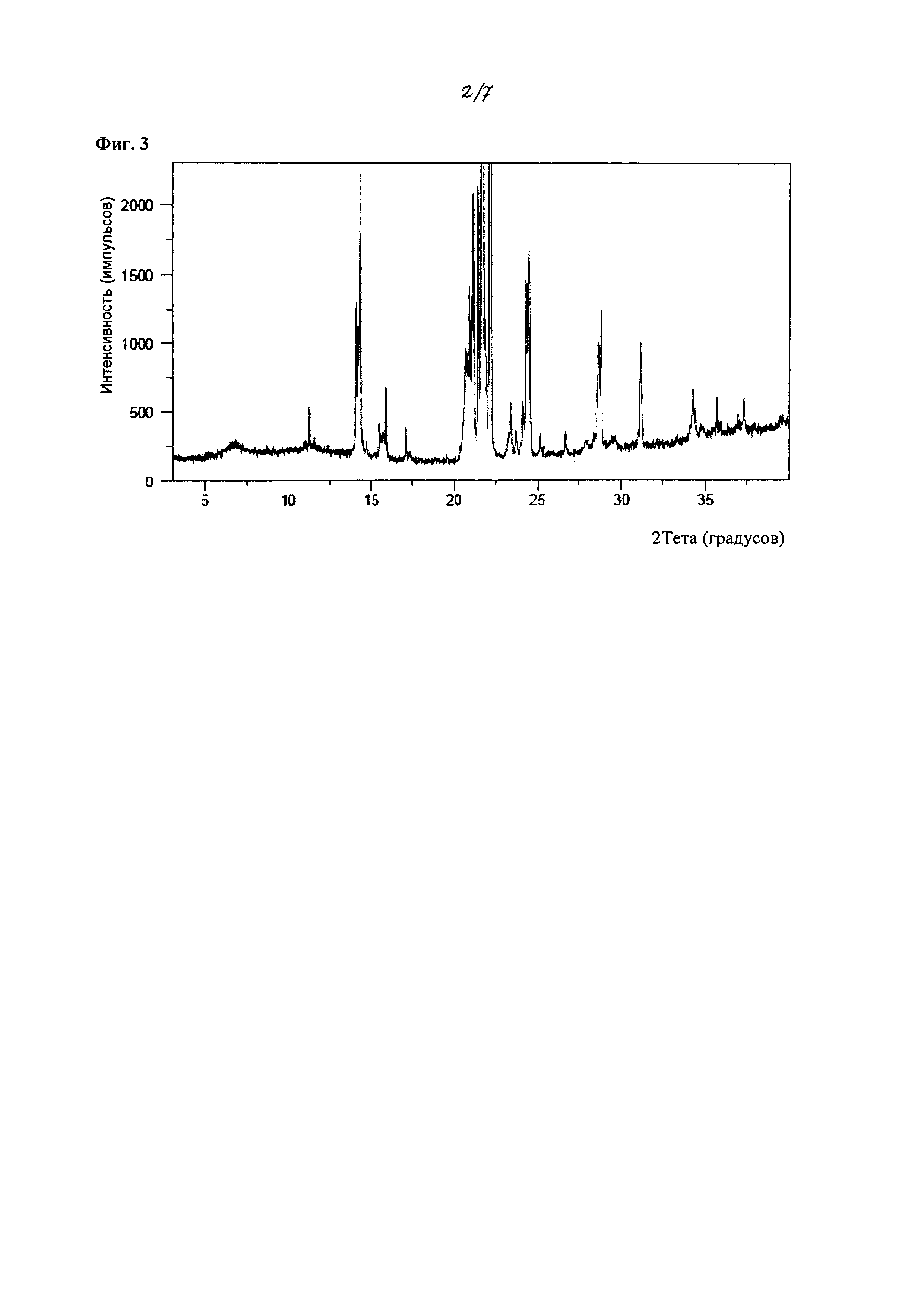
На фиг. 3 изображена расширенная версия XRPD спектров из фиг. 2.
На фиг. 4 приведена таблица XRPD данных для XRPD спектров из фиг. 2 и фиг. 3
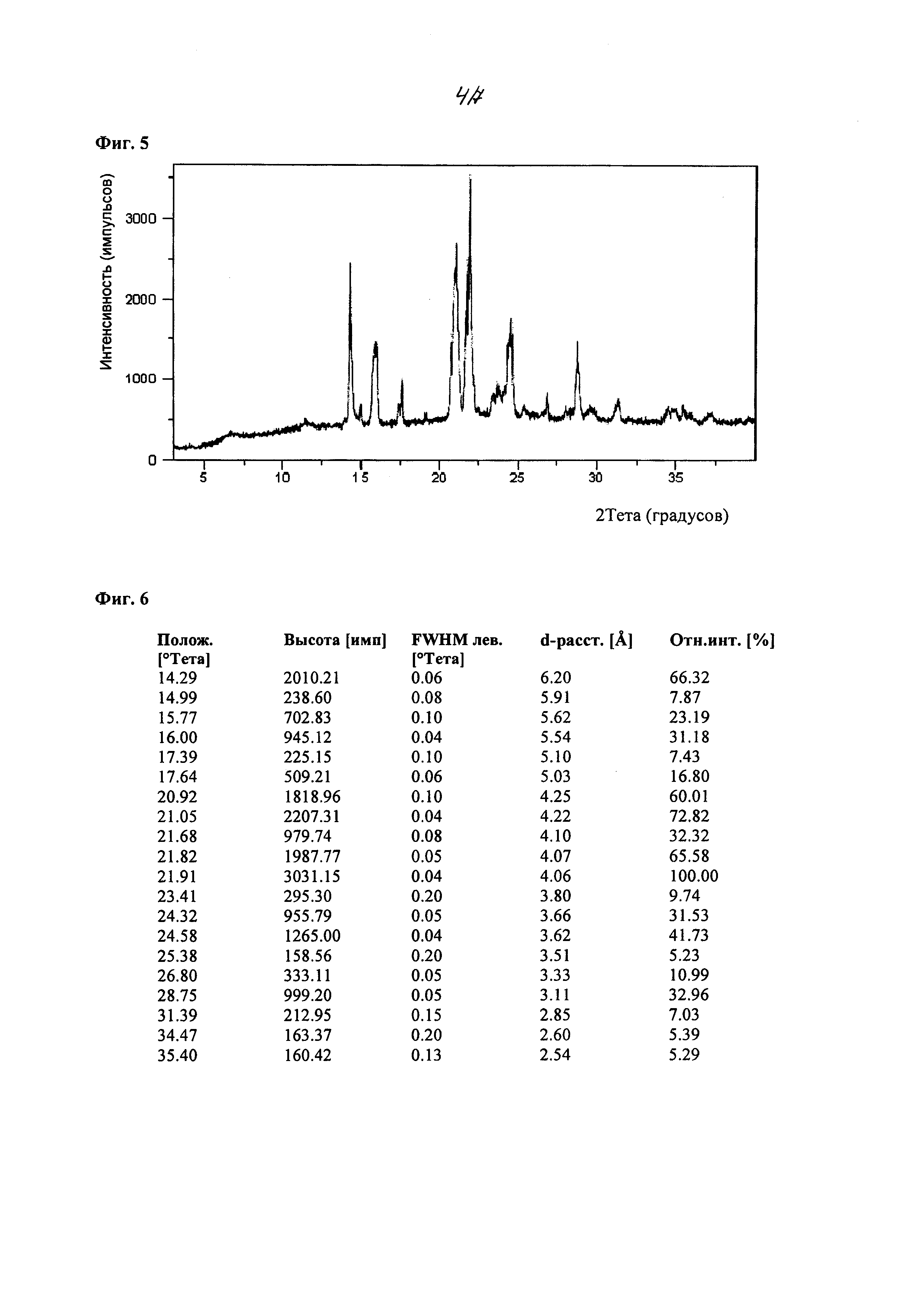
На фиг. 5 изображен спектр порошковой рентгеновской дифракции (XRPD) кристаллического 2-циклопропоксиэтил 4-метилбензолсульфоната, полученного из смеси метанол/гептан.
На фиг. 6 приведена таблица XRPD данных для XRPD спектров из фиг. 5.
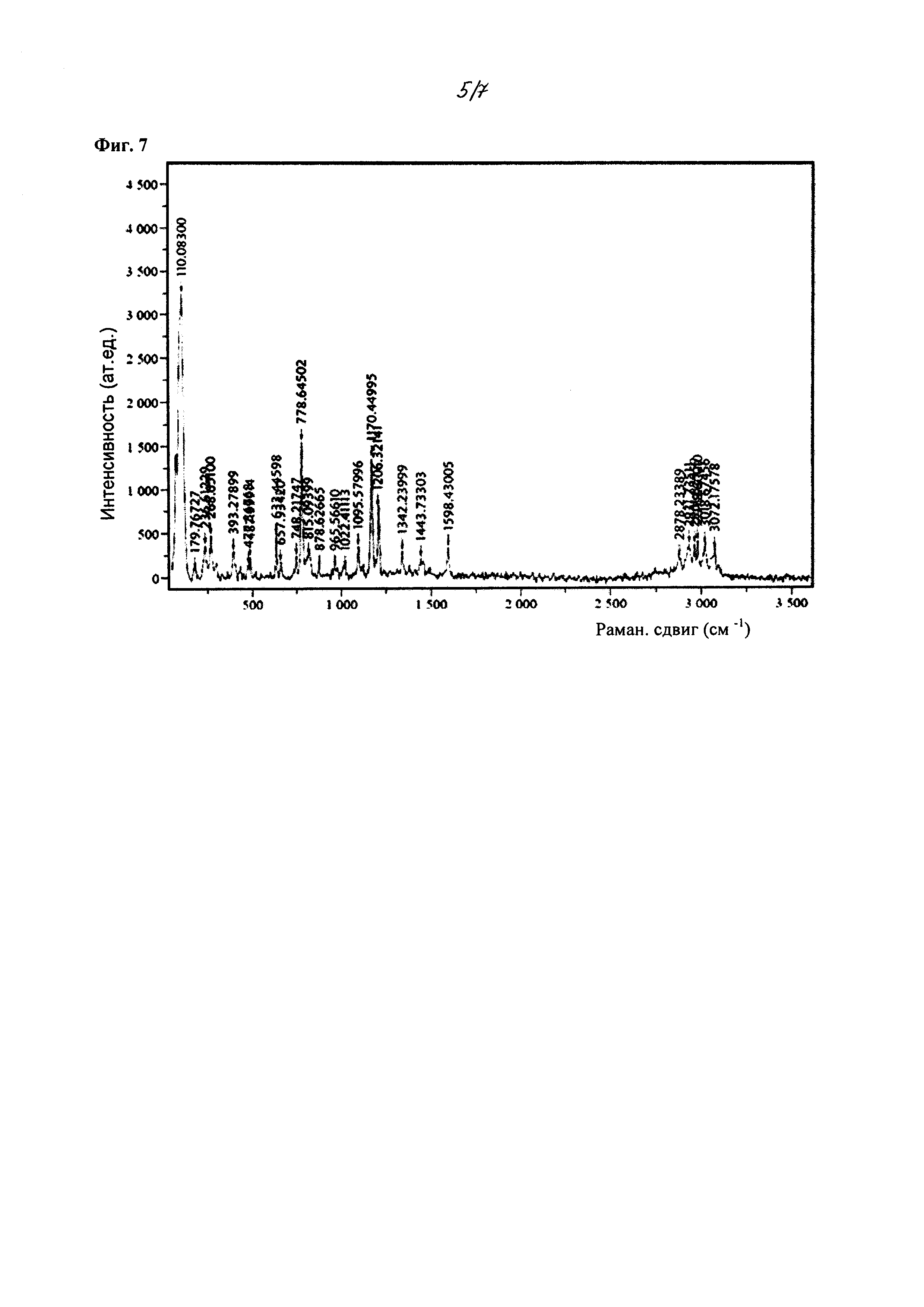
На фиг. 7 изображены спектры рамановской спектроскопии для кристаллического 2-циклопропоксиэтил 4-метилбензолсульфоната, полученного из смеси метанол/гептан.
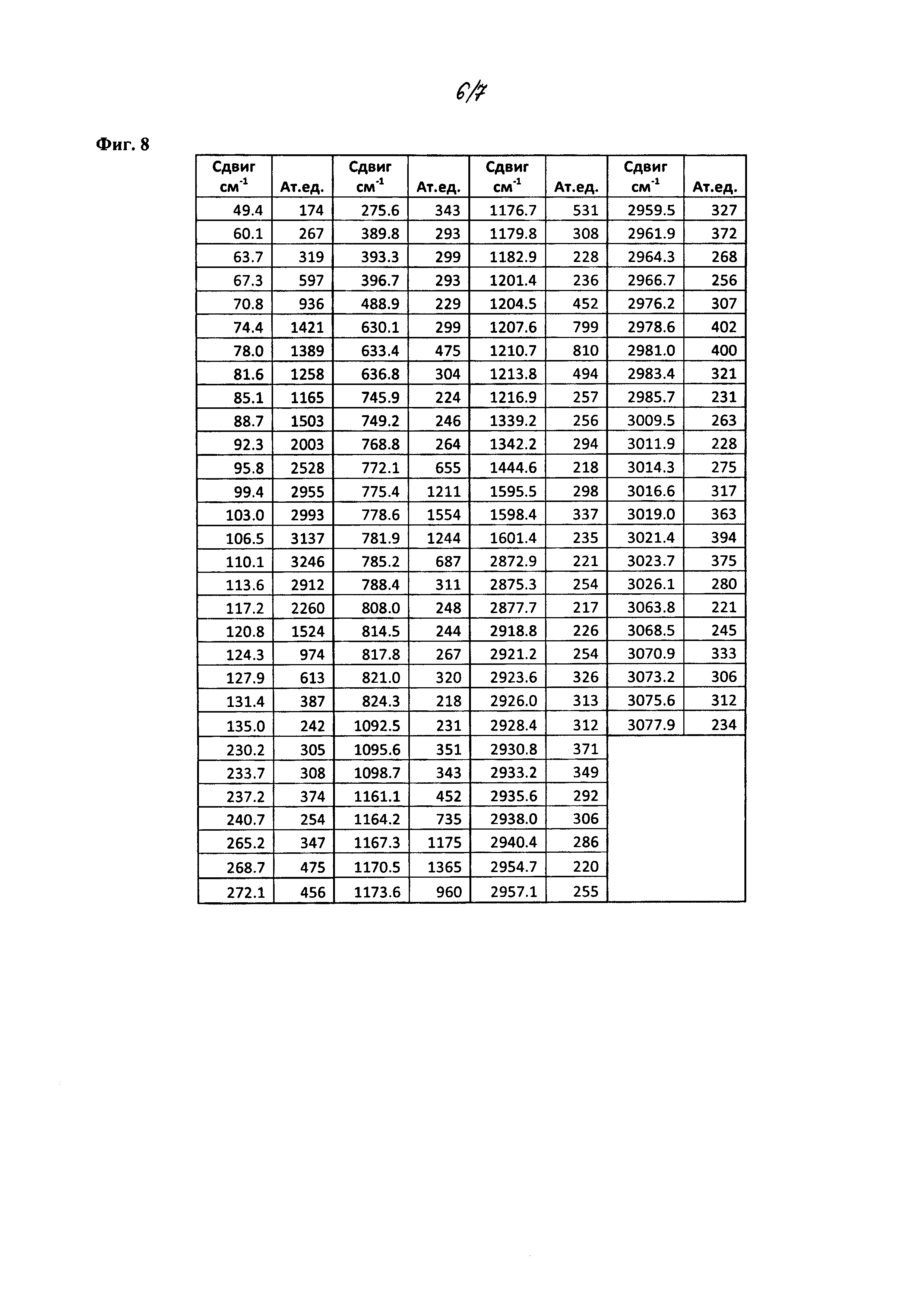
На фиг. 8 приведен список пиков рамановского спектра из фиг. 7.
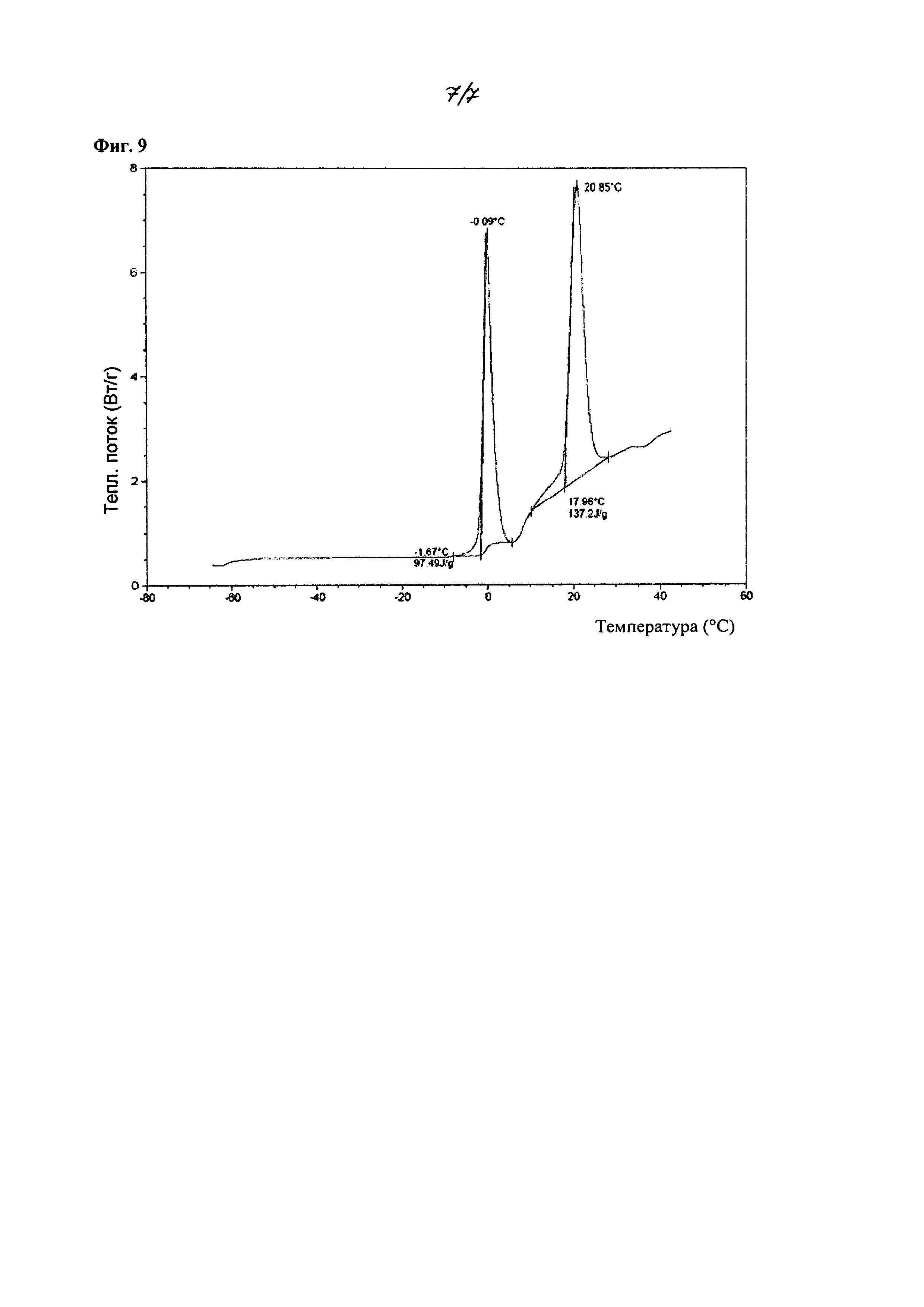
На фиг. 9 изображена диаграмма дифференциальной сканирующей калориметрии (ДСК) для кристаллического 2-циклопропоксиэтил 4-метилбензолсульфоната, полученного из смеси метанол/гептан. Пик при -0,09°C обусловлен плавлением льда, применяемого для охлаждения образца.
Подробное описание изобретения
I. Общие положения
В настоящем изобретении описаны способы получения промежуточных соединений для получения ингибиторов натрий-зависимых котранспортеров глюкозы SGLT. Некоторые соединения можно получать с высоким выходом и степенью чистоты путем одновременного восстановления бензофенонкетона и деалкилирования метоксифенильной группы с помощью борного катализатора и тетраметилдисилоксана в толуоле. Другие промежуточные соединения можно получать с применением реакции Барбье - магний-катализируемого внутримолекулярного раскрытия цикла/циклизации, где продукт выделяют с помощью 2-метилтетрагидрофурана, который применяют в качестве растворителя в последующей стадии без упаривания, получая продукт высокой чистоты и с высоким выходом. Наконец, в настоящем изобретении также описано кристаллическое соединение и способы получения данного кристаллического соединения.
II. Определения
Термин "получение реакционной смеси" означает процесс введения в контакт по меньшей мере двух разных веществ, так что они смешиваются и могут реагировать друг с другом. Однако, необходимо учитывать, что финальный продукт реакции может образовываться при реакции непосредственно добавляемых реагентов или из промежуточного вещества, которое может образоваться в реакционной смеси из одного или более добавляемых реагентов.
Термин "силановый восстановитель" означает средство, применяемое на стадии восстановлении кетона и/или на стадии деалкилирования, которое содержит силан-функциональную группу "R3Si-H". Примеры силановых восстановителей включают (но не: ограничены только ими) тетраметилдисилоксан (TMDS), пентаметилдисилоксан (PMDS), полиметилгидросилоксан (PMHS) и Et3SiH. В способах по настоящему изобретению могут применяться другие силановые восстановители.
Термин "катализатор" означает средство, которое повышает скорость химической реакции, но само не расходуется в ходе реакции. Катализаторы по настоящему изобретению способны катализировать восстановление кетона и восстанавливать -OR группу до -OH. Применяемые в настоящем изобретении катализаторы включают катализаторы, представляющие собой кислоты Льюиса, содержащие, среди прочих, алюминий, бор, кремний, олово, титан, цирконий, железо, медь или цинк. Примеры катализаторов включают (но не ограничены только ими) B(C6Fs)3, BF3-Et2O, BF3-THF, BF3-Bu2O, BF3-MeCN, BF3AcOH, BF3H3PO4, BF3, AlCl3 и триметилсилил трифторметансульфонат (TMSOTf). В способах по настоящему изобретению могут применяться другие катализаторы.
Термин "растворитель" означает вещество, такое как жидкость, способное растворять растворенный компонент. Растворители могут быть полярными и неполярными, протонными и апротонными. Полярные растворители обычно имеют диэлектрическую постоянную больше примерно 5, или дипольный момент больше примерно 1,0, а неполярные растворители имеют диэлектрическую постоянную меньше примерно 5 или дипольный момент меньше примерно 1,0. Протонные растворители характеризуются наличием протона, доступного для удаления, например вследствие наличия гидроксильной или карбоксильной группы. Апротонные растворители не имеют такой группы. Примеры полярных протонных растворителей включают спирты (метанол, этанол, пропанол, изопропанол и т.д.), кислоты (муравьиная кислоты, уксусная кислота и т.д.) и воду. Примеры полярных апротонных растворителей включают дихлорметан, хлороформ, тетрагидрофуран, диэтиловый эфир, ацетон, этилацетат, диметилформамид, ацетонитрил и диметилсульфоксид. Примеры неполярных растворителей включают алканы (пентаны, гексаны и т.д.), циклоалканы (циклопентан, циклогексан и т.д.), бензол, толуол и 1,4-диоксан. В способах по настоящему изобретению могут применяться другие растворители.
Термин "алкил" отдельно или в комбинации означает одновалентный насыщенный алифатический углеводородный радикал, содержащий указанное количество атомов углерода. Данный радикал может иметь линейную или разветвленную цепь и, если указано, опционально замещен одним-тремя подходящими заместителями, как указано ниже. Иллюстративные примеры алкильных групп включают (но не ограничены только ими) метил, этил, н-пропил, н-бутил, н-пентил, н-гексил, изопропил, изобутил, изопентил, амил, втор-бутил, трет-бутил, трет-пентил, н-гептил, н-октил, н-нонил, н-децил, н-додецил, н-тетрадецил, н-гексадецил, н-октадецил, н-эйкозил и тому подобные. Предпочтительные алкильные группы включают метил, этил, н-пропил и изопропил. Предпочтительные опциональные подходящие заместители включают атом галогена, метокси-группу, этокси-группу, циано-группу, нитро-группу и амино-группу.
Термин "алкокси" и "алкилокси" отдельно или в комбинации означают алифатический радикал вида алкил-O-, где алкил соответствует данному выше определению. Иллюстративные примеры алкокси-групп включают (но не ограничены только ими) метокси-группу, этокси-группу, пропокси-группу, изопропокси-группу, бутокси-группу, изобутокси-группу, трет-бутокси-группу, пентокси-группу, изопентокси-группу, неопентокси-группу, трет-пентокси-группу, гексокси-группу, изогексокси-группу, гептокси-группу, октокси-группу и тому подобные. Предпочтительные алкокси-группы включают метокси-группу и этокси-группу.
Термин "алкенил" отдельно или в комбинации означает одновалентный алифатический углеводородный радикал, содержащий указанное количество атомов углерода и по меньшей мере одну углерод-углеродную двойную связь. Данный радикал может иметь линейную или разветвленную цепь, E или Z форму, и, если указано, опционально замещен одним-тремя подходящими заместителями, как указано ниже. Иллюстративные примеры алкенильных групп включают (но не ограничены только ими) винил, 1-пропенил, 2-пропенил, изопропенил, 1-бутенил, 2-бутенил, изобутенил, 2-метил-1-пропенил, 1-пентенил, 2-пентенил, 4-метил-2-пентенил, 1,3-пентадиенил, 2,4-пентадиенил, 1,3-бутадиенил и тому подобные. Предпочтительные алкенильные группы включают винил, 1-пропенил и 2-пропенил. Предпочтительные опциональные подходящие заместители включают атом галогена, метокси-группу, этокси-группу, циано-группу, нитро-группу и амино-группу.
Термин "алкенилокси" отдельно или в комбинации означает алифатический радикал вида алкенил-О- где алкенил соответствует данному выше определению. Иллюстративные примеры алкенилокси-групп включают (но не ограничены только ими) винилокси-группу, 1-пропенилокси-группу, 2-пропенилокси-группу, изопропенилокси-группу, 1-бутенилокси-группу, 2-бутенилокси-группу, 3-бутенилокси-группу, 1-изобутенилокси-группу, 2-изобутенилокси-группу, 1-пентенилокси-группу, 2-пентенилокси-группу, 3-пентенилокси-группу, 4-пентенилокси-группу и тому подобные.
Термин "алкинил" отдельно или в комбинации означает одновалентный алифатический углеводородный радикал, содержащий указанное количество атомов углерода и по меньшей мере одну углерод-углеродную тройную связь. Данный радикал может иметь линейную или разветвленную цепь и, если указано, опционально замещен одним-тремя подходящими заместителями, как указано ниже. Иллюстративные примеры алкинильных групп включают (но не ограничены только ими) этинил, 1-пропинил, 2-пропинил, 1-бутинил, 2-бутинил, 1-пентинил, 2-пентинил, 3-метил-1-пентинил, 3-пентинил, 1-гексинил, 2-гексинил, 3-гексинил и тому подобные. Предпочтительные алкинильные группы включают этинил, 1-пропинил и 2-пропинил. Предпочтительные опциональные подходящие заместители включают атом галогена, метокси-группу, этокси-группу, циано-группу, нитро-группу и амино-группу.
Термин "алкинилокси" отдельно или в комбинации означает алифатический радикал вида алкинил-O- где алкинил соответствует данному выше определению. Иллюстративные примеры алкинилокси-групп включают (но не ограничены только ими) этинилокси-группу, 1-пропинилокси-группу, 2-пропинил окси-группу, 1-бутинилокси-группу, 2-бутинилокси-группу, 3-бутинилокси-группу, 1-пентинилокси-группу, 2-пентинил окси-группу, 3-пентинил окси-группу, 4-пентинил окси-группу, 1-гексинил окси-группу, 2-гексинилокси-группу, 3-гексинилокси-грутшу и тому подобные.
Термин "атом галогена" означает одновалентный галогеновый радикал или атом, выбранный из атомов фтора, хлора, брома и йода. Предпочтительные галогеновые группы представляют собой атом фтора, хлора и брома.
Термин "галогеналкил" означает описанный выше алкильный радикал, замещенный одним или более атомами галогена. Иллюстративные примеры галогеналкильных групп включают (но не ограничены только ими) хлорметил, дихлорметил, фторметил, дифторметил, трифторметил, 2,2,2-трихлорэтил и тому подобные.
Термин "галогеналкокси" означает описанный выше алкокси-радикал, замещенный одним или более атомами галогена. Иллюстративные примеры галогеналкокси-групп включают (но не ограничены только ими) трифторметокси-группу, дифторметокси-группу и тому подобные.
Термин "гидрокси" означает группу "-OH".
Термин "алкилгидрокси" обозначает описанную выше алкильную группу, в которой по меньшей мере один из атомов водорода замещен на гидрокси-группу. Что касается алкильной группы, алкилгидрокси-группы могут содержать любое подходящее количество атомов углерода, такое как C1-6. Примеры алкилгидрокси-групп включают (но не ограничены только ими) гидроксиметил, гидроксиэтил (где гидрокси-группа находится в положении 1 или 2), гидроксипропил (где гидрокси-группа находится в положении 1, 2 или 3), гидроксибутил (где гидрокси-группа находится в положении 1, 2, 3 или 4), гидроксипентил (где гидрокси-группа находится в положении 1, 2, 3, 4 или 5), гидроксигексил (где гидрокси-группа находится в положении 1, 2, 3, 4, 5 или 6), 1,2-дигидроксиэтил и тому подобные.
Термин "гидроксиалкокси" и "гидроксиалкилокси" отдельно или в комбинации означает алифатический радикал вида HO-алкокси-, где алкокси соответствует данному выше определению. Иллюстративные примеры гидроксиалкокси-групп включают (но не ограничены только ими) гидроксиметокси-группу, гидроксиэтокси-группу, гидроксиэтокси-группу, гидроксипропокси-группу, гидроксиизопропокси-группу, гидроксибутокси-группу, гидроксиизобутокси-группу, гидрокси-трет-бутокси-группу, гидроксипентокси-группу, гидроксиизопентокси-группу, гидроксигексокси-группу, гидроксиизогексокси-группу, гидроксигептокси-группу, гидроксиоктокси-группу и тому подобные.
Термин "циклоалкил" отдельно или в комбинации означает одновалентный алициклический насыщенный углеводородный радикал, содержащий три или более атомов углерода, образующих карбоциклический цикл, и, если указано, опционально замещенный одним-тремя подходящими заместителями, как указано ниже. Иллюстративные примеры циклоалкильных групп включают (но не ограничены только ими) циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклононил и тому подобные. Предпочтительные опциональные подходящие заместители: включают атом галогена, метил, этил, метокси-группу, этокси-группу, циано-группу, нитро-группу и амино-группу.
Термин "циклоалкокси" отдельно или в комбинации означает алифатический радикал вида циклоалкил-O- где циклоалкил соответствует данному выше определению. Иллюстративные примеры циклоалкокси-групп включают (но не ограничены только ими) циклопропокси-группу, циклобутокси-группу и циклопентокси-группу.
Термин "гетероциклоалкил" отдельно или в комбинации означает описанную выше циклоалкильную группу, в которой один или более атомов углерода в цикле замещены на гетероатом, выбранный из N, S и О. Иллюстративные примеры гетероциклоалкильных групп включают (но не ограничены только ими) пирролидинил, тетрагидрофуранил, пиперазинил, тетрагидропиранил и тому подобные.
Термин "гетероциклоалкокси" отдельно или в комбинации означает алифатический радикал вида гетероциклоалкил-O-, где гетероциклоалкил соответствует данному выше определению. Иллюстративные примеры гетероциклоалкокси-групп включают (но не ограничены только ими) тетрагидрофуранокси-группу, пирролидинокси-группу и тетрагидротиофенокси-группу.
Термин "арил" означает моноциклическую или конденсированную бициклическую, трициклическую или с еще большим количеством циклов, ароматическую циклическую систему, содержащую 6-16 атомов углерода в цикле. Например, арил может представлять собой фенил, бензил или нафтил, предпочтительно фенил. Термин "арилен" означает двухвалентный радикал, полученный из арильной группы. Арильные группы могут быть моно-, ди- или три-замещенными одним, двумя или тремя радикалами, выбранными из алкила, алкокси-группы, арила, гидрокси-группы, атома галогена, циано-группы, амино-группы, амино-алкила, трифторметила, алкилендиокси-группы и окси-C2-C3-алкилена; каждый из которых также необязательно замещен описанными ниже заместителями; или 1- или 2-нафтил; или 1- или 2-фенантренил. Алкилендиокси-группа представляет собой двухвалентный заместитель, присоединенный к двум соседним атомам углерода в фениле, например, метилендиокси-группа или этилендиокси-группа. Окси-C2-C3-алкилен также представляет собой: двухвалентный заместитель, присоединенный к двум соседним атомам углерода в фениле, например, оксиэтилен или оксипропилен. Примером окси- C2-C3-алкилен-фенила является 2,3-дигидробензофуран-5-ил.
Предпочтительным арилом является нафтил, фенил или фенил, моно- или дизамещенный алкокси-группой, фенилом, атомом галогена, алкилом или трифторметилом, особенно фенил или фенил, моно- или дизамещенный алкокси-группой, атомом галогена или трифторметилом, и в частности фенил.
Термин "гетероарил" означает моноциклическую или конденсированную бициклическую или трициклическую ароматическую циклическую систему, содержащую 5-16 атомов в цикле, где 1-4 атомов в цикле представляют собой гетероатом N, O или S. Например, гетероарил включает пиридил, индолил, индазолил, хиноксалинил, хинолинил, изохинолинил, бензотиенил, бензофуранил, фуранил, пирролил, тиазолил, бензотиазолил, оксазолил, изоксазолил, триазолил, тетразолил, пиразолил, имидазолил, тиенил или любые другие радикалы, замещенные, особенно моно- или дизамещенные, например, алкил, нитро-группой или атомом галогена. Пиридил представляет собой 2-, 3- или 4-пиридил, преимущественно 2- или 3-пиридил. Тиенил представляет собой 2- или 3-тиенил. Хинолинил представляет собой предпочтительно 2-, 3- или 4-хинолинил. Изохинолинил представляет собой предпочтительно 1-, 3- или 4-изохинолинил. Бензопиранил, бензотиопиранил представляет собой предпочтительно 3-бензопиранил или 3-бензотиопиранил, соответственно. Тиазолил представляет собой предпочтительно 2- или 4-тиазолил, и наиболее предпочтительно 4-тиазолил. Триазолил представляет собой предпочтительно 1-, 2- или 5-(1,2,4-триазолил). Тетразолил представляет собой предпочтительно 5-тетразолил.
Предпочтительно, гетероарил представляет собой пиридил, индолил, хинолинил, пирролил, тиазолил, изоксазолил, триазолил, тетразолил, пиразолил, имидазолил, тиенил, фуранил, бензотиазолил, бензофуранил, изохинолинил, бензотиенил, оксазолил, индазолил или любые замещенные перечисленные радикалы, в особенности моно- или дизамещенные.
Термин "силильная группа" означает силильную группу формулы -Si(R)3, где каждый R может представлять собой любую подходящую группу, такую как (но не ограничиваясь только ими) атом водорода, алкил, алкенил, алкинил, арил и -OSi(R')3, где каждый R' может представлять собой любую подходящую группу, такую как (но не ограничиваясь только ими) атом водорода, алкил, алкенил, алкинил, арил или по лисил океан. Примеры силильных групп включают (но не ограничены только ими) диметилсилан, диэтилсилан, триметилсилил, триэтилсилил, третбутилдиметилсилил, тетраметилдисилоксил (-Si(Me)2OSi(Me)2H), пентаметилдисилоксил (-Si(Me)2OSi(Me)3) и полиметилгидросилоксил (-(Me)(H)Si-O-)x-).
Термин "кислота" означает соединение, способное быть донором протона (H+) согласно определению Бренстеда-Лоури, или являющееся акцептором электронной пары согласно определению Льюиса. Кислоты, которые могут применяться по настоящему изобретению, представляют собой кислоты Бренстеда-Лоури, которые включают (но не ограничены только ими) алкановые кислоты или карбоновые кислоты (муравьиная кислота, уксусная кислота, лимонная кислота, молочная кислота, щавелевая кислота и т.д.), сульфокислоты и минеральные кислоты, определение которых дано в настоящем тексте. Минеральные кислоты представляют собой неорганические кислоты, такие как гидрогалогениды (фтористоводородная кислота, соляная кислота, бромоводородная кислота и т.д.), галоген-содержащие оксокислоты (гипохлорная кислота, перхлорная кислота и т.д.), а также серную кислоту, азотную кислоту, фосфорную кислоту, хромовую кислоту и борную кислоту. Сульфокислоты включают, среди прочих, метансульфокислоту, бензолсульфокислоту, п-толуолсульфокислоту, трифторметансульфокислоту.
Термин "подходящий заместитель" означает химически и фармацевтически приемлемую группу, т.е. фрагмент, который практически не участвует в получении или не снижает активность соединения по настоящему изобретению. Такие подходящие заместители могут быть обычным образом подобраны квалифицированным специалистом в данной области. Подходящие заместители могут быть выбраны из группы, состоящей из атома галогена, C1-C6 алкила, C2-C6 алкенила, C1-C6 галогеналкила, C1-C6 алкокси-группы, C1-C6 галогеналкокси-группы, C2-C6 алкинила, C3-C8 циклоалкенила, (C3-C8 циклоалкил)C1-C6 алкила, (C3-C8 циклоалкил)C2-C6 алкенила, (C3-C8 циклоалкил)C1-C6 алкокси-группы, С3-С7 гетероциклоалкила, (С3-С7 гетероциклоалкил)C1-C6 алкила, (С3-С7 гетероциклоалкил)C2-C6 алкенила, (С3-С7 гетероциклоалкил)C1-C6 алкокси-группы, гидрокси-группы, карбокси-группы, оксо-группы, сульфанила, C1-C6 алкилсульфанила, арила, гетероарила, арилокси-группы, гетероарилокси-группы, аралкила, гетероаралкила, аралкокси-группы, гетероаралкокси-группы, нитро-группы, циано-группы, амино-группы, C1-C6 алкиламино-группы, ди-(C1-C6 алкил)амино-группы, карбамоила, (C1-C6 алкил)карбонила, (C1-C6 алкокси)карбонила, (C1-C6 алкил)аминокарбонила, ди-(C1-C6 алкил)аминокарбонила, арилкарбонила, арилоксикарбонила, (C1-C6 алкил)сульфонила и арилсульфонила. Перечисленные выше в качестве подходящих заместителей группы соответствуют приведенным далее в тексте определениям, за исключением того, что подходящий заместитель не может быть опционально дополнительно замещен.
Термин "фторированный" означает описанный выше радикал, в котором по меньшей мере один атом водорода замещен на атом фтора. Когда все доступные атомы водорода замещены на атомы фтора, данную группу называют "перфторированной" или "перфтор", как, например, "перфторалкил", "перфторметил" или "перфторфенил".
Термин "в значительной степени растворенный" означает соединение, продукт или растворенное соединение, растворенные в растворителе, где большая часть растворенного соединения растворена в растворителе. Например, в растворителе может быть растворено по меньшей мере около 75, 80, 85, 90, 95% или 99% растворенного соединения.
III. Способы одновременного восстановления
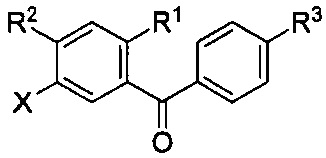
В настоящем изобретении описан способ получения соединений одновременным восстановлением кетона и деалкилированием -OR группы до -OH. В некоторых вариантах осуществления, в настоящем изобретении описан способ получения соединения формулы I:
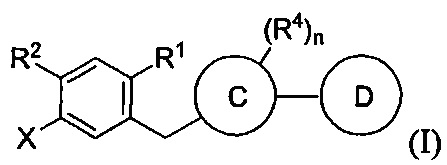
Данный способ включает получение реакционной смеси, содержащей соединение формулы II:
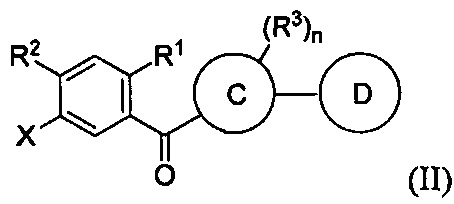
Данная реакционная смесь также содержит силановый восстановитель, катализатор и растворитель. Указанная реакционная смесь находится в условиях, подходящих для получения соединения формулы I.
Радикал X может представлять собой атом брома или йода. Радикал R1 может представлять собой атом водорода, атом галогена, C1-C3 алкил, C2-C4 алкен, C2-C4 алкин, C3-C6 циклоалкил или -CN. Каждый R2 и R3 может независимо представлять собой атом водорода, атом галогена, гидрокси-группу, C1-C3 алкил, C2-C4 алкенил, C1-C3 алкокси-группу, C1-C3 алкил-гидрокси-группу, C3-C6 циклоалкил, (C1-C3 алкокси)C1-C3 алкил, (C1-C3 галогеналкокси)C1-C3 алкил, (C2-C4 алкенилокси)C1-C3 алкил, (C2-C4 алкинилокси)C1-C3 алкил, (C3-C6 циклоалкокси)C1-C3 алкил, C1-C3 гидроксиалкокси-группу, C3-C6 циклоалкокси-группу, C3-C6 гетероциклоалкокси-группу, (C1-C3 алкокси)C1-C3 алкокси-группу, (C1-C3 галогеналкокси)C1-C3 алкокси-группу, (C2-C4 алкенилокси)C1-C3 алкокси-группу, (C2-C4 алкинилокси)C1-C3 алкокси-группу, (C3-C6 циклоалкокси)C1-C3 алкокси-группу, (C3-C6 гетероциклоалкокси)C1-C3 алкокси-группу, (C3-C6 циклоалкил)C1-C3 алкокси-группу, (C3-C6 циклоалкил)C2-C4 алкенилокси-группу, (C3-C6 циклоалкил)C2-C4 алкинилокси-группу, -C(O)Н, -C(O)ОН или -C(O)O-C1-C3 алкил. По меньшей мере один R3 может представлять собой C1-C3 алкокси-группу, C1-C3 гидроксиалкокси-группу, C3-C6 циклоалкокси-группу, C3-C6 гетероциклоалкокси-группу, (C1-C3 алкокси)C1-C3 алкокси-группу, (C1-C3 галогеналкокси)C1-C3 алкокси-группу, (C2-C4 алкенилокси)C1-C3 алкокси-группу, (C2-C4 алкинилокси)C1-C3 алкокси-группу, (C3-C6 циклоалкокси)C1-C3 алкокси-группу, (C3-C6 гетероциклоалкокси)C1-C3 алкокси-группу, (C3-C6 циклоалкил)C1-C3 алкокси-группу, (C3-C6 циклоалкил)C2-C4 алкенилокси-группу или (C3-C6 циклоалкил)C2-C4 алкинилокси-группу.
Каждый R4 в формуле I может независимо представлять собой атом водорода, атом галогена, -OR4a, C1-C3 алкил, C2-C4 алкенил, C1-C3 алкокси-группу, C1-C3 алкил-гидрокси-группу, C3-C6 циклоалкил, (C1-C3 алкокси)C1-C3 алкил, (C1-C3 галогеналкокси)C1-C3 алкил, (C2-C4 алкенилокси)C1-C3 алкил, (C2-C4 алкинилокси)C1-C3 алкил, (C3-C6 циклоалкокси)C1-C3 алкил, C1-C3 гидроксиалкокси-группу, C3-C6 циклоалкокси-группу, C3-C6 гетероциклоалкокси-группу, (C1-C3 алкокси)C1-C3 алкокси-группу, (C1-C3 галогеналкокси)C1-C3 алкокси-группу, (C2-C4 алкенилокси)C1-C3 алкокси-группу, (C2-C4 алкинилокси)C1-C3 алкокси-группу, (C3-C6 циклоалкокси)C1-C3 алкокси-группу, (C3-C6 гетероциклоалкокси)C1-C3 алкокси-группу, (C3-C6 циклоалкил)C1-C3 алкокси-группу, (C3-C6 циклоалкил)C2-C4 алкенилокси-группу, (C3-C6 циклоалкил)C2-C4 алкинилокси-группу, -C(O)Н, -C(O)ОН или -C(O)O-C1-C3 алкил, где R4a Может представлять собой атом водорода или силильную группу. По меньшей мере один R4 в формуле I может представлять собой -OR4a.
Цикл C может представлять собой арил или гетероарил. A цикл D может отсутствовать или представлять собой арил или гетероарил. Подстрочный индекс n может представлять собой целое число от 1 до 4. Алкильные, алкокси-, циклоалкильные, алкенилокси-, алкинилокси-, циклоалкокси-, гидроксиалкокси- или гетероциклоалкокси-группы или их фрагменты в формулах I и II и вышеуказанных радикалах необязательно могут быть частично или полностью фторированными. Один или более атомов водорода в формулах I и II и вышеуказанных радикалах могут быть необязательно замещены на дейтерий.
В некоторых вариантах осуществления, соединение формулы I может иметь структуру формулы Ia:
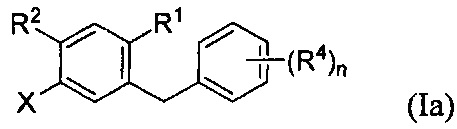
и соединение формулы II может иметь структуру формулы IIa:
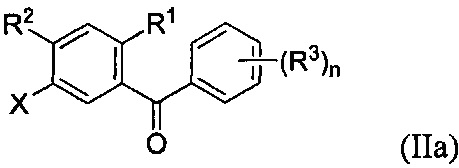
В некоторых вариантах осуществления, соединение формулы Ia может иметь структуру:
и соединение формулы IIa может иметь структуру:
Радикал X в формуле I может представлять собой атом брома или йода. В некоторых вариантах осуществления, X может представлять собой атом йода.
R1 в формуле I может представлять собой любую подходящую группу. В некоторых вариантах осуществления, R1 может представлять собой атом водорода, атом галогена, C1-C3 алкил, C2-C4 алкен, C2-C4 алкин, C3-C6 циклоалкил или -CN. R1 также может представлять собой атом галогена или C1-C3 алкил. В некоторых вариантах осуществления, R1 может представлять атом галогена. Когда R1 представляет собой атом галогена, R1 может представлять собой атом фтора, хлора, брома или йода. В некоторых вариантах осуществления, R1 может представлять собой атом хлора.
Радикал R2 может представлять собой атом водорода, атом галогена, гидрокси-группу, C1-C3 алкил, C2-C4 алкенил, C1-C3 алкокси-группу, C1-C3 алкил-гидрокси-группу, C3-C6 циклоалкил, (C1-C3 алкокси)C1-C3 алкил, (C1-C3 галогеналкокси)C1-C3 алкил, (C2-C4 алкенилокси)C1-C3 алкил, (C2-C4 алкинилокси)C1-C3 алкил, (C3-C6 циклоалкокси)C1-C3 алкил, C1-C3 гидроксиалкокси-группу, C3-C6 циклоалкокси-группу, C3-C6 гетероциклоалкокси-группу, (C1-C3 алкокси)C1-C3 алкокси-группу, (C1-C3 галогеналкокси)C1-C3 алкокси-группу, (C2-C4 алкенилокси)C1-C3 алкокси-группу, (C2-C4 алкинилокси)C1-C3 алкокси-группу, (C3-C6 циклоалкокси)C1-C3 алкокси-группу, (C3-C6 гетероциклоалкокси)C1-C3 алкокси-группу, (C3-C6 циклоалкил)C1-C3 алкокси-группу, (C3-C6 циклоалкил)C2-C4 алкенилокси-группу, (C3-C6 циклоалкил)C2-C4 алкинилокси-группу, -C(O)Н, -C(O)ОН или -C(O)O-C1-C3 алкил. В некоторых вариантах осуществления, R2 может представлять собой атом водорода или C1-C3 алкил. В некоторых вариантах осуществления, R2 может представлять собой атом водорода.
Каждый R3 может независимо представлять собой атом водорода, атом галогена, гидрокси-группу, C1-C3 алкил, C2-C4 алкенил, C1-C3 алкокси-группу, C1-C3 алкил-гидрокси-группу, C3-C6 циклоалкил, (C1-C3 алкокси)C1-C3 алкил, (C1-C3 галогеналкокси)C1-C3 алкил, (C2-C4 алкенилокси)C1-C3 алкил, (C2-C4 алкинилокси)C1-C3 алкил, (C3-C6 циклоалкокси)C1-C3 алкил, C1-C3 гидроксиалкокси-группу, C3-C6 циклоалкокси-группу, C3-C6 гетероциклоалкокси-группу, (C1-C3 алкокси)C1-C3 алкокси-группу, (C1-C3 галогеналкокси)C1-C3 алкокси-группу, (C2-C4 алкенилокси)C1-C3 алкокси-группу, (C2-C4 алкинилокси)C1-C3 алкокси-группу, (C3-C6 циклоалкокси)C1-C3 алкокси-группу, (C3-C6 гетероциклоалкокси)C1-C3 алкокси-группу, (C3-C6 циклоалкил)C1-C3 алкокси-группу, (C3-C6 циклоалкил)C2-C4 алкенилокси-группу, (C3-C6 циклоалкил)C2-C4 алкинилокси-группу, -C(O)Н, -C(O)ОН или -C(O)O-C1-C3 алкил. В некоторых вариантах осуществления, каждый R3 может независимо представлять собой C1-C3 алкокси-группу, C1-C3 гидроксиалкокси-группу, C3-C6 циклоалкокси-группу, C3-C6 гетероциклоалкокси-группу, (C1-C3 алкокси)C1-C3 алкокси-группу, (C1-C3 галогеналкокси)C1-C3 алкокси-группу, (C2-C4 алкенилокси)C1-C3 алкокси-группу, (C2-C4 алкинилокси)C1-C3 алкокси-группу, (C3-C6 циклоалкокси)C1-C3 алкокси-группу, (C3-C6 гетероциклоалкокси)C1-C3 алкокси-группу, (C3-C6 циклоалкил)C1-C3 алкокси-группу, (C3-C6 циклоалкил)C2-C4 алкенилокси-группу или (C3-C6 циклоалкил)C2-C4 алкинилокси-группу. В некоторых вариантах осуществления, каждый R3 может независимо представлять собой C1-C3 алкокси-группу или C3-C6 циклоалкокси-группу. В некоторых вариантах осуществления, каждый R3 может независимо представлять собой C1-C3 алкокси-группу. В некоторых вариантах осуществления, каждый R3 может независимо представлять собой метокси-группу, этокси-группу, пропокси-группу или изопропокси-группу. В некоторых вариантах осуществления, R3 может представлять собой метокси-группу.
Каждый R4 может независимо представлять собой атом водорода, атом галогена, -OR4a, C1-C3 алкил, C2-C4 алкенил, C1-C3 алкокси-группу, C1-C3 алкил-гидрокси-группу, C3-C6 циклоалкил, (C1-C3 алкокси)C1-C3 алкил, (C1-C3 галогеналкокси)C1-C3 алкил, (C2-C4 алкенилокси)C1-C3 алкил, (C2-C4 алкинилокси)C1-C3 алкил, (C3-C6 циклоалкокси)C1-C3 алкил, C1-C3 гидроксиалкокси-группу, C3-C6 циклоалкокси-группу, C3-C6 гетероциклоалкокси-группу, (C1-C3 алкокси)C1-C3 алкокси-группу, (C1-C3 галогеналкокси)C1-C3 алкокси-группу, (C2-C4 алкенилокси)C1-C3 алкокси-группу, (C2-C4 алкинилокси)C1-C3 алкокси-группу, (C3-C6 циклоалкокси)C1-C3 алкокси-группу, (C3-C6 гетероциклоалкокси)C1-C3 алкокси-группу, (C3-C6 циклоалкил)C1-C3 алкокси-группу, (C3-C6 циклоалкил)C2-C4 алкенилокси-группу, (C3-C6 циклоалкил)C2-C4 алкинилокси-группу, -C(O)Н, -C(O)ОН или -C(O)O-C1-C3 алкил, где R4a может представлять собой атом водорода или силильную группу. В некоторых вариантах осуществления, по меньшей мере один из R4 может представлять собой -OR4a. В некоторых вариантах осуществления R4 может представлять собой -OH. В некоторых вариантах осуществления, R4 может представлять собой -O-силильную группу.
В некоторых вариантах осуществления, R1 может представлять собой атом хлора, R2 может представлять собой Н, R3 может представлять собой C1-C3 алкокси-группу, и R4 может представлять собой -OR4a. В некоторых вариантах осуществления, R1 может представлять собой атом хлора, R2 может представлять собой Н, R3 может представлять собой метокси-группу, и R4 может представлять собой -OR4a. В некоторых вариантах осуществления, R4 может представлять собой -OH.
В некоторых вариантах осуществления, подстрочный индекс n может представлять собой целое число от 1 до 4. В некоторых вариантах осуществления, подстрочный индекс n может быть равен 1.
Цикл C может представлять собой любой подходящий арильный или гетероарильный цикл. Арильные циклы, которые могут применяться в качестве цикла C, включают (но не ограничены только ими) фенил, нафтил и бифенил. Гетероарильные циклы, которые могут применяться в качестве цикла C, включают (но не ограничены только ими) пиррол, пиридин, пиран, тиофен, тиопиран, тиазол, имидазол, тиадиазол, пиразин, пиримидин, пиридазин, индол и бензотиофен. В некоторых вариантах осуществления, цикл C может представлять собой фенил, тиадиазол или бензотиофен. В других вариантах осуществления, цикл C может представлять собой фенил. В некоторых других вариантах осуществления, цикл C может представлять собой тиадиазол.
Цикл D может отсутствовать или представлять собой любой подходящий гетероарильный цикл. Гетероарильные циклы, которые могут применяться в качестве цикла D, включают (но не ограничены только ими) пиррол, пиридин, пиран, тиофен, тиопиран, тиазол, имидазол, тиадиазол, пиразин, пиримидин, пиридазин, индол и бензотиофен. В некоторых вариантах осуществления, цикл D может отсутствовать. В других вариантах осуществления, цикл D может представлять собой фуран, тиофен или пиразин.
В некоторых вариантах осуществления, цикл C может представлять собой фенил, и цикл D может отсутствовать. В других вариантах осуществления, цикл C может представлять собой бензотиофен, и цикл D может отсутствовать. В некоторых других вариантах осуществления, цикл C может представлять собой тиадиазол, и цикл D может представлять собой фуран, тиофен или пиразин.
В некоторых вариантах осуществления, R1 может представлять собой атом хлора, R2 может представлять собой Н, R3 может представлять собой метокси-группу, R4 может представлять собой гидрокси-группу, индекс n может быть равен 1, цикл C может представлять собой фенил, и цикл D может отсутствовать.
Любой подходящий силановый восстановитель может применяться в способе по настоящему изобретению. Примеры силановых восстановителей среди прочих включают (но не ограничены только ими) тетраметилдисилоксан (TMDS), пентаметилдисилоксан (PMDS), полиметилгидросилоксан (PMHS), Et3SiH, Ph2MeSiH, Ph2SiH2. Другие силановые восстановители можно найдены в каталоге Gelest "Silicon, Germanium & Tin Compounds, Metal Alkoxides and Metal Diketonates" и в приложении "Silicon-Based Reducing Agents". В некоторых вариантах осуществления, силановый восстановитель может представлять собой тетраметилдисилоксан (TMDS), пентаметилдисилоксан (PMDS), полиметилгидросилоксан (PMHS) или Et3SiH. В некоторых вариантах осуществления, силановый восстановитель может представлять собой тетраметилдисилоксан (TMDS), пентаметилдисилоксан (PMDS) или Et3SiH. В некоторых вариантах осуществления, силановый восстановитель может представлять собой тетраметилдисилоксан (TMDS) или пентаметилдисилоксан (PMDS). В некоторых вариантах осуществления, силановый восстановитель может представлять собой тетраметилдисилоксан (TMDS).
Силановый восстановитель может присутствовать в любом подходящем количестве. Например, силановый восстановитель может присутствовать в количестве по меньшей мере 1,0 экв. (моль/моль) относительно соединения формулы II, как, например, около 1,0, 2, 3, 4, 5, 6, 7, 8, 9 или около 10,0 экв. (моль/моль). Силановый восстановитель также может присутствовать в количестве от около 1,0 до около 10,0 экв. (моль/моль) относительно соединения формулы II, как, например, от около 1,0 до около 5,0 экв. (моль/моль), или от около 1,0 до около 2,0 экв. (моль/моль). В некоторых вариантах осуществления, силановый восстановитель может присутствовать в количестве от около 1,0 до около 5,0 экв. (моль/моль) относительно соединения формулы II. В некоторых вариантах осуществления, силановый восстановитель может присутствовать в количестве от около 1,0 до около 2,0 экв. (моль/моль) относительно соединения формулы II.
Любой подходящий катализатор может применяться в способе по настоящему изобретению. Примеры катализаторов включают катализаторы, представляющие собой кислоты Льюиса, B(C6F5)3, BF3-Et2O, BF3-THF, BF3-Bu2O, BF3-MeCN, BF3AcOH, BF3H3PO4, BF3, AlCl3, TMSOTf и другие. В некоторых вариантах осуществления, катализатор может представлять собой B(C6F5)3, BF3-THF, BF3-Bu2O, BF3-MeCN, BF3AcOH, BF3H3PO4, BF3 или TMSOTf. В некоторых вариантах осуществления, катализатор может представлять собой B(C6F5)3, -BF3-THF, BF3-Bu2O, BF3-MeCN, BF3AcOH, BF3H3PO4 или BF3. В некоторых вариантах осуществления, катализатор может представлять собой B(C6F5)3 или TMSOTf. В некоторых вариантах осуществления, катализатор может представлять собой B(C6F5)3. Другие катализаторы, которые можно применять по настоящему изобретению, известны в данной области техники и включают катализаторы, содержащие по меньшей мере один перфторированный фенил, такой как B(C6F5)(R)2, где каждый R может представлять собой любой подходящий заместитель, как описано выше. В некоторых вариантах осуществления, катализатор может представлять собой смесь B(C6F5)3, BF3-Et2O, BF3-THF, BF3-Bu2O, BF3-MeCN, BF3AcOH, BF3H3PO4, BF3, AlCl3 или TMSOTf.
Катализатор по настоящему изобретению может присутствовать в любом подходящем количестве. Например, катализатор может присутствовать в количестве менее 1,0 экв. (моль/моль) относительно соединения формулы II, или менее около 0,5, 0,4, 0,3, 0,2, или менее около 0,1 экв. (моль/моль). Катализатор также может присутствовать в количестве от около 0,0001 до около 0,1 экв. (моль/моль) относительно соединения формулы II. В некоторых вариантах осуществления, катализатор может присутствовать в количестве менее около 0,1 экв. (моль/моль) относительно соединения формулы II. Катализатор также может присутствовать в количестве от около 0,0001 до около 0,1 экв. (моль/моль) относительно соединения формулы II. В некоторых вариантах осуществления, катализатор может присутствовать в количестве менее около 0,01 экв. (моль/моль) относительно соединения формулы II. Катализатор также может присутствовать в количестве от около 0,0001 до около 0,01 экв. (моль/моль) относительно соединения формулы II.
Реагенты, применяемые в способах по настоящему изобретению, могут быть объединены в любом подходящем порядке. Например, силановый восстановитель и катализатор могут быть объединены в первом растворе, который затем добавляют во второй раствор соединения формулы II. В некоторых вариантах осуществления, способ получения соединения формулы I включает получение первого раствора силанового восстановителя и катализатора, и добавление первого раствора во второй раствор соединения формулы II, таким образом получая реакционную смесь для получения соединения формулы I. Альтернативно, второй раствор соединения формулы II можно добавлять в первый раствор силанового восстановителя и катализатора. В некоторых вариантах осуществления, способ получения соединения формулы I включает получение первого раствора силанового восстановителя и катализатора, и добавление второго раствора соединения формулы II в первый раствор, таким образом получая реакционную смесь для получения соединения формулы I.
В некоторых вариантах осуществления, один или более реагентов может быть разделено на две или более порции для добавления в реакционную смесь. Например, силановый восстановитель может быть разделен на две порции, при этом первая порция силанового восстановителя может быть объединена с соединением формулы II с образованием первого раствора, а вторая порция силанового восстановителя может быть объединена с катализатором с образованием второго раствора. Первый раствор, содержащий первую порцию силанового восстановителя и соединение формулы II, можно добавлять во второй раствор, содержащий вторую порцию силанового восстановителя и катализатор. Первая и вторая порции силанового восстановителя могут быть практически равны или не равны. Например, соотношение первой порции ко второй порции силанового восстановителя может составлять от около 1:20 до около 20:1, или около 1:10, 1:9, 1:8, 1:7, 1:6, 1:5, 1:4, 1:3, 1:2, 1:1, 2:1, 3:1, 4:1, 5:1, 6:1, 7:1, 8:1, 9:1 или около 10:1. В некоторых вариантах осуществления, способ получения соединения формулы I включает получение первого раствора, содержащего соединение формулы II и первую порцию силанового восстановителя, получение второго раствора катализатора и второй порции силанового восстановителя, и добавление первого раствора во второй раствор, с получением таким образом реакционной смеси для получения соединения формулы I. В некоторых вариантах осуществления, соотношение первой и второй порций силанового восстановителя может составлять около 1:1.
Любой подходящий растворитель может применяться в способе по настоящему изобретению. Примеры растворителей включают (но не ограничены только ими) пентан, пентаны, гексан, гексаны, гептан, гептаны, петролейный эфир, циклопентаны, циклогексаны, бензол, толуол, ксилол, трифторметилбензол, галогенбензолы, такие как хлорбензол, фторбензол, дихлорбензол и дифторбензол, метиленхлорид, хлороформ или их комбинации. Растворители могут включать такие растворители, в которых соединения формулы I и II могут быть слаборастворимы или нерастворимы, с образованием суспензии или гетерогенной реакционной смеси. В некоторых вариантах осуществления, растворитель может представлять собой пентаны, гексаны, гептаны, циклопентаны, циклогексаны, бензол, толуол, ксилол, трифторметилбензол, хлорбензол или их комбинации. В некоторых вариантах осуществления, растворитель может представлять собой пентаны, гексаны, гептаны, циклопентаны, циклогексаны или их комбинации. В некоторых вариантах осуществления, растворитель может представлять собой пентаны, гексаны, гептаны или их комбинации. В некоторых вариантах осуществления, растворитель может представлять собой гептаны. В некоторых вариантах осуществления, растворитель может представлять собой толуол. В некоторых вариантах осуществления, реакционная смесь может представлять собой гетерогенную реакционную смесь. В некоторых вариантах осуществления, реакционная смесь может представлять собой суспензию.
Температура реакционной смеси по настоящему способу может представлять собой любую подходящую температуру. Например, температура реакционной смеси может составлять от около -78°C до около 100°C, или от около -50°C до около 100°C, или от около -25°C до около 50°C, или от около -10°C до около 25°C, или от около 0°C до около 20°C. В некоторых вариантах осуществления, температура реакционной смеси может составлять от около -25°C до около 50°C. В некоторых вариантах осуществления, температура реакционной смеси может составлять от около -10°C до около 25°C. В некоторых вариантах осуществления, температура реакционной смеси может составлять от около 0°C до около 20°C.
Реакционная смесь по настоящему способу может находиться под любым подходящим давлением. Например, реакционная смесь может находиться под атмосферным давлением. Реакционную смесь можно подвергать любым подходящим условиям, таким как атмосферные газы или инертные газы, такие как азот или аргон.
Способом по настоящему изобретению можно получать соединение формулы I с любым подходящим выходом. Например, соединение формулы I можно получать с выходом по меньшей мере около 50, 55, 60, 65, 70, 75, 80, 85, 90% или по меньшей мере около 95%, В некоторых вариантах осуществления, соединение формулы I можно получать по меньшей мере с 75%-ным выходом. В некоторых вариантах осуществления, соединение формулы I можно получать по меньшей мере с 90%-ным выходом. В некоторых вариантах осуществления, соединение формулы I можно получать по меньшей мере с 95%-ным выходом.
Способом по настоящему изобретению можно получать соединение формулы I с любой подходящей чистотой. Например, соединение формулы I можно получать с чистотой по меньшей мере около 90, 95, 96, 97, 98 или по меньшей мере около 99%. В некоторых вариантах осуществления, соединение формулы I можно получать с чистотой по меньшей мере 95%. В некоторых вариантах осуществления, соединение формулы I можно получать с чистотой по меньшей мере 98%. В некоторых вариантах осуществления, соединение формулы I можно получать с чистотой по меньшей мере 99%.
R4a может представлять собой любую подходящую синильную группу. Силильные группы, которые могут применяться по настоящему изобретению, могут иметь формулу -Si(R)3, где каждый R может представлять собой любую подходящую группу, такую как (но не ограничиваясь только ими) атом водорода, алкил, алкенил, алкинил, арил и -OSi(R')3, где каждый R' может представлять собой любую подходящую группу, такую как (но не ограничиваясь только ими) атом водорода, алкил, алкенил, алкинил, арил или полигидросилоксан. В некоторых вариантах осуществления, все R группы представляют собой алкил. В некоторых вариантах осуществления, по меньшей мере одна R группа может представлять собой -OSi(R')3. Когда по меньшей мере одна R группа представляет собой -OSi(R')3, каждая R' группа может представлять собой атом водорода, алкил или полигидросилокеан. В некоторых вариантах осуществления, R4a может представлять собой диметилсилан, диэтилсилан, триметилсилил, триэтилсилил,: третбутилдиметилсилил, тетраметилдисилоксил (-Si(Me)2OSi(Me)2H), пентаметилдисилоксил (-Si(Me)2OSi(Me)3) или полиметилгидросилоксил (-(Me)(H)Si-O-)x-). В некоторых вариантах осуществления, R4a может представлять собой триэтилсилан, тетраметилдисилоксил (-Si(Me)2OSi(Me)2H), пентаметилдисилоксил (-Si(Me)2OSi(Me)3) или полиметилгидросилоксил (-(Me)(H)Si-O-)x-). В некоторых вариантах осуществления, R4a может представлять собой тетраметилдисилоксил (-Si(Me)2OSi(Me)2H).
Когда R4a представляет собой синильную группу, способ по настоящему изобретению может включать стадию обработки кислотой для удаления силильной группы. В некоторых вариантах осуществления, в которых R4a представляет собой синильную группу, способ также включает добавление кислоты в реакционную смесь, в условиях, пригодных для получения соединения формулы I, где R4 представляет собой -OH. Кислота может представлять собой любую подходящую кислоту, пригодную для удаления силильной группы. В некоторых вариантах осуществления, кислота может представлять собой соляную кислоту, серную кислоту, фосфорную кислоту или азотную кислоту. В некоторых вариантах осуществления, кислота может представлять собой соляную кислоту. Стадию обработки соединения формулы I кислотой можно проводить в любых подходящих условиях, получая соединение формулы I, где R4 представляет собой -OH. Например, данные условия могут включать хранение реакционной смеси при комнатной температуре или нагревание реакционной смеси при любой подходящей температуре, вплоть до 100°C. Например, реакционную смесь с кислотой может можно нагревать при любой температуре от около 25°C до около 100°C, или от около 50°C до 100°C, или от около 65°C до 85°C. В некоторых вариантах осуществления, реакционную смесь, содержащую кислоту, нагревают. В некоторых вариантах осуществления, реакционную смесь, содержащую кислоту, нагревают при температуре от около 65°C до 85°C.
В некоторых вариантах осуществления, соединение формулы I, имеющее следующую структуру:
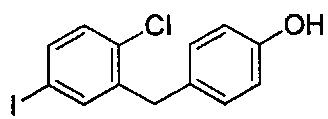
можно получать способом по настоящему изобретению путем получения реакционной смеси, содержащей соединение формулы II, имеющее следующую структуру:
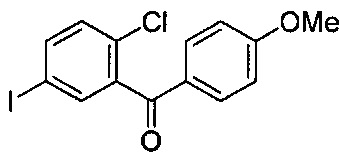
тетраметилдисилоксан (TMDS), каталитическое количество B(C6F5)3 и толуол, и добавления соляной кислоты в данную реакционную смесь, в условиях, подходящих для получения соединения формулы I.
IV. Соединение формулы III
В настоящем изобретении также описаны кристаллические формы, способы кристаллизации и способы получения следующего соединения:
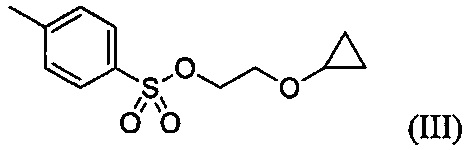
А. Кристаллическая форма соединения формулы III
В некоторых вариантах осуществления, в настоящем изобретении описана кристаллическая форма соединения, имеющего следующую структуру:
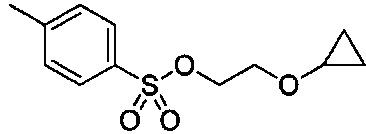
Кристаллическое соединение по настоящему изобретению можно охарактеризовать методами порошковой рентгеновской дифракции (XRPD), рамановской спектроскопии, дифференциальной сканирующей калориметрии (ДСК), термогравиметрическим анализом (ТГА), показывающим температуру разложения, и элементарной ячейкой кристаллической структуры.
В некоторых вариантах осуществления, в настоящем изобретении описана кристаллическая форма соединения, характеризующаяся данными XRPD, в значительной степени соответствующими фиг. 2 или фиг. 3, и пиками, в значительной степени соответствующими данным таблиц на фиг. 4. В некоторых вариантах осуществления, в настоящем изобретении описана кристаллическая форма соединения, характеризующаяся данными XRPD, в значительной степени соответствующими фиг. 5, и пиками, в значительной степени соответствующими данным таблиц на фиг. 6. Кристаллическое соединение по настоящему изобретению может иметь любую комбинацию пиков, в значительной степени соответствующих фиг. 4 или фиг. 6. Более того, каждый пик, перечисленный на фиг. 4 и фиг. 6, может иметь диапазон погрешности ±0,2 градуса 2θ, предпочтительно ±0,1 градуса 2θ.
В других вариантах осуществления, кристаллическая форма соединения характеризуется порошковой рентгеновской дифрактограммой, которая включает один или более пиков при 14,3, 15,8, 16,0, 17,6, 20,9, 21,1, 21,7, 21,8, 21,9, 24,3, 24,6, 26,8 и 28,8 градусах 2θ (±0,1 градуса 2θ), где анализ методом XRPD проводят с применением CuKα1 излучения. В другом варианте осуществления, кристаллическая форма соединения характеризуется данными XRPD, которые включают два или более, три или более, четыре или более, или пять или более пиков при 14,3, 15,8, 16,0, 17,6, 20,9, 21,1, 21,7, 21,8, 21,9, 24,3, 24,6, 26,8 и 28,8 градусах 29 (±0,1 градуса 2θ). В некоторых вариантах осуществления, кристаллическая форма соединения характеризуется данными XRPD, которые включают пики при 14,3, 21,1 и 21,9 градусах 20 (±0,1 градуса 2θ). В некоторых вариантах осуществления, кристаллическая форма соединения характеризуется данными XRPD, которые включают пики при 14,3, 20,9, 21,1, 21,8 и 21,9 градусах 2θ (±0,1 градуса 2θ). В некоторых вариантах осуществления, кристаллическая форма соединения характеризуется данными XRPD, которые включают пики при 14,3, 16,0, 20,9, 21,1, 21,7, 21,8, 21,9, 24,3, 24,6 и 28,8 градусах 20 (±0,1 градуса 2θ). В других вариантах осуществления, кристаллическая форма соединения характеризуется пиками XRPD, в значительной степени соответствующими фиг. 5.
Кристаллическое соединение по настоящему изобретению также характеризуется рамановскими спектрами, в значительной степени соответствующими фиг. 7, и пиками, в значительной степени соответствующими Фиг. 8. В некоторых вариантах осуществления, кристаллическая форма соединения характеризуется рамановскими спектрами, которые включают один или более пиков при около 110, 236, 268, 393, 488, 633, 778, 1095, 1170, 1206, 1342, 1443, 1598, 2878, 2931, 3018 и 3072 см-1. В другом варианте осуществления, кристаллическая форма соединения характеризуется рамановскими спектрами, которые включают два или более, три или более, четыре или более, или пять или более пиков. В других вариантах осуществления, кристаллическая форма соединения характеризуется рамановскими спектрами, включающими пики при около 110, 778, 1170 и 1206 см-1. В некоторых других вариантах осуществления, кристаллическая форма соединения характеризуется рамановскими спектрами, в значительной степени соответствующими Фиг. 8.
Кристаллическое соединение по настоящему изобретению также характеризуется данными дифференциальной сканирующей калориметрии (ДСК). В некоторых вариантах осуществления, кристаллическая форма соединения характеризуется эндотермой ДСК при около 21°C.
Кристаллическое соединение по настоящему изобретению также может характеризоваться значениями элементарной ячейки. Термогравиметирческий анализ (ТГА) также может применяться для характеристики кристаллического соединения по настоящему изобретению.
В некоторых вариантах осуществления, кристаллическое соединение характеризуется по меньшей мере одним из следующих: по меньшей мере одним из описанных выше пиков XRPD, по меньшей мере одним из описанных выше пиков в рамановской спектроскопии, и описанной выше эндотермой ДСК. В других вариантах осуществления, кристаллическое соединение характеризуется по меньшей мере двумя из следующих: по меньшей мере одним из описанных выше пиков XRPD, по меньшей мере одним из описанных выше пиков в рамановской спектроскопии, и описанной выше эндотермой ДСК. Например, кристаллическое соединение можно охарактеризовать по меньшей мере одним пиком XRPD и по меньшей мере одним пиком в рамановской спектроскопии, или по меньшей мере одним пиком XRPD и эндотермой ДСК, или по меньшей мере одним пиком в рамановской спектроскопии и эндотермой ДСК, и т.д.
В некоторых вариантах осуществления, кристаллическое соединение по настоящему изобретению характеризуется порошковой рентгеновской дифрактограммой (XRPD), которая включает один или более пиков при 14,3, 15,8, 16,0, 17,6, 20,9, 21,1, 21,7, 21,8, 21,9, 24,3, 24,6, 26,8 и 28,8 градусах 2θ (±0,1 градуса 2θ), где указанный анализ методом XRPD проводят с применением CuKαl излучения, и рамановскими спектрами, которые включают один или более пиков при около 110, 236, 268, 393, 488, 633, 778, 1095, 1170, 1206, 1342, 1443, 1598, 2878, 2931, 3018 и 3072 см-1. В других вариантах ; осуществления, кристаллическое соединение по настоящему изобретению характеризуется порошковой рентгеновской дифрактограммой (XRPD), которая включает один или более пиков при 14,3, 16,0, 20,9, 21,1, 21,7, 21,8, 21,9, 24,3, 24,6 и 28,8 градусах 2θ (±0,1 градуса 2θ), где анализ методом XRPD проводят с применением CuKα1 излучения, и рамановскими спектрами, которые включают один или более пиков при около 110, 778,1170 и 1206 см-1.
В некоторых вариантах осуществления, кристаллическая форма соединения по настоящему изобретению характеризуется порошковой рентгеновской дифрактограммой, которая включает один или более пиков при 14,3, 21,4, 21,6, 21,7, 22,1, 22,2 и 24,4 градусах 2θ (±0,1 градуса 2θ), где анализ методом XRPD проводят с применением CuKα1 излучения. В другом варианте осуществления, кристаллическая форма соединения по настоящему изобретению характеризуется данными XRPD, которые включают два или более, три или более, четыре при 22,1, 22,2 и 24,4 градусах 2θ (± 0,1 градуса 2θ). В некоторых вариантах осуществления, кристаллическая форма соединения характеризуется данными XRPD, которые включают пики при 21,6, 21,7 и 22,1 градусах 2θ (± 0,1 градуса 2θ). В некоторых вариантах осуществления, кристаллическая форма соединения характеризуется данными XRPD, которые включают пики при 14,3, 21,4, 21,6, 21,7, 22,1, 22,2 и 24,4 градусах 2θ (± 0,1 градуса 2θ). В других вариантах осуществления, кристаллическая форма соединения характеризуется пиками XRPD, в значительной степени соответствующими фиг. 2 или фиг. 3.
В некоторых вариантах осуществления, в настоящем изобретении описана кристаллическая форма соединения по настоящему изобретению, которая является изотопно-меченой. Примеры изотопов, которые могут быть включены в соединения по настоящему изобретению, включают (но не ограничены только ими) изотопы водорода, углерода, азота, кислорода, фтора, серы и хлора (такие как2H,3H,13C,14C,15N,18O,17O,18F,35S и36Cl). Изотопно-меченые соединения и их пролекарства, а также изотопно-меченые фармацевтически приемлемые соли и их пролекарства, входят в объем настоящего изобретения. Изотопно-меченые соединения по настоящему изобретению пригодны для исследований распределения соединений и их пролекарств и метаболитов в тканях; предпочтительные для данных исследований изотопы включают3H и14C. Кроме того, в некоторых обстоятельствах замещение более тяжелыми изотопами, такими как дейтерий (2H), может обеспечивать повышенную метаболическую устойчивость, что обуславливает такие терапевтические преимущества, как увеличение времени полужизни in vivo или снижение дозировки. Изотопно-меченые соединения по настоящему изобретению и их пролекарства в целом можно получать описанными в данном тексте способами посредством замены изотопно-немеченого реагента на изотопно-меченый.
Способы получения кристаллических форм соединения формулы III
В некоторых вариантах осуществления, в настоящем изобретении описан способ получения кристаллической формы соединения, имеющего следующую структуру:
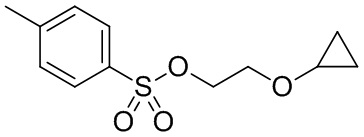
включающий стадию (a) смешивания 2-циклопропоксиэтил-4-метилбензолсульфоната и первого растворителя, который представляет собой полярный протонный растворитель, с получением раствора, и стадию (b) добавления второго растворителя в указанный раствор с получением смеси, в условиях, подходящих для получения кристаллической формы соединения.
Первый растворитель может представлять собой любой подходящий полярный протонный растворитель. Полярные протонные растворители, применяемые в способах по настоящему изобретению, включают (но не ограничены только ими) C1-4 спирты (метанол, этанол, пропанол, изопропанол и т.д.), C1-4 кислоты (муравьиная кислота, уксусная кислота и т.д.) и воду. В некоторых вариантах осуществления, полярный протонный растворитель из стадии (а) может представлять собой C1-4 спирт. Например, полярный протонный растворитель может представлять собой метанол, этанол, пропанол, изопропанол, бутанол, изобутанол, втор-бутанол или трет-бутанол. Полярный протонный растворитель может представлять собой один растворитель или смесь растворителей. В некоторых вариантах осуществления, полярный протонный растворитель может представлять собой метанол или этанол, или их комбинации. В некоторых вариантах осуществления, полярный протонный растворитель может представлять собой этанол.
Второй растворитель может представлять собой любой подходящий растворитель, такой как полярный протонный растворитель или неполярный растворитель. Примеры растворителей включают (но не ограничены только ими) C1-4 спирты (метанол, этанол, пропанол, изопропанол и т.д.), C1-4 кислоты (муравьиная кислота, уксусная кислота и т.д.), воду, алканы (пентаны, н-гексан, гексаны, н-гептан, гептаны и т.д.), циклоалканы (циклопентан, циклогексан и т.д.), бензол, толуол и 1,4-диоксан. В некоторых вариантах осуществления, второй растворитель может представлять собой полярный протонный растворитель или неполярный растворитель. Второй растворитель может представлять собой один растворитель или смесь растворителей. В некоторых вариантах осуществления, второй растворитель может представлять собой воду, пентаны, гексаны, петролейный эфир, гептаны, циклопентан или циклогексан, или их комбинации. В некоторых вариантах осуществления, второй растворитель может представлять собой воду.
В способе по настоящему изобретению можно применять любую подходящую комбинацию первого и второго растворителей. В некоторых вариантах осуществления, первый растворитель может представлять собой этанол, и второй растворитель может представлять собой воду. В некоторых вариантах осуществления, первый растворитель может представлять собой метанол, и второй растворитель может представлять собой гептаны.
Первый и второй растворители могут присутствовать в любом подходящем соотношении друг к другу. Например, соотношение первого растворителя ко второму растворителю может составлять около 10:1 (об./об.), 5:1, 4:1, 3:1, 2,5:1,2:1, 1,5:1, 1:1, 1:1,5, 1:2, 1:2,5, 1:3, 1;4, 1:5 или около 1:10 (об./об.). В некоторых вариантах осуществления, соотношение первого растворителя ко второму растворителю может составлять от около 5:1 до около 1:1 (об./об.). В некоторых вариантах осуществления, соотношение первого растворителя ко второму растворителю может составлять около 2,5:1 (об./об.).
Первый растворитель и 2-циклопропоксиэтил-4-метилбензолсульфонат могут присутствовать в любом подходящем соотношении. Например, соотношение первого растворителя к 2-циклопропоксиэтил-4-метилбензолсульфонату может составлять около 10:1 (об./об:), 5:1, 4:1, 3:1, 2,5:1, 2:1, 1,5:1, 1:1, 1:1,5, 1:2, 1:2,5, 1:3, 1:4, 1:5 или около 1:10 (об./об.). В некоторых вариантах осуществления, соотношение первого растворителя к 2-циклопропоксиэтил-4-метилбензолсульфонату может составлять около 1:1 (об./об.).
Способ кристаллизации соединения формулы III может включать дополнительные стадии. Например, способ кристаллизации может включать стадии нагревания и охлаждения. Нагревание может способствовать растворению 2-циклопропоксиэтил-4-метилбензолсульфоната, и охлаждение может способствовать кристаллизации. Смесь можно нагревать до температуры кипения смеси растворителей. Например, смесь можно нагревать до температуры ниже примерно 30°C, 40, 50, 60, 70, 80, 90 или ниже примерно 100°C. Нагревание можно производить в течение любого подходящего периода времени, например, в течение времени, необходимого для растворения 2-циклопропоксиэтил-4-метилбензолсульфоната. Например, нагревание можно производить в течение менее чем примерно 1 минуты, или в течение 2, 3, 4, 5, 10, 15, 30, 60 минут или дольше. В некоторых вариантах осуществления, нагревание можно производить при температуре ниже примерно 50°C. В некоторых вариантах осуществления, нагревание можно производить при температуре от около 20°C до около 50°C.
При охлаждении смеси, смесь растворителей можно охлаждать быстро, с помощью ледяной бани, или медленно. Смесь растворителей также можно охлаждать до комнатной температуры или до температуры ниже комнатной. Например, смесь растворителей можно охлаждать до температуры ниже комнатной, или ниже, чем примерно 20°C, 15, 10, 5, или ниже, чем примерно 0°C. Смесь растворителей можно хранить при более низкой температуре в течение любого подходящего периода времени, например, в течение нескольких часов, дней или недель. В некоторых вариантах осуществления, способ кристаллизации также включает стадию (с) нагревания смеси при температуре от около 20°C до около 50°C до получения прозрачной смеси; и стадию (d) охлаждения прозрачной смеси до температуры ниже примерно 10°C.
Смесь растворителей также может содержать различные другие компоненты, такие как кислоты, основания и соли. Кислоты, применяемые в настоящем изобретении, включают (но не ограничены только ими) уксусную кислоту, муравьиную кислоту, соляную кислоту, серную кислоту и другие слабые кислоты и сильные кислоты. Основания, применяемые в настоящем изобретении, включают (но не ограничены только ими) аммиак, гидроксид натрия и другие. Соли, применяемые в настоящем изобретении, включают (но не ограничены только ими) хлорид натрия, хлорид калия, карбонат калия и другие.
Кристаллизацию можно вызывать известными в данной области техники способами, например, механическими средствами, как например царапание или трение контактной поверхности реакционного сосуда, например, стеклянной палочкой. Опционально, в насыщенный или перенасыщенный раствор можно вносить затравочные кристаллы. Данный способ может также включать применение затравочного кристалла кристаллического 2-циклопропоксиэтил-4-метилбензолсульфоната. В некоторых вариантах осуществления, смесь в вышеуказанных способах содержит затравочный кристалл кристаллического соединения по настоящему изобретению.
Выделение целевой кристаллической формы можно осуществлять удалением растворителя и осаждающего растворителя из кристаллов. В целом, выделение осуществляют известными способами, как, например, фильтрованием, фильтрованием с отсасыванием, декантированием или центрифугированием. Последующее выделение можно осуществлять удалением любого избытка растворителя (растворителей) из кристаллической формы способами, известными квалифицированному специалисту в данной области, как, например, с применением вакуума, и/или нагреванием выше -80°C, предпочтительно в диапазоне температур ниже 80°C, еще более предпочтительно - ниже 50°C.
Применяемый в способе кристаллизации по настоящему изобретению 2-циклопропоксиэтил-4-метилбензолсульфонат можно получать любым подходящим способом. В некоторых вариантах осуществления, 2-циклопропоксиэтил-4-метилбензолсульфонат можно получать описанным ниже способом.
Способом кристаллизации по настоящему изобретению можно получать кристаллический 2-циклопропоксиэтил-4-метилбензолсульфонат по настоящему изобретению, описанный выше. В некоторых вариантах осуществления, продукт стадии (b) может представлять собой кристаллический 2-циклопропоксиэтил-4-метилбензолсульфонат по настоящему изобретению.
C. Способы получения соединения формулы III
В настоящем изобретении также описаны способы получения соединения формулы III. Соединение формулы III получали ранее (см. патент США №7838499). После ранее описанной стадии реакции Барбье - магний-катализируемого внутримолекулярного раскрытия цикла/циклизации, способ по настоящему изобретению включает стадию экстрагирования с применением 2-метилтетрагидрофурана, на которой растворитель для экстракции, содержащий промежуточное соединение 2-циклопропоксиэтанол, используют напрямую на стадии тозилирования без дополнительного упаривания.
В некоторых вариантах осуществления, в настоящем изобретении описан способ получения соединения формулы III:
включающий стадию (а) получения первой реакционной смеси, содержащей Mg и соединение, имеющее следующую структуру:
в тетрагидрофурановом растворителе, в условиях, подходящих для получения промежуточного соединения, имеющего следующую структуру:
Данный способ также включает стадию (b) контакта первой реакционной смеси с водой и 2-метилтетрагидрофураном, так что промежуточное соединение из стадии (а) в значительной степени растворяется в 2-метилтетрагидрофуране. Данный способ также включает стадию (с) получения второй реакционной смеси, содержащей 4-метилбензол-1-сульфонилхлорид (Тозил-Cl) и 2-метилтетрагидрофуран со стадии (b), содержащий промежуточное соединение со стадии (а), в условиях, подходящих для получения соединения формулы III.
Способ получения соединения формулы III может включать применение некоторых других реагентов. Например, первая реакционная смесь со стадии (а) может, содержать такие реагенты (но не ограничиваясь только ими), как йод (I2) и 1,2-дибромэтан (BrCH2CH2Br). В некоторых вариантах осуществления, первая реакционная смесь также содержит BrCH2CH2Br и I2. В некоторых вариантах осуществления, первая реакционная смесь содержит BrCH2CH2Br, I2, Mg и соединение, имеющее следующую структуру:
После стадии (a), первую реакционную смесь можно вводить в контакт с различными растворителями, реагентами и компонентами на стадии (b). Например, первую реакционную смесь можно вводить в контакт с водой, кислотой, хлоридом натрия, среди прочих, на стадии (b). Кислота может представлять собой минеральную кислоту или органическую кислоту, такую как карбоновая кислота. Примеры кислот, которые могут применяться на стадии (b), включают (но не ограничены только ими) соляную кислоту, муравьиную кислоту, уксусную кислоту, лимонную кислоту, молочную кислоту, щавелевую кислоту, гликолевую кислоту и другие. В некоторых вариантах осуществления, первую реакционную смесь можно вводить в контакт с водой и кислотой на стадии (b). В некоторых вариантах осуществления, кислота может представлять собой соляную кислоту, муравьиную кислоту, уксусную кислоту, лимонную кислоту, молочную кислоту, щавелевую кислоту или гликолевую кислоту. В некоторых вариантах осуществления, кислота может представлять собой соляную кислоту. В некоторых вариантах осуществления, кислота может представлять собой гликолевую кислоту. В некоторых вариантах осуществления, первую реакционную смесь можно вводить в контакт с водой и соляной кислотой на стадии (b). В некоторых вариантах осуществления, первую реакционную смесь можно вводить в контакт с водой и гликолевой кислотой на стадии (b). В некоторых вариантах осуществления, первую реакционную смесь также можно вводить в контакт с хлоридом натрия на стадии (b).
Стадии указанного способа можно осуществлять при любых подходящих условиях реакции. Например, температура на каждой стадии может независимо составлять от около -10 до около 100°C, или от около -10 до около 10°C, или от около 20 до около 60°C, или от около 30 до около 40°C. Альтернативно, температура на каждой стадии может независимо составлять около -10, 0, 10, 20, 30, 40, 50, 60, 70, 80, 90°C или около 100°C. В некоторых вариантах осуществления, температура на стадии (а) может составлять от около 20 до около 60°C. В некоторых вариантах осуществления, температура на стадии (b) может примерно соответствовать комнатной температуре. В некоторых вариантах осуществления, температура стадии (с) может составлять от около -10 до около 10°C.
Время реакции для каждой стадии указанного способа подходит для существенного завершения реакции. Например, время каждой стадии может составлять от нескольких минут до нескольких часов. Каждая из стадий (a) и (c) указанного способа может независимо длиться от около 10 до около 30 часов.
Соединение формулы III можно получать способом по настоящему изобретению с любым подходящим выходом. Например, выход может составлять по меньшей мере около 50% (моль/моль), 55, 60, 65, 70, 75, 80, 85, 90% или по меньшей мере около 95% (моль/моль). В некоторых вариантах осуществления, соединение формулы III можно получать с выходом по меньшей мере 50%. В некоторых вариантах осуществления, соединение формулы III можно получать с выходом по меньшей мере 65%.
2-Метилтетрагидрофурановую смесь со стадии (b), содержащую промежуточное соединение со стадии (а), можно применять на стадии (с) без получения концентрированного промежуточного вещества. В некоторых вариантах осуществления, 2-метилтетрагидрофуран, содержащий промежуточное соединение со стадии (а), применяют на стадии (с) без удаления 2-метилтетрагидрофурана, с получением концентрированного промежуточного вещества.
Способ получения соединения формулы III также можно осуществлять, применяя соединение, имеющее следующую структуру:
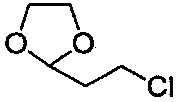
в аналогичных условиях. Другие условия получения соединения формулы III можно найти в статье Tetrahedron Letters 1999, 40, 8647-8650.
D. Способы применения соединения формулы III
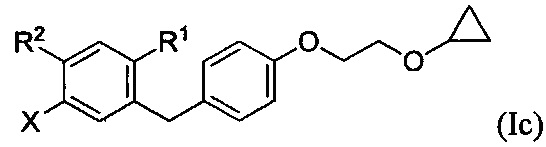
В настоящем изобретении описаны способы применения соединения формулы III для получения других соединений. Например, соединение формулы III применяли ранее (см. Заявку на патент США №13/889,980) для получения соединений формулы Ic:
В некоторых вариантах осуществления, в настоящем изобретении описан способ получения соединения формулы Ic:
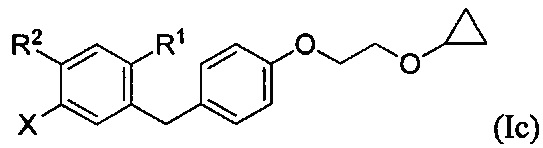
включающий получение реакционной смеси, содержащей соединение формулы III, имеющее чистоту по меньшей мере 90%, и соединение формулы Ib:
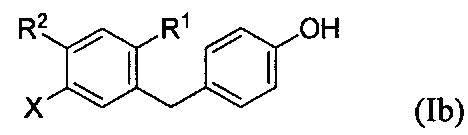
в условиях, подходящих для получения соединения формулы Ic, где X может представлять собой атом брома или атом йода. R1 может представлять собой атом водорода, атом галогена, гидрокси-группу, C1-C3 алкил или C1-C3 алкокси-группу. R2 может представлять собой атом водорода, атом галогена, гидрокси-группу, C1-C3 алкил, C1-C3 алкокси-группу, C3-C6 циклоалкил, (C1-C3 алкокси)C1-C3 алкил, (C1-C3 галогеналкокси)C1-C3 алкил, (C2-C4 алкенилокси)C1-C3 алкил, (C2-C4 алкинилокси)C1-C3 алкил, (C3-C6 циклоалкокси)C1-C3 алкил, C1-C3 гидроксиалкокси-группу, C3-C6 циклоалкокси-группу, C3-C6 гетероциклоалкокси-группу, (C1-C3 алкокси)C1-C3 алкокси-группу, (C1-C3 галогеналкокси)C1-C3 алкокси-группу, (C2-C4 алкенилокси)C1-C3 алкокси-группу, (C2-C4 алкинилокси)C1-C3 алкокси-группу, (C3-C6 циклоалкокси)C1-C3 алкокси-группу, (C3-C6 гетероциклоалкокси)C1-C3 алкокси-группу, (C3-C6 циклоалкил)C1-C3 алкокси-группу, (C3-C6 циклоалкил)C2-C4 алкенилокси-группу или (C3-C6 циклоалкил)C2-C4 алкинилокси-группу.
Соединение формулы III может иметь любую подходящую чистоту, составляющую по меньшей мере 90%. Например, соединение формулы III может иметь чистоту по меньшей мере 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99%. В некоторых вариантах осуществления, соединение формулы II может иметь чистоту по меньшей мере 95%. В некоторых вариантах осуществления, соединение формулы II может иметь чистоту по меньшей мере 97%.
В некоторых вариантах осуществления, описанные соединения включают соединения, в которых R1 может представлять собой атом галогена. В других вариантах осуществления, R1 может представлять собой F, Cl, Br или I. В некоторых других вариантах осуществления, R1 может представлять собой Cl.
В некоторых вариантах осуществления, описанные соединения включают соединения, в которых R2 может представлять собой H.
В некоторых вариантах осуществления, соединение имеет структуру, в которой R1 может представлять собой атом галогена; R2 может представлять собой H. В других вариантах осуществления, соединение имеет структуру, в которой R1 может представлять собой атом хлора; R2 может представлять собой H. В некоторых вариантах осуществления, соединение имеет структуру, в которой R1 может представлять собой атом хлора; R2 может представлять собой H; и X может представлять собой атом йода.
Способ получения соединения формулы Ic можно осуществлять в любых подходящих условиях. Например, реакционная смесь может содержать основание. Основание может включать неорганические основания, такие как (но не ограничиваясь только ими) карбонат цезия, карбонат калия, карбонат натрия или их смеси. В некоторых вариантах осуществления, основание может включать карбонат цезия. В некоторых вариантах осуществления, основание может включать карбонат калия. В некоторых вариантах осуществления, основание может включать смесь карбоната цезия и карбоната калия.
Способ получения соединения формулы Ic может также включать аммониевую соль. Примеры аммониевых солей включают (но не ограничены только ими) тетраметиламмония бромид, тетраметиламмония йодид, тетраметиламмония гидроксид и тетрабутиламмония йодид. В некоторых вариантах осуществления, реакционная смесь также содержит тетрабутиламмония йодид.
Соединение формулы III может находиться в любой физической форме, подходящей для способа получения соединения формулы Ic. Например, соединение формулы III может представлять собой масло или кристаллическое соединение, как описано выше. В некоторых вариантах осуществления, соединение формулы III является кристаллическим. В некоторых вариантах осуществления, соединение формулы III представляет собой описанную выше кристаллическую форму.
В некоторых вариантах осуществления, соединение формулы Ic имеет следующую структуру:
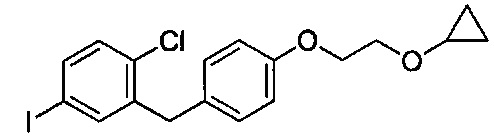
В некоторых вариантах осуществления, соединение формулы Ib имеет следующую структуру:
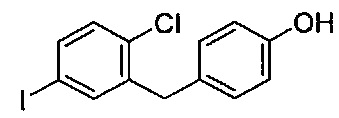
В некоторых вариантах осуществления, способ получения соединения формулы Ic включает получение реакционной смеси, содержащей Cs2CO3, K2CO3, тетрабутиламмония йодид, кристаллическое соединение формулы III и соединение формулы Ib, имеющее следующую структуру:
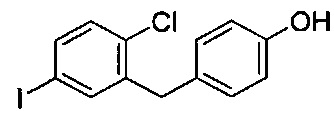
в условиях, подходящих для получения соединения формулы Ic, имеющего следующую структуру:
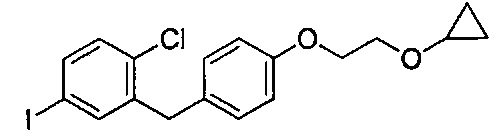
Соединение формулы Ib можно получать с помощью любых известных в данной области техники способов. В некоторых вариантах осуществления, соединение формулы Ib, применяемое в способе получения соединения формулы Ic, можно получать описанными выше способами по настоящему изобретению.
Алкильные, алкокси-, циклоалкильные, алкенил окси-, алкинил окси-, циклоалкокси-, гидроксиалкокси- и гетероциклоалкокси-группы или фрагменты в формуле Ic могут опционально быть частично или полностью фторированными. И один или более атомов водорода в формуле Ic могут опционально быть замещены на дейтерий.
V. Примеры
Последующие примеры приведены только в целях иллюстрации, и никаким образом не ограничивают настоящее изобретение. Квалифицированные специалисты в данной области техники легко определят различные некритичные параметры, которые можно изменять или модифицировать с получением практически аналогичных результатов.
Названия соединений, приведенные в последующих примерах, генерировали из приведенных структурных формул с применением алгоритма CambridgeSoft Struct = Name, применяемому в программе ChemDraw Ultra version 10,0. Если не указано иное, структуры соединений,: синтезируемых в примерах ниже, были подтверждены следующими методами:,
(1) спектры, получаемые методом газовой хроматографии-масс-спектрометрии с ионизацией электрораспылением (MS ESI), регистрировали с помощью масс-спектрометра Agilent 5973N, оснащенного газовым хроматографом Agilent 6890 с НР-5 MS колонкой (0,25 мкм покрытие; 30 м × 0,25 мм). Температуру ионизатора устанавливали равной 230°C, и спектры сканировали в диапазоне масс 25-500 со скоростью 3,09 секунды на скан.
(2) ВЭЖХ-МС спектры (LC-MS) получали с применением ВЭЖХ прибора Finnigan Surveyor, оснащенного насосом для четырехкомпонентных смесей, детектором с перестраиваемой длиной волны, установленного на 254 нм, XB-C18 колонкой (4,6×50 мм,: 5 мкм), и масс-спектрометра Finnigan LCQ с ионной ловушкой, при ионизации методом электрораспыления. Спектры сканировали в диапазоне масс 80-2000 с применением различного времени выхода ионов, в соответствии с количеством ионов в ионизаторе. Элюенты представляли собой B: ацетонитрил и D: вода. Применяли элюирование с градиентом от 10 до 90% B в течение 8 минут при скорости потока 1,0 мл/мин, затем 90% B в течение 7 минут. Общее время анализа 15 мин.
(3) Стандартную одномерную ЯМР спектроскопию проводили с помощью 400 МГц или 300 МГц Varian Mercury-Plus спектрометров. Образцы растворяли в дейтерированных растворителях, приобретенных в Qingdao Tenglong Weibo Technology Co., Ltd., и перемещали в 5 мм ID ЯМР ампулы. Спектры регистрировали при 293 K. Значения химических сдвигов регистрировали по шкале м.д. и соотносили с сигналами соответствующих растворителей, такими как 2,49 м.д. для ДМСО-d6, 1,93 м.д. для CD3CN, 3,30 м.д. для CD3OD, 5,32 м.д. для CD2Cl2 и 7,26 м.д. для CDCl3, в случае1H спектров.
Пример 1. Получение 4-(2-хлор-5-йодбензил)фенола (1)
Была разработана реакция восстановления-деметилирования. В данном способе применяют тетраметилдисилоксан в качестве восстановителя и трис(пентафторфенил)боран в качестве катализатора. После гидролиза силоксана, неочищенный 4-(2-хлор-5-йодбензил)фенол легко очищали растиранием в н-гептане или петролейном эфире (30-60°C (в основном, фракции гексановых изомеров) или 90-100°C (в основном, фракции гептановых изомеров)), которые с легкостью удаляют примеси и орто-изомер. Обе фракции качественно удаляли примеси, но гептановая фракция предпочтительна из соображений безопасности.
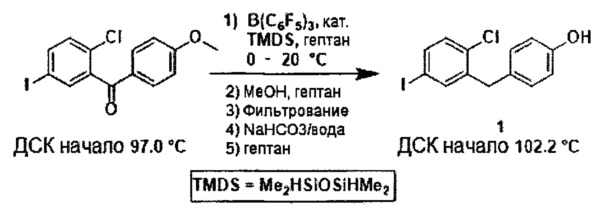
Раствор 1. В 1-литровую колбу загружали петролейный эфир (0,2 л) и трис(пентафторфенил)боран (907 мг, 1,77 ммоль) в атмосфере азота при перемешивании. Полученный раствор охлаждали до 0-5°C и добавляли по каплям тетраметил-1,1,3,3-дисилоксан (TMDS) (143 г, 1,06 моль) через капельную воронку в течение 15 мин.
В 5-литровую четырехгорлую стеклянную колбу загружали (2-хлор-5-йодфенил)(4-метоксифенил)метанон (220 г, 590,5 ммоль) и петролейный эфир (1,0 л). Полученную смесь охлаждали до 0-5°C, и добавляли по каплям раствор 1 в течение 50 мин, поддерживая температуру реакции ниже 10°C. Полученную смесь перемешивали в течение 6 часов при 20°C и отслеживали посредством ТСХ и/или LCMS. В полученный раствор при 20°C осторожно добавляли раствор соляной кислоты в метаноле (6н., 720 ммоль, 240 мл), и полученную смесь перемешивали при 120 об/мин в течение 6 часов.
Добавляли деионизированную воду (1200 мл), и смесь перемешивали в течение 30 минут. Полученную смесь фильтровали, и фильтрат промывали водой (500 мл), 5% NaHCO3 (500 мл), водой (500 мл) и петролейным эфиром (2×250 мл). Осадок на фильтре сушили при пониженном давлении (0,09 МПа) при 70°C, получая 4-(2-хлор-5-йодбензил)фенол в виде белого твердого вещества (236 г).

Пример 2. Крупномасштабное получение 4-(2-хлор-5-йодбензил)фенола (1)
Раствор 1. В 2-литровую колбу загружали петролейный эфир (1 л, фракция 90-100°C) и трис(пентафторфенил)боран (3,44 г, 6,71 ммоль) в атмосфере азота при перемешивании. Полученный раствор охлаждали до 0-5°C и добавляли по каплям TMDS (143 г, 2,42 моль) через капельную воронку в течение 15 мин.
В 5-литровую четырехгорлую стеклянную колбу загружали (2-хлор-5-йодфенил)(4-метоксифенил)метанон (500 г, 1,34 моль) и петролейный эфир (2,0 л). Полученную смесь охлаждали до 0-5°C и добавляли по каплям раствор 1 в течение 1,5 ч, поддерживая температуру реакции ниже 20°C во время выделения газа из раствора. Полученную смесь перемешивали в течение 16 часов при 20-30°C и мониторили методом LCMS. В полученный раствор при 20°C осторожно добавляли раствор соляной кислоты (357 г, 3,6 моль) в метаноле (237 г), и полученную смесь перемешивали при 120 об/мин в течение 0,5 ч при 20-30°C, и нагревали при 75-85°C в течение 16 ч, наблюдая образование осадка.
Полученную смесь фильтровали, и осадок на фильтре промывали водой (2×1 л), 5% NaHCO3 (1 л) и петролейным эфиром (2×500 мл). Осадок на фильтре сушили при пониженном давлении (0,09 МПа) при 55°C в течение 16 ч, получая 4-(2-хлор-5-йодбензил)фенол в виде белого твердого вещества. Выход: 422 г (91,3%).1H ЯМР (400 МГц, CDCl3) δ 7,46 (м, 2Н), 7,07 (м, 3Н), 6,78 (д, J=8,6 Гц, 2Н), 4,73 (с, 1Н), 3,96 (с, 2Н). MS ESI (m/z) вычислено: 344, найдено 343 [M-H]-, 687 [2M-H]-.
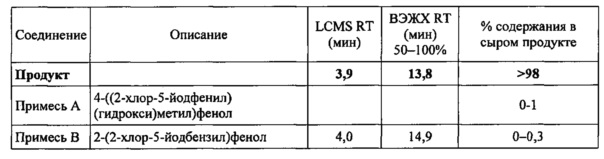
Пример 3. Крупномасштабное получение 4-(2-хлор-5-йодбензил)фенола (1)
Раствор 1. В реактор, имеющий стеклянную внутреннюю поверхность, загружали (2-хлор-5-йодфенил)(4-метоксифенил)метанон (15,8 кг) и толуол (94,8 кг) в атмосфере азота, и полученную реакционную смесь упаривали до кипения для удаления воды и следов спирта. После охлаждения до комнатной температуры, убывший вес дистиллята компенсировали добавлением свежего безводного толуола. Затем загружали тетраметилдисилоксан (5,7 кг), и полученный раствор перемещали в атмосфере азота в пластиковый бак.
Раствор 2. В реактор, имеющий стеклянную внутреннюю поверхность, загружали трис(пентафторфенил)боран (0,123 кг) и толуол (13,9 кг) в атмосфере азота, и полученную реакционную смесь перемешивали до растворения и переносили в пластиковый бак в инертной атмосфере.
Раствор 3. В реактор, имеющий стеклянную внутреннюю поверхность, загружали тетраметилдисилоксан (5,7 кг) и толуол (13,9 кг) в атмосфере азота, и полученную реакционную смесь охлаждали до -5-0°C. Раствор 2 добавляли в раствор 3 в течение 1 часа, поддерживая температуру ниже 5°C. В конце добавления реакционную смесь перемешивали 15 минут, и раствор 1 добавляли в раствор 3 в течение 4 часов при температуре между -3 и 15°C. Полученную смесь затем перемешивали в течение 3 часов при 12-15°C.
Полученную реакционную смесь затем охлаждали до 0-10°C и добавляли раствор метанола (31,6 кг) и водного хлорангидрида кислоты (6,5 кг) и перемешивали в течение 12 ч. Затем добавляли воду (43 кг), и фазы разделяли. Органическую фазу промывали насыщенным раствором хлорида натрия (48 кг) и упаривали при пониженном давлении. Затем загружали гептан B (44,2 кг), и полученную смесь оставляли охлаждаться на ночь. После 3 ч перемешивания при 0-5°C отфильтровали осадок и промывали холодным гептаном (7 кг). После сушки получали продукт (13,5 кг/выход: 92,4%) в виде белого порошка. Данные ЯМР и МС соответствовали данным, приведенным в примере 2.
Пример 4. Крупномасштабное получение 4-(2-хлор-5-йодбензил)фенола (1)
Раствор 1. В реактор, имеющий стеклянную внутреннюю поверхность, загружали (2-хл6р-5-йодфенил)(4-метоксифенил)метанон (200,0 кг/1,0 экв.) и толуол (1200 кг) в атмосфере азота, и полученный раствор перегоняли до удаления из реакционной смеси 200 кг растворителей, чтобы удалить из реакционной смеси возможные следы воды и спирта. После охлаждения до комнатной температуры загружали тетраметилдисилоксан (72 кг/1,0 экв.), и полученный раствор перемещали и упаковывали в атмосфере азота в пластиковые баки.
Раствор 2. В реактор, имеющий стеклянную внутреннюю поверхность, загружали трис(пентафторфенил)боран (1,56 кг/0,006 экв.) и толуол (176 кг) в атмосфере азота, и полученную реакционную смесь перемешивали до растворения и переносили в пластиковый бак в инертной атмосфере.
Раствор 3. В реактор, имеющий стеклянную внутреннюю поверхность, загружали тетраметилдисилоксан (72 кг/1,0 экв.) и толуол (176 кг) в атмосфере азота, и полученную реакционную смесь охлаждали до -5°C. Раствор 2 добавляли в раствор 3 в течение 30 минут, поддерживая температуру ниже 5°C. После добавления реакционную смесь перемешивали 15 минут, и раствор 1 добавляли в раствор 3 в течение 3,45 ч при температуре между -3 и 15°C. Полученную смесь затем перемешивали в течение 3 ч при 12-15°C.
Реакционную смесь затем охлаждали до 0-10°C и добавляли раствор метанола (400 кг) и 33% соляной кислоты (82 кг). После добавления реакционную смесь нагревали до 15-20°C и перемешивали в течение 8-12 ч.
Добавляли воду (544 кг), и слои разделяли. Органический слой промывали насыщенным раствором хлорида натрия (150 кг NaCl в 461 кг воды). После отфильтровывания органического слоя, растворитель удаляли при пониженном давлении, не превышая температуру 60°C. Затем добавляли гептан B (560 кг) при 50-55°C. Полученную реакционную смесь перемешивали 2 часа при 50-55°C и оставляли охлаждаться при 0-5°C. После 3 ч перемешивания при 0-5°C, осадок отфильтровывали и промывали предварительно охлажденным до 0-5°C гептаном B (100 кг). Сырой продукт (200 кг) затем сушили под вакуумом при 40°C в течение 24 часов. После сушки получали 148,9 кг указанного в заголовке соединения (выход = 80,5%) в виде белого порошка. Данные ЯМР и МС соответствовали данным, указанным в Примере 2.
Пример 5а. Получение 2-циклопропоксиэтил 4-метилбензолсульфоната (2)
Указанное в заголовке соединение получали в две стадии из 2-(2-бромэтил)-1,3-: диоксолана посредством реакции Барбье - магний-катализируемого внутримолекулярного раскрытия цикла/циклизации.
Получение 2-циклопропоксиэтанола
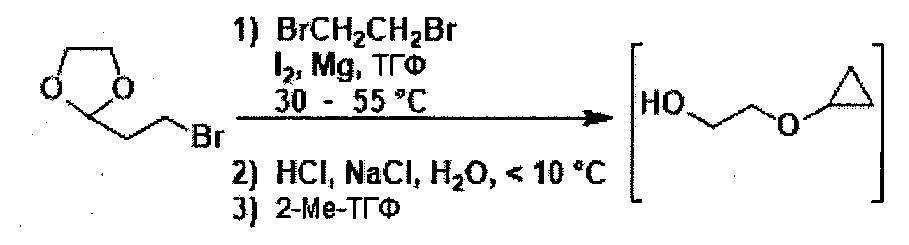
В 1500-литровый реактор, имеющий стеклянную внутреннюю поверхность, оснащенный подачей азота снизу, загружали ТГФ (200 кг, 1,67 экв.) при перемешивании (80 об/мин), после чего добавляли магниевые стружки (27,4 кг, 1,7 экв.) и йод (1,0 кг, 0,06 экв.). Полученную смесь нагревали до температуры между 30 и 40°C и добавляли по каплям продутый азотом раствор 1,2-дибромэтана (5,0 кг) в ТГФ (20,0 кг). После начала реакции Гриньяра, добавляли раствор 1,2-дибромэтана (53,6 кг) в ТГФ (250,0 кг) в течение 10 ч, поддерживая внутреннюю температуру около 50°C.
По окончании добавления, медленно добавляли раствор 2-(2-бромэтил)-1,3-диоксолана (120,0 кг, 1,0 экв.) в ТГФ (270,0 кг, 2,25 вес/вес) в течение 10 ч, поддерживая внутреннюю температуру около 50°C. Полученную реакционную смесь перемешивали при 40~50°C в течение 20 ч, в процессе чего формировался обильный осадок из белых твердых веществ (вероятно, бромид магния (II)).
При продувании азотом, смесь охлаждали до 0°C, и очень медленно добавляли обескислороженную воду (160 кг), поддерживая внутреннюю температуру ниже 10°C.Концентрированный хлороводород (67,2 кг, 0,56 экв.) добавляли в насыщенный раствор хлорида натрия (420 кг) при интенсивном перемешивании. Полученный раствор хлорида натрия в HCl очень медленно добавляли в реакционную смесь Гриньяра, поддерживая внутреннюю температуру ниже 10°C. Полученную смесь перемешивали при 10-20°C в течение 2 ч перед отделением органического слоя, и водный слой экстрагировали 2-метилтетрагидрофураном (3×160 кг).
Получение 2-циклопропоксиэтил 4-метилбензолсульфоната (2)
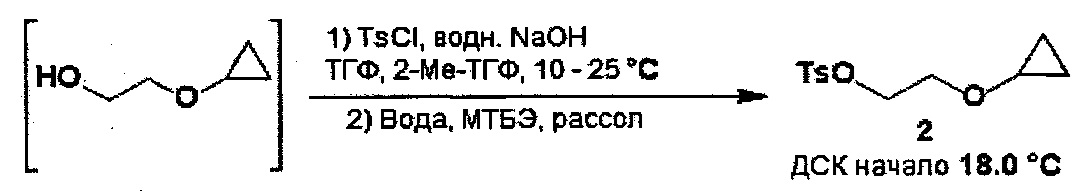
Вышеуказанный органический раствор 2-циклопропоксиэтанола охлаждали до 0°C и добавляли водный раствор гидроксида натрия (80,0 кг) в воде (300,0 кг). П-толуолсульфонил хлорид (151,0 кг, 1,2 экв.) добавляли в течение 8 ч, поддерживая внутреннюю температуру ниже 5°C. Полученную реакционную смесь охлаждали до 0°C и перемешивали еще 16 ч. Охлаждение прекращали, и фазы разделяли в процессе медленного нагревания смеси до 20-25°C. Водный слой разбавляли водой (240,0 кг) и экстрагировали MTBE (180,0 кг). Объединенные органические фазы промывали насыщенным раствором хлорида натрия (240,0 кг). Органический слой упаривали при пониженном давлении (поддерживая температуру бани ниже 45°C), получая масло (130 кг).
В полученное масло добавляли абсолютный спирт (156,0 кг). Добавляли деионизованную воду (65,0 кг), и полученную смесь осторожно нагревали до температуры около 30°C до прозрачности раствора. Полученный раствор охлаждали до 0°C и перемешивали в течение 5 ч при -5-0°C. Твердые фракции отфильтровывали. Твердые фракции (120,0 кг) добавляли в абсолютный спирт (135,0 кг). Добавляли деионизованную раствора (около 30°C). Полученную смесь охлаждали до 0°C, и затем охлаждали в течение 5 ч при -5-0°C. Полученную смесь фильтровали, собирали твердый осадок и сушили его в вакууме, получая 107 кг указанного в заголовке соединения (66,3% выход).1H ЯМР (400 МГц, CDCl3) δ 7,82 (д, J=8,4 Гц, 2Н), 7,36 (д, J=8,4 Гц, 2Н), 4,17 (т, J=4,8 Гц, 2Н), 3,70 (т, J=4,8 Гц, 2Н), 3,30-3,24 (м, 1H), 2,47 (с, 3H), 0,55-0,42 (м, 4Н). ДСК начало 18°C.
Альтернативно, в стеклянный флакон объемом 40 мл загружали описанное выше масло (1,0 г) и метанол/н-гексан (10:1, 5 мл) при перемешивании при 30-35°C. После превращения полученной смеси в прозрачный раствор, смесь охлаждали до -10-5°C и перемешивали еще 4 часа. Полученную смесь фильтровали, и осадок на фильтре сушили лиофилизацией в течение 24 часов, получая белое твердое вещество. Выход: 0,82 г (82,0%).
Пример 5b. Кристаллизация 2-циклопропоксиэтил 4-метилбензолсульфоната (2)
Условия кристаллизации для соединения 2 представлены в следующих таблицах:
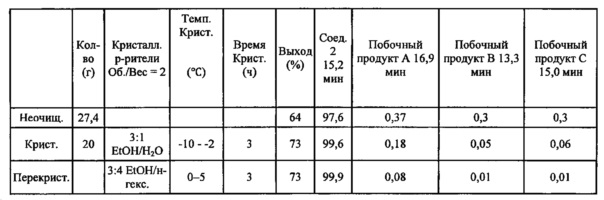
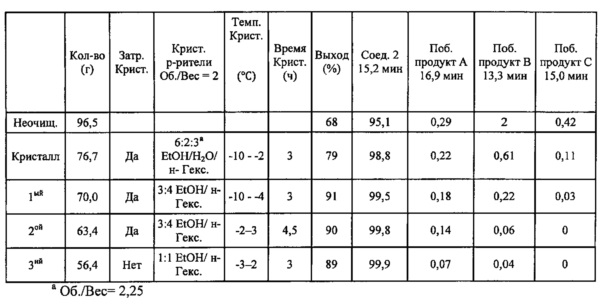
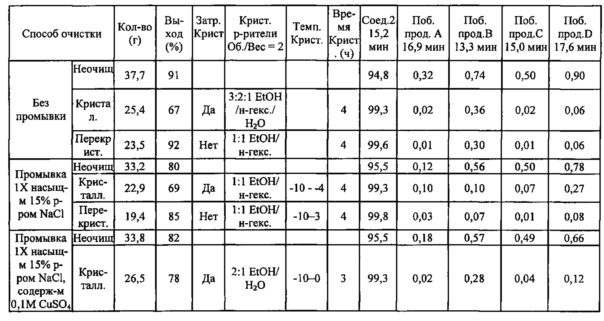
Побочные продукты A и B имеют следующие структуры:
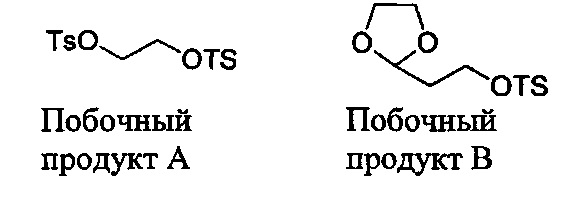
Другие применяемые растворители: 3:1 EtOH:вода, 2:1 EtOH:вода, 3:4 EtOH:н-гексан, 6:2:3 EtOH:вода:н-гексан, 3:2:1 EtOH:вода:н-гексан, 1:1 EtOH:н-гексан, 3:4 EtOH:н-гептан и 1:1 MeOH:н-гептан.
Пример 6. Получение 2-циклопропоксиэтил 4-метилбензолсульфоната (2)
Указанное в заголовке соединение получали в две стадии из 2-(2-бромэтил)-1,3-диоксолана, с применением реакции Барбье - магний-катализируемого внутримолекулярного раскрытия цикла/циклизации.
Получение 2-циклопропоксиэтанола
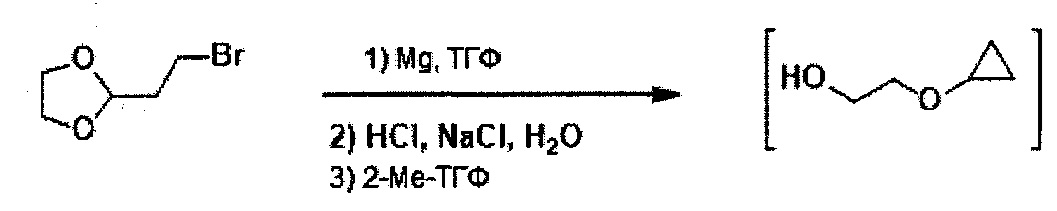
Круглодонную колбу, оснащенную термометром, магнитной мешалкой, обратным холодильником и капельной воронкой, продували азотом и загружали безводный ТГФ (44 мл) и магний (4,5 г, 0,185 моль). После перемешивания и продувания азотом при температуре окружающей среды (23-28°C), добавляли 2-(2-бромэтил)-1,3-диоксолан (3 г, 2,0 мл, 15 ммоль) в один прием. После перемешивания инициировали реакцию (применяли водяную баню для поддержания внешней температуры ниже 30°C).
Оставшийся 2-(2-бромэтил)-1,3-диоксолан (27 г, 17,7 мл, 0,15 моль) в ТГФ (30 мл) добавляли в полученную смесь через подходящую капельную воронку в токе азота при скорости, поддерживающей внутреннюю температуру в диапазоне 45°C-60°C (внешнюю температуру водяной бани поддерживали на уровне 20°C-30°C). После добавления смесь нагревали до 60°C и перемешивали в токе азота в течение ночи.
Продутый азотом 37%-ный водный раствор соляной кислоты (16,4 г) и хлорида натрия (18,2 г) в воде (93 г) добавляли по каплям в реакционную смесь, поддерживая внутреннюю температуру между -15°C и -10°C. Полученную реакционную смесь нагревали до 10°C-15°C. Реакционную смесь экстрагировали тремя порциями по 35 мл 2-метилтетрагидрофурана. Объединенный органический раствор использовали напрямую в следующей стадии.
Получение 2-циклопропоксиэтил 4-метилбензолсульфоната (2)
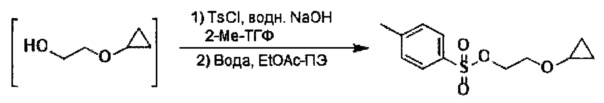
Круглодонную колбу, оснащенную термометром, магнитной мешалкой, обратным холодильником и капельной воронкой, продували азотом и загружали описанный выше раствор 2-циклопропоксиэтанола в 2-метилтетрагидрофуране. Полученную смесь охлаждали до -5°C-0°C при перемешивании. Водный раствор NaOH (20,1 г) в воде (87 мл) добавляли по каплям в указанную смесь, поддерживая внутреннюю температуру между -5°C и 0°C. Добавляли 4-метил-бензолсульфонил хлорид (37,8 г), поддерживая внутреннюю температуру между 0°C и 5°C. Полученную реакционную смесь перемешивали при 0°C-5°C в атмосфере азота еще 5 часов в охлаждающей бане. Охлаждающую баню удаляли, и реакционную смесь медленно нагревали до 10°C-20°C и, перемешивали в течение ночи.
В реакционную смесь добавляли насыщенный раствор хлорида натрия (57 г воды и 15 г NaCl). Полученную смесь экстрагировали смесью этилацетат/петролейный эфир (38 мл EtOAc и 8 мл петролейного эфира, трижды). Объединенные органические слои промывали насыщенным раствором хлорида натрия (54 г) и водой (30 мл), и затем упаривали при пониженном давлении при 35-40°C, получая неочищенный продукт в виде жидкости. Выход: 32 г (75%).
Пример 7. Получение 2-циклопропоксиэтил 4-метилбензолсульфоната (2)
Указанное в заголовке соединение получали в две стадии из 2-(2-бромэтил)-1,3-диоксолана, с применением реакции Барбье - магний-катализируемого внутримолекулярного раскрытия цикла/циклизации.
Получение 2-циклопропоксиэтанола
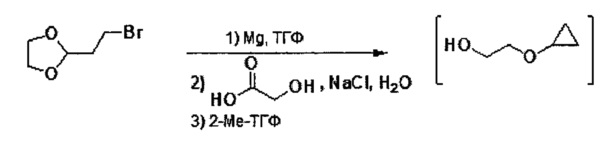
Четырехгорлую 2-литровую колбу, оснащенную термометром, магнитной мешалкой, обратным холодильником и капельной воронкой, продували азотом и загружали безводный ТГФ (500 мл) и магний (30 г, 1,2 моль). После перемешивания и продувания азотом в течение 45 минут при температуре окружающей среды (23-28°C), добавляли в один прием 2-(2-бромэтил)-1,3-диоксолан (20 г, 13,1 мл, 0,1 моль). После перемешивания в течение 5 минут, инициировали реакцию, и внутренняя температура поднималась с 25°C до 45°C (применяли водяную баню для поддержания внешней температуры ниже 30°C).
Оставшийся 2-(2-бромэтил)-1,3-диоксолан (180 г, 118,1 мл, 1,0 моль) добавляли в указанную смесь через подходящую капельную воронку в течение 2,5 часов в токе азота со скоростью, которая позволяла поддерживать внутреннюю температуру на уровне 40-60°C (температуру внешней водяной бани оставляли на уровне 20-30°C). По завершении добавления, полученную реакционную смесь медленно охлаждали до 20-30°C в течение 4 часов. Реакционную смесь затем нагревали до 60°C и перемешивали в токе азота в течение ночи.
Продутую азотом воду (200 г, 11,1 моль) добавляли по каплям в полученную реакционную смесь в течение 1 часа, поддерживая температуру между -15°C и -10°C (перед добавлением деионизованную воду дегазировали продуванием азотом в течение 40 минут). Продутый азотом водный раствор гликолевой кислоты (75,6 г, 0,99 моль) и хлорида натрия (100 г, 1,7 моль) в воде (400 г, 22,2 моль) добавляли по каплям в реакционную смесь в течение 3 часов, поддерживая внутреннюю температуру между -15°C и -10°C (перед добавлением водный раствор дегазировали продуванием азотом в течение 1 часа). По завершении добавления, полученную реакционную смесь перемешивали при -15-10°C в течение 10 минут. Реакционную смесь нагревали до 10-15°C. Реакционную смесь экстрагировали тремя порциями по 200 г 2-метилтетрагидрофурана. Объединенный органический раствор использовали напрямую в следующей стадии.
Получение 2-циклопропоксиэтил 4-метилбензолсульфоната (2)
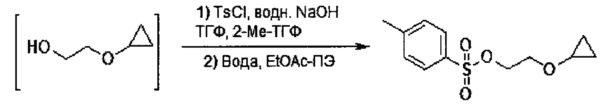
Четырехгорлую 3-литровую колбу, оснащенную термометром, магнитной мешалкой, обратным холодильником и капельной воронкой, продували азотом и загружали описанный выше раствор 2-циклопропоксиэтанола в ТГФ и 2-метилтетрагидрофуран. Полученную реакционную смесь охлаждали до -5°C - 0°C при перемешивании (100 об/мин). Предварительно охлажденный (0°C) водный раствор NaOH (134 г, 3,3 моль) в воде (580 мл) добавляли по каплям в полученную смесь в течение 40 минут, поддерживая внутреннюю температуру между -5°C и 0°C. Реакционную смесь перемешивали в течение еще 20 минут при -5°C-0°C. Порциями добавляли 4-метил-бензолсульфонил хлорид (252 г, 1,32 моль) в течение 40 минут, при этом поддерживая внутреннюю температуру между -5°C и 0°C. Полученную реакционную смесь перемешивали при -5°C-0°C в атмосфере азота еще 5 часов в охлаждающей бане. Охлаждающую баню удаляли, и реакционную смесь медленно нагревали до 10-20°C и перемешивали в течение ночи.
В реакционную смесь добавляли насыщенный раствор хлорида натрия (400 мл). Полученную смесь экстрагировали смесью этилацетат/петролейный эфир (фракции: 60°C-90°C) (5:1 об./об., 300 мл×3). Объединенные органические слои промывали насыщенным раствором хлорида натрия (300 мл) и водой (200 мл), и затем упаривали при пониженном давлении при 40°C, получая неочищенный продукт в виде жидкости (215,6 г, выход: 76%, чистота: 99,0%. В неочищенный продукт добавляли 200 г этанола и упаривали при пониженном давлении (~0,1 МПа) при 40°C для удаления любых остатков растворителей.
Пример 8. Получение 2-(4-(2-циклопропоксиэтокси)бензил)-1-хлор-4-йодбензола
Данный пример описывает получение 2-(4-(2-циклопропоксиэтокси)бензил)-1-хлор-4-йодбензола посредством сочетания 4-(2-хлор-5-йодбензил)фенола с 2-циклопропоксиэтил 4-метилбензолсульфонатом.
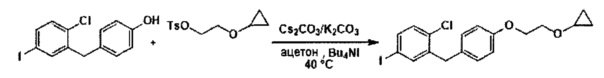
В атмосфере азота в 500-литровый реактор, имеющий стеклянную внутреннюю поверхность, при перемешивании (120 об/мин) загружали ацетон (123 кг), 4-(2-хлор-5-йодбензил)фенол (19,37 кг, 0,056 кмоль), 2-циклопропоксиэтил 4-метилбензолсульфонат (15,85 кг, 0,062 кмоль), порошок карбоната цезия (18,31 кг, 0,0562 кмоль), порошок карбоната калия (23,3 кг, 0,169 кмоль) и TBAI (4,15 кг, 0,011 кмоль). После перемешивания в течение 40-45 ч при 40°C, ТСХ тест (петролейный эфир (30-60°C фракция):этилацетат=4:1, Rf=0,3) показал отсутствие исходных веществ. Полученную реакционную смесь охлаждали до 20-25°C.
Реакционную смесь фильтровали через диатомовую землю (28 кг), и твердый остаток промывали ацетоном (2×31 кг). Объединенные фильтраты переносили в 500-литровый реактор, имеющий стеклянную внутреннюю поверхность, и упаривали. Осадок растворяли в этилацетате (175 кг), промывали водой (2×97 кг) и упаривали до достижения объема около 100 л, после чего перемещали в 200-литровый реактор, имеющий стеклянную внутреннюю поверхность, и продолжали упаривать до получения около 22,5 кг неочищенного вещества.
Неочищенное вещество растворяли в смеси метанол/н-гексан (10:1, 110 кг) при кипячении в течение 30 мин при перемешивании (100 об/мин) до прозрачности раствора. Полученную смесь охлаждали до 5-10°C и добавляли несколько затравочных кристаллов (20 г). Суспензию перемешивали в течение еще 5 ч при 5-10°C. Полученную смесь фильтровали при 0-5°C, и остаток на фильтре промывали предварительно охлажденной смесью метанол/н-гексан (10:1, 5°C, 2×11 кг). Осадок на фильтре сушили при пониженном давлении (0,09 МПа) при 15-20°C в течение 15 ч, получая твердое вещество от не совсем белого до белого цвета. Выход: 18,1 кг, 75%. Температура плавления: 31°C (ДСК начало).1H ЯМР (CDCl3, 400 МГц): δ 7,45~7,50 (м, 2Н), 7,09~7,12 (м, 3H), 6,88 (д, J=8,8 Гц, 2Н), 4,11 (т, J=5,2 Гц, 2Н), 3,99 (с, 2Н), 3,88 (т, J=5,2 Гц, 2Н), 3,40~3,44 (м, 1Н), 0,63~0,67 (м, 2Н), 0,49~0,54 (м, 1Н). MS ESI (m/z): 429 [M1]+.13C ЯМР (CDCl3, 100 МГц): δ 157,5, 141,5, 139,5, 136,6, 134,2, 131,2, 130,8, 129,9, 114,9, 91,66, 69,00, 67,13, 53,72, 38,08, 5,63.
Несмотря на то, что настоящее изобретение было подробно описано посредством иллюстрации и примеров в целях ясности понимания, квалифицированному специалисту в данной области техники понятно, что в рамках объема прилагаемой формулы изобретения возможны некоторые изменения и модификации. Кроме того, каждая приведенная ссылка полностью включена посредством ссылки таким образом, как если бы каждый отдельный источник был отдельно включен посредством ссылки. При возникновении противоречия между текстом настоящей патентной заявки и приведенной в ней ссылки, преимущество должно отдаваться тексту настоящей патентной заявки.
Реферат
Настоящее изобретение относится к способу получения соединения формулы (I), где по меньшей мере Rпредставляет собой –OR, Rвыбран из группы, состоящей из атома водорода и силильной группы, которые используют в качестве промежуточных соединений для получения ингибиторов SGLT2. Способ включает получение реакционной смеси, содержащей соединение формулы (II), силановый восстановитель, выбранный из группы, состоящей из тетраметилдисилоксана (TMDS), пентаметилдисилоксана (PMDS), полиметилгидросилоксана (PMHS) и EtSiH, катализатор, выбранный из группы, состоящей из B(CF), -BF-THF, BF-BuO, BF-MeCN, BFAcOH, BFHPOи BF, и растворитель. Предлагаемый способ позволяет получить целевые продукты с высоким выходом. 22 з.п. ф-лы, 9 ил., 9 пр.(I)(II)
Формула
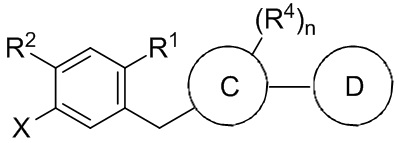
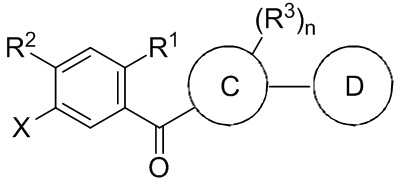
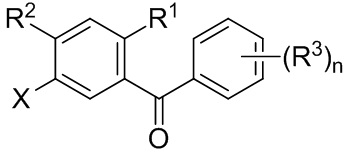
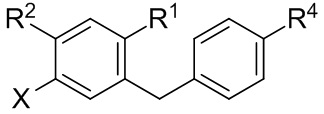
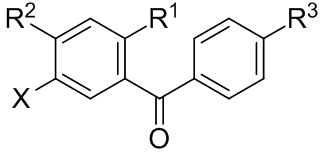
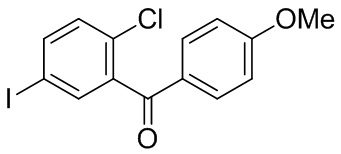
Документы, цитированные в отчёте о поиске
С-арилглюкозидные ингибиторы sglt2

Комментарии