Экстракт, обогащенный нмп - RU2592679C2
Код документа: RU2592679C2
Чертежи













Описание
Настоящее изобретение относится к обогащенному N-метилпиридинием (NMP) экстракту депарафинированного тригонеллин-содержащего органического материала со значительно сниженным содержанием С5НТ, способу его получения, использованию указанного обогащенного NMP экстракта депарафинированного тригонеллин-содержащего органического материала в качестве пищевой добавки и к пищевому продукту, содержащему указанный экстракт.
Экстракты тригонеллин-содержащего органического материала, такие как, например, кофейные напитки, представляют собой сложные растворы, содержащие биологически активные соединения, которые взаимодействуют со своим микроокружением в желудке человека. Предполагается, что благодаря такому взаимодействию усиливается секреция кислоты желудочного сока. Поэтому несколько раз сообщалось о желудочном раздражении после употребления кофе. В сложном процессе секреции кислоты желудочного сока, ключевым игроком является желудочная H+,K+-АТФаза. Благодаря активации париетальных клеток гормонами и трансмиттерами она транспортирует водород в полость желудка в обмен на калий и подкисляет желудок. Параллельно, в полость желудка секретируется хлорид. Процесс в целом регулируется благодаря рецепторам клеточной поверхности. Стимуляция секреции кислоты желудочного сока медиируется H2-гистаминовым рецептором, М3-ацетилхолиновым рецептором и холецистокининовым бета-рецептором. Обратная регуляция происходит путем активации рецептора соматостатина. Таким образом, гормоны гистамин, гастрин и соматостатин, а также ацетилхолин, играют критическую роль в регуляции секреции кислоты. Активация рецепторов клеточной поверхности прямо связана с внутриклеточной трансдукцией сигнала. Было показано, что MAPK-киназы и рецепторные тирозинкиназы принимают участие в регуляции секреции кислоты желудочного сока. До этого момента, активация рецептора фактора роста эпителия (EGFr) связана с повышенным секреторным статусом париетальных клеток. Последующая передача сигналов активирует Akt1 и ERK1/2 MAPK-киназы. Передача сигналов Akt1 активирует транскрипцию H+,K+-АТФазы, а также усиливает секреторную активность париетальных клеток. ERK1/2 проявляет острый ингибирующий эффект на секреторную активность, но предполагается, что его хроническая стимуляция является просекреторной. Однако, считается, что ERK1/2 также активирует экспрессию гена H+,K+-АТФазы. Помимо этих сигнальных путей, после активации связанного с GS-белком Н2-гистаминового рецептора образуется циклический АМФ. Циклический АМФ может активировать протеинкиназу А, которая в свою очередь может активировать фактор транскрипции в ядре. Фактор транскрипции ATF-2 может принимать участие в экспрессии H+,K+-АТФазы и рецептора соматостатина 2, поскольку оба гена содержат циклический АМФ-чувствительный элемент.
До обжаривания, необработанные кофейные зерна содержат от примерно 1000 до 1400 мкг/г N-алканоил-5-гидрокситриптамида (С5НТ), а жареные кофейные зерна содержат от примерно 500 до 800 мкг/г С5НТ. Кроме того, жареные кофейные зерна, подвергнутые декофеинизации, содержат примерно 50 мкг/л С5НТ. Дополнительно, кофе с кофеином содержит от примерно 200 до 500 мкг/л С5НТ, тогда как декофеинированный кофе содержит примерно 50 мкг/л С5НТ.
Соответственно, часто сообщалось, что употребление кофе ассоциировано с изжогой или раздражением желудка, которые оба могут быть индуцированы повышенной секрецией желудочной кислоты. Эффект кофейных напитков на желудочное раздражение и внутрижелудочный pH у людей впервые был исследован Ehrlich et al. (Ehrlich A, Basse H, Henkel-Ernst J, Hey B, Menthe J and Lücker PW. Effect of differently processed coffee on gastric activity difference and intraastric pH in healthy volunteers. ethods Find Exp Clin Pharmacol 20: 155-161, 2006). После приема перорально 150 мл кофейного напитка, приготовленного из обычного или обработанного паром кофе, последний индуцировал значительно меньшее раздражение слизистой у здоровых добровольцев, чем обычный кофейный напиток. На основании этих результатов было выдвинуто предположение, что продувка кофе паром значительно снижает содержание раздражающих желудок соединений в жареных кофейных зернах, и производители кофе начали маркировать продутый паром кофе как "безвредный для желудка" ('stomach-friendly). Эта технология была первоначально разработана для удаления кофеина и хлорогеновых кислот как основных соединений, позволяющих улучшить сенсорные характеристики кофейных напитков.
Таким образом, технической проблемой, лежащей в основе настоящего изобретения, является обеспечение продукта или других средств предотвращения или уменьшения желудочных проблем, вызванных секрецией кислоты желудочного сока, который может быть использован, например, в качестве пищевой добавки.
Решение вышеуказанной технической проблемы достигается с помощью вариантов осуществления, охарактеризованных в формуле изобретения.
В частности, настоящее изобретение относится к способу получения обогащенного N-метилпиридинием (NMP) экстракта из тригонеллин-содержащего органического материала, сключающему стадии:
(a) депарафинирования тригонеллин-содержащего органического материала;
(b) обжаривания тригонеллин-содержащего органического материала;
(c) обработки обжареного тригонеллин-содержащего органического материала горячей водой для получения водного экстракта; и
(d) прибавления NMP к водному экстракту.
Депарафинирование тригонеллин-содержащего органического материала, обжаривание тригонеллин-содержащего органического материала, а также экстракция горячей водой могут быть осуществлены способами, хорошо известными специалистам.
Например, депарафинирование на Стадии (а) может быть осуществлено способами, описанными van der Stegen, 1979 (van der Stegen, The effect of dewaxing of green coffee on the coffee brew, Fd. Chem (4) 23-29, 1979).
В тех случаях, когда тригонеллин-содержащий органический материал содержит кофеин, способ по настоящему изобретению может необязательно дополнительно включать стадию декофеинирования тригонеллин-содержащего органического материала до и/или после стадии (а), например, путем обработки тригонеллин-содержащего органического материала этилацетатом. Эта стадия может быть осуществлена способами, хорошо известными специалистам.
В предпочтительном варианте осуществления, степень обжаривания тригонеллин-содержащего органического материала после обжаривания на Стадии (b) составляет по меньшей мере 50, более предпочтительно, по меньшей мере 80, более предпочтительно, по меньшей мере 100 делений шкалы. В другом предпочтительном варианте осуществления, степень обжаривания тригонеллин-содержащего органического материала после обжаривания на Стадии (b) составляет от 40 до 110 делений шкалы, более предпочтительно, от 60 до 90 делений шкалы и еще более предпочтительно, от 70 до 90 делений шкалы, и наиболее предпочтительно, от 70 до 80 делений шкалы. Что касается окраски, то степень обжаривания менее 50 делений шкалы считается темной, степень обжаривания примерно 75 делений шкалы считается средней, и степень обжаривания, равная по меньшей мере 90 делений шкалы, считается светлой. Степень обжаривания может быть легко определена квалифицированным специалистом в данной области техники, например, с помощью прибора для определения окраски Dr. Lange - LFM 1, прибора для определения окраски Dr. Lange - LK 100 или прибора для определения окраски RSM 2, производимого фирмой Schaltex GmbH, согласно соответствующим протоколам, предоставляемым производителями указанного устройства.
После обжаривания на Стадии (b) вышеуказанного способа, тригонеллин-содержащий органический материал, предпочтительно, имеет содержание С5НТ менее 50 мкг/г С5НТ, более предпочтительно, менее 40 мкг/г С5НТ, еще более предпочтительно, менее 30 мкг/г С5НТ, еще более предпочтительно, менее 20 мкг/г С5НТ, и наиболее предпочтительно, менее 10 мкг/г С5НТ.
Способ по настоящему изобретению необязательно дополнительно включает стадию помола обжаренного тригонеллин-содержащего органического материала после стадии (b). В предпочтительном варианте осуществления настоящего изобретения, тригонеллин-содержащий органический материал представляет собой кофе, которое размалывают до марки, выбранной из группы, состоящей из тонкого, среднего и грубого помола.
Обработка горячей водой на Стадии (с) не подлежит каким-либо ограничениям. Например, обработка горячей водой на Стадии (с) может осуществляться в течение по меньшей мере 30 секунд и/или вода может иметь температуру по меньшей мере 80°С.
Способ по настоящему изобретению, необязательно, дополнительно включает стадии фильтрации водного экстракта перед и/или после стадии (d). Предпочтительно, фильтрация осуществляется при комнатной температуре с использованием коммерчески доступных кофейных фильтров под действием силы тяжести.
В другом предпочтительном варианте осуществления, по меньшей мере 2,95 мг NMP/100 мл, более предпочтительно, по меньшей мере 5 мг NMP/100 мл, более предпочтительно, по меньшей мере 8 мг NMP/100 мл, прибавляют к водному экстракту на Стадии (d).
Предпочтительно, обогащенный NMP экстракт, полученный способом по настоящему изобретению, содержит по меньшей мере 23 мг/л NMP, более предпочтительно, по меньшей мере 36 мг/л NMP, более предпочтительно, по меньшей мере 48 мг/л NMP.
Обогащенный NMP экстракт, полученный способом по настоящему изобретению, предпочтительно, имеет пониженное содержание С5НТ. В частности, обогащенный NMP экстракт, полученный способом по настоящему изобретению, предпочтительно, имеет пониженное содержание С5НТ по сравнению с тригонеллин-содержащим органическим материалом, используемым в качестве исходного материала в способе по настоящему изобретению.
В предпочтительном варианте осуществления, обогащенный NMP экстракт, полученный способом по настоящему изобретению, содержит менее 50 мкг/л С5НТ, более предпочтительно, менее 40 мкг/л С5НТ, еще более предпочтительно, менее 30 мкг/л С5НТ, еще более предпочтительно, менее 20 мкг/л С5НТ, и наиболее предпочтительно, менее 10 мкг/л С5НТ.
В другом предпочтительном варианте осуществления, соотношение NMP/C5HT×100 в обогащенном NMP экстракте, полученном способом по настоящему изобретению составляет по меньшей мере 100, более предпочтительно, по меньшей мере 120, более предпочтительно, по меньшей мере 140, и наиболее предпочтительно, по меньшей мере 180.
Термин "N-метилпиридиний", в используемом тут значении, относится к N-метилпиридинию в его ионной форме, а также в форме соли, например, в виде его йодида (NMPI), хлорида, гидроксида или сульфата. Аббревиатуры N-MP и NMP используются тут синонимично для обозначения N-метилпиридиния.
Термин "тригонеллин-содержащий органический материал", в используемом тут значении, относится к любому встречающемуся в природе материалу, содержащему алкалоид тригонеллин.
В общем, тригонеллин-содержащий органический материал выбирают из группы, состоящей из кофе, в частности, Coffea arabica, Coffea canephora, Coffea spp.и Psilanthus spp., членов Fabaceae, в частности, Pisum sativum, Glycine max, Phaseolus vulgaris, Lens culinaris, Cicer arietinum и Trigonella foenum-graecum, членов Chenopodiaceae, в частности Chenopodium quinoa, и членов Роасеае, в частности, Avena sativa.
В предпочтительном варианте осуществления, тригонеллин-содержащий органический материал представляет собой Coffea spp. В более предпочтительном варианте осуществления, тригонеллин-содержащий органический материал представляет собой Coffea arabica, более предпочтительно, Coffea arabica, provenience Columbia, или Coffea arabica, provenience Brazil. В другом предпочтительном варианте осуществления, тригонеллин-содержащий органический материал представляет собой Coffea canephora, также известный как "кофе робуста", более предпочтительно, Coffea canephora, provenience Vietnam.
Настоящее изобретение дополнительно относится к обогащенному N-метилпиридинием (NMP) экстракту, полученному способом по настоящему изобретению.
В другом аспекте, настоящее изобретение также относится к использованию указанного обогащенного N-метилпиридинием (NMP) экстракта в качестве пищевой добавки.
В другом аспекте, настоящее изобретение относится к фармацевтической композиции, содержащей, в терапевтически эффективном количестве, обогащенный N-метилпиридинием (NMP) экстракт по настоящему изобретению, необязательно, в комбинации с одним или несколькими фармацевтически приемлемым эксципиентом (эксципиентами) и/или носителем (носителями) и/или разбавителем (разбавителями) и/или растворителем (растворителями) и/или солью (солями) и/или буфером (буферами).
Фармацевтическая композиция в соответствии с настоящим изобретением может иметь любую пригодную форму, известную специалистам. Предпочтительно, она представляет собой твердую форму, жидкую форму или форму аэрозоля. Введение фармацевтической композиции по настоящему изобретению может быть осуществлено в любой пригодной форме, известной специалистам, например, перорально, внутривенно, интрадермально, интраперитонеально, внутримышечно или путем ингаляции.
Фармацевтическая композиция по настоящему изобретению является пригодной для предотвращения или снижения секреции кислоты желудочного сока и для профилактики или ослабления расстройств и/или болезней, связанных с секрецией кислоты желудочного сока.
В еще одном аспекте, настоящее изобретение относится к способу предотвращения или снижения секреции кислоты желудочного сока и к the профилактике расстройств и/или болезней, связанных с секрецией кислоты желудочного сока, причем указанный способ включает введение субъекту обогащенного N-метилпиридинием (NMP) экстракта по настоящему изобретению и/или медикамента и/или фармацевтической композиции по настоящему изобретению. Такое введение не подлежит каким-либо особым ограничениям и может осуществляться в любой форме, известной специалистам, например, перорально, внутривенно, интрадермально, интраперитонеально или внутримышечно. В предпочтительном варианте осуществления, субъект является человеком.
В предпочтительном варианте осуществления, расстройства и/или болезни, связанные с секрецией кислоты желудочного сока, выбирают из группы, включающей гастроэзофагеальную рефлюксную болезнь, раки и язвы. В более предпочтительных вариантах осуществления, рак представляет собой рак желудка, и язва представляет собой язву желудка.
В другом аспекте, настоящее изобретение относится к пищевому продукту, обогащенному N-метилпиридинием (NMP) путем прибавления указанного обогащенного NMP экстракта по настоящему изобретению.
Термин "пищевой продукт", в используемом тут значении, относится к любому веществу которое может быть съедено или выпито животным или человеком, например, в качестве пищи и/или для удовольствия. В особенно предпочтительном варианте осуществления, пищевой продукт представляет собой кофе.
Предпочтительно, обогащенный NMP экстракт тригонеллин-содержащего органического материала, полученный способом по настоящему изобретению, объединяет высокое содержание NMP с низким содержанием С5НТ. Благодаря депарафинированию тригонеллин-содержащего органического материала содержание NMP в экстракте сохраняется, и содержание С5НТ снижается. Соответственно, обогащенный NMP экстракт по настоящему изобретению имеет очень предпочтительное соотношение NMP/C5HT. Вследствие этого, антисекреторный эффект NMP по отношению к кислоте желудочного сока пролонгируется во времени после употребления обогащенного NMP экстракта по настоящему изобретению путем минимизации содержания С5НТ.
На фигурах изображено:
Фигура 1: Внутриклеточный протонный индекс (IPX) клеток HGT-1, обработанных в течение 10 минут гистамином (HIS, 1 ммоль/л) или одной из фракций растворителя, приготовленного из кофейного напитка, в концентрациях, соответствующих количественному выходу: вода (Н2O: 2,14 мг/мл), этилацетат (EtAc: 0,16 мг/мл), дихлорметан (CH2Cl2: 0,18 мг/мл) и пентан: 0,005 мг/мл). Распределение количественно определяемых соединений по фракциям растворителя приведено в таблице ниже (Статистика: двусторонний t-критерий vs. контрольные клетки, ***=р.0.001, n=9).
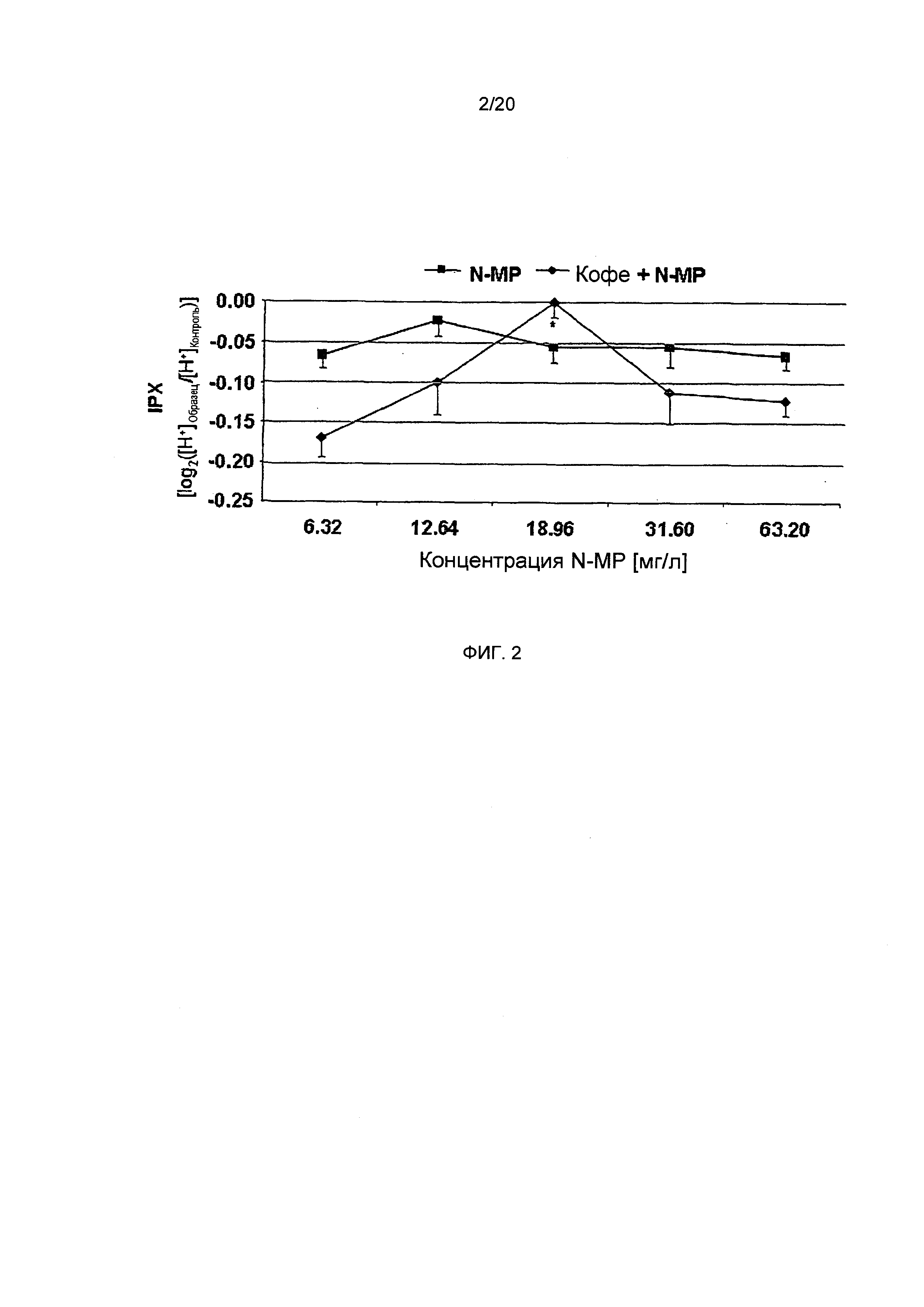
Фигура 2: Внутриклеточный протонный индекс (IPX) клеток HGT-1, обработанных в течение 10 минут разными концентрациями N-метилпиридиния в виде отдельного соединения (N-MP) или в комбинации с лиофилизатом, полученным из обычного кофе (Кофе + N-MP), при такой же концентрации N-метилпиридиния в системе, как и при его спользовании в виде отдельного соединения (Статистика: односторонний дисперсионный анализ (ANOVA) с дополнительным тестом Холма-Сидака (Holm-Sidak), *=p.0.05, n=9).
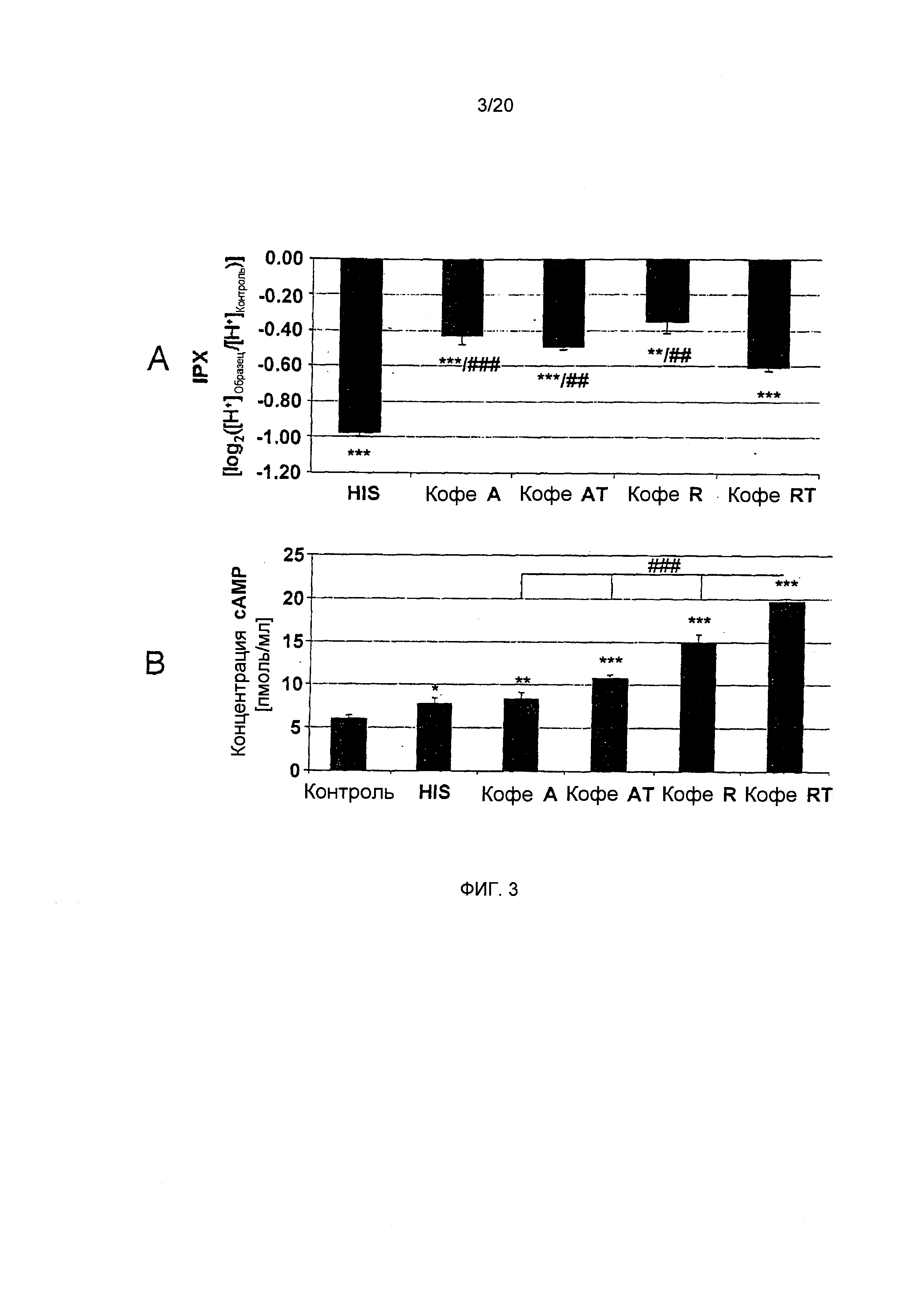
Фигура 3: Внутриклеточный протонный индекс (IPX, время воздействия: 10 мин., А) и содержание циклического АМФ (сАМР, время воздействия: 0,5 мин., В) для клеток HGT-1, обработанных гистамином (HIS: 1 ммоль/л) или лиофилизатами, (2,5 мг/мл) приготовленными из С. Arabica Brazil (Кофе А), обработанного паром С. Arabica Brazil (Кофе AT), С. Robusta Vietnam (кофе R) или обработанного паром С. Robusta Vietnam (кофе RT), с высокой (кофе A, AT), средней (кофе R) и низкой (кофе RT) концентрациями N-метилпиридиния, соответственно (Статистика: двусторонний t-критерий vs. контрольные клетки, "=р.0.01, ***=р.0.001, n=9; или vs. кофе RT ##=p.0.01, ###=р.0.001).
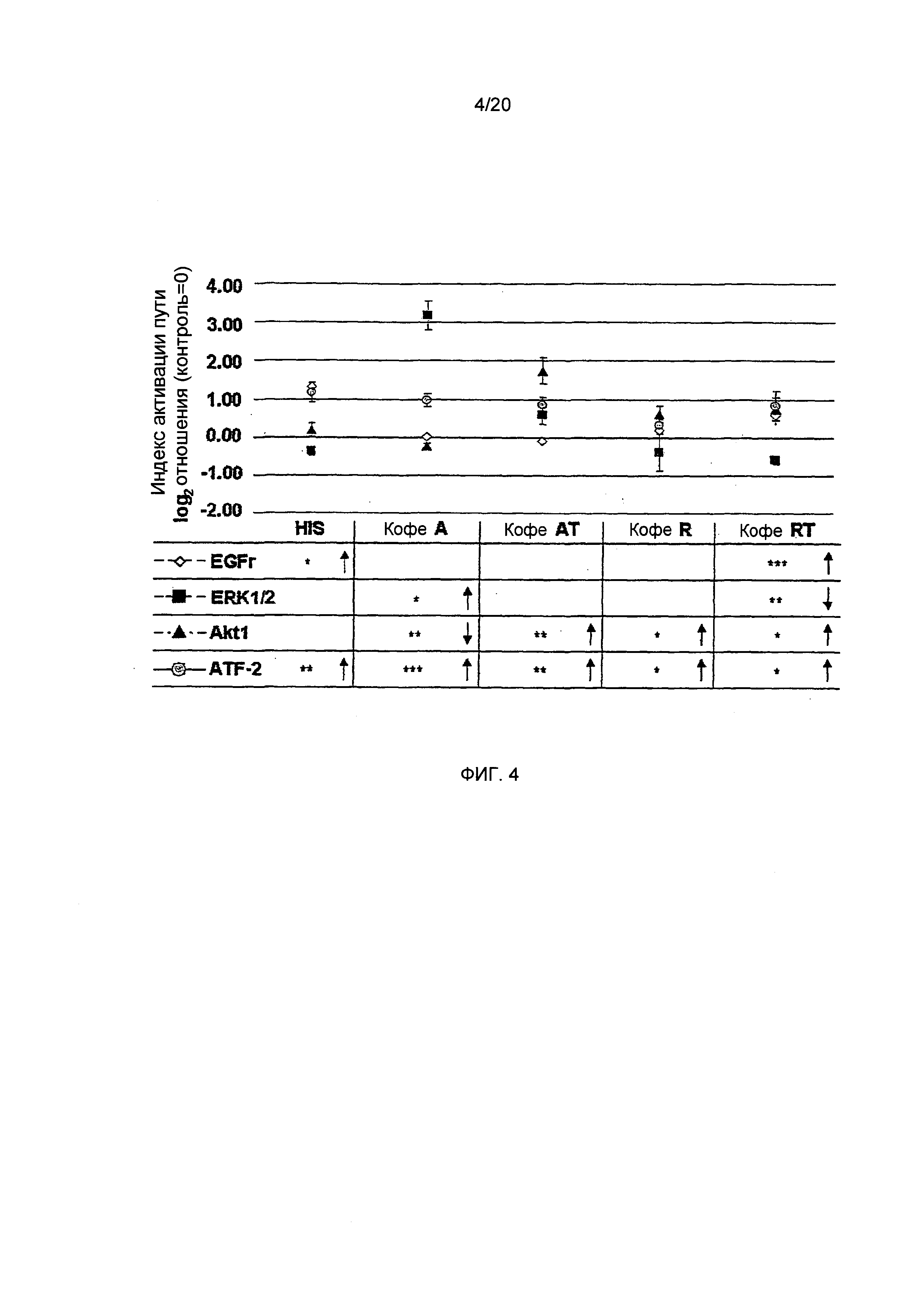
Фигура 4: Индексы активации путей EGFr, ERK1/2, Akt1 и ATF-2 в клетках HGT-1, обработанных в течение 10 мин. гистамином (HIS: 1 ммоль/л) или лиофилизатами (2,5 мг/мл) приготовленными из С. Arabica Brazil (Кофе А), обработанного паром С. Arabica Brazil (Кофе AT), С. Robusta Vietnam (кофе R) или обработанного паром С. Robusta Vietnam (кофе RT), с высокой (кофе A, AT), средней (кофе R) и низкой (кофе RT) концентрациями N-метилпиридиния, соответственно. (Статистика: двусторонний t-критерий vs. контрольные клетки, **=р.0.01, ***=р.0.001, n=9; или vs. кофе RT ##=p.0.01, ###=р.0.001).
Фигура 5: Время-зависимые индексы экспрессии генов Н+,K+-АТФазы (АТР4А), Н2-гистаминового рецептора (HRH2), ацетилхолинового рецептора М3 (CHRM3) и рецептора соматостатина (SSTR2) в клетках HGT-1 после воздействия лиофилизатов (2,5 мг/л), приготовленных из С. Robusta Vietnam (кофе R) или обработанного паром С. Robusta Vietnam (кофе RT), со средней (кофе R) и низкой (кофе RT) концентрациями N-метилпиридиния, соответственно (Статистика: односторонний дисперсионный анализ с дополнительным тестом Холма-Сидака, *=р.0.05, **=р.0.01, n=6; р-значение для одностороннего дисперсионного анализа указано на графике, в таблицах ниже приводятся значимые изменения временной зависимости по сравнению с наиболее выраженным изменением экспрессии, определенным путем проведения дополнительного анализа).
Фигура 6: Время-зависимые индексы экспрессии генов Н+,K+-АТФазы (АТР4А), Н2-гистаминового рецептора (HRH2), ацетилхолинового рецептора М3 (CHRM3) и рецептора соматостатина (SSTR2) в клетках HGT-1 после воздействия лиофилизатов (2,5 мг/л), приготовленных из С. Arabica Brazil (кофе А) или обработанного паром С. Arabica Brazil (кофе AT), с высокими концентрациями N-метилпиридиния (Статистика: односторонний дисперсионный анализ с дополнительным тестом Холма-Сидака, *=р.0.05, **=р.0.01, n=6; р-значение для одностороннего дисперсионного анализа указано на графике, в таблицах ниже приводятся значимые изменения временной зависимости по сравнению с наиболее выраженным изменением экспрессии, определенным путем проведения дополнительного анализа).
Фигура 7: Эффект отдельно взятого соединения и комбинации соединений на экспрессию гена Н+,K+-АТФазы (АТР4А) и Н2-гистаминового рецептора (HRH2). А: Было определено, что хлорогеновая кислота (СА) и кофеин (CAFF) через 20 минут осуществляют повышающую регуляцию экспрессии АТР4А. В отличие от этого, пирогаллол (PYR) и N-метилпиридиний (N-MP) осуществляют понижающую регуляцию экспрессии после 20 минут. (Статистика: односторонний дисперсионный анализ с дополнительным тестом). В: Комбинация СА, CAFF или обоих с N-NMP приводила к значительной компенсации повышающей регуляции CAFF или СА (Статистика: t-критерий для CS или CF vs. комбинация с N-MP или PYR). С: N-алканоил-гидрокситриптамиды (С5НТ) осуществляют чрезвычайно сильную понижающую регуляцию HRH2 после пяти минут. Катехин (CAT) также вызывает понижающую регуляцию. СА повышающее регулирует HRH2 после 20 минут. (Статистика: односторонний дисперсионный анализ с дополнительным тестом). D: Комбинация СА с С5НТ приводит к значительному увеличению экспрессии HRH2 (р.0.001) по сравнению с контрольными клетками. СА в комбинации с CAT не влияют на экспрессию HRH2 по сравнению с отдельно взятым CAT (Статистика: t-критерий для обработанных клеток vs. контрольных клеток). (*=р.0.05, **=р.0.01, ***=р.0.001, n=5-9)
Фигура 8: Эффект отдельно взятого соединения и комбинации соединений на экспрессию гена ацетилхолинового рецептора М3 (CHRM3) и рецептора соматостатина 2 (SSTR2). А: Экспрессия CHRM3 значительно усиливается пирогаллолом (PYR) и, в меньшей степени, кофеином (CAFF) и N-метилпиридинием (N-MP). N-MP через 20 минут, а также PYR через 15 минут вызывают последующую понижающую регуляцию. (Статистика: односторонний дисперсионный анализ с дополнительным тестом). В: Рецептор соматостатина 2 подвергается чрезвычайно сильной понижающей регуляции N-алканоил-гидрокситриптамидами (С5НТ) и незначительной - катехином (CAT). N-MP повышающее регулирует этот антисекреторный рецептор более чем вдвое с последующей понижающей регуляцией. (Статистика: односторонний дисперсионный анализ с дополнительным тестом). С: Комбинированный эффект N-MP и С5НТ после пяти минут приводит к полной компенсации эффектов каждого из соединений по отдельности (Статистика: t-критерий для N-MP/C5HT vs. N-MP или С5НТ). (*=р.0.05, **=р.0.01, ***=р.0.001, n=5-9)
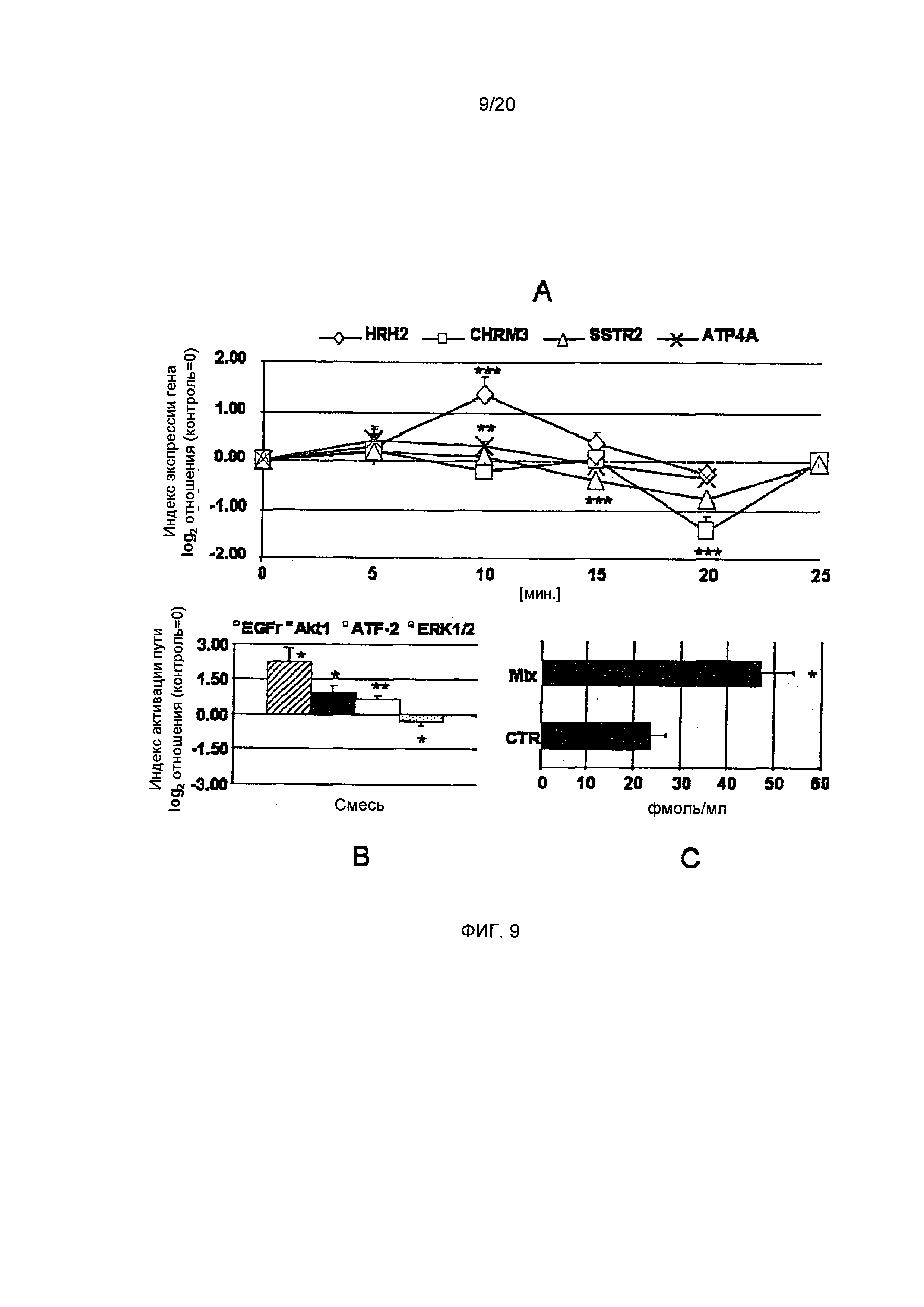
Фигура 9: Эффект полной рекомбинации всех соединений на экспрессию гена Н2-гистаминового рецептора (HRH2) ацетилхолинового рецептора М3 (CHRM3), рецептора соматостатина 2 (SSTR2) и Н+,K+-АТФазы (АТР4А). Также представлены активация трансдукции сигнала киназ и фактора транскрипции ATF-2, а также концентрации циклического АМФ. А: HRH2 подвергается сильной повышающей регуляции смесью всех соединений через 10 минут. CHRM3 и SSTR2 подвергается понижающей регуляции с минимумом через 20 минут. АТР4А регулируется в меньшей степени, чем рецепторы, но все же значительно через пять и 10 минут. (Статистика: односторонний дисперсионный анализ с дополнительным тестом). В: EGFr в значительной степени активируется смесью всех соединений, а также Akt1 и фактора транскрипции ATF-2. В отличие от этого, было показано, что статус фосфорилирования ERK1/2 был ниже ниже контрольных уровней (t-критерий для обработанных клеток vs. необработанные клетки (CTR)). С: Концентрации циклического АМФ возрастают вдвое после обработки смесью соединений в течение одной минуты (t-критерий для обработанных клеток vs. необработанные клетки (CTR)). (*=р.0.05, **=р.0.01, ***=р.0.001, n=3-9)
Фигура 10: Влияние отдельно взятых соединений на концентрации циклического АМФ, активацию киназ и фактора транскрипции ATF-2. А: Гистамин (HIS), кофеин (CAFF), катехин (CAT), пирогаллол (PYR), N-алканоил-гидрокситриптамиды (С5НТ) и N-метилпиридиний (N-MP) значительно повышают концентрации циклического АМФ по сравнению с контрольными клетками (CTR). Хлорогеновая кислота (СА) вызывает значительное снижение концентрации циклического АМФ. В: Рецептор эпидермального фактора роста (EGFr) в значительной сиепени активируется HIS, СА, CAFF и С5НТ, но не PYR, CAT и N-МР. Только Akt1 киназа значительно активировалась путем обработки CAFF, PYR, CAT, С5НТ и N-MP. Передача сигналов ERK1/2 усиливается только вследствие обработки N-MP. С: Связующий белок чувствительного элемента циклического АМФ, известный как фактор транскрипции ATF-2, в значительной степени активируется HIS, CAT и N-MP. CAFF вызывает состояние активации ниже контрольных уровней. (Статистика: t-критерий для обработанных клеток vs. необработанные клетки (CTR), *=р.0.05, **=р.0.01, ***=р.0.001, n=3-7)
Фигура 11: Измерение секреторной активности по внутриклеточному протонному индексу (IPX). А: Обработка клеток HGT-1 гистамином (HIS), кофеином (CAFF), пирогаллолом (PYR), катехином (CAT) или С5НТ приводит к усилению секреции, на что указывает отрицательное значение IPX. В отличие от этого, хлорогеновая кислота (СА) N-метилпиридиний (N-MP) и тригонеллин (TRI) вызывают снижение секреции протонов, на что указывает положительное значение IPX. Статистика: односторонний дисперсионный анализ, р=0,01.0,001; n=10-12). В: Обработка клеток HGT-1 хлорогеновой кислотой (СА) усиливает ток, в то время как рекомбинация всех соединений (Mix) приводит к снижению IPX. (Статистика: t-критерий для обработанных клеток vs. необработанные клетки, **=р=0.05, ***=р=0.001, n=3-7)
Фигура 12: Измерение секреторной активности в камере Уссинга. А: Обработка гистамином (HIS) усиливала ток после апикального применения.
Повышенный ток затем уменьшали путем апикального применения омепразола (ОМР), специфическ ингибитора Н+,K+-АТФазы. В: Апикальное применение хлорогеновой кислоты (СА) вызывает снижение тока, что указывает на пониженную секреторную активность, как в (А). С: Апикальное применение кофеина (CAFF) увеличивает ток. После базального применения N-метилпиридиния (N-MP) ток снова уменьшался, что указывает на ингибирующий эффект N-MP. D: Базальное применение одного лишь N-MP вызывает незначительное снижение тока. Е:. Апикальное прибавление катехина (CAT) усиливало ток, но максимум пика не достигался в месте применения, указывая на замедленный ответ париетальных клеток на CAT. F: Апикальное прибавление С5НТ сильно увеличивало ток в месте применения, однако, величина IPX была недостаточной для значимости (р=0.07, см. A). G: Пирогаллол (PYR) вызывал падение тока после апикального применение, что указывает на снижение секреции. H: Базальное применение тригонеллина (TRI) вызывает сильное снижение тока, указывая на антисекреторный потенциал.
Фигура 13: Рекомбинационные эффекты исследуемых соединений. Из полной рекомбинации всех исследуемых соединений (Mix) исключают N-метилпиридиний (N-MP), хлорогеновую кислоту (СА), кофеин (CAFF), катехин (CAT), C5HT или пирогаллол (PYR) для выявления синергичных эффектов каждого соединения. (Статистика: односторонний или двусторонний t-критерий для смеси без соединения vs. смесь, **=р=0.01, ***=р=0.001, n=9)
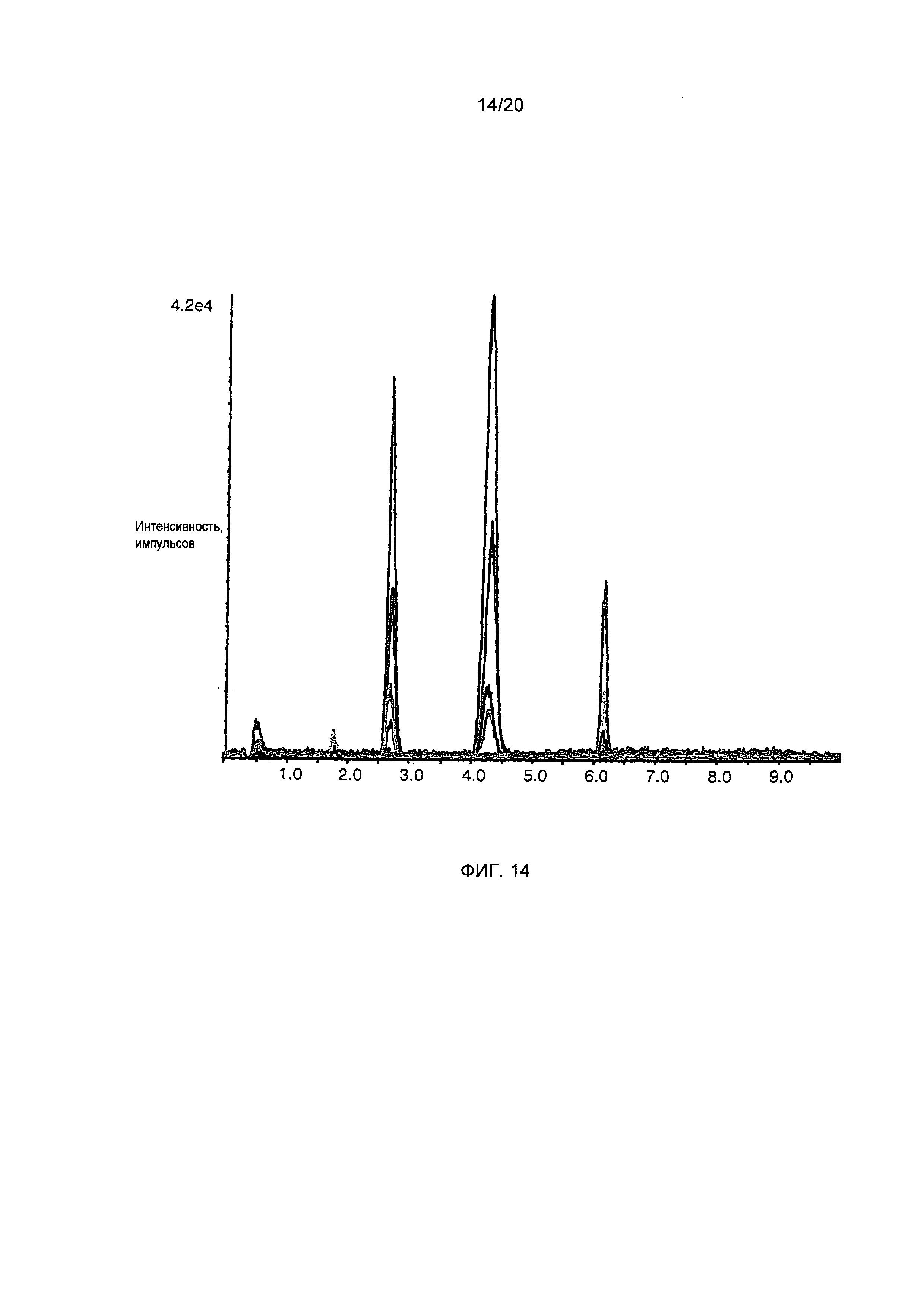
Фигура 14: Анализ методом ВЭЖХ-МС/МС (ESI+) (с ионизацией электрораспылением) фильтрованных напитков из жареного кофе. Кроме C5HT, N-метилпиридиний определяют в том же напитке методом анализа с растворением стабильного изотопа, который был успешно использован в предшествующих исследованиях. Данные приведены на Фиг. 15.
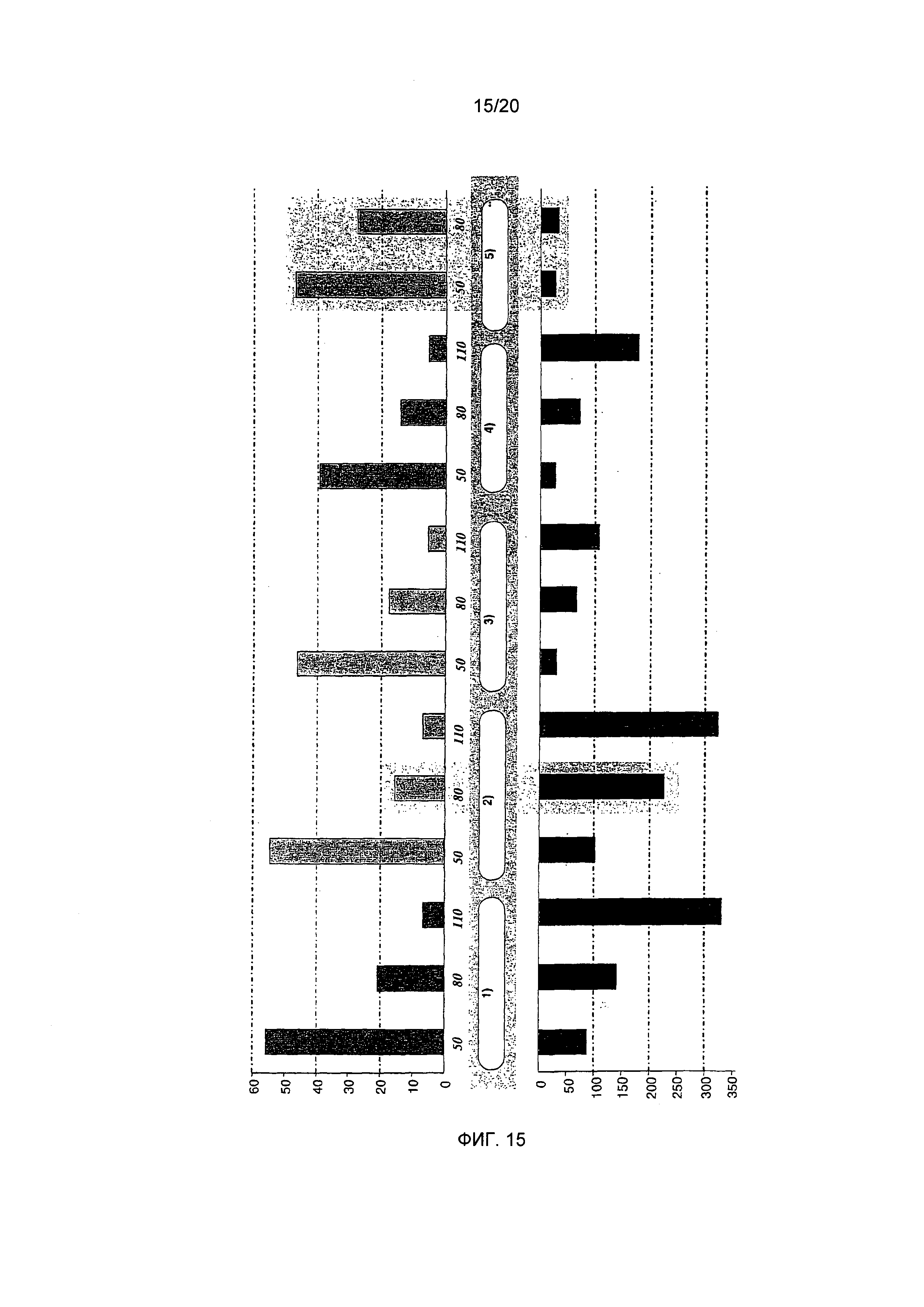
Фигура 15: Обобщение собранных данных, касающихся N-алканоил-5-гидрокситриптамидов (нижняя панель, мкг/л, сумма производных) и N-метилпиридиния (верхняя панель, мг/л). 50, 80, 110 обозначают степень обжаривания в делениях шкалы. 1) "необработанный Col 5", 2) "необработанный Col 2", 3) "декофеинированный 2+2", 4) "депарафинированный Col 5", 5) "депарафинированный Col 2**"
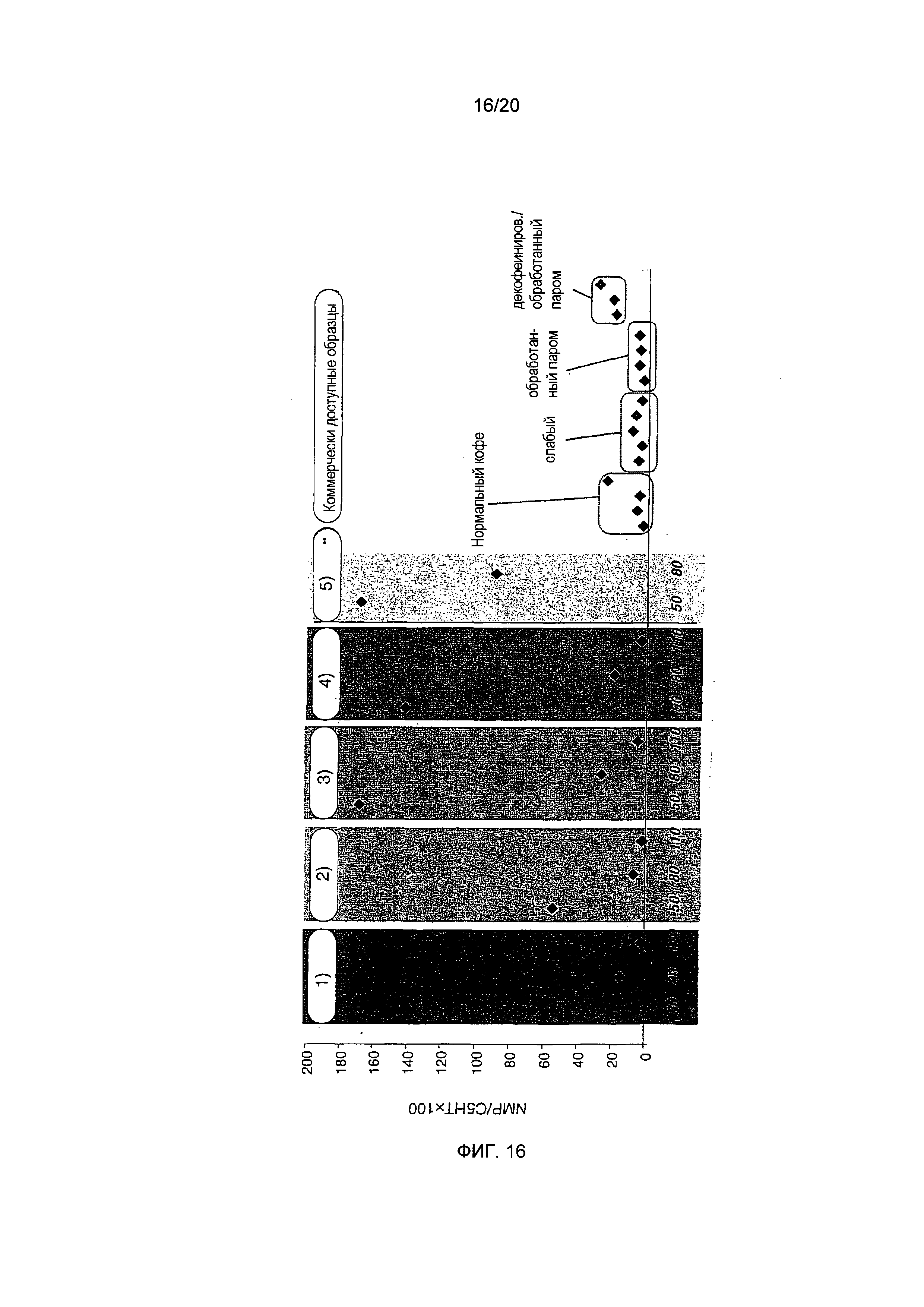
Фигура 16: Сравнение проанализированных образцов кофе на основании соотношения NMP/C5HT (фактор = NMP/C5HT×100). 50, 80, 110 обозначают степень обжаривания в делениях шкалы. Образцы кофе из предыдущих исследований приведены для сравнения. 1) "необработанный Col 5", 2) "необработанный Col 2", 3) "декофеинированный 2+2", 4) "депарафинированный Col 5", 5) "депарафинированный Col 2**"
Фигура 17: Сравнение секреторного потенциала образцов кофе, обогащенных N-MP. Указан внутриклеточный протонный индекс (IPX). Наиболее эффективные концентрации N-метилпиридиния (в ресуспендированном лиофилизате) указаны над фигурой (статистика: двусторонний t-критерий, ***=р<0.001, $ = р<0.05, $$ = р<0.01, $$$ = р<0.001).
Фигура 18: Влияние тригонеллина на секреторную активность (статистика: двусторонний t-критерий, ***=р<0.001).
Фигура 19: Зависимость доза-эффект для тригонеллина (статистика: односторонний дисперсионный анализ; *=р<0.05, $ = р<0.05, $$ = р<0.01, $$$ = р<0.001, n=4)
Фигура 20: Влияние тригонеллина и N-метилпиридиния на ток короткого замыкания.
Настоящее изобретение будет дополнительно проиллюстрировано следующими неограничивающими примерами.
Примеры
Пример 1: Фракционирование по активности для характеризации кофейного напитка, эффективно обеспечивающего понижающее регулирование механизмов секреции кислоты желудочного сока, по сравнению с обычным кофе
У некоторых особ, употребление кофейных напитков часто связано с симптомами раздражения желудка. Обработка необжаренных кофейных зерен горячим водяным паром гипотетически будет существенно снижать одержание раздражающих желудок соединений, и продукты, обработанные по этой технологии, выпускаются на рынок как "безвредный для желудка кофе". Однако, данные о влиянии обработанного паром кофе на секрецию кислоты желудочного сока являются противоречивыми и до настоящего времени не было точно установлено, какие из компонентов кофе действуют как про- или антисекреторные стимуляторы. Представленный тут пример направлен на характеризацию кофейного напитка, который осуществляет эффективную понижающую регуляцию механизмов секреция протонов в желудочных клетках человека (HGT-1).
Сначала, обычный кофейный напиток фракционируют с помощью растворителей разной полярности: воды, этилацетата, дихлорметана и пентана. Функциональные анализы протон-секреторной активности (PSA) этих фракций растворителя продемонстрировали наименее выраженный эффект для водной фракции, в которой количественными анализами было выявлено наибольшее из всех фракций содержание хлорогеновой кислоты (95%), βN-алканоил-5-гидрокситриптамидов (55%) и N-метилпиридиния (N-MP, >99%). Последующие эксперименты продемонстрировали, что клетки HGT-1, обработанные обычным кофе с повышенным содержанием N-MP в концентрации примерно 20 мг/мл N-MP, показывают значительное снижение PSA по сравнению с клетками, которые были подвергнуты воздействию лиофилизатами кофейного напитка, содержащего более высокие (32-34 мг/л) или низкие (5 мг/л) концентрации N-MP. Эти результаты были подтверждены путем проведения анализов метаболических путей факторов транскрипции (ATF-1, Akt1) и передачи сигналов (cAMP, EGFr), киназы (ERK1/2) и экспериментами по экспрессии гена про- (гистамин-НRН2, ацетилхолин-СНRМ3) и анти- (соматостатин-SSTRI) секреторных рецепторов и Н+,K+-АТФазы.
Подготовка образцов. Для фракционирования растворителя, взвешивают 54 г гомогенного материала порошка молотого жареного кофе (обычная рыночная кофейная смесь, не обработанная паром и не декофеинированная) на бумажном фильтре, обычно используемом для домашнего приготовления кофейного напитка (Melitta Gold, Nr. 4, Aldi, Germany). Порции свежевскипяченной водопроводной воды (Т 90-95°С, приблизительно 100 мл каждая) выливают на порошок и горячий фильтрат собирают в мерную колбу на 1000 мл. Точно 500 мл раствора кофе переносят в кристаллизаторы, немедленно замораживают (-20°С) и наконец высушивают лиофилизацией (48 ч, 0,77 мбар, 25°С). Вторую часть кофейного напитка (500 мл) переносят в делительную воронку и водную фазу поочередно экстрагируют пентаном (4×500 мл), дихлорметаном (4×500 мл) и этилацетатом (4×500 мл), причем остается остаток водной фазы. Все полученные фракции концентрируют под вакуумом, разводят в воде, замораживают (-20°С) и лиофилизируют (48 ч, 0,77 мбар, 25°С). Выход определяют гравиметрически. Фракции растворителя используют затем для функциональных анализов секреторной активности желудочных париетальных клеток человека в концентрациях, соответствующих их соответствующему выходу.
Исследования клеточных механизмов регуляции кислоты желудочного сока проводят с двумя образцами С. Arabica Brazil (кофе А) и двумя - С. Robusta Vietnam (кофе R). Один образец каждого сорта кофе представлял собой обычный кофе, не обработанный паром и не декофеинированный, а другой парный образец был подвергнут обработке паром (кофе AT, кофе RT), в соответствии с практикой производителя для удаления предполагаемых раздражающих желудок веществ. Все образцы кофе были типичными торговыми продуктами и были предоставлены местным производителем кофе. Вкратце, необжаренные кофейные зерна подвергают экстракция горячим водяным паром под давлением от 19 до 22 psi (131-152 кПа) в течение 10-30 минут. После этого остаточную влагу испаряют нагреванием зерен до 130-150°С. Наконец, испарившийся водяной пар выпускают из аппарата, а исходное влагосодержание необжаренных кофейных зерен восстанавливают в разреженной атмосфере. Из всех этих четырех образцов кофе (A, AT, R и RT) готовят напитки по стандартному рецепту, типично используемому для домашнего приготовления.
Клеточная культура. Париетальные клетки карциномы человека (HGT-1) были предоставлены Dr. C. Laboisse (Laboratory of Pathological Anatomy, Nantes France) и культивировались при 37°С и 5% CO2. Модифицированную по Дульбекко среду Игла (DMEM, РАА, Coelbe, Germany) с глюкозой (4%, РАА, Coelbe, Germany) используют в качестве культуральной среды с добавками 20% фетальной телячьей сыворотки (РАА, Coelbe, Germany), 2% L-глутамина (РАА, Coelbe, Germany), 2% пенициллина-стрептомицина (РАА, Coelbe, Germany) и 2% буфера HEPES (4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота) (РАА, Coelbe, Germany). Перед каждым экспериментом, клетки культивируют в течение 5 дней и синхронизуют с DMEM без добавки фетальной телячьей сыворотки.
Выделение РНК и синтез кДНК. Высеивают 100000 клеток в шестилуночные планшеты. После обработки образца, клетки собирают для анализа полной РНК, которую выделяют с помощью набора RNeasy Midi Kit (Qiagen, Hilden, Germany). Гидролиз ДНКазы I проводят на колонке с помощью набора RNase free DNase Kit (Qiagen, Hilden, Germany). Перед количественной ПЦР (qPCR), общее содержание РНК количественно определяют фотометрически при 260 нм. кДНК синтезируюи с использованием набора cDNA High Capacity Synthesis Kit (Applied Biosystems, Munich, Germany), как описано в руководстве производителя.
Анализы генной экспрессии. Анализы генной экспрессии проводят после обработки клеток образцом в течение 5, 10, 15 или 20 мин. Праймеры для альфа-субъединицы Н+,K+-АТФазы (АТР4А), Н2-гистаминового рецептора (HRH2), рецептора соматостатина (SSTR2) и ацетилхол и нового рецептора М3 (CHRM3) были сконструированы с помощью Beacon Designer 7.0 (PremierBiosoft, Palo Alto, CA) и проверены стандартными анализами и по кривой плавления, как описано в литературе. Точность последовательности продуктов ПЦР проверяли методом секвенирования (Medigenomics, Martinsried, Germany, данные не приведены). Анализы методом ПЦР в реальном времени проводили с помощью термоциклера М×3000р cycler (Stratagene, Amsterdam, Netherlands) с использованием набора Brilliant SYBR Green Kit (Stratagene, Amsterdam, Netherlands). Условия термоциклирования: 10:00 мин./95°С (активация), 00:30 с/95°С (денатурация), 00:30 с/60°С (отжиг с измерением флуоресценции), 00:30 с/72°С (удлинение цепи).
Количественное определение циклического АМФ. В общей сложности 50000 клеток высеивают на 24-луночные планшеты и обрабатывают соответствующим образцом в течение 0,5 минут. Для определения циклического АМФ в клеточных супернатантах, мы использовали набор для конкурентного определения циклического АМФ ELISA parameter kit (R&D Systems, Minneapolis, MN) как описано в протоколе производителя. Супернатанты выделяют после 1 минуты инкубации.
Анализ трансдукции сигнала. Состояние фосфорилирования рецептора тирозинкиназы и MAPK киназы детектируют методом твердофазовых иммуноферментных анализов. Выделяют общий белок из клеток HGT-1 после инкубации с исследуемыми марками кофе в течение 10 мин. в соответствии с рекомендациями протокола производителя. Общее содержание белка количественно определяют фотометрически с помощью реагента Бредфорда (Bradford) (Bio-Rad, Munich). Для определения состояния фосфорилирования используют следующие наборы ELISA: EGFr-ELISA, ERK1/2 ELISA (оба Calbiochem/Merck, Nottingham, UK), Akt1 pathscan ELISA и ATF-2 pathscan ELISA (оба Cell Signaling/New England Biolabs, Frankfurt a. M., Germany). Поглощение считывают при 450 нм с помощью планшет-ридера MRX (Dynex, Berlin, Germany) или планшет-ридера Varioscan Flash (Thermo Electron Cooperation, Walthman, MI) с дополнительным считыванием длины волны эталона при 620 нм, если это указано в протоколе производителя.
Секреторная Активность. Для каждого биологического независимого эксперимента используют объем суспензии клеток, равный 2 мл, что соответствует 2000000 клеток, и обрабатывают в течение 10 минут 2,5 мг лиофилизата кофейного напитка (54 г/1,1 л горячей воды) на мл PBS, гистамином (1 ммоль в PBS (фосфатно-солевой буфер)) или разными фракциями растворителя при 37°С. Секреторную активность измеряют путем определения внутриклеточного протонного индекса (IPX). Для измерения внутриклеточного pH используют флуоресцентный краситель Carboxy-SNARF-AM (Invitrogen, Karlsruhe, Germany). Способ аттестуют, как описано в литературе, и гистамин (1 ммоль/л) используют в качестве хорошо изученного эталонного соединения, которое стимулирует секрецию желудочной кислоты. Вкратце, клетки HGT-1 насыщают 3 мкМ красителя в течение 30 минут на льду. Внутриклеточный pH рассчитывают по калибровочной кривой для обработанных 2 мкМ нигерицина (РАА, Coelbe, Germany) клеток HGT-1 в буфере K+ clamp, содержащем 20 мМ NaCl, 110 мМ KCl, 1 мМ CaCl2, 1 мМ MgSO4, 18 мМ D-глюкозы и 20 мМ HEPES, который настраивают на разные калибровочные точки pH (6,8-8,2) путем титрования NaOH. Затем рассчитывают внутриклеточный протонный индекс (IPX) путем log2-преобразования соотношения концентраций внутриклеточных протонов для обработанных клеток и контрольных клеток. Чем выше значение IPX, тем больше протонов остается в клетке, что указывает на более низкую секреторную активность, в то время как более низкие значения IPX указывают на более высокую секрецию протонов.
Статистический анализ. Статистический анализ проводят с помощью Excel 2003 или SigmaStat (Systat Software GmbH, Erkrath, Germany). Наборы данных, полученные при проведении qPCR (количественной ПЦР) и ELISA, трансформируют путем логарифмического преобразования для получения нормального распределения, и представляют на фигурах проиндексированными по log2 соотношения. Отдельные сравнения между обработанными и контрольными клетками выполняют с помощью двустороннего t-критерия Стьюдента для одинаковых дисперсий. Для анализа экспрессии генов во времени, мы проводили односторонний дисперсионный анализ с дополнительным анализом по Холму-Сидаку для параметрических наборов данных и тест Крускала-Уоллиса (Kruskal-Wallis) с дополнительным анализом по Данну для непараметрических наборов данных. Число повторов для каждого эксперимента указывается в результатах, но составляло не менее n=3. На каждом графике, планки погрешностей соответствуют стандартной ошибке (SE).
Секреторная активность фракций растворителя, приготовленных из обычного кофе. Используют следующий подход для оценки секреторной активности кофейных напитков по отношению к кислоте желудочного сока в клетках рака желудка у человека (HGT-1). Клетки, обработанные лиофилизованными кофейными напитками, приготовленными из декофеинированного и/или обработанного паром кофе, демонстрируют пониженную секреторную активность по сравнению с клетками, обработанными лиофилизатами, приготовленными из обычного кофе. В этой модели, анализируют внутриклеточный pH как индикатор секреции протонов методом проточной цитометрии использованием pH-чувствительного красителя SNARF-АМ. Данные рассчитывают как показатель внутриклеточного pH (IPX), на основании гипотезы о том, что внутриклеточная концентрация Н+ снижается вследствие секреции протонов. Чем выше значение IPX, тем больше протонов остается в клетке, что указывает на более низкую секреторную активность, в то время как более низкие значения IPX указывают на более высокую секрецию протонов. Наконец, значения IPX подвергают log2-преобразованию для стабилизации дисперсии. В представленной тут работе, обработка клеток HGT-1 физиологическим стимулятором гистамином приводит к стимуляции секреторной активности, на что указывает значительное снижение IPX (-0,41±0,04; р.0.001) по сравнению с необработанными контрольными клетками (Фиг. 1). Клетки, обработанные такими фракциями, экстрагированнми из обычной торговой кофейной смеси этилацетатом, дихлорметаном и пентаном, реагировали аналогично, з значениями IPX, равными -0,43±0,6, -0,20±0.03 и -0,34±0.04, соответственно (двусторонний t-критерий, р.0.001 vs. необработанные контрольные клетки для каждой фракции; Фиг. 1). В отличие от этого, клетки, обработанные водным экстрактом, демонстрируют значительно сниженную секреторную активность по сравнению с контрольными клетками, на что указывают положительные значения IPX +0.07±0.03 (двусторонний t-критерий, р.0.05; Фиг. 1). Принимая во внимание распределение количественно определяемых соединений между фракциями растворителя, фракция пентана содержала только одно из них: кофеин, примерно 1% от общего количества, определенного во всех фракциях.
Неожиданно, большая часть количественно определяемых соединений были распределены между водной, этилацетатной и дихлорметановой фракциями, в то время как катехин и пирогаллол преимущественно экстрагировались этилацетатом, а кофеин преимущественно собирался в дихлорметановом экстракте. Однако, водный экстракт, который продемонстрировал антисекреторную активность в функциональном анализе, содержал большую часть хлорогеновой кислоты и βN-алканоил-5-гидрокситриптамидов, и был единственным экстрактом, содержащим более 99% от общего количества определяемого N-метилпиридиния (Фиг. 1).
Секреторная активность лиофилизатов обычного кофе после прибавления N-метилпиридиния. Поскольку результаты экспериментов с фракциями растворителя, выделенными из обычной торговой кофейной смеси, позволяют предположить, что антисекреторный эффект кофе с повышенным содержанием водорастворимых соединений, и, в частности, N-метилпиридиния, который количественно определялся только в водном экстракте, то была исследована на секреторную активность в клетках HGT-1 N-метилпиридиния как отдельного соединения, а также лиофилизата, приготовленного из обычного кофе, в которому был добавлен N-метилпиридиний. Количественное определение N-метилпиридиния в кофе А показало его концентрацию, равную 6,32 мг/л (Фиг. 2). Обогащение лиофилизата напитка проводят путем добавления разных количеств для достижения 2-кратного (12,64 мг/л), 3-кратного (18,96 мг/л), 5-кратного (31,60 мг/л) и 10-кратного (63,20 мг/л) увеличения по сравнению с необогащенным лиофилизатом. Как изображено на Фиг. 2, обработка клеток HGT-1 лиофилизатом необогащенного кофе оказывала стимулирующий эффект на секреторную активность, с величиной IPX, равной -0,17±0.03 (двусторонний t-критерий, р.0.001 vs. необработанные контрольные клетки), в то время как в клетках, обработанных лиофилизатами с удвоенным и утроенным содержанием N-метилпиридиния, анализы показали значительно более низкую секреторную активность (-0,10±0.04 и -3.46-17±0.01, соответственно, двусторонний t-критерий, р.0.01 vs. необработанные контрольные клетки для обоих образцов). Лиофилизат, содержащий увеличенную в 3 раза концентрацию N-метилпиридиния по сравнению с необогащенным лиофилизатом, на самом деле практически не оказывал какого-либо эффекта, поскольку клетки, обработанные этим образцом, демонстрировали такую же величину IPX, как и необработанные контрольные клетки. Однако, при увеличении количества N-метилпиридиния до 10-кратного (63,2 мг/л), секреторная активность кофе А является практически такой же, как определенная для необогащенного лиофилизата (односторонний дисперсионный анализ, р.0.05; Фиг. 2).
В тех случаях, когда клетки HGT-1 были обработаны N-метилпиридинием как отдельно взятым соединением, никакого доза-зависимого эффекта не наблюдалось (Фиг. 2). Эти результаты четко демонстрируют, что N-метилпиридиний в кофейном напитке действует как антисекреторное соединение, но не как отдельно взятое вещество.
Секреторная активность лиофилизатов, приготовленных из стандартизированных кофейных напитков с различным содержанием N-метилпиридиния, и их эффект на образование циклического АМФ. Поскольку эксперименты с обогащенными N-метилпиридинием лиофилизатами, приготовленными из кофе А позволяют предположить, что антисекреторный эффект кофейных напитков, имеющих 3-кратную по сравнению с необогащенными лиофилизатами концентрацию N-метилпиридиния, были приготовлены три дополнительные образца кофе с определенным содержанием N-метилпиридиния. Во-первых, образец, эквивалентный кофе А, состоящий из того же самого кофе, но слабо обработанного паром (кофе AT) таким образом, чтобы содержание N-метилпиридиния не изменялось (Таблица 1). Для второго набора образцов, были приготовлены С. Robusta Vietnam (кофе R) и С. Robusta Vietnam - обработанный паром (кофе RT). Количественное определение N-метилпиридиния в этих двух образцах показало "средне-высокую" и "низкую" концентрации, 22,4 мг/л и 5,41 мг/л, соответственно (Таблица 1). Таким образом, кофе R имело концентрацию N-метилпиридиния, сопоставимую с кофе А, обогащенным до 18,96 мг/л.
Анализ IPX в клетках HGT-1 после обработки лиофилизатами, приготовленными из кофе А (-0,43±0.05), AT (-0,49±0.02) и R (-0,35±0.07), продемонстрировал их значительно более низкую секреторную активность по сравнению с кофе RT (-0,60±0.02) (Фиг. 3А). Таким образом, "высокая" и "средне-высокая" концентрации N-метилпиридиния, количественно определенные в кофе А / AT и R, соответственно, по-видимому, ассоциированы с более низким секреторным потенциалом по сравнению с кофе RT, имеющим наименьшую концентрацию N-метилпиридиния, количественно определенную для этих образцов кофе.
Стимуляция секреции кислоты желудочного сока связана с повышенными уровнями циклического АМФ в париетальных клетках, поскольку передача сигналов гастриновых и гистаминовых рецепторов увеличивает синтез циклического АМФаденилатциклазой вследствие активации G-белка. В данных исследованиях, клетки HGT-1, обработанные гистамином, стимулируют секреторную активность в значительной степени, до величины IPX, равной -0,97±0,02, по сравнению с необработанными контрольными клетками. В соответствии с этим результатом, концентрация циклического АМФ также увеличивалась до 7,76±0,69 пмоль/мл от базового уровня, равного 6,02±0,36 пмоль/мл в необработанных контрольных клетках (двусторонний t-критерий, p<0.05; Фиг. 3А и В). В соответствии с результатами анализа секреторной активности, концентрация циклического АМФ после обработки HGT-1 (HGT-Vs) кофе RT (19,69±0,41 пмоль/мл) была значительно выше (двусторонний t-критерий, p<0.05) по сравнению с контрольными клетками и с концентрациями циклического АМФ после обработки кофе А (8,83±0,69 пмоль/мл), кофе AT (10,76±0,38 пмоль/мл) или кофе R (14,98±0,89 пмоль/мл) (Фиг. 3В). В общем, кофе RT стимулирует секрецию протонов по сравнению с контрольными клетками сильнее, чем любой другой исследованный лиофилизат кофе, приводя к наивысшим внутриклеточным уровням циклического АМФ. Кофе R, в отличие от этого, проявляло наименьший стимулирующий эффект на протон-секреторную активность, но индуцировал вторые по величине уровни циклического АМФ в клетках HGT-1. Эти результаты позволяют предположить, что исследуемые лиофилизаты кофе активируют желудочную секрецию другими путями, кроме передачи сигналов циклического АМФ.
Эффект лиофилизатов кофе на пути трансдукции сигналов и на генную экспрессию. Трансдукция сигнала является промежуточным звеном между активацией рецептора и регуляцией генной транскрипции функциональных белков, например Н+,K+-АТФазы. До настоящего времени было показано, что передача сигналов EGFr, ERK1/2 и Akt1 участвует в секреции кислоты желудочного сока. Регуляция генной транскрипции зависит от факторов транскрипции. Поскольку Н+,K+-АТФаза и рецептор соматостатина содержат связующие мотивы для циклический АМФ-зависимых факторов транскрипции, мы также исследовали роль ATF-2 в процессе генной регуляции и секреторной активности. В результате, обработка клеток HGT-1 гистамином приводила к активации ATF-2 (индекс активации путей 1,17+0,25 vs. 0 для необработанных контрольных клеток; p≤0.001, Фиг. 4). Для всех исследованных лиофилизатов кофе, был продемонстрирован индуктивный эффект активации ATF-2, который был самым низким для кофе R (кофе R: 0,33±0,13; кофе RT: 0,84±0,39; кофе А: 0,97±0,15; кофе AT: 0,85±0,20; все р.0.05 vs. необработанные контрольные клетки; Фиг. 4). Однако, кофе RT не влиял на экспрессию метаболический путь-ассоциированного гена альфа-субъединицы Н+,K+-АТФазы (АТР4А), в то время как клетки, обработанные кофе R, демонстрируют повышенную генную экспрессию антисекреторного соматостатинового рецептора (0,74±0,19, односторонний дисперсионный анализ p<0.01 vs. необработанные контрольные клетки (=0), Фиг. 5А и В). При исследованиях обработанного паром кофе R (кофе RT) не было выявлено никаких эффектов для рецептора соматостатина, но также было продемонстрировано увеличение генной экспрессии АТР4А (0,55±0.04, односторонний дисперсионный анализ p≤0.05 vs. необработанные контрольные клетки (=0), Фиг. 5А и В). Клетки HGT-1, обработанные кофе А, показывали увеличение генной экспрессии АТР4А (0,47±0.09, р≤0.05 vs. необработанные контрольные клетки (=0)), в то время как генная экспрессия антисекреторного соматостатинового рецептора уменьшалась (-0,59±0,17, односторонний дисперсионный анализ р<0.01 vs. необработанные контрольные клетки (=0), Фиг. 6А и В).
Другим фактором транскрипции, который, как сообщается, усиливает секрецию кислоты желудочного сока и генную экспрессию Н+,K+-АТФазы, является Akt1. В данных исследованиях, передача сигналов Akt1 значительно активировалась в клетках HGT-1, подвергнутых воздействию кофе AT, R или RT, с максимальными индексами активации путей, равными 1,75±0,34, 0,60±0,22 и 0,75±0,30, соответственно (двусторонний t-критерий, р<0.05-0.01 vs. необработанные контрольные клетки; Фиг. 4). Однако, ни кофе AT, ни кофе R не влияли на генную экспрессию АТР4А. В отличие от этого, обработка клеток HGT-1 кофе А вызывала небольшое, но значимое снижение активации Akt1 по сравнению с необработанными контрольными клетками (-0,22±0.05, двусторонний t-критерий р<0.05, Фиг. 6). Поскольку кофе А увеличивало экспрессию АТР4А, передача сигналов Akt1, по-видимому, не является пусковым фактором экспрессии АТР4А после воздействия кофе. Тем не менее, когда клетки HGT-1 подвергали воздействию кофе A, ERK1/2 активировался (1,30±0,58, двусторонний t-критерий vs. необработанного контроля р≤0.05, Фиг. 4). В отличие от этого, передача сигналов ERK1/2 снижалась после обработки кофе RT (-0,58±0,49, двусторонний t-критерий, Фиг. 4).
Активация рецептора EGFr была значительной только после воздействия на HGT-1 гистамина (1,32+0,42) и кофе RT (0,58±0,23) (двусторонний t-критерий, р≤0.05-0.001, Фиг. 4). В данном случае, это опять указывает на более высокую секреторную активность кофе RT. Принимая во внимание экспрессию просекреторных рецепторов, функция H2-гистаминового рецептора не снижалась в результате инкубации клеток HGT-1 с кофе А или AT. Кофе RT, в отличие от этого, значительно увеличивало его экспрессию (0,41±0,10, односторонний дисперсионный анализ р≤0.01 vs. необработанные контрольные клетки, Фиг. 5С). Генная экспрессия просекреторного ацетилхолинового рецептора М3 снижалась после обработки клеток HGT-1 кофе А (-0,56±0.09, односторонний дисперсионный анализ р≤0.001, Фиг. 6В). Кофе R и RT, в отличие от этого, проявляли усиливающий эффект на экспрессию гена ацетилхолинового рецептора М3 (0,43±0,12 и 0,71±0,23, соответственно, односторонний дисперсионный анализ, р≤0.01 vs. необработанные контрольные клетки, Фиг. 6В). Обобщая, обработка париетальных клеток кофе RT приводила к наивысшей секреторной активности, наиболее полной повышающей регуляции просекреторных генов и метаболических путей, связанных с активацией секреции кислоты желудочного сока. Клетки HGT-1, подвергнутые воздействию кофе AT, не демонстрируют какого-либо увеличения экспрессии просекреторных генов, а также не наблюдается снижения экспрессии антисекреторных генов. С этим согласуется наблюдение, что секреторная активность париетальных клеток после воздействия кофе AT была ниже, чем для кофе RT (Фиг. 3).
Самый слабо выраженный эффект на секреторную активность был продемонстрирован для кофе R (Фиг. 3), которое не проявляло усиливающего эффекта на экспрессию гена просекреторного ацетилхолинового рецептора М3, но также продемонстрировало наивысший стимулирующий эффект на экспрессию гена антисекреторного соматостатинового рецептора среди всех исследованных марок кофе (Фиг. 5В).
Вышеприведенный пример касается характеризации состава кофейного напитка, который эффективно понижающее регулирует выбранные механизмы секреции кислоты желудочного сока. Сначала, обычный кофейный напиток, не обработанный паром и не декофеинированный, подвергают фракционированию растворителями для определения полярности соединений, влияющих на протон-секреторную активность в клетках HGT-1. Кроме того, каждую из этих фракций растворителя, полученных путем экстракции кофейного напитка водой, этилацетатом, дихпорметаном или пентаном, анализируют на содержание в ней предполагаемых раздражающих желудок соединений, а именно, кофеина, хлорогеновой кислоты, βN-алканоил-5-гидрокситриптамидв, пирогаллола, катехина, а также N-метилпиридиния как еще одного недавно идентифицированного биологически активного соединения кофейного напитка. Функциональные анализы продемонстрировали стимулирующий эффект на протон-секреторную активность этилацетатного, дихлорметанового и пентанового экстрактов, в то время как водный экстракт не проявлял никакого влияния на секрецию протонов. Этот результат был довольно неожиданным, поскольку водный экстракт содержал большую часть хлорогеновой кислоты (95%) и βN-алканоил-5-гидрокситриптамидов (55%), от общего количества, присутствующего в кофейном напитке. Предполагается, что оба эти соединения промотируют секрецию желудочной кислоты. Однако, мы отнесли отсутствие стимулирующего эффекта на секрецию протонов в клетках HGT-1 к содержанию N-метилпиридиния в водной фракции, которая единственная содержала это соединение. Хотя мы не смогли подтвердить этот эффект экспериментами, в которых клетки HGT-1 обрабатывали отдельно взятым соединением N-метилпиридиния, добавление N-метилпиридиния к лиофилизату, приготовленному из обычного кофейного напитка (не обработанного паром и не декофеинированного) четко продемонстрировало антисекреторный эффект этого соединения при концентрации в напитке примерно 18 мг/л. Такое различие между отдельно взятым соединением и сложным напитком кажется обоснованным, поскольку кофейный напиток содержит различные компоненты, которые могут конкурировать за связывание с рецептором, действовать как ингибиторы или энхансеры функциональных белков, а также генной регуляции и, наконец, могут проявлять синергичные или анти-синергичные эффекты.
Для дополнительной оценки эффекта кофейных напитков с разными концентрациями N-метилпиридиния на клеточные механизмы секреции желудочной кислоты, лиофилизаты, приготовленные из кофейных напитков с высокими (С. Arabica: 32 мг/л и С. Arabica Brazil, слабо обработанный паром: 34 мг/л), средними (С. Robusta Vietnam: 22 мг/л) и низкими (С. Robusta Vietnam, обработанный паром: 5 мг/л) концентрациями, были получены от местного производителя кофе. Обработка паром применялась в соответствии с процедурой, используемой производства рыночных марок кофе с маркировкой "безвреден для желудка". Результаты функциональных экспериментов, исследующих влияние лиофилизованного кофейного напитка на протон-секреторную активность продемонстрировали значительно более низкую секреторную активность для кофейных напитков со средней или высокой концентрациями N-метилпиридиния по сравнению с напитком, имеющим самую низкую концентрацию. Однако, наименьшая секреторная активность была продемонстрирована для С. Robusta Vietnam, с концентрацией N-метилпиридиния, составляющей 22 мг/л напитка. Этот результат согласуется с результатами, полученными в экспериментах, в которых лиофилизат, приготовленный из обычного рыночного кофе, был обогащен N-метилпиридинием до конечной Концентрации 18 мг/л напитка. Также, результаты исследований молекулярных механизмов секреции желудочной кислоты, таких как генная регуляция, пути трансдукции сигнала и родственные факторы транскрипции, продемонстрировали, что наименьшим просекреторным эффектом из исследованных кофейных напитков обладает С. Robusta Vietnam. В частности, был показан индуцирующий эффект на экспрессию гена антисекреторного рецептора соматостатина (SSTR2), в то время как влияние на экспрессию гена Н+,K+-АТФазы не наблюдалось.
Неожиданно, наименьшая секреторная активность среди испытанных образцов кофе коррелировала с повышенной генной экспрессией ацетилхолинового рецептора (CHRM3). Этот результат указывает, что пути регуляции секреции желудочной кислоты различаются по своей эффективности. Повышающая регуляция просекреторных генов или белков факторов транскрипции не обязательно приводит к повышенной секреции протонов и наоборот. Это также продемонстрировано результатами для других кофейных напитков, исследованных в данной работе. Обработанный паром С. Robusta Vietnam, например, демонстрировал наибольший стимулирующий эффект на протон-секреторную активность, эффект повышающей регуляции экспрессии гена Н+,K+-АТФазы, ключевого участника секреции кислоты желудочного сока, а также на экспрессию гена просекреторных гистаминового (HRH2) и ацетилхолинового (CHRM3) рецепторов. Несмотря на такие просекреторные эффекты, клетки HGT-1, обработанные С. Robusta Vietnam, также демонстрировали пониженные концентрации циклического АМФ и пониженную активацию ERK1/2, которые оба участвуют в просекреторных метаболических путях.
В заключение укажем, что нами было впервые продемонстрировано, что регуляция и функция протон-секреторной активности клеток желудка человека, индуцируемой кофейными напитками, зависит от концентрации в них N-метилпиридиния. Влияние других компонента, таких как кофеин, хлорогеновая кислота или βN-алканоил-5-гидрокситриптамиды, рассматриваются в последующих многопараметрических исследованиях.
Пример 2: Многопараметрический подход к идентификации компонентов кофе. регулирующих механизмы секреции кислоты желудочного сока
В данных исследованиях, шесть различных соединений - хлорогеновая кислота (СА), кофеин (CAFF), пирогаллол (PYR), катехин (CAT), N-алканоил-гидрокситриптамиды (С5НТ) и N-метилпиридиний (N-MP), были проанализированы на их влияние на гены, связанные с секреторной активностью, трансдукцией сигнала и экспрессией кислоты желудочного сока, а также активацией фактора транскрипции ATF-2, а также концентрациями сАМР. Мы установили, какие соединения могут действовать как защитные для желудка соединения в кофейных напитках. Кроме того, мы разработали статистическую модель для прогнозирования синергичных и анти-синергичных эффектов растворов, содержащих большое количество соединений, на желудочную секрецию.
N-MP, CAFF, CAT, С5НТ, PYR и СА используют в концентрациях, соответствующих обычному кофейному напитку. Для in vitro исследований используют клеточную линию рака желудка человека HGT-1. Секреторную активность измеряют с помощью камеры Уссинга и анализа методом FACS (активируемый флуоресценцией анализ клеток). Для детектирования активации уровней EGFr, Akt1, ERK1/2, ATF-1 и сАМР мы проводили анализы ELISA, тогда как изменения время-зависимой экспрессии генов, связанных с кислотой желудочного сока, таких как гистаминовые, ацетилхолиновые и соматостатиновые рецепторы, а также Н+,K+-АТФаза, определяют методом ПЦР в реальном времени. Экспериментальные данные были затем частично использованы для статистического моделирования с использованием программы "нейронных сетей".
N-MP повышает экспрессию антисекреторного соматостатинового рецептора на 114%, в то время как С5НТ снижает его экспрессию до 48%. Кроме того, N-MP понижающе регулирует просекреторный ацетилхолиновый рецептор М3 (-36%) и Н+,K+-АТФазу на -27%. АТФаза подвергается 2-кратной повышающей регуляции СА и CAFF. CAFF наиболее сильно стимулирует секреторную активность в функциональных анализах. N-MP действует как ингибитор секреторной активности, индуцируемой CAFF. Неожиданно, СА не увеличивает секрецию, а скорее приводит к снижению секреции. Анализ метаболических путей позволил установить различия между CAFF, СА, CAT, С5НТ, PYR и гистамином, активирующими передачу сигналов EGFr, и N-MP, активирующим передачу сигналов Akt1 и ERK1/2. В общем, эти результаты позволяют предположить наличие защитного по отношению к желудку потенциала у пирогаллола и N-метилпиридиния in vitro.
Клеточная культура. Клетки HGT-1 (Dr. С.Laboisse, Nantes, France) культивируют при 37°С с 5% CO2 в среде Игла, модифицированной по Дульбекко, с 20% фетальной телячьей сывороткой, 5% глутамина и 5% пенициллина/стрептомицина. Клетки синхронизуют в течение 24 часов перед экспериментами со средой Игла, модифицированной по Дульбекко, как описано выше, но не содержащей фетальной телячьей сыворотки.
Эксперименты с отдельно взятыми соединениями. Клетки подвергают воздействию кофеина (3 мМ), хлорогеновой кислоты (3 мМ), катехина (52 мкМ), пирогаллола (32 мкМ) (все Sigma-Aldrich, Munich, Germany), βN-алканоил-5-гидрокситриптамидов (1 мкМ) и N-метилпиридиния (0,34 мкМ), в концентрациях, соответствующих их содержанию, определенному для обычного кофейного напитка. Другими использованными соединениями были омепразол (1 мМ), соматостатин (0,5 мМ), гистамин (1 мМ), ацетилхолин (1 мМ) (все Sigma-Aldrich, Munich, Germany). Все соединения растворяли непосредственно в фосфатно-солевом буфере (PBS) или в растворе Рингера, за исключением N-алканоил-5-гидрокситриптамидов, которые растворяют в тетрагидрофуране (1 мг/мл ТГФ) и прибавляют в объеме 2 мкл на 10 мл буфера для получения конечной концентрации.
Анализы экспрессии. После 5, 10, 15 и 20 мин. воздействия, клетки обирают для анализа экспрессии генов. Праймеры АТР4А, HRH2, SSTR2 и CHRM3 были сконструированы с помощью Beacon Designer 7.0 (PremierBiosoft, Palo Alto, CA) и проверены на соответствие стандарту и анализом кривых плавления. Точную последовательность продуктов ПЦР проверяли путем секвенирования (Medigenomics, Martinsried, Germany). Анализы ПЦР в реальном времени проводят с использованием набора Brilliant SYBR Green Kit (Stratagene, Amsterdam, Netherlands) на термоциклере М×3000р (Stratagene, Amsterdam, Netherlands). Условия термоциклирования: 10:00 мин./95°С (активация), 00:30 с/95°С (денатурация), 00:30 с/60°С (отжиг с измерением флуоресценции), 00:30 с/72°С (удлинение цепи).
Количественное определение циклического АМФ (сАМР). Для определения сАМР в клеточных супернатантах мы использовали набор для конкурентного определения сАМР ELISA parameter kit (R&D Systems, Minneapolis, MN), как описано в протоколе производителя. Супернатанты выделяют после одной минуты инкубации.
Выделение РНК и синтез кДНК. Высеивают 100000 клеток в шестилуночные планшеты и выращивают до слияния. Выделяют полную РНК с помощью набора Rneasy Midi Kit (Qiagen, Hilden, Germany). Гидролиз ДНКазы I проводят с помощью набора RNase free DNAse Kit (Qiagen, Hilden, Germany) на колонке. Перед qPCR (количественная ПЦР), общее содержание РНК количественно определяют фотометрически при 260 нм. кДНК синтезируют с использованием набора cDNA High Capacity Synthesis Kit (Applied Biosystems, Munich, Germany), как описано в руководстве производителя.
Секреторная активность. Для каждого биологического независимого эксперимента используют объем суспензии клеток, равный 2 мл, соответствующий 2000000 клеток, и нкубируют в течение 10 минут с 2,5 мг лиофилизата кофе на мл PBS, гистамина, отдельных соединений или разных комбинаций всех соединений при 37°С. Секреторную активность измеряют путем определения внутриклеточного протонного индекса (IPX). Для измерения внутриклеточного pH используют флуоресцентный краситель Carboxy-SNARF-AM (Invitrogen, Karlsruhe, Germany). Способ был аттестован. Клетки HGT-1 насыщают 3 мкМ красителя в течение 30 минут на льду. Внутриклеточный pH рассчитывают по калибровочной кривой для клетки HGT-1, обработанных 2 мкМ нигерицина (РАА, Coelbe, Germany) в буфере K+ clamp, содержащем 20 мМ NaCl, 110 мМ KCl, 1 мМ СаСl2, 1 мМ MgSO4, 18 мМ D-глюкозы и 20 мМ HEPES, который устанавливают на разные калибровочные точки pH (6,8-8,2) путем титрования NaOH. Затем внутриклеточный протонный индекс (IPX) рассчитывают путем log2-преобразования соотношения внутриклеточных концентраций протонов между обработанными клетками и контрольными клетками. Чем выше значение IPX, тем больше протонов остается в клетке, что указывает на более низкую секреторную активность. Более отрицательное значение IPX, соответственно, обозначает повышенную секреторную активность.
Эксперименты с камерой Уссинга. Для проверки того, как отдельные вещества влияют на ионный транспорт от базолатерального к апикальному участку монослоя HGT-1, мы провели эксперименты с камерой Уссинга. Для этого, клетки HGT-1 культивируют на проницаемой подложке с полиэфирной мембраной SNAP-well с порами 0,4 мкМ (Sigma-Aldrich, Munich, Germany). Поверхность культивируемого участка составляет примерно 1,13 см2. Клетки выращивают до слияния, которое подтверждают микроскопическим анализом и измерениями сопротивления с помощью камеры Endohm (WPI, Berlin, Germany). Вкладыши SNAP-well устанавливают в камеру Уссинга (Easy Mount Chambers, Harvard Аппарат, March-Hugstetten, Germany), заливают раствором Рингера (Sigma-Aldrich, Munich, Germany) при 37°C и осторожно барботируют воздух при контроле рН. Все исследуемые вещества также растворяют в растворе Рингера. Разность трансэпителиальных потенциалов измеряют с помощью пары Ag/AgCl электродов, подключенных к аппарату гальванического напряжения (KMSCI, Aachen, Germany). Электроды тока и напряжения устанавливают по обе стороны монослоя. Электроды вставляют в наконечник для электрода и подсоединяют к раствору Рингера с помощью заполненного 3М KCl агар-агарового мостика. Секрецию измеряют как ток в режиме короткого замыкания и представляют в мкА/см2 (длительность импульса, 0,2 с; частота импульсов, 1 Гц; амплитуда импульсов, 25 мс). Соединения вводят в апикальный компартмент, имитирующий полость желудка.
Анализ трансдукции сигнала. Состояние фосфорилирования рецептора тирозинкиназы и МАРK киназы детектируют методом твердофазовых иммуноферментных анализов (ELISA). Общий белок выделяют из клеток HGT-1 после инкубации с исследуемыми веществами в течение 10 минут в соответствии с протоколом производителя и с использованием предоставленного буфера для лизиса. Общее содержание белка количественно определяют фотометрически при 595 нм с использованием реагента Бредфорда (Bradford) (Bio-Rad, Munich). Для определения состояния фосфорилирования используют такие ELISA: набор EGFr-ELISA, набор ERK1/2 ELISA (оба Calbiochem/Merck, Nottingham, UK), Akt1 pathscan ELISA и ATF-2 pathscan ELISA (оба Cell Signaling/New England Biolabs, Frankfurt a. M., Germany). Поглощение считывают при 450 нм с помощью планшет-ридера MRX (Dynex, Berlin, Germany).
Анализ данных методом нейронной сети. Нейронные сети для трех рецепторов HRH2, CHRM3 и SSTR2 индвидуально обучают на наборе рекомбинированных данных для кофе. Используют прикладную программу нейронной сети, NeuraIWorks Predict (NeuralWare, Pittsburg, PA), с настройками по умолчанию, за исключением использования каскадного выбора переменной и принудительной обработки входного сигнала как непрерывных переменных числовых данных. Значимость индивидуальных компонентов кофе на генную экспресси в нейронных сетях характеризуют по частоте, с которой конкретный компонент появляется в конечной популяции генетического алгоритма выбора переменных сети. Максимальная частота 1,00 для входной переменной (компонент кофе) указывает, что она очень важна для нейронной сеть и всегда выбрана.
Статистический анализ. Статистический анализ проводят с помощью Excel 2003 или SigmaStat (Systat Software GmbH, Erkrath, Germany). Наборы данных, генерируемых qPCR (количественная ПЦР) и ELISA, трансформируют путем логарифмического преобразования для достижения нормальности и индексируются на фигурах как log2 отношения. Отдельные сравнения между обработанными и контрольными клетками проводят с использованием двустороннего t-критерия Стьюдента для одинаковых дисперсий, если не указано иное. Для анализа экспрессии генов во времени мы проводили односторонний дисперсионный анализ с дополнительным анализом по Холму-Сидаку для параметрических наборов данных и тест Крускала-Уоллеса с дополнительным анализом по Данну для непараметрических наборов данных. Число повторов для каждого эксперимента указано в разделе результатов и на фигурах. На каждом графике приводятся средние значения для независимых биологических экспериментов ± стандартная ошибка (SE). Эксперименты с камерой Уссинга проводят как отдельные эксперименты и первоначально зарегистрированные значения приведены на соответствующем графике.
Регуляция генов, связанных с секрецией кислоты желудочного сока. Регуляция генов, связанных с секрецией кислоты желудочного сока, является важным средством определения восприимчивости париетальных клеток к секреции паракринного и эндокринного гормонов. Кроме того, индуцированный синтез функциональных белков может влиять на секреторную активность париетальных клеток. В данных исследованиях, мы изучили время-зависимое влияние шести различных соединений, выделенных из кофейных напитков, на экспрессию Н+,K+-АТФазы (АТР4А), Н2-гистаминового рецептора (HRH2), ацетилхолинового рецептора М3 {CHRM3) и рецептора соматостатина 2 (SSTR2). Время-зависимую экспрессию измеряют до тех пор, пока экспрессия не возвращается на контрольный уровень. Одна контррегуляция после предшествующей повышающей или понижающей регуляции считается физиологической регуляцией.
Н+,K+-АТФаза. Экспрессия Н+,K+-АТФазы нарушается преимущественно и в значительной степени хлорогеновой кислотой, кофеином, пирогаллолом и N-метилпиридинием (односторонний дисперсионный анализ, p<0.01-0.001; n=5-6, Фиг. 7А), в то время как катехин и С5НТ значительно не изменяют экспрессию на протяжении всего времени измерений (графики не приведены). Хлорогеновая кислота и кофеин повышают экспрессию Н+, K+-АТФазы почти вдвое (СА: 0,91±0,17, CAFF: 0,94±0,24; дополнительный тест, р<0.05, Фиг. 7А) после 20 минут. Изменение экспрессии оставалось значительным на протяжении всего периода измерений, равного 30 минутам. В отличие от этого, N-метилпиридиний и пирогаллол приводили к значительному снижению экспрессии после 20 минут (N-МР: -0,64±0,11, PYR: -0,46±0.07, дополнительный тест, р≤0.05, Фиг. 7А). Для выявления синергичных или анти-синергичных эффектов этих соединений при их максимумах/минимумах пиковой экспрессии, было изучено влияние их комбинаций на генную экспрессию. Как пирогаллол, так и N-метилпиридиний были способны в значительной степени компенсировать эффект повышающей регуляции хлорогеновой кислоты и кофеина (двусторонний t-критерий, р<0.01-0.001, n=4-6, Фиг. 7В) до N-MP/CA: -0,76±0,24, N-MP/CAFF: -0,46±0.05, N-MP/CA/CAFF: -0,21±0,22 и PYR/CA: -0,36±0,19, PYR/CAFF: -0,10±0,13, PYR/CA/CAFF: -0,27±0,15. Таким образом, было показано, что N-метилпиридиний и пирогаллол доминируют над эффектами хлорогеновой кислоты и кофеина в более сложном растворе. Обработка клеток HGT-1 физиологическими индукторами секреции кислоты желудочного сока, такими как гистамин (0,74±0,16; дополнительный тест, р<0,05, график не приведен) и ацетилхолин (0,62±0,19; дополнительный тест, n=6, р<0.05, график не приведен), приводила к значительноу увеличению экспрессии после 20 и 15 минут, соответственно. Интересно, что обработка соматостатином также вызывала значительную повышающую регуляцию Н+,K+-АТФазы после 20 минут 0,83±0,20 (дополнительный тест, n=6, р≤0.05, график не приведен). С учетом такого характера регуляции при воздействии физиологических соединений, кажется вероятным, что повышающая регуляция Н+,K+-АТФазы происходит как первый ответ на обработку клеток HGT-1, Таким образом, последующая контррегуляция, продемонстрированная для пирогаллола и N-метилпиридиния, вероятно, является более существенной для регуляции секреции кислоты желудочного сока.
Н2-Гистаминовый рецептор. Просекреторные рецепторы принимают участие в активации париетальных клеток следствие связывания гормонов и трансмиттеров. Была изучена время-зависимая экспрессия просекреторных Н2-гистаминового рецептора и ацетилхолинового рецептора М3 в клетках HGT-1. Н2-Рецептор в значительной степени регулировался на протяжении всего времени измерений хлорогеновой кислотой, катехином и С5НТ (односторонний дисперсионный анализ, р≤0.01-0.05, n=5-6, Фиг. 7С), в то время как кофеин и N-метилпиридиний не влияли на экспрессию этого рецептора. Катехин (-0,54±0,23, дополнительный тест; р<0.05) и С5НТ (-1,35±0,21; дополнительный тест, р<0.05) вызывали значительную понижающую регуляцию экспрессии. Хлорогеновая кислота вызывала значительную повышающую регуляцию экспрессии Н2-рецептора (0,55±0,21, дополнительный тест, р<0.05) после 20 минут. Комбинация С5НТ с хлорогеновой кислотой приводит к значительной повышающей регуляции Н2-рецептора после пяти минут (0,46±0.04, двусторонний t-критерий, р≤0.001, n=4-6, Фиг. 7D) по сравнению с контрольными клетками и отдельно взятым С5НТ. Поскольку понижающая регуляция Н2-рецептора не увеличивает восприимчивость париетальных клеток к гистамину, С5НТ-кислота могут поддерживать этот эффект в сложном растворе. Однако, в комбинации с хлорогеновой кислотой он будет аннулирован. Комбинация катехина и хлорогеновой кислоты не изменяет значительно уровень экспрессии по сравнению с отдельно взятым катехином (Фиг. 7D). Гистамин как физиологический лиганд не регулирует в значительной степени Н2-рецептор (результаты не приведены).
Ацетилхолиновый рецептор М3. Было показано, что холинергический рецептор М3 в значительной степени регулируется только кофеином, пирогаллолом и N-метилпиридинием (односторонний дисперсионный анализ, р≤0.01-0.001, n=4-9, Фиг. 8А). Хлорогеновая кислота, С5НТ и катехин значительно не влияют на экспрессию М3-рецептора (графики не приведены). Соединения кофеина, пирогаллола и N-метилпиридиния сначала приводят к повышающей регуляции М3-рецептора после пяти минут, CAFF: 0,55±0.08, N-MP: 0,53±0,25, PYR: 1,14±0,14 (дополнительный тест, р<0.05, Фиг. 8А), причем пирогаллол демонстрировал наиболее выраженную повышающую регуляцию этого рецептора. Однако, последующая контррегуляция была значительной для N-метилпиридиния (-0,76±0,26, дополнительный тест, р<0.05, Фиг. 8В) после 20 минут и для пирогаллола (-0,70±0,21, дополнительный тест, р.0.05, Фиг. 8В) после 15 минут. Поскольку мы не выявили какой-либо противодействующей повышающей или понижающей регуляции определенными соединениями, мы не проводили дополнительных исследований эффекта комбинации соединений на этот рецептор. Экспрессия М3-рецептора не регулировалась в значительной степени путем обработки ацетилхолином (результаты не приведены).
Соматостатиновый рецептор 2. Антисекреторный соматостатиновый рецептор 2 в значительной степени регулировался N-метилпиридинием, С5НТ и катехином (односторонний дисперсионный анализ, р≤0.01-0.001, n=4-9, Фиг. 8В). Катехин снижал экспрессию рецептора соматостатина до -0,56±0,28 после 15 минут (дополнительный тест, р≤0.05, Фиг. 8В). Кроме того, С5НТ вызывал гигантское снижение экспрессии рецептора до -2,12±0,25 после пяти минут (дополнительный тест, р≤0.05, Фиг. 8В). В отличие от этого, М-метилпиридиний повышал экспрессию антисекреторного соматостатинового рецептора более чем вдвое до 1,14±0,15 после пяти минут (дополнительный тест, р≤0.05, Фиг. 8В). Обработка соматостатином регулировала этот рецептор в такой же степени, как N-метилпиридиний, но с пиком максимума после 20 минут (1,14±0,31; дополнительный тест, р<0.05, график не приведен). Таким образом, мы объединили С5НТ и N-метилпиридиний, что приводило к экспрессии рецептора соматостатина на контрольном уровне (1,14±0,31, Фиг. 8D). Уровень экспрессии по сравнению с обработкой отдельно взытыми N-метилпиридинием или С5НТ при этом значительно изменялся (двусторонний t-критерий, р<0.05-0.001, n=4-6, Фиг. 8D).
Полная рекомбинация соединений. После того, как мы охарактеризовали эффект каждого отдельно взятого соединения и их комбинаций в наиболее выраженные моменты времени, мы протестировали полную рекомбинацию всех шести соединений вместе. Наши результаты для Н+,K+-АТФазы были подтверждены тем фактом, что экспрессия протонного насоса не увеличивалась и не уменьшалась после 20 минут. Весь период проведения измерений оставался значащим для регуляции (односторонний дисперсионный анализ, р≤0.05, n=5-6, Фиг. 9А), но был подтвержден компенсирующий эффект N-метилпиридиния и пирогаллола после 20 минут. Было показано, что просекреторный М3-рецептор подвергается понижающей регуляции N-метилпиридинием после 20 минут. Рекомбинация всех шести соединений также значительно понижающе регулирует экспрессию этого рецептора после 20 минут до -1,43±0,31 (односторонний дисперсионный анализ, р≤0.001, n=6, Фиг. 9А; дополнительный тест, р.0.05), что значительно превышает эффект отдельно взятого N-метилпиридиния. Таким образом, было выдвинуто предположение о комбинированном эффекте N-метилпиридиния и пирогаллола. Кроме того, обработка полной рекомбинацией не вызывала повышающей регуляции М3-рецептора после пяти минут, что позволяет предположить наличие анти-синергичных эффектов всех вместе взятых соединений. Было показано, что антисекреторный соматостатиновый рецептор подвергается повышающей регуляции N-метилпиридинием и противоположно регулируется С5НТ. Полная рекомбинация подтвердила наши результаты, касающиеся противодействия друг другу С5НТ/N-метилпиридиния после пяти минут. Уровень экспрессии был немного, но не значимо, выше контрольных уровней. В отличие от этого, последующая понижающая регуляция рецептора соматостатина все равно наблюдалась после 20 минут, как также было показано для отдельно взятого N-метилпиридиния (односторонний дисперсионный анализ, р≤0.001, n=6, Фиг. 9А; дополнительный тест, р<0.05).
H2-гистаминовый рецептор продемонстрировал схему поведения, которая полностью отличается от описаной для отдельно взятых соединений. Сильный эффект понижающей регуляции С5НТ, вероятно, компенсируется благодаря хлорогеновой кислоте, как показано ранее (Фиг. 7, С и D). Однако, после 10 минут экспрессия H2-рецептора гигантски возрастала до 1,36±0,37 (односторонний дисперсионный анализ, р≤0.001, n=6, Фиг. 9А; дополнительный тест, р≤0.05). Поскольку наши эксперименты с отдельно взятыми соединениями не дают объяснения этому эффекту, мы разработали подход к определению соотношений между отдельно взятыми соединениями или их комбинациями и экспрессией H2-рецептора, а также трансдукцией сигнала и функциональными аспектами, путем статистического моделирования, которое описано в следующем абзаце.
Идентификация комбинаторных эффектов на генную экспрессию рецептора методами вычислительного анализа. Различные комбинации исследуемых соединений используют для оценки эффектов, вызванных комбинацией отдельно взятых соединений, путем расчета нейронной сети (Таблица 2). В качестве доминирующих соединений в многокомпонентном растворе были идентифицирован N-метилпиридиний, кофеин и хлорогеновая кислота. N-метилпиридиний считался важным фактором в 94% всех рассчитаных сценариев экспрессии Н2-гистаминового рецептора. Наивысшую значимость продемонстрировал кофеин - 100%. Пирогаллол и хлорогеновая кислота имели значимость 71% и 79%, тогда как N-алканоил-5-гидрокситриптамиды и катехин имели более низкую, равную 50% и 29%. В общем, рассчитаные сценарии коррелируют с экспериментальными данными для экспрессии Н2-гистаминового рецептора с R=94%. Экспериментальные результаты для экспрессии ацетилхол и нового рецептора М3 также имеют корреляцию 94% с рассчитаной моделью. В этом случае, хлорогеновая кислота имеет наивысшую значимость, равную 100%. N-метилпиридиний использовался в 91% всех рассчитаных сценариев как важный фактор в комбинации с другими компонентами. Кофеин имел значимость 82%. Катехин (59%), N-алканоил-5-гидрокситриптамид (68%) и пирогаллол (23%) имели меньшую важность. Нейронная сеть, рассчитанная для антисекреторного соматостатинового рецептора, коррелирует с экспериментальными данными с достаточно приемлемым значением R, равным 80%. За исключением N-алканоил-5-гидрокситриптамидов (25%), все соединения продемонстрировали значимость выше 83% (пирогаллол). Наибольший весовой коэффициент, рассчитанный для хлорогеновой кислоты и кофеина, был равен 100%. N-метилпиридиний показал значимость, равную 96%, также как катехин.
Концентрация циклического АМФ в клеточных лизатах. Передача сигналов Н2-гистаминового рецептора сильно связана с повышенными уровнями цАМФ вследствие активации аденилатциклазы. Обработка гистамином значительно повышала концентрацию цАМФ в клетках HGT-1 до 71±17 фмоль/мл (двусторонний t-критерий; р<0.05; n=4; Фиг. 10А). Аналогично гистамину, кофеин (56±15 фмоль/мл), пирогаллол (56±23 фмоль/мл), катехин (74±27 фмоль/мл), С5НТ (40±1,0 фмоль/мл) и N-метилпиридиний также значительно повышали уровни циклического АМФ в клетках HGT-1 (двусторонний t-критерий; р<0.05-0.01; n=4; Фиг. 10А). В отличие от этого, хлорогеновая кислота (12±1,9 фмоль/мл) приводила к значительному снижению концентрации циклического АМФ по сравнению с контрольными клетками (двусторонний t-критерий; р<0.05; n=4; Фиг. 10А). Полная рекомбинация всех отдельно взятых соединений также значительно увеличивала концентрации циклического АМФ до 46±7,1 фмоль/мл по сравнению с контролями (23±3.4 фмоль/мл) (двусторонний t-критерий, р<0.05; n=7; Фиг. 9, С).
Трансдукция сигнала. Индукция секреции кислоты желудочного сока является многопараметрической. Изменения на регуляторном и функциональном уровне медиируются внутриклеточной передачей сигналов киназ. Поэтому мы исследовали, будут ли три разные киназы активироваться путем фосфорилирования после обработки компонентами обжареного кофе или гистамином. Сначала, степень фосфорилирования рецептора EGFr тирозинкиназы после прибавления гистамина (1,32±0,42), хлорогеновой кислоты (2,22±0,30), кофеина (1,78±0,64) или С5НТ (1,19±0,21) значительно возрастала (р<0.001-0.05; n=3-7; Фиг. 10, В), в то время как N-метилпиридиний не влиял на активацию по сравнению с контрольными клетками. Поскольку передача сигналов EGFr и G-белка может впоследствии активировать Akt1 киназу, этот путь также был исследован для определения его состояния фосфорилирования. Неожиданно, Akt1 лишь незначительно активировался кофеином (0,48±0,30), пирогаллолом (0,66±0,38), катехином (0,66±0,13) и С5НТ (0,53±0,32) (двусторонний t-критерий, р<0.05; n=7; Фиг. 10 В), и более значительно - N-метилпиридинием (1,39±0,25) (двусторонний t-критерий, р<0.01; n=7; Фиг. 10, В). Индуцированная гистамином желудочная секреция преимущественно развивалась путем передачи сигналов циклического АМФ. Однако, хлорогеновая кислота не повышала уровни циклического АМФ и не активировала Akt1, что позволяет предположить ее низкий секреторный потенциал. В то же время, активация Akt1 N-метилпиридинием должна была вызываться индукцией рецептора, отличного от EGFr. Кроме этого, мы исследовали, продемонстрируют ли внеклеточно регулируемые киназы 1/2 (ERK1/2) отличные уровни фосфорилирования после обработки гистамином или компонентами обжареного кофе. N-метилпиридиний (0,52±0,14) был единственным веществом, вызывавшим значительную активацию ERK1/2 (двусторонний t-критерий, р≤0.01; n=3; Фиг. 10, В). В отличие от этого, обработка гистамином (-0,37±0.09), хлорогеновой кислотой (-1,09±0,38), С5НТ (-0,81±0,22) и кофеином (-0,30±0,13) приводит даже к значительно сниженной активации ERK1/2 по сравнению с контрольными клетками (двусторонний t-критерий, р<0.01-0.05; n=7; Фиг. 10 В). Полная рекомбинация всех соединений, однако, активирует EGFr (2,19±0,59) и Akt1 (0,88±0,28), но не ERK1/2 (-0,33±0,14). Этот результат указывает на преобладающий эффект других соединений, отличных от N-метилпиридиния, на передачу сигналов ERK1/2, которая, как было определено ранее, играет критическую ингибирующую роль в секреции кислоты желудочного сока.
Активация фактора транскрипции. Факторы транскрипции играют критическую роль в транскрипции генов. Поскольку гены альфа-субъединицы Н+,K+-АТФазы (АТР4А) и рецептора соматостатина (SSTR2) содержат элементы, чувствительные к циклическому цАМФ, мы исследовали роль фактора транскрипции ATF-2 в стимуляции секреции кислоты желудочного сока под действием гистамина, отдельно взятых соединений и их полной рекомбинации. Только гистамин (1,17±0,25), катехин (1,22±0.08) и N-метилпиридиний (0,84±0,23) значительно активировали ATF-2. Только кофеин вызывал дефосфорилирование, которые было значительно ниже, чем у контрольных клеток (0,64±0.06) (двусторонний t-критерий, р≤0.05-0.001; n=7; Фиг. 10, С). Полная рекомбинация всех соединений приводила к значительному увеличению активации ATF-2 по сравнению с контролями (двусторонний t-критерий, р<0.01; n=4; Фиг. 9, В). Связанная с измерениями концентраций циклического АМФ в клетках HGT-1, гистаминовая активация париетальных клеток, как указывается, сильно связана с активацией под действием ATF-2, а также катехина и N-метилпиридиния. Кроме этого, дефосфорилирование ATF-2 хлорогеновой кислотой согласуется с пониженными уровнями циклического АМФ в клетках HGT-1. Вероятно, транскрипция генов, связанных с секрецией кислоты желудочного сока, также активируется другими путями и факторами транскрипции, чем передача сигналов циклического АМФ, поскольку кофеин и хлорогеновая кислота вызывают сильное увеличение экспрессии Н+,K+-АТФазы. Однако, индуцированная N-метилпиридинием экспрессия рецептора соматостатина может быть поддержана как циклическим АМФ, так и активацией ATF-2.
Секреторный потенциал. Внутриклеточный протонный индекс (IPX) сначала измеряли для оценки стимулирующего потенциала отдельно взятых соединений, полной рекомбинации и разных рекомбинаций, не содержащих каждого одного из шести соединений. IPX позволяет получить информацию о внутриклеточной концентрации протонов по сравнению с необработанными клетками. Более отрицательное значение IPX, чем у контрольных клеток, указывает на более высокую секреторную активность, если предположить, что внутриклеточный рН временно возрастает вследствие секреции протонов. Величина изменения рН, однако, находится в диапазоне физиологических значений, но является измеримой. Гистамин вызывал сильную стимуляцию секреторной функции, на что указывает значение IPX, равное -1,15±0.04 (двусторонний t-критерий, р<0.01; n=4; Фиг. 11А). Этот результат подтверждается результатами измерений в камере Уссинга, где гистамин повышал секрецию до 39 мкА/см2 (Фиг. 11В), которая позднее ингибировалась омепразолом, специфическим ингибиторм Н+,K+-АТФазы, и затем возвращалась на контрольный уровень (77 мкА/см2, Фиг. 11В). Эффект хлорогеновой кислоты быль сильно антисекреторным. Как измеренное существенно положительное значение IPX (0,17±0.02; двусторонний t-критерий, р<0.001; п=7; Фиг. 11А), так и пониженный ток в камере Уссинга (-76 мкА/см2, Фиг. 11С) позволяют предположить наличие ингибирующего эффекта хлорогеновой кислоты на функциональном уровне in vitro. Рекомбинация всех соединений, кроме хлорогеновой кислоты, также указывает на анти-синергичный эффект хлорогеновой кислоты при полной рекомбинации, поскольку величина IPX (0.02±0.01) значительно уменьшается (двусторонний t-критерий, р<0.001; n=7; Фиг. 11, А). В отличие от этого, кофеин стимулирует секрецию, с величиной IPX, равной -0.09±0.04 (двусторонний t-критерий, р<0.01; n=7; Фиг. 11, А). Секреторная активность была подтверждена увеличением тока до 16 мкА/см2 (Фиг. 11С). Отдельно взятый N-метилпиридиний совершенно не влияет на IPX (Фиг. 11А) или ток (график не приведен). Поэтому, при добавлении в базальный компартмент камеры Уссинга он приводит к уменьшению тока с 16 мкА/см2 до -5 мкА/см2 (Фиг. 11С), если перед этим в апикальный компартмент был добавлен кофеин. Комбинация кофеина с N-метилпиридинием приводит к пониженному IPX, равному 0,03±0.06, что несущественно отличалось как от контрольного уровня, так и от эффекта отдельно взятого кофеина (результаты не приведены). Наиболее сильный эффект рекомбинации был определен для катехина. Величина IPX ля отдельно взятого катехина указывает на наличие стимулирующего эффекта на клетки HGT-1 (-0.04±0.02; двусторонний t-критерий, р.0.05; n=7; Фиг. 11, А). Рекомбинация всех соединений, не содержащая катехина, продемонстрировала в высшей степени значимое изменение до положительного значения IPX, равного 0,12±0.02 (двусторонний t-критерий, р≤0.001; n=7; Фиг. 11, А). Как показывает определение IPX катехина, который был значимым, но не настолько сильным, как для гистамина или кофеина, ток, вызываемый апикальной обработкой клеток HGT-1 катехином, был относительно гладким по сравнению со стимуляцией кофеином или гистамином (Фиг. 11А, С, D). Таким образом, эффект катехина, по-видимому, более синергичен, чем влияние отдельно взятого соединения. Испытания не показали для С5НТ значительного изменения IPX по сравнению с контрольными клетками, однако отдельно взятый С5НТ демонстрировал тенденцию к значимости с р - значением, равным 0.07. Это подтверждается измерениями тока после апикальной обработки клеток HGT-1 с помощью С5НТ, которая приводит увеличению тока до 70 мкА/см2 после прибавления (Фиг. НЕ). Наконец, были проведены испытания пирогаллола, который продемонстрировал антисекреторную активность с значительным положительным значением IPX, равным 0.05±0.02, по сравнению с контрольными клетками (двусторонний t-критерий, р<0.05; n=7; Фиг. 11, А). Измерение тока оказало снижение до -24 мкА/см2 после апикальной обработки клеток HGT-1. Полная рекомбинация, однако, не продемонстрировала значительного изменения IPX по сравнению с контрольными клетками, что подтверждает гипотезу о синергичных и анти-синергичных эффектов в ногокомпонентных растворах.
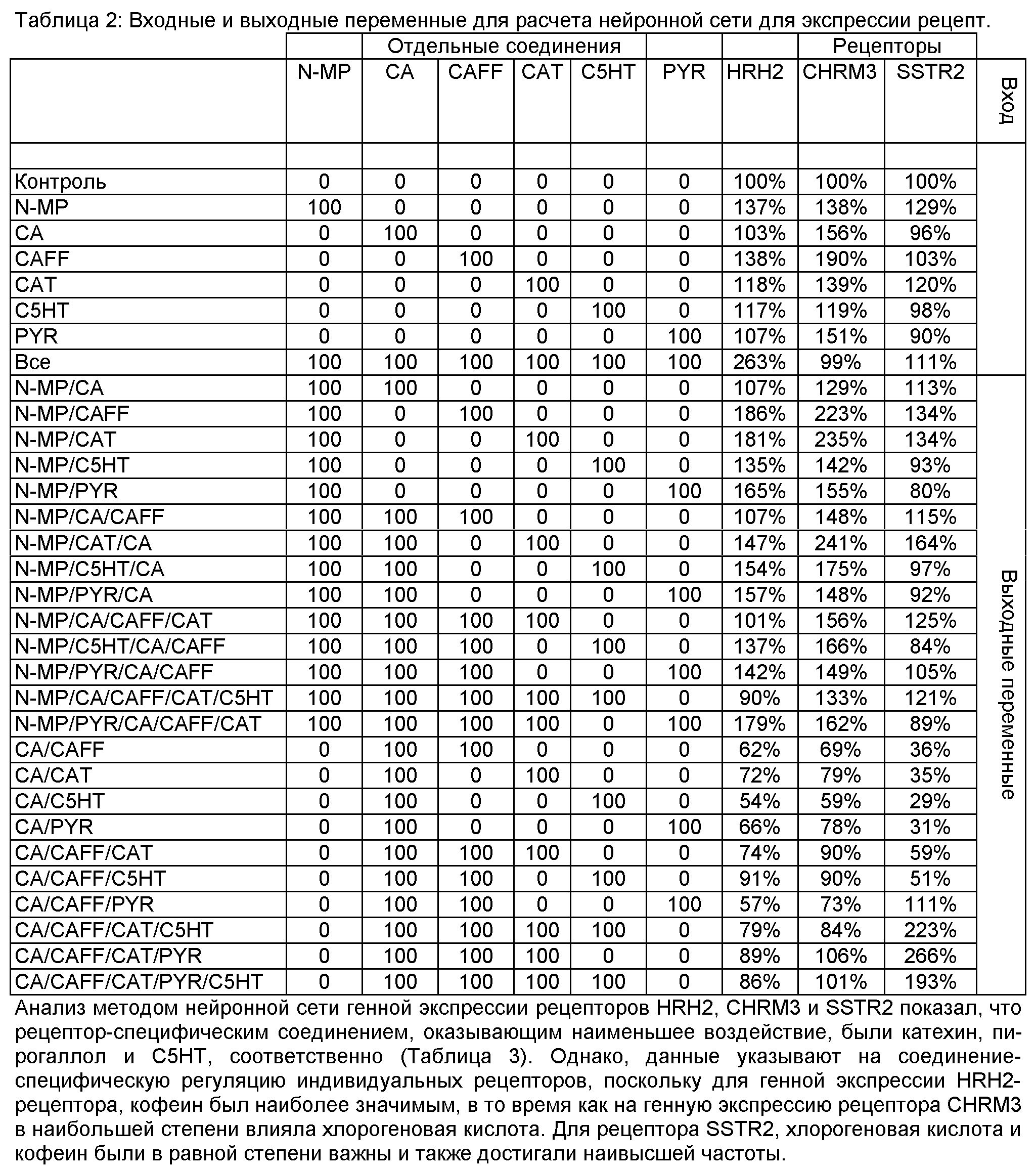
Все соединения использовались в концентрациях, аналогичных тем, в которых они присутствуют в обычном кофейном напитке. В нашем многопараметрическом подходе мы исследовали эффект этих соединений на известные до настоящего времени гены, передатчики сигналов и функциональные аспекты секреции кислоты желудочного сока. Кроме того, мы применили моделирование нейронных сетей для идентификации соединений, представляющих наибольшую важность для генной экспрессии про- и антисекреторных рецепторов. Однако, наши результаты для отдельно взятых соединений на уровень генной регуляции, соответствовали, за одним исключением, результатам измерений для полной рекомбинации, первые было показано, что N-метилпиридиний и пирогаллол понижающе регулируют ключевого игрока секреции кислоты желудочного сока - Н+,K+-АТФазу, и противодействуют кофеину и хлорогеновой кислоте, которые повышающее регулируют этот ген почти в два раза. В экспериментах с рекомбинацией как N-метилпиридиний, так и пирогаллол компенсировали эффект повышающей регуляции кофеина и хлорогеновой кислоты, также как и полная рекомбинация всех соединений. Просекреторный ацетилхолиновый рецептор М3 подвергался повышающей регуляции пирогаллолом, хлорогеновой кислотой и N-метилпиридинием. N-метилпиридиний впоследствии понижающе регулировал этот рецептор после 20 минут таким же образом, как полная рекомбинация всех соединений воздействовала на экспрессию этого рецептора. Дополнительно, пирогаллол также понижающе регулировал этот рецептор в момент времени 15 минут, после сильной повышающей регуляции в момент времени пять минут. Таким образом, после 20 минут вероятно наблюдается комбинированный эффект. Дополнительно, антисекреторный соматостатиновый рецептор 2 подвергался сильной понижающей регуляции С5НТ, что может приводить к пониженной восприимчивости париетальных клеток к передаче антисекреторных сигналов in vivo. В отличие от этого, N-метилпиридиний увеличивал экспрессию этого рецептора более чем вдвое. Комбинация обоих соединений давала уровни экспрессии, незначительные по сравнению с контролем. Таким же образом, полная рекомбинация всех соединений регулирует антисекреторный соматостатиновый рецептор.
Обобщая эти результаты, укажем, что N-метилпиридиний, по-видимому, оказывал на все важные гены, за исключением гистаминового рецептора, антисекреторное воздействие. Пирогаллол в равной степени влияет на Н+,K+-АТФазу и, совместно с N-метилпиридинием, вероятно, на ацетилхолиновый рецептор М3. Поскольку С5НТ сильно понижающе регулирует антисекреторный соматостатиновый рецептор и компенсирует эффект повышающей регуляции N-метилпиридиния, С5НТ может поддерживать повышенную секрецию кислоты желудочного сока после употребления кофе in vivo. В отличие от этого, С5НТ понижающе регулирует экспрессию Н2-гистаминового рецептора в гигантской степени после пяти минут, в то время как хлорогеновая кислота вызывала повышающую регуляцию после 15 минут. Рекомбинация всех соединений, однако, продемонстрировала нормальный уровень экспрессии после пяти минут, но увеличение экспрессии до более чем 2-кратного после 10 минут. В данном случае остается непонятным, почему комбинированный эффект вызывает повышающую регуляцию экспрессии Н2-рецептора. Нейронная сеть предсказывает наивысшую значимость при экспрессии Н2-гистаминового рецептора для кофеина, хлорогеновой кислоты и N-метилпиридиния. Различные комбинации отдельно взятых соединений продемонстрировали, что увеличение сложности растворов приводит к показателям значимости, отличным от тех, на которые указывают отдельно взятые соединения. Так, понижающий эффект С5НТ на экспрессию М3-ацетилхолинового рецептор даже усиливался при совместной инкубации с хлорогеновой кислотой. Эффект отдельно взятой хлорогеновой кислоты не был настолько сильным, чтобы указывать его доминирующее влияние по сравнению с С5НТ. Тем не менее, нейронная сеть идентифицировала хлорогеновую кислоту как имеющую наивысшую значимость для изменения экспрессии ацетилхолинового рецептора М3 в многокомпонентных растворах, равную 100%. N-метилпиридиний был идентифицирован как соединение, имеющее вторую по величине значимость, равную 91%. Однако, N-метилпиридиний продемонстрировал эффект понижающей регуляции на экспрессию ацетилхолинового рецептора М3 как отдельно взятое соединение. Эти результаты подтверждаются высокими R-значениями корреляции рассчитанных сценариев и экспериментальных данных. Поскольку ни одно отдельно взятое соединение, а также полная рекомбинация всех исследованных соединений не продемонстрировали сильного воздействия на экспрессию Н2-гистаминового рецептора или на ацетилхолиновый рецептор М3 после 10 мин., нейронная сеть служит мощным инструментом идентификации синергичного и анти-синергичного эффектов.
С точки зрения трансдукции сигнала, активация EGFr, Akt1 и ERK1/2 продемонстрировала дифференцированный характер. До настоящего времени считалось, что EGFr усиливает секрецию кислоты желудочного сока и может также частично активироваться гистамином. Наши результаты поддерживают эту гипотезу. Таким же образом действуют кофеин, хлорогеновая кислота и С5НТ, а также полная рекомбинация. Интересно, что в предшествующих исследованиях, кофейный напиток с высоким содержанием хлорогеновой кислоты и кофеина, но низким - N-метилпиридиния, также активировали EGFr, но напитки с высоким одержанием N-метилпиридиния не активируют этот рецептор. Последующая передача сигналов EGFr включает передачу сигналов Akt1 и ERK1/2. Предполагается, что Akt1 повышает экспрессию Н+,K+-АТФазы и увеличивает секреторную активность. Все соединения, за исключением гистамина и хлорогеновой кислоты, активирют передачу сигналов Akt1. Так же ведет себя полная рекомбинация всех соединений. Наоборот, передача сигналов ERK1/2, оторая предположительно остро ингибирует желудочную секрецию, активировалась только N-метилпиридинием. Кроме того, полная рекомбинация уменьшала передачу сигналов ERK1/2 ниже контрольного уровня. Было показано, что на циклический АМФ и родственный фактор транскрипции, ATF-2, специфически не влияет ни одно из исследуемых соединений, хотя гистамин повышает клеточные концентрации циклического АМФ и активацию ATF-2. N-метилпиридиний действует таким же образом. Поскольку эффект N-метилпиридиния был скорее антисекреторным, повышенные уровни цАМФ и активация ATF-2 могут быть связаны с повышенной экспрессией антисекреторного соматостатинового рецептора. Кроме того, хлорогеновая кислота снижала уровни циклического АМФ и не активировала ATF-2 и, кроме того, была ассоциирована с пониженной секреторной активностью клеток HGT-1. Секреторная активность характеризовалась измереними внутриклеточного рН и экспериментами с камерой Уссинга. Кофеин, катехин и С5НТ стимулировали секрецию, в то время как хлорогеновая кислота и пирогаллол приводили к снижению секреции. N-метилпиридиний совершенно не влиял на внутриклеточный рН или секрецию в экспериментах с камерой Уссинга. Таким образом, он продемонстрировал контррегулирующий эффект на индуцируемую кофеином секрецию.
Обобщая наши результаты, укажем, что биологический эффект отдельно взятого соединения всегда может отличаться от эффекта этого же соединения в сложных растворах. Наши результаты поддерживают гипотезу о синергичных и анти-синергичных взаимодействиях разных компонентов.
Пример 3: Количественный анализ NMP и 5СНТ в образцах кофе
N-Алканоил-5-гидрокситриптамиды (С5НТ) и N-метилпиридиний (NMP) были количественно проанализированы в ряде образцов кофе с разными степенями обжаривания и разной предварительной обработкой. Было отмечено, что концентрация NMP в кофейном напитке возрастала с увеличением степени обжаривания. Концентрация С5НТ в кофейнм напиток уменьшалась с увеличением степени обжаривания. Декофеинированные и депарафинированные образцы кофе демонстрировали значительно более низкое содержание С5НТ по сравнению с необработанными образцами.
Количественный анализ, были количественно определены N-алканоил-5-гидрокситриптамид (С5НТ) и N-метилпиридиний (NMP) в образцах кофе. Коды образцов были заменены на легко понятные сокращенные наименования для лучшего понимания (Таблица 4).
Для количественного анализа N-алканоил-5-гидрокситриптамидов (С5НТ) аликвоту свежеприготовленного кофейного напитка смешивают с мечеными дейтерием внутренними стандартами и разбавляют метанолом после уравновешивания. Охлаждение и центрифугирование дает окрашенный в коричневый цвет осадок и желтоватую надосадочную жидкость, которую вводят в систему ВЭЖХ-МС/МС без дополнительной обработки. На Фиг. 16 приведены результаты типичного анализа. Термины "Skt" и "деления шкалы" используются тут синонимично.
Хотя проанализированные кофейные напитки демонстрировали по существу одинаковые тенденции для концентраций NMP и С5НТ в зависимости от степени обжаривания (в делениях шкалы), в напитке депарафинированного Columbia 2 (помечен на Фиг. 15) при средней степени обжаривания было определено сильно увеличенное содержание (+60%) NMP по сравнению с другими образцами. Этот кофе (депарафинированный Col 2, 80 Skt) и его необработанный аналог используют для экспериментов импульсным вводом NMP.
По количественным данным для каждого образца кофе рассчитывают безразмерный показатель, представляющий собой частное от деления концентрации NMP (мг/л) и концентрации С5НТ (мкг/л)×100. Этот предложенный показатель, предположительно, визуально иллюстрирует отношение С5НТ к NMP. Кроме данных образцов, на Фиг. 16 для сравнения приведены данные для коммерчески доступных марок кофе, полученные в предшествующих исследованиях.
Можно увидеть на основании предложенного показателя, что депарафинированный Columbia 2, обжаренный при 80 делений шкалы, чрезвычайно сильно отличается от сравнительных образцов. При этом, было получено чрезвычайное значение отношения концентраций NMP и С5НТ, без достижения очень темной окраски при обжаривании.
Подмешивание N-метилпиридиния к кофейному напитку. Стандартизированные кофейные напитки были приготовлен из образцов "необработанного Columbia 2, 80 Skt" и "депарафинированного Columbia 2, 80 Skt". Стандартный раствор N-метилпиридиния йодида был подмешан к напитку, приготовленному из депарафинированного обжареного кофе, с получением содержания NMP, равного +100%, +200% и +300% по сравнению с собственным содержанием NMP в смеси. После лиофилизации, образцы подвергают дополнительной обработке.
Пример 4: Секреция протонов в желудочных клетках в ответ на NMP и тригонеллин
Далее, разные количества N-метилпиридиния прибавляли к двум выбранным маркам кофе. Дополнительно, был охарактеризован тригонеллин как вещество-прекурсор N-метилпиридиния, в виде отдельно взятого вещества, по его эффекту на секрецию протонов желудочными клетками человека in vitro.
Клеточная культура. Для in vitro экспериментов используют опухолевую клеточную линию HGT-1 (клеточная линия опухоли желудка человека). Клетки выделяют из первичной опухоли желудка человека в возрасте 60 лет. Клеточная линия HGT-1 (клон 6) была получена Dr. Laboisse (Laboratory of Pathological Anatomy, Nantes, France) в 1982 г. Клеточная линия росла адгерентно и микроскопически проявляла ромбическую морфологию, характерную для эпителиальных клеток.
Клеточную линию культивируют в инкубаторе при 37°С и 5% СO2. В качестве культуральной среди используется не содержащая глутамина "среда Игла, модифицированная по Дульбекко", с добавкой:
20% фетальной телячьей сыворотки
2% пенициллина/стрептомицина
2% глутамина
Для минимизации влияния физиологически активных компонентов фетальной телячьей сыворотки, эквивалентная среда используется для культивации в течение 24 ч перед проведением эксперимента, но без добавления сыворотки. Культивацию клеток HGT-1 проводят в колбах для клеточных культур (75 см2) или на планшетах для клеточных культур (6-луночных, 24-луночных, 6-SNAP-well). Число клеток, используемых для индивидуальных экспериментов, а также дополнительные подробности, касающиеся проведения индивидуальных экспериментов, приведены более детально в соответствующем разделе.
Измерение секреции путем определения внутриклеточного рН. Измерение внутриклеточного рН производится методом проточной цитометрии. Внутриклеточный рН жестко регулируется в диапазоне значений рН от 6,8 до 7,4. Большие по величине отклонения компенсируются внутриклеточным протеинатным буфером. Внутриклеточный рН может быть использован как индикатор переноса ионов H+ через клеточную мембрану. Суммарный транспорт ионов Н+ из внутриклеточной во внеклеточную среду приводит к кратковременному повышению внутриклеточного рН и снижению внутриклеточной концентрации ионов H+, соответственно.
Эксперименты проводят следующим образом. Клетки HGT-1 промывают предварительно подогретым PBS и затем соскабливают в 5 мл PBS и ресуспендируют. Суспензию доводят до 1×106 жизнеспособных клеток на мл и помещают по 2 мл каждой суспензии клеток в пробирки для FACS. После этого клетки центрифугируют при 1000 об./мин. в течение 5 мин., надосадочную жидкость отбрасывают, осадок ресуспендируют в 2 мл каждого из предварительно подогретых образцов раствор при 37°С и инкубируют при 37°С в течение 10 мин. После нового центрифугирования отбирают образец раствора, клетки ресуспендируют в 2 мл ранее приготовленного раствора 3 мкМ SNARF-AM и помещают на лед на 30 мин. Раствор красителя удаляют новым центрифугированием и осадок клеток ресуспендируют в 1 мл холодного PBS. Во время проведения измерений FACS образцы держат на льду. Для построения калибровочной кривой, 500 мкл каждого калибровочного буферого раствора с установленным значением рН (20 ммоль/л NaCl, 110 ммоль/л KCl, 1 ммоль/л CaCl2, 1 ммоль/л MgSO4, 18 ммоль/л D-глюкозы и 20 ммоль/л HEPES) помещают в пробирки для FACS вместе с 1 мкл нигерицина. Для калибровочной кривой, три дополнительные пробирки наполняют отрегулированной суспензией клеток и инкубируют в PBS. После окрашивания SNARF-AM клетки ресуспендируют в 20 мкл холодного PBS и по 5 мкл каждого образца помещают в подготовленные калибровочные пробирки. Измерения выполняют аналогично образцам.
Результаты измерений представляют в виде ратиометрического отношения медианы результатов подсчета для двух максимумов излучения красителя при 580 нм и 640 нм и определяют внутриклеточный рН с помощью калибровочной кривой. Для представления результатов был разработан внутриклеточный протонный индекс. Он рассчитывается путем log2-преобразования относительного показателя внутриклеточной концентрации ионов H+ для обработанного образца и необработанного контроля. Чем ниже величина индекса, тем больше протонов перемещается.
Измерение секреции по величине трансэпителиального тока. Для измерения ионных токов в монослое клеток HGT-1 используют камеру Уссинга производства фирмы Harvard-Apparatus. Для регистрации тока и напряжения используют интерфейс производства фирмы KMSI. По существу, она состоит из двух компартментов - апикальной и базальной камер. Между двумя камерами может быть закреплен зажимом образец ткани или клеток, культивируемых на специальной мембране. При проведении экспериментов, камера может поддерживаться при 37°С с помощью термостата. Для подготовки эксперимента, клетки HGT-1 культивируют на мембранных вкладышах SNAP-well. Для проведения эксперимента высеивают 100000 клеток на лунку. Целостность монослоя клеток проверяют путем определения трансэпителиального сопротивления с помощью камеры ENDOHM и микроскопическим контролем. Вкладыш SNAP-well размещают между двумя камерами с помощью специальной рамки. При проведении измерений можно прикладывать определенный ток или напряжение с помощью интерфейса с использованием двух электродов напряжения и двух - тока (AgCl-электроды), размещенных по обе стороны от вкладыша SNAP-well. Для измерения ионных токов выбирают режим короткого замыкания (ISC). Для этого устанавливают напряжение 0 вольт. Поскольку электрический потенциал на монослое клеток возникает благодаря активному и диффузия-зависимому переносу зарядов, то с помощью электродов устанавливается точное значение тока, создающее потенциал, равный 0 мВ. Частоту приложенного тока выбирают таким образом, чтобы за короткий период времени могло происходить нарастание потенциала. Таким образом, измеренные токи являются мерой происходящих транспортных событий. Для определения специфичности транспортного события используются определенные ингибиторы, для которых известны ингибируемый переносчик или канал. Таким образом, могут быть определены переносчики или ионные каналы, ответственные за изменение кривой тока после применения вещества, эффект которого требуется определить. В экспериментах, поставленных в рамках данных исследований, представляла интерес активность Н+,K+-АТФазы. Гистамин является физиологическим раздражителем данного Н+/K+-обменника. Фармакологическим ингибитором, селективно связывающимся с функциональной субъединицей этого протонного насоса, является омепразол.
Подготовка образцов. Для подготовки эксперимента были выбраны Arabica Columbia 2, необработанный, 80 делений шкалы (Соl2) и Arabica Columbia 2**, депарафинированный, 80 делений шкалы (Соl2**). Кофе заваривали стандартными способами. Arabica Columbia** затем обогащали 2,95 мг/100 мл, 5,8 мл/100 мл или 8,93 мг/100 мл N-метилпиридиния. Кофейные напитки лиофилизировали для эксперимента с клеточными культурами. Для экспериментов используют кофе с концентрацией фосфатного буфера, равной 2,5 мг/мл.
Для характеризации тригонеллина используют концентрацию в соответствии с "Lehrbuch der Lebensmittelchemie" (497 мкМ). Гистамин используют во всех экспериментах с концентрацией 1 мМ.
Все вещества и лиофилизаты кофе готовят в фосфатном буфере (PBS).
Влияние обогащенных кофе на секрецию. Клетки HGT-1 могут в значительной степени стимулироваться гистамином по сравнению с контролем (-0,38±0.06; р≤0.001). Исследуемые кофе демонстрировали полностью ослабленный секреторный потенциал по сравнению с гистамин-стимулированными клетками. Соl2 (-0,21±0.02) стимулировал секреторную активность значительно сильнее, чем Соl2** (0.09±0.03) (р<0.05). Кофе Соl2**, обогащенные N-метилпиридинием, демонстрировали более слабый эффект, чем Соl2. 3-кратное обогащение N-метилпиридинием (+8,93 мг/100 мл) Соl2** приводило к значительно (р<0.001) более слабой секреторной активности (0,19±0.03) по сравнению с Соl2**. Однако, обогащение Соl2** с использованием 5,98/100 мл N-метилпиридиния уже приводит к значительно более слабой секреции (0.03±0.01) по сравнению с Col" (p<0.05) (Фиг. 17).
Эксперименты на клеточных культурах с кофе, обогащенным N-метилпиридинием, могут подтвердить ингибирующий эффект N-метилпиридиния на секреторный потенциал кофейных напитков. Дополнительно, можно показать, что обработка Соl2 приводит к ослаблению секреторного потенциала полученного продукта Соl2** по сравнению с исходным продуктом.
Влияние тригонеллина на секрецию. N-метилпиридиний образуется в результате пиролитического декарбоксилирования тригонеллина. Вследствие этого, был продемонстрирован эффект отдельно взятого вещества тригонеллина на секреторную активность клеток HGT-1. Гистамин значительно стимулирует секрецию (-0,67±0.06; р≤0.001). Инкубация с тригонеллином приводит к значительному снижению секреторной активности по сравнению с контролем (0,46±0.04; р<0.001) (ср. Фиг. 18).
Эксперимент по определению концентрация-зависимого эффекта тригонеллина показал наличие значимой взаимосвязи. Может быть продемонстрировано ступенчатое снижение ингибирующего эффекта тригонеллина в диапазоне концентраций 4970, 497, 49,7, 4,97 мкМ. Величина IPX снижалась с 0,7 после обработки клеток наивысшей концентрацией, равной 4870 мкМ, до -0,4 после обработки концентрацией, равной 4,97 мкМ (Фиг. 19).
Ингибирующий эффект тригонеллина на секрецию по сравнению с контролем можно также подтвердить с помощью экспериментов с диффузионной камерой. После применения раствора тригонеллина с концентрацией 497 мкМ, ток короткого замыкания уменьшался с +2 мкА/см2 до -25 мкА/см2. В отличие от этого, N-метилпиридиний в виде отдельно взятого вещества не проявлял детектируемого эффекта на ток короткого замыкания (Фиг. 20).
Реферат
Группа изобретений относится к пищевой промышленности и фармакологии. Способ получения обогащенного N-метилпиридинием (NMP) экстракта тригонеллин-содержащего органического материала включает стадии депарафинизации, обжаривания, обработки тригонеллин-содержащего органического материала горячей водой для получения водного экстракта и добавления NMP, по меньшей мере, 2,95 мг NMP/100 мл к водному экстракту. В качестве тригонеллин-содержащего органического материала используют следующие материалы, выбранные из группы: кофе, в частности Coffea arabica, Coffea canephora, Coffea spp.и Psilanthus spp., членов Fabaceae, в частности Pisum sativum, Glycine max, Phaseolus vulgaris, Lens culinaris, Cicer arietinum и Trigonella foenum-graecum, членов Chenopodiaceae, в частности Chenopodium quinoa, и членов Poaceae, в частности Avena sativa. Фармацевтическая композиция для предотвращения или снижения секреции кислоты желудочного сока и/или для предотвращения расстройств и/или болезней, ассоциированных с секрецией кислоты желудочного сока, содержащая, в терапевтически эффективном количестве, обогащенный NMP полученный экстракт в комбинации с одним или несколькими фармацевтически приемлемым эксципиентом (эксципиентами), и/или носителем (носителями), и/или разбавителем (разбавителями), и/или растворителем (растворителями), и/или солью (солями), и/или буфером (буферами). Применение обогащенного NMP экстракта в качестве пищевой добавки. Применение обогащенного NMP экстракта для предотвращения или снижения секреции кислоты желудочного сока и/или для предотвращения расстройств и/или болезней, ассоциированных с секрецией кислоты желудочного сока (гастроэзофагеальная рефлюксная болезнь, рак, язва). Пищевой продукт, представляющий собой кофе, содержащий обогащенный NMP экстракт. Группа изобретений обеспечивает получение продукта для предотвращения или ум
Формула
(a) депарафинируют тригонеллин-содержащий органический материал;
(b) обжаривают тригонеллин-содержащий органический материал;
(c) обрабатывают обжареный тригонеллин-содержащий органический материал горячей водой для получения водного экстракта; и
(d) прибавляют NMP к водному экстракту.

Комментарии