Композиции и способы диагностики и лечения заболеваний, ассоциированных с дегенерацией нейритов - RU2644337C2
Код документа: RU2644337C2
Чертежи











































































Описание
Информация о родственной заявке
В настоящей заявке испрашивается преимущество заявки на патент США рег. № 61/591324, поданной 27 января 2012 г., и содержание этой заявки во всей своей полноте вводится в настоящее описание посредством ссылки.
Список последовательностей
Настоящая заявка содержит список последовательностей, который представлен в ASCII-формате на EFS-Web-сайте и во всей своей полноте вводится в настоящее описание посредством ссылки. Указанная ASCII-копия была создана 25 января 2013 г. под названием 11423USO.txt и имеет размер 100936 байт.
Область, к которой относится изобретение
Настоящее изобретение относится к антителам и к способам их применения для лечения и диагностики заболеваний, ассоциированных с дегенерацией нейритов, таких как рассеянный склероз.
Предшествующий уровень техники
Многие нейродегенеративные заболевания на ранней стадии характеризуются повреждением нейритов и нарушением синаптической функции. Дегенерация нейритов часто приводит к гибели нервных клеток и может препятствовать передаче сигналов в поврежденной нервной ткани, что приводит к нарушению чувствительности, двигательных функций, познавательных функций или каких-либо других функций в зависимости от типа нервных клеток, ответственных за эти функции. Дегенерация нейритов также является патологическим признаком рассеянного склероза («РС»). РС представляет собой аутоиммунное нейродегенеративное заболевание, которым страдает приблизительно 350000 человек в Соединенных штатах, и является главной причиной расстройств нервной системы или смерти у взрослых молодых людей. Самым распространенным расстройством у людей, страдающих РС, является дегенеративное поражение нервной ткани в результате обширной деградации миелинового слоя, окружающего аксоны нейронов, и фактической деградации самих аксонов. Демиелинизация, происходящая при РС, очевидно, инициируется атакой протеазных ферментов на три основных белка нервных клеток, таких как миелиновый основный белок (MBP), протеолипидный белок (PLP) и миелиновый гликопротеин олигодендроцитов (MOG). С механистической точки зрения, РС представляет собой воспалительное демиелинизирующее заболевание, которое, по меньшей мере частично, вызывается аутоиммунным ответом на продукты разложения миелина. Недавно проведенные исследования показали, что повреждение нейритов и аксонов, помимо уже хорошо известных механизмов, также вносит свой вклад в демиелинизацию и воспаление нервных клеток.
Обычно диагноз «воспалительное заболевание нейритов» основывается на анамнезе и обследовании нервной системы пациента, включая, магнитную резонансную томографию (МРТ) головного и спинного мозга, электродиагностическое обследование (например, тесты на вызванные потенциалы, такие как зрительные вызванные потенциалы, слуховые вызванные потенциалы ствола головного мозга или соматосенсорные вызванные потенциалы) и люмбальную пункцию для подтверждения синтеза иммуноглобулина в цереброспинальной жидкости.
В настоящее время не существует методов лечения заболеваний, ассоциированных с дегенерацией нейритов, и поэтому современные способы лечения обычно включает лишь ослабление симптомов и снижение частоты и тяжести рецидивов.
Описание сущности изобретения
В одном из своих аспектов настоящее изобретение относится к выделенному антителу или к его фрагменту, которые связываются с молекулой отталкивающего направляющего сигнала («RGMa»). Указанное антитело содержит домен или область, выбранные из (a) вариабельного домена или вариабельной области тяжелой цепи, включающих аминокислотную последовательность SEQ ID NO: 1, (b) вариабельного домена или вариабельной области легкой цепи, включающих аминокислотную последовательность SEQ ID NO: 5, (c) вариабельного домена или вариабельной области тяжелой цепи, включающих аминокислотную последовательность SEQ ID NO: 9, (d) вариабельного домена или вариабельной области легкой цепи, включающих аминокислотную последовательность SEQ ID NO: 13, (e) вариабельного домена или вариабельной области тяжелой цепи, включающих аминокислотную последовательность SEQ ID NO: 17, (f) вариабельного домена или вариабельной области легкой цепи, включающих аминокислотную последовательность SEQ ID NO: 21, (g) вариабельного домена или вариабельной области тяжелой цепи, включающих аминокислотную последовательность SEQ ID NO: 25, (h) вариабельного домена или вариабельной области легкой цепи, включающих аминокислотную последовательность SEQ ID NO: 29, (i) вариабельного домена или вариабельной области тяжелой цепи, включающих аминокислотную последовательность SEQ ID NO: 33, (j) вариабельного домена или вариабельной области легкой цепи, включающих аминокислотную последовательность SEQ ID NO: 37; (k) вариабельного домена или вариабельной области тяжелой цепи, включающих аминокислотную последовательность SEQ ID NO: 41; (l) вариабельного домена или вариабельной области легкой цепи, включающих аминокислотную последовательность SEQ ID NO: 45; (m) вариабельного домена или вариабельной области тяжелой цепи, включающих аминокислотную последовательность SEQ ID NO: 49; (n) вариабельного домена или вариабельной области легкой цепи, включающих аминокислотную последовательность SEQ ID NO: 53, (o) вариабельного домена или вариабельной области тяжелой цепи, включающих аминокислотную последовательность SEQ ID NO: 57, (p) вариабельного домена или вариабельной области легкой цепи, включающих аминокислотную последовательность SEQ ID NO: 61, (q) вариабельного домена или вариабельной области тяжелой цепи, включающих аминокислотную последовательность SEQ ID NO: 152, (r) вариабельного домена или вариабельной области легкой цепи, включающих аминокислотную последовательность SEQ ID NO: 95, (s) вариабельного домена или вариабельной области тяжелой цепи, включающих аминокислотную последовательность SEQ ID NO: 99, (t) вариабельного домена или вариабельной области легкой цепи, включающих аминокислотную последовательность SEQ ID NO: 103, (u) вариабельного домена или вариабельной области тяжелой цепи, включающих аминокислотную последовательность SEQ ID NO: 107, (v) вариабельного домена или вариабельной области легкой цепи, включающих аминокислотную последовательность SEQ ID NO: 111, (w) вариабельного домена или вариабельной области тяжелой цепи, включающих аминокислотную последовательность SEQ ID NO: 115, (x) вариабельного домена или вариабельной области легкой цепи, включающих аминокислотную последовательность SEQ ID NO: 119, (y) вариабельного домена или вариабельной области тяжелой цепи, включающих аминокислотную последовательность SEQ ID NO: 123, (z) вариабельного домена или вариабельной области легкой цепи, включающих аминокислотную последовательность SEQ ID NO: 127, (aa) вариабельного домена или вариабельной области тяжелой цепи, включающих аминокислотную последовательность SEQ ID NO: 131, (bb) вариабельного домена или вариабельной области легкой цепи, включающих аминокислотную последовательность SEQ ID NO: 135, (cc) вариабельного домена или вариабельной области легкой цепи, включающих аминокислотную последовательность SEQ ID NO: 67, (dd) вариабельного домена или вариабельной области легкой цепи, включающих аминокислотную последовательность SEQ ID NO: 68, (ee) вариабельного домена или вариабельной области легкой цепи, включающих аминокислотную последовательность SEQ ID NO: 69, (ff) вариабельного домена или вариабельной области легкой цепи, включающих аминокислотную последовательность SEQ ID NO: 70, (gg) вариабельного домена или вариабельной области легкой цепи, включающих аминокислотную последовательность SEQ ID NO: 71, (hh) вариабельного домена или вариабельной области легкой цепи, включающих аминокислотную последовательность SEQ ID NO: 72, (ii) вариабельного домена или вариабельной области легкой цепи, включающих аминокислотную последовательность SEQ ID NO: 73, (jj) вариабельного домена тяжелой цепи, включающего аминокислотную последовательность SEQ ID NO: 1, и вариабельного домена или вариабельной области легкой цепи, включающих аминокислотную последовательность SEQ ID NO: 5, (kk) вариабельного домена тяжелой цепи, включающего аминокислотную последовательность SEQ ID NO: 9, и вариабельного домена или вариабельной области легкой цепи, включающих аминокислотную последовательность SEQ ID NO: 13, (ll) вариабельного домена тяжелой цепи, включающего аминокислотную последовательность SEQ ID NO: 17, и вариабельного домена или вариабельной области легкой цепи, включающих аминокислотную последовательность SEQ ID NO: 21, (mm) вариабельного домена тяжелой цепи, включающего аминокислотную последовательность SEQ ID NO: 25, и вариабельного домена или вариабельной области легкой цепи, включающих аминокислотную последовательность SEQ ID NO: 29, (nn) вариабельного домена тяжелой цепи, включающего аминокислотную последовательность SEQ ID NO: 33, и вариабельного домена или вариабельной области легкой цепи, включающих аминокислотную последовательность SEQ ID NO: 37, (oo) вариабельного домена тяжелой цепи, включающего аминокислотную последовательность SEQ ID NO: 41, и вариабельного домена или вариабельной области легкой цепи, включающих аминокислотную последовательность SEQ ID NO: 45, (pp) вариабельного домена тяжелой цепи, включающего аминокислотную последовательность SEQ ID NO: 49, и вариабельного домена или вариабельной области легкой цепи, включающих аминокислотную последовательность SEQ ID NO: 53, (qq) вариабельного домена тяжелой цепи, включающего аминокислотную последовательность SEQ ID NO: 57, и вариабельного домена или вариабельной области легкой цепи, включающих аминокислотную последовательность SEQ ID NO: 61, (rr) вариабельного домена или вариабельной области тяжелой цепи, включающих аминокислотную последовательность SEQ ID NO: 152, и вариабельного домена или вариабельной области легкой цепи, включающих аминокислотную последовательность SEQ ID NO: 95, (ss) вариабельного домена или вариабельной области тяжелой цепи, включающих аминокислотную последовательность SEQ ID NO: 99, и вариабельного домена или вариабельной области легкой цепи, включающих аминокислотную последовательность SEQ ID NO: 103, (tt) вариабельного домена или вариабельной области тяжелой цепи, включающих аминокислотную последовательность SEQ ID NO: 107, и вариабельного домена или вариабельной области легкой цепи, включающих аминокислотную последовательность SEQ ID NO: 111, (uu) вариабельного домена или вариабельной области тяжелой цепи, включающих аминокислотную последовательность SEQ ID NO: 115, и вариабельного домена или вариабельной области легкой цепи, включающих аминокислотную последовательность SEQ ID NO: 119, (vv) вариабельного домена или вариабельной области тяжелой цепи, включающих аминокислотную последовательность SEQ ID NO: 123, и вариабельного домена или вариабельной области легкой цепи, включающих аминокислотную последовательность SEQ ID NO: 127, (ww) вариабельного домена или вариабельной области тяжелой цепи, включающих аминокислотную последовательность SEQ ID NO: 131, и вариабельного домена или вариабельной области легкой цепи, включающих аминокислотную последовательность SEQ ID NO: 135, (xx) вариабельной тяжелой цепи, включающей гипервариабельную область (CDR)1, содержащую аминокислотную последовательность SEQ ID NO: 2, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 3, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 4, (yy) вариабельной легкой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 6, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 7, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 8, (zz) вариабельной тяжелой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 10, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 11, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 12, (aaa) вариабельной легкой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 14, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 15, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 16, (bbb) вариабельной тяжелой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 18, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 19, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 20, (ccc) вариабельной легкой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 22, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 23, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 24, (ddd) вариабельной тяжелой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO:26, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 27, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 28, (eee) вариабельной легкой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 30, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 31, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 32, (fff) вариабельной тяжелой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 34, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 35, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 36, (ggg) вариабельной легкой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 38, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 39, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 40, (hhh) вариабельной тяжелой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 42, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 43, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 44; (iii) вариабельной легкой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 46, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 47, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 48; (jjj) вариабельной тяжелой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 50, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 51, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 52, и вариабельной легкой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 54, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 55, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 56, (kkk) вариабельной тяжелой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 58, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 59, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 60, (lll) вариабельной легкой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 62, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 63, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 64, (mmm) вариабельной тяжелой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 92 или 153, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 93 или 154, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 94 или 155, (nnn) вариабельной легкой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 96 или 156, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 97 или 157, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 98 или 158, (ooo) вариабельной тяжелой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 100, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 101, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 102, (ppp) вариабельной легкой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 104, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 105, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 106, (qqq) вариабельной тяжелой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 108, a CDR2, содержащую аминокислотную последовательность SEQ ID NO: 109, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 110, (rrr) вариабельной легкой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 112, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 113, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 114, (sss) вариабельной тяжелой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 116, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 117, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 118, (ttt) вариабельной легкой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 120, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 121, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 122, (uuu) вариабельной тяжелой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 124, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 125, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 126, (vvv) вариабельной легкой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 128, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 129, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 130, (www) вариабельной тяжелой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 132, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 133, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 134, (xxx) вариабельной легкой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 136, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 137, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 138, (yyy) вариабельной легкой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 6, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 7, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 67, (zzz) вариабельной легкой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 6, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 7, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 68, (aaaa) вариабельной легкой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 6, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 7, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 69, (bbbb) вариабельной легкой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 6, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 7, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 70, (cccc) вариабельной легкой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 6, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 7, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 71, (dddd) вариабельной легкой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 6, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 7, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 72, (eeee) вариабельной легкой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO:6, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 7, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 73, (ffff) вариабельной тяжелой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 2, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 3, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 4, и вариабельной легкой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 6, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 7, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 8, (gggg) вариабельной тяжелой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 2, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 3, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 4, и вариабельной легкой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 6, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 7, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 67, (hhhh) вариабельной тяжелой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 92 или 153, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 93 или 154, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 94 или 155, и вариабельной легкой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 96 или 156, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 97 или 157, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 98 или 158, (iiii) вариабельной тяжелой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 100, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 101, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 102, и вариабельной легкой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 104, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 105, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 106, (jjjj) вариабельной тяжелой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 108, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 109, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 110, и вариабельной легкой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 112, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 113, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 114, (kkkk) вариабельной тяжелой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 116, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 117, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 118, и вариабельной легкой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 120, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 121, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 122, (llll) вариабельной тяжелой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 124, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 125, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 126, и вариабельной легкой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 128, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 129, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 130, (mmmm) вариабельной тяжелой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 132, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 133, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 134, и вариабельной легкой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 136, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 137, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 138, (nnnn) вариабельной тяжелой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 2, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 3, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 4, и вариабельной легкой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 6, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 7, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 68, (oooo) вариабельной тяжелой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 2, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 3, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 4, и вариабельной легкой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 6, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 7, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 69, (pppp) вариабельной тяжелой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 2, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 3, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 4, и вариабельной легкой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 6, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 7, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 70, (qqqq) вариабельной тяжелой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 2, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 3, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 4, и вариабельной легкой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 6, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 7, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 71, (rrrr) вариабельной тяжелой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 2, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 3, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 4, и вариабельной легкой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 6, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 7, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 72, (ssss) вариабельной тяжелой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 2, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 3, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 4, и вариабельной легкой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 6, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 7, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 73, (tttt) вариабельной тяжелой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 10, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 11, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 12, и вариабельной легкой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 14, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 15, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 16, (uuuu) вариабельной тяжелой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 18, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 19, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 20, и вариабельной легкой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 22, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 23, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 24, (vvvv) вариабельной тяжелой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 26, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 27, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 28, и вариабельной легкой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 30, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 31, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 32, (wwww) вариабельной тяжелой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 34, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 35, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 36, и вариабельной легкой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 38, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 39, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 40, (xxxx) вариабельного домена тяжелой цепи, включающего CDR1, содержащую аминокислотную последовательность SEQ ID NO: 42, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 43, и CDR, содержащую аминокислотную последовательность SEQ ID NO: 44, и вариабельного домена легкой цепи, включающего CDR1, содержащую аминокислотную последовательность SEQ ID NO: 46, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 47, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 48; (yyyy) вариабельной тяжелой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 50, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 51, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 52, и вариабельной легкой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 54, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 55, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 56, (zzzz) вариабельной тяжелой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 58, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 59, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 60, и вариабельной легкой цепи, включающей CDR1, содержащую аминокислотную последовательность SEQ ID NO: 62, CDR2, содержащую аминокислотную последовательность SEQ ID NO: 63, и CDR3, содержащую аминокислотную последовательность SEQ ID NO: 64.
Выделенным антителом или его фрагментом могут быть человеческое антитело, молекула иммуноглобулина, связанный с дисульфидом Fv, моноклональное антитело, аффинно зрелое антитело, scFv, химерное антитело, однодоменное антитело, CDR-привитое антитело, диантитело, гуманизованное антитело, мультиспецифическое антитело, Fab, антитело с двойной специфичностью, DVD, Fab', биспецифическое антитело, F(ab')2 или Fv. Антитело или его фрагмент могут быть человеческими. Антитело или его фрагмент могут содержать константный домен тяжелой цепи иммуноглобулина, выбранный из группы, состоящей из константного домена человеческого IgM, константного домена человеческого IgG4, константного домена человеческого IgG1, константного домена человеческого IgE, константного домена человеческого IgG2, константного домена человеческого IgG3 или константного домена человеческого IgA. Константный домен человеческого IgG1 может содержать последовательность SEQ ID NO: 140 или состоять из этой последовательности.
Антитело или его фрагмент могут включать вариабельную область тяжелой цепи, содержащую последовательность, выбранную из группы, состоящей из SEQ ID NO: 1, SEQ ID NO: 9, SEQ ID NO: 17, SEQ ID NO: 25, SEQ ID NO: 33, SEQ ID NO: 41, SEQ ID NO: 49, SEQ ID NO: 57, SEQ ID NO: 91, SEQ ID NO: 99, SEQ ID NO: 107, SEQ ID NO: 115, SEQ ID NO: 123 и SEQ ID NO: 131.
Выделенное антитело или его фрагмент могут включать вариабельную область легкой цепи, содержащую последовательность, выбранную из группы, состоящей из SEQ ID NO: 5, SEQ ID NO: 13, SEQ ID NO: 21, SEQ ID NO: 29, SEQ ID NO: 37, SEQ ID NO: 45, SEQ ID NO: 53, SEQ ID NO: 61, SEQ ID NO: 95, SEQ ID NO: 103, SEQ ID NO: l1l, SEQ ID NO: 119, SEQ ID NO: 127 и SEQ ID NO: 135.
Выделенное антитело или его фрагмент могут включать вариабельный домен легкой цепи, содержащий остатки гипервариабельной области (CDR) последовательностей SEQ ID NO: 6, SEQ ID NO: 7 и SEQ ID NO: 8 или SEQ ID NO: 6, SEQ ID NO: 7 и SEQ ID NO: 67, SEQ ID NO: 6, SEQ ID NO: 7 и SEQ ID NO: 68 или SEQ ID NO: 6, SEQ ID NO: 7 и SEQ ID NO: 69 или SEQ ID NO: 6, SEQ ID NO: 7 и SEQ ID NO: 70 или SEQ ID NO: 6, SEQ ID NO: 7 и SEQ ID NO: 71 или SEQ ID NO: 6, SEQ ID NO: 7 и SEQ ID NO: 72 или SEQ ID NO: 6, SEQ ID NO: 7 и SEQ ID NO: 73 или SEQ ID NO: 14, SEQ ID NO: 15 и SEQ ID NO: 16 или SEQ ID NO: 22, SEQ ID NO: 23 и SEQ ID NO: 24 или SEQ ID NO: 30, SEQ ID NO: 31 и SEQ ID NO: 32 или SEQ ID NO: 38, SEQ ID NO: 39 и SEQ ID NO: 40 или SEQ ID NO: 54, SEQ ID NO: 55 и SEQ ID NO: 56 или SEQ ID NO: 62, SEQ ID NO: 63 и SEQ ID NO: 64 или SEQ ID NO: 46, SEQ ID NO: 47 и SEQ ID NO: 48, SEQ ID NO: 96, SEQ ID NO: 97 и SEQ ID NO: 98, SEQ ID NO: 104, SEQ ID NO: 105 и SEQ ID NO: 106, SEQ ID NO: 112, SEQ ID NO:113 и SEQ ID NO: 114, SEQ ID NO: 120, SEQ ID NO: 121 и SEQ ID NO: 122, SEQ ID NO: 128, SEQ ID NO: 129 и SEQ ID NO: 130, SEQ ID NO: 136, SEQ ID NO: 137, SEQ ID NO: 138, SEQ ID NO: 156 и SEQ ID NO: 157 и SEQ ID NO: 158.
Выделенное антитело или его фрагмент могут включать вариабельный домен тяжелой цепи, содержащий остатки гипервариабельной области (CDR) последовательностей SEQ ID NO: 2, SEQ ID NO: 3 и SEQ ID NO: 4 или SEQ ID NO: 10, SEQ ID NO: 11 и SEQ ID NO: 12 или SEQ ID NO: 18, SEQ ID NO: 19 и SEQ ID NO: 20 или SEQ ID NO: 26, SEQ ID NO: 27 и SEQ ID NO: 28 или SEQ ID NO: 34, SEQ ID NO: 35 и SEQ ID NO: 36 или SEQ ID NO: 50, SEQ ID NO: 51 и SEQ ID NO: 52 или SEQ ID NO: 58, SEQ ID NO: 59 и SEQ ID NO: 60, SEQ ID NO: 42, SEQ ID NO: 43 и SEQ ID NO: 44, SEQ ID NO: 92, SEQ ID NO: 93 и SEQ ID NO: 94, SEQ ID NO: 100, SEQ ID NO: 101 и SEQ ID NO: 102, SEQ ID NO: 108, SEQ ID NO: 109 и SEQ ID NO: 110, SEQ ID NO: 116, SEQ ID NO: 117 и SEQ ID NO: 118, SEQ ID NO: 124, SEQ ID NO: 125 и SEQ ID NO: 126, SEQ ID NO: 132, SEQ ID NO: 133, SEQ ID NO: 134, SEQ ID NO: 153, SEQ ID NO: 154 и SEQ ID NO: 155.
Выделенное антитело или его фрагмент могут включать вариабельный домен тяжелой цепи, содержащий остатки гипервариабельной области (CDR) последовательностей SEQ ID NO: 2, SEQ ID NO: 3 и SEQ ID NO: 4, и вариабельный домен легкой цепи, содержащий остатки гипервариабельной области (CDR) последовательностей SEQ ID NO: 6, SEQ ID NO: 7 и SEQ ID NO: 8.
Выделенное антитело или его фрагмент могут включать вариабельный домен тяжелой цепи, содержащий остатки гипервариабельной области (CDR) последовательностей SEQ ID NO: 10, SEQ ID NO: 11 и SEQ ID NO: 12, и вариабельный домен легкой цепи, содержащий остатки гипервариабельной области (CDR) последовательностей SEQ ID NO: 14, SEQ ID NO: 15 и SEQ ID NO: 16.
Выделенное антитело или его фрагмент могут включать вариабельный домен тяжелой цепи, содержащий остатки гипервариабельной области (CDR) последовательностей SEQ ID NO: 18, SEQ ID NO: 19 и SEQ ID NO: 20, и вариабельный домен легкой цепи, содержащий остатки гипервариабельной области (CDR) последовательностей SEQ ID NO: 22, SEQ ID NO: 23 и SEQ ID NO: 24.
Выделенное антитело или его фрагмент могут включать вариабельный домен тяжелой цепи, содержащий остатки гипервариабельной области (CDR) последовательностей SEQ ID NO: 26, SEQ ID NO: 27 и SEQ ID NO: 28, и вариабельный домен легкой цепи, содержащий остатки гипервариабельной области (CDR) последовательностей SEQ ID NO: 30, SEQ ID NO: 31 и SEQ ID NO: 32.
Выделенное антитело или его фрагмент могут включать вариабельный домен тяжелой цепи, содержащий остатки гипервариабельной области (CDR) последовательностей SEQ ID NO: 34, SEQ ID NO: 35 и SEQ ID NO: 36, и вариабельный домен легкой цепи, содержащий остатки гипервариабельной области (CDR) последовательностей SEQ ID NO: 38, SEQ ID NO: 39 и SEQ ID NO: 40.
Выделенное антитело или его фрагмент могут включать вариабельный домен тяжелой цепи, содержащий остатки гипервариабельной области (CDR) последовательностей SEQ ID NO: 50, SEQ ID NO: 51 и SEQ ID NO: 52, и вариабельный домен легкой цепи, содержащий остатки гипервариабельной области (CDR) последовательностей SEQ ID NO: 54, SEQ ID NO: 55 и SEQ ID NO: 56.
Выделенное антитело или его фрагмент могут включать вариабельный домен тяжелой цепи, содержащий остатки гипервариабельной области (CDR) последовательностей SEQ ID NO: 58, SEQ ID NO: 59 и SEQ ID NO: 60, и вариабельный домен легкой цепи, содержащий остатки гипервариабельной области (CDR) последовательностей SEQ ID NO: 62, SEQ ID NO: 63 и SEQ ID NO: 64.
Выделенное антитело или его фрагмент могут включать вариабельный домен тяжелой цепи, содержащий остатки гипервариабельной области (CDR) последовательностей SEQ ID NO: 42, SEQ ID NO: 43 и SEQ ID NO: 44, и вариабельный домен легкой цепи, содержащий остатки гипервариабельной области (CDR) последовательностей SEQ ID NO: 46, SEQ ID NO: 47 и SEQ ID NO: 48.
Выделенное антитело или его фрагмент могут включать вариабельный домен тяжелой цепи, содержащий остатки гипервариабельной области (CDR) последовательностей SEQ ID NO: 92 или 153, SEQ ID NO: 93 или 154 и SEQ ID NO: 94 или 155, и вариабельный домен легкой цепи, содержащий остатки гипервариабельной области (CDR) последовательностей SEQ ID NO: 96 или 156, SEQ ID NO: 97 или 157 и SEQ ID NO: 98 или 158.
Выделенное антитело или его фрагмент могут включать вариабельный домен тяжелой цепи, содержащий остатки гипервариабельной области (CDR) последовательностей SEQ ID NO: 100, SEQ ID NO: 101 и SEQ ID NO: 102, и вариабельный домен легкой цепи, содержащий остатки гипервариабельной области (CDR) последовательностей SEQ ID NO: 104, SEQ ID NO: 105 и SEQ ID NO: 106.
Выделенное антитело или его фрагмент могут включать вариабельный домен тяжелой цепи, содержащий остатки гипервариабельной области (CDR) последовательностей SEQ ID NO: 108, SEQ ID NO: 109 и SEQ ID NO: 110, и вариабельный домен легкой цепи, содержащий остатки гипервариабельной области (CDR) последовательностей (CDR) SEQ ID NO: 112, SEQ ID NO: 113 и SEQ ID NO: 114.
Выделенное антитело или его фрагмент могут включать вариабельный домен тяжелой цепи, содержащий остатки гипервариабельной области (CDR) последовательностей SEQ ID NO: 116, SEQ ID NO: 117 и SEQ ID NO: 118, и вариабельный домен легкой цепи, содержащий остатки гипервариабельной области (CDR) последовательностей SEQ ID NO: 120, SEQ ID NO: 121 и SEQ ID NO: 122.
Выделенное антитело или его фрагмент могут включать вариабельный домен тяжелой цепи, содержащий остатки гипервариабельной области (CDR) последовательностей SEQ ID NO: 124, SEQ ID NO: 125 и SEQ ID NO: 126, и вариабельный домен легкой цепи, содержащий остатки гипервариабельной области (CDR) последовательностей SEQ ID NO: 128, SEQ ID NO: 129 и SEQ ID NO: 130.
Выделенное антитело или его фрагмент могут включать вариабельный домен тяжелой цепи, содержащий остатки гипервариабельной области (CDR) последовательностей SEQ ID NO: 132, SEQ ID NO: 133 и SEQ ID NO: 134, и вариабельный домен егкой цепи, содержащий остатки гипервариабельной области (CDR) последовательностей SEQ ID NO: 136, SEQ ID NO: 137 и SEQ ID NO: 138.
Выделенное антитело или его фрагмент могут включать агент, выбранные из группы, состоящей из иммуноадгезивной молекулы, визуализирующего агента и терапевтического агента. Визуализирующим агентом может быть радиоактивная метка, фермент, флуоресцентная метка, люминесцентная метка, биолюминесцентная метка, магнитная метка или биотин. Радиоактивной меткой может быть3H,14C,35S,90Y,99Tc,111In,125I,131I,177Lu,166Ho или153Sm.
В другом своем аспекте, настоящее изобретение относится к антителу или к его фрагменту, которые связываются с эпитопом RGMa PCKILKCNSEFWSATSGSHAPAS (hRGMa 47-69) (SEQ ID NO: 79). Антитело, которое связывается с эпитопом RGMa PCKILKCNSEFWSATSGSHAPAS (hRGMa 47-69) (SEQ ID NO: 79), может включать вариабельный домен тяжелой цепи, содержащий остатки гипервариабельной области (CDR) SEQ ID NO: 2, SEQ ID NO: 3 и SEQ ID NO: 4, и вариабельный домен легкой цепи, содержащий остатки гипервариабельной области (CDR) SEQ ID NO: 6, SEQ ID NO: 7 и SEQ ID NO: 8.
В другом своем аспекте, настоящее изобретение относится к антителу или к его фрагменту, которые связываются с молекулой отталкивающего направляющего сигнала («RGMa»). Антитело или его фрагмент включают вариабельный домен тяжелой цепи, содержащий три гипервариабельных области (CDR-H1, H2 и H3), имеющие следующие формулы, соответственно:
Xaa1 - Xaa2 - Xaa3 - Xaa4 - Xaa5 (формула 1-CDR-H1), где Xaa1 представляет собой аминокислоту, выбранную из группы, состоящей из S, D, E, N, G и T; Xaa2 представляет собой аминокислоту, выбранную из группы, состоящей из H, Y, L, S и Q; Xaa3 представляет собой аминокислоту, выбранную из группы, состоящей из G, D, A, T и Y; Xaa4 представляет собой аминокислоту, выбранную из группы, состоящей из I, M и W; и Xaa5 представляет собой аминокислоту, выбранную из группы, состоящей из S, N, H, A, T и Q;
Xaa1 - Xaa2 - Xaa3 - Xaa4 - Xaa5 - Xaa6 - Xaa7 - Xaa8 - Xaa9 - Xaa10 - Xaa11 - Xaa12 - Xaa13 - Xaa14 - Xaa15 - Xaa16 - (Xaa)n (формула 2-CDR-H2), где n равно 0 или 1 и где Xaa1 представляет собой аминокислоту, выбранную из группы, состоящей из W, V, A, G, L, E, S и N; Xaa2 представляет собой аминокислоту, выбранную из группы, состоящей из I, M и F; Xaa3 представляет собой аминокислоту, выбранную из группы, состоящей из S, N, D, F и Y; Xaa4 представляет собой аминокислоту, выбранную из группы, состоящей из P, Y, G, W, H, A и S; Xaa5 представляет собой аминокислоту, выбранную из группы, состоящей из Y, N, D, E, S, K, G и T; Xaa6 представляет собой аминокислоту, выбранную из группы, состоящей из S, G, D, T и N; Xaa7 представляет собой аминокислоту, выбранную из группы, состоящей из G, S, I, E, N и R; Xaa8 представляет собой аминокислоту, выбранную из группы, состоящей из N, L, R, S, T и Y; Xaa9 представляет собой аминокислоту, выбранную из группы, состоящей из T, K, G, N, I и Y; Xaa10 представляет собой аминокислоту, выбранную из группы, состоящей из N, G, Y, T и K; Xaa11 представляет собой аминокислоту, выбранную из группы, состоящей из Y, F, N и H; Xaa12 представляет собой аминокислоту, выбранную из группы, состоящей из A, T, V, P, L и S; Xaa13 представляет собой аминокислоту, выбранную из группы, состоящей из Q, D, P и S; Xaa14 представляет собой аминокислоту, выбранную из группы, состоящей из K, S, N и L; Xaa15 представляет собой аминокислоту, выбранную из группы, состоящей из L, F, V, K и R; Xaa16 представляет собой аминокислоту, выбранную из группы, состоящей из Q, K, R и S; и Xaa17 представляет собой глицин; и
Xaa1 - Xaa2 - Xaa3 - Xaa4 - Xaa5 - Xaa6 - (Xaa)n (формула 3-CDR-H3), где n равно 0-11 и где Xaa1 представляет собой аминокислоту, выбранную из группы, состоящей из V, S, E, N, L, D, Q и A; Xaa2 представляет собой аминокислоту, выбранную из группы, состоящей из G, T, R, Y, L, I, D и S; Xaa3 представляет собой аминокислоту, выбранную из группы, состоящей из S, V, D, G, F, Y, P, M, C, L и A; Xaa4 представляет собой аминокислоту, выбранную из группы, состоящей из G, L, Y, N, E, K, A и F; Xaa5 представляет собой аминокислоту, выбранную из группы, состоящей из P, S, Y, A, V, G, T, E и W; Xaa6 представляет собой аминокислоту, выбранную из группы, состоящей из Y, V, S, L, D, G, H и P; Xaa7 представляет собой аминокислоту, выбранную из группы, состоящей из Tyr, Asp, Gly, Ser, Phe, Leu и Cys; Xaa8 представляет собой аминокислоту, выбранную из группы, состоящей из Tyr, Lys, Asp, Ala и Gln; Xaa9 представляет собой аминокислоту, выбранную из группы, состоящей из Met, Glu, Phe, Leu, Ser, Thr, Pro и Tyr; Xaa10 представляет собой аминокислоту, выбранную из группы, состоящей из Asp, Gly, Tyr, Ser, Leu, His и Phe; Xaa11 представляет собой аминокислоту, выбранную из группы, состоящей из Val, Tyr, Leu, His, Gly, Trp и Asp; Xaa12 представляет собой аминокислоту, выбранную из группы, состоящей из Tyr и Phe; Xaa13 представляет собой аминокислоту, выбранную из группы, состоящей из Tyr, Gly и Asp; Xaa14 представляет собой аминокислоту, выбранную из группы, состоящей из Ala, Leu, Pro и Tyr; Xaa15 представляет собой аминокислоту, выбранную из группы, состоящей из Met, Leu и Phe; Xaa16 представляет собой аминокислоту, выбранную из группы, состоящей из Asp и Gly; и Xaa17 представляет собой аминокислоту, выбранную из группы, состоящей из Val, Asp и Tyr.
В другом своем аспекте, настоящее изобретение относится к выделенному антителу или к его фрагменту, которые связываются с молекулой отталкивающего направляющего сигнала («RGMa»). Антитело или его фрагмент включают вариабельный домен легкой цепи, содержащий три гипервариабельных области (CDR-L1, L2 и L3), имеющие следующие формулы, соответственно:
Xaa1 - Xaa2 - Xaa3 - Xaa4 - Xaa5 - Xaa6 - Xaa7 - Xaa8 - Xaa9 - Xaa10 - Xaa11 - (Xaa)n (формула 1-CDR-L1), где n равно 0-3 и где Xaa1 представляет собой аминокислоту, выбранную из группы, состоящей из T, S, R, G и Q; Xaa2 представляет собой аминокислоту, выбранную из группы, состоящей из G, L и A; Xaa3 представляет собой аминокислоту, выбранную из группы, состоящей из T, D, S, N и A; Xaa4 представляет собой аминокислоту, выбранную из группы, состоящей из S, K, G, Q, N и E; Xaa5 представляет собой аминокислоту, выбранную из группы, состоящей из S, L, G, I, D и P; Xaa6 представляет собой аминокислоту, выбранную из группы, состоящей из S, G, N, H и I; Xaa7 представляет собой аминокислоту, выбранную из группы, состоящей из V, D, I, S, G и H; Xaa8 представляет собой аминокислоту, выбранную из группы, состоящей из G, K, A, S, I, N, T и D; Xaa9 представляет собой аминокислоту, выбранную из группы, состоящей из D, Y, A, C, S и F; Xaa10 представляет собой аминокислоту, выбранную из группы, состоящей из S, A, G, L, V и N; Xaa11 представляет собой аминокислоту, выбранную из группы, состоящей из I, C, Y, H, R, N и S; Xaa12 представляет собой аминокислоту, выбранную из группы, состоящей из Tyr, Gly, Ala и Val; Xaa13 представляет собой аминокислоту, выбранную из группы, состоящей из Val и Asn; и Xaa14 представляет собой аминокислоту, выбранную из группы, состоящей из Ser и His;
Xaa1 - Xaa2 - Xaa3 - Xaa4 - Xaa5 - Xaa6 - Xaa7 - (Xaa)n (формула 2-CDR-L2), где n равно 0-4 и где Xaa1 представляет собой аминокислоту, выбранную из группы, состоящей из D, Q, G, V, Y, S и E; Xaa2 представляет собой аминокислоту, выбранную из группы, состоящей из V, D, N и A; Xaa3 представляет собой аминокислоту, выбранную из группы, состоящей из T, S, Y, N и K; Xaa4 представляет собой аминокислоту, выбранную из группы, состоящей из K, N, D, Q и T; Xaa5 представляет собой аминокислоту, выбранную из группы, состоящей из R, G, S и L; Xaa6 представляет собой аминокислоту, выбранную из группы, состоящей из P, S, I и E; Xaa7 представляет собой аминокислоту, выбранную из группы, состоящей из S, H, I и T; Xaa8 представляет собой Asn; Xaa9 представляет собой Lys; и Xaa10 представляет собой Gly; Xaa11 представляет собой Asp; и
Xaa1 - Xaa2 - Xaa3 - Xaa4 - Xaa5 - Xaa6 - Xaa7 - Xaa8 - Xaa9 - (Xaa)n (формула 3-CDR-L3), где n равно 0-2 и где Xaa1 представляет собой аминокислоту, выбранную из группы, состоящей из C, Q, H, F, H, L, V, I, K, Y и A; Xaa2 представляет собой аминокислоту, выбранную из группы, состоящей из S, A, T, Q и V; Xaa3 представляет собой аминокислоту, выбранную из группы, состоящей из Y, W и S; Xaa4 представляет собой аминокислоту, выбранную из группы, состоящей из A, D, G, S, H и Y; Xaa5 представляет собой аминокислоту, выбранную из группы, состоящей из G, S, N, P, D, V и T; Xaa6 представляет собой аминокислоту, выбранную из группы, состоящей из I, T, S, G, L, F и Y; Xaa7 представляет собой аминокислоту, выбранную из группы, состоящей из D, T, L, I, P и S; Xaa8 представляет собой аминокислоту, выбранную из группы, состоящей из T, G, R, Y, D, N, W, L, F и P; Xaa9 представляет собой аминокислоту, выбранную из группы, состоящей из L, V, G, T и H; Xaa10 представляет собой аминокислоту, выбранную из группы, состоящей из Val, Tyr и His; Xaa11 представляет собой Leu или Val.
В другом своем аспекте, настоящее изобретение относится к выделенному антителу или к его фрагменту, которые связываются с молекулой отталкивающего направляющего сигнала («RGMa»), где указанное антитело или его фрагмент включают вариабельный домен тяжелой цепи, содержащий три гипервариабельных области (CDR-H1, H2 и H3), имеющие следующие формулы, соответственно:
Xaa1 - Xaa2 - Xaa3 - Xaa4 - Xaa5 (формула 1-CDR-H1), где Xaa1 представляет собой аминокислоту, выбранную из группы, состоящей из S, D, E, N, G и T; Xaa2 представляет собой аминокислоту, выбранную из группы, состоящей из H, Y, L, S и Q; Xaa3 представляет собой аминокислоту, выбранную из группы, состоящей из G, D, A, T и Y; Xaa4 представляет собой аминокислоту, выбранную из группы, состоящей из I, M и W; и Xaa5 представляет собой аминокислоту, выбранную из группы, состоящей из S, N, H, A, T и Q;
Xaa1 - Xaa2 - Xaa3 - Xaa4 - Xaa5 - Xaa6 - Xaa7 - Xaa8 - Xaa9 - Xaa10 - Xaa11 - Xaa12 - Xaa13 - Xaa14 - Xaa15 - Xaa16 - (Xaa)n (формула 2-CDR-H2), где n равно 0 или 1 и
где Xaa1 представляет собой аминокислоту, выбранную из группы, состоящей из Y, V, A, G, L, G, S и N; Xaa2 представляет собой аминокислоту, выбранную из группы, состоящей из I, M и F; Xaa3 представляет собой аминокислоту, выбранную из группы, состоящей из S, N, D, F и Y; Xaa4 представляет собой аминокислоту, выбранную из группы, состоящей из P, Y, G, W, H, A и S; Xaa5 представляет собой аминокислоту, выбранную из группы, состоящей из Y, N, D, E, S, K, G и T; Xaa6 представляет собой аминокислоту, выбранную из группы, состоящей из S, G, D, T и N; Xaa7 представляет собой аминокислоту, выбранную из группы, состоящей из G, S, I, E, N и R; Xaa8 представляет собой аминокислоту, выбранную из группы, состоящей из N, L, R, S, T и Y; Xaa9 представляет собой аминокислоту, выбранную из группы, состоящей из T, K, G, N, I и Y; Xaa10 представляет собой аминокислоту, выбранную из группы, состоящей из N, G, Y, T и K; Xaa11 представляет собой аминокислоту, выбранную из группы, состоящей из Y, F, N и H; Xaa12 представляет собой аминокислоту, выбранную из группы, состоящей из A, T, V, P, L и S; Xaa13 представляет собой аминокислоту, выбранную из группы, состоящей из Q, D, P и S; Xaa14 представляет собой аминокислоту, выбранную из группы, состоящей из K, S, N и L; Xaa15 представляет собой аминокислоту, выбранную из группы, состоящей из L, F, V, K и R; Xaa16 представляет собой аминокислоту, выбранную из группы, состоящей из Q, K, R и S; и Xaa17 представляет собой глицин; и
Xaa1 - Xaa2 - Xaa3 - Xaa4 - Xaa5 - Xaa6 - (Xaa)n (формула 3-CDR-H3), где n равно 0-11 и
где Xaa1 представляет собой аминокислоту, выбранную из группы, состоящей из V, S, E, N, L, D, Q и A; Xaa2 представляет собой аминокислоту, выбранную из группы, состоящей из G, T, R, Y, L, I, D и S; Xaa3 представляет собой аминокислоту, выбранную из группы, состоящей из S, V, D, G, F, Y, P, M, C, L и A; Xaa4 представляет собой аминокислоту, выбранную из группы, состоящей из G, L, Y, N, E, K, A и F; Xaa5 представляет собой аминокислоту, выбранную из группы, состоящей из P, S, Y, A, V, G, T, E и W; Xaa6 представляет собой аминокислоту, выбранную из группы, состоящей из Y, V, S, L, D, G, H и P; Xaa7 представляет собой аминокислоту, выбранную из группы, состоящей из Tyr, Asp, Gly, Ser, Phe, Leu и Cys; Xaa8 представляет собой аминокислоту, выбранную из группы, состоящей из Tyr, Lys, Asp, Ala и Gln; Xaa9 представляет собой аминокислоту, выбранную из группы, состоящей из Met, Glu, Phe, Leu, Ser, Thr, Pro и Tyr; Xaa10 представляет собой аминокислоту, выбранную из группы, состоящей из Asp, Gly, Tyr, Ser, Leu, His и Phe; Xaa11 представляет собой аминокислоту, выбранную из группы, состоящей из Val, Tyr, Leu, His, Gly, Trp и Asp; Xaa12 представляет собой аминокислоту, выбранную из группы, состоящей из Tyr и Phe; Xaa13 представляет собой аминокислоту, выбранную из группы, состоящей из Tyr, Gly и Asp; Xaa14 представляет собой аминокислоту, выбранную из группы, состоящей из Ala, Leu, Pro и Tyr; Xaa15 представляет собой аминокислоту, выбранную из группы, состоящей из Met, Leu и Phe; Xaa16 представляет собой аминокислоту, выбранную из группы, состоящей из Asp и Gly; и Xaa17 представляет собой аминокислоту, выбранную из группы, состоящей из Val, Asp и Tyr; и
где указанное антитело или его фрагмент включают вариабельный домен легкой цепи, содержащий три гипервариабельных области (CDR-L1, L2 и L3), имеющие следующие формулы, соответственно:
Xaa1 - Xaa2 - Xaa3 - Xaa4 - Xaa5 - Xaa6 - Xaa7 - Xaa8 - Xaa9 - Xaa10 - Xaa11 - (Xaa)n (формула 1-CDR-L1), где n равно 0-3 и
где Xaa1 представляет собой аминокислоту, выбранную из группы, состоящей из T, S, R, G и Q; Xaa2 представляет собой аминокислоту, выбранную из группы, состоящей из G, L и A; Xaa3 представляет собой аминокислоту, выбранную из группы, состоящей из T, D, S, N и A; Xaa4 представляет собой аминокислоту, выбранную из группы, состоящей из S, K, G, Q, N и E; Xaa5 представляет собой аминокислоту, выбранную из группы, состоящей из S, L, G, I, D и P; Xaa6 представляет собой аминокислоту, выбранную из группы, состоящей из S, G, N, H и I; Xaa7 представляет собой аминокислоту, выбранную из группы, состоящей из V, D, I, S, G и H; Xaa8 представляет собой аминокислоту, выбранную из группы, состоящей из G, K, A, S, I, N, T и D; Xaa9 представляет собой аминокислоту, выбранную из группы, состоящей из D, Y, A, C, S и F; Xaa10 представляет собой аминокислоту, выбранную из группы, состоящей из S, A, G, L, V и N; Xaa11 представляет собой аминокислоту, выбранную из группы, состоящей из I, C, Y, H, R, N и S; Xaa12 представляет собой аминокислоту, выбранную из группы, состоящей из Tyr, Gly, Ala и Val; Xaa13 представляет собой аминокислоту, выбранную из группы, состоящей из Val и Asn; и Xaa14 представляет собой аминокислоту, выбранную из группы, состоящей из Ser и His;
Xaa1 - Xaa2 - Xaa3 - Xaa4 - Xaa5 - Xaa6 - Xaa7 - (Xaa)n (формула 2-CDR-L2), где n равно 0-4 и где Xaa1 представляет собой аминокислоту, выбранную из группы, состоящей из D, Q, G, V, Y, S и E; Xaa2 представляет собой аминокислоту, выбранную из группы, состоящей из V, D, N и A; Xaa3 представляет собой аминокислоту, выбранную из группы, состоящей из T, S, Y, N и K; Xaa4 представляет собой аминокислоту, выбранную из группы, состоящей из K, N, D, Q и T; Xaa5 представляет собой аминокислоту, выбранную из группы, состоящей из R, G, S и L; Xaa6 представляет собой аминокислоту, выбранную из группы, состоящей из P, S, I и E; Xaa7 представляет собой аминокислоту, выбранную из группы, состоящей из S, H, I и T; Xaa8 представляет собой Asn; Xaa9 представляет собой Lys; Xaa10 представляет собой Gly; Xaa11 представляет собой Asp; и
Xaa1 - Xaa2 - Xaa3 - Xaa4 - Xaa5 - Xaa6 - Xaa7 - Xaa8 - Xaa9 - (Xaa)n (формула 3-CDR-L3), где n равно 0-2 и
где Xaa1 представляет собой аминокислоту, выбранную из группы, состоящей из C, Q, H, F, H, L, V, I, K, Y и A; Xaa2 представляет собой аминокислоту, выбранную из группы, состоящей из S, A, T, Q и V; Xaa3 представляет собой аминокислоту, выбранную из группы, состоящей из Y, W и S; Xaa4 представляет собой аминокислоту, выбранную из группы, состоящей из A, D, G, S, H и Y; Xaa5 представляет собой аминокислоту, выбранную из группы, состоящей из G, S, N, P, D, V и T; Xaa6 представляет собой аминокислоту, выбранную из группы, состоящей из I, T, S, G, L, F и Y; Xaa7 представляет собой аминокислоту, выбранную из группы, состоящей из D, T, L, I, P и S; Xaa8 представляет собой аминокислоту, выбранную из группы, состоящей из T, G, R, Y, D, N, W, L, F и P; Xaa9 представляет собой аминокислоту, выбранную из группы, состоящей из L, V, G, T и H; Xaa10 представляет собой аминокислоту, выбранную из группы, состоящей из Val, Tyr и His; Xaa11 представляет собой Leu или Val.
В другом своем аспекте настоящее изобретение относится к фармацевтической композиции, которая включает описанное здесь антитело, фрагмент антитела или их смесь, или производное.
В другом своем аспекте настоящее изобретение относится к способу лечения, предупреждения, модуляции или ослабления тяжести заболевания или расстройства, ассоциированного с дегенерацией нейритов, где указанный способ включает введение индивидууму, нуждающемуся в этом, терапевтически эффективного количества описанного здесь антитела. Расстройствами, ассоциированными с дегенерацией нейритов, могут быть рассеянный склероз; болезнь Паркинсона; болезнь Альцгеймера; болезнь Гентингтона; амиотрофический боковой склероз и другие заболевания двигательных нейронов; болезнь Тау-Сакса; болезнь Ньюмана-Пика; болезнь Гуше; синдром Гурлера; идиопатические воспалительные демиелинизирующие заболевания; заболевание, вызываемое дефицитом витамина B12; заболевание, ассоциированное с лизисом миелина центрального моста; сухотка спинного мозга; поперечный миелит; болезнь Девика; прогрессирующая мультифокальная лейкоэнцефалопатия; неврит зрительного нерва; травматическое повреждение ЦНС; ишемический инсульт головного мозга; ретинопатия, такая как глаукома, диабетическая ретинопатия или возрастная дегенерация желтого пятна; и лейкодистрофия.
В другом своем аспекте настоящее изобретение относится к способу диагностики у индивидуума расстройства, ассоциированного с дегенерацией нейритов. Указанный способ может включать определение уровня RGMa в образце, взятом у указанного индивидуума и сравнение уровня RGMa в данном образце с уровнем RGMa в контрольном образце. Изменение уровня RGMa указывает на наличие у индивидуума расстройства, ассоциированного с дегенерацией нейритов. Повышенный уровень RGMa, по сравнению с уровнем RGMa в контрольном образце, указывает на наличие у индивидуума расстройства, ассоциированного с дегенерацией нейритов. Образцом может быть проба крови или проба сыворотки или проба цереброспинальной жидкости. Стадия определения уровня RGMa в образце может быть проведена с помощью иммуноанализа. Таким иммуноанализом может быть твердофазный иммуноферментный анализ (ELISA). ELISA может представлять собой «сэндвич»-ELISA.
В другом своем аспекте настоящее изобретение относится к выделенному антителу или к его фрагменту, содержащим последовательности SEQ ID NO: 1-7 и 67.
В другом своем аспекте настоящее изобретение относится к выделенному антителу или к его фрагменту, содержащим последовательности SEQ ID NO: 1-7 и 68.
В другом своем аспекте настоящее изобретение относится к выделенному антителу или к его фрагменту, содержащим последовательности SEQ ID NO: 1-7 и 69.
В другом своем аспекте настоящее изобретение относится к выделенному антителу или к его фрагменту, содержащим последовательности SEQ ID NO: 1-7 и 70.
В другом своем аспекте настоящее изобретение относится к выделенному антителу или к его фрагменту, содержащим последовательности SEQ ID NO: 1-7 и 71.
В другом своем аспекте настоящее изобретение относится к выделенному антителу или к его фрагменту, содержащим последовательности SEQ ID NO: 1-7 и 72.
В другом своем аспекте настоящее изобретение относится к выделенному антителу или к его фрагменту, содержащим последовательности SEQ ID NO: 1-7 и 73.
В другом своем аспекте настоящее изобретение относится к выделенному моноклональному антителу или к его фрагменту, содержащим последовательности SEQ ID NO: 1-7 и 67, 68, 69, 70, 71, 72 или 73, которые связываются с эпитопом RGMa PCKILKCNSEFWSATSGSHAPAS (hRGMa 47-69) (SEQ ID NO: 79).
Краткое описание графического материала
На фигуре 1 представлены результаты анализа на разрастание нейритов, проводимого с использованием 50 мкг/мл фрагмента hRGMa. Этот фрагмент включает N-концевые аминокислоты 47-127 SEQ ID NO:65 (см. SEQ ID NO: 139) и содержит высокоаффинные домены взаимодействия с неогенином и остеогенным белком.
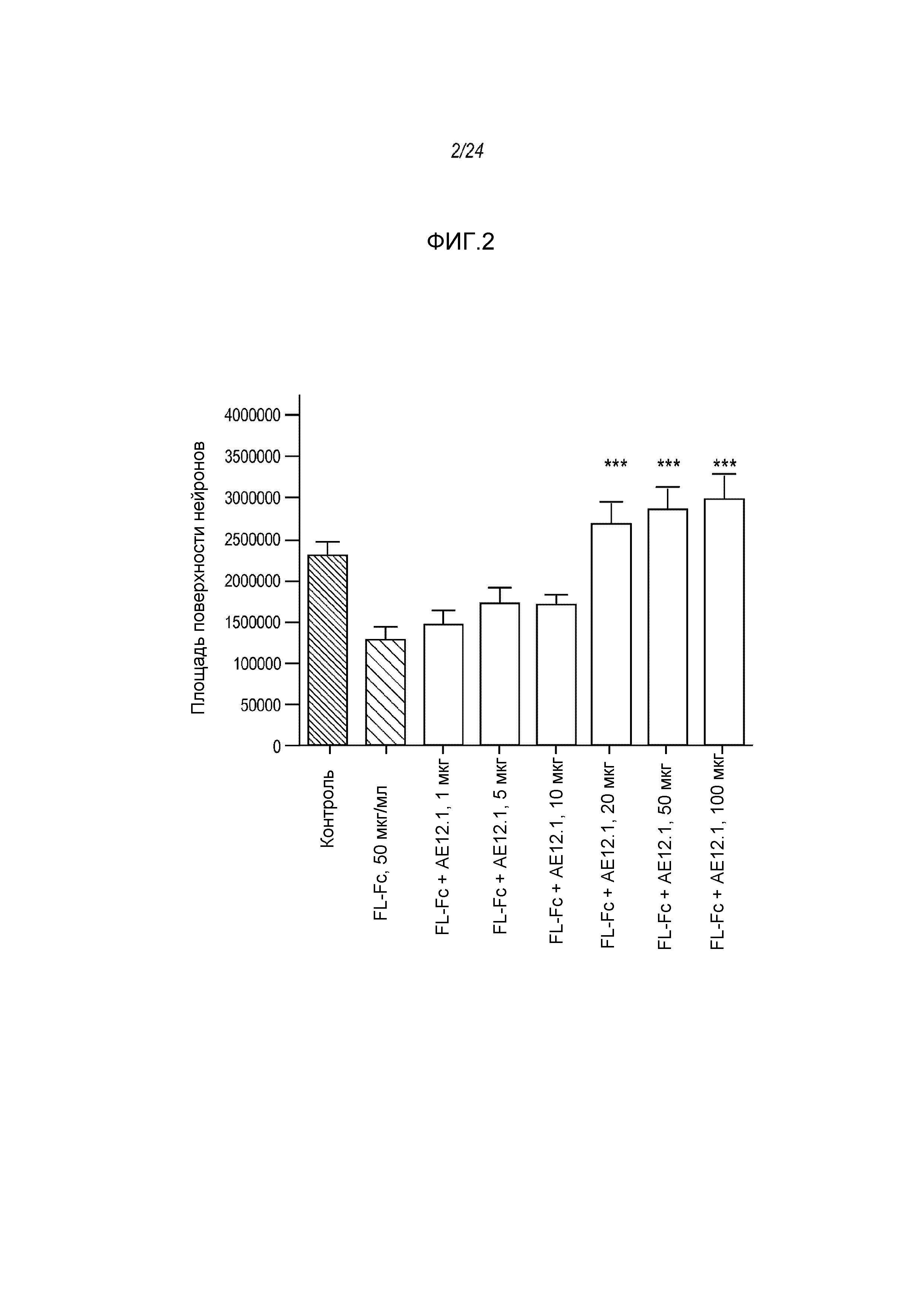
На фигуре 2 представлены результаты анализа на разрастание нейритов, проводимого с использованием 50 мкг/мл полноразмерной молекулы hRGMa.
На фигуре 3 представлены гистограммы, где указаны уровни регенеративного роста in vivo аксонов ганглиозных клеток сетчатки возле участка поражения (0-500 мкм) в присутствии антитела AE12-1.
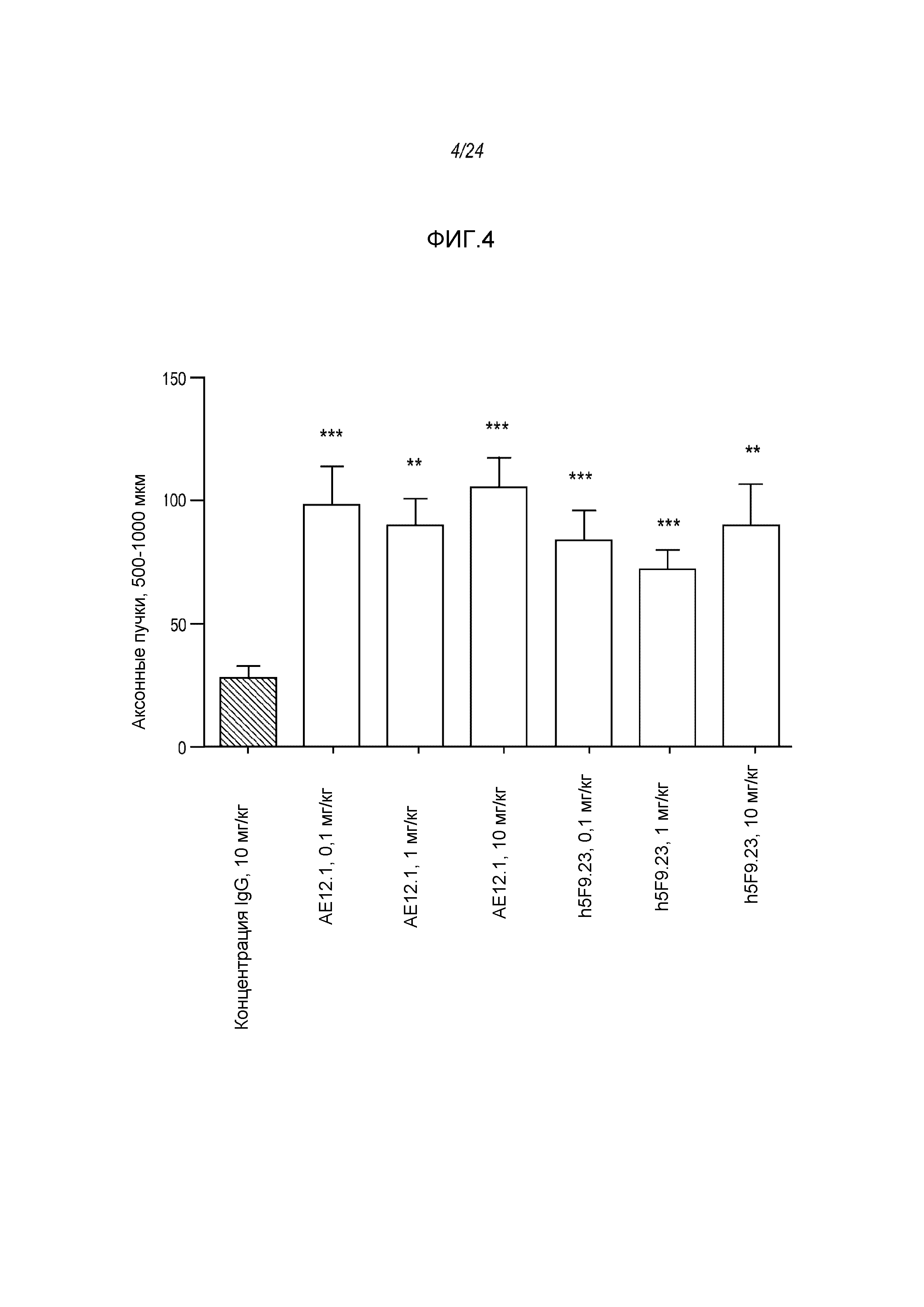
На фигуре 4 представлены гистограммы, где указаны уровни регенеративного роста in vivo аксонов ганглиозных клеток сетчатки (500-1000 мкм) в присутствии антитела AE12-1 непосредственно по сравнению с уровнями в присутствии человеческого антитела 5F9.23.
На фигуре 5 представлены МС-спектры, полученные от восстановленной фракции E1 молекулы hRGMa E. coli, связанной с mAb AE12-1 и гидролизованной трипсином/Asp-N, где указанные спектры были получены для двух пептидов с зарядами +3 и +4 (указаны в рамке), соответствующих последовательностям (SEQ ID NO: 74 и 80, соответственно, в таком же порядке, как указано на рисунке), показанным на спектрах. Пики, отмеченные *, представляют собой пептиды, которые не были отнесены к антигену hRGMa и могут быть родственными антителу.
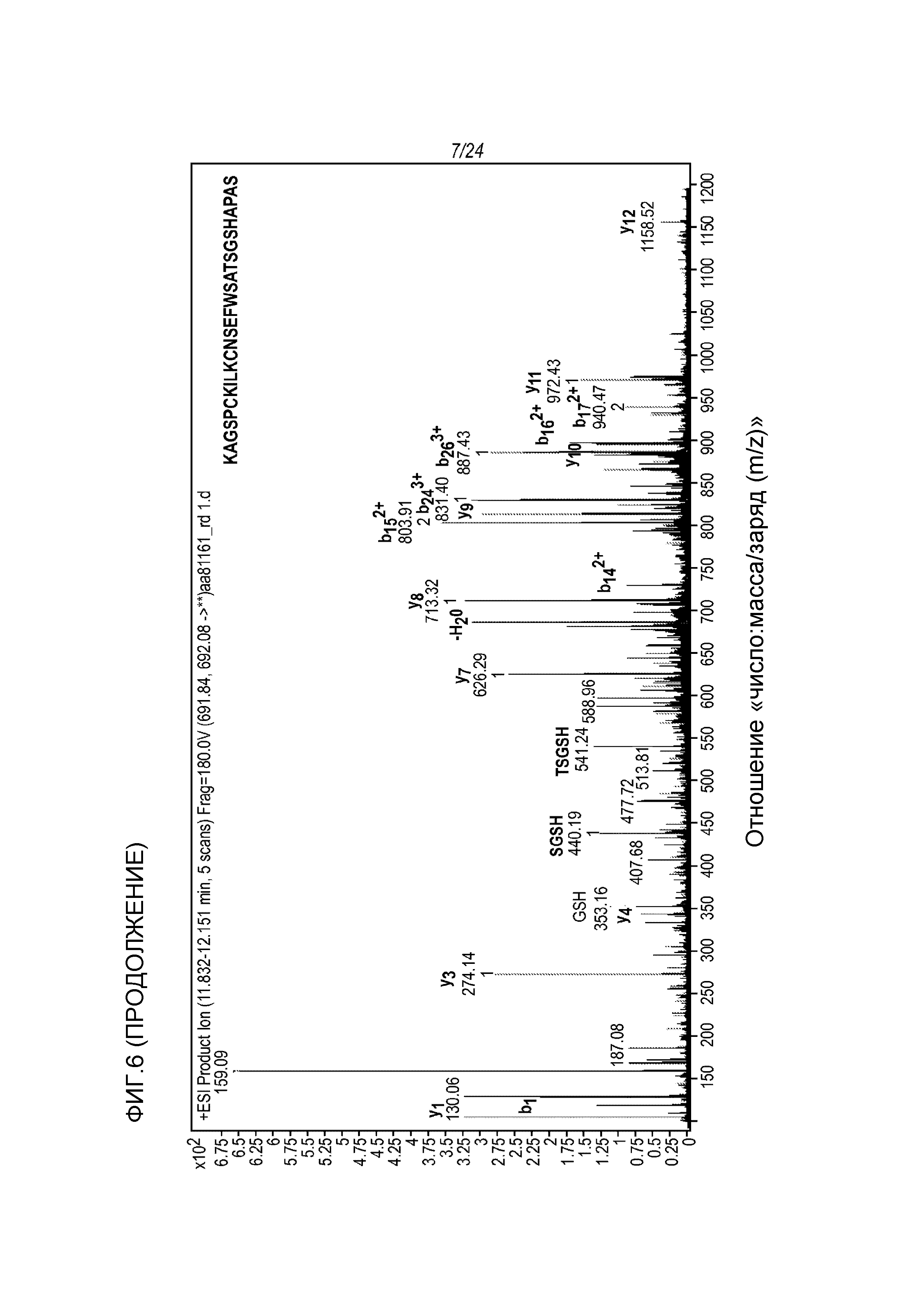
На фигуре 6 представлены МС-спектры (вверху) и МС/MС-спектры (внизу), которые были получены от денатурированной восстановленной фракции E1 молекулы hRGMa (конструкции MYC), связанной с mAb AE12-1 и гидролизованной трипсином и Asp-N и которые подтвердили последовательность гидролизованного пептида, а именно KAGSPCKILKCNSEFWSATSGSHAPAS (SEQ ID NO: 81).
На фигуре 7 представлены МС-спектры (вверху) и МС/MС-спектры (внизу), которые были получены от денатурированной восстановленной фракции E1 молекулы hRGMa (конструкции MYC), связанной с mAb AE12-1 и гидролизованной трипсином и Asp-N и которые подтвердили последовательность гидролизованного пептида, а именно AGSPCKILKCNSEFWSATSGSHAPAS (SEQ ID NO: 89).
На фигуре 8 представлены микрофотографии поражений нервной ткани у крыс, обработанных контрольным антителом (hIgG в концентрации 10 мг/кг; см. верхнюю панель), антителом AE12-1 в концентрации 1 мг/кг (см. среднюю панель) или антителом h5F9.23 в концентрации 1 мг/кг (см. нижнюю панель).
На фигуре 9 представлены результаты анализа на разрастание нейритов клеток SH-SY5Y на 96-луночных планшетах, покрытых фибронектином, используемым в качестве субстрата, где указанный анализ проводили после обработки полноразмерной человеческой RGMa и ее нейтрализации антителом AE12-1 (левый столбец на графике) и антителом AE12-1-H (правый столбец на графике). Антитело и полноразмерную hRGMa добавляли одновременно, а затем культуры инкубировали в течение 24 часов.
На фигуре 10 представлены результаты анализа на разрастание нейритов клеток SH-SY5Y на 96-луночных планшетах, покрытых фибронектином, используемым в качестве субстрата, где указанный анализ проводили после обработки полноразмерной человеческой RGMa и ее нейтрализации антителом AE12-1-К (левый столбец на графике) и антителом AE12-1-F (правый столбец на графике). Антитело и полноразмерную hRGMa добавляли одновременно, а затем культуры инкубировали в течение 24 часов.
На фигуре 11 представлены результаты анализа на разрастание нейритов клеток SH-SY5Y на 96-луночных планшетах, покрытых фибронектином, используемым в качестве субстрата, где указанный анализ проводили после обработки полноразмерной человеческой RGMa и ее нейтрализации антителом AE12-1-I (левый столбец на графике) и антителом AE-12-L (правый столбец на графике). Антитело и полноразмерную hRGMa добавляли одновременно, а затем культуры инкубировали в течение 24 часов.
На фигуре 12 представлены результаты анализа на разрастание нейритов клеток SH-SY5Y на 96-луночных планшетах, покрытых фибронектином в качестве субстрата, где указанный анализ проводили после обработки полноразмерной человеческой RGMa и ее нейтрализации антителом AE12-1-V (левый столбец на графике) и антителом AE12-1-Y (правый столбец на графике). Антитело и полноразмерную hRGMa добавляли одновременно, а затем культуры инкубировали в течение 24 часов.
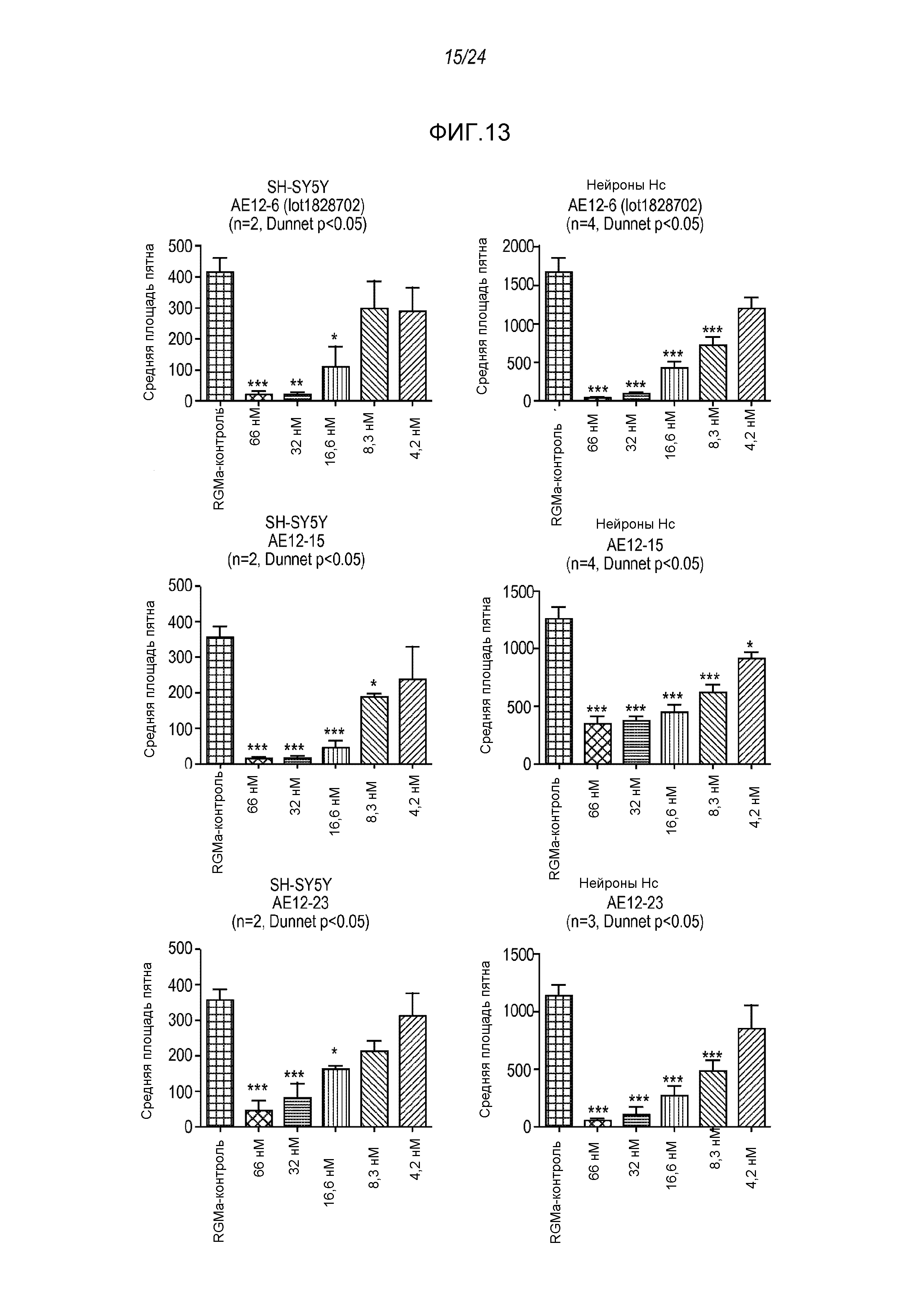
На фигуре 13 представлены результаты анализа на связывание с RGMa на клетках SH-SY5Y и на первичных нейронах (анализ на высокое содержание RGMa (HCA)), проводимого с использованием AE12-6, AE12-15 и AE12-23.
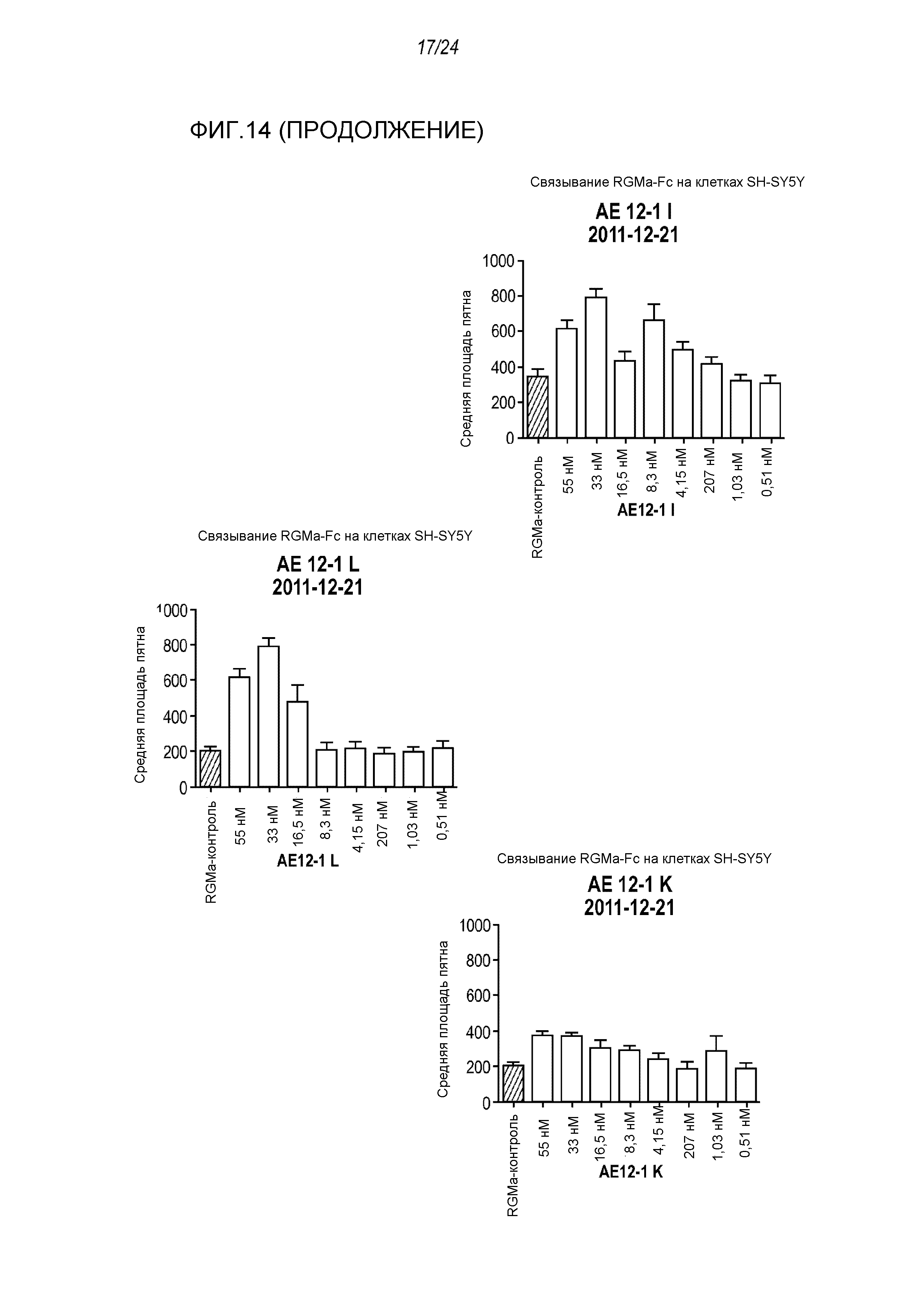
На фигуре 14 представлены результаты анализа на ингибирование связывания с RGMa на клетках SH-SY5Y (анализ на высокое содержание RGMa (HCA)), проводимого с использованием AE12-1 и цистеиновых вариантов AE12-1.
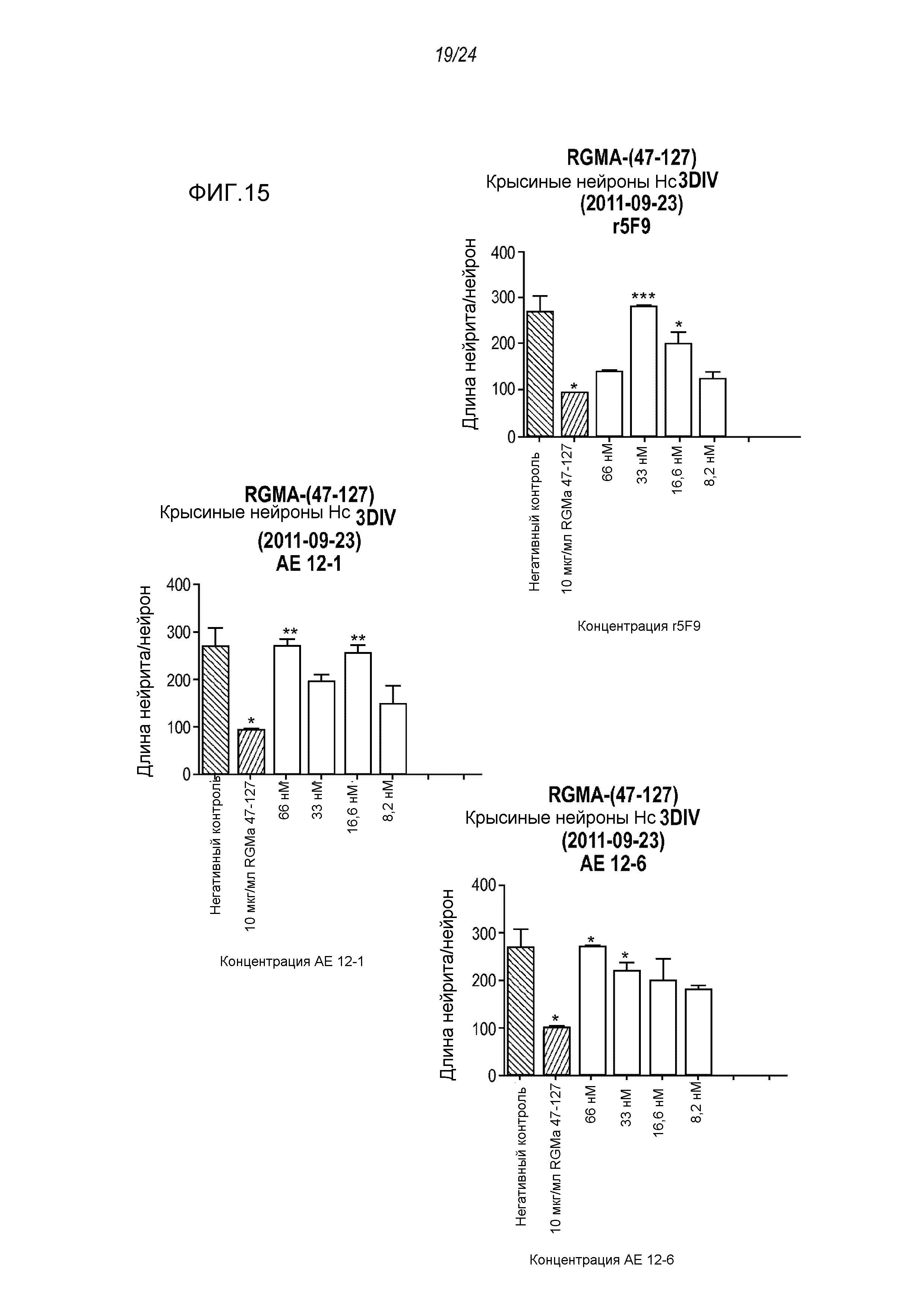
На фигуре 15 проиллюстрировано влияние нейтрализующего действия AE12-1 и AE12-6 на молекулу RGMa, ингибирующую рост нейритов, в анализе на разрастание нейритов в первичных нейронах крысиного гиппокампа. Антитело r5F9 использовали в качестве контроля.
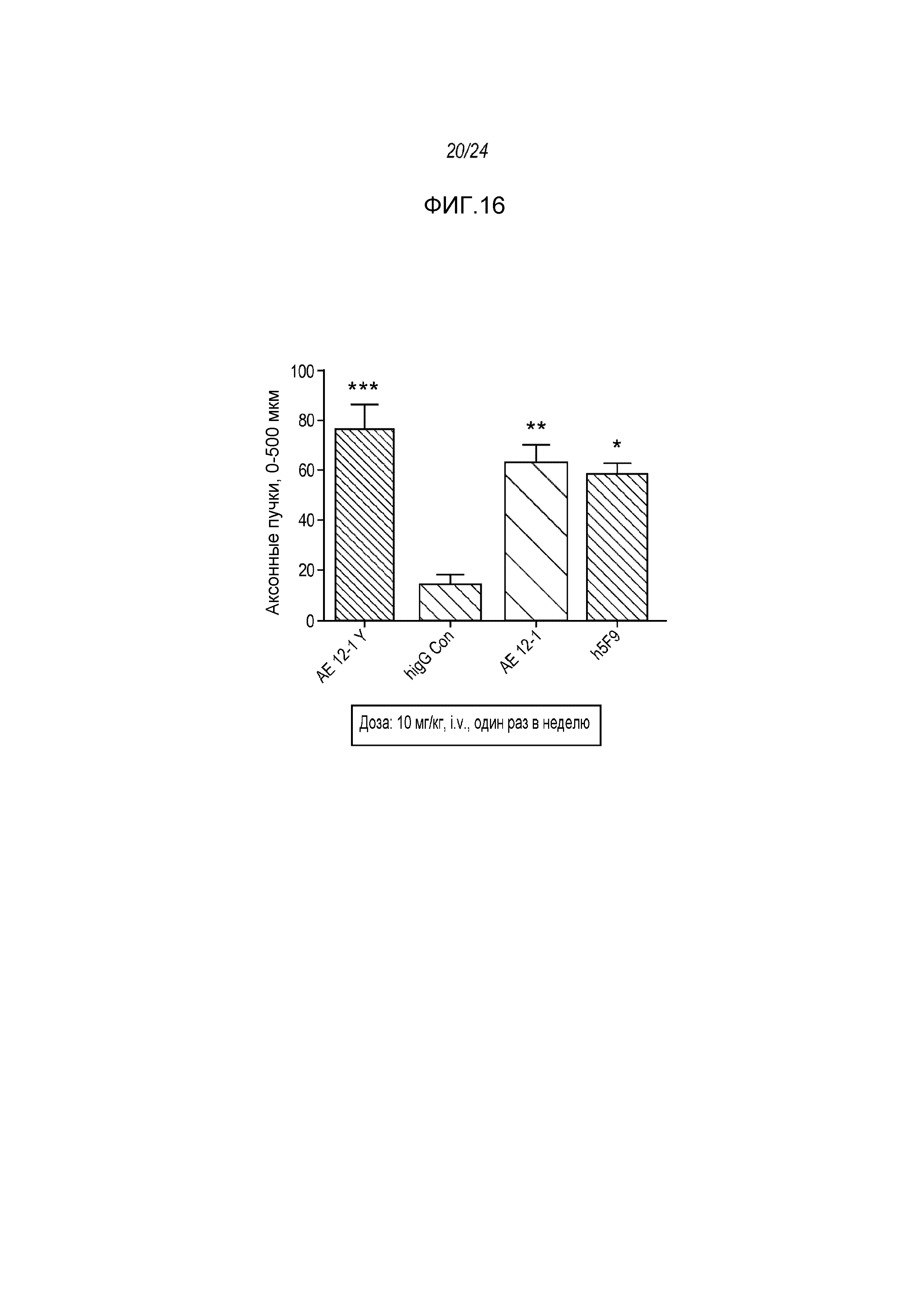
На фигуре 16 показано, что три (3) RGMa-специфических моноклональных антитела, а в частности AE12-1, AE12-1Y и h5F9.23, индуцируют массивную регенерацию GAP-43-позитивных волокон за пределами участка разрушения нервов как описано в примере 9. Ось Y - число пучков аксонов на площади 0-500 мкм за пределами участка разрушения нерва. ***p<0,001: значимость для hIgG, **p<0,01: значимость для hIgG, *p<0,05: значимость для человеческого IgG.
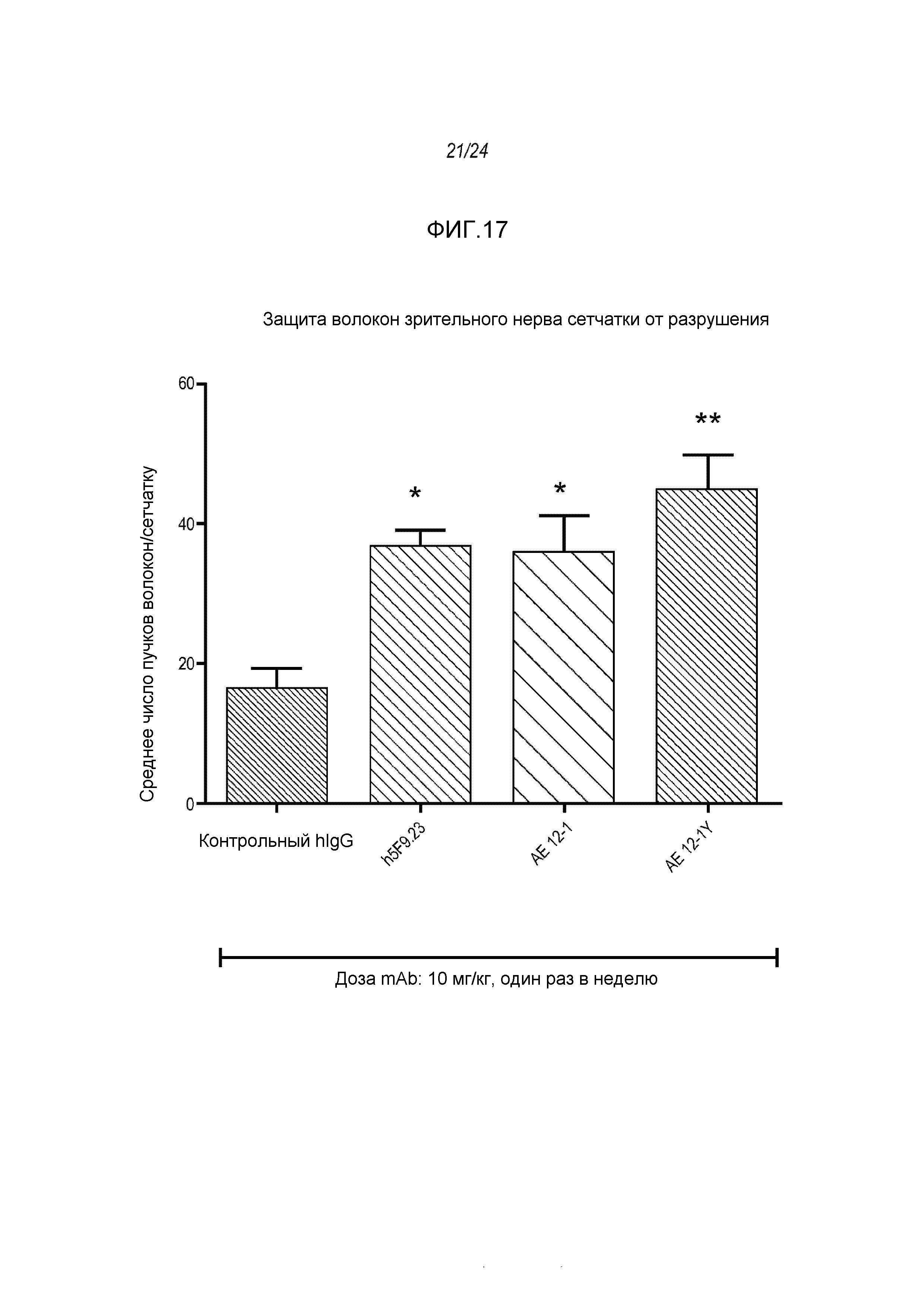
На фигуре 17 показано, что три (3) RGMa-специфических моноклональных антитела, а в частности AE12-1, AE12-1Y и h5F9.23, увеличивают число аксонных пучков сетчатки и тем самым, защищают слой нервного волокна сетчатки. Ось Y - число пучков волокон в сетчатке, как описано в примере 10. **p<0,01: значимость для hIgG, *p<0,05: значимость для hIgG.
На фигуре 18 показано, что анти-RGMa mAb AE12-1, AE12-1Y и h5F9.23 ускоряют восстановление функции спинного мозга у модели tEAE, как описано в примере 11. Обработку антителом (iv) начинали приблизительно через одну неделю после инъекции цитокина и повторяли один раз в неделю. Дозы составляли 10 мг/кг. ***p<0,001: значимость для hIgG, **p<0,01: значимость для hIgG, *p<0,05: значимость для hIgG.
На фигуре 19 показано, что анти-RGMa mAb AE12-1, AE12-1Y и ABT-207 (h5F9.23) увеличивают площадь GAP-43 и MBP и снижают воспалительные поражения, как показало прямое сравнение с человеческим контрольным антителом IgG, описанное в примере 11. ***p<0,001: значимость для hIgG, **p<0,01: значимость для hIgG, *p<0,05: значимость для hIgG.
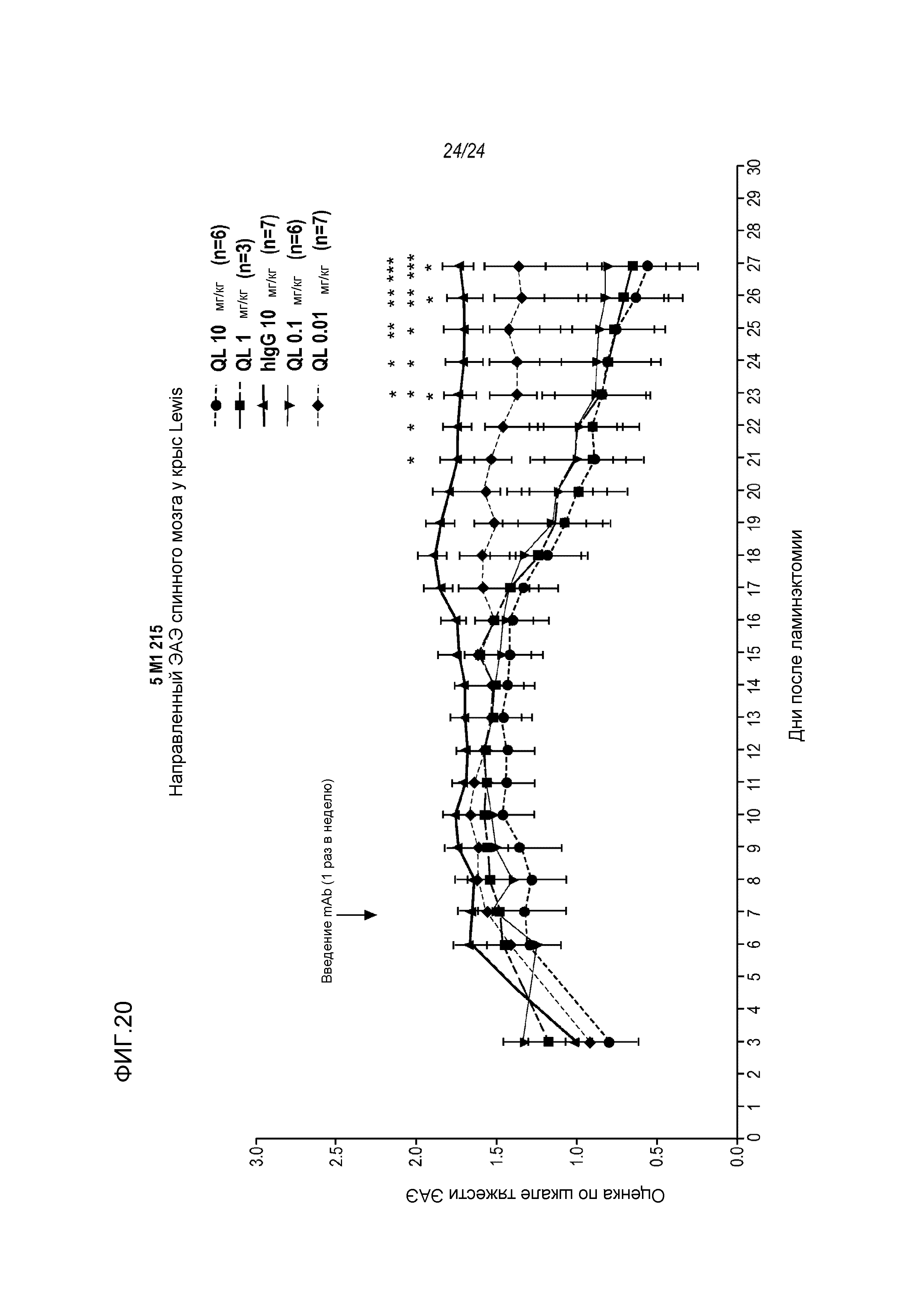
На фигуре 20 показано, что анти-RGMa mAb AE12-1Y-QL ускоряет восстановление функции спинного мозга у модели направленного ЭAЭ (нЭАЭ) при его введении в трех различных дозах 0,1; 1 и 10 мг/кг, вводимых внутривенно один раз в неделю, как описано в примере 11. Обработку антителом (iv) начинали приблизительно через одну неделю после инъекции цитокина и повторяли один раз в неделю. ***p<0,001: значимость для hIgG, **p<0,01: значимость для hIgG, *p<0,05: значимость для hIgG.
Подробное описание изобретения
Авторами настоящего изобретения описаны новые антитела, которые связываются с молекулой отталкивающего направляющего сигнала («RGMa») и которые могут быть использованы для лечения заболеваний, ассоциированных с дегенерацией нейритов. Настоящее изобретение относится к специфическим и неспецифическим антителам, способным ослаблять клинические признаки заболеваний, ассоциированных с дегенерацией нейритов.
1. Определения
Используемая здесь терминология приводится лишь в целях описания конкретных вариантов осуществления изобретения и не рассматривается как ограничение объема изобретения. Используемые здесь артикли «a», «an» и «the», употребляемые с существительными в единственном числе, могут относиться к существительным во множественном числе, если из контекста описания не следует обратное.
a. Приблизительно
Используемый здесь термин «приблизительно» может означать примерно ±10%-ное отклонение от имеющейся величины. Следует отметить, что такое отклонение всегда дается для любой указанной здесь величины, даже если отсутствует конкретное указание на данное отклонение.
b. Аффинно зрелое антитело
Используемый здесь термин «аффинно зрелое антитело» означает антитело с одной или более модификациями в одной или более CDR, где указанные модификации способствуют повышению аффинности (то есть KD, kd или ka) связывания антитела с антигеном-мишенью по сравнению с аффинностью связывания родительского антитела, в котором отсутствует(ют) такая(ие) модификация(модификации). Репрезентативные аффинно зрелые антитела обладают аффинностью по отношению к антигену-мишени в наномолярной или даже в пикомолярной концентрации. Специалистам известны различные методы продуцирования аффинно зрелых антител, включая скрининг комбинаторной библиотеки антител, которая была создана с использованием биологического представления. Так, например, в публикации, Marks et al., BioTechnology, 10: 779-783 (1992) описано созревание аффинности, осуществляемое путем перестановки доменов VH и VL. Неспецифический мутагенез CDR и/или каркасных остатков описан Barbas et al., Proc. Nat. Acad. Sci. USA, 91: 3809-3813 (1994); Schier et al., Gene, 169: 147-155 (1995); Yelton et al., J. Immunol, 155: 1994-2004 (1995); Jackson et al., J. Immunol, 154(7): 3310-3319 (1995); и Hawkins et al., J. Mol. Biol, 226: 889-896 (1992). Селективная мутация в выбранных положениях мутагенеза и положениях контактирования с аминокислотным остатком, повышающим активность или гипермутации в положениях указанных остатков описаны в патенте США № 6914128 B1.
c. Антитело и антитела
Используемые здесь термины «антитело» и «антитела» означают моноклональные антитела, мультиспецифические антитела, человеческие антитела, гуманизованные антитела (полностью или частично гуманизованные), антитела животных, таких как, но не ограничивающихся ими, птицы (например, утки или гуси), акулы, киты и млекопитающие, не являющиеся приматами (например, коровы, свиньи, верблюды, ламы, лошади, козы, кролики, овцы, хомячки, морские свинки, кошки, собаки, крысы, мыши и т.п.) или приматы, не являющиеся человеком (например, мартышки, шимпанзе и т.п.); рекомбинантные антитела, химерные антитела, одноцепочечные Fv («scFv»), одноцепочечные антитела, однодоменные антитела, Fab-фрагменты, F(ab')-фрагменты, F(ab')2-фрагменты, Fv, связанные дисульфидной связью («sdFv»), антиидиотипические антитела («анти-Id антитела»), антитела с двумя доменами, антитела с двумя вариабельными доменами (DVD) или с тремя вариабельными доменами (TVD) (иммуноглобулины с двумя вариабельными доменами и методы их получения описаны в публикации Wu, C, et al., Nature Biotechnology, 25(11): 1290-1297 (2007) и в международной заявке PCT WO 2001/058956, содержание которых вводится в настоящее описание посредством ссылки) и функционально активные эпитоп-связывающие фрагменты любых вышеуказанных антител. В частности, антитела включают молекулы иммуноглобулина и иммунологически активные фрагменты молекул иммуноглобулина, а именно молекулы, содержащие сайт связывания с аналитом. Молекулы иммуноглобулина могут принадлежать к любому типу (например, к IgG, IgE, IgM, IgD, IgA и IgY), классу (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или подклассу. Для простоты используемый здесь термин «антитело, направленное против аналита» часто называют «антителом против аналита» или просто «антианалитным антителом» (например, анти-RGMa антителом или антителом против RGMa).
d. Фрагмент антитела
Используемый здесь термин «фрагмент антитела» означает часть интактного антитела, содержащую антигенсвязывающий сайт или вариабельную область. Эта часть может не включать константные домены тяжелой цепи (то есть CH2, CH3 или CH4, в зависимости от изотипа антитела) Fc-области интактного антитела. Примерами фрагментов антитела являются, но не ограничиваются ими, Fab-фрагменты, Fab'-фрагменты, Fab'-SH-фрагменты, F(ab')2-фрагменты Fd-фрагменты, Fv-фрагменты, диантитела, одноцепочечные молекулы Fv (scFv), одноцепочечные полипептиды, содержащие только один вариабельный домен легкой цепи, одноцепочечные полипептиды, содержащие три CDR вариабельного домена легкой цепи, одноцепочечные полипептиды, содержащие только одну вариабельную область тяжелой цепи и одноцепочечные полипептиды, содержащие три CDR вариабельной области тяжелой цепи.
е. Константы связывания
В настоящей заявке описаны «константы связывания». Используемые здесь термины «константа скорости ассоциации» или «kon» или «ka» означают величину, указывающую на скорость связывания антитела с его антигеном-мишенью или скорость образования комплекса антитела с антигеном, как показано в нижеследующем уравнении:
Антитело («Ab») + Антиген («Ag») → Ab-Ag.
Используемые здесь термины «константа скорости диссоциации», «koff» или «kd» являются синонимами и означают величину скорости диссоциации антитела из его антигена-мишени или разложения комплекса Ab-Ag в течение определенного периода времени с образованием свободного антитела и антигена, как представлено в нижеследующем уравнении:
Антитело («Ab») + Антиген («Ag») ← Ab-Ag.
Методы определения констант скорости ассоциации и диссоциации хорошо известны специалистам. Применение флуоресцентных методов позволяет с высокой степенью чувствительности проанализировать образцы в физиологических буферах при равновесии. Могут быть применены и другие экспериментальные подходы, такие как анализ BIAcore® (анализ на биомолекулярное взаимодействие) и экспериментальное оборудование (например, оборудование, поставляемое компанией BIAcore International AB, a GE Healthcare company, Uppsala, Sweden). Кроме того, может быть также проведен анализ KinExA® (кинетически исключающий анализ), разработанный компанией Sapidyne Instruments (Boise, Idaho).
f. Связывающий белок
Используемые здесь термины «константа равновесной диссоциации» или «KD» являются синонимами и означают величину, полученную путем деления константы скорости диссоциации (kоff) на константу скорости ассоциации (kon). Константа скорости ассоциации, константа скорости диссоциации и константа равновесной диссоциации используются для определения аффинности связывания антитела с антигеном.
Используемый здесь термин «связывающий белок» означает мономерный или мультимерный белок, которые связываются и образуют комплекс с партнером по связыванию, таким как, например, полипептид, антиген, химическое соединение или другая молекула или субстрат любого вида. Связывающий белок специфически связывается с партнером по связыванию. Связывающими белками являются антитела, а также их антигенсвязывающие фрагменты и их другие различные формы и производные, известные специалистам и описанные ниже и другие молекулы, содержащие один или более антигенсвязывающих доменов, которые связываются с молекулой антигена или с конкретным сайтом (эпитопом) на молекуле антигена. В соответствии с этим, связывающими белками являются, но не ограничиваются ими, антитело, тетрамерный иммуноглобулин, молекула IgG, молекула IgG1, моноклональное антитело, химерное антитело, CDR-привитое антитело, гуманизованное антитело, аффинно зрелое антитело и фрагменты любых указанных антител, которые сохраняют свою способность связываться с антигеном.
g. Биспецифическое антитело
Используемый здесь термин «биспецифическое антитело» означает полноразмерное антитело, которое получают с применением квадромной технологии (см. Milstein et al., C. Nature, 305(5934): p. 537-540 (1983)), химического конъюгирования двух различных моноклональных антител (см. Staerz, et al., Nature, 314(6012): 628-631 (1985)) или с применением технологии «узлы в дырках» или аналогичных технологий, которые позволяют вводить мутации в Fc-область (см. Holliger, et al., Proc. Natl. Acad. Sci. USA, 90(14): 6444-6448 (1993)), что приводит к получению множества различных молекул иммуноглобулина из которых только одна молекула является функциональным биспецифическим антителом. Биспецифическое антитело связывается с одним антигеном (или эпитопом) на одной из двух связывающихся ветвей (одна пара HC/LC) и с другим антигеном (или эпитопом) на второй ветви (другая пара HC/LC). Согласно такому определению, биспецифическое антитело имеет две отдельных антигенсвязывающих ветви (отличающихся по специфичности и по последовательностям CDR) и является одновалентным для каждого антигена, с которым оно связывается.
h. CDR
Используемый здесь термин «CDR» означает «гипервариабельную область» в вариабельной последовательности антитела. В каждой из вариабельных областей тяжелой цепи и легкой цепи присутствуют три CDR, которые, для каждой вариабельной области, обозначаются «CDR1», «CDR2» и «CDR3». Используемый здесь термин «набор CDR» означает группу из трех CDR, которые присутствуют в одной вариабельной области, обладающей способностью связываться с антигеном. Точные границы этих CDR были определены различным образом в зависимости от различных систем. Система, описанная Кэбатом (Kabat et al., Sequences of Proteins of Immunological Interest (National Institutes of Health, Bethesda, Md. (1987) и (1991)) имеет не только однозначную систему нумерации остатков, применяемую к любой вариабельной области антитела, но также и точные границы остатков, определяющие три СDR. Эти CDR могут называться «СDR по Кэбату». Чотия и сотрудники (Chothia & Lesk, J. Mol. Biol. 196:901-917 (1987) и Chothia et al., Nature 342:877-883 (1989)) обнаружили, что некоторые субположения в СDR по Кэбату приобретают почти идентичную конформацию пептидного остова, несмотря на то, что они имеют значительные различия на уровне аминокислотной последовательности. Такие подобласти были обозначены L1, L2 и L3 или H1, H2 и H3, где «L» и «H» означают области легкой и тяжелой цепи, соответственно. Такие области, которые имеют границы, перекрывающиеся с СDR по Кэбату, могут называться «СDR по Чотия». Другие границы, определяющие перекрывание СDR с СDR по Кэбату, были описаны в публикации Padlan (FASEB J. 9:133-139 (1995)) и MacCallum (J. Mol. Biol. 262(5):732-45 (1996)). Другие определения границ CDR могут, но не строго, соответствовать одной из описанных здесь систем, но тем не менее, эти границы перекрываются с СDR по Кэбату, хотя эти области могут быть короче или длиннее, как это было предсказано или получено из экспериментальных данных, которые указывают на то, что конкретные остатки или группы остатков или даже полноразмерные СDR не оказывают значительного влияния на связывание с антигеном. В описанных здесь способах могут использоваться СDR, определенные в соответствии с любой из этих систем, хотя в некоторых вариантах используются СDR, определенные по Кэбату или Чотия.
i. Компонент или компоненты
Термины «компонент», «компоненты» или «по меньшей мере один компонент», по существу, означают иммобилизованное антитело, детектирующее или конъюгированное антитело-калибратор, контроль, набор тест-соединений для определения чувствительности, контейнер, буфер, разбавитель, соль, фермент, кофактор для фермента, детектирующий реагент, реагент/раствор для предварительной обработки, субстрат (например, в виде раствора), блокирующий раствор и т.п., которые могут быть включены в набор для анализа тест-образца, такого как проба мочи, сыворотки или плазмы пациента, где указанный анализ проводят проводимого в соответствии с описанными здесь методами и другими методами, известными специалистам. Некоторые компоненты могут присутствовать в растворе или в лиофилизованной форме, которую затем разводят для использования в данном анализе.
j. Консенсус или консенсусная последовательность
Используемые здесь термины «консенсус» или «консенсусная последовательность» означают синтетическую последовательность нуклеиновой кислоты или соответствующую полипептидную последовательность, сконструированную на основе анализа выравнивания последовательностей конкретного антигена множества подтипов. Эта последовательность может быть использована для индуцирования иммунитета широкого спектра против конкретного антигена множества подтипов или серотипов. Синтетические антигены, такие как гибридные белки, могут быть подвергнуты модификации с получением консенсусных последовательностей (или консенсусных антигенов).
k. Контроль
Используемый здесь термин «контроль» означает композицию, которая, как известно, не содержит аналит («негативный контроль»), например, молекулу RGMа (такую как мембрано-ассоциированная RGMа, растворимая RGMа, фрагменты мембрано-ассоциированной RGMа, фрагменты растворимой RGMа, варианты RGMа (варианты мембрано-ассоциированной RGMа или растворимой RGMа) или любые их комбинации), или содержит представляющий интерес аналит («позитивный контроль»), например, молекулу RGMа (такую как мембрано-ассоциированная RGMа, растворимая RGMа, фрагменты мембрано-ассоциированной RGMа, фрагменты растворимой RGMа, варианты RGMа (варианты мембрано-ассоциированной RGMа или растворимой RGMа) или любые их комбинации). Позитивный контроль может содержать известную концентрацию RGMа. Используемые здесь термины «контроль», «позитивный контроль» и «калибратор» могут употребляться как синонимы и означают композицию, содержащую известную концентрацию RGMа. «Позитивный контроль» может быть использован в целях определения технологических свойств, необходимых для проведения анализа, и представляет собой ценный индикатор целостности реагентов (например, аналитов). Термин «нормальный контроль» может означать образец, в котором отсутствуют признаки заболевания или расстройства, ассоциированного с изменением содержания железа или пациента, не страдающего указанным заболеванием или расстройством.
l. Производное
Используемый здесь термин «производное антитела» может означать антитело, имеющее одну или более модификаций в своей аминокислотной последовательности, по сравнению с исходным или родительским антителом и модифицированную структуру доменов. Такое производное может принимать типичную конфигурацию доменов, наблюдаемую в нативных антителах, а также имеет аминокислотную последовательность, способную специфически связываться с мишенями (антигенами). Типичными примерами производных антител являются антитела, связанные с другими полипептидами, а также реаранжированные домены антител или их фрагменты. Производное может также содержать по меньшей мере одно другое соединение, например, домен белка, где указанный домен белка связан ковалентными или нековалентными связями. Связь может быть образована посредством генетического сцепления методами, известными специалистам. Дополнительный домен, присутствующий в гибридном белке, содержащем антитело, используемое в соответствии с настоящим изобретением, может быть, предпочтительно, связан посредством гибкого линкера, а преимущественно пептидного линкера, где указанный пептидный линкер содержит множество гидрофильных аминокислот, связанных пептидными связями и имеющих длину, соответствующую расстоянию между С-концом другого домена белка и N-концом антитела или наоборот. Это антитело может быть связано с эффекторной молекулой, имеющей конформацию, подходящую для сообщения биологической активности или селективного связывания с твердым носителем, с биологически активным веществом (например, с цитокином или гормоном роста), химическим веществом, пептидом, белком или, например, с лекарственным средством.
m. Антитело с двойной специфичностью
Используемый здесь термин «антитело с двойной специфичностью» означает полноразмерное антитело, которое может связываться с двумя различными антигенами (или эпитопами) в каждой из своих двух связывающихся ветвей (пара HC/LC) (см. публикацию заявки РСТ WO 02/02773). В соответствии с этим, связывающийся белок с двойной специфичностью имеет две идентичных антигенсвязывающихся ветви с идентичными специфичностями и идентичными последовательностями CDR, и является двухвалентным для каждого антигена, с которым он связывается.
n. Два вариабельных домена
Используемый здесь термин «два вариабельных домена» означает два или более антигенсвязывающих сайта на связывающем белке, которые могут представлять собой двухвалентные связывающиеся белки (с двумя антигенсвязывающими сайтами), четырехвалентные связывающиеся белки (с четырьмя антигенсвязывающими сайтами) или поливалентные связывающиеся белки. DVD могут быть моноспецифическими, то есть они могут связываться с одним антигеном (или с одним специфическим эпитопом) или мультиспецифическими, то есть они могут связываться с двумя или более антигенами (то есть с двумя или более эпитопами одной и той же молекулы антигена-мишени или с двумя или более эпитопами различных антигенов-мишеней). Предпочтительный связывающийся DVD-белок содержит два DVD-полипептида тяжелой цепи и два DVD-полипептида легкой цепи и называется «DVD-иммуноглобулином» или «DVD-Ig». Поэтому такой связывающийся белок DVD-Ig является тетрамерным и напоминает молекулу IgG, но имеет большее количество антигенсвязывающих сайтов, чем молекула IgG. Таким образом, каждая половина тетрамерной молекулы DVD-Ig напоминает одну половину молекулы IgG и включает DVD-полипептид тяжелой цепи и DVD-полипептид легкой цепи, но в отличие от пары тяжелой и легкой цепей молекулы IgG, которая имеет один антигенсвязывающий домен, пара тяжелой и легкой цепей молекулы DVD-Ig имеет два или более антигенсвязывающих сайтов.
Каждый антигенсвязывающий сайт связывающего белка DVD-Ig может происходить от донорного («родительского») моноклонального антитела, а поэтому содержит вариабельный домен тяжелой цепи (VH), и вариабельный домен легкой цепи (VL), где общее число CDR, участвующих в связывании с антигеном, в каждом антигенсвязывающем сайте равно шести. В соответствии с этим, связывающийся белок DVD-Ig, который связывается с двумя различными эпитопами (то есть с двумя различными эпитопами двух различных молекул антигенов или с двумя различными эпитопами одной и той же молекулы антигена), содержит антигенсвязывающий сайт, происходящий от первого родительского моноклонального антитела и антигенсвязывающий сайт, происходящий от второго родительского моноклонального антитела.
Описание конструирования и экспрессии, а также характеризация связывающихся молекул DVD-Ig приводится в публикации заявки PCT № WO 2007/024715, в патенте США № 7612181 и в публикации Wu et al., Nature Biotech., 25: 1290-1297 (2007). Предпочтительным примером таких молекул DVD-Ig являются молекулы, которые содержат тяжелую цепь, имеющую структурную формулу VD1-(X1)n-VD2-C-(X2)n, где VD1 представляет собой первый вариабельный домен тяжелой цепи, VD2 представляет собой второй вариабельный домен тяжелой цепи, C представляет собой константный домен тяжелой цепи, X1 представляет собой линкер, при условии, что он не является CH1, X2 представляет собой Fc-область, а n равно 0 или 1, а предпочтительно, 1; и легкую цепь, имеющую структурную формулу VD1-(Х1)n-VD2-C-(X2)n, где VD1 представляет собой первый вариабельный домен легкой цепи, VD2 представляет собой второй вариабельный домен легкой цепи, C представляет собой константный домен легкой цепи, X1 представляет собой линкер, при условии, что он не является CH1, а X2 не содержит Fc-область, n равно 0 или 1, а предпочтительно, 1. Такой DVD-Ig может содержать две указанных тяжелых цепи и две указанных легких цепи, где каждая из этих цепей содержит вариабельные домены, тандемно присоединенные друг к другу без промежуточной константной области, обычно присутствующей между вариабельными областями, где тяжелая цепь и легкая цепь связаны друг с другом и образуют тандемные функциональные антигенсвязывающие сайты, а пара тяжелой и легкой цепей может быть связана с другой парой тяжелой и легкой цепей с образованием тетрамерного связывающегося белка, имеющего четыре функциональных антигенсвязывающих сайта. В другом примере, молекула DVD-Ig может содержать тяжелую и легкую цепи, каждая из которых включает три вариабельных домена (VD1, VD2, VD3), тандемно присоединенных друг к другу без промежуточной константной области, обычно присутствующей между вариабельными областями, где тяжелая и легкая цепи могут быть связаны друг с другом и образуют три антигенсвязывающих сайта, а пара тяжелой и легкой цепей может быть связана с другой парой тяжелой и легкой цепей с образованием тетрамерного связывающегося белка, имеющего шесть антигенсвязывающих сайтов.
В предпочтительном варианте осуществления изобретения, связывающийся белок DVD-Ig согласно изобретению не только способен связываться с одними и теми же молекулами-мишенями, связанными с родительскими моноклональными антителами, но также обладает одним или более нужными свойствами, которыми обладают одно или более родительских моноклональных антител. Предпочтительно, таким дополнительным свойством является свойство антитела, присущее одному или более родительским моноклональным антителам. Свойствами антител, которые могут быть сообщены связывающемуся белку DVD-Ig одним или более родительскими моноклональными антителами, являются, но не ограничиваются ими, специфичность к антигену, аффинность к антигену, активность, биологическая функция, распознавание эпитопа, стабильность белка, растворимость белка, эффективность продуцирования иммуногенность, фармакокинетические свойства, биологическая доступность, способность перекрестно реагировать с тканями и способность к связыванию с ортологичным антигеном.
Связывающийся белок DVD-Ig связывается по меньшей мере с одним эпитопом RGMа. Неограничивающими примерами связывающегося белка DVD-Ig являются связывающийся белок DVD-Ig, который связывается с одним или более эпитопами RGMа; связывающийся белок DVD-Ig, который связывается с эпитопом человеческой RGMа и с эпитопом RGMа других видов (например, мыши); и связывающийся белок DVD-Ig, который связывается с эпитопом человеческой RGMа и с эпитопом другой молекулы-мишени (например, VEGFR2 или VEGFR1).
o. Эпитоп или эпитопы
Термины «эпитоп», «эпитопы» или «представляющие интерес эпитопы» означают сайт(ы) на любой распознаваемой молекуле, которая может связываться с комплементарным(и) сайтом(ами) на партнере по специфическому связыванию. Эта молекула и партнер по специфическому связыванию являются частью специфической связывающей пары. Так, например, такой эпитоп может находиться на полипептиде, белке, гаптене, углеводном антигене (таком как, но не ограничивающемся ими, гликолипиды, гликопротеины или липополисахариды) или на полисахариде. Партнером по специфическому связыванию может быть, но не ограничивается им, антитело.
p. Каркасная область или каркасная последовательность
Используемые здесь термины «каркасная область» (FR) или «каркасная последовательность» могут означать остальные последовательности вариабельной области минус СDR. Поскольку точное определение последовательности СDR может быть дано исходя из других систем (например, см. выше), то термин «каркасная последовательность» может иметь, соответственно, другую интерпретацию. Шесть CDR (CDR-L1, -L2 и -L3 легкой цепи и CDR-H1, -H2 и -H3 тяжелой цепи) также разделяют каркасные области в легкой цепи и в тяжелой цепи на четыре подобласти (FR1, FR2, FR3 и FR4) на каждой цепи, где СDR1 расположена между FR1 и FR2, CDR2 расположена между FR2 и FR3, а CDR3 расположена между FR3 и FR4. Не прибегая к точному определению подобластей, таких как FR1, FR2, FR3 или FR4, можно сказать, что каркасная область, определяемая иначе, представляет собой объединенные FR в вариабельной области в одной природной цепи иммуноглобулина. Используемый здесь термин «область FR» означает одну из четырех подобластей, а термин «области FR» означает две или более из четырех подобластей, составляющих каркасную область.
Последовательности FR человеческой тяжелой и легкой цепей известны специалистам и могут быть использованы в качестве «акцепторных» каркасных последовательностей тяжелой и легкой цепей (или просто «акцепторных» последовательностей) для гуманизации не-человеческого антитела с применением известных методов. В одном из вариантов осуществления изобретения, акцепторные последовательности человеческих тяжелой и легкой цепей выбраны из каркасных последовательностей, имеющихся в общедоступных базах данных, таких как V-base (hypertext transfer protocol://vbase.mrc-cpe.cam.ac.uk/), или в Международной информационной системе ImMunoGeneTics® (IMGT®) (hypertext transfer protocol://imgt.cines.fr/texts/IMGTrepertoire/ LocusGenes/).
q. Функциональный антигенсвязывающий сайт
Используемый здесь термин «Функциональный антигенсвязывающий сайт» может означать сайт на связывающем белке (например, на антителе), который обладает способностью связываться с антигеном-мишенью. Аффинность связывания антигенсвязывающего сайта с антигеном необязательно должна быть такой же высокой, как и аффинность связывающего белка, например, родительского антитела, от которого происходит этот антигенсвязывающий сайт, однако его способность связываться с антигеном должна быть детектируемой любым из различных методов, обычно применяемых для оценки связывания белка, например, антитела, с антигеном. Кроме того, аффинности связывания каждого антигенсвязывающего сайта поливалентного белка, например поливалентного антитела, с антигеном необязательно должны быть количественно равноценными.
r. Человеческое антитело
Используемый здесь термин «человеческое антитело» может включать антитела, имеющие вариабельные и константные области, происходящие от последовательностей иммуноглобулина человеческой зародышевой линии. Человеческие антитела согласно изобретению могут включать аминокислотные остатки, не кодируемые последовательностями иммуноглобулина человеческой зародышевой линии (например, в них могут быть введены мутации посредством неспецифического или сайт-специфического мутагенеза in vitro или посредством соматической мутации in vivo). Однако используемый здесь термин «человеческое антитело» не включает антитела, в которых последовательности СDR, происходящие от зародышевой линии млекопитающих других видов, таких как мышь, были присоединены к человеческим каркасным последовательностям.
s. Гуманизованное антитело
Используемый здесь термин «гуманизованное антитело» означает антитело, которое содержит последовательности вариабельной области тяжелой и легкой цепи, происходящие от млекопитающих, не являющихся человеком (например, мыши), но в которых по меньшей мере часть последовательности VH и/или VL была модифицирована для сообщения ей большего сходства с последовательностью человеческого антитела, то есть большего сходства с вариабельными последовательностями человеческой зародышевой линии. «Гуманизованное антитело» представляет собой антитело или его вариант, производное, аналог или фрагмент, которые иммуноспецифически связываются с представляющим интерес антигеном и содержат каркасную область (FR), имеющую, в основном, аминокислотную последовательность человеческого антитела и гипервариабельную область (СDR), имеющую, в основном, аминокислотную последовательность не-человеческого антитела. Используемый здесь термин «в основном», относящийся к CDR, означает, что CDR имеет аминокислотную последовательность, которая по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 98% или по меньшей мере на 99% идентична аминокислотной последовательности СDR не-человеческого антитела. Гуманизованное антитело включает, в основном, все или по меньшей мере один, а обычно два вариабельных домена (Fab, Fab', F(ab’)2, FabC, Fv), в которых все или, в основном, все области CDR соответствуют не-человеческому иммуноглобулину (то есть донорному антителу), а все или, в основном, все каркасные области представляют собой области, имеющие консенсусную последовательность человеческого иммуноглобулина. В одном из вариантов осуществления изобретения, гуманизованное антитело также содержит по меньшей мере часть константной области иммуноглобулина (Fc), а обычно, человеческого иммуноглобулина. В некоторых вариантах осуществления изобретения, гуманизованное антитело содержит легкую цепь, а также по меньшей мере вариабельный домен тяжелой цепи. Такое антитело также может включать область CH1, шарнирную область и области CH2, CH3 и CH4 тяжелой цепи. В некоторых вариантах осуществления изобретения, гуманизованное антитело содержит только гуманизованную легкую цепь. В некоторых вариантах осуществления изобретения, гуманизованное антитело содержит только гуманизованную тяжелую цепь. В конкретных вариантах осуществления изобретения, гуманизованное антитело содержит только гуманизованный вариабельный домен легкой цепи и/или гуманизованную тяжелую цепь.
Гуманизованное антитело может быть выбрано из иммуноглобулинов любого класса, включая IgM, IgG, IgD, IgA и IgE и любого изотипа, включая, но не ограничиваясь ими, IgG1, IgG2, IgG3 и IgG4. Гуманизованное антитело может содержать последовательности, происходящие от антител более чем одного класса или изотипа, а конкретные константные домены могут быть выбраны для оптимизации нужных эффекторных функций методами, хорошо известными специалистам.
Каркасные области и CDR гуманизованного антитела необязательно должны точно соответствовать родительским последовательностям, так, например, CDR донорного антитела или консенсусная каркасная область могут быть подвергнуты мутагенезу путем замены инсерции и/или делеции по меньшей мере одного аминокислотного остатка так, чтобы CDR или каркасный остаток в этом сайте не соответствовал остатку донорного антитела или консенсусной каркасной области. Однако в предпочтительном варианте осуществления изобретения такие мутации не должны быть избыточными. Обычно остатки гуманизованного антитела по меньшей мере на 80%, предпочтительно, по меньшей мере на 85%, более предпочтительно, по меньшей мере на 90%, а наиболее предпочтительно, по меньшей мере на 95% соответствуют остаткам последовательностей родительских FR и CDR. Используемый здесь термин «консенсусная каркасная область» означает каркасную область в консенсусной последовательности иммуноглобулина. Используемый здесь термин «консенсусная последовательность иммуноглобулина» означает последовательность, происходящую от наиболее часто встречающихся аминокислот (или нуклеотидов) в семействе родственных последовательностей иммуноглобулина (см., например, Winnaker, From Genes to Clones (Verlagsgesellschaft, Weinheim, 1987)). «Консенсусная последовательность иммуноглобулина» может также содержать «консенсусную(ые) каркасную(ые) область(и)» и/или «консенсусную(ые) CDR». В семействе иммуноглобулинов, каждое положение в консенсусной последовательности занято аминокислотой, наиболее часто встречающейся в этом положении указанного семейства. Если две аминокислоты встречаются с одинаковой частотой, то в консенсусной последовательности может присутствовать любая из этих аминокислот.
t. Идентичный или идентичность
Термины «идентичный» или «идентичность», используемые здесь по отношению к двум или более полипептидным или полинуклеотидным последовательностям, означают, что указанные последовательности имеют определенный процент одних и тех же остатков по всей указанной области. Этот процент может быть вычислен путем оптимального выравнивания двух последовательностей, сравнения этих двух последовательностей по всей указанной области, определения числа положений, в которых присутствуют одинаковые остатки в обеих последовательностях с получением числа совпадающих положений, деления числа совпадающих положений на общее число положений в данной области и умножения результата на 100 с получением процента идентичности последовательностей. В случае, если две последовательности имеют различные длины или выравнивание дает один или более «ступенчатых» концов и конкретная область сравнения включает только одну последовательность, то при вычислении остатки этой одной последовательности включают в знаменатель, но не в числитель.
u. Выделенный полинуклеотид
Используемый здесь термин «выделенный полинуклеотид» может означать полинуклеотид (например, геномную ДНК, кДНК, синтетическую ДНК или их комбинацию), который, по своему происхождению не связан с полноразмерным полинуклеотидом или с его частью, вместе с которыми данный «выделенный полинуклеотид» обнаруживается в природе; или полинуклеотид, функционально присоединенный к полинуклеотиду, с которым он не связан в природе; или полинуклеотид, который не существует в природе как часть более крупной последовательности.
v. Метка и детектируемая метка
Используемые здесь термины «метка» и «детектируемая метка» означают молекулу, присоединенную к антителу или аналиту для обеспечения реакции между антителом и детектируемым аналитом и антитело или аналит, меченные таким образом, также являются «детектируемо меченными». Метка может продуцировать сигнал, детектируемый визуально или с помощью приборов. Различными метками являются сигнал-продуцирующие вещества, такие как хромогены, флуоресцентные соединения, хемилюминесцентные соединения, радиоактивные соединения и т.п. Репрезентативными примерами меток являются молекулы, излучающие свет, например, соединения акридиния и молекулы, продуцирующие флуоресцентное излучение, например, флуоресцеин. В настоящей заявке описаны и другие метки. В этой связи следует отметить, что сама молекула может не быть детектируемой меченной, но может стать детектируемой после ее реакции с другой молекулой. При этом подразумевается, что термин «детектируемо меченный» относится к такому мечению.
Может быть использована любая подходящая детектируемая метка, известная специалистам. Так, например, детектируемой меткой может быть радиоактивная метка (такая как3H,125I,35S,14C,32P и33P), ферментная метка (такая как пероксидаза хрена, щелочная пероксидаза, глюкозо-6-фосфат-дегидрогенза и т.п.), хемилюминесцентная метка, (такая как сложные эфиры, тиоэфиры или сульфонамиды акридиния; люминол, изолюминол, сложные эфиры фенантридиния и т.п.), флуоресцентная метка (такая как флуоресцеин (например, 5-флуоресцеин, 6-карбоксифлуоресцеин, 3'6-карбоксифлуоресцеин, 5(6)-карбоксифлуоресцеин, 6-гексахлорфлуоресцеин, 6-тетрахлорфлуоресцеин, флуоресцеинизотиоцианат и т.п.)), родамин, фикобилипротеины, R-фикоэритрин, квантовые частицы (например, селенид кадмия, кэпированный сульфидом цинка), термо-метка или метка для иммуно-полимеразной цепной реакции. Методы включения меток, процедуры мечения и способы детектирования меток можно найти в публикации Polak и Van Noorden, Introduction to Immunocytochemistry, 2nd ed., Springer Verlag, N.Y. (1997) и в руководстве Haugland, Handbook of Fluorescent Probes and Research Chemicals (1996), которое было объединено с каталогом, опубликованным Molecular Probes, Inc., Eugene, Oregon. Флуоресцентная метка может быть использована в FPIA (см., например, патенты США 5593896, 5573904, 5496925, 5359093 и 5352803, которые во всей своей полноте вводятся в настоящее описание посредством ссылки). Соединение акридиния может быть использовано в качестве детектируемой метки в анализе на гомогенное хемилюминесцентное излучение (см., например, Adamczyk et al., Bioorg. Med. Chem. Lett. 16: 1324-1328 (2006); Adamczyk et al., Bioorg. Med. Chem. Lett. 4: 2313-2317 (2004); Adamczyk et al., Biorg. Med. Chem. Lett. 14: 3917-3921 (2004); и Adamczyk et al., Org. Lett. 5: 3779-3782 (2003)).
В одном из аспектов изобретения, соединением акридиния является акридиний-9-карбоксамид. Методы получения акридиний-9-карбоксамидов описаны в публикациях Mattingly, J. Biolumin. Chemilumin. 6: 107-114 (1991); Adamczyk et al., J. Org. Chem. 63: 5636-5639 (1998); Adamczyk et al., Tetrahedron 55: 10899-10914 (1999); Adamczyk et al., Org. Lett. 1:779-781 (1999); Adamczyk et al., Bioconjugate Chem. 11:714-724 (2000); Mattingly et al., In Luminescence Biotechnology: Instruments and Applications; Dyke, K. V. Ed.; CRC Press: Boca Raton, pp. 77-105 (2002); Adamczyk et al., Org. Lett. 5: 3779-3782 (2003); и в патентах США № 5468646, 5543524 и 5783699 (которые во всей своей полноте вводятся в настоящее описание посредством ссылки, если они относятся к данному разделу).
Другим примером соединения акридиния является ариловый эфир акридиний-9-карбоксилата. Примером арилового эфира акридиний-9-карбоксилата формулы II является фторсульфонат 10-метил-9-(феноксикарбонил)акридиния (поставляемый компанией Cayman Chemical, Ann Arbor, MI). Методы получения ариловых эфиров акридиний-9-карбоксилата описаны в публикации McCapra et al., Photochem. Photobiol. 4: 1111-21 (1965); Razavi et al., Luminescence 15: 245-249 (2000); Razavi et al., Luminescence 15: 239-244 (2000); и в патенте США № 5241070 (которые во всей своей полноте вводятся в настоящее описание посредством ссылки, если они относятся к данному разделу). Такие ариловые эфиры акридиний-9-карбоксилата являются эффективными хемилюминесцентными индикаторами пероксида водорода, продуцируемого при окислении аналита по меньшей мере одной оксидазой, с точки зрения интенсивности сигнала и/или быстроты его передачи. Процесс хемилюминесцентного излучения, испускаемого ариловым эфиром акридиний-9-карбоксилата, протекает быстро, то есть менее чем за 1 секунду, тогда как процесс хемилюминесцентного излучения, испускаемого акридиний-9-карбоксамидом, протекает за более чем 2 секунды. Однако ариловый эфир акридиний-9-карбоксилата теряет свои хемилюминесцентные свойства в присутствии белка. Поэтому для передачи и детектирования сигнала белок должен отсутствовать. Методы разделения белков в образце или удаления этих белков из образца хорошо известны специалистам и такими методами являются, но не ограничиваются ими, ультрафильтрация, экстракция, осаждение, диализ, хроматография и/или гидролиз (см., например, Wells, High Throughput Bioanalytical Sample Preparation. Methods and Automation Strategies, Elsevier (2003)). Количество удаленного или выделенного белка из тест-образца может составлять приблизительно 40%, приблизительно 45%, приблизительно 50%, приблизительно 55%, приблизительно 60%, приблизительно 65%, приблизительно 70%, приблизительно 75%, приблизительно 80%, приблизительно 85%, приблизительно 90% или приблизительно 95%. Более подробное описание арилового эфира акридиний-9-карбоксилата и его применения приводится в заявке на патент США № 11/697835, поданной 9 апреля 2007 г. Ариловые эфиры акридиний-9-карбоксилата могут быть растворены в любом подходящем растворителе, таком как дегазированный безводный N,N-диметилформамид (ДМФ) или водный холат натрия.
w. Линкерная последовательность и линкерная пептидная последовательность
Термины «линкерная последовательность» и «линкерная пептидная последовательность» означают природную или искусственную полипептидную последовательность, присоединенную к одной или более представляющим интерес полипептидным последовательностям (например, к полноразмерной последовательности, ее фрагменту и т.п.). Термин «присоединенный» относится к связыванию линкерной последовательности с представляющей интерес полипептидной последовательностью. Такие полипептидные последовательности предпочтительно, соединены одной или более пептидными связями. Линкерные последовательности могут иметь длину приблизительно от 4 до 50 аминокислот. Длина линкерной последовательности, предпочтительно, составляет приблизительно от 6 до 30 аминокислот. Природные линкерные последовательности могут быть модифицированы посредством аминокислотных замен, добавлений или делеций с получением искусственных линкерных последовательностей. Репрезентативными линкерными последовательностями являются, но не ограничиваются ими, (i) гистидиновые (His) метки, такие как 6 х His-метки (SEQ ID NO: 148), которые имеют аминокислотную последовательность HHHHHH (SEQ ID NO: 148) и которые используются в качестве линкерных последовательностей для облегчения выделения и очистки представляющих интерес полипептидов и антител; (ii) сайты расщепления энтерокиназой, подобные His-меткам, которые могут быть использованы для выделения и очистки представляющих интерес белков и антител. В большинстве случаев, сайты расщепления энтерокиназой используются вместе с His-метками для выделения и очистки представляющих интерес белков и антител. Различные сайты расщепления энтерокиназой известны специалистам. Репрезентативными сайтами расщепления энтерокиназой являются, но не ограничиваются ими, аминокислотная последовательность DDDDK (SEQ ID NO: 149) и ее производные (например, ADDDDK (SEQ ID NO: 150) и т.п.); и (iii) смешанные последовательности, которые могут быть использованы для связывания или соединения вариабельных областей легкой и/или тяжелой цепи одноцепочечных фрагментов антител. Примеры других линкерных последовательностей можно найти в публикации Bird et al., Science 242: 423-426 (1988); Huston et al., PNAS USA 85: 5879-5883 (1988); и McCafferty et al., Nature 348: 552-554 (1990). Линкерные последовательности могут быть также модифицированы для сообщения им дополнительных функций, таких как способность связываться с лекарственными средствами или с твердыми носителями. В соответствии с настоящим изобретением, моноклональное антитело может содержать, например, линкерную последовательность, такую как His-метка, сайт расщепления энтерокиназой или то и другое.
x. Поливалентный связывающийся белок
Используемый здесь термин «поливалентный связывающийся белок» означает связывающийся белок, содержащий два или более антигенсвязывающих сайтов (также называемых здесь «антигенсвязывающими доменами»). Поливалентный связывающийся белок, предпочтительно, конструируют так, чтобы он имел три или более антигенсвязывающих сайта и, по существу, не являлся природным антителом. Термин «мультиспецифический связывающийся белок» означает связывающийся белок, который может связываться с двумя или более родственными или неродственными мишенями, включая связывающийся белок, способный связываться с двумя или более различными эпитопами одной и той же молекулы-мишени.
y. Предварительно определенное пороговое значение и предварительно определенный уровень
«Предварительно определенное пороговое значение» и «предварительно определенный уровень» означают, в основном, величину аналитического порогового значения, которая используется для оценки результатов диагностической/прогностической/терапевтической эффективности путем сравнения результатов анализа с предварительно определенным пороговым значением/уровнем, где предварительно определенное пороговое значение/предварительно определенный уровень связан или ассоциирован с различными клиническими параметрами (например, тяжестью заболевания, прогрессированием заболевания/отсутствием прогрессирования заболевания/положительной динамикой заболевания и т.п.). В настоящей заявке приводятся репрезентативные предварительно определенные уровни. Однако хорошо известно, что эти пороговые значения могут варьироваться в зависимости от природы иммуноанализа (например, от используемых антител и т.п.). Кроме того, средний специалист в данной области может внести некоторые изменения в приведенное описание изобретения для его применения в других иммуноанализах и на основе этого описания может получить пороговые величины, специфичные для указанных других иммуноанализов. Поскольку точная величина предварительно определенного порогового значения/уровня может варьироваться в различных анализах, то обычно проводят корреляцию, как описано в настоящей заявке, если это необходимо.
z. Реагент для предварительной обработки
«Реагент для предварительной обработки», например, реагент для лизиса, преципитации и/или солюбилизации, используемый в диагностическом анализе, описанном в настоящей заявке, представляет собой реагент, который способствует лизису любых клеток и/или солюбилизации любого аналита, присутствующих в тест-образце. Как описано в настоящей заявке, предварительная обработка не является обязательной для всех образцов. В частности, солюбилизация аналита (то есть RGMa (такой как мембрано-связанная RGMa, растворимая RGMa, фрагменты мембрано-связанной RGMa, фрагменты растворимой RGMa, варианты RGMa (мембрано-связанной или растворимой RGMa) или любых их комбинаций)) может приводить к высвобождению аналита из любых эндогенных связывающихся белков, присутствующих в образце. Реагент для предварительной обработки может быть гомогенным (не требующим проведения стадии разделения) или гетерогенным (требующим проведения стадии разделения). Использование гетерогенного реагента для предварительной обработки позволяет удалять из тест-образца любые осажденные белки, связывающиеся с аналитом, после чего может быть проведена следующая стадия анализа. Реагент для предварительной обработки может содержать, но необязательно: (a) один или более растворителей и одну или более солей, (b) один или более растворителей, одну или более солей и один или более детергентов, (c) детергент, (d) детергент и соль или (e) любой реагент или комбинацию реагентов, подходящих для лизиса клеток и/или солюбилизации аналита.
аа. Реагенты контроля качества
Термин «реагенты контроля качества», используемый в связи с описанными здесь иммуноанализами и наборами, включает, но не ограничивается ими, калибровочные маркеры, контроль и наборы тест-соединений для определения чувствительности. «Калибровочный маркер» или «стандарт» (например, один или несколько, то есть множество) обычно используются для построения калибровочных (стандартных) кривых интерполяции концентрации аналита, такого как антитело или аналит. Альтернативно, может быть использован один калибровочный маркер, который имеет величину, близкую к предварительно определенному положительному/отрицательному пороговому значению. Множество калибровочных маркеров (то есть более чем один калибровочный маркер или различные количества калибровочного(ых) маркера(ов)) могут быть использованы в комбинации друг с другом и составляют «набор тест-соединений для определения чувствительности».
bb. Рекомбинантное антитело и рекомбинантные антитела
Термины «рекомбинантное антитело» и «рекомбинантные антитела» означают антитела, полученные в одну или более стадий, включая клонирование последовательностей нуклеиновой кислоты, кодирующих полноразмерные моноклональные антитела, или часть одного или более моноклональных антител в соответствующий экспрессионный вектор рекомбинантными методами с последующей экспрессией антитела в соответствующей клетке-хозяине. Такими антителами являются, но не ограничиваются ими, рекомбинантно продуцированные моноклональные антитела, химерные антитела, гуманизованные антитела (полностью или частично гуманизованные), мультиспецифические или поливалентные структуры, образованные из фрагментов антител, бифункциональные антитела, гетероконъюгаты Ab, DVD-Ig® и другие антитела, описанные здесь в (i). (Иммуноглобулины с двумя вариабельными доменами и методы их получения описаны в публикации Wu, C, et al., Nature Biotechnology, 25: 1290-1297 (2007)). Используемый здесь термин «бифункциональное антитело» означает антитело, содержащее первую ветвь, обладающую специфичностью к одному антигенсвязывающему сайту и вторую ветвь, обладающую специфичностью к другому антигенсвязывающему сайту, то есть эти бифункциональные антитела обладают двойной специфичностью.
cc. Образец, тест-образец и образец, взятый у пациента
Используемые здесь термины «образец», «тест-образец» и «образец, взятый у пациента» являются синонимами. Образцы, такие как проба мочи, сыворотки, плазмы, амниотической жидкости, цереброспинальной жидкости, образцы клеток плаценты или ткани, эндотелиальных клеток, лейкоцитов или моноцитов могут быть использованы непосредственно в том виде, в котором они были взяты у пациента, либо они могут быть предварительно обработаны, например, путем фильтрации, дистилляции, экстракции, концентрирования, центрифугирования инактивации нежелательных компонентов, добавления реагентов и т.п. для изменения типа образца в определенной степени, как обсуждается в настоящей заявке или изменения типа образца каким-либо другим образом, как известно специалистам.
dd. Серии калибровочных композиций
Термин «серии калибровочных композиций» означает множество композиций, содержащих Сys-CRGMa в известной концентрации, где каждая из этих композиций отличается от других композиций этой серии концентрацией Cys-CRGMa.
ee. Твердая фаза
Термин «твердая фаза» означает любое вещество, которое является нерастворимым, или которое может быть сделано нерастворимым путем проведения соответствующей реакции. Твердая фаза может быть выбрана так, чтобы она обладала природной способностью захватывать и иммобилизовать агент для захвата. Альтернативно, твердая фаза может быть присоединена к линкерному агенту, обладающему способностью захватывать и иммобилизовать агент для захвата. Линкерный агент может включать, например, заряженное вещество, имеющее заряд, противоположный заряду самого линкерного агента, или заряженное вещество, конъюгированное с агентом для захвата. Вообще говоря, линкерным агентом может быть любой партнер по связыванию (предпочтительно, специфический), который иммобилизован на твердой фазе (присоединен к твердой фазе) и обладает способностью иммобилизовать агент для захвата посредством реакции связывания. Линкерный агент обладает способностью опосредованно связывать агент для захвата с твердой фазой еще до проведения анализа или во время проведения анализа. Твердой фазой могут быть, например, пластик, дериватизированный пластик, магнитный или не-магнитный металл, стекло или кремний, включая, например, тест-пробирку, лунку микротитрационного планшета, листы, сферы, микрочастицы, чипы и другие материалы, известные специалистам.
ff. Специфическое связывание
Используемые здесь термины «специфическое связывание» или «специфически связывающийся» могут означать взаимодействие антитела, белка или пептида со второй химической молекулой, где такое взаимодействие зависит от присутствия конкретной структуры (например, антигенной детерминанты или эпитопа) на химической молекуле, так, например, антитело распознает специфическую белковую структуру, а не белки в целом и связывается с этой структурой. Если антитело является специфичным к эпитопу «A», то присутствие молекулы, содержащей эпитоп A (или свободный немеченный A), в реакционной смеси, включающей меченный «A» и антитело, будет приводить к снижению количества меченного A, связанного с антителом.
gg. Партнер по специфическому связыванию
«Партнер по специфическому связыванию» представляет собой член специфически связывающейся пары. Специфически связывающаяся пара содержит две различных молекулы, каждая из которых специфически связывается друг с другом по химическому или физическому механизму. Поэтому, помимо специфически связывающейся пары, используемой в общих иммуноанализах, такой как антиген-антитело, могут быть использованы и другие специфически связывающиеся пары, которые могут включать биотин и авидин (или стерптавидин), углеводы и лектины, комплементарные нуклеотидные последовательности, молекулы эффекторов и рецепторов, кофакторы и ферменты, ферменты и ингибиторы ферментов и т.п. Кроме того, специфически связывающиеся пары могут включать члены, которые являются аналогами исходных специфически связывающихся членов, таких как, например, аналит-аналог. Иммунореактивными специфически связывающимися членами являются антигены, фрагменты антигена и антитела, включая моноклональные и поликлональные антитела, а также их комплексы и фрагменты, независимо от того, являются ли они выделенными или рекомбинантно продуцированными.
hh. Условия жесткости
Используемый здесь термин «условия жесткости» относится к гибридизации с ДНК, связанной с фильтром в 6 х хлориде натрия/цитрате натрия (SSC), приблизительно при 45°C с последующими одной или более промывками в 0,2×SSC/0,1% ДСН приблизительно при 50-65°C. Термин «в условиях высокой жесткости» относится к гибридизации с нуклеиновой кислотой, связанной с фильтром, в 6×SSC приблизительно при 45°C с последующими одной или более промывками в 0,1×SSC/0,2% ДСН приблизительно при 68°C или в других условиях жесткости. См., например, Ausubel, F. M. et al., eds., 1989, Current Protocols in Molecular Biology, Vol.1, Green Publishing Associates, Inc. andJohn Wiley & Sons, Inc., New York at pages 6.3.1-6.3.6 and2.10.3.
ii. Лечение или терапия
Используемые здесь термины «лечить», «лечение» или «терапия» являются синонимами и означают полное излечение заболевания, ослабление симптомов заболевания или ингибирование прогрессирования заболевания или одного или более симптомов рассматриваемого заболевания. В зависимости от состояния индивидуума, этот термин может также означать предупреждение заболевания, а также предупреждение начала развития заболевания или предупреждение симптомов, ассоциированных с таким заболеванием. Лечение может быть осуществлено способами, применяемыми для лечения острого или хронического заболевания. Этот термин также означает ослабление тяжести заболевания или симптомов, ассоциированных с таким заболеванием, до начала его осложнения. Такое предупреждение заболевания или снижение его тяжести до начала его осложнений означает введение антитела или фармацевтической композиции согласно изобретению индивидууму, которое осуществляют заранее, то есть не во время появления осложнений заболевания. Термин «предупреждение» также относится к предупреждению рецидива заболевания или одного или более симптомов, ассоциированных с таким заболеванием. Термины «лечение» и «терапия» означают сам процесс лечения, где термин «лечение» определен выше.
jj. Агент для мечения
Используемый здесь термин «агент для мечения» означает аналит или фрагмент аналита, конъюгированный с меткой, такой как молекула Cys-CRGMa, конъюгированная с флуоресцентной молекулой, где указанный аналит, конъюгированный с меткой, может эффективно конкурировать с аналитом за сайты на антителе, специфичном к аналиту.
kk. Вариант
Используемый здесь термин «вариант» означает пептид или полипептид, отличающиеся своей аминокислотной последовательностью, что обусловлено инсерцией, делецией или консервативной заменой аминокислот, но при этом сохраняющие по меньшей мере одну биологическую активность. Репрезентативными примерами «биологической активности» являются способность связываться со специфическим антителом или стимулировать иммунный ответ. Используемый здесь «вариант» означает белок, аминокислотная последовательность которого, по существу идентична аминокислотной последовательности сравниваемого белка, но который сохраняет по меньшей мере одну биологическую активность. Консервативная аминокислотная замена, то есть замена одной аминокислоты другой аминокислотой с аналогичными свойствами (например, гидрофильностью, количеством и распределением заряженных областей) может быть легко осуществлена специалистом, поскольку обычно такая замена не приводит к значительным изменениям. Такие незначительные изменения могут быть, отчасти идентифицированы путем определения гидропатического индекса аминокислот, известного специалистам (см., например, Kyte et al., J. Mol. Biol. 157: 105-132 (1982)). Гидропатический индекс аминокислот определяют, исходя из их гидрофобности и заряда. Специалистам в данной области известно, что аминокислоты с аналогичными гидропатическими индексами могут быть заменены с сохранением функции белка. В одном из аспектов изобретения аминокислоты, имеющие гидропатические индексы ±2, являются замененными. Гидрофильность аминокислот может быть также использована для выявления замен, которые должны приводить к получению белков, сохраняющих свою биологическую функцию. Определение гидрофильности аминокислот в данном пептиде позволяет вычислить наибольшую локальную среднюю гидрофильность этого пептида, которая, как сообщалось, является ценным параметром, хорошо коррелирующим с антигенностью и иммуногенностью (см., например, патент США № 4554101, который во всей своей полноте вводится в настоящее описание посредством ссылки). Замена аминокислот, имеющих аналогичные индексы гидрофильности, может приводить к получению пептидов, сохраняющих биологическую активность, например иммуногенность, как известно специалистам. Каждая аминокислота может быть заменена аминокислотой, имеющей величину гидрофильности в пределах ±2. На индекс гидрофобности и на величину гидрофильности аминокислот влияет конкретная боковая цепь этой аминокислоты. Согласно этому наблюдению, аминокислотные замены, совместимые с биологической функцией, зависят от относительного сходства аминокислот, а в частности, от боковых цепей этих аминокислот, на что указывают гидрофобность, гидрофильность, заряд, размер и другие свойства. Термин «вариант» может быть также использован для описания реагирующего с антигеном фрагмента анти-RGMa антитела, который отличается от соответствующего фрагмента анти-RGMa антитела аминокислотной последовательностью, но сохраняет способность реагировать с антигеном и может конкурировать с соответствующим фрагментом анти-RGMa антитела за связывание с RGMa. Термин «вариант» может быть также использован для описания полипептида или его фрагмента, который был подвергнут альтернативному процессингу, такому как протеолиз, фосфорилирование или другая посттрансляционная модификация, но который все еще сохраняет свою реактивность по отношению к антигену.
ll. Вектор
Используемый здесь термин «вектор» означает молекулу нуклеиновой кислоты, способную осуществлять транспорт другой нуклеиновой кислоты, с которой он был связан. Одним из типов вектора является «плазмида», представляющая собой кольцевую двухцепочечную ДНК-петлю, в которую могут быть лигированы дополнительные ДНК-сегменты. Другим типом вектора является вирусный вектор, в вирусный геном которого могут быть лигированы дополнительные ДНК-сегменты. Некоторые векторы обладают способностью автономно реплицироваться в клетке-хозяине, в которую они были встроены (например, бактериальные векторы, имеющие бактериальный ориджин репликации и эписомные векторы млекопитающих). Другие векторы (например, не-эписомные векторы млекопитающих) могут быть интегрированы в геном клетки-хозяина после их введения в эту клетку-хозяина, а затем они могут реплицироваться вместе с геномом хозяина. Кроме того, некоторые векторы способны направлять экспрессию генов, к которым они функционально присоединены. Такие векторы называются здесь «рекомбинантными экспрессионными векторами» (или просто «экспрессионными векторами»). В общих чертах, экспрессионные векторы, применяемые в методах рекомбинантных ДНК, часто присутствуют в форме плазмид. Термины «плазмида» и «вектор» могут быть синонимами, поскольку плазмида наиболее часто используется в качестве вектора. Однако в настоящем изобретении могут быть использованы и другие формы экспрессионных векторов, такие как вирусные векторы (например, дефектные по репликации ретровирусы, аденовирусы и аденоассоциированные вирусы), которые имеют эквивалентные функции. В соответствии с этим, в настоящем изобретении могут быть также использованы РНК-варианты этих векторов (включая вирусные РНК-векторы).
При указании используемых здесь численных интервалов предусматривается, что каждое промежуточное значение в данном интервале также непосредственно рассматривается с той же степенью точности. Так, например, в интервал значений 6-9, помимо самих значений 6 и 9, также входят непосредственно рассматриваемые значения 7 и 8, а в интервал 6,0-7,0, значения 6,0, 6,1, 6,2, 6,3, 6,4, 6,5, 6,6, 6,7, 6,8, 6,9 и 7,0.
2. Анти-RGMa антитела
Настоящее изобретение относится к антителам, которые могут быть использованы в способах лечения заболеваний и расстройств, ассоциированных с дегенерацией нейритов. Были отобраны некоторые описанные здесь антитела, которые связываются с RGMa, но обладают минимальной способностью или вообще не обладают способностью реагировать с молекулой регуляции отталкивания с («RGMc»). Так, например, см. таблицу 4, где моноклональное антитело AE12-1 и его варианты, полученные от PROfusion (AE12-1F, AE12-1H, AE12-1L, AE12-1V, AE12-1I, AE12-1K и AE12-1Y), обладают RGMa-нейтрализующей активностью, но не обладают способностью (детектируемой на низком уровне) перекрестно реагировать с RGMc. Поскольку антитела против RGMa часто перекрестно реагируют с RGMc и, при высоких внутривенных дозах могут способствовать аккумуляции железа в гепатоцитах, то специфическое связывание описанных здесь антител против RGMa дает терапевтический эффект. Кроме того, высокая селективность этих антител позволяет использовать эти антитела для лечения в широких «окнах» или диапазонах терапевтических доз.
a. RGMa
Впервые человеческую молекулу RGMa, которая может существовать в виде белка из 450 аминокислот с предсказанным N-концевым сигнальным пептидом из 47 аминокислот и C-концевого GPI-связывающего сигнала, было предложено использовать для регуляции направления аксонов сетчатки путем связывания этой молекулы с неогенином, то есть с трансмембранным белком, который является также рецептором для нетринов, которые секретируют молекулы, играющие определенную роль в развитии нейронов и в жизнеспособности клеток. Было показано, что RGMa, помимо регуляции направления аксонов сетчатки, ингибирует рост аксонов у взрослых крыс. См. Yamashita et al., Current Opinion in Neurobiology (2007)17: 1-6. В соответствии с этими механизмами, уровень экспрессии RGMa повышается после поражения спинного мозга и в это время, ингибирование RGMa будет способствовать росту аксонов. См. Kitayama et al., PLoS One, (2011) Vol.6 (9), pages 1-9; и Hata et al., J. Cell Biol. (2006)173:47-58. Уровень экспрессии RGMa также повышается на участке поражения и в рубцующейся ткани человека, страдающего фокальной ишемией коры головного мозга или человека с травматическими поражениями головного мозга. См. Yamashita et al., Current Opinion in Neurobiology (2007)17: 1-6; Schwab et al., Arch Neurol (2005)22:2134-2144; и Muramatsu et al., Nat. Medicine (2011) 17:488-94.
RGMa может иметь следующую аминокислотную последовательность:

RGMa может представлять собой фрагмент или вариант SEQ ID NO: 65.
Фрагмент RGMa может иметь длину в 5-425 аминокислот, 10-400 аминокислот, 50-350 аминокислот, 100-300 аминокислот, 150-250 аминокислот, 200-300 аминокислот или 75-150 аминокислот. Этот фрагмент может содержать непрерывно следующие друг за другом аминокислоты последовательности SEQ ID NO: 65.
Фрагмент RGMa может иметь следующую аминокислотную последовательность:

которая соответствует аминокислотам 47-168 SEQ ID NO: 65. Фрагмент RGMa может представлять собой фрагмент последовательности SEQ ID NO: 66. Фрагмент RGMa может быть вариантом последовательности SEQ ID NO: 66. Фрагмент RGMa может иметь следующую аминокислотную последовательность RGMa: PCKILKCNSEFWSATSGSHAPAS (SEQ ID NO: 74).
RGMa может присутствовать в виде клеточной мембраносвязанной формы и/или в растворимой форме.
b. RGMa-распознающее антитело
Указанное антитело представляет собой антитело, которое связывается с RGMa, с его фрагментом или вариантом. Указанным антителом может быть фрагмент анти-RGMa антитела или вариант или производное такого антитела. Антителом может быть поликлональное или моноклональное антитело. Таким антителом может быть химерное антитело, одноцепочечное антитело, аффинно зрелое антитело, человеческое антитело, гуманизованное антитело, полностью человеческое антитело или фрагмент антитела, такой как Fab-фрагмент или их смеси. Фрагменты антител или их производные могут содержать F(ab')2-, Fv- или scFv-фрагменты. Производные антител могут продуцироваться пептидо-миметиками. Кроме того, описанные методы продуцирования одноцепочечных антител могут быть адаптированы для продуцирования одноцепочечных антител.
Человеческие антитела могут быть получены методами фагового представления, либо они могут быть выделены у трансгенных мышей, экспрессирующих гены человеческого иммуноглобулина. Человеческое антитело может быть продуцировано в результате иммунного ответа у человека in vivo и такое антитело является выделенным. См., например, Funaro et al., BMC Biotechnology, 2008(8): 85. Поэтому такое антитело может представлять собой продукт репертуара человеческих антител, но не антител животного. Поскольку это антитело происходит от человека, то риск возможности его реагирования с аутоантигенами может быть минимизирован. Альтернативно, для отбора и выделения человеческих анти-RGMa антител могут быть применены стандартные технологии, такие как методы получения библиотек дрожжевого представления. Так, например, для отбора человеческих анти-RGMa антител могут быть использованы библиотеки природных человеческих одноцепочечных вариабельных фрагментов (scFv). Для экспрессии человеческих антител могут быть использованы трансгенные животные.
Гуманизованными антителами могут быть молекулы антител, происходящие от не-человеческих антител, которые связываются с нужным антигеном и имеют одну или более гипервариабельных областей (CDR), не происходящих от человека и каркасных областей, происходящих от молекулы человеческого иммуноглобулина.
Указанное антитело отличается от известных антител тем, что оно обладает другой(ими) биологической(ими) функцией(ями), известной(ыми) специалистам. Так, например, антитела согласно изобретению не только распознают RGMa и связываются с RGMa, но также обладают и дополнительной биологической активностью, например, способностью ослаблять клинические признаки заболеваний, ассоциированных с дегенерацией нейритов.
Антитело может специфически связываться с RGMa. RGMa-специфическое антитело может содержать SEQ ID NO: 1 и 5; SEQ ID NO: 2-4 и 6-8; SEQ ID NO: 2-4, 6, 7 и 67; SEQ ID NO: 2-4, 6, 7 и 68; SEQ ID NO: 2-4, 6, 7 и 69; SEQ ID NO: 2-4, 6, 7 и 70; SEQ ID NO: 2-4, 6, 7 и 71; SEQ ID NO: 2-4, 6, 7 и 72; или SEQ ID NO: 2-4, 6, 7 и 73. Антитело может связываться с SEQ ID NO: 65, SEQ ID NO: 66, SEQ ID NO: 74 или с их фрагментами или вариантами. Это антитело может распознавать эпитоп, присутствующий на описанном выше полипептиде RGMa или его варианте, и специфически связываться с этим эпитопом. Эпитоп может представлять собой SEQ ID NO: 66, SEQ ID NO: 74 или их вариант.
(1) Связывающие свойства антитела
Антитело может иммуноспецифически связываться с RGMa (SEQ ID NO: 65), SEQ ID NO: 66, SEQ ID NO: 74, с его фрагментом или вариантом и может иметь koff (или kd) по меньшей мере 1,0×10-3с-1, по меньшей мере 1,0×10-4с-1, по меньшей мере 1,0×10-5с-1, по меньшей мере 1,0×10-6с-1, либо он может иметь koff/(или kd) в пределах от 1,0×10-3с-1 до 1,0×10-6с-1, от 1,0×10-3с-1 до 1,0×10-5с-1 или от 1,0×10-3с-1 до 1,0×10-4с-1. Этот фрагмент может представлять собой последовательность SEQ ID NO: 66 или SEQ ID NO: 74.
Антитело может иммуноспецифически связываться с RGMa (SEQ ID NO: 65), SEQ ID NO: 66, SEQ ID NO: 74, с его фрагментом или вариантом и может иметь kon (или ka) по меньшей мере 2,4×104 приблизительно 2,5×104 M-1с-1, по меньшей мере приблизительно 3,3×104 M-1с-1, по меньшей мере приблизительно 5,0×104 M-1с-1, по меньшей мере приблизительно 1,25×106 M-1с-1, по меньшей мере приблизительно 1,35×106 M-1с-1, по меньшей мере приблизительно 1,0×106 M-1с-1, по меньшей мере приблизительно 1,0×107 M-1с-1, либо он может иметь kon (или ka) приблизительно в пределах от 5,0×104 M-1с-1 до 1,0×108 M-1с-1 приблизительно в пределах от 3,3×104 M-1с-1 до 1,0×109 M-1с-1, приблизительно в пределах от 2,5×104 M-1с-1 до 1,25×106 M-1с-1, приблизительно в пределах от 2,4×104 M-1с-1 до 1,35×107 M-1с-1. Этот фрагмент может представлять собой последовательность SEQ ID NO: 66 или SEQ ID NO: 74.
(2) Структура антитела
(a) CDR тяжелой и легкой цепей
Антитело может иммуноспецифически связываться с молекулой RGMa (SEQ ID NO: 65, SEQ ID NO: 66, SEQ ID NO: 74), ее фрагментом или вариантом и содержит вариабельную область тяжелой цепи и/или вариабельную область легкой цепи, как показано в таблице 1. Антитело может иммуноспецифически связываться с молекулой RGMa, ее фрагментом или вариантом и содержит одну иди более последовательностей CDR тяжелой цепи или легкой цепи, как показано в таблице 1. Легкая цепь антитела может представлять собой цепь каппа или лямбда. См., например, таблицу 1.
Настоящее изобретение относится к выделенной нуклеиновой кислоте, кодирующей антитело, которое иммуноспецифически связывается с молекулой RGMa, ее фрагментом или вариантом. Выделенная нуклеиновая кислота может содержать нуклеотидную последовательность, которая гибридизуется в условиях высокой жесткости с молекулой нуклеиновой кислоты, которая кодирует антитело, содержащее последовательности CDR тяжелой цепи или легкой цепи, как показано в таблице 1.
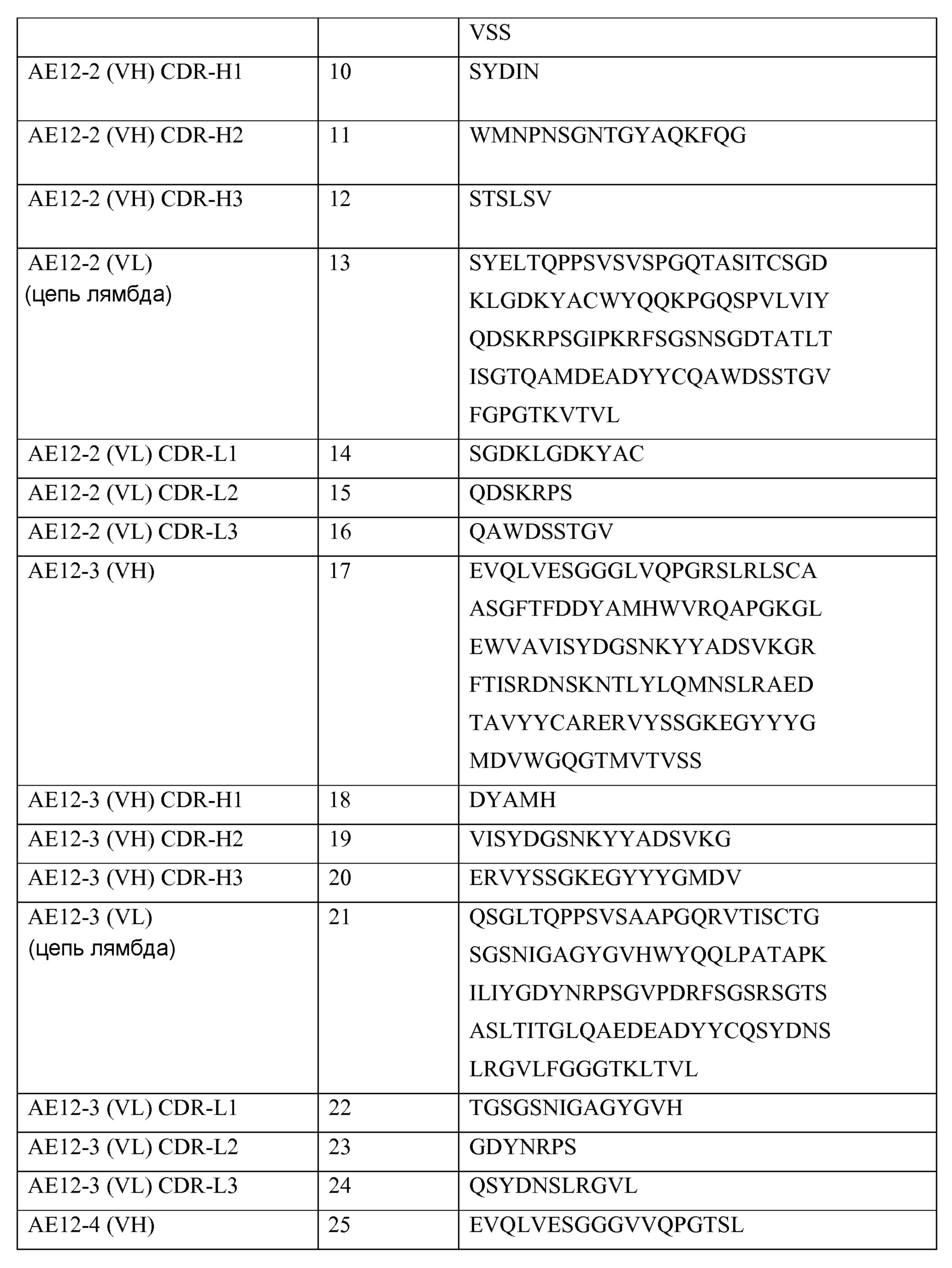
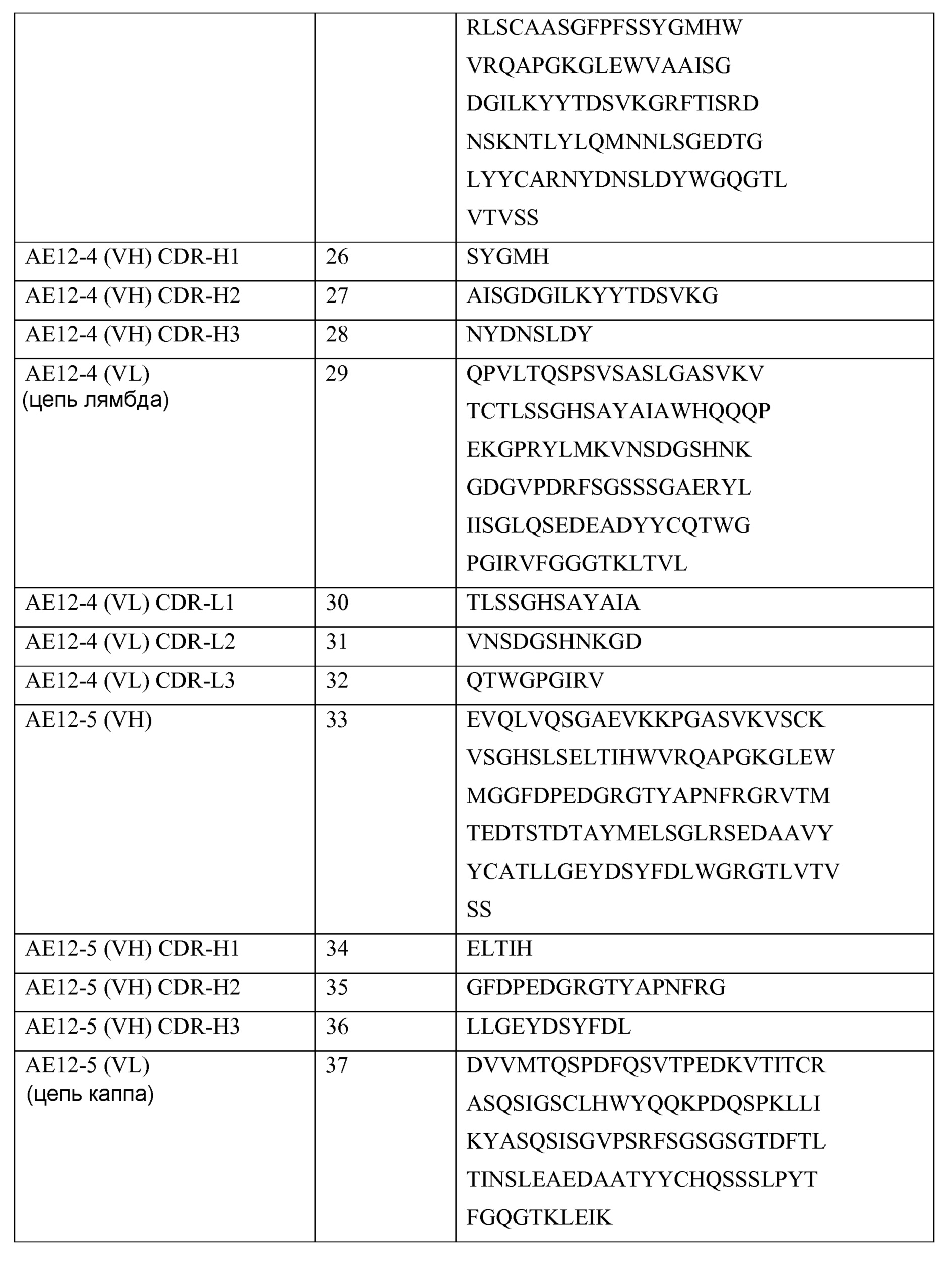
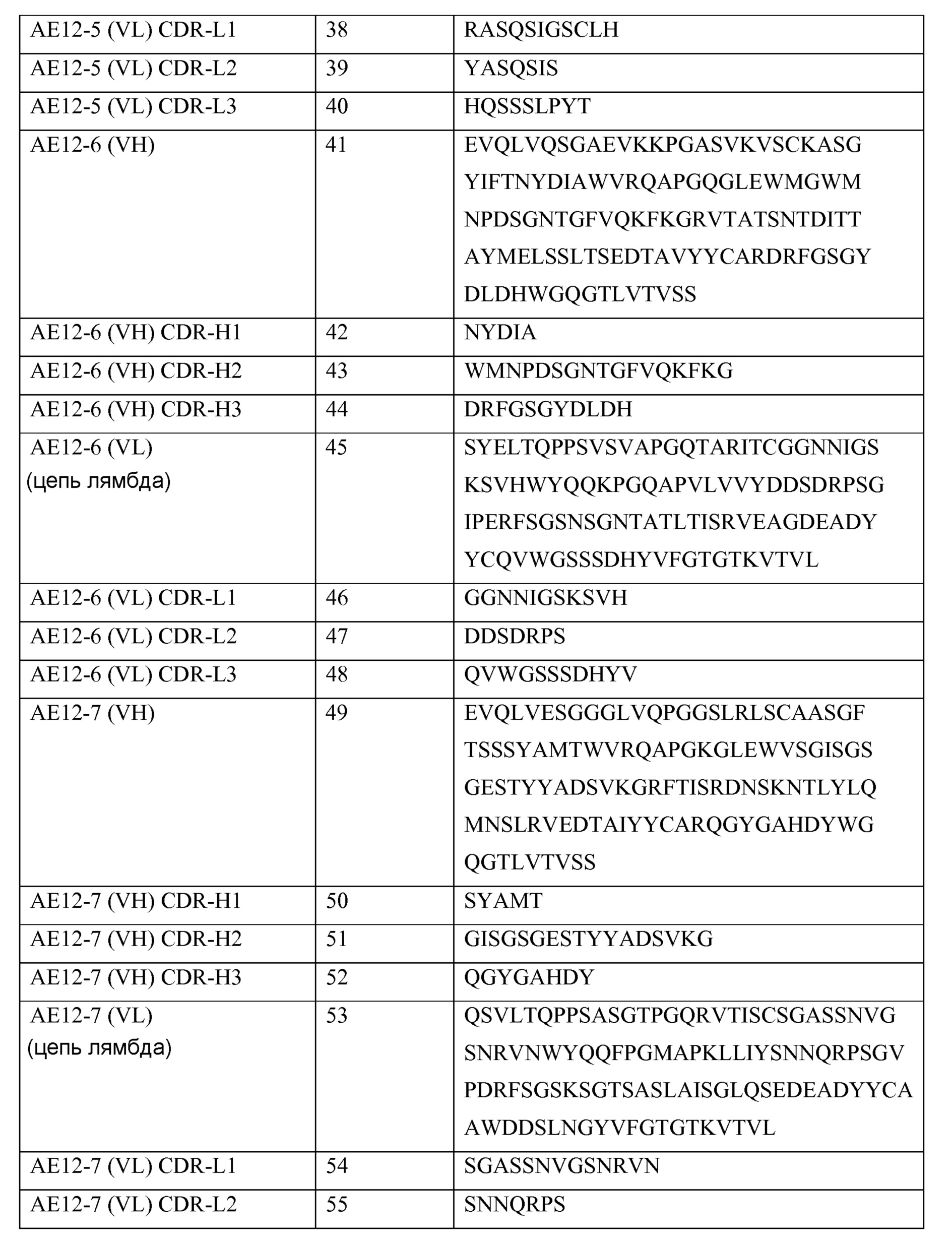
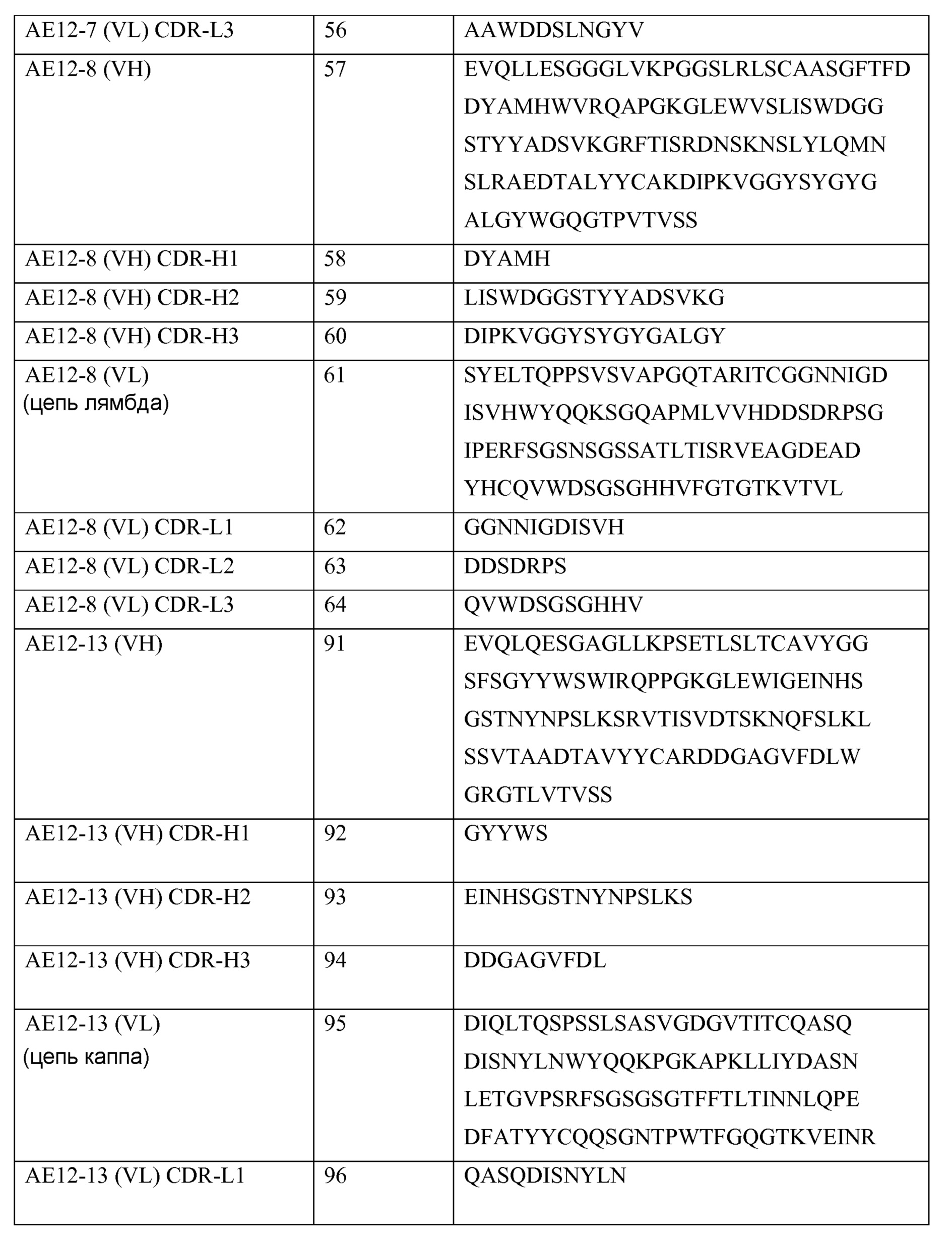
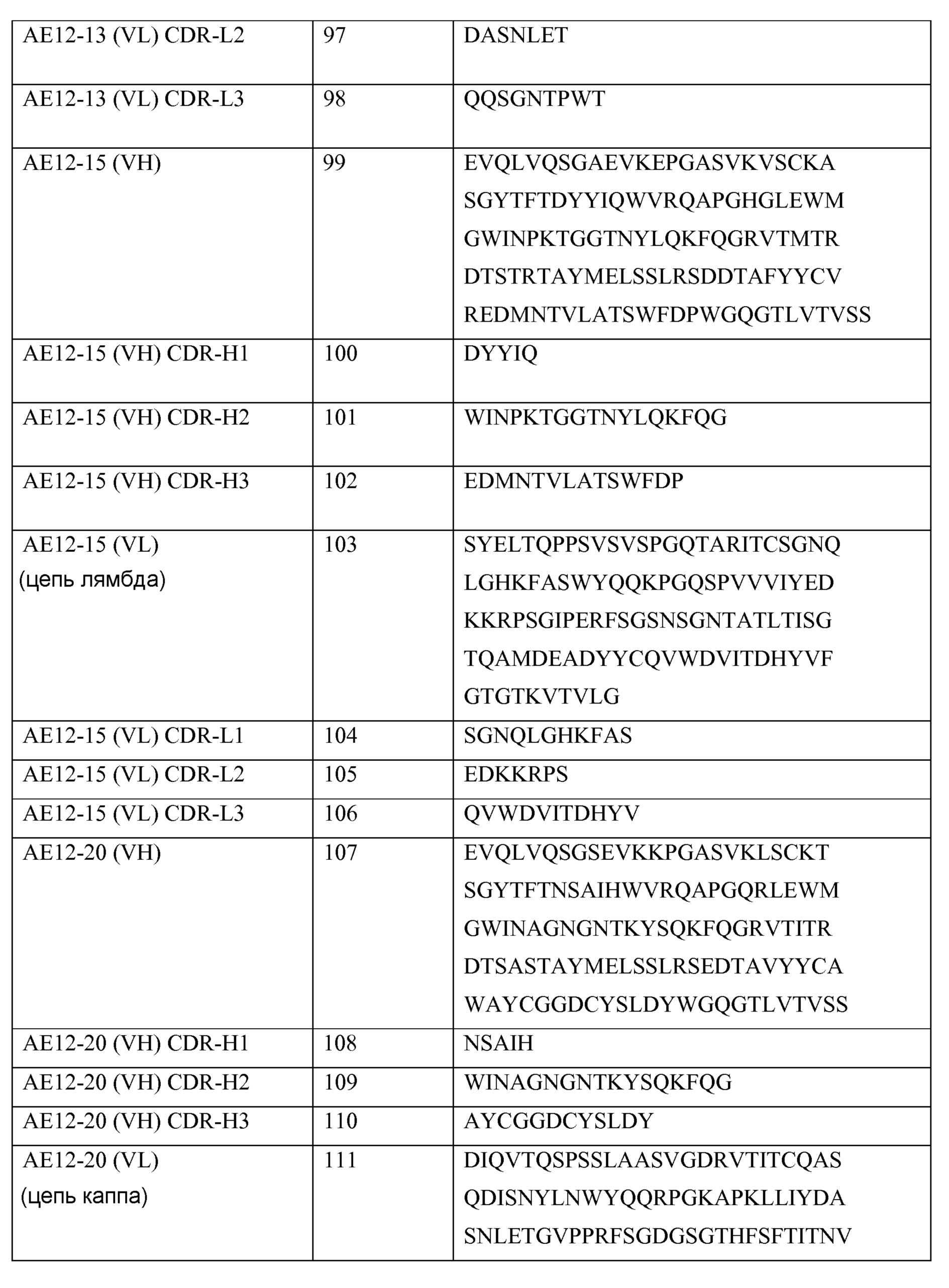
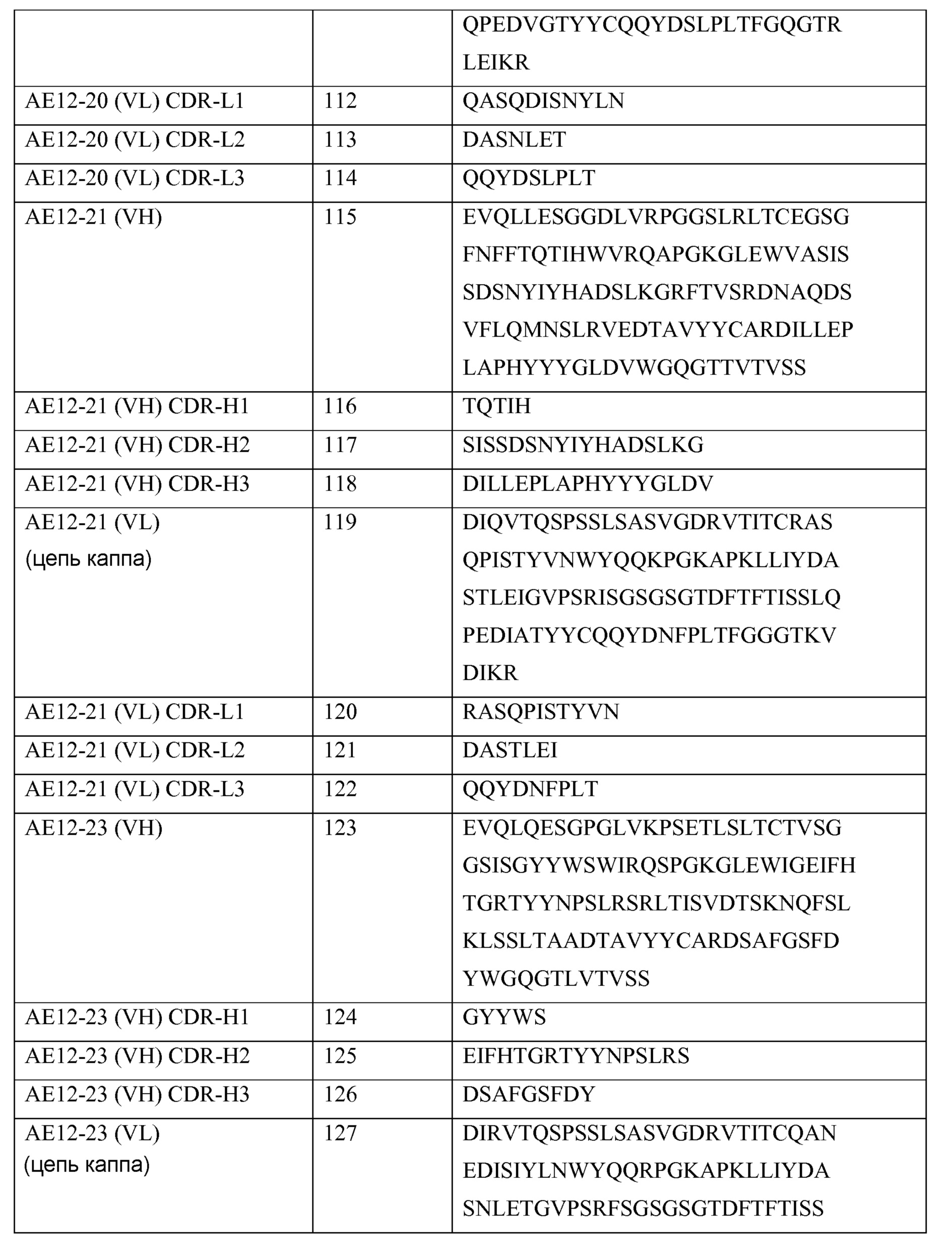
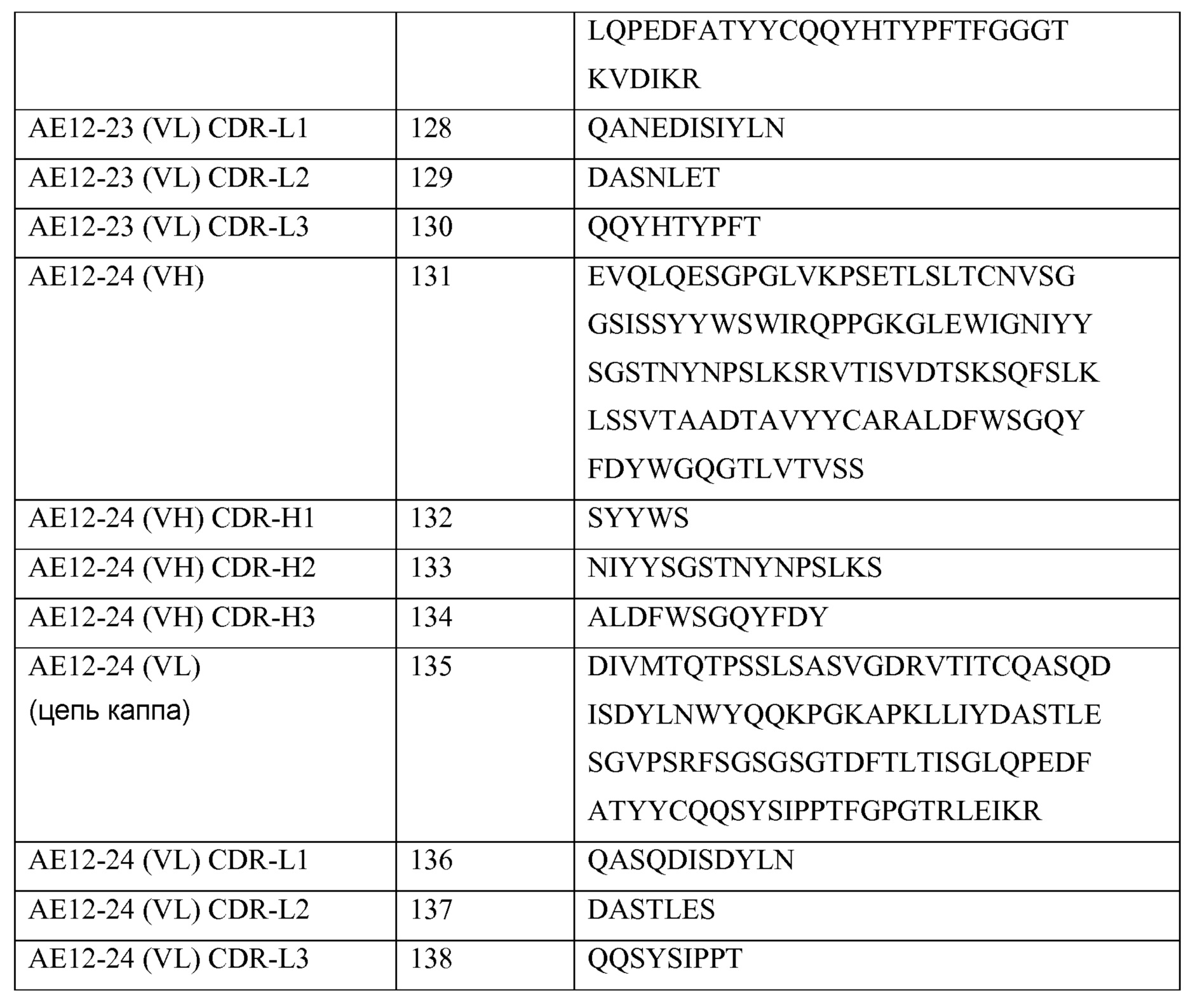
Антитело или его вариант или производное могут содержать одну или более аминокислотных последовательностей, которые более чем на 95%, 90%, 85%, 80%, 75%, 70%, 65%, 60%, 55% или 50% идентичны одной или более SEQ ID NO: 1-64 и 67-73. Антитело или его вариант или производное могут кодироваться одной или более последовательностями нуклеиновой кислоты, которые более чем на 95%, 90%, 85%, 80%, 75%, 70%, 65%, 60%, 55% или 50% идентичны одной или более SEQ ID NO: 1-64 и 67-73. Идентичность и гомология полипептидов могут быть определены, например, с помощью алгоритма, описанного в публикации Wilbur, W.J. и Lipman, D. J. Proc. Natl. Acad. Sci. USA 80, 726-730 (1983). Описанное здесь антитело или его вариант или производное могут кодироваться нуклеиновой кислотой, которая гибридизуется в жестких условиях с комплементом одной или более SEQ ID NO: 3-42. Описанное здесь антитело или его вариант или производное могут кодироваться нуклеиновой кислотой, которая гибридизуется в условиях высокой жесткости с комплементом одной или более нуклеиновых кислот, кодирующих одну или более SEQ ID NO: 1-64 и 67-73.
Антитело может содержать SEQ ID NO: 8, где остаток Cys последовательности SEQ ID NO: 8 заменен другой аминокислотой. Антитело может содержать SEQ ID NO: 1 и 5 или 2-4 и 6-8, где остаток Cys последовательности SEQ ID NO: 8 заменен другой аминокислотой или где остаток Cys в положении 91 SEQ ID NO: 5 заменен другой аминокислотой. Остаток Cys в положении 91 SEQ ID NO: 5 может быть заменен, например, фенилаланином, гистидином, лейцином, валином, изолейцином, лизином или тирозином. Остаток Cys последовательности SEQ ID NO: 8 может быть заменен фенилаланином (см. SEQ ID NO: 67), гистидином (см. SEQ ID NO: 68), лейцином (см. SEQ ID NO: 69), валином (см. SEQ ID NO: 70) изолейцином (см. SEQ ID NO:71), лизином (см. SEQ ID NO: 72) или, например, тирозином (см. SEQ ID NO: 73). См. таблицу 2.
Антитело может представлять собой молекулу класса IgG, IgE, IgM, IgD, IgA и IgY или подкласса, например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Так, например, антитело может представлять собой молекулу IgG1, имеющую нижеследующую последовательность константной области:

Вышеуказанная константная область в SEQ ID NO: 140 содержит две (2) мутации в последовательности константной области дикого типа в положениях 234 и 235. Более конкретно, такими мутациями являются замена лейцина аланином в каждом из положений 234 и 235 (которые называются мутациями «LLAA»). Эти мутации показаны выше жирным шрифтом и подчеркнуты. Эти мутации были введены в целях элиминации эффекторной функции.
Альтернативно, молекула IgG1 может иметь вышеуказанную последовательность константной области (SEQ ID NO: 140), содержащую одну или более мутаций. Так, например, последовательность константной области SEQ ID NO: 140 может содержать мутацию аминокислоты в положении 250, где треонин заменен глутамином (SEQ ID NO: 141), мутацию аминокислоты в положении 428, где метионин заменен лейцином (SEQ ID NO: 142) или мутацию аминокислоты в положении 250, где треонин заменен глутамином, и мутацию аминокислоты в положении 428, где метионин заменен лейцином (SEQ ID NO: 143), как показано в таблице 2A.
Альтернативно, молекула IgG1 может содержать тяжелую цепь, включающую: AE12-1 (VH) CDR-H1 (SEQ ID NO: 2), AE12-1 (VH) CDR-H2 (SEQ ID NO: 3), AE12-1 (VH) CDR-H3 (SEQ ID NO: 4) и легкую цепь, включающую: AE12-1 (VL) CDR-L1 (SEQ ID NO: 6), AE12-1 (VL) CDR-L2 (SEQ ID NO: 7) и AE12-1-V (VL) CDR-L3 (SEQ ID NO: 70), а также константную последовательность SEQ ID NO: 143, как показано в таблице 2B (это антитело обозначается AE12-IV-QL и имеет последовательность легкой цепи SEQ ID NO: 144 и последовательность тяжелой цепи SEQ ID NO: 145).
Альтернативно, молекула IgG1 может содержать тяжелую цепь, включающую: AE12-1 (VH) CDR-H1 (SEQ ID NO: 2), AE12-1 (VH) CDR-H2 (SEQ ID NO: 3), AE12-1 (VH) CDR-H3 (SEQ ID NO: 4) и легкую цепь, включающую: AE12-1 (VL) CDR-L1 (SEQ ID NO:6), AE12-1 (VL) CDR-L2 (SEQ ID NO: 7) и AE12-1-Y (VL) CDR-L3 (SEQ ID NO: 73), а также константную последовательность SEQ ID NO: 143, как показано в таблице 2B (это антитело обозначается AE12-IY-QL и имеет последовательность легкой цепи SEQ ID NO: 146 и последовательность тяжелой цепи SEQ ID NO: 147).


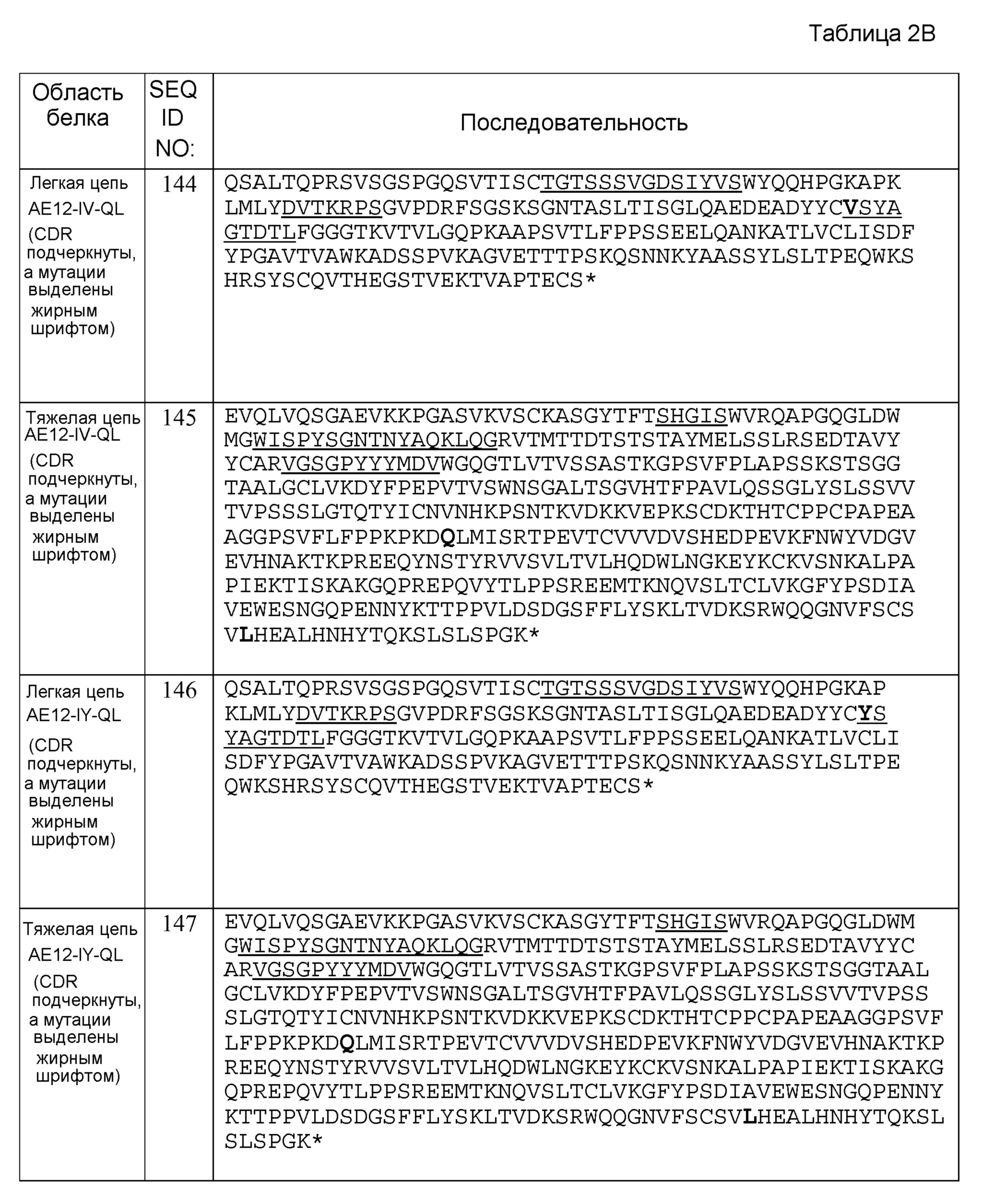
Антитело или его фрагмент могут содержать вариабельный домен тяжелой цепи, включающий три гипервариабельных области (CDR-H1, H2 и H3), представленные нижеследующими формулами, соответственно:
Xaa1 - Xaa2 - Xaa3 - Xaa4 - Xaa5 (формула 1-CDR-H1), где Xaa1 представляет собой аминокислоту, выбранную из группы, состоящей из S, D, E, N, G и T; Xaa2 представляет собой аминокислоту, выбранную из группы, состоящей из H, Y, L, S и Q; Xaa3 представляет собой аминокислоту, выбранную из группы, состоящей из G, D, A, T и Y; Xaa4 представляет собой аминокислоту, выбранную из группы, состоящей из I, M и W; и Xaa5 представляет собой аминокислоту, выбранную из группы, состоящей из S, N, H, A, T и Q;
Xaa1 - Xaa2 - Xaa3 - Xaa4 - Xaa5 - Xaa6 - Xaa7 - Xaa8 - Xaa9 - Xaa10 - Xaa11 - Xaa12 - Xaa13 - Xaa14 - Xaa15 - Xaa16 - (Xaa)n (формула 2-CDR-H2), где n равно 0 или 1 и где Xaa1 представляет собой аминокислоту, выбранную из группы, состоящей из W, V, A, G, L, E, S и N; Xaa2 представляет собой аминокислоту, выбранную из группы, состоящей из I, M и F; Xaa3 представляет собой аминокислоту, выбранную из группы, состоящей из S, N, D, F и Y; Xaa4 представляет собой аминокислоту, выбранную из группы, состоящей из P, Y, G, W, H, A и S; Xaa5 представляет собой аминокислоту, выбранную из группы, состоящей из Y, N, D, E, S, K, G и T; Xaa6 представляет собой аминокислоту, выбранную из группы, состоящей из S, G, D, T и N; Xaa7 представляет собой аминокислоту, выбранную из группы, состоящей из G, S, I, E, N и R; Xaa8 представляет собой аминокислоту, выбранную из группы, состоящей из N, L, R, S, T и Y; Xaa9 представляет собой аминокислоту, выбранную из группы, состоящей из T, K, G, N, I и Y; Xaa10 представляет собой аминокислоту, выбранную из группы, состоящей из N, G, Y, T и K; Xaa11 представляет собой аминокислоту, выбранную из группы, состоящей из Y, F, N и H; Xaa12 представляет собой аминокислоту, выбранную из группы, состоящей из A, T, V, P, L и S; Xaa13 представляет собой аминокислоту, выбранную из группы, состоящей из Q, D, P и S; Xaa14 представляет собой аминокислоту, выбранную из группы, состоящей из K, S, N и L; Xaa15 представляет собой аминокислоту, выбранную из группы, состоящей из L, F, V, K и R; Xaa16 представляет собой аминокислоту, выбранную из группы, состоящей из Q, K, R и S; и Xaa17 представляет собой глицин; и
Xaa1 - Xaa2 - Xaa3 - Xaa4 - Xaa5 - Xaa6 - (Xaa)n (формула 3-CDR-H3), где n равно 0-11 и где Xaa1 представляет собой аминокислоту, выбранную из группы, состоящей из V, S, E, N, L, D, Q и A; Xaa2 представляет собой аминокислоту, выбранную из группы, состоящей из G, T, R, Y, L, I, D и S; Xaa3 представляет собой аминокислоту, выбранную из группы, состоящей из S, V, D, G, F, Y, P, M, C, L и A; Xaa4 представляет собой аминокислоту, выбранную из группы, состоящей из G, L, Y, N, E, K, A и F; Xaa5 представляет собой аминокислоту, выбранную из группы, состоящей из P, S, Y, A, V, G, T, E и W; Xaa6 представляет собой аминокислоту, выбранную из группы, состоящей из Y, V, S, L, D, G, H и P; Xaa7 представляет собой аминокислоту, выбранную из группы, состоящей из Tyr, Asp, Gly, Ser, Phe, Leu и Cys; Xaa8 представляет собой аминокислоту, выбранную из группы, состоящей из Tyr, Lys, Asp, Ala и Gln; Xaa9 представляет собой аминокислоту, выбранную из группы, состоящей из Met, Glu, Phe, Leu, Ser, Thr, Pro и Tyr; Xaa10 представляет собой аминокислоту, выбранную из группы, состоящей из Asp, Gly, Tyr, Ser, Leu, His и Phe; Xaa11 представляет собой аминокислоту, выбранную из группы, состоящей из Val, Tyr, Leu, His, Gly, Trp и Asp; Xaa12 представляет собой аминокислоту, выбранную из группы, состоящей из Tyr и Phe; Xaa13 представляет собой аминокислоту, выбранную из группы, состоящей из Tyr, Gly и Asp; Xaa14 представляет собой аминокислоту, выбранную из группы, состоящей из Ala, Leu, Pro и Tyr; Xaa15 представляет собой аминокислоту, выбранную из группы, состоящей из Met, Leu и Phe; Xaa16 представляет собой аминокислоту, выбранную из группы, состоящей из Asp и Gly; и Xaa17 представляет собой аминокислоту, выбранную из группы, состоящей из Val, Asp и Tyr.
Выделенное антитело или его фрагмент могут содержать вариабельный домен легкой цепи, включающий три гипервариабельных области (CDR-L1, L2 и L3), представленные нижеследующими формулами, соответственно:
Xaa1 - Xaa2 - Xaa3 - Xaa4 - Xaa5 - Xaa6 - Xaa7 - Xaa8 - Xaa9 - Xaa10 - Xaa11 - (Xaa)n (формула 1-CDR-L1), где n равно 0-3 и где Xaa1 представляет собой аминокислоту, выбранную из группы, состоящей из T, S, R, G и Q; Xaa2 представляет собой аминокислоту, выбранную из группы, состоящей из G, L и A; Xaa3 представляет собой аминокислоту, выбранную из группы, состоящей из T, D, S, N и A; Xaa4 представляет собой аминокислоту, выбранную из группы, состоящей из S, K, G, Q, N и E; Xaa5 представляет собой аминокислоту, выбранную из группы, состоящей из S, L, G, I, D и P; Xaa6 представляет собой аминокислоту, выбранную из группы, состоящей из S, G, N, H и I; Xaa7 представляет собой аминокислоту, выбранную из группы, состоящей из V, D, I, S, G и H; Xaa8 представляет собой аминокислоту, выбранную из группы, состоящей из G, K, A, S, I, N, T и D; Xaa9 представляет собой аминокислоту, выбранную из группы, состоящей из D, Y, A, C, S и F; Xaa10 представляет собой аминокислоту, выбранную из группы, состоящей из S, A, G, L, V и N; Xaa11 представляет собой аминокислоту, выбранную из группы, состоящей из I, C, Y, H, R, N и S; Xaa12 представляет собой аминокислоту, выбранную из группы, состоящей из Tyr, Gly, Ala и Val; Xaa13 представляет собой аминокислоту, выбранную из группы, состоящей из Val и Asn; и Xaa14 представляет собой аминокислоту, выбранную из группы, состоящей из Ser и His; Xaa1 - Xaa2 - Xaa3 - Xaa4 - Xaa5 - Xaa6 - Xaa7 - (Xaa)n (формула 2-CDR-L2), где n равно 0-4 и где Xaa1 представляет собой аминокислоту, выбранную из группы, состоящей из D, Q, G, V, Y, S и E; Xaa2 представляет собой аминокислоту, выбранную из группы, состоящей из V, D, N и A; Xaa3 представляет собой аминокислоту, выбранную из группы, состоящей из T, S, Y, N и K; Xaa4 представляет собой аминокислоту, выбранную из группы, состоящей из K, N, D, Q и T; Xaa5 представляет собой аминокислоту, выбранную из группы, состоящей из R, G, S и L; Xaa6 представляет собой аминокислоту, выбранную из группы, состоящей из P, S, I и E; Xaa7 представляет собой аминокислоту, выбранную из группы, состоящей из S, H, I и T; Xaa8 представляет собой Asn; Xaa9 представляет собой Lys; Xaa10 представляет собой Gly; Xaa11 представляет собой Asp; и
Xaa1 - Xaa2 - Xaa3 - Xaa4 - Xaa5 - Xaa6 - Xaa7 - Xaa8 - Xaa9 - (Xaa)n (формула 3-CDR-L3), где n равно 0-2 и где Xaa1 представляет собой аминокислоту, выбранную из группы, состоящей из C, Q, H, F, H, L, V, I, K, Y и A; Xaa2 представляет собой аминокислоту, выбранную из группы, состоящей из S, A, T, Q и V; Xaa3 представляет собой аминокислоту, выбранную из группы, состоящей из Y, W и S; Xaa4 представляет собой аминокислоту, выбранную из группы, состоящей из A, D, G, S, H и Y; Xaa5 представляет собой аминокислоту, выбранную из группы, состоящей из G, S, N, P, D, V и T; Xaa6 представляет собой аминокислоту, выбранную из группы, состоящей из I, T, S, G, L, F и Y; Xaa7 представляет собой аминокислоту, выбранную из группы, состоящей из D, T, L, I, P и S; Xaa8 представляет собой аминокислоту, выбранную из группы, состоящей из T, G, R, Y, D, N, W, L, F и P; Xaa9 представляет собой аминокислоту, выбранную из группы, состоящей из L, V, G, T и H; Xaa10 представляет собой аминокислоту, выбранную из группы, состоящей из Val, Tyr и His; Xaa11 представляет собой Leu или Val.
Антитело или его фрагмент содержат вариабельный домен тяжелой цепи, включающий три гипервариабельных области (CDR-H1, H2 и H3), представленные нижеследующими формулами, соответственно:
Xaa1 - Xaa2 - Xaa3 - Xaa4 - Xaa5 (формула 1-CDR-H1), где Xaa1 представляет собой аминокислоту, выбранную из группы, состоящей из S, D, E, N, G и T; Xaa2 представляет собой аминокислоту, выбранную из группы, состоящей из H, Y, L, S и Q; Xaa3 представляет собой аминокислоту, выбранную из группы, состоящей из G, D, A, T и Y; Xaa4 представляет собой аминокислоту, выбранную из группы, состоящей из I, M и W; и Xaa5 представляет собой аминокислоту, выбранную из группы, состоящей из S, N, H, A, T и Q;
Xaa1 - Xaa2 - Xaa3 - Xaa4 - Xaa5 - Xaa6 - Xaa7 - Xaa8 - Xaa9 - Xaa10 - Xaa11 - Xaa12 - Xaa13 - Xaa14 - Xaa15 - Xaa16 - (Xaa)n (формула 2-CDR-H2), где n равно 0 или 1 и где Xaa1 представляет собой аминокислоту, выбранную из группы, состоящей из Y, V, A, G, L, G, S и N; Xaa2 представляет собой аминокислоту, выбранную из группы, состоящей из I, M и F; Xaa3 представляет собой аминокислоту, выбранную из группы, состоящей из S, N, D, F и Y; Xaa4 представляет собой аминокислоту, выбранную из группы, состоящей из P, Y, G, W, H, A и S; Xaa5 представляет собой аминокислоту, выбранную из группы, состоящей из Y, N, D, E, S, K, G и T; Xaa6 представляет собой аминокислоту, выбранную из группы, состоящей из S, G, D, T и N; Xaa7 представляет собой аминокислоту, выбранную из группы, состоящей из G, S, I, E, N и R; Xaa8 представляет собой аминокислоту, выбранную из группы, состоящей из N, L, R, S, T и Y; Xaa9 представляет собой аминокислоту, выбранную из группы, состоящей из T, K, G, N, I и Y; Xaa10 представляет собой аминокислоту, выбранную из группы, состоящей из N, G, Y, T и K; Xaa11 представляет собой аминокислоту, выбранную из группы, состоящей из Y, F, N и H; Xaa12 представляет собой аминокислоту, выбранную из группы, состоящей из A, T, V, P, L и S; Xaa13 представляет собой аминокислоту, выбранную из группы, состоящей из Q, D, P и S; Xaa14 представляет собой аминокислоту, выбранную из группы, состоящей из K, S, N и L; Xaa15 представляет собой аминокислоту, выбранную из группы, состоящей из L, F, V, K и R; Xaa16 представляет собой аминокислоту, выбранную из группы, состоящей из Q, K, R и S; и Xaa17 представляет собой глицин; и
Xaa1 - Xaa2 - Xaa3 - Xaa4 - Xaa5 - Xaa6 - (Xaa)n (формула 3 - CDR-H3), где n равно 0-11, и где Xaa1 представляет собой аминокислоту, выбранную из группы, состоящей из V, S, E, N, L, D, Q и A; Xaa2 представляет собой аминокислоту, выбранную из группы, состоящей из G, T, R, Y, L, I, D и S; Xaa3 представляет собой аминокислоту, выбранную из группы, состоящей из S, V, D, G, F, Y, P, M, C, L и A; Xaa4 представляет собой аминокислоту, выбранную из группы, состоящей из G, L, Y, N, E, K, A и F; Xaa5 представляет собой аминокислоту, выбранную из группы, состоящей из P, S, Y, A, V, G, T, E и W; Xaa6 представляет собой аминокислоту, выбранную из группы, состоящей из Y, V, S, L, D, G, H и P; Xaa7 представляет собой аминокислоту, выбранную из группы, состоящей из Tyr, Asp, Gly, Ser, Phe, Leu и Cys; Xaa8 представляет собой аминокислоту, выбранную из группы, состоящей из Tyr, Lys, Asp, Ala и Gln; Xaa9 представляет собой аминокислоту, выбранную из группы, состоящей из Met, Glu, Phe, Leu, Ser, Thr, Pro и Tyr; Xaa10 представляет собой аминокислоту, выбранную из группы, состоящей из Asp, Gly, Tyr, Ser, Leu, His и Phe; Xaa11 представляет собой аминокислоту, выбранную из группы, состоящей из Val, Tyr, Leu, His, Gly, Trp и Asp; Xaa12 представляет собой аминокислоту, выбранную из группы, состоящей из Tyr и Phe; Xaa13 представляет собой аминокислоту, выбранную из группы, состоящей из Tyr, Gly и Asp; Xaa14 представляет собой аминокислоту, выбранную из группы, состоящей из Ala, Leu, Pro и Tyr; Xaa15 представляет собой аминокислоту, выбранную из группы, состоящей из Met, Leu и Phe; Xaa16 представляет собой аминокислоту, выбранную из группы, состоящей из Asp и Gly; и Xaa17 представляет собой аминокислоту, выбранную из группы, состоящей из Val, Asp и Tyr; и
где антитело или его фрагмент также содержат вариабельный домен легкой цепи, включающий три гипервариабельных области (CDR-L1, L2 и L3), представленные нижеследующими формулами, соответственно:
Xaa1 - Xaa2 - Xaa3 - Xaa4 - Xaa5 - Xaa6 - Xaa7 - Xaa8 - Xaa9 - Xaa10 - Xaa11 - (Xaa)n (формула 1-CDR-L1), где n равно 0-3, и где Xaa1 представляет собой аминокислоту, выбранную из группы, состоящей из T, S, R, G и Q; Xaa2 представляет собой аминокислоту, выбранную из группы, состоящей из G, L и A; Xaa3 представляет собой аминокислоту, выбранную из группы, состоящей из T, D, S, N и A; Xaa4 представляет собой аминокислоту, выбранную из группы, состоящей из S, K, G, Q, N и E; Xaa5 представляет собой аминокислоту, выбранную из группы, состоящей из S, L, G, I, D и P; Xaa6 представляет собой аминокислоту, выбранную из группы, состоящей из S, G, N, H и I; Xaa7 представляет собой аминокислоту, выбранную из группы, состоящей из V, D, I, S, G и H; Xaa8 представляет собой аминокислоту, выбранную из группы, состоящей из G, K, A, S, I, N, T и D; Xaa9 представляет собой аминокислоту, выбранную из группы, состоящей из D, Y, A, C, S и F; Xaa10 представляет собой аминокислоту, выбранную из группы, состоящей из S, A, G, L, V и N; Xaa11 представляет собой аминокислоту, выбранную из группы, состоящей из I, C, Y, H, R, N и S; Xaa12 представляет собой аминокислоту, выбранную из группы, состоящей из Tyr, Gly, Ala и Val; Xaa13 представляет собой аминокислоту, выбранную из группы, состоящей из Val и Asn; и Xaa14 представляет собой аминокислоту, выбранную из группы, состоящей из Ser и His;
Xaa1 - Xaa2 - Xaa3 - Xaa4 - Xaa5 - Xaa6 - Xaa7 - (Xaa)n (формула 2 - CDR-L2), где n равно 0-4, и где Xaa1 представляет собой аминокислоту, выбранную из группы, состоящей из D, Q, G, V, Y, S и E; Xaa2 представляет собой аминокислоту, выбранную из группы, состоящей из V, D, N и A; Xaa3 представляет собой аминокислоту, выбранную из группы, состоящей из T, S, Y, N и K; Xaa4 представляет собой аминокислоту, выбранную из группы, состоящей из K, N, D, Q и T; Xaa5 представляет собой аминокислоту, выбранную из группы, состоящей из R, G, S и L; Xaa6 представляет собой аминокислоту, выбранную из группы, состоящей из P, S, I и E; Xaa7 представляет собой аминокислоту, выбранную из группы, состоящей из S, H, I и T; Xaa8 представляет собой Asn; Xaa9 представляет собой Lys; Xaa10 представляет собой Gly; Xaa11 представляет собой Asp; и
Xaa1 - Xaa2 - Xaa3 - Xaa4 - Xaa5 - Xaa6 - Xaa7 - Xaa8 - Xaa9 - (Xaa)n (формула 3-CDR-L3), где n равно 0-2, и где Xaa1 представляет собой аминокислоту, выбранную из группы, состоящей из C, Q, H, F, H, L, V, I, K, Y и A; Xaa2 представляет собой аминокислоту, выбранную из группы, состоящей из S, A, T, Q и V; Xaa3 представляет собой аминокислоту, выбранную из группы, состоящей из Y, W и S; Xaa4 представляет собой аминокислоту, выбранную из группы, состоящей из A, D, G, S, H и Y; Xaa5 представляет собой аминокислоту, выбранную из группы, состоящей из G, S, N, P, D, V и T; Xaa6 представляет собой аминокислоту, выбранную из группы, состоящей из I, T, S, G, L, F и Y; Xaa7 представляет собой аминокислоту, выбранную из группы, состоящей из D, T, L, I, P и S; Xaa8 представляет собой аминокислоту, выбранную из группы, состоящей из T, G, R, Y, D, N, W, L, F и P; Xaa9 представляет собой аминокислоту, выбранную из группы, состоящей из L, V, G, T и H; Xaa10 представляет собой аминокислоту, выбранную из группы, состоящей из Val, Tyr и His; Xaa11 представляет собой Leu или Val.
В формуле 1-CDR-L1, если n равно 1, то эта формула имеет вид:
Xaa1 - Xaa2 - Xaa3 - Xaa4 - Xaa5 - Xaa6 - Xaa7 - Xaa8 - Xaa9 - Xaa10 - Xaa11 - Xaa12.
В формуле 1-CDR-L1, если n равно 2, то эта формула имеет вид:
Xaa1 - Xaa2 - Xaa3 - Xaa4 - Xaa5 - Xaa6 - Xaa7 - Xaa8 - Xaa9 - Xaa10 - Xaa11 - Xaa12 - Xaa13.
В формуле 1-CDR-L1, если n равно 3, то эта формула имеет вид:
Xaa1 - Xaa2 - Xaa3 - Xaa4 - Xaa5 - Xaa6 - Xaa7 - Xaa8 - Xaa9 - Xaa10 - Xaa11 - Xaa12 - Xaa13 - Xaa14.
В формуле 2-CDR-L2, если n равно 1, то эта формула имеет вид:
Xaa1 - Xaa2 - Xaa3 - Xaa4 - Xaa5 - Xaa6 - Xaa7 - Xaa8.
В формуле 2-CDR-L2, если n равно 2, то эта формула имеет вид:
Xaa1 - Xaa2 - Xaa3 - Xaa4 - Xaa5 - Xaa6 - Xaa7 - Xaa8 - Xaa9.
В формуле 2-CDR-L2, если n равно 3, то эта формула имеет вид:
Xaa1 - Xaa2 - Xaa3 - Xaa4 - Xaa5 - Xaa6 - Xaa7 - Xaa8 - Xaa9 - Xaa10.
В формуле 2-CDR-L2, если n равно 4, то эта формула имеет вид:
Xaa1 - Xaa2 - Xaa3 - Xaa4 - Xaa5 - Xaa6 - Xaa7 - Xaa8 - Xaa9 - Xaa10 - Xaa11.
В формуле 3-CDR-L3, если n равно 1, то эта формула имеет вид:
Xaa1 - Xaa2 - Xaa3 - Xaa4 - Xaa5 - Xaa6 - Xaa7 - Xaa8 - Xaa9 - Xaa10.
В формуле 3-CDR-L3, если n равно 2, то эта формула имеет вид:
Xaa1 - Xaa2 - Xaa3 - Xaa4 - Xaa5 - Xaa6 - Xaa7 - Xaa8 - Xaa9 - Xaa10 - Xaa13.
В формуле 2-CDR-H2, если n равно 1, то эта формула имеет вид:
Xaa1 - Xaa2 - Xaa3 - Xaa4 - Xaa5 - Xaa6 - Xaa7 - Xaa8 - Xaa9 - Xaa10 - Xaa11 - Xaa12 - Xaa13 - Xaa14 - Xaa15 - Xaa16 - Xaa17.
В формуле 2-CDR-H3, если n равно 1, то эта формула имеет вид:
Xaa1 - Xaa2 - Xaa3 - Xaa4 - Xaa5 - Xaa6 - Xaa7.
В формуле 3-CDR-H3, если n равно 2, то эта формула имеет вид:
Xaa1 - Xaa2 - Xaa3 - Xaa4 - Xaa5 - Xaa6 - Xaa7 - Xaa8.
В формуле 3-CDR-H3, если n равно 3, то эта формула имеет вид:
Xaa1 - Xaa2 - Xaa3 - Xaa4 - Xaa5 - Xaa6 - Xaa7 - Xaa8 - Xaa9.
В формуле 3-CDR-H3, если n равно 4, то эта формула имеет вид:
Xaa1 - Xaa2 - Xaa3 - Xaa4 - Xaa5 - Xaa6 - Xaa7 - Xaa8 - Xaa9 - Xaa10.
В формуле 3-CDR-H3, если n равно 5, то эта формула имеет вид:
Xaa1 - Xaa2 - Xaa3 - Xaa4 - Xaa5 - Xaa6 - Xaa7 - Xaa8 - Xaa9 - Xaa10 - Xaa11.
В формуле 3-CDR-H3, если n равно 6, то эта формула имеет вид:
Xaa1 - Xaa2 - Xaa3 - Xaa4 - Xaa5 - Xaa6 - Xaa7 - Xaa8 - Xaa9 - Xaa10 - Xaa11 - Xaa12.
В формуле 3-CDR-H3, если n равно 7, то эта формула имеет вид:
Xaa1 - Xaa2 - Xaa3 - Xaa4 - Xaa5 - Xaa6 - Xaa7 - Xaa8 - Xaa9 - Xaa10 - Xaa11 - Xaa12 - Xaa13.
В формуле 3-CDR-H3, если n равно 8, то эта формула имеет вид:
Xaa1 - Xaa2 - Xaa3 - Xaa4 - Xaa5 - Xaa6 - Xaa7 - Xaa8 - Xaa9 - Xaa10 - Xaa11 - Xaa12 - Xaa13 - Xaa14.
В формуле 3-CDR-H3, если n равно 9, то эта формула имеет вид:
Xaa1 - Xaa2 - Xaa3 - Xaa4 - Xaa5 - Xaa6 - Xaa7 - Xaa8 - Xaa9 - Xaa10 - Xaa11 - Xaa12 - Xaa13 - Xaa14 - Xaa15.
В формуле 3-CDR-H3, если n равно 10, то эта формула имеет вид:
Xaa1 - Xaa2 - Xaa3 - Xaa4 - Xaa5 - Xaa6 - Xaa7 - Xaa8 - Xaa9 - Xaa10 - Xaa11 - Xaa12 - Xaa13 - Xaa14 - Xaa15 - Xaa16.
В формуле 3-CDR-H3, если n равно 11, то эта формула имеет вид:
Xaa1 - Xaa2 - Xaa3 - Xaa4 - Xaa5 - Xaa6 - Xaa7 - Xaa8 - Xaa9 - Xaa10 - Xaa11 - Xaa12 - Xaa13 - Xaa14 - Xaa15 -Xaa16 - Xaa17.
с. Получение/продуцирование антител
Антитела могут быть получены различными методами. В общих чертах, антитела могут быть продуцированы методами культивирования клеток, включая стандартные методы продуцирования моноклональных антител или методы трансфекции генов тяжелых цепей и/или легких цепей антител в подходящие бактериальные клетки-хозяева или в клетки-хозяева млекопитающих в целях продуцирования антител, где такие антитела могут быть рекомбинантными. Термин «трансфекция» в различных его формах охватывают широкий ряд методов, широко применяемых для введения экзогенной ДНК в прокариотические или эукариотические клетки-хозяева, например, электропорацию, осаждение фосфатом кальция, трансфекцию, опосредуемую DEAE-декстраном и т.п. Хотя антитела согласно изобретению могут экспрессироваться в прокариотических или эукариотических клетках-хозяевах, однако экспрессия этих антител в эукариотических клетках является предпочтительной, а экспрессия в клетках млекопитающих является наиболее предпочтительной, поскольку такие эукариотические клетки (а в частности, клетки млекопитающих) с большей вероятностью, чем прокариотические клетки, будут подвергаться сборке и секретировать «правильно» уложенное и иммунологически активное антитело.
Репрезентативными клетками-хозяевами млекопитающих, используемыми для экспрессии рекомбинантных антител согласно изобретению, являются клетки яичника китайского хомячка (клетки CHO) (включая клетки dhfr-CHO, описанные Urlaub и Chasin, (Proc. Natl. Acad. Sci. USA 77:4216-4220(1980)), используемые с DHFR-селективным маркером, например, как описано R.J. Kaufman и P.A. Sharp (Mol. Biol. 159:601-621 (1982)), клетки миеломы NSO, клетки COS и клетки SP2. После введения рекомбинантных экспрессионных векторов, включающих гены антитела, в клетки-хозяева млекопитающих, указанные антитела получают путем культивирования клеток-хозяев в течение периода времени, достаточного для экспрессии антител в клетках-хозяевах или, более предпочтительно, секреции антител в культуральную среду, в которой культивируют данные клетки-хозяева. Антитела могут быть выделены из культуральной среды стандартными методами очистки белков.
Клетки-хозяева могут быть также использованы для продуцирования функциональных фрагментов антитела, таких как Fab-фрагменты или молекулы scFv. При этом совершенно очевидно, что в вышеуказанные способы могут быть внесены изменения, не выходящие за рамки объема настоящего изобретения. Так, например, может оказаться желательным трансфицировать клетки-хозяева ДНК, кодирующей функциональные фрагменты легкой цепи и/или тяжелой цепи антитела согласно изобретению. Технология рекомбинантных ДНК может быть использована для удаления некоторых или всех ДНК, кодирующих любые или обе легкие и тяжелые цепи, которые не являются необходимыми для связывания с представляющим интерес антигеном. Антитела согласно изобретению также охватывают молекулы, экспрессированные из таких усеченных молекул ДНК. Кроме того, могут быть продуцированы бифункциональные антитела, в которых одна тяжелая цепь и одна легкая цепь представляют собой антитело согласно изобретению (то есть связываются с человеческой молекулой RGMa), а другая тяжелая цепь и легкая цепь являются специфичными к другому антигену, отличающемуся от человеческой RGMa, и продуцирование таких антител осуществляют стандартными методами химического связывания, то есть путем перекрестного связывания антитела согласно изобретению со вторым антителом.
В предпочтительной системе рекомбинантной экспрессии антитела или его антигенсвязывающей части согласно изобретению, рекомбинантный экспрессионный вектор, кодирующий тяжелую цепь антитела и легкую цепь антитела, встраивают в клетки dhfr-СHO методом трансфекции, опосредуемой фосфатом кальция. В рекомбинантном экспрессионном векторе, гены тяжелой и легкой цепи антитела функционально присоединены к регуляторным элементам «энхансер CMV/промотор AdMLP», что приводит к запуску транскрипции генов на высоком уровне. Рекомбинантный экспрессионный вектор также несет ген DHFR, что позволяет проводить отбор клеток CHO, трансфицированных вектором, путем их культивирования в присутствии метотрексата/амплификации. Отобранные трансформированные клетки-хозяева культивируют для экспрессии тяжелой и легкой цепей антитела и из культуральной среды выделяют интактное антитело. Для получения рекомбинантного экспрессионного вектора, трансфекции клеток-хозяев, отбора трансформантов, культивирования клеток-хозяев и выделения антитела из культуральной среды применяют стандартные методы молекулярной биологии. Настоящее изобретение также относится к способу синтеза рекомбинантного антитела согласно изобретению путем культивирования клети-хозяина согласно изобретению в подходящей культуральной среде с получением рекомбинантного антитела согласно изобретению. Этот способ может также включать выделение рекомбинантного антитела из культуральной среды.
Способы продуцирования моноклональных антител включают получение иммортализованных клеточных линий, способных продуцировать антитела с нужной специфичностью. Такие клеточные линии могут быть продуцированы из клеток селезенки, полученных от иммунизованных животных. Животные могут быть иммунизованы RGMa или его фрагментом и/или вариантом. Так, например, для иммунизации животного может быть использована любая из последовательностей SEQ ID NO: 65, SEQ ID NO:66, SEQ ID NO: 74, фрагмент SEQ ID NO: 65, SEQ ID NO: 66 или SEQ ID NO: 74 или вариант SEQ ID NO: 65, SEQ ID NO: 66 или SEQ ID NO: 74. Пептид, используемый для иммунизации животного, может включать аминокислоты, составляющие человеческий Fc, например, область кристаллизуемого фрагмента или концевую область человеческого антитела. Затем клетки селезенки могут быть иммортализованы, например, путем их слияния с миеломной клеткой, то есть с партнером по слиянию. При этом могут быть применены различные способы слияния. Так, например, клетки селезенки и миеломные клетки могут быть объединены с неионогенным детергентом и оставлены на несколько минут, а затем они могут быть посеяны при низкой плотности на селективную среду, которая поддерживает рост гибридных клеток, но не миеломных клеток. В одном из таких методов осуществляют отбор с использованием гипоксантина, аминоптерина, тимидина (HAT). По прошествии достаточного периода времени, обычно приблизительно 1-2 недели, наблюдается появление колоний гибридных клеток. Моноколонии отбирают и супернатанты их культуры тестируют на активность связывания с полипептидом. Могут быть использованы гибридомы, имеющие высокую реактивность и специфичность.
Моноклональные антитела могут быть выделены из супернатанов культуры гибридомных колоний. Кроме того, для повышения выхода могут быть применены различные методы, такие как инжекция гибридомной клеточной линии в брюшную полость подходящего хозяина-позвоночного, такого как мышь. Моноклональные антитела могут быть затем выделены из асцитной жидкости или крови. Примеси могут быть удалены из антител стандартными методами, такими как хроматография, гель-фильтрация, преципитация и экстракция. Примером метода, который может быть применен для очистки антител, является аффинная хроматография.
Протеолитический фермент папаин расщепляет преимущественно молекулы IgG с образованием нескольких фрагментов, причем каждый из двух образованных F(ab)-фрагментов содержит гетеродимер с ковалентной связью, включающий интактный антигенсвязывающий сайт. Фермент пепсин может расщеплять молекулы IgG с образованием нескольких фрагментов, включая F(ab')2-фрагмент, который содержит оба антигенсвязывающих сайта.
Fv-фрагмент может быть продуцирован преимущественно посредством протеолитического расщепления IgM и, в редких случаях, молекул иммуноглобулина IgG или IgA. Fv-фрагмент содержит быть получен рекомбинантными методами. Fv-фрагмент включает нековалентный гетеродимер VH::VL, включающий антигенсвязывающий сайт, который, в основном, сохраняет способность к распознаванию антигена и к связыванию с нативной молекулой антитела.
Антитело, его фрагмент или производное могут содержать ряд гипервариабельных областей («CDR») тяжелой и легкой цепей, соответственно, где указанные гипервариабельные области расположены между каркасными областями («FR») тяжелой и легкой цепей и эти каркасные области способствуют сохранению CDR и определяют пространственное взаимодействие CDR друг с другом. Ряд CDR может содержать три гипервариабельных области V-области тяжелой или легкой цепи. Эти области, простирающиеся от N-конца тяжелой цепи или легкой цепи, обозначаются «CDR1», «CDR2» и «CDR3», соответственно. Поэтому антигенсвязывающий сайт может включать шесть CDR от каждой V-области тяжелой и легкой цепи. Полипептид, содержащий одну CDR (например, CDR1, CDR2 или CDR3), может называться «молекулярной распознающей единицей». Кристаллографические анализы комплексов «антиген-антитело» показали, что аминокислотные остатки CDR образуют пространственные контакты со связанным антигеном, где большинство пространственных контактов образуется посредством взаимодействия антигена с CDR3 тяжелой цепи. Таким образом, молекулярные распознающие единицы могут быть ответственны, главным образом, за специфичность антигенсвязывающего сайта. Вообще говоря, остатки CDR непосредственно участвуют в связывании с антигеном и в большинстве случаев влияют на такое связывание.
Для получения или выделения антител с нужной специфичностью могут быть применены и другие подходящие методы, включая, но не ограничиваясь ими, известные методы отбора рекомбинантного антитела из пептидных или белковых библиотек (например, таких как, но не ограничивающихся ими, бактериофаговые библиотеки, рибосомные библиотеки, олигонуклеотидные библиотеки, РНК-библиотеки, кДНК-библиотеки, дрожжевые библиотеки или т.п., а также библиотек представления), например, поставляемых различными коммерческими фирмами, такими как Cambridge Antibody Technologies (Cambridgeshire, UK), MorphoSys (Martinsreid/Planegg, Del), Biovation (Aberdeen, Scotland, UK) Biolnvent (Lund, Sweden). См., например, патенты США №№ 4704692; 5723323; 5763192; 5814476; 5817483; 5824514; 5976862. Альтернативные методы основаны на иммунизации трансгенных животных (например, мышей SCID, Nguyen et al. (1997) Microbiol. Immunol. 41:901-907; Sandhu et al. (1996) Crit. Rev. Biotechnol. 16:95-118; Eren et al. (1998) Immunol. 93: 154-161), которые могут продуцировать репертуар человеческих антител, как известно специалистам и/или как описано в настоящей заявке. Такими методами являются, но не ограничиваются ими, метод рибосомного представления (Hanes et al. (1997) Proc. Natl. Acad. Sci. USA, 94:4937-4942; Hanes et al. (1998) Proc. Natl. Acad. Sci. USA, 95: 14130-14135); и методы продуцирования антител из одной клетки (например, метод отбора антитело-продуцирующих лимфоцитов («SLAM») (патент США № 5627052, Wen et al. (1987) J. Immunol. 17:887-892; Babcook et al. (1996) Proc. Natl. Acad. Sci. USA 93:7843-7848); метод гелевых микрокапелек и проточная цитометрия (Powell et al. (1990) Biotechnol. 8:333-337; One Cell Systems, (Cambridge, Mass); Gray et al. (1995) J. Imm. Meth. 182: 155-163; Kenny et al. (1995) Bio/Technol. 13:787-790); B-клеточный отбор (Steenbakkers et al. (1994) Molec. Biol. Reports 19: 125-134 (1994)).
Аффинно зрелое антитело может быть получено одним из различных методов, известных специалистам. Так, например, в публикации Marks et al., BioTechnology, 10: 779-783 (1992) описано созревание аффинности, достигаемое посредством перестановки доменов VH и VL. Неспецифический мутагенез остатков CDR и/или каркасных остатков описан в публикациях Barbas et al., Proc. Nat. Acad. Sci. USA, 91: 3809-3813 (1994); Schier et al., Gene, 169: 147-155 (1995); Yelton et al., J. Immunol, 155: 1994- 2004 (1995); Jackson et al., J. Immunol, 154(7): 3310-3319 (1995); Hawkins et al., J. Mol. Biol, 226: 889-896 (1992). Селективная мутация в положениях селективного мутагенеза и в положениях контактирования или гипермутации, осуществляемая путем введения аминокислотного остатка, повышающего активность, описана в патенте США № 6914128 B1.
Варианты антител согласно изобретению могут быть также получены путем введения полинуклеотида, кодирующего антитело согласно изобретению, подходящему хозяину для получения трансгенных животных или млекопитающих, таких как козы, коровы, лошади, овцы и т.п., в молоке которых будут продуцироваться указанные антитела. Такие методы известны специалистам и описаны, например, в патентах США №№ 5827690; 5849992; 4873316; 5849992; 5994616; 5565362 и 5304489.
Варианты антител могут быть также продуцированы путем введения полинуклеотида согласно изобретению с получением трансгенных растений и клеток культурных растений (таких как, но не ограничивающихся ими, табак, кукуруза и ряска), продуцирующих такие антитела и их специфические части или варианты в органах растений или в их культивированных клетках. Так, например, в публикации Cramer et al. (1999) Curr. Top. Microbol. Immunol. 240:95-118 и в цитируемых там работах описано продуцирование трансгенного табака, листья которого экспрессируют большие количества рекомбинантных белков, например, с использованием индуцибельного промотора. Трансгенная кукуруза была использована для экспрессии белков млекопитающих на промышленных уровнях продуцирования, где указанные белки обладают биологической активностью, эквивалентной активности белков, продуцируемых в других рекомбинантных системах или выделенных из природных источников. См., например, публикацию Hood et al., Adv. Exp. Med. Biol. (1999) 464: 127-147 и цитируемые там работы. Варианты антител, включая фрагменты антител, такие как одноцепочечные антитела (scFv), были также продуцированы в больших количествах из семян трансгенных растений, включая семена табака и клубни картофеля. См., например, публикацию Conrad et al. (1998) Plant Mol. Biol. 38: 101-109 и цитируемые там работы. Таким образом, антитела согласно изобретению могут быть также продуцированы в трансгенных растениях известными методами.
Производные антител могут быть продуцированы, например, путем добавления экзогенных последовательностей в целях модификации иммуногенности или снижения, увеличения или модификации связывания, аффинности, скорости ассоциации, скорости диссоциации, авидности, специфичности, времени полужизни или любых других нужных свойств. Обычно все не-человеческие или человеческие последовательности CDR или их части сохраняют, а не-человеческие последовательности вариабельных и константных областей заменяют человеческими или другими аминокислотами.
Небольшие фрагменты антитела могут представлять собой диантитела, имеющие два антигенсвязывающих сайта, где указанные фрагменты включают вариабельный домен тяжелой цепи (VH), присоединенный к вариабельному домену легкой цепи (VL) на одной и той же полипептидной цепи (VH VL). См., например, EP 404097; WO 93/11161; и Hollinger et al., (1993) Proc. Natl. Acad. Sci. USA 90:6444-6448. При использовании линкера, который является слишком коротким для образования пары между двумя доменами на одной и той же цепи, домены вынуждены спариваться с комплементарными доменами другой цепи и образовывать два антигенсвязывающих сайта. См. также патент США № 6632926, Chen et al., который во всей своей полноте вводится в настоящее описание посредством ссылки и в котором описаны варианты антител, имеющие одну или более аминокислот, встроенных в гипервариабельную область родительского антитела и обладающих аффинностью связывания с антигеном-мишенью, которая по меньшей мере приблизительно в два раза превышает аффинность связывания родительского антитела с антигеном.
Антителом может быть линейное антитело. Метод получения линейного антитела известен специалистам и описан в публикации Zapata et al. (1995) Protein Eng. 8(10): 1057-1062. Вкратце, эти антитела содержат пару тандемных Fd-сегментов (VH-CH1-VH-CH1), образующих пару антигенсвязывающих областей. Линейные антитела могут быть биспецифическими или моноспецифическими.
Антитела могут быть выделены и очищены из рекомбинантных клеточных культур известными методами, включая, но не ограничиваясь ими, очистку на белке А, преципитацию сульфатом аммония или этанолом, экстракцию кислотой, анионообменную или катионообменную хроматографию, хроматографию на фосфоцеллюлозе, гидрофобную хроматографию, аффинную хроматографию, хроматографию на гидроксиапатитах и хроматографию на лектине. Для очистки может быть также применена высокоэффективная жидкостная хроматография («ВЭЖХ»).
При этом может быть использовано детектируемое антитело или антитело, меченное терапевтическими агентами. Методы конъюгирования антител с этими агентами известны специалистам. Антитела могут быть помечены детектируемыми молекулами, такими как радиоактивный атом, хромофор, флуорофор или т.п., которые приводятся лишь в целях иллюстрации. Такие меченные антитела могут быть использованы в методах диагностики, in vivo или в выделенном тест-образце. Антитела могут быть также конъюгированы, например, с фармацевтическим агентом, таким как химиотерапевтическое средство или токсин. Они могут быть связаны с цитокином, с лигандом или с другим антителом. Для достижения противоопухолевого эффекта к антителам могут быть присоединены подходящие агенты, такие как цитокины, например интерлейкин 2 (IL-2) и фактор некроза опухоли (TNF); фотосенсибилизаторы, используемые в фотодинамической терапии, включая тетрасульфонат фталоцианина-алюминия (III), гематопорфирин и фталоцианин; радионуклиды, такие как йод-131 (131I), иттрий-90 (90Y), висмут-212 (212Bi), висмут-213 (213Bi), технеций-99m (99mTc), рений-186 (186Re) и рений-188 (188Re); антибиотики, такие как доксорубицин, адриамицин, даунорубицин, метотрексат, дауномицин, неокарзиностатин и карбоплатин; бактериальные, растительные и другие токсины, такие как дифтерийный токсин, экзотоксин Рseudomonas A, стафилококковый энтеротоксин A, токсин абрин-A, рицин A (дегликозилированный рицин A и природный рицин A), токсин TGF-альфа, цитотоксин китайской кобры (naja naja atra) и гелонин (растительный токсин); инактивирующие рибосому белки растительного, бактериального и грибкового происхождения, такие как рестриктоцин (инактивирующий рибосому белок растения Aspergillus restrictus), сапорин (инактивирующий рибосому белок Saponaria officinalis) и РНКаза; ингибиторы тирозинкиназы; ly207702 (дифторированный пурин-нуклеозид); липосомы, содержащие антикистозные агенты (например, антисмысловые олигонуклеотиды, плазмиды, кодирующие токсины; метотрексат и т.п.); и другие антитела или их фрагменты, такие как F(ab).
Антитела могут быть секвенированы и реплицированы рекомбинантными методами или методами синтеза. Эти антитела могут быть также секвенированы для определения кодирующей их первичной последовательности нуклеотидов. В соответствии с этим, настоящее изобретение относится к указанным полинуклеотидам, взятым отдельно или в комбинации с носителем, вектором или клеткой-хозяином, описанными выше и кодирующим последовательность антитела согласно изобретению.
Продуцирование антитела гибридомным методом, методом отбора антитело-продуцирующих лимфоцитов (SLAM), с использованием трансгенных животных и с использованием библиотек рекомбинантных антител, более подробно описано ниже.
(1) Моноклональные анти-RGMa антитела, продуцируемые гибридомным методом
Моноклональные антитела могут быть получены с применением широкого ряда методов, известных специалистам, включая применение гибридомных технологий, рекомбинантных методов и методов фагового представления или их комбинаций. Так, например, моноклональные антитела могут быть продуцированы гибридомными методами, включая методы, известные специалистам, и описанные, например, в публикации Harlow et al., Antibodies: A Laboratory Manual, (Cold Spring Harbor Laboratory Press, 2nd ed. 1988); Hammerling, et al., in: Monoclonal Antibodies and T-Cell Hybridomas 563-681 (Elsevier, N.Y., 1981). Следует отметить, что используемый здесь термин «моноклональное антитело» не ограничивается антителами, продуцируемыми с применением гибридомной технологии. Термин «моноклональное антитело» означает антитело, происходящее от одного клона, включая любой эукариотический, прокариотический или фаговый клон, независимо от метода, которым оно было получено.
В одном из своих вариантов, настоящее изобретение относится к способам получения моноклональных антител, а также к антителам, полученным таким способом. Данный способ может включать культивирование гибридомных клеток, секретирующих антитело согласно изобретению, где гибридому, предпочтительно, получают путем слияния спленоцитов, выделенных у животного, например, у RGMa-иммунизированной крысы или мыши, с миеломными клетками, и скрининга гибридом, образованных в результате такого слияния на гибридомные клоны, секретирующее антитело, способное связываться с полипептидом согласно изобретению. Вкратце, крысы могут быть иммунизованы антигеном RGMa. В предпочтительном варианте осуществления изобретения, антиген RGMa вводят вместе с адъювантом для стимуляции иммунного ответа. Такими адъювантами являются полный или неполный адъювант Фрейнда, RIBI (мурамил-дипептиды) или ISCOM (иммуностимулирующие комплексы). Такие адъюванты могут защищать полипептид от быстрого диспергирования в результате его секвестрации в локальном положении, либо они могут содержать вещества, стимулирующие у хозяина секрецию определенных факторов, которые являются хемотаксическими по отношению к макрофагам и другим компонентам иммунной системы. При введении полипептида, предпочтительно, чтобы схема иммунизации включала два или более введений полипептида через несколько недель, однако полипептид может быть также введен один раз.
После иммунизации животного антигеном RGMa, у этого животного могут быть выделены антитела и/или антитело-продуцирующие клетки. Сыворотку, содержащую анти-RGMa антитело, берут у животного путем забора крови или после умерщвления. Эта сыворотка может быть использована в таком виде, в каком она была взята у животного, либо из этой сыворотки может быть получена фракция иммуноглобулина, либо из этой сыворотки могут быть выделены анти-RGMa антитела. Сыворотка или иммуноглобулины, полученные таким образом, являются поликлональными, то есть обладают гетерогенным рядом свойств.
После детектирования иммунного ответа, например, детектирования антител, специфичных к антигену RGMa в крысиной сыворотке, у крыс берут селезенку и выделяют спленоциты. Затем спленоциты подвергают слиянию хорошо известными методами с любыми подходящими миеломными клетками, например клетками, происходящими от клеточной линии SP20, имеющейся в Американской коллекции типовых культур (ATCC, Manassas, Va., US). Гибридомы отбирают и клонируют путем лимитирующего разведения. Затем гибридомные клоны анализируют известными методами на клетки, секретирующие антитела, способные связываться с RGMa. Асцитная жидкость, которая обычно содержит большое количество антител, может быть получена путем иммунизации крыс позитивными гибридомными клонами.
В другом варианте осуществления изобретения, антитело-продуцирующие иммортализованные гибридомы могут быть продуцированы у иммунизованного животного. После иммунизации животное умерщвляют и В-клетки селезенки подвергают слиянию с иммортализованными миеломными клетками методом, хорошо известным специалистам. См., например, Harlow & Lane, см. выше. В предпочтительном варианте осуществления изобретения, миеломные клетки не секретируют иммуноглобулиновые полипептиды (не-секреторная клеточная линия). После слияния и отбора на резистентность к антибиотикам, гибридомы скринируют с использованием RGMa или ее части или с использованием клеток, экспрессирующих RGMa. В предпочтительном варианте осуществления изобретения, предварительный скрининг осуществляют с помощью твердофазного иммуноферментного анализа (ELISA) или радиоиммуноанализа (РИА), а предпочтительно, ELISA. Пример ELISA-скрининга описан в публикации PCT № WO 00/37504.
Гибридомы, продуцирующие анти-RGMa антитело, отбирают, клонируют, а затем скринируют на нужные свойства, включая устойчивый рост гибридомы, высокий уровень продуцирования антитела, и желаемые свойства антитела, как подробно обсуждается ниже. Гибридомы могут быть культивированы и размножены in vivo у сингенных животных, у животных, у которых отсутствует иммунная система, например, у «голых» мышей или в клеточной культуре in vitro. Методы отбора, клонирования и размножения гибридом хорошо известны специалистам в данной области.
В предпочтительном варианте осуществления изобретения гибридомами являются крысиные гибридомы. В другом варианте осуществления изобретения гибридомы продуцируют у животных, не являющихся человеком и крысой, например, у мышей, овец, свиней, коз, крупного рогатого скота или лошадей. В другом предпочтительном варианте осуществления изобретения гибридомами являются человеческие гибридомы, в которых человеческая не-секреторная миелома была слита с человеческой клеткой, экспрессирующей анти-RGMa антитело.
Фрагменты антител, распознающие специфические эпитопы, могут быть продуцированы известными методами. Так, например, Fab- и F(ab')2-фрагменты могут быть продуцированы посредством протеолитического гидролиза молекул иммуноглобулина с использованием ферментов, таких как папаин (для продуцирования идентичных Fab-фрагментов) или пепсин (для продуцирования F(ab')2-фрагмента). F(ab')2-фрагмент молекулы IgG содержит два антигенсвязывающих сайта более крупной (родительской) молекулы IgG, включающей обе легкие цепи (содержащие вариабельную область и константную область легкой цепи), домены CH1 тяжелых цепей и дисульфид-образующую шарнирную область родительской молекулы IgG. В соответствии с этим, F(ab')2-фрагмент сохраняет такую же способность перекрестно связываться с молекулами антигена, как и родительская молекула IgG.
(2) Моноклональные анти-RGMa антитела, полученные с использованием технологии SLAM
В другом аспекте изобретения рекомбинантные антитела получают из отдельных выделенных лимфоцитов методом, описанным в литературе, таким как метод отбора антитело-продуцирующих лимфоцитов (SLAM), описанный в патенте США № 5627052, в публикации заявки PCT WO 92/02551 и в публикации Babcock, J.S. et al. Proc. Natl. Acad. Sci. USA 93:7843-7848 (1996). В этом методе одиночные клетки, секретирующие представляющие интерес антитела, например, лимфоциты, происходящие от одного из иммунизованных животных, скринируют с помощью анализа антиген-специфических гемолитических бляшек, где антиген RGMa, субъединицу RGMa или их фрагмент подвергают связыванию с овечьими эритроцитами с помощью линкера, такого как биотин, и используют для идентификации одиночных клеток, секретирующих антитела, специфичные к RGMa. После идентификации представляющих интерес антитело-секретирующих клеток, из этих клеток высвобождают кДНК вариабельной области тяжелой и легкой цепи с помощью ПЦР с обратной транскриптазой (ОТ-ПЦР), после чего такие вариабельные области могут быть экспрессированы в окружении соответствующих константных областей иммуноглобулинов (например, человеческих константных областей) в клетках-хозяевах млекопитающих, таких как клетки COS или CHO. Эти клетки-хозяева, трансфицированные амплифицированными последовательностями иммуноглобулина, происходящими от in vivo отобранных лимфоцитов, могут быть подвергнуты дополнительному анализу и отбору in vitro, например, путем пэннинга трансфицированных клеток в целях выделения клеток, экспрессирующих антитела против RGMa. Затем амплифицированные последовательности иммуноглобулина могут быть модифицированы in vitro, например, методами созревания аффинности in vitro. См., например, публикацию заявки PCT WO 97/29131 и публикацию заявки PCT WO 00/56772.
(3) Моноклональные анти-RGMa антитела, полученные с использованием трансгенных животных
В другом варианте осуществления изобретения антитела получают путем иммунизации животного, не являющегося человеком и содержащего некоторые или все локусы человеческих иммуноглобулинов, антигеном RGMa. В одном из вариантов осуществления изобретения животным, не являющимся человеком, является трансгенная мышь XENOMOUSE®, то есть искусственно сконструированный штамм мыши, который содержит крупные фрагменты локусов человеческого иммуноглобулина и является дефицитным по продуцированию мышиного антитела. См., например, Green et al. Nature Genetics 7:13-21 (1994) и патенты США №№ 5916771, 5939598, 5985615, 5998209, 6075181, 6091001, 6114598 и 6130364. См. также публикации заявок РСТ №№ WO 91/10741; WO 94/02602; WO 96/34096; WO 96/33735; WO 98/16654; WO 98/24893; WO 98/50433; WO 99/45031; WO 99/53049; WO 00/09560; и WO 00/37504. Трансгенная мышь XENOMOUSE продуцирует репертуар полностью человеческих антител, подобных антителам взрослого человека, и генерирует антигенспецифические человеческие моноклональные антитела. Трансгенная мышь XENOMOUSE® содержит приблизительно 80% репертуара человеческих антител, что обусловлено введением фрагментов локусов человеческой тяжелой цепи и х локусов человеческой легкой цепи, имеющих размер мегаоснований и конфигурацию зародышевых линий YAC. См. публикации Mendez et al., Nature Genetics 15:146-156 (1997), Green & Jakobovits J. Exp. Med. 188:483-495 (1998), которые вводятся в настоящее описание посредством ссылки.
(4) Моноклональные анти-RGMa антитела, полученные с использованием библиотек рекомбинантных антител
Методы in vitro могут быть также применены для получения антител согласно изобретению, где указанную библиотеку антител скринируют для идентификации антитела, обладающего нужной специфичностью связывания с RGMa. Методы такого скрининга библиотек рекомбинантных антител хорошо известны специалистам и включают методы, описанные, например, в патенте США № 5223409 (Ladner et al.); в публикации заявки PCT WO 92/18619 (Kang et al.); в публикации заявки PCT WO 91/17271 (Dower et al.); в публикации заявки PCT WO 92/20791 (Winter et al.); в публикации заявки PCT WO 92/15679 (Markland et al.); в публикации заявки PCT WO 93/01288 (Breitling et al.); в публикации заявки PCT WO 92/01047 (McCafferty et al.); в публикации заявки PCT WO 92/09690 (Garrard et al.); Fuchs et al., Bio/Technology, 9: 1369-1372 (1991); Hay et al., Hum. Antibod. Hybridomas, 3: 81-85 (1992); Huse et al., Science, 246: 1275-1281 (1989); McCafferty et al., Nature, 348: 552-554 (1990); Griffiths et al., EMBO J., 12: 725-734 (1993); Hawkins et al., J. Mol. Biol, 226: 889- 896 (1992); Clackson et al., Nature, 352: 624-628 (1991); Gram et al., Proc. Natl. Acad. Sci. USA, 89: 3576-3580 (1992); Garrard et al., Bio/Technology, 9: 1373-1377 (1991); Hoogenboom et al., Nucl. Acids Res., 19: 4133-4137 (1991); Barbas et al., Proc. Natl. Acad. Sci. USA, 88: 7978-7982 (1991); в публикации заявки на патент США № 2003/0186374; и в публикации заявки PCT WO 97/29131, содержание которых вводится в настоящее описание посредством ссылки.
Библиотека рекомбинантных антител может быть получена от индивидуума, иммунизованного RGMa или его частью. Альтернативно, библиотека рекомбинантных антител может быть получена от неиммунизованного индивидуума, то есть от индивидуума, который не был иммунизован RGMa, то есть библиотека человеческих антител может быть получена от человека, который не был иммунизован человеческим RGMa. Антитела согласно изобретению отбирают путем скрининга библиотеки рекомбинантных антител с использованием пептида, содержащего человеческий RGMa, и тем самым отбора антител, распознающих RGMa. Методы проведения такого скрининга и отбора хорошо известны специалистам и описаны в работах, указанных в предыдущем параграфе. Для отбора антител согласно изобретению, обладающих конкретными аффинностями связывания с RGMa, то есть способностью диссоциироваться из человеческого RGMa с конкретной константой скорости диссоциации Koff, может быть применен хорошо известный метод поверхностного плазмонного резонанса, позволяющий проводить отбор антител с нужной константой скорости диссоциации Koff. Для отбора антител согласно изобретению, обладающих конкретной hRGMa-нейтрализующей активностью, такой как активность с определенной концентрацией IC50, могут быть применены стандартные методы оценки уровня ингибирования активности RGMa.
В одном из своих аспектов, настоящее изобретение относится к выделенному антителу или к его антигенсвязывающей части, которые связываются с человеческим RGMa. Предпочтительно, указанным антителом является нейтрализующее антитело. В различных вариантах осуществления изобретения, указанным антителом является рекомбинантное антитело или моноклональное антитело.
Так, например, антитела согласно изобретению могут быть также получены различными методами фагового представления, известными специалистам. В методах фагового представления, функциональные домены антител представляют на поверхности фаговых частиц, которые несут полинуклеотидные последовательности, кодирующие эти домены. Такой фаг может быть использован для представления антигенсвязывающих доменов, экспрессированных из репертуара или комбинаторной библиотеки антител (например, человеческих или мышиных антител). Фаг, экспрессирующий антигенсвязывающий домен, который связывается с представляющим интерес антигеном, может быть отобран или идентифицирован с использованием антигена, например, меченного антигена или антигена, связанного с твердой поверхностью или сферой, или иммобилизованного на этой поверхности или сфере. Фагом, используемым в этих методах, обычно является нитчатый фаг, включающий связывающие домены фагов fd и M13, экспрессируемые из фага, имеющего домены Fab-фрагмента, Fv-фрагмента или стабилизированного дисульфидом Fv-фрагмента антител, рекомбинантно присоединенных к белку фагового гена III или VIII. Примерами методов фагового представления, которые могут быть применены для получения антител согласно изобретению, являются методы, описанные Brinkman et al., J. Immunol. Methods 182:41-50 (1995); Ames et al., J. Immunol. Methods 184:177-186 (1995); Kettleborough et al., Eur. J. Immunol. 24:952-958 (1994); Persic et al., Gene 187 9-18 (1997); Burton et al., Advances in Immunology 57:191-280 (1994); в публикации заявки PCT № WO 92/01047, в публикациях заявок PCT WO 90/02809; WO 91/10737; WO 92/01047; WO 92/18619; WO 93/11236; WO 95/15982; WO 95/20401; и в патентах США NN 5698426; 5223409; 5403484; 5580717; 5427908; 5750753; 5821047; 5571698; 5427908; 5516637; 5780225; 5658727; 5733743 и 5969108.
Как описано в цитируемых выше работах, после отбора фага, антитело-кодирующие области фага могут быть выделены и использованы для получения полноразмерных антител, включая человеческие антитела или любой другой нужный антигенсвязывающий фрагмент, и экспрессированы в любом нужном хозяине, включая клетки млекопитающих, клетки насекомых, клетки растений, дрожжи и бактерии, например, подробно описанные ниже. Так, например, способы рекомбинантного продуцирования Fab-, Fab'- и F(ab’)2-фрагментов могут быть также осуществлены с применением методов, известных специалистам, таких как методы, описанные в публикации заявки РСТ WO 92/22324; и в публикациях Mullinax et al., BioTechniques 12(6):864-869 (1992); Sawai et al., AJRI 34:26-34 (1995); и Better et al., Science 240:1041-1043 (1988). Примерами методов, которые могут быть применены для продуцирования одноцепочечных Fv-фрагментов и антител, являются методы, описанные в патентах США 4946778 и 5258498; и в публикациях Huston et al., Methods in Enzymology 203:46-88 (1991); Shu et al., PNAS 90:7995-7999 (1993); и Skerra et al., Science 240:1038-1040 (1988).
В качестве альтернативы скринингу библиотек рекомбинантных антител методом фагового представления, используемому для идентификации антител согласно изобретению, могут быть применены и другие методы, известные специалистам в области скрининга крупных комбинаторных библиотек. Одним из типов альтернативной экспрессионной системы является система, в которой библиотеку рекомбинантных антител экспрессируют в виде гибрида РНК-белок, как описано в публикации заявки PCT WO 98/31700 (Szostak и Roberts) и в публикации Roberts, R.W. и Szostak, J. W. Proc. Natl. Acad. Sci. USA 94:12297-12302 (1997). В этой системе, ковалентное связывание осуществляется между мРНК и пептидом или белком, которые она кодирует, посредством in vitro трансляции синтетических мРНК, несущих, у своего 3'-конца, пуромицин, то есть антибиотик-акцептор пептидила. Таким образом, специфическая мРНК может быть обогащена из комплексной смеси мРНК (например, комбинаторной библиотеки), исходя из свойств кодируемого пептида или белка, например, антитела или его части, таких как связывание антитела или его части с антигеном с двойной специфичностью. Последовательности нуклеиновой кислоты, кодирующие антитела или их части, выявленные путем скрининга указанных библиотек, могут быть экспрессированы описанными выше рекомбинантными методами (например, в клетках-хозяевах млекопитающих) и кроме того, они могут быть подвергнуты последующему созреванию аффинности путем проведения либо дополнительных раундов скрининга гибридов мРНК-пептид, в которых в их первоначально отобранную(ые) последовательность(и) были введены мутации, либо другими методами созревания аффинности рекомбинантных антител in vitro, описанными выше. Предпочтительным примером такого метода является технология представления PROfusion.
В другом подходе, антитела согласно изобретению могут быть также получены методами дрожжевого представления, известными специалистам. В методах дрожжевого представления, для связывания доменов антител со стенками дрожжевых клеток и их представления на поверхности дрожжей применяются генетические методы. В частности, такие дрожжи могут быть использованы для представления антигенсвязывающих доменов, экспрессируемых из репертуара или комбинаторной библиотеки антител (например, человеческих или мышиных антител). Примерами методов дрожжевого представления, которые могут быть применены для получения антител согласно изобретению, являются методы, описанные в патенте США № 6699658 (Wittrup, et al.), который вводится в настоящее описание посредством ссылки.
d. Продуцирование рекомбинантных анти-RGMa антител
Антитела согласно изобретению могут быть получены любыми методами, известными специалистам. Так, например, экспрессию в клетках-хозяевах, где экспрессионный(е) вектор(ы), кодирующий(ие) тяжелую и легкую цепи, был(и) перенесен(ы) в указанную клетку-хозяина, осуществляют стандартными методами. Различные формы термина «трансфекция» охватывают широкий ряд методов, обычно применяемых для введения экзогенной ДНК в прокариотические или эукариотические клетки-хозяева, например, электропорацию, осаждение фосфатом кальция, трансфекцию, опосредуемую DEAE-декстраном, и т.п. Хотя антитела согласно изобретению могут экспрессироваться в прокариотических или эукариотических клетках-хозаевах, однако эти антитела экспрессируют, предпочтительно, в эукариотических клетках, а наиболее предпочтительно, в клетках-хозяевах млекопитающих, поскольку такие эукариотические клетки (а в частности, клетки млекопитающих) с большей вероятностью, чем прокариотические клетки, будут подвергаться сборке и секретировать «правильно» уложенное и иммунологически активное антитело.
Репрезентативными клетками-хозяевами млекопитающих, используемыми для экспрессии рекомбинантных антител согласно изобретению, являются клетки яичника китайского хомячка (клетки CHO) (включая клетки dhfr-CHO, описанные Urlaub и Chasin, (Proc. Natl. Acad. Sci. USA 77:4216-4220 (1980)), используемые с DHFR-селективным маркером, например, как описано Kaufman и Sharp, J. (Mol. Biol. 159:601-621 (1982)), клетки миеломы NSO, клетки COS и клетки SP2. После введения рекомбинантных экспрессионных векторов, содержащих гены антител, в клетки-хозяева млекопитающих, антитела получают путем культивирования клеток-хозяев в течение периода времени, достаточного для экспрессии антитела в клетках-хозяевах или, более предпочтительно, секреции антитела в культуральную среду, в которой выращивают клетки-хозяева. Антитела могут быть выделены из культуральной среды стандартными методами очистки белков.
Клетки-хозяева могут быть также использованы для продуцирования функциональных фрагментов антитела, таких как Fab-фрагменты или молекулы scFv. При этом совершенно очевидно, что в вышеуказанные способы могут быть внесены изменения, не выходящие за рамки объема настоящего изобретения. Так, например, может оказаться желательным трансфицировать клетки-хозяева ДНК, кодирующей функциональные фрагменты легкой цепи и/или тяжелой цепи антитела согласно изобретению. Технология рекомбинантных ДНК может быть использована для удаления некоторых или всех ДНК, кодирующих любые или обе легкие и тяжелые цепи, которые не являются необходимыми для связывания с представляющим интерес антигеном. Антитела согласно изобретению также охватывают молекулы, экспрессированные из таких усеченных молекул ДНК. Кроме того, могут быть продуцированы бифункциональные антитела, в которых одна тяжелая цепь и одна легкая цепь представляют собой антитело согласно изобретению (то есть связываются с человеческой молекулой RGMa), а другая тяжелая цепь и легкая цепь являются специфичными к другому антигену, отличающемуся от RGMa и продуцирование таких антител осуществляют стандартными методами химического связывания, то есть путем перекрестного связывания антитела согласно изобретению со вторым антителом.
В предпочтительной системе рекомбинантной экспрессии антитела или его антигенсвязывающей части согласно изобретению, рекомбинантный экспрессионный вектор, кодирующий тяжелую цепь антитела и легкую цепь антитела, встраивают в клетки dhfr-СHO методом трансфекции, опосредуемой фосфатом кальция. В рекомбинантном экспрессионном векторе, гены тяжелой и легкой цепи антитела функционально присоединены к регуляторным элементам «энхансер CMV/промотор AdMLP», что приводит к запуску транскрипции генов на высоком уровне. Рекомбинантный экспрессионный вектор также несет ген DHFR, что позволяет проводить отбор клеток CHO, трансфицированных вектором, путем их культивирования в присутствии метотрексата/амплификации. Отобранные трансформированные клетки-хозяева культивируют для экспрессии тяжелой и легкой цепей антитела и из культуральной среды выделяют интактное антитело. Для получения рекомбинантного экспрессионного вектора, трансфекции клеток-хозяев, отбора трансформантов, культивирования клеток-хозяев и выделения антитела из культуральной среды применяют стандартные методы молекулярной биологии. Настоящее изобретение также относится к способу синтеза рекомбинантного антитела согласно изобретению путем культивирования клеток-хозяев согласно изобретению в подходящей культуральной среде с получением рекомбинантного антитела согласно изобретению. Этот способ может также включать выделение рекомбинантного антитела из культуральной среды.
(а) Гуманизованное антитело
Гуманизованное антитело может представлять собой антитело или его вариант, производное, аналог или фрагмент, которые иммуноспецифически связываются с представляющим интерес антигеном и содержат каркасную область (FR), имеющую, в основном, аминокислотную последовательность человеческого антитела и гипервариабельную область (СDR), имеющую, в основном, аминокислотную последовательность не-человеческого антитела. Гуманизованное антитело может происходить от не-человеческого антитела, связывающегося с нужным антигеном и имеющего одну или более гипервариабельных областей (СDR), происходящих от не-человеческих антител и каркасные области, происходящие от человеческой молекулы иммуноглобулина.
Используемый здесь термин «в основном», относящийся к CDR, означает, что CDR имеет аминокислотную последовательность, которая по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 98% или по меньшей мере на 99% идентична аминокислотной последовательности СDR не-человеческого антитела. Гуманизованное антитело включает, в основном, все или по меньшей мере один, а обычно два вариабельных домена (Fab, Fab', F(ab’)2, FabC, Fv), в которых все или, в основном, все области CDR соответствуют не-человеческому иммуноглобулину (то есть донорному антителу), а все или, в основном, все каркасные области представляют собой области, имеющие консенсусную последовательность человеческого иммуноглобулина. В одном из аспектов, гуманизованное антитело также содержит по меньшей мере часть константной области иммуноглобулина (Fc), а обычно человеческого иммуноглобулина. В некоторых вариантах осуществления изобретения, гуманизованное антитело содержит легкую цепь, а также по меньшей мере вариабельный домен тяжелой цепи. Такое антитело также может включать области CH1, шарнирную область и области CH2, CH3 и CH4 тяжелой цепи. В некоторых вариантах осуществления изобретения, гуманизованное антитело содержит только гуманизованную легкую цепь. В некоторых вариантах осуществления изобретения, гуманизованное антитело содержит только гуманизованную тяжелую цепь. В конкретных вариантах осуществления изобретения, гуманизованное антитело содержит только гуманизованный вариабельный домен легкой цепи и/или тяжелой цепи.
Гуманизованное антитело может быть выбрано из иммуноглобулинов любого класса, включая IgM, IgG, IgD, IgA и IgE и любого изотипа, включая, но не ограничиваясь ими, IgG1, IgG2, IgG3 и IgG4. Гуманизованное антитело может содержать последовательности, происходящие от антител более чем одного класса или изотипа, а конкретные константные домены могут быть выбраны для оптимизации нужных эффекторных функций методами, хорошо известными специалистам.
Каркасные области и CDR гуманизованного антитела необязательно должны точно соответствовать родительским последовательностям, так, например, CDR донорного антитела или консенсусная каркасная область могут быть подвергнуты мутагенезу путем замены инсерции и/или делеции по меньшей мере одного аминокислотного остатка так, чтобы CDR или каркасный остаток в этом сайте не соответствовал остатку донорного антитела или консенсусной каркасной области. Однако в одном из вариантов осуществления изобретения такие мутации не должны быть избыточными. Обычно остатки гуманизованного антитела по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 98% или по меньшей мере на 99% соответствуют остаткам последовательностей родительских FR и CDR. Используемый здесь термин «консенсусная каркасная область» означает каркасную область в консенсусной последовательности иммуноглобулина. Используемый здесь термин «консенсусная последовательность иммуноглобулина» означает последовательность, происходящую от наиболее часто встречающихся аминокислот (или нуклеотидов) в семействе родственных последовательностей иммуноглобулина (см., например, Winnaker, From Genes to Clones (Verlagsgesellschaft, Weinheim, Germany 1987)). В семействе иммуноглобулинов, каждое положение в консенсусной последовательности занято аминокислотой, наиболее часто встречающейся в этом положении указанного семейства. Если две аминокислоты встречаются с одинаковой частотой, то в консенсусной последовательности может присутствовать любая из этих аминокислот.
Гуманизованное антитело может быть сконструировано в целях минимизации нежелательного иммунологического ответа на воздействие не-человеческих антител грызунов, которые ограничивают продолжительность и эффективность терапевтического действия этих молекул у человека-реципиента. Гуманизованное антитело могут иметь один или более введенных аминокислотных остатков, происходящих от не-человеческого источника. Эти не-человеческие остатки часто называют «импортными» остатками, которые обычно получают из вариабельного домена. Гуманизация может быть осуществлена путем замены последовательностей гипервариабельной области соответствующими последовательностями человеческого антитела. В соответствии с этим, такими «гуманизованными антителами» являются химерные антитела, где вариабельный домен, который имеет, в основном, меньший размер, чем интактный человеческий вариабельный домен, был заменен соответствующей последовательностью, происходящей от не-человеческого антитела. См., например, патент США № 4816567, содержание которого вводится в настоящее описание посредством ссылки. Гуманизованным антителом может быть человеческое антитело, в котором некоторые остатки гипервариабельной области и, возможно, некоторые остатки FR заменены остатками, происходящими из аналогичных сайтов антител грызунов. Гуманизация или конструирование антител согласно изобретению могут быть осуществлены любым известным методом, например, такими методами, но не ограничивающимися ими, как методы, описанные в патентах США №№ 5723323; 5976862; 5824514; 5817483; 5814476; 5763192; 5723323; 5766886; 5714352; 6204023; 6180370; 5693762; 5530101; 5585089; 5225539 и 4816567.
Гуманизованное антитело может сохранять высокую аффинность по отношению к RGMa и другие предпочтительные биологические свойства. Гуманизованное антитело может быть получено с помощью анализа родительских последовательностей и различных концептуальных гуманизованных продуктов с использованием трехмерных моделей родительских и гуманизованных последовательностей. Трехмерные модели иммуноглобулинов являются общедоступными. Существуют компьютерные программы, которые иллюстрируют и представляют вероятные трехмерные конформационные структуры выбранных последовательностей-кандидатов иммуноглобулина. Анализ таких представлений позволяет определить вероятную роль этих остатков в функционировании последовательности-кандидата иммуноглобулина, то есть выявить остатки, влияющие на способность иммуноглобулина-кандидата связываться с антигеном. Таким образом, остатки FR могут быть выбраны из последовательностей реципиента и «импортных» последовательностей и объединены так, чтобы получить антитело с желаемыми свойствами, такими как повышенная аффинность по отношению к RGMa. В общих чертах, остатки гипервариабельной области могут непосредственно и в самой высокой степени влиять на связывание с антигеном.
В качестве альтернативы гуманизации могут быть получены человеческие антитела (также называемые здесь «полностью человеческими антителами»). Так, например, человеческие антитела могут быть выделены из библиотек с применением методов PROfusion и/или технологий с использованием дрожжей. См. примеры, представленные ниже. Могут быть также продуцированы трансгенные животные (например, мыши, которые обладают способностью, после иммунизации, продуцировать полный репертуар человеческих антител в отсутствии продуцирования эндогенного иммуноглобулина). Так, например, гомозиготная делеция гена в области стыка тяжелой цепи антител (JH) у химерных мышей и у мутантных мышей зародышевой линии приводит к полному ингибированию продуцирования эндогенного антитела. Перенос массива генов человеческого иммуноглобулина зародышевой линии таким мутантным мышам зародышевой линии будет приводить к продуцированию человеческих антител после воздействия антигена. Гуманизованные или полностью человеческие антитела могут быть получены методами, описанными в патентах США №№ 5770429; 5833985; 5837243; 5922845; 6017517; 6096311; 6111166; 6270765; 6303755; 6365116; 6410690; 6682928 и 6984720, содержание которых вводится в настоящее описание посредством ссылки.
3. Фармацевтические композиции
Антитело может быть компонентом фармацевтической композиции. Фармацевтическая композиция может также содержать фармацевтически приемлемый носитель. Фармацевтические композиции, содержащие антитела согласно изобретению, могут быть использованы в целях, но не ограничивающихся ими, диагностики, детектирования или мониторинга расстройства, а также для предупреждения, лечения, устранения или снижения тяжести расстройства, либо одного или более его симптомов и/или они могут быть использованы в исследованиях. В конкретном варианте изобретения, композиция содержит одно или более антител согласно изобретению. В другом варианте осуществления изобретения, фармацевтическая композиция содержит одно или более антител согласно изобретению и одно или более профилактических или терапевтических средств, не являющихся антителами согласно изобретению и использующихся для лечения данного расстройства, которое ассоциируется с нарушением активности, направленной на ингибирование RGMa. В другом варианте осуществления изобретения применяются профилактические или терапевтические средства, которые, как известно, могут быть использованы, были использованы или используются в настоящее время для предупреждения, лечения, устранения или снижения тяжести расстройства или одного или более его симптомов. В соответствии с этими вариантами, указанная композиция может также содержать носитель, разбавитель или наполнитель.
Антитела согласно изобретению могут быть включены в фармацевтические композиции, подходящие для введения индивидууму. Обычно, фармацевтическая композиция содержит антитело согласно изобретению и фармацевтически приемлемый носитель. Используемый здесь термин «фармацевтически приемлемый носитель» включает любые и все растворители, дисперсионные среды, материал для покрытий, антибактериальные и противогрибковые средства изотонические агенты и агенты, замедляющие абсорбцию, и т.п., которые являются физиологически совместимыми. Примерами фармацевтически приемлемых носителей являются один или более компонентов, таких как вода, физиологический раствор, забуференный фосфатом физиологический раствор, декстроза, глицерин, этанол и т.п., а также их комбинации. Во многих случаях, в указанную композицию предпочтительно, включают изотонические агенты, например, сахара, многоатомные спирты, такие как маннит и сорбит или хлорид натрия. Фармацевтически приемлемые носители могут также содержать небольшие количества вспомогательных веществ, таких как смачивающие или эмульгирующие агенты, консерванты или буферы, которые позволяют увеличивать срок годности или эффективность антитела.
В другом варианте осуществления изобретения, фармацевтическая композиция содержит по меньшей мере одно дополнительное терапевтическое средство, используемое для лечения описанного здесь расстройства.
Различные системы доставки известны специалистам и могут быть использованы для введения одного или более антител согласно изобретению или комбинаций одного или более антител согласно изобретению и профилактического или терапевтического средства, подходящих для предупреждения, лечения, устранения или снижения тяжести расстройства или одного или более его симптомов, например, введения путем инкапсулирования в липосомы, в микрочастицы, в микрокапсулы, в рекомбинантные клетки, способные экспрессировать антитело или его фрагмент; введения посредством рецептор-опосредуемого эндоцитоза (см., например, Wu & Wu, J. Biol. Chem. 262:4429-4432 (1987)) и путем конструирования нуклеиновой кислоты как части ретровирусного или другого вектора и т.п. Методы введения профилактического или терапевтического средства согласно изобретению включают, но не ограничиваются ими, парентеральное введение (например, интрадермальное, внутримышечное, внутрибрюшинное, внутривенное и подкожное), эпидуральное введение, введение в опухоль и введение в слизистую (например, интраназальное и пероральное введение). Кроме того, введение в легкие может быть осуществлено, например, с использованием ингалятора или аэрозольного распылителя и препарата, содержащего аэрозоль-образующий агент. См., например, патенты США №№ 6019968; 5985320; 5985309; 5934272; 5874064; 5855913; 5290540; и 4880078; и публикации заявок PCT WO 92/19244; WO 97/32572; WO 97/44013; WO 98/31346 и WO 99/66903, которые во всей своей полноте вводятся в настоящее описание посредством ссылки. В одном из вариантов осуществления изобретения, антитело согласно изобретению, средства для комбинированной терапии или композицию согласно изобретению вводят с применением технологии доставки лекарственного средства в легкие Alkermes AIR® (Alkermes, Inc., Cambridge, Mass.). В конкретном варианте осуществления изобретения, профилактические или терапевтические средства согласно изобретению вводят внутримышечно, внутривенно, вовнутрь опухоли, перорально, интраназально, в легкие или подкожно. Профилактические или терапевтические средства могут быть введены любым стандартным способом, например, путем вливания или инъекции ударной дозы, путем абсорбции через эпителиальную или кожно-слизистую выстилку (например, через слизистую ротовой полости, слизистую прямой кишки и тонкой кишки и т.п.) и эти средства могут быть также введены в комбинации с другими биологически активными агентами. Введение может быть системным или местным.
В конкретном варианте осуществления изобретения может оказаться желательным местное введение антител согласно изобретению в область, на которую направлено лечение, и это может быть достигнуто, например, такими способами, но не ограничивающимися ими, как местная инфузия, инъекция или введение имплантата, где указанный имплантат состоит из пористого или не-пористого материала, включая мембраны и матрицы, такие как силастические мембраны, полимеры, волокнистый матрикс (например, Tissuel®) или коллагеновый матрикс. В одном из вариантов осуществления изобретения, эффективное количество одного или более антител согласно изобретению вводят пациенту местно в пораженную область для предупреждения, лечения, устранения и/или снижения тяжести расстройства или его симптомов. В другом варианте осуществления изобретения, эффективное количество одного или более антител согласно изобретению вводят местно в пораженную область в комбинации с эффективным количеством одного или более терапевтических средств (например, одного или более профилактических или терапевтических средств), не являющихся антителом согласно изобретению и используемых для предупреждения, лечения, устранения и/или снижения тяжести расстройства или одного или более его симптомов.
В другом варианте осуществления изобретения, антитело может быть доставлено в виде системы регулируемого высвобождения или системы пролонгированного высвобождения. В одном из вариантов осуществления изобретения, для достижения регулируемого или пролонгированного высвобождения может быть использован насос (Langer, см. выше; Sefton, 1987, CRC Crit. Ref. Biomed. Eng. 14:20; Buchwald et al., 1980, Surgery 88:507; Saudek et al., 1989, N. Engl. J. Med. 321:574). В другом варианте осуществления изобретения, для обеспечения регулируемого или пролонгированного высвобождения терапевтических средств согласно изобретению могут быть использованы полимерные материалы (см., например, Medical Applications of Controlled Release, Langer and Wise (eds.), CRC Pres., Boca Raton, FIa. (1974); Controlled Drug Bioavailability, Drug Product Design and Performance, Smolen and Ball (eds.), Wiley, New York (1984); Ranger and Peppas, 1983, J., Macromol. Sci. Rev. Macromol. Chem. 23:61; см. также Levy et al., 1985, Science 228:190; During et al., 1989, Ann. Neurol. 25:351; Howard et al., 1989, J. Neurosurg. 71:105); патент США № 5679377; патент США № 5916597; патент США № 5912015; патент США № 5989463; патент США № 5128326; публикацию РСТ № WO 99/15154; и публикацию PCT № WO 99/20253. Примерами полимеров, используемых в препаратах пролонгированного высвобождения, являются, но не ограничиваются ими, поли(2-гидроксиэтилметакрилат), полиметилметакрилат, полиакриловая кислота, сополимер этилена и винилацетата, полиметакриловая кислота, полигликолиды (ПЛГ), полиангидриды, поли-N-винилпирролидон, поливиниловый спирт, полиакриламид, полиэтиленгликоль, полилактиды (PLA), сополимеры лактида и гликолида (PLGA) и полиортоэфиры. В конкретном варианте осуществления изобретения, полимер, используемый в препарате пролонгированного высвобождения, является инертным, не содержит выщелачиваемых примесей, является стабильным при хранении, стерильным и биологически разлагаемым. В другом варианте осуществления изобретения, система регулируемого или пролонгированного высвобождения может быть введена поблизости от профилактической или терапевтической мишени, для чего потребуется лишь часть системной дозы (см., например, Goodson, in Medical Applications of Controlled Release, supra, vol. 2, pp. 115-138 (1984)).
Системы регулируемого высвобождения обсуждаются в работе Langer (1990, Science 249:1527-1533). Для получения препаратов пролонгированного высвобождения, содержащих одно или несколько антител согласно изобретению, может быть применен любой метод, известный специалистам в данной области. См., например, патент США № 4526938, публикацию заявки РСТ WO 91/05548, публикацию заявки PCT WO 96/20698, Ning et al., 1996, «Intratumoral Radioimmunotheraphy of a Human Colon Cancer Xenograft Using a Sustained-Release Gel» Radiotherapy & Oncology 39:179-189, Song et al., 1995, «Antibody Mediated Lung Targeting of Long- Circulating Emulsions» PDA Journal of Pharmaceutical Science &Technology 50:372-397, Cleek et al., 1997, «Biodegradable Polymeric Carriers for a bFGF Antibody for Cardiovascular Application» Pro. Int'l. Symp. Control. ReI. Bioact. Mater. 24:853-854 и Lam et al., 1997, «Microencapsulation of Recombinant Humanized Monoclonal Antibody for Local Delivery» Proc. Int'l. Symp. Control ReI. Bioact. Mater. 24:759-760, которые во всей своей полноте вводятся в настоящее описание посредством ссылки.
В конкретном варианте осуществления изобретения, если композицией согласно изобретению является нуклеиновая кислота, кодирующая антитело, то такая нуклеиновая кислота может быть введена in vivo для стимуляции экспрессии кодируемых ею антител, например, путем ее конструирования как части соответствующего вектора, экспрессирующего нуклеиновую кислоту, с последующим ее введением так, чтобы она проникала вовнутрь клетки, например, с использованием ретровирусного вектора (см. патент США № 4980286), либо посредством прямой инъекции, либо посредством бомбардировки микрочастицами (например, с использованием «дробовика» для выстреливания генов; Biolistic, Dupont), либо покрытия липидами, рецепторами клеточной поверхности или трансфицирующими агентами; либо путем ее включения в форме, связанной с гомеобокс-подобным пептидом, который, как известно, встраивается в ядро (см., например, Joliot et al., 1991, Proc. Natl. Acad. Sci. USA 88:1864-1868). Альтернативно, нуклеиновая кислота может быть введена вовнутрь клетки и встроена в ДНК клетки-хозяина для экспрессии посредством гомологичной рекомбинации.
Фармацевтическую композицию согласно изобретению получают в форме, совместимой с предполагаемым способом введения. Примерами способов введения являются, но не ограничиваются ими, парентеральное введение, например, внутривенное введение, интрадермальное введение, подкожное введение, пероральное введение интраназальное введение (например, путем ингаляции), трансдермальное введение (например, местное введение), введение через слизистую и ректальное введение. В конкретном варианте осуществления изобретения, указанную композицию приготавливают рутинными методами в виде фармацевтической композиции, адаптированной для внутривенного, подкожного, внутримышечного, перорального, интраназального или местного введения человеку. Обычно композиции для внутривенного введения представляют собой растворы в стерильном изотоническом водном буфере. При необходимости, такая композиция может также включать солюбилизирующий агент и местный анестетик, такой как лигнокаин для облегчения боли на участке инъекции.
Если композиции согласно изобретению вводят местно, то они могут быть приготовлены в виде мази, крема, чрезкожного пластыря, лосьона, геля, шампуня, спрея, аэрозоля, раствора, эмульсии или другой формы, хорошо известной специалистам. См., например, Remington's Pharmaceutical Sciences и Introduction to Pharmaceutical Dosage Forms, 19th ed., Mack Pub. Co., Easton, Pa. (1995). В случае применения лекарственных форм для местного введения, не являющихся спреем, обычно используют вязкие или полутвердые или твердые формы, содержащие носитель или один или более наполнителей, совместимых с местным введением и имеющих динамическую вязкость, превышающую динамическую вязкость воды. Подходящими препаратами являются, но не ограничиваются ими, растворы, суспензии, эмульсии, кремы, жидкие мази, порошки, пастообразные мази, твердые мази и т.п., которые, при необходимости, могут быть стерилизованы или смешаны со вспомогательными агентами (например, с консервантами, стабилизаторами, смачивающими агентами, буферами или солями) для изменения различных свойств, таких как, например, осмотическое давление. Другими подходящими лекарственными формами для местного введения являются распыляемые аэрозольные препараты, в которых активный ингредиент, присутствующий в комбинации с твердым или жидким инертным носителем, упакован в виде смеси с летучими веществами под давлением (например, с газообразным пропеллентом, таким как фреон) или упакован в бутыль под давлением. В фармацевтические композиции и в лекарственные формы могут быть добавлены, если это необходимо, увлажнители или смачивающие средства. Примеры таких дополнительных ингредиентов хорошо известны специалистам.
Если способ согласно изобретению включает интраназальное введение композиции, то такая композиция может быть приготовлена в форме аэрозоля, спрея, паров, создающих туман или в форме капель. В частности, профилактические или терапевтические средства, используемые в настоящем изобретении, могут быть легко доставлены в форме аэрозольного спрея из упаковок под давлением или аэрозольного ингалятора с использованием подходящего пропеллента (например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, диоксида углерода или другого подходящего газа). В случае использования аэрозоля под давлением, унифицированная доза лекарственной формы может быть определена с помощью дозирующего клапана. Могут быть приготовлены капсулы и картриджи (состоящие, например, из желатина) для их использования в ингаляторе или в инсуффляторе, где указанные капсулы и картриджи содержат порошкообразную смесь соединения и подходящей порошкообразной основы, такой как лактоза или крахмал.
Если способ согласно изобретению включает пероральное введение, то композиции для такого перорального введения могут быть приготовлены в форме таблеток, капсул, саше, гелевых капсул, растворов, суспензий и т.п. Таблетки или капсулы могут быть получены стандартными методами с использованием фармацевтически приемлемых наполнителей, таких как связывающие агенты (например, кукурузный крахмал в предварительной стадии желатинизации, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза или бифосфат кальция); замасливатели (например, стеарат магния, тальк или двуокись кремния); дезинтеграторы (например, кукурузный крахмал или натрий-содержащий гликолят крахмала); или смачивающие агенты (например, лаурилсульфат натрия). На таблетки могут быть нанесены покрытия хорошо известными методами. Жидкие препараты для перорального введения могут быть приготовлены в таких формах, но не ограничивающихся ими, как растворы, сиропы или суспензии, либо они могут быть получены в виде сухого продукта, который, перед его применением, может быть разведен водой или другим подходящим носителем. Такие жидкие препараты могут быть получены стандартными методами с использованием фармацевтически приемлемых добавок, таких как суспендирующие агенты (например, сорбитоловый сироп, производные целлюлозы или гидрогенизированные пищевые жиры); эмульгирующие агенты (например, лецитин и аравийская камедь); безводные носители (например, миндальное масло, эфиры масел, этиловый спирт или фракционированные растительные масла); и консерванты (например, метил- или пропил-п-гидроксибензоаты или сорбиновая кислота). Эти препараты могут также содержать забуферивающие соли, ароматизаторы, красители и подсластители, если это необходимо. Препараты для перорального введения могут быть соответствующим образом приготовлены для достижения замедленного высвобождения, регулируемого высвобождения или пролонгированного высвобождения профилактического(их) или терапевтического(их) средства (средств).
Способ согласно изобретению может включать введение в легкие композиции, приготовленной в комбинации с аэрозоль-образующим агентом, например, с использованием ингалятора или аэрозольного распылителя. См., например, патенты США №№ 6019968; 5985320; 5985309; 5934272; 5874064; 5855913; 5290540 и 4880078; и публикации заявок PCT №№ WO 92/19244; WO 97/32572; WO 97/44013; WO 98/31346; и WO 99/66903, которые во всей своей полноте вводятся в настоящее описание посредством ссылки. В конкретном варианте осуществления изобретения, антитело согласно изобретению, средство для комбинированной терапии и/или композицию согласно изобретению вводят с применением технологии доставки лекарственного средства в легкие Alkermes AIR® (Alkermes, Inc., Cambridge, Mass.).
Способ согласно изобретению может включать введение композиции, приготовленной для парентерального введения путем инъекции (например, путем инъекции ударной дозы или непрерывного вливания). Композиции для инъекции могут быть приготовлены в унифицированной лекарственной форме (например, в ампулах или в контейнерах для многократного введения доз) с добавлением консерванта. Композиции могут быть получены в таких формах, как суспензии, растворы или эмульсии в масляных или водных носителях и могут содержать агенты для приготовления композиций, такие как суспендирующие, стабилизирующие и/или диспергирующие агенты. Альтернативно, активный ингредиент может быть приготовлен в порошкообразной форме, которая, перед ее применением, может быть разведена подходящим носителем (например, стерильной апирогенной водой). Способы согласно изобретению могут также включать введение композиций, приготовленных в виде депо-препаратов. Такие препараты пролонгированного действия могут быть введены путем имплантации (например, подкожно или внутримышечно) или путем внутримышечной инъекции. Так, например, композиции могут быть приготовлены с использованием подходящих полимерных или гидрофобных материалов (например, в виде эмульсии в подходящем масле) или ионообменных смол или в виде слаборастворимых производных (например, в виде слаборастворимой соли).
Способы согласно изобретению включают введение композиций, приготовленных в нейтральной или солевой форме. Фармацевтически приемлемыми солями являются соли, образованные анионами, такими как анионы хлористоводородной, фосфорной, уксусной, щавелевой, винной кислот и т.п. и соли, образованные катионами натрия, калия, аммония, кальция, гидроксидов железа(3) изопропиламина, триэтиламина, 2-этиламиноэтанола, гистидина, прокаина и т.п.
Обычно ингредиенты композиций поставляются либо отдельно, либо в смеси в унифицированнной лекарственной форме, например, в виде сухого лиофилизованного порошка или безводного концентрата в герметически запаянном контейнере, таком как ампула или саше с указанным количеством активного агента. Если способом введения является вливание, то композиция может быть расфасована по бутылям для вливания, содержащим стерильную воду фармацевтического качества или физиологический раствор. Если способом введения является инъекция, то ампулу со стерильной водой для инъекций или с физиологическим раствором приготавливают так, чтобы ингредиенты могли быть смешаны перед введением.
В частности, настоящее изобретение также относится к одному или более антителам или к фармацевтическим композициям согласно изобретению, упакованным в герметически запаянный контейнер, такой как ампула или саше с указанным количеством активного антитела. В одном из вариантов осуществления изобретения, одно или более антител или фармацевтические композиции согласно изобретению поставляются в виде сухого стерильного лиофилизованного порошка или безводного концентрата в герметически запаянном контейнере и могут быть разведены (например, водой или физиологическим раствором) до соответствующей концентрации, необходимой для введения индивидууму. В одном из вариантов осуществления изобретения, одно или более антител или фармацевтические композиции согласно изобретению поставляются в виде сухого стерильного лиофилизованного порошка в герметически запаянном контейнере в унифицированной дозе, составляющей по меньшей мере 5 мг, например, по меньшей мере 10 мг, по меньшей мере 15 мг, по меньшей мере 25 мг, по меньшей мере 35 мг, по меньшей мере 45 мг, по меньшей мере 50 мг, по меньшей мере 75 мг или по меньшей мере 100 мг. Лиофилизованные антитела или фармацевтические композиции согласно изобретению должны храниться при 2°C-8°C в контейнере, в котором они были получены, либо эти антитела или фармацевтические композиции согласно изобретению должны быть введены через 1 неделю, например, через 5 дней, через 72 часа, через 48 часов, через 24 часа, через 12 часов, через 6 часов, через 5 часов, через 3 часа или через 1 час после разведения. В альтернативном варианте осуществления изобретения, одно или более антител или фармацевтические композиции согласно изобретению поставляются в жидкой форме в герметически запаянном контейнере с указанным количеством и концентрацией антитела. В другом варианте осуществления изобретения, композиция, вводимая в жидкой форме, поставляется в герметично запаянном контейнере в количестве, составляющем по меньшей мере 0,25 мг/мл, например, по меньшей мере 0,5 мг/мл, по меньшей мере 1 мг/мл, по меньшей мере 2,5 мг/мл, по меньшей мере 5 мг/мл, по меньшей мере 8 мг/мл, по меньшей мере 10 мг/мл, по меньшей мере 15 мг/кг, по меньшей мере 25 мг/мл, по меньшей мере 50 мг/мл, по меньшей мере 75 мг/мл или по меньшей мере 100 мг/мл. Такая жидкая форма должна храниться при 2°C-8°C в контейнере, в котором она была получена.
Антитела согласно изобретению могут быть введены в фармацевтическую композицию, подходящую для парентерального введения. В одном из аспектов изобретения, антитела получают в виде раствора для инъекций, содержащего 0,1-250 мг/мл антитела. Раствор для инъекций может состоять из жидкой или лиофилизованной лекарственной формы и находиться в сосуде из кремния или янтарной смолы, ампулы или предварительно заполненного шприца. Буфер может представлять собой L-гистидин в концентрации 1-50 мM (оптимально 5-10 мM) при pH 5,0-7,0 (оптимально pH 6,0). Другими подходящими буферами являются, но не ограничиваются ими, сукцинат натрия, цитрат натрия, фосфат натрия или фосфат калия. Хлорид натрия может быть использован для снижения токсичности раствора в концентрации 0-300 мM (для жидкой лекарственной формы оптимальной является концентрация 150 мM). В лиофилизованную лекарственную форму могут быть включены криозащитные агенты, главным образом, 0-10% сахароза (оптимально, 0,5-1,0%). Другими подходящими криозащитными агентами являются трегалоза и лактоза. В лиофилизованную лекарственную форму могут быть включены агенты, придающие объем, главным образом, 1-10% маннит (оптимально, 2-4%). В жидких и лиофилизованных лекарственных формах могут использоваться стабилизаторы, главным образом, 1-50 мM L-метионина (оптимально, 5-10 мM). Другими подходящими агентами, придающими объем, являются глицин и аргинин, которые могут быть включены в виде 0-0,05% полисорбата-80 (оптимально, 0,005-0,01%). Дополнительными поверхностно-активными веществами являются, но не ограничиваются ими, полисорбат 20 и поверхностно-активные вещества BRIJ. Фармацевтическая композиция, содержащая антитела согласно изобретению и полученная в виде раствора для парентеральной инъекции, может также содержать агент, подходящий для его использования в качестве адъюванта, такой как агент, используемый для повышения абсорбции или улучшения диспергируемости антитела. Особенно подходящим адъювантом является гиалуронидаза, такая как Hylenex® (рекомбинантная человеческая гиалуронидаза). Добавление гиалуронидазы в раствор для инъекции повышает биологическую доступность для человека после парентерального введения, а в частности после подкожного введения. Это также позволяет увеличить объем участка инъекции (то есть более чем на 1 мл) с минимальными болевыми ощущениями и дискомфортом, а также с минимальным риском возникновения реакций на участке инъекции (см. публикацию международной заявки № WO2004078140 и публикацию заявки на патент США No US2006104968, которые вводятся в настоящее описание посредством ссылки).
Композиции согласно изобретению могут иметь различные формы. Такими формами являются, например, жидкие, полутвердые и твердые лекарственные формы, такие как жидкие растворы (например, растворы для инъекций и инфузий), дисперсии или суспензии, таблетки, драже, порошки, липосомы и суппозитории. Выбор таких форм зависит от предполагаемого способа введения и терапевтического применения. Указанными композициями могут быть композиции в форме растворов для инъекций или инфузий, такие как композиции, аналогичные композициям, используемым для пассивной иммунизации человека другими антителами. В одном из вариантов осуществления изобретения, антитело вводят путем внутривенного вливания или внутривенной инъекции. В другом варианте осуществления изобретения, указанное антитело вводят путем внутримышечной или подкожной инъекции.
Терапевтические композиции должны быть стерильными и стабильными в условиях их получения и хранения. Такая композиция может быть приготовлена в виде раствора, микроэмульсии, дисперсии, липосомы или другой упорядоченной структуры, подходящей для введения лекарственного средства в высокой концентрации. Стерильные растворы для инъекций могут быть получены путем введения активного соединения (то есть связывающего белка, например, антитела согласно изобретению) в нужном количестве в соответствующем растворителе вместе с одним из перечисленных здесь ингредиентов или с их комбинациями, если это необходимо, с последующей стерилизацией путем фильтрации. Вообще говоря, дисперсии получают путем введения активного соединения в стерильный носитель, содержащий основную дисперсионную среду и другие необходимые ингредиенты из числа ингредиентов, перечисленных выше. В случае использования стерильных лиофилизованных порошков для получения стерильных растворов для инъекций, такие порошки приготавливают из предварительно стерильно отфильтрованного раствора путем его вакуумной сушки и сушки распылением с получением порошка, содержащего активный ингредиент плюс любой дополнительный нужный ингредиент. Соответствующая текучесть раствора может поддерживаться, например, с использованием покрытия, такого как лецитин, путем сохранения требуемого размера частиц в случае дисперсии и с использованием поверхностно-активных веществ. Пролонгированная абсорбция композиций для инъекций может достигаться путем включения в данную композицию агента, замедляющего абсорбцию, например, моностеаратных солей и желатина.
Антитела согласно изобретению могут быть введены различными методами, известными специалистам. Для многих терапевтических применений, путь/способ введения может представлять собой подкожную инъекцию, внутривенную инъекцию или инфузию. Следует отметить, что путь и/или способ введения варьируется в зависимости от желаемых результатов. В некоторых вариантах осуществления изобретения, активное соединение может быть получено с использованием носителя, который будет защищать данное соединение от быстрого высвобождения, например, в виде препарата с регулируемым высвобождением, включая имплантаты, чрезкожные пластыри и микроинкапсулированные системы доставки. Могут быть использованы биологически разлагаемые, биологически совместимые полимеры, такие как этилвинилацетат, полиангидриды, полигликолевая кислота, коллаген, полиортоэфиры и полимолочная кислота. Многие методы получения таких препаратов запатентованы или по существу известны специалистам. См., например, Sustained and Controlled Release Drug Delivery Systems, J. R. Robinson, ed., Marcel Dekker, Inc., New York, 1978.
В некоторых вариантах осуществления изобретения, антитело согласно изобретению может быть введено перорально, например, вместе с инертным разбавителем или с легко усваиваемым пищевым носителем. Антитело (и другие ингредиенты, если это необходимо) может быть заключено в жесткие или мягкие желатиновые капсулы, спрессовано в таблетки или включено непосредственно в пищу индивидуума. Для перорального терапевтического введения, антитело может быть введено вместе с наполнителями и использовано в форме таблеток для проглатывания, защечных таблеток, пастилок, капсул, эликсиров, суспензий, сиропов, облаток и т.п. Для введения антитела согласно изобретению не-парентеральными методами может оказаться необходимым нанесение на антитело покрытия из материала, предупреждающего его инактивацию или совместное введение антитела с этим материалом.
В композиции могут быть также включены вспомогательные активные соединения. В некоторых вариантах осуществления изобретения, антитело согласно изобретению приготавливают и/или вводят вместе с одним или более другими терапевтическими средствами, которые могут быть использованы для лечения описанных здесь расстройств или заболеваний. Так, например, анти-RGMa антитело согласно изобретению может быть приготовлено и/или введено вместе с одним или более дополнительными антителами, которые связываются с другими мишенями (например, с антителами, которые связываются с другими растворимыми антигенами или с молекулами клеточной поверхности). Кроме того, одно или более антител согласно изобретению могут быть использованы в комбинации с двумя или более вышеупомянутыми терапевтическими средствами. В такой комбинированной терапии могут применяться преимущественно более низкие дозы вводимых терапевтических средств, что позволяет избежать возможной токсичности или осложнений, ассоциированных с различными монотерапиями.
В некоторых вариантах осуществления изобретения, антитело согласно изобретению присоединяют к известному носителю, увеличивающему время полужизни этого антитела. Такими носителями являются, но не ограничиваются ими, Fc-домен, полиэтиленгликоль и декстран. Такие носители описаны, например, в заявке на патент США рег. № 09/428082 и в опубликованной заявке PCT WO 99/25044, которые в любых целях вводятся в настоящее описание посредством ссылки.
В конкретном варианте осуществления изобретения, методами генотерапии, проводимой в целях лечения, предупреждения, устранения или снижения тяжести расстройства или одного или более его симптомов, являются введение последовательностей нуклеиновой кислоты, кодирующих антитело согласно изобретению. Термин «генотерапия» означает терапию, осуществляемую путем введения индивидууму экспрессированной или экспрессируемой нуклеиновой кислоты. В этом варианте осуществления изобретения, нуклеиновые кислоты продуцируют кодируемое ими антитело согласно изобретению, которое опосредует профилактический или терапевтический эффект.
В настоящем изобретении может быть применен любой из методов генотерапии известных специалистам. Общий обзор этих методов генотерапии можно найти в публикациях Goldspiel et al., 1993, Clinical Pharmacy 12:488-505; Wu and Wu, 1991, Biotherapy 3:87-95; Tolstoshev, 1993, Ann. Rev. Pharmacol. Toxicol. 32:573-596; Mulligan, Science 260:926-932 (1993); и Morgan & Anderson, 1993, Ann. Rev. Biochem. 62:191-217; May, 1993, TIBTECH 11(5):155-215. Методы, хорошо известные специалистам в области техники рекомбинантных ДНК, можно найти в руководстве Ausubel et al. (eds.), Current Protocols in Molecular Biology, John Wiley & Sons, NY (1993); и Kriegler, Gene Transfer and Expression, A Laboratory Manual, Stockton Press, NY (1990). Подробное описание различных методов генотерапии приводится в заявке US 20050042664 A1, которая вводится в настоящее описание посредством ссылки.
Антитела согласно изобретению могут быть использованы отдельно или в комбинации друг с другом для лечения заболеваний или состояний, ассоциированных с дегенерацией нейритов, таких как рассеянный склероз, болезнь Альцгеймера, синдром Дауна, деменция, болезнь Паркинсона, травматическое повреждение центральной нервной системы или любое другое заболевание или состояние, ассоциированное с RGMa.
Следует отметить, что антитела согласно изобретению могут быть использованы отдельно или в комбинации с одним или более дополнительными агентами, например, с терапевтическим средством (например, с небольшой молекулой или биологической молекулой), где указанный дополнительный агент может быть выбран самим специалистом в данной области в зависимости от цели его применения. Так, например, дополнительным терапевтическим агентом может быть иммунодепрессант или агент, который может быть использован для лечения одного или более симптомов, ассоциированных с рассеянным склерозом. Дополнительным лекарственным средством может быть бета-интерферон. Бета-интерфероны, такие как Avonex, Betaseron, Extavia и Rebif, могут замедлять скорость прогрессирования симптомов рассеянного склероза. Указанным дополнительным агентом может быть глатирамер (Copaxone), который может блокировать атаку иммунной системы на миелин. Таким дополнительным агентом может быть финголимод (Gilenya), который может захватывать иммунные клетки в лимфоузлах. Дополнительным агентом может быть натализумаб (Tysabri), который может препятствовать поступлению потенциально опасных иммунных клеток из кровотока в головной и спинной мозг. Таким дополнительным лекарственным средством может быть митоксантрон (Novantrone), который представляет собой иммунодепрессант.
Дополнительным терапевтическим агентом может быть «лекарственное средство, улучшающее познавательные способности», где указанное лекарственное средство препятствует ухудшению когнитивной функции головного мозга человека (а именно способности к мышлению, способности к обучению и памяти). Лекарственные средства, улучшающие познавательную способность, действуют по механизму изменения доступности нейрохимических соединений (например, нейромедиаторов, ферментов и гормонов), улучшения подачи кислорода, стимуляции роста нервных клеток или ингибирования поражения нервных клеток. Примерами лекарственных средств, улучшающих познавательную способность, являются соединения, которые повышают активность ацетилхолина, такие как, но не ограничивающиеся ими, агонист рецептора ацетилхолина (например, агонист или аллостерический модулятор никотинового рецептора α-7, агонист или аллостерические модуляторы никотинового рецептора α4β2) ингибитор ацетилхолинэстеразы (например, донепезил, риватигмин и галантамин), ингибитор бутирилхолинэстеразы, антагонист рецептора N-метил-D-аспартата (NMDA) (например, мемантин), агонист зависимого от активности нейропротективного белка (ADNP), агонист серотонинового рецептора 5-HT1A (например, ксалипроден), aгонист рецептора 5-HT4, антагонист рецептора 5-HT6, антагонист серотонинового рецептора 1A, антагонист гистаминового рецептора H3, ингибитор кальпаина, васкулярный эндотелиальный фактор роста (VEGF) или его агонист, трофный фактор роста, антиапоптотическое соединение, активатор глутаматного рецептора типа AMPA, блокатор или модулятор кальциевых каналов L-типа или N-типа, блокатор калиевых каналов, активатор фактора, индуцирующего гипоксию (HIF), ингибитор пролил-4-гидроксилазы HIF, противовоспалительное средство, ингибитор амилоидного пептида Αβ или ингибитор образования амилоидных бляшек, ингибитор гиперфосфорилирования tau ингибитор фосфодиэстеразы 5 (например, тадалафил, силденафил), ингибитор фосфодиэстеразы 4, ингибитор моноаминоксидазы или их фармацевтически приемлемая соль. Конкретными примерами таких лекарственных средств, улучшающих познавательную способность, являются, но не ограничиваются ими ингибиторы холинэстеразы, такие как донепезил (Aricept®), ривастигмин (Exelon®), галантамин (Reminyl®), антагонисты N-метил-D-аспартата, такие как мемантин (Namenda®). По меньшей мере одно лекарственное средство, улучшающее познавательную способность, может быть введено одновременно с введением антител согласно изобретению или после введения антител согласно изобретению (и в любом порядке), включая уже известные агенты или агенты, которые будут получены в будущем и которые могут быть использованы для лечения заболевания или состояния, поддающиеся лечению антителом согласно изобретению. Кроме того, очевидно, что описанные здесь комбинации, используемые для лечения вышеупомянутых заболеваний, могут давать аддитивные или синергические эффекты. Таким дополнительным агентом может быть также агент, который сообщает терапевтической композиции нужные свойства, например, агент, который влияет на вязкость данной композиции.
Следует отметить, что указанными комбинациями являются комбинации, которые могут быть использованы в нужных целях. Указанные выше агенты приводятся лишь в целях иллюстрации и не ограничивают настоящего изобретения. Указанные комбинации могут содержать антитело и по меньшей мере один дополнительный агент, выбранный из агентов, перечисленных ниже. Такая комбинация может также включать более чем один дополнительный агент, например два или три дополнительных агента, в случае, если такая комбинация образует композицию, способную осуществлять нужную функцию.
Фармацевтические композиции могут включать «терапевтически эффективное количество» или «профилактически эффективное количество» антитела. Термин «терапевтически эффективное количество» означает количество, которое, в соответствующих дозах и в течение необходимого периода времени, является эффективным для достижения желаемого терапевтического эффекта. Терапевтически эффективное количество антитела может быть определено самим специалистом, и это количество может варьироваться в зависимости от таких факторов, как тип патологического расстройства, возраст, пол и масса индивидуума, а также от способности антитела вырабатывать желаемый ответ у индивидуума. Терапевтически эффективное количество также означает количество, при котором терапевтически благоприятные эффекты превышают любые токсические или негативные эффекты антитела. Термин «профилактически эффективное количество» означает количество, которое, в соответствующих дозах и в течение необходимого периода времени, является эффективным для достижения желаемого профилактического эффекта. Обычно, поскольку профилактическая доза вводится индивидуумам до начала развития заболевания или на ранней стадии его развития, то профилактически эффективное количество должно быть меньше терапевтически эффективного количества.
Схемы введения доз могут быть скорректированы для получения оптимального желаемого ответа (например, терапевтического или профилактического ответа). Так, например, в течение определенного периода времени может быть введена одна ударная доза или может быть введено несколько дробных доз, либо эта доза может быть пропорционально снижена или увеличена в зависимости от терапевтической ситуации. Для облегчения введения и для достижения однородности дозы, особенно предпочтительно, если композиции для парентерального введения будут получены в унифицированной лекарственной форме. Используемый здесь термин «унифицированная лекарственная форма» означает физически дискретные единицы, используемые в качестве унитарных доз для лечения млекопитающих; причем каждую дозу такой единицы, содержащей предварительно определенное количество активного соединения, вычисляют так, чтобы достигался желаемый терапевтический эффект в комбинации с требуемым фармацевтическим носителем. Определение спецификации дозы таких унифицированных лекарственных форм непосредственно зависит от (a) уникальных свойств активного соединения и от конкретно достигаемого терапевтического или профилактического эффекта, и (b) ограничений, известных специалистам и связанных с приготовлением данного активного соединения, с точки зрения восприимчивости индивидуума к такому лечению.
Репрезентативное и неограничивающее терапевтически или профилактически эффективное количество антитела составляет в пределах 0,1-200 мг/кг, например, 0,1-10 мг/кг. Терапевтически или профилактически эффективное количество антитела может составлять 1-200 мг/кг, 10-200 мг/кг, 20-200 мг/кг, 50-200 мг/кг, 75-200 мг/кг, 100-200 мг/кг, 150-200 мг/кг, 50-100 мг/кг, 5-10 мг/кг или 1-10 мг/кг. При этом следует отметить, что уровни доз могут варьироваться в зависимости от типа и тяжести состояния, подвергаемого лечению. Кроме того, для любого конкретного индивидуума, доза антитела может варьироваться в зависимости от таких факторов, как тип патологического состояния, возраст, пол и масса индивидуума и от способности антитела вырабатывать нужный ответ у индивидуума. Такой дозой также является доза, при которой терапевтически благоприятные эффекты превышают любые токсические или негативные эффекты такого антитела. Следует также отметить, что для любого конкретного индивидуума, конкретная схема введения доз должна быть скорректирована в зависимости от таких факторов, как время, требующееся для лечения индивидуума, и от назначения врача, осуществляющего введение или наблюдение за введением таких композиций и что приведенные здесь интервалы доз являются лишь иллюстративными и не ограничивают объема или практического применения заявленной композиции.
4. Способ лечения, предупреждения, модуляции или ослабления тяжести заболевания, ассоциированного с дегенерацией нейритов
Любой индивидуум может быть обследован для того, чтобы определить, страдает ли данный индивидуум расстройством, ассоциированным с дегенерацией нейритов. Результат такого обследования может служить показателем для выбора соответствующего курса терапии, такой как превентивная терапия, поддерживающая терапия или модулирующая терапия. В соответствии с этим, настоящее изобретение относится к способу лечения, предупреждения, модуляции или ослабления тяжести заболевания/расстройства, ассоциированного с дегенерацией нейритов. Антитело может быть введено индивидууму, нуждающемуся в этом. Такое антитело может быть введено в терапевтически эффективном количестве.
Вообще говоря, доза вводимых антител варьируется в зависимости от таких факторов, как возраст, масса, рост, пол, общее состояние здоровья и история болезни пациента. Обычно, реципиенту желательно вводить компоненты антитела, иммуноконъюгат или гибридный белок в дозе, составляющей приблизительно от 1 пг/кг до 10 мг/кг (количество агента/массу тела пациента), хотя, в зависимости от ситуации, вводимая доза может быть также уменьшена или увеличена. Схемы введения доз могут быть скорректированы для получения оптимального желаемого ответа (например, терапевтического или профилактического ответа). Так, например, в течение определенного периода времени может быть введена одна ударная доза или может быть введено несколько дробных доз, либо эта доза может быть пропорционально снижена или увеличена в зависимости от терапевтической ситуации. Для облегчения введения и для достижения однородности дозы особенно предпочтительно, если композиции для парентерального введения будут получены в унифицированной лекарственной форме. Используемый здесь термин «унифицированная лекарственная форма» означает физически дискретные единицы, используемые в качестве унитарных доз для лечения млекопитающих; причем каждую дозу такой единицы, содержащей предварительно определенное количество активного соединения, вычисляют так, чтобы достигался желаемый терапевтический эффект в комбинации с требуемым фармацевтическим носителем. Определение спецификации дозы такой унифицированной лекарственной формы согласно изобретению непосредственно зависит от (a) уникальных свойств активного соединения и от конкретно достигаемого терапевтического или профилактического эффекта, и (b) ограничений, известных специалистам и связанных с приготовлением данного активного соединения, с точки зрения восприимчивости индивидуума к такому лечению.
Репрезентативное и неограничивающее терапевтически или профилактически эффективное количество антитела или его части согласно изобретению составляет в пределах 0,1-20 мг/кг, а более предпочтительно, 0,5-10 мг/кг. При этом следует отметить, что уровни доз могут варьироваться в зависимости от типа и тяжести состояния, подвергаемого лечению. Кроме того, для любого индивидуума, конкретные схемы введения доз могут быть скорректированы в зависимости от потребности индивидуума и от назначения врача, осуществляющего введение или наблюдение за введением таких композиций, и приведенные здесь интервалы доз являются лишь иллюстративными и не ограничивают объема или практического применения заявленной композиции.
Антитела могут быть введены пациенту внутривенно внутриартериально, внутрибрюшинно, внутримышечно, подкожно, интраплеврально, интратекально, путем внутриглазного введения, путем введения в стекловидное тело, путем перфузии через катетер, установленный в определенном участке, или путем прямой инъекции в участок поражения. Введение терапевтических белков путем инъекции может быть осуществлено путем непрерывного вливания или путем введения разовой или многократной ударной дозы. Наиболее подходящим способом введения является внутривенная инъекция, поскольку она позволяет антителам быстро распределяться по кровотоку. Антитело может быть введено перорально, например, вместе с инертным разбавителем или пищевым носителем. Антитело и другие ингредиенты, если это необходимо, могут быть заключены в жесткие или мягкие желатиновые капсулы или введены в форме спрессованных таблеток для проглатывания или защечных таблеток, или в форме пастилок, капсул, эликсиров, суспензий, сиропов, облаток и т.п.
Белки, то есть анти-RGMa антитела, могут быть введены в низких дозах, таких как 20 миллиграммов - 2 грамма белка на дозу, вводимую парентерально один или несколько раз. Альтернативно, антитела могут быть введены в дозах, составляющих 20-1000 миллиграммов белка на дозу, 20-500 миллиграммов белка на дозу или 20-100 миллиграммов белка на дозу.
Антитела могут быть введены отдельно, либо они могут быть конъюгированы с липосомами и могут быть приготовлены известными методами с получением фармацевтически эффективных композиций, в которых указанные антитела объединены в смеси с фармацевтически приемлемым носителем. «Фармацевтически приемлемый носитель» может легко переноситься организмом пациента-реципиента. Одним из примеров фармацевтически приемлемого носителя является стерильный забуференный фосфатом физиологический раствор. Существуют и другие хорошо известные подходящие носители. См., например, REMINGTON'S PHARMACEUTICAL SCIENCES, 19th Ed. (1995).
Антитела, используемые в терапевтических целях, вводят пациенту в терапевтически эффективном количестве в фармацевтически приемлемом носителе. «Терапевтически эффективное количество» означает физиологически значимое количество. Антитело является физиологически значимым, если его присутствие приводит к детектируемому изменению физиологии пациента-реципиента. В контексте настоящего описания, антитело может быть физиологически значимым, если его присутствие приводит, например, к снижению уровня секреции интерферона-γ (INF-γ), интерлейкина-2 (IL-2), IL-4 и/или IL-17 из CD4+-T-клеток. Агент является физиологически значимым, если его присутствие приводит, например, к снижению пролиферативных ответов и/или к снижению уровня экспрессии провоспалительных цитокинов в мононуклеарных клетках периферической крови (МКПК).
Для регуляции продолжительности действия антитела при его терапевтическом применении могут быть применены и другие способы лечения. Препараты с регулируемым высвобождением могут быть получены с использованием полимеров, образующих комплекс с антителом или адсорбирующих указанное антитело. Так, например, биологически совместимыми полимерами являются матрицы из сополимера этилена и винилацетата и матрицы, состоящие из полиангидридного сополимера, включающего димер стеариновой кислоты и себациновую кислоту. Sherwood et al., Bio/Technology 10: 1446 (1992). Скорость высвобождения антитела из такой матрицы зависит от молекулярной массы белка, количества антитела, присутствующего в матрице, и от размера диспергированных частиц. Saltzman et al., Biophys. J. 55: 163 (1989); Sherwood et al., см. выше. Другие твердые лекарственные формы описаны в руководстве REMINGTON'S PHARMACEUTICAL SCIENCES, 19th ed. (1995).
a. Расстройства/заболевания, ассоциированные с дегенерацией нейритов
Расстройством/заболеванием, ассоциированным с дегенерацией нейритов, может быть любое заболевание или расстройство, ассоциированное с поражением нейритов и нарушением синаптической функции. Такое поражение и нарушение указанной функции может быть обусловлено отсутствием достаточного уровня миелинизации и/или разрыва аксона нервных клеток. Указанным расстройством или заболеванием, ассоциированным с дегенерацией нейритов, могут быть рассеянный склероз; болезнь Альцгеймера; болезнь Паркинсона; амиотрофический боковой склероз и другие заболевания двигательных нейронов; болезнь Гентингтона; болезнь Тау-Сакса; болезнь Ньюмана-Пика; болезнь Гуше; синдром Гурлера; идиопатические воспалительные демиелинизирующие заболевания; заболевание, вызываемое дефицитом витамина B12; заболевание, ассоциированное с лизисом миелина центрального моста; сухотка спинного мозга; поперечный миелит; болезнь Девика; прогрессирующая мультифокальная лейкоэнцефалопатия; неврит зрительного нерва и другие ретинопатии, ассоциированные с дегенерацией нейритов; такие как глаукома, диабетическая ретинопатия и возрастная дегенерация желтого пятна; травматическое повреждение центральной нервной системы или, например, лейкодистрофия. Расстройство или заболевание, ассоциированное с дегенерацией нейритов, может быть вызвано отсутствием выстилки слоев ткани, состоящей из жира (липопротеина), называемого миелином, в нервных волокнах. Эти слои образуют миелиновую оболочку. Такая миелиновая оболочка может проводить электрические импульсы по всему нервному волокну с определенной скоростью и точностью. При повреждении или отсутствии миелиновой оболочки, нервная ткань не может проводить электрические импульсы на нормальном уровне. Иногда, в результате поражения или отсутствия миелиновой оболочки, могут также повреждаться нервные волокна.
У детей раннего возраста может, как правило, отсутствовать зрелая миелиновая оболочка. В результате этого, у таких детей наблюдаются судорожные подергивания, нарушение координации движения и неуклюжесть. По мере развития миелиновой оболочки, движения становятся более ровными, более целенаправленными и более скоординированными. Однако у детей с некоторыми заболеваниями, такими как болезнь Тау-Сакса, болезнь Ньюмана-Пика, болезнь Гуше и синдром Гурлера, миелиновая оболочка обычно не развивается.
У взрослых людей, миелиновая оболочка может разрушаться в результате инсульта, воспаления, иммунных расстройств, метаболических расстройств и дефицита питательных веществ (такого как недостаток витамина B12). Яды, лекарственные средства (такие как антибиотик этамбутол) и злоупотребление алкоголем могут приводить к повреждению или разрушению миелиновой оболочки. Если миелиновая оболочка способна сама репарироваться или регенерироваться, то нормальная функция нервной ткани может восстанавливаться. Однако если повреждение миелиновой оболочки является достаточно серьезным, то нервные волокна, выстилающие эту оболочку, могут погибать. Поскольку нервные волокна в центральной нервной системе (в головном и спинном мозге) могут регенерироваться в очень редких случаях, то такое поражение является, как правило, необратимым.
Некоторые расстройства, ассоциированные с дегенерацией нейритов, которое вызывает демиелинизацию, приводят, главным образом, к поражению центральной нервной системы. Другие расстройства приводят, в основном, к повреждению нервной ткани в других частях организма. Расстройства, ассоциированные с дегенерацией нейритов, которые вызывают демиелинизацию центральной нервной системы и имеют неясную этиологию, называются первичными демиелинизирующими расстройствами. Среди таких расстройств наиболее распространенным является рассеянный склероз.
(1) Рассеянный склероз
Стадии течения PC могут подразделяться на четыре основных категории (или четыре подтипа): рецидивирующий-ремиттирующий рассеянный склероз (РPРC), вторичный прогрессирующий РС (ВПРС), первичный прогрессирующий РС (ППРС) и прогрессирующий рецидивирующий РС (ПPPC). Пациенты, у которых наблюдаются рецидивы заболевания через каждые несколько месяцев или лет с промежуточными периодами клинически стабильного состояния, рассматриваются как пациенты с РPРC. РPРC встречается в два раза чаще у женщин, чем у мужчин, и развивается в возрасте от 20 до 30 лет. В противоположность РPРC, у пациентов с ВПРС наблюдается прогрессирование заболевания между рецидивами. У пациентов с РPРC, такое заболевание со временем может переходить в ВПРС, характеризующийся постепенным снижением неврологической функции. Приблизительно 15% пациентов с PC страдают ППРС, характеризующимся поздним началом развития заболевания и последующим неослабляющимся нарушением неврологической функции. Пациенты с PC в легкой форме условно определяются как пациенты с РPРC, у которых через более чем 15 лет после первоначального диагноза все еще сохраняется подвижность и наблюдаются лишь небольшие нарушения (по расширенной шкале оценок статуса нетрудоспособности [EDSS]). Обычно у этих пациентов наблюдаются незначительные нарушения или отсутствие прогрессирования заболевания после первого приступа, и им не требуется терапевтического лечения, однако эту форму РС невозможно диагностировать в течение 5 лет после начала развития РС.
(2) Болезнь Паркинсона
Болезнь Паркинсона широко распространена в странах Западного полушария и была впервые описана врачом Джеймсом Паркинсоном в 1817 году. Болезнь Паркинсона была впервые определена как тремор конечностей и была описана как болезнь, которая может, в конечном счете, прогрессировать в состояние, характеризующееся тремя другими манифестациями, такими как: (i) ригидность, которая характеризуется движениями, определенными как «феномен зубчатого колеса» и ригидность по типу «свинцовой трубы»; (ii) брадикинезия или замедленность движения и (iii) постуральная нестабильность, выражающаяся в сутулости и неустойчивости походки. Такие нарушения движения являются показателями дисфункции двигательной системы, причем почти у 40% всех пациентов с болезнью Паркинсона может также наблюдаться нарушение умственных способностей.
Болезнь Паркинсона может вызываться дефицитом леводопамина в головном мозге. Более конкретно, у пациентов с болезнью Паркинсона, леводопамин может индуцировать дискинезию и приводить к денервации черной субстанции. До настоящего времени медицине не известен субстрат, позволяющий получить инъецируемую форму леводопы, которая достигала бы головного мозга и могла бы успешно переходить через гематоэнцефалический барьер. Современная допамин-заместительная терапия позволяет осуществлять непосредственную замену допамина или имитировать действие допамина в сайтах допаминовых рецепторов в головном мозге. Хотя терапия с использованием леводопы может давать некоторые благоприятные эффекты на начальном этапе, однако такие эффекты могут со временем исчезать и при этом могут возникать другие расстройства, такие как тяжелое нарушение сна, дискинезия и постоянная тошнота. Клинические методы лечения болезни Паркинсона включают хирургическое удаление ткани головного мозга и встраивание микроэлектродов (для высокочастотной электростимуляции головного мозга) в пораженные участки головного мозга. Встраивание электродов имеет то преимущество, что их можно заменять. Однако такое лечение обычно дает временный эффект и не приводит ни к постоянному изменению статуса Паркинсонизма, ни к обратному развитию заболевания.
Болезнь Паркинсона может быть многофакторным нейродегенеративным расстройством, вызываемым избыточным окислением. Черная субстанция является восприимчивой к окислительному стрессу, что подтверждает теорию развития болезни Паркинсона. Нарушение окислительного фосфорилирования приводит к нарушению функционирования митохондрий черной субстанции и к повышению уровня образования свободных радикалов.
(3) Повреждение, вызываемое действием молекул активного кислорода (свободных радикалов)
Молекулы активного кислорода (МАК) могут атаковать ткани некоторых типов, и постоянное воздействие МАК может приводить к ослаблению различных биологических функций и повышать риск развития тяжелых расстройств некоторых типов, включая расстройства и заболевания, ассоциированные с дегенерацией нейритов. МАК могут атаковать нейроны и индуцировать клеточную гибель. Так, например, воздействие на нейроны низких концентраций пероксида водорода может индуцировать повреждение нейритов в результате негативного изменения морфологии нейритов, иногда называемого утолщением нейритов. Утолщение нейритов может быть одним из ранних проявлений дегенерации нейронов, индуцирующих гибель нейронов, подвергнутых воздействию пероксида водорода.
(4) Болезнь Альцгеймера
Болезнь Альцгеймера (БА) является главной причиной развития деменции у пожилых людей. Хотя существуют редкие генетические формы БА, однако большинство пациентов классифицируются как пациенты со спорадической БА, обычно не идентифицируемой как наследственное заболевание. С точки зрения патологии, БА характеризуется дегенерацией нейронов и синапсов с увеличением числа сенильных бляшек и нейрофибриллярных клубков, в отличие от индивидуумов того же возраста, не страдающих деменцией.
Сенильные бляшки, характерные для болезни Альцгеймера, состоят из центральной сердцевины, включающей агрегированный бета-амилоид, то есть продукт разложения белка-предшественника амилоида (APP). Нейрофибриллярные клубки представляют собой нерастворимые структуры, напоминающие внутриклеточные нити, состоящие из гиперфосфорилированной формы белка, называемого тау, который ассоциируется с микротрубочками.
Паталогоанатомические срезы ткани головного мозга людей, умерших от болезни Альцгеймера, обнаруживали присутствие амилоида в форме белковых внеклеточных ядер нейритных бляшек, которые являются характерным признаком БА. Амилоидные ядра этих нейритных бляшек состоят из белка, называемого β-амилоидом, который преимущественно имеет конфигурацию в форме бета-складки. Mori et al., Journal of Biological Chemistry 267: 17082 (1992); Kirschner et al., PNAS 83: 503 (1986). Нейритные бляшки являются ранним и неизменным признаком этого заболевания. Mann et al., J. Neurol. Sci. 89: 169; Mann, Mech. Ageing Dev. 31: 213 (1985); Terry et al., J. Neuropathol. Exp. Neurol 46: 262 (1987).
Изначальное отложение Αβ может происходить еще до появления клинических симптомов. Рекомендованные в настоящее время «минимальные микроскопические критерии» для диагностики БА основаны на обнаружении ряда нейритных бляшек в головном мозге. Khachaturian, Arch. Neurol., см. выше (1985). К сожалению, оценка числа нейритных бляшек может быть осуществлена только после смерти пациента.
Амилоид-содержащие нейритные бляшки являются характерным признаком селективных участков головного мозга при БА, а также при синдроме Дауна и у индивидуумов, гомозиготных по аллелю аполипопротеина E4, у которых существует очень высокая вероятность развития БА. Corder et al., Science 261: 921 (1993); Divry, P., J. Neurol. Psych. 27: 643-657 (1927); Wisniewski et al., in Zimmerman, H. M. (ed.): PROGRESS IN NEUROPATHOLOGY (Grune and Stratton, N.Y. 1973) pp. 1-26. Амилоид головного мозга можно легко идентифицировать путем окрашивания срезов головного мозга тиофлавином S или Конго красным. Puchtler et al., J. Histochem. Cytochem. 10: 35 (1962). Амилоид, окрашенный Конго красным, характеризуется дихроизмом и имеет поляризованную желто-зеленую окраску. Дихроическое связывание является результатом присутствия бета-складчатой структуры амилоидных белков. Glenner, G. N. Eng. J. Med. 302: 1283 (1980). Подробное обсуждение биохимических и гистохимических свойств амилоида можно найти в работе Glenner, N. Eng. J. Med., 302: 1333 (1980).
(5) Травматическое повреждение центральной нервной системы
По оценкам специалистов, в Соединенных Штатах, травматическое повреждение головного мозга (TBI) встречается у более чем 2 миллионов пациентов, причем ежегодно приблизительно 500000 из них подвергаются госпитализации. Из этого числа пациентов, приблизительно 70000-90000 выживших пациентов с травмами головы на всю жизнь остаются инвалидами.
Существует риск поражения нервных путей в центральной нервной системе индивидуума, если нейроны подвергаются механическим или химическим травмам или нейропатической дегенерации, достаточной для создания ситуации, при которой возрастает риск гибели нейронов. В настоящее время были идентифицированы многие виды невропатий, некоторые из которых влияют только на субпопуляцию или систему нейронов в периферической или в центральной нервной системе. Невропатии, которые могут поражать сами нейроны или ассоциированные с ними глиальные клетки, могут возникать в результате метаболической дисфункции клеток, инфицирования, воздействия токсических веществ, аутоиммунной дисфункции, нарушения питания или ишемии. В некоторых случаях, клеточная дисфункция, предположительно, непосредственно индуцирует клеточную гибель. В других случаях, невропатия может индуцировать некроз ткани на уровне, достаточном для стимуляции иммунной/воспалительной системы и механизмов иммунного ответа организма на первоначальное повреждение нервной системы с последующим разрушением нейронов и путей, определяемых этими нейронами.
b. Индивидуум
Индивидуумом может быть млекопитающее, например, человек. Индивидуум может иметь расстройство или заболевание, ассоциированные с дегенерацией нейритов, либо он может быть подвержен риску развития этого расстройства или заболевания. Такой индивидуум может уже проходить лечение расстройства или заболевания, ассоциированного с дегенерацией нейритов.
5. Метод диагностики
Настоящее изобретение относится к способу определения наличия у индивидуума заболевания или расстройства, ассоциированного с дегенерацией нейритов. Может быть измерен уровень мембраносвязанного RGMa, и этот уровень сравнивают с уровнем RGMa в контрольном образце. Контрольный образец может происходить от нормальной ткани. Изменение уровня RGMa по сравнению с контролем может указывать на наличие у индивидуума заболевания или расстройства, ассоциированного с дегенерацией нейритов. Так, например, повышенный уровень RGMa по сравнению с нормальным контролем может указывать на наличие у индивидуума заболевания или расстройства, ассоциированного с дегенерацией нейритов. Уровень RGMa может быть измерен с использованием описанных здесь антител.
a. Образец
Образцом может быть любой образец ткани, взятый у индивидуума. Образец может содержать белок, происходящий от указанного индивидуума. Таким образцом может быть проба крови, сыворотки, плазмы или тканевый биоптат. Образец может быть использован в том виде, в котором он был получен от индивидуума, либо он может быть подвергнут предварительной обработке для модификации его свойств. Предварительная обработка может включать экстракцию, концентрирование, инактивацию нежелательных компонентов и/или добавление реагентов.
Для приготовления образца могут быть использованы любые клетки, ткани или физиологическая жидкость. Такими типами клеток, тканей и жидкостей могут быть срезы тканей, такие как образцы, взятые при биопсии и аутопсии; замороженные срезы, полученные в целях проведения гистологических анализов; кровь, плазма, сыворотка, мокрота, стул, слеза, слизистая, слюна, волосы и кожа. Типами клеток и тканей могут быть также лимфатическая жидкость, асцитная жидкость, влагалищные выделения, моча, перитонеальная жидкость, цереброспинальная жидкость, жидкость, собранная путем вагинального полоскания, или жидкость, собранная путем вагинальной смывки. Клетки и ткани такого типа могут быть получены путем взятия образца клеток у животного, но они могут быть также получены с использованием ранее выделенных клеток (например, клеток, выделенных другим индивидуумом, в другое время и/или в других целях). Могут быть также использованы архивированные ткани, такие как ткани, взятые у пациента, прошедшего курс лечения, или у пациента, у которого в анамнезе имеются данные о благоприятном исходе заболевания. При этом очистку белка проводить необязательно.
b. Детектирование RGMa
Наличие или количество RGMa, присутствующего в образце, взятом у пациента, может быть легко определено, например, методами масс-спектрометрии иммуноанализа или иммуногистохимического анализа (например, на срезах, взятых при биопсии) с использованием описанных здесь антител (моноклональных или поликлональных) или их фрагментов, направленных против RGMa. Анти-RGMa антитела и их фрагменты могут быть получены, как описано выше. Другие методы детектирования описаны, например, в патентах США №№ 6143576; 6113855; 6019944; 5985579; 5947124; 5939272; 5922615; 5885527; 5851776; 5824799; 5679526; 5525524 и 5480792, каждый из которых во всей своей полноте вводится в настоящее описание посредством ссылки.
(1) Иммуноанализ
RGMa и/или их пептиды могут быть проанализированы с помощью иммуноанализа. Присутствие или количество RGMa может быть определено с использованием описанных здесь антител путем детектирования их специфического связывания с RGMa. Так, например, антитело или его фрагмент могут специфически связываться с полипептидом, содержащим SEQ ID NO: 65, или с его фрагментом. Антитело или его фрагмент могут специфически связываться с полипептидом, содержащим SEQ ID NO: 66, или с его фрагментом.
Может быть проведен любой иммуноанализ. Таким иммуноанализом могут быть твердофазный иммуноферментный анализ (ELISA), радиоиммуноанализ (РИА), анализ на конкурентное ингибирование, такой как анализы на прямое или обратное конкурентное ингибирование, анализ на поляризацию флуоресценции или, например, анализ на конкурентное связывание. ELISA-анализом может быть «сэндвич»-ELISA. Специфическое иммунологическое связывание антитела с RGMa может быть детектировано посредством прямого мечения такими метками, как флуоресцентные или люминесцентные метки, металлы и радионуклиды, присоединенные к антителу, или посредством непрямого мечения, например, щелочной фосфатазой или пероксидазой хрена.
Иммуноанализ может быть проведен с использованием иммобилизованных антител или их фрагментов. Антитела могут быть иммобилизованы на различных носителях, таких как магнитные или хроматографические матриксные частицы, поверхность аналитического планшета (например, лунки микротитрационного планшета), фрагменты твердого материала, используемого в качестве субстрата, и т.п. Аналитическая полоска может быть приготовлена путем нанесения на твердый носитель антитела или множества антител. Затем эту полоску погружают в биологический тест-образец, после чего быстро обрабатывают путем проведения стадий промывки и детектирования с получением измеримого сигнала, такого как окрашенное пятно.
(a) «Сэндвич»-ELISA
В «сэндвич»-ELISA измеряют количество антигена между двумя слоями антител (то есть антитела для захвата и детектирующего антитела). Измеряемый RGMa может содержать по меньшей мере два антигенных сайта, способных связываться с антителом. В «сэндвич»-ELISA, в качестве антител для захвата и детектирующих антител могут быть использованы моноклональные или поликлональные антитела.
Вообще говоря, для выделения и количественной оценки RGMa или фрагмента RGMa в тест-образце используются по меньшей мере два антитела. Более конкретно, по меньшей мере два антитела связываются с определенными эпитопами RGMa или фрагмента RGMa с образованием иммунного комплекса, называемого «сэндвичем». Для захвата RGMa или фрагмента RGMa в тест-образце могут быть использованы одно или более антител (эти антитела часто называются антителом для «захвата» или антителами для «захвата») и для связывания с детектируемой (а именно количественно оцениваемой) меткой в «сэндвич»-анализе могут быть также использованы одно или более антител (эти антитела часто называются «детектирующим» антителом или «детектирующими» антителами). В таком «сэндвич»-анализе, оба антитела, связывающиеся со своими эпитопами, не препятствуют связыванию любого другого антитела, участвующего в этом анализе, с его соответствующим эпитопом. Другими словами, антитела могут быть подобраны так, чтобы одно или более «первых» антител, контактирующие с тест-образцом, который, предположительно, содержит RGMa или фрагмент RGMa, не связывались со всем эпитопом или с частью эпитопа, распознаваемого «вторыми» или последующими антителами и, тем самым, не подавляли способность одного или более «вторых» детектирующих антител связываться с RGMa или фрагментом RGMa.
В указанном иммуноанализе антитела могут быть использованы в качестве «первого» антитела. При этом предпочтительно, чтобы антитело иммуноспецифически связывалось с эпитопами, содержащими по меньшей мере три (3) смежных аминокислоты SEQ ID NO: 65, 66 или 74. В указанном иммуноанализе, помимо антител согласно изобретению может быть использовано «второе» антитело, которое иммуноспецифически связывается с эпитопами, имеющими аминокислотную последовательность, содержащую по меньшей мере три (3) смежных аминокислоты SEQ ID NO: 65, 66 или 74, где указанные три (3) смежных аминокислоты, с которыми связывается «второе» антитело, отличаются от трех (3) смежных аминокислот, с которыми связывается «первое» антитело.
В предпочтительном варианте осуществления изобретения, тест-образец, который, предположительно, содержит RGMa или фрагмент RGMa, может быть подвергнут одновременному или последовательному контактированию по меньшей мере с одним «первым» антителом для захвата (или антителами для захвата) и по меньшей мере с одним «вторым» детектирующим антителом. В анализе «сэндвич»-формата, тест-образец, который, предположительно, содержит RGMa или фрагмент RGMa, сначала подвергают контактированию по меньшей мере с одним «первым» антителом для захвата, которое специфически связывается с конкретным эпитопом в условиях, способствующих образованию комплекса «первое антитело - RGMa». При использовании более чем одного антитела для захвата образуется комплекс «множество «первых» антител для захвата - RGMa». В «сэндвич»-анализе, антитела, а предпочтительно по меньшей мере одно антитело для захвата используются в молярном избытке по отношению к максимальному количеству RGMa или фрагмента RGMa, предположительно, содержащихся в тест-образце. Так, например, может быть использовано приблизительно от 5 мкг/мл до 1 мг/мл антитела на миллилитр буфера для покрытия микрочастиц.
Перед контактированием тест-образца по меньшей мере с одним «первым» антителом для захвата, указанное по меньшей мере одно «первое» антитело для захвата может быть связано, но необязательно, с твердым носителем, что будет облегчать выделение комплекса «первое антитело - RGMa» из тест-образца. Может быть использован любой твердый носитель, известный специалистам, включая, но не ограничиваясь ими, твердые носители, полученные из полимерных материалов, используемых для изготовления лунок, пробирок или сфер. Антитело (или антитела) может быть связано с твердым носителем путем адсорбции, путем ковалентного связывания с использованием химического агента для связывания или другими методами, известными специалистам, при условии, что такое связывание не будет негативно влиять на способность антитела связываться с RGMa или фрагментом RGMa. Кроме того, при необходимости, твердый носитель может быть дериватизирован так, чтобы он мог взаимодействовать с различными функциональными группами на антителе. Для такой дериватизации требуются некоторые связывающие агенты, такие как, но не ограничивающиеся ими, малеиновый ангидрид, N-гидроксисукцинимид и 1-этил-3-(3-диметиламинопропил)карбодиимид.
После контактирования тест-образца, предположительно содержащего RGMa или фрагмент RGMa, по меньшей мере с одним «первым» антителом для захвата, тест-образец инкубируют так, чтобы это приводило к образованию комплекса «первое антитело для захвата (или множество антител для захвата)-RGMa». Инкубирование может быть осуществлено при pH приблизительно 4,5-10,0 и при температуре приблизительно от 2°C и приблизительно до 45°C в течение периода времени, составляющего по меньшей мере приблизительно от одной (1) минуты и приблизительно до восемнадцати (18) часов, приблизительно 2-6 минут или приблизительно 3-4 минут.
После образования комплекса «первое антитело для захвата/множество антител для захвата - RGMa», этот комплекс подвергают контактированию по меньшей мере с одним «вторым» детектирующим антителом (в условиях, способствующих образованию комплекса «первое антитело/множество антител для захвата - RGMa - второе антитело»). Если комплекс «первое антитело - RGMa» контактирует с более чем одним детектирующим антителом, то, в данном случае, образуется комплекс «первое антитело для захвата/множество антител для захвата - RGMa - множество детектирующих антител». Как и в случае «первого» антитела, если по меньшей мере «второе» (и последующее) антитело контактирует с комплексом «первое антитело - RGMa», то для образования комплекса «первое антитело/множество антител - RGMa - «второе» антитело/множество антител», инкубирование проводят в условиях, аналогичных условиям, описанным выше. Предпочтительно, чтобы по меньшей мере одно второе антитело содержало детектируемую метку. Детектируемая метка может быть присоединена по меньшей мере к одному «второму» антителу до, во время или после образования комплекса «первое антитело/множество антител - RGMa - «второе» антитело/множество антител». Может быть использована любая детектируемая метка, известная специалистам.
(b) Прямое конкурентное ингибирование
В анализе, проводимом в формате прямого конкурентного ингибирования, аликвоту меченного RGMa, фрагмента RGMa или варианта RGMa в известной концентрации используют для анализа тест-образца на конкурентное связывание RGMa или фрагмента RGMa с анти-RGMa антителом (таким как антитело согласно изобретению).
В анализе на прямое конкурентное связывание, иммобилизованное антитело (такое как антитело согласно изобретению) может быть подвергнуто последовательному или одновременному контактированию с тест-образцом и с меченным RGMa, фрагментом RGMa или вариантом RGMa. Пептид RGMa, фрагмент RGMa или вариант RGMa могут быть помечены любой детектируемой меткой, включая детектируемые метки, обсуждаемые выше в разделе, относящемся к анти-RGMa антителам. В этом анализе, антитело может быть иммобилизовано на твердом носителе. Альтернативно, данное антитело может быть присоединено к антителу против молекул антигена, которое было иммобилизовано на твердом носителе, таком как микрочастица.
Меченный пептид RGMa, фрагмент RGMa или вариант RGMa, тест-образец и антитело инкубируют в условиях, аналогичных условиям, описанным выше для анализа в формате «сэндвич». Затем могут быть получены две различных молекулы комплексов «антитело - RGMa». В частности, один из комплексов «антитело - RGMa» содержит детектируемую метку, а другой комплекс «антитело - RGMa» не содержит детектируемой метки. Перед количественной оценкой детектируемой метки, комплекс «антитело - RGMa» может быть, а может и не быть удален из оставшегося тест-образца. Затем, независимо от того, удален ли комплекс «антитело - RGMa» из оставшегося тест-образца, проводят количественную оценку детектируемой метки в комплексе «антитело - RGMa». После этого определяют концентрацию RGMa или фрагмента RGMa в тест-образце путем сравнения количества детектируемой метки в комплексе «антитело - RGMa» по стандартной кривой. Стандартная кривая может быть построена с использованием серийных разведений RGMa или фрагмента RGMa в известной концентрации с применением масс-спектрометрии, гравиметрического метода и других известных методов.
Комплекс «антитело - RGMa» может быть удален из тест-образца путем связывания антитела с твердым носителем, таким как твердые носители, обсуждаемые выше в разделе, относящемся к описанию анализа в «сэндвич»-формате, а затем указанное антитело, после его контактирования с твердым носителем, удаляют из оставшегося тест-образца.
(c) Анализ на обратное конкурентное связывание
В анализе на обратное конкурентное связывание, иммобилизованный пептид RGMa, фрагмент RGMa или вариант RGMa могут быть подвергнуты последовательному или одновременному контактированию с тест-образцом и по меньшей мере с одним меченным антителом. Предпочтительно, антитело специфически связывается с эпитопом, имеющим аминокислотную последовательность, содержащую по меньшей мере три (3) смежных аминокислоты SEQ ID NO: 65 или 66. Пептид RGMa, фрагмент RGMa или вариант RGMa могут быть связаны с твердым носителем, таким как твердые носители, обсуждаемые выше в разделе, относящемся к описанию анализа в «сэндвич»-формате. Фрагмент пептида RGMa может иметь аминокислотную последовательность, содержащую SEQ ID NO: 65 или 66.
Иммобилизованный пептид RGMa, фрагмент RGMa или вариант RGMa, тест-образец и по меньшей мере одно меченное антитело инкубируют в условиях, аналогичных условиям, описанным выше для анализа в формате «сэндвич». Затем могут быть получены две различных молекулы комплексов «RGMa - антитело». В частности, один из полученных комплексов «RGMa - антитело» является иммобилизованным и содержит детектируемую метку, а другой комплекс «RGMa - антитело» не является иммобилизованным и содержит детектируемую метку. Затем из оставшегося тест-образца удаляют комплекс «неиммобилизованный RGMa - антитело» известными методами, такими как промывка и оставляют только комплекс «иммобилизованный RGMa - антитело». После удаления комплекса «неиммобилизованный RGMa - антитело» проводят количественную оценку детектируемой метки в комплексе «иммобилизованный RGMa - антитело». Затем концентрация RGMa или фрагмента RGMa в тест-образце может быть определена путем сравнения количества детектируемой метки в RGMa-комплексе по стандартной кривой. Стандартная кривая может быть построена с использованием серийных разведений RGMa или фрагмента RGMa в известной концентрации с применением масс-спектрометрии, гравиметрического метода и других известных методов.
(d) Поляризация флуоресценции
В анализе на поляризацию флуоресценции, антитело или его функционально активный фрагмент могут быть сначала подвергнуты контактированию с немеченным тест-образцом, который, предположительно, содержит RGMa или фрагмент RGMa, с получением комплекса «немеченный RGMa - антитело». Затем комплекс «немеченный RGMa - антитело» подвергают контактированию с флуоресцентно меченным RGMa, фрагментом RGMa или вариантом RGMa. Меченный RGMa, фрагмент RGMa или вариант RGMa конкурирует в тест-образце с любым немеченным RGMa или фрагментом RGMa за связывание с антителом или с его функционально активным фрагментом. Затем определяют количество комплекса «меченный RGMa - антитело», после чего определяют количество RGMa в тест-образце с использованием стандартной кривой.
Антитело, используемое в анализе на поляризацию флуоресценции, специфически связывается с эпитопом, имеющим аминокислотную последовательность, содержащую по меньшей мере три (3) аминокислоты SEQ ID NO: 65 или SEQ ID NO: 66 или SEQ ID NO: 74.
Антитело, меченный пептид RGMa, фрагмент пептида RGMa или вариант RGMa, тест-образец и по меньшей мере одно меченное антитело могут быть инкубированы в условиях, аналогичных условиям, описанным выше для «сэндвич»-иммуноанализа.
Альтернативно, антитело или его функционально активный фрагмент могут быть подвернуты одновременному контактированию с флуоресцентно меченным RGMa, фрагментом RGMa или вариантом RGMa и с немеченным тест-образцом, предположительно содержащим RGMa или фрагмент RGMa, с получением комплексов «меченный RGMa - антитело» и комплексов «немеченный RGMa - антитело». Затем определяют количество образованного комплекса «меченный RGMa - антитело», после чего определяют количество RGMa в тест-образце с использованием стандартной кривой.
Альтернативно, антитело или его функционально активный фрагмент сначала подвергают контактированию с флуоресцентно меченным RGMa, фрагментом RGMa или вариантом RGMa с получением комплекса «меченный RGMa - антитело». Затем комплекс «меченный BNP - антитело» подвергают контактированию с немеченным тест-образцом, предположительно содержащим RGMa или фрагмент RGMa. Любой немеченный RGMa или фрагмент RGMa в тест-образце конкурирует с меченным RGMa, фрагментом RGMa или вариантом RGMa за связывание с антителом или с его функционально активным фрагментом. После этого определяют количество образованного комплекса «меченный RGMa - антитело», а затем количество RGMa в тест-образце с использованием стандартной кривой. Антитело, используемое в этом иммуноанализе, специфически связывается с эпитопом, имеющим аминокислотную последовательность, содержащую по меньшей мере три (3) смежных аминокислоты SEQ ID NO: 65, 66 или 74.
(e) Масс-спектрометрия
Масс-спектрометрический (МС) анализ может быть проведен отдельно или в комбинации с другими методами. Такими другими методами являются иммуноанализы и анализы, описанные выше для детектирования специфических полинуклеотидов. Масс-спектрометрический метод может быть применен для определения присутствия и/или количества одного или более биомаркеров. МС-анализ может включать МС-анализ, проводимый методом матричной лазерной десорбции/времяпролетной ионизации (MALDI-TOF), такой как, например, прямой масс-спектрометрический анализ с использованием пятна или масс-спектрометрический анализ MALDI-TOF, проводимый с помощью жидкостной хроматографии. В некоторых вариантах осуществления изобретения, МС-анализ включает МС с ионизацией электрораспылением (ESI), например, жидкостную хроматографию (ЖХ) с ESI-MS. Масс-спектрометрический анализ может быть проведен на коммерчески доступных спектрометрах. Методы МС-анализа, включая MALDI-TOF MS и ESI-MS, могут быть применены для детектирования присутствия и определения количества биомаркерных пептидов в биологических образцах. Для справки, см., например, патенты США №№ 6925389; 6989100 и 6890763, каждый из которых вводится в настоящее описание посредством ссылки.
c. Контроль
Может оказаться желательным использовать контрольный образец. Контрольный образец может быть проанализирован одновременно с образцом, взятым у индивидуума, как описано выше. Результаты, полученные для образца, взятого у индивидуума, можно сравнить с результатами, полученными для контрольного образца. Могут быть построены стандартные кривые, по которым можно сравнить результаты анализа, полученные для биологического образца. На таких стандартных кривых представлена зависимость уровней маркера от аналитических единиц, то есть от интенсивности флуоресцентного сигнала, если используется флуоресцентная метка. При использовании образцов, взятых от нескольких доноров, могут быть построены стандартные кривые для контрольных уровней RGMa в нормальной ткани, а также для уровней RGMa в ткани доноров «с риском» наличия заболевания, которые могут иметь один или более признаков, соответствующих данному заболеванию, как указано выше.
6. Набор
Настоящее изобретение относится к набору, который может быть использован для лечения или диагностики заболевания у индивидуума. Набор может содержать антитело и средство для введения данного антитела. Такой набор может также содержать инструкции по его применению и инструкции по проведению анализа, мониторинга или лечения.
Набор может также содержать один или более контейнеров, таких как сосуды или флаконы, где каждый их этих контейнеров содержит отдельный реагент. Набор может также включать текстовые инструкции по осуществлению или интерпретации описанного здесь анализа, мониторинга, лечения или метода проведения анализа.
Настоящее изобретение имеет несколько аспектов, проиллюстрированных в нижеследующих неограничивающих примерах.
ПРИМЕРЫ
Пример 1
Получение и выделение человеческого моноклонального анти-RGMa антитела
С применением технологии представления мРНК PROfusion были отобраны библиотеки антител, выделенных их пула человеческой селезенки, миндалин, МКПК и лимфоузлов за восемь раундов, где указанные антитела были направлены против антигенов RGMa: человеческого или крысиного RGMa, меченного 100 нM биотина. Технология PROfusion описана в публикациях заявок на патент США №№ 20100099103 и 20100105569, содержание каждой из которых вводится в настоящее описание посредством ссылки. Отобранные scFv-фрагменты превращали в полностью человеческие IgG. После скрининга IgG в RGMa-ELISA, AE12-1 - AE12-8 были идентифицированы как позитивные антитела, связывающиеся с человеческим и крысиным RGMa.
Антитела AE12-13, AE12-15, AE12-20, AE12-21, AE12-23 и AE 12-24 представляют собой полностью человеческие анти-RGMa антитела идентифицированные из крупных исходных дрожжевых библиотек scFv против человеческого RGMa с применением стандартных методов дрожжевого представления. 2 раунда сортинга клеток, активированных на магнитных сферах (MACS), и 4 раунда клеточного сортинга с активацией флуоресценции (FACS) проводили на библиотеках с использованием 100 нM биотинилированного человеческого RGMa в качестве антигена для отбора. В последнем раунде сортинга, клетки также подвергали негативному отбору на Fc против человеческого антигена RGMc. Отобранные scFv-фрагменты превращали в полностью человеческие IgG. После скрининга IgG в ELISA-анализе на человеческий RGMа, AE12-13, -15, -20, -21, -23 и -24 были идентифицированы как позитивные антитела, связывающиеся с человеческим RGMa. AE12-13, AE12-15 и AE12-23 также подвергали перекрестной реакции с человеческим RGMc, как было оценено с помощью ELISA.
Пример 2
Характеризация антител
8 mAb PROfusion (AE12-1, AE12-2, AE12-3, AE12-4, AE12-5, AE12-6, AE12-7 и AE12-8) тестировали с помощью прямого ELISA-анализа на связывание для оценки уровня связывания с человеческим RGMa (hRGMa) и крысиным RGMa и способности перекрестно реагировать с hRGMc. ELISA-анализ на конкурентное связывание с hRGMa проводили для того, чтобы определить, может ли mAb конкурировать с h5F9.23 за связывание с hRGMa. h5F9.23 представляет собой основное гуманизованное анти-RGMa mAb, которое происходит от крысиной гибридомы и которое, как известно, связывается с N-концевым доменом RGMa. H5F9.23 имеет следующие последовательности:
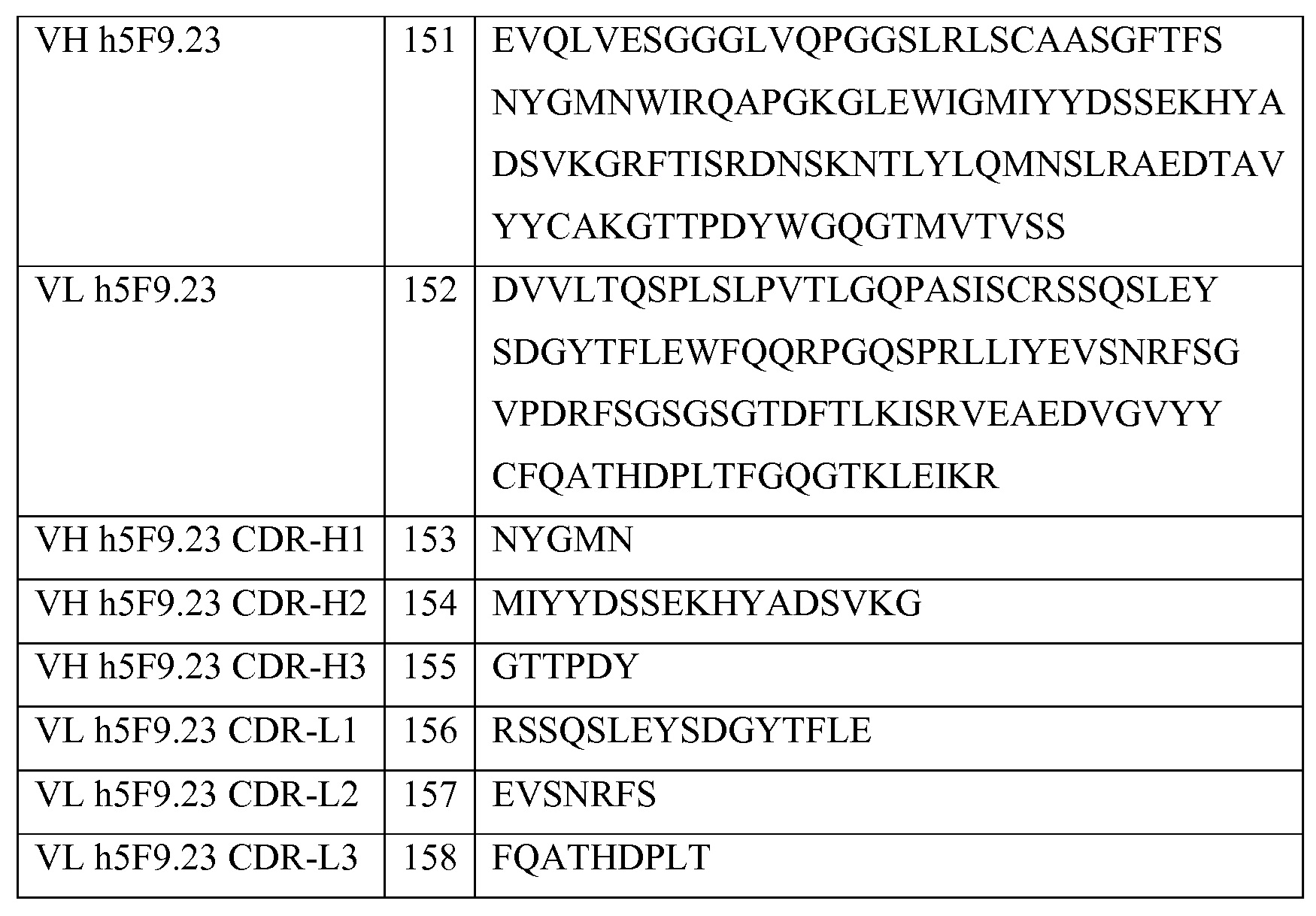
Был проведен ELISA-анализ на конкурентное связывание с неогенином и BMP-2/BMP-4 для того, чтобы определить, могут ли эти mAb блокировать связывание hRGMa с его неогениновым рецептором или с BMP-2/BMP-4.
Как показал ELISA-анализ, все 8 PROfusion-mAb связывались с человеческим и крысиным RGMa (таблица 3). ELISA-анализ на связывание с RGMc показал, что 3 mAb (AE12-6, -7 и -8) связывались с hRGMc, AE12-4 обнаруживало слабый уровень связывания при высоких концентрациях, а другие 4 mAb (AE12-1, -2, -3 и -5) вообще не связывались с hRGMc в концентрациях до 100 нМ. В ELISA-анализе на конкурентное связывание с hRGMa, AE12-1, AE12-3 и AE12-6 конкурировали с h5F9.23 за связывание с hRGMa, что позволяет предположить, что эпитопы, связывающиеся с этими 3 mAb, расположены поблизости от эпитопа h5F9.23 или перекрываются с этим эпитопом. Дот-блот-анализ, проводимый с использованием фрагментов hRGMa, показал, что AE12-1 и AE12-6 связывались с N-концевым фрагментом, AE12-2 и AE12-4 связывались с C-концевым фрагментом, а другие 4 Ab не обнаруживали какого-либо детектируемого сигнала связывания. В ELISA-анализе на блокирование конкурентного связывания hRGMa с неогенином, блокирующей активностью обладали только AE12-5 и AE12-6, и эта активность была сравнима с активностью h5F9.23 или превышала его активность, причем AE12-1 и AE12-4 обладали слабой ингибирующей активностью, а AE12-2, -3, -7 и -8 вообще не обладали ингибирующей активностью в концентрациях до 100 нM. В ELISA-анализе на конкурентное связывание с BMP-2/BMP-4 было обнаружено, что только AE12-1, AE12-4 и AE12-6 блокировали связывание hRGMa с BMP-2/BMP-4.
PROfusion-mAb дополнительно тестировали в клеточных анализах на связывание для оценки способности этих антител блокировать связывание hRGMa с нейронными клетками. В клеточном MSD-анализе на связывание, в котором клетки инкубировали с биотинилированным hRGMa-Fc при комнатной температуре, а связывание с hRGMa детектировали по присутствию стрептавидина-сульфо-метки, было обнаружено, что лишь AE12-1 и AE12-6 блокировали связывание hRGMa с человеческими нейронными клетками SH-SY5Y на уровне, аналогичном уровню, наблюдаемому для h5F9.23 (таблица 3).
Однако в скрининг-анализе (HCS) с использованием высокого содержания RGMa, где клетки инкубировали с hRGMa-Fc при 37°C, связывание hRGMa детектировали с использованием Cy3-меченного анти-Fc Ab, а уровень связывания определяли с помощью визуализирующего анализа с высоким содержанием флуоресцентного вещества, из PROfusion-антител, только антитело AE12-6 обнаруживало высокий уровень ингибирования связывания RGMa с нейронами SH-SY5Y и первичными нейронами крысиного гиппокампа (таблица 3, фигура 13). Как показано на фигуре 13, антитела AE12-15 и AE 12-23, происходящие от дрожжевых библиотек необработанных человеческих scFv, также ингибировали связывание hRGMa с клетками.
BMP-чувствительный элемент (BRE) конструировали с использованием перекрывающихся олигонуклеотидов, исходя из последовательности, описанной Korchynskyi и ten Dijke (J. Biol. Chem. 2002, 277:4883), и клонировали в основной люциферазный вектор-репортер pGL4.27 [luc2P/minP/Hygro] (Promega) в целях продуцирования репортерной конструкции «BRE-люцифераза». Члены семейства RGM (RGMa, RGMb и RGMc) представляют собой ко-рецепторы для передачи BMP-сигнала. BMP-репортерные анализы для обоих RGMa и RGMc были проведены путем ко-трансфекции клеток 293HEK BMP-репортерной плазмидой и RGMa- или RGMc-экспрессирующей плазмидой и скрининга mAb на нейтрализующую активность по отношению к RGMa и RGMc. В BMP-репортерном анализе для RGMa, антитела AE12-1 и AE12-6 нейтрализовали активность RGMa, что соответствовало данным, полученным в клеточном MSD-анализе на связывание (таблица 3). В BMP-репортерном анализе для RGMc, антитело AE12-6 нейтрализовало активность RGMc, тогда как антитело AE12-1 не обнаруживало такой способности. Таким образом, антитело AE12-1 представляет собой нейтрализующее RGMa-специфическое mAb.
PROfusion-mAb были также протестированы на их способность нейтрализовать RGMa в анализе на хемотаксис с использованием нейронов SH-SY5Y. В этом анализе, RGMa действует как отталкивающая молекула, которая ингибирует клеточный хемотаксис. Антитело AE12-1 обнаруживало сильную нейтрализующую активность по отношению к hRGMa (таблица 3). AE12-4 и AE12-6 также обнаруживали некоторую нейтрализующую активность.
AE12-1 было протестировано в анализе на рост нейритов с использованием человеческих нейронов SH-SY5Y. В этом анализе полноразмерный RGMa или его N-концевой фрагмент ингибировали рост нейритов. В BMP-репортерном анализе на функциональную активность RGMa и в анализе на хемотаксис, антитело AE12-1 обнаруживало сильную нейтрализующую активность по отношению к полноразмерному RGMa или к его N-концевому фрагменту (таблица 3).
BIAcore-анализ на действие AE12-1 по отношению к hRGMc и к RGMa человека, собакоподобных обезьян (cyno) и крыс, продемонстрировал, что AE12-1 не связывается с hRGMc, но обнаруживает хорошую перекрестную реактивность с человеческим RGMa, с RGMa собакоподобных обезьян и с крысиным RGMa с аналогичной аффинностью. См. таблицу 4.
В таблице 3 «aNeg» соответствует негативному связыванию со всеми фрагментами, протестированными в дот-блот-анализе. «bMSD» относится к анализу, в котором использовали комплекс биотинилированного hRGMa-Fc со стрептавидин-сульфо-меткой и проводили инкубирование клеток при комнатной температуре (КТ). «сHCS» относится к анализу, в котором использовали комплекс hRGMa-Fc с Cy3-меченным анти-Fc Ab и проводили инкубирование клеток при 37°C. «dAE12-1» соответствует резкому повышению уровня связывания RGMa-Fc с клетками, в отличие от ингибирования связывания «биотин-RGMa-Fc» с клетками SH-SY5Y в анализе MSD. "e?" означает, что данные для AE12-7 отсутствуют. «fAE12-4» - концентрация AE12-4 в анализе на хемотаксис обратно пропорциональна нейтрализующей активности.
В BMP-чувствительном репортерном анализе, в котором RGMa или RGMc усиливает передачу BMP-сигнала посредством взаимодействия с BMPs, антитело, содержащее SEQ ID NO: 1 и 5 (AE12-1), блокировало активность RGMa, но не блокировало активность RGMc, что указывало на его функциональный антагонизм и специфичность связывания с RGMa.
На фигурах 13 и 14 проиллюстрировано нейтрализующее действие специфических антител на связывание RGMa с нейронами при проведении анализа на связываниес «живыми» клетками SH-SY5Y и первичными нейронами крысиного гиппокампа. Fc-меченный RGMa и Cy3-меченные анти-Fc антитела подвергали образованию комплекса при 4°C в течение 60 минут, после чего этот комплекс инкубировали с блокирующим антителом при комнатной температуре в течение 10 минут. Затем комплекс «RGMa-Cy3 + антитело» добавляли к клеткам вместе с Hoechsts 33342 и оставляли на 30 минут при 37°C для связывания с клетками. После этого клетки два раза промывали в культуральной среде и фиксировали PFH. Визуализацию клеток осуществляли с помощью программы BD Pathway и полученные изображения анализировали с помощью компьютерной программы Definiens Architect.
Как указывалось выше, антитела AE12-6, AE12-15 и AE12-23 блокировали связывание RGMa с клетками SH-SY5Y и первичными нейронами. См. фигуру 13. В HCS-анализе, антитело AE12-1 не ингибировало связывание RGMa с клетками SH-SY5Y. См. фигуру 14. Наиболее высокие концентрации AE12-1 усиливали связывание RGMa-Fc с клетками, а более низкие концентрации давали уровни связывания, аналогичные уровням связывания с контрольным RGMa. Эти данные отличались от данных по ингибированию связывания биотин-RGMa-Fc с клетками SH-SY5Y, которые были получены в MSD-анализе (в MSD-анализе использовали комплекс «биотинилированный hRGMa-Fc - стрептавидин-сульфо-метка» и проводили инкубирование с клетками при комнатной температуре). Такое различие между данными MSD- и HCS-анализов может быть обусловлено различиями в условиях проведения анализа.
На фигуре 15 продемонстрирована нейтрализация отталкивающего действия RGMa посредством r5F9 (контроль), антитела AE12-1 и антитела AE12-6 в анализе на рост нейритов. 6500 первичных нейронов крысиного гиппокампа на лунку высевали на 96-луночные визуализирующие планшеты, покрытые поли-l-лизином. Эти клетки в течение 24 часов обрабатывали фрагментом RGMa 47-127 SEQ ID NO: 65 (SEQ ID NO: 139) в комбинации с анти-RGMa антителами. Затем эти клетки фиксировали и окрашивали BIII-тубулином в соответствии с протоколом выращивания нейритов, прилагаемым к набору от Millipore. Изображения получали с помощью программы BD Pathway и анализировали с помощью программы Defmiens Architect для определения роста нейритов на нейрон.
Пример 3
Варианты антител и данные по связыванию
В таблице 4 показано, что замена остатка Cys в CDR3 VL антитела AE12-1 (SEQ ID NO:8) позволяет получить варианты антител с повышенной аффинностью по отношению к hRGMa. См. SEQ ID NO: 67-73. См., например, таблицу 4, где клон антитела AE12-1-Y обладает по меньшей мере в 10 раз большей аффинностью по отношению к hRGMa, а клон антитела AE12-1-F обладает в 5 раз большей аффинностью по отношению к hRGMa. Другие варианты обладали такой же аффинностью, как и родительское AE12-1. Все варианты блокировали связывание hRGMa с клетками SH-SY5Y в MSD-анализе на связывание; нейтрализовали активность RGMa, но не нейтрализовали активность RGMc в анализе с использованием BMP-репортера, а также обладали высокой термостабильностью и хорошей растворимостью в предварительных исследованиях.
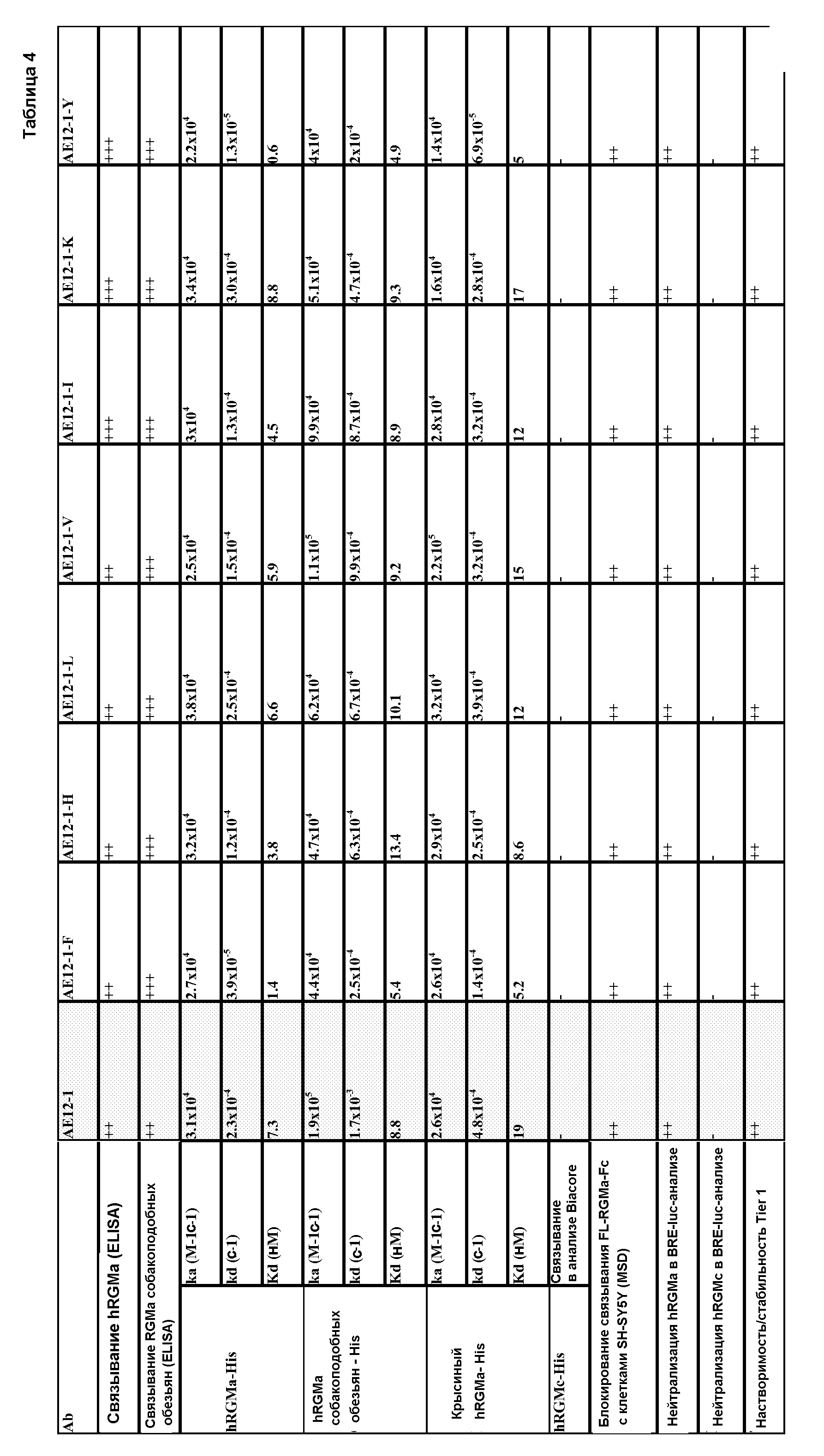
Пример 4
Рост нейритов
Как показано на фигурах 1, 2 и 15, AE12-1 полностью нейтрализовало полноразмерный hRGMa и фрагмент hRGMa в анализе на клетках SH-SY5Y и на первичных нейронах крысиного гиппокампа. Этот фрагмент hRGMa соответствует аминокислотам 47-127 SEQ ID NO: 65, а именно,

Последующие эксперименты на рост нейритов осуществляли для оценки влияния AE12-1, а также вариантов AE12-1, где указанное антитело содержит SEQ ID NO: 1 и 5 или 2-4 и 6-8, а остаток Cys SEQ ID NO: 8 заменен другой аминокислотой или остаток Cys в положении 91 SEQ ID NO: 5 заменен другой аминокислотой (то есть AE12-1-F, AE12-1-H, AE12-1-L, AE12-1-V, AE12-1-I, AE12-1-K и AE12-1-Y). См. фигуры 9-12, где проиллюстрировано ингибирование описанным антителом роста нейритов на клетках SH-SY5Y, обработанных FL hRGMa (после инкубирования в течение 24 часов).
Пример 5
Исследования in vivo
Как показано на фигурах 3 и 4, AE12-1 усиливало регенеративный рост аксонов ганглиозных клеток сетчатки возле участка поражения (0-500 мкм) (n=3-5 крыс/группу). См. фигуру 3. Антитело AE12-1 также усиливало регенеративный рост аксонов ганглиозных клеток сетчатки на участках, расположенных на расстоянии от места поражения (500-1000 мкм) (n=3-5 крыс/группу).
Пример 6
Эксперименты по разрушению зрительного нерва крыс
Антитело AE12-1 обладало активностью в экспериментах по разрушению зрительного нерва крыс. См. фигуру 8. У самцов крыс Wistar индуцировали одностороннее поражение зрительного нерва на 2-4 мм ниже глаза. Крыс наблюдали в течение 6 недель (8 групп, n=6) и внутривенно вводили антитела один раз в неделю в количестве 10 мг/кг, 1 мг/кг или 0,1 мг/кг. Контрольное антитело hIgG1 вводили внутривенно один раз в неделю в количестве 10 мг/кг (n=6 крыс). У AE12-1-обработанных крыс наблюдался рост регенерирующих волокон на участке ниже места поражения зрительного нерва, тогда как у крыс, обработанных контрольным антителом hIgG1, регенерирующие волокна аккумулировались на участке поражения, что было обусловлено их неспособностью препятствовать развитию поражения. См. фигуру 8.
Пример 7
Картирование эпитопа человеческого RGMa (hRGMa) с использованием моноклонального антитела AE12-1
Исследования по картированию эпитопа проводили с использованием моноклонального антитела AE12-1. Полученные данные позволяют предположить, что эпитоп для AE12-1 локализуется в N-концевой области RGMa. В попытке определить эпитоп для AE12-1 было использовано несколько конструкций hRGMa. Эти конструкции включают:
Конструкцию pelB-M-[RGMA(47-168)]-6His («6His» представлен SEQ ID NO: 148) (E.coli), продуцированную рекомбинантным методом. Антиген представляет собой 0,41 мг/мл в ChemTag#16211, буфер S100, pH8, 25 мM Tris, 100 мM NaCl, 1 мM DTT, 10% (об/об) глицерина. Последовательность этой первой антигенной конструкции представляет собой:

Конструкцию [IgK-лидерная последовательность]-AttB1-[hRGMA(47-422)]-AttB2-MYC-6His («6His» представлен SEQ ID NO: 148) (E.coli), продуцированную рекомбинантным методом, 0,85 мг/мл в PBS. Последовательность этой второй антигенной конструкции представляет собой:

Конструкцию [IgK-лидерная последовательность]-AttB1-[hRGMA(47-168)]-Xa-[hIgG-L-Fc (257-481)] (конструкцию, полученную от млекопитающего), продуцированную рекомбинантным методом, 1,18 мг/мл, в PBS. Последовательность этой третьей антигенной конструкции представляет собой:

Все используемые антигены содержат аминокислотную последовательность RGMa (47-168), где нумерация, используемая для идентификации положений последовательности, соответствует нумерации родительского белка. Последовательность hRGMa (47-168) представляет собой:

Для вырезания эпитопов были использованы следующие буферы:
Буфер A: 100 мМ NaHCО3, 500 мМ NaCl, pH 8;
Буфер B: 100 мМ NaHCО3, 100 мМ NaCl, pH 8;
Буфер C: 100 мМ NaOAc, 500 мМ NaCl, pH 4; и
Буфер D: 100 мМ трис-HCl, 500 мМ NaCl, pH 8.
Моноклональное антитело иммобилизовали следующим образом. Двадцать миллиграммов CNBr-активированных сефарозных сфер (GE Healthcare, Uppsala Sweden) взвешивали и загружали в компактную реакционную колонку (USB Corp., Cleveland, OH), снабженную 35 мкм-фриттой, после чего 3 раза промывали 200 мкл 1 мМ HCl, а затем 3 раза промывали 200 мкл буфера A.
Приблизительно 5-6 нмоль раствора mAb AE12-1 диализовали против PBS с использованием устройства для минидиализа, содержащего реагент Slide-A-Lyzer с отсечкой молекулярной массы 10000 (Pierce, Rockford, IL), приблизительно в течение 40 минут для удаления гистидинового буфера, который оказывает негативное влияние на связывание антитела с сефарозой. Диализованный раствор mAb добавляли к активированной смоле и оставляли на 4 часа при комнатной температуре на роторе для смешивания (Mix- All Laboratory Tube Mixer, Torrey Pines Scientific, San Marcos, CA). После связывания, проточную смолу собирали, а затем три раза промывали 200 мкл буфера A. Смолу суспендировали в 200 мкл буфера D, после чего встряхивали при комнатной температуре в течение 1 часа для блокирования избыточных сайтов связывания в смоле. Раствор буфера D интенсивно промывали и смолу поочередно промывали 200 мкл буфера C и буфера D (промывка при низком/высоком pH), каждый раз, всего три раза. Смолу три раза промывали 200 мкл буфера B до тех пор, пока она не была готова к связыванию с антигеном.
Иммобилизованное моноклональное антитело AE12-1 связывали с hRGMa. Компактные реакционные колонки (CRC) приготавливали для связывания с антигеном путем трехкратной промывки 35 мкм-фритты CRC 200 микролитрами буфера B. Смолу со связанным антителом осторожно смешивали для гомогенного ресуспендирования смолы и 50 мкл этой смолы помещали в каждую приготовленную CRC. Смолу три раза промывали 200 мкл буфера B. Приблизительно 1,5 нмоль антигена hRGMa добавляли к смоле с буфером В в количестве, достаточном для получения общего объема по меньшей мере 200 мкл. Перед связыванием с антигеном, E. coli-продуцированный антиген диализовали против буфера PBS приблизительно в течение 30 минут с использованием устройства для минидиализа, содержащего реагент Slide-A-Lyzer с отсечкой молекулярной массы 10000, для удаления DTT из антигенного буфера. Смесь антигена/смолы оставляли на роторе на 4 часа при комнатной температуре для смешивания. Проточную жидкость (FT) собирали и смолу три раза промывали 200 мкл буфера В.
Эпитопы вырезали с использованием трипсина и эндопротеиназы Asp-N. Смолу, содержащую комплекс «иммобилизованное антитело/антиген», суспендировали в 200 мкл буфера В. Содержимое сосуда с 20 мкг трипсина (Promega, Madison, WI) растворяли в 100 мкл буфера для ресуспендирования (50 мМ HOAc) до концентрации 0,2 мкг/мкл и 2 мкг содержимого сосуда с эндопротеиназой Asp-N (Roche) растворяли в 50 мкл воды (0,04 мкг/мкл). Гидролиз антигена осуществляли с использованием фермента в отношении к антигену 1:100 (масс/масс). Реакцию проводили в течение 4-6 часов со встряхиванием при комнатной температуре.
После гидролиза, FT собирали и смолу два раза промывали 200 мкл буфера В, причем такой сбор проводили отдельно после каждой промывки (промывка 1 и 2), 200 мкл буфера A (промывка 3), а затем 200 мкл буфера В (промывка 4). Антигенные пептиды, связанные с антителом, элюировали со смолы тремя 200-мкл аликвотами 2% муравьиной кислоты, и каждый элюат собирали отдельно (элюирование 1, 2 и 3). Фракцию элюата 1 анализировали с помощью масс-спектрометрии (ЖХ-МС/МС) для определения области эпитопа.
Фракции элюата 1, собранные после гидролиза, анализировали с помощью ЖХ-ИЭР-МС/МС (положительный ион) с использованием подающего насоса для капиллярной ВЭЖХ Agilent (Santa Clara, CA) 1100 и наноса для градиентной нано-ВЭЖХ 1200, с чипом Chip Cube (обогатительная 40 нл-колонка, аналитическая колонка, 75 мкм × 43 мм, чип C8 ZORBAX), подсоединенным к Agilent 6510 QTOF MS. Затем впрыскивали до 7 мкл реагента и проводили МС/МС на 3 ионах, наиболее удовлетворяющих критериям передачи специфического МС-сигнала.
Предварительный МС-анализ вырезанных фракций эпитопа (элюат 1) указывал на присутствие крупных пептидных молекул, которые не соответствовали предполагаемым протеолитическим пептидам, что, вероятно, обусловлено присутствием пептидов, связанных дисульфидной связью. Для восстановления дисульфидных связей, 10-мкл аликвоты доводили до рН~8 с использованием разведенного NaOH и восстанавливали в 5 мМ дитиотреитоле (DTT) при 37°C в течение 30 минут, а затем проводили повторный МС-анализ. Для восстановления некоторых фракций требовалась денатурация, и в этом случае аликвоту разводили в равном объеме 8M гидрохлорида гуанидина, 100 мМ триса (pH 8), и добавляли DTT.
ЖХ-ИЭР-МС/МС-анализ всех фракций элюата 1, полученных после ферментативного гидролиза mAb AE12-1, связанного с различными конструкциями hRGMa, указывал на присутствие нескольких крупных пептидных молекул с молекулярными массами в пределах 8,5-12 кДа. Для идентификации пептидов, определения массы и фрагментации крупных молекул было недостаточно. Для идентификации пептидов эпитопов необходимо провести реакцию восстановления дисульфидных связей. Во всех случаях, интенсивность МС-сигнала этих пептидов значительно снижалась после восстановления, а в некоторых случаях, она была недетектируемой, несмотря на восстановление в присутствии денатуранта.
После восстановления фракции элюата 1 с использованием DTT, эти фракции повторно анализировали с помощью ЖХ-МС/МС. В экспериментах по вырезанию, проводимых с использованием E. coli-продуцируемого hRGMa, большинство наблюдаемых пиков на ионной хроматограмме относились к монозаряженным молекулам, большинство из которых соответствовали полимерам или другим добавкам. Два пептида были идентифицированы как пептиды, относящиеся к используемой конструкции hRGMa. См. фигуру 5. Первым пептидом является пептид с моноизотопной молекулярной массой 2420,2 Да. Молекулярная масса пептида и массы нескольких фрагментов, наблюдаемых в МС/МС-спектрах (не приводятся), соответствовали массам последовательности PCKILKCNSEFWSATSGSHAPAS (hRGMa 47-69) (SEQ ID NO: 79), хотя такое определение не соответствовало специфичности данного фермента. Что касается второго потенциального пептида эпитопа с моноизотопной молекулярной массой 2551,2 Да, то было выявлено только 2-3 идентифицированных МС/МС-фрагментов, которые соответствовали последовательности MPCKILKCNSEFWSATSGSHAPAS (SEQ ID NO: 80). Эта последовательность не соответствовала ферментативной специфичности, однако поскольку молекулярная масса исходного антигена не соответствовала вычисленной массе полноразмерной последовательности, то можно сделать вывод, что указанный антиген имеет N-концевую гетерогенность, которая явно не характерна для ферментативной специфичности.
При использовании второй антигенной конструкции, пептиды не наблюдались в МС-спектре после DTT-восстановления. МС-анализ, после восстановления в денатурирующих условиях, выявил пептиды из однозарядных и фоновых ионов. Четыре пептида антигена были идентифицированы в денатурированных и восстановленных фракциях Е1. Первый пептид антигена имел моноизотопную молекулярную массу 2763,3 Да и эта масса, а также МС/МС-фрагментация соответствовали последовательности KAGSPCKILKCNSEFWSATSGSHAPAS (SEQ ID NO: 81) (hRGMa 47-69 с 4 дополнительными N-концевыми остатками). Спектры, ассоциированные с этим пептидом, представлены на фигуре 6. Сигнал пептида очень низкой интенсивности в том же самом спектре (MW 2878,4 Да; +4, m/z 720,84, обозначенный звездочкой на фигуре 6) соответствовал сигналу последовательности KAGSPCKILKCNSEFWSATSGSHAPPASD (SEQ ID NO: 82). Пептид с MW 2635.2, показанный на фигуре 7, соответствовал последовательности AGSPCKILKCNSEFWSATSGSHAPPAS (SEQ ID NO: 90). Дополнительный пептид, m/z 688,82 (наиболее распространенный изотоп, заряд +4), обозначенный звездочкой на фигуре 7, элюировался вместе с пептидом MW 2635,2. Ограниченные МС/МС-данные, полученные для этого компонента с низкой интенсивностью, соответствовали данным, полученным для последовательности AGSPCKILKCNSEFWSATSGSHAPPASD (SEQ ID NO: 83) (MW 2750,3 Да).
В целях подтверждения эпитопа для AE12-1 использовали третью конструкцию hRGMa. Во фракции элюата 1, которая была восстановлена с использованием DTT, наблюдался очень низкий уровень восстановления, однако один пептид мог быть идентифицирован как пептид, соответствующий антигену hRGMa, и эти результаты совпадали с результатами, полученными для других антигенных конструкций. Наблюдаемый пептид имел m/z 691,60 (заряд +4) и моноизотопную молекулярную массу 2762,4 Да. Ограниченные МС/МС-данные, полученные для этого пептида (не приводятся), дают основание предположить, что эта последовательность представляет собой TKLPCKILKCNSEFWSATSGSHAPAS (SEQ ID NO: 84). Другие пептиды, которые наблюдались в МС-спектре и которые могут быть отнесены к области hRGMa (47-168), включали DSPEICHYEK (SEQ ID NO:85); GDLAYHSAVHGIE (SEQ ID NO:86); DLAYHSAVHGIE (SEQ ID NO: 87); и DDTPEFCAALR (SEQ ID NO: 88).
Во фракциях элюата 1 (гидролиз трипсином/Asp-N), полученных в экспериментах по вырезанию эпитопа hRGMa, связанного с AE12-1, пептид hRGMa (47-69) был идентифицирован в трех конструкциях антигена. Пептид, идентифицированный как эпитоп hRGMa для AE12-1, представляет собой PCKILKCNSEFWSATSGSHAPAS (hRGMa 47-69) (SEQ ID NO: 79).
Пример 8
Токсикологические исследования
Поскольку аккумуляция железа в гепатоцитах и снижение содержания железа в селезенке могут быть вызваны нейтрализацией RGMc, то были проведены исследования на токсикокинетику и переносимость описанных здесь RGMa-селективных моноклональных антител. Как и предполагалось, эти исследования показали, что аккумуляции железа в гепатоцитах и истощения содержания железа в селезенке не происходило в том случае, когда крысам Sprague-Dawley вводили RGMa-селективные моноклональные антитела.
Пример 9
RGMa-селективные моноклональные антитела AE12-1 и AE12-1Y, подобные гуманизованному моноклональному антителу 5F9, индуцировали регенерацию разрушенных и поврежденных аксонов зрительного нерва в крысиной модели поражения зрительного нерва
Модель разрушения зрительного нерва (также называемого «повреждением зрительного нерва») представляет собой животное-модель, полученное для тестирования различных веществ, стимулирующих регенерацию волокон зрительного нерва и снижающих уровень массовой гибели ганглиозных клеток сетчатки.
Эти эксперименты проводили на взрослых самцах крыс Wistar, поставляемых из лаборатории Charles River (D) Laboratories (Germany). Животные содержались в отдельных клетках в режиме смены дня и ночи 12:12 часов (свет:темнота) со свободным доступом (ad libitum) к пище и воде. Разрушение зрительного нерва всегда осуществляли только на левом глазу посредством хирургической операции на минимальном участке передней поверхности, как описано в публикации P. Monnier et al., J. Neurosci., 31: 10494-10505 (2011), содержание которой вводится в настоящее описание посредством ссылки, а затем специалист проводил хирургическую операцию на передней поверхности глаза. До и во время операции, животным делали ингаляционную анестезию с использованием севофлурана (Abbott GmbH Co. & KG, Delkenheim, Germany) и фиксировали на операционном столе путем зажима челюсти и заматывания конечностей клейкой лентой. Во избежание снижения температуры тела, животных помещали на нагревательную пластину. Для проведения хирургической операции по разрушению зрительного нерва передней поверхности глаза крыс, левый глаз осторожно освобождали от связок и соединительной ткани. В первой стадии делали микрохирургический разрез (2-3 мм) прилежащей ткани во внешнем углу глаза. В последующей стадии зрительный нерв обнажали с помощью пары пинцетов для его передвижения в сторону глазных мышц и слезных желез, и таким образом сохраняли его целостность. В следующей стадии мозговую оболочку вскрывали путем продольного разреза микроножницами для обнажения зрительного нерва. Это приводило к большей подвижности глаза и обеспечивало боковую ротацию глаза и доступ к левому зрительному нерву. Повреждение зрительного нерва делали приблизительно на 1-3 мм ниже глаза с помощью пары пинцетов для обеспечения фиксированного максимального давления на 10-20 секунд. При этом следует соблюдать особые меры предосторожности, чтобы не повредить сосудистую систему глаза.
После минимальной инвазивной хирургической операции, животных помещали на бумажное полотенце в чистые клетки, установленные на нагревателе для регуляцией температуры тела до тех пор, пока животные не начинали двигаться. Во избежание бактериальной инфекции и высушивания склеры, на глаз наносили мазь, содержащую антибиотик (Gentamytrex, Dr. Mann Pharma).
Карпрофен (римадил, 5 мг/кг) вводили внутрибрюшинно для купирования постоперационной боли непосредственно после хирургической операции, а затем два раза в день в течение 3 дней. Затем животных наблюдали и регулярно проводили мониторинг в течение нескольких часов сразу после хирургической операции и в последующие 2-4 дня для того, чтобы убедиться, что все животные выжили и восстановились после анестезии и хирургической операции.
Описанный выше модифицированный метод разрушения зрительного нерва передней поверхности глаза имеет значительные преимущества по сравнению со стандартным методом разрушения зрительного нерва, который проводят в задней части глаза. В частности, проведение описанной здесь операции не приводит к появлению больших открытых ран, при которых может потребоваться нанесение швов, к тому же, в случае очень небольших ран значительно снижается риск инфицирования. Кроме того, для такого разрушения зрительного нерва требуется меньше времени (описанный выше метод операции на передней поверхности глаза осуществляют приблизительно в 3 раза быстрее, чем метод операции на задней поверхности, как известно специалистам), а поэтому животные страдают меньше и меньше подвержены стрессу. Кроме того, болевые ощущения у животных значительно снижаются, и эти животные восстанавливаются гораздо быстрее.
Системное введение антител
Для системной доставки антитела, самцам крыс Wistar системно и внутривенно (i.v.) вводили гуманизованный RGMa и RGMc-блокирующее антитело 5F9 (h5F9) (n=8 животных) (гуманизованное антитело 5F9 описано в публикации заявки на патент США № 2010/0028340, содержание которой вводится в настоящее описание посредством ссылки), RGMa-селективное антитело, человеческое антитело, AE12-1, описанное в настоящей заявке, близкородственное анти-RGMa mAb, AE12-1Y, также описанное в настоящей заявке, и человеческое антитело контрольного изотипа (hIgG) (n=8 животных). Крысам внутривенно один раз в неделю инъецировали 10 мг/кг данного антитела, и эти инъекции начинали вводить сразу после разрушения зрительного нерва. Всем крысам вводили 5 инъекций, а затем животных подвергали эвтаназии через 6 недель после разрушения нерва. Эти эксперименты проводили слепым методом, а выделение ткани, обработку, приготовление срезов и количественный анализ проводили, как описано в публикациях P. Monnier et al., J. Neurosci., 31: 10494-10505 (2011) и Koeberle et al., Neuroscience, 169:495-504 (2010), содержание которых вводится в настоящее описание посредством ссылки. Затем получали составные изображения крысиных зрительных нервов, идентифицировали участок разрушения и подсчитывали число GAP-43-позитивных волокон, простирающихся на 500 мкм за пределы участка разрушения. Как показано на фигуре 16, все три анти-RGMa антитела - h5F9, AE12-1 и AE12-1Y индуцировали значительный регенеративный рост за пределами участка разрушения, в отличие от контрольных животных, обработанных hIgG.
Пример 10
RGMa-селективные моноклональные антитела AE12-1 и AE12-1Y, подобные гуманизованному антителу 5F9, защищают слой нервного волокна сетчатки (RNLF) от дегенерации
Для оценки защиты RNLF от дегенерации применяли новый лабораторный метод анализа. Этот метод был разработан на основе эксплантации и анализа сетчатки взрослых крыс, выделенной из глаз крыс с поврежденным зрительным нервом и системно обработанной антителом 5F9, AE12-1, AE2-1Y и контрольным антителом, человеческим IgG. Этот метод представляет собой адаптированный вариант методов, описанных P. Monnier et al., J. Neurosci., 31: 10494-10505 (2011) и Koeberle et al., Neuroscience, 169:495-504 (2010). P. Monnier et al., J. Neurosci., 31: 10494-10505 (2011) и Koeberle et al., Neuroscience, 169:495-504 (2010). Взрослым самцам крыс Wistar, поставляемым из лаборатории Charles River Laboratories (Germany), внутривенно один раз в неделю инъецировали 10 мг/кг данного антитела, и эти инъекции начинали вводить сразу после разрушения зрительного нерва. Всем крысам вводили 5 инъекций, а затем животных подвергали эвтаназии через 6 недель после разрушения нерва.
Приготовление сетчатки и иммунофлуоресцентное окрашивание:
Животных подвергали глубокой анестезии севофлураном (8%; Abbott GmbH Co. & KG, Delkenheim, Germany), после чего их сразу умерщвляли путем вскрытия грудной клетки и перфузии левого желудочка сердца 4% раствором параформальдегида (PFA). Глаза вместе с соединительной тканью осторожно извлекали и помещали в 4% PFA до получения препарата сетчатки.
Препарат сетчатки получали в сбалансированном солевом растворе Хэнкса (HBSS, без магния и кальция; Invitrogen, #14170070). Глаз фиксировали на соединительной ткани хирургическим пинцетом и делали круглый разрез в склере непосредственно вокруг роговицы. Полусферу сетчатки разрезали в четырех местах, вскрывали и распределяли на серой нитроцеллюлозной мембране (Sartorius, #13006-50-N). Если это было необходимо, то мембрану с сетчаткой оставляли на 5-10 секунд для сушки на воздухе. Затем сетчатку на мембране помещали в 10% нейтральный забуференный фосфатом раствор формальдегида (pH 7,3; Fisher Scientific, #F/1520/21) при +4°C, а затем проводили иммунофлуоресцентное окрашивание. Окрашивание проводили в соответствии с протоколом, описанным ниже.
Препарат сетчатки промывали TBS, а затем блокировали и делали проницаемым путем обработки 5% BSA, 1% тритона X-100 в TBS в течение 30 минут, после чего снова промывали TBS. «Первые» антитела, а именно моноклональное Ab TUJ-1, мышиное антитело против тубулина βIII, AbCam, # abl4545; в разведении 1:500 в TBS, 5% BSA, добавляли в течение 1 часа при комнатной температуре в темноте, после чего промывали TBS, 0,1% твина 20. Затем «второе» антитело, а именно ослиное антимышиное антитело Cy3; Jackson ImmunoResearch (Dianova) 715-165-151, в разведении 1:1000 и бисбензимид (50 мкг/мл в разведении 1:100 в TBS, 5% BSA) добавляли в течение 1 часа при комнатной температуре в темноте, после чего промывали TBS, 0,1% твина 20, а затем обессоленной H2О. После этого препарат помещали на Fluoromount G и хранили при +4°C в темноте.
Количественный анализ протективного действия анти-RGMa антител на слой нервного волокна сетчатки глаза (RNFL)
С помощью компьютерной программы Axiovision произвольно выбирали изображения (n=12) каждой сетчатки и определяли число нервных волокон для каждого изображения. В этих экспериментах, 5-8 сетчаток с поврежденными зрительными нервами использовали для каждой группы: группы для h5F9 MAb, группы для контрольного MAb hIgG и групп для MAb AE12.1 и AE12-1Y. Анализ данных и статистический анализ проводили с использованием программы GraphPad prism.
Результаты проиллюстрированы на фигуре 17. В частности, в сетчатке животных, системно обработанных анти-RGMa антителами согласно изобретению, наблюдалось значительно большее количество пучков нервных волокон, чем в сетчатке животных, обработанных контрольным антителом hIgG.
Пример 11
Анти-RGMa антитела ускоряют восстановление функции в фокальном участке спинного мозга у модели с экспериментальным аутоиммунным энцефаломиелитом (ЭAЭ)
Kerschensteiner и сотрудниками (Am. J. Pathol. 164: 1455-69, 2004) была создана модель с фокальным локализованным ЭAЭ, где обширные воспалительные поражения произвольно не распространялись на спинной мозг, головной мозг и зрительный нерв, но могли быть селективно индуцированы либо в области спинного мозга, либо в других областях головного мозга. С использованием этой модели фокального или направленного ЭAЭ, обширные воспалительные поражения, очень похожие на поражения спинного мозга при РС, были индуцированы в дорсальный отдел столба спинного мозга и поражали корково-спинномозговой путь. В этой модели, крыс сначала иммунизовали миелиновым белком MOG. Через две или три недели после иммунизации определяли титры анти-MOG антитела, и животным с положительным иммунным ответом местно инъецировали смесь цитокинов (250 нг TNFα, 150 ед. IFNγ) в отдел грудной клетки на торакальном уровне 8 (T8). Через одну неделю после инъекции цитокинов, у крыс развивались нарушения двигательной функции задних конечностей, наблюдался паралич хвоста и нарушения координации движения, достигающие по шкале оценок ЭAЭ величины 2,5. Через четыре недели после инъекции цитокинов, эта величина по шкале оценок ЭAЭ снижалась до 1 (Kerschensteiner et al., Am. J. Pathol. 164: 1455-69, 2004).
Самкам крыс Lewis подкожно инъецировали 75 мкл MOG (75 мкг, 1-125 а.к., BlueSky Biotech, Worcester, MA), растворенных в физиологическом растворе, а затем эмульгировали с 75 мкл неполного адъюванта Фрейнда (НАФ, Sigma, #F5506). Непосредственно перед инъекцией, а затем через каждые 7-8 дней, у животных брали пробы крови для анализа проб на анти-MOG антитела.
Через две или три недели после MOG-иммунизации, у иммунизованных крыс брали кровь и проводили ELISA-анализ для детектирования MOG-специфических антител. Иммунизация приводила к индуцированию анти-MOG антител у более чем 90% иммунизованных крыс. Однако у этих крыс индуцирование анти-MOG антител не приводило к появлению каких-либо симптомов заболевания. У крыс Lewis наблюдалось лишь нарушение двигательной функции после местной инъекции 2 воспалительных цитокинов (TNFα, IFNγ) в грудной отдел спинного мозга на уровне торакальном уровне 8 (T8).
Для инъекции цитокинов, крыс подвергали ингаляционной анестезии севофлураном (8%; Abbott GmbH Co. & KG, Delkenheim, Germany) и ламинэктомии в соответствии со стандартной процедурой. В частности, кожу на спинке крыс выбривали и дезинфицировали 70%-ным этанолом, а затем выбритый участок оборачивали продином и скальпелем делали 2-3-см разрез на участке приблизительно от T3-4 до T11-12. Затем из мышц удаляли поверхностный жир тонкими ножницами и мышцы разрезали по средней линии с одной стороны по всему отделу позвоночника. После этого делали разрез между T8 и T9, и участок T8 извлекали из прилежащей ткани. На участке Т8, микродрелью высверливали круглое отверстие диаметром приблизительно 1-2 мм и небольшими искривленными пинцетами удаляли остеофит и все фрагменты кости. Затем твердую мозговую оболочку удаляли микроножницами и осуществляли стереотаксическую инъекцию с использованием очень тонких стеклянных капилляров, подсоединенных к 10 мкл-шприцу Гамильтона с люэровским наконечником (LT) и заполненных минеральным маслом (Sigma Aldrich).
С использованием автоматического инжектора, капилляры заполняли 3 мкл смеси цитокинов в PBS или только PBS со следовыми количествами голубого Эванса. Была введена в четыре раза более высокая доза (4x) TNFα (1000 нг) и та же самая доза IFNγ (150 ед.), как описано у Kerschensteiner et al. (2004). Эта в четыре раза более высокая доза приводила к значительному замедлению процесса восстановления у крыс, обработанных носителем или контролем.
В следующей стадии, стеклянный капиллар вставляли на глубину 0,7 мм, и 2 мкл смеси цитокинов инъецировали в середину спинного мозга (на участке T8) в течение 5-минутного периода с использованием автоматического инжектора. После введения лидокаина и закрытия раны, крысам вводили анальгетик римадил (сразу после хирургической операции и ежедневно в течение 3-4 дней). Затем крыс помещали в чистую клетку на чистое полотенце и содержали в тепле вплоть до их пробуждения от наркоза.
Через одну неделю после инъекции цитокинов, у крыс появлялись первые симптомы. Обработку антителом начинали на 7-й или 8-й день после введения цитокинов. При этом использовали контрольное антитело hIgG и несколько различных анти-RGMa антител (а именно антитела AE12-1, AE12-1Y и гуманизованное антитело 5F9.23 (h5f9.23, которое описано в публикации заявки на патент США № 2010/0028340)), и эти антитела вводили крысам внутривенно один раз в неделю. ЭAЭ оценивали ежедневно, и оценки регистрировали. Специалистами были проведены эксперименты слепым методом для различных групп обработки. Через 27-29 дней после введения цитокинов, животных умерщвляли, спинной мозг извлекали и анализировали на экспрессию следующих белков: GAP-43 (маркера регенерации), CD68 (маркера воспаления для активированных микроглиальных клеток и макрофагов) и MPB (миелинового основного белка, маркера ремиелинизации или консервативных миелиновых путей). Участки, содержащие эти маркеры, измеряли, анализировали и статистически оценивали с помощью одностороннего дисперсионного анализа ANOVA и критерия значимости Бонферрони. Как показано на фигуре 18, все три анти-RGMa антитела ускоряли восстановление функций спинного мозга у моделей с направленным ЭAЭ спинного мозга.
У моделей с направленным ЭAЭ спинного мозга, все анти-RGMa антитела обнаруживали почти аналогичную активность, направленную на стимуляцию регенерации и нейропротекции. RGMa-селективные антитела AE12-1 и AE12-1Y обладали такой же активностью, как и антитело h5F9.23, которое нейтрализовало оба RGMa и RGMc. Для эффективности лечения, нейтрализация RGMc не требовалась. Поэтому, для лучшего понимания механизма действия всех трех анти-RGMa mAb у моделей фокального ЭAЭ спинного мозга, в нескольких участках спинного мозга крыс, обработанных антителами AE12-1Y, AE12-1 и h5F9.23, оценивали несколько маркеров на увеличение площади регенерации (GAP-43), на увеличение площади ремиелинизации (миелиновый основный белок (MBP)) и на снижение площади CD68-воспаления (CD68-позитивного) вокруг участка повреждения спинного мозга (см. фигуру 19).
RGMa-селективное антитело AE12-1Y-QL тестировали для того, чтобы определить, какие дозы этого антитела являются эффективными у данной модели направленного ЭAЭ спинного мозга. В частности, 4 различных дозы антител (а именно 0,01, 0,1, 1, 10 мг/кг антитела) были введены крысам системно (i.v.) один раз в неделю. AE12-1Y-QL обнаруживало значимую активность в дозах 0,1, 1 и 10 мг/кг (фигура 20). Однако доза 0,01 мг/кг была неэффективной.
Реферат
Настоящее изобретение относится к иммунологии. Предложено антитело к молекуле отталкивающего направляющего сигнала а (RGMa). Также рассмотрена фармацевтическая композиция, содержащая указанное антитело, и способ лечения, предупреждения, модуляции или снижения тяжести заболевания или расстройства, ассоциированного с дегенерацией нейритов. Данное изобретение может найти дальнейшее применение в терапии нейродегенеративных заболеваний, таких как рассеянный склероз. 3 н. и 28 з.п. ф-лы, 20 ил., 4 табл., 11 пр.

Комментарии