Хиральное 4-боронофенилаланиновое (вра) производное и способ его получения и способ полученияf-меченного вра с использованием указанного производного - RU2660433C2
Код документа: RU2660433C2
Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0001]
Настоящее изобретение относится к новому хиральному 4-боронофенилаланиновому (BPA) производному, к способу получения такого производного и к способу получения18F-меченного BPA (18F-2-фтор-4-бороно-L-фенилаланин:18F-BPA), с использованием такого производного.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
[0002]
В настоящее время внимание уделяется позитрон-эмиссионной томографии (ПЭТ) как методу, который является высокочувствительным и является отличным для количественного определения рабочих характеристик и может легко формировать изображения с учетом их принципа. Эта методика широко используется. Период полураспада ПЭТ диагностических реагентов (меченых атомов) является коротким, и каждый из меченых атомов вводят в небольшом количестве, таким образом, чтобы любой живой организм крайне незначительно подвергся воздействию облучения, вызываемого ими. Поэтому этот способ контроля представляет собой низко инвазивный способ контроля, таким образом, является высоко предпочтительным для ПЭТ. Более того, ПЭТ является высокочувствительным даже к опухолям, которые не легко поддаются определению при помощи КТ (компьютерная томография) или МРТ (магнитно-резонансная томография), и опухолевые ткани можно определить в соответствии с изображениями.
[0003]
18F-меченный BPA, в котором18F-фтор атом введен в BPA, который представляет собой борированную аминокислоту, используемую в качестве борного реагента для BNCT (бор-нейтрон-захватная терапия), был разработан Ishiwata в качестве молекулярного зонда для ПЭТ в 1991 (Непатентный документ 1). С тех пор ПЭТ исследование с использованием18F-меченного BPA с использованием зонда по настоящему изобретению имеет важное значение как метод для поддержки BNCT. Другими словами, в клинических и научно-исследовательских учреждениях18F-BPA ПЭТ изображение, полученное, заблаговременно подвергая субъекта измерительным процедурам, может обеспечить данные о внутренней аккумуляции дистрибуции BPA, отношение опухолевые ткани/нормальные ткани (T/N отношение) и другие данные. На основании этих данных, заранее предполагают лечебные эффекты BNCT, и затем можно составить план исследований или терапевтический план.
[0004]
В способе синтеза Ishiwata, BPA непосредственно фторируют с получением18F-меченного BPA, и18F+ используют в качестве электрофильного реагента. Из дейтерия (D) и неона (Ne), ускоряемых циклотроном, получают газообразный18F и затем пропускают через колонку, заполненную ацетатом натрия для преобразования газа в CH3COO-18F+. После этого барботируют раствор BPA в трифторуксусной кислоте путем введения этого полученного в результате конверсии соединения в раствор. Таким путем осуществляют синтез целевого18F-меченного BPA.
[0005]
В качестве другого способа синтеза18F-меченного BPA, Vahatalo et al. предлагают способ, в котором такой традиционный способ частично улучшен (Непатентный документ 2). Этот способ представляет собой способ использования H18F, который может быть получен в большем количестве, для осуществления синтеза через CH318F в качестве промежуточного соединения18F2. Вызывая взаимодействие CH3I с H18F, который получают через излучение протонов к H218O [через18O(p,n)18F реакцию], синтезируют CH318F. Полученное соединение CH318F разряжают для разъединения его C-F связей с получением18F2. Это соединение используют для синтеза18F-меченного BPA, эквивалентного способу синтеза Ishiwata.
ДОКУМЕНТЫ ПРЕДШЕСТВУЮЩЕГО УРОВНЯ ТЕХНИКИ
НЕПАТЕНТНЫЕ ДОКУМЕНТЫ
[0006]
Непатентный документ 1: Appl. Radiat. Isot., 42, 325, 1991
Непатентный документ 2: J. Label. Compd. Radiopharm., 45, 697, 2002
КРАТКОЕ ИЗЛОЖЕНИЕ ИЗОБРЕТЕНИЯ
ПРОБЛЕМЫ, РЕШАЕМЫЕ ПРИ ПОМОЩИ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
[0007]
Однако молекула18F-меченного BPA, полученная обычным способом синтеза в соответствии с Ishiwata и соавт., имеет низкую удельную радиоактивность и, кроме того, чрезвычайно низкий выход. Даже при использовании усовершенствованного способа выход остается небольшим, несмотря на то, что удельная радиоактивность полученных18F-меченных BPA молекул повышается.
[0008]
Одним из объектов настоящего изобретения является обеспечение нового BPA производного, которое может быть промежуточным соединением для синтеза18F-меченного BPA.
[0009]
Другой задачей настоящего изобретения является обеспечение способа получения такого нового BPA производного и способа получения18F-меченного BPA с использованием этого производного.
СПОСОБЫ РЕШЕНИЯ ЗАДАЧ
[0010]
Для того чтобы решить вышеуказанные проблемы, авторы изобретения провели тщательные исследования, чтобы найти новый способ синтеза18F-меченного BPA. Таким образом, было создано настоящее изобретение.
[0011]
Таким образом, настоящее изобретение относится к соединению, представленному следующей формулой:

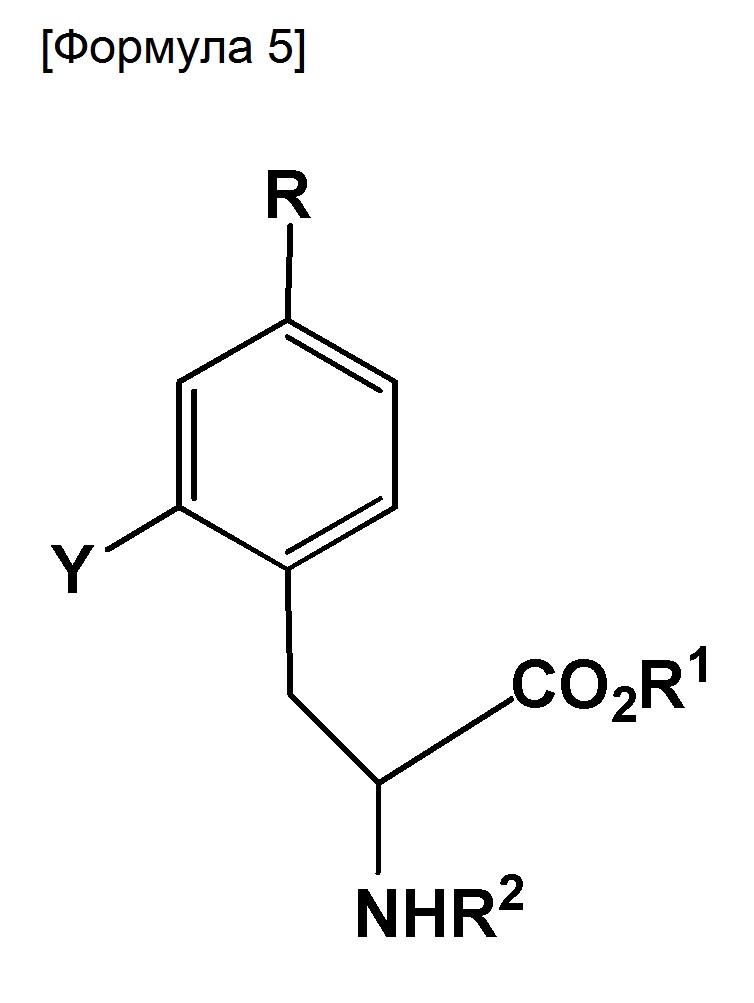
где R представляет собой BR3R4, BX3- или BX3-M+(X представляет собой галоген; M+ представляет собой одновалентный одноатомный катион, многоатомный катион или комплексный катион); R1 представляет собой водород или защитную группу PG1; R2 представляет собой водород или защитную группу PG2; R3 и R4 каждый представляет собой OH, или же R3 и R4 оба объединяются с B (атом бора), с образованием кольца, служащего в качестве защитной группы для B; Y представляет собой галоген, NO2, NH2, Sn(R6)3, N=N-NR7R8, OSO2R9, NR10R11, замещенную или незамещенную фенильную йод группу или замещенную или незамещенную гетероциклическую йод группу; R6 представляет собой алкильную группу, содержащую от 1 до 7 атомов углерода; R7 и R8, которые могут быть одинаковыми или отличными друг от друга, каждый представляет собой водород, алкильную группу, содержащую от 1 до 7 атомов углерода, галоген-замещенную алкильную группу, содержащую от 1 до 7 атомов углерода, или необязательно замещенную фенильную группу, или же R7 и R8 объединяются с N с образованием 3-7-членной циклической структуры; R9 представляет собой алкильную группу, содержащую от 1 до 7 атомов углерода, галоген-замещенную алкильную группу, содержащую от 1 до 7 атомов углерода, или необязательно замещенную фенильную группу; и R10 и R11, которые могут быть одинаковыми или отличными друг от друга, каждый представляет собой алкильную группу, содержащую от 1 до 7 атомов углерода, галоген-замещенную алкильную группу, содержащую от 1 до 7 атомов углерода, или необязательно замещенную фенильную группу, или же R10 и R11 объединяются с N с образованием 3-7-членной циклической структуры; за исключением того, что исключается ситуация, когда одновременно действуют следующие условия: Y представляет собой F, R1 и R2 оба представляют собой водород, и R3 и R4 оба представляют собой OH.
[0012]
В этом соединении, предпочтительно, когда Y представляет собой I, F, NO2, NH2, Sn(R6)3, N=N-NR7R8, OSO2R9, NR10R11, I+R13 или (R14-)I+R13, где: R6 представляет собой метил или н-бутил; R7 и R8 могут быть одинаковыми или отличными друг от друга, и каждый представляет собой водород, метил, этил, пропил, бутил, гептил, трифторметил или необязательно замещенную фенильную группу, или объединяются с N с образованием азиридина, азетидина, пирролидина или пиперидина; R9 представляет собой метил, этил, пропил, бутил, гептил, трифторметил или необязательно замещенную фенильную группу; R10 и R11 могут быть одинаковыми или отличными друг от друга, и каждый представляет собой метил, этил, пропил, бутил, гептил, трифторметил или необязательно замещенную фенильную группу, или объединяются с N с образованием азиридина, азетидина, пирролидина, пиперидина или гомо-пиперидина; R13 представляет собой C1-6-алкил-замещенную фенильную группу, C1-6-алкокси-замещенную фенильную группу или фенильную группу или 5-7-членную гетероциклическую группу, содержащую один или несколько атомов из атомов N, S или О; и R14 представляет собой галоген или группу тетрафторборат, нитрат, трифлат, сульфонилокси, толуолсульфонилокси или перхлорат.
[0013]
В этом соединении, предпочтительно, когда R представляет собой BR3R4, где R3 и R4 каждый представляет собой OH, или R3 и R4, взятые вместе с B, образуют кольцо в качестве защитной группы для B, где группа, образующая кольцо, может быть выбрана из группы, включающей пинакол, 3,3-диметил-1,3-пропандиол, N-метилдиэтаноламин, 1,8-диаминонафталин, N-метилиминодиуксусную кислоту, 1,1,1-трисгидроксиметилэтан и катехин; или R представляет собой BX3- или BX3M, где X представляет собой F, и M+ представляет собой ион щелочного металла, ион аммония, ион тетраалкиламмония, ион тетраариламмония, ион тетраалкилфосфония, ион тетраарилфосфония или ион имидазолия.
[0014]
Соединение по настоящему изобретению может представлять собой любое из следующих соединений:
трет-бутил 2-(трет-бутоксикарбониламино)-3-(2-нитро-4-(4,4,5,5-тетраметил-1,3,2-диоксабороран-2-ил)фенил)пропаноат;
трет-бутил 3-(2-амино-4-(4,4,5,5-тетраметил-1,3,2-диоксабороран-2-ил)фенил)-2-(трет-бутоксикарбониламино)пропаноат;
трет-бутил 2-(трет-бутилоксикарбониламино)-3-(2-йод-4-(4,4,5,5-тетраметил-1,3,2-диоксабороран-2-ил)фенил)пропаноат;
трет-бутил 2-(трет-бутилоксикарбониламино)-3-(4-(4,4,5,5-тетраметил-1,3,2-диоксабороран-2-ил)-2-(три-н-бутилстаннил)фенил)пропаноат;
трет-бутил 2-(трет-бутоксикарбониламино)-3-(2-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксабороран-2-ил)фенил)пропаноат;
(2-(3-трет-бутокси-2-(трет-бутоксикарбониламино)-3-оксопропил)-5-(4,4,5,5-тетраметил-1,3,2-диоксаборан-2-ил)фенил)(3-метоксифенил)йодоний тозилат;
трет-бутил 2-(трет-бутилоксикарбониламино)-3-(2-нитро-4-(калийтрифтор-2-ил)-2-нитрофенил)пропаноат; или
(2-(3-трет-бутокси-2-(трет-бутоксикарбониламино)-3-оксопропил)-5-(калийтрифтор-2-ил)фенил)(3-метоксифенил)йодоний тозилат.
[0015]
Настоящее изобретение также относится к способу получения соединения, включающему стадию использования следующего соединения:

где X1 и X2 могут быть одинаковыми или отличными друг от друга, и каждый представляет собой галоген,
полученное соединение является соединением, представленным следующей формулой:

где R представляет собой BR3R4, BX3- или BX3-M+ (X представляет собой галоген; M+ представляет собой одновалентный одноатомный катион, многоатомный катион или комплексный катион); R1 представляет собой водород или защитную группу PG1; R2 представляет собой водород или защитную группу PG2; R3 и R4 каждый представляет собой OH, или же оба R3 и R4 объединены с B (атом бора) с образованием кольца, служащего в качестве защитной группы для B; Y представляет собой галоген, NO2, NH2, Sn(R6)3, N=N-NR7R8, OSO2R9, NR10R11, замещенную или незамещенную фенильную йод группу или замещенную или незамещенную гетероциклическую йод группу; R6 представляет собой алкильную группу, содержащую от 1 до 7 атомов углерода; R7 и R8, которые могут быть одинаковыми или отличными друг от друга, каждый представляет собой водород, алкильную группу, содержащую от 1 до 7 атомов углерода, галоген-замещенную алкильную группу, содержащую от 1 до 7 атомов углерода, или необязательно замещенную фенильную группу, или же R7 и R8 объединяются с N с образованием 3-7-членной циклической структуры; R9 представляет собой алкильную группу, содержащую от 1 до 7 атомов углерода, галоген-замещенную алкильную группу, содержащую от 1 до 7 атомов углерода, или необязательно замещенную фенильную группу; и R10 и R11, которые могут быть одинаковыми или отличными друг от друга, каждый представляет собой алкильную группу, содержащую от 1 до 7 атомов углерода, галоген-замещенную алкильную группу, содержащую от 1 до 7 атомов углерода, или необязательно замещенную фенильную группу, или же R10 и R11 объединяются с N с образованием 3-7-членной циклической структуры; за исключением того, что исключается ситуация, когда одновременно действуют следующие условия: Y представляет собой F, R1 и R2 оба представляют собой водород, и R3 и R4 оба представляют собой OH.
[0016]
В вышеуказанном способе, является предпочтительным включение стадии, вызывающей взаимодействие соединения, представленного следующей формулой:
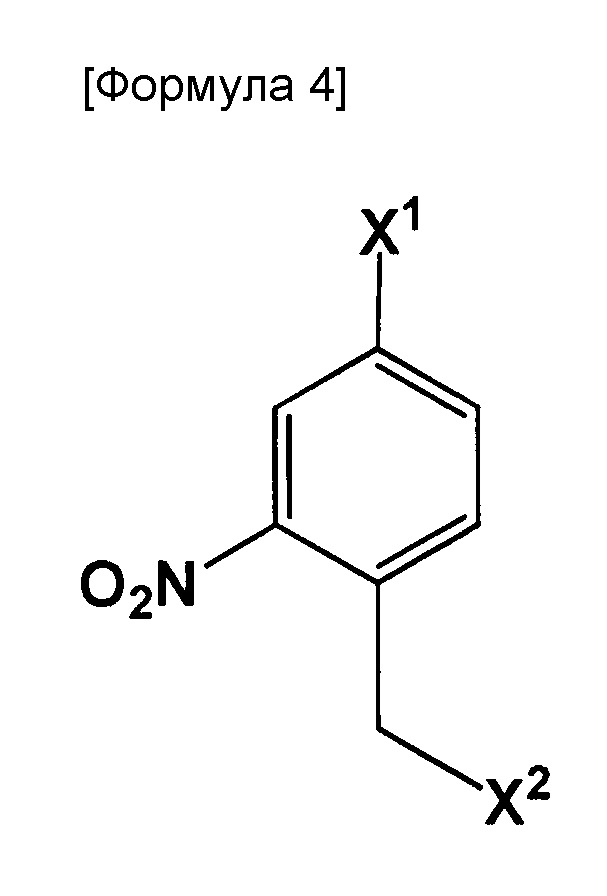
где X1 и X2 могут быть одинаковыми или отличными друг от друга, и каждый представляет собой галоген, с одним реагентом, выбранным из группы, состоящей из следующих соединений, в присутствии основного катализатора:
метиловый эфир N-дифенилметиленглицина, этиловый эфир N-дифенилметиленглицина, N-дифенилметиленглицин и трет-бутиловый эфир N-дифенилметиленглицина и бензиловый эфир N-дифенилметиленглицина.
[0017]
Настоящее изобретение также относится к способу получения18F-меченного BPA, включающему стадию, вызывающую взаимодействие соединения, представленного следующей формулой, с фторирующим реагентом:

где R представляет собой BR3R4, BX3- или BX3-M+ (X представляет собой галоген; M+ представляет собой одновалентный одноатомный катион, многоатомный катион или комплексный катион); R1 представляет собой водород или защитную группу PG1; R2 представляет собой водород или защитную группу PG2; R3 и R4 каждый представляет собой OH, или же R3 и R4 оба объединяются с B с образованием кольца, служащего в качестве защитной группы для B; Y представляет собой галоген, NO2, NH2, Sn(R6)3, N=N-NR7R8, OSO2R9, NR10R11, замещенную или незамещенную фенильную йод группу или замещенную или незамещенную гетероциклическую йод группу; R6 представляет собой алкильную группу, содержащую от 1 до 7 атомов углерода; R7 и R8, которые могут быть одинаковыми или отличными друг от друга, каждый представляет собой водород, алкильную группу, содержащую от 1 до 7 атомов углерода, галоген-замещенную алкильную группу, содержащую от 1 до 7 атомов углерода, или необязательно замещенную фенильную группу, или же R7 и R8 объединяются с N с образованием 3-7-членной циклической структуры; R9 представляет собой алкильную группу, содержащую от 1 до 7 атомов углерода, галоген-замещенную алкильную группу, содержащую от 1 до 7 атомов углерода, или необязательно замещенную фенильную группу; и R10 и R11, которые могут быть одинаковыми или отличными друг от друга, каждый представляет собой алкильную группу, содержащую от 1 до 7 атомов углерода, галоген-замещенную алкильную группу, содержащую от 1 до 7 атомов углерода, или необязательно замещенную фенильную группу, или же R10 и R11 объединяются с N с образованием 3-7-членной циклической структуры; за исключением того, что исключается ситуация, когда одновременно действуют следующие условия: Y представляет собой F, R1 и R2 оба представляют собой водород, и R3 и R4 оба представляют собой OH.
[0018]
Настоящее изобретение также относится к соединению, представленному следующей формулой:

где X1 представляет собой галоген; R1 представляет собой водород или защитную группу PG1; и R12 представляет собой NH2, NHPG2, где PG2 представляет собой защитную группу или аминометилендифенил.
ЭФФЕКТ ИЗОБРЕТЕНИЯ
[0019]
Новое BPA производное по настоящему изобретению можно с успехом использовать, в частности, для получения18F-меченного BPA.
СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
[0020]
Существующие способы синтеза18F-меченного BPA представляют собой способы фторирования непосредственно BPA и достигаются, в частности, путем осуществления электрофильной реакции путем использования18F в качестве электрофильного реагента. Авторы обратили внимание на следующее: на стадии получения газа18F2 в циклотроне, стадии использования F+ из полученного газа18F2 и некоторой другой стадии существующего пути синтеза, описанном выше, возникают проблемы, соответственно; и далее, полученный в конце18F-меченный BPA имеет пониженное значение удельной радиоактивности в результате образования продукта реакции из содержащих примеси молекул19F2 или по какой-либо другой причине, и количество18F-меченного BPA, используемого для ПЭТ диагностики, в соответствии со стандартным синтезом представляет собой количество для нескольких человек. Новый способ по настоящему изобретению для синтеза18F-меченного BPA полностью отличается от обычных способов и представляет собой способ синтеза, в котором могут использоваться18F анионы. Этот способ обеспечивает очень небольшую нагрузку на аппарат и позволяет синтезировать18F-меченный BPA с получением большего выхода, чем соответствующие выходы в соответствии с обычными способами синтеза.
[0021]
В настоящем изобретении получают новое BPA производное. Можно легко осуществить мечение этого нового BPA производного и, весьма вероятно, при помощи18F путем реакции нуклеофильного замещения. Таким образом, можно получить18F-меченный BPA легко и эффективно.
[0022]
В настоящем изобретении BPA производное эквивалентно по значению пинаколборидному производному, представленному следующей формулой.

где R представляет собой BR3R4, BX3- или BX3-M+ (X представляет собой галоген; M+ представляет собой одновалентный одноатомный катион, многоатомный катион или комплексный катион); R1 представляет собой водород или защитную группу PG1; R2 представляет собой водород или защитную группу PG2; R3 и R4 каждый представляет собой OH, или же R3 и R4 оба объединяются с B с образованием кольца, служащего в качестве защитной группы для B; Y представляет собой галоген, NO2, NH2, Sn(R6)3, N=N-NR7R8, OSO2R9, NR10R11, замещенную или незамещенную фенильную йод группу или замещенную или незамещенную гетероциклическую йод группу; R6 представляет собой алкильную группу, содержащую от 1 до 7 атомов углерода; R7 и R8, которые могут быть одинаковыми или отличными друг от друга, каждый представляет собой водород, алкильную группу, содержащую от 1 до 7 атомов углерода, галоген-замещенную алкильную группу, содержащую от 1 до 7 атомов углерода, или необязательно замещенную фенильную группу, или же R7 и R8 объединяются с N с образованием 3-7-членной циклической структуры; R9 представляет собой алкильную группу, содержащую от 1 до 7 атомов углерода, галоген-замещенную алкильную группу, содержащую от 1 до 7 атомов углерода, или необязательно замещенную фенильную группу; и R10 и R11, которые могут быть одинаковыми или отличными друг от друга, каждый представляет собой алкильную группу, содержащую от 1 до 7 атомов углерода, галоген-замещенную алкильную группу, содержащую от 1 до 7 атомов углерода, или необязательно замещенную фенильную группу, или же R10 и R11 объединяются с N с образованием 3-7-членной циклической структуры; за исключением того, что исключается ситуация, когда одновременно действуют следующие условия: Y представляет собой F, R1 и R2 оба представляют собой водород, и R3 и R4 оба представляют собой OH.
[0023]
В BX3- или BX3-M+ в качестве R, каждый X представляет собой галоген, и, предпочтительно, каждый, в частности, представляют собой F. M+ представляет собой одновалентный одноатомный катион, многоатомный катион или комплексный катион. M+ в частности, предпочтительно, представляет собой ион щелочного металла, такой как K+, Na+ или Li+, ион аммония, ион тетраалкиламмония, ион тетраариламмония, ион тетраалкилфосфония, ион тетраарилфосфония или ион имидазолия, хотя M+ не ограничен. Термин “алкил” в настоящей заявке, предпочтительно представляет собой C1-C6 алкил, хотя алкил не ограничен. В частности, предпочтительные примеры иона тетраалкиламмония включают ион тетраметиламмония, ион тетраэтиламмония, ион тетрабутиламмония и ион тетрапропиламмония. Термин “арил” в настоящей заявке, предпочтительно представляет собой замещенную или незамещенную фенильную группу.
[0024]
Термин “объединяются с N с образованием 3-7-членной циклической структуры” обозначает насыщенную или ненасыщенную кольцевую группу, содержащую углерод и азот.
[0025]
В соединении по настоящему изобретению, Y предпочтительно представляет собой I, F, NO2, NH2, Sn(R6)3, N=N-NR7R8, OSO2R9, NR10R11, I+R13 или (R14-)I+R13. В настоящей заявке предпочтительным является следующее: каждый R6 представляет собой метил или н-бутил; R7 и R8 могут быть одинаковыми или отличными друг от друга, и каждый представляет собой водород, метил, этил, пропил, бутил, гептил, трифторметил или необязательно замещенную фенильную группу, или объединяются с N с образованием азиридина, азетидина, пирролидина, пиперидина или гомо-пиперидина; R9 представляет собой метил, этил, пропил, бутил, гептил, трифторметил или необязательно замещенную фенильную группу; R10 и R11 могут быть одинаковыми или отличными друг от друга, и каждый представляет собой метил, этил, пропил, бутил, гептил, трифторметил или необязательно замещенную фенильную группу, или объединяются с N с образованием азиридина, азетидина, пирролидина или пиперидина; и R13 представляет собой C1-6-алкил-замещенную фенильную группу, C1-6-алкокси-замещенную фенильную группу или фенильную группу или представляет собой замещенную или незамещенную 5-7-членную гетероциклическую группу, содержащую один или несколько из N, S или О атомов. Особенно предпочтительные примеры гетероциклической группы включают тиенильные, фуранильные, пиридинильные, пиперидинильные и пиперазинильные группы. R14 предпочтительно представляет собой галогеновую или тетрафторборатную, нитратную, трифлатную, сульфонилокси, толуолсульфонилокси или перхлоратную группу.
[0026]
В соединении по настоящему изобретению, предпочтительно, R представляет собой BR3R4, BX3- или BX3-M+, где каждый X представляет собой F, и M+ представляет собой ион щелочного металла или ион аммония. R3 и R4 каждый представляет собой OH или объединяются вместе с B с образованием кольца в качестве защитной группы.
[0027]
R1 представляет собой водород или защитную группу PG1 для карбоновой кислоты. PG1 не имеет особых ограничений и обозначает любую защитную группу для карбоновой кислоты, известную специалистам в данной области техники. Их примеры включают защитные группы, описанные в Greene Wuts, “Protective Groups in Organic Synthesis”, 3rd edition (a company, Wiley-Interscience in USA). Как правило, рассматриваемая группа может быть преобразована в сложноэфирный тип, подлежащий защите, с использованием условий сложноэфирной конденсации или условий алкилирования. PG1 представляет собой, например, алкильную группу, содержащую от 1 до 7 атомов углерода, или ароматическую группу, такую как бензильная группа. Их конкретные примеры включают алкильные группы, такие как метильные, этильные, н-пропильные, изо-пропильные, н-бутильные, изо-бутильные, втор-бутильные, трет-бутильные и н-пентильные группы, и ароматические группы, такие как бензильные, пара-метоксибензильные и пара-нитробензильные группы. PG1 в частности, предпочтительно, представляет собой трет-бутильную или бензильную группу, которая легко не подвергается влиянию рацемизации при удалении защиты у защищенной группы.
[0028]
R2 представляет собой водород или защитную группу PG2 для аминогруппы. Защитная группа для аминокислоты может представлять собой любую защитную группу, известную специалистам в данной области техники. Их примеры включают защитные группы, описанные в Greene Wuts “Protective Groups in Organic Synthesis”, 3rd edition (the company Wiley-Interscience in USA). Их предпочтительные примеры включают бензилоксикарбонильные, ацетильные, трифторэтилкарбокси, трет-бутилоксикарбонильные, флуоренилметилоксикарбонильные, трихлорэтоксикарбонильные, трифторацетильные, аллилоксикарбонильные, бензильные, пропаргилоксикарбонильные, бензоильные, фталоильные, толуолсульфонильные и нитробензолсульфонильные группы, хотя защитная группа не ограничивается этим. Из этих примеров предпочтительными являются бензилоксикарбонильные и трет-бутилоксикарбонильные группы, которые могут быть подвергнуты реакции удаления защиты через небольшой период времени.
[0029]
Когда R3 и R4 вместе объединяются с B (атом бора) с образованием кольца в качестве защитной группы для B, R3 и R4 каждый представляют собой, предпочтительно, группу, которая образует насыщенное или ненасыщенное 3-10-членное кольцо, которое может быть замещенным. Примеры структуры кольца в данном случае также включают спиро-кольца и конденсированные кольца. Примеры группы, которая может образовывать кольцо, включают пинакол, 2,2-диметил-1,3-пропандиол, N-метилдиэтаноламин, 1,8-диаминонафталин, N-метилиминодиуксусную кислоту, 1,1,1-трисгидроксиметилэтан и катехин, хотя группа этим не ограничивается. Группа, в частности, предпочтительно представляет собой O-R5-O, где -R5- представляет собой алкиленовую группу, которая содержит от 2 до 7 атомов углерода и может быть замещенной. Из этих примеров, пинакол является предпочтительным. Алкиленовая группа, которая может быть замещенной, обозначает C1-6-алкил-группу- или C1-6-алкокси-группа-замещенный алкилен.
[0030]
В настоящем изобретении, алкильная группа, содержащая от 1 до 7 атомов углерода, в частности, предпочтительно представляет собой метильную, этильную, н-пропильную, изо-пропильную, н-бутильную, изо-бутильную, втор-бутильную, трет-бутильную или н-пентильную группу. Галоген-замещенная алкильная группа обозначает алкильную группу, содержащую от 1 до 7 атомов углерода, где ее атом водорода или один или несколько из ее атомов водорода замещены одним или несколькими галогенами. Алкильная группа предпочтительно представляет собой трифторметильную группу, хотя группа этим не ограничивается. Замещенная фенильная группа обозначает фенильную группу или фенильную группу, содержащую, в одном - трех ее положениях, один или несколько заместителей, независимо друг от друга. Замещенное 3-10-членное кольцо обозначает 3-10-членное кольцо или 3-10-членное кольцо, содержащее, в одном - трех его положениях, один или несколько заместителей, независимо друг от друга. Замещенная гетероциклическая группа содержит гетероцикл или гетероциклическую группу, содержащую, в одном - трех положениях гетероцикла, один или несколько заместителей, независимо друг от друга. Примеры заместителя (заместителей) фенильной группы, 3-10-членного кольца или гетероцикла включают C1-6 алкильные, C1-6 алкокси, гидрокси, амино и нитро группы, хотя заместитель (заместители) этим не ограничен (не ограничены).
[0031]
BPA производное по настоящему изобретению можно синтезировать через, например, стадию A, B или C, проиллюстрированные ниже. Любая защитная группа, используемая в формулах реакций, проиллюстрированных ниже, может быть соответствующим образом изменена. Защитная группа не ограничена каким-либо одним из иллюстрированных примеров.

[0032]
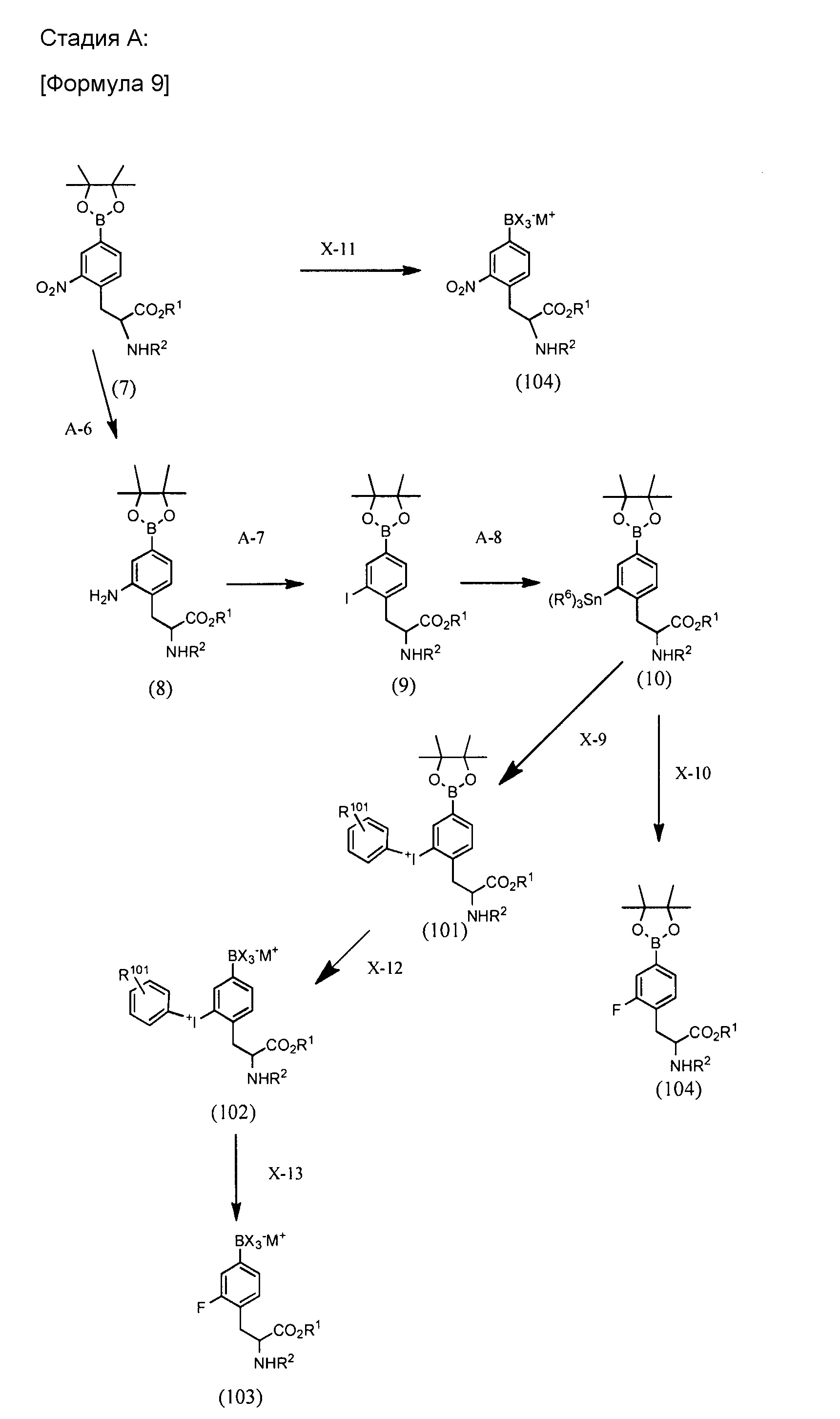

[0033]

[0034]
В реакции в каждой из стадий A - C, температура реакции изменяется в соответствии с растворителем, исходными веществами, реагентом (реагентами) и т.п., которые должны быть выбраны соответствующим образом. Продолжительность реакции изменяется в соответствии с растворителем, исходными веществами, реагентом (реагентами), температурой реакции и т.п., которые должны быть выбраны соответствующим образом.
[0035]
В реакции на каждой из стадий, целевое соединение на каждой стадии может быть выделено из реакционной смеси с использованием рутинных процедур после окончания каждой реакции.
[0036]
Целевое соединение получают, например, путем (i) отфильтровывания катализатора и других нерастворимых веществ, если это необходимо, (ii) добавления к реакционной смеси воды и растворителя, не смешивающегося с водой (например, этилацетат или хлороформ) для экстракции целевого соединения, (iii) промывки органической фазы водой и необязательно использования осушителя, такого как безводный сульфат магния, для сушки фазы и (iv) отгонки растворителя. Полученное целевое соединение может быть дополнительно очищено известным способом (таким как колоночная хроматография на силикагеле), при необходимости. Целевое соединение каждой из стадий может быть использовано для следующей реакции без очистки.
[0037]
На каждой из стадий, любой из символов имеет значение, определенное в другом разделе описания. R100 представляет собой алкильную группу, такую как метил, этил, пропил, бутил, гептил или трифторметил, галоген-замещенную алкильную группу, водород, необязательно замещенную фенильную группу или защитную группу для фенольной группы OH, такую как замещенная силильная группа. R101представляет собой C1-6 алкильную группу, C1-6 алкоксигруппу, гидроксигруппу, аминогруппу или нитрогруппу.
[0038]
Стадия A-1:
Стадия A-1 представляет собой стадию осуществления взаимодействия соединения (2) с галогенирующим реагентом в присутствии катализатора, с получением соединения (3). Соединение (2) является известным и коммерчески доступным. Соединение может быть получено путем синтеза из коммерчески доступного соединения.
[0039]
X1 и X2 каждый независимо представляют собой галоген, и каждый, в частности, предпочтительно представляют собой йод или бром. Символы X, каждый, предпочтительно представляют собой бром с точки зрения доступности соединения.
[0040]
Примеры используемого галогенирующего реагента включают N-бромсукцинимид, дибромизоциануровую кислоту, 1,3-дийод-5,5’-диметилгидантоин и N-йодсукцинимид. Используемый катализатор представляет собой агент радикальной полимеризации, такой как пероксид или AIBN.
[0041]
Используемый растворитель не имеет особых ограничений. Примеры включают бензол, хлороформ и тетрахлорид углерода. Тетрахлорид углерода является особенно предпочтительным.
[0042]
Температура реакции предпочтительно находится в пределах от комнатной температуры до 120°C, более предпочтительно от 70 до 100°C.
[0043]
Продолжительность реакции предпочтительно от 1 до 24 часов, более предпочтительно от 6 до 18 часов.
[0044]
Стадия A-2:
Стадия A-2 представляет собой стадию осуществления взаимодействия соединения (3) с катализатором межфазного переноса и модифицированной аминокислотой, которые обычно используют в реакции Маруока, в присутствии основания с получением соединения (4).
[0045]
Модифицированная аминокислота, используемая в реакции Маруока не ограничена. Предпочтительные примеры включают метиловый эфир N-дифенилметиленглицина, этиловый эфир N-дифенилметиленглицина, трет-бутиловый эфир N-дифенилметиленглицина, N-дифенилметиленглицина, трет-бутиловый эфир 4-хлорбензилиденглицина и бензиловый эфир N-дифенилметиленглицина. Из этих примеров, особенно предпочтительным является трет-бутиловый эфир N-дифенилметиленглицина.
[0046]
Используемое основание не ограничено. Предпочтительные примеры включают гидроксид лития, гидроксид натрия, гидроксид калия и триэтиламин. Гидроксид калия является особенно предпочтительным для скорости реакции.
[0047]
Предпочтительные примеры модифицированных аминокислот, используемых в реакции Маруока, включают O-аллил-N-(9-антраценилметил)цинхонидиниумбромид и (S)-(+)-4,4-дибутил-2,6-бис(3,4,5-трифторфенил)-4,5-дигидро-3H-динафт[7,6,1,2-cde]аземипийбромид.
[0048]
Предпочтительные примеры используемого растворителя включают толуол, дихлорметан и хлороформ. Толуол является особенно предпочтительным для окружающей среды.
[0049]
Температура реакции составляет предпочтительно от -20 до 100°C, более предпочтительно от -4°C до комнатной температуры.
[0050]
Продолжительность реакции предпочтительно от 30 минут до 24 часов, более предпочтительно от 1 до 18 часов.
[0051]
Полученное соединение может быть очищено; однако соединение может быть использовано на следующий стадии без очистки.
[0052]
Стадия A-3:
Стадия A-3 представляет собой стадию, на которой соединение (4) помещают в кислый водный раствор для удаления защиты аминогруппы. Используемый для этого растворитель может представлять собой лимонную кислоту или смешанный растворитель, включающий водный раствор щавелевой кислоты и ацетон, ацетонитрил, THF, DMF или DMSO. Более предпочтительно, растворитель представляет собой лимонную кислоту или смешанный растворитель, включающий водный раствор щавелевой кислоты и ацетон, ацетонитрил или THF, чтобы его можно быть отогнать.
[0053]
Температура реакции составляет предпочтительно от комнатной температуры до 100°C, более предпочтительно от комнатной температуры до 80°C. Продолжительность реакции предпочтительно от 30 минут до 24 часов, более предпочтительно от 1 до 3 часов.
[0054]
Стадия A-4:
Стадия A-4 представляет собой стадию использования защитного реагента для соединения (5) для защиты его аминогруппы в щелочных условиях. Используемый защитный реагент может представлять собой, например, бензилхлороформиат или ди-трет-бутилдикарбонат, хотя реагент не ограничивается этим.
[0055]
Предпочтительные примеры используемого основания включают гидроксид лития, гидроксид натрия, гидроксид калия, карбонат натрия, карбонат калия и триэтиламин, хотя основание не ограничивается этим. Особенно предпочтительными являются карбонат натрия и карбонат калия, которые представляют собой мягкие основания.
[0056]
Используемый растворитель желательно должен быть амфипатическим растворителем. Примеры включают ацетон, ацетонитрил, THF, DMF и DMSO. Растворитель предпочтительно представляет собой ацетон, ацетонитрил или THF, чтобы его можно быть отогнать.
[0057]
Температура реакции составляет предпочтительно от -20 до 100°C, более предпочтительно от -4°C до комнатной температуры. Продолжительность реакции предпочтительно от 30 минут до 24 часов, более предпочтительно от 3 до 18 часов.
[0058]
Стадия A-5:
Стадия A-5 представляет собой стадию использования реагента пинаколборонирования с получением пинаколборатного производного из соединения (6) в присутствии палладиевого катализатора и лиганда. Примеры используемого катализатора включают палладиевые катализаторы, используемые в основном в реакциях сочетания Сузуки-Мияура, такие как комплекс хлорида палладия и циннамила, ацетат палладия и трисдибензилиденацетондипалладий, хотя катализатор не ограничивается этими соединениями.
[0059]
Примеры лиганда включают фосфорсодержащие лиганды, используемые в основном в реакциях сочетания Сузуки-Мияура, такие как трициклогексилфосфин, 2-дициклогексилфосфино-2,4,6-триизопропилбифенил, 2-дициклогексилфосфино-2,-(N,N)-диметиламинобифенил, 3,5-диметокси-2-дициклогексилфосфино-2,4,6-триизопропилбифенил и 3,5-диметокси-2-дитрет-бутилфосфино-2,4,6-триизопропилбифенил, хотя лиганд не ограничивается этими соединениями.
[0060]
Примеры используемого основания включают гидроксид лития, гидроксид натрия, гидроксид калия, карбонат натрия, карбонат калия и триэтиламин, хотя основания не ограничиваются этими соединениями. Особенно предпочтительными являются карбонат натрия и карбонат калия, которые являются мягкими основаниями.
[0061]
Используемый растворитель предпочтительно представляет собой, например, толуол или диоксан. Температура реакции предпочтительно находится в диапазоне от комнатной температуры до 150°C, более предпочтительно от 80 до 120°C. Продолжительность реакции предпочтительно от 1 до 24 часов, более предпочтительно от 2 до 18 часов.
[0062]
Стадия A-6:
Стадия A-6 представляет собой стадию, в которой соединение (7) подвергают восстановительному гидрированию с получением анилинового производного (8). Используемый катализатор представляет собой, например, гидроксид палладия или палладий на углероде, хотя катализатор не ограничивается этим.
[0063]
Примеры используемого растворителя включают ацетон, ацетонитрил, THF, метанол и этанол. Предпочтительными являются метанол и этанол, которые являются неактивными для реакции восстановления.
[0064]
Температура реакции составляет предпочтительно от -20 до 100°C, более предпочтительно от комнатной температуры до 50°C. Продолжительность реакции предпочтительно от 30 минут до 24 часов, более предпочтительно от 3 до 18 часов.
[0065]
Стадия A-7:
Стадия A-7 представляет собой стадию получения, из соединения (8), галогенового производного (9) через диазоний. Реагент для реакции диазотирования может представлять собой, например, нитрит натрия, нитрит калия или алкилнитрит, такой как изобутилнитрит. Йодирующий реагент может представлять собой, например, йодид натрия, йодид калия или йод, который является известным.
[0066]
Примеры используемого растворителя включают воду, ацетон, ацетонитрил, THF, метанол, этанол и смешанные растворители, каждый из которых состоит из двух или более из этих растворителей. Из этих примеров, ацетон является предпочтительным, поскольку этот растворитель не активен в реакции диазотирования.
[0067]
Температура реакции составляет предпочтительно от -20°C до комнатной температуры, более предпочтительно от -10 до 5°C. Продолжительность реакции предпочтительно от 30 минут до 2 часов, более предпочтительно от 30 минут до 1 часа.
[0068]
Стадия A-8:
Стадия A-8 представляет собой стадию получения, из соединения (9), соединения триалкилолова (10) посредством реакции связывания Сузуки-Мияура. Используемый в реакции реагент может представлять собой, например, трибутилолово или триметилолово. Используемый катализатор может представлять собой палладиевый катализатор, используемый обычно в реакциях сочетания Сузуки-Мияура, их примеры включают комплекс хлорида палладия и циннамила, ацетат палладия, трисдибензилиденацетондипалладий и тетракистрифенилфенилфосфинопалладий, хотя катализатор этим не ограничивается. Из этих примеров, предпочтительным является тетракистрифенилфенилфосфинопалладий.
[0069]
Примеры используемого основания включают гидроксид лития, гидроксид натрия, гидроксид калия, карбонат натрия, карбонат калия, ацетат натрия, ацетат калия и триэтиламин. Предпочтительными являются ацетат натрия и ацетат калия, которые являются более мягкими основаниями.
[0070]
Используемый растворитель предпочтительно представляет собой, например, толуол или диоксан. Температура реакции составляет предпочтительно от комнатной температуры до 150°C, более предпочтительно от 80 до 120°C. Продолжительность реакции предпочтительно от 1 до 48 часов, более предпочтительно от 2 до 24 часов.
[0071]
Стадия A-9:
Стадия A-9 представляет собой стадию получения, из соединения (8), триазенового производного (11) через диазоний.
[0072]
Используемый в реакции диазотирования реагент может представлять собой, например, нитрит натрия, нитрит калия или алкилнитрит, такой как изобутилнитрит. Используемый в реакции реагент может представлять собой, например, диметиламин, циклопентиламин или циклогексиламин, являющийся известным.
[0073]
Примеры используемого растворителя включают воду, ацетон, ацетонитрил, THF, метанол, этанол и смешанные растворители, каждый из которых состоит из двух или более из этих растворителей. Из этих примеров, ацетон является предпочтительным, поскольку этот растворитель не активен в реакции диазотирования.
[0074]
Температура реакции составляет предпочтительно от -20°C до комнатной температуры, более предпочтительно от -10 до 5°C. Продолжительность реакции предпочтительно от 30 минут до 2 часов, более предпочтительно от 30 минут до 1 часа.
[0075]
Для стадии X-9 для преобразования соединения (10) в соединение (101) следующая процедура представлена в качестве примера, хотя процедура этим не ограничивается:
[0076]
Соединение (10) растворяют в растворителе и к полученной смеси затем добавляют йодоний, такой как реагент Козера, в потоке газообразного азота.
[0077]
Примеры используемого растворителя включают воду, дихлорметан, ацетон, ацетонитрил, THF, метанол, этанол, трифторэтанол и смешанные растворители, каждый из которых состоит из двух или более из этих растворителей. Из этих примеров предпочтительным является дихлорметан.
[0078]
Температура реакции составляет предпочтительно от -20°C до комнатной температуры, более предпочтительно от -10 до 5°C. Продолжительность реакции предпочтительно от 30 минут до 2 часов.
[0079]
Используемый реагент на стадии X-12 для преобразования соединения (101) в соединение (102) может представлять собой галогенид водорода, такой как фтористый водород или хлористый водород.
[0080]
Примеры используемого растворителя включают воду, дихлорметан, ацетон, ацетонитрил, THF, метанол, этанол и смешанные растворители, каждый из которых состоит из двух или более из этих растворителей. Из этих примеров предпочтительной является комбинация воды с дихлорметаном.
[0081]
Температура реакции составляет предпочтительно от 0 до 60°C, более предпочтительна комнатная температура (температура от 20 до 30°C). Продолжительность реакции предпочтительно от 30 минут до 24 часов, более предпочтительно от 1 до 12 часов.
[0082]
Используемый реагент на стадии X-13 для преобразования соединения (102) в соединение (103) может представлять собой фтористый водород.
[0083]
Примеры используемого растворителя включают воду, дихлорметан, ацетон, ацетонитрил, THF, метанол, этанол, DMF, DMSO и смешанные растворители, каждый из которых состоит из двух или более из этих растворителей. Из этих примеров предпочтительным является дихлорметан в отдельности или его комбинация с ацетонитрилом, DMF или DMSO.
[0084]
Температура реакции составляет предпочтительно от -20 до 180°C, более предпочтительно от 80 до 160°C. Продолжительность реакции составляет предпочтительно от 5 минут до 2 часов, более предпочтительно от 10 минут до 1 часа.
[0085]
Стадия X-10 для преобразования соединения (10) в соединение (104):
[0086]
Реагент может представлять собой щелочной фторид.
[0087]
Примеры используемого растворителя включают воду, дихлорметан, ацетон, ацетонитрил, THF, метанол, этанол и смешанные растворители, каждый из которых состоит из двух или более из этих растворителей. Из этих примеров предпочтительным является дихлорметан в отдельности или комбинация воды с дихлорметаном.
[0088]
Температура реакции составляет предпочтительно от -20°C до комнатной температуры, более предпочтительно от -10 до 5°C. Продолжительность реакции предпочтительно от 30 минут до 2 часов, более предпочтительно от 30 минут до 1 часа.
[0089]
Стадия X-11 для преобразования соединения (7) в соединение (104):
[0090]
Реагент может представлять собой щелочной галогенид.
[0091]
Примеры используемого растворителя включают воду, дихлорметан, ацетон, ацетонитрил, THF, метанол, этанол и смешанные растворители, каждый из которых состоит из двух или более из этих растворителей. Из этих примеров, предпочтительным является дихлорметан в отдельности или комбинация воды с дихлорметаном.
[0092]
Температура реакции составляет предпочтительно от 0 до 60°C, более предпочтительна комнатная температура (температура от 20 до 30°C). Продолжительность реакции предпочтительно от 30 минут до 2 часов, более предпочтительно от 30 минут до 1 часа.
[0093]
Стадия B-1:
Стадия B-1 представляет собой стадию получения, из известного соединения (12), галогенового производного (13) через диазоний.
[0094]
Реагент для реакции диазотирования может представлять собой, например, нитрит натрия, нитрит калия или алкилнитрит, такой как изобутилнитрит.
[0095]
X3 представляет собой галоген, в частности, йод, бром или хлор. Реагент для галогенирования может представлять собой, например, реагент Зандмейера или йодид натрия, йодид калия или йод, являющийся известным. Из этих примеров, подходящим является бромид меди, который является стабильным реагентом Зандмейера. Примеры используемого растворителя включают воду, ацетон, ацетонитрил, THF, метанол, этанол и смешанные растворители, каждый из которых состоит из двух или более из этих растворителей. Из этих примеров, ацетон является предпочтительным, поскольку этот растворитель не активен в реакции диазотирования. Температура реакции составляет предпочтительно от -20°C до комнатной температуры, более предпочтительно от -10 до 5°C. Продолжительность реакции предпочтительно от 30 минут до 2 часов, более предпочтительно от 30 минут до 1 часа.
[0096]
Стадия B-2:
Стадия B-2 представляет собой стадию получения соединения (14), осуществляемую путем защиты гидроксигруппы соединения (13).
[0097]
Примеры защитной группы включают метильную, бензильную, метоксибензильную, трет-бутильную, метоксиметильную, 2-тетрагидропиранильную, этоксиэтильную, ацетильную, пивалоильную, бензоильную, триметилсилильную, триэтилсилильную, трет-бутилдиметилсилильную, триизопропилсилильную и трет-бутилдифенилсилильную группы, хотя этим группа не ограничивается.
Примеры используемого растворителя включают смешанные растворители, каждый из которых состоит из воды с ацетоном, ацетонитрилом, THF, метанолом или этанолом. Из этих примеров, ацетон является предпочтительным, поскольку этот растворитель не активен в реакции диазотирования.
[0098]
Температура реакции составляет предпочтительно от -20°C до комнатной температуры, более предпочтительно от -10 до 5°C.
[0099]
Продолжительность реакции предпочтительно от 30 минут до 2 часов, более предпочтительно от 30 минут до 1 часа.
[0100]
Стадия B-3: Стадия B-3 представляет собой стадию получения соединения (15), получаемого путем галогенирования бензильного положения соединения (14) соответствующим образом.
Реагент, условия и другие параметры для реакции такие же, как на стадии A-1, описанной выше.
[0101]
Стадия B-4: Стадия B-4 представляет собой стадию получения аминокислотного производного (16), которое получают, подвергая соединение (15) реакции Маруока.
Реагент, условия и другие параметры для реакции такие же, как на стадии A-2, описанной выше.
[0102]
Стадия B-5:
Стадия B-5 представляет собой стадию получения аминного производного (17), которое получают, подвергая соединение (16) реакции де-дифенилметилирования. Реагент, условия и другие параметры для реакции такие же, как на стадии A-3.
[0103]
Стадия B-6:
Стадия B-6 представляет собой стадию получения аминного производного (18), получаемого путем введения защитной группы в соединение (17). Реагент, условия и другие параметры для реакции такие же, как на стадии A-4.
[0104]
Стадия B-7:
Стадия B-7 представляет собой стадию получения пинаколборатного производного, (19) получаемого путем введения пинаколборида в соединение (18). Реагент, условия и другие параметры для реакции такие же, как на стадии A-5.
[0105]
Стадия B-8:
Стадия B-8 представляет собой стадию удаления защитной группы для гидроксильной группы соединения (19) с получением фенольного производного (20). Примеры реагента для удаления защиты включают раствор лимонной кислоты в воде; раствор щавелевой кислоты в воде; раствор трифторуксусной кислоты, хлористоводородной кислоты или бромистоводородной кислоты в органическом растворителе, таком как метанол, этанол, диоксан или этилацетат или в воде; кислотные компоненты, такие, как серная кислота, метансульфоновая кислота и трифторметансульфоновая кислота; и фторидные ионы.
[0106]
Примеры используемого растворителя включают воду, ацетон, ацетонитрил, THF, метанол, этанол и смешанные растворители каждый состоит из двух или более из этих растворителей. Из этих примеров, предпочтительным является ацетон, который не активен в реакциях диазотирования.
[0107]
Температура реакции составляет предпочтительно от -20°C до комнатной температуры, более предпочтительно от -10 до 5°C. Продолжительность реакции предпочтительно от 30 минут до 2 часов, более предпочтительно от 30 минут до 1 часа.
[0108]
Полученное соединение может быть легко очищено при помощи колоночной хроматографии на силикагеле.
[0109]
Стадия B-9:
Стадия B-9 представляет собой стадию получения, из фенольного производного (20), алкил- или аллил-сульфонилокси производного (21).
[0110]
Примеры реагента, используемого в реакции, включают метилсульфонилхлорид, трифторметансульфонилхлорид и пара-толуолсульфонилхлорид.
[0111]
Примеры используемого растворителя включают эфирные растворители, такие как диоксан и THF и дихлорметан.
[0112]
Температура реакции составляет предпочтительно от -20 до 100°C, более предпочтительно от -10°C до комнатной температуры. Продолжительность реакции предпочтительно от 30 минут до 2 часов, более предпочтительно от 30 минут до 1 часа.
[0113]
Полученное соединение может быть легко очищено при помощи колоночной хроматографии на силикагеле.
[0114]
Стадия C-1:
Стадия C-1 представляет собой специальную стадию, вызывающую взаимодействие фтора известного соединения (22) с вторичным амином с получением третичного аминового производного. Примеры реагента для использования в реакции включают диметиламин, диэтиламин, азиридин, азетидин, пирролидин и пиперидин, хотя реагент не ограничивается этими соединениями.
[0115]
Примеры используемого растворителя включают эфирные растворители, такие как диоксан и THF, и дихлорметан.
[0116]
Температура реакции составляет предпочтительно от комнатной температуры до 100°C, более предпочтительно от комнатной температуры до 80°C.
Продолжительность реакции предпочтительно от 30 минут до 24 часов, более предпочтительно от 1 до 6 часов.
[0117]
Стадия C-2:
Стадия C-2 представляет собой стадию, вызывающую взаимодействие реагента Виттига с соединением (23), с получением олефина (24).
[0118]
Примеры реагента для использования в реакции включают [2-(1,3-диоксолан-2-ил)этил]трифенилфосфонийбромид, (1,3-диоксолан-2-ил-метил)трифенилфосфонийбромид, (метоксиметил)трифенилфосфонийхлорид, (бромметил)трифенилфосфонийбромид, изоамилтрифенилфосфонийбромид, алкиловые эфиры любой алкилфосфоноуксусной кислоты, такие как метилдиметилфосфоноацетат и этилдиметилфосфоноацетат, и бензиловый эфир или замещенные бензиловые эфиры любой диалкилфосфоноуксусной кислоты.
[0119]
Примеры используемого растворителя включают эфирные растворители, такие как диоксан и THF, и дихлорметан.
[0120]
Температура реакции составляет предпочтительно от -78 до 100°C, более предпочтительно от -20 до 100°C. Продолжительность реакции предпочтительно от 30 минут до 24 часов, более предпочтительно от 1 до 6 часов.
[0121]
Стадия C-3:
Стадия C-3 представляет собой стадию получения пинаколборатного производного, (26) получаемого путем введения пинаколборида в соединение (24).
[0122]
Реагент, условия и другие параметры для реакции такие же, как на стадии A-5, описанной выше.
[0123]
Стадия C-4: Стадия C-4 представляет собой стадию получения пинаколборатного производного, (25) получаемого путем введения пинаколборида в соединение (23). Реагент, условия и другие параметры для реакции такие же, как на стадии A-5, описанной выше.
[0124]
Стадия C-5: Стадия C-5 представляет собой стадию, вызывающую взаимодействие реагента Виттига с соединением (25), с получением олефина (26). Реагент, условия и другие параметры для реакции такие же, как на стадии C-2, описанной выше.
[0125]
Стадия C-6:
Стадия C-6 представляет собой стадию, в которой соединение (26) подвергают восстановительному гидрированию с получением соединения (27). Реагент, условия и другие параметры для реакции такие же, как на стадии C-2, описанной выше.
[0126]
Примеры катализатора для реакции включают палладиевые катализаторы, такие как гидроксид палладия и палладий на углероде, и комплексы рутения.
[0127]
Примеры используемого растворителя включают эфирные растворители, такие как диоксан и THF, и спиртовые растворители, такие как метиловый спирт.
[0128]
Температура реакции составляет предпочтительно от -20 до 100°C, более предпочтительно от комнатной температуры до 80°C. Продолжительность реакции предпочтительно от 30 минут до 120 часов, более предпочтительно от 1 до 24 часов.
[0129]
Замещая далее полученное, таким образом, BPA производное по настоящему изобретению фтором, может быть получен18F-меченный BPA.
[0130]
Например, осуществляли облучение H218O ускоренными протонами для синтеза H18F-фтористоводородной кислоты через реакцию18O(p,n) и затем эту кислоту пропускали через колонку с ионообменной смолой, чтобы адсорбировать на ней кислоту для ее отделения от H218O, представляющего собой не адсорбированное исходное вещество. Эту колонку подвергали элюированию с использованием раствора K2CO3 в воде с получением K+18F-, который может быть использован в качестве нуклеофильного агента.

[0131]
Когда Y представляет собой NO2 или N=N-NR7R8 в BPA производном по настоящему изобретению, осуществляют мечение этого производного при помощи18F известным способом. В частности, полученные в результате18F анионы, используют в качестве нуклеофильного агента, и анионы нагревают вместе с катализатором межфазного переноса в органическом растворителе, получая при этом меченое вещество. Когда Y представляет собой NR10R11, BPA производное подвергают взаимодействию с метилйодидом или подобным веществом с получением четвертичного амина, и затем из него получают целевое соединение известным способом.
[0132]
Когда Y представляет собой NH2, BPA производное подвергают взаимодействию, через его диазониевую соль, с H18F для мечения этого производного. Когда Y представляет собой I или OSO2R9, меченое вещество BPA производного получают известным способом. Меченое вещество может быть получено за короткий период методом Дональда (Непатентный документ: Science, 325, 1661, 2009). В частности, меченое вещество получают в течение короткого периода времени, подвергая BPA производное взаимодействию с нуклеофильным агентом18F- в присутствии палладиевого катализатора и лиганда, такого как 2-дициклогексилфосфино-2,4,6-триизопропилбифенил (Ссылочный Пример 1).
[0133]
Кроме того, когда Y представляет собой Sn(R6)3, меченое вещество BPA производного получают при помощи метода Эрмерта (Непатентный документ: J. Label. Compd. Radiopharm., 47, 429, 2004). В частности, меченое вещество получают, предпочтительно с точки зрения эффективности, путем взаимодействия BPA производного с гидроксил(тозилокси)йодареном, таким как реагент Козера, с получением соли диаллилйодония, и затем подвергая эту соль взаимодействию с нуклеофильным агентом18F- (Ссылочный Пример 2).
[0134]
Предшественник по настоящему изобретению растворяют в количестве от 1 до 100 мг в реакционном растворителе и добавляют катализатор фазового переноса и основание в качестве улавливающего агента. Эту систему нагревают для синтеза целевого соединения. В эту смесь добавляют катализатор и лиганд в соответствии с заместителем предшественника для осуществления реакции. Примеры растворителя реакционной смеси включают хлороформ, бензол, толуол, ксилол, ацетонитрил, тетрагидрофуран, диметилсульфоксид, диметилформамид, этилацетат и ацетон, хотя растворитель не ограничивается этими растворителями. Примеры катализатора межфазного переноса включают краун-эфиры, Kryptofix и соли, каждая из которых содержит длинноцепочечный алкиламмониевый катион, такие как соль тетрабутиламмония, соль триоктилметиламмония и соль бензилдиметилоктадециламмония, хотя катализатор не ограничивается этими солями. Примеры основания в качестве улавливающего агента включают карбонат калия, карбонат цезия, карбонат натрия и карбонат рубидия, хотя основание не ограничено этими соединениями. Температура реакции находится в диапазоне от комнатной температуры до температуры кипения растворителя, предпочтительно от 60 до 180°C, более предпочтительно от 90 до 160°C. Однако в соответствии с заместителем, температура имеет предпочтительный диапазон, не ограничивающийся этим диапазоном.
[0135]
Полученный таким образом18F-меченный BPA означает следующее соединение:

[0136]
Использование способа по настоящему изобретению дает хорошую возможность получить такой18F-меченный BPA с относительно высоким выходом в состоянии с превосходной удельной активностью.
ПРИМЕРЫ
[0137]
Настоящее изобретение будет описано более подробно при помощи рабочих примеров, описанных ниже. Однако изобретение не ограничивается этими примерами.
В примерах использовали следующие устройства и реагенты для анализа любого соединения и выделения/очистки соединения: устройство JNM-AL серии AL400, изготовитель JEOL Ltd., при 400 МГц для спектров ЯМР.
[0138]
Пример 1
(1) Получение 4-бром-1-(бромметил)-2-нитробензола
К тетрахлориду углерода (100 мл) добавляли 2-нитро-6-бромтолуол (25,0 г, 116 ммоль), N-бромсукцинимид (28,2 г, 162 ммоль) и 2,2-азобис(2-метилпропионитрил) (1,90 мг, 11,6 ммоль) для осуществления взаимодействия этих веществ друг с другом в течение 18 часов, при этом реакционную смесь кипятили с обратным холодильником. Затем реакционный раствор фильтровали и полученный фильтрат концентрировали при пониженном давлении. Полученную смесь очищали при помощи колоночной хроматографии на силикагеле (AcOEt/н-гексан=1/9) с получением 18,5 г (54%) целевого соединения.1H-ЯМР (CDCl3); 4,78 (с, 2H, CH2), 7,46 (д, J=8,0, 1H, Ar), 7,74 (дд, J=2,0, 8,1, 1H, Ar), 8,18 (д, J=1,7, 1H, Ar).
[0139]
(2) Получение (S)-трет-бутил 3-(4-бром-2-нитрофенил)-2-(дифенилметилен-амино)-пропаноата
В двухфазный смешанный раствор 9,0 M раствора (100 мл) гидроксида калия и толуола (100 мл) добавляли N-(дифенилметилен)глицинат (10,0 г, 33,9 ммоль) и O-аллил-N-9-антраценилметилцинхонидийбромид (2,05 г, 3,39 ммоль, 0,1 эквивалент). Эту реакционную смесь охлаждали до 0°C и затем по каплям добавляли раствор вышеуказанного синтезированного соединения (10,0 г, 33,9 ммоль) в толуоле (30 мл). После окончания добавления смесь перемешивали в течение 18 часов, поддерживая ее в таком состоянии. Затем реакционный раствор экстрагировали эфиром (50 мл) два раза и далее эфирный раствор промывали насыщенным солевым раствором. Эфирный раствор затем сушили над сульфатом магния и концентрировали при пониженном давлении с получением неочищенного целевого соединения (17,6 г). Это соединение использовали на следующей стадии без очистки.
[0140]
(3) Получение (S)-трет-бутил 2-амино-3-(4-бром-2-нитрофенил)пропаноата
Соединение (17,6 г, 34,6 ммоль), полученное в результате осуществления предыдущих стадий, растворяли в THF (176 мл) и добавляли 30% раствор (88 мл) лимонной кислоты в воде. Этот смешанный раствор подвергали взаимодействию при кипячении с обратным холодильником в течение 1 часа. После окончания реакции реакционный раствор промывали эфиром (80 мл) и затем нейтрализовали карбонатом калия. Затем полученный раствор экстрагировали при помощи EtOAc (80 мл) два раза и объединенную EtOAc фазу сушили над сульфатом магния и концентрировали при пониженном давлении, с получением неочищенного целевого соединения (5,44 г). Его выход из бензилбромидного соединения составил 47,0%. Это соединение использовали на следующей стадии без очистки.1H-ЯМР (CDCl3); 1,45 (с, 9H, t-Bu), 3,08 (дд, J=8,8, 13,6, 1H, CH2-α), 3,29 (дд, J=5,6, 13,6, 1H, CH2-β), 3,62 (дд, J=5,6, 8,5, 1H, CH), 7,31 (д, J=8,4, 1H, Ar), 7,66 (дд, J=2,0, 8,4, 1H, Ar), 8,10 (д, J=2,0, 1H, Ar).
[0141]
(4) Получение (S)-трет-бутил 3-(4-бром-2-нитрофенил)-2-(трет-бутоксикарбонил-амино)пропаноата
Соединение (2,72 г, 7,88 ммоль), полученное в результате осуществления предыдущих стадий, растворяли в ацетоне (27 мл) и добавляли Boc2O (2,06 г, 9,46 ммоль). Затем к этой смеси добавляли раствор (1,25 г, 11,8 ммоль) карбоната натрия в воде для осуществления взаимодействия этих веществ друг с другом в течение 18 часов при комнатной температуре. Затем реакционную смесь концентрировали при пониженном давлении, чтобы отогнать ацетон. Остаток растворяли в AcOEt (40 мл). Этот раствор промывали насыщенным солевым раствором, сушили над сульфатом магния и затем концентрировали при пониженном давлении. Затем полученный раствор очищали при помощи колоночной хроматографии с силикагелем (AcOEt/н-гексан: 1/7) с получением целевого соединения (2,80 г, 80%).1H-ЯМР (CDCl3); 1,75(с, 12H), 1,44 (с, 9H, t-Bu), 3,08 (дд, J=8,0, 13,2, 1H, CH2-α), 3,29 (дд, J=5,2, 13,5, 1H, CH2-β), 4,54 (м, 1H, CH), 5,15 (д, J=8,0, 1H, NH), 7,29 (д, J=8,4, 1H, Ar), 7,65 (дд, J=1,7, 8,0, 1H, Ar), 8,11 (д, J=1,7, 1H, Ar).
[0142]
(5) Получение (S)-трет-бутил 2-(трет-бутоксикарбониламино)-3-(2-нитро-4-(4,4,5,5-тетраметил-1,3,2-диоксабороран-2-ил)фенил)пропаноата
В потоке газообразного азота, PdCl2 (dba) (246 мг, 0,38 ммоль) и трициклофосфин (246 мг, 0,88 ммоль) суспендировали в диоксане (50 мл) и эту суспензию перемешивали в течение 30 минут. Затем к смеси добавляли бис(пинаколат)диборан (3,84 г, 13,8 ммоль) и KOAc (1,86 г, 18,9 ммоль) и затем добавляли соединение 3 (5,60 г, 12,6 ммоль). Затем температуру смеси повышали до 100°C и смесь перемешивали при этой температуре в потоке газообразного азота всю ночь. Затем полученный раствор очищали при помощи колоночной хроматографии на силикагеле (AcOEt/н-гексан=1/7) с получением целевого соединения (11,0 г, 87%).1H-ЯМР (CDCl3); 1,43 (с, 21H), 1,45 (с, 9H, t-Bu), 3,18 (дд, J=8,8, 13,6, 1H, CH2-α), 3,52 (дд, J=5,2, 13,6, 1H, CH2-β), 4,55 (м, 1H, CH), 5,15 (д, J=8,0, 1H, NH), 7,40 (д, J=7,6, 1H, Ar), 7,91 (дд, J=1,4, 7,6, 1H, Ar), 8,34 (д, J=1,2, 1H, Ar).
[0143]
Пример 2
(6) Получение (S)-трет-бутил 3-(2-амино-4-(4,4,5,5-тетраметил-1,3,2-диоксабороран-2-ил)фенил)-2-(трет-бутоксикарбониламино)пропаноата
В колбу для гидрирования при среднем давлении помещали смесь раствора (20 мл) вышеуказанного нитросоединения (5,5 г, 11,2 ммоль) в метаноле и 10% палладий на углероде (0,55 г). При давлении (0,2 МПа), повышенном при помощи водорода, реакционную смесь перемешивали при комнатной температуре в течение 18 часов. При помощи ТСХ подтверждали развитие реакции и затем растворитель отгоняли при пониженном давлении с получением бесцветного маслянистого аминосоединения (3,72 г, 72%). Это соединение использовали на следующей стадии без очистки.1H-ЯМР (CDCl3); 1,30-1,43 (м, 30H, пинакол (CH3)4,-Boc,-t-Bu), 2,89 (дд, J=8,0, 14,0, 1H, CH2-α), 3,03 (дд, J=4,4, 14,0, 1H, CH2-β), 4,36 (м, 1H, CH), 5,36 (д, J=7,2, 1H, NH), 6,96 (д, J=7,6, 1H, Ar), 7,09-7,11 (м, 2H, Ar), 8,34 (д, J=1,2, 1H, Ar).
[0144]
Пример 3
(7) Получение (S)-трет-бутил 2-(трет-бутилоксикарбониламино)-3-(2-йод-4-(4,4,5,5-тетраметил-1,3,2-диоксабороран-2-ил)фенил)пропаноата
В воду (25 мл) добавляли 57% раствор HI (5,0 г) и затем добавляли CuI(I) (480 мг, 2,52 ммоль). К этой смеси добавляли раствор, в котором вышеуказанное аминосоединение (2,50 г, 5,04 ммоль) было растворено в ацетонитриле (25 мл). К смеси по каплям и медленно через капельную воронку добавляли раствор (5 мл) нитрита натрия (365 мг, 5,29 ммоль) в воде, при этом реакционную смесь охлаждали льдом. Эту смесь перемешивали при 0°C в течение 30 минут и затем смесь дополнительно перемешивали при комнатной температуре в течение 30 минут. Затем смесь экстрагировали этилацетатом три раза. Этилацетатную фазу промывали один раз насыщенным солевым раствором, сушили над сульфатом магния и затем концентрировали при пониженном давлении. Затем полученное вещество очищали при помощи колоночной хроматографии на силикагеле (AcOEt/н-гексан=1/9) с получением целевого соединения (1,40 г, 46%).
1H-ЯМР (CDCl3); 1,33 (с, 12H, пинакол(CH3)4), 1,37 (с, 9H, t-Bu), 1,43 (с, 9H, t-Bu), 2,97 (дд, J=9,2, 14,0, 1H, CH2-α), 3,05 (дд, J=4,8, 13,6, 1H, CH2-β), 4,50 (м, 1H, CH), 5,06 (д, J=8,8, 1H, NH), 6,96 (д, J=8,0, 1H, Ar), 7,57 (дд, J=1,6, 8,0, 1H, Ar), 8,16 (д, J=1,6, 1H, Ar).
[0145]
Пример 4
(8) Получение (S)-трет-бутил 2-(трет-бутилоксикарбониламино)-3-(4-(4,4,5,5-тетраметил-1,3,2-диоксабороран-2-ил)-2-(три-н-бутилстаннил)фенил)пропаноата
В колбе, имеющей форму баклажана, указанное выше соединение (371 мг, 0,705 ммоль) растворяли в толуоле (30 мл) в атмосфере аргона. Добавляли Pd(PPh)4 и (SnBu3)2 и затем реакционную смесь нагревали и кипятили с обратным холодильником в течение 24 часов. Реакционный раствор концентрировали и очищали при помощи хроматографии на силикагеле (н-гексан/AcOEt=19/1) с получением целевого соединения в виде бесцветного маслянистого вещества (175 мг, 34%).1H-ЯМР (CDCl3); 0,89 (т, J=7,6, 9H, -CH2CH2CH3×3), 1,11 (м, 6H, -CH2CH2CH3×3), 1,31-1,37 (м, 21H, -CH2CH2CH3×3, пинакол-CH3×4, t-Bu), 1,44 (с, 9H, t-Bu), 2,93 (дд, J=9,2, 14,4, 1H, CH2-α), 3,05 (дд, J=4,4, 14,4, 1H, CH2-β), 4,41 (м, 1H, CH), 4,73 (д, J=8,4, 1H, NH), 7,23 (д, J=7,6, 1H, Ar), 7,68 (дд, J=7,4, 1,2, 1H, Ar), 7,84 (м, J=1,2, 1H, Ar)
[0146]
Пример 5
Получение (S)-(2-(3-трет-бутокси-2-(трет-бутоксикарбониламино)-3-(оксопропил)-5-(4,4,5,5-тетраметил-1,3,2-диоксаборан-2-ил)фенил)(3-метоксифенил)йодонийтозилата
Трифторэтанол (2 мл) добавляли к 168 мг (0,228 ммоль) соединения, полученного в Примере 4, и затем реакционную смесь перемешивали в бане с ледяной водой в потоке газообразного азота в течение 1 часа. Добавляли 96,1 мг (0,228 ммоль) гидрокси(3-метоксифенил)йодонийтозилата, при этом реакционную смесь охлаждали льдом. Реакционную смесь затем перемешивали в бане с ледяной водой в течение 15 минут. Из смешанного реакционного раствора растворитель отгоняли при комнатной температуре. К полученной смеси добавляли гексан (10 мл) и смесь промывали. Реакционную смесь подвергали декантации для удаления фазы раствора. Такую же процедуру осуществляли два раза, чтобы полностью отогнать оставшийся растворитель из полученной смеси. Таким образом, получали 167 мг целевого соединения (выход: 86%).
1H-ЯМР (DMSO-d6); 1,31 (с, 12H, пинакол-CH3×4), 1,39 (с, 9H, t-Bu), 1,54 (с, 9H, t-Bu), 2,29 (с, 3H, TsOH-CH3), 3,15 (дд, J=10,8, 14,8, 1H, CH2-α), 3,19 (м, 1H, CH2-β, перекрывается с водой), 3,80 (с, 3H, -OCH3), 4,18 (м, 1H, CH), 7,12 (д, J=8,0, 2H, TsOH-Ar), 7,22 (дд, J=2,8, 8,8, 1H, Ar), 7,11-7,47 (м, 2H, Ar), 7,47 (д, J=8,0, 2H, TsOH-Ar), 7,60-7,71 (м, 2H, Ar), 7,83-7,87 (м, 3H, Ar).
[0147]
Пример 6
Получение (S)-трет-бутил 2-(трет-бутилоксикарбониламино)-3-(2-нитро-4-калийтрифторборилфенил)пропаноата
Соединение 7 (104 мг, 0,211 ммоль) растворяли в MeCN (2 мл) и в этот раствор добавляли раствор (200 мкл) KF (49 мг, 0,844 ммоль) в воде. Эту смесь перемешивали до полного растворения субстрата. Затем L-винную кислоту (65 мг, 0,433 ммоль) растворяли в THF (1 мл) и эту смесь по каплям добавляли в реакционный раствор. Полученную смесь перемешивали в течение 30 минут. Затем при промывке смеси при помощи MeCN образующийся осадок фильтровали. Полученный фильтрат полностью концентрировали с получением целевого соединения в виде бледно-желтого маслянистого вещества (78,2 мг, 78%).1H-ЯМР (CDCl3); 1,35 (с, 9H, t-Bu), 3,00 (дд, J=9,6, 13,6, 1H, CH2-α), 3,27 (дд, J=5,6, 14,0, 1H, CH2-β), 4,22 (м, 1H, CH), 5,53 (д, J=8,0, 1H, NH), 7,13 (д, J=7,2, 6H, Ar), 7,57 (дд, J=1,2, 7,6, 1H, Ar), 7,86 (д, J=1,2, 1H, Ar).
[0148]
Пример 7
Получение (S)-(2-(3-трет-бутокси-2-(трет-бутоксикарбониламино)-3-оксопропил)-5-(калийтрифторборилфенил)(3-метоксифенил)йодонийтозилата
Соединение 101 (79 мг, 0,093 ммоль) растворяли в MeCN (1 мл) и в этот раствор добавляли раствор (100 мкл) KF (22 мг, 0,372 ммоль) в воде. Эту смесь перемешивали. Затем L-винную кислоту (28 мг, 0,186 ммоль) растворяли в THF (0,5 мл) и эту смесь по каплям добавляли в реакционный раствор. Полученную смесь перемешивали в течение 30 минут. Затем при промывке смеси при помощи MeCN образующийся осадок фильтровали. Полученный фильтрат полностью концентрировали и затем добавляли Et2O (20 мл). Эту реакционную смесь затем перемешивали в течение ночи. Полученный осадок собирали при помощи фильтрации. Таким образом, целевое соединение получали в виде бесцветного кристалла (35,1 мг, 45%).1H-ЯМР (DMSO-d6); 1,31 (с, 9H, t-Bu), 1,44 (с, 9H, t-Bu), 2,29 (с, 3H, TsOH-CH3), 3,06 (дд, J=9,6, 14,8, 1H, CH2-α), 3,20 (м, 1H, CH2-β, перекрывается с водой), 3,78 (с, 3H, -OCH3), 4,13 (м, 1H, CH), 7,11 (д, J=8,0, 2H, TsOH-Ar), 7,19 (дд, J=2,8, 8,8, 1H, Ar), 7,34-7,49 (м, 3H, Ar), 7,48 (д, J=8,0, 2H, TsOH-Ar), 7,59-7,74 (м, 2H, Ar), 8,21 (м, 1H, Ar).
[0149]
Пример 8
(9) Получение (S)-трет-бутил 2-(трет-бутоксикарбониламино)-3-(2-фтор-4-(4,4,5,5-тетраметил-1,3,2-диоксабороран-2-ил)фенил)пропаноата
Используя обычную процедуру, защитную группу вводили в FBPA.1H-ЯМР (CDCl3); 1,33 (с, 9H, -Boc), 1,40 (с, 21H, t-Bu, пинакол(CH3)4), 3,06 (дд, J=8,8, 13,6, 1H, CH2-α), 3,16 (дд, J=5,2, 13,6, 1H, CH2-β), 4,45 (м, 1H, CH), 5,04 (д, J=8,0, 1H, NH), 7,20 (м, 1H, Ar), 7,42-7,50 (м, 2H, Ar).
[0150]
Пример 9
Соединение Примера 1 и соединение Примера 3 каждое использовали для испытания для проверки, действительно ли было достигнуто замещение фтором.
[0151]
Ссылочный Пример 1
Реакция мечения фтором
Соединение (0,10 ммоль), полученное в Примере 1, растворяли в толуоле и добавляли комплекс хлорида палладия и циннамила (5,0 моль %) и 2-дициклогексилфосфино-2,4,6-триизопропилбифенил (6,0моль %) в потоке газообразного азота. После этого к этой смеси добавляли фторирующий реагент для осуществления взаимодействия этих веществ друг с другом при 100°C в потоке газообразного азота в течение 1 часа. Полученное фтор-меченное соединение подвергали анализу ВЭЖХ.
[0152]
Ссылочный Пример 2
Реакция мечения фтором через соль диаллилйодония
Соединение (2,0 ммоль), полученное в Примере 3, растворяли в дихлорметане и затем добавляли реагент Козера (0,81 г, 2,0 ммоль) в потоке газообразного азота. При комнатной температуре реакционную смесь перемешивали в течение 2 часов и растворитель отгоняли при пониженном давлении. Остаток отверждали диэтиловым эфиром и это твердое вещество использовали на следующей стадии без очистки. Добавляли фторирующий реагент в потоке газообразного азота для осуществления взаимодействия этих веществ друг с другом при 80°C. Полученное фтор-меченное соединение подвергали анализу ВЭЖХ.
[0153]
Ссылочный Пример 3
Реакция мечения фтором через трифтор-замещенное соединение калия
Соединение (2,0 ммоль), полученное в Примере 6, растворяли в DMF и затем добавляли фторирующий реагент в потоке газообразного азота для осуществления взаимодействия этих веществ друг с другом при 80°C. Полученное фтор-меченное соединение подвергали анализу ВЭЖХ.
Реферат
Изобретение относится к соединению, представленному следующей формулой:В формуле 1: R представляет собой BRR, BXили BXM(X представляет собой галоген; Mпредставляет собой ион щелочного металла), Rпредставляет собой метильную, этильную, н-пропильную, изо-пропильную, н-бутильную, изо-бутильную, втор-бутильную, трет-бутильную, н-пентильную, бензильную, пара-метоксибензильную или пара-нитробензильную группу, Rпредставляет собой водород, бензилоксикарбонил, ацетил, трифторэтилкарбокси, трет-бутилоксикарбонил, флуоренилметилоксикарбонил, трихлорэтоксикарбонил, трифторацетил, аллилоксикарбонил, бензил, пропаргилоксикарбонил, бензоил, фталоил, толуолсульфонил или нитробензолсульфонил, Rи Rоба объединены с B (атом бора) с образованием кольца, служащего в качестве защитной группы для B, где кольцо выбрано из группы, включающей пинакол, 2,2-диметил-1,3-пропандиол, N-метилдиэтаноламин, 1,8-диаминонафталин, N-метилиминодиуксусную кислоту, 1,1,1-трисгидроксиметилэтан и катехин, Y представляет собой I, F или Br, NO, NH, Sn(R), замещенную или незамещенную фенильную йод группу или замещенную или незамещенную тиенильную йод группу, где заместитель(и) фенильной группы или тиенила включает Cалкильные, Cалкокси, гидрокси, амино и нитро группы, Rпредставляет собой алкильную группу, содержащую от 1 до 7 атомов углерода. Также предложены способ получения соединения формулы 3, способ полученияF-меченного ВРА и соединение формулы 6. Структура соединений формулы 3 и формулы 6 представлена в формуле изобретения. Изобретение позволяет обеспечить новое ВРА производное, которое может быть промежуточным соединением для синтезаF-меченного ВРА. 4 н. и 4 з.п. ф-лы, 12 пр.
Формула






Комментарии