Асимметричная вспомогательная группа - RU2693381C2
Код документа: RU2693381C2
Чертежи

Описание
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0001] Настоящее изобретение относится к хиральному реагенту, используемому для синтезирования стереоконтролируемых модифицированных атомом фосфора производных олигонуклеотидов.
ПРЕДПОСЫЛКИ К СОЗДАНИЮ ИЗОБРЕТЕНИЯ
[0002] В патенте JP 2005-89441 раскрывается способ изготовления производного нуклеотидов, называемый оксазафосфолидиновым способом. Тем не менее фактический выход мономеров является низким, и для осуществления способа требуются специальные блокирующие агенты, коммерчески недоступные на рынке. Полученные мономеры являются химически нестойкими. Более того, фактический выход производных олигонуклеотидов невысок. Предполагается, что низкий выход производных олигонуклеотидов обусловлен реакциями деградации на стадиях снятия защиты.
[0003] В публикации международной заявки WO 2010/064146 раскрывается способ получения производного нуклеотидов. Для осуществления раскрываемого в данной заявке способа требуются специальные блокирующие агенты, коммерчески недоступные на рынке. Более того, фактический выход производных олигонуклеотидов невысок. Предполагается, что низкий выход обусловлен реакциями деградации на стадиях снятия защиты. Указанная тенденция становится все более выраженной при увеличении длины производных олигонуклеотидов.
[0004] В публикации международной заявки WO 2012/039448 раскрывается асимметричная вспомогательная группа, используемая для получения стереоконтролируемых модифицированных атомом фосфора производных олигонуклеотидов.
Список библиографических ссылок
Патентная литература
[0005]
[Патентная литература 1] JP 2005-89441 A
[Патентная литература 2] WO 2010/064146 A
[Патентная литература 3] WO 2012/039448 A
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩЕСТВА ИЗОБРЕТЕНИЯ
[0006] Первый аспект настоящего изобретения относится к хиральному реагенту или к его соли. Хиральный реагент имеет нижеприведенную химическую формулу (I).
[0007]

[0008] В формуле (I) G1 и G2 независимо представляют собой атом водорода, нитрогруппу (-NO2), атом галогена, цианогруппу (-CN), группу, представленную формулой (II), (III) или (V) или как G1, так и G2, взятые вместе, образуют группу, представленную формулой (IV).
[0009]

[0010] В формуле (II) G21-G23 независимо представляют собой атом водорода, нитрогруппу, атом галогена, цианогруппу или С1-3 алкильную группу.
[0011]
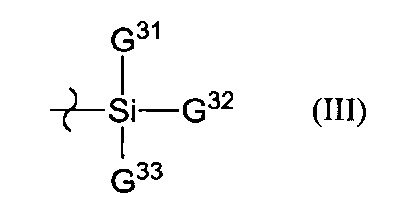
[0012] В формуле (III) G31-G33 независимо представляют собой C1-4 алкильную группу, С6-14 арильную группу, C1-4 алкилокси-группу, C7-14 аралкильную группу, C1-4 алкил-С6-14 арильную группу, C1-4 алкокси-С6-14 арильную группу или С6-14 арил-C1-4 алкильную группу.
[0013]

[0014] В формуле (IV) G41-G46 независимо представляют собой атом водорода, нитрогруппу, атом галогена, цианогруппу или С1-3 алкильную группу.
[0015]

[0016] В формуле (V) G51-G53 независимо представляют собой атом водорода, нитрогруппу, атом галогена, цианогруппу, С1-3 алкильную группу или С1-3 алкилокси-группу.
[0017] G3 и G4 независимо представляют собой атом водорода, С1-3 алкильную группу, С6-14 арильную группу, или как G3, так и G4, взятые вместе, образуют содержащие гетероатом кольцо, включающее от 3 до 16 атомов углерода, вместе с фрагментом NH в формуле (I).
[0018] Предпочтительный пример осуществления настоящего изобретения заключается в том, что хиральный реагент имеет нижеприведенную химическую формулу (I').
[0019]

[0020] В формуле (I') G1 и G2 имеют вышеуказанное значение. А именно: G1 и G2 независимо представляют собой атом водорода, нитрогруппу, атом галогена, цианогруппу, группу, представленную формулой (II) или (III), или как G1, так и G2, взятые вместе, образуют группу, представленную формулой (IV).
[0021] Предпочтительный пример осуществления настоящего изобретения заключается в том, что хиральный реагент имеет химическую формулу (I') и каждый из G1 и G2 представляет собой группу, представленную формулой (II), в котором G21-G23 независимо представляют собой атом водорода, нитрогруппу, атом галогена, цианогруппу или C1-3 алкильную группу.
[0022] Предпочтительный пример осуществления настоящего изобретения заключается в том, что хиральный реагент имеет химическую формулу (I') и каждый из G1 и G2 представляет собой группу, представленную формулой (II), и каждый из G21-G23 представляет собой атом водорода.
[0023] Предпочтительный пример осуществления настоящего изобретения заключается в том, что хиральный реагент имеет химическую формулу (I'), и G1 представляет собой атом водорода, G2 представляет собой группу, представленную формулой (II), и G21-G23 независимо представляют собой атом водорода, нитрогруппу, атом галогена, цианогруппу или C1-3 алкильную группу.
[0024] Предпочтительный пример осуществления настоящего изобретения заключается в том, что хиральный реагент имеет химическую формулу (I'), и G1 представляет собой атом водорода, G2 представляет собой группу, представленную формулой (II), каждый из G21 и G22 представляет собой атом водорода, и G23 представляет собой нитрогруппу.
[0025] Предпочтительный пример осуществления настоящего изобретения заключается в том, что хиральный реагент имеет химическую формулу (I'), и G1 представляет собой атом водорода, G2 представляет собой группу, представленную формулой (III), и G31-G33 независимо представляют собой C1-4 алкильную группу, C6-14 арильную группу, C7-14 аралкильную группу, C1-4 алкил-C6-14 арильную группу, C1-4 алкокси-C6-14 арильную группу или C6-14 арил-C1-4 алкильную группу.
[0026] Предпочтительный пример осуществления настоящего изобретения заключается в том, что хиральный реагент имеет химическую формулу (I'), и G1 представляет собой атом водорода, G2 представляет собой группу, представленную формулой (III), и G31-G33 независимо представляют собой C1-4 алкильную группу, С6 арильную группу, C7-10 аралкильную группу, C1-4 алкил-C6 арильную группу, C1-4 алкокси-С6 арильную группу или С6 арил-C1-4 алкильную группу.
[0027] Предпочтительный пример осуществления настоящего изобретения заключается в том, что хиральный реагент имеет химическую формулу (I'), и G1 представляет собой атом водорода, G2 представляет собой группу, представленную формулой (III), и G31-G33 независимо представляют собой C1-4 алкильную группу или С6 арильную группу. Примеры С1-4 алкильной группы включают метальную группу, этильную группу, n-пропильную группу, iso-пропильную группу, n-бутильную группу и tert-бутильную группу.
[0028] Предпочтительный пример осуществления настоящего изобретения заключается в том, что хиральный реагент имеет химическую формулу (I'), и G1 представляет собой атом водорода, G2 представляет собой группу, представленную формулой (III), и G31-G33 независимо представляют собой C1-4 алкильную группу.
[0029] Предпочтительный пример осуществления настоящего изобретения заключается в том, что хиральный реагент имеет химическую формулу (I'), и G1 представляет собой атом водорода, G2 представляет собой группу, представленную формулой (III), и G31 и G33 представляют собой С6 арильную группу, и G32 представляет собой С1-4 алкильную группу.
[0030] Предпочтительный пример осуществления настоящего изобретения заключается в том, что хиральный реагент имеет химическую формулу (I'), и G1 и G2, взятые вместе, образуют группу, представленную формулой (IV), и G41-G46 независимо представляют собой атом водорода, нитрогруппу, атом галогена, цианогруппу или C1-4 алкильную группу.
[0031] Предпочтительный пример осуществления настоящего изобретения заключается в том, что хиральный реагент имеет химическую формулу (I'), и G1 и G2, взятые вместе, образуют группу, представленную формулой (IV), в которой каждый из G41-G46 представляет собой атом водорода.
[0032] Предпочтительный пример осуществления настоящего изобретения заключается в том, что хиральный реагент имеет химическую формулу (I'), и G1 представляет собой атом водорода, и G представляет собой группу, представленную формулой (V). Далее каждый из G51-G53 независимо представляют собой атом водорода, нитрогруппу, метальную группу или метокси-группу. Более предпочтительный пример осуществления настоящего изобретения заключается в том, что G1 представляет собой атом водорода, и G2 представляет собой группу, представленную формулой (V), в которой каждый из G51 и G53 представляют собой атом водорода, и G53 представляет собой 4-метильную группу.
[0033] Предпочтительный пример осуществления настоящего изобретения заключается в том, что хиральный реагент выбран из одного из соединений III-а, III-b, V-a, VII-a, VII-b, IX-a, IX-b, XI-a, ХIII-а и XIII-b::
(S)-2-(метилдифенилсилил)-1-((S)-пирролидин-2-ил)этанол (III-a)
(R)-2-(метилдифенилсилил)-1-((R)-1-пирролидин-2-ил)этанол (III-b)
(S)-2-(триметилсилил)-1-((S)-1-пирролидин-2-ил)этанол (V-a)
(R)-2,2-дифенил-1-((S)-пирролидин-2-ил)этанол (VII-a)
(S)-2,2-дифенил-1-((R)-пирролидин-2-ил)этанол (VII-b)
(R)-2-(4-нитрофенил)-1-((S)-пирролидин-2-ил)этанол (IX-a)
(S)-2-(4-нитрофенил)-1-((R)-пирролидин-2-ил)этанол (IX-b)
(R)-(9H-флуорен-9-ил)((S)-пирролидин-2-ил)метанол (XI-a)
(S)-2-тозил-1-((S)-1-тритилпирролидин-2-ил)этанол (ХII-а)
(R)-2-тозил-1-((R)-1-тритилпирролидин-2-ил)этанол (XIII-b)
[0034] Второй аспект настоящего изобретения относится к производному нуклеозид 3'-фосфорамидита, которое представлено формулой (Va) или (Vb).
[0035]

[0036] В формуле (Va) и (Vb), G1-G4 имеют вышеуказанные значения, G5 представляет собой защитную группу гидроксильной группы, и Bs представляет собой группу, выбранную из групп, представленных нижеприведенными формулами (VI)-(XI), или их производные.
[0037]

[0038] Примеры Bs включают аденин, тимин, цитозин, гуанин, урацил, 5-метилцитозин или их производные.
[0039] R2 представляет собой водород, -OH, -SH, -NRdRd, -N3, галоген, алкил, алкенил, алкинил, алкил-Y1-, алкенил-Y1-, алкинил-Y1-, арил-Y1-, гетероарил-Y1-, -ORb или -SRb, в котором Rb представляет собой блокирующую часть.
Y1 представляет собой О, NRd, S или Se.
Rd независимо представляет собой водород, алкил, алкенил, алкинил, арил, ацил, замещенный силил, карбамат, -P(O)(Re)2 или -HP(O)(Re).
Re независимо представляет собой водород, алкил, арил, алкенил, алкинил, алкил-Y2-, алкенил-Y2-, алкинил-Y2-, арил-Y2-, или гетероарил-Y2-, или катион, который представляет собой Na+, Li+ или K+.
Y2 представляет собой О, NRd или S.
[0040] R3 представляет собой группу, представленную -CH2-, -(CH2)2-, -CH2NH- или -CH2N(CH3)-.
[0041] Примеры G5 включают тритил, 4-монометокситритил, 4,4'-диметокситритил, 4,4',4''-триметокситритил, 9-фенилксантин-9-ил (Пиксил) и 9-(p-метоксифенил)ксантин-9-ил (МОХ).
[0042] Предпочтительный пример осуществления второго аспекта настоящего изобретения заключается в том, что производное нуклеозид 3'-фосфорамидита представлено формулой (Va') или (Vb').
[0043]

[0044] В формуле (Va') и (Vb'), G1, G2, G5, Bs, R2 и R3 имеют вышеуказанные значения.
[0045] Третий аспект настоящего изобретения относится к способу для проведения синтеза стереоконтролируемого модифицированного атомом фосфора производного олигонуклеотидов.
[0046] Первая стадия представляет собой стадию реакции молекулы, содержащей ахиральный Н-фосфонатный фрагмент, первого активизирующего реагента и хирального реагента или его соли с образованием мономера. Хиральный реагент имеет химическую формулу (I) или (I'), и мономер может быть представлен формулой (Va), (Vb), (Va') или (Vb'). Мономер реагирует со вторым активизирующим реагентом и нуклеозидом с образованием конденсированного промежуточного соединения. Следующая стадия представляет собой стадию преобразования конденсированного промежуточного соединения в нуклеиновую кислоту, включающую хиральный Х-фосфонатный фрагмент.
[0047] Настоящий способ позволяет использовать стойкие и коммерчески доступные на рынке материалы в качестве исходных материалов. Существует возможность изготавливать стереоконтролируемые модифицированные атомом фосфора производные олигонуклеотидов с использованием ахирального исходного материала.
[0048] Как проиллюстрировано в рабочем примере, способ настоящего изобретения не вызывает деградацию на стадиях снятия защиты. Далее для осуществления способа не требуются специальные блокирующие агенты для изготовления модифицированных атомом фосфора производных олигонуклеотидов.
[0049] Четвертый аспект настоящего изобретения относится к способу для проведения синтеза стереоконтролируемых модифицированных атомом фосфора производных олигонуклеотидов с использованием хирального мономера.
[0050] Первая стадия представляет собой стадию реакции производного нуклеозид 3'-фосфорамидита, представленного формулой (Va), (Vb), (Va') или (Vb'), со вторым активизирующим реагентом и нуклеозидом с образованием конденсированного промежуточного соединения. Вторая стадия заключается в преобразовании конденсированного промежуточного соединения в нуклеиновую кислоту, включающую хиральный Х-фосфонатный фрагмент.
ВКЛЮЧЕНИЕ В ОПИСАНИЕ ИЗОБРЕТЕНИЯ СВЕДЕНИЙ ПУТЕМ ССЫЛКИ
[0051] Все публикации и патентные заявки, раскрытые в настоящем документе в данном описании изобретения, включены в описание изобретения путем ссылки во всей своей полноте в той же самой степени, как если бы каждая отдельная публикация или патентная заявка были бы специально или в отдельности указаны для включения путем ссылки.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
[0052] Фиг. 1 - характеристика СВЭЖХ при изготовлении производного олигонуклеотида с использованием мономера формулы 4b.
Фиг. 2 - характеристика СВЭЖХ при изготовлении производного олигонуклеотида с использованием мономера 25.
НАИЛУЧШЕЕ ТЕХНИЧЕСКОЕ ВЫПОЛНЕНИЕ ИЗОБРЕТЕНИЯ
[0053] Термин «нуклеиновая кислота» включает поли- или олиго-рибонуклеотиды (РНК) и поли- или олиго-диоксирибонуклеотиды (ДНК); РНК или ДНК, полученные из N-гликозидов или С-гликозидов нуклеиновых оснований и (или) модифицированных нуклеиновых оснований; нуклеиновые кислоты, полученные из сахаров и (или) модифицированных сахаров; и нуклеиновые кислоты, полученные из фосфатных мостиков и (или) модифицированных мостиков между атомами фосфора. Термин включает нуклеиновые кислоты, содержащие любые сочетания нуклеиновых оснований, модифицированных нуклеиновых оснований, сахаров, модифицированных cахаров, фосфатных мостиков или модифицированных мостиков между атомами фосфора. Примеры включают без ограничения нуклеиновые кислоты, содержащие фрагменты рибозы, нуклеиновые кислоты, содержащие фрагменты деоксирибозы, нуклеиновые кислоты, содержащие как рибозу, так и фрагменты деоксирибозы, нуклеиновые кислоты, содержащие рибозу и модифицированные фрагменты рибозы. Префикс поли- относится к нуклеиновой кислоте, содержащей от приблизительно 1 до приблизительно 10000 единиц мономера нуклеотида, и при этом префикс олиго- относится к нуклеиновой кислоте, содержащей от приблизительно 1 до приблизительно 200 единиц мономера нуклеотида.
[0054] Термин «нуклеиновое основание» относится к частям нуклеиновых кислот, участвующих в образовании водородной связи, которая последовательно-специфически связывает одну цепь нуклеиновой кислоты с другой комплементарной цепью. Наиболее часто встречающимися природными нуклеиновыми основаниями являются аденин (А), гуанин (G), урацил (U), цитозин (С), 5-метилцитозин и тимин (Т).
[0055] Термин «модифицированное нуклеиновое основание» относится к фрагменту, который может заместить нуклеиновое основание. Модифицированное нуклеиновое основание имитирует пространственное расположение, электронные свойства или некоторые другие физико-химические свойства нуклеинового основания и сохраняет свойство водородной связи, которая последовательно-специфически связывает одну цепь нуклеиновой кислоты с другой. Модифицированное нуклеиновое основание может создавать пару с любым из пяти природных оснований (урацил, тимин, аденин, цитозин или гуанин), не оказывая при этом значительное негативное воздействие на характеристики плавления, узнавание внутриклеточными ферментами или активность олигонуклеотидного дуплекса.
[0056] Термин «нуклеозид» относится к фрагменту, в котором нуклеиновое основание или модифицированное нуклеиновое основание ковалентно связано с сахаром или модифицированным сахаром.
[0057] Термин «сахар» относится к моносахариду в закрытой и (или) открытой форме. Сахара включают без ограничения фрагменты рибозы, деоксирибозы, пентафуранозы, пентапиранозы и гексапиранозы.
[0058] Термин «модифицированный сахар» относится к фрагменту, который может заместить сахар. Модифицированный сахар имитирует пространственное расположение, электронные свойства или некоторые другие физико-химические свойства сахара.
[0059] Термин «нуклеотид» относится к фрагменту, в котором нуклеиновое основание или модифицированное нуклеиновое основание ковалентно связано с сахаром или модифицированным сахаром, и сахар или модифицированный сахар ковалентно связан с фосфатной группой или фрагментом, модифицированным атомом фосфора.
[0060] Термин «хиральный реагент» относится к соединению, которое является хиральным или энантиомерно чистым и может быть использовано для асимметричной индукции в синтезе нуклеиновых кислот.
[0061] Термин «хиральный лиганд» или «хиральный вспомогательный элемент» относится к фрагменту, который является хиральным или энантиомерно чистым и контролирует стереохимический результат реакции.
[0062] Термин «активизирующий реагент» при проведении реакции конденсации относится к реагенту, активизирующему менее реакционно-способный центр и делающим его более восприимчивый к нуклеофильной атаке.
[0063] Термин «блокирующий фрагмент» относится к группе, которая временно маскирует реактивность функциональной группы. Функциональная группа может быть в последующем демаскирована путем удаления блокирующего фрагмента.
[0064] Термины «борирующие реагенты», «серные электрофилы», «селеновые электрофилы» относятся к соединениям, которые являются приемлемыми на стадии модификации, используемой для введения ВН3, S, и Se групп, соответственно, для модификации атома фосфора.
[0065] Термин «фрагмент» относится к специфическому сегменту или функциональной группе молекулы. Химические фрагменты являются часто распознаваемыми химическими структурными элементами, внедренными в молекулу или присоединенными к ней.
[0066] Термин «твердая подложка» относится к любой подложке, которая обеспечивает крупномасштабное производство синтетических нуклеиновых кислот и которая при необходимости может быть повторно использована. В соответствии со значением, используемом в настоящем контексте, термин относится к полимеру, который не растворим в средах, используемых на стадиях реакции, проводимых для синтезирования нуклеиновых кислот, и который дериватизирован с включением в него реактивных групп.
[0067] Термин «связующий фрагмент» относится к любому фрагменту, произвольно расположенному между конечным нуклеозидом и твердой подложкой или между конечным нуклеозидом и другим нуклеозидом, нуклеотидом или нуклеиновой кислотой.
[0068] В соответствии со значением, используемом в настоящем контексте, термины «лечение» или «проводить лечение», или «временное облегчение» или «уменьшение интенсивности» используются взаимозаменяемо в данном описании. Указанные термины относятся к подходу для получения эффективных или необходимых результатов, включая без ограничения терапевтический эффект и (или) профилактический эффект. Под терапевтическим эффектом понимается устранение или уменьшение интенсивности симптомов основного лечимого заболевания. Кроме того, терапевтический эффект достигается при устранении или уменьшение интенсивности одного или более физиологических симптомов, связанных с основным заболеванием, в результате чего у пациента наблюдается улучшение несмотря на то, что его организм по-прежнему поражен основным заболеванием. Для достижения профилактического эффекта композиции могут быть введены пациенту, подверженному риску развития определенного заболевания, либо пациенту, имеющему один или более физиологических симптомов заболевания, даже несмотря на то, что не был поставлен диагноз указанного заболевания.
[0069] В соответствии со значением, используемом в настоящем контексте, термин «терапевтический эффект» включает терапевтический эффект и (или) профилактический эффект, как описано выше. «Профилактический эффект» включает замедление или устранение проявления заболевания или состояния, замедление или устранение наступления симптомов заболевания или состояния, замедление, приостановление или купирование прогрессирования заболевания или состояния или любое их сочетание.
[0070] Термин «алкильная» группа относится к группе алифатических углеводородов. Алкильный фрагмент может представлять собой насыщенную алкильную группу (что означает, что она не содержит какие-либо единицы ненасыщения, например, двойные связи углерод-углерод или тройные связи углерод-углерод), или алкильный фрагмент может быть ненасыщенной алкильной группой (что означает, что он содержит, по меньшей мере, одну единицу ненасыщения). Алкильный фрагмент, насыщенный или ненасыщенный, может быть разветвленноцепочечным, прямоцепочечным или включать циклическую часть. Точкой присоединения алкила является атом углерода, не являющийся частью кольца.
[0071] «Алкильный» фрагмент может иметь от 1 до 10 атомов углерода (при любом упоминании термина в тексте числовой диапазон, например, «1-10» относится к каждому целому числу в заданном диапазоне; например, «от 1 до 10 атомов углерода» означает, что алкильная группа может состоять из 1 атома углерода, 2 атомов углерода, 3 атомов углерода, и т.д., вплоть до 10 атомов углерода и включая 10 атомов углерода, хотя настоящее определение также включает случаи упоминания термина «алкил», в которых не указывается числовой диапазон). Алкил включает как разветвленноцепочечные, так и прямоцепочечные алкильные группы. Алкильная группа описанных в данном контексте соединений может быть обозначена как «C1-С6 алкил» или иметь аналогичные обозначения. Исключительно в качестве примера «C1-С6 алкил» указывает на то, что алкильная цепь содержит один, два, три, четыре, пять или шесть атомов углерода, т.е., алкильная цепь выбрана из группы, состоящей из метила, этила, пропила, iso-пропила, n-бутила, iso-бутила, sec-бутила и tert-бутила. Типичные алкильные группы включают без ограничения метил, этил, пропил, изопропил, бутил, изобутил, третичный бутил, пентил, гексил, аллил, циклопропилметил, циклобутилметил, циклопентилметил, циклогексилметил и т.д. В соответствии с одним аспектом алкил представляет собой C1-С6 алкил.
[0072] С1-3 алкильная группа означает неразветвленную или разветвленную алкильную группу, содержащую от 1 до 3 атомов углерода. Примеры С1-3 алкильной группы включают метил, этил, пропил и изопропил. С1-4 алкильная группа означает неразветвленную или разветвленную алкильную группу, содержащую от 1 до 4 атомов углерода. Примеры C1-4 алкильной группы включают метил, этил, пропил, изопропил, бутил, изобутил и tert-бутил.
[0073] В соответствии со значением, используемом в настоящем контексте, термин «арил» относится к ароматическому кольцу, в котором каждый из атомов, образующих кольцо, является атомом углерода. Арильные кольца образованы пятью, шестью, семью, восемью, девятью или более чем девятью атомами углерода. Арильные группы являются замещенными или незамещенными. В одном аспекте арил представляет собой фенил или нафталенил. В зависимости от структуры арильная группа может быть монорадикальной или дирадикальной (т.е. ариленовой группой). В одном аспекте настоящего изобретения арил представляет собой C6-C10 арил.
[0074] С6-14 арильная группа означает арильную группу, имеющую от 6 до 14 атомов углерода. Примеры С6-14 арильной группы включают фенил, бифенил, нафтильная, антрацил, инданил, фталимидил, нафтимидил, фенантридинил и тетрагидронафтил.
[0075] Термин «араркил» относится к алкильной группе, замещенной арильной группой. Приемлемые аралкильные группы включают бензил, пиколил и аналогичные соединения, все из которых могут быть опционально замещенными.
[0076] «Ацильный фрагмент» относится к алкильной (С=O), арильной (С=O) или араркильной (С=O) группе. Ацильный фрагмент может содержать промежуточный фрагмент (Y), представляющий собой окси, амино, тио или селено между карбонильной и углеводородной группой. Например, ацильная группа может представлять собой алкил-Y-(С=O), арил-Y-(С=O) или аралкил-Y-(С=O).
[0077] «Алкенильные» группы представляю собой прямоцепочечные, разветвленноцепочечные и циклические углеводородные группы, содержащие, как минимум, одну двойную связь углерод-углерод. Алкенильные группы могут быть замещенными.
[0078] "Алкинильные" группы являются прямоцепочечными, разветвленноцепочечными и циклическими углеводородными группами, содержащими, как минимум, одну тройную связь углерод-углерод. Алкинильные группы могут быть замещенными.
[0079] «Алкокси»-группа относится к алкильной группе, связанной с кислородом, т.е. (алкил)-O- группой, в которой алкил представляет собой соединение, как указано в данном документе. Примеры включают метокси (-OCH3) или этокси (-ОCH2СН3) группы.
[0080] «Алкенилокси»-группа относится к алкенильной группе, связанной с кислородом, т.е. (алкенил)-O-группой, в которой алкенил представляет собой соединение, как указано в данном документе.
[0081] «Алкинилокси»-группа относится к алкинильной группе, связанной с кислородом, т.е. (алкинил)-O-группой, в которой алкинил представляет собой соединение, как указано в данном документе.
[0082] «Арилокси»-группа относится к арильной группе, связанной с кислородом, т.е. (арил)-O-группой, в которой арил представляет собой соединение, как указано в данном документе. Пример включает фенокси (-OC6H5) группу.
[0083] Термин «алкилселено» относится к алкильной группе, содержащей присоединенную к ней замещенную селено-группу, т.е. (алкил)-Se-группу, в которой алкил представляет собой соединение, как указано в данном документе.
[0084] Термин «алкенилселено» относится к алкенильной группе, содержащей присоединенную к ней замещенную селено-группу, т.е. (алкенил)-Sе-группу, в которой алкенил представляет собой соединение, как указано в данном документе.
[0085] Термин «алкинилселено» относится к алкинильной группе, содержащей присоединенную к ней замещенную селено-группу, т.е. (алкинил)-Sе-группу, в которой алкинил представляет собой соединение, как указано в данном документе.
[0086] Термин «алкилтио» относится к алкильной группе, присоединенной к мостиковому атому серы, т.е. к (алкил)-S-группе, в которой алкил представляет собой соединение, как указано в данном документе. Например, алкилтио представляет собой метилтио и аналогичные соединения.
[0087] Термин «алкенилтио» относится к алкенильной группе, присоединенной к мостиковому атому серы, т.е. к (алкенил)-S-группе, в которой алкенил представляет собой соединение, как указано в данном документе.
[0088] Термин «алкинилтио» относится к алкинильной группе, присоединенной к мостиковому атому серы, т.е. к (алкинил)-S-группе, в которой алкинил представляет собой соединение, как указано в данном документе.
[0089] Термин «алкиламино» относится к амино-группе, замещенной, как минимум, одной алкильной группой, т.е. -NH(алкил) или -N(алкил)2, в которой алкил представляет собой соединение, как указано в данном документе.
[0090] Термин «алкениламино» относится к амино-группе, замещенной, как минимум, одной алкенильной группой, т.е. -NH(алкенил) или -N(алкенил)2, в которой алкенил представляет собой соединение, как указано в данном документе.
[0091] Термин «алкиниламино» относится к амино-группе, замещенной, как минимум, одной алкинильной группой, т.е. -NH(алкинил) или -N(алкинил)2, в которой алкинил представляет собой соединение, как указано в данном документе.
[0092] Термин «галоген» включает фтор, хлор, бром и йод.
[0093] «Флуоресцентная группа» относится к молекуле, которая при возбуждении светом, имеющим подобранную длину волны, испускает свет другой длины волны. Флуоресцентная группа включает без ограничения индольные группы, флуоресцеин, тетраметилродамин, техасский красный, BODIPY, 5-[(2-аминоэтил)амино]нафталин-1-сульфоновую кислоту (EDANS), кумарин и желтую серу.
[0094] «Ион аммония» представляет собой положительно заряженный полиатомный катион, имеющий химическую формулу .
[0095] «Ион алкиламмония» представляет собой ион аммония, в котором, как минимум, один из его атомов водорода замещен на алкильную группу, в которой алкил представляет собой соединение, как указано в данном документе. Примеры включают ион триэтиламмония, ион N,N-диизопропилзтиламмония.
[0096] «Ион имминия» имеет общую структуру . R-группы относятся к алкильным, алкенильным, алкинильным, арильным группам, как определено в данном документе. «Гетероароматический ион имминия» относится к иону имминия, в котором азот и его присоединенные R-группы образуют гетероароматическое кольцо. «Гетероциклический ион имминия» относится к иону имминия, в котором азот и его присоединенные R-группы образуют гетероциклическое кольцо.
[0097] Термины «амино» или «амин» относится к группе -N(Rh)2 радикала, где каждый Rh независимо представляет собой водород, алкил, фтороалкил, карбоциклил, карбоциклилалкил, арил, араркил, гетероциклил, гетероциклилалкил, гетероарил или гетероарилалкил, если, в частности, не указано иное в описании изобретения. Когда группа -N(Rh)2 содержит два Rh, за исключением водорода, они могут быть скомбинированы с атомом азота, образуя 4-, 5-, 6- или 7-членное кольцо. Например, предусматривается, что -N(Rh)2 включает без ограничения 1-пирролидинил и 4-морфолинил. Любой или, как минимум, каждый из водорода, алкила, фтороалкила, карбоциклила, карбоциклилалкила, арила, араркила, гетероциклила, гетероциклилалкила, гетероарила или гетероарилалкила являются опциально замещенными одним или несколькими заместителями, которые независимо представляют собой алкил, гетероалкил, алкенил, алкинильные, циклоалкил, гетероциклоалкил, арил, арилалкил, гетероарил, гетероарилалкил, гидрокси, гало, циано, трифторометила, трифторометокси, нитро, триметилсилил, -ORi, -SRi, -ОС(О)Ri, -N(Ri)2, -C(O)Ri, -C(O)ORi, -OC(O)N(Ri)2, -C(O)N(Ri)2, -N(Ri)C(O)OR, -N(Ri)C(O)Ri, -N(Ri)С(O)N(Ri)2, N(Ri)C(NRi)N(Ri)2, -N(Ri)S(O)tRi (где t - 1 или 2), -S(O) или -S(O)tN(Ri)2 (где t - 1 или 2), где каждый Ri независимо представляет собой водород, алкил, фтороалкил, карбоциклил, карбоциклилалкил, арил, араркил, гетероциклил, гетероциклилалкил, гетероарил или гетероарилалкил.
[0098] «Карбамат» в соответствии со значением, используемом в настоящем контексте, относится к фрагменту, присоединенному к амино-группе, имеющей формулу -C(O)OR, где R представляет собой алкил, фтороалкил, карбоциклил, карбоциклилалкил, арил, араркил, гетероциклил, гетероциклилалкил, гетероарил или гетероарилалкил. Примеры включают без ограничения Boc (tert-бутил-ОС(О)-), CBz (бензил-ОС(О)-), Теос (Me3SiCH2CH2OC(O)-), alloc (аллил-ОС(О)-) или Fmoc (9-фторэнелметил-ОС(O)-) группу.
[0099] «Замещенный силил» в соответствии со значением, используемом в настоящем контексте, относится к фрагменту, имеющему формулу R3Si-. Примеры включают без ограничения, TBDMS (tert-бутилдиметилсилил), TBDPS (tert-бутилдифенилсилил) или TMS (триметилсилил) группу.
[0100] Термин «тиол» относится к -SH группам и включает замещенные тиольные группы, т.е. -SRJ группы, в которых RJ в каждом случае независимо представляют собой замещенную или незамещенную алкильную, циклоалкильную, алкенильную, алкинильную, арил-араркильную, гетероциклическую или гетероциклилалкильную группу, как определено в данном документе.
[0101] Первый аспект настоящего изобретения относится к хиральному реагенту или его соли. Хиральный реагент имеет нижеприведенную химическую формулу (I). Термин «хиральный реагент» является химической композицией, используемой для изготовления стереоконтролируемых модифицированных атомом фосфора нуклеотидов или производных олигонуклеотидов. Хиральный реагент вступает в реакцию с нуклеотидом, образуя хиральное промежуточное соединение.
[0102]
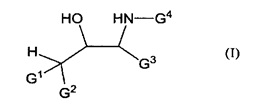
[0103] В формуле (I), G1 и G2 независимо представляют собой атом водорода, нитрогруппу, атом галогена, цианогруппу (-CN), группу, представленную формулой (II), (III) или (V), или как G1 так и G2, взятые вместе, образуют группу, представленную формулой (IV).
[0104]
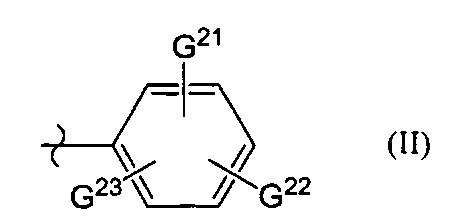
[0105] В формуле (II) G21-G23 независимо представляют собой атом водорода, нитрогруппу, атом галогена, цианогруппу или C1-3 алкильную группу. Предпочтительные примеры G21-G23 включают атом водорода.
[0106]

[0107] В формуле (III) G31-G33 независимо представляют собой C1-4 алкильную группу, С6-14 арильную группу, С1-4 алкокси-группу, C7-14 аралкильную группу, С1-4 алкил-С6-14арильную группу, C1-4 алкокси-С6-14 арильную группу или С6-14 арил-С1-4 алкильную группу. Примеры С1-4 алкил-С6-14 арильной группы включают метилфенильную группу и этилфенильную группу. Примеры С1-4 алкокси-С6-14 арильной группы включают метоксифенильную группу и этоксифенильную группу. Примеры C6-14 арил-С1-4 алкильных групп включают бензильную группу и фенилэтильную группу. Предпочтительные примеры G31-G33 независимо включают метальную группу и фенильную группу.
[0108]

[0109] В формуле (IV) G41-G46 независимо представляют собой атом водорода, нитрогруппу, атом галогена, цианогруппу или С1-3 алкильную группу. Предпочтительные примеры G41-G46 включают атом водорода.
[0110]

[0111] В формуле (V) G51-G53 независимо представляют собой атом водорода, нитрогруппу, атом галогена, цианогруппу, С1-3 алкильную группу или С1-3 алкилокси-группу.
[0112] G3 и G4 независимо представляют собой атом водорода, С1-3 алкильную группу, С6-14 арильную группу или как G3, так и G4, взятые вместе, образуют содержащее гетероатом кольцо, имеющее от 3 до 16 атомов углерода. Предпочтительные примеры G3 и G4, взятые вместе, образуют содержащее гетероатом кольцо, имеющее от 3 до 16 атомов углерода с NH фрагментом в формуле (I).
[0113] Предпочтительный пример осуществления настоящего изобретения заключается в том, что хиральный реагент имеет нижеприведенную химическую формулу (I').
[0114]

[0115] В формуле (I') G1 и G2 имеют вышеуказанные значения, и G1 и G2 независимо представляют собой атом водорода, нитрогруппу, атом галогена, цианогруппу, группу, представленную формулой (II) или (III), или как G1, так и G2, взятые вместе, образуют группу, представленную формулой (IV).
[0116] Предпочтительный пример осуществления настоящего изобретения заключается в том, что хиральный реагент имеет химическую формулу (I'), и каждый из G1 и G2 представляет собой группу, представленную формулой (II), в которой G21-G23 независимо представляют собой атом водорода, нитрогруппу, атом галогена, цианогруппу или С1-3 алкильную группу.
[0117] Предпочтительный пример осуществления настоящего изобретения заключается в том, что хиральный реагент имеет химическую формулу (I'), и каждый из G1 и G2 представляет собой группу, представленную формулой (II), и каждый из G21-G23 представляет собой атом водорода.
[0118] Предпочтительный пример осуществления настоящего изобретения заключается в том, что хиральный реагент имеет химическую формулу (I'), и G1 представляет собой атом водорода, G2 представляет собой группу, представленную формулой (II), и G21-G23 независимо представляют собой атом водорода, нитрогруппу, атом галогена, цианогруппу или C1-3 алкильную группу.
[0119] Предпочтительный пример осуществления настоящего изобретения заключается в том, что хиральный реагент имеет химическую формулу (I'), и G1 представляет собой атом водорода, G2 представляет собой группу, представленную формулой (II), каждый из G21 и G22 представляет собой атом водорода, и G23 представляет собой нитрогруппу (-NO2).
[0120] Предпочтительный пример осуществления настоящего изобретения заключается в том, что хиральный реагент имеет химическую формулу (I'), и G1 представляет собой атом водорода, G2 представляет собой группу, представленную формулой (III), и G31-G33 независимо представляют собой C1-4 алкильную группу, С6-14 арильную группу, С7-14 аралкильную группу, С1-4 алкил-C6-14 арильную группу, С1-4 алкокси-C6-14 арильную группу или С6-14 арил-С1-4 алкильную группу.
[0121] Предпочтительный пример осуществления настоящего изобретения заключается в том, что хиральный реагент имеет химическую формулу (I'), и G1 представляет собой атом водорода, G2 представляет собой группу, представленную формулой (III), и G31-G33 независимо представляют собой С1-4 алкильную группу, С6 арильную группу, C7-10 аралкильную группу, С1-4 алкил-С6 арильную группу, С1-4 алкокси-С6 арильную группу или С6 арил-С1-4 алкильную группу.
[0122] Предпочтительный пример осуществления настоящего изобретения заключается в том, что хиральный реагент имеет химическую формулу (I'), и G1 представляет собой атом водорода, G2 представляет собой группу, представленную формулой (III), и G31-G33 независимо представляют собой C1-4 алкильную группу или С6 арильную группу (фенильную группу). Примеры С1-4 алкильной группы включают метальную группу, этильную группу, n-пропильную группу, iso-пропильную группу, n-бутильную группу и tert-бутильную группу.
[0123] Предпочтительный пример осуществления настоящего изобретения заключается в том, что хиральный реагент имеет химическую формулу (I'), и G1 представляет собой атом водорода, G2 представляет собой группу, представленную формулой (III), и G31-G33 независимо представляют собой C1-4 алкильную группу.
[0124] Предпочтительный пример осуществления настоящего изобретения заключается в том, что хиральный реагент имеет химическую формулу (I'), и G1 представляет собой атом водорода, G2 представляет собой группу, представленную формулой (III), G31 и G33 представляют собой С6 арильную группу (фенильную группу), и G32 представляет собой С1-2 алкильную группу.
[0125] Предпочтительный пример осуществления настоящего изобретения заключается в том, что хиральный реагент имеет химическую формулу (I'), и G1 и G2, взятые вместе, образуют группу, представленную формулой (IV), и G41-G46 независимо представляют собой атом водорода, нитрогруппу, атом галогена, цианогруппу или С1-3 алкильную группу.
[0126] Предпочтительный пример осуществления настоящего изобретения заключается в том, что хиральный реагент имеет химическую формулу (I'), и G1 и G2, взятые вместе, образуют группу, представленную формулой (IV), в которой каждый из G41-G46 представляет собой атом водорода.
[0127] Предпочтительный пример осуществления настоящего изобретения заключается в том, что хиральный реагент имеет химическую формулу (I'), и G1 представляет собой атом водорода, G2 представляет собой группу, представленную формулой (V). Кроме того, каждый из G51-G53 независимо представляет собой атом водорода, нитрогруппу, метальную группу или метокси-группу. Более предпочтительный пример осуществления настоящего изобретения заключается в том, что G1 представляет собой атом водорода, и G2 представляет собой группу, представленную формулой (V), в которой каждый из G51, и G53 представляет собой атом водорода, и G53 представляет собой 4-метильную группу.
[0128] Предпочтительный пример осуществления настоящего изобретения заключается в том, что хиральный реагент выбран из одной из формул III-а, III-b, V-a, VIIa, VII-b, IX-a, IX-b, XI-а, ХIII-а и XIII-b:
(S)-2-(метилдифенилсилил)-1-((S)-пирролидин-2-ил)этанол (III-a)
(R)-2-(метилдифенилсилил)-1-((R)-1-пирролидин-2-ил)этанол (III-b)
(S)-2-(триметилсилил)-1-((S)-1-пирролидин-2-ил)этанол (V-a)
(R)-2,2-дифенил-1-((S)-пирролидин-2-ил)этанол (VII-a)
(S)-2,2-дифенил-1-((R)-пирролидин-2-ил)этанол (VII-b)
(R)-2-(4-нитрофенил)-1-((S)-пирролидин-2-ил)этанол (IX-a)
(S)-2-(4-нитрофенил)-1-((R)-пирролидин-2-ил)этанол (IX-b)
(R)-(9H-флуорен-9-ил)((S)-пирролидин-2-ил)метанол (XI-a)
(S)-2-тозил-1-((S)-1-тритилпирролидин-2-ил)этанол (XIII-a)
(R)-2-тозил-1-((R)-1-тритилпирролидин-2-ил)этанол (XIII-b)
[0129] Хиральный реагент вступает в реакцию с нуклеиновой кислотой или модифицированной нуклеиновой кислотой, образуя асимметричную вспомогательную группу. Производное нуклеозид 3'-фосфорамидита, представляющее собой промежуточное соединение при изготовлении стереоконтролируемого модифицированного атомом фосфора производного олигонуклеотидов, получают путем проведения реакции хирального реагента с нуклеиновой кислотой или модифицированной нуклеиновой кислотой.
[0130] Второй аспект настоящего изобретения относится к производному нуклеозид 3'-фосфорамидита, представленному формулой (Va) или (Vb). Соединения формул (Va) и (Vb) известны как мономеры, используемые при синтезировании производных олигонуклеотидов. Указанные соединения также известны как мономеры оксазафосфолидина. Сахарные фрагменты указанных соединений, представленные формулой (Vb), известны как BNA, так и LNA (где R3 представляет собой метиленовую группу).
[0131]

[0132] В формуле (Va) и (Vb) G1-G4 имеют вышеуказанные значения, G5 представляет собой защитную группу гидроксильной группы, и Bs представляет собой группу, выбранную из групп, представленных формулами (VI)-(XI), или их производные.
[0133]

[0134] Примеры Bs включают аденин, тимин, цитозин, гуанин, урацил, 5-метилцитозин или их производные.
[0135] R2 представляет собой водород, -OH, -SH, -NRdRd, -N3, галоген, алкил, алкенил, алкинил, алкил-Y1-, алкенил-Y1-, алкинил-Y1-, арил-Y1-, гетероарил-Y1-, -ORb или -SRb, в которых Rb представляет собой блокирующий фрагмент.
Y1 представляет собой О, NRd, S или Se.
Rd независимо представляет собой водород, алкил, алкенил, алкинил, арил, ацил, замещенный силил, карбамат, -P(O)(Re)2 или -HP(O)(Re).
Re независимо представляет собой водород, алкил, арил, алкенил, алкинил, алкил-Y2-, алкенил-Y2-, алкинил-Y2-, арил-Y2- или гетероарил-Y2- или катион, который представляет собой Na+, Li+ или K+.
Y2 представляет собой O, NRd или S.
Предпочтительные примеры алкила включают C1-10 алкильную группу, предпочтительные примеры алкенила включают С2-10 алкенильную группу, предпочтительные примеры алкинила включают С2-10 алкинильную группу, предпочтительные примеры арила включают С6-14 арильную группу, и предпочтительные примеры гетероарила включают С6-14 гетероарильную группу.
[0136] R3 обозначает группу, представленную -CH2-, -(CH2)2-, -CH2NH- или -CH2N(CH3)-.
[0137] Примеры G5 включают тритил, 4-монометокситритил, 4,4'-диметокситритил, 4,4',4''-триметокситритил, 9-фенилксантин-9-ил (пиксил) и 9-(р-метоксифенил)ксантин-9-ил (МОХ).
[0138] Bs представляет собой аденин, тимин, цитозин, гуанин или их производные. Bs представляет собой нуклеиновое основание или модифицированное нуклеиновое основание. Примеры производных являются примерами, раскрытыми в патенте JP 2005-89441 A, и представлены ниже.
[0139]

[0140] В вышеприведенной формуле каждый из R8-R10 независимо представляет собой С1-10 алкил, С6-С10 арил, С6-С10 араркил или С6-С10 арилоксиалкил. Предпочтительные примеры R8 включают метил, изопропил, фенил, бензил и феноксиметил. Предпочтительные примеры R9 и R10 включают C1-4 алкильную группу.
[0141] Предпочтительный пример осуществления второго аспекта настоящего изобретения заключается в том, что производное нуклеозид 3'-фосфорамидита представлено формулой (Va') или (Vb').
[0142]

[0143] В формуле (Va') и (Vb') G1, G2, G5, Bs, R2 и R3 имеют вышеуказанные значения. Производное нуклеозид 3'-фосфорамидита является хиральным мономером, используемым для изготовления стереоконтролируемых модифицированных атомом фосфора производных нуклеотидов и производных олигонуклеотидов.
[0144] Предпочтительные примеры производных нуклеозид 3'-фосфорамидита представлены формулами 1a, 1b, 2а, 2b, 3а, 3b, 4а, 4b, 5а, 5b, 6а, 6b, 7а, 7b, 8а, 8b, 9а, 9b, 10а, 10b, 11а, 11b, 12а, 12b, 13а, 13b, 14а, 14b, 15а, 15b, 16а, 16b, 17а, 17b, 18а, 18b, 19а, 19b, 20а, 20b, 21а, 21b, 22а, 22b, 23а, 23b или 24а. Описание указанных формул приведено в Экспериментальном разделе.
[0145] DMTr представляет 4,4'-диметокситритильную группу, и ТОМ представляет триизопропилсилоксиметильную группу.
[0146] Примеры использования производного нуклеозид 3'-фосфорамидита раскрыты, например, в патенте JP 2005-89441 А. При повторении стадий конденсации и снятия защиты обеспечивается удлинение цепи производных олигонуклеотидов, как раскрыто в настоящем документе.
[0147] Формула такого производного олигонуклеотида приведена в формуле (X).
[0148]

[0149] В формуле (X), X представляет сульфид (=S), С1-3 алкил, C1-3 алкокси, C1-3 алкилтио, C6-C10 арил, C6-C10 араркил или C6-C10 арилоксиалкил. X предпочтительно представляет сульфид (=S). "n" является целым числом от 1 до 150, от 1 до 100, от 1 до 50 или от 1 до 30. "n" может предпочтительно являться целым числом от 2 до 100, предпочтительно от 10 до 100, предпочтительно от 10 до 50 и более предпочтительно от 15 до 30.
[0150] Третий аспект настоящего изобретения относится к способу для проведения синтеза стереоконтролируемого модифицированного атомом фосфора производного олигонуклеотидов. Первая стадия представляет собой стадию реакции молекулы, содержащей ахиральный Н-фосфонатный фрагмент, с первым активизирующим реагентом и хиральным реагентом или его солью с образованием мономера. Хиральный реагент имеет химическую формулу (I) или (I'), и мономер может быть представлен формулами (Va), (Vb), (Va') или (Vb'). Мономер реагирует со вторым активизирующим реагентом и нуклеозидом с образованием конденсированного промежуточного соединения. Следующая стадия представляет собой стадию преобразования конденсированного промежуточного соединения в нуклеиновую кислоту, включающую хиральный Х-фосфонатный фрагмент. Способ в целом основан на его раскрытии в заявке WO 2010/064146. В частности, основные стадии раскрыты в ней как путь A и как путь В. В данном способе используют хиральный реагент настоящего изобретения.
[0151] Первая схема относится к синтезу хиральных олиго.
[0152]

[0153] Стадия активизирования
Ахиральный Н-фосфонатный фрагмент обрабатывают первым активизирующим реагентом для формирования первого промежуточного соединения. В одном примере осуществления настоящего изобретения первый активизирующий реагент добавляют к реакционной смеси на стадии конденсирования. Использование первого активизирующего реагента зависит от условий реакции, то есть от используемых растворителей для проведения реакции. Примеры первого активизирующего реагента включают фосген, трихлорметил хлорформат, бис(трихлорметил)карбонат (ВТС), оксалилхлорид, Ph3PCl2, (PhO)3PCl2, N,N'-бис(2-оксо-3-оксазолидинил)фосфиновый хлорид (ВорCl), 1,3-диметил-2-(3-нитро-1,2,4-триазол-1-ил)-2-пирролидин-1-ил-1,3,2-диазафосфолидиний гексафторфосфат (MNTP) или 3-нитро-1,2,4-триазол-1-ил-tris(пирролидин-1-ил)фосфоний гексафторфосфат (PyNTP).
[0154] Пример ахирального Н-фосфонатного фрагмента включает соединение, показанное в вышеприведенной схеме. DBU представляет 1,8-диазабицикло[5.4.0]ундец-7-ен. H+DBU может представлять собой, например, ион аммония, ион алкиламмония, гетероароматический ион имминия или гетероциклический ион имминия, любой из которых является первичным, вторичным, третичным или четвертичным, либо моновалентным ионом металла.
[0155] Реакция с хиральным реагентом
После первой стадии активизирования активизированный ахиральный Н-фосфонатный фрагмент реагирует с хиральным реагентом, представленным формулой (I) или (I'), с образованием хирального промежуточного соединения, представленного формулой (Va), (Vb), (Va') или (Vb').
[0156] Стадия стереоспецифического конденсирования
Хиральное промежуточное соединение, представленное формулой Va ((Vb), (Va') или (Vb')), обрабатывают вторым активизирующим реагентом и нуклеозидом с образованием конденсированного промежуточного соединения. Нуклеозид может быть отвержден. Примеры второго активизирующего реагента включают 4,5-дицианоимидазол (DCI), 4,5-дихлороимидазол, 1-фенилимидазолий трифлат (PhIMT), бензимидазолий трифлат (BIT), бензтриазоле, 3-нитро-1,2,4-триазоле (NT), тетразол, 5-этилатиотетразол (ЕТТ), 5-бензилтиотетразол (ВТТ), 5-(4-нитрофенил)тетразол, N-цианометилпирролидиний трифлат (СМРТ), N-цианометилпиперидиний трифлат, N-цианометилдиметиламмония трифлат. Хиральное промежуточное соединение, представленное формулой Va ((Vb), (Va') или (Vb')), может быть выделено в виде мономера. Как правило, хиральное промежуточное соединение, представленное формулой Va ((Vb), (Va') или (Vb')), не выделяют, и оно вступает в реакцию в том же самом сосуде с нуклеозидом или модифицированным нуклеозидом с образованием хирального фосфитного соединения, т.е. конденсированного промежуточного соединения. В других примерах осуществления настоящего изобретения, в том случае, когда способ осуществляют на основе твредофазного синтеза, твердую подложку, включающую соединение, отфильтровывают от побочных продуктов, примесей и (или) реагентов.
[0157] Стадия блокирования
Если предельная нуклеиновая кислота превышает димер, непрореагировавший -OH фрагмент блокируют блокирующей группой, и хиральный вспомогательный элемент в соединении также может быть блокирован блокирующей группой с образованием блокированного конденсированного промежуточного соединения. Если предельная нуклеиновая кислота равна димеру, то в этом случае отсутствует необходимость в стадии блокирования.
[0158] Стадия модифицирования
Соединение модифицируют путем проведения реакции с электрофилом. Блокированное конденсированное промежуточное соединение может быть получено на стадии модифицирования. В ряде примеров осуществления способа настоящего изобретения стадию модифицирования проводят с использованием серного электрофила, селенового электрофила или борирующего агента. Предпочтительные примеры стадии модифицирования включают стадию оксидирования и сульфуризации.
[0159] В ряде примеров осуществления способа настоящего изобретения серный электрофил является соединением, имеющим одну из нижеприведенных формул:
S8 (формула В), Z1-S-S-Z2 или Z1-S-V-Z2.
[0160] Z1 и Z2 независимо представляют собой алкил, аминоалкил, циклоалкил, гетероцикл, циклоалкилалкил, гетероциклоалкил, арил, гетероарил, алкилокси, арилокси, гетероарилокси, ацил, амид, имид или тиокарбонил или Z1 и Z2, взятые вместе, образуют 3-8-членное алициклическое или гетероциклическое кольцо, которое может быть замещенным или незамещенным; V представляет собой SO2, О или NRf; и Rf представляет собой водород, алкил, алкенил, алкинил или арил.
[0161] В ряде примеров осуществления способа настоящего изобретения серный электрофил является соединением, имеющим нижеприведенную формулу A, В, С, D, Е или F:

[0162] В ряде примеров осуществления способа настоящего изобретения селеновый электрофил является соединением, имеющим одну из нижеприведенных формул:
[0163] Se (формула G), Z3-Se-Se-Z4 или Z3-Se-V-Z4
[0164] Z3 и Z4 независимо представляют собой алкил, аминоалкил, циклоалкил, гетероцикл, циклоалкилалкил, гетероциклоалкил, арил, гетероарил, алкилокси, арилокси, гетероарилокси, ацил, амид, имид или тиокарбонил или Z3 и Z4, взятые вместе, образуют 3-8-членное алициклическое или гетероциклическое кольцо, которое может быть замещенным или незамещенным; V представляет собой SO2, S, О или NRf; и Rf представляет собой водород, алкил, алкенил, алкинил или арил.
[0165] В ряде примеров осуществления способа настоящего изобретения селеновый электрофил является соединением, имеющим одну из нижеприведенных формул Г, Н, I, J, K или L.

[0166] В ряде примеров осуществления способа настоящего изобретения борирующим агентом является боран-N,N-диизопропилэтиламин (ВН3 DIPEA), боран-пиридин(ВН3 Ру), боран-2-хлорпиридин (ВН3 СРу), боран-анилин (ВН3 An), боран-тетрагидрофииран (ВН3 ТГФ) или боран-диметилсульфид (ВН3 Me2S).
[0167] В ряде примеров осуществления способа настоящего изобретения стадия модифицирования является стадией окисления. Стадия окисления раскрыта в, например, JP 2010-265304 A и WO 2010/064146.
[0168] Цикл удлинения цепи и стадия снятия защиты
Блокированное конденсированное промежуточное соединение деблокируется для удаления блокирующей группы на 5'-конце растущей цепи нуклеиновой кислоты для создания соединения. Соединение опционально повторно вступает в цикл удлинения цепи с образованием конденсированного промежуточного соединения, блокированного конденсированного промежуточного соединения, модифицированного блокированного конденсированного промежуточного соединения и 5'-незащищенного модифицированного блокированного промежуточного соединения. После завершения, как минимум, одного очередного цикла удлинения цепи 5'-незащищенное модифицированное блокированное промежуточное соединение далее деблокируется путем удаления хирального вспомогательного лиганда и других защитных групп, например, групп нуклеиновых оснований, модифицированных нуклеиновых оснований, защитных групп сахара и модифицированного сахара для получения нуклеиновой кислоты. В других примерах осуществления настоящего изобретения нуклеозид, содержащий 5'-OH фрагмент представляет собой промежуточное соединение из предыдущего цикла удлинения цепи, как описано в настоящем документе. В других примерах осуществления настоящего изобретения нуклеозид, содержащий 5'-OH фрагмент представляет собой промежуточное соединение, полученное с использованием другого известного способа синтеза нуклеиновых кислот. В примерах осуществления настоящего изобретения, в которых используется твердая подложка, модифицированную атомом фосфора нуклеиновую кислоту далее отделяют от твердой подложки. В некоторых примерах осуществления настоящего изобретения нуклеиновые кислоты остаются присоединенными к твердой подложке для их очистки и затем отделяют от твердой подложки с последующей очисткой.
[0169] На основе настоящего способа существует возможность использовать стойкие и коммерчески доступные материалы в качестве исходных материалов. Существует возможность изготавливать стереоконтролируемые модифицированные атомом фосфора производные олигонуклеотидов с использованием ахирального исходного материала.
[0170] Как показано в рабочем примере, способ настоящего изобретения не вызывает деградацию на стадиях снятия защиты. Кроме того, для осуществления способа не требуются специальные блокирующие агенты для поучения модифицированных атомом фосфора производных олигонуклеотидов.
[0171] Четвертый аспект настоящего изобретения относится к способу синтезирования стереоконтролируемых модифицированных атомом фосфора производных олигонуклеотидов с использованием хирального мономера. Первая стадия включает проведение реакции производного нуклеозид 3'-фосфорамидита, представленного формулой (Va), (Vb), (Va') или (Vb'), со вторым активизирующим реагентом и нуклеозидом с образованием конденсированного промежуточного соединения. Вторая стадия заключается в преобразовании конденсированного промежуточного соединения в нуклеиновую кислоту, включающую хиральный Н-фосфонатный фрагмент.
[0172] Вторая схема относится к синтезу хиральных олиго с использованием мономера, представленного формулой Va ((Vb), (Va') или (Vb')). Вторая схема основана на способе, раскрытом в JP 2005-89441 А.
[0173]

[0174] Конкретные условия вышеприведенной схемы аналогичны условиям первой схемы. Исходный материал, представленный формулой Va (Vb), в частности, представленный формулой Va' (или Vb'), является химически устойчивым. Как показано в рабочем примере, способ настоящего изобретения не вызывает деградацию на стадиях снятия защиты. Кроме того, для осуществления способа не требуются специальные блокирующие агенты для поучения модифицированных атомом фосфора производных олигонуклеотидов.
[0175] Механизм удаления вспомогательных элементов приведен ниже:
[0176]

[0177] В вышеприведенной схеме Nu обозначает нуклеофил. Предполагается, что вышеприведенный механизм отличается от предыдущего механизма, предназначенного для удаления вспомогательных элементов.
ПРИМЕРЫ
[0178]
Abbreviation
ас: acet
bz: бензоил
CSO: (1S)-(+)-(10-камфорсульфонил)оксазиридин
DBU: 1,8-диазабицикло[5.4.0]ундец-7-ен
DCA: дихлоруксусная кислота
DCM: дихлорметан, CH2Cl2
DMTr: 4,4'-диметокситритил
Tr: тритил, трифенилметил
Melm: N-метилимидазол
NIS: N-йодсукцинимид
рас: феноксиацетил
Ph: фенильная
PhIMT: N-фенилимидазолий трифлат
POS: 3-фенил-1,2,4-дитиазолин-5-он
TBS: tert-бутиладиметилсилил
TBDPS: tert-бутилдифенилсилил
ТОМ: триизопропилсилоксиметил
TFA: трифторуксусная кислота
Пример 1
[0179] (S)-1-тритилпирролидин-2-карбальдегид (I-а).

Соединение I-а было синтезировано из L-пролин в соответствии со способом, описание которого приведено в литературе (Guga, P. Curr. Top. Med. Chem. 2007, 7, 695-713.).
Пример 2
[0180] (R)-1-тритилпирролидин-2-карбальдегид (I-b).
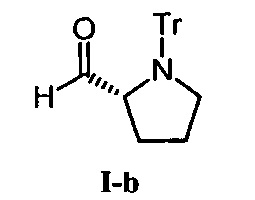
Соединение I-b было синтезировано из D-пролин аналогично получению соединения I-а.
Пример 3
[0181] (S)-2-(метилдифенилсилил)-1-((S)-1-тритилпирролидин-2-ил)этанол (II-а).

К раствору метилдифенилсилилметил магний хлорида в ТГФ, приготовленному из хлорметилдифенилметилсилана (4,02 г, 16,3 ммоль) и магния (402 мг, 16,3 ммоль) в ТГФ (14 мл), добавляли I-а (2,79 г, 8, 14 ммоль) в растворе ТГФ (30 мл) при охлаждении льдом. После перемешивания в течение 1,5 часа при охлаждении льдом, смесь нагревали до комнатной температуры и продолжали перемешивание в течение 30 минут. Насыщенный водный раствор NH4Cl (100 мл) добавляли к реакционной смеси при 0 градусов C, и экстрагирование проводили диэтиловым эфиром (100 мл) три раза. Комбинированный экстракт высушивали над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток хроматографировали на силикагеле и получали II-а в виде бесцветной пены (3,91 г, 87%).
1Н NMR (300 MHz, CDCl3) δ 7.48-7.08 (25Н, m), 4.33-4.23 (1Н, m), 3.16-2.89 (3H, m), 2.84 (1H, brs), 1.70-1.54 (1H, m), 1.35 (1H, dd, J=14.7, 6.3 Hz), 1.10 (1H, dd, J=14.7, 8.1 Hz), 1.18-1.05 (1H, m), 1.04-0.90 (1H, m), 0.34 (3H, s), -0.17- -0.36 (1H, m).
Пример 4
[0182] (S)-2(метилдифенилсилил)-1-((S)-пирролидин-2-ил)этанол (III-а).

II-а (3,91 г, 7,06 ммоль) растворяли в 3% DCА в DCM (70 мл) и перемешивали в течение 10 минут при комнатной температуре. К смеси добавляли 1 М NaOH (200 мл) и экстрагирование проводили DCM (100 мл) три раза. Комбинированный экстракт высушивали над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток хроматографировали на силикагеле и получали III-а в виде масла светло-желтого цвета (1,99 г, 90%).
1Н NMR (300 MHz, CDCl3) δ 7.57-7.52 (5Н, m), 7.38-7.33 (5Н, m), 3.77 (1H, ddd, J=8.9, 5.4, 3.5 Hz), 3.01 (1Н, dt, J=7.4, 3.6Hz), 2.97-2.79 (2H, m), 2.27 (2H, brs), 1.76-1.53 (4H, m), 1.38 (1H, dd, J=15.0, 9.0 Hz), 1.24 (1H, dd, J=15.0, 5.4 Hz), 0.65 (3H, s);13C NMR (100.4 MHz, CDCl3) δ 137.4, 137.1, 134.6, 134.5, 129.1, 127.8, 69.5, 64.1, 47.0, 25.8, 24.0, 19.6, -3.4. MALDI TOF-MS m/z рассчитано для C19H26NOSi [M+H]+ 312.18, обнаружено 312.06.
Пример 5
[0183] (R)-2-(метилдифенилсилил)-1-((R)-1-тритилпирролидин-2-ил)этанол (II-b).
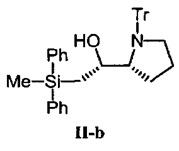
Соединение II-b было получено с использованием I-b вместо I-а аналогично получению соединения II-а.
1Н NMR (300 MHz, CDCl3) δ 7.48-7.12 (25Н, m), 4.33-4.24 (1Н, m), 3.16-2.89 (3H, m), 2.86 (1H, brs), 1.69-1.52 (1H, m), 1.35 (1H, dd, J=14.4, 6.0 Hz), 1.10 (1H, dd, J=14.4, 8.4 Hz), 1.18-1.05 (1H, m), 1.03-0.89 (1H, m), 0.33 (3H, s), -0.19- -0.39 (1H, m);13C NMR (75.5 MHz, CDCl3) δ 144.5, 137.5, 136.8, 134.6, 134.3, 129.8, 129.0, 127.8, 127.7, 127.4, 126.1, 77.9, 71.7, 65.1, 53.5, 25.0, 24.8, 19.6, -4.0. MALDI TOF-MS m/z рассчитано для C38H40NOSi [M+H]+ 554.29, обнаружено 554.09.
Пример 6
[0184] (R)-2-(метилдифенилсилил)-1-((R)-1-пирролидин-2-ил)этанол (III-b).

Соединение III-b было получено с использованием II-b вместо II-а аналогично получению соединения III-а.
1Н NMR (300 MHz, CDCl3) δ 7.58-7.52 (5Н, m), 7.38-7.33 (5Н, m), 3.78 (1Н, ddd, J=9.0, 5.1, 3.6 Hz), 3.00 (1H, dt, J=7.4, 3.3 Hz), 2.97-2.78 (2H, m), 2.19 (2H, brs), 1.76-1.53 (4H, m), 1.38 (1H, dd, J=14.6, 9.0 Hz), 1.24 (1H, dd, J=14.6, 5.1 Hz), 0.66 (3H, s);13C NMR (75.5 MHz, CDCl3) δ 137.5, 137.1, 134.5, 134.4, 129.0, 127.7, 69.2, 64.2, 46.9, 25.8, 24.0, 19.7, -3.4. MALDI TOF-MS m/z рассчитано для C19H26NOSi [M+H]+ 312.18, обнаружено 312.09.
Пример 7
[0185] (S)-2-(триметилсилил)-1-((S)-1-тритилпирролидин-2-ил)этанол (IV-a).
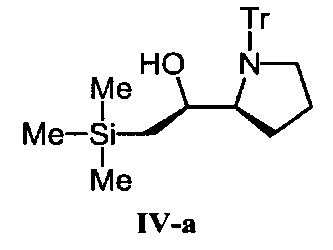
Соединение IV-a было получено с использованием "хлорметилтриметилсилана" вместо "хлорметилдифенилметилсилана" аналогично получению соединения II-а.
1Н NMR (300 MHz, CDCl3) δ 7.58-7.51 (5Н, m), 7.31-7.14 (10Н, m), 4.13 (1H, dt, J=7.5, 3.0 Hz), 3.39-3.31 (1H, m), 3.20-2.99 (2Н, m), 2.84 (1Н, s), 1.74-1.57 (1H, m), 1.29-1.10 (2Н, m), 0.74 (1Н, dd, J=14.4, 7.2 Hz), 0.46 (1Н, dd, J=14.4, 7.2 Hz), -0.15 (9H, s). MALDI TOF-MS m/z рассчитано для C28H36NOSi [M+H]+ 430.26, обнаружено 430.09.
Пример 8
[0186] (S)-2-(триметилсилил)-1-((S)-1-пирролидин-2-ил)этанол (V-a).

Соединение V-a было получено с использованием IV-a вместо II-а аналогично получению соединения III-а.
1Н NMR (300 MHz, CDCl3) δ 3.76 (1H, ddd, J=8.8, 5.7, 3.3 Hz), 3.08 (1H, dt, J=7.8, 3.3 Hz), 3.02-2.87 (2H, m), 2.48 (2H, brs), 1.81-1.58 (4H, m), 0.83 (1H, dd, J=14.7, 8.7 Hz), 0.68 (1H, dd, J=14.7, 6.0 Hz), 0.05 (9H, s);13C NMR (75.5 MHz, CDCl3) δ 69.6, 64.3, 46.9, 25.8, 23.9, 22.0, -0.8. MALDI TOF-MS m/z рассчитано для C9H22NOSi [M+H]+ 188.15, обнаружено 188.00.
Пример 9
[0187] (R)-2,2-дифенил-1-((S)-1-тритилпирролидин-2-ил)этанол (VI-a).
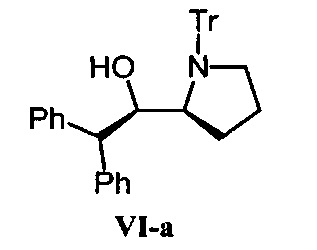
К раствору дифенилметана (6,7 мл, 40 ммоль) в ангидридном ТГФ (36 мл), добавляли по каплям при комнатной температуре n-BuLi (1,67 М раствор гексана, 24 мл, 40 ммоль) и перемешивали в течение 1 часа. К смеси медленно добавляли при 0 градусов C соединение I-a (3,41 г, 10 ммоль) в ангидридном растворе ТГФ (40 мл), которое высушивали путем повторного соиспарения в толуоле, и продолжали перемешивание в течение 45 минут. Затем добавляли насыщенный водный раствор NH4Cl (100 мл) и Et2O (100 мл), отделяли органический слой, и водный слой экстрагировали Et2O (2×100 мл). Органический слой комбинировали, высушивали над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали методом хроматографии на силикагеле и получали VI-a (1,41 г, 28%) в виде пены белого цвета.
1Н NMR (300 MHz, CDCl3) δ 7.45-7.01 (23Н, m), 6.67-6.61 (2Н, m), 4.80 (1Н, d, J=10.8 Hz), 3.63 (1H, d, J=10.8 Hz), 3.36-3.27 (1H, m), 3.23-3.09 (1H, m), 3.02-2.89 (1H, m), 2.66 (1H, s), 1.90-1.75 (1H, m), 1.32-1.04 (2H, m), 0- -0.18 (1H, m).
Пример 10
[0188] (R)-2,2-дифенил-1-((S)-пирролидин-2-ил)этанол (VII-a).

Соединение VII-a было получено с использованием VI-a вместо II-а аналогично получению соединения III-а.
1Н NMR (300 MHz, CDCl3) δ 7.44-7.38 (2Н, m), 7.33-7.14 (8Н, m), 4.46 (1Н, dd, J=9.9, 3.3 Hz), 3.91 (1H, d, J=9.9 Hz), 3.02-2.88 (2H, m), 2.81-2.69 (1H, m), 2.52 (2H, brs), 1.88-1.56 (4H, m);13C NMR (75.5 MHz, CDCl3) δ 142.3, 142.0, 128.6, 128.5, 128.4, 128.2, 126.5, 126.4, 73.5, 60.1, 55.8, 46.6, 25.8, 23.4. MALDI TOF-MS m/z рассчитано для C18H22NO [M+H]+ 268.17, обнаружено 268.06.
Пример 11
[0189] (S)-2,2-дифенил-1-((R)-1-тритилпирролидин-2-ил)этанол (VI-b).

Соединение VI-b было получено с использованием I-b вместо I-а аналогично получению соединения VI-a.
1Н NMR (300 MHz, CDCl3) δ 7.44-7.37 (6Н, m), 7.30-7.01 (17Н, m), 6.66-6.61 (2Н, m), 4.80 (1H, d, J=10.8 Hz), 3.63 (1H, d, J=10.8 Hz), 3.36-3.28 (1H, m), 3.22-3.09 (1H, m), 3.01-2.89 (1H, m), 2.66 (1H, s), 1.90-1.75 (1H, m), 1.29-1.04 (2H, m), 0.00--0.19 (1H, m);13C NMR (75.5 MHz, CDCl3) δ 144.2, 142.9, 141.6, 130.0, 128.5, 128.4, 127.9, 127.8, 127.4, 126.4, 126.2, 77.9, 75.9, 61.9, 55.4, 53.4, 24.7, 24.5. MALDI TOF-MS m/z рассчитано для C37H36NO [M+H]+ 510.28, обнаружено 510.11.
Пример 12
[0190] (S)-2,2-дифенил-1-((R)-пирролидин-2-ил)этанол (VII-b).

Соединение VII-b было получено с использованием VI-b вместо VI-а аналогично получению соединения VII-a.
lH NMR (300 MHz, CDCl3) δ 7.45-7.14 (10Н, m), 4.45 (1H, dd, J=9.9, 3.3 Hz), 3.91 (1H, d, J=9.9 Hz), 3.00-2.89 (2H, m), 2.82-2.71 (1H, m), 2.40 (2H, brs), 1.87-1.55 (4H, m);13C NMR (75.5 MHz, CDCl3) δ 142.3, 142.0, 128.5, 128.3, 128.1, 126.3, 126.2, 73.4, 60.1, 55.9, 46.5, 25.8, 23.5. MALDI TOF-MS m/z рассчитано для C18H22NO [M+H]+ 268.17, обнаружено 268.03.
Пример 13
[0191] (R)-2-(4-нитрофенил)-1-((S)-1-тритилпирролидин-2-ил)этанол (VIII-a).

Соединение VIII-a было получено с использованием "4-нитробензилхлорида" вместо "дифенилметана" аналогично получению соединения VI-а.
1Н NMR (300 MHz, CDCl3) δ 8.09-8.03 (2Н, m), 7.49-7.43 (6Н, m), 7.28-7.09 (11H, m), 4.23 (1Н, ddd, J=8.3, 5.6, 3.0 Hz), 3.43-3.33 (1Н, m), 3.23-3.11 (1H, m), 3.07-2.96 (1H, m), 2.83 (1H, brs), 2.74 (1H, dd, J=13.8, 8.4 Hz), 2.49 (1H, dd, J=13.8, 5.1 Hz), 1.83-1.67 (1H, m), 1.41-1.17 (2H, m), 0.27-0.08 (1H, m);13C NMR (75.5 MHz, CDCl3) δ 147.3, 146.3, 144.3, 129.8, 129.6, 127.5, 126.3, 123.4, 77.9, 74.8, 63.5, 53.2, 39.5, 25.0, 24.9. MALDI TOF-MS m/z рассчитано для C31H31N2O3 [M+H]+ 479.23, обнаружено 479.08.
Пример 14
[0192] (R)-2-(4-нитрофенил)-1-((S)-пирролидин-2-ил)этанол (IX-a).

Соединение IX-a было получено с использованием VIII-а вместо VI-а аналогично получению соединения VII-a.
1Н NMR (300 MHz, CDCl3) δ 8.15 (2Н, d, J=8.7 Hz), 7.42 (2Н, d, J=8.7 Hz), 3.86-3.79 (1H, m), 3.16-3.07 (1H, m), 2.99-2.68 (6H, m), 1.84-1.68 (4H, m);13C NMR (75.5 MHz, CDCl3) δ 147.4, 146.2, 129.9, 123.2, 72.4, 62.0, 46.6, 40.4, 25.7, 24.4. MALDI TOF-MS m/z рассчитано для C12H17N2O3 [M+H]+ 237.12, обнаружено 237.01.
Пример 15
[0193]] (S)-2-(4-нитрофенил)-1-((R)-1-тритилпирролидин-2-ил)этанол (VIII-b).

Соединение VIII-b было получено с использованием I-b вместо I-а аналогично получению соединения VIII-а.
1Н NMR (300 MHz, CDCl3) δ 8.09-8.04 (2Н, m), 7.49-7.43 (6Н, m), 7.28-7.09 (11Н, m), 4.22 (1Н, ddd, J=8.4, 5.6, 3.0 Hz), 3.43-3.33 (1H, m), 3.24-3.10 (1H, m), 3.08-2.94 (1H, m), 2.81 (1H, brs), 2.75 (1H, dd, J=14.0, 8.1 Hz), 2.49 (1H, dd, J=14.0, 5.1 Hz), 1.81-1.67 (1H, m), 1.40-1.16 (2H, m), 0.26-0.09 (1H, m);13C NMR (75.5 MHz, CDCl3) δ 147.3, 144.3, 129.8, 129.6, 129.4, 126.3, 123.5, 77.9, 74.8, 63.5, 53.2, 39.5, 25.0, 24.9. MALDI TOF-MS m/z рассчитано для C31H31N2O3 [M+H]+ 479.23, обнаружено 479.08.
Пример 16
[0194]] (S)-2-(4-нитрофенил)-1-((R)-пирролидин-2-ил)этанол (IX-b).

Соединение IX-b было получено с использованием VIII-b вместо VIH-a аналогично получению соединения IX-a.
1Н NMR (300 MHz, CDCl3) δ 8.19-8.13 (2Н, m), 7.45-7.39 (2Н, m), 3.83 (1H, ddd, J=7.7, 5.4, 3.9 Hz), 3.14 (1H, dt, J=7.7, 3.9 Hz), 3.01-2.87 (2H, m), 2.83 (1H, d, J=3.3 Hz), 2.81 (1H, s), 2.62 (2H, brs), 1.79-1.72 (4H, m);13C NMR (75.5 MHz, CDCl3) δ 147.3, 146.5, 130.0, 123.5, 72.7, 61.7, 46.7, 40.1, 25.8, 24.2. MALDI TOF-MS m/z рассчитано для C12H17N2O3 [M+H]+ 237.12, обнаружено 237.02.
Пример 17
[0195] (R)-(9Н-флуорен-9-ил)((S)-1-тритилпирролидин-2-ил)метанол (Х-а).

Соединение Х-а было получено с использованием "флуорена" вместо "дифенилметана" аналогично получению соединения VI-a.
1Н NMR (300 MHz, CDCl3) δ 7.70 (1H, d, J=7.5 Hz), 7.66 (1Н, d, J=7.8 Hz), 7.55 (2H, d, J=7.5 Hz), 7.44-7.09 (18H, m), 6.87-6.62 (1H, m), 4.55-4.48 (1H, m), 4.06 (1H, d, J=7.5 Hz), 3.43-3.34 (1H, m), 3.18-3.06 (1H, m), 2.98-2.88 (1H, m), 2.85 (1H, brs), 1.42-1.24 (1H, m), 1.18-1.04 (1H, m), 0.53-0.39 (1H, m), -0.02- -0.20 (1H, m); MALDI TOF-MS m/z рассчитано для C37H34NO [M+H]+ 508.26, обнаружено 508.12.
Пример 18
[0196] (R)-(9Н-флуорен-9-ил)((S)-пирролидин-2-ил метанол (ХI-а).

Соединение XI-а было получено с использованием Х-а вместо II-а аналогично получению соединения III-а.
1Н NMR (300 MHz, CDCl3) δ 7.76 (2Н, d, J=7.5 Hz), 7.68 (2Н, t, J=8.0 Hz), 7.43-7.35 (2H, m), 7.34-7.25 (2H, m), 4.28 (1H, d, J=6.3 Hz), 4.03 (1H, dd, J=6.5, 4.2 Hz), 3.19-3.11 (1H, m), 2.97-2.88 (1Н, m), 2.86-2.76 (1H, m), 2.02 (2H, brs), 1.77-1.53 (3H, m), 1.38-1.23 (1H, m); MALDI TOF-MS m/z рассчитано для C18H20NO [M+H]+ 266.15, обнаружено 266.04.
Пример 19
[0197] (S)-2-тозил-1-((S)-1-тритилпирролидин-2-ил)этанол (ХII-а).
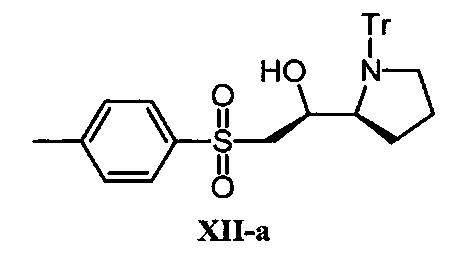
Соединение ХII-а было получено с использованием "хлорметил р-толил сульфона" вместо "хлорметилдифенилметилсилана" аналогично получению соединения II-а.
1Н NMR (600 MHz, CDCl3) δ 7.66 (2Н, d, J=8.4 Hz), 7.48-7.44 (6Н, m), 7.35 (2Н, d, J=7.2 Hz), 7.21-7.13 (9H, m), 4.39-4.36 (1H, m), 3.33 (1H, s), 3.24-3.20 (1H, m), 3.19-3.10 (2H, m), 2.98-2.92 (2H, m), 2.49 (3H, s), 1.55-1.49 (1H, m), 1.33-1.26 (1H, m), 1.12-1.04 (1H, m), 0.22-0.14 (1H, m);13C NMR (150.9 MHz, CDCl3) δ 144.6, 144.5, 136.3, 129.9, 129.5, 128.1, 127.5, 126.2, 78.0, 69.1, 63.9, 60.2, 52.6, 25.5, 24.7, 21.7.
Пример 20
[0198] (S)-2-тозил-1-((S)-1-тритилпирролидин-2-ил)этанол (ХIII-а).

Соединение ХIII-а было получено с использованием ХII-а вместо II-а аналогично получению соединения III-а.
1Н NMR (600 MHz, CDCl3) δ 7.82 (2Н, d, J=8.4 Hz), 7.37 (2Н, d, J=8.4 Hz), 4.01 (1H, ddd, J=12.0, 5.1, 3.0 Hz), 3.32 (1H, dd, J=14.4, 3.0 Hz), 3.25 (1H, dd, J=14.4, 9.0 Hz), 3.16 (1H, dt, J=7.8, 5.1 Hz), 2.90-2.82 (2H, m), 2.46 (3H, s), 2.04 (2H, brs), 1.78-1.63 (3H, m), 1.62-1.55 (1H, m);13C NMR (150.9 MHz, CDCl3) δ 144.5, 136.7, 129.7, 127.7, 67.4, 61.8, 60.1, 46.7, 25.7, 21.4. MALDI TOF-MS m/z рассчитано для C13H20NO3S [M+H]+ 270.12, обнаружено 270.04.
Пример 20а
[0199] (R)-тозил-1-((R)-1-тритилпирролидин-2-ил)этанол (ХII-b).

Соединение XII-b было получено с использованием I-b вместо I-а аналогично получению соединения ХII-а.
1Н NMR (600 MHz, CDCl3) δ 7.66 (2Н, d, J=8.4 Hz), 7.47-7.44 (6Н, m), 7.35 (2Н, d, J=7.8 Hz), 7.21-7.13 (9H, m), 4.37 (1H, dt, J=8.6, 2.4 Hz), 3.33 (1H, s), 3.23-3.20 (1H, m), 3.19-3.12 (2H, m), 2.98-2.92 (2H, m), 2.49 (3H, s), 1.56-1.49 (1H, m), 1.32-1.26 (1H, m), 1.11-1.03 (1H, m), 0.23-0.15 (1H, m);13C NMR (150.9 MHz, CDCl3) δ 144.6, 144.5, 136.3, 129.9, 129.6, 128.1, 127.6, 126.2, 78.0, 69.1, 63.9, 60.2, 52.6, 25.5, 24.7, 21.7.
Пример 21
[0200] (R)-2-тозил-1-((R)-1-тритилпирролидин-2-ил)этанол (XIII-b).

Соединение XIII-b было получено с использованием ХII-b вместо ХII-а аналогично получению соединения ХIII-а.
1Н NMR (600 MHz, CDCl3) δ 7.82 (2Н, d, J=8.4 Hz), 7.37 (2Н, d, J=8.4 Hz), 4.01 (1H, ddd, J=9.0, 5.1, 3.0 Hz), 3.32 (1H, dd, J=14.4, 3.0 Hz), 3.25 (1H, dd, J=14.4, 9.0 Hz), 3.17 (1H, dt, J=7.2, 5.1 Hz), 2.89-2.83 (2H, m), 2.46 (3H, s), 2.04 (2H, brs), 1.79-1.64 (3H, m), 1.62-1.55 (1H, m);l3C NMR (150.9 MHz, CDCl3) δ 144.8, 136.6, 129.8, 127.9, 67.7, 61.8, 60.1, 46.8, 25.9, 25.8, 21.6. MALDI TOF-MS m/z рассчитано для C13H20NO3S [M+H]+ 270.12, обнаружено 270.05.
Пример 22
[0201] Мономер 3а оксазафосфолидина.
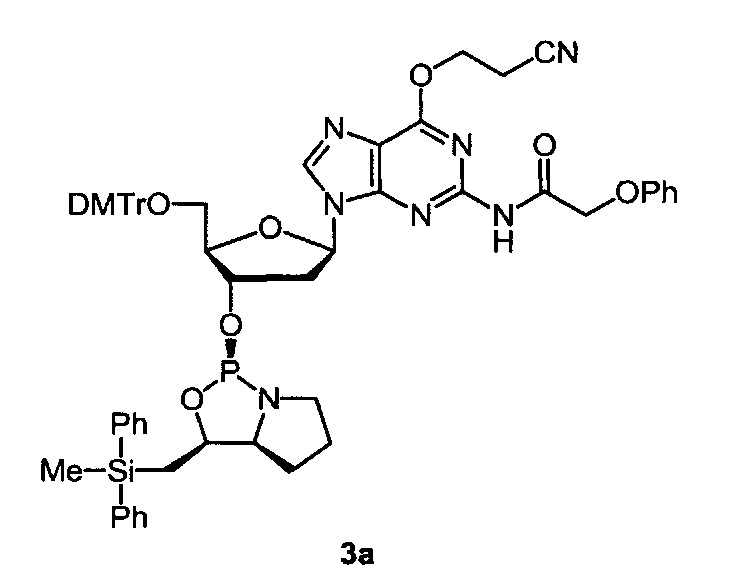
3а (560 мг, 1,80 ммоль) высушивали повторным соиспарением с использованием сухого толуола и и растворяли в сухом диэтиловом эфире (0,90 мл) в атмосфере аргона. К раствору добавляли N-метилморфолин (400 мкл, 3,60 ммоль), и полученный раствор добавляли по каплям к раствору PCl3 (160 мкл, 1,80 ммоль) в сухом диэтиловом эфире (0,90 мл) при 0 градусов C в атмосфере аргона при перемешивании. Затем смесь нагревалась до комнатной температуры, и ее перемешивали в течение 30 минут. Полученный гидрохлорид N-метилморфолина удаляли путем фильтрации в атмосфере азота, фильтрат концентрировали до сухого состояния при пониженном давлении и получали неочищенное производное 2-хлор-1,3,2-оксазафосфолидина. Неочищенные материалы растворяли в свежедистиллированном ТГФ (3,6 мл) для получения растворов 0,5 М, которые использовали для синтезирования нуклеозид 3'-O-оксазафосфолидинов без дальнейшей очистки. 5'-O-(DMTr)-2-N-(феноксиацетил)-6-O-(цианоэтил)гуанозин (636 мг, 0,84 ммоль) высушивали повторным соиспарением с применением сухого толуола и растворяли в свежедистиллированном ТГФ (2,5 мл) в атмосфере аргона. Добавляли Et3N (0,58 мл, 4,2 ммоль), и смесь охлаждали до -78 градусов С. Раствор 0,5 М соответствующего неочищенного производного 2-хлор-1,3,2-оксазафосфолидина в свежедистиллированном ТГФ (3,6 мл, 1,80 ммоль) добавляли по каплям с помощью шприца, и смесь перемешивали в течение 15 минут при комнатной температуре. Затем добавляли насыщенный водный раствор NaНСО3 (70 мл) и СНCl3 (70 мл), отделяли органический слой и промывали насыщенными водными растворами NaHCO3 (2×70 мл). Комбинированные водные слои обратно экстрагировали CHCl3 (70 мл). Органические слои комбинировали, высушивали над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали методом хроматографии на силикагеле и получали 3а (829 мг, 90%) в виде пены белого цвета.
1Н NMR (300 MHz, CDCl3) δ 8.77 (1Н, brs), 7.99 (1Н, s), 7.54-6.98 (24Н, m), 6.81-6.73 (4Н, m), 6.35 (1Н, dd, J=8.0, 6.3 Hz), 4.89-4.73 (4H, m), 4.68 (2H, brs), 4.05-3.98 (1H, m), 3.75 (6H, s), 3.62-3.46 (1H, m), 3.41-3.20 (3H, m), 3.18-3.04 (1H, m), 3.08 (2H, t, J=6.6 Hz), 2.58-2.36 (2H, m), 1.94-1.59 (2H, m), 1.56 (1H, dd, J=15.0, 8.7 Hz), 1.43 (1H, dd, J=15.0, 5.7 Hz), 1.33-1.16 (2H, m), 0.62 (3H, s);31P NMR (121.5 MHz, CDCl3) δ 153.5 (1P, s).
Пример 23
[0202] Мономер 3b оксазафосфолидина.
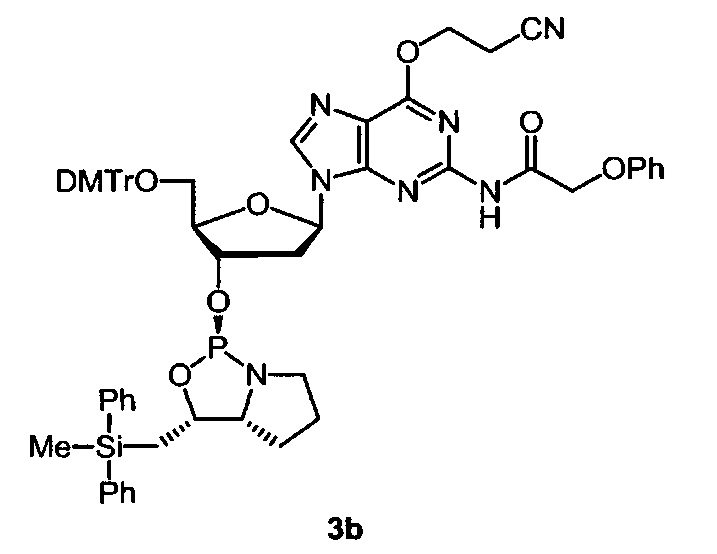
Соединение 3b было получено с использованием III-b вместо III-а аналогично получению соединения 3а.
1Н NMR (300 MHz, CDCl3) δ 8.80 (1H, brs), 7.96 (1H, s), 7.54-6.96 (24Н, m), 6.79-6.71 (4Н, m), 6.19 (1Н, t, J=6.6 Hz), 4.90-4.73 (4H, m), 4.66 (2H, brs), 4.16-4.08 (1H, m), 3.76 (6H, s), 3.60-3.36 (2H, m), 3.29 (1H, d, J=3.9 Hz), 3.27-3.12 (2H, m), 3.09 (2H, t, J=6.6 Hz), 2.59-2.46 (1H, m), 2.07-1.97 (1H, m), 1.94-1.41 (5H, m), 1.36-1.18 (1H, m), 0.65 (3H, s);31P NMR (121.5 MHz, CDCl3) δ 157.1 (1P, s).
Пример 24
[0203] Мономер 1a оксазафосфолидина.

Соединение 1a было получено с использованием "5'-O-(DMTr)-6-N-(бензоил)аденозина" вместо "5'-O-(DMTr)-2-N-(феноксиацетил)-6-O-(цианоэтил)гуанозина" аналогично получению соединения 3а.
1Н NMR (600 MHz, CDCl3) δ 8.71 (1Н, s), 8.12 (1H, s), 8.04 (2Н, d, J=7.8 Hz), 7.62-7.15 (23Н, m), 6.80-6.75 (4H, m), 6.37 (1H, dd, J=7.8, 6.0 Hz), 4.94-4.88 (1H, m), 4.80 (1H, ddd, J=12.0, 6.0, 5.4 Hz), 4.07-4.04 (1H, m), 3.76 (6H, s), 3.58-3.49 (1H, m), 3.41-3.34 (1H, m), 3.33 (1H, dd, J=10.8, 4.8 Hz), 3.25 (1H, dd, J=10.8, 4.8 Hz), 3.13-3.06 (1H, m), 2.66-2.58 (1H, m), 2.40-2.35 (1H, m), 1.91-1.84 (1H, m), 1.73-1.66 (1H, m), 1.56 (1H, dd, J=15.0, 9.0 Hz), 1.44 (1H, dd, J=15.0, 5.4 Hz), 1.47-1.41 (1H, m), 1.30-1.23 (1H, m), 0.63 (3H, s);31P NMR (243.0 MHz, CDCl3) δ 151.8 (1P, s).
Пример 25
[0204] Мономер 1b оксазафосфолидина.

Соединение 1b было получено с использованием III-b вместо III-а аналогично получению соединения 1а.
1H NMR (300 MHz, CDCl3) δ 9.06 (1H, brs), 8.76 (1H, s), 8.12 (1H, s), 8.07-7.99 (2H, m), 7.64-7.14 (22H, m), 6.83-6.75 (4H, m), 6.25 (1H, t, J=6.6 Hz), 4.86-4.75 (2H, m), 4.20-4.15 (1H, m), 3.77 (6H, s), 3.61-3.38 (2H, m), 3.36 (1H, dd, J=10.2, 4.2 Hz), 3.27 (1H, dd, J=10.2, 4.2 Hz), 3.27-3.13 (1H, m), 2.71-2.59 (1H, m), 2.12-2.01 (1H, m), 1.94-1.42 (5H, m), 1.36-1.20 (1H, m), 0.67 (3H, s);31P NMR (121.5 MHz, CDCl3) δ 157.3 (1P, s).
Пример 26
[0205] Мономер 2a оксазафосфолидина.

Соединение 2a было получено с использованием "5'-O-(DMTr)-4-N-(изобутирил)цитидина" вместо "5'-O-(DMTr)-2-N-(феноксиацетил)-6-O-(цианоэтил)гуанозина" аналогично получению соединения 3а.
1Н NMR (300 MHz, CDCl3) δ 8.33 (1H, brs), 8.17 (1Н, d, J=7.5 Hz), 7.52-7.22 (19Н, m), 7.07 (1H, d, J=7.5 Hz), 6.88-6.81 (4H, m), 6.20 (1H, t, J=6.2 Hz), 4.81-4.64 (2H, m), 3.93-3.87 (1H, m), 3.79 (6H, s), 3.59-3.43 (1H, m), 3.39-3.29 (3H, m), 3.16-3.02 (1H, m), 2.69-2.52 (2H, m), 2.12-2.00 (1H, m), 1.91-1.50 (3H, m), 1.47-1.32 (2H, m), 1.27-1.16 (7H, m), 0.60 (3H, s);31P NMR (121.5 MHz, CDCl3) δ 154.8 (1P, s).
Пример 27
[0206] Мономер 2b оксазафосфолидина.

Соединение 2b было получено с использованием III-b вместо III-а аналогично получению соединения 2а.
1Н NMR (300 MHz, CDCl3) δ 8.33 (1Н, d, J=7.5 Hz), 8.23 (1Н, brs), 7.57-7.22 (19Н, m), 7.12 (1H, d, J=7.5 Hz), 6.88-6.81 (4H, m), 6.15 (1H, dd, J=6.6, 4.2 Hz), 4.82-4.63 (2H, m), 4.03-3.97 (1H, m), 3.80 (6H, s), 3.55-3.26 (4H, m), 3.19-3.05 (1H, m), 2.59 (1H, квинтет, J=6.9 Hz), 2.39-2.27 (1H, m), 2.21-2.10 (1H, m), 1.90-1.56 (3H, m), 1.50-1.32 (2H, m), 1.26-1.17 (7H, m), 0.66 (3H, s);31P NMR (121.5 MHz, CDCl3) δ 157.2 (1P, s).
Пример 28
[0207] Мономер 4a оксазафосфолидина.

Соединение 4a было получено с использованием "5'-O-(DMTr)тимидина" вместо "5'-O-(DMTr)-2-N-(феноксиацетил)-6-O-(цианоэтил)гуанозина" аналогично получению соединения 3а.
1Н NMR (300 MHz, CDCl3) δ 7.58-7.23 (21Н, m), 6.86-6.79 (4Н, m), 6.35 (1Н, dd, J=8.1, 5.7 Hz), 4.79-4.67 (2H, m), 3.83-3.78 (1H, m), 3.78 (6H, s), 3.59-3.43 (1H, m), 3.34 (1H, dd, J=10.5, 2.4 Hz), 3.35-3.24 (1H, m), 3.20 (1H, dd, J=10.5, 2.4Hz), 3.16-3.02 (1H, m), 2.36-2.26 (1H, m), 2.15-2.02 (1H,m), 1.92-1.77 (1H, m), 1.74-1.59 (1H, m), 1.52 (1H, dd, J=14.7, 9.0 Hz), 1.40 (3H, s), 1.45-1.15 (3H, m), 0.60 (3H, s);31P NMR (121.5 MHz, CDCl3) δ 153.7 (1P, s).
Пример 29
[0208] Мономер 4b оксазафосфолидина.

Соединение 4b было получено с использованием III-b вместо III-а аналогично получению соединения 4а.
1Н NMR (300 MHz, CDCl3) δ 8.46 (1H, brs), 7.59-7.20 (20Н, m), 6.86-6.79 (4Н, m), 6.26 (1Н, t, J=6.8 Hz), 4.78-4.65 (2H, m), 4.01-3.95 (1H, m), 3.78 (6H, s), 3.55-3.40 (1H, m), 3.42 (1H, dd, J=10.5, 2.7 Hz), 3.40-3.28 (1H, m), 3.22 (1H, dd, J=10.5, 3.0 Hz), 3.19-3.06 (1H, m), 2.16-1.95 (2H, m), 1.90-1.54 (3H, m), 1.49-1.35 (1H, m), 1.43 (3H, s), 1.34-1.17 (2H, m), 0.67 (3H, s);31P NMR (121.5 MHz, CDCl3) δ 156.2 (1P, s).
Пример 30
[0209] Мономер 5a оксазафосфолидина.

Соединение 5а было получено с использованием "5'-O-(DMTr)-2'-O-метил-6-N-(бензоил)аденозина" вместо "5'-O-(DMTr)-2-N-(феноксиацетил)-6-O-(цианоэтил)гуанозина" аналогично получению соединения 3а.
1Н NMR (300 MHz, CDCl3) δ 8.66 (1H, s), 8.13 (1H, s), 8.03 (2Н, d, J=7.2 Hz), 7.64-7.16 (23Н, m), 6.79 (4H, d, J=8.7 Hz), 6.08 (1H, d, J=6.3 Hz), 4.91-4.81 (1H, m), 4.77-4.69 (1H, m), 4.64-4.57 (1H, m), 4.15-4.10 (1H, m), 3.76 (6H, s), 3.60-3.23 (4H, m), 3.35 (3H, s), 3.14-3.00 (1H, m), 1.90-1.19 (6H, m), 0.62 (3H, s);31P NMR (121.5 MHz, CDCl3) δ 155.8 (1P, s).
Пример 31
[0210] Мономер 5b оксазафосфолидина.

Соединение 5b было получено с использованием III-b вместо III-а аналогично получению соединения 5а.
1Н NMR (300 MHz, CDCl3) δ 9.12 (1Н, brs), 8.73 (1H, s), 8.24 (1Н, s), 8.07-8.01 (2Н, m), 7.62-7.17 (22Н, m), 6.83-6.77 (4Н, m), 6.12 (1Н, d, J=4.8Hz), 4.84-4.73 (2Н, m), 4.43 (1Н, t, J=4.8Hz), 4.25-4.19 (1H, m), 3.77 (6H, s), 3.55-3.20 (4H, m), 3.28 (3H, s), 3.16-3.03 (1H, m), 1.90-1.17 (6H, m), 0.65 (3H, s);31P NMR (121.5 MHz, CDCl3) δ 155.0 (1P, s).
Пример 32
[0211] Мономер 6a оксазафосфолидина.

Соединение 6а было получено с использованием "5'-O-(DMTr)-2'-O-метил-4-N-(изобутирил)цитидина" вместо "5'-O-(DTMr)-2-N-(феноксиацетил)-6-O-(цианоэтил)гуанозина" аналогично получению соединения 3а.
1Н NMR (300 MHz, CDCl3) δ 8.49 (1H, d, J=7.2 Hz), 7.58-7.20 (19Н, m), 6.96 (1H, d, J=7.2 Hz), 6.90-6.82 (4H, m), 5.98 (1H, s), 4.84 (1H, dd, J=13.1, 7.5 Hz), 4.59 (1H, dt, J=8.3, 4.5 Hz), 4.19-4.13 (1H, m), 3.79 (6H, s), 3.78-3.72 (1H, m), 3.63-3.40 (3H, m), 3.55 (3H, s), 3.36-3.24 (1H, m), 3.09-2.95 (1H, m), 2.59 (1H, септет, J=6.9 Hz), 1.85-1.53 (5H, m), 1.48-1.37 (1H, m), 1.24-1.17 (6H, m), 0.59 (3H, s);31P NMR (121.5 MHz, CDCl3) δ 155.2 (1P, s).
Пример 33
[0212] Мономер 6b оксазафосфолидина.

Соединение 6b было получено с использованием III-b вместо III-а аналогично получению соединения 6а.
1H NMR (300 MHz, CDCl3) δ 8.62 (1H, d, J=7.5 Hz), 7.57-7.23 (19H, m), 7.02 (1H, d, J=7.5 Hz), 6.89-6.81 (4H, m), 5.92 (1H, s), 4.90 (1H, dt, J=9.0, 5.7 Hz), 4.61 (1H, dt, J=8.7, 4.8 Hz), 4.25-4.17 (1H, m), 3.81 (6H, s), 3.67 (1H, d, J=4.5 Hz), 3.62-3.25 (4H, m), 3.38 (3H, s), 3.16-3.02 (1H, m), 2.58 (1H, септет, J=6.9 Hz), 1.87-1.40 (6H, m), 1.26-1.14 (6H, m), 0.64 (3H, s);31P NMR (121.5 MHz, CDCl3) δ 158.2 (1P, s).
Пример 34
[0213] Мономер 7a оксазафосфолидина.

Соединение 7a было получено с использованием "5'-O-(DMTr)-2'-O-метил-2-N-(феноксиацетил)-6-O-(цианоэтил)гуанозина" вместо "5'-O-(DMTr)-2-N-(феноксиацетил)-6-O-(цианоэтил)гуанозина" аналогично получению соединения 3а.
1H NMR (300 MHz, CDCl3) δ 8.67 (1Н, brs), 8.01 (1H, s), 7.56-7.16 (24H, m), 6.83-6.74 (4H, m), 6.08 (1H, d, J=6.9 Hz), 4.85-4.76 (1H, m), 4.84 (2H, t, J=6.6 Hz), 4.65-4.56 (1H, m), 4.59 (2H, brs), 4.48 (1H, dd, J=6.6, 5.1 Hz), 4.09-4.05 (1H, m), 3.75 (6H, s), 3.60-3.42 (2H, m), 3.40-3.26 (2H, m), 3.35 (3H, s), 3.18-3.05 (1H, m), 3.08 (2H, t, J=6.6 Hz), 1.89-1.49 (3H, m), 1.48-1.16 (3H, m), 0.59 (3H, s);31P NMR (121.5 MHz, CDCl3) δ 156.9 (1P, s).
Пример 35
[0214] Мономер 7b оксазафосфолидина.

Соединение 7b было получено с использованием III-b вместо III-а аналогично получению соединения 7а.
1Н NMR (300 MHz, CDCl3) δ 8.74 (1H, brs), 8.09 (1Н, s), 7.56-6.94 (24Н, m), 6.84-6.71 (4Н, m), 6.09 (1H, d, J=4.8 Hz), 4.83-4.70 (2H, m), 4.83 (2H, t, J=6.6 Hz), 4.63 (2H, brs), 4.35 (1H, t, J=5.0 Hz), 4.23-4.16 (1H, m), 3.75 (6H, s), 3.58-3.19 (4H, m), 3.32 (3H, s), 3.16-3.04 (1H, m), 3.07 (2H, t, J=6.6 Hz), 1.90-1.55 (3H, m), 1.48-1.15 (3H, m), 0.64 (3H, s);31P NMR (121.5 MHz, CDCl3) δ 154.6 (1P, s).
Пример 36
[0215] Мономер 8a оксазафосфолидина.

Соединение 8a было получено с использованием "5'-(9-(DMTr)-2'-O-(метила)уридина" вместо "5'-O-(DMTr)-2-N-(феноксиацетил)-6-O-(цианоэтил)гуанозина" аналогично получению соединения 3а.
1Н NMR (300 MHz, CDCl3) δ 7.91 (1Н, d, J=7.8 Hz), 7.58-7.20 (19Н, m), 6.88-6.80 (4H, m), 5.96 (1H, d, J=3.3 Hz), 5.19 (1H, d, J=7.8 Hz), 4.88-4.78 (1H, m), 4.66-4.57 (1H, m), 4.03-3.95 (1H, m), 3.90-3.74 (1H, m), 3.78 (6H, s), 3.77-3.71 (1H, m), 3.58-3.29 (2H, m), 3.45 (3H, s), 3.13-2.82 (2H, m), 1.88-1.53 (3H, m), 1.49-1.16 (3H, m), 0.60 (3H, s);31P NMR (121.5 MHz, CDCl3) δ 155.3 (1P, s).
Пример 37
[0216] Мономер 8b оксазафосфолидина.

Соединение 8b было получено с использованием III-b вместо III-а аналогично получению соединения 8а.
1H NMR (300 MHz, CDCl3) δ 8.10 (1H, d, J=8.4 Hz), 7.58-7.20 (19Н, m), 6.87-6.79 (4H, m), 5.89 (1H, d, J=1.5 Hz), 5.21 (1H, d, J=8.4 Hz), 4.92-4.82 (1H, m), 4.73-4.63 (1H, m), 4.15-4.08 (1H, m), 3.89-3.73 (1H, m), 3.78 (6H, s), 3.66-3.62 (1H, m), 3.57-3.27 (2H, m), 3.30 (3H, s), 3.17-2.82 (2H, m), 1.89-1.55 (3H, m), 1.55-1.40 (1H, m), 1.35-1.15 (2H, m), 0.66 (3H, s);31P NMR (121.5 MHz, CDCl3) δ 157.5 (1P, s).
Пример 38
[0217] Мономер 9a оксазафосфолидина.

Соединение 9a было получено с использованием "5'-O-(DMTr)-2'-деокси-2'-фтор-6-N-(бензоил)аденозина" вместо "5'-O-(DMTr)-2-N-(феноксиацетил)-6-O-(цианоэтил)гуанозина" аналогично получению соединения 3а.
1H NMR (300 MHz, CDCl3) δ 8.64 (1H, s), 8.14 (1H, s), 8.06-8.01 (2Н, m), 7.63-7.07 (23Н, m), 6.78-6.70 (4Н, m), 6.12 (1H, dd, J=18.0, 2.4 Hz), 5.24-5.01 (2Н, m), 4.94-4.84 (1H, m), 4.17-4.06 (1Н, m), 3.73 (6Н, s), 3.55-3.40 (3Н, m), 3.30-3.22 (1H, m), 3.03-2.88 (1H, m), 1.92-1.19 (6Н, m), 0.62 (3Н, s);31Р NMR (121.5 MHz, CDCl3) δ 150.5 (1P, d, J=7.7 Hz).
Пример 39
[0218] Мономер 9b оксазафосфолидина.
Соединение 9b было получено с использованием III-b вместо III-а аналогично получению соединения 9а.
1Н NMR (300 MHz, CDCl3) δ 9.07 (1H, brs), 8.80 (1H, s), 8.24 (1H, s), 8.08-8.01 (2Н, m), 7.66-7.15 (22Н, m), 6.81-6.75 (4Н, m), 6.14 (1Н, dd, J=18.0, 1.8 Hz), 5.16-4.91 (3Н, m), 4.28-4.21 (1H, m), 3.76 (6Н, s), 3.57-3.11 (5Н, m), 1.82-1.16 (6Н, m), 0.65 (3Н, s);31P NMR (121.5 MHz, CDCl3) δ 157.8 (1P, d, J=5.6Hz).
Пример 40
[0219] Мономер 10a оксазафосфолидина.

Соединение 10а было получено с использованием "5'-O-(DMTr)-2'-деокси-2'-фтор-4-N-(изобутирил)цитидина" вместо н 5'-O-(DMTr)-2-N-(феноксиацетил)-6-O-(цианоэтил)гуанозина" аналогично получению соединения 3а.
1H NMR (300 MHz, CDCl3) δ 8.66 (1H, brs), 8.41 (1Н, d, J=7.5Hz), 7.55-7.20 (19Н, m), 7.01 (1H, d, J=7.5 Hz), 6.89-6.81 (4H, m), 6.06 (1H, d, J=15.9 Hz), 4.85 (1H, dd, J=51.4, 3.9 Hz), 4.84 (1H, dd, J=12.9, 7.5 Hz), 4.77-4.59 (1H, m), 4.15-4.08 (1H, m), 3.79 (6H, s), 3.63-3.29 (4H, m), 3.10-2.96 (1H, m), 2.65 (1H, септет, J=6.9 Hz), 1.85-1.53 (3H, m), 1.48-1.17 (3H, m), 1.21 (3H, d, J=4.8Hz), 1.19 (3H, d, J=4.8Hz), 0.59 (3H, s);31P NMR (121.5 MHz, CDCl3) δ 155.5 (1P, d, J=6.6 Hz).
Пример 41
[0220] Мономер 10b оксазафосфолидина.
Соединение 10b было получено с использованием III-b вместо III-а аналогично получению соединения 10а.
1Н NMR (300 MHz, CDCl3) δ 8.53 (1H, d, J=7.5 Hz), 7.57-7.23 (20Н, m), 7.10 (1H, d, J=1.5 Hz), 6.89-6.81 (4H, m), 6.10 (1H, d, J=15.9 Hz), 5.00-4.92 (1H, m), 4.84 (1H, dd, J=51.5, 3.3 Hz), 4.75-4.58 (1H, m), 4.24 (1H, d, J=9.3 Hz), 3.81 (6H, s), 3.65-3.39 (3H, m), 3.32-3.06 (2H, m), 2.59 (1H, септет, J=6.9 Hz), 1.88-1.53 (4H, m), 1.49-1.34 (2H, m), 1.27-1.18 (6H, m), 0.65 (3H, s);31P NMR (121.5 MHz, CDCl3) δ 159.0 (1P, d, J=4.4).
Пример 42
[0221] Мономер 11a оксазафосфолидина.

Соединение 11а было получено с использованием "5'-O-(DMTr)-2'-деокси-2'-фтор-2-N-(феноксиацетил)-6-O-(цианоэтил)гуанозина" вместо "5'-O-(DMTr)-2-N-(феноксиацетил)-6-O-(цианоэтил)гуанозина" аналогично получению соединения 3а.
1Н NMR (300 MHz, CDCl3) δ 8.74 (1H, brs), 8.03 (1H, s), 7.55-6.94 (24Н, m), 6.80-6.69 (4Н, m), 6.21 (1Н, dd, J=14.9, 3.6 Hz), 5.34 (1H, dt, J=52.3, 3.6Hz), 5.01-4.75 (2H, m), 4.84 (1H, t, J=6.6Hz), 4.62 (2H, brs), 4.15-4.07 (1H, m), 3.73 (6H, s), 3.59-3.29 (4H, m), 3.15-3.00 (1H, m), 3.07 (2H, t, J=6.6 Hz), 1.90-1.49 (3H, m), 1.47-1.12 (3H, m), 0.58 (3H, s);31P NMR (121.5 MHz, CDCl3) δ 155.6 (1P, d, J=10.9 Hz).
Пример 43
[0222] Мономер 11b оксазафосфолидина.

Соединение 11b было получено с использованием III-b вместо III-а аналогично получению соединения 11а.
1H NMR (300 MHz, CDCl3) δ 8.81 (1Н, brs), 8.06 (1Н, s), 7.55-6.95 (24Н, m), 6.77-6.69 (4Н, m), 6.06 (1H, d, J=17.1 Hz), 5.24-5.08 (1H, m), 5.04-4.80 (2H, m), 4.87 (1H, t, J=6.6 Hz), 4.62 (2H, brs), 4.25-4.19 (1H, m), 3.73 (6H, s), 3.58-3.02 (5H, m), 3.10 (2H, t, J=6.6 Hz), 1.90-1.56 (3H, m), 1.50-1.15 (3H, m), 0.63 (3H, s);31P NMR (121.5 MHz, CDCl3) δ 158.0 (1P, d, J=4.4 Hz).
Пример 44
[0223] Мономер 12a оксазафосфолидина.
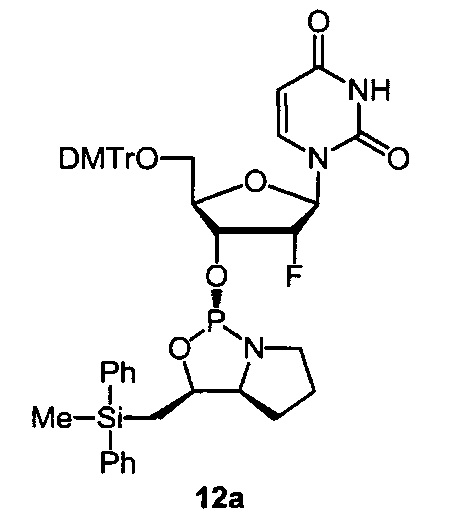
Соединение 12a было получено с использованием "5'-O-(DMTr)-2'-деокси-2'-фторуридина" вместо "5'-O-(DMTr)-2-N-(феноксиацетил)-6-O-(цианоэтил)гуанозина" аналогично получению соединения 3а.
1Н NMR (300 MHz, CDCl3) δ 7.85 (1H, d, J=8.1 Hz), 7.58-7.20 (19Н, m), 6.87-6.79 (4H, m), 5.98 (1H, d, J=16.5 Hz), 5.23 (1H, d, J=8.1Hz), 4.86-4.61 (3H, m), 3.99 (1H, d, J=6.9 Hz), 3.76 (6H, d, J=3.0 Hz), 3.56-3.34 (4H, m), 3.10-2.96 (1H, m), 1.88-1.74 (1H, m), 1.72-1.52 (2H, m), 1.48-1.16 (3H, m), 0.61 (3H, s);31P NMR (121.5 MHz, CDCl3) δ 154.3 (1P, d, J=8.9 Hz).
Пример 45
[0224] Мономер 12b оксазафосфолидина.

Соединение 12b было получено с использованием III-b вместо III-а аналогично получению соединения 12а.
1Н NMR (300 MHz, CDCl3) δ 8.01 (1H, d, J=8.4 Hz), 7.58-7.20 (19Н, m), 6.87-6.79 (4H, m), 6.03 (1H, d, J=16.2 Hz), 5.29 (1H, d, J=8.4 Hz), 4.96 (1H, dd, J=13.1, 7.5 Hz), 4.80-4.54 (2H, m), 4.15 (1H, d, J=9.0 Hz), 3.78 (6H, s), 3.61-3.39 (3H, m), 3.37-3.25 (1H, m), 3.23-3.09 (1H, m), 1.91-1.56 (3H, m), 1.51-1.13 (3H, m), 0.66 (3H, s);31P NMR (121.5 MHz, CDCl3) δ 158.9 (1P, d, J=4.4 Hz).
Пример 46
[0225] Мономер 13a оксазафосфолидина.

Соединение 13a было получено с использованием "5'-O-(DMTr)-2'-O-ТОМ-6-N-(ацетил)аденозина" вместо "5'-O-(DMTr)-2-N-(феноксиацетил)-6-O-(цианоэтил)гуанозина" аналогично получению соединения 3а.
1Н NMR (300 MHz, CDCl3) δ 8.82 (1H, brs), 8.49 (1Н, s), 8.10 (1Н, s), 7.58-7.17 (19Н, m), 6.83-6.73 (4Н, m), 6.11 (1Н, d, J=6.6 Hz), 5.15 (1H, dd, J=6.6, 5.4 Hz), 4.98-4.77 (4H, m), 4.18-4.11 (1H, m), 3.76 (6H, s), 3.59-3.25 (4H, m), 3.16-3.02 (1H, m), 2.62 (3H, s), 1.91-1.53 (3H, m), 1.49-1.18 (3H, m), 0.96-0.80 (3H, m), 0.90 (18H, s), 0.62 (3H, s);31P NMR (121.5 MHz, CDCl3) δ 156.7 (1P, s).
Пример 47
[0226] Мономер 13b оксазафосфолидина.

Соединение 13b было получено с использованием III-b вместо III-а аналогично получению соединения 13а.
1Н NMR (300 MHz, CDCl3) δ 8.56 (1Н, brs), 8.55 (1Н, s), 8.13 (1Н, s), 7.57-7.17 (19Н, m), 6.82-6.73 (4Н, m), 6.16 (1Н, d, J=5.7 Hz), 5.06 (1H, t, J=5.6 Hz), 4.93 (1H, d, J=5.1 Hz), 4.83 (1H, d, J=5.1 Hz), 4.81-4.69 (2H, m), 4.27-4.19 (1H, m), 3.76 (6H, s), 3.55-3.40 (2H, m), 3.33-3.16 (2H, m), 3.12-2.97 (1H, m), 2.63 (3H, s), 1.88-1.52 (3H, m), 1.45-1.16 (3H, m), 0.91-0.79 (3H, m), 0.86 (18H, s), 0.64 (3H, s);31P NMR (121.5 MHz, CDCl3) δ 154.8 (1P, s).
Пример 48
[0227] Мономер 14a оксазафосфолидина.

Соединение 14а было получено с использованием "5'-O-(DMTr)-2'-O-ТОМ-4-N-(ацетил)цитидина" вместо "5,-O-(DMTr)-2-N-(феноксиацетил)-6-O-(цианоэтил)гуанозина" аналогично получению соединения 3а.
1Н NMR (300 MHz, CDCl3) δ 10.04 (1Н, brs), 8.30 (1H, d, J=7.5 Hz), 7.51-7.21 (19Н, m), 6.99 (1H, d, J=7.5 Hz), 6.89-6.81 (4H, m), 6.12 (1H, d, J=3.3 Hz), 5.07 (1H, d, J=4.8 Hz), 5.05 (1H, d, J=4.8Hz), 4.84-4.75 (1H, m), 4.62-4.52 (1H, m), 4.31-4.25 (1H, m), 4.08-4.01 (1H, m), 3.78 (6H, d, J=3.0 Hz), 3.55-3.23 (4H, m), 3.10-2.96 (1H, m), 2.24 (3H, s), 1.84-1.49 (3H, m), 1.46-0.96 (24H, m), 0.58 (3H, s);31P NMR (121.5 MHz, CDCl3) δ 156.5 (1P, s).
Пример 49
[0228] Мономер 14b оксазафосфолидина.

Соединение 14b было получено с использованием III-b вместо III-а аналогично получению соединения 14а.
1Н NMR (300 MHz, CDl3) δ 10.19 (1H, brs), 8.46 (1H, d, J=7.5 Hz), 7.54-7.23 (19Н, m), 7.01 (1H, d, J=7.5 Hz), 6.88-6.79 (4H, m), 6.19 (1H, d, J=1.8 Hz), 5.11 (1H, d, J=4.8 Hz), 5.07 (1H, d, J=4.8 Hz), 4.81-4.71 (1H, m), 4.60-4.51 (1H, m), 4.26-4.18 (2H, m), 3.79 (6H, s), 3.63-3.55 (1H, m), 3.48-3.28 (2H, m), 3.21-2.94 (2H, m), 2.26 (3H, s), 1.81-1.49 (3H, m), 1.43-0.96 (24H, m), 0.62 (3H, s);31P NMR (121.5 MHz, CDCl3) δ 156.4 (1P, s).
Пример 50
[0229] Мономер 15a оксазафосфолидина.
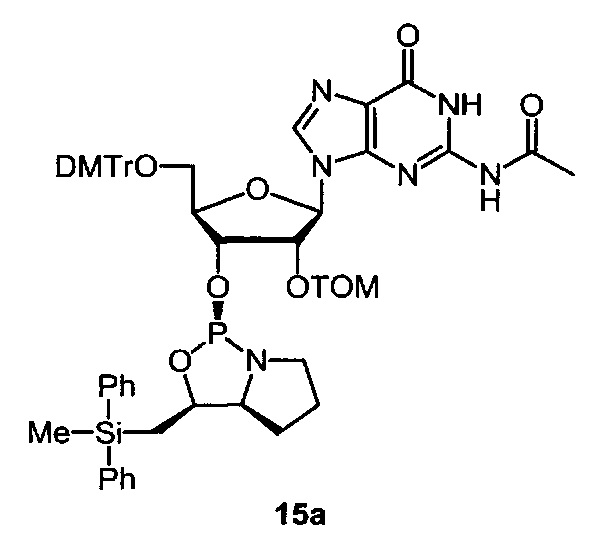
Соединение 15a было получено с использованием "5'-O-(DMTr)-2'-(9-ТОМ-2-N-(ацетил)гуанозина" вместо "5'-O-(DMTr)-2-N-(феноксиацетил)-6-O-(цианоэтил)гуанозина" аналогично получению соединения 3а.
1Н NMR (300 MHz, CDCl3) δ 7.70 (1H, s), 7.63-7.13 (21Н, m), 6.84-6.76 (4Н, m), 5.77 (1Н, d, J=8.4 Hz), 5.41-5.33 (1H, m), 4.90 (2H, s), 4.78-4.68 (2H, m), 3.86 (1H, brs), 3.75 (3H, s), 3.74 (3H, s), 3.56-3.41 (2H, m), 3.32-2.90 (3H, m), 1.92-1.10 (9H, m), 0.97-0.87 (21H, m), 0.52 (3H, s);31P NMR (121.5 MHz, CDCl3) δ 158.1 (1P, s).
Пример 51
[0230] Мономер 15b оксазафосфолидина.

Соединение 15b было получено с использованием III-b вместо III-а аналогично получению соединения 15а.
1Н NMR (300 MHz, CDCl3) δ 7.77 (1H, s), 7.56-7.15 (21Н, m), 6.82-6.75 (4Н, m), 5.86 (1H, d, J=7.5 Hz), 5.26-5.17 (1H, m), 4.95 (1H, d, J=5.4 Hz), 4.85 (1H, d, J=5.4 Hz), 4.78-4.71 (1H, m), 4.59.4.49 (1H, m), 4.10-4.05 (1H, m), 3.74 (6H, s), 3.52-3.37 (2H, m), 3.30-3.18 (1H, m), 3.11-2.85 (2H, m), 1.85-1.15 (9H, m), 0.93-0.84 (21H, m), 0.62 (3H, s);31P NMR (121.5 MHz, CDCl3) δ 152.3 (1P, s).
Пример 52
[0231] Мономер 16a оксазафосфолидина.

Соединение 16a было получено с использованием "5'-O-(DMTr)-2'-O-ТОМ-уридина" вместо "5'-O-(DMTr)-2-N-(феноксиацетил)-6-O-(цианоэтил)гуанозина" аналогично получению соединения 3а.
1Н NMR (300 MHz, CDCl3) δ 7.76 (1H, d, J=8.1 Hz), 7.55-7.18 (20Н, m), 6.88-6.80 (4Н, m), 6.11 (1H, d, J=6.0 Hz), 5.32 (1H, d, J=8.1 Hz), 4.99 (1H, d, J=5.1 Hz), 4.93 (1H, d, J=5.1 Hz), 4.84-4.75 (1H, m), 4.54-4.46 (1H, m), 4.38 (1H, t, J=5.7 Hz), 3.87-3.83 (1H, m), 3.78 (3H, s), 3.77 (3Н, s), 3.56-3.42 (1H, m), 3.39-3.28 (1H, m), 3.36 (1H, dd, J=11.0, 2.7H z), 3.25 (1H, dd, J=11.0, 2.7 Hz), 3.16-3.03 (1H, m), 1.88-1.12 (6H, m), 1.08-0.97 (21H, m), 0.59 (3H, s);31P NMR (121.5 MHz, CDCl3) δ 156.6 (1P, s).
Пример 53
[0232] Мономер 16b оксазафосфолидина.

Соединение 16b было получено с использованием III-b вместо III-а аналогично получению соединения 16а.
1Н NMR (600 MHz, CDCl3) δ 7.87 (1Н, d, J=7.8 Hz), 7.52-7.48 (4Н, m), 7.38-7.21 (16Н, m), 6.83-6.79 (4H, m), 6.14 (1H, d, J=4.8 Hz), 5.33 (1H, d, J=7.8 Hz), 4.99 (1H, d, J=5.4 Hz), 4.89 (1H, d, J=5.4 Hz), 4.67 (1H, dd, J=13.8, 7.2 Hz), 4.52 (1H, dt, J=10.4, 4.8 Hz), 4.31 (1H, t, J=4.8 Hz), 4.06-4.03 (1H, m), 3.78 (3H, s), 3.77 (3H, s), 3.47 (1H, dd, J=10.4, 2.4Hz), 3.47-3.39 (1H, m), 3.22-3.17 (2H, m), 3.00 (1H, ddd, J=19.5, 10.4, 4.8 Hz), 1.82-1.74 (1H, m), 1.68-1.58 (1H, m), 1.56 (1H, dd, J=14.4, 8.4 Hz), 1.38 (1H, dd, J=14.4, 7.2 Hz), 1.31-1.25 (1H, m), 1.26-1.17 (1H, m), 1.08-0.98 (21H, m), 0.63 (3H, s);31P NMR (243.0 MHz, CDCl3) δ 154.3 (1P, s).
Пример 54
[0233] Мономер 17a оксазафосфолидина.
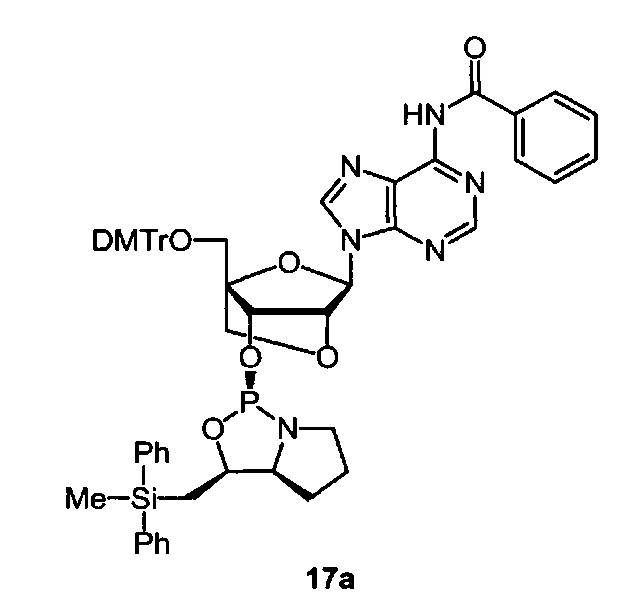
Соединение 17а было получено с использованием "5'-O-(DMTr)-2'-O,4'-С-метилен-6-N-(бензоил)аденозина" вместо "5'-O-(DMTr)-2-N-(феноксиацетил)-6-O-(цианоэтил)гуанозина" аналогично получению соединения 3а.
1Н NMR (300 MHz, CDCl3) δ 9.10 (1H, brs), 8.76 (1Н, s), 8.32 (1Н, s), 8.04 (2Н, d, J=7.2 Hz), 7.64-7.18 (22Н, m), 6.84 (4H, d, J=8.7 Hz), 6.10 (1H, s), 4.76 (1H, d J=6.9 Hz), 4.58 (1H, s), 4.61-4.51 (1H, m), 3.91 (1H, d, J=7.8 Hz), 3.77 (1H, d, J=7.8 Hz), 3.75 (6H, s), 3.50 (1H, s), 3.47-3.33 (1H, m), 3.31-3.19 (1H, m), 3.03-2.88 (1H, m), 1.84-1.09 (6H, m), 0.51 (3H, s);31P NMR (121.5 MHz, CDCl3) δ 152.9 (1P, s).
Пример 55
[0234] Мономер 17b оксазафосфолидина.

Соединение 17b было получено с использованием III-b вместо III-а аналогично получению соединения 17а.
1H NMR (300 MHz, CDCl3) δ 8.81 (1H, s), 8.30 (1H, s), 8.07-8.00 (2H, m), 7.64-7.17 (22H, m), 6.86-6.79 (4H, m), 6.12 (1H, s), 4.81-4.72 (1H, m), 4.62 (1H, d J=7.2 Hz), 4.57 (1H, s), 3.94 (1H, d, J=7.8 Hz), 3.89 (1H, d, J=7.8 Hz), 3.77 (6H, s), 3.48 (2H, s), 3.46-3.32 (1H, m), 3.24-3.13 (1H, m), 3.10-2.97 (1H, m), 1.84-1.49 (3H, m), 1.42-1.09 (3H, m), 0.58 (3H, s);31P NMR (121.5 MHz, CDCl3) δ 157.3 (1P, s).
Пример 56
[0235] Мономер 18a оксазафосфолидина.

Соединение 18a было получено с использованием "5'-O-(DMTr)-2'-O,4,-С-метилен-4-N-(изобутирил)-5-метилцитидина" вместо "5'-(9-(DMTr)-2-N-(феноксиацетил)-6-O-(цианоэтил)гуанозина" аналогично получению соединения 3а.
1Н NMR (300 MHz, CDCl3) δ 7.88 (1H, brs), 7.58-7.18 (20Н, m), 6.88-6.80 (4Н, m), 5.65 (1Н, s), 4.69-4.60 (1H, m), 4.52 (1H, d, J=6.6 Hz), 4.49 (1H, s), 3.81-3.74 (1H, m), 3.75 (3H, s), 3.73 (3H, s), 3.64 (1H, d, J=8.1 Hz), 3.56 (1H, d, J=11.1 Hz), 3.53 (1H, d, J=8.1 Hz), 3.46 (1H, d, J=11.1 Hz), 3.56-3.40 (1H, m), 3.32-3.20 (1H, m), 3.14-3.00 (1H, m), 1.85-1.12 (6H, m), 1.60 (3H, s), 1.19 (6H, d, J=6.9Hz), 0.55 (3H, s);31P NMR (121.5 MHz, CDCl3) δ 155.9 (1P, s).
Пример 57
[0236] Мономер 18b оксазафосфолидина.

Соединение 18b было получено с использованием III-b вместо III-а аналогично получению соединения 18а.
1Н NMR (300 MHz, CDCl3) δ 7.86 (1H, brs), 7.56-7.19 (20Н, m), 6.88-6.79 (4Н, m), 5.69 (1Н, s), 4.86-4.76 (1H, m), 4.46 (1H, s), 4.45 (1H, d, J=7.5 Hz), 3.80-3.75 (1H, m), 3.79 (6H, s), 3.74 (1H, d, J=8.1 Hz), 3.69 (1H, d, J=8.1 Hz), 3.51 (1H, d, J=11.1 Hz), 3.44-3.30 (1H, m), 3.39 (1H, d, J=11.1 Hz), 3.29-3.17 (lH,m), 3.11-2.97 (1H, m), 1.86-1.52 (3H, m), 1.64 (3H, s), 1.45-1.10 (3H, m), 1.21 (6H, d, J=6.6 Hz), 0.62 (3H, s);31PNMR (121.5 MHz, CDCl3) δ 158.2 (1P, s).
Пример 58
[0237] Мономер 19a оксазафосфолидина.

Соединение 19a было получено с использованием
"5'-O-(DMTr)-2'-O,4'-С-метилен-2-N-(феноксиацетил)-6-O-(цианоэтил)гуанозина" вместо "5'-O-(DMTr)-2-N-(феноксиацетил)-6-O-(цианоэтил)гуанозина" аналогично получению соединения 3а.
1Н NMR (300 MHz, CDCl3) δ 8.71 (1H, brs), 8.16 (1H, s), 7.50-7.17 (21Н, m), 7.09-7.01 (3Н, m), 6.86-6.79 (4Н, m), 6.03 (1H, s), 4.84 (2H, t, J=6.6 Hz), 4.72 (2H, s), 4.68 (1H, d, J=7.2 Hz), 4.55-4.46 (1Н, m), 4.50 (1H, s), 3.90 (1H, d, J=7.8 Hz), 3.77 (1H, d, J=7.8 Hz), 3.75 (6H, s), 3.51 (1H, d, J=10.8 Hz), 3.47 (1H, d, J=10.8 Hz), 3.45-3.21 (2H, m), 3.08 (2H, t, J=6.6 Hz), 3.03-2.89 (1H, m), 1.80-1.08 (6H, m), 0.47 (3H, s);31P NMR (121.5 MHz, CDCl3) δ 153.2 (1P, s).
Пример 59
[0238] Мономер 19b оксазафосфолидина.
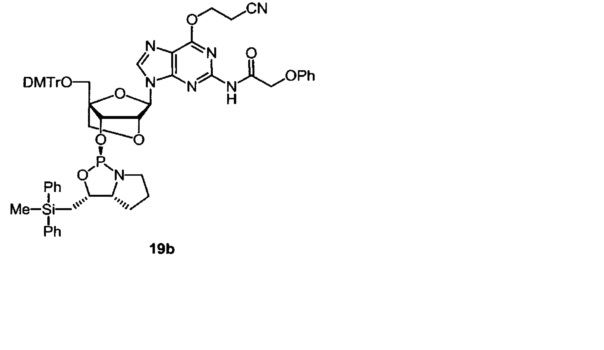
Соединение 19b было получено с использованием III-b вместо III-а аналогично получению соединения 19а.
1Н NMR (300 MHz, CDCl3) δ 8.86 (1Н, brs), 8.13 (1Н, s), 7.55-7.17 (21Н, m), 7.08-6.98 (3Н, m), 6.95-6.78 (4Н, m), 6.01 (1H, s), 4.86 (2H, t, J=6.6 Hz), 4.82-4.73 (1H, m), 4.70 (2H, s), 4.64 (1H, d, J=7.5 Hz), 4.49 (1H, s), 3.94 (1H, d, J=7.8 Hz), 3.89 (1H, d, J=7.8 Hz), 3.77 (6H, s), 3.46 (2H, s), 3.45-3.30 (1H, m), 3.24-3.12 (1H, m), 3.09 (2H, t, J=6.6 Hz), 3.09-2.96 (1H, m), 1.81-1.50 (3H, m), 1.41-1.06 (3H, m), 0.58 (3H, s);31P NMR (121.5 MHz, CDCl3) δ 157.4 (1P, s).
Пример 60
[0239] Мономер 20a оксазафосфолидина.

Соединение 20a было получено с использованием "5'-O-(DMTr)-2'-O,4'-С-метилен-5-метилури дина" вместо "5'-O-(DMTr)-2-N-(феноксиацетил)-6-O-(цианоэтил)гуанозина" аналогично получению соединения 3а.
1Н NMR (300 MHz, CDCl3) δ 7.71 (1H, d, J=0.9 Hz), 7.50-7.17 (20Н, m), 6.87-6.80 (4H, m), 5.61 (1H, s), 4.69-4.60 (1H, m), 4.55 (1H, d, J=6.9H z), 4.41 (1H, s), 3.74 (3H, s), 3.73 (3H, s), 3.64 (1H, d, J=7.8 Hz), 3.55 (1H, d, J=7.8 Hz), 3.53 (1H, d, J=10.8 Hz), 3.46 (1H, d, J=10.8 Hz), 3.56-3.42 (1H, m), 3.35-3.24 (1H, m), 3.13-3.00 (1H, m), 1.85-1.45 (3H, m), 1.55 (3H, d, J=0.9 Hz), 1.41-1.12 (3H, m), 0.56 (3H, s);31P NMR (121.5 MHz, CDCl3) δ 155.1 (1P, s).
Пример 61
[0240] Мономер 20b оксазафосфолидина.

Соединение 20b было получено с использованием III-b вместо III-а аналогично получению соединения 20а.
1Н NMR (300 MHz, CDCl3) δ 7.69 (1Н, s), 7.56-7.19 (20Н, m), 6.88-6.79 (4Н, m), 5.66 (1H, s), 4.87-4.77 (1H, m), 4.47 (1H, d, J=7.8 Hz), 4.40 (1H, s), 3.78 (6H, s), 3.74 (1H, d, J=7.8 Hz), 3.68 (1H, d, J=7.8 Hz), 3.50 (1H, d, J=10.8 Hz), 3.46-3.32 (1H, m), 3.39 (1H, d, J=10.8 Hz), 3.30-3.19 (1H, m), 3.12-2.98 (1H, m), 1.85-1.56 (3H, m), 1.59 (3H, s), 1.46-1.12 (3H, m), 0.63 (3H, s);3 1P NMR (121.5 MHz, CDCl3) δ 158.1 (1P, s).
Пример 62
[0241] Мономер 21a оксазафосфолидина.

Соединение 21а было получено с использованием "5'-O-(DMTr)-2'-O-метоксиэтила-5-метилуридинам вместо "5'-O-(DMTr)-2-N-(феноксиацетил)-6-O-(цианоэтил)гуанозина" аналогично получению соединения 3а.
1Н NMR (300 MHz, CDCl3) δ 7.62-7.18 (21Н, m), 6.84 (4Н, d, J=8.7 Hz), 6.07 (1H, d, J=5.7 Hz), 4.86-4.76 (1H, m), 4.63-4.54 (1H, m), 4.20 (1H, t, J=5.4 Hz), 3.95-3.89 (1H, m), 3.78 (6H, s), 3.78-3.71 (2H, m), 3.60-3.48 (2H, m), 3.44-3.02 (5H, m), 3.31 (3H, s), 1.88-1.15 (6H, m), 1.35 (3H, s), 0.58 (3H, s);31P NMR (121.5 MHz, CDCl3) δ 156.3 (1P, s).
Пример 63
[0242] Мономер 21b оксазафосфолидина.

Соединение 21b было получено с использованием III-b вместо III-а аналогично получению соединения 21а.
1Н NMR (300 MHz, CDCl3) δ 7.71 (1Н, d, J=1.2 Hz), 7.55-7.22 (20Н, m), 6.86-6.78 (4H, m), 5.99 (1H, d, J=3.9 Hz), 4.78-4.62 (2H, m), 4.13-4.08 (1H, m), 4.07-4.02 (1H, m), 3.77 (6H, s), 3.77-3.70 (1H, m), 3.65-3.56 (1H, m), 3.52-3.36 (4H, m), 3.33-3.14 (2H, m), 3.29 (3H, s), 3.08-2.94 (1H, m), 1.86-1.72 (1H, m), 1.71-1.55 (2H, m), 1.30 (3H, d, J=1.2 Hz), 1.47-1.16 (3H, m) 0.64 (3H, s);31P NMR (121.5 MHz, CDCl3) δ 155.6 (1P, s).
Пример 64
[0243] Мономер 22a оксазафосфолидина.
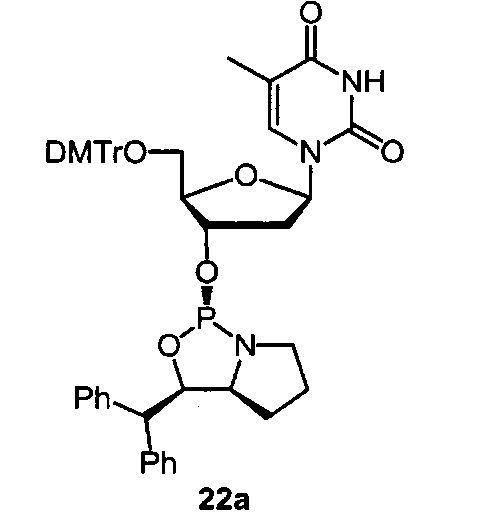
Соединение 22a было получено с использованием VII-a вместо III-а аналогично получению соединения 4а.
1Н NMR (300 MHz, CDCl3) δ 7.57 (1H, d, J=0.9Hz), 7.37-6.94 (20Н, m), 6.87-6.78 (4H, m), 6.48 (1H, dd, J=8.6, 5.7Hz), 5.42 (1H, dd, J=11.0, 5.1 Hz), 4.81-4.71 (1H, m), 4.02 (1H, d, J=11.0 Hz), 3.83 (1H, d, J=2.1 Hz), 3.79 (6H, s), 3.61-3.41 (2H, m), 3.24-3.09 (1H, m), 3.16 (1H, dd, J=10.8, 2.4 Hz), 3.02 (1H, dd, J=10.8, 2.4 Hz), 2.54-2.44 (1H, m), 2.34-2.22 (1H, m), 1.94-1.79 (1H, m), 1.74-1.56 (1H, m), 1.38 (3H, s), 1.38-1.28 (2H, m);31P NMR (121.5 MHz, CDCl3) δ 160.9 (1P, s).
Пример 65
[0244] Мономер 22b оксазафосфолидина.
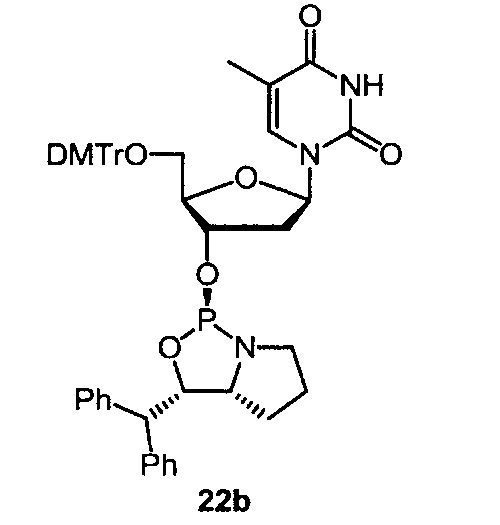
Соединение 22b было получено с использованием VII-b вместо VII-а аналогично получению соединения 22а.
1Н NMR (300 MHz, CDCl3) δ 7.57 (1Н, d, J=1.5 Hz), 7.43-7.11 (20Н, m), 6.85-6.78 (4H, m), 6.48 (1Н, dd, J=7.5, 5.7 Hz), 5.58 (1H, dd, J=11.4, 5.1 Hz), 4.82-4.73 (1H, m), 4.17-4.02 (2H, m), 3.78 (6H, s), 3.56-3.40 (3H, m), 3.32 (1H, dd, J=10.7, 2.4 Hz), 3.22-3.07 (1H, m), 2.26-2.04 (2H, m), 1.95-1.81 (1H, m), 1.74-1.56 (1H, m), 1.40 (3H, d, J=1.5 Hz), 1.44-1.34 (2H, m);31P NMR (121.5 MHz, CDCl3) δ 162.2 (1P, s).
Пример 66
[0245] Мономер 23a оксазафосфолидина.

Соединение 23a было получено с использованием IX-а вместо III-а аналогично получению соединения 4а.
1Н NMR (300 MHz, CDCl3) δ 9.22 (1Н, brs), 8.05-7.99 (2Н, m), 7.52 (1Н, d, J=1.2 Hz), 7.41-7.19 (11Н, m), 6.87-6.79 (4Н, m), 6.37 (1H, dd, J=8.4, 5.7 Hz), 4.88-4.75 (2Н, m), 3.86-3.80 (1H, m), 3.79 (6Н, s), 3.64-3.49 (2Н, m), 3.27-3.12 (3Н, m), 2.97 (2Н, d, J=6.6 Hz), 2.51-2.41 (1H, m), 2.33-2.20 (1H, m), 2.03-1.75 (2H, m), 1.72-1.59 (1H, m), 1.46-1.36 (1H, m), 1.40 (3H, s);31P NMR (121.5 MHz, CDCl3) δ 157.5 (1P, s).
Пример 67
[0246] Мономер 23b оксазафосфолидина.

Соединение 23b было получено с использованием IX-b вместо IX-а аналогично получению соединения 23а.
1Н NMR (300 MHz, CDCl3) δ 8.67 (1H, brs), 8.18-8.11 (2Н, m), 7.57 (1H, d, J=1.2 Hz), 7.47-7.22 (11Н, m), 6.86-6.79 (4Н, m), 6.29 (1H, t, J=6.6 Hz), 4.87 (1Н, dt, J=7.5, 5.7 Hz), 4.80-4.72 (1H, m), 4.11-4.05 (1H, m), 3.79 (6H, s), 3.67-3.47 (2H, m), 3.43 (1H, dd, J=10.8, 2.7 Hz), 3.27 (1H, dd, J=10.8, 2.4 Hz), 3.25-3.13 (1H, m), 3.07-2.99 (2H, m), 2.19-2.12 (2H, m), 2.03-1.62 (3H, m), 1.46-1.30 (1H, m), 1.41 (3H, s);31P NMR (121.5 MHz, CDCl3) δ 158.1 (1P, s).
Пример 68
[0247] Мономер 24a оксазафосфолидина.

Соединение 24a было получено с использованием XIII-а вместо III-а аналогично получению соединения 4а.
1Н NMR (600 MHz, CDCl3) δ 7.76 (2Н, d, J=9.0 Hz), 7.62 (1H, d, J=1.2 Hz), 7.40 (2H, d, J=7.2 Hz), 7.32-7.23 (10H, m), 6.85 (4H, d, J=8.4 Hz), 6.41 (1H, dd, J=8.4, 5.4 Hz), 4.94 (1H, dd, J=12.3, 5.4 Hz), 4.84-4.79 (1H, m), 4.03-4.01 (1H, m), 3.79 (6H, s), 3.59-3.53 (1H, m), 3.52-3.44 (2H, m), 3.41 (1H, dd, J=14.7, 7.2 Hz), 3.37-3.30 (2H, m), 3.13 (1H, ddd, J=19.3, 10.3, 4.1 Hz), 2.50-2.44 (1H, m), 2.39 (3H, s), 2.35-2.29 (1H, m), 1.91-1.72 (2H, m), 1.64-1.59 (1H, m), 1.40 (3H, s), 1.12-1.05 (lH,m);31P NMR (243.0 MHz, CDCl3) δ 154.2 (1P, s).
[0248] Общая процедура синтеза хиральных олиго:
Автоматизированный твердофазный синтез хиральных олиго проводили в соответствии с циклами, приведенными в Таблице 1. После синтеза смолу обрабатывали 25% водным раствором NH3 (1 мл) в течение 12 часов при 55 градусах С. Смесь охлаждали до комнатной температуры и смолу удаляли путем мембранной фильтрации. Фильтрат концентрировали до сухого состояния при пониженном давлении. Остаток растворяли в H2O (3 мл) и анализировали методом СВЭЖХ с обратной фазой-МС при линейном градиенте ацетонитрила (0-50%/30 минут) в буферном растворе 0,1 М триэтиламмоний ацетата (рН 7,0) при 50 градусах C со скоростью 0,3 мл/минуту.

[Сравнительный пример 1]
[0250]

[0251] Вышеприведенное соединение 25, представляющее собой известный мономер, использовали для получения олиго. На Фиг. 2 приведена диаграмма продуктов, полученных на основе сравнительного Примера 1.
[0252] Анализ
Мономеры, приведенные в рабочих примерах, являлись химически устойчивыми. Фактический выход мономеров составил более 80%, что превышало выход при использовании известного способа.
[0253] Нами были синтезированы производные олигонуклеотидов с использованием хиральных реагентов, указанных в вышеприведенных рабочих примерах на основе второй общей процедуры, и мономеров, приведенных в вышеуказанных рабочих примерах, на основе первой общей процедуры. Как показано на Фиг. 2, известный мономер приводит к образованию продуктов с неполным снятием защиты, побочных продуктов и к последовательностям отказов. С другой стороны, способ настоящего изобретения приводит к незначительному образованию продуктов с неполным снятием защиты и побочных продуктов, хотя он приводит к последовательностям отказов, как показано на Фиг. 1. Очевидно, что способ настоящего изобретения может уменьшить образование продуктов с неполным снятием защиты и побочных продуктов. Процесс отделения целевых производных олигонуклеотидов оказался простым ввиду того, что настоящее изобретение позволяет сократить образование нежелательных продуктов.
Реферат
Изобретение относится к хиральному реагенту формулы (I') для получения производного нуклеозид 3'-фосфорамидита формул (Va') или (Vb'), которые могут использоваться в химической промышленности для синтеза олигонуклеотидов:где Gпредставляет собой H или группу формулы (II), Gпредставляет собой группу формул (III) или (V), или Gи Gвместе образуют группу формулы (IV),,,,,где G- Gпредставляют собой H или нитрогруппу, G- Gпредставляют собой Салкил или Сарил, G- Gпредставляют собой Н, G- Gпредставляют собой H или Салкил. Предложены новые реагенты и полученные с их использованием новые производные нуклеозид 3'-фосфорамидита формул (Va') или (Vb'), эффективные для синтеза олигонуклеотидов,,,где Gпредставляет собой 4,4'-диметокситритил, Rпредставляет собой Н, О-Салкил, галоген, Rпредставляет собой -СН-, и Bs выбран из остатков немодифицированных и модифицированных нуклеозидов. Предложены новые эффективные способы синтеза указанных производных олигонуклеотидов. 6 н. и 8 з.п. ф-лы, 69 пр., 1 табл., 2 ил.
Формула













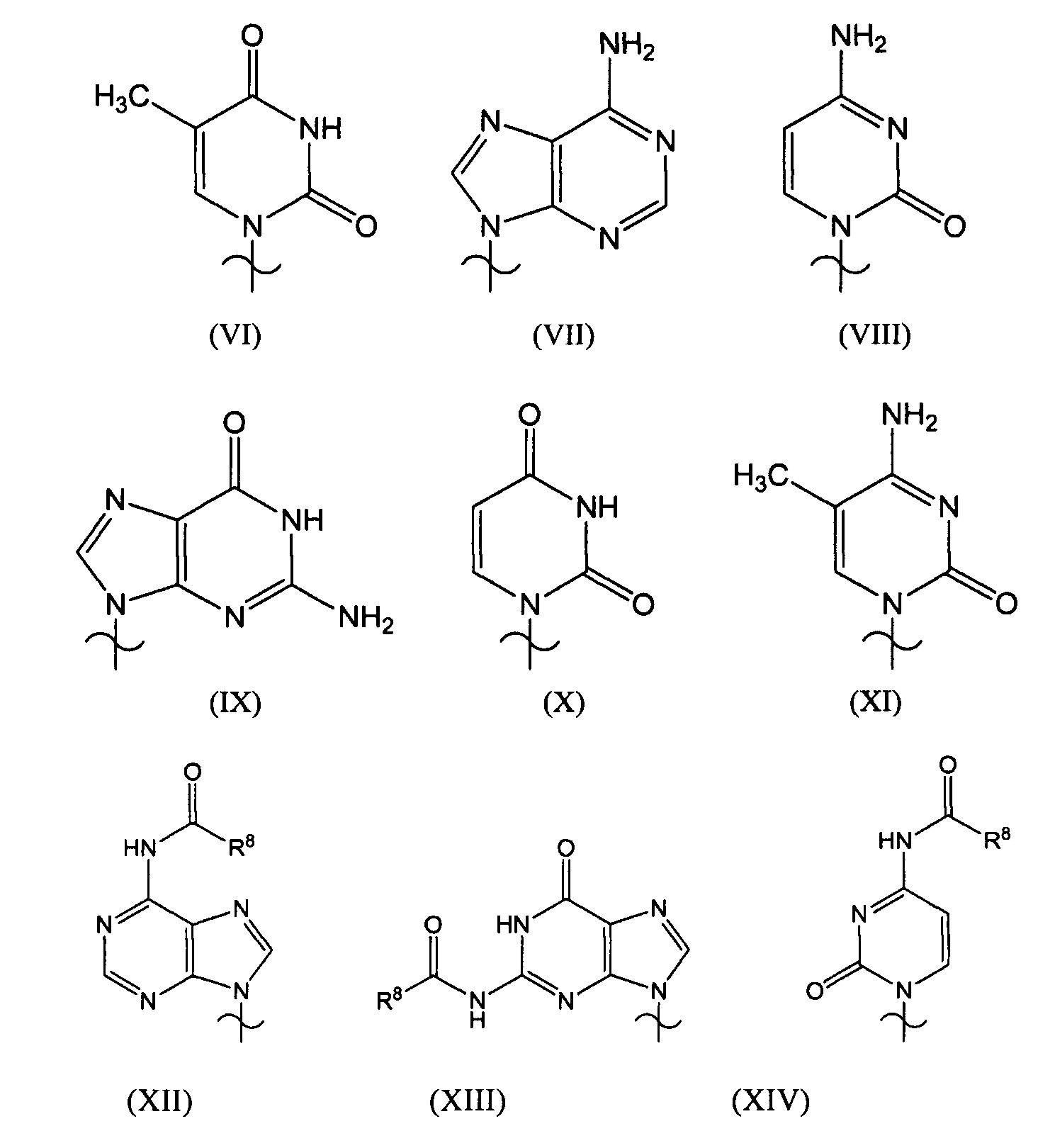







Комментарии