Реакционный реагент для трифторметилирования - RU2437868C2
Код документа: RU2437868C2
Описание
Область техники
Настоящее изобретение относится к реакционному реагенту, используемому для трифторметилирования.
Уровень техники
Хорошо известно, что введение трифторметильной группы в различные органические соединения влечет за собой многочисленные полезные действия, такие как улучшение физиологических показателей медицинских и сельскохозяйственных химических препаратов и улучшение эксплуатационных качеств функциональных материалов. Поэтому реакционные реагенты для прямого трифторметилирования органического соединения изучаются до сего времени.
Несмотря на то, что S-(трифторметил)дибензотиофен трифторметансульфонат, описанный в непатентных документах 1-5, способен превращать углерод-водородную связь в различных органических соединениях в углерод-трифторметильную связь, недостатки его заключаются в том, что получение S-(трифторметил)дибензотиофен трифторметансульфоната чрезвычайно сложно и достаточно дорого.
Несмотря на то, что непатентные документы 6 и 7 раскрывают трифторметилирование с использованием дихлордифторметана, дибромдифторметана или бромхлордифторметана, и кадмия, цинка или меди, их применение ограничено реакцией замещения галогена в органическом галогениде трифторметильной группой.
Непатентный документ 8 описывает, что бензолы превращаются в соответствующие трифторметилбензолы посредством использования (трифторметил)фенилиод трифторметансульфоната, полученного путем окисления трифторметилиодида пероксидом водорода в трифторацетоуксусном ангидриде, с последующим реагированием полученного в результате вещества с трифторметансульфокислотой и бензолом. Однако получение (трифторметил)фенилиод трифторметансульфоната сложно и в промышленности трудно осуществимо.
Непатентный документ 9 раскрывает трифторметилирование нуклеиновых оснований и бензолов с использованием трифторуксусной кислоты и дифторида ксенона. Однако дифторид ксенона неудобно использовать в промышленном масштабе, потому что ксенон, который является исходным веществом для дифторида ксенона, дорог и дифторид ксенона является нестабильным при воздействии воды.
Непатентный документ 10 раскрывает способ, использующий порошок меди и трифторметилиодид в процессе прямого трифторметилирования органического соединения трифторметилгалогенидом. Однако этот процесс имеет недостатки, заключающиеся в том, что он предполагает использование гексаметилфосфотриамида, с которым в промышленных условиях трудно иметь дело, в качестве растворителя, и в том, что он предполагает использование соединения меди, которое загрязняет окружающую среду. Несмотря на то, что другой известный способ представляет собой использование трифторметилиодида и триэтилборана (непатентный документ 11), подходящий субстрат ограничен карбонильным соединением, которое может претерпевать енолизацию в присутствии диизопропиламида лития. Кроме того, непатентный документ 12 раскрывает, что бензолы, пиридины и пирролы могут быть трифторметилированы посредством использования трифторметилбромида, цинка и диоксида серы. Этот документ также описывает, что аналогичная реакция происходит при использовании трифторметилбромида и дитионита натрия. Поскольку оба способа используют токсичное вещество, содержащее серу, они являются трудно осуществимыми в промышленности.
Патентный документ 1 раскрывает перфторалкилирование бензолов с использованием перфторалкилиодида и ди(трет-бутил)пероксида. Ди(трет-бутил)пероксид, используемый в этом способе, является очень взрывоопасным и трудно применимым в промышленности.
Непатентный документ 13 раскрывает способ превращения карбоксильной группы фуранового кольца в трифторметильную группу с помощью тетрафторида серы. Однако способ имеет недостатки, заключающиеся в том, что подходящий субстрат ограничен субстратом, имеющим карбоксильную группу, и в том, что используется токсичный тетрафторид серы.
С другой стороны, несмотря на то, что перфторбутилирование бензолов с помощью перфторбутилиодида в диметилсульфоксиде в присутствии сульфата железа(II) и пероксида водорода (непатентный документ 14) и перфторпропилирование и перфторбутилирование пирролов и индолов с помощью перфторпропилиодида или перфторбутилиодида в диметилсульфоксиде в присутствии сульфата железа(II) (непатентный документ 15) известно, пример реакции, использующей трифторметилиодид отсутствует и отсутствует так же описание реакционного реагента для трифторметилирования в соответствии с настоящим изобретением.
Непатентный документ 1: Tetrahedron Letters, Vol.31, pp.3579-3582, 1990.
Непатентный документ 2: Journal of the American Chemical Society, Vol. 115, рр.2156-2164, 1993.
Непатентный документ 3: Journal of Organic Chemistry, Vol. 59, рр.5692-5699, 1994.
Непатентный документ 4: Journal of Fluorine Chemistry, Vol. 74, рр.77-82, 1995.
Непатентный документ 5: Journal of Organic Chemistry, Vol. 68, рр.8726-8729, 2003.
Непатентный документ 6: Journal of the American Chemical Society, Vol. 107, рр.5014-5015, 1985.
Непатентный документ 7: Journal of the American Chemical Society, Vol. 108, рр.832-834, 1986.
Непатентный документ 8: Journal of Synthetic Organic Chemistry, Japan, Vol. 41, рр.251-265, 1983.
Непатентный документ 9: Journal of Organic Chemistry, Vol. 53, рр.4582-4585, 1988.
Непатентный документ 10: Journal of Chemical Society, Perkin Transaction I, рр.2755-2761, 1980.
Непатентный документ 11: Organic Letters, Vol. 7, рр.4883-4885, 2005.
Непатентный документ 12: Journal of Chemical Society, Perkin Transaction I, рр.2293-2299, 1990.
Непатентный документ 13: Journal of Fluorine Chemistry, Vol. 75, рр.115-116, 1995.
Патентный документ 1: US Patent No. 3271441.
Непатентный документ 14: Journal of Organic Chemistry, Vol. 62, рр.7128-7136, 1997.
Непатентный документ 15: Tetrahedron Letters, Vol. 34, рр.3799-3800, 1993.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Задача, решаемая посредством изобретения
Задачей настоящего изобретения является создание реакционного реагента для трифторметилирования в высокой степени общего многоцелевого назначения и с высокой эффективностью.
Средства решения задачи
Изобретатели настоящего изобретения провели интенсивные и экстенсивные исследования и установили, что соответствующий sp2 углерод можно трифторметилировать посредством применения реакционного реагента, включающего соединение железа, трифторметилиодид, пероксид и сульфоксид.
Настоящее изобретение имеет следующие аспекты:
(1) Реакционный реагент для трифторметилирования, включающий соединение железа, трифторметилиодид, пероксид и сульфоксид.
(2) Реакционный реагент в соответствии с вышеуказанным аспектом (1), дополнительно включающий кислоту.
(3) Реакционный реагент в соответствии с вышеуказанным аспектом (1) или (2), в котором молярное соотношение соединения железа и трифторметилиодида находится в диапазоне от 1:1 до 1:100.
(4) Реакционный реагент в соответствии с каким-либо одним из вышеуказанных аспектов (1)-(3), в котором молярное соотношение соединения железа и пероксида находится в диапазоне от 1:1 до 1:50.
(5) Реакционный реагент в соответствии с каким-либо одним из вышеуказанных аспектов (1)-(4), в котором молярное соотношение соединения железа и сульфоксида находится в диапазоне от 1:50 до 1:30000.
(6) Реакционный реагент в соответствии с каким-либо одним из вышеуказанных аспектов (2)-(5), в котором молярное соотношение соединения железа и кислоты находится в диапазоне от 1:0,001 до 1:50.
(7) Реакционный реагент в соответствии с каким-либо одним из вышеуказанных аспектов (1)-(6), в котором соединение железа представляет собой сульфат железа(II), аммонийсульфат железа(II), тетрафторборат железа(II), хлорид железа(II), бромид железа(II), иодид железа(II), ацетат железа(II), оксалат железа(II), бис(ацетилацетонат)железа (II), ферроцен, бис(ŋ5-пентаметилциклопентадиенил)железо или порошок железа.
(8) Реакционный реагент в соответствии с каким-либо одним из вышеуказанных аспектов (1)-(6), в котором соединение железа представляет собой сульфат железа(II), аммонийсульфат железа(II), тетрафторборат железа(II), ферроцен, бис(ŋ5-пентаметилциклопентадиенил)железо или порошок железа.
(9) Реакционный реагент в соответствии с каким-либо одним из вышеуказанных аспектов (1)-(8), в котором пероксид представляет собой пероксид водорода, композит пероксид водорода-мочевина, трет-бутилпероксид или пероксиуксусную кислоту.
(10) Реакционный реагент в соответствии с каким-либо одним из вышеуказанных аспектов (1)-(8), в котором пероксид представляет собой пероксид водорода или композит пероксид водорода-мочевина.
(11) Реакционный реагент в соответствии с каким-либо одним из вышеуказанных аспектов (1)-(10), в котором сульфоксид представляет собой диметилсульфоксид, дибутилсульфоксид или дифенилсульфоксид.
(12) Реакционный реагент в соответствии с каким-либо одним из вышеуказанных аспектов (1)-(10), в котором сульфоксид представляет собой диметилсульфоксид.
(13) Реакционный реагент в соответствии с каким-либо одним из вышеуказанных аспектов (2)-(12), в котором кислота представляет собой серную кислоту, хлористоводородную кислоту, бромистоводородную кислоту, йодистоводородную кислоту, азотную кислоту, фосфорную кислоту, гексафторфосфорную кислоту, тетрафторборную кислоту, муравьиную кислоту, уксусную кислоту, пропионовую кислоту, щавелевую кислоту, пара-толуолсульфокислоту, трифторметансульфоновую кислоту или трифторуксусную кислоту.
(14) Реакционный реагент в соответствии с каким-либо одним из вышеуказанных аспектов (2)-(12), в котором кислота представляет собой серную кислоту, тетрафторборную кислоту или трифторметансульфоновую кислоту.
Эффект изобретения
Настоящее изобретение относится к реакционному реагенту для трифторметилирования в высокой степени общего многоцелевого назначения и с высокой эффективностью.
Наилучший вариант осуществления изобретения
Соединение железа, подходящее в качестве реакционного реагента для трифторметилирования в настоящем изобретении (которое также будет именоваться в дальнейшем в этом документе как «настоящий реакционный реагент»), предпочтительно представляет собой соль железа(II), примеры которой включают соли неорганической кислоты, такие как сульфат железа(II), аммонийсульфат железа(II), тетрафторборат железа(II), хлорид железа(II), бромид железа(II), иодид железа(II), и металлоорганические соединения, такие как ацетат железа(II), оксалат железа(II), бис(ацетилацетонат) железа(II), ферроцен и бис(ŋ5-пентаметилциклопентадиенил)железо, и они могут применяться в комбинации соответствующим образом. Кроме того, порошок железа, соединение железа(0) или соль железа(I) могут применяться в комбинации с окисляющим реагентом, таким как пероксид, для того чтобы генерировать в системе соль железа(II). По этой причине включенный в реакционный реагент настоящего изобретения пероксид может также использоваться фактически как окисляющий реагент.
С точки зрения хорошего выхода, предпочтительным соединением железа является сульфат железа(II), аммонийсульфат железа(II), тетрафторборат железа(II), ферроцен, бис(ŋ5-пентаметилциклопентадиенил)железо или порошок железа.
Примеры пероксидов, применимых в настоящем изобретении, включают пероксид водорода, композит пероксид водорода-мочевина, трет-бутилпероксид, пероксиуксусную кислоту и т.д., и они могут применяться соответственно в комбинации. Предпочтительным пероксидом, который позволит получить хороший выход, является пероксид водорода или композит пероксид водорода-мочевина.
Пероксид водорода может применяться после разбавления его водой. В этом случае, несмотря на то, что концентрация может составить от 3 до 70% масс., может фактически использоваться коммерчески доступный 35% масс. пероксид водорода. С целью получения хорошего выхода и безопасности представляется более предпочтительным разбавлять пероксид водорода водой до раствора, массовая процентная концентрация которого составляет от 10 до 30% масс.
Примеры сульфоксидов, применимых в настоящем изобретении, включают диметилсульфоксид, дибутилсульфоксид, ди-втор-бутилсульфоксид, метилфенилсульфоксид, (R)-(+)-метил-пара-толилсульфоксид, (S)-(-)-метил-пара-толилсульфоксид или дифенилсульфоксид и т.д. С точки зрения хорошего выхода и низкой стоимости, предпочтительным сульфоксидом является диметилсульфоксид, дибутилсульфоксид или дифенилсульфоксид, и более предпочтительно - диметилсульфоксид.
Молярное соотношение соединения железа и трифторметилиодида предпочтительно составляет от 1:1 до 1:100, и более предпочтительно - от 1:1 до 1:30.
Молярное соотношение соединения железа и пероксида предпочтительно составляет от 1:1 до 1:50, и более предпочтительно - от 1:1 до 1:10.
Молярное соотношение соединения железа и сульфоксида предпочтительно составляет от 1:50 до 1:30000, и более предпочтительно - от 1:100 до 1:10000.
Настоящий реакционный реагент может дополнительно содержать кислоту. Например, подходящей кислотой может быть любая из неорганических кислот, такая как серная кислота, хлористоводородная кислота, бромистоводородная кислота, йодистоводородная кислота, азотная кислота, фосфорная кислота, гексафторфосфорная кислота и тетрафторборная кислота, и из органических кислот, такая как муравьиная кислота, уксусная кислота, пропионовая кислота, щавелевая кислота, пара-толуолсульфокислота, трифторметансульфоновая кислота и трифторуксусная кислота, и они могут применяться в соответствующей комбинации. Предпочтительной кислотой, позволяющей получить хороший выход, является серная кислота, тетрафторборная кислота или трифторметансульфоновая кислота, и более предпочтительна серная кислота.
Кроме того, также может применяться кислая соль серной кислоты. Примеры кислых солей включают гидросульфат тетраметиламмония, гидросульфат тетраэтиламмония, гидросульфат тетрабутиламмония, гидросульфат тетрафенилфосфония и т.д.
Если добавляется кислота, молярное соотношение соединения железа и кислоты предпочтительно составляет от 1:0,001 до 1:50, и более предпочтительно от 1:1 до 1:5.
Настоящий реакционный реагент может применяться при температурах, необязательно, выбранных в диапазоне от 20 до 100°С. Предпочтительной температурой, позволяющей получить хороший выход, является температура от 20 до 70°С.
Настоящий реакционный реагент может применяться в растворителе в соответствии с растворимостью соединения железа, трифторметилиодида, пероксида и сульфоксида, и/или растворимостью кислоты, если она используется.
Примеры используемых растворителей включают воду, N,N-диметилформамид, уксусную кислоту, трифторуксусную кислоту, тетрагидрофуран, диэтиловый эфир, этилацетат, ацетон, 1,4-диоксан, трет-бутиловый спирт, этанол, метанол, изопропиловый спирт, трифторэтанол, гексаметилфосфорный триамид, N-метил-2-пирролидон, N,N,N',N'-тетраметилмочевину, N,N'-диметилпропиленмочевину и т.д., и они могут применяться соответственно в комбинации. Растворитель может представлять собой сульфоксид, являющийся жидким при температуре реакции, а именно диметилсульфоксид, дибутилсульфоксид и т.д. Для получения хорошего выхода предпочтительным растворителем является вода, сульфоксид или смесь растворителей воды и сульфоксида. Количество растворителя, которое следует использовать, определяется так, чтобы концентрация соединения железа стала, предпочтительно, от 0,1 до 10 моль/л, и, более предпочтительно, от 0,5 до 5 моль/л, тем не менее это зависит от растворимости соединения железа.
Трифторметилиодид может применяться в газообразном состоянии, не переводя его в раствор. В этом случае он может применяться в виде газообразной смеси после его разбавления газом, таким как аргон, азот, воздух, гелий или кислород, в которой молярная фракция трифторметилиодида составляет от 1 до 100%. В том случае, когда реакция осуществляется в закрытой системе, трифторметилиодид или его газообразная смесь могут использоваться как реакционная атмосфера. В этом случае, несмотря на то, что давление может быть, необязательно, выбрано в диапазоне от атмосферного давления 0,1 МПа до 1,0 МПа, реакция довольно успешно протекает даже при атмосферном давлении. С другой стороны, трифторметилиодид или его газовая смесь могут быть введены путем барботирования в реакционный раствор в открытой системе. В этом случае скорость введения трифторметилиодида или его газовой смеси может быть выбрана в диапазоне от 1 до 200 мл/мин, впрочем это зависит от объема реакции, от количества катализатора, от температуры реакции и от молярной фракции трифторметилиодида в газовой смеси.
Посредством применения настоящего реакционного реагента различные органические соединения как субстраты могут быть трифторметилированы, и среди них соединения, имеющие енаминовый фрагмент в их молекуле, фураны, тиофены и бензолы могут быть трифторметилированы довольно успешно. Примеры соединений, имеющие енаминовый фрагмент, включают енамины, N-виниллактамы, урацилы, псевдоурацилы, тимины, цитозины, аденины, гуанины, гипоксантины, ксантины, пиразолы, индолы, пирролы, триазолы, анилины, пиридины, пиримидины, пиразины и т.п.
Молярное соотношение соединения железа к одному из этих веществ предпочтительно составляет от 1:0,1 до 1:1000, и более предпочтительно от 1:1 до 1:50.
Не существует определенных ограничений в отношении порядка соединения железа, трифторметилиодида, пероксида и сульфоксида реакционного реагента для взаимодействия с реакционным субстратом, и ингредиенты реагента могут вноситься для взаимодействия последовательно или все вместе с субстратом.
Примеры
Настоящее изобретение описано далее более подробно со ссылками на примеры, но следует понимать, что настоящее изобретение не ограничивается такими примерами.
Пример 1
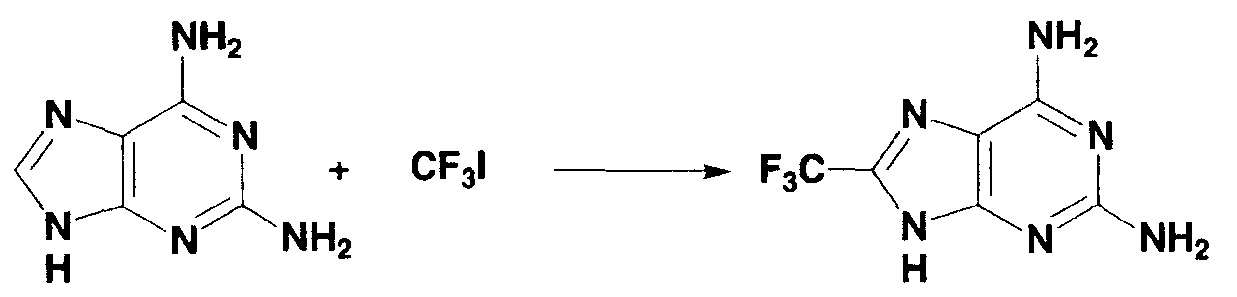
0,12 г (0,8 ммоль) 2,6-диаминопурина взвешивали и помещали в двугорлую колбу, и газообразную среду в колбе заменяли аргоном. Туда же добавляли следующие вещества: 3,0 мл диметилсульфоксида, 0,8 мл раствора трифторметилиодида в диметилсульфоксиде с концентрацией 3,0 моль/л, 0,25 мл 1,0 моль/л водного раствора сульфата железа (II) и 0,15 мл 30% водного раствора пероксида водорода и смесь перемешивали в течение 20 минут. Во время перемешивания температура реакционной системы возрастала в диапазоне от 40°С до 50°С. Затем полученный в результате раствор охлаждали до комнатной температуры. Образование 2,6-диамино-8-трифторметилпурина (выход по данным19F-ЯМР: 40%) подтверждали спектром19F-ЯМР с 2,2,2-трифторэтанолом в качестве внутреннего стандарта. К полученному раствору добавляли воду, гидрокарбонат натрия, кроме того, добавляли для нейтрализации и требуемый продукт экстрагировали этилацетатом. Экстракт пропускали через хроматографическую колонку и концентрировали при пониженном давлении, получая 2,6-диамино-8-трифторметилпиридин в виде белого твердого вещества (0,043 г, выход: 20%).
1Н-ЯМР (дейтерированный диметилсульфоксид): δ 6,17 (с, 2Н), 7,26 (с, 2Н), 12,2 (ушир.с, 1Н).
13С-ЯМР (дейтерированный диметилсульфоксид): δ 114,8, 116,0 (кв, JCF=269,1 Гц), 144,3, 152,7, 157,0, 161,7.
19F-ЯМР (дейтерированный диметилсульфоксид): δ -62,6.
МС (m/z): 218 [M]+.
Пример 2
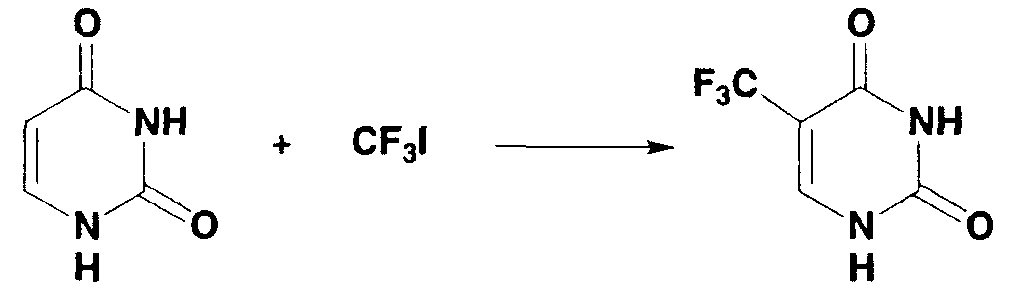
0,055 г (0,5 ммоль) урацила взвешивали и помещали в двугорлую колбу, и газообразную среду в колбе заменяли аргоном. Туда же добавляли следующие вещества: 1,0 мл 1N раствора серной кислоты в диметилсульфоксиде, 0,5 мл 2,1 моль/л раствора трифторметилиодида в диметилсульфоксиде, 0,1 мл 30% водного раствора пероксида водорода и 0,15 мл 1,0 моль/л водного раствора сульфата железа(II) и смесь перемешивали в течение 20 минут. Во время перемешивания температура реакционной системы возрастала в диапазоне от 40°С до 50°С. Затем полученный в результате раствор охлаждали до комнатной температуры. Образование 5-трифторметилурацила (выход по данным19F-ЯМР: 90%) подтверждали спектром19F-ЯМР с 2,2,2-трифторэтанолом в качестве внутреннего стандарта. 5-Трифторметилурацил получали в виде белого твердого вещества (0,16 г, выход: 87%) таким же образом, как в примере 1.
1Н-ЯМР (дейтерированный ацетон): δ 8,09 (с, 1Н), 10,5 (ушир.с, 2Н).
13С-ЯМР (дейтерированный ацетон): δ 104,0 (кв, JCF=32,4 Гц), 123,6 (кв, JCF=268,2 Гц), 144,2 (кв, JCF=5,9 Гц), 150,9, 160,2.
19F-ЯМР (дейтерированный ацетон): δ -64,1.
МС (m/z): 180 [M]+.
Пример 3
Образование 5-трифторметилурацила (выход по данным19F-ЯМР: 75%) подтверждали таким же образом, как и в примере 2, за исключением того, что 1,0 моль/л водный раствор аммонийсульфата железа (II) использовали вместо 1,0 моль/л водного раствора сульфата железа (II).
Пример 4
0,055 г (0,5 ммоль) урацила и 0,014 г (0,25 ммоль) порошка железа взвешивали и помещали в двугорлую колбу, и газообразную среду в колбе заменяли аргоном. Туда же добавляли следующие вещества: 1,0 мл диметилсульфоксида, 1,0 мл 1N раствора серной кислоты в диметилсульфоксиде, 0,5 мл 3,0 моль/л раствора трифторметилиодида в диметилсульфоксиде и 0,1 мл 30% водного раствора пероксида водорода и смесь перемешивали в течение 20 минут. Во время перемешивания температура реакционной системы возрастала в диапазоне от 40°С до 50°С. Затем полученный в результате раствор охлаждали до комнатной температуры. Последующую процедуру осуществляли таким же образом, как в примере 2 и образование 5-трифторметилурацила подтверждали (выход по данным19F-ЯМР: 30%).
Пример 5
0,055 г (0,5 ммоль) урацила взвешивали и помещали в двугорлую колбу, и газообразную среду в колбе заменяли аргоном. Туда же добавляли следующие вещества: 0,1 мл 42% водного раствора тетрафторборной кислоты, 1,0 мл диметилсульфоксида, 1,5 мл 2,0 моль/л раствора трифторметилиодида в диметилсульфоксиде, 0,15 мл 1,0 моль/л водного раствора тетрафторбората железа(II) и 0,1 мл 30% водного раствора пероксида водорода и смесь перемешивали 20 минут. Во время перемешивания температура реакционной системы возрастала в диапазоне от 40°С до 50°С. Затем полученный в результате раствор охлаждали до комнатной температуры. Последующую процедуру осуществляли таким же образом, как в примере 2 и образование 5-трифторметилурацила подтверждали (выход по данным19F-ЯМР: 88%).
Пример 6
0,055 г (0,5 ммоль) урацила взвешивали и помещали в двугорлую колбу, и газообразную среду в колбе заменяли аргоном. Туда же добавляли следующие вещества: 1,0 мл 1N раствора серной кислоты в диметилсульфоксиде, 1,5 мл 2,0 моль/л раствора трифторметилиодида в диметилсульфоксиде, 0,06 г композита пероксид водорода-мочевина и 0,15 мл 1 моль/л водного раствора сульфата железа(II) и смесь перемешивали в течение 20 минут. Во время перемешивания температура реакционной системы возрастала в диапазоне от 40°С до 50°С. Затем полученный в результате раствор охлаждали до комнатной температуры. Последующую процедуру осуществляли таким же образом, как в примере 2 и образование 5-трифторметилурацила подтверждали (выход по данным19F-ЯМР: 66%).
Пример 7
Образование 5-трифторметилурацила (выход по данным19F-ЯМР: 36%) подтверждали точно таким же образом, как и в примере 2, за исключением того, что диметилсульфоксид использовали вместо 1N раствора серной кислоты в диметилсульфоксиде.
Пример 8
0,055 г (0,5 ммоль) урацила взвешивали и помещали в двугорлую колбу, и газообразную среду в колбе заменяли трифторметилиодидом. Туда же добавляли следующие вещества: 2,5 мл дибутилсульфоксида, 0,027 мл концентрированной серной кислоты, 0,1 мл 30% водного раствора пероксида водорода и 0,15 мл 1,0 моль/л водного раствора сульфата железа (II) и смесь перемешивали в течение 20 минут. Во время перемешивания температура реакционной системы возрастала в диапазоне от 40°С до 50°С. Затем полученный в результате раствор охлаждали до комнатной температуры. Образование 5-трифторметилурацила (выход по данным19F-ЯМР: 0,19%) подтверждали спектром19F-ЯМР с 2,2,2-трифторэтанолом в качестве внутреннего стандарта.
Пример 9
0,055 г (0,5 ммоль) урацила взвешивали и помещали в двугорлую колбу, и газообразную среду в колбе заменяли трифторметилиодидом. Туда же добавляли следующие вещества: 2,5 г дифенилсульфоксида, 0,027 мл концентрированной серной кислоты, 0,1 мл 30% водного раствора пероксида водорода и 0,15 мл 1,0 моль/л водного раствора сульфата железа(II) и смесь перемешивали в течение 20 минут. Во время перемешивания температура реакционной системы возрастала в диапазоне от 40°С до 50°С. Затем полученный в результате раствор охлаждали до комнатной температуры. Образование 5-трифторметилурацила (выход по данным19F-ЯМР: 0,47%) подтверждали спектром19F-ЯМР с 2,2,2-трифторэтанолом в качестве внутреннего стандарта.
Пример 10
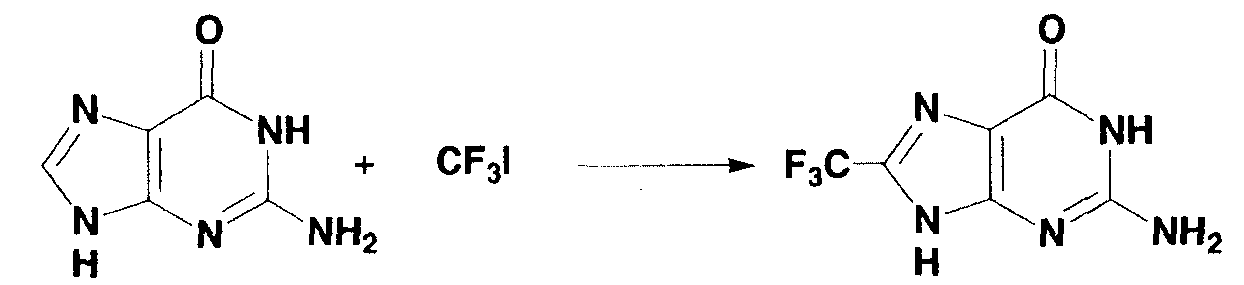
0,10 г (0,67 ммоль) гуанина взвешивали и помещали в двугорлую колбу, и газообразную среду в колбе заменяли аргоном. Туда же добавляли следующие вещества: 130 мл диметилсульфоксида, 1,3 мл 1N раствора серной кислоты в диметилсульфоксиде, 0,7 мл 3,0 моль/л раствора трифторметилиодида в диметилсульфоксиде, 0,15 мл 30% водного раствора пероксида водорода и 0,2 мл 1,0 моль/л водного раствора сульфата железа(II) и смесь перемешивали в течение 20 минут. Во время перемешивания температура реакционной системы возрастала в диапазоне от 40°С до 50°С. Затем полученный в результате раствор охлаждали до комнатной температуры. Образование 8-трифторметилгуанина (выход по данным19F-ЯМР: 43%) подтверждали спектром19F-ЯМР с 2,2,2-трифторэтанолом в качестве внутреннего стандарта. Последующую процедуру осуществляли таким же образом, как в примере 1 и 8-трифторметилгуанин получали в виде белого твердого вещества (0,018 г, выход: 8%).
1Н-ЯМР (дейтерированный диметилсульфоксид): δ 6,60 (ушир.с, 2Н), 10,81 (ушир.с, 1Н), 13,73 (ушир.с, 1Н).
13С-ЯМР (дейтерированный диметилсульфоксид): δ 116,3, 119,2 (кв, JCF=269,3 Гц), 134,9 (кв, JCF=40,7 Гц), 152,8, 154,7, 156,6.
19F-ЯМР (дейтерированный диметилсульфоксид): δ -63,0.
МС (m/z): 218 [M-Н]-.
Пример 11
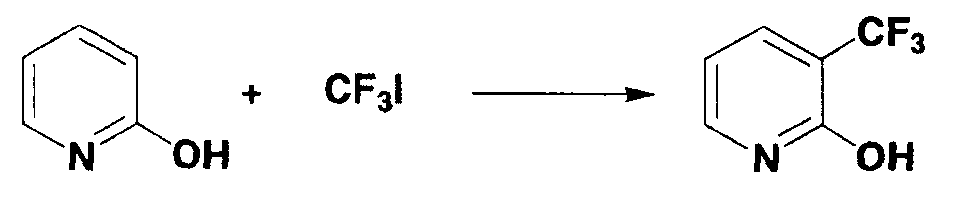
0,19 г (2,0 ммоль) 2-гидроксипиридина и 0,11 г (0,6 ммоль) ферроцена взвешивали и помещали в двугорлую колбу, и газообразную среду в колбе заменяли аргоном. Туда же добавляли следующие вещества: 8,0 мл диметилсульфоксида, 2,0 мл 3,0 моль/л раствора трифторметилиодида в диметилсульфоксиде и 0,4 мл 30% водного раствора пероксида водорода и смесь перемешивали в течение 20 минут. Во время перемешивания температура реакционной системы возрастала в диапазоне от 40°С до 50°С. Затем полученный в результате раствор охлаждали до комнатной температуры. Образование 2-гидрокси-3-трифторметилпиридина (выход по данным19F-ЯМР: 64%) подтверждали спектром19F-ЯМР с 2,2,2-трифторэтанолом в качестве внутреннего стандарта. Последующую процедуру осуществляли таким же образом, как в примере 1 и 2-гидрокси-3-трифторметилпиридин получали в виде белого твердого вещества (0,081 г, выход: 50%).
1Н-ЯМР (дейтерированный хлороформ): δ 6,34 (дд, J=6,9, 5,6 Гц, 1Н), 7,65 (д, J=5,6 Гц, 1Н), 7,88 (д, J=6,9 Гц, 1Н), 13,25 (ушир.с, 1Н).
13С-ЯМР (дейтерированный хлороформ): δ 105,6, 120,4 (кв, JCF=31,4 Гц), 122,7 (кв, JCF=271,3 Гц), 139,2, 140,7 (кв, JCF=4,9 Гц), 161,4.
19F-ЯМР (дейтерированный хлороформ): δ -66,0.
МС (m/z): 163 [M]+.
Пример 12
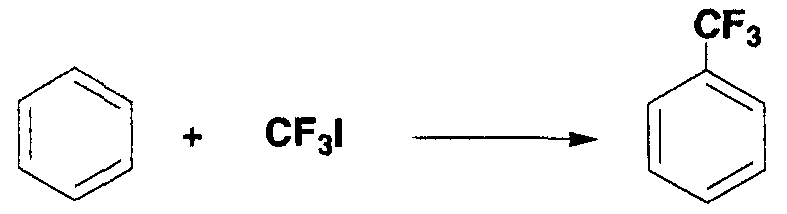
100 мл бензола, 2,0 мл диметилсульфоксида, 2,0 мл 1N раствора серной кислоты в диметилсульфоксиде, 1,0 мл 3,0 моль/л раствора трифторметилиодида в диметилсульфоксиде, 0,2 мл 30% водного раствора пероксида водорода и 0,3 мл 1,0 моль/л водного раствора сульфата железа (II) загружали в двугорлую колбу, в которой газообразную среду замещали аргоном, и смесь перемешивали в течение 20 минут. Во время перемешивания температура реакционной системы возрастала в диапазоне от 40°С до 50°С. Затем полученный в результате раствор охлаждали до комнатной температуры. Образование трифторметилбензола (выход по данным19F-ЯМР: 20%) подтверждали спектром19F-ЯМР с 2,2,2-трифторэтанолом в качестве внутреннего стандарта. Последующую процедуру осуществляли таким же образом, как в примере 1 и трифторметилбензол получали в виде бесцветного масла (0,02 г, выход: 13%).
1Н-ЯМР (дейтерированный хлороформ): δ 7,74 (м, 5Н).
13С-ЯМР (дейтерированный хлороформ): δ 124,3 (кв, JCF=266,4 Гц), 125,3 (кв, JCF=3,0 Гц), 128,8, 130,8 (кв, JCF=31,5 Гц), 131,8.
19F-ЯМР (дейтерированный хлороформ): δ -63,1.
МС (m/z): 146 [M]+.
Пример 13
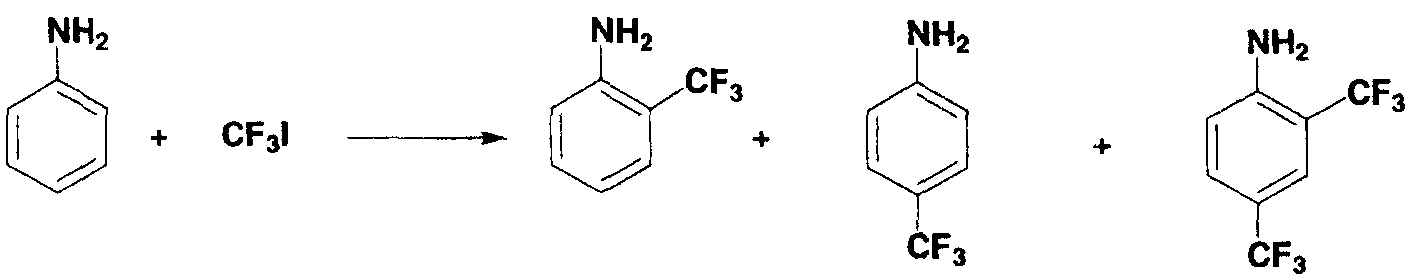
180 мл анилина, 5,0 мл диметилсульфоксида, 4,0 мл 1N раствора серной кислоты в диметилсульфоксиде, 0,7 мл 3,0 моль/л раствора трифторметилиодида в диметилсульфоксиде, 0,4 мл 30% водного раствора пероксида водорода и 0,6 мл 1,0 моль/л водного раствора сульфата железа(II) загружали в двугорлую колбу, в которой газообразную среду заменяли аргоном и смесь перемешивали в течение 20 минут. Во время перемешивания температура реакционной системы возрастала в диапазоне от 40°С до 50°С. Затем полученный в результате раствор охлаждали до комнатной температуры. Молекулярную массу и время удерживания, полученные по данным19F-ЯМР и ГХ-МС, сравнивали с подобными данными для коммерчески доступного стандартного образца для подтверждения образования каждого вещества, 2-трифторметиланилина (выход по данным19F-ЯМР: 8,5%), 4-трифторметиланилина (выход по данным19F-ЯМР: 7,2%) и 2,4-бис(трифторметил)анилина (выход по данным19F-ЯМР: 4,2%).
2-трифторметиланилин
19F-ЯМР (дейтерированный диметилсульфоксид): δ -63,0.
МС (m/z): 161 [M]+.
4-трифторметиланилин
19F-ЯМР (дейтерированный диметилсульфоксид): δ -61,3.
МС (m/z): 161 [M]+.
2,4-бис(трифторметил)анилин
19F-ЯМР (дейтерированный диметилсульфоксид): δ -62,0, -63,7.
МС (m/z): 229 [M]+.
Пример 14
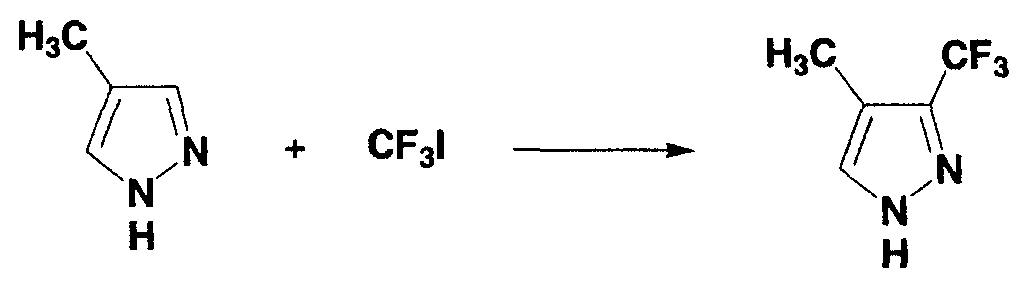
0,047 г (0,25 ммоль) ферроцена взвешивали и помещали в двугорлую колбу, и газообразную среду в колбе замещали аргоном. Туда же добавляли следующие вещества: 0,07 мл (0,88 ммоль) 4-метилпиразола, 1,7 мл диметилсульфоксида, 1,7 мл 1N раствора серной кислоты в диметилсульфоксиде, 0,7 мл 3,0 моль/л раствора трифторметилиодида в диметилсульфоксиде и 0,15 мл 30% водного раствора пероксида водорода и смесь перемешивали в течение 20 минут. Во время перемешивания температура реакционной системы возрастала в диапазоне от 40°С до 50°С. Затем полученный в результате раствор охлаждали до комнатной температуры. Образование 4-метил-3-трифторметилпиразола (выход по данным19F-ЯМР: 45%) подтверждали спектром19F-ЯМР с 2,2,2-трифторэтанолом в качестве внутреннего стандарта. Последующую процедуру осуществляли таким же образом, как в примере 1 и 4-метил-3-трифторметилпиразол получали в виде бесцветного масла (0,054 г, выход: 36%).
1Н-ЯМР (дейтерированный диметилсульфоксид): δ 2,12 (с, 3Н), 7,73 (с, 1Н)), 13,29 (ушир.с, 1Н).
13С-ЯМР (дейтерированный диметилсульфоксид): δ 7,62, 113,5, 122,5 (кв, JCF=268,7 Гц), 129,8, 138,7 (кв, JCF=34,2 Гц).
19F-ЯМР (дейтерированный диметилсульфоксид): δ -59,8.
МС (m/z): 150 [M]+.
Сравнительный пример 1
0,055 г (0,5 ммоль) урацила взвешивали и помещали в двугорлую колбу, и газообразную среду в колбе заменяли аргоном. Туда же добавляли следующие вещества: 1,0 мл 1N раствора серной кислоты в диметилсульфоксиде, 0,5 мл 2,1 моль/л раствора трифторметилиодида в диметилсульфоксиде и 0,15 мл 1,0 моль/л водного раствора сульфата железа(II) и смесь перемешивали в течение 20 минут. Последующую процедуру осуществляли таким же образом, как в примере 2 и образование 5-трифторметилурацила не обнаруживали.
Сравнительный пример 2
0,055 г (0,5 ммоль) урацила взвешивали и помещали в двугорлую колбу, и газообразную среду в колбе заменяли аргоном. Туда же добавляли следующие вещества: 1,0 мл 1N раствора серной кислоты в диметилсульфоксиде, 0,5 мл 2,1 моль/л раствора трифторметилиодида в диметилсульфоксиде и 0,1 мл 30% водного раствора пероксида водорода, и смесь перемешивали в течение 20 минут. Последующую процедуру осуществляли таким же образом, как в примере 2 и образование 5-трифторметилурацила не обнаруживали.
Сравнительный пример 3
0,055 г (0,5 ммоль) урацила взвешивали и помещали в двугорлую колбу, и газообразную среду в колбе заменяли аргоном. Туда же добавляли следующие вещества: 1,0 мл 1N раствора серной кислоты в ацетоне, 0,5 мл 2,1 моль/л раствора трифторметилиодида в ацетоне, 0,1 мл 30% водного раствора пероксида водорода и 0,15 мл 1,0 моль/л водного раствора сульфата железа (II), и смесь перемешивали в течение 20 минут. Последующую процедуру осуществляли таким же образом, как в примере 2 и образование 5-трифторметилурацила не обнаруживали.
Возможность применения в производственных условиях
Реакционный реагент в соответствии с настоящим изобретением очень полезен в промышленности в качестве универсального реагента, предоставляющего возможность получения с высоким выходом и эффективностью органических соединений, содержащих трифторметильную группу, которые являются полезными соединениями для медицинских и сельскохозяйственных препаратов, функциональных материалов и промежуточных соединений для их промышленного получения.
Полное раскрытие заявки на патент Японии № 2006-300571, зарегистрированной 6 ноября 2006 года, включающей описание, формулу изобретения и реферат, включено в настоящее описание в качестве ссылки в полном объеме.
Реферат
Раскрыт реакционный реагент для трифторметилирования, который имеет высокую степень общего многоцелевого назначения и высокую эффективность, а именно раскрыт реакционный реагент для трифторметилирования, который включает соединение железа, иодированный трифторметил, сульфоксид и пероксид. Реакционный реагент может дополнительно включать кислоту. Соединением железа может быть сульфат железа(II), аммонийсульфат железа(II), тетрафторборат железа(II), ферроцен, бис(η5-пентаметилциклопентадиенил)железо или порошок железа. Сульфоксидом может быть диметилсульфоксид. Пероксидом может быть пероксид водорода или комплекс пероксид водорода-мочевина. Кислотой может быть серная кислота, тетрафторборная кислота или трифторметансульфоновая кислота. 12 з.п. ф-лы.
Формула
Документы, цитированные в отчёте о поиске
Производное пиразола, агент для борьбы с насекомыми, содержащий его в качестве активного ингредиента, и способы его получения

Комментарии