Комплексы - RU2682680C2
Код документа: RU2682680C2
Чертежи






Описание
Настоящее изобретение относится к необязательно замещенным π-аллильным палладиевым комплексам и их применению в реакциях сочетания.
Заявка WO2011/161451 (от Johnson Matthey PLC) описывает π-аллильные комплексы, такие как π-аллильные палладиевые комплексы и π-аллильные никелевые комплексы.
Faller с соавт. (Organometallics, 2004, 23, 2179-2185) описывает получение комплекса (кротил)Pd(Cy2P-бифенил)Cl в исследованиях механизма. Faller с соавт. не раскрывает и не предполагает, что этот комплекс может быть использован в качестве предкатализатора для реакций сочетания.
Подтверждено, что применение [(аллил)PdCl]2 или [(циннамил)PdCl]2 в комбинации с биарильными/гетероарильными фосфиновыми лигандами, такими как лиганды Бухвальда, в реакциях сочетания является ограниченным и имеет непредсказуемый успех. В попытке преодолеть ограничения генерирования катализатора из палладиевых источников, таких как [(аллил)PdCl]2, Pd(dba)х (х=1, 1,5 или 2), или Pd(OAc)2, с помощью комбинаций лигандов Бухвальда, группа Бухвальда в МТИ представила библиотеку трех поколений палладациклических предкатализаторов, использующих громоздкие биарилфосфины, как показано ниже.

Палладациклы, однако, демонстрируют ряд ограничений. Во-первых, синтез палладациклов 1-го поколения требует нескольких стадий, включая генерирование нестабильного промежуточного продукта [(TMEDA)PdMe2]. Синтезы палладациклов 2-го и 3-го поколения требуют использование потенциально токсичного 2-аминобифенила, который может быть загрязнен высокотоксичным 4-изомером, что требует необходимости высокой чистоты сырья. Кроме того, активация палладациклов 2-го и 3-го поколения генерирует эквивалент генотоксического карбазола. Исходное вещество аминобифенил и побочный продукт карбазол могут загрязнять реакционные смеси. Следовательно, очистка может быть сложной, в дополнение к рассмотрению опасений по поводу вопросов безопасности и охраны здоровья участвующих в обращении с этими веществами. Кроме того, восстановительно отщепленный карбазол (как это показано на следующей фигуре) может разрушать арил-электрофильное исходное вещество, а также значительно замедлять скорость некоторых реакций кросс-сочетания.
Активация палладацикла

Активация самых последних N-замещенных палладациклов 3-го поколения генерирует эквивалент либо N-метилкарбазола, либо N-фенилкарбазола, и мало известно об их токсичности. N-Замещенный вариант палладациклов 3-го поколения также требует дополнительной стадии синтеза для получения соответствующих незамещенных аналогов.
Остается потребность в создании палладиевых предкатализаторов с однозначно определенными соотношениями лиганд/палладий, которые преодолевают ограничения предшествующего уровня техники.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Во многих случаях, аллильные димеры, такие как [(аллил)PdCl]2, не функционируют хорошо в качестве палладиевых источников с биарилфосфинами и возникают трудности в образовании активных катализаторов с помощью комбинации аллильного димера/лиганда Бухвальда. Авторы настоящего изобретения, однако, обнаружили класс необязательно замещенных π-аллилпалладиевых комплексов, которые могут быть использованы для осуществления различных реакций сочетания, таких как реакции образования связи C-N и С-С. В некоторых вариантах осуществления π-аллильные комплексы представляют собой высокоактивные катализаторы. В некоторых вариантах осуществления π-аллильные комплексы устойчивы к воздуху и влажности при температуре окружающей среды.
В одном аспекте настоящее изобретение относится к комплексу палладия (II) формулы (1):

в котором:
R1 и R2 независимо представляют собой органические группы, имеющие 1-20 атомов углерода, или R1 и R2 соединены с образованием кольцевой структуры с Е;
R3, R4, R5, R6, R7, R8, R9, R10 и R11 независимо представляют собой -Н или органические группы, имеющие 1-20 атомов углерода; или
R1/R3 или R2/R3 образует кольцевую структуру с атомами, к которым они присоединены, и в этом случае R4/R5, R5/R6, R7/R8, R8/R9, R9/R10 или R10/R11 могут независимо образовывать кольцевую структуру с атомами углерода, к которым они присоединены, или R1, R2, R4, R5, R6, R7, R8, R9, R10 и R11 являются такими, как определено выше;
R12 представляет собой органическую группу, имеющую 1-20 атомов углерода;
m равно 0, 1, 2, 3, 4 или 5;
Е представляет собой P или As; и
Х представляет собой координирующий анионный лиганд;
при условии, что палладиевый комплекс формулы (1) не представляет собой (π-кротил)PdCl(дициклогексилфосфино-2-бифенил).
В другом аспекте настоящее изобретение относится к палладиевому комплексу формулы (2):

в котором:
R18 и R19 независимо выбирают из группы, состоящей из -Me, -Et, -нPr, -изоPr, -нBu, -изоBu, циклогексила и циклогептила;
R12 представляет собой органическую группу, имеющую 1-20 атомов углерода;
R20, R21, R22, R23 и R24 независимо представляют собой -Н или органические группы, имеющие 1-20 атомов углерода; или
одна или обе пары, выбранные из R20/R21 или R22/R23, могут независимо образовывать циклическую структуру с атомами, к которым они присоединены;
m равно 0, 1, 2, 3, 4 или 5; и
Х представляет собой координирующий анионный лиганд.
В другом аспекте настоящее изобретение относится к способу получения комплекса формулы (1) или комплекса формулы (2), включающему стадию взаимодействия комплекса формулы (3) с монодентатным биарильным лигандом формулы (4) или монодентатным бигетероарильным третичным фосфиновым лигандом формулы (5) с образованием комплекса формулы (1) или комплекса формулы (2),



где,
R1 и R2 независимо представляют собой органические группы, имеющие 1-20 атомов углерода, или R1 и R2 соединены с образованием кольцевой структуры с Е;
R3, R4, R5, R6, R7, R8, R9, R10 и R11 независимо представляют собой -Н или органические группы, имеющие 1-20 атомов углерода; или
одна или несколько пар, выбранных из R1/R3, R2/R3, R3/R4, R4/R5, R5/R6, R7/R8, R8/R9, R9/R10 или R10/R11, независимо могут образовывать кольцевую структуру с атомами углерода, к которым они присоединены;
R12 представляет собой органическую группу, имеющую 1-20 атомов углерода;
R18 и R19 независимо выбирают из группы, состоящей из -Me, -Et, -нPr, -изоPr, -нBu, -изоBu, циклогексила и циклогептила;
R20, R21, R22, R23 и R24 независимо представляют собой -Н или органические группы, имеющие 1-20 атомов углерода; или
одна или обе пары, выбранные из R20/R21 или R22/R23, независимо могут образовывать кольцевую структуру с атомами, к которым они присоединены;
m равно 0, 1, 2, 3, 4 или 5;
Е представляет собой P или As; и
Х представляет собой координирующий анионный лиганд;
при условии, что палладиевый комплекс формулы (1) не представляет собой (π-кротил)PdCl(дициклогексилфосфино-2-бифенил).
В другом аспекте настоящее изобретение относится к способу проведения реакции сочетания углерод-углерод в присутствии катализатора, причем способ включает:
(a) применение комплекса формулы (1):

в котором:
R1 и R2 независимо представляют собой органические группы, имеющие 1-20 атомов углерода, или R1 и R2 соединены с образованием кольцевой структуры с Е;
R3, R4, R5, R6, R7, R8, R9, R10 и R11 независимо представляют собой -Н или органические группы, имеющие 1-20 атомов углерода; или
R1/R3 или R2/R3 образует кольцевую структуру с атомами, к которым они присоединены, и в этом случае R4/R5, R5/R6, R7/R8, R8/R9, R9/R10 или R10/R11 могут независимо образовывать кольцевую структуру с атомами углерода, к которым они присоединены, или R1, R2, R4, R5, R6, R7, R8, R9, R10 и R11 являются такими, как определено выше;
R12 представляет собой органическую группу, имеющую 1-20 атомов углерода;
m равно 0, 1, 2, 3, 4 или 5;
Е представляет собой P или As; и
Х представляет собой координирующий анионный лиганд;
или:
(b) комплекса формулы (2), как определено в данном описании.
В другом аспекте настоящее изобретение относится к способу проведения реакции сочетания углерод-гетероатом в присутствии катализатора, причем способ включает:
(a) применение комплекса формулы (1):

в котором:
R1 и R2 независимо представляют собой органические группы, имеющие 1-20 атомов углерода, или R1 и R2 соединены с образованием кольцевой структуры с Е;
R3, R4, R5, R6, R7, R8, R9, R10 и R11 независимо представляют собой -Н или органические группы, имеющие 1-20 атомов углерода; или
R1/R3 или R2/R3 образует кольцевую структуру с атомами, к которым они присоединены, и в этом случае R4/R5, R5/R6, R7/R8, R8/R9, R9/R10 или R10/R11 могут независимо образовывать кольцевую структуру с атомами углерода, к которым они присоединены, или R1, R2, R4, R5, R6, R7, R8, R9, R10 и R11 являются такими, как определено выше;
R12 представляет собой органическую группу, имеющую 1-20 атомов углерода;
m равно 0, 1, 2, 3, 4 или 5;
Е представляет собой P или As; и
Х представляет собой координирующий анионный лиганд;
или:
(b) комплекса формулы (2), как определено в данном описании.
В другом аспекте настоящее изобретение относится к применению комплекса формулы (1) или комплекса формулы (2) в качестве катализатора реакции сочетания углерод-углерод, где:
(a) комплекс формулы (1) представляет собой:

где:
R1 и R2 независимо представляют собой органические группы, имеющие 1-20 атомов углерода, или R1 и R2 соединены с образованием кольцевой структуры с Е;
R3, R4, R5, R6, R7, R8, R9, R10 и R11 независимо представляют собой -Н или органические группы, имеющие 1-20 атомов углерода; или
R1/R3 или R2/R3 образует кольцевую структуру с атомами, к которым они присоединены, и в этом случае R4/R5, R5/R6, R7/R8, R8/R9, R9/R10 или R10/R11 могут независимо образовывать кольцевую структуру с атомами углерода, к которым они присоединены, или R1, R2, R4, R5, R6, R7, R8, R9, R10 и R11 являются такими, как определено выше;
R12 представляет собой органическую группу, имеющую 1-20 атомов углерода;
m равно 0, 1, 2, 3, 4 или 5;
Е представляет собой P или As; и
Х представляет собой координирующий анионный лиганд;
и:
(b) комплекс формулы (2) такой, как определено в данном описании.
В другом аспекте настоящее изобретение относится к применению комплекса формулы (1) или комплекса формулы (2) в качестве катализатора в реакциях сочетания углерод-гетероатом, где:
(a) комплекс формулы (1) представляет собой:

где:
R1 и R2 независимо представляют собой органические группы, имеющие 1-20 атомов углерода, или R1 и R2 соединены с образованием кольцевой структуры с Е;
R3, R4, R5, R6, R7, R8, R9, R10 и R11 независимо представляют собой -Н или органические группы, имеющие 1-20 атомов углерода; или
R1/R3 или R2/R3 образует кольцевую структуру с атомами, к которым они присоединены, и в этом случае R4/R5, R5/R6, R7/R8, R8/R9, R9/R10 или R10/R11 могут независимо образовывать кольцевую структуру с атомами углерода, к которым они присоединены, или R1, R2, R4, R5, R6, R7, R8, R9, R10 и R11 являются такими, как определено выше;
R12 представляет собой органическую группу, имеющую 1-20 атомов углерода;
m равно 0, 1, 2, 3, 4 или 5;
Е представляет собой P или As; и
Х представляет собой координирующий анионный лиганд;
и:
(b) комплекс формулы (2) такой, как определено в данном описании.
Определения
Точка прикрепления фрагмента или заместителя представлена с помощью "-". Например, -ОН присоединен через атом кислорода.
"Алкил" относится к неразветвленной или разветвленной насыщенной углеводородной группе. В некоторых вариантах осуществления алкильная группа может иметь 1-20 атомов углерода, в некоторых вариантах осуществления 1-15 атомов углерода, в некоторых вариантах осуществления 1-8 атомов углерода. Алкильная группа может быть незамещенной. В качестве альтернативы алкильная группа может быть замещенной. Если не указано иное, алкильная группа может быть присоединена по любому подходящему атому углерода и, если она является замещенной, может быть замещена по любому подходящему атому. Типичные алкильные группы включают, но не ограничиваются ими, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, н-гексил и тому подобное.
Термин "циклоалкил" используется для обозначения насыщенного карбоциклического углеводородного радикала. Циклоалкильная группа может иметь одно кольцо или несколько конденсированных колец. В некоторых вариантах осуществления циклоалкильная группа может иметь 3-15 атомов углерода, в некоторых вариантах осуществления 3-10 атомов углерода, в некоторых вариантах осуществления 3-8 атомов углерода. Циклоалкильная группа может быть незамещенной. В качестве альтернативы циклоалкильная группа может быть замещенной. Если не указано иное, циклоалкильная группа может быть присоединена по любому подходящему атому углерода и, если она является замещенной, может быть замещена по любому подходящему атому. Типичные циклоалкильные группы включают, но не ограничиваются ими, циклопропил, циклобутил, циклопентил, циклогексил и тому подобное.
"Алкокси" относится к необязательно замещенной группе формулы алкил-O- или циклоалкил-O-, где алкил и циклоалкил являются такими, как определено выше.
"Алкоксиалкил" относится к необязательно замещенной группе формулы алкокси-алкил-, где алкокси и алкил являются такими, как определено выше.
"Арил" относится к ароматической карбоциклической группе. Арильная группа может иметь одно кольцо или несколько конденсированных колец. В некоторых вариантах осуществления арильная группа может иметь 6-20 атомов углерода, в некоторых вариантах осуществления 6-15 атомов углерода, в некоторых вариантах осуществления 6-12 атомов углерода. Арильная группа может быть незамещенной. В качестве альтернативы арильная группа может быть замещенной. Если не указано иное, арильная группа может быть присоединена по любому подходящему атому углерода и, если она является замещенной, может быть замещена по любому подходящему атому. Примеры арильных групп включают, но не ограничиваются ими, фенил, нафтил, антраценил и тому подобное.
"Арилалкил" относится к необязательно замещенной группе формулы арил-алкил-, где арил и алкил являются такими, как определено выше.
"Сочетание" относится к химической реакции, в которой соединяются две молекулы или части молекулы (Oxford Dictionary of Chemistry, Sixth Edition, 2008).
"Гало" или "галоген" означает -F, -Cl, -Br и -I.
"Гетероалкил" относится к неразветвленной или разветвленной насыщенной углеводородной группе, в которой один или несколько атомов углерода независимо замещены одним или несколькими гетероатомами (например, атомами азота, кислорода, фосфора и/или серы). Гетероалкильная группа может быть незамещенной. В качестве альтернативы гетероалкильная группа может быть замещенной. Если не указано иное, гетероалкильная группа может быть присоединена по любому подходящему атому и, если она является замещенной, может быть замещена по любому подходящему атому. Примеры гетероалкильных групп включают, но не ограничиваются ими, эфиры, тиоэфиры, первичные амины, вторичные амины, третичные амины и тому подобное.
Термин "гетероциклоалкил" относится к насыщенной циклической углеводородной группе, в которой один или несколько атомов углерода независимо замещены одним или несколькими гетероатомами (например, атомами азота, кислорода, фосфора и/или серы). Гетероциклоалкильная группа может быть незамещенной. В качестве альтернативы гетероциклоалкильная группа может быть замещенной. Если не указано иное, гетероциклоалкильная группа может быть присоединена по любому подходящему атому и, если она является замещенной, может быть замещена по любому подходящему атому. Примеры гетероциклоалкильных групп включают, но не ограничиваются ими, эпоксид, морфолинил, пиперидинил, пиперазинил, тииранил, пирролидинил, пиразолидинил, имидазолидинил, тиазолидинил, тиоморфолинил и тому подобное.
"Гетероарил" относится к ароматической карбоциклической группе, в которой один или несколько атомов углерода независимо замещены одним или несколькими гетероатомами (например, атомами азота, кислорода, фосфора и/или серы). Гетероарильная группа может быть незамещенной. В качестве альтернативы гетероарильная группа может быть замещенной. Если не указано иное, гетероарильная группа может быть присоединена по любому подходящему атому и, если она является замещенной, может быть замещена по любому подходящему атому. Примеры гетероарильных групп включают, но не ограничиваются ими, тиенил, фуранил, пирролил, имидазолил, пиразолил, тиазолил, изотиазолил, оксазолил, изоксазолил, триазолил, тиадиазолил, тиофенил, оксадиазолил, пиридинил, пиримидил, бензоксазолил, бензтиазолил, бензимидазолил, индолил, хинолинил и тому подобное.
"Замещенный" относится к группе, в которой один или несколько атомов водорода каждый независимо замещены заместителями (например, 1, 2, 3, 4, 5 или более), которые могут быть одинаковыми или различными. Примеры заместителей включают, но не ограничиваются ими, -гало, -C(гало)3, -Ra, =O, =S, -O-Ra, -S-Ra, -NRaRb, -CN, -NO2, -C(O)-Ra, -COORa, -C(S)-Ra, -C(S)ORa, -S(O)2OH, -S(O)2-Ra, -S(O)2NRaRb, -O-S(O)-Ra и -CONRaRb, и, в частности -гало, -C(гало)3 (например, -CF3), -Ra, -O-Ra, -NRaRb, -CN, или -NO2. Ra и Rb независимо выбирают из группы, состоящей из Н, алкила, арила, арилалкила, гетероалкила, гетероарила, или Ra и Rb вместе с атомом, к которому они присоединены, образуют гетероциклоалкильную группу. Ra и Rb могут быть незамещенными или дополнительно замещены, как определено в данном описании.
"Тиоалкил" относится к необязательно замещенной группе формулы алкил-S- или циклоалкил-S-, где алкил и циклоалкил являются такими, как определено выше.
ПОДРОБНОЕ ОПИСАНИЕ
В одном аспекте настоящее изобретение относится к комплексу палладия (II) формулы (1):

в котором:
R1 и R2 независимо представляют собой органические группы, имеющие 1-20 атомов углерода, или R1 и R2 соединены с образованием кольцевой структуры с Е;
R3, R4, R5, R6, R7, R8, R9, R10 и R11 независимо представляют собой -Н или органические группы, имеющие 1-20 атомов углерода; или
R1/R3 или R2/R3 образует кольцевую структуру с атомами, к которым они присоединены, и в этом случае R4/R5, R5/R6, R7/R8, R8/R9, R9/R10 или R10/R11 могут независимо образовывать кольцевую структуру с атомами углерода, к которым они присоединены, или R1, R2, R4, R5, R6, R7, R8, R9, R10 и R11 являются такими, как определено выше;
R12 представляет собой органическую группу, имеющую 1-20 атомов углерода;
m равно 0, 1, 2, 3, 4 или 5;
Е представляет собой P или As; и
Х представляет собой координирующий анионный лиганд;
при условии, что палладиевый комплекс формулы (1) не представляет собой (π-кротил)PdCl(дициклогексилфосфино-2-бифенил).
Когда Е представляет собой атом фосфора (т.е. Р), комплекс формулы (1) представляет собой комплекс палладия (II), содержащий монодентатный биарильный третичный фосфиновый лиганд, координирующий анионный лиганд и необязательно замещенную π-аллильную группу.
Когда Е представляет собой атом мышьяка (т.е. As), комплекс формулы (1) представляет собой комплекс палладия (II), содержащий монодентатный биарильный третичный арсиновый лиганд, координирующий анионный лиганд и необязательно замещенную π-аллильную группу.
R1 и R2 могут быть одинаковыми или различными. В одном варианте осуществления R1 и R2 являются одинаковыми. В другом варианте осуществления R1 и R2 являются различными. R1 и R2 выбирают в пределах ограничений, налагаемых стабильностью и правилами валентности. R1 и R2 могут быть независимо выбраны из группы, состоящей из замещенного и незамещенного неразветвленного алкила, замещенного и незамещенного разветвленного алкила, замещенного и незамещенного циклоалкила, замещенного и незамещенного арила и замещенного и незамещенного гетероарила, где гетероатомы независимо выбирают из серы, азота и кислорода. R1 и R2 независимо могут представлять собой замещенные или незамещенные разветвленные или неразветвленные алкильные группы, такие как метильная, этильная, н-пропильная, изопропильная, н-бутильная, изобутильная, втор-бутильная, трет-бутильная, пентильная (например, н-пентильная или неопентильная), гексильная, гептильная, октильная, нонильная, децильная, додецильная или стеарильная, циклоалкильные группы, такие как циклопропильная, циклобутильная, циклопентильная, циклогексильная или адамантильная, или арильные группы, такие как фенильная, нафтильная или антрацильная. В одном варианте осуществления алкильные группы могут быть необязательно замещены одним или несколькими (например, 1, 2, 3, 4 или 5) заместителями, каждый из которых может быть одинаковым или различным, такими как галогенид (F, Cl, Br или I) или алкоксигруппы, например, метокси, этокси или пропокси. Арильная группа может быть необязательно замещена одним или несколькими (например, 1, 2, 3, 4 или 5) заместителями, каждый из которых может быть одинаковым или различным, такими как галогенид (F, Cl, Br или I), неразветвленный или разветвленный алкил (например, С1-С10), алкокси (например, С1-С10алкокси), неразветвленный или разветвленный (диалкил)амино (например, (C1-C10диалкил)амино), гетероциклоалкил (например, С3-10 гетероциклоалкильные группы, такие как морфолинил и пиперидинил) или три(гало)метил (например, F3C-). Подходящие замещенные арильные группы включают, но не ограничиваются ими, 4-диметиламинофенил, 4-метилфенил, 3,5-диметилфенил, 4-метоксифенил, 4-метокси-3,5-диметилфенил и 3,5-ди(трифторметил)фенил. Замещенные или незамещенные гетероарильные группы, такие как пиридил, могут быть также использованы. В альтернативном варианте осуществления R1 и R2 соединены с образованием кольцевой структуры с Е, предпочтительно 4-7-членных колец. Предпочтительно R1 и R2 являются одинаковыми и представляют собой трет-бутил, циклогексил, фенил или замещенные фенильные группы, такие как 3,5-ди(трифторметил)фенил. R1 и R2 могут быть независимо выбраны из группы, состоящей из -Me, -Et, -нPr, -изоPr, -нBu, -изоBu, циклогексила и циклогептила.
R3, R4, R5, R6, R7, R8, R9, R10 и R11 независимо представляют собой -Н или органические группы, имеющие 1-20 атомов углерода. R3, R4, R5, R6, R7, R8, R9, R10 и R11 выбирают в пределах ограничений, налагаемых стабильностью и правилами валентности. R3, R4, R5 и R6 могут быть независимо выбраны из группы, состоящей из -Н, замещенных и незамещенных неразветвленных алкильных, замещенных и незамещенных разветвленных алкильных, замещенных и незамещенных циклоалкильных, замещенных и незамещенных алкокси, замещенных и незамещенных арильных, замещенных и незамещенных гетероарильных, замещенных и незамещенных -N(алкил)2 (где алкильные группы могут быть одинаковыми или различными и могут быть независимо выбраны из неразветвленных или разветвленных групп), замещенных и незамещенных -N(циклоалкил)2 (где циклоалкильные группы могут быть одинаковыми или различными), замещенных и незамещенных -N(арил)2 (где арильные группы могут быть одинаковыми или различными), замещенных и незамещенных -N(гетероарил)2 (где гетероарильные группы могут быть одинаковыми или различными) и замещенных и незамещенных гетероциклоалкильных групп. Гетероатомы в гетеарильных или гетероциклоалкильных группах могут быть независимо выбраны из серы, азота и/или кислорода. В одном варианте осуществления алкильные группы могут быть необязательно замещены одним или несколькими (например, 1, 2, 3, 4 или 5) заместителями, каждый из которых может быть одинаковым или различным, такими как галогенид (F, Cl, Br или I), алкоксигруппы, например, метокси, этокси или пропокси. Арильная группа может быть необязательно замещена одним или несколькими (например, 1, 2, 3, 4 или 5) заместителями, каждый из которых может быть одинаковым или различным, такими как галогенид (F, Cl, Br или I), неразветвленный или разветвленный алкил (например, С1-С10), алкокси (например, С1-С10алкокси), неразветвленный или разветвленный (диалкил)амино (например, (С1-С10диалкил)амино), гетероциклоалкил (например, С3-10 гетероциклоалкильные группы, такие как морфолинил и пиперидинил) или три(гало)метил (например, F3C-). Подходящие замещенные арильные группы включают, но не ограничиваются ими, 2-, 3- или 4-диметиламинофенил, 2-, 3- или 4-метилфенил, 2,3- или 3,5-диметилфенил, 2-, 3- или 4-метоксифенил и 4-метокси-3,5-диметилфенил. Замещенные или незамещенные гетероарильные группы, такие как пиридил, могут быть также использованы. Подходящие незамещенные группы -N(алкил)2 включают, но не ограничиваются ими, -NMe2, -NEt2 и -NPr2 (н- или изо-). Подходящая незамещенная группа -N(циклоалкил)2 включает, но не ограничивается ими, -N(Cy)2. Подходящие замещенные группы -N(алкил)2 включают, но не ограничиваются ими, -N(CH2CH2OMe)2 и -N(CF3)2. Подходящие незамещенные группы -N(арил)2 включают, но не ограничиваются ими, -NPh2. Подходящие замещенные группы -N(арил)2 включают, но не ограничиваются ими, -N(2-, 3- или 4-диметиламинофенил)2, -N(2-, 3- или 4-метилфенил)2, -N(2,3- или 3,5-диметилфенил)2, -N (2-, 3- или 4-метоксифенил)2 и -N(4-метокси-3,5-диметилфенил)2. Подходящие незамещенные группы -N(гетероарил)2 включают, но не ограничиваются ими, -N(фурил)2 и -N(пиридил)2. Замещенные и незамещенные гетероциклоалкильные группы включают, но не ограничиваются ими, С4-8-гетероциклоалкильные группы, такие как пиперидинил и морфолинил.
R3, R4, R5 и R6 могут быть независимо выбраны из группы, состоящей из -Н, незамещенного неразветвленного алкила, незамещенного разветвленного алкила, незамещенного циклоалкила, незамещенного алкокси, незамещенного -N(алкил)2 (где алкильные группы могут быть одинаковыми или различными и могут быть независимо выбраны из неразветвленных или разветвленных групп) и незамещенного -N(арил)2 (где арильные группы могут быть одинаковыми или различными). Разветвленные или неразветвленные алкильные группы могут включать группы, такие как метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил (например, н-пентил или неопентил), гексил, гептил, октил, нонил, децил, додецил или стеарил. Циклоалкильные группы могут включать группы, такие как циклопропил, циклобутил, циклопентил, циклогексил или адамантил. Алкоксигруппы могут включать в себя такие группы, как метокси (-ОМе), этокси (-OEt), н-пропокси (-O-н-Pr), изопропокси (-O-изо-Pr), н-бутокси (-O-н-Bu), изобутокси (-O-изо-Bu), втор-бутокси (-O-втор-Bu), трет-бутокси (-O-трет-Bu), -O-пентил, -O-гексил, -O-гептил, -O-октил, -O-нонил, -O-децил, -O-додецил. Группы -N(алкил)2 могут включать группы, такие как -NMe2, -NEt2, -N(н-Pr)2 или -N(изо-Pr)2.
R3, R4, R5 и R6 могут быть независимо выбраны из группы, состоящей из -Н, незамещенного -N(алкил)2 (где алкильные группы могут быть одинаковыми или различными и могут быть независимо выбраны из неразветвленных или разветвленных групп) и незамещенного -N(арил)2 (где арильные группы могут быть одинаковыми или различными).
R3, R4, R5 и R6 могут быть независимо выбраны из группы, состоящей из -Н, незамещенного неразветвленного алкила, незамещенного разветвленного алкила, незамещенного циклоалкила и незамещенного алкокси.
В одном варианте осуществления каждый из R3, R4, R5 и R6 представляет собой -H.
В другом варианте осуществления, по меньшей мере, один из R3, R4, R5 и R6 выбирают из группы, которая не представляет собой -Н. Например, один из R3, R4, R5 и R6 может быть выбран из группы, которая не представляет собой -Н, и, в частности два из R3, R4, R5 и R6, три из R3, R4, R5 и R6 или все из R3, R4, R5 и R6.
В другом варианте осуществления два из R3, R4, R5 и R6 представляют собой -H, а другие два из R3, R4, R5 и R6 независимо выбирают из группы, состоящей из незамещенного неразветвленного алкила, незамещенного разветвленного алкила, незамещенного циклоалкила и незамещенного алкокси. В другом варианте осуществления два из R3, R4, R5 и R6 представляют собой -H (например, R4 и R5), а другие два из R3, R4, R5 и R6 (например, R3 и R6) независимо выбирают из группы, состоящей из С1-5-алкила и -O-С1-5-алкила, и, в частности -Me, -Et, -Pr (н- или изо-),-Bu (н-, изо- или трет-), -ОМе, -OEt, -OPr (н- или изо-) и -OBu (н-, изо- или трет-), например, -Me, -Et, -ОМе и -OEt.
В другом варианте осуществления два из R3, R4, R5 и R6 представляют собой -H (например, R4 и R5), а другие два из R3, R4, R5 и R6 (например, R3 и R6), выбирают из группы, состоящей из незамещенного неразветвленного алкила, незамещенного разветвленного алкила, незамещенного циклоалкила и незамещенного алкокси. В предпочтительном варианте осуществления два из R3, R4, R5 и R6 представляют собой -H, а другие два из R3, R4, R5 и R6 выбирают из группы, состоящей из С1-5-алкила и -O-С1-5-алкила, и, в частности -Me, -Et, -Pr (н- или изо-),-Bu (н-, изо- или трет-), -ОМе, -OEt, -OPr (н- или изо-) и -OBu (н-, изо- или трет-), например, -Me, -Et, -ОМе и -OEt. В одном особенно предпочтительном варианте R4 и R5 представляют собой -H, а R3 и R6 представляют собой ОМе.
R7, R8, R9, R10 и R11 могут быть независимо выбраны из группы, состоящей из -Н, замещенных и незамещенных неразветвленных алкильных, замещенных и незамещенных разветвленных алкильных, замещенных и незамещенных циклоалкильных, замещенных и незамещенных алкокси, замещенных и незамещенных арильных, замещенных и незамещенных гетероарильных, замещенных и незамещенных -N(алкил)2 (где алкильные группы могут быть одинаковыми или различными и могут быть независимо выбраны из неразветвленных или разветвленных групп), замещенных и незамещенных -N(циклоалкил)2 (где циклоалкильные группы могут быть одинаковыми или различными), замещенных и незамещенных -N(арил)2 (где арильные группы могут быть одинаковыми или различными), замещенных и незамещенных -N(гетероарил)2 (где гетероарильные группы могут быть одинаковыми или различными) и замещенных и незамещенных гетероциклоалкильных групп. Гетероатомы в гетероарильных или гетероциклоалкильных группах могут быть независимо выбраны из серы, азота и/или кислорода. В одном варианте осуществления алкильные группы могут быть необязательно замещены одним или несколькими (например, 1, 2, 3, 4 или 5) заместителями, каждый из которых может быть одинаковым или различным, такими как галогенид (F, Cl, Br или I), алкоксигруппы, например, метокси, этокси или пропокси. Арильная группа может быть необязательно замещена одним или несколькими (например, 1, 2, 3, 4 или 5) заместителями, каждый из которых может быть одинаковым или различным, такими как галогенид (F, Cl, Br или I), неразветвленный или разветвленный алкил (например, С1-С10), алкокси (например, С1-С10алкокси), неразветвленный или разветвленный (диалкил)амино (например, (С1-С10диалкил)амино), гетероциклоалкил (например, С3-10 гетероциклоалкильные группы, такие как морфолинил и пиперидинил) или три(гало)метил (например, F3C-). Подходящие замещенные арильные группы включают, но не ограничиваются ими, 2-, 3- или 4-диметиламинофенил, 2-, 3- или 4-метилфенил, 2,3- или 3,5-диметилфенил, 2-, 3- или 4-метоксифенил и 4-метокси-3,5-диметилфенил. Замещенные или незамещенные гетероарильные группы, такие как пиридил, могут быть также использованы. Подходящие незамещенные группы -N(алкил)2 включают, но не ограничиваются ими, -NMe2, -NEt2 и -NPr2 (н- или изо-). Подходящая незамещенная группа -N(циклоалкил)2 включает, но не ограничивается ими, -N(Cy)2. Подходящие замещенные группы -N(алкил)2 включают, но не ограничиваются ими, -N(CH2CH2OMe)2 и -N(CF3)2. Подходящие незамещенные группы -N(арил)2 включают, но не ограничиваются ими, -NPh2. Подходящие замещенные группы -N(арил)2 включают, но не ограничиваются ими, -N(2-, 3- или 4-диметиламинофенил)2, -N(2-, 3- или 4-метилфенил)2, -N(2,3- или 3,5-диметилфенил)2, -N(2-, 3- или 4-метоксифенил)2 и -N(4-метокси-3,5-диметилфенил)2. Подходящие незамещенные группы -N(гетероарил)2 включают, но не ограничиваются ими, -N(фурил)2 и -N(пиридил)2. Замещенные и незамещенные гетероциклоалкильные группы включают С4-8-гетероциклоалкильные группы, такие как пиперидинил и морфолинил.
R7, R8, R9, R10 и R11, могут быть независимо выбраны из группы, состоящей из -Н, незамещенного неразветвленного алкила, незамещенного разветвленного алкила, незамещенного циклоалкила, незамещенного алкокси, незамещенного -N(алкил)2 (где алкильные группы могут быть одинаковыми или различными и могут быть независимо выбраны из неразветвленных или разветвленных групп) и незамещенного -N(арил)2 (где арильные группы могут быть одинаковыми или различными). Разветвленные или неразветвленные алкильные группы могут включать группы, такие как метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил (например, н-пентил или неопентил), гексил, гептил, октил, нонил, децил, додецил или стеарил. Циклоалкильные группы могут включать группы, такие как циклопропил, циклобутил, циклопентил, циклогексил или адамантил. Алкоксигруппы могут включать в себя такие группы, как метокси (-ОМе), этокси (-OEt), н-пропокси (-O-н-Pr), изопропокси (-O-изо-Pr), н-бутокси (-O-н-Bu), изобутокси (-O-изо-Bu), втор-бутокси (-O-втор-Bu), трет-бутокси (-O-трет-Bu), -O-пентил, -O-гексил, -O-гептил, -O-октил, -O-нонил, -O-децил, -O-додецил. Группы -N(алкил)2 могут включать группы, такие как -NMe2, -NEt2, -N(н-Pr)2 или -N(изо-Pr)2.
R7, R8, R9, R10 и R11, могут быть независимо выбраны из группы, состоящей из -Н, незамещенного -N(алкил)2 (где алкильные группы могут быть одинаковыми или различными и могут быть независимо выбраны из неразветвленных или разветвленных групп) и незамещенного -N(арил)2 (где арильные группы могут быть одинаковыми или различными).
R7, R8, R9, R10 и R11 могут быть независимо выбраны из группы, состоящей из -Н, незамещенного неразветвленного алкила, незамещенного разветвленного алкила, незамещенного циклоалкила и незамещенного алкокси.
В другом варианте осуществления, по меньшей мере, один из R7, R8, R9, R10 и R11 выбирают из группы, которая не представляет собой -H. Например, один из R7, R8, R9, R10 и R11 может быть выбран из группы, которая не представляет собой -Н, и, в частности два из R7, R8, R9, R10 и R11 (например, R7 и R11), три из R7, R8, R9, R10 и R11 (например, R7, R9 и R11), четыре из R7, R8, R9, R10 и R11 или все из R7, R8, R9, R10 и R11.
В одном варианте осуществления каждый из R7, R8, R9, R10 и R11 представляют собой -H.
В другом варианте осуществления четыре из R7, R8, R9, R10 и R11 представляют собой -H (например, R8, R9, R10 и R11), а другой один из R7, R8, R9, R10 и R11 (например, R7) выбирают из группы, состоящей из незамещенного неразветвленного алкила, незамещенного разветвленного алкила, незамещенного циклоалкила, незамещенного алкокси, незамещенного -N(алкил)2 (где алкильные группы могут быть одинаковыми или различными и могут быть независимо выбраны из неразветвленных или разветвленных групп) и незамещенного -N(арил)2 (где арильные группы могут быть одинаковыми или различными).
В другом варианте осуществления четыре из R7, R8, R9, R10 и R11 представляют собой -H (например, R8, R9, R10 и R11), а другой один из R7, R8, R9, R10 и R11 (например, R7) выбирают из группы, состоящей из С1-5-алкила, -O-С1-5-алкила и -N(С1-5-алкил)2, и, в частности -Me, -Et, -Pr (н- или изо-),-Bu (н-, изо- или трет-), -ОМе, -OEt, -OPr (н- или изо-), -OBu (н-, изо- или трет-), -NMe2, -NEt2, -N(н-Pr)2 или -N(изо-Pr)2, например, -Me, -Et, -н-Pr, -изо-Pr, -ОМе, -OEt, -O-н-Pr, -O-изо-Pr, -NMe2, -NEt2. Например, R8, R9, R10 и R11 представляют собой -H, и R7 выбирают из групп С1-5-алкила, -O-C1-5-алкила и -N(С1-5-алкил)2, таких как те, которые описаны выше. В другом варианте осуществления R8, R9, R10 и R11 представляют собой -H, а R7 выбирают из группы, состоящей из -ОМе, -O-изо-Pr, -NMe2, -NEt2, -N(н-Pr)2 и -N(изо-Pr)2, и, в частности -ОМе и -NMe2.
В другом варианте осуществления три из R7, R8, R9, R10 и R11 представляют собой -H (например, R8, R9 и R10), а другие два из R7, R8, R9, R10 и R11 (например, R7 и R11) независимо выбирают из группы, состоящей из незамещенного неразветвленного алкила, незамещенного разветвленного алкила, незамещенного циклоалкила, незамещенного алкокси, незамещенного -N(алкил)2 (где алкильные группы могут быть одинаковыми или различными и могут быть независимо выбраны из неразветвленных или разветвленных групп) и незамещенного -N(арил)2 (где арильные группы могут быть одинаковыми или различными).
В одном варианте осуществления три из R7, R8, R9, R10 и R11 представляют собой -H (например, R8, R9 и R10), а другие два из R7, R8, R9, R10 и R11 (например, R7 и R11) выбирают из группы, состоящей из незамещенного неразветвленного алкила, незамещенного разветвленного алкила, незамещенного циклоалкила, незамещенного алкокси, незамещенного -N(алкил)2 (где алкильные группы могут быть одинаковыми или различными и могут быть независимо выбраны из неразветвленных или разветвленных групп) и незамещенного -N(арил)2 (где арильные группы могут быть одинаковыми или различными).
В другом варианте осуществления три из R7, R8, R9, R10 и R11 представляют собой -H (например, R8, R9 и R10), а другие два из R7, R8, R9, R10 и R11 (например, R7 и R11) независимо выбирают из группы, состоящей из С1-5-алкила, -O-С1-5-алкила и -N(С1-5-алкил)2, и, в частности -Me, -Et, -Pr (н- или изо-),-Bu (н-, изо- или трет-), -ОМе, -OEt, -OPr (н- или изо-), -OBu (н-, изо- или трет-), -NMe2, -NEt2, -N(н-Pr)2 или -N(изо-Pr)2, например, -Me, -Et, -н-Pr, -изо-Pr, -ОМе, -OEt, -O-н-Pr, -O-изо-Pr, -NMe2, -NEt2. Например, R8, R9 и R10 представляют собой -H, а R7 и R11 независимо выбирают из групп С1-5-алкила, -O-C1-5-алкила и -N(С1-5-алкил)2, таких как те, которые описаны выше. В другом варианте осуществления R8, R9 и R10 представляют собой -H, а R7 и R11 независимо выбирают из группы, состоящей из -ОМе, -O-изо-Pr, -NMe2, -NEt2, -N(н-Pr)2 и -N(изо-Pr)2, и, в частности -ОМе и -O-изо-Pr.
В предпочтительном варианте осуществления три из R7, R8, R9, R10 и R11 представляют собой -H (например, R8, R9 и R10), а другие два из R7, R8, R9, R10 и R11 (например, R7 и R11) выбирают из группы, состоящей из С1-5-алкила, -O-С1-5-алкила и -N(С1-5-алкил)2, и, в частности -Me, -Et, -Pr (н- или изо-),-Bu (н-, изо- или трет-), -ОМе, -OEt, -OPr (н- или изо-), -OBu (н-, изо- или трет-), -NMe2, -NEt2, -N(н-Pr)2 или -N(изо-Pr)2, например, -Me, -Et, -н-Pr, -изо-Pr, -ОМе, -OEt, -O-н-Pr, -O-изо-Pr, -NMe2, -NEt2. В особенно предпочтительном варианте осуществления R8, R9 и R10 представляют собой -H, а R7 и R11 независимо выбирают из групп С1-5-алкила, -O-C1-5-алкила и -N(С1-5-алкил)2, таких как те, которые описаны выше. В особенно предпочтительном варианте осуществления R8, R9 и R10 представляют собой -H, а R7 и R11 выбирают из группы, состоящей из -ОМе, -O-изо-Pr, -NMe2, -NEt2, -N(н-Pr)2 и -N(изо-Pr)2, и, в частности -ОМе и -O-изо-Pr.
В другом варианте осуществления два из R7, R8, R9, R10 и R11 представляют собой -H (например, R8 и R10), а другие три из R7, R8, R9, R10 и R11 (например, R7, R9 и R11) независимо выбирают из группы, состоящей из незамещенного неразветвленного алкила, незамещенного разветвленного алкила, незамещенного циклоалкила, незамещенного алкокси, незамещенного -N(алкил)2 (где алкильные группы могут быть одинаковыми или различными и могут быть независимо выбраны из неразветвленных или разветвленных групп) и незамещенного -N(арил)2 (где арильные группы могут быть одинаковыми или различными).
В другом варианте осуществления два из R7, R8, R9, R10 и R11 представляют собой -H (например, R8 и R10), а другие три из R7, R8, R9, R10 и R11 (например, R7, R9 и R11) выбирают из группы, состоящей из незамещенного неразветвленного алкила, незамещенного разветвленного алкила, незамещенного циклоалкила, незамещенного алкокси, незамещенного -N(алкил)2 (где алкильные группы могут быть одинаковыми или различными и могут быть независимо выбраны из неразветвленных или разветвленных групп) и незамещенного -N(арил)2 (где арильные группы могут быть одинаковыми или различными).
В одном предпочтительном варианте осуществления два из R7, R8, R9, R10 и R11 представляют собой -H (например, R8 и R10), а другие три из R7, R8, R9, R10 и R11 (например, R7, R9 и R11) независимо выбирают из группы, состоящей из С1-5-алкила, -O-С1-5-алкила и -N(С1-5-алкил)2, и, в частности -Me, -Et, -Pr (н- или изо-),-Bu (н-, изо- или трет-), -ОМе, -OEt, -OPr (н- или изо-), -OBu (н-, изо- или трет-), -NMe2, -NEt2, -N(н-Pr)2 или -N(изо-Pr)2, например, -Me, -Et, -н-Pr, -изо-Pr, -ОМе, -OEt, -O-н-Pr, -O-изо-Pr, -NMe2, -NEt2. В особенно предпочтительном варианте осуществления R8 и R10 представляют собой -H, а R7, R9 и R11 независимо выбирают из -C1-5-алкильных групп, таких как те, которые описаны выше.
В другом предпочтительном варианте осуществления два из R7, R8, R9, R10 и R11 представляют собой -H (например, R8 и R10), а другие три из R7, R8, R9, R10 и R11 (например, R7, R9 и R11) выбирают из группы, состоящей из С1-5-алкила, -O-С1-5-алкила и -N(С1-5-алкил)2, и, в частности -Me, -Et, -Pr (н- или изо-),-Bu (н-, изо- или трет-), -ОМе, -OEt, -OPr (н- или изо-), -OBu (н-, изо- или трет-), -NMe2, -NEt2, -N(н-Pr)2 или -N(изо-Pr)2, например, -Me, -Et, -н-Pr, -изо-Pr, -ОМе, -OEt, -O-н-Pr, -O-изо-Pr, -NMe2, -NEt2. В особенно предпочтительном варианте осуществления R8 и R10 представляют собой -H, а R7, R9 и R11 независимо выбирают из -C1-5-алкильных групп, таких, как те, которые описаны выше. В особенно предпочтительном варианте осуществления R8 и R10 представляют собой -H, а R7, R9 и R11 представляют собой -изо-Pr.
В одном варианте осуществления монодентатный третичный фосфиновый лиганд выбирают из группы, состоящей из:


R1/R3 или R2/R3 могут образовывать кольцевую структуру с атомами, к которым они присоединены, и в этом случае R4/R5, R5/R6, R7/R8, R8/R9, R9/R10 или R10/R11 независимо образуют кольцевую структуру с атомами углерода, к которым они присоединены, или R1, R2, R4, R5, R6, R7, R8, R9, R10 и R11 являются такими, как определено выше. Пару или пары выбирают в пределах ограничений, налагаемых стабильностью и правилами валентности.
Связывающая группа для R1/R3 или R2/R3 может представлять собой замещенный или незамещенный алкил, замещенный или незамещенный алкокси, замещенный или незамещенный гетероалкил. Кольцевая структура, образованная из пары или пар, выбранных из группы, состоящей из R4/R5, R5/R6, R7/R8, R8/R9, R9/R10 и R10/R11, может представлять собой замещенную или незамещенную циклоалкильную, замещенную или незамещенную гетероциклоалкильную, замещенную или незамещенную арильную или замещенную или незамещенную гетероарильную группу. R1 и R2 могут быть независимо выбраны из групп, определенных выше, в тех случаях, когда они не образуют кольцевую структуру с R3.
В одном варианте осуществления R4, R5 и R6 представляют собой -H, а пара R1/R3 или R2/R3 образует кольцевую структуру с атомами, к которым они присоединены. В другом варианте осуществления R4, R5 и R6 представляют собой -H, а пара R1/R3 или R2/R3 образует кольцевую структуру с атомами, к которым они присоединены. В любом из этих случаев R7/R8, R8/R9, R9/R10 или R10/R11 могут независимо образовывать циклическую структуру с атомами углерода, к которым они присоединены, или R7, R8, R9, R10 и R11 являются такими, как определено выше. R1/R3 или R2/R3 могут образовывать кольцевую структуру, выбранную из группы, состоящей из:

где:
R1 и R2 являются такими, как определено выше; и
Rʹ и Rʹʹ являются независимо такими, как определено выше для R1 и R2.
В одном варианте осуществления Rʹ и Rʹʹ независимо выбирают из группы, состоящей из метила, пропила (н- или изо-), бутила (н-, изо- или трет-), циклогексила или фенила.
Примеры лигандов фосфора включают те, которые описаны Tang с совт., Angew. Chem. Int. Ed. 2010, 49, 5879-5883, Zhao с соавт., Chem. Eur. J, 2013, 19(7), 2261-2265 и Xu с соавт., Journal of the American Chemical Society, 2014, 136(2), 570-573, и в частности:

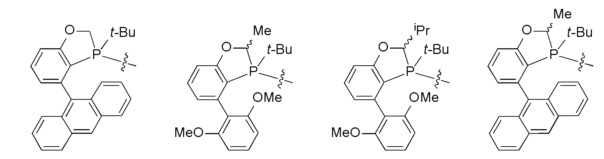
Следует понимать, что в описаниях в настоящем документе, где -Me или -изоPr присоединены волнистой линией (

Атом Pd в комплексе формулы (1) координируется с необязательно замещенной аллильной группой. R12 представляет собой органическую группу, имеющую 1-20 атомов углерода, предпочтительно 1-10 атомов углерода и более предпочтительно 1-8 атомов углерода. R12 выбирают в пределах ограничений, налагаемых стабильностью и правилами валентности. Число групп R12 находится в диапазоне от 0 до 5, т.е. m равно 0, 1, 2, 3, 4 или 5. В случае, когда m равно 2, 3, 4 или 5, каждый R12 может быть одинаковым или различным. В некоторых вариантах осуществления, когда m равно 2, 3, 4, или 5, каждый R12 является одинаковым. В некоторых вариантах осуществления m равно 0, т.е. аллильная группа является незамещенной. В некоторых вариантах осуществления m равно 1. В некоторых вариантах осуществления m 2, где каждый R12 является одинаковым или различным.
R12 может быть выбран из группы, состоящей из замещенного и незамещенного неразветвленного алкила, замещенного и незамещенного разветвленного алкила, замещенного и незамещенного циклоалкила, замещенного и незамещенного арила и замещенного и незамещенного гетероарила, где гетероатомы независимо выбирают из серы, азота и кислорода. В одном варианте осуществления R12 выбирают из группы, состоящей из замещенного и незамещенного неразветвленного алкила, замещенного и незамещенного разветвленного алкила и замещенного и незамещенного циклоалкила. В другом варианте осуществления R12 выбирают из группы, состоящей из замещенного и незамещенного арила и замещенного и незамещенного гетероарила, где гетероатомы независимо выбирают из серы, азота и кислорода. R12 может представлять собой замещенные или незамещенные разветвленные или неразветвленные алкильные группы, такие как метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, гексил, гептил, октил, нонил, децил, додецил или стеарил, циклоалкильные группы, такие как циклопропил, циклобутил, циклопентил, циклогексил или адамантил или арильные группы, такие как фенил, нафтил или антрацил. В одном варианте осуществления алкильные группы могут быть необязательно замещены одним или несколькими (например, 1, 2, 3, 4 или 5) заместителями, каждый из которых может быть одинаковым или различным, такими как галогенид (F, Cl, Br или I), алкоксигруппы, например, метокси, этокси или пропокси. Арильная группа может быть необязательно замещена одним или несколькими (например, 1, 2, 3, 4 или 5) заместителями, каждый из которых может быть одинаковым или различным, такими как галогенид (F, Cl, Br или I), неразветвленной или разветвленный алкил (например, С1-С10), алкокси (например, С1-С10алкокси), неразветвленный или разветвленный (диалкил)амино (например, (C1-C10диалкил)амино), гетероциклоалкил (например, С3-10 гетероциклоалкильные группы, такие как морфолинил и пиперидинил) или три(гало)метил (например, F3C-). Подходящие замещенные арильные группы включают, но не ограничиваются ими, 2-, 3- или 4-диметиламинофенил, 2-, 3- или 4-метилфенил, 2,3- или 3,5-диметилфенил, 2-, 3- или 4-метоксифенил и 4-метокси-3,5-диметилфенил. Замещенные или незамещенные гетероарильные группы, такие как пиридил, могут быть также использованы. В одном варианте осуществления каждый R12 независимо представляет собой метил, фенил или замещенный фенил.
Подходящие необязательно замещенные аллильные группы, как они скоординированы с атомом Pd, приведены ниже:
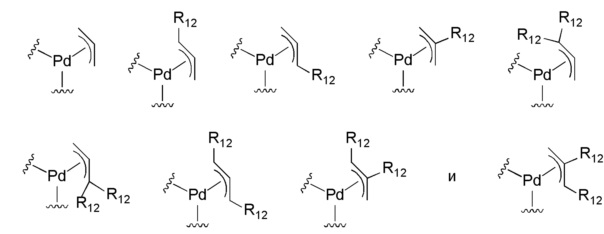
и в частности

В комплексе формулы (1) Х представляет собой скоординированный анионный лиганд, т.е. анионный лиганд, связанный с атомом Pd в координационной сфере. В одном варианте осуществления Х представляет собой галоген, предпочтительно Cl, Br, I, и, более предпочтительно Cl. В другом варианте осуществления Х представляет собой трифторацетат (т.е. F3CCO2-).
Комплекс формулы (1) может быть выбран из группы, состоящей из:





В другом аспекте настоящее изобретение относится к палладиевому комплексу формулы (2):
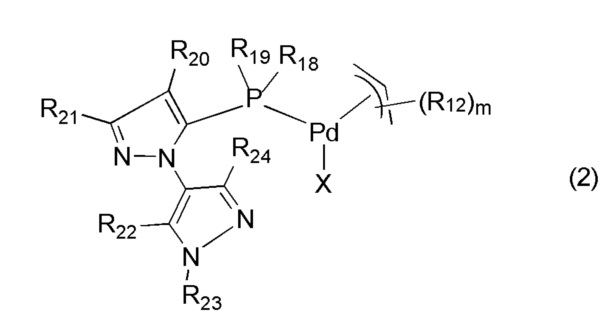
в котором:
R18 и R19 независимо выбирают из группы, состоящей из -Me, -Et, -нPr, -изоPr, -нBu, -изоBu, циклогексила и циклогептила;
R12 представляет собой органическую группу, имеющую 1-20 атомов углерода;
R20, R21, R22, R23 и R24 независимо представляют собой -Н или органические группы, имеющие 1-20 атомов углерода; или
одна или обе пары, выбранные из R20/R21 или R22/R23, могут независимо образовывать циклическую структуру с атомами, к которым они присоединены;
m равно 0, 1, 2, 3, 4 или 5; и
Х представляет собой координирующий анионный лиганд.
Комплекс формулы (2), представляет собой комплекс палладия (II), содержащий монодентатный бигетероарильный третичный фосфиновый лиганд, координирующий анионный лиганд и необязательно замещенную π-аллильную группу.
R12, m и Х являются такими, как описано выше.
R18 и R19 независимо выбирают из группы, состоящей из -Me, -Et, -нPr, -изоPr, -нBu, -изоBu и циклогексила. R18 и R19 выбирают в пределах ограничений, налагаемых стабильностью и правилами валентности. R18 и R19 могут быть одинаковыми. В качестве альтернативы R18 и R19 могут быть различными. В одном предпочтительном варианте R18 и R19 являются одинаковыми и представляют собой циклогексильные группы.
R20, R21, R22, R23 и R24 независимо представляют собой -Н или органические группы, имеющие 1-20 атомов углерода. R20, R21, R22, R23 и R24 выбирают в пределах ограничений, налагаемых стабильностью и правилами валентности. R20 и R21 могут быть независимо выбраны из группы, состоящей из -Н, замещенных и незамещенных неразветвленных алкильных, замещенных и незамещенных разветвленных алкильных, замещенных и незамещенных циклоалкильных, замещенных и незамещенных алкокси, замещенных и незамещенных арильных, замещенных и незамещенных гетероарильных, замещенных и незамещенных -N(алкил)2 (где алкильные группы могут быть одинаковыми или различными и могут быть независимо выбраны из неразветвленных или разветвленных групп), замещенных и незамещенных -N(циклоалкил)2 (где циклоалкильные группы могут быть одинаковыми или различными), замещенных и незамещенных -N(арил)2 (где арильные группы могут быть одинаковыми или различными), замещенных и незамещенных -N(гетероарил)2 (где гетероарильные группы могут быть одинаковыми или различными) и замещенных и незамещенных гетероциклоалкильных групп. Гетероатомы в гетеарильных или гетероциклоалкильных группах могут быть независимо выбраны из серы, азота и/или кислорода. В одном варианте осуществления алкильные группы могут быть необязательно замещены одним или несколькими (например, 1, 2, 3, 4 или 5) заместителями, каждый из которых может быть одинаковым или различным, такими как галогенид (F, Cl, Br или I), например, -CF3, алкоксигруппы, например, метокси, этокси или пропокси. Арильная группа может быть необязательно замещена одним или несколькими (например, 1, 2, 3, 4 или 5) заместителями, каждый из которых может быть одинаковым или различным, такими как галогенид (F, Cl, Br или I), неразветвленный или разветвленный алкил (например, С1-С10), алкокси (например, С1-С10алкокси), неразветвленный или разветвленный (диалкил)амино (например, (C1-C10диалкил)амино), гетероциклоалкил (например, С3-10 гетероциклоалкильные группы, такие как морфолинил и пиперидинил) или три(гало)метил (например, F3C-). Подходящие замещенные арильные группы включают, но не ограничиваются ими, 2-, 3- или 4-диметиламинофенил, 2-, 3- или 4-метилфенил, 2,3- или 3,5-диметилфенил, 2-, 3- или 4-метоксифенил и 4-метокси-3,5-диметилфенил. Замещенные или незамещенные гетероарильные группы, такие как пиридил, могут быть также использованы. Подходящие незамещенные группы -N(алкил)2 включают, но не ограничиваются ими, -NMe2, -NEt2 и -NPr2 (н- или изо-). Подходящая незамещенная группа -N(циклоалкил)2 включает, но не ограничивается ими, -N(Cy)2. Подходящие замещенные группы -N(алкил)2 включают, но не ограничиваются ими, -N(CH2CH2OMe)2 и -N(CF3)2. Подходящие незамещенные группы -N(арил)2 включают, но не ограничиваются ими, -NPh2. Подходящие замещенные группы -N(арил)2 включают, но не ограничиваются ими, -N(2-, 3- или 4-диметиламинофенил)2, -N(2-, 3- или 4-метилфенил)2, -N(2,3- или 3,5-диметилфенил)2, -N(2-, 3- или 4-метоксифенил)2 и -N(4-метокси-3,5-диметилфенил)2. Подходящие незамещенные группы -N(гетероарил)2 включают, но не ограничиваются ими, -N(фурил)2 и -N(пиридил)2. Замещенные и незамещенные гетероциклоалкильные группы включают С4-8-гетероциклоалкильные группы, такие как пиперидинил и морфолинил.
В одном предпочтительном варианте осуществления как R20, так и R21 представляют собой -H.
R22 и R24 могут быть независимо выбраны из группы, состоящей из -Н, замещенного и незамещенного неразветвленного алкила, замещенного и незамещенного разветвленного алкила, замещенного и незамещенного циклоалкила, замещенного и незамещенного алкокси, замещенного и незамещенного -тиоалкила, замещенного и незамещенного арила, замещенного и незамещенного гетероарила, замещенного и незамещенного -N(алкил)2 (где алкильные группы могут быть одинаковыми или различными и могут быть независимо выбраны из неразветвленных или разветвленных групп), замещенного и незамещенного -N(циклоалкил)2 (где циклоалкильные группы могут быть одинаковыми или различными), замещенного и незамещенного -N(арил)2 (где арильные группы могут быть одинаковыми или различными), замещенного и незамещенного -N(гетероарил)2 (где гетероарильные группы могут быть одинаковыми или различными). Гетероатомы в гетероарильных группах могут быть независимо выбраны из серы, азота и/или кислорода. В одном варианте осуществления алкильные группы могут быть необязательно замещены одним или несколькими (например, 1, 2, 3, 4 или 5) заместителями, такими как галогенид (F, Cl, Br или I), алкоксигруппы, например метокси, этокси или пропокси. Арильная группа может быть необязательно замещена одним или несколькими (например, 1, 2, 3, 4 или 5) заместителями, такими как галогенид (F, Cl, Br или I), неразветвленный или разветвленный алкил (например, C1-C10), алкокси (например, С1-С10алкокси), неразветвленный или разветвленный (диалкил)амино (например, (С1-С10диалкил)амино), гетероциклоалкил (например, С3-10 гетероциклоалкильные группы, такие как морфолинил и пиперидинил) или три(гало)метил (например, F3C-). Подходящие замещенные арильные группы включают, но не ограничиваются ими, 2-, 3- или 4-диметиламинофенил, 2-, 3- или 4-метилфенил, 2,3- или 3,5-диметилфенил, 2-, 3- или 4-метоксифенил и 4-метокси-3,5-диметилфенил. Замещенные или незамещенные гетероарильные группы, такие как пиридил, могут быть также использованы. Замещенные или незамещенные -тиоалкильные группы включают -S(С1-5-алкил), такой как -SMe, -SEt, -SPr (н- или изо-). В одном варианте осуществления как R22, так и R24 представляют собой фенил.
R23 может быть независимо выбран из группы, состоящей из -Н, замещенного и незамещенного неразветвленного алкила, замещенного и незамещенного разветвленного алкила, замещенного и незамещенного циклоалкила, замещенного и незамещенного алкокси, замещенного и незамещенного арила и замещенного и незамещенного гетероарила. Гетероатомы в гетероарильных группах могут быть независимо выбраны из серы, азота и/или кислорода. В одном варианте осуществления алкильные группы могут быть необязательно замещены одним или несколькими (например, 1, 2, 3, 4 или 5) заместителями, такими как галогенид (F, Cl, Br или I), алкоксигруппы, например метокси, этокси или пропокси. Арильная группа может быть необязательно замещена одним или несколькими (например, 1, 2, 3, 4 или 5) заместителями, такими как галогенид (F, Cl, Br или I), неразветвленный или разветвленный алкил (например, C1-C10), алкокси (например, С1-С10алкокси), неразветвленный или разветвленный (диалкил)амино (например, (С1-С10диалкил)амино), гетероциклоалкил (например, С3-10гетероциклоалкильные группы, такие как морфолинил и пиперидинил) или три(гало)метил (например, F3C-). Подходящие замещенные арильные группы включают, но не ограничиваются ими, 2-, 3- или 4-диметиламинофенил, 2-, 3- или 4-метилфенил, 2,3- или 3,5-диметилфенил, 2-, 3- или 4-метоксифенил и 4-метокси-3,5-диметилфенил. Замещенные или незамещенные гетероарильные группы, такие как пиридил, могут быть также использованы. В одном варианте осуществления R23 представляет собой фенил.
В одном предпочтительном варианте осуществления изобретения каждый из R22, R23 и R24 представляют собой фенильные группы.
В одном варианте осуществления монодентатный бигетероарильный третичный фосфиновый лиганд выбирают из группы, состоящей из:

Комплекс формулы (2) может быть выбран из группы, состоящей из:

Комплекс формулы (1) или комплекс формулы (2) может быть получен способом, включающим стадию взаимодействия комплекса формулы (3) с монодентатным биарильным лигандом формулы (4) или монодентатным бигетероарильным третичным фосфиновым лигандом формулы (5) с образованием комплекса формулы (1) или комплекса формулы (2),



где,
R1 и R2 независимо представляют собой органические группы, имеющие 1-20 атомов углерода, или R1 и R2 соединены с образованием кольцевой структуры с Е;
R3, R4, R5, R6, R7, R8, R9, R10 и R11 независимо представляют собой -Н или органические группы, имеющие 1-20 атомов углерода; или
одна или несколько пар, выбранных из R1/R3, R2/R3, R3/R4, R4/R5, R5/R6, R7/R8, R8/R9, R9/R10 или R10/R11, независимо могут образовывать кольцевую структуру с атомами углерода, к которым они присоединены;
R12 представляет собой органическую группу, имеющую 1-20 атомов углерода;
R18 и R19 независимо выбирают из группы, состоящей из -Me, -Et, -нPr, -изоPr, -нBu, -изоBu, циклогексила и циклогептила;
R20, R21, R22, R23 и R24 независимо представляют собой -Н или органические группы, имеющие 1-20 атомов углерода; или
одна или обе пары, выбранные из R20/R21 или R22/R23, независимо могут образовывать кольцевую структуру с атомами, к которым они присоединены;
m равно 0, 1, 2, 3, 4 или 5;
Е представляет собой P или As; и
Х представляет собой координирующий анионный лиганд;
при условии, что палладиевый комплекс формулы (1) не представляет собой (π-кротил)PdCl(дициклогексилфосфино-2-бифенил).
R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R18, R19, R20, R21, R22, R23 и R24, m, Е и Х являются такими, как описано выше.
Одна или несколько пар (например, 1, 2 или 3 пары), выбранных из R1/R3, R2/R3, R3/R4, R4/R5, R5/R6, R7/R8, R8/R9, R9/R10 или R10/R11 могут независимо образовывать циклическую структуру с атомами, к которым они присоединены. Пару или пары выбирают в пределах ограничений, налагаемых стабильностью и правилами валентности. Кольцевая структура может представлять собой замещенную или незамещенную циклоалкильную, замещенную или незамещенную гетероциклоалкильную, замещенную или незамещенную арильную или замещенную или незамещенную гетероарильную группу.
Если R1, R2, R3, R4, R5, R6, R7, R8, R9, R10 или R11 не образует часть пары, группы являются такими, как описано выше.
R1/R3 или R2/R3 могут образовывать кольцевую структуру с атомами, к которым они присоединены, и в этом случае R4/R5, R5/R6, R7/R8, R8/R9, R9/R10 или R10/R11 независимо образуют кольцевую структуру с атомами углерода, к которым они присоединены, или R1, R2, R4, R5, R6, R7, R8, R9, R10 и R11 являются такими, как определено выше. R1 и R2 могут быть независимо выбраны из групп, определенных выше, в тех случаях, когда они не образуют кольцевую структуру с R3.
Связывающая группа для R1/R3 или R2/R3 может представлять собой замещенный или незамещенный алкил, замещенный или незамещенный алкокси, замещенный или незамещенный гетероалкил. Кольцевая структура, образованная из пары или пар, выбранных из группы, состоящей из R4/R5, R5/R6, R7/R8, R8/R9, R9/R10 и R10/R11, может представлять собой замещенную или незамещенную циклоалкильную, замещенную или незамещенную гетероциклоалкильную, замещенную или незамещенную арильную или замещенную или незамещенную гетероарильную группу. R1 и R2 могут быть независимо выбраны из групп, определенных выше, в тех случаях, когда они не образуют кольцевую структуру с R3.
В одном варианте осуществления R4, R5 и R6 представляют собой -H, а пара R1/R3 или R2/R3 образует кольцевую структуру с атомами, к которым они присоединены. В другом варианте осуществления R4, R5 и R6 представляют собой -H, а пара R1/R3 или R2/R3 образует кольцевую структуру с атомами, к которым они присоединены. В любом из этих случаев R7/R8, R8/R9, R9/R10 или R10/R11 могут независимо образовывать циклическую структуру с атомами углерода, к которым они присоединены, или R7, R8, R9, R10 и R11 являются такими, как определено выше. R1/R3 или R2/R3 могут образовывать кольцевую структуру, выбранную из группы, состоящей из:

где:
R1 и R2 являются такими, как определено выше; и
Rʹ и Rʹʹ являются независимо такими, как определено выше для R1 и R2.
В одном варианте осуществления Rʹ и Rʹʹ независимо выбирают из группы, состоящей из метила, пропила (н- или изо-), бутила (н-, изо- или трет-), циклогексила или фенила.
В другом варианте осуществления R9 представляет собой -Н, и пары R7/R8 и R10/R11 образуют кольцевую структуру с атомами, к которым они присоединены. Каждая пара может образовывать замещенное или незамещенное арильное кольцо (например, фенильное кольцо) вместе с атомами углерода, к которым они присоединены.
Примеры лигандов фосфора включают те, которые описаны Tang с совт., Angew. Chem. Int. Ed. 2010, 49, 5879-5883, Zhao с соавт., Chem. Eur. J, 2013, 19(7), 2261-2265 и Xu с соавт., Journal of the American Chemical Society, 2014, 136(2), 570-573, и в частности:


Следует понимать, что в описаниях в настоящем документе, где -Me или -изоPr присоединены волнистой линией (

В одном варианте осуществления R5 и R6 образуют замещенное или незамещенное арильное кольцо, предпочтительно фенильное кольцо, вместе с атомами углерода, к которым они присоединены. В другом варианте осуществления R7 и R8 образуют замещенное или незамещенное арильное кольцо, предпочтительно фенильное кольцо, вместе с атомами углерода, к которым они присоединены. Пример представлен ниже:

Не желая быть связанными теорией, авторы полагают, что комплексы формулы (1) могут быть получены в результате балансировки стерического объема групп R1 и R2 со стерическим объемом групп R7, R8, R9, R10 и/или R11. Например, в комплексе формулы (1), когда Е представляет собой Р, R1 и R2 могут быть выбраны таким образом, чтобы они были более стерически объемными, чем циклогексильная группа (например, трет-бутильная группа), в то время как заместители R7, R8, R9, R10 и/или R11 выбирают таким образом, чтобы они были менее стерически объемными (например, H). Аналогичным образом, R1 и R2, как правило, выбирают таким образом, чтобы они были менее стерически объемными (например, циклогексильная группа или меньше), в то время как заместители R7, R8, R9, R10 и/или R11 выбирают так, чтобы быть более стерически объемными (например, метокси, изопропил, диметиламино).
Комплекс формулы (3) может быть получен в соответствии с известными способами (смотри, например, а) Marion, N.: Navarro, O.; Mei, J.; Stevens, E. D.; Scott, N. M.; Nolan, S. P. J. Am. Chem. Soc.2006, 128, 4101. b) Auburn, P. R.; Mackenzie, P. B.; Bosnich, B. J. Am. Chem. Soc. 1985, 107, 2033. c) Dent, W. I.; Long, R.; Wilkinson, G. J. Chem. Soc.1964, 1585. d) Nicholson, J. K.; Powell, J.; Shaw, B. L. J. Chem. Soc.; Chem. Commun. 1966, 174), каждый из которых включен в настоящее описание в качестве ссылки во всей своей полноте во всех отношениях. Подходящие комплексы формулы (3) включают в себя:

В одном варианте осуществления способ включает стадию взаимодействия комплекса формулы (3) с монодентатным лигандом формулы (4) с образованием комплекса формулы (1). В другом варианте осуществления способ включает стадию взаимодействия комплекса формулы (3) с монодентатным бигетероарильным фосфиновым лигандом формулы (5) с образованием комплекса формулы (2).
Комплекс формулы (3) и лиганд (4) или (5) могут быть объединены в растворителе. В этом случае растворитель представляет собой любой подходящий апротонный растворитель или комбинацию апротонных растворителей. Примерами апротонных растворителей являются толуол, бензол, тетрагидрофуран (ТГФ), 2-метилтетрагидрофуран, дихлорметан (ДХМ), диоксан, ацетон, ацетонитрил, диметилформамид (ДМФА), N-метилпирролидин (NMP), диметилацетамид (DMAc), метил-трет-бутиловый эфир (МТБЭ), диэтиловый эфир, гексан, гептан, пентан или этилацетат. Предпочтительными растворителями являются ТГФ, 2-метилтетрагидрофуран, толуол, ДХМ или их комбинация. Растворитель может быть безводным. Концентрация комплекса формулы (3) в растворителе составляет предпочтительно от приблизительно 0,001 моль/л до приблизительно 3,00 моль/л и более предпочтительно от приблизительно 0,03 моль/л до приблизительно 2,50 моль/л.
Любое подходящее количество лиганда может быть использовано, хотя предпочтительно, чтобы молярное соотношение комплекса формулы (3):лиганда составляло от приблизительно 1:1 до приблизительно 1:15, например, от приблизительно 1:1 до приблизительно 1:11. В одном варианте осуществления молярное соотношение комплекса формулы (3):лиганда составляет от 1:1,90 до 1:2,30.
Реакцию предпочтительно проводят в инертной атмосфере, такой как азот или аргон.
Способ по настоящему изобретению может быть осуществлен при температуре в интервале от приблизительно -10°C до приблизительно 60°С, предпочтительно от приблизительно 0°С до приблизительно 35°С и более предпочтительно приблизительно при комнатной температуре (кт) (т.е. от приблизительно 20°С до приблизительно 30°С). Предпочтительно, чтобы температура поддерживалась ниже температуры разложения и, таким образом, когда известно, что комплексы формулы (1), (2) или (3) разлагаются в температурных интервалах, приведенных выше, температура должна поддерживаться на уровне ниже температуры разложения.
Реакция может быть осуществлена в течение периода времени от приблизительно нескольких минут до приблизительно 24 часов. Обычно реакция завершается в течение приблизительно 6 часов для реакции в лабораторном масштабе. По завершении, при необходимости часть растворителя может быть выпарена до выделения комплекса. Кроме того, при необходимости антирастворитель (например, алкан, такой как пентан или гексан) может быть использован для осаждения комплекса из растворителя. Продукт комплекса может быть выделен непосредственно путем фильтрации, декантирования или центрифугирования.
Как бы ни был выделен комплекс, отделенный комплекс может быть промыт и затем высушен. Сушка может быть осуществлена с использованием известных способов, например, при температурах в диапазоне 10-60°C и предпочтительно 20-40°C в вакууме 1-30 мбар в течение от 1 часа до 5 дней. При необходимости этот комплекс может быть перекристаллизован.
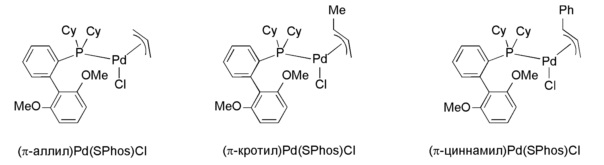
В некоторых вариантах осуществления комплексы могут быть получены с высоким выходом. В некоторых вариантах осуществления комплексы могут быть получены с высокой чистотой. В некоторых вариантах осуществления комплексы являются высокоактивными катализаторами. В некоторых вариантах осуществления комплексы устойчивы к воздуху и влажности при температуре окружающей среды. Ряд комплексов (например, (π-аллил)Pd(CyBippyPhos)Cl, (π-аллил)Pd(SPhos)Cl, (π-аллил)Pd(XPhos)Cl, (π-аллил)Pd(RuPhos)Cl, (π-аллил)Pd(BrettPhos)Cl, (π-кротил)Pd(XPhos)Cl, (π-кротил)Pd(SPhos)Cl, (π-кротил)Pd(RuPhos)Cl, (π-циннамил)Pd(SPhos)Cl и (π-циннамил)Pd(RuPhos)Cl) тестировали на стабильность при хранении, и они по существу не продемонстрировали никакого разложения, о чем судили по31Р ЯМР при нормальных условиях хранения в течение 1-2 лет. Нормальные условия хранения относятся к хранению на воздухе при нормальных условиях влажности (т.е. не в перчаточном боксе или эксикаторе). Исследования по применению комплексов показывают, что они могут быть легко активированы в мягких условиях. Например, аллильные комплексы могут быть активированы, как правило, при >60°С, а кротильные и циннамильные комплексы могут быть легко активированы при комнатной температуре. При необходимости, однако, комплексы по настоящему изобретению могут быть использованы в реакции при более высоких температурах (например, ≥приблизительно 60°С до приблизительно≤150°С).
Не желая быть связанными теорией, авторы полагают, что комплексы активируются с образованием соединений LPd(0) (L=фосфиновый лиганд). Относительно безопасные замещенные олефины, как побочные продукты, могут быть также получены при активации комплексов. Пример олефина, как побочного продукта, показан ниже для конкретного π-аллильного комплекса, где m равно 1.

Не желая быть связанными теорией, авторы также полагают, что активность, наблюдаемая у комплексов по настоящему изобретению, может быть в результате подавления образования стабильных химически неактивных димеров (μ-(R12)m-аллил)Pd2(L)2(μ-Cl). В связи с этим, активные соединения "LPd(0)" могут расходоваться в процессе конпропорционирования с еще не вступившим в реакцию комплексом формулы (1) или (2) с образованием димерных комплексов. Подавление процесса конпропорционирования может быть вызвано димерными комплексами, которые становятся все более дестабилизированными с увеличением размера лиганда и/или замещения по аллильной группе вследствие стерической деформации, замедляя таким образом их склонность к образованию. Кроме того, быстрая скорость окислительного присоединения, которую демонстрируют комплексы по изобретению, должна быстро перетянуть активный L-Pd(0) в каталитический цикл, не благоприятствуя таким образом непродуктивному процессу конпропорционирования. Эти механизмы проиллюстрированы ниже для конкретного π-аллильного комплекса, где L представляет собой лиганд формулы (4) или (5), Х представляет собой хлор, и m равно 1.
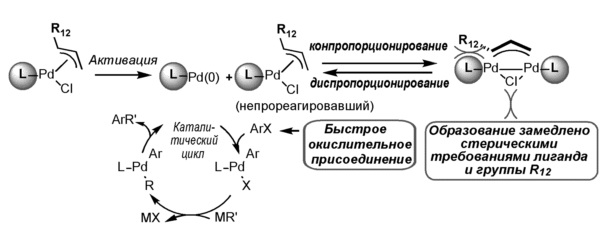
Катализаторы по настоящему изобретению могут быть использованы для реакций сочетания углерод-углерод. Примеры реакций сочетания углерод-углерод включают реакции Хека, Сузуки, Соногаширы или Негиши, реакции α-арилирования кетонов, реакции α-арилирования альдегидов, реакции аллильного замещения и реакции трифторметилирования. Катализаторы по настоящему изобретению также могут быть использованы для реакций сочетания углерод-гетероатом, таких как реакции сочетания углерод-азот (т.е. реакции Бухвальда-Хартвига), или реакции сочетания углерод-кислород или углерод-сера.
В другом аспекте, следовательно, настоящее изобретение относится к способу проведения реакции сочетания углерод-углерод в присутствии катализатора, причем этот способ включает:
(a) применение комплекса формулы (1):

в котором:
R1 и R2 независимо представляют собой органические группы, имеющие 1-20 атомов углерода, или R1 и R2 соединены с образованием кольцевой структуры с Е;
R3, R4, R5, R6, R7, R8, R9, R10 и R11 независимо представляют собой -Н или органические группы, имеющие 1-20 атомов углерода; или
R1/R3 или R2/R3 образует кольцевую структуру с атомами, к которым они присоединены, и в этом случае R4/R5, R5/R6, R7/R8, R8/R9, R9/R10 или R10/R11 могут независимо образовывать кольцевую структуру с атомами углерода, к которым они присоединены, или R1, R2, R4, R5, R6, R7, R8, R9, R10 и R11 являются такими, как определено выше;
R12 представляет собой органическую группу, имеющую 1-20 атомов углерода;
m равно 0, 1, 2, 3, 4 или 5;
Е представляет собой P или As; и
Х представляет собой координирующий анионный лиганд;
или:
(b) комплекса формулы (2) по любому из пп.17-24.
Комплекс формулы (1), комплекс формулы (2), R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R18, R19, R20, R21, R22, R23 и R24, m, Е и Х являются такими, как описано выше.
В одном варианте осуществления способ включает в себя применение комплекса формулы (1) по любому из пп.1-16. В другом варианте осуществления способ включает в себя применение комплекса формулы (2) по любому из пп.17-24.
В другом аспекте настоящее изобретение относится к способу проведения реакции сочетания углерод-гетероатом в присутствии катализатора, причем этот способ включает:
(a) применение комплекса формулы (1):

в котором:
R1 и R2 независимо представляют собой органические группы, имеющие 1-20 атомов углерода, или R1 и R2 соединены с образованием кольцевой структуры с Е;
R3, R4, R5, R6, R7, R8, R9, R10 и R11 независимо представляют собой -Н или органические группы, имеющие 1-20 атомов углерода; или
R1/R3 или R2/R3 образует кольцевую структуру с атомами, к которым они присоединены, и в этом случае R4/R5, R5/R6, R7/R8, R8/R9, R9/R10 или R10/R11 могут независимо образовывать кольцевую структуру с атомами углерода, к которым они присоединены, или R1, R2, R4, R5, R6, R7, R8, R9, R10 и R11 являются такими, как определено выше;
R12 представляет собой органическую группу, имеющую 1-20 атомов углерода;
m равно 0, 1, 2, 3, 4 или 5;
Е представляет собой P или As; и
Х представляет собой координирующий анионный лиганд;
или:
(b) комплекса формулы (2) по любому из пп.17-24.
Комплекс формулы (1), комплекс формулы (2), R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R18, R19, R20, R21, R22, R23 и R24, m, Е и Х являются такими, как описано выше.
В одном варианте осуществления способ включает в себя применение комплекса формулы (1) по любому из пп.1-16. В другом варианте осуществления способ включает в себя применение комплекса формулы (2) по любому из пп.17-24.
В другом аспекте настоящее изобретение относится к применению комплекса формулы (1) или комплекса формулы (2) в качестве катализатора реакции сочетания углерод-углерод, где:
(a) комплекс формулы (1) представляет собой:

в котором:
R1 и R2 независимо представляют собой органические группы, имеющие 1-20 атомов углерода, или R1 и R2 соединены с образованием кольцевой структуры с Е;
R3, R4, R5, R6, R7, R8, R9, R10 и R11 независимо представляют собой -Н или органические группы, имеющие 1-20 атомов углерода; или
R1/R3 или R2/R3 образует кольцевую структуру с атомами, к которым они присоединены, и в этом случае R4/R5, R5/R6, R7/R8, R8/R9, R9/R10 или R10/R11 могут независимо образовывать кольцевую структуру с атомами углерода, к которым они присоединены, или R1, R2, R4, R5, R6, R7, R8, R9, R10 и R11 являются такими, как определено выше;
R12 представляет собой органическую группу, имеющую 1-20 атомов углерода;
m равно 0, 1, 2, 3, 4 или 5;
Е представляет собой P или As; и
Х представляет собой координирующий анионный лиганд;
и:
(b) комплекс формулы (2) является таким, как определено в любом из пп.17-24.
Комплекс формулы (1), комплекс формулы (2), R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R18, R19, R20, R21, R22, R23 и R24, m, Е и Х являются такими, как описано выше.
В одном варианте осуществления комплекс формулы (1) является таким, как определено в любом из пп.1-14. В другом варианте осуществления комплекса формулы (2) является таким, как определено в любом из пп.17-24.
В другом аспекте настоящее изобретение относится к применению комплекса формулы (1) или комплекса формулы (2) в качестве катализатора в реакциях сочетания углерод-гетероатом, где:
(a) комплекс формулы (1) представляет собой:

в котором:
R1 и R2 независимо представляют собой органические группы, имеющие 1-20 атомов углерода, или R1 и R2 соединены с образованием кольцевой структуры с Е;
R3, R4, R5, R6, R7, R8, R9, R10 и R11 независимо представляют собой -Н или органические группы, имеющие 1-20 атомов углерода; или
R1/R3 или R2/R3 образует кольцевую структуру с атомами, к которым они присоединены, и в этом случае R4/R5, R5/R6, R7/R8, R8/R9, R9/R10 или R10/R11 могут независимо образовывать кольцевую структуру с атомами углерода, к которым они присоединены, или R1, R2, R4, R5, R6, R7, R8, R9, R10 и R11 являются такими, как определено выше;
R12 представляет собой органическую группу, имеющую 1-20 атомов углерода;
m равно 0, 1, 2, 3, 4 или 5;
Е представляет собой P или As; и
Х представляет собой координирующий анионный лиганд;
и:
(b) комплекс формулы (2) является таким, как определено в любом из пп.17-24.
Комплекс формулы (1), комплекс формулы (2), R1, R2, R3, R4, R5, R6, R7, R8, R9, R10, R11, R12, R18, R19, R20, R21, R22, R23 и R24, m, Е и Х являются такими, как описано выше.
В одном варианте осуществления комплекс формулы (1) является таким, как определено в любом из пп.1-16. В другом варианте осуществления комплекса формулы (2) является таким, как определено в любом из пп.17-24.
Варианты осуществления и/или необязательные признаки настоящего изобретения были описаны выше. Любой аспект настоящего изобретения может быть объединен с любым другим аспектом настоящего изобретения, если контекст не требует иного. Любой из вариантов осуществления или необязательные признаки любого из аспектов могут быть объединены, по отдельности или в сочетании с любым аспектом настоящего изобретения, если контекст не требует иного.
Изобретение теперь будет описано с помощью следующих не ограничивающих примеров и со ссылкой на следующие чертежи, на которых:
Фигура 1 представляет собой1H ЯМР-спектр Pd(π-аллил)(BrettPhos)Cl.
Фигура 2 представляет собой1H ЯМР-спектр Pd(π-кротил)(BrettPhos)Cl.
Фигура 3 представляет собой1H ЯМР-спектр Pd(π-циннамил)(BrettPhos)Cl.
Фигура 4 представляет собой1H ЯМР-спектр Pd(π-аллил)(JackiePhos)Cl.
Фигура 5 представляет собой1H ЯМР спектр (π-кротил)Pd(CyBippyPhos)Cl.
На фигуре 6 показана скорость конверсии в α-арилировании ацетофенона с помощью 4-хлоранизола с применением (π-аллил)Pd(XPhos)Cl, (π-кротил)Pd(XPhos)Cl, (π-циннамил)Pd(XPhos)Cl, палладацикла XPhos 3-го поколения и (π-аллил)Pd(XPhos)Cl с 1% мольн. добавленного карбазола.
Примеры
Все растворители и реагенты приобретали из коммерческих источников и использовали в полученном виде. Все катализаторы, лиганды или предшественники драгоценных металлов получали от Johnson Matthey Catalysis или Alfa Aesar. Флэш-хроматографию проводили также на Teledyne Isco CombiFlashRf с использованием 12 г силикагелевых картриджей RediSepRf. Спектры31Р,1H и13C-ЯМР записывали на спектрометре 400 МГц, с химическими сдвигами, описанными относительно остаточного растворителя в качестве внутренних стандартов (CDCl3: 7,26 м.д. для1Н ЯМР и 77,26 м.д. для13С ЯМР, C6D6: 7,16 м.д. для1H ЯМР и 128,06 м.д. для13С ЯМР, ДМСО-d6: 2,50 м.д. для1Н ЯМР и 39,52 м.д. для13С ЯМР, толуол-D8: 2,08 м.д. для1Н ЯМР и 20,43 м.д. для13С ЯМР), если не указано иное, в то время как31Р{1H} ЯМР-спектры внешне относили с 85% H3PO4. Следующие сокращения использовали для интерпретации мультиплетностей: с=синглет, д=дублет, т=триплет, кв.=квартет, квинт.=квинтет, септ.=септет, м=мультиплет, уш.=уширенный, каж. т=кажущийся триплет, каж. д=кажущийся дублет, уш.=уширенный. Элементный анализ направляли в Robertson Microlit Laboratories, Inc. Все реакции проводили в отдельных колбах Шленка в атмосфере азота. Чистота выделенных продуктов составляла ~95%, как определено с помощью1H ЯМР, ГХ/МС или элементного анализа, если не указано иное.
Кристаллографические данные получали при 120К на рентгеновском дифрактометре APEX Bruker-AXS CCD, оснащенном однолинзовым коллиматором. Структуры разгадывали с помощью программного обеспечения SHELXTL. Эти данные получали из лаборатории рентгеновской кристаллографии кафедры химии и биохимии Университета штата Делавэр.
Общая методика получения комплексов [Pd(необязательно замещенный (R12)n-аллил)(Х)]2:
Дистиллированную H2O в трехгорлой круглодонной колбе продувают азотом в течение 30 минут. PdCl2 и KCl последовательно добавляют в колбу, и раствор перемешивают при комнатной температуре в течение 1 ч. Затем добавляют необязательно замещенный (R4)n--аллилхлорид, и полученную реакционную смесь перемешивают при комнатной температуре в течение ночи (18-20 ч). Реакционную смесь экстрагируют хлороформом, и водный слой промывают хлороформом три раза. Органические слои объединяют, сушат над MgSO4, фильтруют и концентрируют в вакууме. Сырой продукт перекристаллизовывают из хлороформа и метил-трет-бутилового эфира, и полученное твердое вещество отделяют фильтрованием и сушат в вакууме.
[Pd(π-циннамил)Cl]2

PdCl2 (590 мг, 3,33 ммоль); KCl (473 мг, 6,67 ммоль); циннамил хлорид (1,39 мл, 9,99 ммоль); H2O (83 мл). Димер получают в виде желтого твердого вещества.
[Pd(π-1-кротил)Cl]2

PdCl2 (590 мг, 3,33 ммоль); KCl (473 мг, 6,67 ммоль); кротил хлорид (0,97 мл, 9,99 ммоль); H2O (83 мл). Димер получают в виде желтого твердого вещества.
[Pd(π-пренил)Cl]2

PdCl2 (590 мг, 3,33 ммоль); KCl (473 мг, 6,67 ммоль); 1-хлорид-3-метил-2-бутен (1,13 мл, 9,99 ммоль); H2O (83 мл). Димер получают в виде желтого твердого вещества.
[Pd(π-металлил)Cl]2

PdCl2 (590 мг, 3,33 ммоль); KCl (473 мг, 6,67 ммоль); 3-хлорид-2-метил-1-пропен (0,98 мл, 9,99 ммоль); H2O (83 мл). Димер получают в виде желтого твердого вещества (269 мг, 41%).
Пример 1 (согласно изобретению)
Репрезентативная методика получения комплексов [Pd(необязательно замещенный(R12)m-аллил)(лиганд)(X):
В сухой сосуд Шленка загружают лиганд (4,74 ммоль) и [(необязательно замещенный(R12)m-аллил)PdCl]2 (2,36 ммоль). Сосуд вакуумируют и заполняют азотом в общей сложности три раза. Добавляют 10 мл безводного растворителя (такого как ТГФ или толуол), и смесь перемешивают при комнатной температуре в течение определенного периода времени (например, 20 минут). Добавляют пентан (5 мл) или гексаны, чтобы полностью высадить продукт. Продукт собирают с помощью вакуумной фильтрации, промывают (3 × 10 мл пентана или гексанов) и сушат в вакууме.
Pd(π-аллил)(JohnPhos)Cl

Следуя репрезентативной методике: [(аллил)PdCl]2 (1,00 г, 2,75 ммоль); JohnPhos (1,64 г, 5,50 ммоль); толуол (13,2 мл); 1ч. Продукт получают в виде бледно-желтого твердого вещества (2,46 г, 93%);1H ЯМР (400 МГц, CDCl3, δ): 7,93-7,82 (м, 1H), 7,71-7,57 (м, 2H), 7,50-7,19 (м, 6H), 4,85-2,60 (м, 5H), 1,90-1,10 (м, 18Н);13С ЯМР (100 МГц, CDCl3, δ): 149,0, 148,8, 142,2 (2 пика), 134,8, 134,6, 133,6 (2 пика), 130,4, 129,8, 129,7, 129,6, 128,1, 126,3, 125,4, 125,3, 113,3, 113,2, 81,7 (уш.), 57,6 (уш.), 37,2, 30,9 [Наблюдаемая сложность из-за связи C-P];31P ЯМР (162 МГц, CDCl3, δ): 57,3; Анализ: рассчитано для C23H32ClPPd: C, 57,39; Н, 6,70. Найдено: C, 57,35; Н, 6,53.
(π-кротил)Pd(JohnPhos)Cl

В сухую колбу Шленка, снабженную магнитной мешалкой с тефлоновым покрытием, загружают 1,00 г (2,54 ммоль) [(кротил)PdCl]2 (0,50 эквив.) с последующей загрузкой 1,52 г (5,08 ммоль) JohnPhos. Колбу оснащают резиновой септой, и вакуумируют и заполняют азотом. Этот цикл вакуумирования/заполнения азотом повторяют еще два раза. Растворитель (безводный толуол) добавляют с помощью шприца, и реакционную смесь перемешивают при комнатной температуре в течение 1,25 ч. Затем добавляют пентан (25 мл), чтобы полностью высадить продукт. Твердое вещество затем собирают фильтрацией с отсасыванием, промывают дополнительным количеством пентана (или гексанов) и сушат в вакууме с получением 2,40 г (4,84 ммоль, 95%) указанного в заголовке соединения в виде желтого твердого вещества.
1H ЯМР (400 МГц, CDCl3, δ): 7,87 (с, 1H), 7,50-7,75 (м, 2H), 7,10-7,50 (м, 6H), 3,98-4,23 (м, 1H), 3,60-3,83 (м, 1H), 2,99-3,11 (м, 1H), 1,20-1,76 (м, 22H).
13С ЯМР (101 МГц, CDCl3, δ): 149,0, 148,8, 142,1 (2 пика), 135,0, 133,9 (2 пика), 130,4, 130,0, 129,8, 129,7, 127,9, 126,4, 125,2 (2 пика), 112,7 (2 пика), 100,3, 100,0, 52,2, 37,7, 37,6, 37,3, 37,2, 31,7, 31,6, 30,5, 30,4, 17,7, 17,6 [Наблюдаемая сложность из-за связи C-P].
31P ЯМР (162 МГц, CDCl3, δ): 57,1.
Анализ: рассчитано для C24H34ClPPd: C, 58,19; Н, 6,92. Найдено: C, 57,91; Н, 6,74.
Pd(π-аллил)(SPhos)Cl
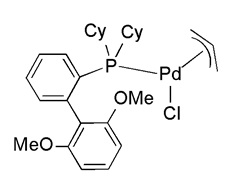
Следуя репрезентативной методике: [(аллил)PdCl]2 (505 мг, 1,39 ммоль); SPhos (1,14 г, 2,78 ммоль); ТГФ (3 мл); 6ч. Продукт получают в виде белого твердого вещества (1,30 г, 79%);1H ЯМР (400 МГц, CDCl3, δ): 7,65 (т, J=8,6 Гц, 1H), 7,42 (т, J=7,4 Гц, 1H), 7,33 (т, J=7,8 Гц, 1H), 7,30-7,22 (м, 1H), 7,06 (дд, J=3,5 Гц, 8,2 Гц, 1H), 6,70-6,44 (м, 2H), 5,24-5,08 (м, 1H), 4,47 (т, J=7,1 Гц, 1H), 3,82-3,60 (м, 6H), 3,40-3,22 (м, 1H), 3,02 (дд, J=9,4 Гц, 13,7 Гц, 1H), 2,41-2,00 (м, 3H), 2,00-0,90 (м, 20H);13С ЯМР (100 МГц, CDCl3, δ): 158,0, 140,6, 140,5, 134,8, 134,7, 133,0, 132,9, 131,3, 131,0, 129,5, 128,9, 125,9, 125,8, 119,4, 119,4, 115,9, 115,8, 109,9, 104,2, 103,1, 82,2, 81,9, 55,4, 54,7, 36,2 (4 пика), 29,8, 29,0, 27,3, 27,2, 26,1 [Наблюдаемая сложность из-за связи C-P];31P ЯМР (162 МГц, CDCl3, δ): 31,8; Анализ: рассчитано для C29H40O2ClPPd: C, 58,67; Н, 6,79. Найдено: C, 58,93; Н, 6,76.
Монокристаллы Pd(π-аллил)(SPhos)Cl получают путем медленного охлаждения раствора в ТГФ/пентане 1:1 в морозильной камере.
Pd(π-кротил)(SPhos)Cl

Следуя репрезентативной методике: [(кротил)PdCl]2 (501 мг, 1,27 ммоль); SPhos (1,05 г, 2,56 ммоль); ТГФ (5 мл); 6ч. Продукт получают в виде желтовато-белого твердого вещества (1,28 г, 83%);1H ЯМР (400 МГц, C6D6, δ): 7,58 (т, J=7,7 Гц, 1H), 7,17-7,04 (м, 4H), 6,42 (д, J=8,5 Гц, 1H), 6,28 (д, J=8,3 Гц, 1H), 4,69-4,58 (м, 1H), 3,77-3,62 (м, 1H), 3,53 (с, 3H), 3,25 (с, 3H), 3,20 (д, J=6,6 Гц, 1H), 2,52-2,29 (м, 2H), 2,20-1,15 (м, 24H);13С ЯМР (100 МГц, C6D6, δ): 158,0, 157,7, 141,8, 141,7, 133,4 (2 пика), 133,2, 133,1, 132,0, 131,7, 129,1 (2 пика), 128,2, 125,6, 125,5, 119,8, 119,7, 114,1 (2 пика), 103,7, 102,8, 99,8, 99,6, 54,8, 54,6, 48,4, 38,0, 37,8, 37,3, 37,1, 29,9, 28,5, 28,3, 27,4 (2 пика), 27,3, 27,1, 27,0 (2 пика), 26,9, 26,1, 17,1 (2 пика) [Наблюдаемая сложность из-за связи C-P];31P ЯМР (162 МГц, C6D6, δ): 28,9; Анализ: рассчитано для C30H42O2ClPPd: C, 59,31; Н, 6,97. Найдено: C, 59,15; Н, 7,17
Pd(π-циннамил)(SPhos)Cl

Следуя репрезентативной методике: [(циннамил)PdCl]2 (1,00 г, 1,93 ммоль); SPhos (1,59 г, 3,86 ммоль); толуол (4,3 мл); 1ч. Продукт получают в виде желтого твердого вещества (2,56 г, 99%);1H ЯМР (400 МГц, CDCl3, δ): 7,68 (т, J=8,5 Гц, 1H), 7,48-7,20 (м, 8H), 7,08-7,02 (м, 1H), 6,60 (д, J=8,3 Гц, 1H), 5,53-5,42 (м, 1H), 4,78-4,67 (м, 1H), 3,67 (с, 6H), 3,43-2,20 (м, 4H), 2,01-1,88 (м, 2H), 1,80-1,51 (м, 8H), 1,46-1,05 (м, 10H);13С ЯМР (100 МГц, CDCl3, δ): 157,8, 140,3, 140,2, 136,9, 136,8, 135,0, 134,9, 133,0 (2 пика), 131,3, 131,0, 129,3, 129,0, 128,4, 128,4, 128,1, 127,6 (2 пика), 127,5, 125,7, 125,6, 119,4 (2 пика), 109,3, 109,2, 103,6, 101,7, 101,4, 55,3, 50,0, 36,1, 35,9, 29,8, 29,7, 29,2, 27,3, 27,2, 27,0, 26,9, 26,1 [Наблюдаемая сложность из-за связи C-P];31P ЯМР (162 МГц, CDCl3, δ): 37,5; Анализ: рассчитано для C35H44O2ClPPd: C, 62,78; Н, 6,62. Найдено: C, 62,66; H, 6,54.
Монокристаллы для рентгеноструктурного анализа Pd(π-циннамил)(SPhos)Cl получают путем медленного охлаждения раствора в ТГФ/пентане 1:1 в морозильной камере.
Pd(π-аллил)(RuPhos)Cl

Следуя репрезентативной методике: [(аллил)PdCl]2 (503 мг, 1,43 ммоль); RuPhos (1,29 г, 2,77 ммоль); ТГФ (2 мл); 1ч. Продукт получают в виде белого твердого вещества (1,52 г, 85%);1H ЯМР (400 МГц, C6D6, δ): 7,60 (т, J=8,7 Гц, 1H), 7,18-7,05 (м, 4H), 6,96-6,86 (м, 1H), 6,92 (д, J=7,7 Гц, 1H), 6,32 (д, J=7,5 Гц, 1H), 5,03-4,91 (м, 1H), 4,49 (т, J=7,4 Гц, 1H), 4,46-4,30 (м, 1H), 4,22-4,08 (м, 1H), 3,37-3,22 (м, 1H), 3,01 (дд, J=9,7 Гц, 13,4 Гц, 1H), 2,55-2,04 (м, 5H), 2,03-0,80 (м, 30H);13С ЯМР (100 МГц, C6D6, δ): 157,2, 156,7, 141,3 (2 пика), 134,4, 134,3, 132,7, 132,6, 132,4, 132,1, 128,7 (2 пика), 128,3, 127,9, 125,4, 125,3, 122,5, 122,4, 115,3 (2 пика), 106,4, 105,5, 80,1, 79,8, 70,2, 69,9, 55,8, 36,2, 36,0, 35,5, 35,3, 29,5, 29,4, 27,1, 27,0, 26,2, 25,5, 22,3, 22,2, 21,6, 21,3 [Наблюдаемая сложность из-за связи C-P];31P ЯМР (162 МГц, C6D6, δ): 34,6; Анализ: рассчитано для C33H48O2ClPPd: C, 61,02; Н, 7,45. Найдено: C, 60,87; H, 7,42.
Монокристаллы Pd(π-аллил)(RuPhos)Cl для рентгеноструктурного анализа получают путем медленного охлаждения раствора в ТГФ/гексанах 1:1 в морозильной камере.
Pd(π-кротил)(RuPhos)Cl

Следуя репрезентативной методике: [(кротил)PdCl]2 (1,022 г, 5,09 ммоль); RuPhos (2,37 г, 10,18 ммоль); ТГФ (2,5 мл); 2ч. Продукт получают в виде бледно-желтого твердого вещества (2,93 г, 87%);1H ЯМР (400 МГц, C6D6, δ): 7,64 (т, J=8,4 Гц, 1H), 7,24-7,09 (м, 3H), 7,06-7,00 (м, 1H), 6,50 (д, J=7,9 Гц, 1H), 6,34 (д, J=7,6 Гц, 1H), 4,90-4,80 (м, 1H), 4,58-4,45 (м, 1H), 4,31-4,18 (м, 1H), 3,82-3,70 (м, 1H), 3,34-3,26 (м, 1H), 2,57-0,80 (м, 38H);13С ЯМР (100 МГц, C6D6, δ): 157,4, 156,9, 142,3, 142,2, 133,9, 133,8, 132,8 (2 пика), 132,5, 128,9 (2 пика), 128,2, 125,6, 125,5, 122,7 (2 пика), 114,7 (2 пика), 106,3, 105,4, 99,4, 99,1, 70,2, 70,0, 50,7, 37,5, 37,3, 36,7, 36,5, 30,0, 29,2, 27,4, 27,3, 27,1, 26,4, 22,5, 22,4, 21,6, 21,4, 17,4 (2 пика) [Наблюдаемая сложность из-за связи C-P];31P ЯМР (162 МГц, C6D6, δ): 33,2; МСВР-ИЭС м/з: [М-Cl], рассчитано для C33H48O2PPd, 627,2583; найдено 627,2554.
Монокристаллы Pd(π-кротил)(RuPhos)Cl для рентгеноструктурного анализа получают путем медленного охлаждения раствора в ТГФ/гексанах 1:1 в морозильной камере.
Pd(π-циннамил)(RuPhos)Cl

Следуя репрезентативной методике: [(циннамил)PdCl]2 (1,00 г, 1,93 ммоль); RuPhos (1,80 г, 3,86 ммоль); ТГФ (4 мл); 2ч. Продукт получают в виде желтого твердого вещества (2,13 г, 76%);1H ЯМР (400 МГц, CDCl3, δ): 7,78-7,68 (м, 1H), 7,46 (д, J=7,5 Гц, 1H), 7,35-7,18 (м, 7H), 6,92-6,87 (м, 1H), 6,55 (д, J=8,2 Гц, 1H), 5,72-5,58 (м, 1H), 4,91-4,77 (м, 1H), 4,52-4,39 (м, 1H), 3,00-2,50 (м, 1H), 2,31-2,19 (м, 2H), 2,05-1,94 (м, 2H), 1,74-1,49 (м, 8H), 1,44-0,89 (м, 24H);13С ЯМР (100 МГц, CDCl3, δ): 156,9, 140,1, 137,1 (2 пика), 135,1, 132,8, 132,7, 131,8, 131,5, 128,7, 128,4, 127,5 (2 пика), 127,4, 125,2, 125,1, 122,4 (2 пика), 109,7, 109,6, 106,0, 100,3, 100,0, 70,4, 52,6, 35,0, 24,8, 30,0, 29,2, 27,0, 26,9, 26,8, 26,0, 22,4, 22,0, 21,8 [Наблюдаемая сложность из-за связи C-P];31P ЯМР (162 МГц, CDCl3, δ): 44,0; МСВР-ИЭС м/з: [М-Cl], рассчитано для C39H52O2PPd, 689,2740; найдено 689,2739.
Pd(π-аллил)(XPhos)Cl

Следуя репрезентативной методике: [(аллил)PdCl]2 (858 мг, 2,36 ммоль); XPhos (2,56 г, 5,37 ммоль); ТГФ (5 мл); 3ч. Продукт получают в виде желтого твердого вещества (3,11 г, 97%), продукт содержит ~ 5% мольн. ТГФ;1H ЯМР (400 МГц, CDCl3, δ): 7,98-7,84 (м, 1H), 7,40-7,27 (м, 2H), 7,07-6,99 (м, 3H), 5,47-5,26 (м, 1H), 4,54 (т, J=7,1 Гц, 1H), 3,51 (дд, J=9,3 Гц, 13,6 Гц, 1H), 3,12-3,01 (м, 1H), 3,00-2,88 (м, 1H), 2,70-2,42 (м, 2H), 2,41-2,10 (м, 3H), 1,92-0,73 (м, 38H);13С ЯМР (100 МГц, CDCl3, δ): 148,7, 146,2, 142,1, 136,6, 136,4, 136,3, 133,7, 133,6, 131,8, 131,6, 128,0 (2 пика), 125,5, 125,4, 120,7, 116,0, 116,0, 79,3, 79,0, 55,7, 34,4, 34,1, 33,9, 31,3, 30,4, 29,0, 27,1, 27,0, 26,8, 26,7, 25,6, 25,4, 23,9, 22,3 [Наблюдаемая сложность из-за связи C-P], наблюдали пики при 67,7, 25,8, относящиеся к ТГФ;31P ЯМР (162 МГц, CDCl3, δ): 48,0; Анализ: рассчитано для C36H54ClPPd: C, 65,55; H, 8,25. Найдено: C, 65,79; Н, 8,01.
Pd(π-кротил)(XPhos)Cl

Следуя репрезентативной методике: [(кротил)PdCl]2 (1,00 г, 2,54 ммоль); XPhos (2,42 г, 5,08 ммоль); толуол (30 мл); 2ч. Продукт получают в виде белого твердого вещества (3,11 г, 91%);1H ЯМР (400 МГц, CDCl3, δ): 7,99-7,86 (м, 1H), 7,38-7,29 (м, 2H), 7,18-6,99 (м, 3H), 5,19-5,03 (м, 1H), 4,32-4,13 (м, 1H), 3,00-2,80 (м, 2H), 2,71-2,42 (м, 2H), 2,31-2,02 (м, 3H), 1,95-0,74 (м, 47H);13С ЯМР (100 МГц, CDCl3, δ): 148,7, 146,3, 142,1, 136,9, 136,7, 136,5, 133,7, 133,6, 132,3, 132,0, 128,8, 128,0 (2 пика), 125,5, 125,4, 120,8, 115,0 (2 пика), 98,5, 98,2, 50,9, 34,8, 34,2, 31,4, 30,5 (2 пика), 29,2, 27,2, 27,1, 27,0, 26,9, 26,8, 25,8, 25,7, 24,0, 22,4, 17,2, 17,1 [Наблюдаемая сложность из-за связи C-P];31P ЯМР (162 МГц, CDCl3, δ): 50,8; МСВР-ИЭС м/з: [М-Cl], рассчитано для C37H56PPd, 637,3154; найдено 637,3153.
Pd(π-циннамил)(XPhos)Cl

Следуя репрезентативной методике: [(циннамил)PdCl]2 (1,00 г, 1,93 ммоль); XPhos (1,84 г, 3,86 ммоль); толуол (5 мл); 2ч. Продукт получают в виде желтого твердого вещества (2,27 г, 80%), продукт содержит следы остаточного толуола;1H ЯМР (400 МГц, CDCl3, δ): 8,10-7,95 (м, 1H), 7,52 (д, J=7,5 Гц, 2H), 7,42-7,23 (м, 5H), 7,11-7,01 (м, 3H), 5,87-5,69 (м, 1H), 5,20-5,06 (м, 1H), 3,08-2,90 (м, 2H), 2,73-0,70 (м, 49H), наблюдали пики при 7,17 и 2,36, относящиеся к толуолу;13С ЯМР (100 МГц, CDCl3, δ): 148,9, 146,4, 142,1, 137,2, 136,9, 136,8, 136,7, 136,6, 133,8, 133,7, 132,4, 132,2, 129,0, 128,6, 128,4, 128,1, 127,6 (2 пика), 125,7, 125,6, 125,2, 121,0, 109,7, 109,6, 99,4, 99,1, 51,9, 34,5, 34,3, 31,7, 30,6, 29,2, 27,3, 27,2, 27,0, 26,9, 26,0, 25,7, 24,1, 22,5 [Наблюдаемая сложность из-за связи C-P], наблюдали пики при 137,7, 21,4, относящиеся к толуолу;31P ЯМР (162 МГц, CDCl3, δ): 54,3; Анализ: рассчитано для C36H54ClPPd: C, 68,56; Н, 7,95. Найдено: C, 68,85; H, 7,93.
Pd(π-аллил)(BrettPhos)Cl

Следуя репрезентативной методике: [(аллил)PdCl]2 (502 мг, 1,38 ммоль); BrettPhos (1,48 г, 2,76 ммоль); толуол (6 мл); 1ч. Продукт получают в виде желтовато-белого твердого вещества (1,95 г, 99%);1H ЯМР (400 МГц, CDCl3, δ): сложный спектр (см. фигуру 1);31P ЯМР (162 МГц, CDCl3, δ): 54,1, 48,7; Анализ: рассчитано для C38H58O2ClPPd: C, 63,42; H, 8,12. Найдено: C, 63,17; H, 8,16.
Pd(π-кротил)(BrettPhos)Cl

Следуя репрезентативной методике: [(кротил)PdCl]2 (303 мг, 0,769 ммоль); BrettPhos (827 мг, 1,53 ммоль); толуол (2 мл); 1ч. Продукт получают в виде желтовато-белого твердого вещества (1,04 г, 92%);1H ЯМР (400 МГц, CDCl3, δ): сложный спектр (см. фигуру 2);31P ЯМР (162 МГц, CDCl3, δ): 41,4; Анализ: рассчитано для C39H60O2ClPPd: C, 63,84; Н, 8,24. Найдено: C, 65,01; Н, 8,57
Pd(π-циннамил)(BrettPhos)Cl
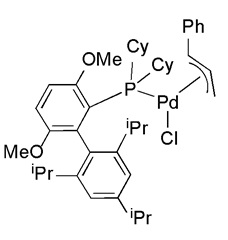
Следуя репрезентативной методике: [(циннамил)PdCl]2 (503 мг, 0,971 ммоль); BrettPhos (1,04 г, 1,94 ммоль); толуол (4 мл); 0,5ч. Продукт получают в виде желтого твердого вещества (1,34 г, 87%);1H ЯМР (400 МГц, CDCl3, δ): сложный спектр (см. фигуру 3);31P ЯМР (162 МГц, CDCl3, δ): 43,9; Анализ: рассчитано для C44H62O2ClPPd: C, 66,41; Н, 7,85. Найдено: C 66,44; Н, 8,15.
Pd(π-аллил)(JackiePhos)Cl

Следуя репрезентативной методике: [(аллил)PdCl]2 (183 мг, 0,500 ммоль); JackiePhos (797 мг, 1,00 ммоль); толуол (5 мл); 1ч. Продукт получают в виде белого твердого вещества (529 мг, 54%);1H ЯМР (400 МГц, CDCl3, δ): сложный спектр (см. фигуру 4);31P ЯМР (162 МГц, CDCl3, δ): 18,1; Анализ: рассчитано для C42H42F12O2ClPPd: C, 51,50; Н, 4,32. Найдено: C, 51,52; H, 4,15.
Pd(π-аллил)(CyBippyPhos)Cl

Следуя репрезентативной методике: [(аллил)PdCl]2 (245 мг, 0,671 ммоль); CyBippyPhos (750 мг, 1,34 ммоль); ТГФ (4,5 мл); 0,5ч. Продукт получают в виде бледно-желтого твердого вещества (220 мг, 22%).
Pd(π-аллил)(CyBippyPhos)Cl может быть также получен с помощью следующей методики:
В сухой сцинтилляционный флакон 20 мл загружают 245 мг (0,67 ммоль) [(аллил)PdCl]2, и переносят в перчаточный бокс, заполненный азотом. Во флакон затем загружают 750 мг (1,34 ммоль) CyBippyPhos. Добавляют 4 мл толуола, и полученную смесь перемешивают при комнатной температуре в течение 30 минут. В течение времени перемешивания смесь становится густой, и перемешивание затруднено. Дополнительные 4 мл толуола добавляют, чтобы перемешивание продолжалось. Продукт полностью осаждают добавлением 8 мл гексана. Твердое вещество собирают путем вакуумной фильтрации на воздухе и промывают 3 × 10 мл гексанов. Твердое вещество сушат в вакууме с получением 913 мг (1,23 ммоль, 92%) указанного в заголовке соединения в виде не совсем белого твердого вещества. Продукт содержит <2% масс. остаточного толуола.
1H ЯМР (400 МГц, CDCl3, δ): 7,99 (с, 1H), 7,44-7,18 (м, 15H), 6,68-6,55 (м, 1H), 5,30-4,99 (м, 1H), 4,60-4,50 (м, 1H), 3,54-3,33 (м, 1H), 2,88-2,78 (м, 1H), 2,20-0,77 (м, 22H), 0,48-0,30 (м, 1H);31P ЯМР (162 МГц, CDCl3, δ): 25,2, 23,2; МСВР-ИЭС м/з: [М-Cl], рассчитано для C37H56PPd, 637,3154; найдено 637,3153. Анализ: рассчитано для C39H44N4ClPPd: C, 63,16; Н, 5,98; N, 7,55. Найдено: C 63,22; Н, 6,14; N, 7,30.
(π-кротил)Pd(CyBippyPhos)Cl

В сухую колбу Шленка загружают 264 мг (0,67 ммоль) [(кротил)PdCl]2, и переносят в перчаточный бокс, заполненный азотом. Затем в колбу загружают 750 мг (1,34 ммоль) CyBippyPhos. Добавляют 8 мл толуола, и полученную смесь перемешивают при комнатной температуре в течение 1 часа. Продукт осаждают добавлением 20 мл пентана при охлаждении в бане со льдом. Твердое вещество собирают путем вакуумной фильтрации на воздухе, промывают 3 × 10 мл гексанов и сушат в вакууме с получением 904 мг (1,10 ммоль, 83%) указанного в заголовке соединения в виде не совсем белого твердого вещества. Продукт представляет собой 2/3 толуолового аддукта, который разрушается растворением в CH2Cl2 и выпаривания растворителя при пониженном давлении при 60°C.
1H ЯМР (400 МГц, CDCl3, δ): сложный спектр (см. фигуру 5).
13С ЯМР (101 МГц, CDCl3, δ): 147,2, 142,2, 142,0, 140,5, 140,4, 140,0, 139,9, 137,9, 137,6, 137,3, 137,1, 131,4, 131,3, 130,4, 129,1 (2 пика), 129,0, 128,7, 128,6 (2 пика), 128,5, 128,2 (2 пика), 127,6, 127,5, 126,2 (2 пика), 126,1, 125,3, 120,1, 119,8, 116,9, 116,8, 116,4, 116,3, 115,8 (2 пика), 115,3 (2 пика), 100,9, 100,6, 100,4, 52,0, 50,6, 34,9, 34,7, 34,4, 34,1, 30,6, 29,9 (2 пика), 29,6, 29,5, 28,5, 28,3, 27,9, 27,7, 27,2, 27,0, 26,9, 26,8, 26,7, 26,6, 26,0, 25,8, 22,4, 21,5 [Наблюдаемая сложность из-за связи C-P].
31P ЯМР (162 МГц, CDCl3, δ): 22,6 (уш.), 19,8 (уш.).
МСВР-ИЭС м/з: [М-Cl]+ рассчитано для C40H46NPPd: 719,2495; Найдено: 719,2510.
Пример 2 (сравнительный)
Арилирование ацетофенона с помощью 4-хлоанизола

Репрезентативная методика: В сухой сосуд Шленка, снабженный магнитной мешалкой с тефлоновым покрытием, загружают 1% мольн. (0,01 ммоль) Pd-предкатализатора и 2,00 ммоль (2,0 эквив.) трет-BuOK. Сосуд оснащают резиновой септой, и вакуумируют и заполняют азотом. Эту процедуру вакуумирования/заполнения азотом повторяют еще два раза. 4-Хлоранизол (1,00 ммоль, 1 эквив.) и ацетофенон (1,20 ммоль, 1,2 эквив.) добавляют с помощью шприца с последующим добавлением 4 мл безводного толуола. Сосуд помещают в предварительно нагретую (40-60°C) масляную баню, и полученную смесь энергично перемешивают в течение 18 часов. Затем сосуд вынимают из масляной бани, и содержимое оставляют охлаждаться до комнатной температуры. Образец сырой реакционной смеси анализируют с помощью1H ЯМР.
Пример 3 (согласно изобретению)
Арилирование ацетофенона с помощью 4-хлоранизола

Репрезентативная методика: В сухой сосуд Шленка, снабженный магнитной мешалкой с тефлоновым покрытием, загружают 6,5 мг (0,01 ммоль) (R-аллил)Pd(XPhos)Cl и 224 мг (2,00 ммоль) трет-BuOK. Сосуд оснащают резиновой септой, и вакуумируют и заполняют азотом. Эту процедуру вакуумирования/заполнения азотом повторяют еще два раза. 4-Хлоранизол (129 мкл, 1,05 ммоль) и ацетофенон (117 мкл, 1,00 ммоль) добавляют с помощью шприца с последующим добавлением 4 мл безводного толуола. Сосуд помещают в предварительно нагретую (60°C) масляную баню, и полученную смесь интенсивно перемешивают в течение 4 часов. Затем сосуд вынимают из масляной бани, и содержимое оставляют охлаждаться до комнатной температуры. Образец анализируют с помощью ГХ.
Общей проблемой, наблюдаемой в α-арилировании метилкетонов, является образование диарилированных продуктов. Результаты этого примера показывают, что значительно более высокие выходы и более высокая селективность (>20:1) для моноарилирования:диарилирования ацетофенона с помощью хлораренов достигаются с применением комплексов (R-аллил)Pd(XPhos)Cl по сравнению с комплексами (R-аллил)Pd(AmPhos)Cl (см. пример 2). Важно отметить идентичность лиганда, который определяет активность катализатора.
Пример 4 (согласно изобретению)
Аминирование 4-хлоранизола с помощью морфолина[а]

* с 0,5% мольн. добавленного карбазола
**сравнительный
ПЦ-палладацикл
[а] Условия реакции: 4-хлоранизол (1,0 ммоль), морфолин (1,2 ммоль), NaO-трет-Bu (1,2 ммоль), катализатор (0,5% мольн.), ТГФ (2 мл). [b] Определяется с помощью ГХ с использованием додекана в качестве внутреннего стандарта. [с] С 0,5% мольн. дополнительно добавленного RuPhos. [d] Проводят в течение 2,5 ч.

Приведенные выше данные свидетельствуют о том, что комплексы (R-π-аллил)Pd(L)Cl (L=RuPhos) по настоящему изобретению проявляют лучшую активность, чем палладацикл RuPhos первого поколения, и значительно более высокую активность, чем палладациклы RuPhos второго и третьего поколения.
Кроме того, палладациклические предкатализаторы Бухвальда второго и третьего поколения высвобождают эквивалент генотоксического карбазола при активации в отличие от комплексов по настоящему изобретению. Приведенные данные также показывают, что активный катализатор, генерируемый из комплексов (R-π-аллил)Pd(L)Cl, не подвергается ингибированию из-за образования карбазола, как это делают палладациклы второго и третьего поколения.
Пример 5 (согласно изобретению)
Сочетание 3-хлорпиридина и п-толуолборной кислоты по Сузуки-Мияура[а]

* Сравнительный.
[а] Условия реакции: 3-хлорпиридин (1,0 ммоль), п-толуолборная кислота (1,5 ммоль), K3PO4 (2,0 ммоль), катализатор (2% мольн.), ТГФ (2 мл), H2O (4 мл). [b] Проводят в течение 2 ч.

В сухой сосуд Шленка, снабженный магнитной мешалкой с тефлоновым покрытием и оснащенный резиновой септой, загружают предкатализатор (0,02 ммоль, 2% мольн.) и 204 мг (1,50 ммоль, 1,50 эквив.) п-толуолборной кислоты. Сосуд вакуумируют и заполняют азотом. Этот цикл вакуумирования/заполнения азотом повторяют еще два раза. Добавляют 3-хлорпиридин (95 мкл, 1,00 ммоль, 1,00 эквив.) с последующим добавлением 2 мл безводного ТГФ и 4,0 мл 0,5 М K3PO4 (водный). Содержимое энергично перемешивают в течение 30 мин. Отбирают аликвоту и анализируют с помощью газовой хроматографии.
Комплекс (аллил)Pd(XPhos)Cl демонстрирует конверсию, сравнимую с палладациклом XPhos 3-го поколения. Тем не менее, как (кротил)Pd(XPhos)Cl, так и (циннамил)Pd(XPhos)Cl способствуют реакции сочетания по Сузуки-Мияура с более высокими скоростями, чем палладацикл 3-го поколения.
Пример 6 (согласно изобретению)
Аминирование арил/гетероарил хлоридов с применением (π-кротил)Pd(RuPhos)Cl[а]
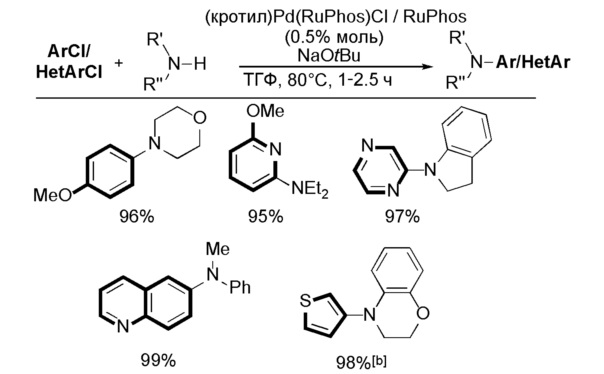
[а] Условия реакции: ArCl/HetArCl (1,0 ммоль), амин (1,2 ммоль), NaO-трет-Bu (1,2 ммоль), катализатор (0,5% мольн.), RuPhos (0,5% мольн.), ТГФ (2 мл). [b] 1% мольн. (π-кротил)Pd(RuPhos)Cl/1% мольн. RuPhos, K2CO3, трет-AmOH, 110°C, 18ч.
Быстрое время реакции наблюдали со 100% конверсией, достигаемой за 1-2,5 ч во всех случаях, за исключением 4-(тиофен-3-ил)-3,4-дигидро-2Н-бензо[b][1,4]оксазина, который требовал 18 ч. Синтез 4-(тиофен-3-ил)-3,4-дигидро-2Н-бензо[b][1,4]оксазина также демонстрирует активацию катализатора с использованием слабого основания (K2CO3) по сравнению с NaO-трет-Bu.
Общая методика для реакций аминирования
В высушенный в сушильной печи сосуд Шленка, снабженный магнитной мешалкой с тефлоновым покрытием, загружают (π-кротил)Pd RuPhos)Cl (0,5-1% мольн., как указано), RuPhos (0,5-1% мольн., как указано), арил хлорид (1,00 ммоль, если в твердом состоянии) и NaO-трет-Bu (1,20 ммоль). Сосуд вакуумируют и заполняют азотом. Этот цикл вакуумирования/заполнения азотом повторяют еще два раза. Додекан (GC стандарт, 0,20 ммоль), амин (1,20 ммоль), арил хлорид (1,00 ммоль, если жидкость) и безводный ТГФ (2 мл) добавляют последовательно с помощью шприца. Сосуд помещают в предварительно нагретую масляную баню и перемешивают в течение указанного времени. Затем сосуд вынимают из масляной бани и дают охладиться до комнатной температуры. Реакционную смесь разбавляют с помощью 10 мл этилацетата и фильтруют через слой целита. Раствор концентрируют в вакууме, и остаток хроматографируют на силикагеле с использованием Teledyne ISCO CombiFlashRf.
4-(4-метоксифенил)морфолин

В соответствии с общей методикой смесь 4-хлоранизола (123 мкл, 1,00 ммоль), морфолина (105 мкл, 1,20 ммоль), NaO-трет-Bu (115 мг, 1,20 ммоль), (π-кротил)Pd(RuPhos)Cl (3,3 мг, 0,005 ммоль), RuPhos (2,3 мг, 0,005 ммоль) и 2 мл ТГФ перемешивают при 80°С в течение 2,5 ч. Сырой продукт хроматографируют на силикагеле с градиентом 0-20% EtOAc/гексаны в качестве элюента с получением 186 мг (0,96 ммоль, 96%) 4-(4-метоксифенил)морфолина в виде бесцветного твердого вещества. Спектроскопические данные соответствуют тем, которые ранее сообщались (D. Maiti, B. P. Fors, J. L. Henderson, Y. Nakamura, S. L. Buchwald, Chem. Sci.2011, 2, 57).
N,N-диэтил-6-метоксипиридин-2-амин

В соответствии с общей методикой смесь 2-хлор-6-метоксипиридина (119 мкл, 1,00 ммоль), диэтиламина (124 мкл, 1,20 ммоль), NaO-трет-Bu (115 мг, 1,20 ммоль), (π-кротил)Pd(RuPhos)Cl (3,3 мг, 0,005 ммоль), RuPhos (2,3 мг, 0,005 ммоль) и 2 мл ТГФ перемешивают при 80°С в течение 70 минут. Сырой продукт хроматографируют на силикагеле с градиентом 0-5% EtOAc/гексаны в качестве элюента с получением 171 мг (0,95 ммоль, выход 95%) N,N-диэтил-6-метоксипиридин-2-амина в виде бесцветного масла.
1H ЯМР (400 МГц, CDCl3, δ): 7,33 (т, J=7,5 Гц, 1H), 5,99 (д, J=7,8 Гц, 1H), 5,93 (д, J=7,8 Гц, 1H), 3,86 (с, 3H), 3,49 (д, J=7,0 Гц, 4 Н), 1,81 (т, J=7,0 Гц, 6H).
13С ЯМР (100 МГц, CDCl3, δ): 163,4, 156,7, 139,8, 96,8, 95,2, 52,9, 42,7, 13,2.
МСВР-ИЭС: м/з [М+Н]+ рассчитано для C10H17N2O: 181,1341. Найдено: 181,1318
1-(пиразин-2-ил)индолин

В соответствии с общей методикой смесь 2-хлорпиразина (89 мкл, 1,00 ммоль), индолина (135 мкл, 1,20 ммоль), NaO-трет-Bu (115 мг, 1,20 ммоль), (π-кротил)Pd(RuPhos)Cl (3,3 мг, 0,005 ммоль), RuPhos (2,3 мг, 0,005 ммоль) и 2 мл ТГФ перемешивают при 80°С в течение 1 часа. Сырой продукт хроматографируют на силикагеле с градиентом 0-50% EtOAc/гексаны в качестве элюента с получением 191 мг (0,97 ммоль, 97%) 1-(пиразин-2-ил)индолина в виде желтого твердого вещества.
1H ЯМР (400 МГц, CDCl3, δ): 8,14-8,28 (м, 3H), 8,00 (каж. д, J=2,6 Гц, 1H), 7,13-7,27 (м, 2H), 6,88-6,93 (м, 1H), 4,05 (т, J=8,7 Гц, 2H), 3,24 (т, J=8,7 Гц, 2H).
13С ЯМР (100 МГц, CDCl3, δ): 151,6, 144,1, 141,8, 134,3, 132,0, 131,3, 127,5, 124,8, 121,6, 114,2, 48,7, 27,9.
Анализ: рассчитано для C12H11N3: C, 73,07; Н, 5,62; N, 21,30. Найдено: C, 73,17; Н, 5,63; N, 21,42.
N-метил-N-фенилхинолин-6-амин

В соответствии с общей методикой смесь 6-хлорхинолина (164 мг, 1,00 ммоль), N-метиланилина (130 мкл, 1,20 ммоль), NaO-трет-Bu (115 мг, 1,20 ммоль), (π-кротил)Pd(RuPhos)Cl (3,3 мг, 0,005 ммоль), RuPhos (2,3 мг, 0,005 ммоль) и 2 мл ТГФ перемешивают при 80°С в течение 1 часа. Сырой продукт хроматографируют на силикагеле с градиентом 0-50% EtOAc/гексаны в качестве элюента с получением 231 мг (0,99 ммоль, 99%) N-метил-N-фенилхинолин-6-амина в виде желтого масла. Спектроскопические данные соответствуют тем, которые ранее сообщались (M. Tobisu, A. Yasutome, K. Yamakawa, T. Shimasaki, N. Chatani, Tetrahedron2012, 68, 5157).
4-(тиофен-3-ил)-3,4-дигидро-2Н-бензо[b][1,4]оксазин

Выполняют общую методику со следующими изменениями: смесь 3-хлортиофена (93 мкл, 1,00 ммоль), бензоморфолина (140 мкл, 1,20 ммоль), К2СО3 (194 мг, 1,40 ммоль), (π-кротил)Pd(RuPhos)Cl (6,6 мг, 0,01 ммоль), RuPhos (4,7 мг, 0,01 ммоль) и 2 мл трет-AmOH перемешивают при 110°С в течение 20 час. Сырой продукт хроматографируют на силикагеле с градиентом 0-5% EtOAc/гексаны в качестве элюента с получением 212 мг (0,98 ммоль, 98%) 4-(тиофен-3-ил)-3,4-дигидро-2H-бензо[b][1,4]оксазина в виде желтого масла.
1H ЯМР (400 МГц, CDCl3, δ): 7,30 (дд, J=3,2 Гц, 5,2 Гц, 1H), 7,07 (дд, J=1,4 Гц, 5,2 Гц, 1H), 6,92-6,98 (м, 1H), 6,85-6,91 (м, 1H), 6,81 (дд, J=1,4 Гц, 3,2 Гц, 1H), 6,73-6,81 (м, 2H), 4,33 (т, J=4,5 Гц, 2H), 3,69 (т, J=4,4 Гц, 2H).
13С ЯМР (100 МГц, CDCl3, δ): 146,1, 144,5, 133,1, 125,4, 124,1, 121,2, 120,1, 117,0, 116,3, 112,3, 64,5, 49,0.
Анализ: рассчитано для C12H11NOS: C, 66,33; Н, 5,10; N, 6,45. Найдено: C, 66,42; Н, 5,24; N, 6,42.
Пример 7 (согласно изобретению)
Реакции Сузуки-Мияура с применением (π-кротил)Pd(XPhos)Cl[а]

[а] Условия реакции: HetArCl (1,0 ммоль), ArB(OH)2 (1,5 ммоль), K3PO4 (2,0 ммоль), катализатор (2% мольн.), ТГФ (2 мл), H2O (4 мл). [b] выделяют в виде гидрометансульфонатной соли для простоты очистки.
Используя катализатор (кротил)Pd(XPhos)Cl, ряд гетероарил хлоридов можно сочетать с представляющими сложность арил- и гетероарил-борными кислотами с постоянно высокими выходами, в том числе с теми, которые склонны к быстрому протодеборированию при или чуть выше комнатной температуры (до 45°C) за счет быстрого генерирования активного "L-Pd(0)". Например, 2-тиенилборную кислоту, 2-фуранборную кислоту и 2,6-дифторфенилборную кислоту, все сочетали с высоким выходом с коротким временем реакции (≤1 час).
Общая методика сочетаний по Сузуки-Мияура
В высушенный в сушильной печи сосуд Шленка, снабженный магнитной мешалкой с тефлоновым покрытием, загружают (π-кротил)Pd(XPhos)Cl (2% мольн.), гетероарил хлорид (1,00 ммоль, если твердое вещество) и арил-/гетероарил-борную кислоту (1,5 ммоль). Сосуд вакуумируют и заполняют. Этот цикл вакуумирования/заполнения азотом повторяют еще два раза. Гетероарил хлорид (1,00 ммоль, если жидкость), безводный ТГФ (2 мл) и водный 0,5 М K3PO4 (4,0 мл) последовательно добавляют с помощью шприца. Сосуд перемешивают при комнатной температуре или помещают в предварительно нагретую масляную баню при температуре 45°С, как указано, и перемешивают в течение указанного времени. В случае если нагревают, сосуд затем вынимают из масляной бани и дают охладиться до комнатной температуры. Реакционную смесь разбавляют с помощью 10 мл EtOAc и 10 мл H2O, а затем водную фазу экстрагируют с помощью 3 × 10 мл EtOAc. Объединенные органические экстракты сушат над безводным MgSO4, фильтруют и концентрируют в вакууме. Остаток хроматографируют на силикагеле с использованием Teledyne ISCO CombiFlashRf, если не указано иное.
3-(4-толил)пиридин

В соответствии с общей методикой смесь 3-хлорпиридина (95 мкл, 1,00 ммоль), п-толуолборной кислоты (204 мг, 1,50 ммоль), (π-кротил)Pd(XPhos)Cl (14 мг, 0,02 ммоль), 2 мл ТГФ и 4 мл 0,5 М водного K3PO4 перемешивают при комнатной температуре в течение 2 часов. Сырой продукт хроматографируют на силикагеле с градиентом 10-40% EtOAc/гексаны в качестве элюента с получением 160 мг (0,95 ммоль, 95%) 3-(4-толил)пиридина в виде бесцветного твердого вещества. Спектроскопические данные соответствуют тем, которые ранее сообщались (C. L. Cioffi, W. T. Spencer, J. J. Richards, R. J. Herr, J. Org. Chem.2004, 69, 2210).
2-(тиофен-2-ил)хинолин

В соответствии с общей методикой смесь 2-хлорхинолина (164 мг, 1,00 ммоль), 2-тиенилборной кислоты (192 мг, 1,50 ммоль), (π-кротил)Pd(XPhos)Cl (14 мг, 0,02 ммоль), 2 мл ТГФ и 4 мл 0,5 М водного K3PO4 перемешивают при 45°С в течение 2 часов. Сырой продукт хроматографируют на силикагеле с градиентом 0-5% EtOAc/гексаны в качестве элюента с получением 208 мг (0,99 ммоль, 99%) 2-(тиофен-2-ил)хинолина в виде бесцветного твердого вещества. Спектроскопические данные соответствуют тем, которые ранее сообщались (F.-F. Zhuo, W.-W. Xie, Y.-X. Yang, L. Zhang, P. Wang, R. Yuan, C.-S. Da, J. Org. Chem.2013, 78, 3243).
4-(фуран-2-ил)-2,6-диметоксипиримидин

В соответствии с общей методикой смесь 6-хлор-2,4-диметоксипиримидина (175 мг, 1,00 ммоль), 2-фуранборной кислоты (168 мг, 1,50 ммоль), (π-кротил)Pd(XPhos)Cl (14 мг, 0,02 ммоль), 2 мл ТГФ и 4 мл 0,5 М водного K3PO4 перемешивают при комнатной температуре в течение 1 часа. Сырой продукт хроматографируют на силикагеле с градиентом 0-10% EtOAc/гексаны в качестве элюента с получением 194 мг (0,94 ммоль, 94%) 4-(фуран-2-ил)-2,6-диметоксипиримидина в виде бесцветного твердого вещества.
1H ЯМР (400 МГц, CDCl3, δ): 7,53 (дд, J=0,9 Гц, 1,9 Гц, 1H), 7,19 (дд, J=0,7 Гц, 3,5 Гц, 1H), 6,69 (с, 1H), 6,53 (дд, J=1,7 Гц, 3,4 Гц, 1H), 4,02 (с, 3H), 3,99 (с, 3H).
13С ЯМР (100 МГц, CDCl3, δ): 172,6, 165,6, 157,4, 152,2, 144,6, 112,3, 111,9, 95,0, 54,8, 54,0.
Анализ: рассчитано для C10H10N2O3: C, 58,25; Н, 4,89; N, 13.59. Найдено: C, 58,19; Н, 4,72; N, 13,42.
2-(2,6-дифторфенил)-6-метоксипиридин

В соответствии с общей методикой смесь 2-хлор-6-метоксипиридина (119 мкл, 1,00 ммоль), 2,6-дифторфенилборной кислоты (237 мг, 1,50 ммоль), (π-кротил)Pd(XPhos)Cl (14 мг, 0,02 ммоль), 2 мл ТГФ и 4 мл 0,5 М водного K3PO4 перемешивают при комнатной температуре в течение 30 минут. Сырой продукт хроматографируют на силикагеле с градиентом 0-5% EtOAc/гексаны в качестве элюента с получением 195 мг (0,88 ммоль, 88%) 2-(2,6-дифторфенил)-6-метоксипиридина в виде бледно-желтого масла.
1H ЯМР (400 МГц, CDCl3, δ): 7,64 (т, J=7,8 Гц, 1H), 7,35-7,26 (м, 1H), 7,05 (д, J=7,1 Гц, 1H), 7,00-6,92 (м, 2H), 6,75 (д, J=8,3 Гц, 1H), 3,95 (с, 3H).
13С ЯМР (100 МГц, CDCl3, δ): 163,8, 160,5 (дд, J=250,7 Гц, 6,97 Гц), 146,7, 138,6, 129,8 (т, J=10,23 Гц), 118,8 (т, J=1,95 Гц), 118,2 (т, J=17,23 Гц), 111,8 (дд, J=26,1 Гц, 6,6 Гц), 110,3, 53,6.
Анализ: рассчитано для C12H9F2NO: C, 65,16; H, 4,10; N, 6,33. Найдено: C, 65,14; Н, 4,37; N, 6,46.
5-(дибензо[b,d]фуран-4-ил)-1,3-диметил-1Н-пиразол

В соответствии с общей методикой смесь 5-хлор-1,3-диметил-1Н-пиразола (115 мкл, 1,00 ммоль), дибензо[b]фуран-4-борной кислоты (318 мг, 1,50 ммоль), (π-кротил)Pd(XPhos)Cl (14 мг, 0,02 ммоль), 2 мл ТГФ и 4 мл 0,5 М водного K3PO4 перемешивают при комнатной температуре в течение 2 часов. Сырой продукт хроматографируют на силикагеле с градиентом 0-10% EtOAc/гексаны в качестве элюента с получением 240 мг (0,92 ммоль, 92%) 5-(дибензо[b,d]фуран-4-ил)-1,3-диметил-1Н-пиразола в виде не совсем белого твердого вещества.
1H ЯМР (400 МГц, CDCl3, δ): 8,02-7,97 (м, 2H), 7,57 (д, J=8,8 Гц, 1H), 7,58-7,36 (м, 4H), 6,33 (с, 1H), 3,85 (с, 3H), 2,39 (с, 3H).
13С ЯМР (100 МГц, CDCl3, δ): 156,2, 153,3, 147,9, 139,1, 128,0, 127,7, 125,0, 124,0, 123,2, 123,0, 121,1, 120,9, 115,6, 112,0, 107,1, 37,4, 13,7.
Анализ: рассчитано для C17H14N2O: C, 77,84; Н, 5,38; N, 10.68. Найдено: C, 77,93; Н, 5,29; N, 10,56.
5-метил-6-(тиофен-3-ил)имидазо[1,2-а]пиридин гидрометансульфонат

В соответствии с общей методикой смесь 6-бром-5-метилимидазо[1,2-а]пиридина (167 мг, 1,00 ммоль), 3-тиенилборной кислоты (152 мг, 1,50 ммоль), (π-кротил)Pd(XPhos)Cl (14 мг, 0,02 ммоль), 2 мл ТГФ и 4 мл 0,5 М водного K3PO4 перемешивают при 45°С в течение 5 часов. Сырой продукт растворяют в 10 мл изопропил ацетата и перемешивают. Медленно добавляют 0,08 мл метансульфоновой кислоты, так как образуется осадок, и смесь перемешивают при комнатной температуре в течение 30 минут. Твердое вещество собирают вакуумной фильтрацией, промывают (3 × 5 мл изопропил ацетата, 1 × 10 мл гексанов) и сушат в вакууме с получением 194 мг (0,80 ммоль, 80%) 5-метил-6-(тиофен-3-ил)имидазо[1,2-а]пиридина гидрометансульфоната в виде желтовато-коричневого твердого вещества.
1H ЯМР (400 МГц, 4:1 D2O/ДМСО-d6, δ): 8,18 (с, 1H), 8,06 (с, 1H), 7,97 (д, J=9,3 Гц, 1H), 7,85 (д, J=9,3 Гц, 1H), 7,70-7,60 (м, 2H), 7,32 (д, J=4,6 Гц, 1H), 2,87-2,77 (м, 6H).
13С ЯМР (100 МГц, 4:1 D2O/ДМСО-d6, δ): 140,4, 137,8, 137,3, 137,2, 130,1, 128,5, 127,3, 126,5, 123,9, 114,7, 110,4, 40,1, 17,4.
МСВР-ИЭС: м/з [М+Н-OMs]+ рассчитано для C12H10N2S: 215,0643. Найдено: 215,0644.
Пример 8 (согласно изобретению)
Моноарилирование енолятов кетонов

Комплексы XPhos (π-аллил)Pd(XPhos)Cl, (π-кротил)Pd(XPhos)Cl и (π-циннамил)Pd(XPhos)Cl оценивали в моноарилировании енолятов кетонов. Эти комплексы все способствовали быстрой конверсии (≥95%) через 1 час в α-арилировании ацетофенона с помощью 4-хлоранизола (см. фигуру 6). Скорость конверсии значительно ниже, когда использовали XPhos 3-го поколения в качестве предкатализатора; конверсия 34% наблюдается через 1 час, и 4 часа было необходимо для достижения высокой степени конверсии (93%). Показано, что карбазол замедляет скорость этой реакции, хотя и в меньшей степени, чем в аминировании. Кинетический профиль реакции, катализируемой (π-аллил)Pd(XPhos)Cl с 1% мольн. добавленного карбазола, почти соответствовал профилю реакции, катализируемой XPhos 3-го поколения.
Четыре примера арилирования енолятов кетонов с применением (π-аллил)Pd(XPhos)Cl подчеркивают универсальность этого катализатора:

Условия реакции: ArCl (1,0 ммоль), кетон (2,0 ммоль), KO-трет-Bu (2,0 ммоль), (π-аллил)Pd(XPhos)Cl (1% мольн.), толуол (4 мл), 60°С, 2-4 ч. [а] Используют 2% мольн. (π-аллил)Pd(XPhos)Cl.
Общая методика реакций арилирования енолятов кетонов
В высушенный в сушильной печи сосуд Шленка, снабженный магнитной мешалкой с тефлоновым покрытием, загружают (π-аллил)Pd(XPhos)Cl (1-2% мольн., как указано), арил хлорид (1,00 ммоль, если в твердом состоянии) и KO-трет-Bu (2,00-2,40 ммоль, как указано). Сосуд закрывают резиновой септой, вакуумируют и заполняют. Этот цикл вакуумирования/заполнения азотом повторяют еще два раза. Додекан (стандарт ГХ, 0,20 ммоль), кетон (1,20 ммоль), арил хлорид (1,00 ммоль, если жидкость) и безводный толуол (4 мл) добавляют последовательно с помощью шприца. Сосуд помещают в предварительно нагретую масляную баню (60°С) и перемешивают в течение указанного времени. Затем сосуд вынимают из масляной бани и дают охладиться до комнатной температуры. Насыщенный NH4Cl (4 мл) и EtOAc (10 мл) добавляют, и водную фазу экстрагируют с помощью EtOAc (3 × 10 мл). Органические экстракты объединяют, сушат над безводным MgSO4, фильтруют и концентрируют в вакууме. Остаток хроматографируют на силикагеле с использованием Teledyne ISCO CombiFlashRf.
2-(4-метоксифенил)-1-фенилэтан-1-он

В соответствии с общей методикой смесь 4-хлоранизола (123 мкл, 1,00 ммоль), ацетофенона (140 мкл, 1,20 ммоль), KO-трет-Bu (224 мг, 2,00 ммоль), (π-аллил)Pd(XPhos)Cl (6,6 мг, 0,01 ммоль) и 4 мл толуола перемешивают при 60°С в течение 2 часов. Сырой продукт хроматографируют на силикагеле с градиентом 0-4% EtOAc/гексаны в качестве элюента с получением 210 мг (0,93 ммоль, 93%) 2-(4-метоксифенил)-1-фенилэтан-1-она в виде бесцветного твердого вещества. Спектроскопические данные соответствуют тем, которые ранее сообщались (M. R. Biscoe, S. L. Buchwald, Org. Lett.2009, 11, 1773).
1-(пиридин-3-ил)-2-(хинолин-6-ил)этан-1-он

В соответствии с общей методикой смесь 6-хлорхинолина (164 мг, 1,00 ммоль), 3-ацетилпиридина (132 мкл, 1,20 ммоль), KO-трет-Bu (269 мг, 2,40 ммоль), (π-аллил)Pd(XPhos)Cl (6,6 мг, 0,01 ммоль) и 4 мл толуола перемешивают при 60°С в течение 4 часов. Сырой продукт хроматографируют на силикагеле с использованием EtOAc в качестве элюента с получением 236 мг (0,95 ммоль, 95%) 1-(пиридин-3-ил)-2-(хинолин-6-ил)этан-1-она в виде бледно-желтого твердого вещества.
1H ЯМР (400 МГц, CDCl3, δ): 9,29 (с, 1H), 8,90 (д, J=3,5 Гц, 1H), 8,88 (д, J=3,5 Гц, 1H), 8,29 (д, J=8,2 Гц, 1H), 8,17-8,02 (м, 2H), 7,72 (с, 1H), 7,65 (д, J=8,5 Гц, 1H), 7,47-7,31 (м, 2H), 4,50 (с, 2H).
13С ЯМР (100 МГц, CDCl3, δ): 196,1, 153,8, 150,6, 150,1, 147,6, 135,9, 135,8, 132,1, 131,8, 131,2, 130,1, 128,4, 128,2, 123,9, 121,5, 45,7.
МСВР-ИЭС: м/з [М+Н]+ рассчитано для C16H13N2O: 249,1028. Найдено: 249,1020.
1-(фуран-2-ил)-2-(4-(трифторметил)фенил)этан-1-он

В соответствии с общей методикой смесь 4-хлорбензотрифторида (133 мкл, 1,00 ммоль), 2-ацетилфурана (132 мкл, 1,20 ммоль), KO-трет-Bu (269 мг, 2,40 ммоль), (π-аллил)Pd(XPhos)Cl (13,2 мг, 0,02 ммоль) и 4 мл толуола перемешивают при 60°С в течение 4 часов. Сырой продукт хроматографируют на силикагеле с использованием EtOAc в качестве элюента с получением 236 мг (0,95 ммоль, 95%) 1-(фуран-2-ил)-2-(4-(трифторметил)фенил)этан-1-она в виде бледно-желтого твердого вещества. Спектроскопические данные соответствуют тем, которые ранее сообщались (T. Miura, S. Fujioka, N. Takemura, H. Iwasaki, M. Ozeki, N. Kojima, M. Yamashita, Synthesis, 2014, 46, 496).
1-(нафталин-1-ил)-2-(пиридин-3-ил)этан-1-он

В соответствии с общей методикой смесь 3-хлорпиридина (95 мкл, 1,00 ммоль), 1-ацетонафталина (182 мкл, 1,20 ммоль), KO-трет-Bu (269 мг, 2,40 ммоль), (π-аллил)Pd(XPhos)Cl (13,2 мг, 0,02 ммоль) и 4 мл толуола перемешивают при 60°С в течение 4 часов. Сырой продукт хроматографируют на силикагеле с 50% EtOAc/гексанов в качестве элюента с получением 237 мг (0,96 ммоль, 96%) 1-(нафталин-1-ил)-2-(пиридин-3-ил)этан-1-она в виде желтого масла.
1H ЯМР (400 МГц, CDCl3, δ): 8,61-8,49 (м, 3H), 8,01-7,94 (м, 2H), 7,89 (дд, J=1,6 Гц, 7,9 Гц, 1H), 7,63 (дт, J=1,8 Гц, 7,8 Гц, 1H), 7,60-7,48 (м, 3H), 7,29-7,23 (м, 1H), 4,38 (с, 2H).
13С ЯМР (100 МГц, CDCl3, δ): 200,3, 150,8, 148,5, 137,2, 135,0, 134,1, 133,4, 130,4 (2 пика), 128,6, 128,3, 128,2, 126,8, 125,8, 124,4, 123,6, 45,7.
МСВР-ИЭС: м/з [М+Н]+ рассчитано для C17H14NO: 248,1075. Найдено: 248,1075.
Пример 9 (согласно изобретению)
Трифторметилирование с применением (π-аллил)Pd(BrettPhos)Cl

В заполненном азотом перчаточном боксе в реакционную пробирку на 2 драхмы, снабженную магнитной мешалкой с тефлоновым покрытием, загружают (аллил)Pd(BrettPhos)Cl (21 6 мг, 30 мкмоль), BrettPhos (16,1 мг, 30 мкмоль) и фторид калия (58,1 мг, 1,0 ммоль). Диоксан (1,65 мл), триэтил(трифторметил)силан (188 мкл, 1,0 ммоль), и 1-н-бутил-4-хлорбензол (84,3 мкл, 0,50 ммоль) добавляют с помощью шприца. Реакционную пробирку закрывают колпачком с открытым верхом и плоской силиконовой септой PTFE, удаляют из перчаточной камеры и помещают на предварительно нагретый алюминиевый блок (120°C), и энергично перемешивают в течение 16 часов. После охлаждения до комнатной температуры флакон открывают для воздуха, и аликвоту (~200 мкл) удаляют, пропускают через слой целита, элюируют этилацетатом (2 мл) и анализируют с помощью ГХ. Бензотрифторидный продукт обнаруживают с выходом 84% согласно ГХ (некалиброванный).
Этот эксперимент показывает, что предкатализатор (π-аллил)Pd(BrettPhos)Cl удовлетворяет требованиям трифторметилирования 4-н-бутил-1-хлорбензола.
Реферат
Настоящее изобретение относится к комплексу палладия (II) формулы (1) и комплексу палладия (II) формулы (2).Значение групп R, R, R, R, R, R, R, R, R, R, R, R, R, R, R, R, R, Rи R, m, Е и Х приведено в формуле изобретения. Также предложены способ получения комплекса формулы (1) или комплекса формулы (2), способ проведения реакции сочетания углерод-углерод и реакции сочетания углерод-гетероатом с применением комплекса формулы (1) или комплекса формулы (2), применение комплекса формулы (1) или комплекса формулы (2) в качестве катализатора реакций сочетания углерод-углерод и углерод-гетероатом. Предложенные комплексы являются высокоактивными катализаторами реакций сочетания углерод-углерод и углерод-гетероатом. 7 н. и 22 з.п. ф-лы, 6 ил., 9 пр.
Формула

















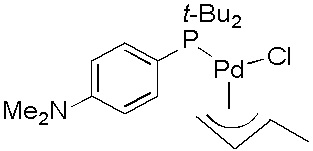

Комментарии