Способ получения диенов гидродимеризацией - RU2421440C2
Код документа: RU2421440C2
Описание
Настоящее изобретение относится к способу получения замещенных или незамещенных 1,7-диолефинов гидродимеризацией нециклических олефинов, по меньшей мере, с двумя сопряженными двойными связями в присутствии восстановителя и карбенового комплекса металла.
1,7-Октадиен используют в качестве сомономера или для последующего сшивания полиолефинов в производстве полимеров. Кроме того, замещенные или незамещенные 1,7-диолефины являются ценными исходными веществами для производства α,ω-диолов, соответственно α,ω-диаминов, или себациновой кислоты, которые, в свою очередь, представляют интерес для получения сложных полиэфиров, соответственно полиамидов, или алкидных смол. Кроме того, 1,7-октадиен служит эдуктом для получения 1-октена, используемого в качестве сомономера при синтезе полимеров.
Получению 1,7-октадиена гидродимеризацией 1,3-бутадиена посвящены многочисленные публикации.
Гарднер и другие (Tetrahedron Lett., 2 (1972), 163-164) описывают взаимодействие 1,3-бутадиена с муравьиной кислотой в присутствии различных катализаторов, например, таких как диацетопалладий (II) (Pd(OAc)2), Li2PtCl4 или комплексы палладия с фосфиновыми лигандами, сопровождаемое образованием 1,6-октадиена. Авторы этой публикации отмечают, что в результате взаимодействия 1,3-бутадиена с муравьиной кислотой, осуществляемого в диметилформамиде в присутствии катализатора на основе Li2PtCl4, образуется до 80% 1,7-октадиена.
Взаимодействие 1,3-бутадиена с муравьиной кислотой рассматривают также Роффиа и другие (J. Organomet. Chem., 55 (1973) 405-407). В качестве исходного продукта для получения катализатора используют (PPh3)PdCl2, который восстанавливают в соответствующих реакционных условиях. В качестве продукта реакции получают смесь 1,3,7-октатриена, 1,7-октадиена и 1,6-октадиена.
Pittmann и другие (J. Mol. Catal., 15 (1982) 377-381) сообщают об использовании катализаторов на основе палладия с фосфиновыми лигандами для получения 1,7-октадиена. При этом в случае триэтилфосфиновых лигандов максимальная селективность образования 1,7-октадиена достигает 93%.
В европейских заявках на патент EP 0004408 B1 и EP 0004410 В1 описан способ получения 1,7-октадиена из 1,3-бутадиена в присутствии палладийфосфинового катализатора. В европейском патенте EP 0004410 предложено также использовать в качестве сокатализатора палладий, платину или родий на инертном носителе.
Кроме того, в европейской заявке на патент EP 0007666 B1 предложен способ получения 1,7-октадиена из 1,3-бутадиена в присутствии палладийфосфинового катализатора, отличительной особенностью которого является использование в качестве восстановителей формиатов.
Из европейских патентов EP 0012472 и EP 0012475 известен способ получения 1,7-октадиена из 1,3-бутадиена и муравьиной кислоты, соответственно формиатов, в присутствии палладиевого катализатора и третичных фосфорорганических соединений, например, таких как органофосфониты, соответственно органофосфиниты или их смеси.
В европейской заявке на патент EP 0008139 B1 предложен способ получения 1,7-октадиена из 1,3-бутадиена в присутствии палладиевого катализатора, третичных фосфинов и растворителя, выбранного из группы, включающей диалкилсульфоксиды, соответственно диалкилформамиды, которые реализуют в отсутствие основания.
В немецких заявках на патент DE 3024877 A1 и DE 3024878 A1 описан способ гидродимеризации 1,3-бутадиена до 1,7-октадиена с использованием палладийфосфинового катализатора, в соответствии с которым в качестве восстановителя используют водород или смесь водорода с диоксидом углерода.
Из немецкой заявки на патент DE 3024879 A1 известен способ гидроди-меризации 1,3-бутадиена до 1,7-октадиена, предусматривающий использование палладийфосфинового катализатора и восстановителя, а также кислородсодержащего азотного гетероцикла в качестве растворителя. Содержащий катализатор кубовый остаток после осуществляемого дистилляцией выделения 1,7-октадиена возвращают на стадию гидродимеризации.
Из немецкой заявки на патент DE 3034098 A1 известен способ получения алкадиенов гидродимеризацией 1,3-бутадиена или изопрена в присутствии палладиевого или платинового катализатора в растворе сульфолана, причем реакционная смесь содержит третичные алкиламиноформиаты и фосфиновые соединения. Выделяемый после гидродимеризации катализатор в данном случае также возвращают на гидродимеризацию.
В японской заявке на патент JP 09-087207 A описана димеризация алкадиенов, например, таких как 1,3-бутадиен, в присутствии восстановителя и палладийфосфинитного катализатора. Выход октадиена достигает 94,7%, причем степень чистоты 1,7-октадиена составляет 97,1%.
В европейской заявке на патент ЕР 0704417 A2 предложен способ получения октадиенов из 1,3-бутадиена и муравьиной кислоты в присутствии палладиевого катализатора с фосфорсодержащими лигандами, причем давление в системе не превышает давления паров бутадиена. Количественное отношение 1,7-октадиена к 1,6-октадиену в реакционном продукте составляет 89:11.
Из немецкой заявки на патент DE 10149347 A1 известен двустадийный способ получения 1-октена. На первой стадии 1,3-бутадиен в присутствии катализатора теломеризации и восстановителя превращают в 1,7-октадиен, который на второй стадии подвергают частичному гидрированию, получая 1-октен. В качестве пригодного катализатора теломеризации приводятся многочисленные соединения никеля, родия, палладия и платины, включая, в частности, также соединения Pd(0) с карбеновыми лигандами. Пригодными карбеновыми лигандами являются 1,3-дизамещенные 2,3-дигидро-1H-имидазол-2-илидены, 1,3-дизамещенные 4,5-дигидро-1H-триазол-5-илидены и при необходимости 2,3-дигидротиазол-2-илидены.
В международных заявках WO 2005/047217 и WO 2005/047218 опубликован способ двустадийного получения 1-октена. На первой стадии способа 1,3-бутадиен превращают в 1,7-октадиен в апротонном полярном растворителе в присутствии комплекса палладия, содержащего одно или более тризамещенное монодентатное фосфорное соединение, и донора водорода.
Из немецкой заявки на патент DE 10128144 A1 известен способ теломеризации нециклических олефинов, по меньшей мере, с двумя сопряженными двойными связями с нуклеофилами, причем в качестве катализатора используют карбеновый комплекс палладия.
Под теломеризацией подразумевают осуществляемое в присутствии нуклеофилов превращение олефинов с сопряженными двойными связями. Продуктами подобного превращения являются соединения, состоящие из двух эквивалентов диена и одного эквивалента нуклеофила, причем, как показано на схеме реакции 1, продукт теломеризации является смесью нескольких соединений.

Основными продуктами теломеризации являются замещенные в положении 1 2,7-октадиены, причем в качестве побочных продуктов образуются замещенные в положении 3 1,7-октадиены. В случае использования катализаторов теломеризации, модифицированных карбеновыми лигандами, соотношение между основным и побочным продуктами может достигать 98:2 (Chem. Eur. J., 10 (2004) 3891-3900).
В отличие от этого взаимодействие двух эквивалентов олефина с сопряженными двойными связями в присутствии восстановителя протекает при гидродимеризации в соответствии со схемой реакции 2.

Используемый для гидродимеризации восстановитель является источником водорода, причем в случае использования для этой цели муравьиной кислоты в качестве побочного продукта образуется диоксид углерода. Основным продуктом гидродимеризации 1,3-бутадиена является 1,7-октадиен.
Способ гидродимеризации 1,3-бутадиена до 1,7-октадиена в присутствии модифицированных фосфором палладиевых катализаторов характеризуется низкой продуктивностью (TON), активностью (TOF) и/или селективностью, которые определяются следующими соотношениями:
TON=n(продукт)/n(катализатор) соотв.
TOF=n(продукт)/[n(катализатор)·время].
Селективность=n(продукт)/[n(продукт)+n(побочные продукты)].
Соединения трехвалентного фосфора в общем случае характеризуются повышенной чувствительностью к кислороду и легко окисляются до соответствующих производных пятивалентного фосфора, что приводит к деактивации катализатора. Рециркуляция указанных выше модифицированных фосфором палладиевых катализаторов в связи с их повышенной чувствительностью затруднительна и технически возможна лишь при условии значительной потери активности. В условиях выполнения гидродимеризации фосфиновые комплексы палладия(II) восстанавливаются, образуя термически нестабильные промежуточные соединения. Благодаря модифицированию комплексов палладия триалкилфосфинами образуются активные катализаторы, которые обеспечивают селективное образование 1,7-октадиена. Однако триалкилфосфины являются пирофорами, которые дороги и малопригодны для использования в промышленном масштабе. В случае использования триарилфосфинов, отличающихся от триалкилфосфинов возможностью более удобного обращения, достигают гораздо более низкой селективности гидродимеризации. В соответствии со способами уровня техники подобные фосфиновые соединения используют для гидродимеризации в избытке. Использование фосфонитов и фосфинитов для осуществления гидродимеризации на промышленных установках также требует соблюдения мер предосторожности, поскольку эти соединения чувствительны к гидролизу и воздействию кислот. Использование для гидродимеризации муравьиной кислоты или ее производных негативно влияет на стабильность модифицированных фосфонитами или фосфинитами катализаторов.
Исходя из вышеизложенного в основу настоящего изобретения была положена задача предложить способ получения замещенных или незамещенных 1,7-диолефинов гидродимеризацией с использованием катализатора, который наряду с возможностью упрощенного обращения с катализатором отличается высокой продуктивностью. Подобный катализатор, прежде всего, должен обеспечивать высокую селективность образования замещенного или незамещенного 1,7-октадиена.
Неожиданно было обнаружено, что замещенные или незамещенные 1,7-диолефины можно получать гидродимеризацией нециклических олефинов по меньшей мере с двумя сопряженными двойными связями в присутствии восстановителя и катализатора новым способом, отличающимся тем, что в качестве катализатора используют карбеновый комплекс металла, который содержит металл от 8-й до 10-й групп периодической системы элементов и по меньшей мере один карбеновый лиганд. В отличие от соответствующих способов уровня техники предлагаемый в изобретении способ характеризуется более высокими показателями селективности и продуктивности. В соответствии с предлагаемым в изобретении способом при гидродимеризации 1,3-бутадиена с использованием муравьиной кислоты может быть реализована продуктивность катализатора, составляющая, например, более 10000. Прежде всего установлено, что при использовании стабилизаторов нециклических олефинов, выбранных из группы, включающей алкилированные фенолы и стабильные N-оксильные радикалы, требуются меньшие количества катализатора по сравнению с используемым согласно уровню техники в качестве стабилизатора 4-трет-бутилкатехола. Кроме того, варианты осуществления предлагаемого в изобретении способа характеризуются образованием меньших количеств побочных продуктов. Таким образом, предлагаемый в изобретении способ в отличие от соответствующих способов уровня техники обладает более высокой технологической надежностью и высокой продуктивностью катализатора.
Таким образом, объектом настоящего изобретения является способ получения замещенных или незамещенных 1,7-диолефинов гидродимеризацией нециклических олефинов по меньшей мере с двумя сопряженными двойными связями в присутствии восстановителя и катализатора, отличающийся тем, что в качестве катализатора используют карбеновый комплекс металла, который содержит металл от 8-й до 10-й групп периодической системы элементов и по меньшей мере один карбеновый лиганд формулы (1), (2), (3) или (4)
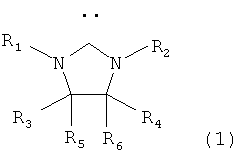



в которой R1, R2 означают -(CH2)n-B,
B означает моноциклическую или полициклическую арильную группу с 6-14 атомами углерода или моноциклический или полициклический гетероцикл с 5-14 атомами углерода и гетероатомами, который содержит от 1 до 3 гетероатомов, выбранных из группы, включающей азот, кислород и серу,
n означает число от 0 до 4,
R3, R4, R5 и R6 означают водород, алкил, гетероарил, арил, -CN, -COOH, -COO-алкил, -COO-арил, -OCO-алкил, -OCO-арил, -OCOO-алкил, -OCOO-арил, -CHO, -CO-алкил, -CO-арил, -NH2, -NH(алкил), -N(алкил)2, -NH(арил), -N(алкил)2, фтор, хлор, бром, йод, -OH, -CF3, -NO2, -ферроценил, -SO3H, -РО3Н2, причем алкил означает алкильную группу с 1-12 атомами углерода, арил означает арильную группу с 5-14 атомами углерода, и заместители R3 и R4 могут быть также частью связанного мостиком алифатического или ароматического кольца, причем заместители R1 и R2 могут быть одинаковыми или разными, замещенными или незамещенными, и заместители R3, R4, R5 и R6 также могут быть одинаковыми или разными, замещенными или незамещенными.
Предлагаемый в изобретении способ получения замещенных или незамещенных 1,7-диолефинов гидродимеризацией нециклических олефинов по меньшей мере с двумя сопряженными двойными связями в присутствии восстановителя и катализатора отличается тем, что в качестве катализатора используют карбеновый комплекс металла, который содержит металл от 8-й до 10-й групп периодической системы элементов и по меньшей мере один карбеновый лиганд формулы (1), (2), (3) или (4)




в которой R1, R2 означают -(CH2)n-B,
B означает моноциклическую или полициклическую арильную группу с 6-14 атомами углерода или моноциклический или полициклический гетероцикл с 5-14 атомами углерода и гетероатомами, который содержит от 1 до 3 гетероатомов, выбранных из группы, включающей азот, кислород и серу, однако предпочтительно означает моноциклическую арильную группу с шестью атомами углерода,
n означает число от 0 до 4, предпочтительно от 0 до 1, особенно предпочтительно 0,
R3, R4, R5 и R6 означают водород, алкил, гетероарил, арил, -CN, -COOH, -COO-алкил, -COO-арил, -OCO-алкил, -OCO-арил, -OCOO-алкил, -OCOO-арил, -CHO, -CO-алкил, -CO-арил, -NH2, -NH(алкил), -N(алкил)2, -NH(арил), -N(алкил)2, фтор, хлор, бром, йод, -OH, -CF3, -NO2, -ферроценил, -SO3H, -РО3Н2, причем алкил означает алкильную группу с 1-12 атомами углерода, арил означает арильную группу с 5-14 атомами углерода и заместители R3 и R4 могут быть также частью связанного мостиком алифатического или ароматического кольца,
причем заместители R1 и R2 могут быть одинаковыми или разными, замещенными или незамещенными и заместители R3, R4, R5 и R6 также могут быть одинаковыми или разными, замещенными или незамещенными.
В соответствии с настоящим изобретением под замещенными или незамещенными 1,7-диолефинами подразумевают соединения формулы (9)

в которой заместители R7-R12 независимо друг от друга означают водород, алкил, прежде всего алкил с 1-4 атомами углерода, предпочтительно алкил с одним атомом углерода, или галоген, прежде всего хлор.
В особенно предпочтительном варианте осуществления предлагаемого в изобретении способа карбеновые комплексы металлов содержат карбеновые лиганды с заместителями R1, R2, R3, R4, R5 или R6, по меньшей мере один из которых выбран из группы, включающей водород, -CN, -СООН, -СОО-алкил, -СОО-арил, -ОСО-алкил,
-ОСО-арил, -ОСОО-алкил, -ОСОО-арил, -СНО, -СО-алкил, -СО-арил, -NH2, -NH(алкил), -N(алкил)2, -NH(арил), -N(арил)2, фтор, хлор, бром, йод, -ОН, -CF3, -NO2,
-ферроценил, -SO3H и -РО3Н2, причем алкил означает алкильную группу с 1-12 атомами углерода и арил означает арильную группу с 5-14 атомами углерода.
В соответствии с предлагаемым в изобретении способом предпочтительно используют карбеновые комплексы металлов, в которых металл выбран из группы, включающей никель, родий, палладий и/или платину. Однако особенно предпочтительно используют карбеновые комплексы металлов, которые содержат в качестве металла палладий.
В соответствии с настоящим изобретением под карбеновыми лигандами подразумевают как свободные карбены, способные выполнять функцию лигандов, так и карбены, координированные металлом. В соответствии с предлагаемым в изобретении способом предпочтительно используют карбеновые комплексы металлов, которые содержат по меньшей мере один карбеновый лиганд, выбранный из группы, включающей структуры формул (1)-(4), в которых заместители R3-R6 означают водород. Используемые карбеновые комплексы металлов предпочтительно содержат по меньшей мере один карбеновый лиганд формулы (2), в которой заместители R3 и R4 означают водород. Особенно предпочтительно используют карбеновые комплексы металлов, которые содержат по меньшей мере один карбеновый лиганд формулы (2) с заместителями R3 и R4, означающими водород, и заместителями R1 и R2, в которых n означает 0 и B означает фенильную или 2,4,6-триметилфенильную группу.
Примеры карбеновых лигандов общей формулы (1) или (2) и содержащих подобные лиганды комплексов приводятся в специальной литературе (W.A.Herrmann, С.Köcher, Angew. Chem., 1997, 109, 2257; Angew. Chem. Int. Ed. Engl., 1997, 36, 2162; V.P.W. Böhm, C.W.K.Gstöttmayr, T.Weskamp, W.A.Herrmann, J.Organomet. Chem. 2000, 595, 186; немецкий патент DE 4447066).
Присутствующий в катализаторе металл, под которым предпочтительно подразумевают палладий и который в реакционных условиях образует активные катализаторы, можно различным образом вводить в предлагаемый в изобретении способ:
a) в виде карбенового комплекса палладия, в котором палладий предпочтительно обладает степенью окисления (II) или (0).
b) в виде исходных соединений, катализаторы из которых образуются in situ. Подобный вариант может быть реализован исходя из солей или комплексов металлов путем расширения лигандной сферы или раскрытия мостиковых структур. Другая возможность состоит в замене лигандов, координируемых центральным атомом металла, карбеновыми лигандами. При этом предпочтительно используют соединения палладия(0) и/или палладия(II), особенно предпочтительныо ацетат палладия(II), ацетилацетонат палладия(II) и/или бис(дибензилиденацетон)палладий(0). Карбеновые лиганды формул (1)-(4) используют в виде свободных карбенов или комплексов металлов или получают in situ из исходных соединений для синтеза карбенов. В качестве подобных исходных соединений пригодны, например, соли карбенов формул (5)-(8)




в которых заместители R1-R6 аналогичны указанными выше заместителям в формулах (1)-(4) и Y означает однозарядную анионную группу или многозарядную анионную группу, распределенную соответственно стехиометрическим долям.
Примерами Y являются галогениды, гидросульфат, сульфат, алкилсульфаты, арилсульфаты, бораты, гидрокарбонат, карбонат, алкилкарбоксилаты, арилкарбоксилаты. Карбены могут быть выделены из соответствующих солей карбенов, например, благодаря взаимодействию последних с основанием. Пригодными основаниями являются, например, гидриды металлов, алкоголяты металлов, карбонилметаллаты, карбоксилаты металлов, амиды металлов или гидроксиды металлов.
Количество сильно зависит от типа используемого основания. В случае карбеновых комплексов металлов предпочтительно используют от 0 до 50000, предпочтительно от 0,5 до 5000, особенно предпочтительно от 0,5 до 500 молей основания на моль металла. Можно использовать также смесь нескольких оснований.
В соответствии с предлагаемым в изобретении способом концентрация катализатора, формально указываемая в частях на миллион (по массе) металла в пересчете на общую массу реакционной смеси, в начальный период гидродимеризации преимущественно составляет от 0,01 до 5000 частей на миллион, предпочтительно от 0,1 до 1000 частей на миллион, особенно предпочтительно от 0,1 до 500 частей на миллион и еще более предпочтительно от 1 до 100 частей на миллион. В особенно предпочтительном варианте осуществления предлагаемого в изобретении способа указанная концентрация может составлять от 1 до 50 частей на миллион. Мольное отношение карбенового лиганда к металлу преимущественно составляет от 0,01:1 до 250:1, предпочтительно от 0,1:1 до 100:1, особенно предпочтительно от 1:1 до 20:1.
Карбеновый лиганд можно вводить в реакцию в субстанции, в растворенном состоянии или в виде комплексов металлов. Дополнительный лиганд можно вводить в реакцию в любой момент времени и в любом месте реактора в субстанции, в виде раствора или в виде комплекса металла. Подобный дополнительный лиганд также может являться карбеном или исходным соединением для получения карбена или может относиться к другому классу лигандов, например, такому как фосфорсодержащие лиганды, особенно трифенилфосфин. В соответствии с предлагаемым в изобретении способом предпочтительно используют катализаторы, не содержащие фосфорсодержащих лигандов, особенно предпочтительны катализаторы, содержащие только карбеновые лиганды, и особенно предпочтительны катализаторы, содержащие карбеновые лиганды только формул (1), (2), (3) или (4).
По завершении процесса гидродимеризации катализатор может быть выделен и возвращен в реакцию для повторного использования. Катализатор может быть выделен, например, дистилляцией, экстракцией, осаждением или адсорбцией. В случае, если весь катализатор или его часть находятся во второй фазе, его можно выделить простым расслоением фаз.
Поскольку катализатор обладает высокой активностью и стабильностью, для осуществления предлагаемого в изобретении способа можно использовать чрезвычайно незначительные количества катализатора. В связи с низкими концентрациями катализатора в реакционной смеси его при необходимости можно не возвращать на стадию гидродимеризации.
При использовании карбенового комплекса металла со степенью окисления более 0 перед гидродимеризацией при необходимости может быть выполнено восстановление подобного комплекса. Используемый для этого восстановитель может быть идентичен восстановителю, используемому для гидродимеризации. Восстановителями могут являться, например, муравьиная кислота, формиаты, водород, борогидриды щелочных металлов, алюминийгидриды щелочных металлов или бораны.
В соответствии с предлагаемым в изобретении способом предпочтительно используют нециклические олефины по меньшей мере с двумя сопряженными двойными связями, выбранные из группы, включающей 1,3-бутадиен, изопрен, 1,3-пентадиен, хлоропрен и соответствующие смеси нециклических олефинов по меньшей мере с двумя сопряженными двойными связями, например, образующиеся при крекинге. В соответствии с предлагаемым в изобретении способом предпочтительно используют 1,3-бутадиен.
Нециклические олефины по меньшей мере с двумя сопряженными двойными связями можно использовать в стабилизированном или нестабилизированном состоянии. В качестве стабилизаторов пригодны действующие предпочтительно по радикальному механизму ингибиторы, например, такие как алкилированные фенолы, алкилированные катехины или стабильные N-оксильные радикалы. В соответствии с предлагаемым в изобретении способом, в особенности, используют нециклические олефины, которые не содержат стабилизатора или содержат стабилизатор, выбранный из группы, включающей алкилированные фенолы и стабильные N-оксильные радикалы. В соответствии с предлагаемым в изобретении способом предпочтительно используют нециклические олефины, которые в качестве стабилизатора содержат алкилированные фенолы или стабильные N-оксильные радикалы. Особенно предпочтительными стабилизаторами являются стабильные N-оксильные радикалы, например, такие как 2,2,6,6,-тетраметилпиперидин-N-оксилы, замещенные или незамещенные в положении 4, прежде всего 4-гидрокси-2,2,6,6-тетраметилпиперидин-N-оксил или 2,2,6,6-тетраметилпиперидин-N-оксил. Кроме того, в соответствии с предлагаемым в изобретении способом стабилизатор можно добавлять к реакционной смеси независимо от нециклических олефинов.
В соответствии с предлагаемым в изобретении способом в качестве восстановителя можно использовать муравьиную кислоту, формиаты и/или водород, причем предпочтительным восстановителем является муравьиная кислота. Примерами пригодных формиатов являются формиат аммония, органические соли, например, такие как формиат триэтиламмония, формиат триметиламмония и формиат трипропиламмония, и соли щелочных или щелочноземельных металлов, прежде всего формиат лития, формиат натрия, формиат калия, формиат магния и формиат кальция.
Формиаты можно вводить в реакцию в субстанции, а также в растворенном состоянии или получать in situ. Так, например, формиаты щелочных металлов могут быть получены благодаря взаимодействию муравьиной кислоты с гидроксидами металлов, а также из гидроксидов металлов и монооксида углерода. В качестве источника монооксида углерода можно использовать содержащие монооксид углерода газы, например синтез-газ (смесь водорода с монооксидом углерода).
Для образования одного моля 1,7-октадиена из двух молей бутадиена в соответствии со стехиометрией необходим один моль муравьиной кислоты или формиата. В зависимости от условий выполнения гидродимеризации все количество и при необходимости избыток восстановителя можно полностью вводить в реакционную систему на начальной стадии. В другом варианте восстановитель можно дозировать по мере протекания реакции. При использовании в соответствии с предлагаемым в изобретении способом муравьиной кислоты в качестве восстановителя ее следует дозировать по мере протекания гидродимеризации. Единовременная загрузка всего количества муравьиной кислоты может привести к деактивированию катализатора.
При использовании в качестве восстановителя водорода его парциальное давление преимущественно составляет от 1 до 300 бар, предпочтительно от 1 до 64 бар. Водород предпочтительно используют в чистом виде или в смеси с другими газами, например диоксидом углерода или азотом.
Возможно последовательное использование нескольких восстановителей, например муравьиной кислоты и водорода.
В соответствии с предлагаемым в изобретении способом мольное отношение используемого нециклического олефина по меньшей мере с двумя сопряженными двойными связями к восстановителю преимущественно составляет от 1:1 до 10:1, предпочтительно от 2:1 до 4:1 и особенно предпочтительно от 2:1 до 3:1.
В соответствии с предлагаемым в изобретении способом предпочтительно используют растворители, которые в реакционных условиях являются инертными или обладают преимущественно инертными свойствами. Пригодными растворителями являются, в частности, алифатические, циклоалифатические и ароматическое углеводороды, амины, например, такие как пиридин и 2,6-лутидин, амиды, например, такие как N-метилпирролидон, ацетамид, N,N-диметилформамид и N,N-диметилацетамид, нитрилы, например, такие как ацетонитрил и бензонитрил, кетоны, например, такие как ацетон и метилэтилкетон, сложные эфиры карбоновых кислот, например, такие как этилацетат, простые эфиры, например, такие как метил-трет-бутиловый эфир, тетрагидрофуран, диоксан, анизол, алкиловые или ариловые эфиры этиленгликоля, диэтиленгликоля и полиэтиленгликоля, а также другие полярные растворители, например, такие как диметилсульфоксид, 1,3-диметил-2-имидазолидинон, 1,3-диметил-3,4,5,6-тетрагидро-2(1H)-пиримидинон, сульфолан, пропиленкарбонат или тетрагидротиофеноксид. В качестве растворителей можно использовать также ионные жидкости, например соли имидазола или пиридина. Растворители можно использовать по отдельности или в виде смесей разных растворителей. В соответствии с предлагаемым в изобретении способом предпочтительно используют растворители, относительная диэлектрическая постоянная которых находится в интервале от 30 до 100 (при температуре 20°C), прежде всего растворители, выбранные из группы, включающей N-метилпирролидон, N,N-диметилформамид, диметилсульфоксид и диметилацетамид.
Нередко предпочтительным оказывается осуществление гидродимеризации в присутствии оснований. Примерами пригодных оснований являются гидроксиды металлов, прежде всего гидроксиды щелочных или щелочноземельных металлов, карбонаты и гидрокарбонаты металлов, прежде всего карбонаты и гидрокарбонаты щелочных или щелочноземельных металлов, гидроксиды ионов четвертичного аммония или фосфония, алкоголяты, еноляты, феноляты, соли металлов и карбоновых кислот, амиды металлов, например, такие как амид натрия или диэтиламид лития, а также органические азотсодержащие основания, прежде всего амины, например, такие как триэтиламин, триоктиламин или пиридин. В качестве основания можно использовать также диоксид углерода. В качестве оснований в соответствии с предлагаемым в изобретении способом предпочтительно используют гидроксиды щелочных металлов, алкоголяты щелочных металлов или третичные амины.
Количество основания, которое можно использовать для гидродимеризации, в значительной степени зависит от его типа. В соответствии с предлагаемым в изобретении способом преимущественно используют от 0 до 100 мол.%, предпочтительно от 0 до 50 мол.%, особенно предпочтительно от 0 до 20 мол.% и наиболее предпочтительно от 0 до 10 мол.% основного компонента в пересчете на используемый олефин. В соответствии с предлагаемым в изобретении способом можно использовать также смесь нескольких оснований.
Для осуществления предлагаемого в изобретении способа благоприятным обстоятельством является отсутствие в реакционной смеси кислотных компонентов, поскольку они способствуют обусловленному изомеризацией интенсивному образованию побочных продуктов. Указанное условие может быть обеспечено благодаря использованию нейтральных восстановителей, например, таких как водород или формиаты.
При использовании в качестве восстановителя чистой муравьиной кислоты в реакционную систему можно добавлять эквимолярное количество основания, например, такого как триэтиламин. Предпочтительным является предлагаемый в изобретении способ, в соответствии с которым используемая в качестве восстановителя муравьиная кислота полностью превращается в отсутствие основания или при использовании последнего в количестве, меньшем по сравнению со стехиометрическим (то есть при отношении основания к муравьиной кислоте от 0:1 до 1:1). Особенно предпочтительным является такой вариант осуществления изобретения, в соответствии с которым дозирование муравьиной кислоты осуществляют при реакционной температуре, что, в связи с высокой скоростью реакции, обусловливает самопроизвольное превращение муравьиной кислоты и отсутствие возможности ее накапливания в реакционной смеси. В подобном случае резко сокращается количество необходимого основания или его использование может быть полностью исключено.
В соответствии с предлагаемым в изобретении способом гидродимеризацию предпочтительно выполняют под давлением от 1 до 100 бар, предпочтительно от 6 до 25 бар.
В соответствии с предлагаемым в изобретении способом температура гидродимеризации преимущественно составляет от 20 до 160°C, предпочтительно от 60 до 120°C и особенно предпочтительно от 70 до 100°C.
Предлагаемый в изобретении способ можно осуществлять в непрерывном или периодическом режиме и не ограничиваться использованием реактора только одного определенного типа. Примерами пригодных для осуществления гидродимеризации реакторов являются котлы с мешалками, каскады из котлов с мешалками, проточные трубчатые реакторы, а также реакторы с внутренним контуром циркуляции. Кроме того, можно использовать комбинации различных реакторов, например котел с мешалкой, к которому присоединен проточный трубчатый реактор.
Образующееся при гидродимеризации реакционное тепло отводят известными методами, например, посредством внутренних или внешних холодильников. Речь при этом может идти об использовании кожухотрубных реакторов и реакторов с охлаждающими пальцами, змеевиками или пластинами, а также об охлаждении рециркулируемого потока (в реакторах с циркуляцией или рециклом).
Полного превращения нециклического олефина по реакции гидродимеризации в соответствии с предлагаемым в изобретении способом не требуется. Таким образом, степень превращения нециклического олефина предпочтительно составляет от 40 до 100%, особенно предпочтительно от 60 до 99%, еще более предпочтительно от 85 до 98%. Полное превращение нециклического олефина в соответствии с предлагаемым в изобретении способом может сопровождаться интенсивным образованием побочных продуктов, обусловленным отсутствием полноты превращения восстановителя. В случае использования муравьиной кислоты в качестве восстановителя одновременно могут протекать реакции изомеризации. При использовании в качестве восстановителя водорода полное превращение нециклического олефина может сопровождаться его гидрированием.
Гидродимеризацию предлагаемым в изобретении способом предпочтительно осуществляют в отсутствие кислорода, который способствует полимеризации нециклических олефинов по меньшей мере с двумя сопряженными двойными связями и, соответственно, снижению выхода замещенных или незамещенных 1,7-диолефинов.
Используемые в предлагаемом в изобретении способе эдукты могут быть одновременно загружены в реактор, после чего устанавливают соответствующие реакционные условия. В особенно предпочтительном варианте осуществления предлагаемого в изобретении способа сначала in situ получают катализатор, после чего вводят стабилизатор и нециклический олефин и устанавливают надлежащие реакционные условия. В соответствии с предлагаемым в изобретении способом восстановитель, прежде всего, рекомендуется дозировать по мере протекания реакции, а не загружать вначале, что в первую очередь относится к использованию в качестве восстановителя муравьиной кислоты. Даже слишком быстрое дозирование используемой в качестве восстановителя муравьиной кислоты может обусловить низкие выходы 1,7-диолефинов.
Приведенные ниже примеры служат для более подробного пояснения предлагаемого в изобретении способа и не ограничивают его объема.
Пример 1. Получение карбенового лиганда бис(2,4,6-триметилфенил)имидазол-o-крезолят-o-крезола
Описанным в Organometallics, 1999, 18, 529-533, способом получают 1,3-бис(2,4,6-триметилфенил)имидазолхлорид. Полученный 1,3-бис(2,4,6-триметилфенил)имидазолхлорид преобразуют в соответствующий крезолят следующим образом: 2,35 г гидроксида натрия растворяют в 45 г воды и полученный раствор добавляют к 12,7 г расплавленного o-крезола. Образуется молочно-серая жидкость. Этот раствор медленно при перемешивании добавляют к раствору 20 г 1,3-бис(2,4,6-триметилфенил)имидазолхлорида в 45 г воды. Выпадает светло-серый осадок, который выделяют на стеклянном фильтре G4. Осадок промывают небольшим количеством воды и метил-трет-бутилового эфира. После сушки получают 18,9 г бис(2,4,6-триметилфенил)имидазол-o-крезолят-o-крезола, что соответствует его выходу 91%.
Пример 2 (100 частей на миллион палладия, 1,3-бутадиен, стабилизированный 4-трет-бутилкатехолом)
0,112 г ацетата палладия (47,5% Pd, фирма Acros), 0,312 г 1,3-бис(2,4,6-триметилфенил)имидазол-o-крезолят-o-крезола и 0,108 г метанолята натрия (чистота >97%, фирма Merck) в атмосфере инертного газа растворяют в 200 г свежеперегнанного N-метилпирролидона (чистота ≥99,5%, фирма Merck) и в течение 1 ч перемешивают при 50°С. Полученную смесь засасывают в эвакуированный автоклав объемом 2 л фирмы Büchi, в который затем при -5°C переконденсируют 240 г 1,3-бутадиена (стабилизированный посредством около 100 частей на миллион 4-трет-бутилкатехола 1,3-бутадиен 2.6 фирмы Oxeno Olefinchemie GmbH). Количество бутадиена измеряют взвешиванием газового баллона. Затем автоклав заполняют аргоном под давлением 11 бар и нагревают до 75°C. В течение 30 мин дозируют 101 г муравьиной кислоты (чистота 98-100%, фирма Riedel-de Haen).
Давление в автоклаве посредством клапана поддерживают на уровне 20 бар. Объем отходящего газа составляет 31,7 л. Время дополнительной реакции составляет 15 минут. После охлаждения и декомпрессии автоклава смесь продуктов реакции анализируют газовой хроматографией (ГХ). После одноступенчатой дистилляции при 50 мбар и максимальной температуре в кубе 80°C вновь выполняют анализ методом ГХ. Результаты соответствующего анализа приведены в таблице 1 в виде выраженных в процентах площадей хроматографических пиков.

В качестве дистиллята получают 215,7 г октадиенов, выход которых после выделения составляет 89,3%. Степень чистоты в пересчете на 1,7-октадиен составляет 97,4%. Муравьиная кислота превращается полностью.
Пример 3 (50 частей на миллион палладия, 1,3-бутадиен, стабилизированный 4-трет-бутилкатехолом)
0,056 г ацетата палладия, 0,26 г 1,3-бис(2,4,6-триметилфенил)имидазол-о-крезолят-о-крезола и 0,108 г метанолята натрия в атмосфере инертного газа растворяют в 200 г свежеперегнанного N-метилпирролидона и в течение 1 ч перемешивают при 50°C. Полученную смесь засасывают в эвакуированный автоклав объемом 2 л фирмы Büchi, в который затем при -5°C переконденсируют 240 г 1,3-бутадиена (стабилизированного посредством около 100 частей на миллион 4-трет-бутилкатехола). Количество бутадиена измеряют взвешиванием газового баллона. Затем автоклав заполняют аргоном под давлением 14 бар и нагревают до 75°C. В течение 30 мин дозируют 93 г муравьиной кислоты. Давление в автоклаве посредством клапана поддерживают на уровне 20 бар. Объем отходящего газа составляет менее 1 л. Время дополнительной реакции составляет 30 мин. После охлаждения и декомпрессии автоклава смесь продуктов реакции анализируют с помощью ГХ. Результаты соответствующего анализа приведены в таблице 2 в виде выраженных в процентах площадей хромато-графических пиков.

Получают 318,4 г сырой смеси продуктов. Титриметрически определенное остаточное количество муравьиной кислоты составляет 82,4 г, то есть степень ее превращения не превышает 11% в пересчете на исходную муравьиную кислоту.
Пример 4 (не в соответствии с изобретением)
0,112 г ацетата палладия, 0,134 г 1,3-диметилимидазолйодида (полученного в соответствии с примером 1 А из международной заявки WO 97/34875) и 0,108 г метанолята натрия в атмосфере инертного газа растворяют в 200 г свежеперегнанного N-метилпирролидона и перемешивают в течение 1 ч при 50°C. Полученную смесь засасывают в эвакуированный автоклав объемом 2 л фирмы Büchi, в который затем при -5°C переконденсируют 240 г 1,3-бутадиена (стабилизированного посредством около 100 частей на миллион 4-трет-бутилкатехола). Количество бутадиена измеряют взвешиванием газового баллона. Затем автоклав заполняют аргоном под давлением 14 бар и нагревают до 75°C. В течение 64 мин дозируют 101 г муравьиной кислоты. Давление в автоклаве посредством клапана поддерживают на уровне 20 бар. Выделение отходящего газа отсутствует. После охлаждения и декомпрессии автоклава смесь продуктов реакции анализируют с помощью ГХ. Результаты анализа приведены в таблице 3.

1,7-Октадиен в сырой смеси продуктов реакции отсутствует.
Пример 5 (не в соответствии с изобретением)
0,112 г ацетата палладия, 0,109 г 1,3-диизопропилимидазолхлорида (чистота >97%, фирма ABCR) и 0,108 г метанолят натрия в атмосфере инертного газа растворяют в 200 г свежеперегнанного N-метилпирролидона и в течение 1 ч перемешивают при 50°C. Полученную смесь засасывают в эвакуированный автоклав объемом 2 л фирмы Büchi, в который затем при -5°C переконденсируют 240 г 1,3-бутадиена (стабилизированного посредством около 100 частей на миллион 4-трет-бутилкатехола). Количество бутадиена измеряют взвешиванием газового баллона. Затем автоклав заполняют аргоном под давлением 11 бар и нагревают до 75°C. В течение 65 мин дозируют 101 г муравьиной кислоты. Давление в автоклаве посредством клапана поддерживают на уровне 20 бар. Объем отходящего газа составляет 2,9 л. Время дополнительной реакции составляет 30 мин. После охлаждения и декомпрессии автоклава смесь продуктов реакции анализируют с помощью ГХ. Результаты анализа приведены в таблице 4.

1,7-Октадиен в сырой смеси продуктов реакции не обнаружен.
Пример 6 (не в соответствии с изобретением)
0,112 г ацетата палладия, 0,130 г 1,3-ди-трет-бутилимидазолхлорида (чистота >97%, фирма ABCR) и 0,108 г метанолята натрия в атмосфере инертного газа растворяют в 200 г свежеперегнанного N-метилпирролидона и в течение 1 ч перемешивают при 50°С. Полученную смесь засасывают в эвакуированный автоклав объемом 2 л фирмы Büchi, в который затем при -5°C переконденсируют 240 г 1,3-бутадиена (стабилизированного посредством около 100 частей на миллион 4-трет-бутилкатехола). Количество бутадиена измеряют взвешиванием газового баллона. Затем автоклав заполняют аргоном под давлением 11 бар и нагревают до 75°C. В течение 60 мин дозируют 101 г муравьиной кислоты. Давление в автоклаве посредством клапана поддерживают на уровне 20 бар. Объем отходящего газа составляет 2,8 л. Время дополнительной реакции составляет 30 мин.
После охлаждения и декомпрессии автоклава смесь продуктов реакции анализируют с помощью ГХ. Результаты анализа приведены в таблице 5.

1,7-Октадиен в сырой смеси продуктов реакции не обнаружен.
Пример 7 (не в соответствии с изобретением)
0,112 г ацетата палладия, 0,109 г 1,3-ди-трет-бутилимидазол-2-илидена (чистота 98%, фирма Strem) и 0,108 г метанолята натрия в атмосфере инертного газа растворяют в 200 г свежеперегнанного N-метилпирролидона и в течение 1 ч перемешивают при 50°C. Полученную смесь засасывают в эвакуированный автоклав объемом 2 л фирмы Büchi, в который затем при -5°С переконденсируют 240 г 1,3-бутадиена (стабилизированного посредством около 100 частей на миллион 4-трет-бутилкатехола). Количество бутадиена измеряют взвешиванием газового баллона. Затем автоклав заполняют аргоном под давлением 14 бар и нагревают до 75°С. В течение 66 мин дозируют 101 г муравьиной кислоты. Давление в автоклаве посредством клапана поддерживают на уровне 20 бар. Объем отходящего газа составляет 3,42 литра. Время дополнительной реакции составляет 30 минут. После охлаждения и декомпрессии автоклава смесь продуктов реакции анализируют с помощью ГХ. Результаты анализа приведены в таблице 6.

Площади хроматографического пика 1,7-октадиена, содержащегося в сырой смеси продуктов реакции, соответствует всего 0,2%.
Примеры 4-7 однозначно показывают, что не все карбеновые комплексы металлов катализируют гидродимеризацию 1,3-бутадиена до 1,7-октадиена.
Пример 8 (30 частей на миллион палладия, 1,3-бутадиен, стабилизированный посредством 100 частей на миллион 4-гидрокси-2,2,6,6-тетраметилпиперидин-N-оксила в пересчете на 1,3-бутадиен)
0,056 г ацетата палладия, 0,521 г 1,3-бис(2,4,6-триметилфенил)имидазол-o-крезолят-o-крезола и 0,27 г метанолята натрия в атмосфере инертного газа растворяют в 200 г свежеперегнанного N-метилпирролидона и в течение 1 ч перемешивают при 50°C, после чего охлаждают до 20°C. Затем добавляют 0,32 г 4-гидрокси-2,2,6,6-тетраметилпиперидин-N-оксила (SiYPro С710 фирмы Degussa AG). Полученную смесь засасывают в эвакуированный автоклав объемом 2 л фирмы Büchi, в который затем при -5°C переконденсируют 480 г 1,3-бутадиена (нестабилизированного). Количество бутадиена измеряют взвешиванием газового баллона. Затем автоклав заполняют аргоном под давлением 10 бар и нагревают до 75°C. В течение 120 мин дозируют 202 г муравьиной кислоты (чистота 98-100%). Температуру после начала реакции поддерживают в интервале от 80 до 90°C. Давление в автоклаве посредством клапана поддерживают на уровне 20 бар. Объем отходящего газа составляет 82,7 л. Время дополнительной реакции составляет 30 мин. После охлаждения и декомпрессии автоклава смесь продуктов реакции анализируют с помощью ГХ. После одноступенчатой дистилляции при разрежении 50 мбар и максимальной температуре в кубе 80°C осуществляют дополнительный ГХ-анализ. Результаты анализа (площади хроматографических пиков в %) приведены в таблице 7.

В качестве дистиллята получают 336,3 г октадиенов, выход которых после выделения составляет 69,4%. Степень чистоты в пересчете на 1,7-октадиен составляет 94,3%. Муравьиная кислота превращается полностью.
Пример 9 (28 частей на миллион палладия, основание, 1,3-бутадиен, стабилизированный посредством 100 частей на миллион 4-гидрокси-2,2,6,6-тетраметил-пиперидин-N-оксила в пересчете на 1,3-бутадиен)
0,056 г ацетата палладия, 0,521 г 1,3-бис(2,4,6-триметилфенил)имидазол-о-крезолят-о-крезола и 0,27 г метанолята натрия в атмосфере инертного газа растворяют в 200 г свежеперегнанного N-метилпирролидона и в течение 1 ч перемешивают при 50°C, после чего охлаждают до 20°C. Затем добавляют 0,32 г 4-гидрокси-2,2,6,6-тетраметилпиперидин-N-оксила (SiYPro C710 фирмы Degussa AG) и 44,4 г триэтиламина в качестве основания. Полученную смесь засасывают в эвакуированный автоклав объемом 2 л фирмы Büchi, в который при -5°C переконденсируют 480 г 1,3-бутадиена (нестабилизированного). Количество бутадиена измеряют взвешиванием газового баллона. Затем автоклав заполняют аргоном под давлением 10 бар и нагревают до 75°C. В течение 123 мин дозируют 202 г муравьиной кислоты (чистота 98-100%). Температуру после начала реакции поддерживают в интервале от 80 до 90°C. Давление в автоклаве посредством клапана поддерживают на уровне 20 бар. Объем отходящего газа составляет 77 л. Время дополнительной реакции составляет 15 мин. После охлаждения и декомпрессии автоклава смесь продуктов реакции анализируют с помощью ГХ. После дистилляции с отбором двух фракций при разрежении 50 мбар и максимальной температуре в кубе 80°C осуществляют дополнительный анализ с помощью ГХ. Результаты анализа (площади хроматографических пиков в %) приведены в таблице 8.

Дистилляты содержат 400,8 г октадиенов, что соответствует выходу 82,7%. Степень чистоты октадиенов в пересчете на 1,7-октадиен составляет 93,5%. Муравьиная кислота превращается полностью.
Пример 10 (15 частей на миллион палладия, 1,3-бутадиен, стабилизированный посредством 100 частей на миллион 4-гидрокси-2,2,6,6-тетраметилпиперидин-N-оксила в пересчете на 1,3-бутадиен)
0,028 г ацетата палладия, 0,26 г 1,3-бис(2,4,6-триметилфенил)имидазол-o-крезолят-o-крезола и 0,13 г метанолята натрия в атмосфере инертного газа растворяют в 200 г свежеперегнанного N-метилпирролидона и в течение 1 ч перемешивают при 50°C, после чего охлаждают до 20°C. Затем добавляют 0,32 г 4-гидрокси-2,2,6,6-тетраметилпиперидин-N-оксила (SiYPro С710 фирмы Degussa AG). Полученную смесь засасывают в эвакуированный автоклав объемом 2 л фирмы Büchi, в который затем при -5°C переконденсируют 480 г 1,3-бутадиена (нестабилизированного). Количество бутадиена измеряют взвешиванием газового баллона. Затем автоклав заполняют аргоном под давлением 10 бар и нагревают до 80°C. В течение 240 мин дозируют 193 г муравьиной кислоты (чистота 98-100%). Температуру после начала реакции поддерживают в интервале от 80 до 81°C посредством помещенного внутрь автоклава охлаждающего змеевика. Давление в автоклаве посредством клапана поддерживают на уровне 20 бар. Объем отходящего газа составляет 71 л. Время дополнительной реакции составляет 10 мин. После охлаждения и декомпрессии автоклава смесь продуктов реакции анализируют с помощью ГХ. После одноступенчатой дистилляции, выполняемой под давлением от 100 до 50 мбар при максимальной температуре в кубе 80°C, осуществляют дополнительный анализ с помощью ГХ. Результаты анализа (площади хроматографических пиков в %) приведены в таблице 9.

В качестве дистиллята получают 421,2 г октадиенов, выход которых после выделения составляет 94,7%. Степень чистоты в пересчете на 1,7-октадиен составляет 96,1%. Муравьиная кислота превращается полностью.
Пример 11 (6 частей на миллион палладия, 1,3-бутадиен, стабилизированного посредством 100 частей на миллион 4-гидрокси-2,2,6,6-тетраметилпиперидин-N-оксила в пересчете на 1,3-бутадиен)
0,0112 г ацетата палладия, 0,521 г 1,3-бис(2,4,6-триметилфенил)имидазол-o-крезолят-o-крезола и 0,13 г метанолята натрия в атмосфере инертного газа растворяют в 200 г свежеперегнанного N-метилпирролидона и в течение 1 ч перемешивают при 50°C, после чего охлаждают до 20°C. Затем добавляют 0,32 г 4-гидрокси-2,2,6,6-тетраметилпиперидин-N-оксила (SiYPro С710 фирмы Degussa AG). Полученную смесь засасывают в эвакуированный автоклав объемом 2 л фирмы Büchi, в который затем при -5°C переконденсируют 480 г 1,3-бутадиена (нестабилизированного). Количество бутадиена измеряют взвешиванием газового баллона. Затем автоклав заполняют аргоном под давлением 10 бар и нагревают до 80°C. В течение 12 ч добавляют 193 г муравьиной кислоты (чистота 98-100%). Температуру после начала реакции поддерживают в интервале от 80 до 81°C посредством помещенного внутрь автоклава охлаждающего змеевика. Давление в автоклаве посредством клапана поддерживают на уровне 20 бар. Объем отходящего газа составляет 71,4 л. Время дополнительной реакции составляет 10 мин. После охлаждения и декомпрессии автоклава смесь продуктов реакции анализируют методом ГХ. После одноступенчатой дистилляции, выполняемой при разрежении от 100 до 50 мбар и максимальной температуре в кубе 80°C, осуществляют дополнительный анализ с помощью ГХ. Резуьтаты анализа (площади хроматографических пиков в %) приведены в таблице 10.

В качестве дистиллята получают 395,6 г октадиенов, выход которых после выделения составляет 85,5%. Соответствующая продуктивность катализатора TON (октадиены) составляет 72248. Степень чистоты в пересчете на 1,7-октадиен составляет 96,1%. Муравьиная кислота превращается полностью. Следует отметить, что, несмотря на значительную длительность гидродимеризации, изомеризация 1,7-октадиена в этом примере отсутствует.
Примеры 8-11 однозначно показывают, что в случае использования N-оксильных радикалов, например, таких как 4-гидрокси-2,2,6,6-тетраметилпиперидин-N-оксил, в качестве стабилизатора 1,3-бутадиена, для гидродимеризации также оказывается достаточно использования незначительных количеств катализатора (менее 50 частей на миллион). В отличие от этого пример 3 показывает, что в случае использования для стабилизации 1,3-бутадиена 4-трет-бутилкатехола и катализатора в количестве 50 частей на миллион получают гораздо более низкий выход целевого продукта.
Пример 12 (45 частей на миллион палладия, изопрен, стабилизированный посредством 100 частей на миллион 4-гидрокси-2,2,6,6-тетраметилпиперидин-N-оксила в пересчете на 1,3-бутадиен)
0,112 г ацетата палладия, 0,521 г 1,3-бис(2,4,6-триметилфенил)имидазол-o-крезолят-o-крезола и 0,27 г метанолята натрия в атмосфере инертного газа растворяют в 200 г свежеперегнанного N-метилпирролидона и в течение 1 ч перемешивают при 50°C, после чего охлаждают до 20°C. Затем добавляют 0,32 г 4-гидрокси-2,2,6,6-тетраметилпиперидин-N-оксила (SiYPro C710 фирмы Degussa AG). Полученную смесь засасывают в эвакуированный автоклав объемом 2 л фирмы Büchi, в который затем засасывают 606 г свежеперегнанного изопрена (нестабилизированного). После этого автоклав заполняют аргоном под давлением 14 бар и нагревают до 80°C. В течение 240 мин дозируют 193 г муравьиной кислоты (чистота 98-100%). Температуру после начала реакции поддерживают в интервале от 80 до 81°C посредством помещенного внутрь автоклава охлаждающего змеевика. Давление в автоклаве посредством клапана поддерживают на уровне 20 бар. Объем отходящего газа составляет 73,4 л. Время дополнительной реакции составляет 20 мин. После охлаждения и декомпрессии автоклава смесь продуктов реакции анализируют с помощью ГХ. После одноступенчатой дистилляции при разрежении от 100 до 40 мбар и максимальной температуре в кубе 105°C выполняют дополнительный анализ с помощью ГХ. Результаты анализа (площади хроматографических пиков в %) приведены в таблице 11.

В качестве дистиллята получают 510,8 г изомеров диметилоктадиена, выход которых после выделения составляет 83,2%.
Пример 13 (57 частей на миллион палладия, изопрен и 1,3-бутадиен, стабилизированный посредством 100 частей на миллион 4-гидрокси-2,2,6,6-тетраметил-пиперидин-N-оксила в пересчете на 1,3-бутадиен)
0,112 г ацетата палладия, 0,521 г 1,3-бис(2,4,6-триметилфенил)имидазол-o-крезолят-o-крезола и 0,27 г метанолята натрия в атмосфере инертного газа растворяют в 200 г свежеперегнанного N-метилпирролидона и в течение 1 ч перемешивают при 50°C, после чего охлаждают до 20°C. Затем добавляют 0,32 г 4-гидрокси-2,2,6,6-тетраметилпиперидин-N-оксила (SiYPro C710 фирмы Degussa AG). Полученную смесь засасывают в эвакуированный автоклав объемом 2 л фирмы Büchi, в который затем засасывают 303 г свежеперегнанного изопрена (нестабилизированного). Затем в автоклав при -5°C переконденсируют 240 г 1,3-бутадиена (нестабилизированного). После этого автоклав заполняют аргоном под давлением 14 бар и нагревают до 80°C. В течение 60 мин дозируют 193 г муравьиной кислоты (чистота 98-100%). Температуру после начала реакции поддерживают в интервале от 80 до 81°C посредством помещенного внутрь автоклава охлаждающего змеевика. Давление в автоклаве посредством клапана поддерживают на уровне 20 бар. Объем отходящего газа составляет 79,2 л. Время дополнительной реакции составляет 20 мин. После охлаждения и декомпрессии автоклава смесь продуктов реакции анализируют с помощью ГХ. После одноступенчатой дистилляции при разрежении от 100 до 40 мбар и максимальной температуре в кубе 105°C выполняют дополнительный анализ с помощью ГХ. Результаты анализа (площади хромато-графических пиков в %) приведены в таблице 12.

В качестве дистиллята получают смесь изомеров диолефинов с 8-10 атомами углерода. Смесь в основном состоит из октадиена, метилоктадиена и диметилоктадиена. Получают 441,9 г дистиллята, что соответствует выходу продуктов гидродимеризации после их выделения 88,4%.
Пример 14 (не в соответствии с изобретением; 30 частей на миллион палладия; 1,3-бутадиен, стабилизированный посредством 100 частей на миллион 4-гидрокси-2,2,6,6-тетраметилпиперидин-N-оксила в пересчете на 1,3-бутадиен)
0,056 г ацетата палладия, 0,521 г 1,3-бис(2,4,6-триметилфенил)имидазол-o-крезолят-o-крезола и 0,27 г метанолята натрия в атмосфере инертного газа растворяют в 200 г свежеперегнанного N-метилпирролидона и в течение 1 ч перемешивают при 50°C, после чего охлаждают до 20°C. Затем добавляют 0,32 г 4-гидрокси-2,2,6,6-тетраметилпиперидин-N-оксила (SiYPro C710 фирмы Degussa AG). Полученную смесь засасывают в эвакуированный автоклав объемом 2 л фирмы Büchi, в который затем при -5°C переконденсируют 480 г свежеперегнанного 1,3-бутадиена (нестабилизированного). Количество бутадиена измеряют взвешиванием газового баллона. После этого насосом дозируют 202 г муравьиной кислоты (чистота 98-100%). Автоклав заполняют аргоном под давлением 10 бар, нагревают до 75°C и в течение 2 ч осуществляют перемешивание. Давление в автоклаве посредством клапана поддерживают на уровне 20 бар. В течение указанного времени выделения отходящего газа не наблюдается. Время дополнительной реакции составляет 30 мин. После охлаждения и декомпрессии автоклава смесь продуктов реакции анализируют с помощью ГХ. Присутствие 1,7-октадиена в реакционной смеси не обнаружено.
Реферат
Изобретение относится к способу получения замещенных или незамещенных 1,7-диолефинов формулы (9) ! , ! в которой R7-R12 независимо друг от друга обозначают водород, алкил с 1-4 атомами углерода или галоген, гидродимеризацией нециклических олефинов с, по меньшей мере, двумя сопряженными двойными связями в присутствии восстановителя и катализатора, характеризующемуся тем, что в качестве восстановителя используют муравьиную кислоту и/или формиаты, а в качестве катализатора используют карбеновый комплекс металла, который содержит металл от 8-й до 10-й групп периодической системы элементов и, по меньшей мере, один карбеновый лиганд формулы (1) или (2): ! ! в которой R1, R2 означают -(СН2)n-В, В означает моноциклическую или полициклическую арильную группу с 6-14 атомами углерода или моноциклический или полициклический гетероцикл с 5-14 атомами углерода и гетероатомами, который содержит от 1 до 3 гетероатомов, выбранных из группы, включающей азот, кислород и серу, n означает число от 0 до 4, R3, R4, R5 и R6 означают водород, алкил, гетероарил, арил, -CN, -СООН, -СОО-алкил, -СОО-арил, -ОСО-алкил, -ОСО-арил, -ОСОО-алкил, -ОСОО-арил, -СНО, -СО-алкил, -СО-арил, -NH2, -NH(алкил), -N(алкил)2, -NH(арил), -N(арил)2, фтор, хлор, бром, йод, -ОН, -CF3, -NO2, -ферроценил, -SO3H или -РО3Н2, причем алкил означает алкильную группу с 1-12 атомами углерода, арил означает арильную группу с 5-14 атомами углерода, и заместители R3 и R4 могут быть также частью связанного мостиком алифатического или ароматического кольца, причем заместители R1 и R2 могут быть одинаковыми или разными, замещенными или незамещенными, и заместители R3, R4, R5 и R6 также могут быть одинаковыми или разными, замещенными или незамещенными. На�
Формула

в которой R7-R12 независимо друг от друга обозначают водород, алкил с 1 до 4 атомами углерода или галоген гидродимеризацией нециклических олефинов с, по меньшей мере, двумя сопряженными двойными связями в присутствии восстановителя и катализатора, отличающийся тем, что в качестве восстановителя используют муравьиную кислоту и/или формиаты, а в качестве катализатора используют карбеновый комплекс металла, который содержит металл от 8-й до 10-й групп периодической системы элементов и, по меньшей мере, один карбеновый лиганд формулы (1) или (2):


в которой R1, R2 означают -(СН2)n-В, В означает моноциклическую или полициклическую арильную группу с 6-14 атомами углерода или моноциклический или полициклический гетероцикл с 5-14 атомами углерода и гетероатомами, который содержит от 1 до 3 гетероатомов, выбранных из группы, включающей азот, кислород и серу,
n означает число от 0 до 4,
R3, R4, R5 и R6 означают водород, алкил, гетероарил, арил, -CN, -СООН, -СОО-алкил, -СОО-арил, -ОСО-алкил, -ОСО-арил, -ОСОО-алкил, -ОСОО-арил, -СНО, -СО-алкил, -СО-арил, -NH2, -NH(алкил), -N(алкил)2, -NH(арил), -N(арил)2, фтор, хлор, бром, йод, -ОН, -CF3, -NO2, -ферроценил, -SO3H или -РО3Н2, причем алкил означает алкильную группу с 1-12 атомами углерода, арил означает арильную группу с 5-14 атомами углерода, и заместители R3 и R4 могут быть также частью связанного мостиком алифатического или ароматического кольца, причем заместители R1 и R2 могут быть одинаковыми или разными, замещенными или незамещенными, и заместители R3, R4, R5 и R6 также могут быть одинаковыми или разными, замещенными или незамещенными.

Комментарии