Способ получения n-метил-n-[(1s)-1-фенил-2-((3s)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамида в виде чистого энантиомера - RU2298549C2
Код документа: RU2298549C2
Описание
Настоящее изобретение относится к новому способу получения по выбору N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамида или N-метил-N-[(1R)-1-фенил-2-((3R)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамида, а также новых соединений N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил) этана] и N-метил-N-[(1R)-1-фенил-2-((3R)-3-гидроксипирролидин-1-ил)этана], образующихся в качестве промежуточных продуктов при осуществлении этого способа.
Как описано у Barber и др. (B.J.Pharmacol. 113 (1994), стр.1317-1327), как соединение N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамид, так и его физиологически приемлемые соли обладают ценными фармакологическими свойствами, такими как анальгетическая, противовоспалительная и водорастворимая эффективность, благодаря которым они особенно пригодны для изготовления соответствующих лекарственных средств.
Аналогично тому, как описано в заявках DE 19523502, соответственно ЕР 752246, было установлено, что указанное соединение представляет собой особенно эффективное соединение, которое может исключительно успешно применяться в качестве лекарственного средства для лечения воспалительных заболеваний кишечника. Прежде всего благодаря этому показанию соединение проявляет при его применении высокую эффективность, поскольку одновременно оно способно уменьшать боли, связанные с такими заболеваниями, а в случае обусловленной острым воспалением, соответственно спровоцированной воспалением опасности закупорки просвета кишки оно нормализует моторику кишечника или способствует возобновлению его нормальной деятельности, не вызывая при этом заметных побочных эффектов. Кроме того, соединение может применяться и при невоспалительных заболеваниях кишечника, таких, в частности, как СРК (синдром раздраженной кишки).
В заявках DE 4034785 А1 и DE 4215213 А1, соответственно ЕР 0569802 А1 описано получение N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамида взаимодействием (2S)-2-N-карбоксиэтил-2-фенилглицин-N, N-[(3S)-3-гидрокситетраметиламида] с дифенилацетилхлоридом. Как описано в DE 4215213, исходное соединение (2S)-2-N-карбоксиэтил-2-фенилглицин-N,N-[(3S)-3-гидрокситетраметиленамид, другое его название (1S)-[1-N-метиламино-1-фенил-2-((3S)-3-гидроксипирролидино)этан], можно получить взаимодействием (1S)-1-амино-1-фенил-2-хлорэтана с (3S)-3-гидроксипирролидином и последующим метилированием метилиодидом. Однако этому методу получения присущи определенные проблемы, заключающиеся в неудовлетворительной растворимости исходных продуктов, а также в том, что по завершении синтеза для разделения полученной, содержащей примеси побочных продуктов рацемической смеси требуются значительные затраты. По этой причине известный на сегодняшний день способ получения N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамида неэкономичен и не обеспечивает к тому же достаточно высокого выхода продукта с учетом используемых исходных соединений.
Исходя из вышеизложенного в основу настоящего изобретения была положена задача разработать простой в осуществлении и экономичный способ получения N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамида, соответственно при использовании энантиомерных эдуктов N-метил-N-[(1R)-1-фенил-2-((3R)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамида, исходя из недорогих, хорошо растворимых исходных продуктов, которые обеспечивали бы возможность получать продукт в виде максимально чистого энантиомера с его последующим, также беспроблемным выделением и очисткой.
Указанная задача решается с помощью способа согласно пункту 1 формулы изобретения, в котором для получения N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамида в качестве нового промежуточного продукта используют неизвестное на сегодняшний день соединение - N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этан], а для получения N-метил-N-[(1R)-1-фенил-2-((3R)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамида также в качестве нового промежуточного продукта используют N-метил-N-[(1R)-1-фенил-2-((3R)-3-гидроксипирролидин-1-ил)этан].
Было установлено, что соединения формулы III

в которой R и R2 имеют следующие значения:
R обозначает Н, OR1 или SR1,
R1 обозначает А, арил, гетероарил, Si(R3)3 или COR3,
R2 обозначает Н, А, арил, гетероарил, а также Si(R3)3 или COR3,
R3 обозначает Н, А, арил или гетероарил,
А обозначает прямоцепочечный либо разветвленный алкильный остаток с 1-6 С-атомами,
можно получать с высоким выходом и в виде чистого энантиомера, если, в зависимости от требуемого конечного продукта, (3S)-3-гидроксипирролидины или (3R)-3-гидроксипирролидины формулы II

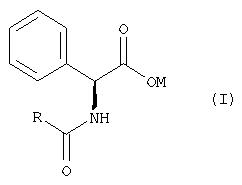
в которой R2 обозначает Н, А, арил, гетероарил, а также Si(R3)3 или COR3, R3 обозначает Н, А, арил или гетероарил, либо их соли, образуемые с HCl, HBr, HI, H2SO4, Н3PO4 или с соответствующми органическими кислотами, подвергать взаимодействию по реакции амидного сочетания с соответствующими (S)- или (R)-энантиомерными формами N-замещенных фенилглицинов формулы I

в которой R обозначает Н, OR1 или SR1,
R1 обозначает А, арил, гетероарил, Si(R3)3 или COR3,
R3 обозначает Н, А, арил или гетероарил,
М обозначает Н или катион из группы, включающей щелочные металлы, щелочно-земельные металлы, аммоний и алкиламмоний.
Алкил содержит 1-6, предпочтительно 1, 2, 3 или 4 С-атома, и представляет собой предпочтительно метил, кроме того, этил, пропил, изопропил, бутил, изобутил, втор-бутил или трет-бутил, а также пентил, 1-, 2- либо 3-метилбутил, 1,1-, 1,2- либо 2, 2-диметилпропил, 1-этилпропил, гексил, 1-, 2-, 3- либо 4-метилфенил, 1,1-, 1,2-, 1,3-, 2,2-, 2,3- либо 3,3-диметилбутил, 1- либо 2-этилбутил, 1-этил-1-метилпропил, 1-этил-2-метилпропил, 1,1,2- либо 1, 2, 2-триметилпропил.
Арил представляет собой предпочтительно незамещенный фенил или одно- либо двукратно замещенный галогеном, ОА или алкилом фенил, а также, например, бифенил или нафтил.
Гетероарил представляет собой предпочтительно, например, фуранил, тиофенил, пиридинил, пирролил или тиазолил.
Si(R3)3 обозначает предпочтительно, например, Si(СН3)3.
COR3 обозначает предпочтительно, например, ацетил или бензоил.
R обозначает предпочтительно прежде всего, например, метокси или этокси.
R1 обозначает прежде всего, например, метил, этил, пропил, бутил, фенил, Si(СН3)3 или ацетил.
R2 обозначает прежде всего, например, Н, трет-бутил, Si(СН3)3, ацетил, бензил или бензоил, но наиболее предпочтительно Н.
Получаемые амиды формулы III по простой методике путем восстановления, необязательно при отщеплении защитной группы в гидроксильной группе пирролидина можно переводить в N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этан] или в N-метил-N-[(1R)-1-фенил-2-((3R)-3-гидроксипирролидин-1-ил)этан] формулы IV.
Взаимодействием с активированными карбоновыми кислотами формулы V

в которой R4 обозначает F, Cl, Br, I, ОА или O-СО-А,
из свободных оснований соединений формулы IV

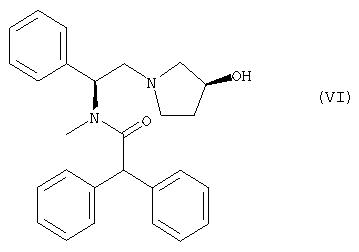
либо из их солей, образуемых с HCl, HBr, HI, H2SO4, Н3PO4 или с соответствующими органическими кислотами, могут быть получены энантиомерные соединения формулы VI

в чистой форме. Предпочтительно получать указанные соединения в виде гидрохлоридов, при этом под соединением N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамид имеется в виду известная форма EMD 61753; аналогичным путем можно получать и соответствующие соли, используя в этих целях другие кислоты из числа вышеназванных.
Прежде всего подобным образом указанным в качестве последнего взаимодействием с хлорангидридом дифенилуксусной кислоты может быть получен N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамид.
Синтезированные в качестве промежуточного продукта соединения формулы IV можно в принципе получать взаимодействием соединений формулы I с соединениями формулы II. Предпочтительно использовать в этой реакции такие соединения формулы I, в которых значением R является OR1, где R1обозначает А, арил, гетероарил, Si(R3)3 или COR2, а R2 обозначает Н, алкил, арил или гетероарил, имеющие указанные выше предпочтительные значения. Неожиданным образом была установлена возможность получать, в отличие от случаев применения соответствующего формильного соединения, продукты формулы III в виде чистых энантиомеров. Благодаря этому отпадает необходимость в разделении рацемата, что следует отнести к несомненным преимуществам изобретения.
Взаимодействие соединений формул I и II можно осуществлять в любом апротонном растворителе. Особенно пригодны в этих целях полярные апротонные растворители, выбранные из группы, включающей диэтиловый эфир, петролейный эфир, ацетон, нитробензол, диметилформамид, диметилсульфоксид или же другие соответствующие растворители. При этом эдукты растворяют в таком количестве растворителя, чтобы получить в результате 10-30%-ный раствор. Предпочтительно выбирать для проведения реакции в качестве растворителя тетрагидрофуран.
Реакции между соединениями формул I и II осуществляют в соответствующих условиях при температурах в интервале от 0 до 50°С. Особенно хороших результатов достигают, однако, при комнатной температуре в интервале от 20 до 30°С и при нормальном давлении.
Для активации эдуктов требуется наличие вспомогательного реагента, функцию которого могут выполнять такие вспомогательные вещества, которые также используют в реакциях пептидного сочетания. Пригодны в этих целях такие соединения, как, например, окситрихлорид фосфора, галогениды фосфора с валентностью III и V, фосген, дициклогексилкарбодиимид, трибутиламмониевая соль пиридина, фенилдихлорфосфат, 2-хлор-1,2,3-тринитробензол, эфиры фосфорной кислоты, хлорсульфонилизоцианат, СН3SO2Cl-(С2Н5)3N, (С6Н5)3 Р-CCl4-(C2H5)3N, N,N'-карбонилдиимидазол, N-(алкилкарбонил)имидазолы, ангидриды кислот или хлорангидриды кислот и прежде всего алкилхлорформиаты, такие как этиловый эфир хлормуравьиной кислоты. Другие соответствующие вспомогательные реагенты описаны в различных справочных изданиях, как, например, С.Ferri "Reaktionen der organischen Synthese"; R.C.Larock "Comprehensive Organic Transformations; A Guide to Functional Group Preparations", изд-во Verlag Chemie, 1989.
Помимо наличия вспомогательного реагента из числа вышеназванных, необходимо присутствие основания. При выборе соответствующего основания можно также руководствоваться указанными изданиями. В качестве примера можно назвать такие основания, как третичные амины, в частности триэтиламин. В то же время можно добавлять и неорганические основания. В качестве неорганических оснований пригодны в первую очередь карбонаты. При использовании гидроксидов щелочных металлов, таких как NaOH или КОН, необходимо особенно тщательно соблюдать точную дозировку, поскольку в противном случае могут иметь место нежелательные побочные реакции. Для упрощения переработки можно применять также гидроксипирролидин в избытке, благодаря чему он сам выполняет функцию основания.
Переработку полученного продукта реакции формулы III можно осуществлять после отфильтровывания выпавшего осадка с помощью обычных лабораторных методов, работая с фильтратом. Так, например, традиционно используемый метод состоит в том, что растворитель отгоняют, сырой продукт повторно растворяют в органическом растворителе, полученный раствор несколько раз экстрагируют водой, растворитель повторно отгоняют и полученный продукт перекристаллизовывают из соответствующего растворителя, такого например, как метанол. В принципе возможны и другие варианты, известные специалисту в данной области техники, в частности такие, в которых предусматривается хроматографическая очистка.
В зависимости от условий, в которых осуществляют реакцию, продукт формулы III получают в виде свободного основания или в виде кислотно-аддитивной соли кислот HCl, HBr, HI, H2SO4 или какой-либо органической карбоновой кислоты из содержащей воду смеси растворителей. В последних случаях выделение продукта можно проводить после разделения фаз с помощью обычных лабораторных методов.
В качестве приемлемых органических карбоновых кислот могут использоваться прежде всего алифатические, алициклические, аралифатические, ароматические или гетероциклические одно- либо многоосновные карбоновые, сульфоновые или серные кислоты, как, например, муравьиная кислота, уксусная кислота, пропионовая кислота, пивалиновая кислота, диэтилуксусная кислота, малоновая кислота, янтарная кислота, пимелиновая кислота, фумаровая кислота, малеиновая кислота, молочная кислота, винная кислота, яблочная кислота, лимонная кислота, глюконовая кислота, аскорбиновая кислота, никотиновая кислота, изоникотиновая кислота, метан- либо этансульфокислота, этандисульфокислота, 2-гидроксиэтансульфокислота, бензолсульфокислота, п-толуолсульфокислота, нафталинмоно- и -дисульфокислоты и лаурилсерная кислота.
Восстановление соединений формулы III проводят в атмосфере защитного газа, например в атмосфере азота, в присутствии реагента гидридного переноса. Пригодными в этих целях реагентами гидридного переноса являются таковые из группы, включающей алюмогидриды металлов, предпочтительно алюмогидрид лития, алкоксиалюмогидриды металлов, как, например, триэтоксиалюмогидрид лития, борогидриды металлов, предпочтительно NaBH4, или бораны, причем в дополнение к ним требуется присутствие кислоты Льюиса, например трифторида бора. Восстановление проводят предпочтительно в полярном апротонном и инертном по отношению к гидриду растворителе. Пригодны в этих целях те же растворители, что и указанные выше. Особенно целесообразно использовать среди прочих диэтиловый эфир или тетрагидрофуран.
Для осуществления гидрирования соединение формулы III растворяют в соответствующем растворителе и добавляют при нагревании к раствору, содержащему реагент гидридного переноса в эквимолярных количествах, соответственно в небольшом избытке. Возможен и другой вариант, согласно которому сначала загружают в реактор гидрируемое исходное соединение, а затем соответствующим образом добавляют гидрирующий реагент в предусмотренном количестве, получая в результате реакционную смесь, в которой концентрация эдукта составляет от 10 до 25 мас.% в пересчете на растворитель. Для завершения реакции смесь в течение нескольких часов перемешивают с использованием обратного холодильника. Затем реакционный раствор по методам, известным специалисту в данной области техники, подвергают последующей переработке, при которой, в частности, добавлением смеси растворителей, состоящей из растворителя, отдающего протоны, и апротонного растворителя, разлагают избыток реагента гидридного переноса и выделяют продукт реакции. В качестве отдающих протоны растворителей пригодны, например, вода или спирты, такие как этанол или метанол. В качестве апротонных растворителей приемлемы все полярные апротонные растворители, указанные выше, и прежде всего тетрагидрофуран. Последний наиболее предпочтителен для применения, поскольку технологически его можно получать в виде безводного продукта.
Переработка продукта может осуществляться после разделения фаз с помощью обычных лабораторных методов. Так, в частности, полученный сырой продукт можно перерабатывать по методам кристаллизации или же его можно растворять, например, в органическом, не смешиваемом с водой растворителе и примешивать в избытке какую-либо неорганическую кислоту, предпочтительно соляную кислоту. Образованную таким образом соль можно затем отделять путем кристаллизации.
Последующее взаимодействие N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этана] или его дигидрохлорида с соответствующим производным дифенилуксусной кислоты, предпочтительно с хлорангидридом кислоты, с получением требуемого конечного продукта, каковым является N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамид (формула VI, EMD 61753), осуществляют с помощью методов, описанных в заявках DE-A1 4034785 и DE-A1 4215213, соответственно ЕР 0569802 А1.
Ниже настоящее изобретение более подробно поясняется на примерах его осуществления, которые никоим образом не ограничивают его объем, поскольку возможны и другие варианты, также приводящие к получению требуемого промежуточного продукта - N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этана] [формула IV], используемого в качестве такового для получения N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2, 2-дифенилацетамида.
Примеры
N-замещенные (2S)-2-фенилглицин-N,N-[(3S)-3-гидрокситетраметиленамиды] формулы III из (2S)-2-фенилглицинов формулы I
Пример 1
(2S)-N-Формил-2-фенилглицин-N, N-[(3S)-3-гидрокситетраметиленамид]
Это соединение получают из (2S)-N-формил-2-фенилглицина (получаемого из (S)-(+)-α -аминофенилуксусной кислоты и ацетангидрида/муравьиной кислоты, например, согласно Peter Huszthy, Masatoshi Oue, Jerald S.Bradshaw, Cheng Y.Zhu, Tingmin Wang и др., J.Org. Chem., EN, 57 (20) [1992], стр.5383-5394) и (3S)-3-гидроксипирролидина (получаемого из коммерчески доступного (S)-1-бензил-3-пирролидинола, например, согласно Kristina L.Bhat, Denise M.Flanagan, Madeleine M.Joullie, Synth. Commun., EN, 15 (7) [1985], стр.587-598, или Alan Naylor, Duncan В.Judd, David I.C.Scopes, Ann G.Hayes, Philip J.Birch, J.Med. Chem., EN, 37 (14) [1994], стр.2138-2144) следующим путем.
В атмосфере азота к 9 г (2S)-N-формил-2-фенилглицина и 5, 5 мл N-метилморфолина в 250 мл ТГФ при -15°С добавляют при перемешивании 4,8 мл этилхлорформиата в 10 мл тетрагидрофурана и по истечении 10 мин выдержки добавляют раствор из 6,2 г гидрохлорида (3S)-3-гидроксипирролидина и 7 мл триэтиламина в 50 мл диметилформамида. После перемешивания в течение 18 ч выпавший осадок отделяют и из фильтрата с помощью обычных лабораторных методов путем концентрирования и последующей хроматографической очистки выделяют образовавшийся (2S)-N-формил-2-фенилглицин-N, N-[(3S)-3-гидрокситетраметиленамид.
1H-ЯМР (D6 -ДМСО): 3,0-3,8 (m), 4,25 (d), 5,0 (s, шир.), 5,7 (dd), 7,4 (ArH), 8,0 (ArH), 8,8 (СНО).
MC-FAB: (M+1)+ 221, 205.
Кристаллы с tпл 97-101° С.
[α]D20=+208, с=1 в метаноле.
Пример 2
(2S)-N-Карбоксибензил-2-фенилглицин-N,N-[(3S)-3-гидрокситетраметиленамид]
Это соединение получают из (2S)-N-карбоксибензил-2-фенилглицина (получаемого из (S)-(+)-α -аминофенилуксусной кислоты и бензилового эфира хлоругольной кислоты согласно, например, Raymond C.F.Jones, lan Turner, Kevin J.Howard, Tetrahedron Lett., 34 (39) [1993], стр.6329-6332) и (3S)-3-гидроксипирролидина (получаемого из коммерчески доступного (S)-1-бензил-3-пирролидинола, например, согласно Kristina L.Bhat, Denise M.Flanagan, Madeleine M.Joullie, Synth. Commun., EN, 15 (7) [1985], стр.587-598, или Alan Naylor, Duncan В. Judd, David I.C. Scopes, Ann G.Hayes, Philip J.Birch, J.Med. Chem., EN, 37 (14) [1994], стр.2138-2144) следующим путем.
В атмосфере азота к 14,3 г (2S)-N-карбоксибензил-2-фенилглицина в 100 мл тетрагидрофурана примешивают на холоде 5,5 мл 4-метилморфолина и раствор из 4,8 мл этилхлорформиата и 10 мл тетрагидрофурана, после чего перемешивают в течение 30 мин. Затем добавляют раствор из 4,36 г (3S)-3-гидроксипирролидина и 10 мл тетрагидрофурана. После перемешивания в течение 18 ч выпавший осадок отделяют и образовавшийся (2S)-N-карбоксибензил-2-фенилглицин-N,N-[(3S)-3-гидрокситетраметиленамид выделяют из фильтрата с помощью обычных лабораторных методов путем концентрирования, растворения в органическом растворителе, промывки водной фазой, повторного концентрирования и кристаллизации.
1 H-ЯМР (D6-ДМСО+ТФУК): 5,1 (s), PhCH2R.
FAB-MC: 355 (М+1)+, 311, 196, 176.
Консистенция: масло.
[α]D20=+108, с=1 в метаноле.
Пример 3
(2S)-N-Карбоксиэтил-2-фенилглицин-N,N-[(3S)-3-гидрокситетраметиленамид]
3а)
В этом варианте указанное соединение получают из (2S)-N-карбоксиэтил-2-фенилглицина (получаемого из (S)-(+)-α-аминофенилуксусной кислоты и этилового эфира хлоругольной кислоты согласно, например, С.С.Bodurow, B.D.Boyer, J.Brennan, C.A.Bunnell, J.E.Burks и др., Tetrahedron Lett., EN, 30 (18) [1989], стр.2321-2324) и (3S)-3-гидроксипирролидина (получаемого из коммерчески доступного (S)-1-бензил-3-пирролидинола, например, согласно Kristina L.Bhat, Denise M.Flanagan, Madeleine M.Joullie, Synth. Commun., EN, 15 (7) [1985], стр.587-598 или Alan Naylor, Duncan В.Judd, David I.C.Scopes, Ann G.Hayes, Philip J.Birch, J.Med. Chem., EN, 37 (14) [1994], стр.2138-2144) следующим путем.
В атмосфере азота к 16,7 г (2S)-N-карбоксиэтил-2-фенилглицина в 100 мл тетрагидрофурана примешивают на холоде 8,3 мл 4-метилморфолина и раствор из 7,1 мл этилхлорформиата и 20 мл тетрагидрофурана, после чего перемешивают в течение 60 мин. Затем добавляют раствор из 6,5 г (3S)-3-гидроксипирролидина и 30 мл тетрагидрофурана. После перемешивания в течение 18 ч выпавший осадок отделяют и образовавшийся (2S)-N-карбоксиэтил-2-фенилглицин-N,N-[(3S)-3-гидрокситетраметиленамид выделяют из фильтрата с помощью обычных лабораторных методов путем концентрирования, растворения в органическом растворителе, промывки водной фазой, повторного концентрирования и кристаллизации.
3б) В этом варианте указанное соединение получают из (2S)-N-карбоксиэтил-2-фенилглицина (получение см. выше) и гидрохлорида (3S)-3-гидроксипирролидина (коммерчески доступного) следующим путем.
К 11 г этилхлорформиата в 100 мл ТГФ при температуре приблизительно -10°С добавляют смесь из 24 г (2S)-N-карбоксиэтил-2-фенилгицина и 10 г метилморфолина в 100 мл ТГФ. Далее, после перемешивания, добавляют смесь из 12 г гидрохлорида (3S)-3-гидроксипирролидина в 10 мл полностью деминерализованной воды и другую смесь из 10 г метилморфолина в 20 мл ТГФ. После дальнейшего перемешивания в течение нескольких часов и разделения фаз с помощью обычных лабораторных методов путем концентрирования, растворения в органическом растворителе, промывки водной фазой, повторного концентрирования и кристаллизации выделяют (2S)-N-карбоксиэтил-2-фенилглицин-N,N-[(3S)-3-гидрокситетраметиленамид.
Представленные ниже данные анализа, полученные в вариантах 3а) и 3б), совпадают.
1 H-ЯМР (D6-ДМСО): 1,2 (t), 3-3,8 (m, шир.), 4,05 (q), 4,25 (s, шир.), 7,25-7,45 (m).
МС: 293 (М+1)+, 247, 178, 106.
Кристаллы с tпл 124-126°С.
[α]D20=+137, с=1 в метаноле.
N-Метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этаны] формулы IV
Пример 4
N-Метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этан]=1-[(3S)-3-гидроксипирролидин-1-ил]-(2S)-2-метиламино-2-фенилэтан
В атмосфере азота слегка нагревают 2200 мл 1, 08-молярного раствора алюмогидрида лития в тетрагидрофуране и при перемешивании добавляют раствор из 264 г (2S)-N-карбоксиэтил-2-фенилглицин-N, N-[(3S)-3-гидрокситетраметиленамида] и 1400 мл тетрагидрофурана. По завершении процесса добавления нагревают в течение 3 ч с обратным холодильником и охлажденный раствор гидролизуют с помощью смеси воды и тетрагидрофурана.
После обработки карбонатом натрия и удаления неорганических компонентов продукт по обычным лабораторным методам выделяют из фильтрата. Из сырого маслянистого продукта после очистки путем кристаллизации или посредством хроматографии образуется твердое вещество.
1H-ЯМР (D6-ДМСО): 2,1-3,1 (m), 3,6 (dd), 4,3 (m), 7,15-7,35 (m).
MC: 220 (M)+, 205, 120, 100, 91.
Внешний вид: желтоватое масло, которое в зависимости от полученной порции кристаллизуется.
[α]D20=+66,8; с=0,0938 г в 10 мл метанола.
Пример 5
Дигидрохлорид N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этана] или дигидрохлорид 1-[(3S)-3-гидроксипирролидин-1-ил]-(2S)-2-метиламино-2-фенилэтана
В атмосфере азота слегка нагревают 2200 мл 1,08-молярного раствора алюмогидрида лития в тетрагидрофуране и при перемешивании добавляют раствор из 264 г (2S)-N-карбоксиэтил-2-фенилглицин-N,N-[(3S)-3-гидрокситетраметиленамида] и 1400 мл тетрагидрофурана. По завершении процесса добавления нагревают в течение 3 ч с обратным холодильником, затем охлаждают и реакционный раствор гидролизуют с помощью смеси из 80 мл воды и 400 мл тетрагидрофурана. После обработки карбонатом натрия и удаления неорганических компонентов продукт по обычным лабораторным методам выделяют из фильтрата. Сырой маслянистый продукт растворяют в органическом, не смешиваемом с водой растворителе и смешивают с определенным избытком соляной кислоты. Образовавшийся кристаллический продукт выделяют и сушат.
1Н-ЯМР (D6-ДМСО): 3,4 (m), 3,8 (m), 4,2 (m), 4,4 (m), 4,9 (m), 7,5 и 7,8 (ArH).
Температура плавления 240-242°С.
[α]D20=-22,4, с=1 в воде.
Дополнительные примеры
Описание экперимента
Алюмогидрид лития (270 г) в 180 г тетрагидрофурана нагревают в атмосфере азота. К реакционной смеси при перемешивании добвпяют раствор 60 г (2S)-N-карбоксиэтил-2-фенилглицин-N,N-[(3S)-гидрокситетраметиленамида] в 600 г тетрагидрофурана и смесь кипятят с обратным холодильником при перемешивании в течение 3 ч. Затем смесь охлаждают и при охлаждении гидролизуют добавлением смеси 160 мл воды и 30 г тетрагидрофурана. Органическую фазу отделяют, водную фазу промывают ТГФ, объединенные органические экстракты упаривают для удаления растворителя. После обычной обработки получают 39 г (выход 87%) N-метил-N-[(1S)-1-фенип-2-((3S)-гидроксипирролидин-1-ил)этанамина].
N-Метип-N-[(1S)-1-фенил-2-((3S)-гидроксипирролидин-1-ил)этанамина] (22 г) растворяют в 180 мл ТГФ в атмосфере азота и охлаждают до -5°С. Затем при температуре от -5 до 0°С в течение 120 мин по каплям добавляют раствор 27 г хлорангидрида дифенипуксусной кислоты в 35 мл тетрагидрофурна. Полученную суспензию перемешивают в течение еще 90 мин и, наконец, фильтруют при 0°С в вакууме. После обработки получают 43 г (выход 95%) гидрохлорида N-метил-N-[(1S)-1-фенил-2-((3S)-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамида в виде бесцветного твердого вещества.
Восстановление витридом
14,73 г (2S)-N-карбоксиэтил-2-фенилглицин-N,N-[(3S)-гидрокситетраметиленамида] растворяют в 250 мл тетрагидрофурана в атмосфере азота. Затем при перемешивании к смеси добавляют по каплям раствор 79,5 г витрида в толуоле (70% раствор). После добавления восстановителя реационную смесь нагревают при перемешивании в течение 3 ч. Затем реакционную смесь охлаждают и при охлаждении гидролизуют раствором 10 г карбоната натрия в 40 мл воды. Образовавшийся осадок отделяют фильтрованием и от фильтрата отделяют органическую фазу. Остаток (водную фазу) экстрагируют 100 мл ТГФ. Объединенные органические фазы сушат и удаляют растворитель. После обычной обработки получают 9,9 г (выход 89%) N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирро-лидин-1-ил)этаноамина. tпл. 246-248°С (дигидрохлорид) (газообразование/разложение).
Описание дополнительного эксперимента
S-Этиловый эфир [2-((3S)-3-гидроксипирролипин-1-ил)-2-оксо-(1S)-1-фенилэтил]метилтиокарбаминовой кислоты (соединение IIIα, tпл. 144°C) получали при взаимодействии этилсульфанилкарбонил-(2S)-аминофенилуксусной кислоты (соединение Iα, tпл. 123-125°С) с гидрохлоридом (3S)-3-гидроксипирролидина аналогично тому, как описано в примерах 2 и 3 настоящего изобретения.
0,9 г литийалюминийгидрида в атмосфере азота суспендируют в 20 мл сухого тетрагидрофурана и в течение 10 мин добавляют по каплям к перемешиваемому раствору 2,6 г соединения (IIIα) в 20 мл тетрагидрофурана. После прибавления реагента реакционную смесь кипятят с обратным холодильником при перемешивании в течение 3 ч, затем охлаждают до комнатной температуры и медленно добавляют смесь 1 мл воды и 5 мл тетрагидрофурана. Образовавшийся осадок отделяют фильтрованием, остаток на фильтре промывают 50 мл ТГФ и отбрасывают. Объединенные органические растворы упаривают в вакууме, остаток в виде масла кристаллизуется при хранении, при этом получают 2,17 г (84%) 1-[(3S)-3-гидроксипирролидин-1-ил]-2-(2S)-метиламино-2-фенилэтана (соединение IVα ).
Для необязательного получения дигидрохлорида кристаллическое вещество переносят в 40 мл метилацетата, фильтруют, фильтрат охлаждают до 10°С и смешивают с раствором соляной кислоты в этаноле. Смесь премешивают в течение 30 мин при 10°С, выпавший в осадок дигидрохлорид отделяют фильтрованием и высушивают в вакууме, при этом получают дигидрохлорид соединения IVα. tпл. 247-248°С (газообразование/разложение).
Физические данные (ЯМР) соединений (Iα), (IIα), (IIIα) и (IVα)

Приложение
Клинические испытания приведены с целью демонстрации эффекта воздействия полученного по п.7 соединения ("асимадолин") как нового агониста периферических каппа-опиатных рецепторов на боль, индуцируемую ректальным вздутием живота у больных с синдромом раздраженной толстой кишки (СРК).
Асимадолин является новым агонистом периферических каппа-опиоидных рецепторов, которые принимают участие в передаче сигналов на висцеральные афференты.
Целью исследования было оценить воздействие асимадолина на характер восприятия толстого кишечника путем измерения вздутия левой части толстой кишки у пациентов, страдающих СКР, с помощью баростата (барометрический контактный датчик).
Пациенты и метод
Эксперимент проводили с участием двадцати пациенток, страдающих СРК (40+/-13у по критерию Роме). Барометрический мешочек (10 см, 700 мл) вводили в левую толстую кишку во время колоноскопии под анестезией (протокол IV). На следующие сутки (день 1) у пациентов натощак в 9 ч вызывали серию вздутий, повышая давление в мешочке (с интервалами 5 мм рт. ст., продолжительность 5 мин) вплоть до болезненных ощущений (фоновое вздутие). Затем пациентов с болевым порогом, равным или ниже 32 мм рт. ст., рандомизировали двойным контролируемым испытанием: в 15 час пациентам вводили однократную пероральную дозу асимадолина 0,5 мг или плацебо, а в 16 час вызывали серию вздутий по указанной схеме. На вторые сутки с пациентами проводили аналогичные испытания, но в обратном порядке. Ответную реакцию на вздутие характеризовали давлением внутри мешочка, вызывающим болевое ощущение на уровне 4 баллов или более, которое оценивали по шестибальной вербальной шкале. Кроме того, сравнивали AUC (среднечисленное значение) ответных реакций, фиксированных при интервалах давления от 5 до 40 мм рт. ст. На каждой стадии вздутия регистрировали объем мешочка, а для определения упругости толстой кишки строили индивидуальные кривые зависимости давление-объем.
Результаты
Ответные реакции пациентов по сравнению с фоновыми вздутиями были по всем параметрам совершенно идентичными в первые и вторые сутки. Болевой порог при давлении (среднее значение SD) было выше при введении 0,5 мг асимадолина (29,8 7,2 мм рт. ст.), чем при введении плацебо (26,3 7,8 мм рт. ст.) (NS). Однако AUC интенсивности боли, указанной пациентами на каждой стадии прироста давления, расчитанное при анализе LOCF в диапазоне давлений от 5 до 40 мм рт. ст., было существенно ниже при введении 0,5 мг асимадолина (89,3 33,9 мм рт. ст.), чем при введении плацебо (101,1 29,7 мм рт. ст.) (Р=0,0411). Кроме того, средняя балльная оценка боли была существенно ниже при введении 0,5 мг асимадолина при вздутии на уровне 20 мм рт. ст. (Р=0,0243) и имела тенденцию к снижению при 25 и 30 мм рт.ст. (Р=0,0576) по сравнению с плацебо. И напротив, асимадопин не оказывал влияния на ощущение боли ни при безболезненных вздутиях, ни при оценке упругости толстой кишки, рассчитанной как наклон кривой давление-объем.
Выводы
Асимадолин при разовом пероральном введении дозы 0,5 мг снижает ощущение болезненных вздутий толстой кишки у пациентов (женщин), страдающих СРК, не оказывая воздействия на упругость толстой кишки.
Таким образом, приведенные данные свидетельствуют о крайне перспективном возможном новом способе лечения СРК.
Реферат
Изобретение относится к способу получения N-метил-N-[(1S)-1-фенил-2-((3S)-3-гидроксипирролидин-1-ил)этил]-2,2-дифенилацетамида и заключается в том, что
а) N-замещенное производное фенилглицина формулы I

где R означает OR1, SR1;
R1 означает А, бензил, незамещенный фенил, одно- или двузамещенный галоидом, ОА или C1-С6алкилом фенил, бифенил или нафтил;
А означает линейный или разветвленный C1-С6алкил;
М означает Н или катион из группы, включающей щелочные металлы, щелочно-земельные металлы, аммоний или алкиламмоний, подвергают взаимодействию с соединением формулы II

в которой R2 обозначает Н, А, или с кислотно-аддитивной солью соединения формулы II кислот HCl, HBr, HI, Н2SO4, Н3РО4 либо органической карбоновой кислоты с получением соединения формулы III

в которой R и R2 имеют указанные выше значения;
б) затем путем восстановления превращают в соединение формулы IV

которое необязательно переводят в кислотно-аддитивную соль кислот HCl, HBr, HI, Н2SO4, Н3PO4 или в соль органической карбоновой кислоты, и
в) полученное таким путем соединение формулы IV подвергают взаимодействию с активированной карбоновой кислотой формулы V

в которой R4 обозначает F, Cl, Br, I, ОА или O-СО-А, с получением соединения формулы VI

которое необязательно с помощью неорганической кислоты, выбранной из группы, включающей HCl, HBr, HI, серную кислоту, сульфаминовую кислоту, азотную кислоту, фосфорную кислоту, ортофосфорную кислоту, или с помощью органической кислоты переводят в соответствующую кислотно-аддитивную соль. 2 н. и 5 з.п. ф-лы.
Формула





Комментарии