Топливные композиции, содержащие производные изопрена - RU2531623C2
Код документа: RU2531623C2
Чертежи



















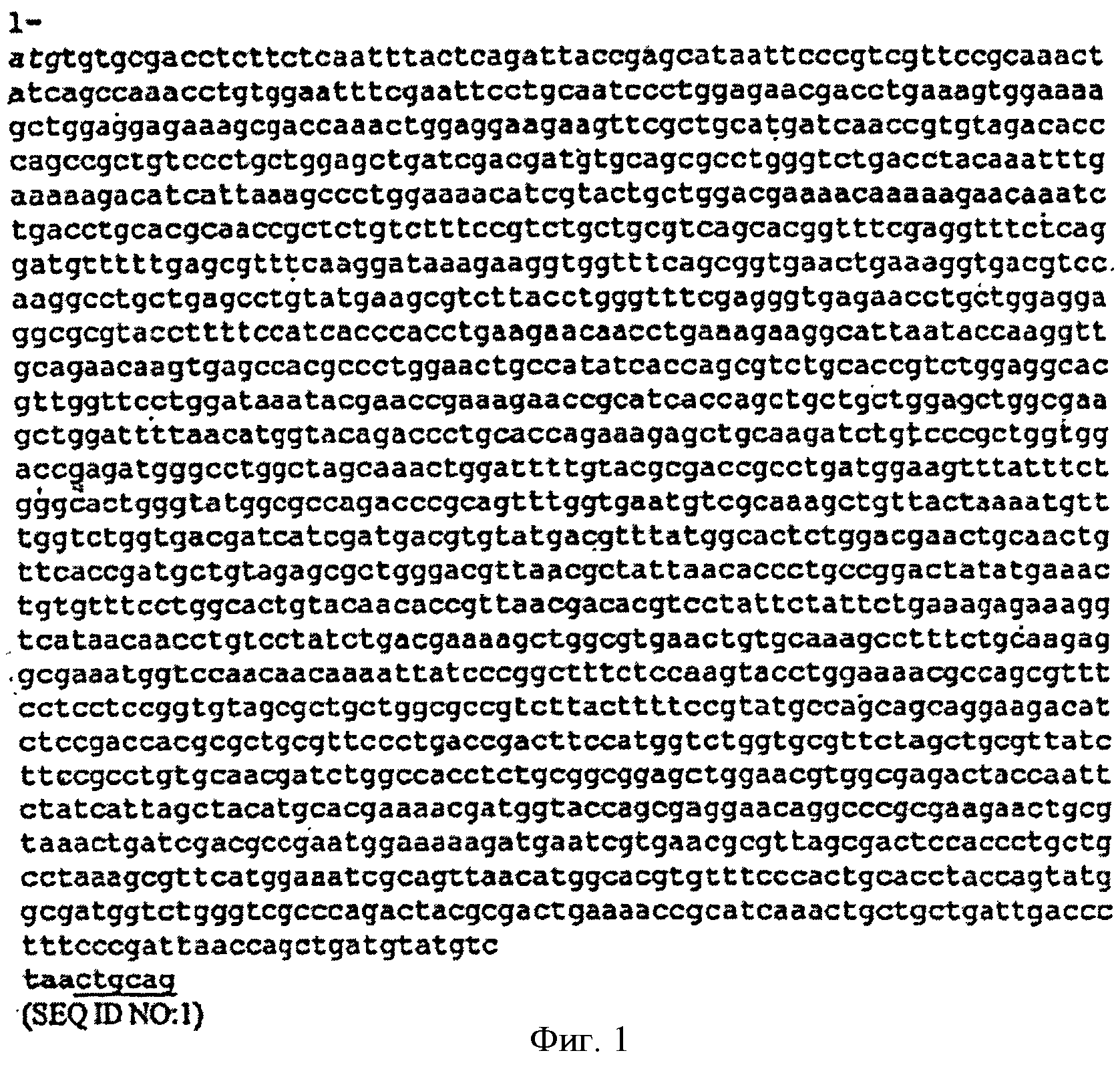
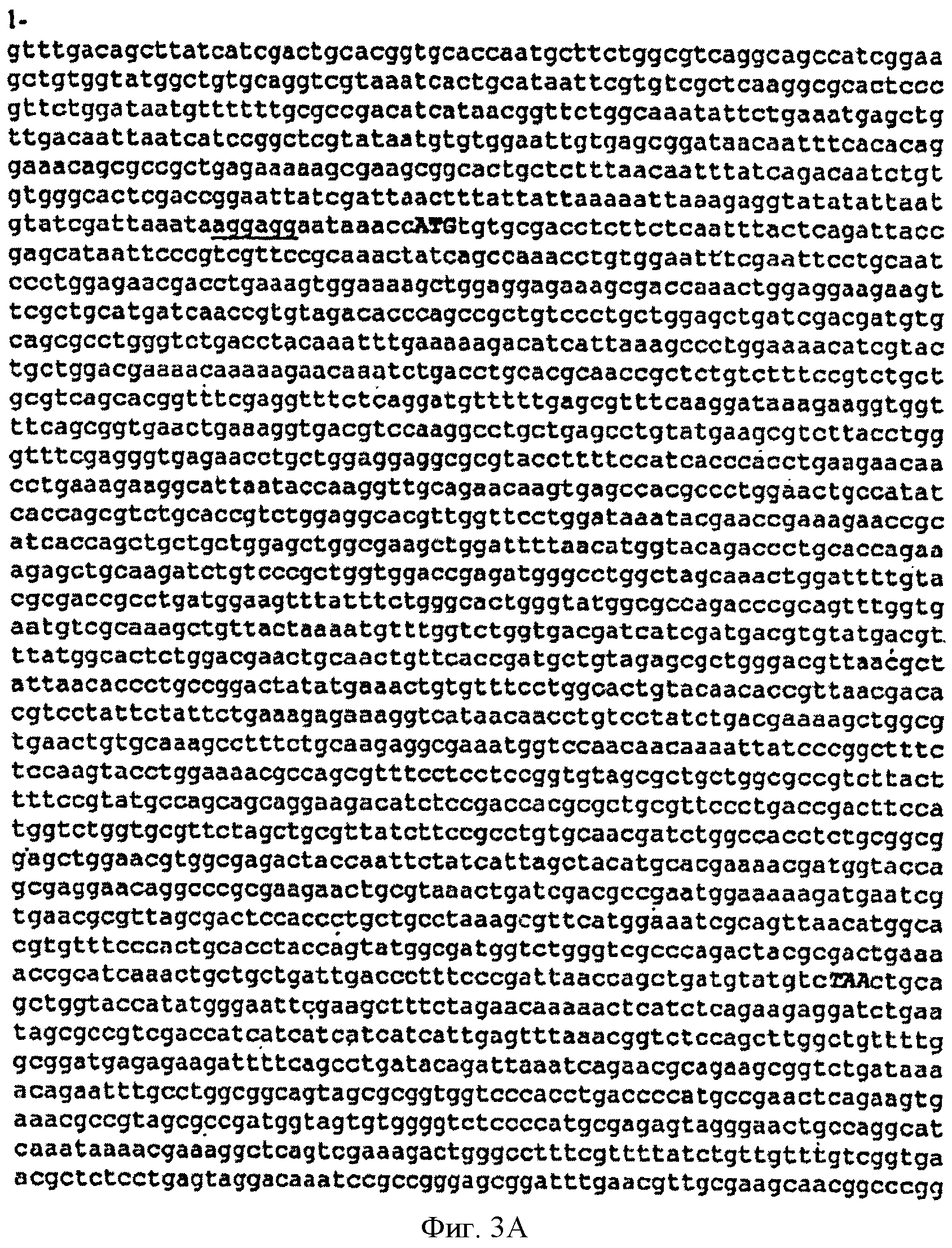
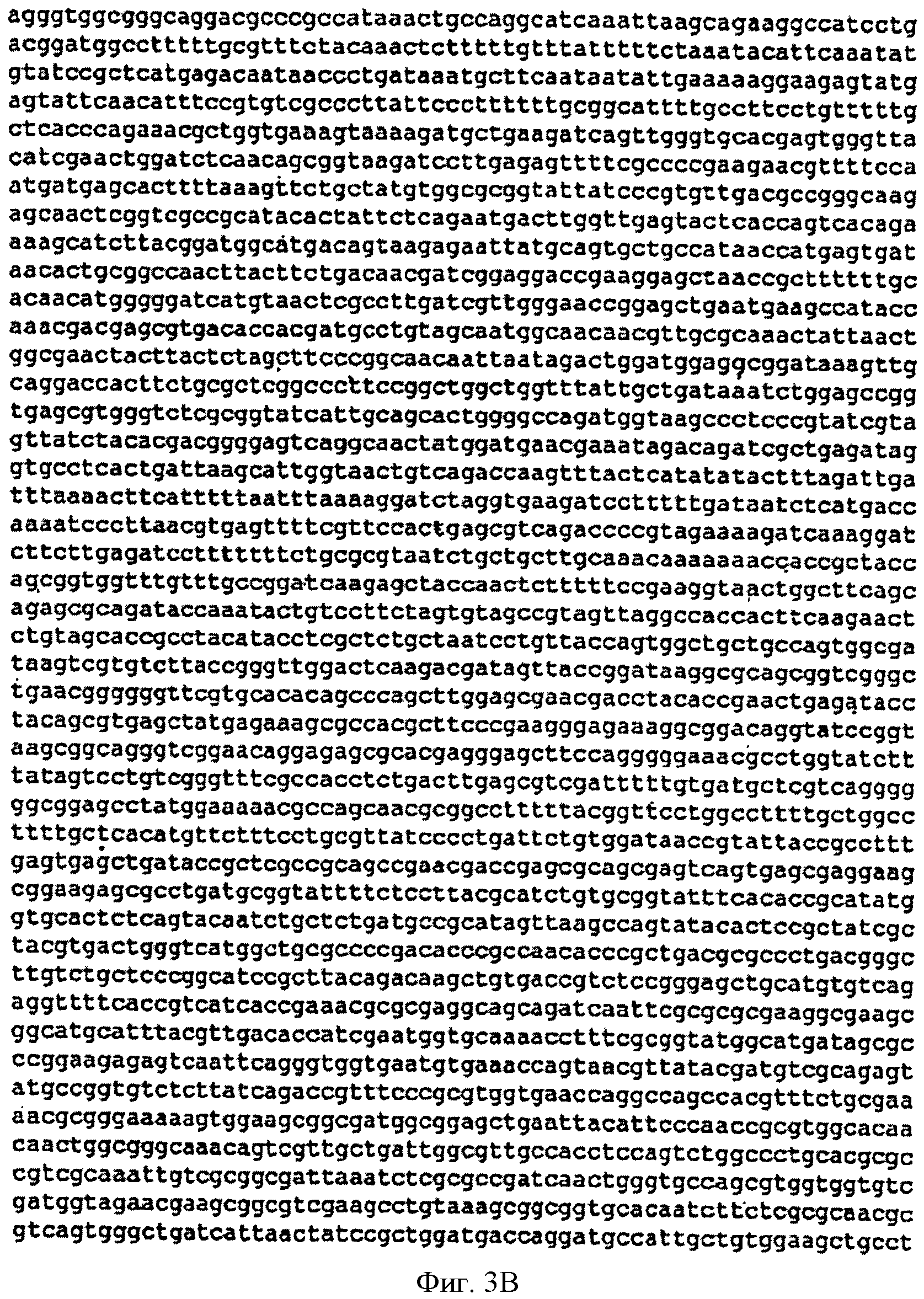
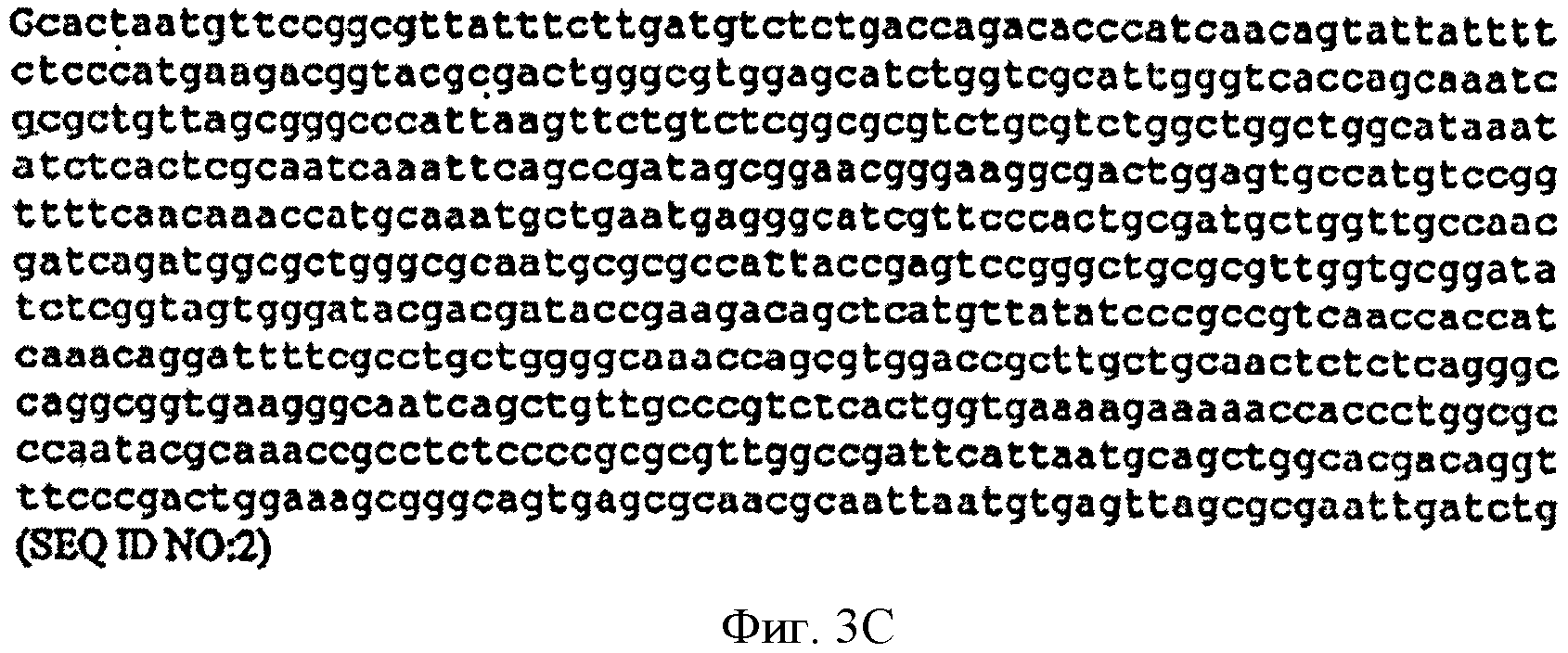
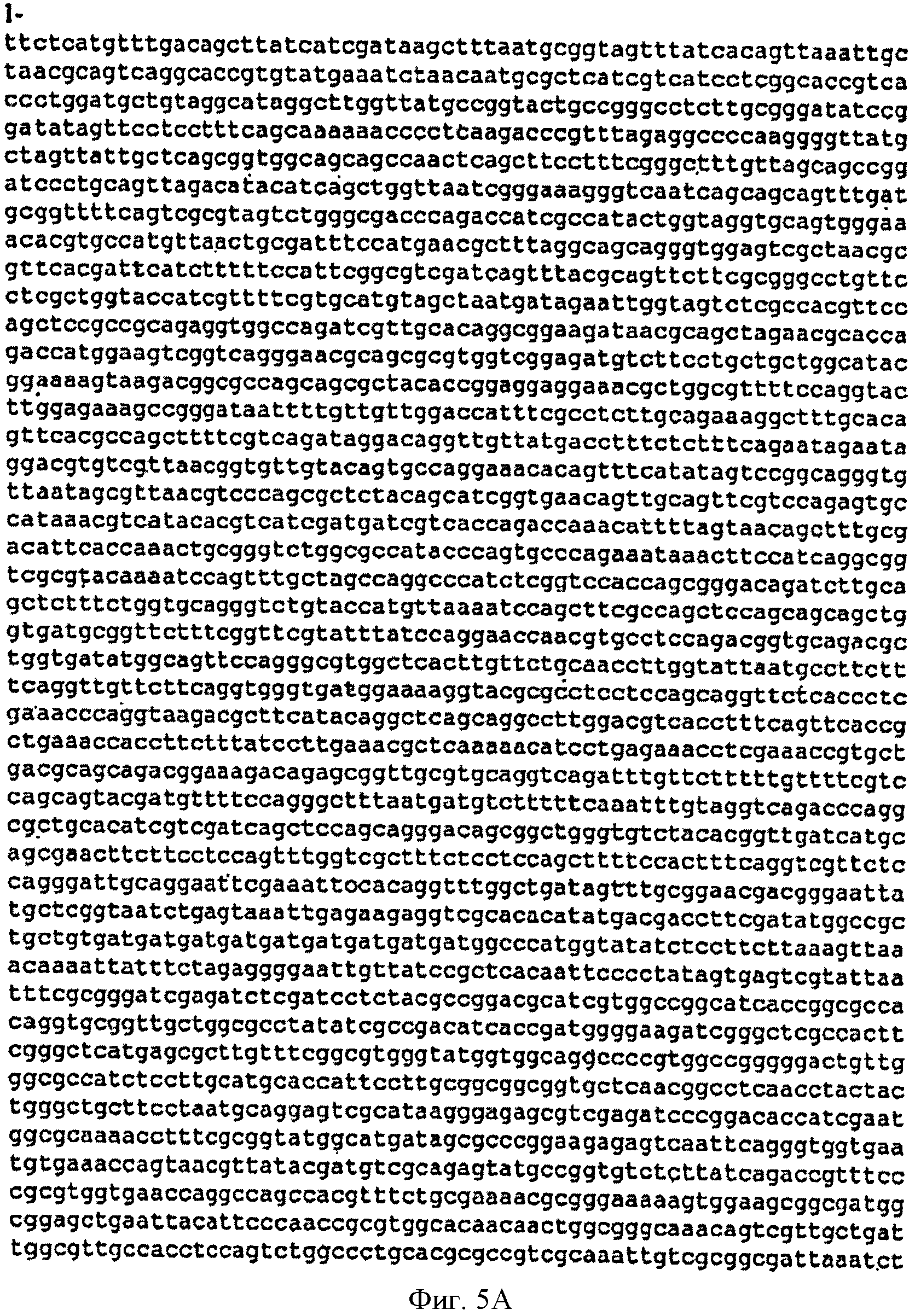
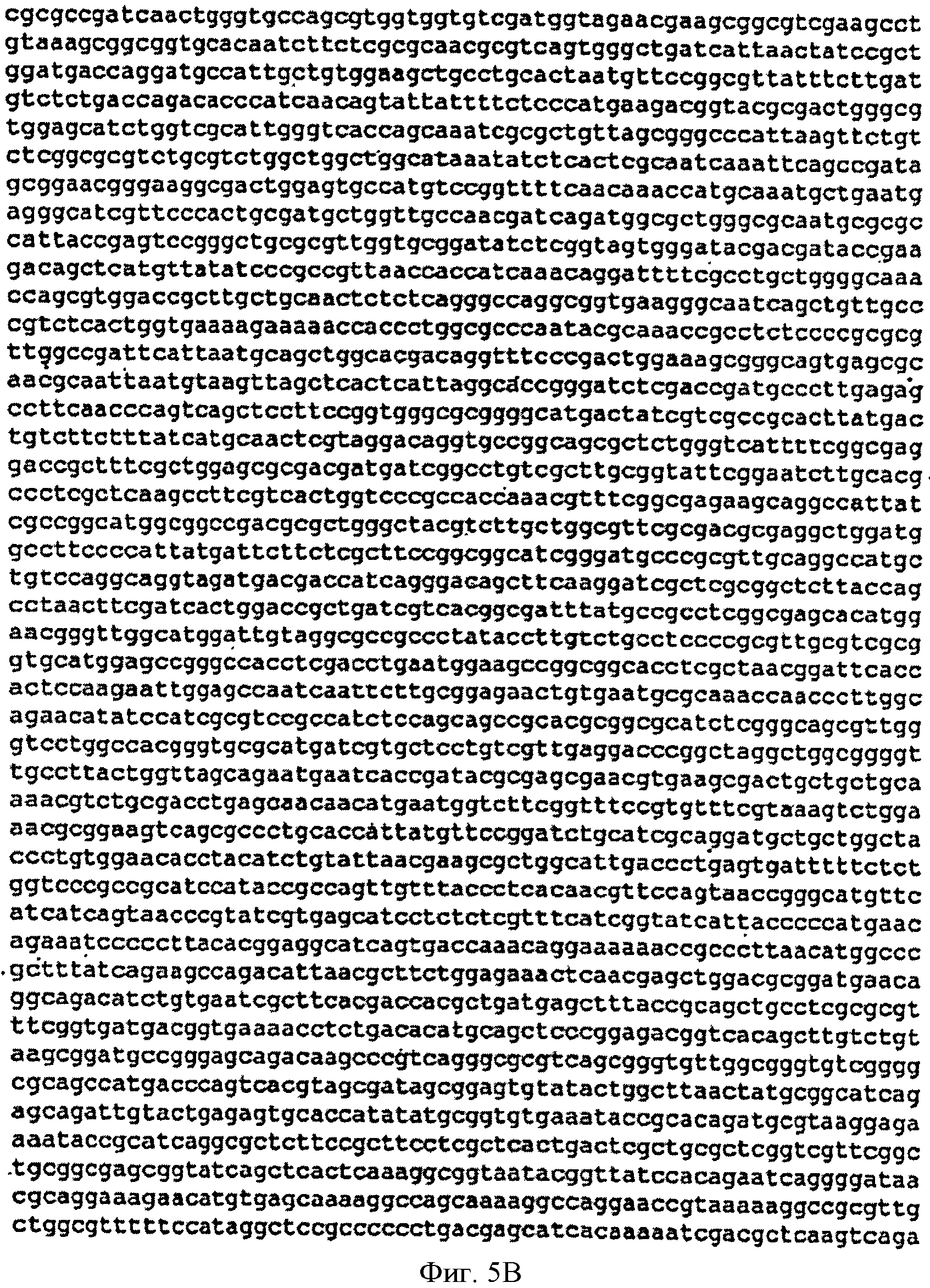

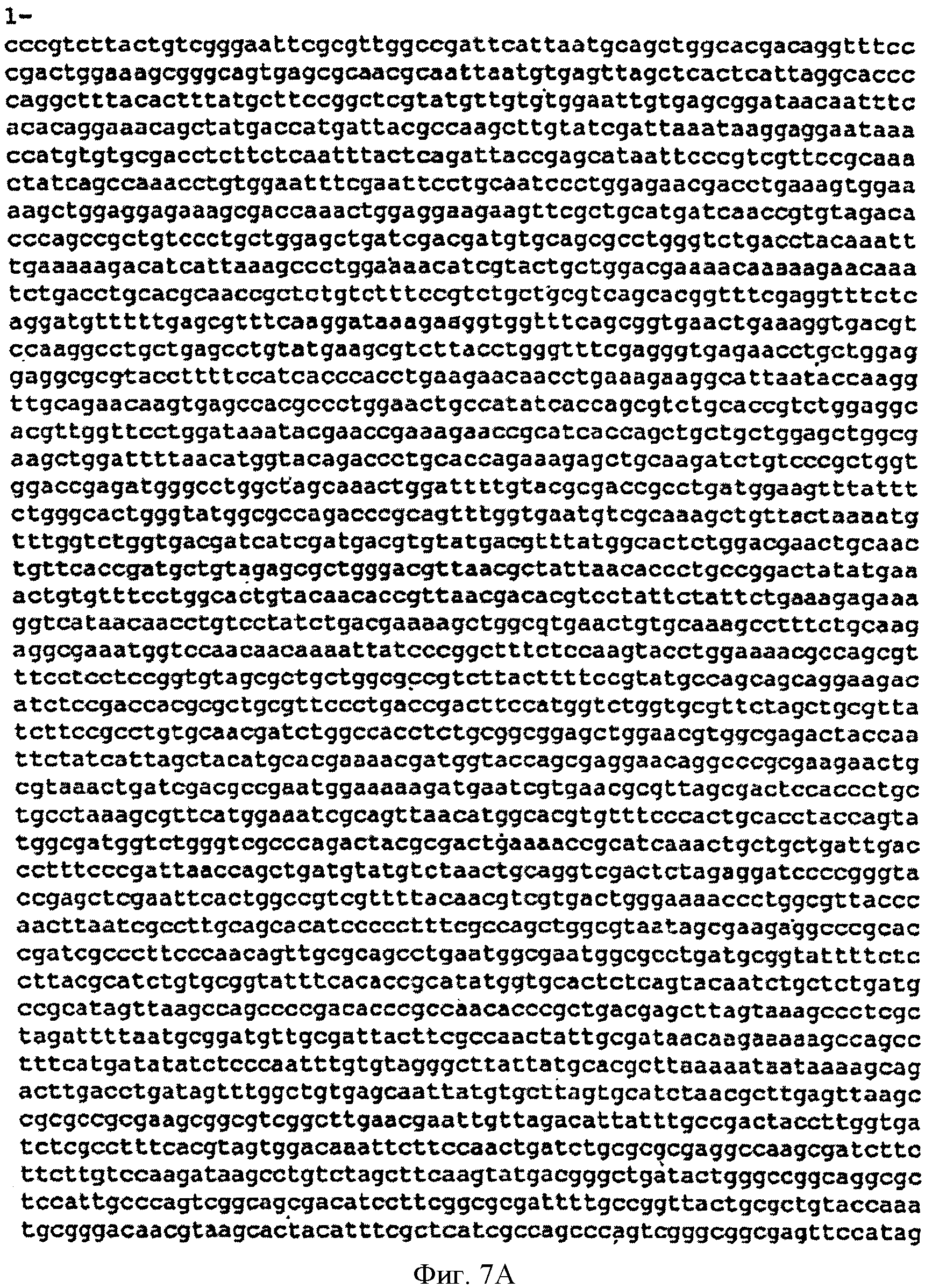
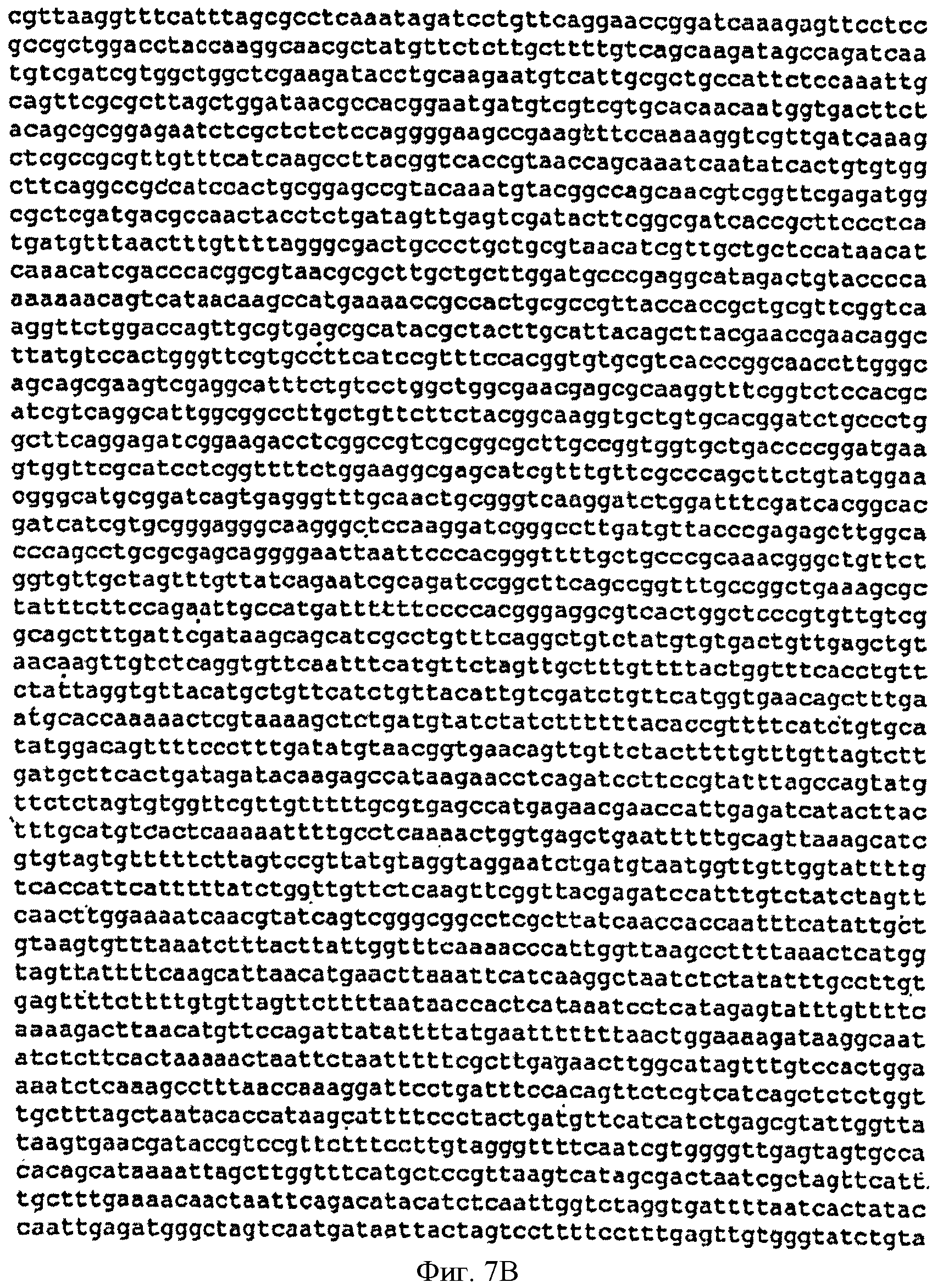
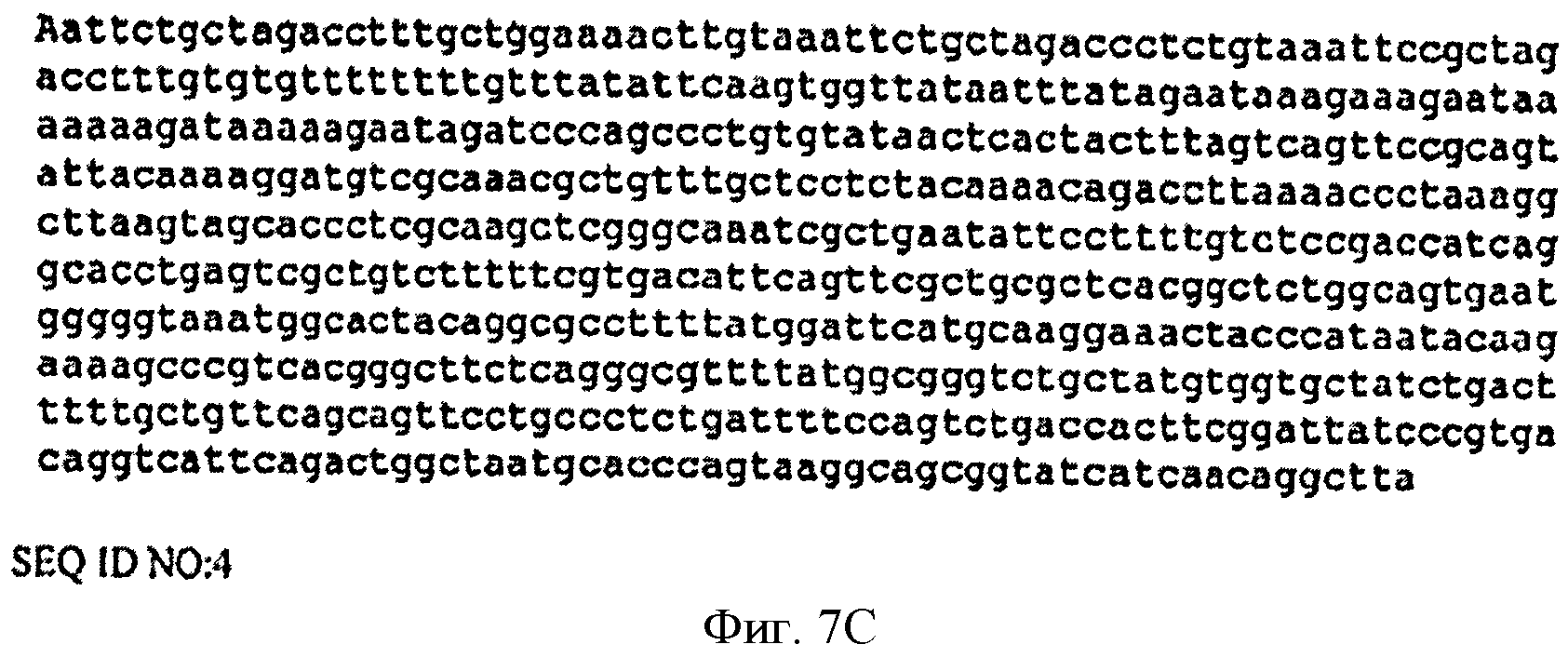

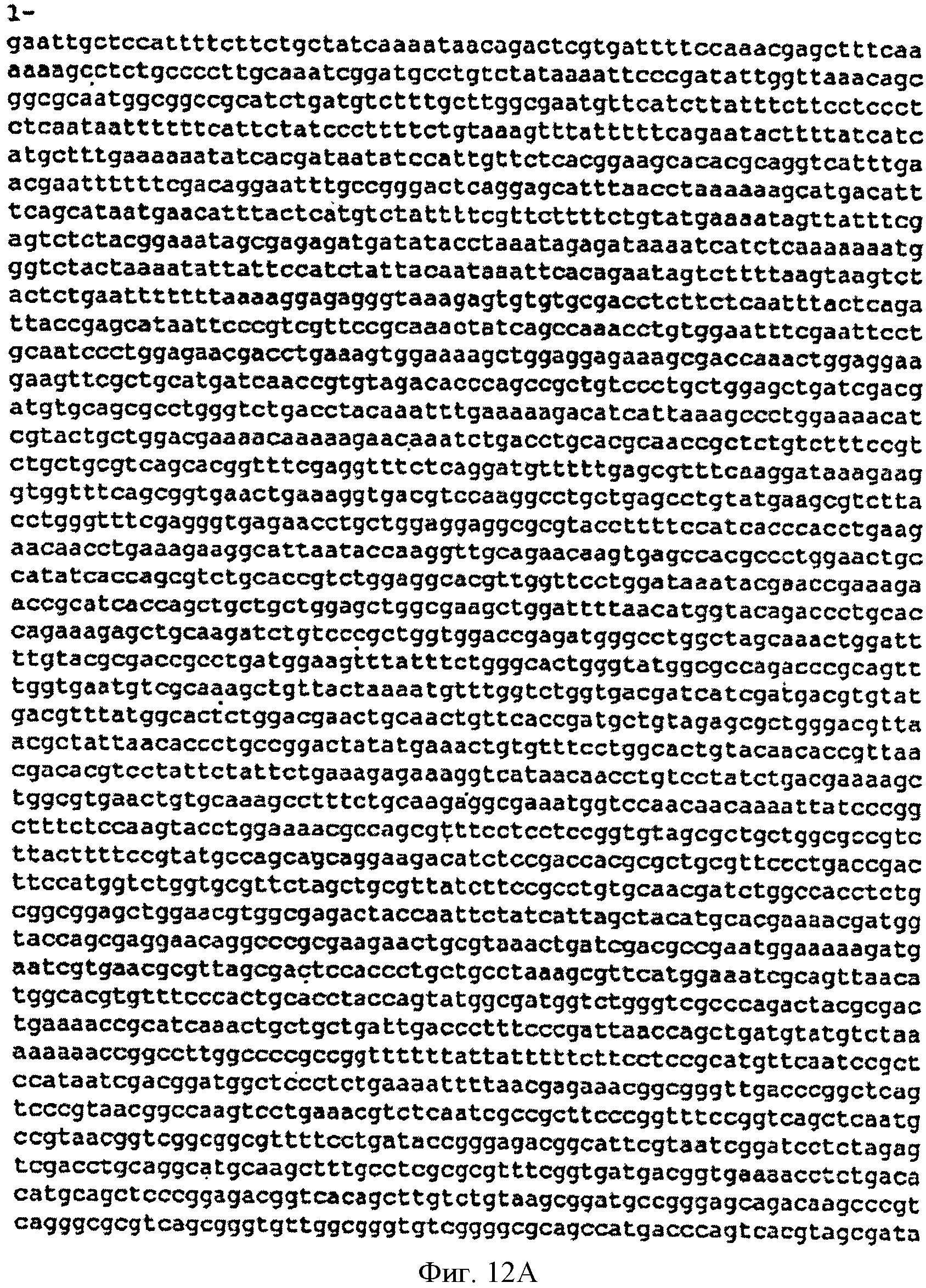
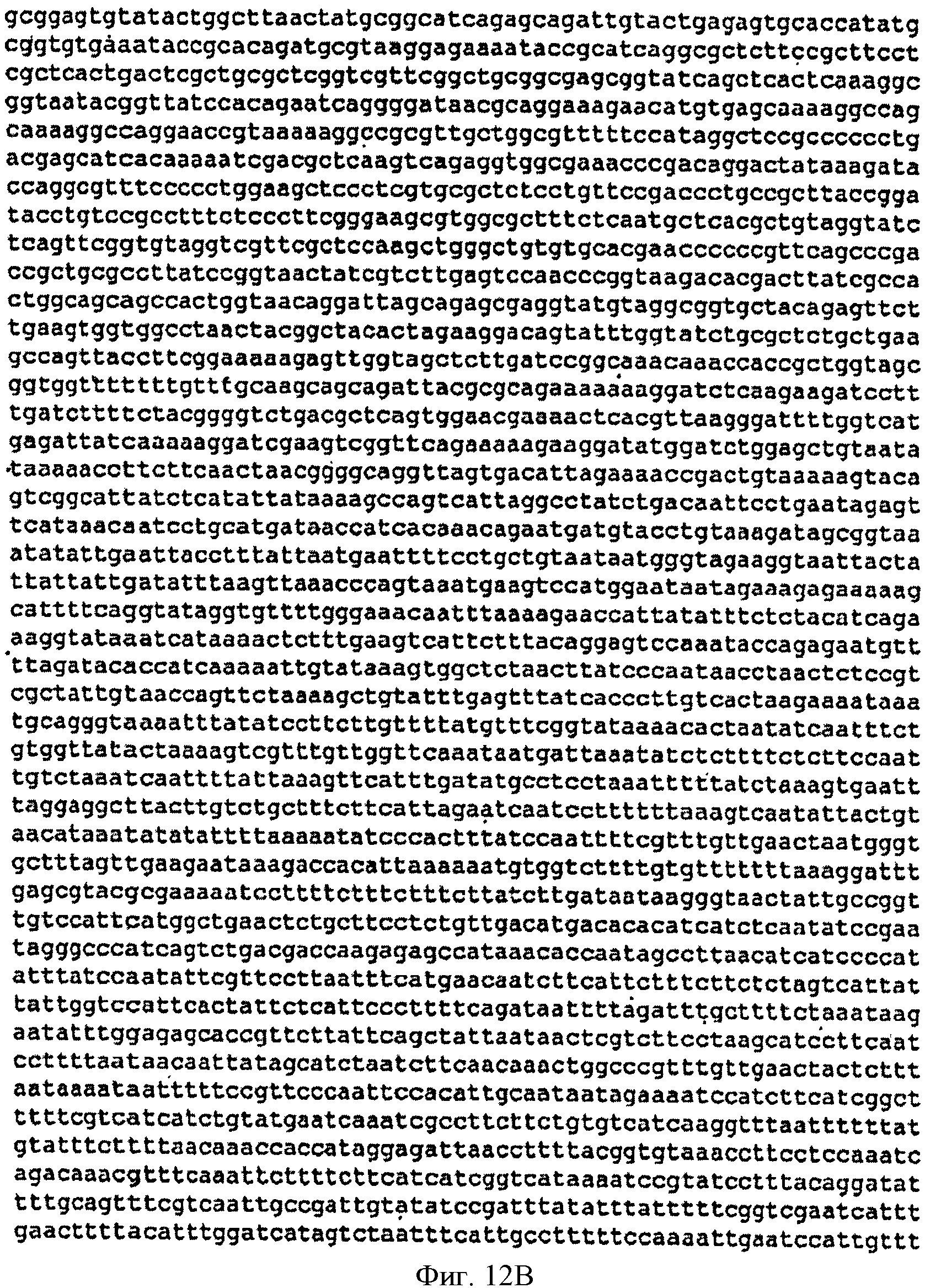
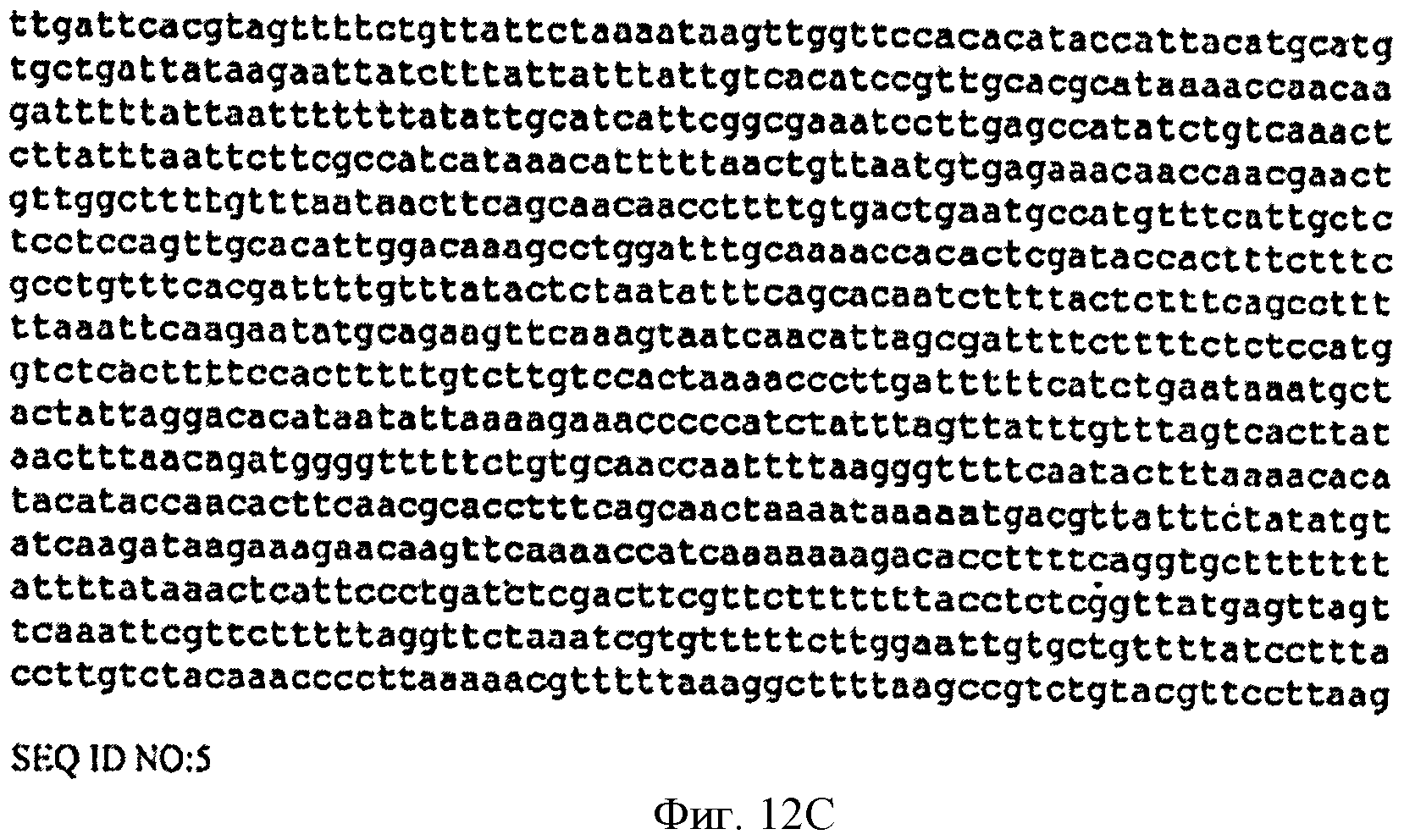
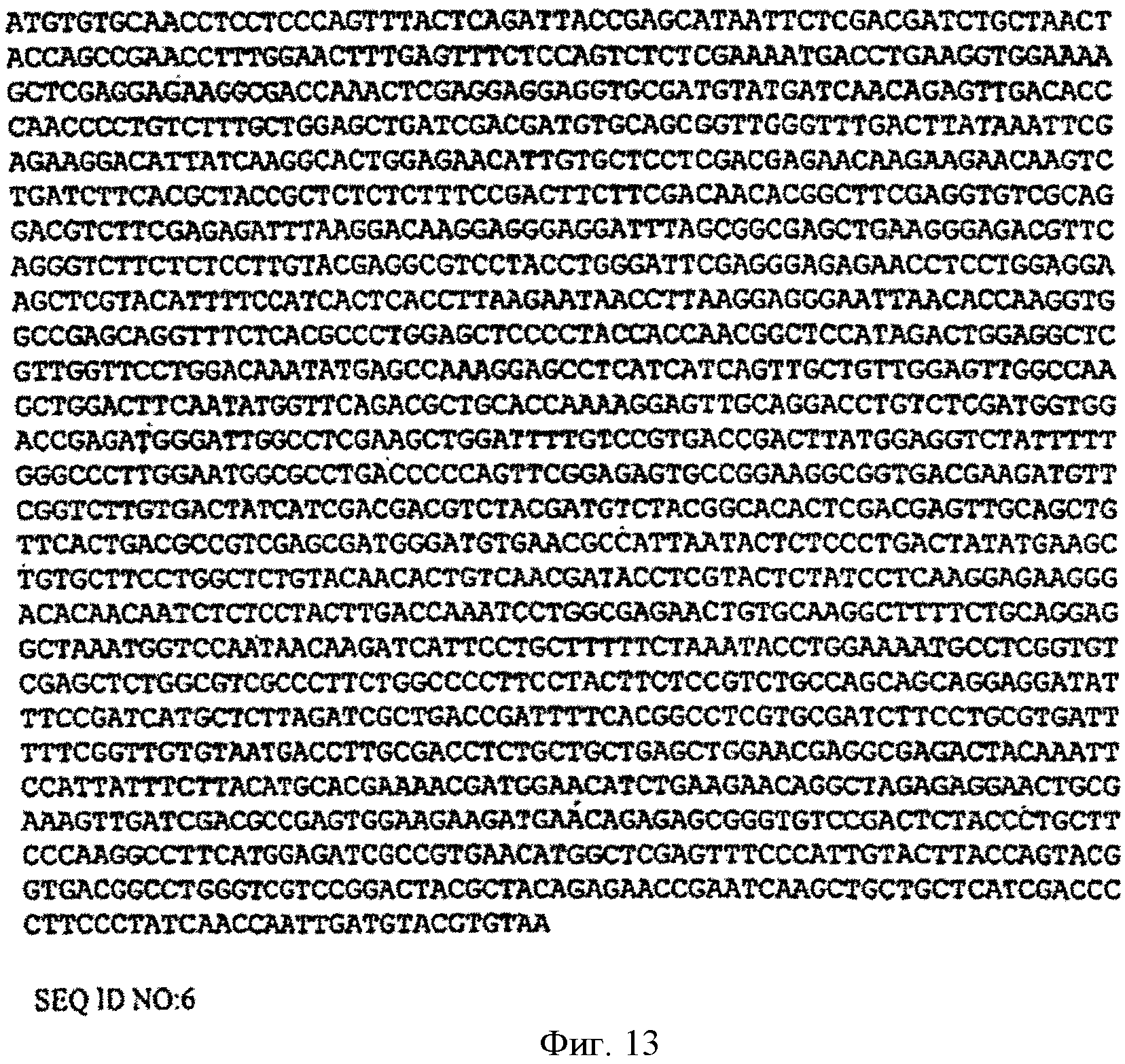


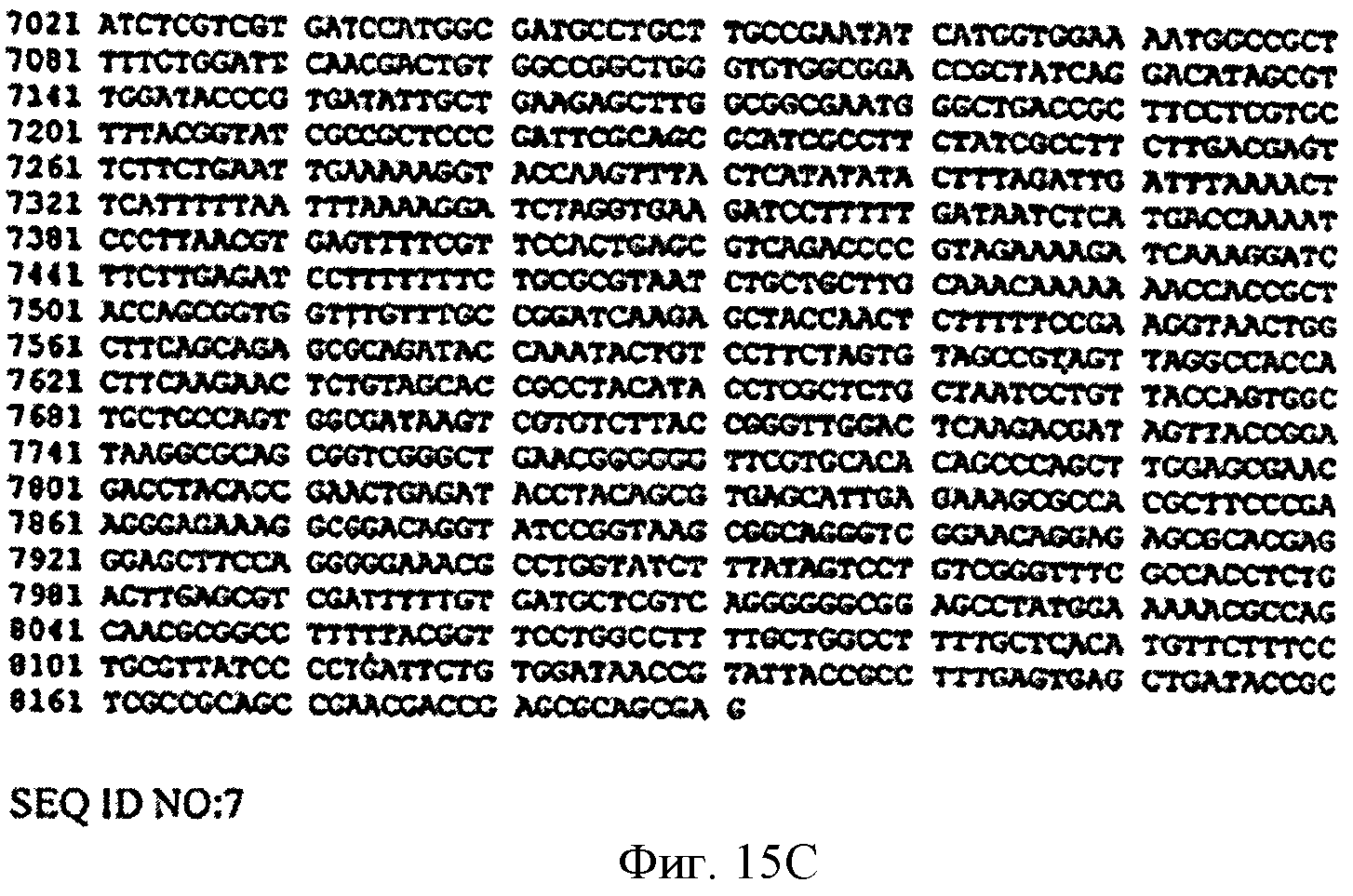










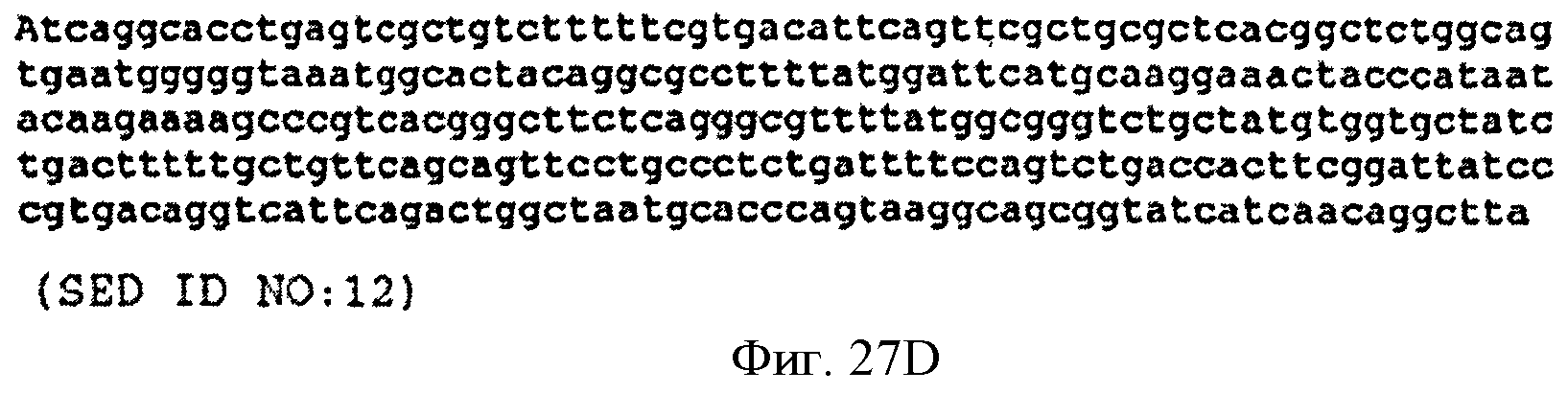
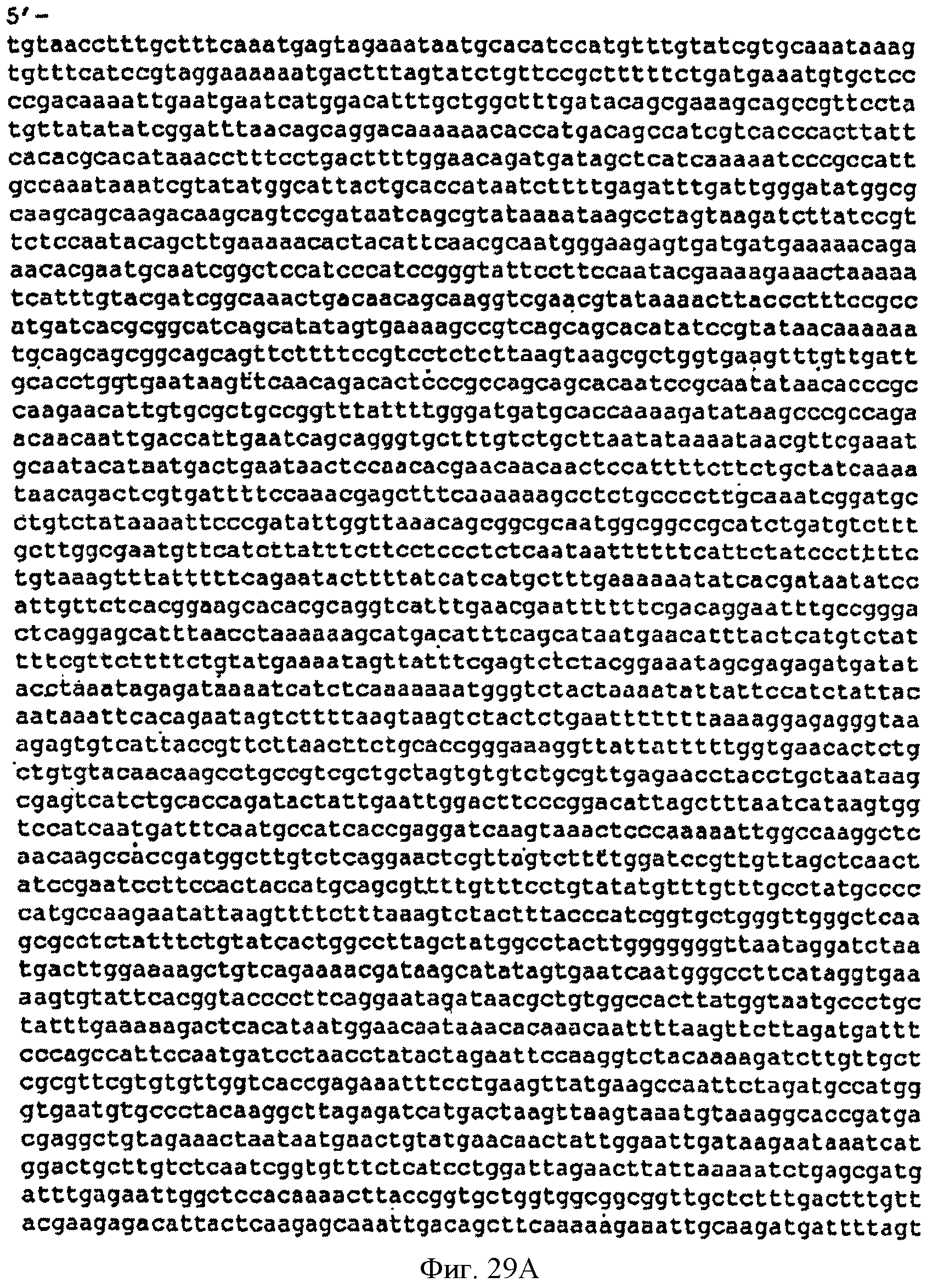
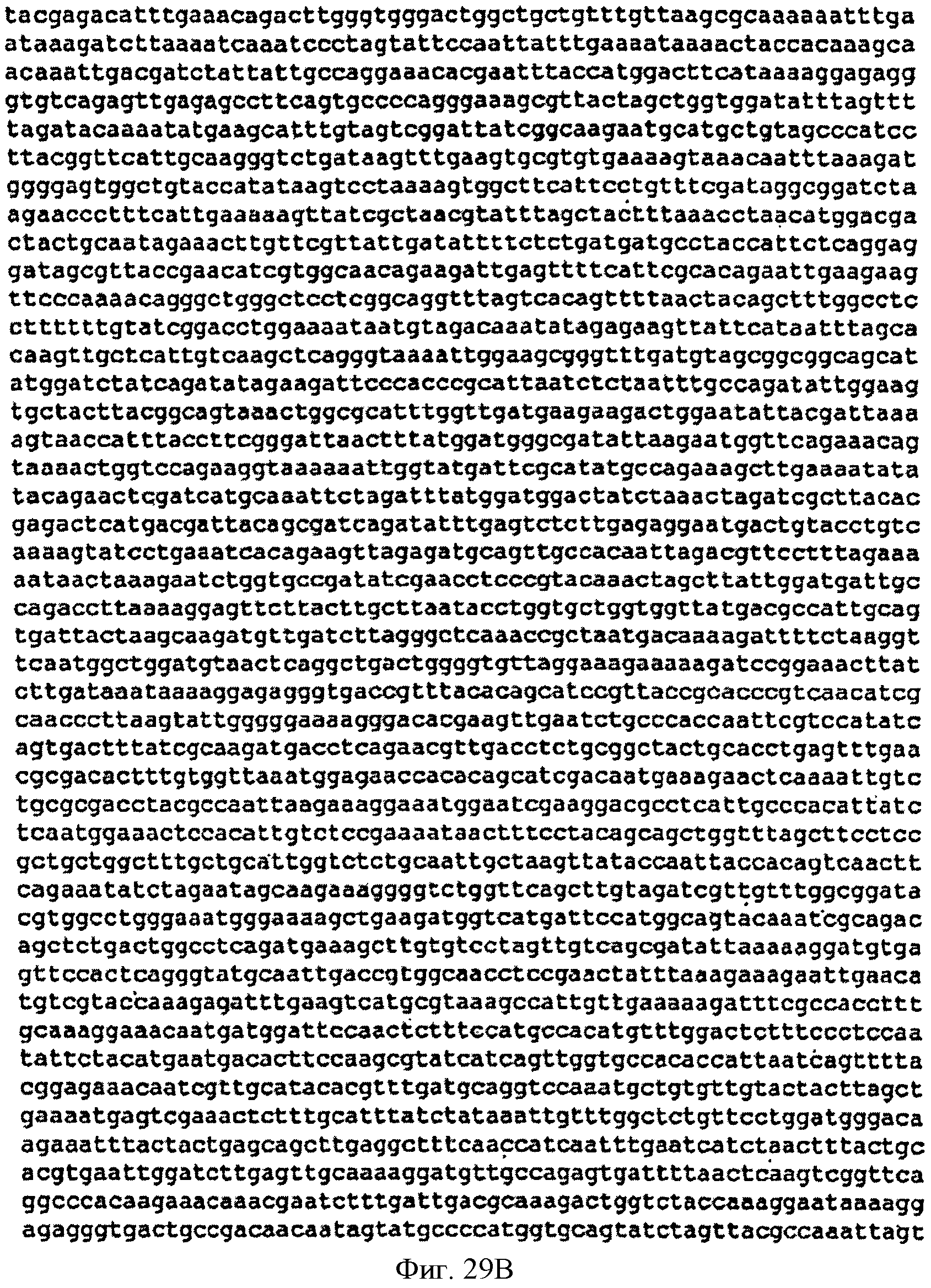
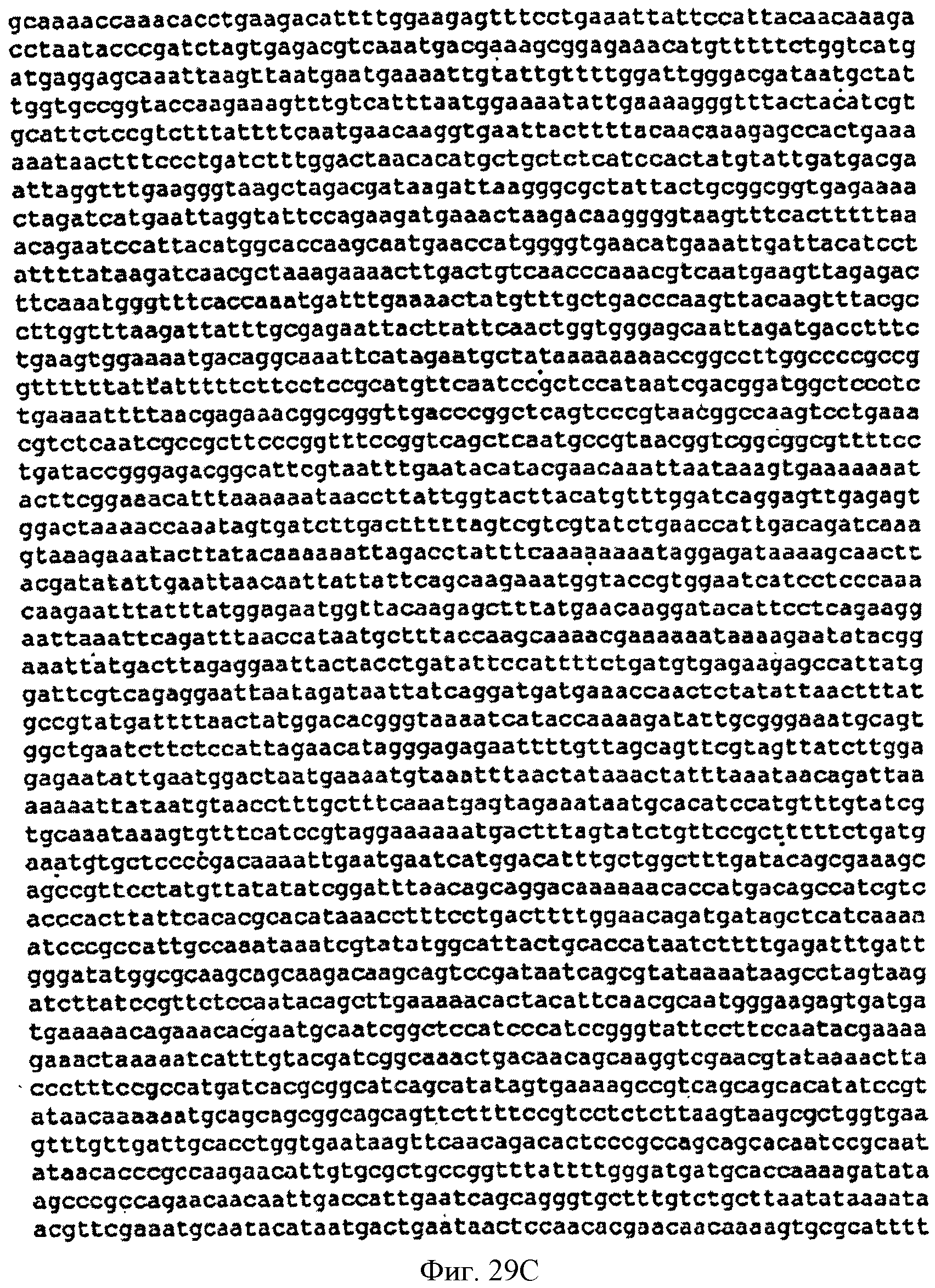
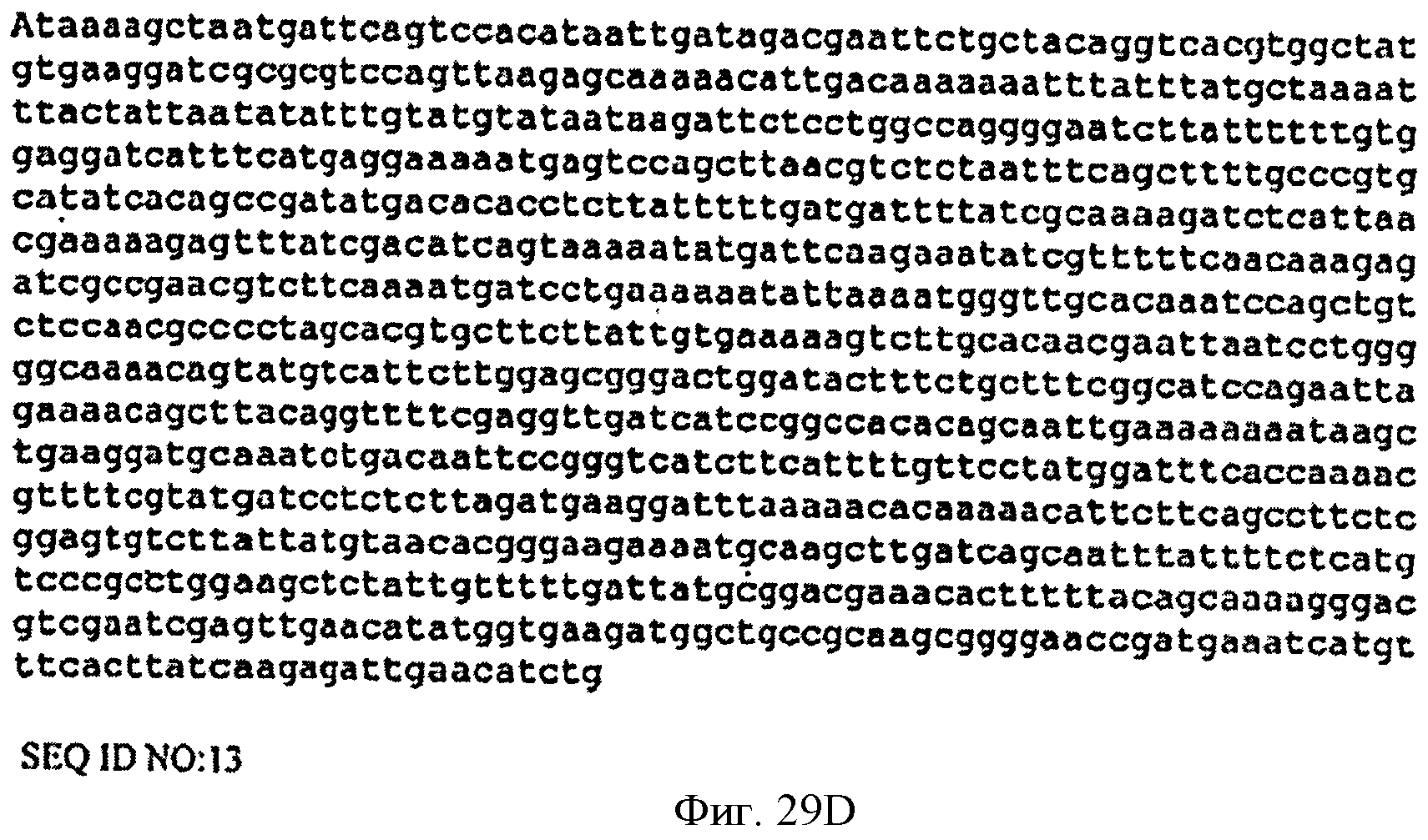
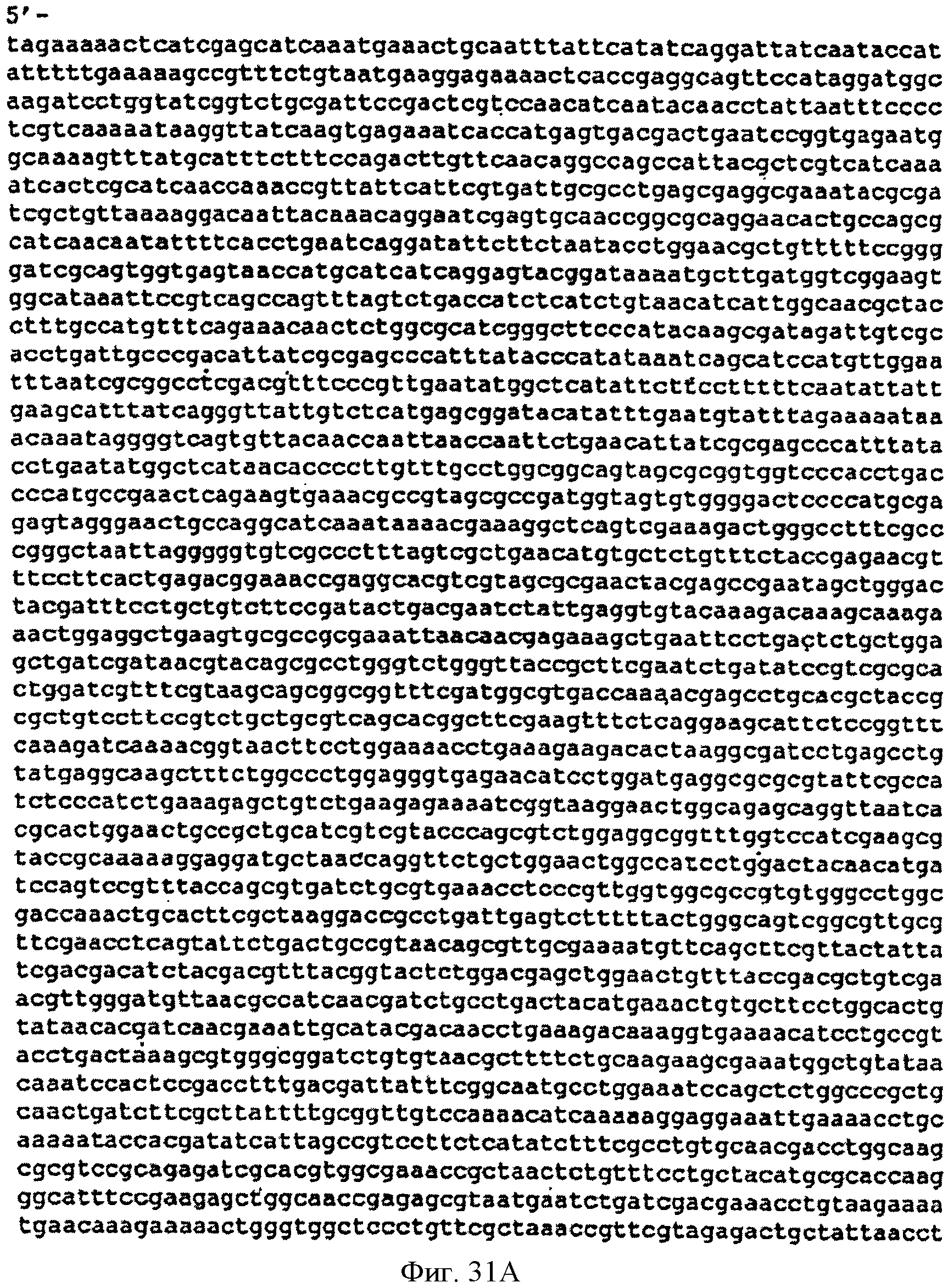
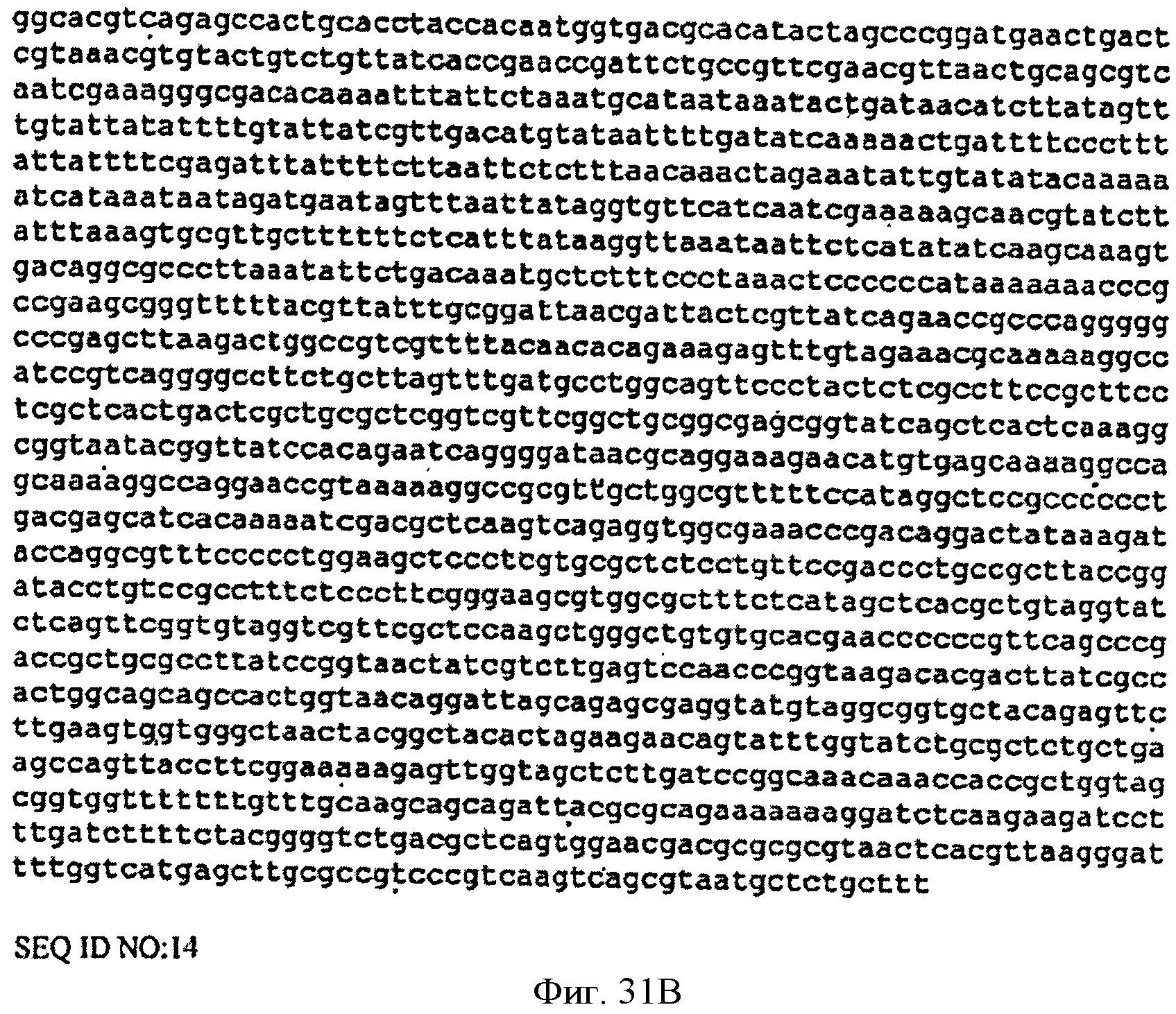

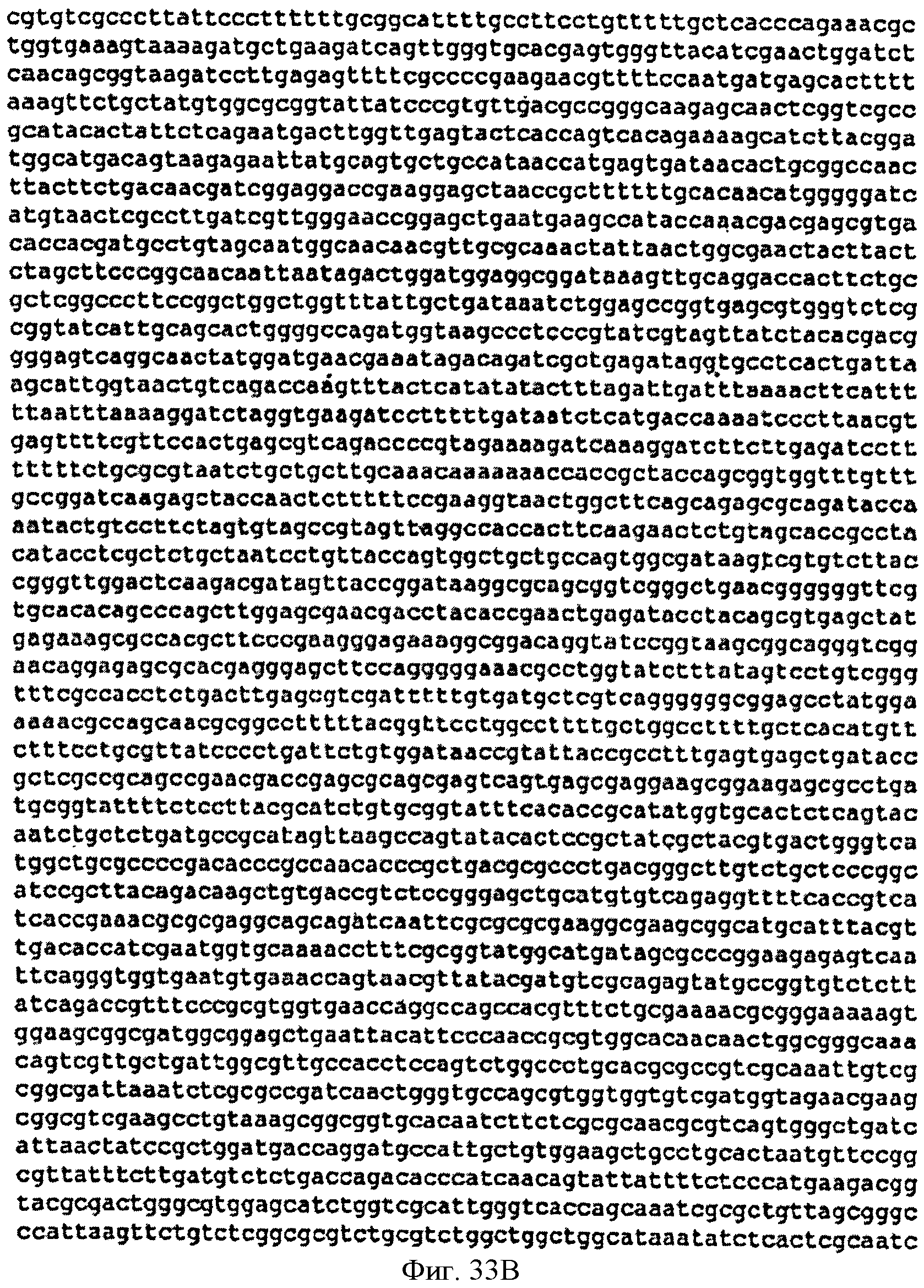
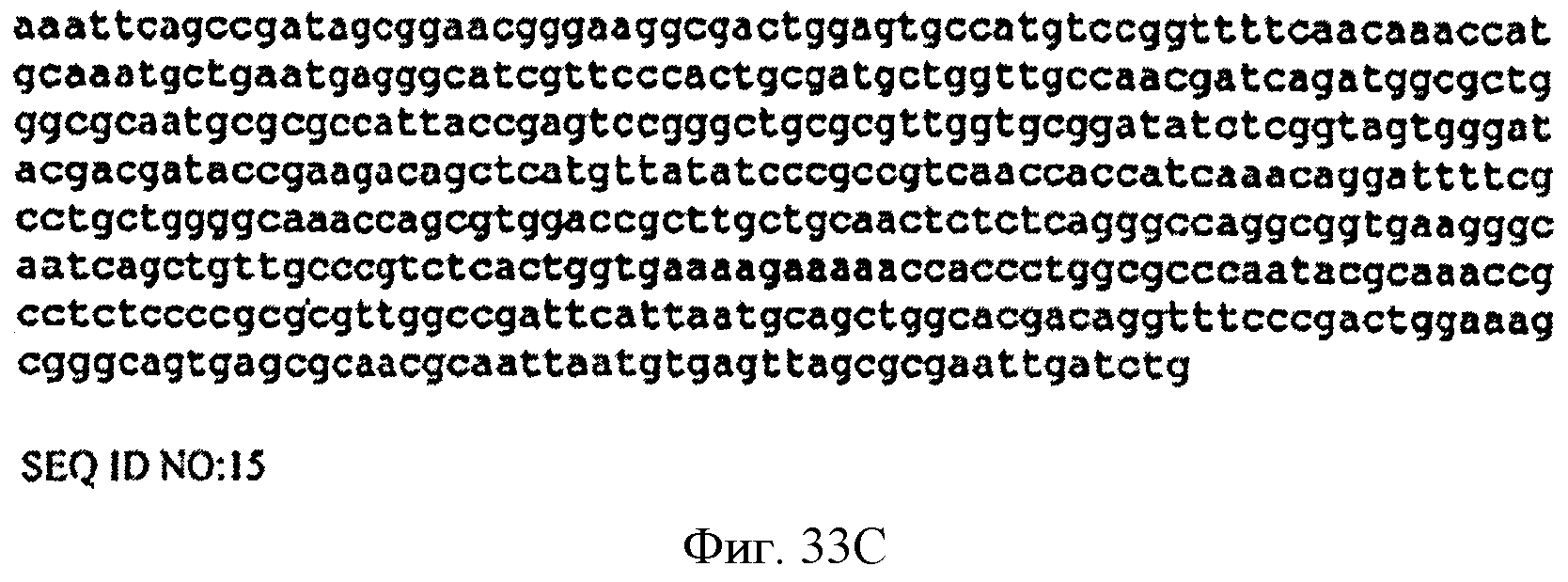
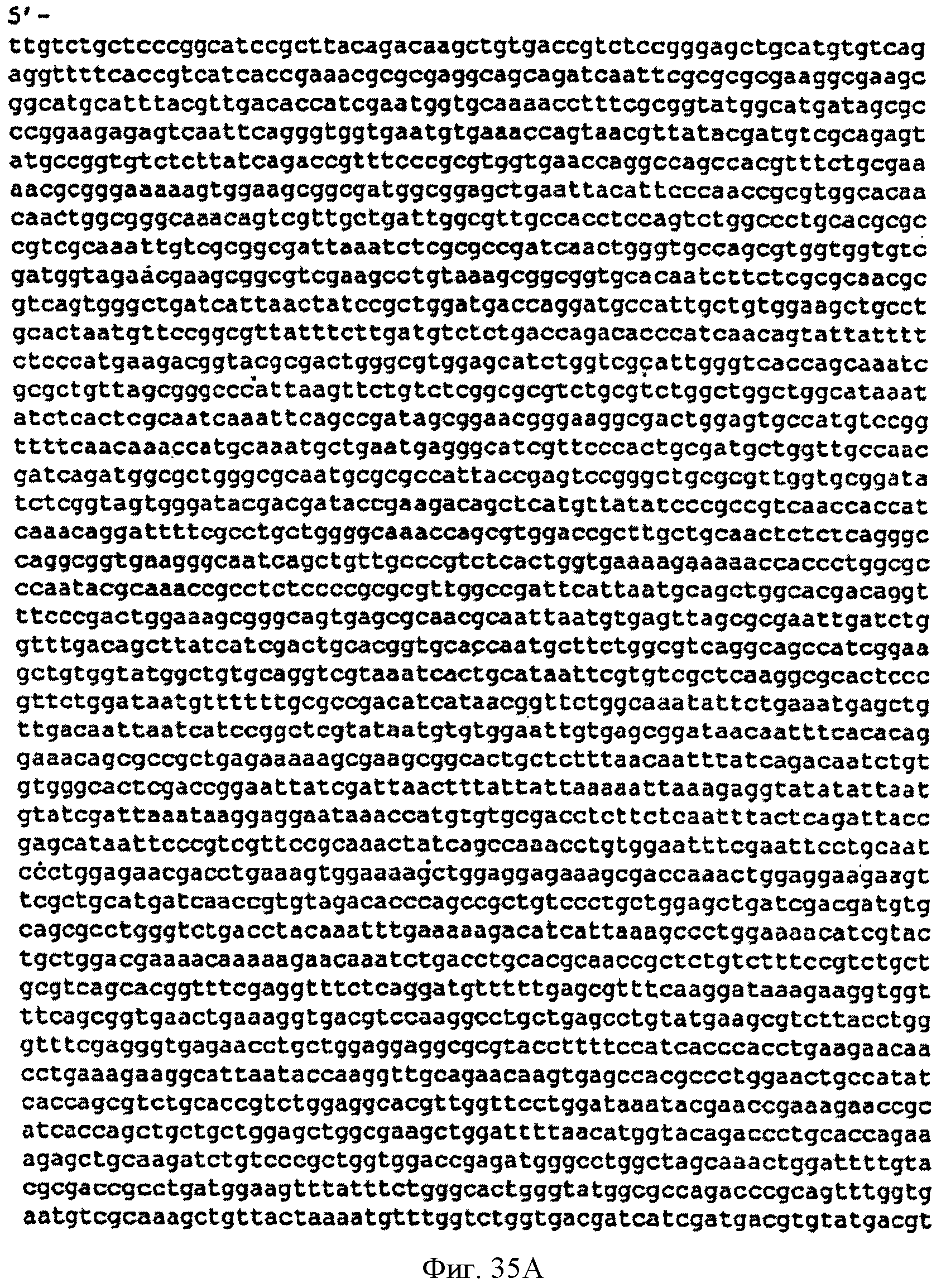
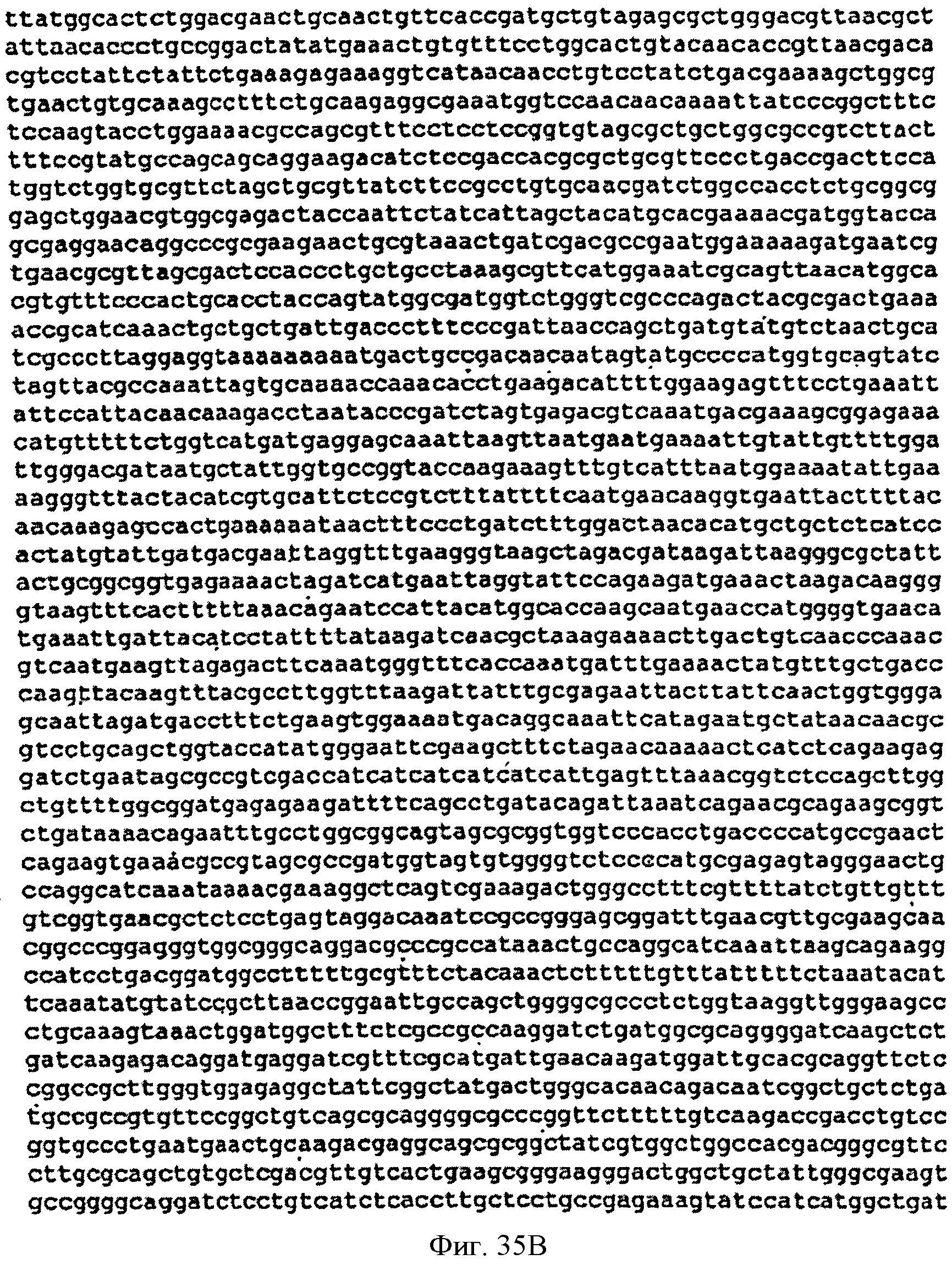
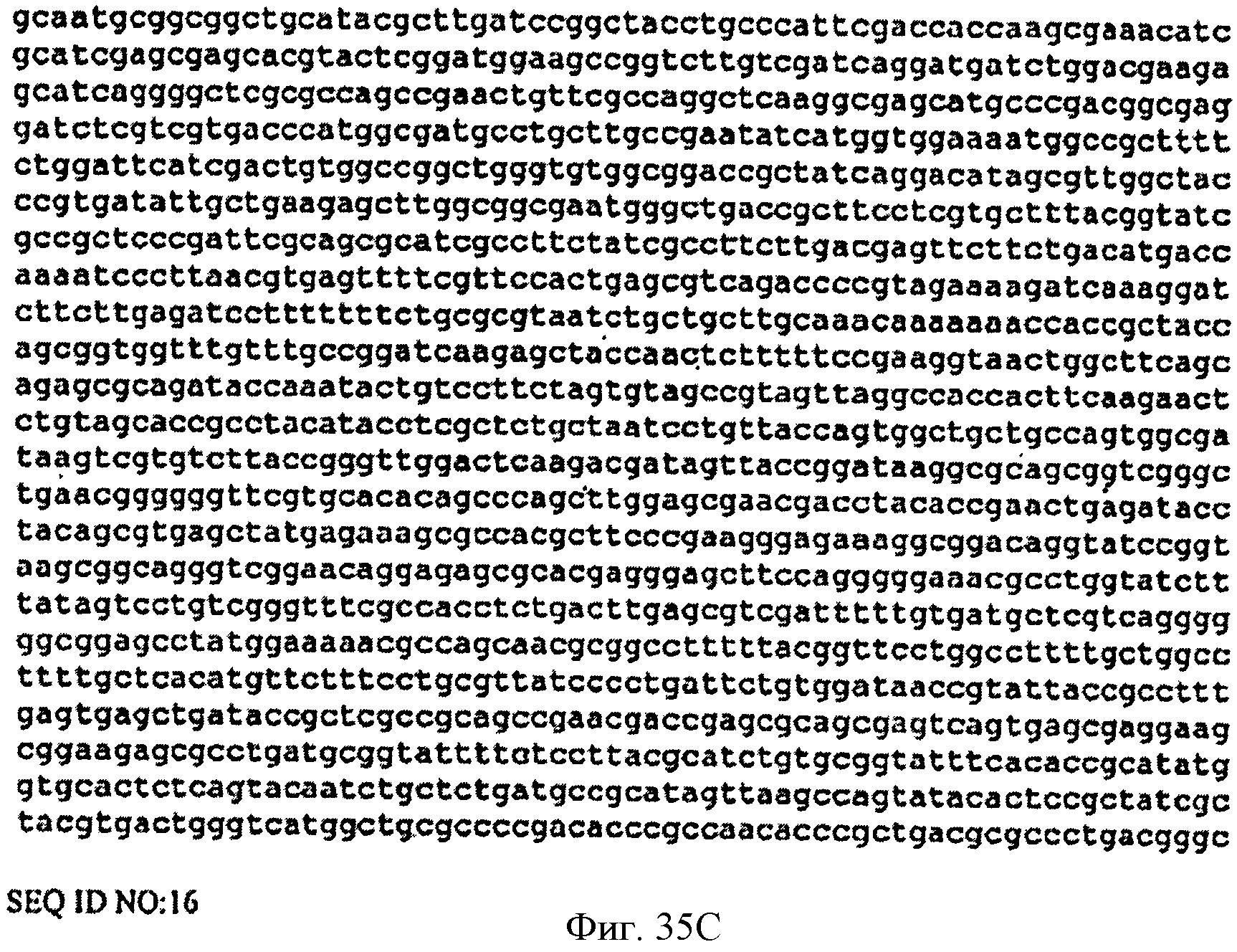
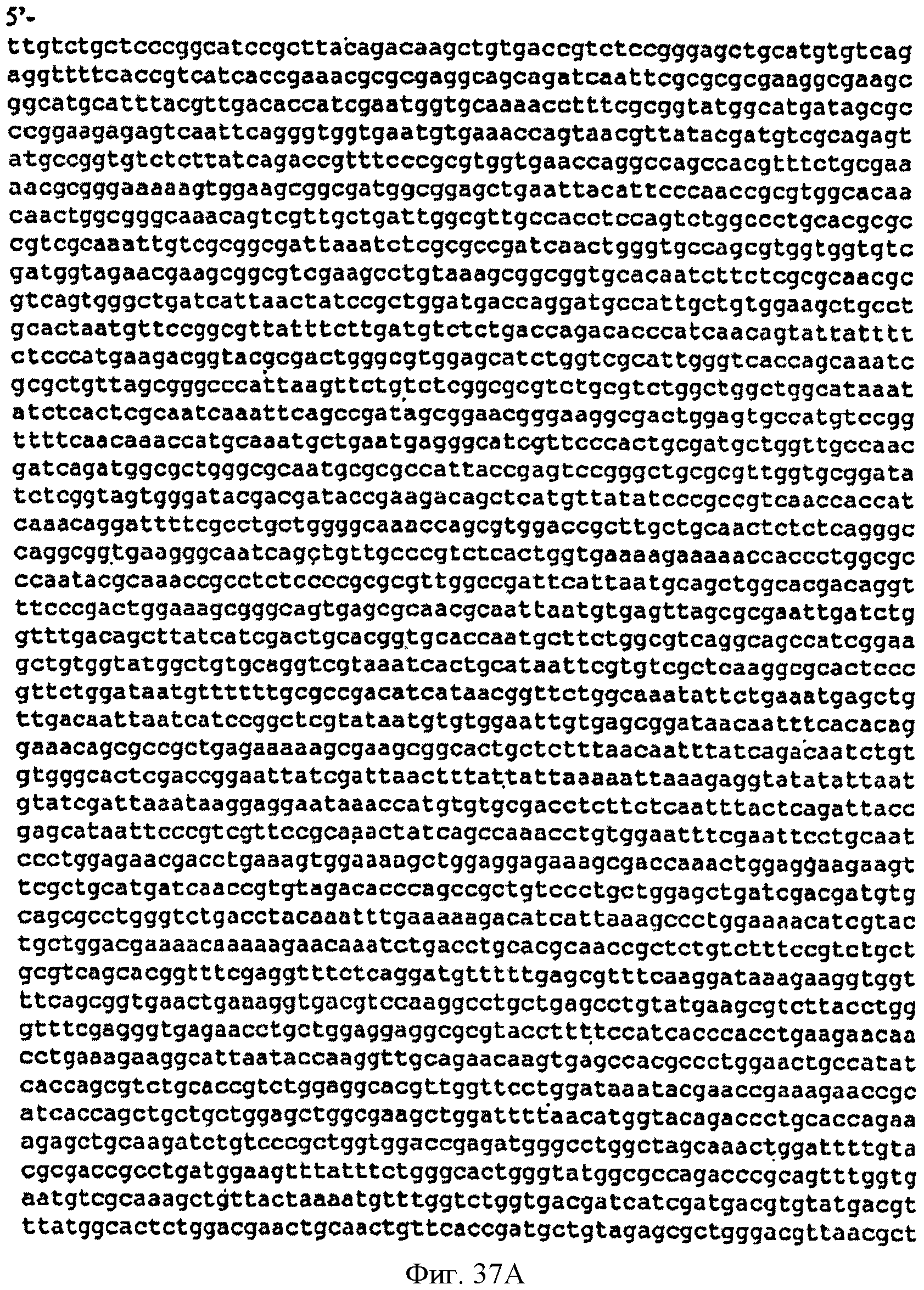
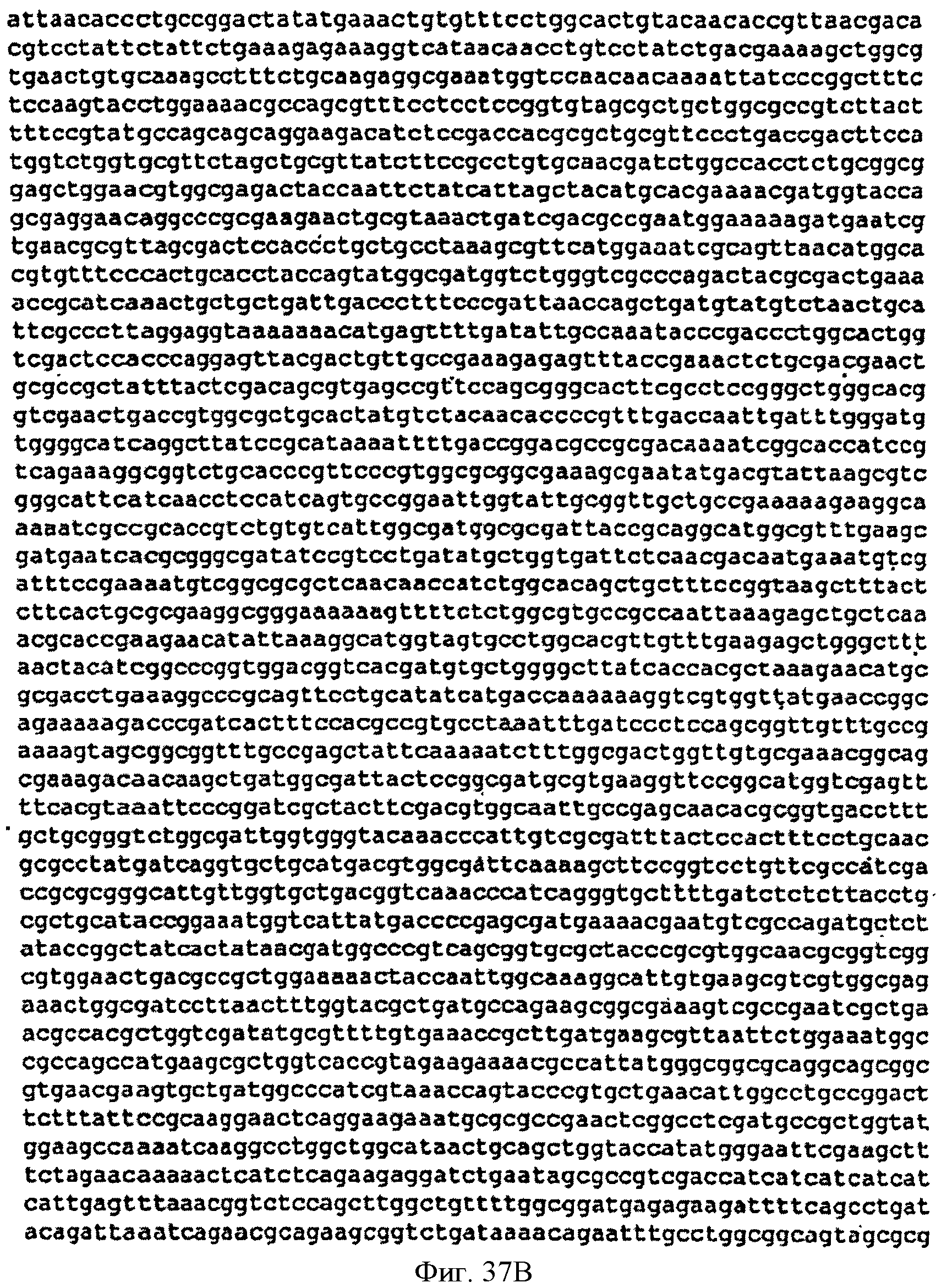
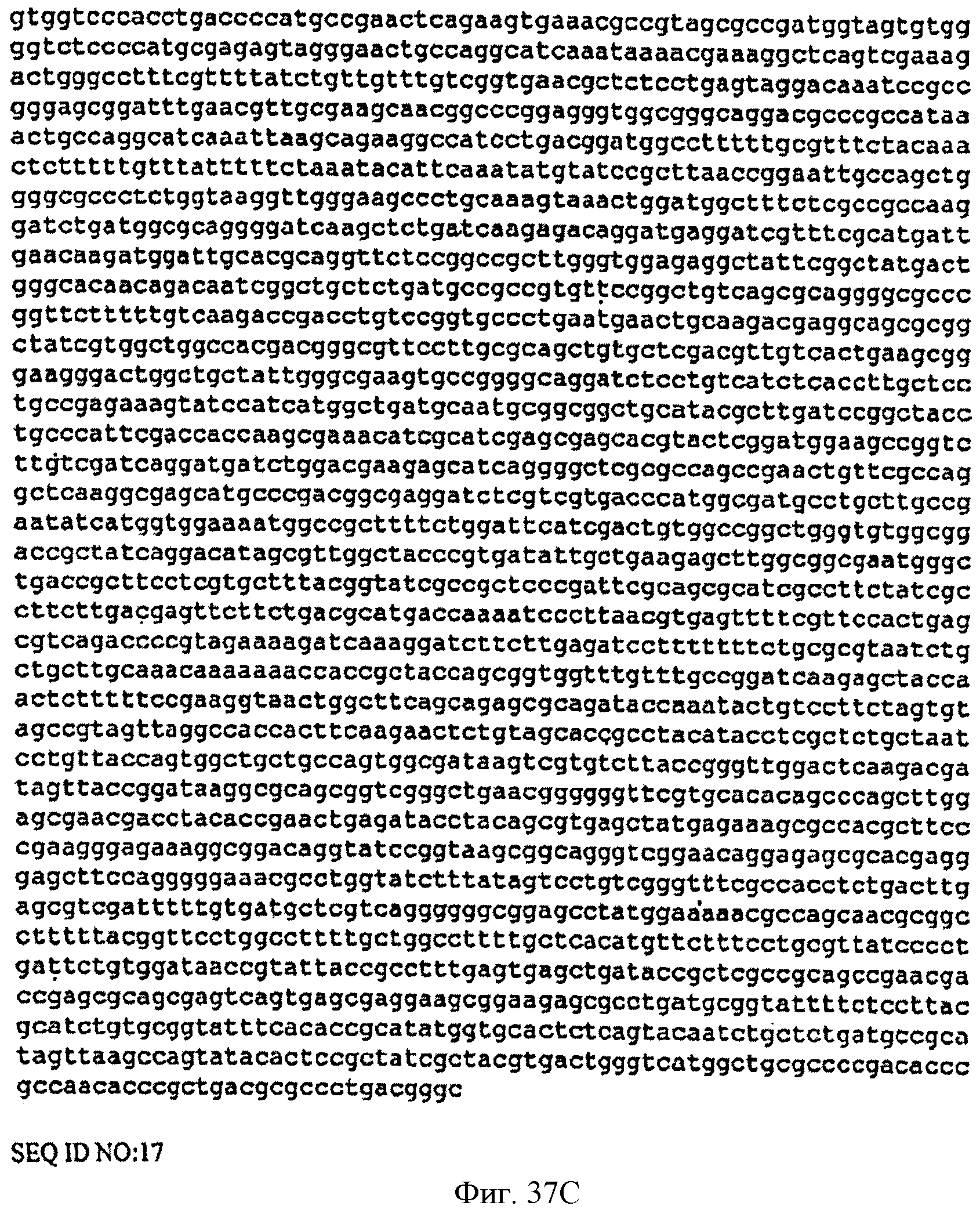
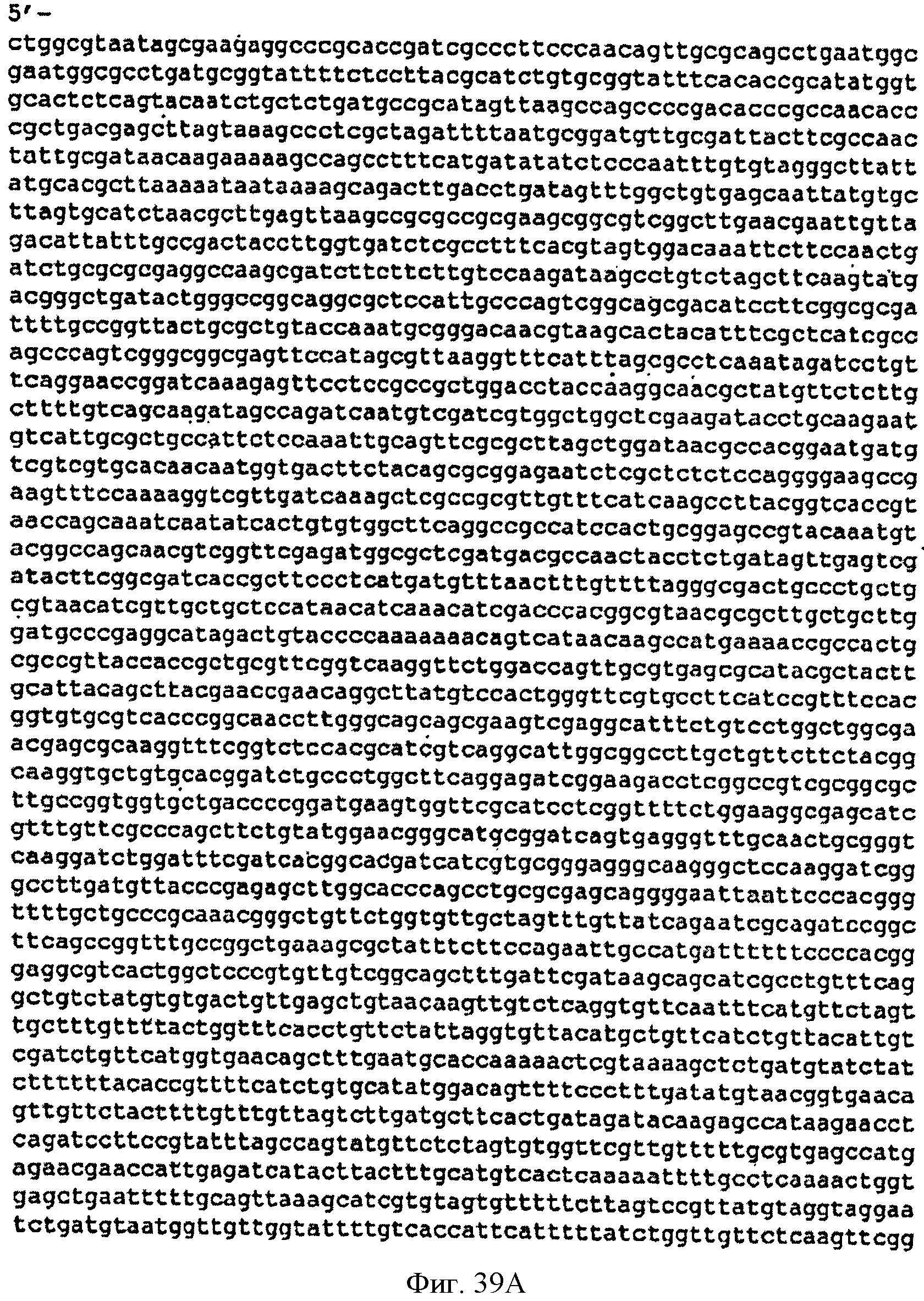
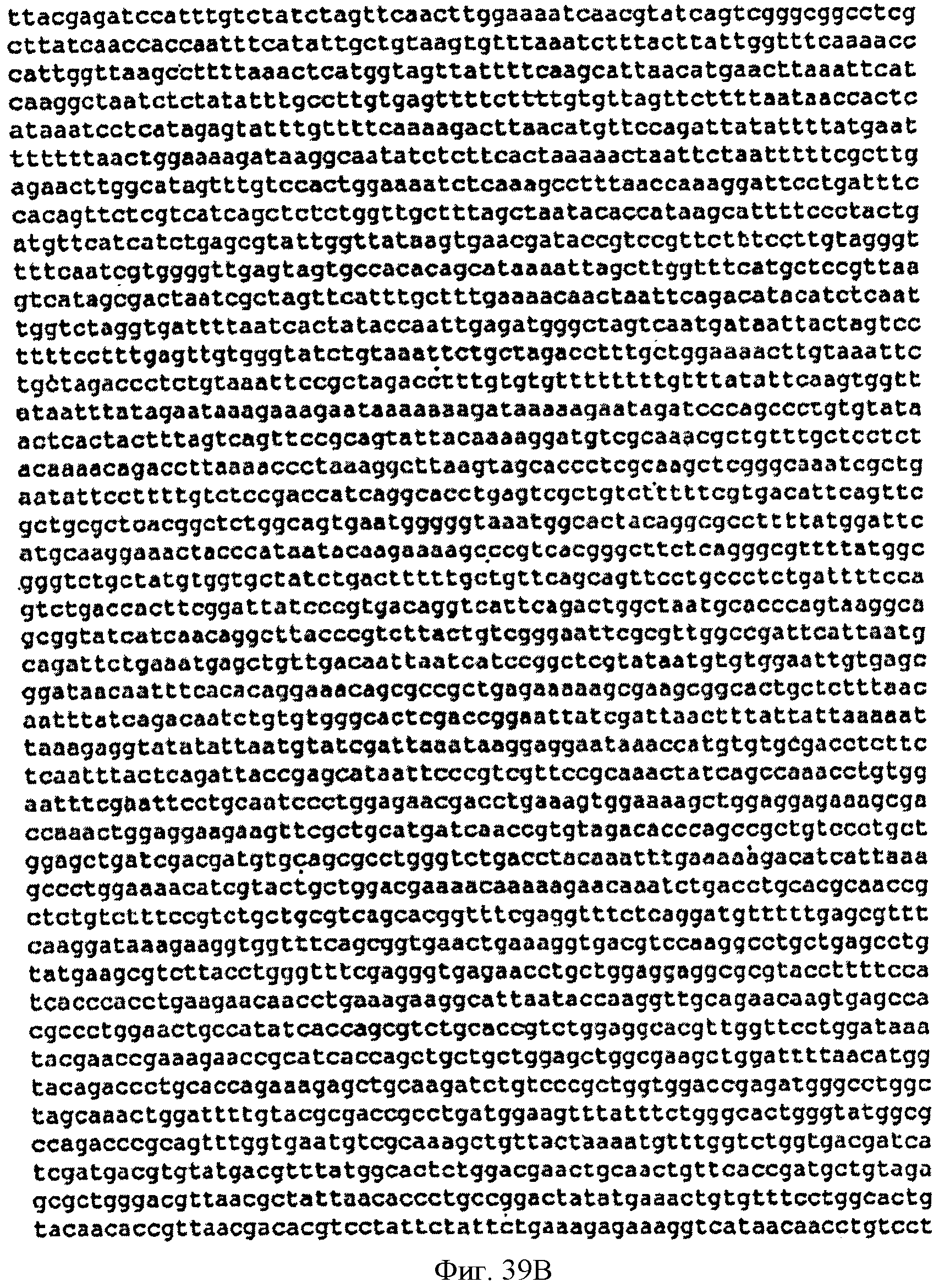
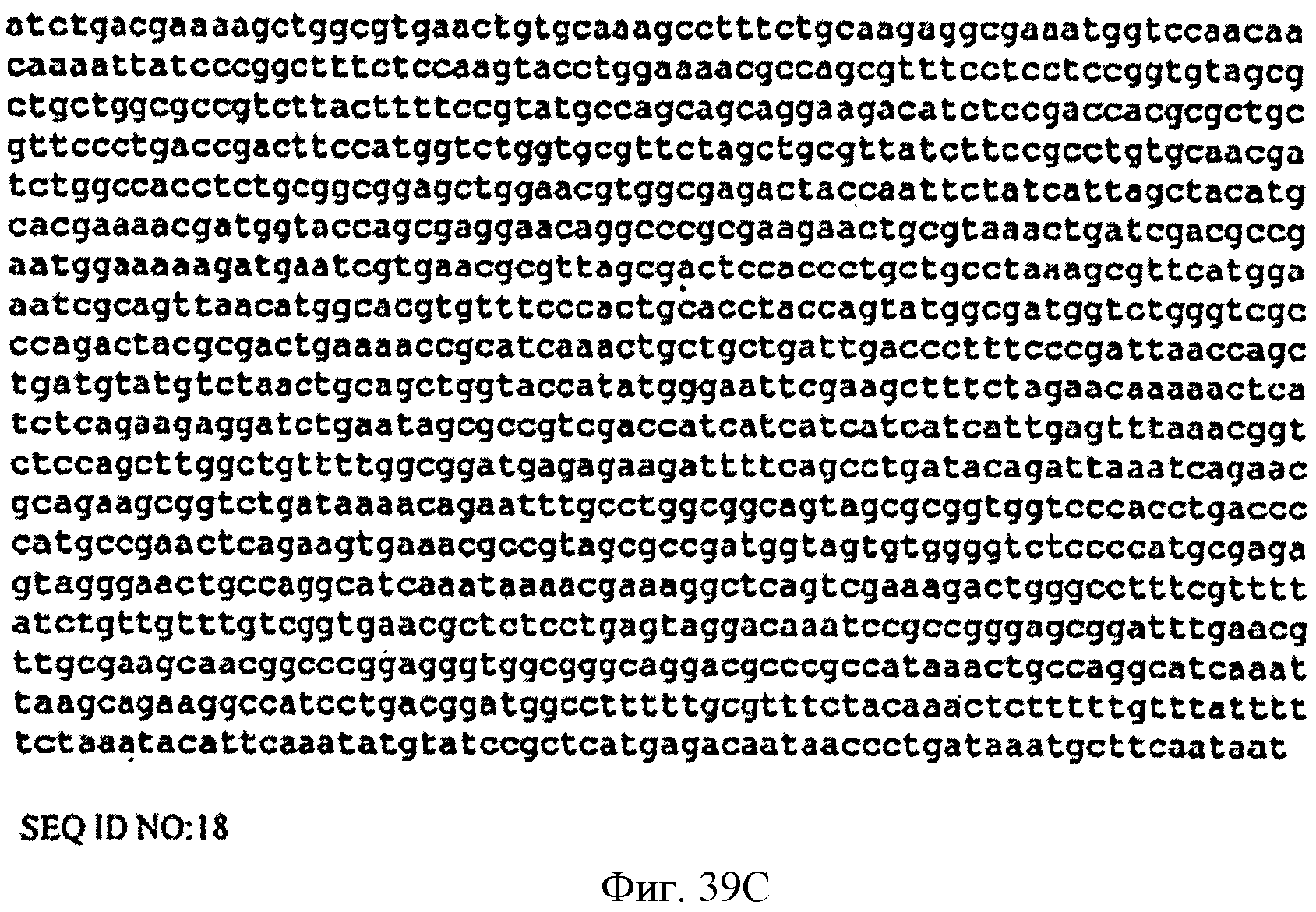
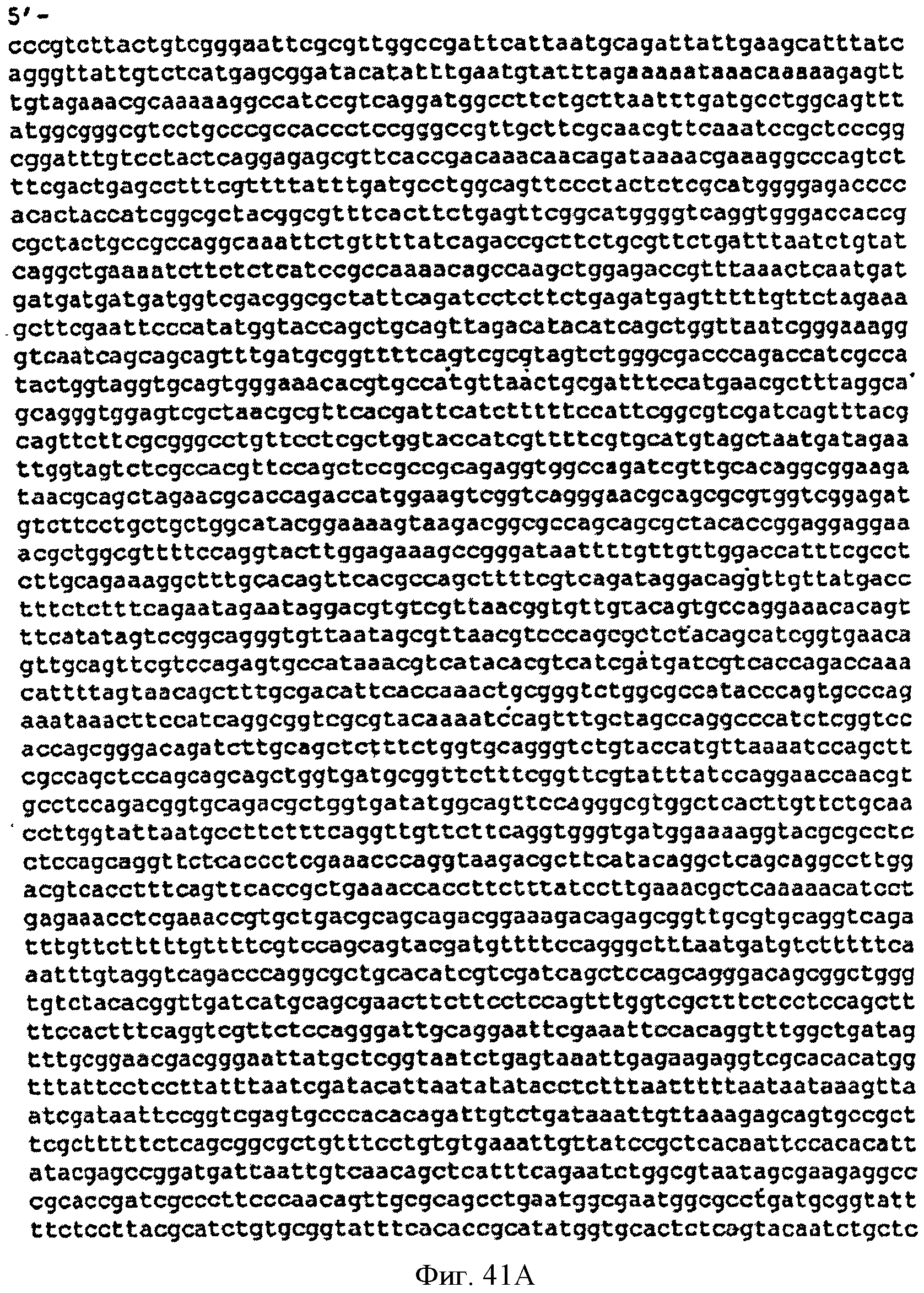
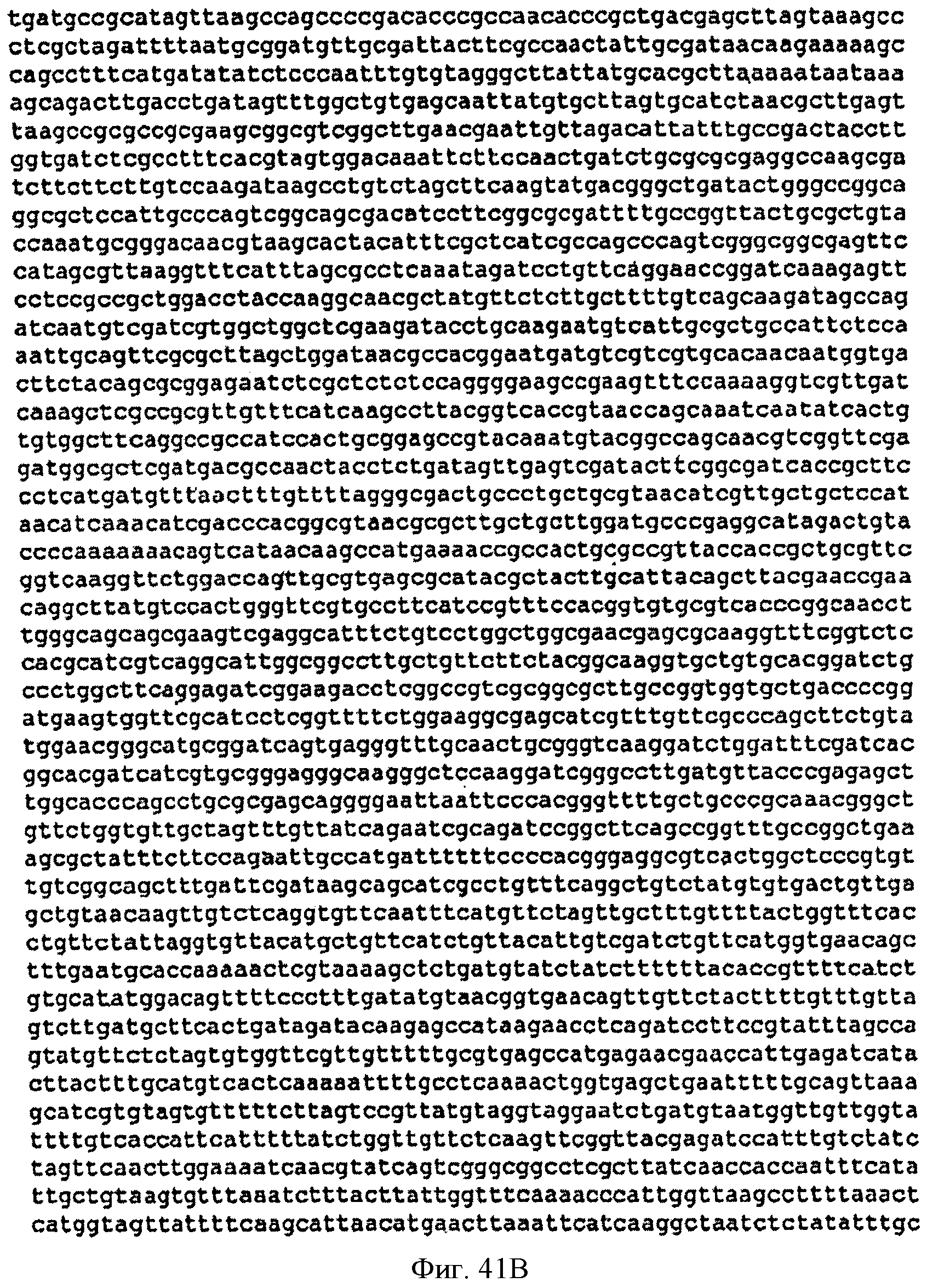
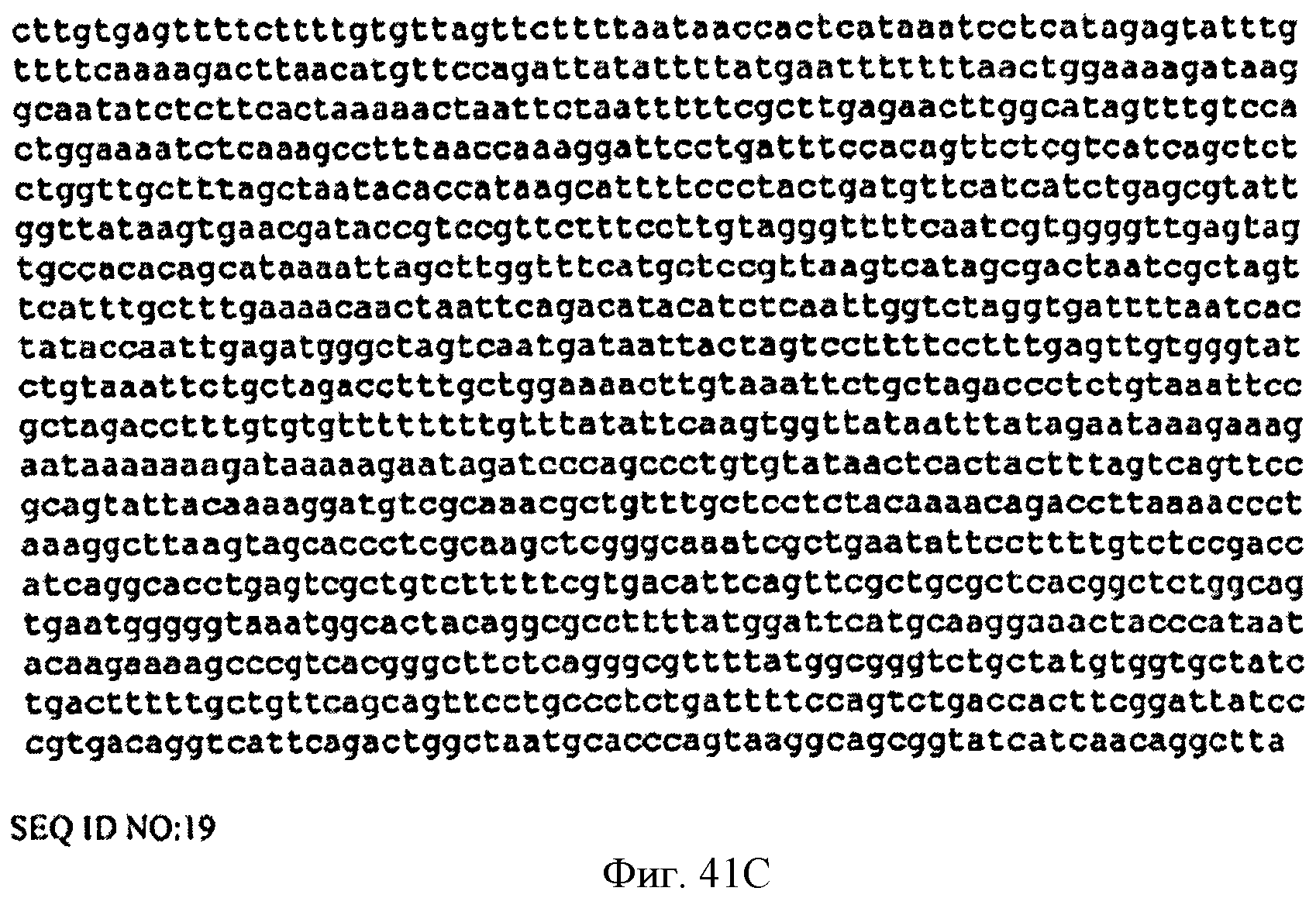
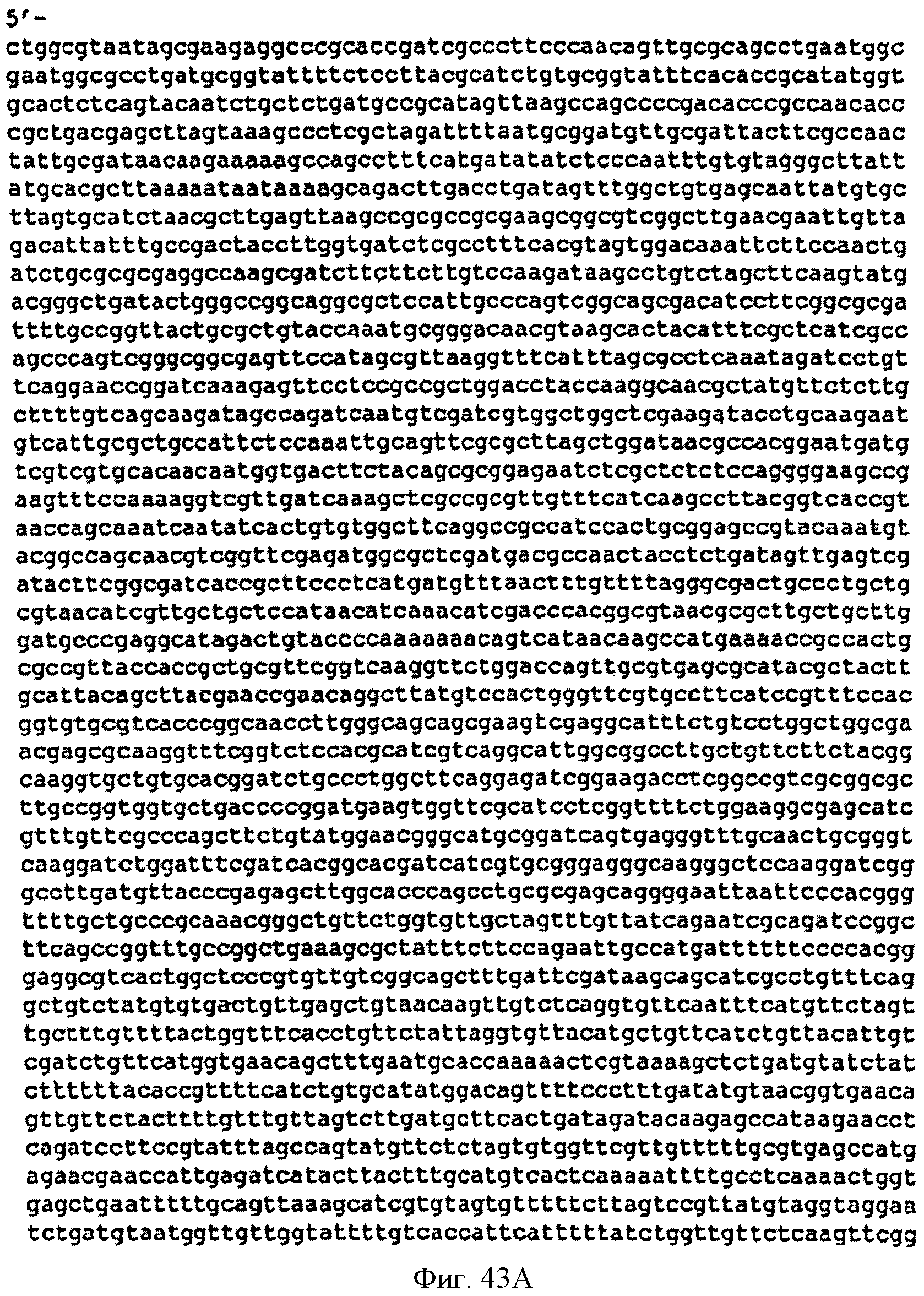
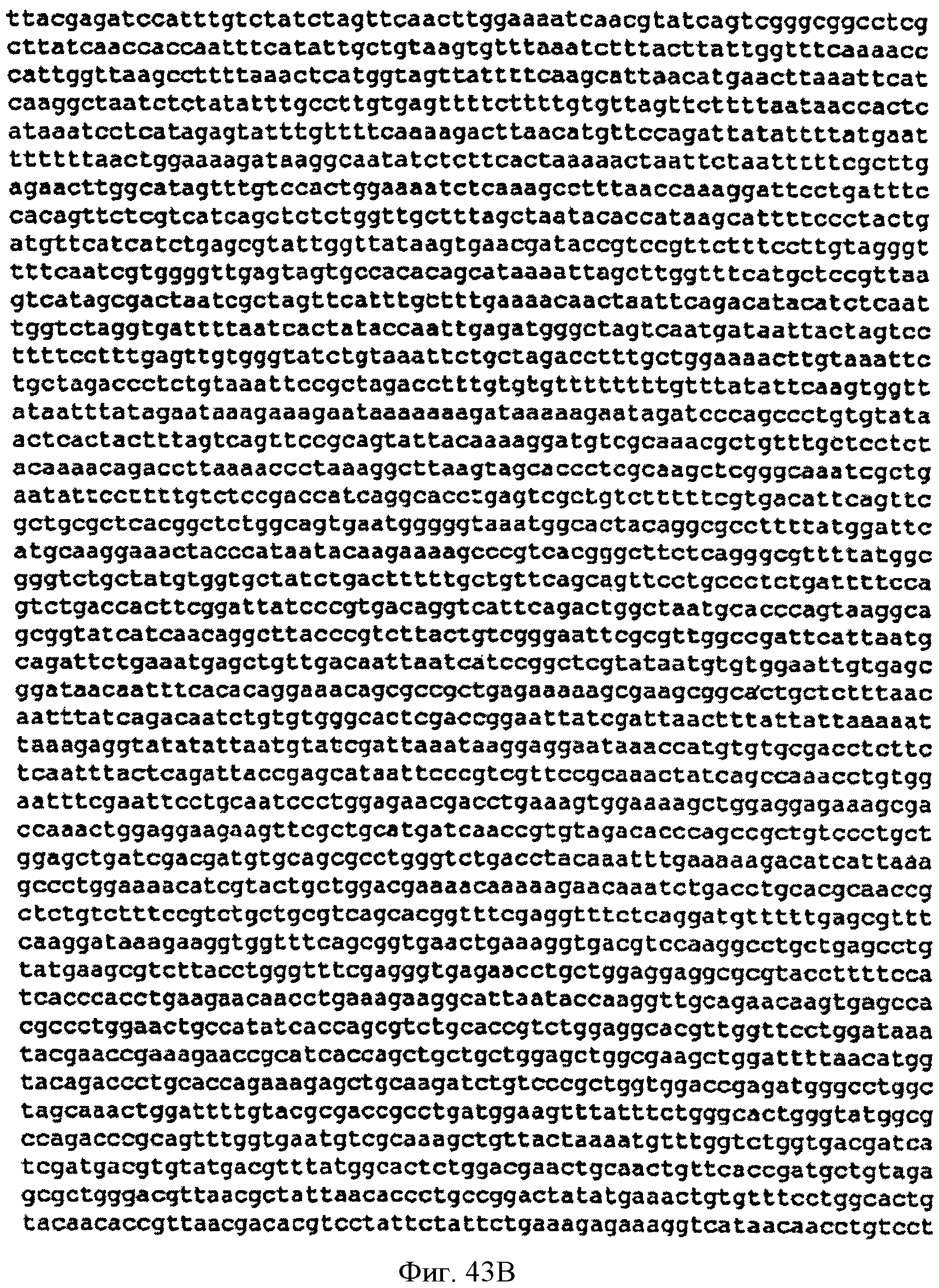
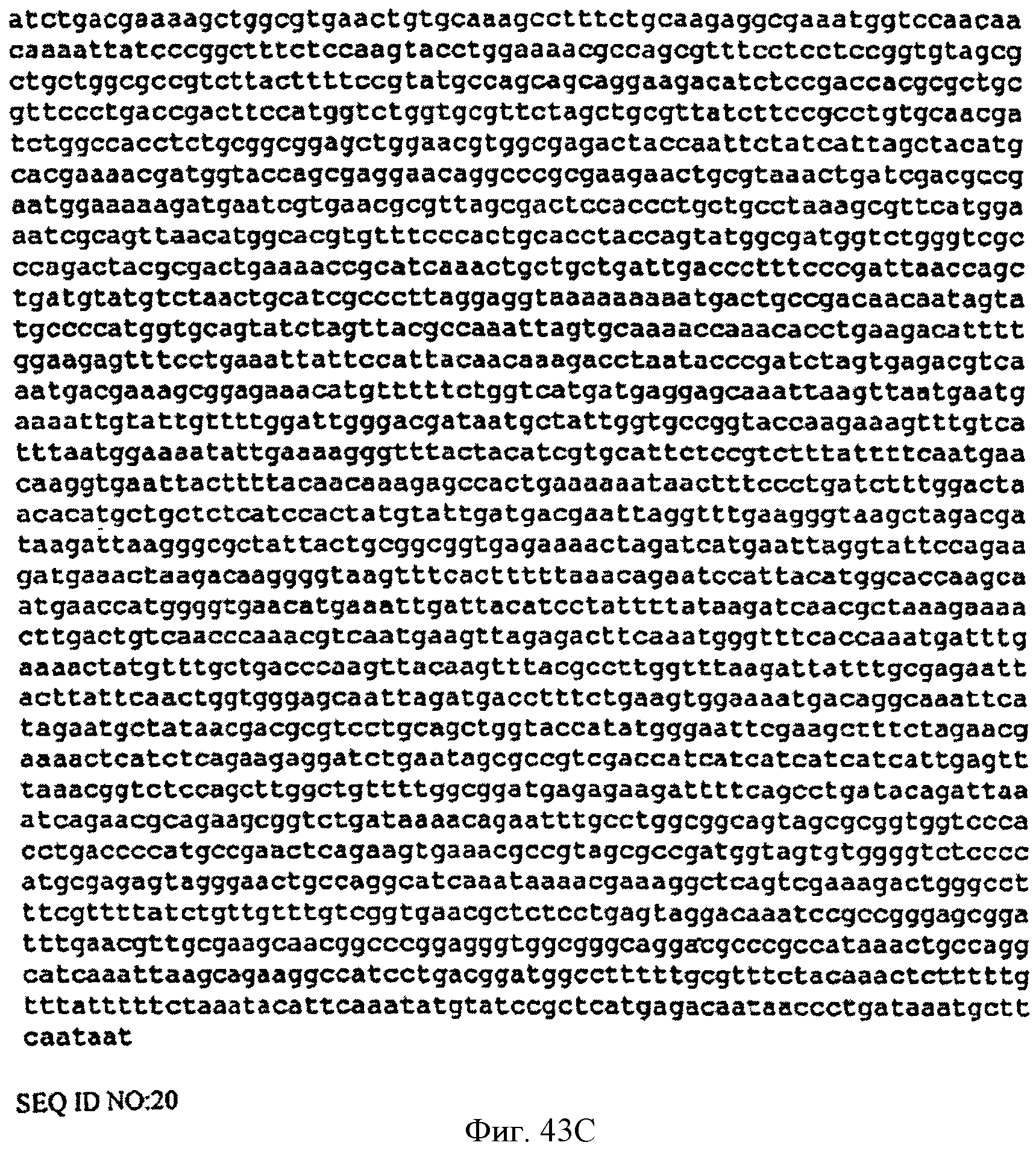
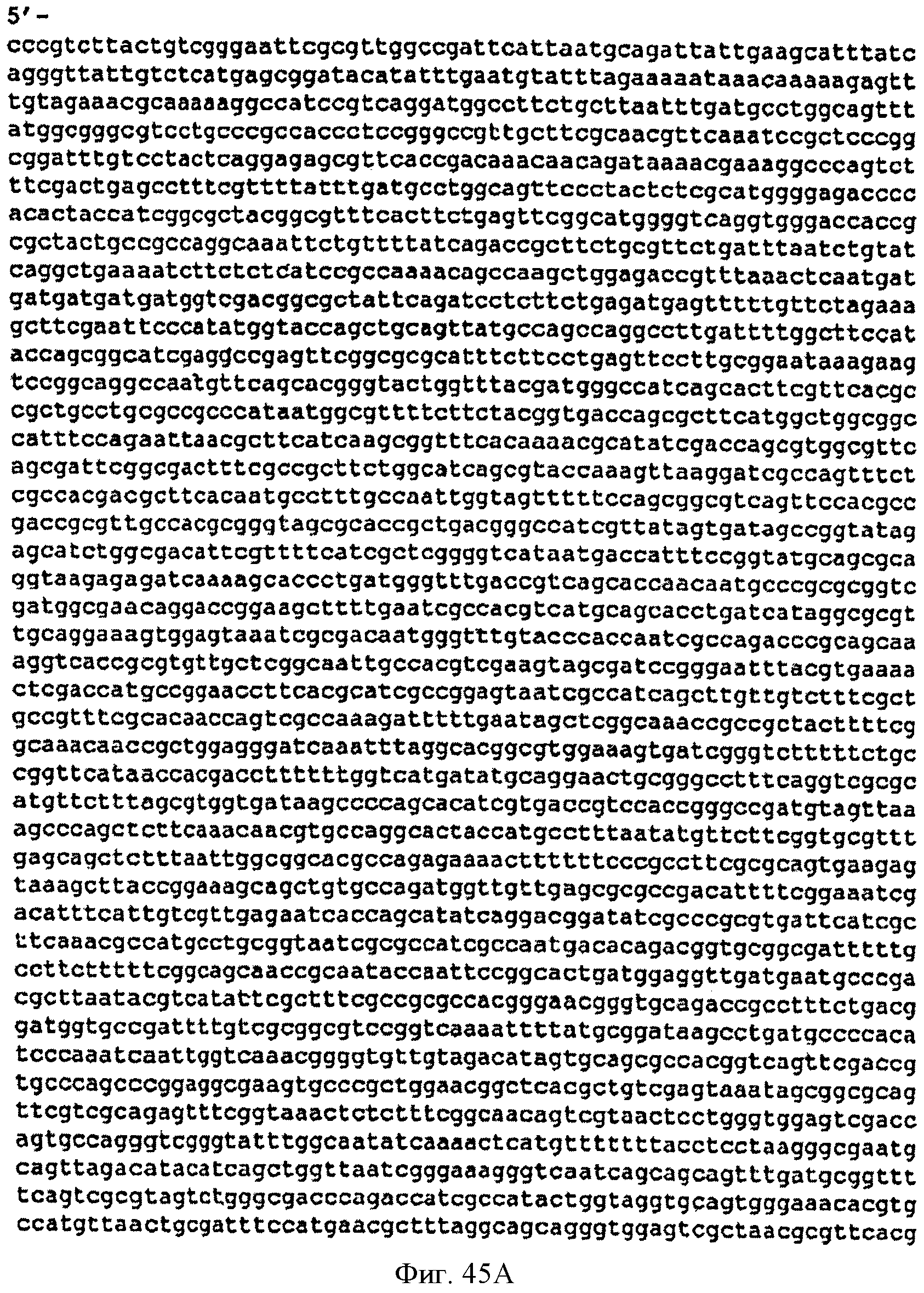
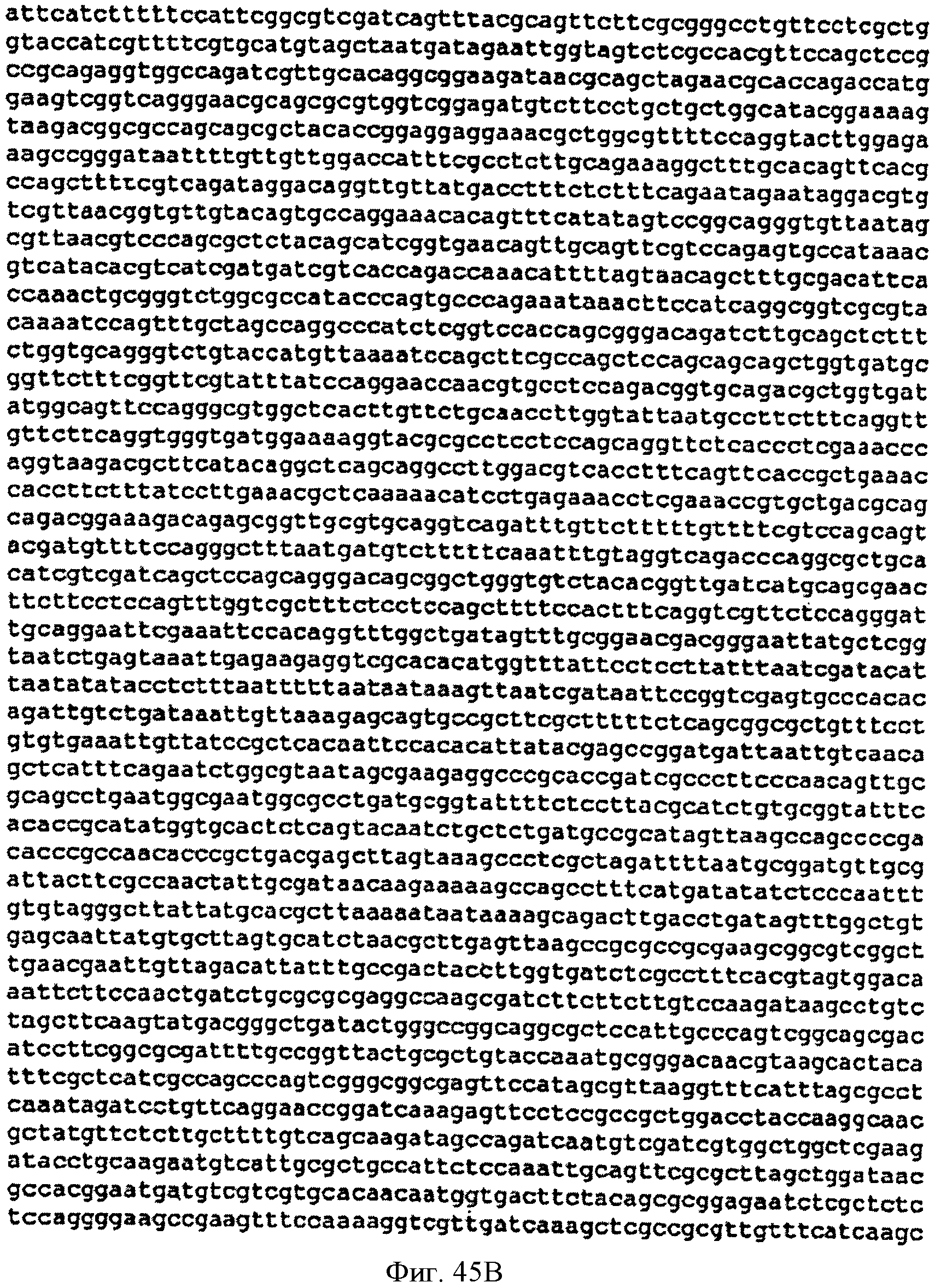
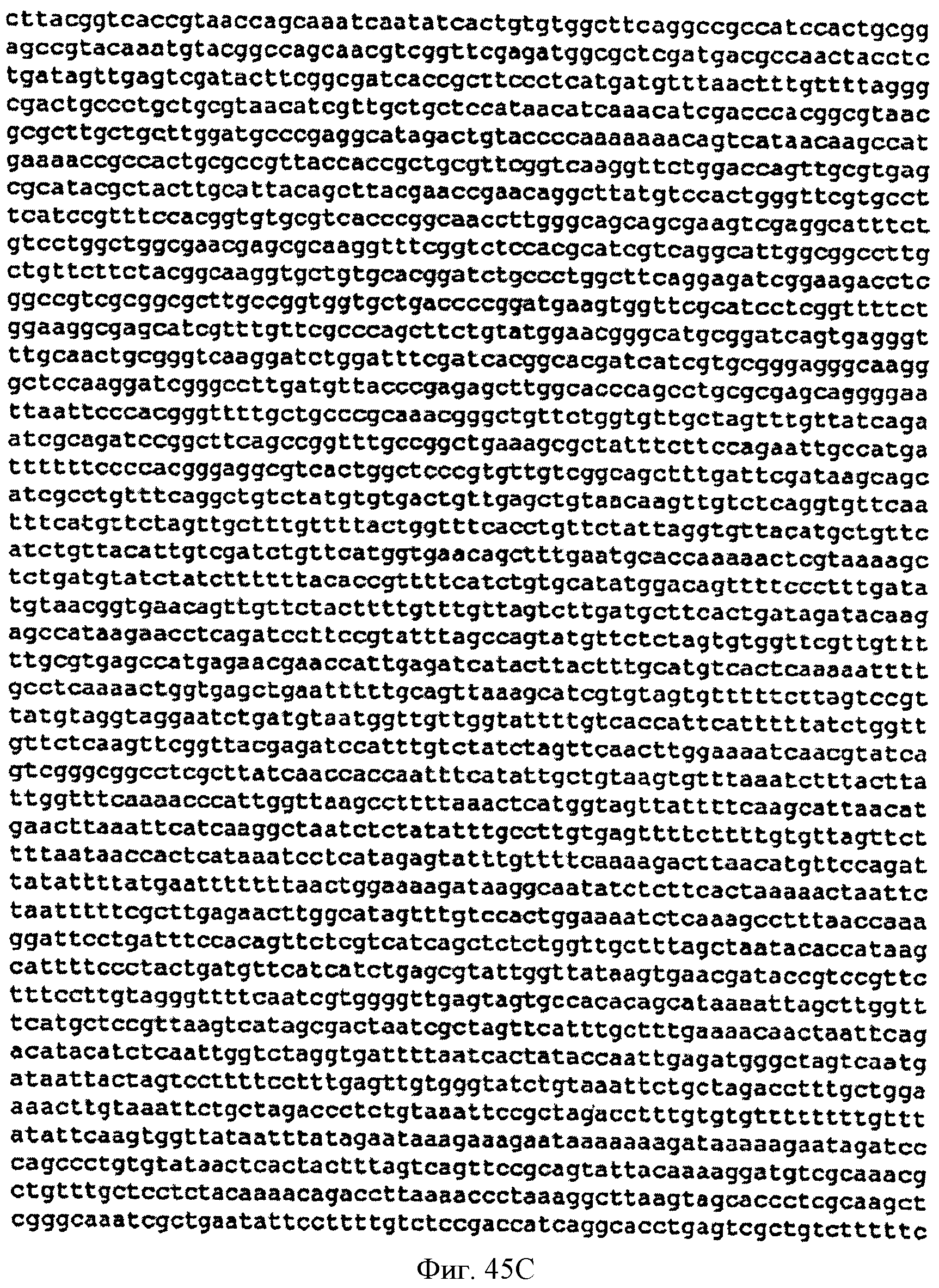



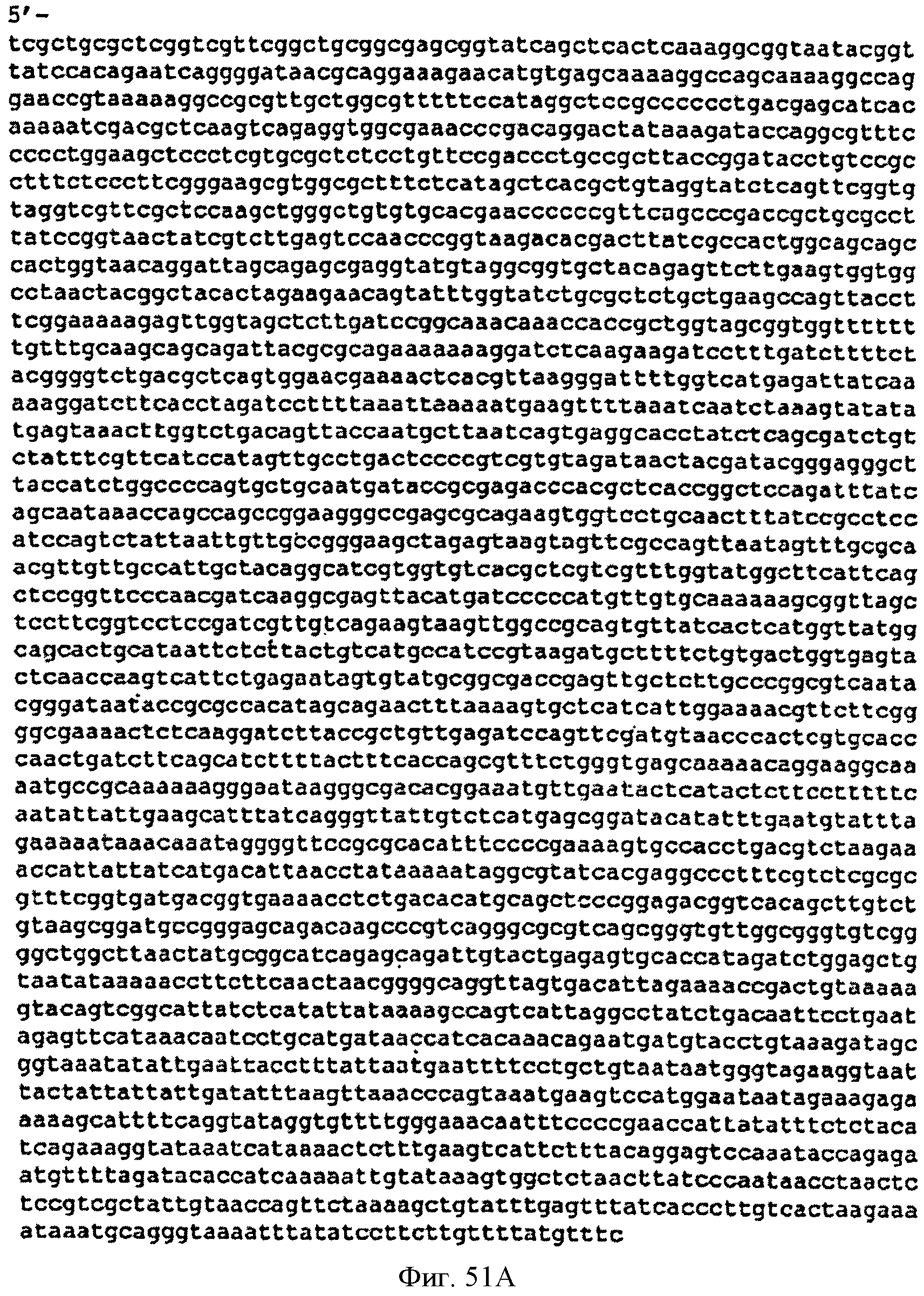
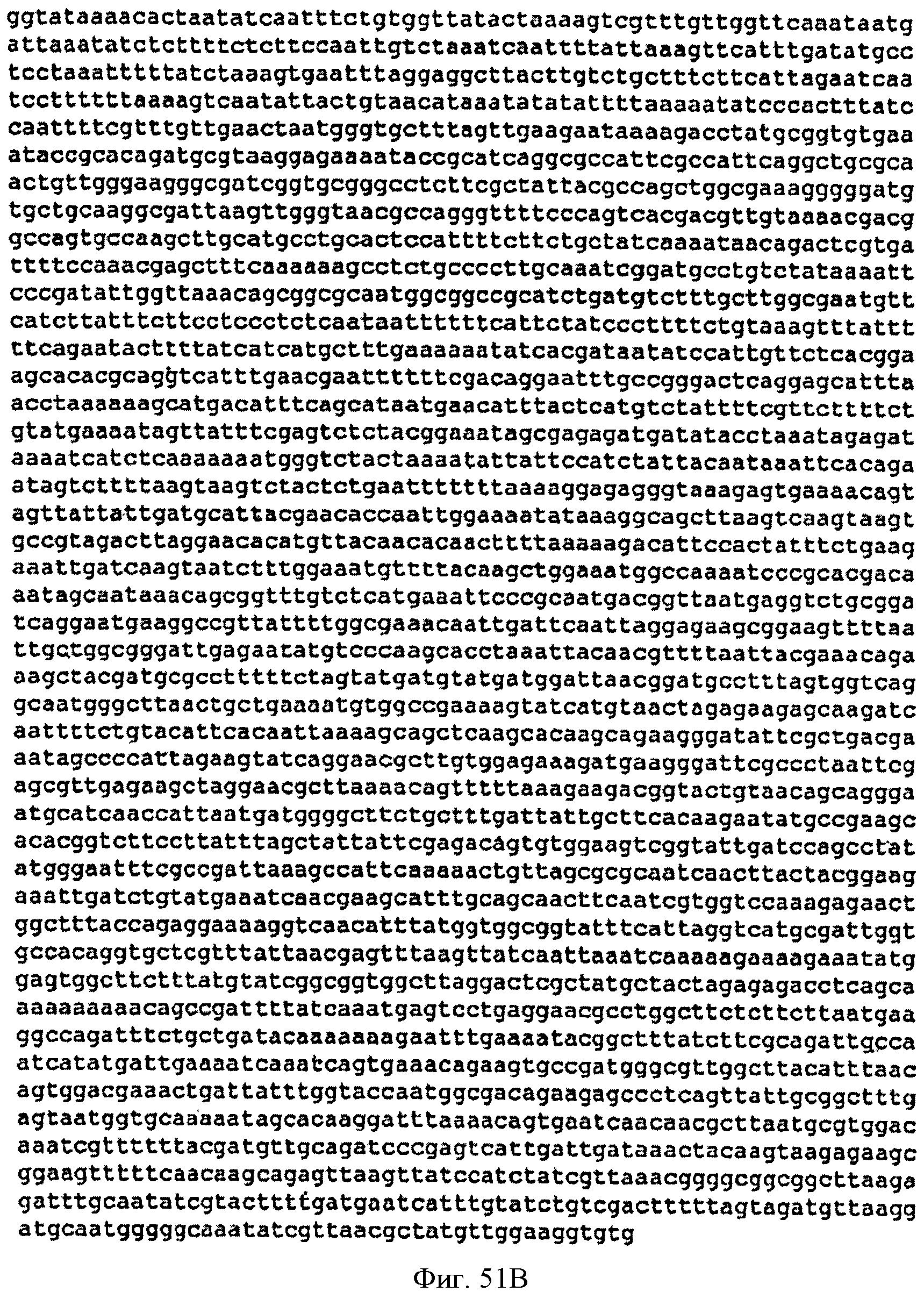
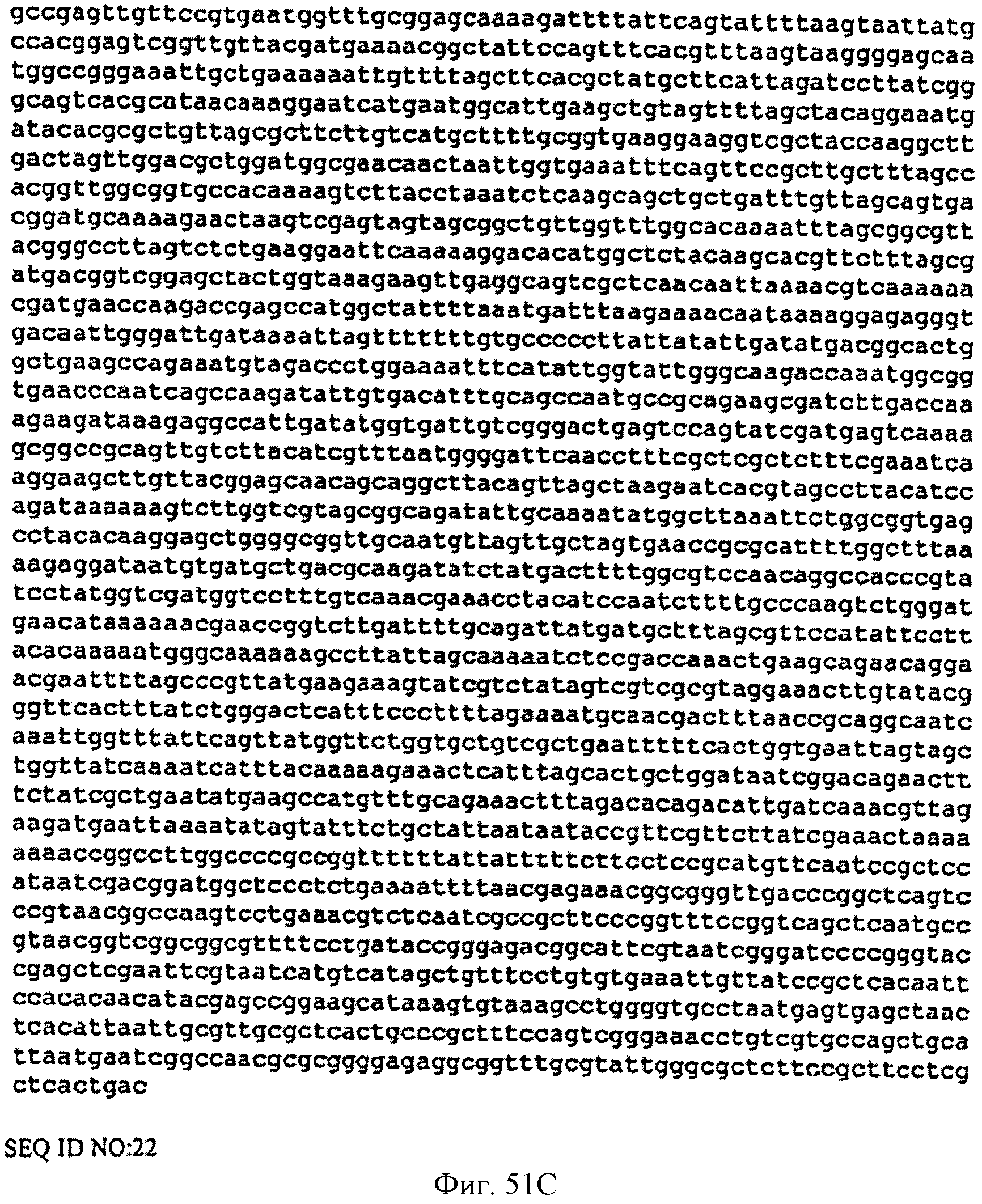












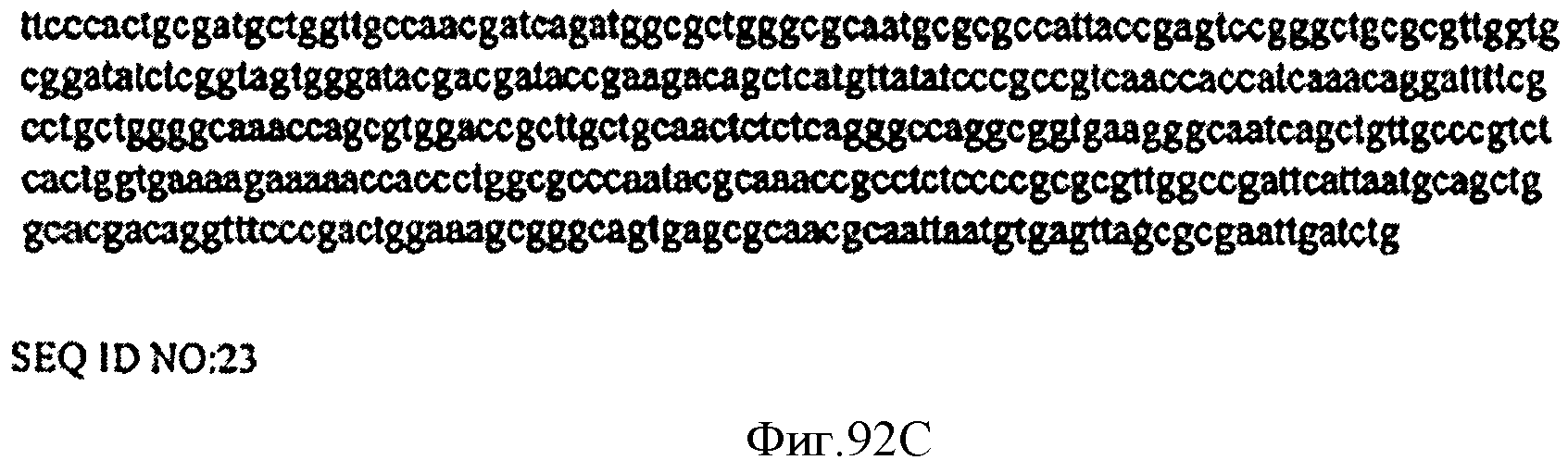









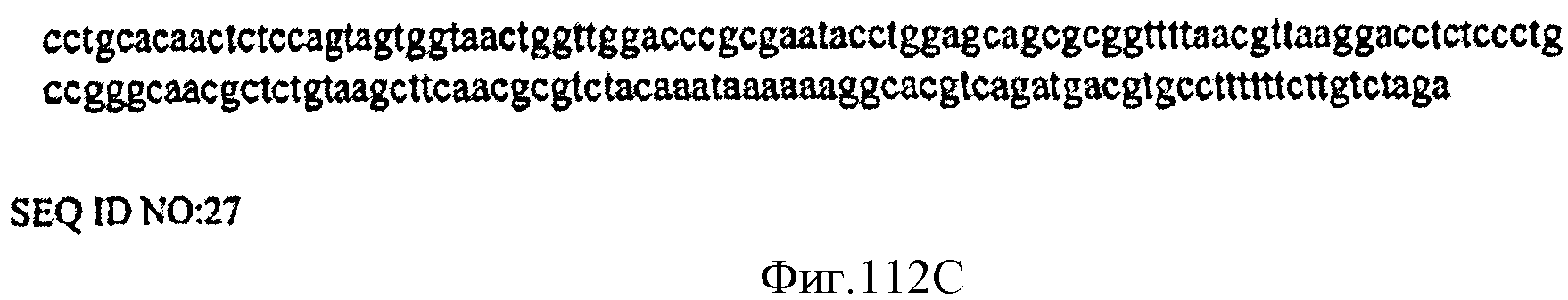











































Описание
ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящая заявка испрашивает приоритет на основании предварительной заявки на патент США №61/187959, поданной 17 июня 2009 г., содержание которой полностью включено в данную заявку посредством ссылки.
УРОВЕНЬ ТЕХНИКИ
[0002] Разработка новых видов возобновляемого транспортного топлива представляет собой одну из ключевых задач двадцать первого века. На современном рынке преобладает этанол, полученный в результате брожения сахарозы и крахмала, осуществляемого дрожжами, и, в меньшей степени, биодизель (сложные эфиры жирных кислот), полученный из триглицеридов. Этанол в качестве жидкого топлива имеет ограниченное применение, так как обладает более низкой удельной энергоемкостью по сравнению с углеводородами. Кроме того, этанол нельзя транспортировать в условиях обычной инфраструктуры вследствие его аффинности к воде и коррелирующих свойств. Процессы переработки возобновляемых источников углерода (биомассы, Сахаров, масел) в углеводородное топливо представляют собой привлекательную альтернативу биоэтанолу.
[0003] Изопрен (2-метил-1,3-бутадиен) представляет собой ключевое промышленное химическое вещество, которое используют, в основном, для получения синтетического каучука. На сегодняшний день изопрен получают из нефтехимических источников либо непосредственно путем крекинга нафты и других светлых нефтепродуктов, либо опосредованно путем химического синтеза (см., например, Н. Pommer и A. Nurrenbach, Industrial Synthesis of Terpene Compounds, Pure Appl. Chem., 1975, 43, 527-551; Н. М. Weitz и Е. Loser, Isoprene в Ullmann 's Encyclopedia of Industrial Chemistry, седьмое издание. Electronic Release, Wiley-VCH Verlag GMBH, Вайнхайм, 2005; и Н.М. Lybarger, Isoprene в Kirk-Othmer Encyclopedia of Chemical Technology, 4oe изд., Wiley, Нью-Йорк (1995), 14, 934-952.) Полученные в результате этого фракции изопрена-сырца, как правило, подвергают комплексным процессам очистки, чтобы удалить многочисленные близкие по химической природе примеси, многие из которых могут препятствовать последующему превращению изопрена в полимеры и другие химические вещества.
[0004] Наоборот, изопрен, полученный из биологических источников, содержит очень мало углеводородных примесей и, вместо этого, содержит множество кислородсодержащих соединений, таких как этанол, ацетальдегид и ацетон. Многие из данных соединений можно легко удалить путем приведения в контакт с водой или пропускания через оксид алюминия или другие адсорбенты.
[0005] В промышленности для получения изопрена используют нефтехимическое сырье, также необходимы технологические линии комплексной очистки перед тем, как изопрен можно будет превратить в полимеры и другие химические вещества. Необходимы экономически эффективные способы превращения полученного биологическим путем изопрена в полезные химические продукты, с тем, чтобы использовать преимущества высокой степени чистоты биоизопрена и/или уникальных профилей распределения примесей.
[0006] Все патенты, заявки на патенты, документы и статьи, цитированные в данной заявке, полностью включены в настоящее описание посредством ссылки.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0007] В настоящем изобретении предложены способы и системы для получения компонентов топлива из изопрена высокой степени чистоты, а также топливные композиции, полученные из изопрена высокой степени чистоты.
[0008] В одном аспекте настоящего изобретения предложен способ получения компонента топлива из биоизопреновой композиции, включающий химическое превращение значительной части изопрена в указанной биоизопреновой композиции в неизопреновые соединения. В одном варианте реализации, указанную биоизопреновую композицию подвергают химическому превращению с помощью температурных или каталитических условий, подходящих для димеризации изопрена, с получением димера изопрена и последующего каталитического гидрирования димера изопрена с получением компонента топлива с насыщенной углеводородной цепью С10. В другом варианте реализации, указанную биоизопреновую композицию подвергают химическому превращению путем (i) частичного гидрирования биоизопреновой композиции с получением изоамилена, (ii) димеризации изоамилена с моноолефином, выбранным из группы, состоящей из изоамилена, пропилена и изобутена, с получением димата и (iii) полного гидрирования димата с получением компонента топлива, В некоторых вариантах реализации, по меньшей мере приблизительно 95% изопрена в указанной биоизопреновой композиции превращают в неизопреновые соединения в процессе химического превращения. В некоторых вариантах реализации, указанную биоизопреновую композицию нагревают до температуры от приблизительно 150°С до приблизительно 250°С с получением ненасыщенного циклического димера изопрена, и указанный ненасыщенный циклический димер изопрена подвергают каталитическому гидрированию с получением компонента топлива на основе насыщенного циклического димера изопрена. В некоторых вариантах реализации, указанный способ включает: (i) приведение в контакт биоизопреновой композиции с катализатором для катализа циклодимеризации изопрена с получением ненасыщенного циклического димера изопрена, и полученный ненасыщенный циклический димер изопрена подвергают каталитическому гидрированию с получением компонента топлива на основе насыщенного циклического - димера изопрена. В некоторых вариантах реализации, указанный катализатор для катализа циклодимеризации изопрена, включает катализатор, выбранный из группы, состоящей из никелевого катализатора, железных катализаторов и хромовых катализаторов. В некоторых вариантах реализации, указанный этап частичного гидрирования биоизопреновой композиции включает приведение биоизопреновой композиции в контакт с газообразным водородом и катализатором для катализа частичного гидрирования изопрена. В некоторых вариантах реализации, указанный катализатор для катализа частичного гидрирования изопрена включает палладиевый катализатор. В некоторых вариантах реализации, указанный этап димеризации изоамилена с моноолефином включает приведение изоамилена в контакт с моноолефином в присутствии катализатора для катализа димеризации моноолефина. В некоторых вариантах реализации, указанный катализатор для катализа димеризации моноолефина включает кислотный катализатор. В некоторых вариантах реализации, указанный способ дополнительно включает очистку изопрена из биоизопреновой композиции перед химическим превращением биоизопреновой композиции в компонент топлива.
[0009] В одном аспекте настоящего изобретения предложена система для получения компонента топлива из биоизопреновой композиции, где значительную часть изопрена в биоизопреновой композиции химически превращают в неизопреновые соединения, при этом указанная система содержит биоизопреновую композицию и (а) (i) одно или более химических веществ, способных димеризоватъ изопрен в биоизопреновой композиции, или источник тепла, способный димеризовать изопрен в биоизопреновой композиции; и (ii) катализатор, способный катализировать гидрирование димера изопрена с получением компонента топлива с насыщенной углеводородной цепью С10;
или (b) (i) химическое вещество, способное частично гидрировать изопрен в указанной биоизопреновой композиции с получением изоамилена, (ii) химическое вещество, способное димеризовать изоамилен с моноолефинами, выбранными из группы, состоящей из изоамилена, пропилена и изобутена, с получением димата, и (iii) химическое вещество, способное полностью гидрировать димат с получением компонента топлива.
[0010] В некоторых вариантах реализации указанной системы, биоизопреновая композиция содержит более чем приблизительно 2 мг изопрена и содержит больше или приблизительно 99,94% масс. изопрена по отношению к общей массе всех С5-углеводородовв композиции. В некоторых вариантах реализации указанной системы, одно или более химических веществ, способных димеризовать изопрен, включают катализатор для катализа циклодимеризации изопрена, включая катализатор, выбранный из группы, состоящей из рутениевых катализаторов, никелевых катализаторов, железных катализаторов и хромовых катализаторов. В некоторых вариантах реализации указанной системы, катализатор для гидрирования ненасыщенных димеров изопрена включает катализатор, выбранный из группы, состоящей из палладиевых катализаторов, никелевых катализаторов, рутениевых катализаторов и родиевых катализаторов. В некоторых вариантах реализации указанной системы, указанное химическое вещество, способное частично гидрировать изопрен, включает палладиевый катализатор. В некоторых вариантах реализации указанной системы, химическое вещество, способное димеризовать изоамилен с моноолефинами, включает кислотный катализатор.
[0011] В одном аспекте настоящего изобретения предложена топливная композиция, содержащая компонент топлива, полученный с помощью способов, описанных в данной заявке. В некоторых вариантах реализации, указанная топливная композиция по существу не содержит изопрен, В некоторых вариантах реализации, указанная топливная композиция имеет значение δ13С, которое больше, чем -22‰, или находится в диапазоне от -32‰ до -24‰.
[0012] В некоторых аспектах настоящего изобретения предложена система для получения компонента топлива из изопрена, содержащая: (а) коммерчески предпочтительное количество изопрена высокой степени чистоты; и (b) компонент топлива, полученный из по меньшей мере части изопрена высокой степени чистоты; в которой по меньшей мере часть коммерчески предпочтительное количества изопрена высокой степени чистоты подвергается химическому превращению.
[0013] В некоторых вариантах реализации указанной системы, указанное коммерчески предпочтительное количество изопрена высокой степени чистоты включает более чем приблизительно 2 мг изопрена и включает приблизительно 99,94% масс. изопрена или более по отношению к общей массе всех С5-углеводородов в указанной композиции. В некоторых вариантах реализации, указанное коммерчески подходящее количество изопрена высокой степени чистоты включает более чем приблизительно 2 мг изопрена и включает одно или более соединений, выбранных из группы, состоящей из этанола, ацетона, пренильных спиртов С5 и изопреноидных соединений с 10 или более атомами углерода. В некоторых вариантах реализации, указанное коммерчески предпочтительное количество изопрена высокой степени чистоты включает более чем приблизительно 2 мг изопрена и включает одно или более дополнительных соединений, выбранных из группы, состоящей из этанола, ацетона, метанола, ацетальдегида, метакролеина, метилвинилкетона, 2-метил-2-винилоксирана, цис- и транс-3-метил-1,3-пентадиена, пренильного спирта С5, 2-гептанона, 6-метил-5-гептен-2-она, 2,4,5-триметилпиридина, 2,3,5-триметилпиразина. цитронеллаля, метантиола, метилацетата, 1-пропанола, диацетила, 2-бутанона, 2-метил-3-бутен-2-ола, этилацетата, 2-метил-1-пропанола, 3-метил-1-бутаналя, 3-метил-2-бутанона, 1-бутанола, 2-пентанона, 3-метил-1-бутан ола, этилизобутирата, 3-метил-2-бутеналя, бутилацетата, 3-метилбутилацетата, 3-метил-3-бутен-1-ил ацетата, 3-метил-2-бутен-1-ил ацетата, 3-гексен-1-ола, 3-гексен-1-ил ацетата, лимонена, гераниола (транс-3,7-диметил-2,6-октадиен-1-ола), цитронеллола (3,7-диметил-6-октен-1-ола), (Е)-3,7-диметил-1,3,6-октатриена, (г)-3,7-диметил-1,3,6-октатриена и 2,3-циклогептенолпиридина; при этом количество дополнительного соединения по отношению к количеству изопрена составляет приблизительно 0,01% (масс./масс.) или более. В некоторых вариантах реализации, указанное коммерчески предпочтительное количество изопрена высокой степени чистоты включает более чем приблизительно 2 мг изопрена и включает меньше или приблизительно 0,5 мкг/л на соединение любого соединения в указанной композиции, которое ингибирует полимеризацию изопрена. В некоторых предпочтительных вариантах реализации, указанное коммерчески предпочтительное количество изопрена высокой степени чистоты получают посредством биологического процесса.
[0014] В некоторых вариантах реализации указанной системы, указанный компонент топлива содержит одно или более соединений, выбранных из группы, состоящей из циклических димеров и тримеров изопрена, линейных олигомеров изопрена, ароматических и алициклических производных изопрена и кислородсодержащих производных изопрена. В некоторых вариантах реализации, указанные кислородсодержащие производные изопрена представляют собой соединения, выбранные из группы, состоящей из спиртов, кетонов, сложных и простых эфиров, полученных из изопрена.
[0015] В некоторых вариантах реализации, указанный компонент топлива включает циклические димеры изопрена и указанное химическое превращение включает реакцию димеризации изопрена. В некоторых вариантах реализации, реакцию димеризации осуществляют путем нагревания коммерчески предпочтительного количества изопрена высокой степени чистоты. В некоторых вариантах реализации, реакция димеризации изопрена позволяет получить продукт, содержащий ненасыщенные димеры изопрена, и химическое превращение дополнительно включает реакцию гидрирования ненасыщенных димеров изопрена. В некоторых вариантах реализации, указанная система дополнительно включает катализатор для катализа реакции гидрирования ненасыщенных димеров изопрена. В некоторых вариантах реализации, указанный катализатор для катализа реакции гидрирования ненасыщенных димеров изопрена включает катализатор, выбранный из группы, состоящей из палладиевых катализаторов, никелевых катализаторов, рутениевых катализаторов и родиевых катализаторов.
[0016] В некоторых вариантах реализации, реакцию димеризации осуществляют путем приведения коммерчески предпочтительного количества изопрена высокой степени чистоты в контакт с катализатором для катализа циклодимеризации изопрена. В некоторых вариантах реализации, указанный катализатор для катализа циклодимеризации изопрена включает катализатор, выбранный из группы, состоящей из рутениевых катализаторов, никелевых катализаторов, железных катализаторов и хромовых катализаторов. В некоторых вариантах реализации, указанный катализатор для катализа циклодимеризации изопрена представляет собой никелевый катализатор, и указанный компонент топлива включает один или более восьмичленных кольцевых димеров изопрена.
[0017] В некоторых вариантах реализации, указанный компонент топлива включает линейные и/или циклические тримеры изопрена, и химическое превращение включает каталитическую тримеризацию изопрена.
[0018] В одном аспекте настоящего изобретения предложен способ получения компонента топлива из изопрена, включающий: (а) получение коммерчески предпочтительного количества изопрена высокой степени чистоты; и (b) химическое превращение по меньшей мере части коммерчески предпочтительного количества изопрена высокой степени чистоты в компонент топлива. В некоторых вариантах реализации, указанное коммерчески предпочтительное количество изопрена высокой степени чистоты включает биоизопрен.
[0019] В некоторых вариантах реализации, указанное коммерчески предпочтительное количество изопрена высокой степени чистоты получают Согласно этапам, включающим: (i) культивирование клеток, содержащих гетерологичную нуклеиновую кислоту, кодирующую полипептид изопренсинтазы, при подходящих для получения изопрена условиях культивирования, при этом указанные клетки (1) продуцируют более чем приблизительно 400 нмоль изопрена на грамм сырой массы клеток (гсмк) в час, (2) осуществляют превращение более чем приблизительно 0,002 молярного процента углерода, который клетки потребляют из среды для культивирования, в изопрен, или (3) имеют среднюю объемную производительность по изопрену более чем приблизительно 0,1 мг изопрена/лбульона/ч, и (ii) получение изопрена, В некоторых вариантах реализации, указанные клетки дополнительно содержат гетерологичную нуклеиновую кислоту, кодирующую полипептид изопренсинтазы или полипептид мевалонатного пути (MVA).
[0020] В некоторых вариантах реализации способов, описанных в данной заявке, химическое превращение по меньшей мере части коммерчески предпочтительного количества изопрена высокой степени чистоты в компонент топлива включает: (i) нагревание коммерчески предпочтительного количества изопрена высокой степени чистоты до температуры от приблизительно 150°С до приблизительно 250°С; (ii) превращение по меньшей мере части коммерчески предпочтительного количества изопрена высокой степени чистоты в ненасыщенные циклические димеры изопрена;
(iii) гидрирование ненасыщенных циклических димеров изопрена с получением насыщенных циклических димеров изопрена; и (iv) получение компонента топлива. В некоторых вариантах реализации, по меньшей мере от приблизительно 20% до приблизительно 100% изопрена из коммерчески предпочтительного количества изопрена высокой степени чистоты превращают в ненасыщенные циклические димеры изопрена.
[0021] В некоторых вариантах реализации указанного способа, химическое превращение по меньшей мере части коммерчески предпочтительного количества изопрена высокой степени чистоты в компонент топлива включает: (i) приведение коммерчески предпочтительного количества изопрена высокой степени чистоты в контакт с катализатором для катализа циклодимеризации изопрена, (п) превращение по меньшей мере части коммерчески предпочтительного количества изопрена высокой степени чистоты в циклические димеры изопрена; и (iii) получение компонента топлива.
[0022] В некоторых вариантах реализации указанного способа, химическое превращение по меньшей мере части коммерчески предпочтительного количества изопрена высокой степени чистоты в компонент топлива включает: (i) приведение коммерчески предпочтительного количества изопрена высокой степени чистоты в контакт с катализатором для катализа циклодимеризации изопрена, (ii) превращение по меньшей мере части коммерчески предпочтительного количества изопрена высокой степени чистоты в ненасыщенные циклические димеры изопрена; (iii) гидрирование ненасыщенных циклических димеров изопрена с получением насыщенных циклических димеров изопрена; и (iv) получение компонента топлива. В некоторых вариантах реализации указанного способа, катализатор для катализа циклодимеризации изопрена включает катализатор, выбранный из группы, состоящей из никелевого катализатора, железных катализаторов и хромовых катализаторов.
[0023] В некоторых вариантах реализации указанного способа, химическое превращение по меньшей мере части коммерчески предпочтительного количества изопрена высокой степени чистоты в компонент топлива включает; (i) приведение композиции изопрена высокой степени чистоты в контакт с каталитической системой;
(ii) превращение по меньшей мере части исходной композиции изопрена в ненасыщенные димеры и/или тримеры изопрена; и (iii) гидрирование ненасыщенных димеров и/или тримеров с получением насыщенных С10 и/или С15-углеводородов.
[0024] В некоторых вариантах реализации, указанный способ получения компонента топлива из изопрена включает: (а) получение коммерчески предпочтительного количества любой из исходных композиций изопрена высокой степени чистоты, описанных в данной заявке; (b) превращение по меньшей мере части исходной композиции изопрена в кислородсодержащие производные изопрена; и возможно (с) гидрирование любых ненасыщенных кислородсодержащих производных изопрена с получением насыщенных оксигенатов. В некоторых вариантах реализации, указанные кислородсодержащие производные изопрена представляют собой соединения, выбранные из группы, состоящей из спиртов, кетонов, сложных и простых эфиров, полученных из изопрена.
[0025] В некоторых вариантах реализации, любой из способов, описанных в данной заявке, дополнительно включает очистку коммерчески предпочтительного количества изопрена высокой степени чистоты перед химическим превращением по меньшей мере части коммерчески предпочтительного количества изопрена высокой степени чистоты в компонент топлива.
[0026] В одном аспекте предусмотрен непрерывный процесс получения компонента топлива из изопрена, включающий: (а) непрерывное получение коммерчески предпочтительного количества изопрена высокой степени чистоты; и (b) непрерывное химическое превращение по меньшей мере части коммерчески предпочтительного количества изопрена высокой степени чистоты в компонент топлива. В некоторых вариантах реализации, указанное коммерчески предпочтительное количество изопрена высокой степени чистоты включает газообразную фазу, содержащую изопрен. В некоторых вариантах реализации, указанный способ дополнительно включает пропускание газообразной фазы, содержащей изопрен, в реактор для химического превращения по меньшей мере части коммерчески предпочтительного количества изопрена высокой степени чистоты в компонент топлива. В предпочтительном варианте реализации, указанное коммерчески предпочтительное количество изопрена высокой степени чистоты включает биоизопрен.
[0027] Также предусмотрена топливная композиция, содержащая компонент топлива, полученный с помощью любого из способов, описанных в данной заявке. В некоторых вариантах реализации, указанный компонент топлива включает меньше или приблизительно 0,5 мкг/л продукта из С5-углеводорода, отличного от изопрена, после того, как его подвергли этапам Согласно способам, описанным в данной заявке. В некоторых вариантах реализации, указанный компонент топлива включает один или более продуктов из одного или нескольких соединений, выбранных из группы, состоящей из этанола, ацетона, метанола, ацетальдегида, метакролеина, метилвинилкетона, 2-метил-2-винилоксирана, цис- и транс-3-метил-1,3-пентадиена, пренильных спиртов С5, 2-гептанона, 6-метил-5-гептен-2-она, 2,4,5-триметилпиридина, 2,3,5-триметилпиразина, цитронеллаля, метантиола, метилацетата, 1-пропанола, диацетила, 2-бутанона, 2-метил-3-бутен-2-ола, этилацетата, 2-метил-1-пропанола, 3-метил-1-бутаналя, 3-метил-2-бутанона, 1-бутанола, 2-пентанона, 3-метил-1-бутанола, этилизобутирата, 3-метил-2-бутеналя, бутилацетата, 3-метилбутилацетата, 3-метил-3-бутен-1-ил ацетата, 3-метил-2-бутен-1-ил ацетата, 3-гексен-1-ола, 3-гексен-1-ил ацетата, лимонена, гераниола (транс-3,7-диметил-2,6-октадиен-1-ола), цитронеллола (3,7-диметил-6-октен-1-ола), (Е)-3,7-диметил-1,3,6-октатриена, (Z)-3,7-диметил-1,3,6-октатриена и 2,3-циклогептенолпиридина, после того, как его подвергли этапам Согласно способам, описанным в данной заявке.
[0028] В некоторых вариантах реализации, указанная топливная композиция включает топливную композицию, имеющую значение δ13С, большее чем -22‰. В некоторых вариантах реализации, указанная топливная композиция имеет значение δ13С, которое находится в диапазоне от -22‰ до -10‰ или от -34‰ до -24‰. В некоторых вариантах реализации, указанная топливная композиция имеет значение fм, более чем 0,9. Также предложена смесь любой из топливных композиций, описанных в данной заявке, с топливом на нефтяной основе в количестве от приблизительно 1% до приблизительно 95% по массе или объему, от общей массы или объема всей топливной композиции.
КРАТКОЕ ОПИСАНИЕ ФИГУР
[0029] Фигура 1 представляет собой последовательность нуклеотидов гена изопренсинтазы кудзу, кодон-оптимизированную для экспрессии в Е. coli (SEQ ID NO:1). Инициирующий кодон atg выделен курсивом, стоп-кодон выделен жирным шрифтом и вставленный сайт для PstI подчеркнут.
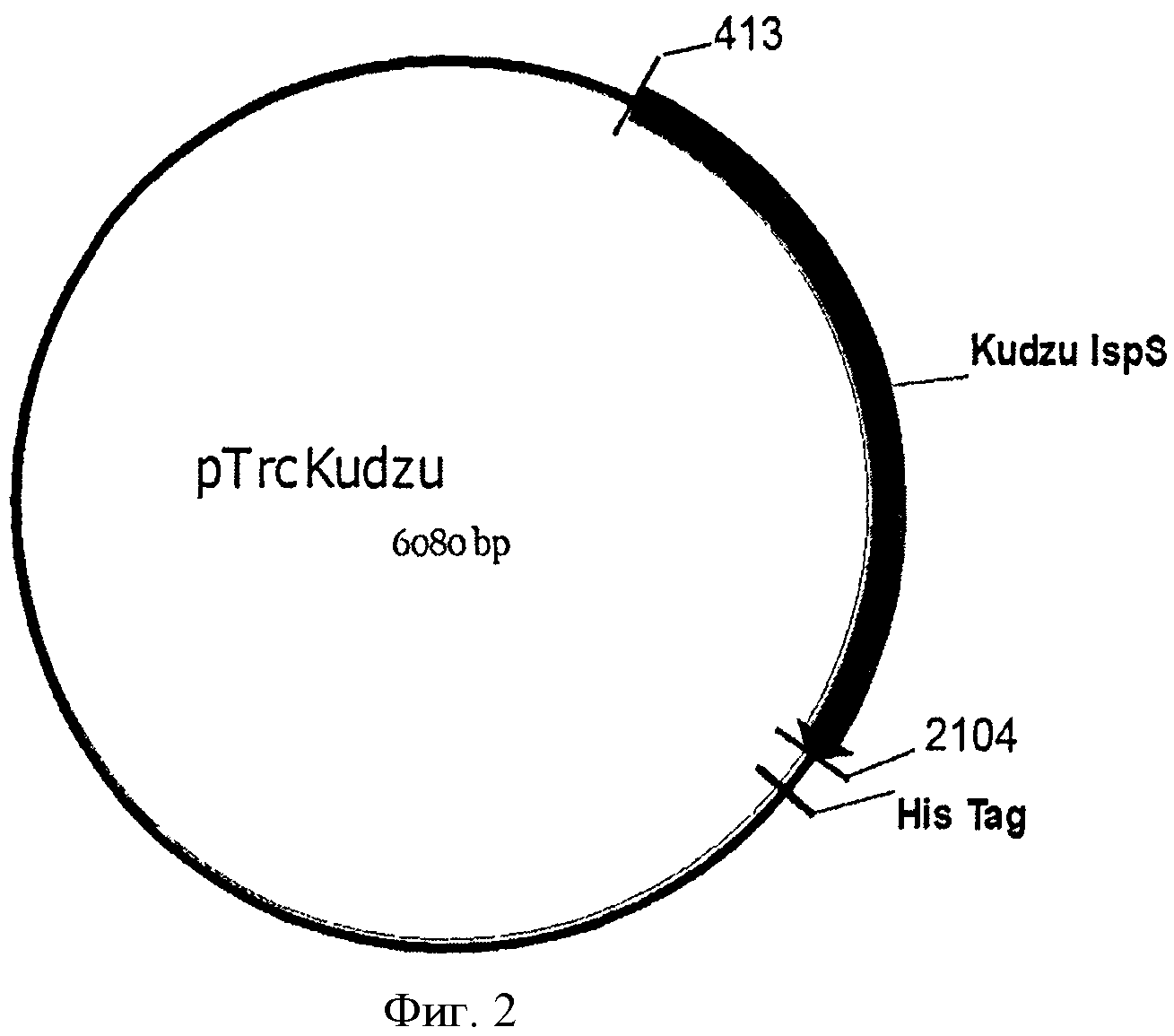
[0030] Фигура 2 представляет собой карту pTrcKudzu.
[0031] Фигуры 3А-С представляют собой последовательность нуклеотидов pTrcKudzu (SEQ ID NO: 2). Сайт связывания рибосом (RBS) подчеркнут, инициирующий кодон изопренсинтазы кудзу обозначен жирными заглавными буквами и стоп-кодон обозначен жирными заглавными буквами. Остов вектора представляет собой pTrcHis2B.
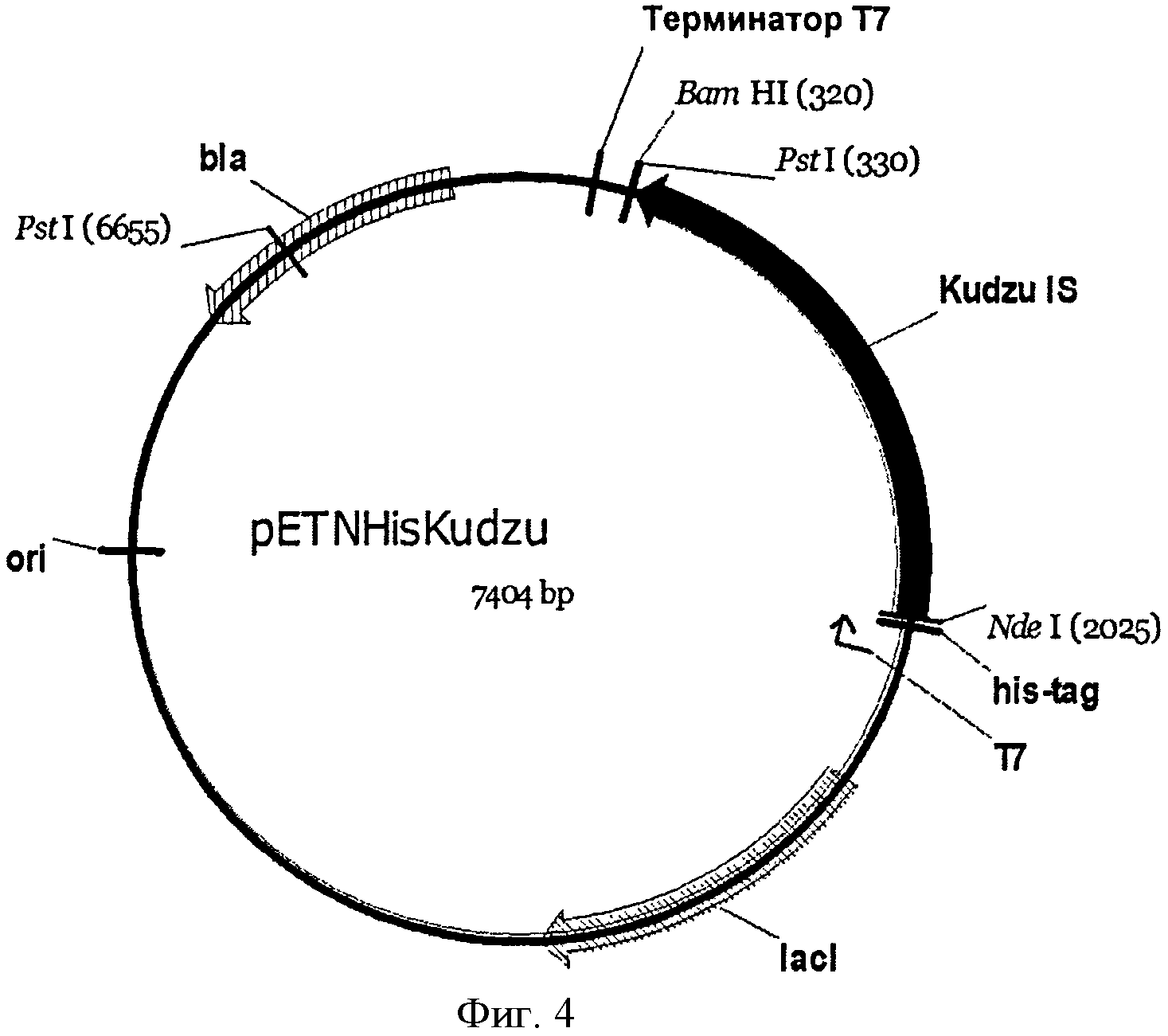
[0032] Фигура 4 представляет собой карту pETNHisKudzu.
[0033] Фигуры 5А-С представляют собой последовательность нуклеотидов pETNHisKudzu (SEQ ID NO: 3).
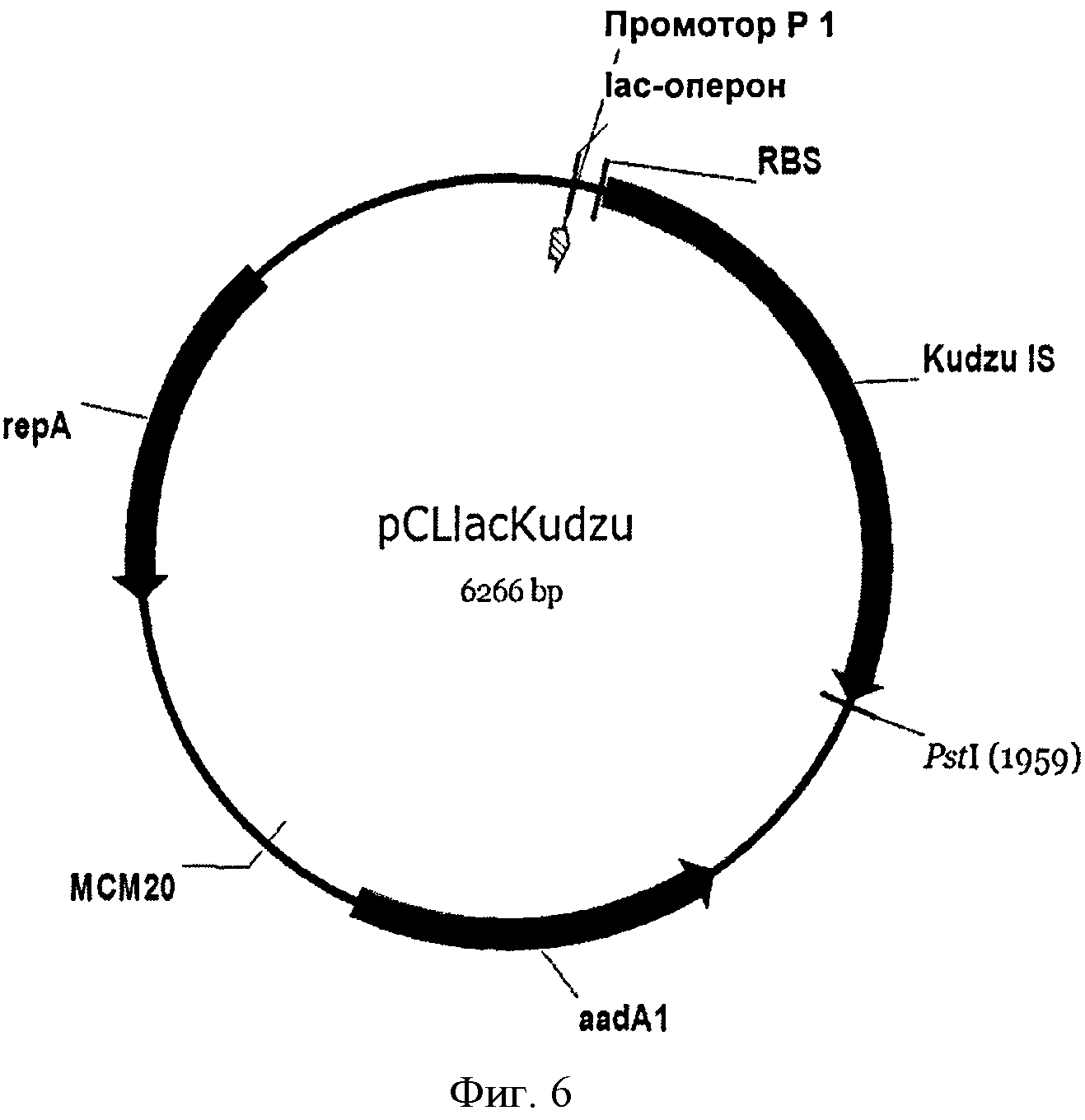
[0034] Фигура 6 представляет собой карту pCL-lac-Kudzu.
[0035] Фигуры 7А-С представляют собой последовательность нуклеотидов pCL-lac-Kudzu (SEQ ID NO: 4).
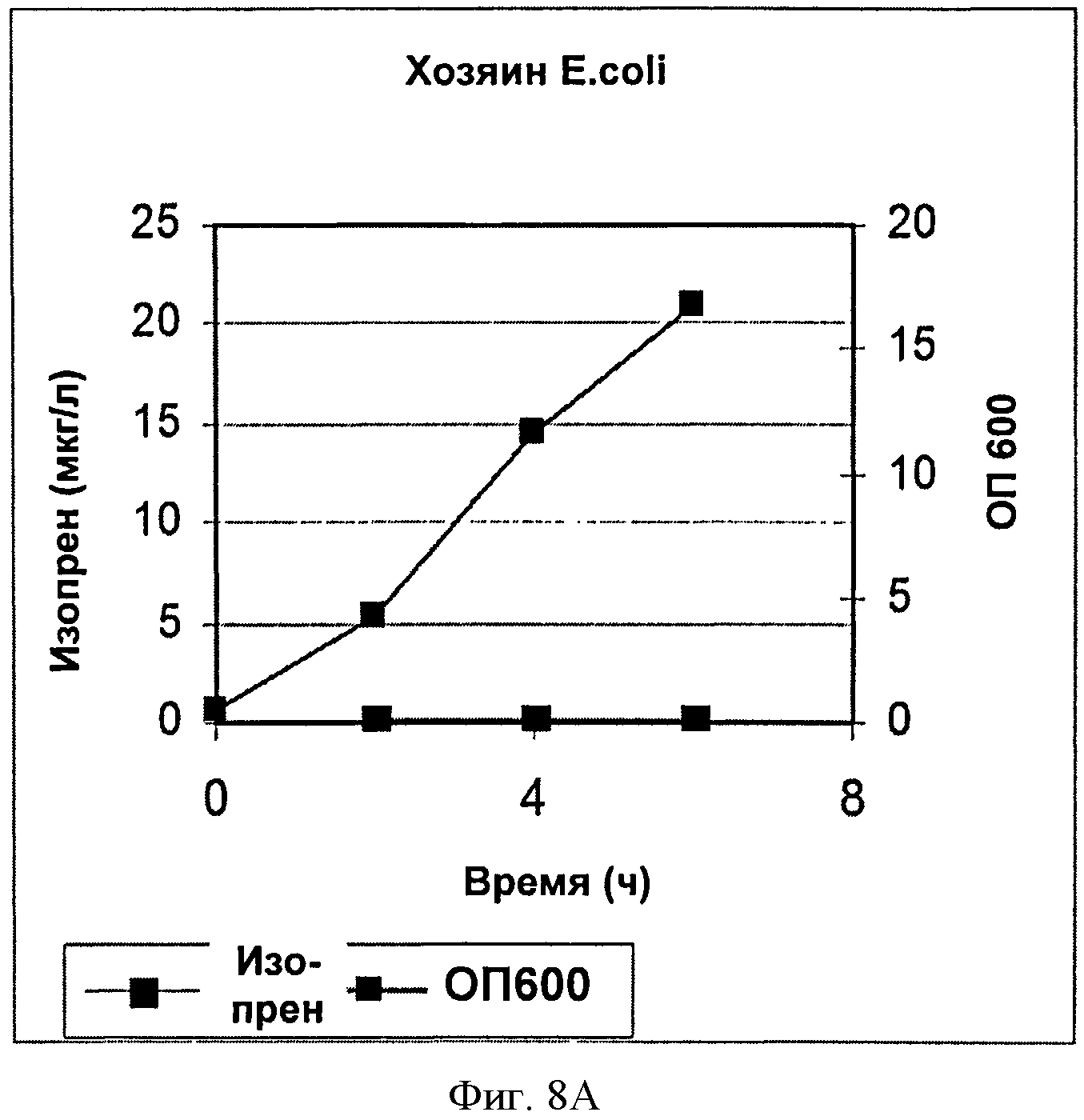
[0036] Фигура 8А представляет собой график, на котором изображена продукция изопрена клетками BL21 Е. coli без вектора.
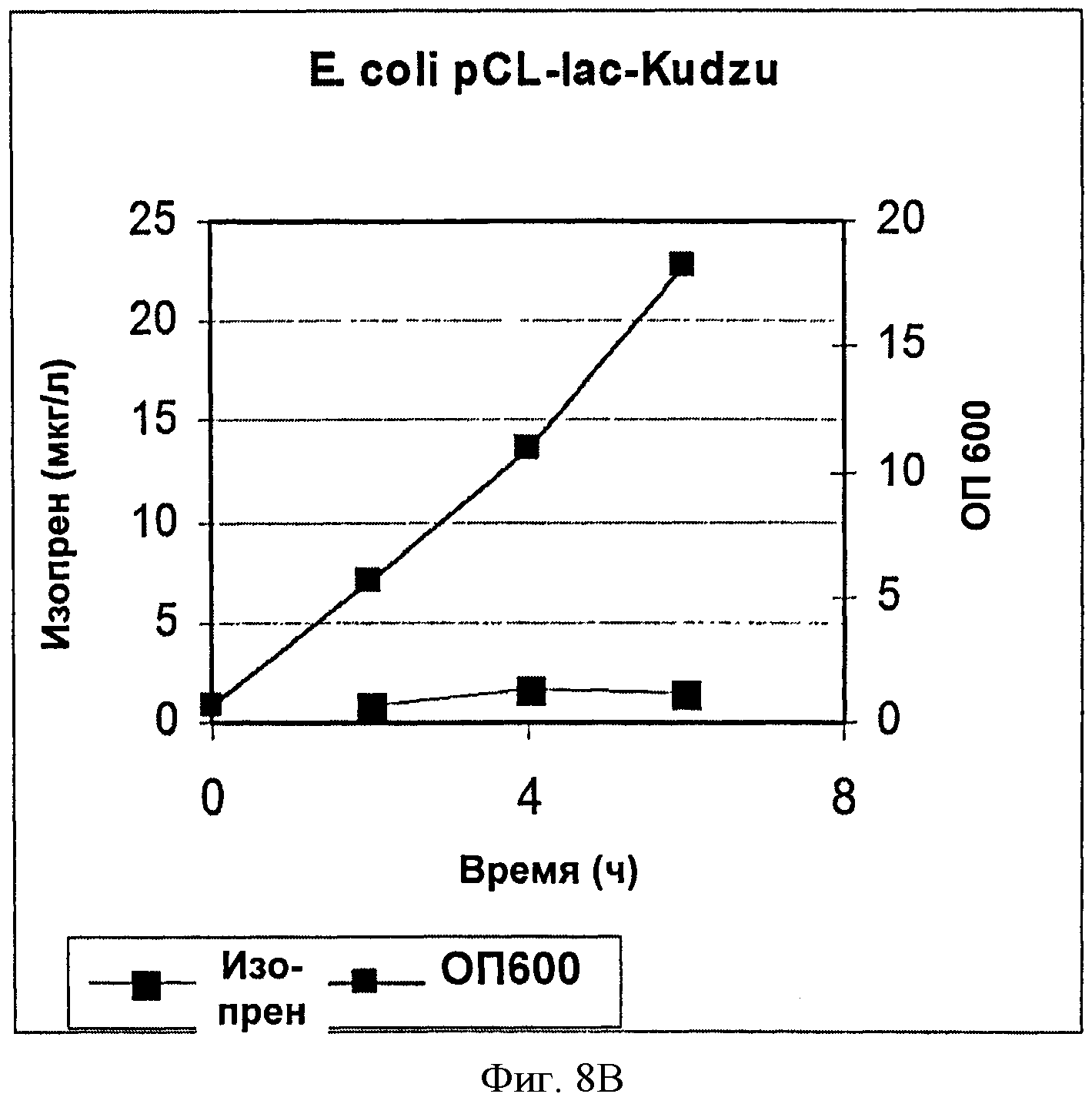
[0037] Фигура 8В представляет собой график, на котором изображена продукция изопрена клетками BL21 Е. coli с pCL-lac-Kudzu.
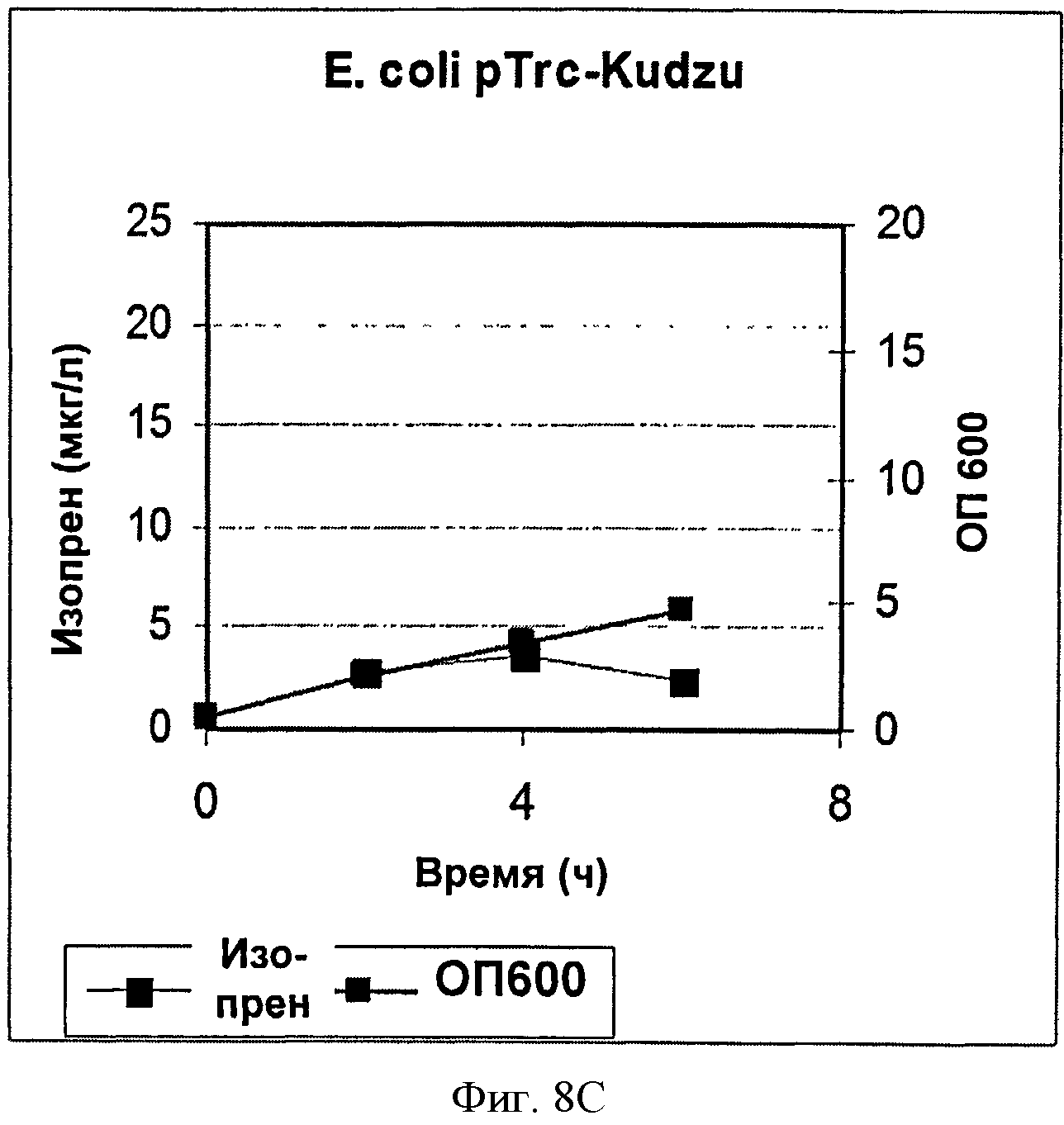
[0038] Фигура 8С представляет собой график, на котором изображена продукция изопрена клетками BL21 Е, coli с pTrcKudzu.
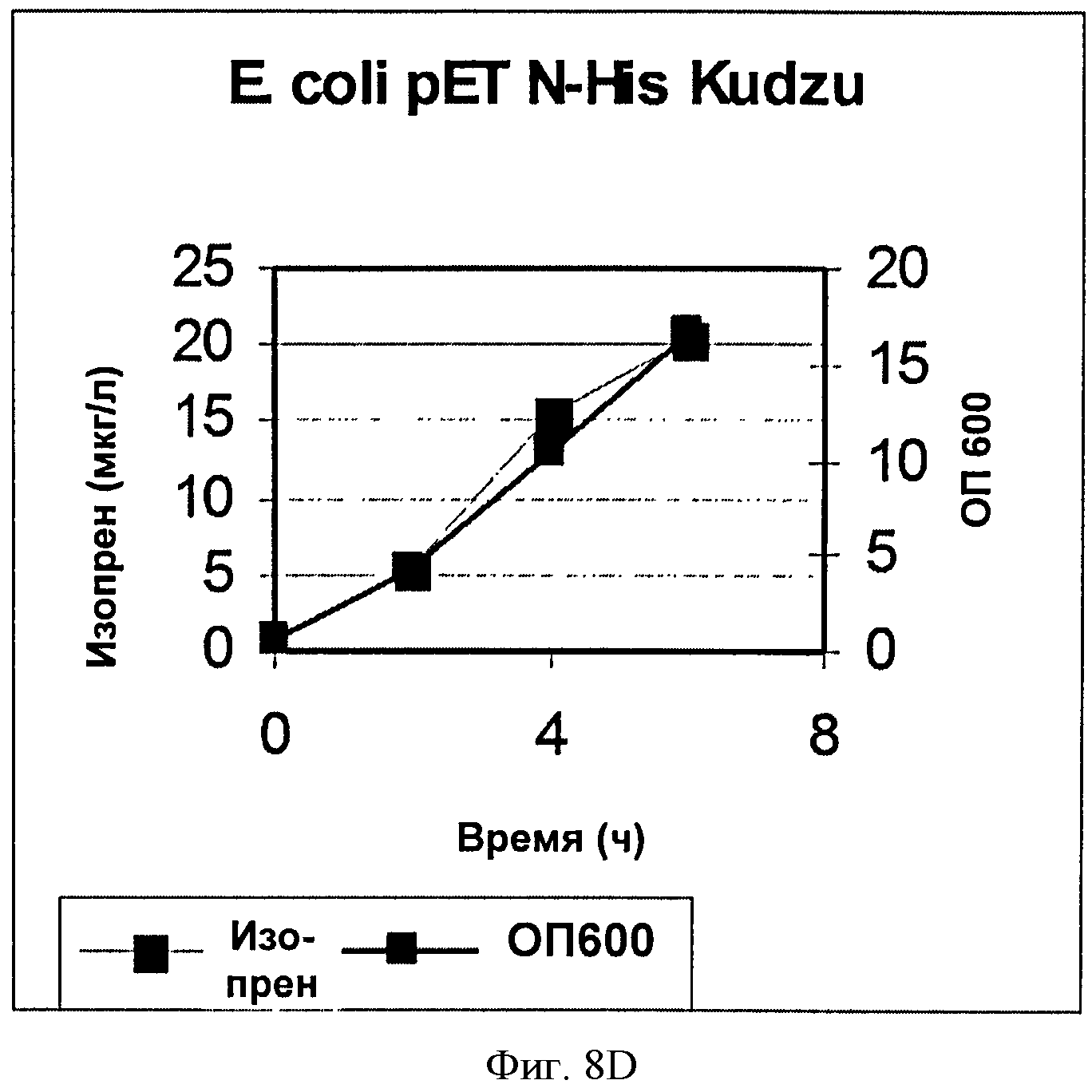
[0039] Фигура 8D представляет собой график, на котором изображена продукция изопрена клетками BL21 Е. coli с pETN-HisKudzu.
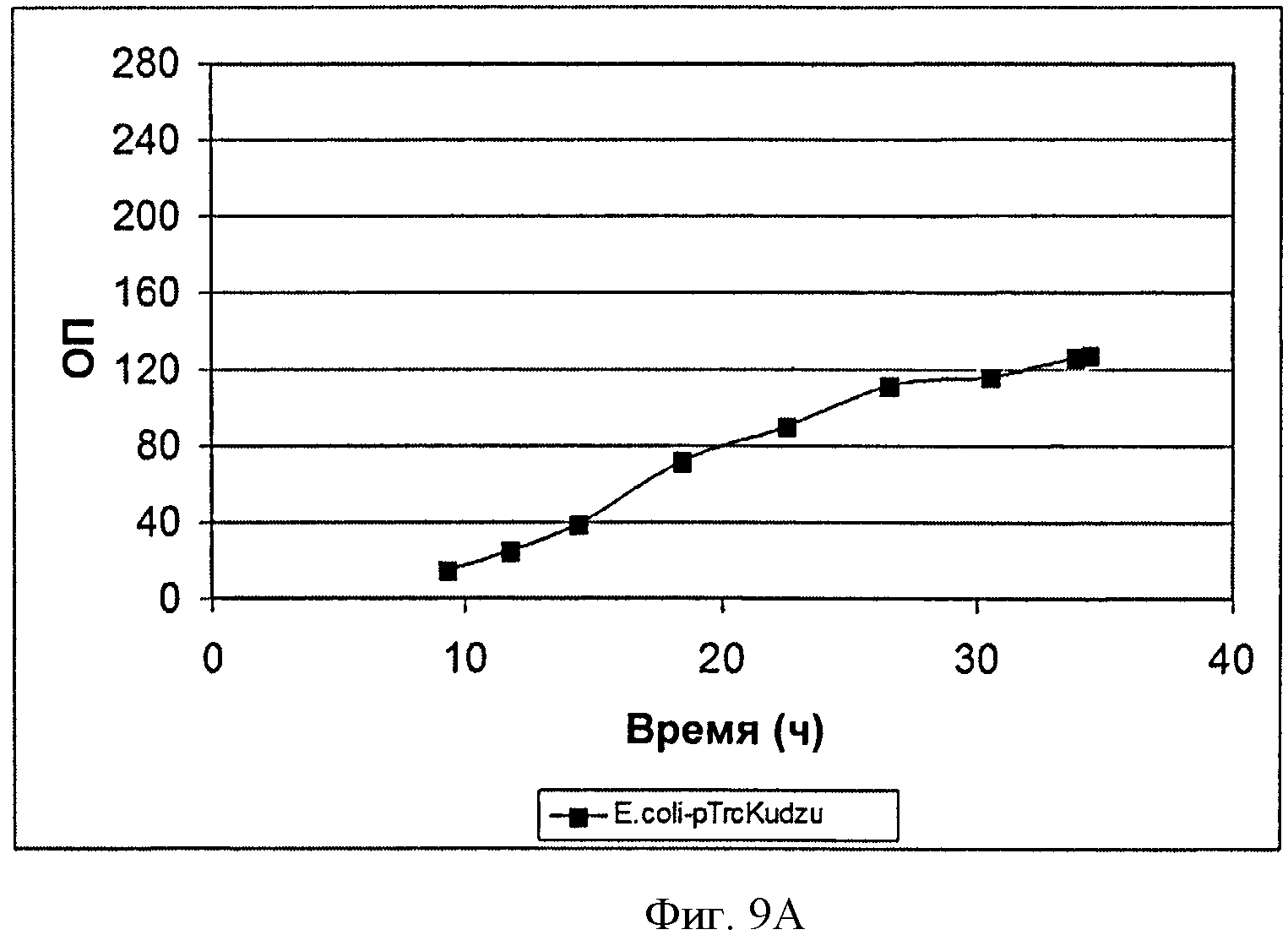
[0040] Фигура 9А представляет собой график, на котором изображена зависимость ОП от времени при ферментации BL21/pTrcKudzu Е. coli в 14-литровом ферментаторе периодического действия с подпиткой.
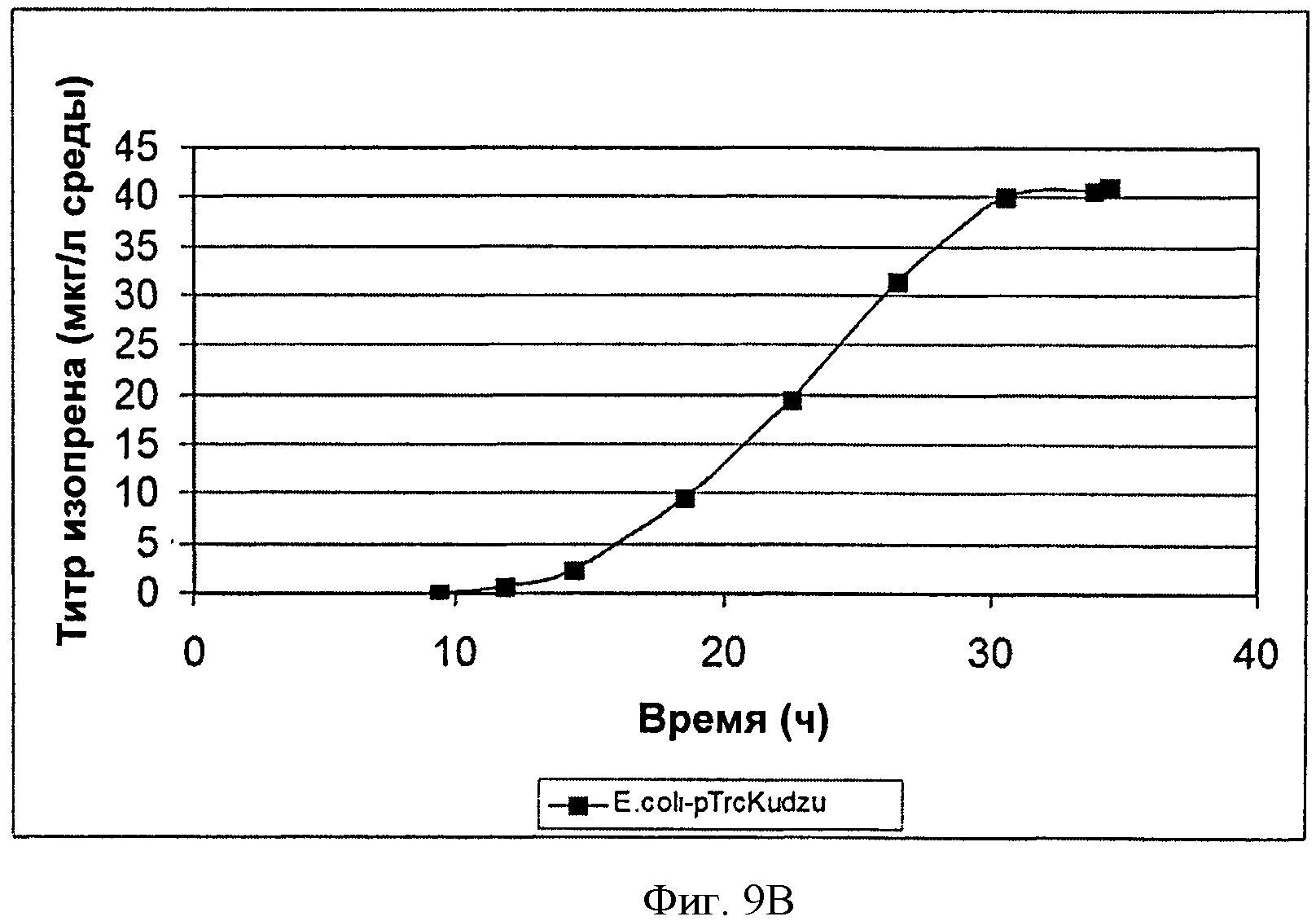
[0041] Фигура 9В представляет собой график, на котором изображена зависимость продукции изопрена от времени при ферментации BL21/pTrcKudzu Е. coli в 14-литровом ферментаторе периодического действия с подпиткой.
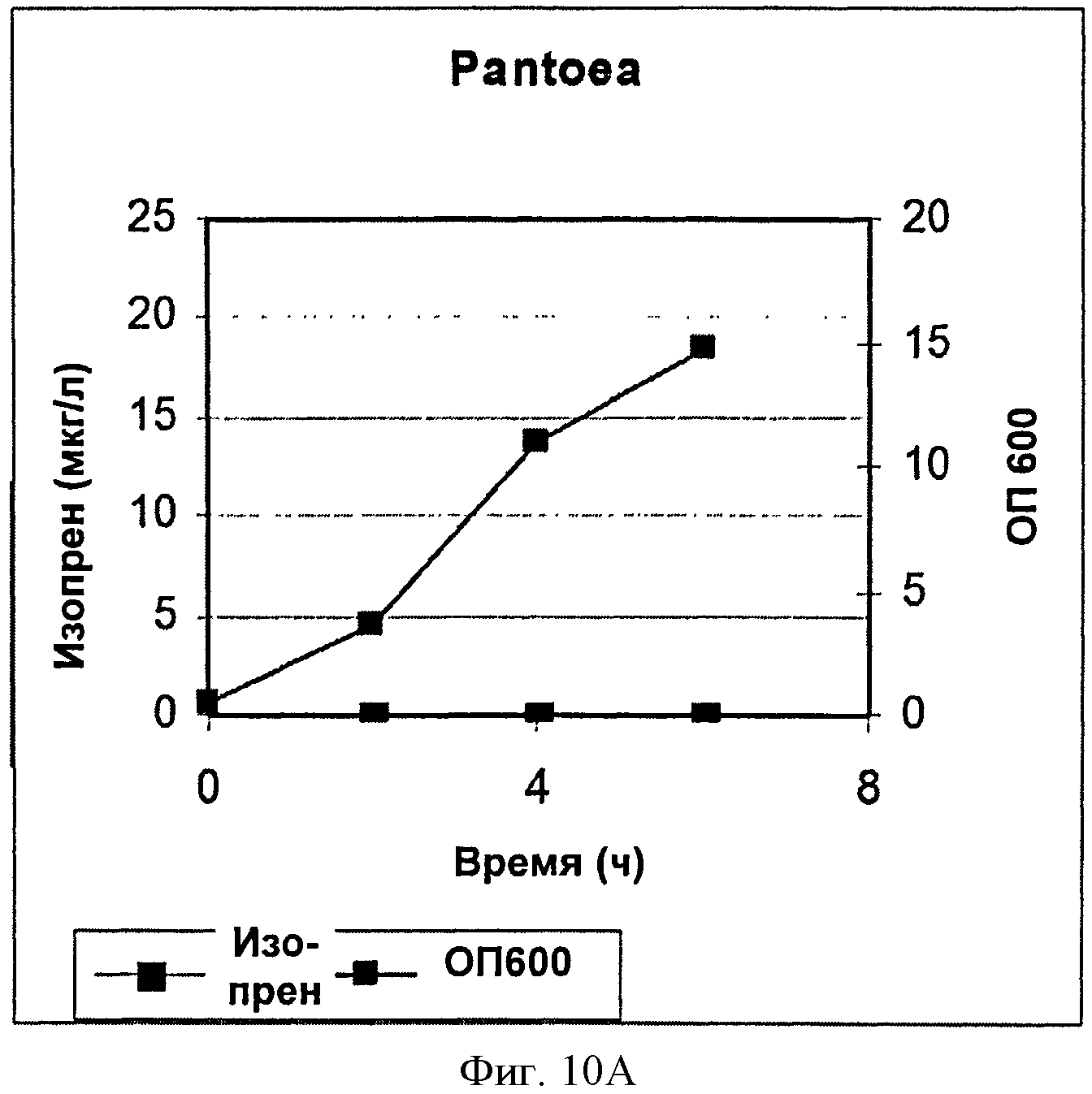
[0042] Фигура 10А представляет собой график, на котором изображена продукция изопрена контрольными клетками Panteoa citrea без рекомбинантной изопренсинтазы кудзу. Серые ромбы представляют синтез изопрена, черные квадраты представляют ОП600.
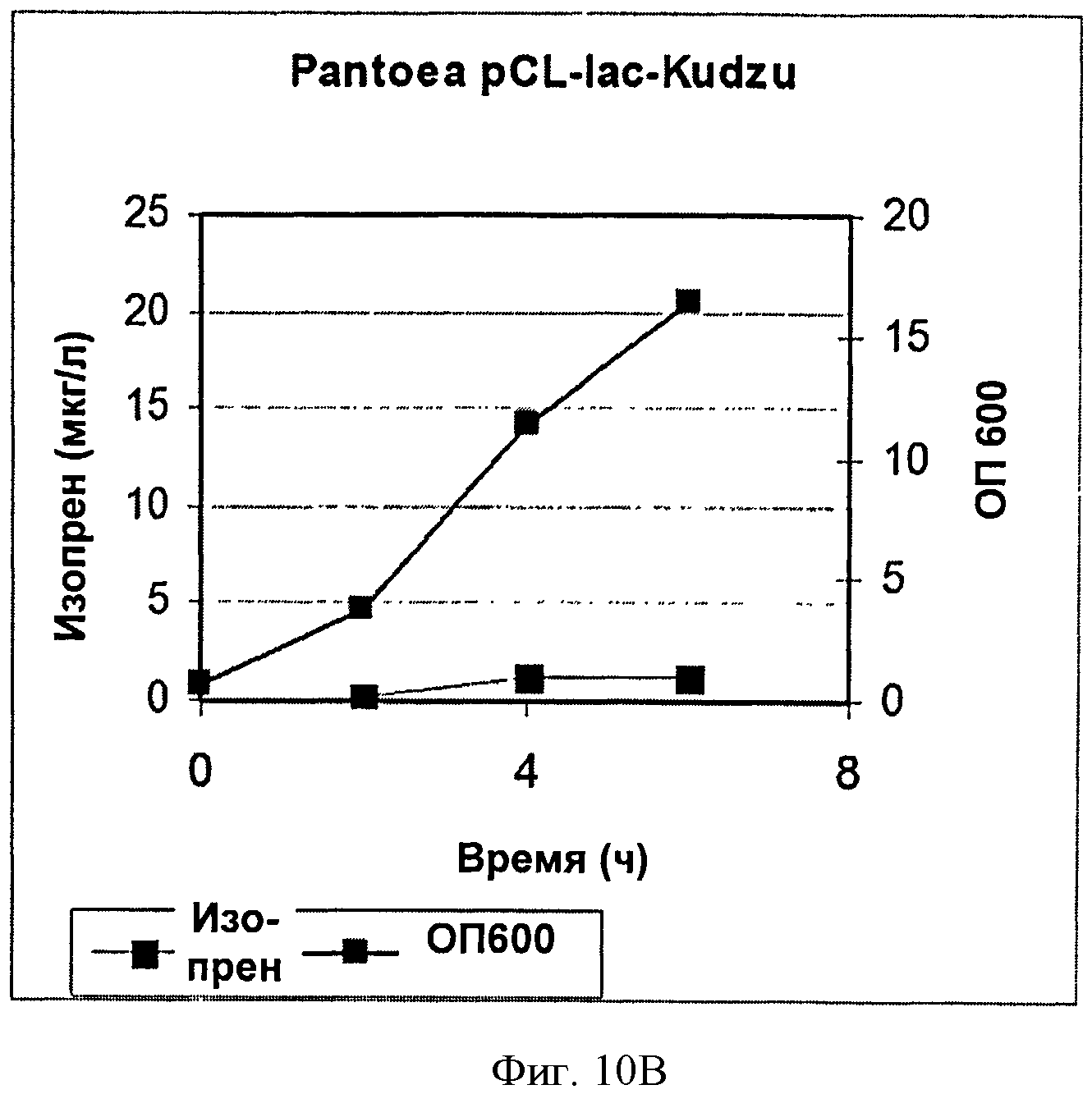
[0043] Фигура 10В представляет собой график, на котором изображена продукция изопрена клетками Panteoa citrea, экспрессирующими pCL-lac-Kudzu. Серые ромбы представляют синтез изопрена, черные квадраты представляют ОП600.
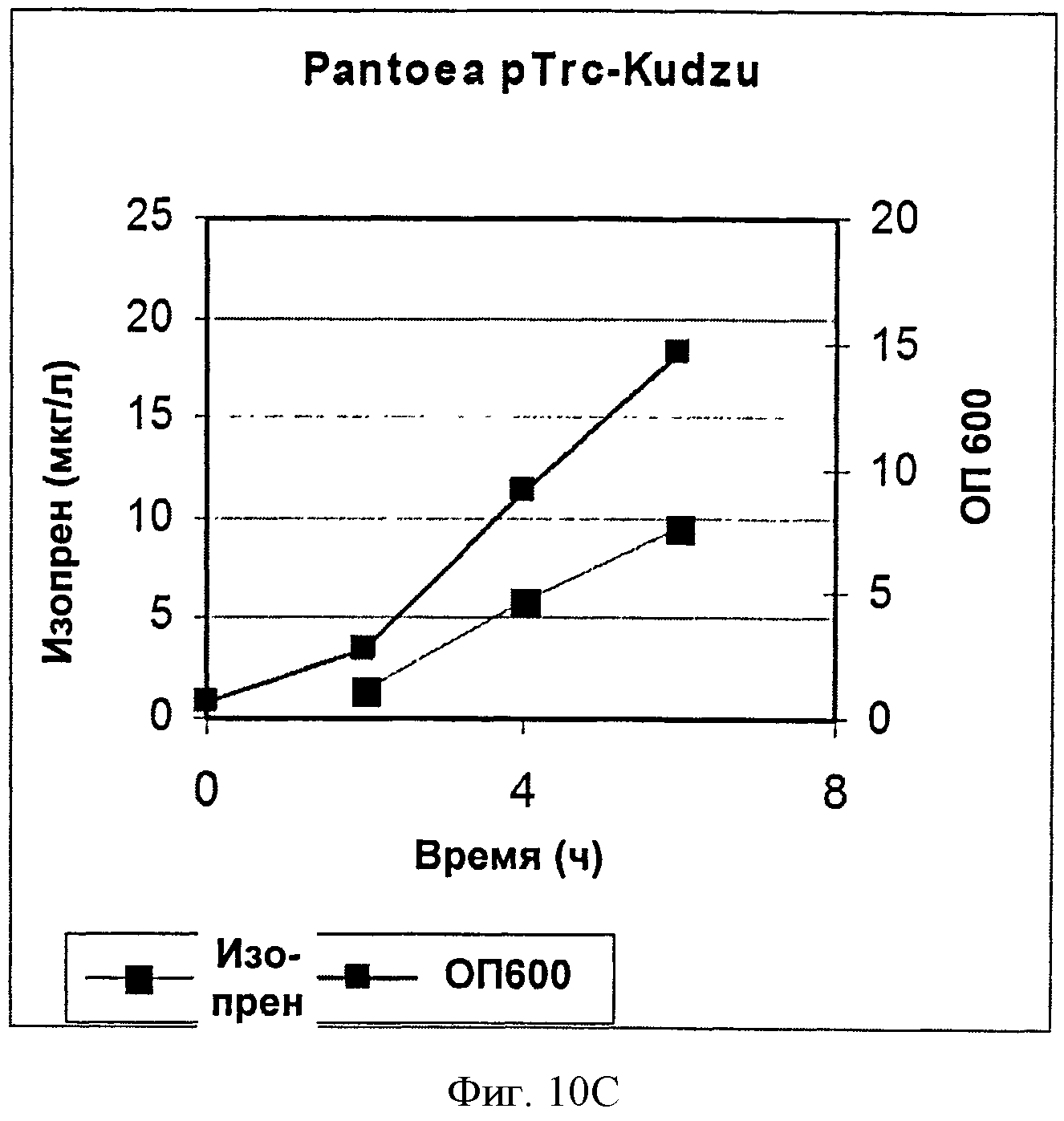
[0044] Фигура 10С представляет собой график, на котором изображена продукция изопрена клетками Panteoa citrea, экспрессирующими pTrcKudzu. Серые ромбы представляют синтез изопрена, черные квадраты представляют ОП600.
[0045] Фигура 11 представляет собой график, на котором изображена продукция изопрена клетками Bacillus subtilis, экспрессирующими рекомбинантную изопренсинтазу. BG3594comK представляет собой штамм В. subtilis без плазмиды (продукция нативного изопрена). CF443 представляет собой штамм BG3594comK В. subtilis с pBS Kudzu (продукция рекомбинантного изопрена). IS на оси у обозначает изопрен.
[0046] Фигуры 12А-С представляют собой последовательность нуклеотидов pBS Kudzu #2 (SEQ ID NO: 5).
[0047] Фигура 13 представляет собой последовательность нуклеотидов изопренсинтазы кудзу, кодон-оптимизированную для экспрессии в Yarrowia (SEQ ID NO: 6).
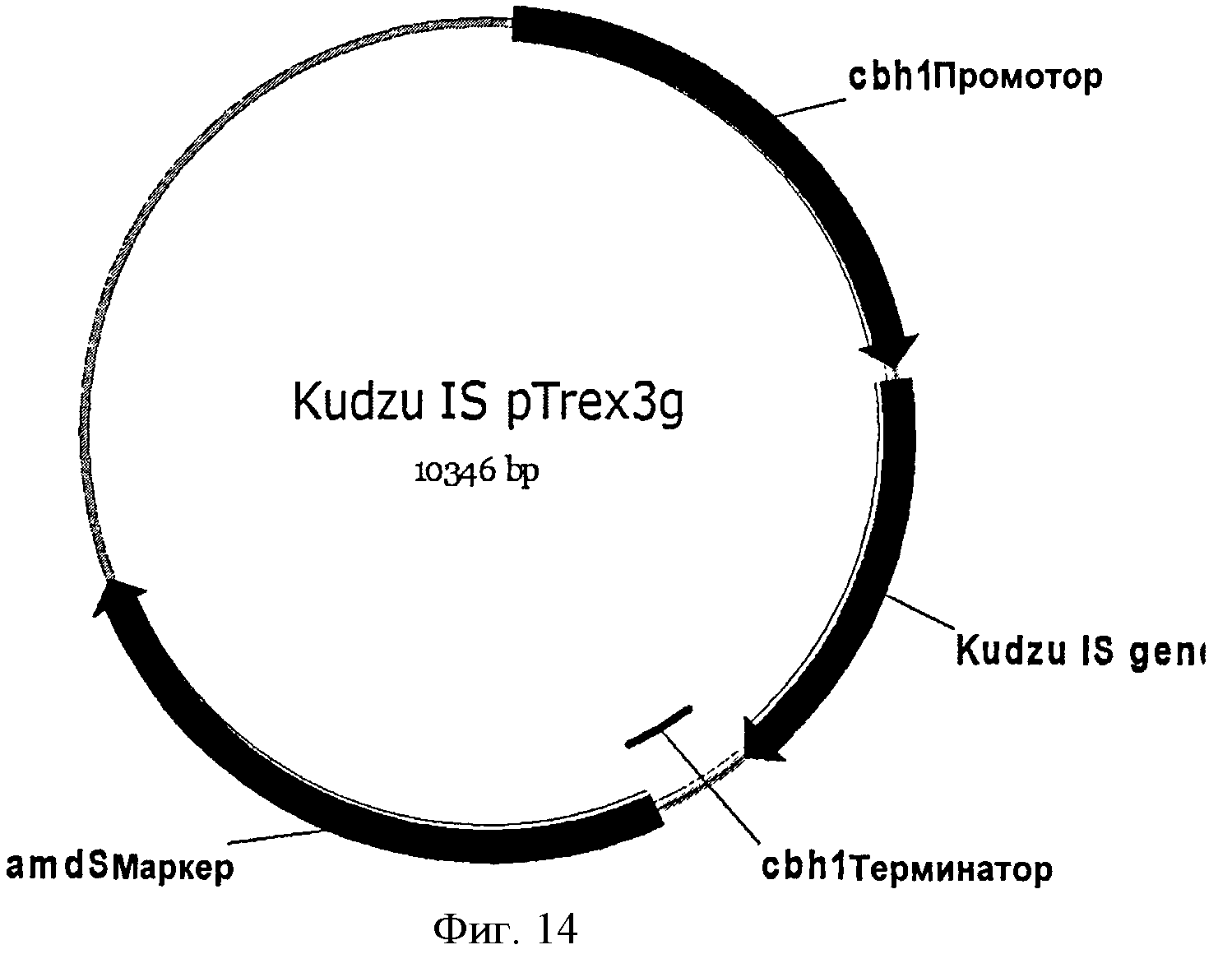
[0048] Фигура 14 представляет собой карту pTrex3g, содержащей ген изопренсинтазы кудзу, кодон-оптимизированный для экспрессии в Yarrowia.
[0049] Фигуры 15А-С представляют собой последовательность нуклеотидов вектора pSPZl(MAP29Spb) (SEQ ID NO: 7).
[0050] Фигура 16 представляет собой последовательность нуклеотидов синтетического гена изопренсинтазы кудзу (Pueraria montand), кодон-оптимизированную для экспрессии в Yarrowia (SEQ ID NO: 8).
[0051] Фигура 17 представляет собой последовательность нуклеотидов синтетического гена изопренсинтазы гибридного тополя (Populus alba x Populus tremula) (SEQ ID NO: 9). Инициирующий кодон ATG выделен жирным шрифтом и стоп-кодон подчеркнут.
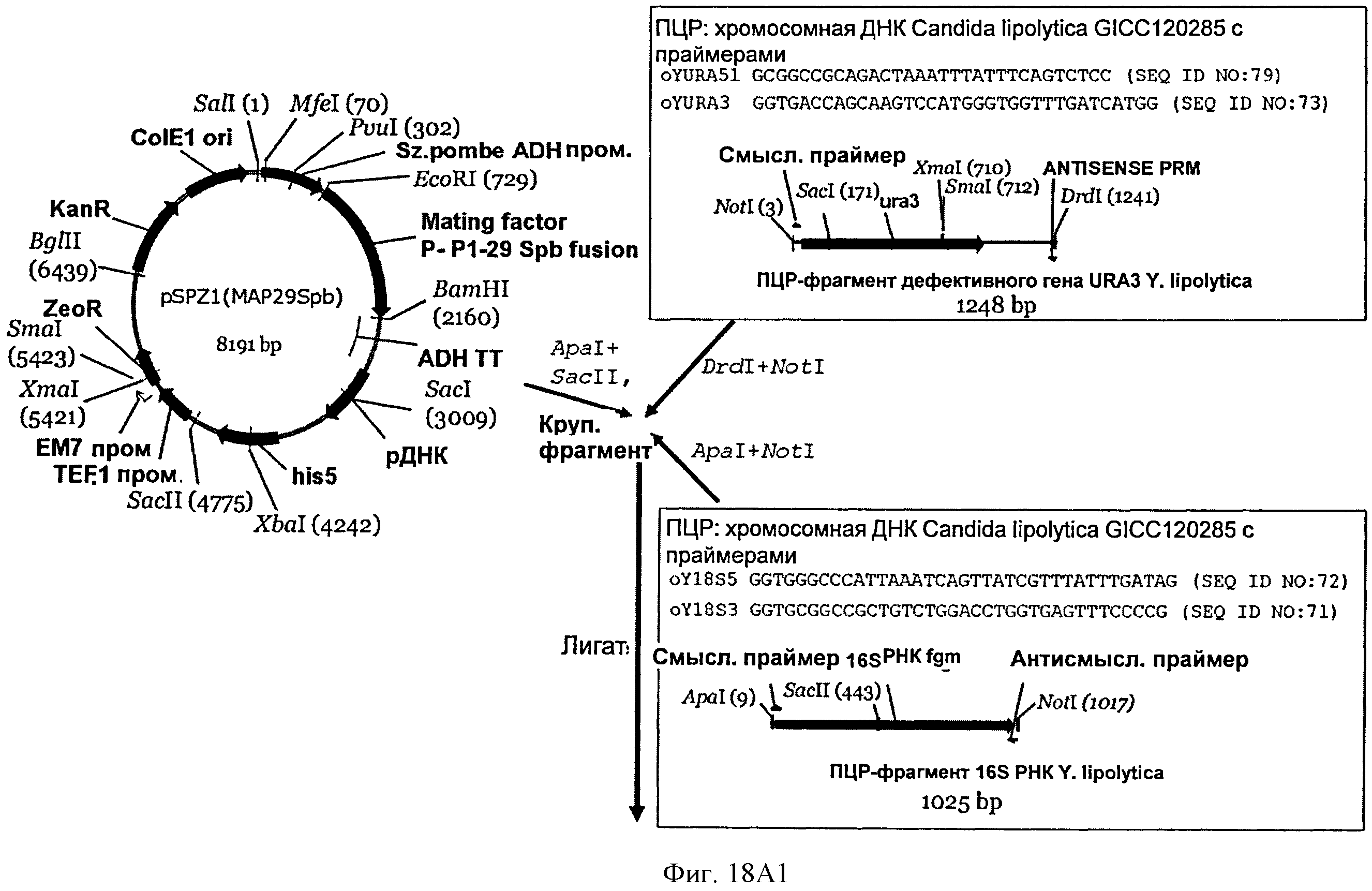
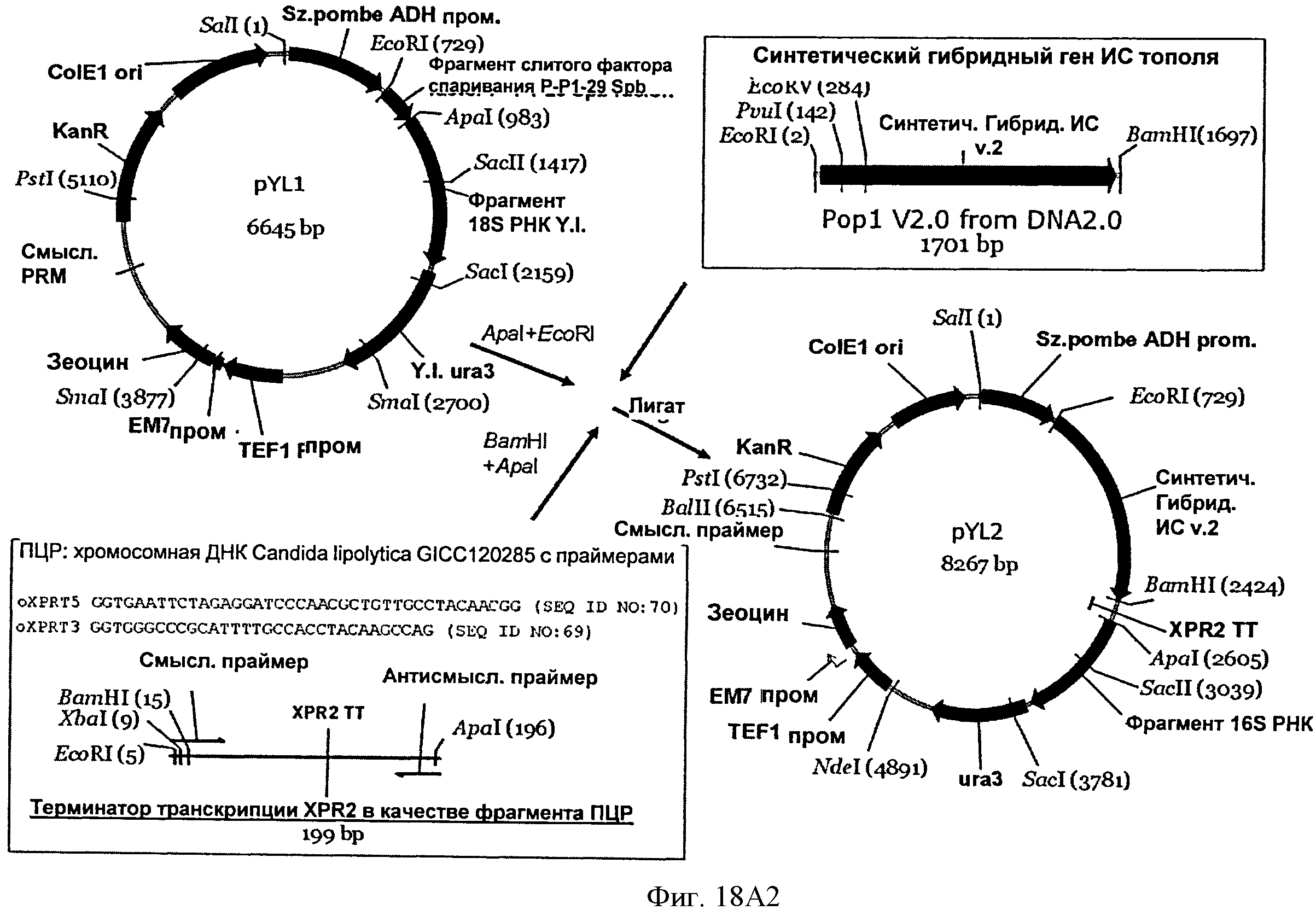
[0052] На Фигуре 18А (Фигуры 18А1 и 18А2) в контуре схематически показано конструирование векторов pYLA I, pYLl и pYL2 (SEQ ID NO: 75, 73. 72, 71, 70, 69).
[0053] На Фигуре 18В схематически показан план конструирования вектора pYLA(POPl) (SEQ ID NO: 68, 69).
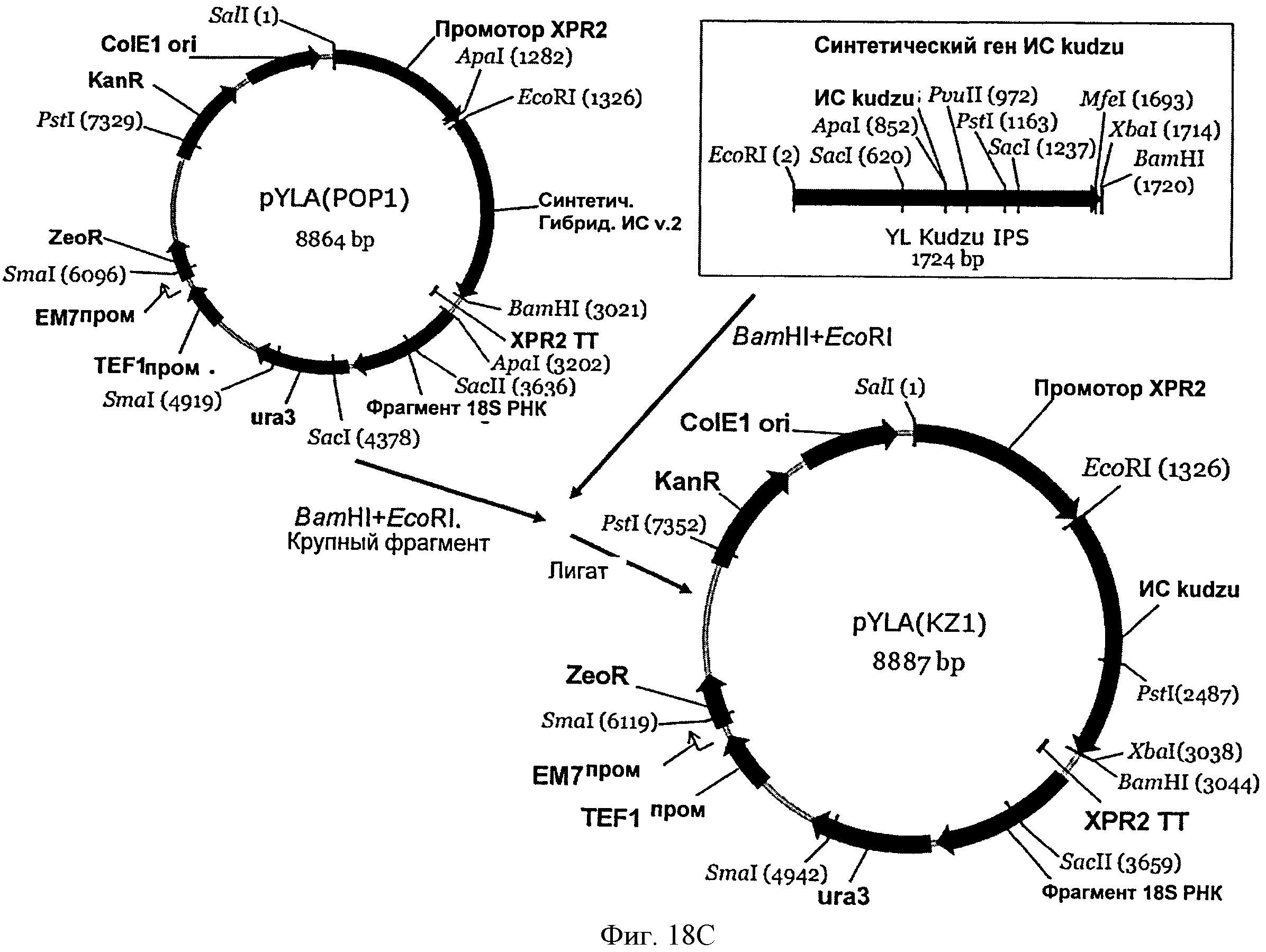
[0054] На Фигуре 18С схематически показан план конструирования вектора pYLA(KZl).
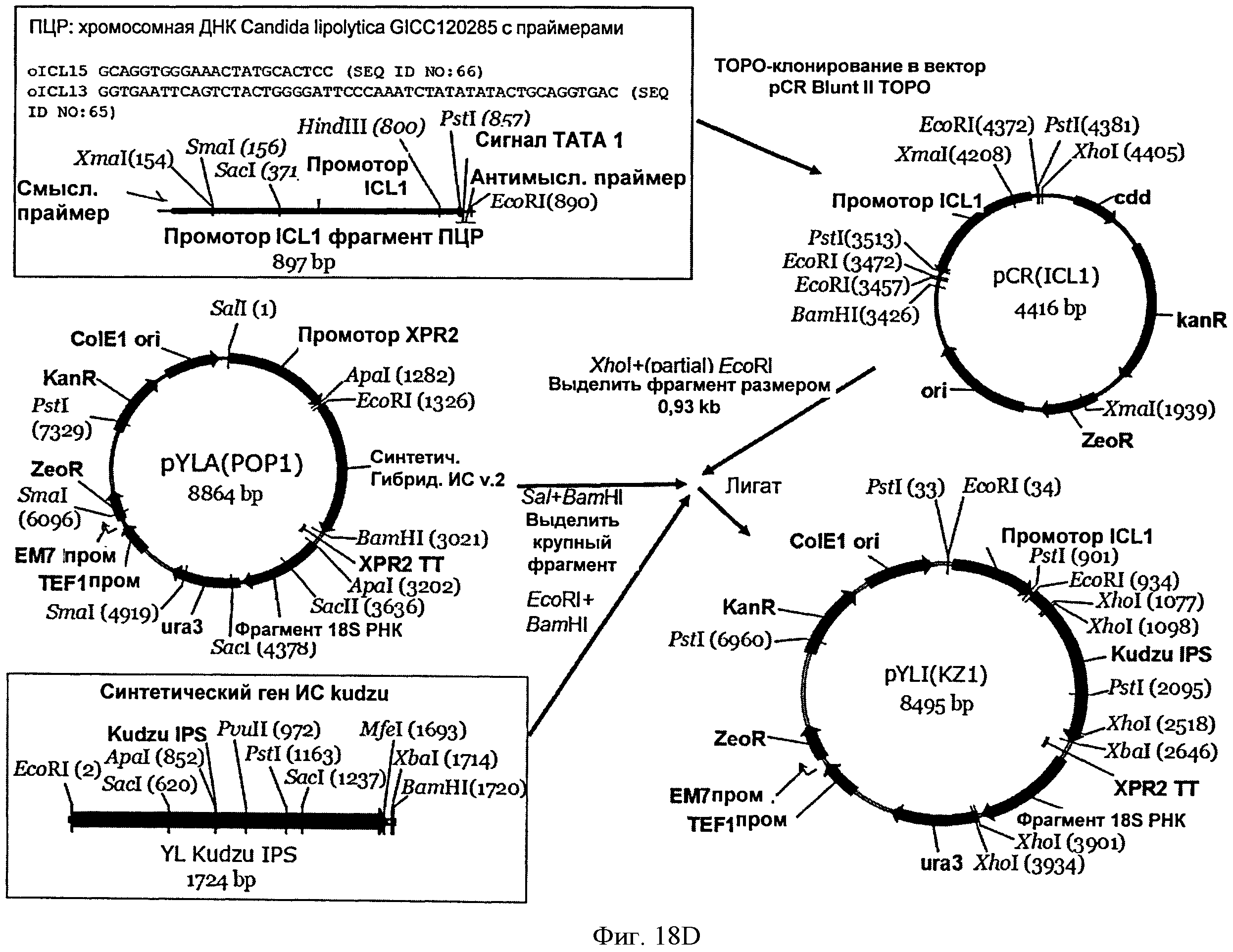
[0055] На Фигуре 18D схематически показан план конструирования вектора pYLI(KZl) (SEQ ID NO: 66, 67).
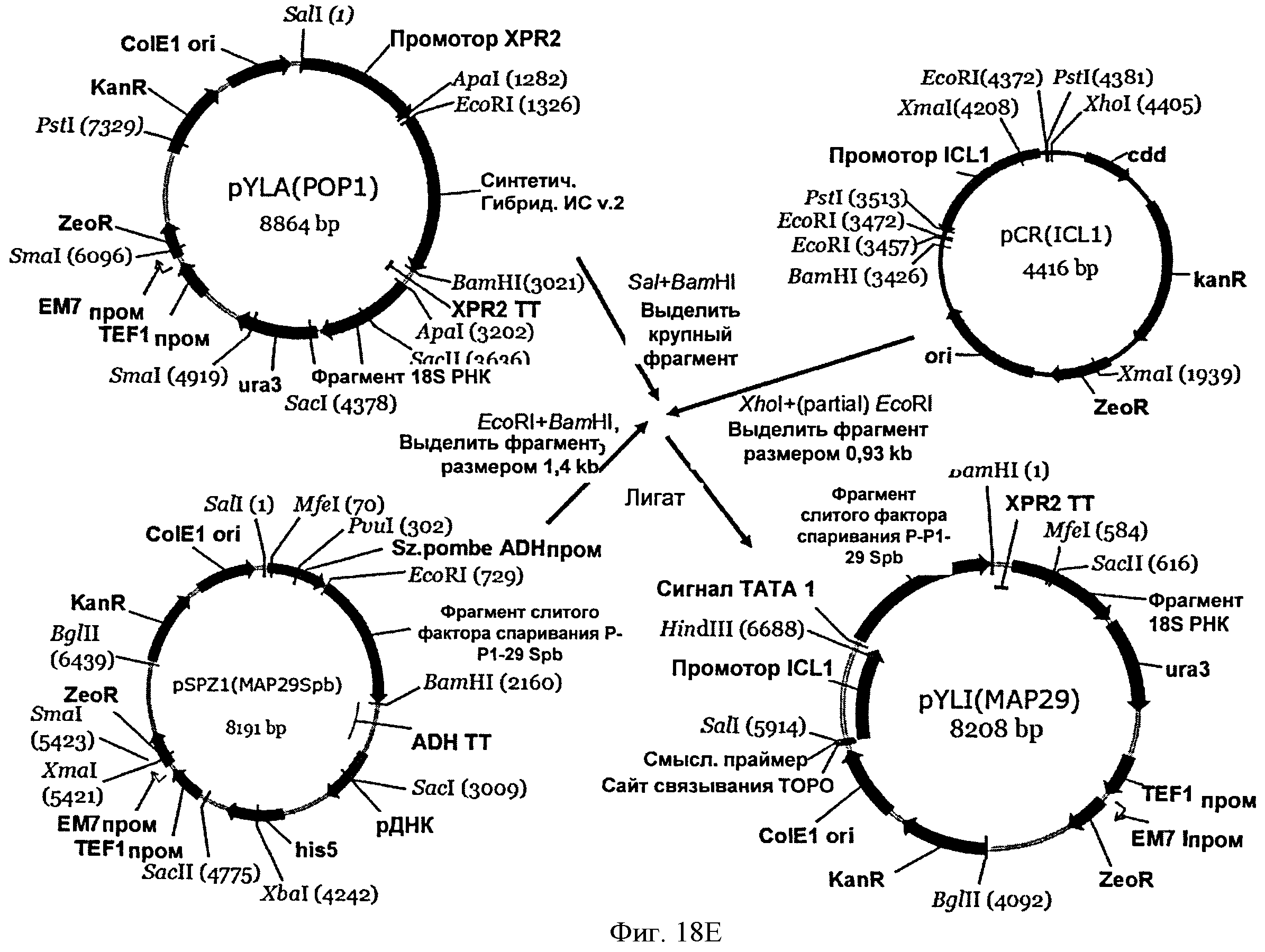
[0056] На Фигуре 18Е схематически показан план конструирования вектора pYLI(MAP29).
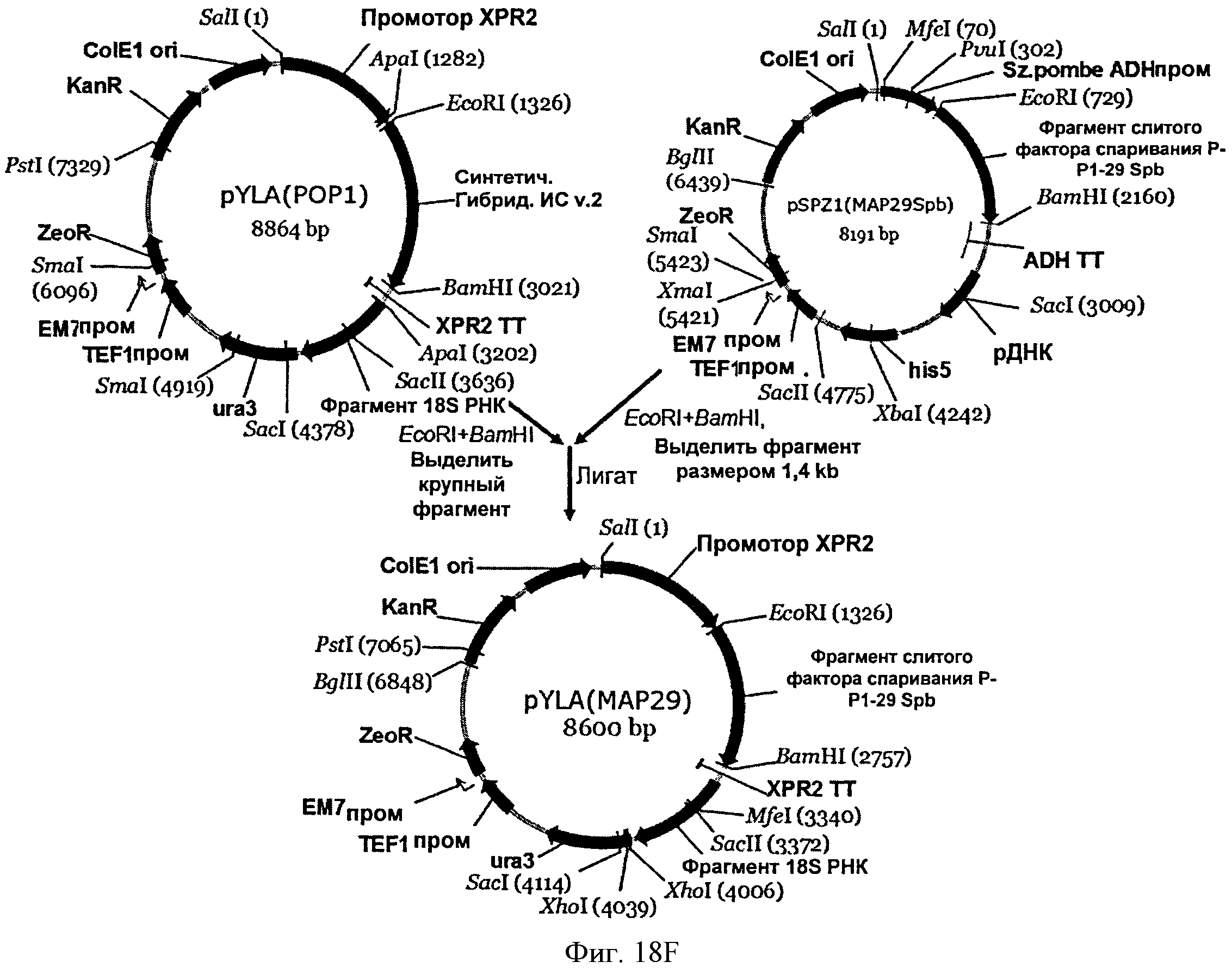
[0057] На Фигуре 18F схематически показан план конструирования вектора pYLA(MAP29).
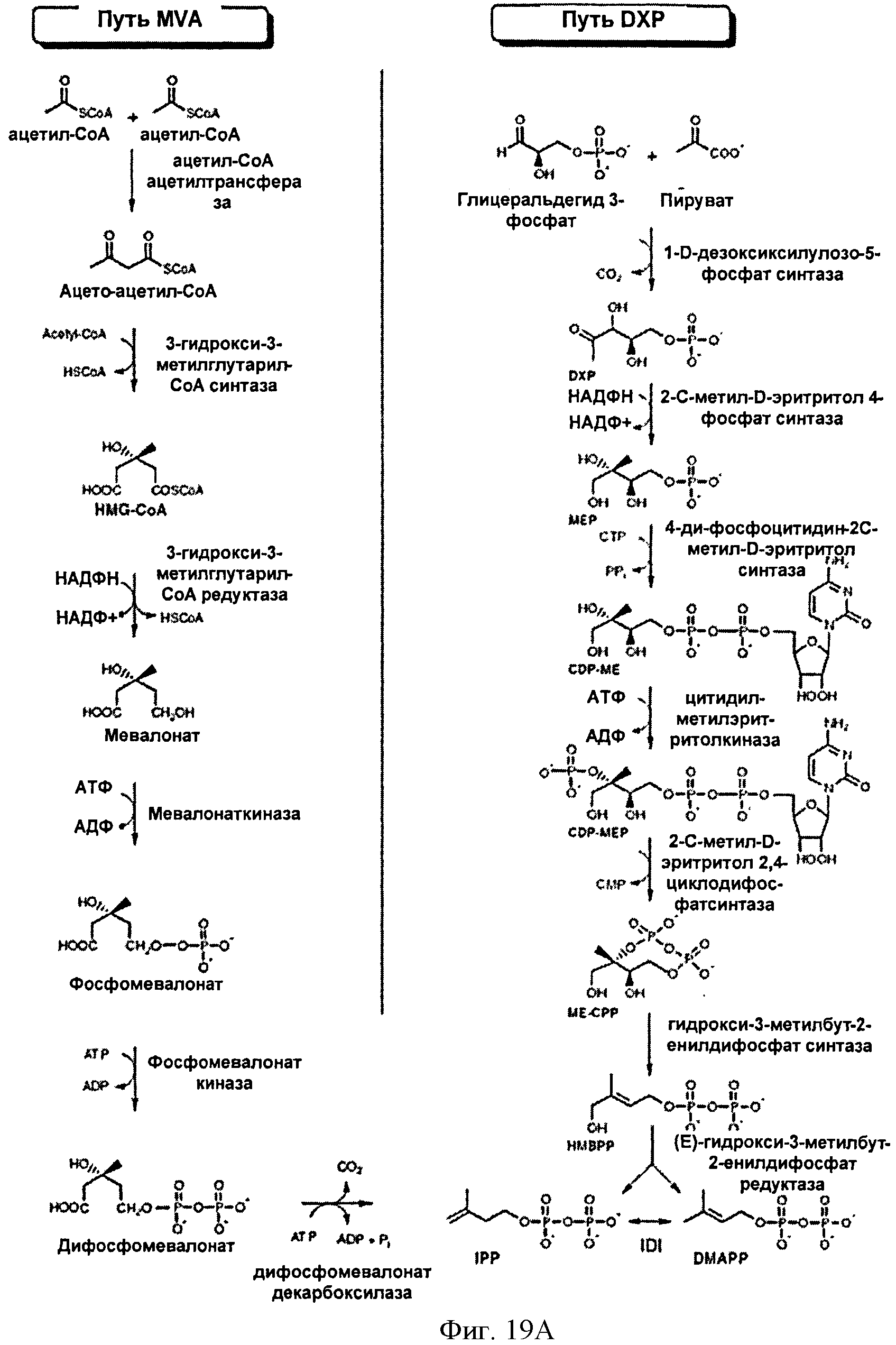
[0058] На Фигуре 19А показаны мевалонатный (MVA) и 1-дезокси-0-ксилулоза-5-фосфатный (DXP) метаболические пути для изопрена (на основании публикации F. Bouvier и др.. Progress in Lipid Res. 44: 357-429, 2005). Следующее описание содержит альтернативные названия для каждого полипептида в указанных путях и ссылку на источник, в котором описан способ измерения активности указанного полипептида (каждый из данных источников настоящим полностью включен посредством ссылки, особенно в отношении тестов на активность полипептов для полипептидов в путях MVA и DXP). Мевалонатный путь: ААСТ; Ацетил-коА-ацетилтрансфераза, MvaE, ЕС 2.3.1.9. Анализ: J. Bacterial., 184: 2116-2122,2002; HMGS; гидроксиметилглутарил-коА-синтаза, MvaS, EC 2.3.3.10. Анализ: J. Bacterial., 184: 4065-4070, 2002; HMGR; 3-гидрокси-3-метилглутарил-коА-редуктаза, MvaE, EC 1.1.1.34. Анализ: J. Bacterial., 184: 2116-2122, 2002; MVK; мевалонаткиназа, ERG12, ЕС 2.7.1.36. Анализ: Curr Genet 19:9-14, 1991. РМК; фосфомевалонаткиназа, ERG8, ЕС 2.7.4.2. Анализ: Mol Cell Biol., 11:620-631, 1991; DPMDC; дифосфомевалонатдекарбоксилаза, MVD1, EC 4.1.1.33. Анализ: Biochemistry, 33:13355-13362, 1994; IDI; изопентенилдифосфат-дельта-изомераза, IDI1, ЕС 5.3.3.2. Анализ: J. Biol. Chem. 264:19169-19175, 1989. Путь DXP: DXS; 1-дезоксиксилулоза-5-фосфатсинтаза, dxs, EC 2.2.1.7. Анализ: PNAS, 94:12857-62, 1997; DXR; 1-дезокси-0-ксилулоза-5-фосфатредуктоизомераза, dxr, EC 2.2.1.7. Анализ: Eur. J. Biochem. 269:4446-4457, 2002; МСТ; 4-дифосфоцитидил-2С-метил-D-эритритолсинтаза, IspD, ЕС 2.7.7.60. Анализ: PNAS, 97: 6451-6456, 2000; СМК; 4-дифосфоцитидил-2-С-метил-0-эритритолкиназа, IspE, EC 2.7.1.148. Анализ: PNAS, 97:1062-1067, 2000; MCS; 2С-метил-0-эритритол-2,4-циклодифосфатсинтаза, IspF, EC 4.6.1.12. Анализ: PNAS, 96:11758-11763, 1999; HDS; 1-гидрокси-2-метил-2-(Е)-бутенил-. 4-дифосфатсинтаза, ispG, EC 1.17.4.3. Анализ: J. Org. Chem., 70:9168 -9174, 2005; HDR; 1-гидрокси-2-метил-2-(Е)-бутенил-4-дифосфатредуктаза, IspH, EC 1.17.1.2. Анализ: JACS, 126:12847-12855.2004.
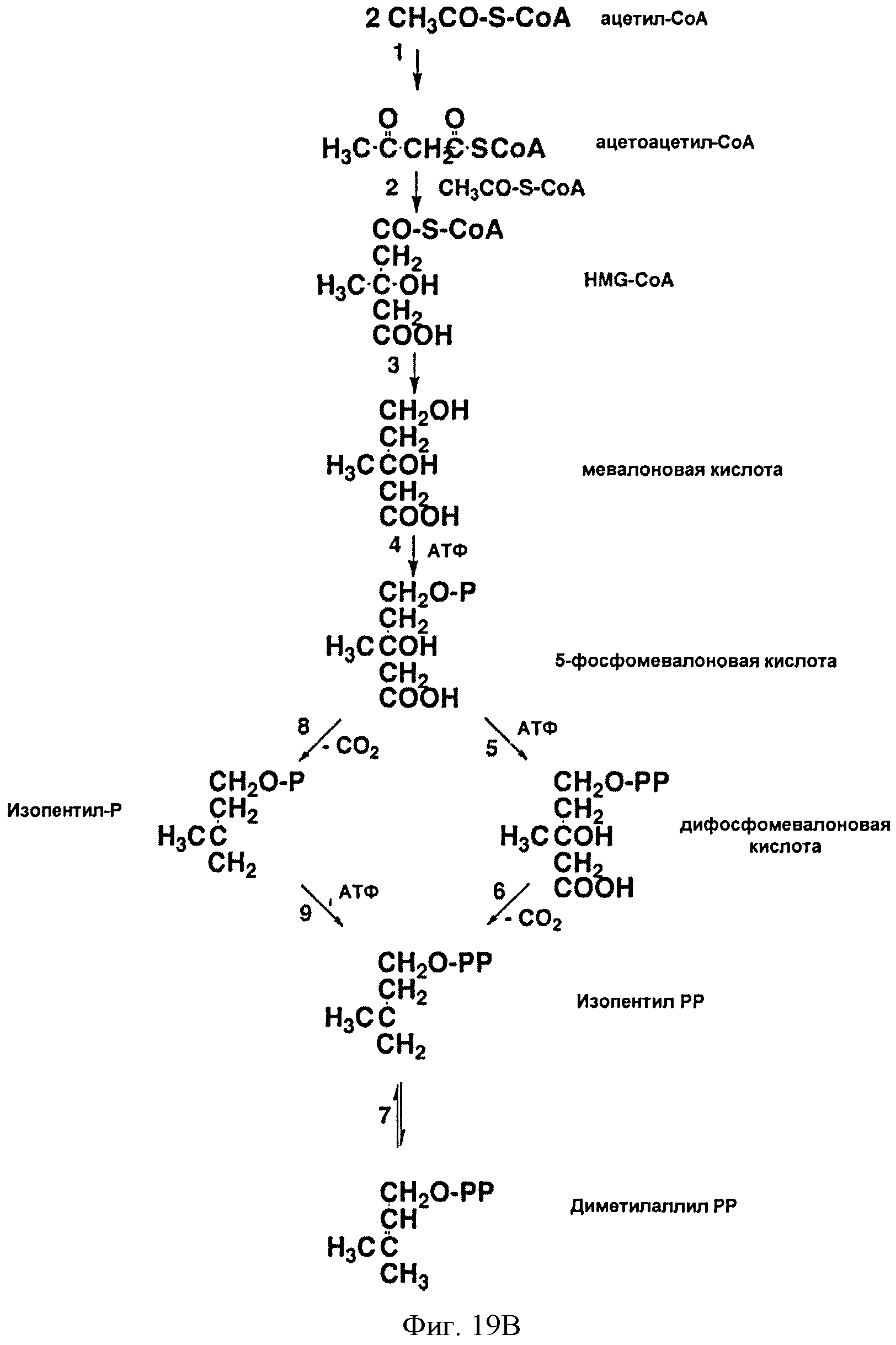
[0059] На Фигуре 19В проиллюстрированы классический и модифицированный мевалонатные пути. 1- ацетил-коА-ацетилтрансфераза (ААСТ); 2 - ГМГ-КоА-синтаза (HMGS); 3 - ГМГ-КоА-редуктаза (HMGR); 4 - мевалонаткиназа (MVK); 5 -фосфомевалонаткиназа (РМК); 6 - дифосфомевалонатдекарбоксилаза (MVD или DPMDC); 7- изопентенилдифосфатизомераза (IDI); 8 фосфомевалонатдекарбоксилаза (PMDC); 9 - изопентенилфосфаткиназа (IPK). В классическом мевалонатном пути реакции с 1 по 7 идут через реакции 5 и 6, тогда как модифицированный мевалонатный путь идет через реакции 8 и 9. Р и РР в структурной формуле представляют собой фосфат и пирофосфат, соответственно. Данная фигура была взята из статьи авторов Koga и Morrii, Mocrobiology and Mol, Biology Reviews, 71:97-120, 2007, которая полностью включена посредством ссылки, особенно в отношении нуклеиновых кислот и полипептидов модифицированного мевалонатного пути. Модифицированный мевалонатный путь представлен, например, у некоторых архейных организмов, таких как Methanosarcina maw.
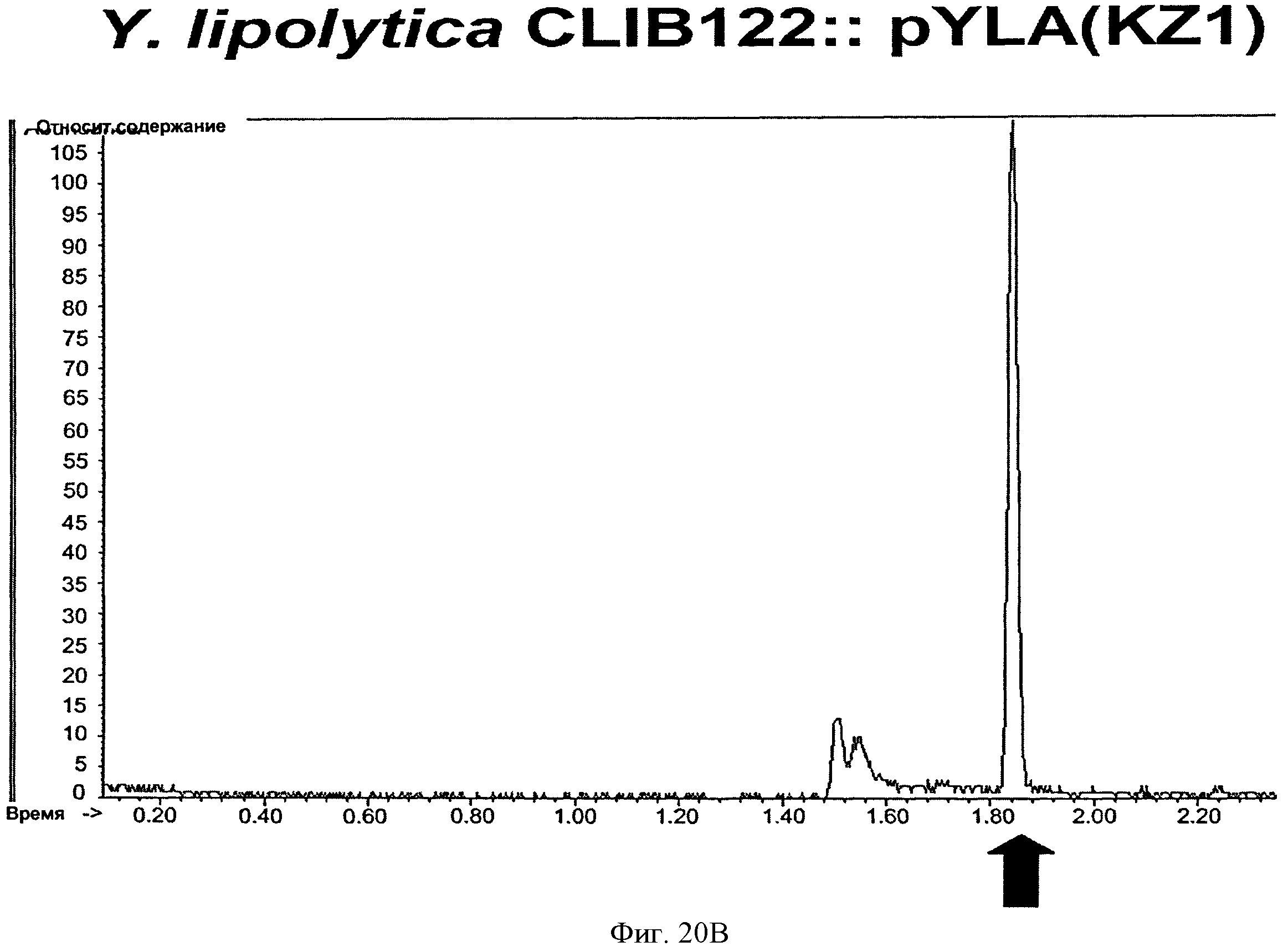
[0060] На Фигуре 20 (Фигуры 20А и 20В) приведены графики, на которых представлены результаты анализа методом газовой хроматографии-масс- спектрометрии (ГХ-МС) продукции изопрена рекомбинантными штаммами У. lipolytica без гена изопренсинтазы кудзу (слева) или с геном изопренсинтазы кудзу (справа), Стрелки показывают время элюирования стандартного натурального изопрена.
[0061] Фигура 21 представляет собой карту pTrcKudzu yIDI DXS Kan.
[0062] Фигуры 22A-D представляют собой последовательность нуклеотидов pTrcKudzu yIDI DXS Kan (SEQ ID NO: 10).
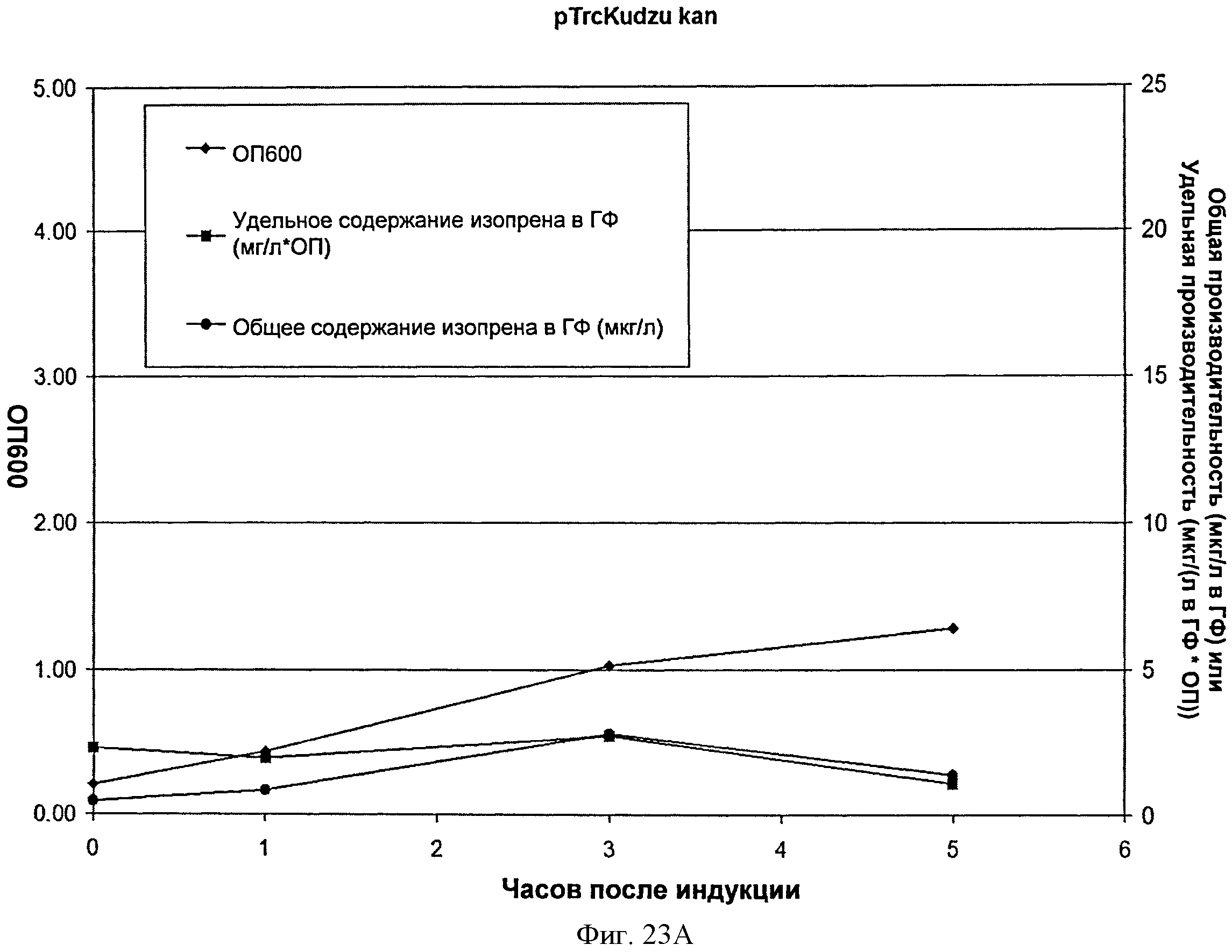
[0063] Фигура 23А представляет собой график, на котором изображена продукция изопрена из глюкозы клетками BL21/pTrcKudzukan. Момент времени 0 представляет собой момент индукции изопропилтиогалактозидом (IPTG) (400 мкмоль). На оси х представлено время после индукции; на оси у представлена оптическая плотность ОП600, а оси у2 - общая производительность в отношении изопрена (мкг/л свободного пространства над поверхностью) или удельная производительность (мкг/л свободного пространства над поверхностью/ОП). Ромбы представляют ОП600, круги представляют общую производительность в отношении изопрена (мкг/л) и квадраты представляют удельную производительность в отношении изопрена (мкг/л/ОП).
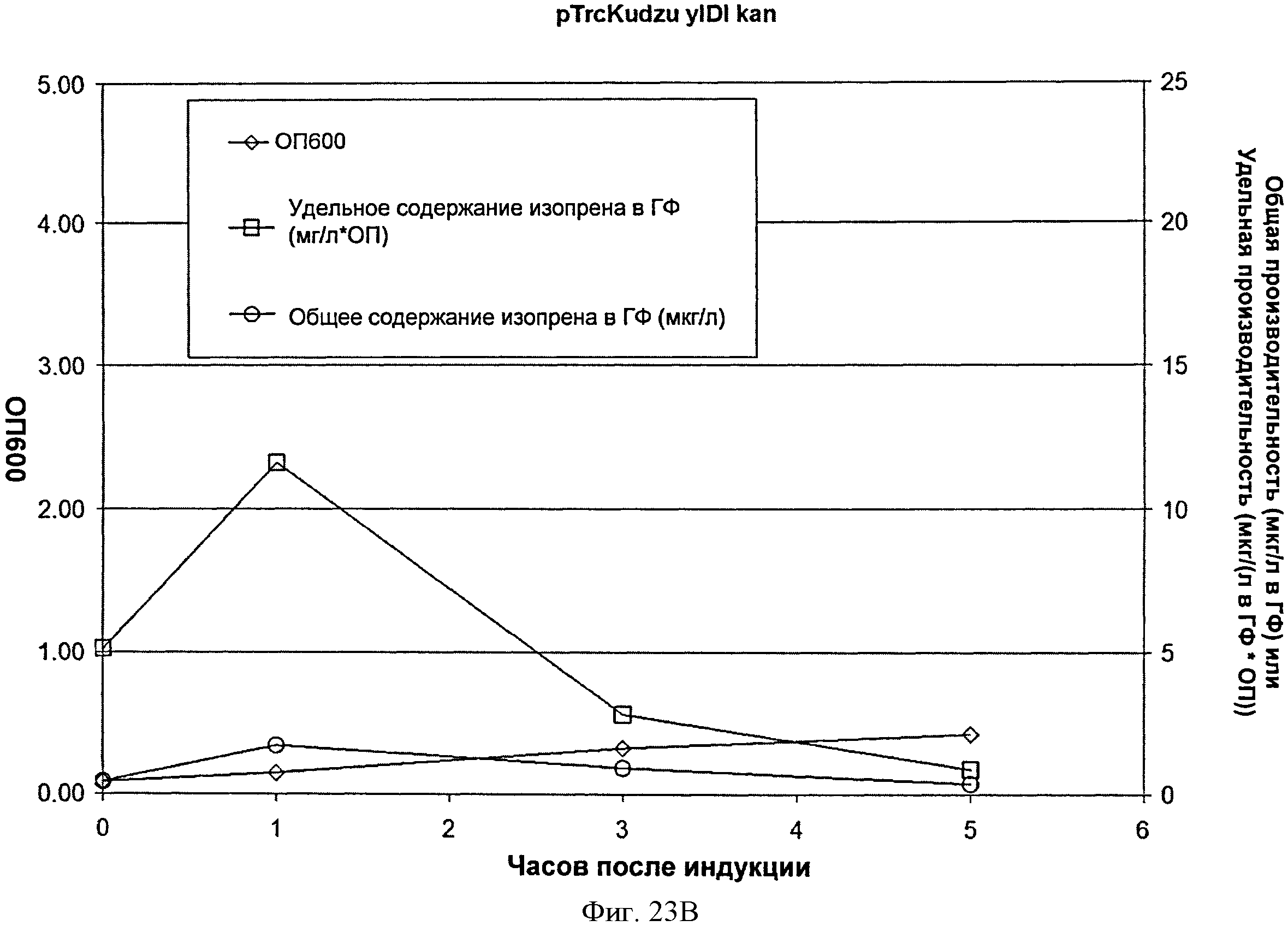
[0064] Фигура 23В представляет собой график, на котором изображена продукция изопрена из глюкозы клетками BL21/pTrcKudzu уIDI kan. Момент времени О представляет собой момент индукции IPTG (400 мкмоль). На оси х представлено время после индукции; на оси у представлена ОП600, а на оси у2 представлена общая производительность в отношении изопрена (мкг/л свободного пространства над поверхностью) или удельная производительность (мкг/л свободного пространства над поверхностью/ОП). Ромбы представляют ОП600. круги представляют общую производительность в отношении изопрена (мкг/л) и квадраты представляют удельную производительность в отношении изопрена (мкг/л/ОП).
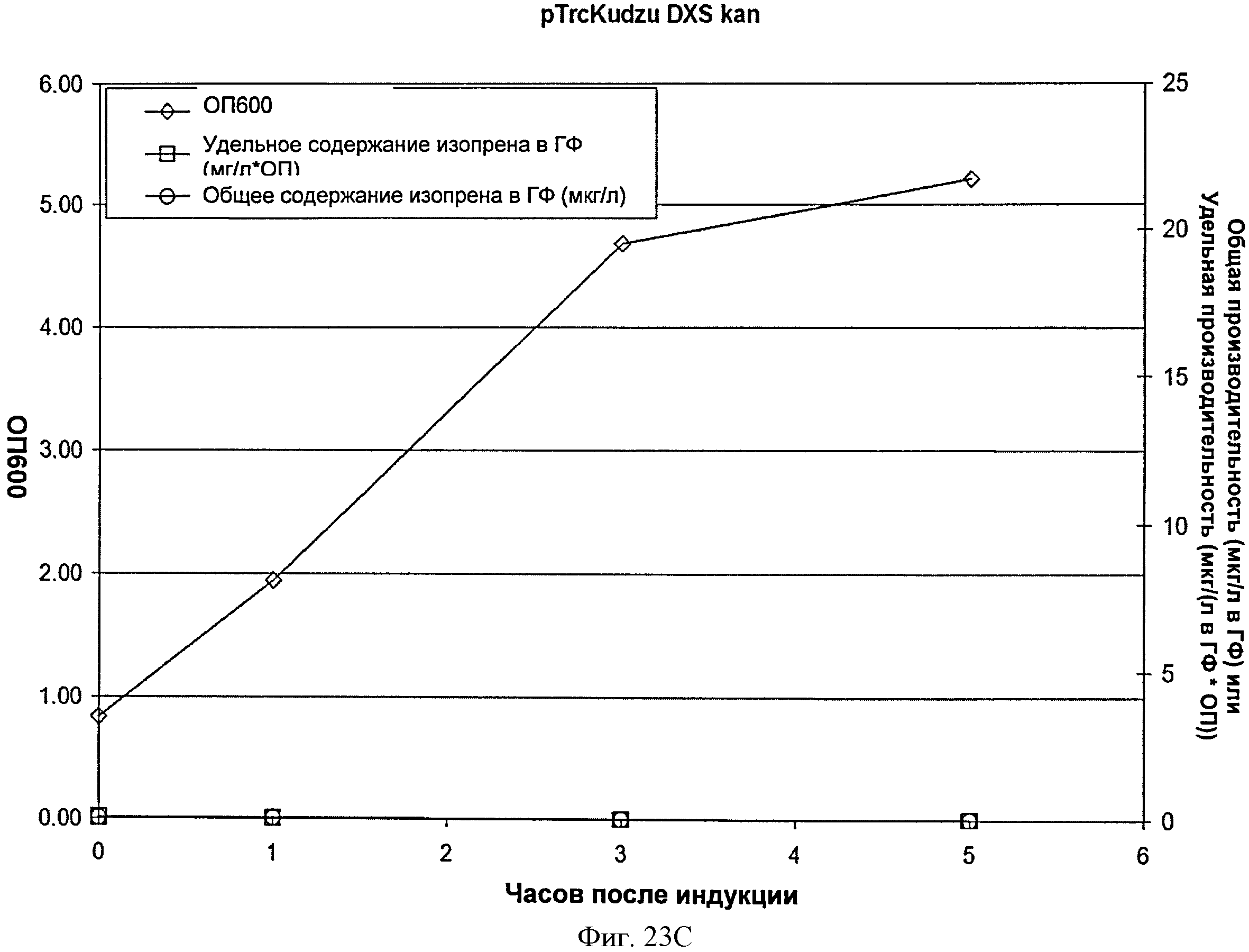
[0065] Фигура 23С представляет собой график, на котором изображена продукция изопрена из глюкозы клетками BL21/pTrcKudzu DXS kan. Момент времени О представляет собой момент индукции IPTG (400 мкмоль). На оси х представлено время после индукции; на оси у представлена ОП600, а на оси у2 представлена общую производительность в отношении изопрена (мкг/л свободного пространства над поверхностью) или удельная производительность (мкг/л свободного пространства над поверхностью/ОП). Ромбы представляют ОП600, круги представляют общую производительность в отношении изопрена (мкг/л) и квадраты представляют удельную производительность в отношении изопрена (мкг/л/ОП).
[0066] Фигура 23D представляет собой график, на котором изображена продукция изопрена из глюкозы клетками BL21/pTrcKudzu yIDI DXS kan. Момент времени О представляет собой момент индукции IPTG (400 мкмоль). На оси х представлено время после индукции; на оси у представлена ОП600, а на оси у2 представлена общая производительность в отношении изопрена (мкг/л свободного пространства над поверхностью) или удельная производительность (мкг/л свободного пространства над поверхностью/ОП). Ромбы представляют ОП600, круги представляют общую производительность в отношении изопрена (мкг/л) и квадраты представляют удельную производительность в отношении изопрена (мкг/л/ОП).
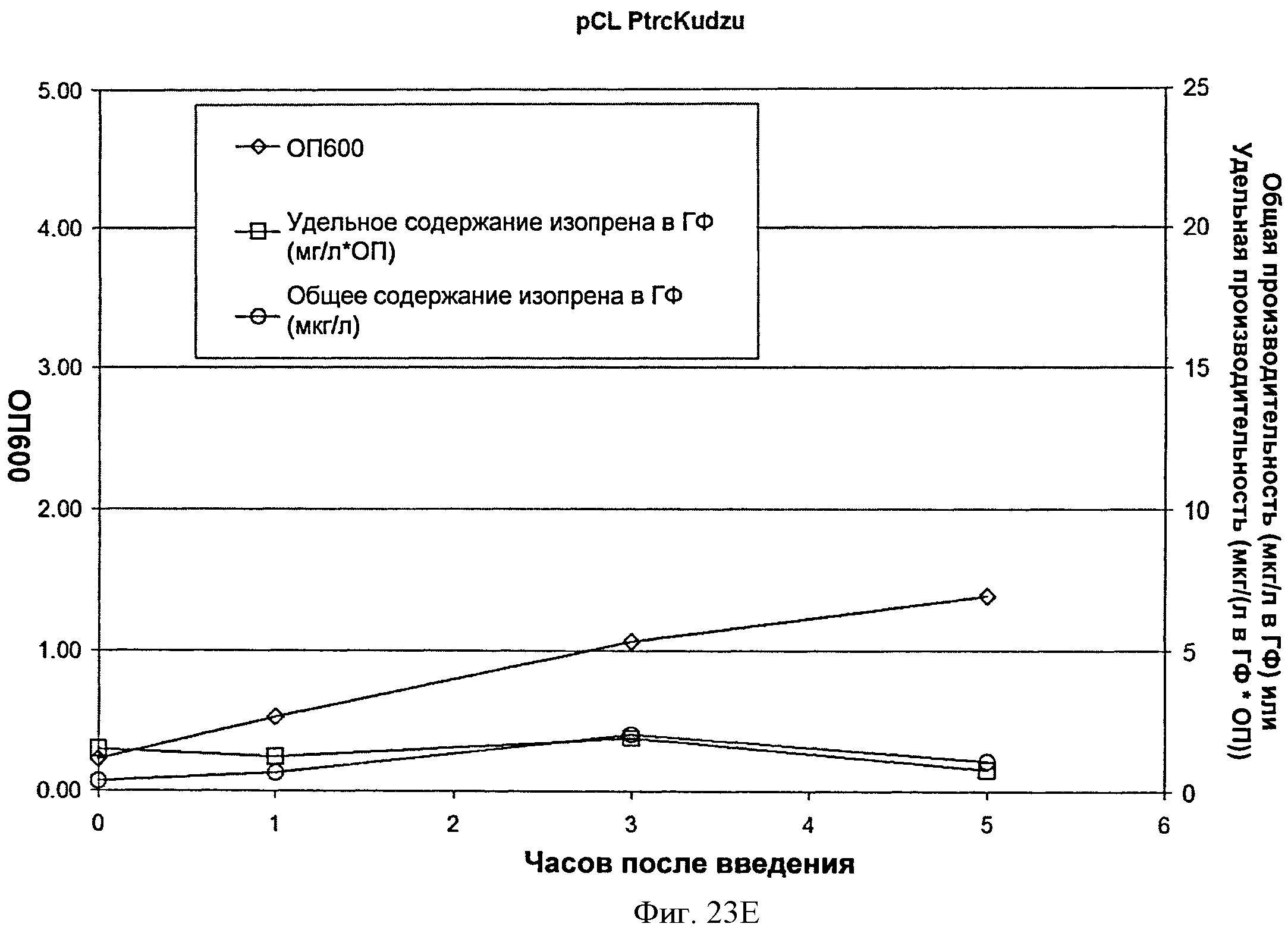
[0067] Фигура 23Е представляет собой график, на котором изображена продукция изопрена из глюкозы клетками BL21/pCL PTrcKudzu. Момент времени 0 представляет собой момент индукции IPTG (400 мкмоль). На оси х представлено время после индукции; на оси у представлена ОП600, а на оси у2 представлена общая производительность в отношении изопрена (мкг/л свободного пространства над поверхностью) или удельная производительность (мкг/л свободного пространства над поверхностью/ОП). Ромбы представляют ОП600. круги представляют общую производительность в отношении изопрена (мкг/л) и квадраты представляют удельную производительность в отношении изопрена (мкг/л/ОП).
[0068] Фигура 23F представляет собой график, на котором изображено получение изопрена из глюкозы клетками BL21/pCL PTrcKudzu yIDI. Момент времени О представляет собой момент индукции IPTG (400 мкмоль). На оси х представлено время после индукции; на оси у представлена ОП600, а на оси у2 представлена общая производительность в отношении изопрена (мкг/л свободного пространства над поверхностью) или удельная производительность (мкг/л свободного пространства над поверхностью/ОП). Ромбы представляют ОП600, круги представляют общую производительность в отношении изопрена (мкг/л) и квадраты представляют удельную производительность в отношении изопрена (мкг/л/ОП).
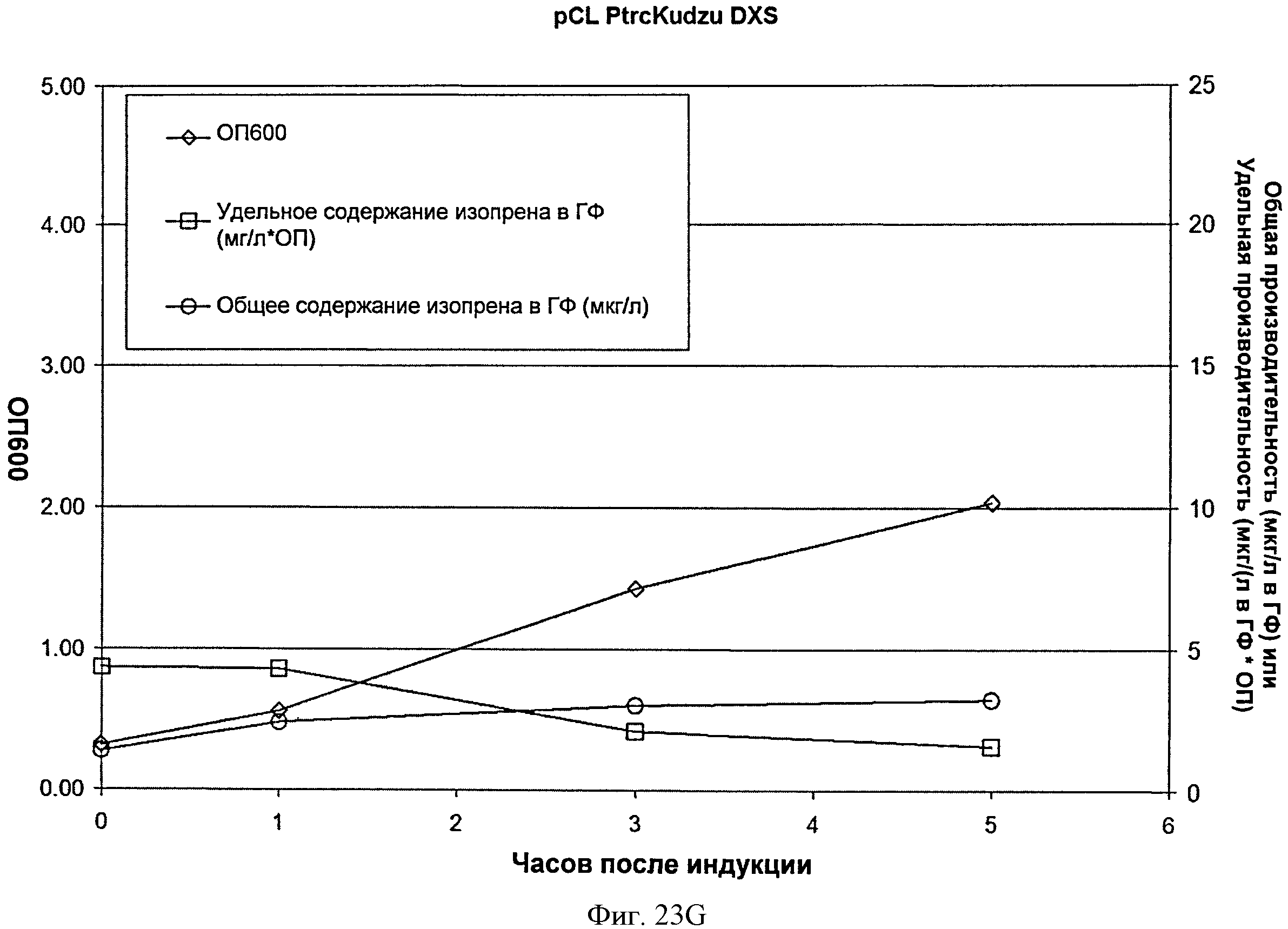
[0069] Фигура 23G представляет собой график, на котором изображена продукция изопрена из глюкозы клетками BL21/pCL PTrcKudzu DXS. Момент времени О представляет собой момент индукции IPTG (400 мкмоль). На оси х представлено время после индукции; на оси у представлена ОП600, а на оси у2 представлена общая производительность в отношении изопрена (мкг/л свободного пространства над поверхностью) или удельная производительность (мкг/л свободного пространства над поверхностью/ОП). Ромбы представляют ОП600, круги представляют общую производительность в отношении изопрена (мкг/л) и квадраты представляют удельную производительность в отношении изопрена (мкг/л/ОП).
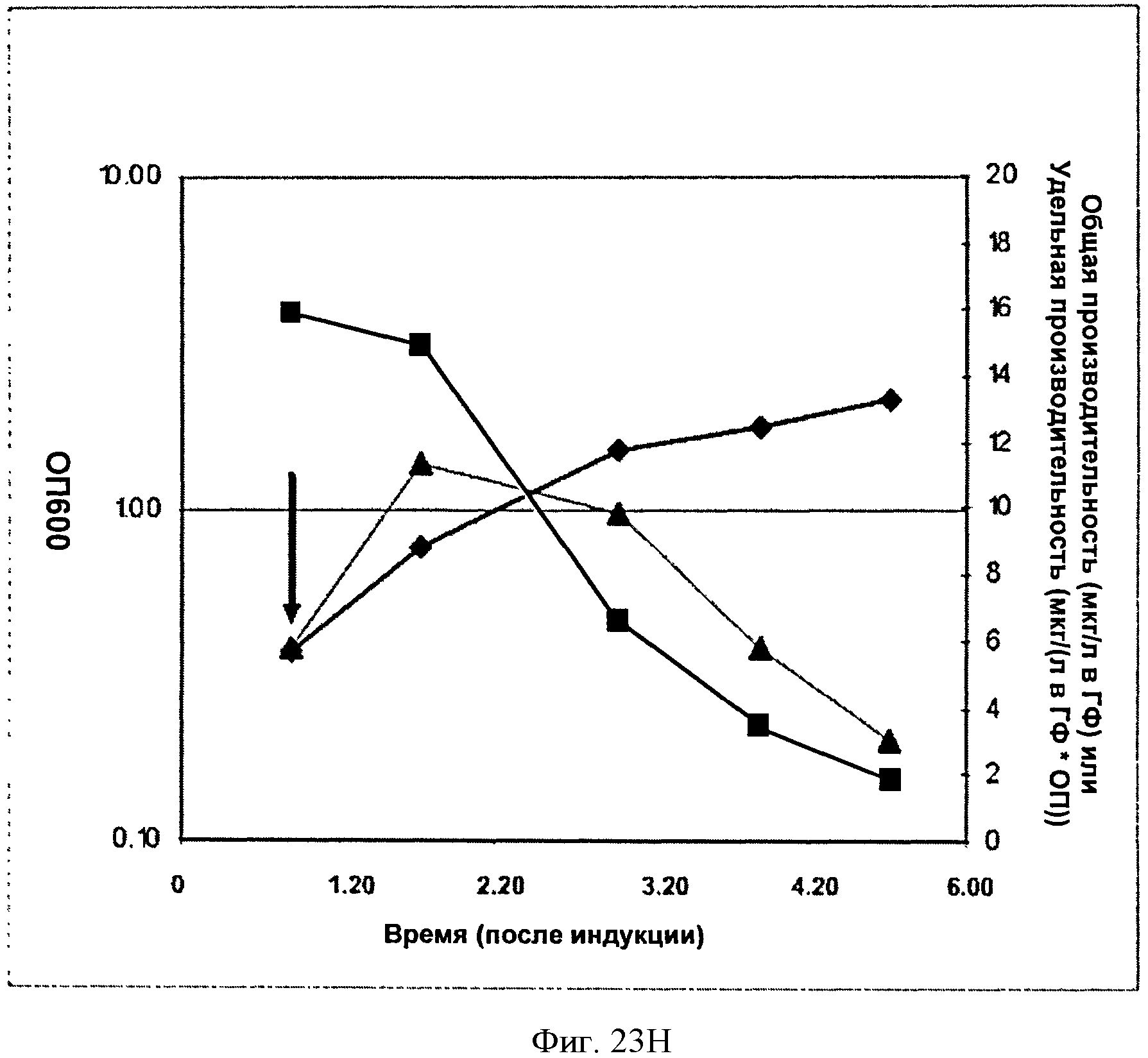
[0070] Фигура 23Н представляет собой график, на котором изображена продукция изопрена из глюкозы клетками BL21/pTrcKudzuIDIDXSkan. Стрелка указывает на момент времени индукции IPTG (400 мкмоль). На оси х представлено время после индукции; на оси у представлена ОП600, а на оси у2 представлена общая производительность в отношении изопрена (мкг/л свободного пространства над поверхностью) или удельная производительность (мкг/л свободного пространства над поверхностью/ОП). Черные ромбы представляют ОП600, черные треугольники представляют производительность в отношении изопрена (мкг/л) и белые квадраты представляют удельную производительность в отношении изопрена (мкг/л/ОП),
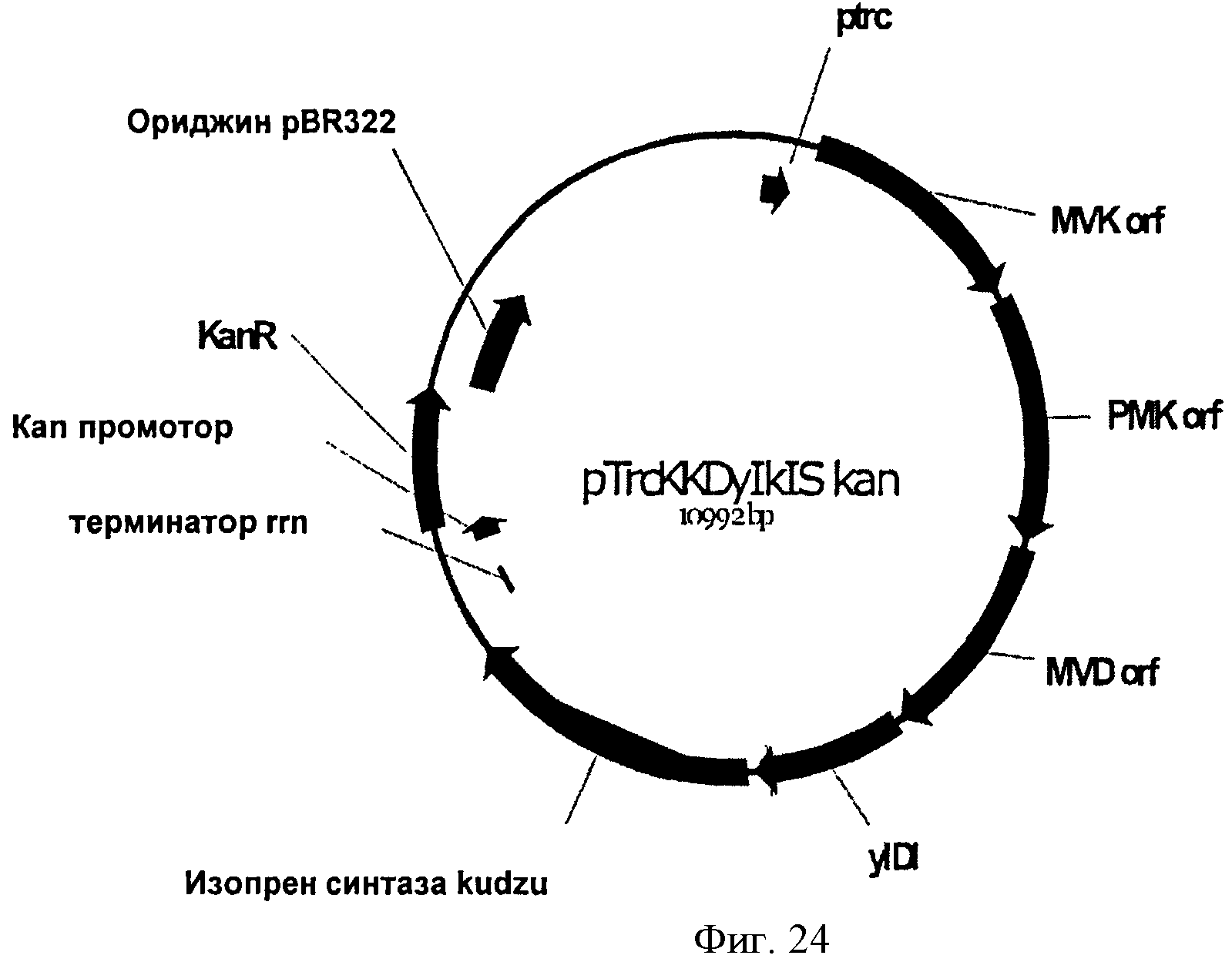
[0071] Фигура 24 представляет собой карту pTrcKKDyIkIS kan,
[0072] Фигуры 25A-D представляют собой последовательность нуклеотидов pTrcKKDyIkIS kan (SEQ ID NO: 11).
[0073] Фигура 26 представляет собой карту pCL PtrcUpperPathway
[0074] Фигуры 27A-27D представляют собой последовательность нуклеотидов pCL PtrcUpperPathway (SEQ ID NO: 12).
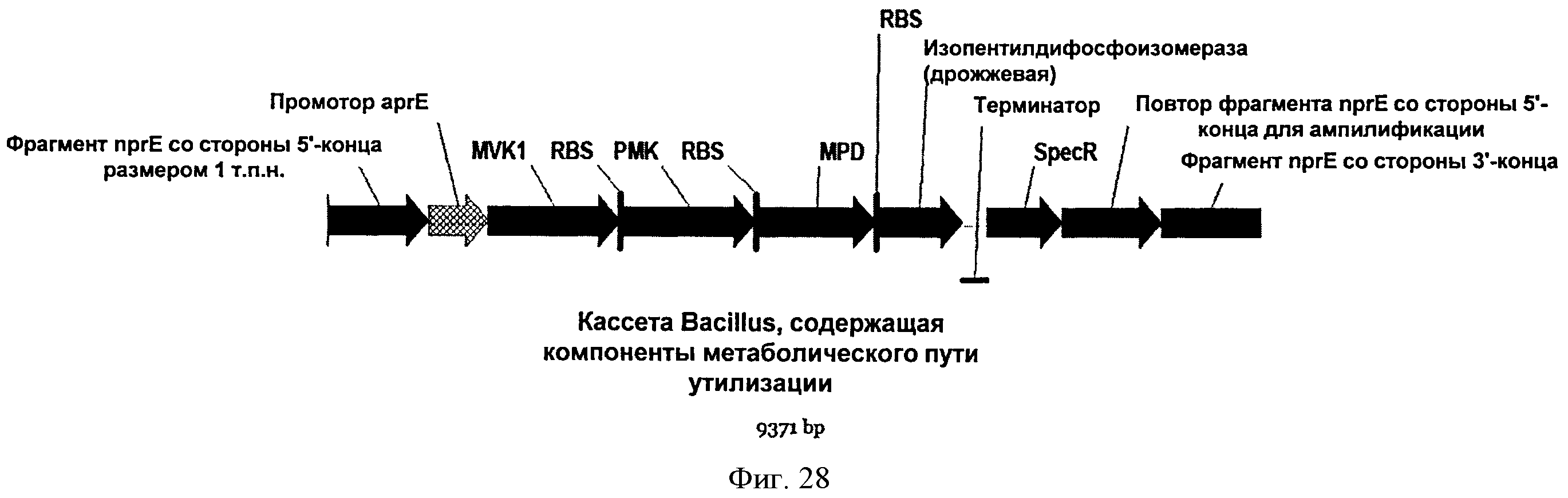
[0075] На Фигуре 28 представлена карта кассеты, содержащей нижний мевалонатный путь и дрожжевую idi для интеграции в локус пргЕ хромосомы В. subtilis. nprE против хода транскрипции/по ходу транскрипции указывает на расстояние 1 тысяч пар нуклеотидов (т.п.о.) от места интеграции nprE для каждой последовательности. Промотор аргЕ (промотор щелочной сериновой протеазы) обозначает промотор (сайт инициации транскрипции -35, -10,+1, сайт связывания рибосомы (RBS)) гена аргЕ. MVK1 обозначает ген мевалонаткиназы дрожжей. RBS-PMK обозначает ген фосфомевалонаткиназы дрожжей с RBS Bacillus против хода транскрипции от сайта инициации. RBS-MPD обозначает ген дифосфомевалонатдекарбоксилазы дрожжей с RBS Bacillus против хода транскрипции от сайта инициации. RBS-IDI обозначает ген idi дрожжей с RBS Bacillus против хода транскрипции от сайта инициации. Терминатор обозначает терминатор транскрипции щелочной сериновой протеазы из В. amyliquefaciens. SpecR обозначает маркер устойчивости к спектиномицину. "Повтор против хода транскрипции от nprE для ампл." обозначает прямой повтор участка против хода транскрипции, используемый для амплификации.
[0076] Фигуры 29A-D представляют собой последовательность нуклеотидов кассеты, содержащей нижний мевалонатный путь и дрожжевую idi для интеграции в локус пргЕ хромосомы В. subtilis (SEQ ID NO: 13).
[0077] Фигура 30 представляет собой карту р9796-рорlаr.
[0078] Фигуры 31А-В представляют собой последовательность нуклеотидов р9796-рорlаr (SEQ ID NO: 14).
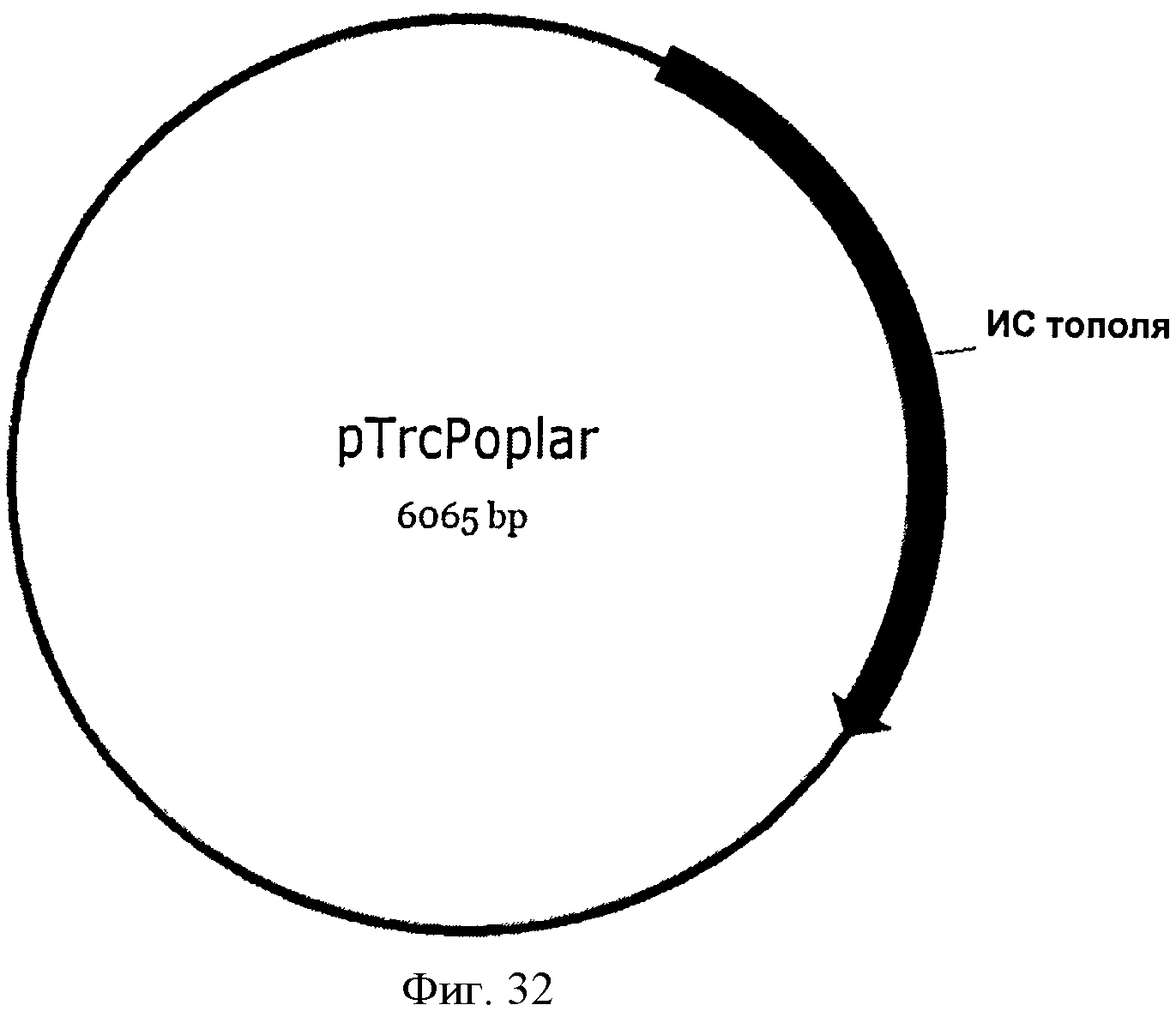
[0079] Фигура 32 представляет собой карту pTrcPoplar.
[0080] Фигуры 33А-С представляют собой последовательность нуклеотидов pTrcPoplar (SEQ ID NO: 15).
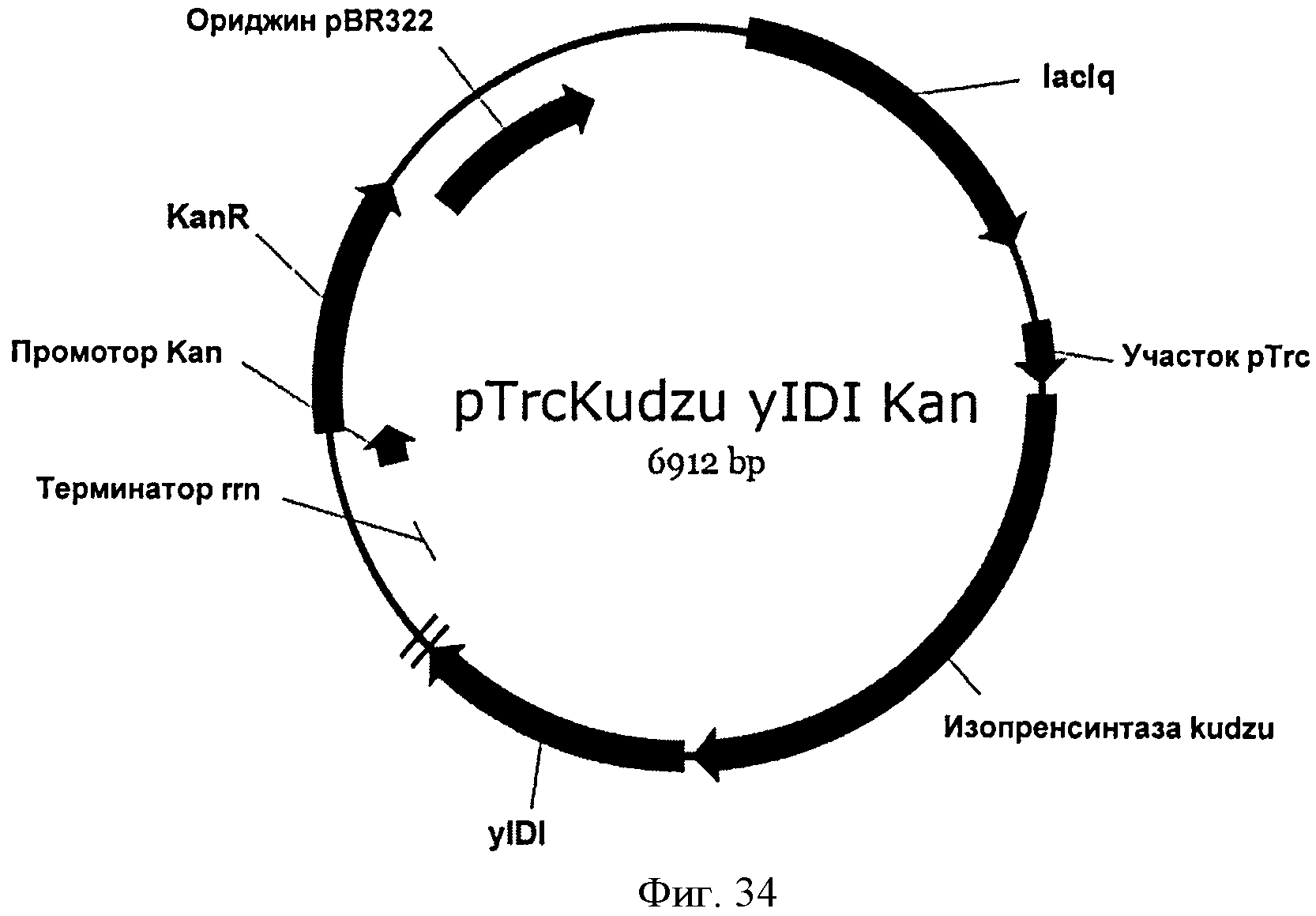
[0081] Фигура 34 представляет собой карту pTrcKudzu уIDI Kan.
[0082] Фигуры 35А-С представляют собой последовательность нуклеотидов pTrcKudzu уIDI Kan (SEQ ID NO: 16).
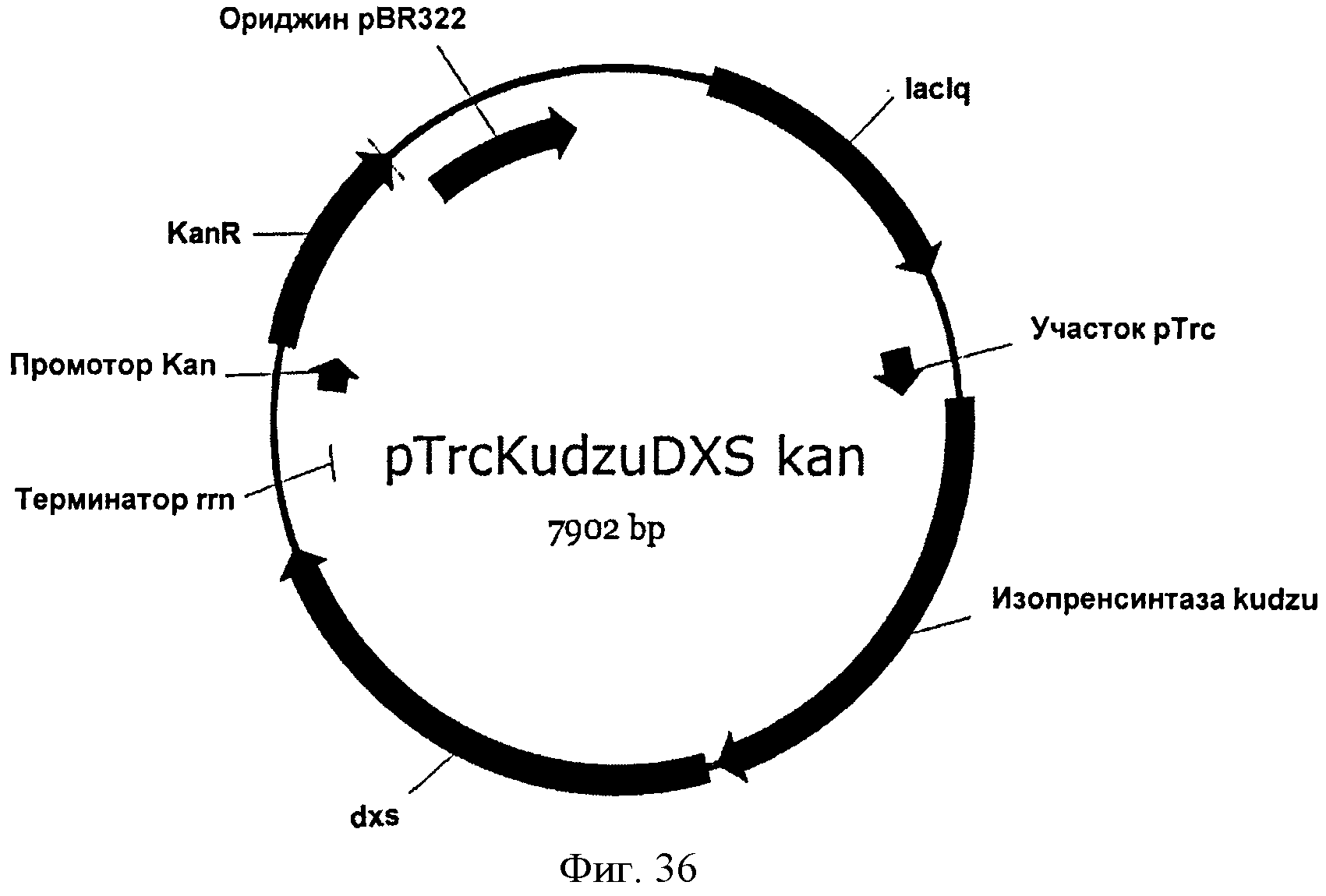
[0083] Фигура 36 представляет собой карту pTrcKudzuDXS Kan.
[0084] Фигуры 37А-С представляют собой последовательность нуклеотидов pTrcKudzuDXS Kan (SEQ ID NO: 17).
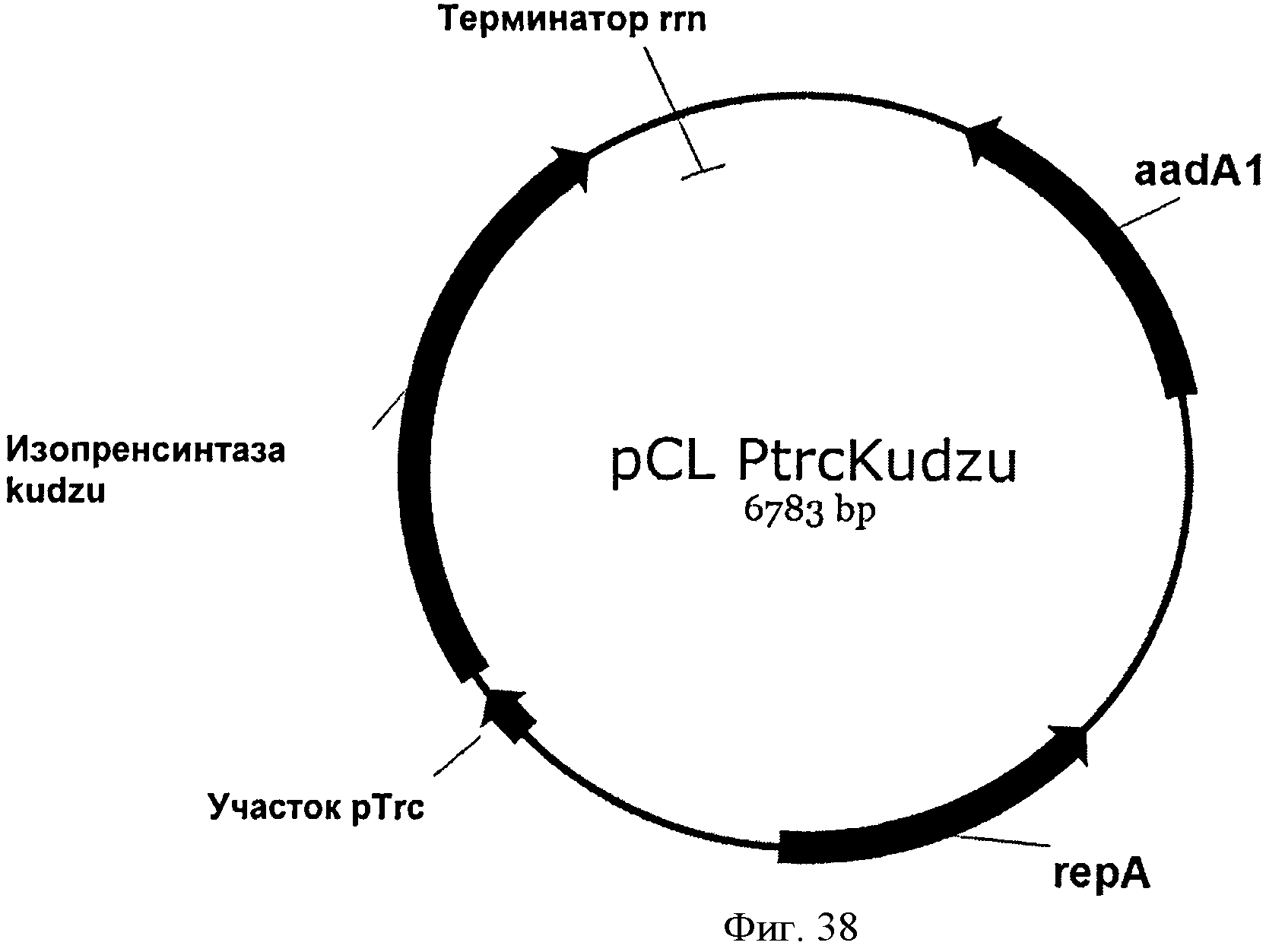
[0085] Фигура 38 представляет собой карту pCL PTrcKudzu.
[0086] Фигуры 39А-С представляют собой последовательность нуклеотидов pCL PTrcKudzu (SEQ ID NO: 18).
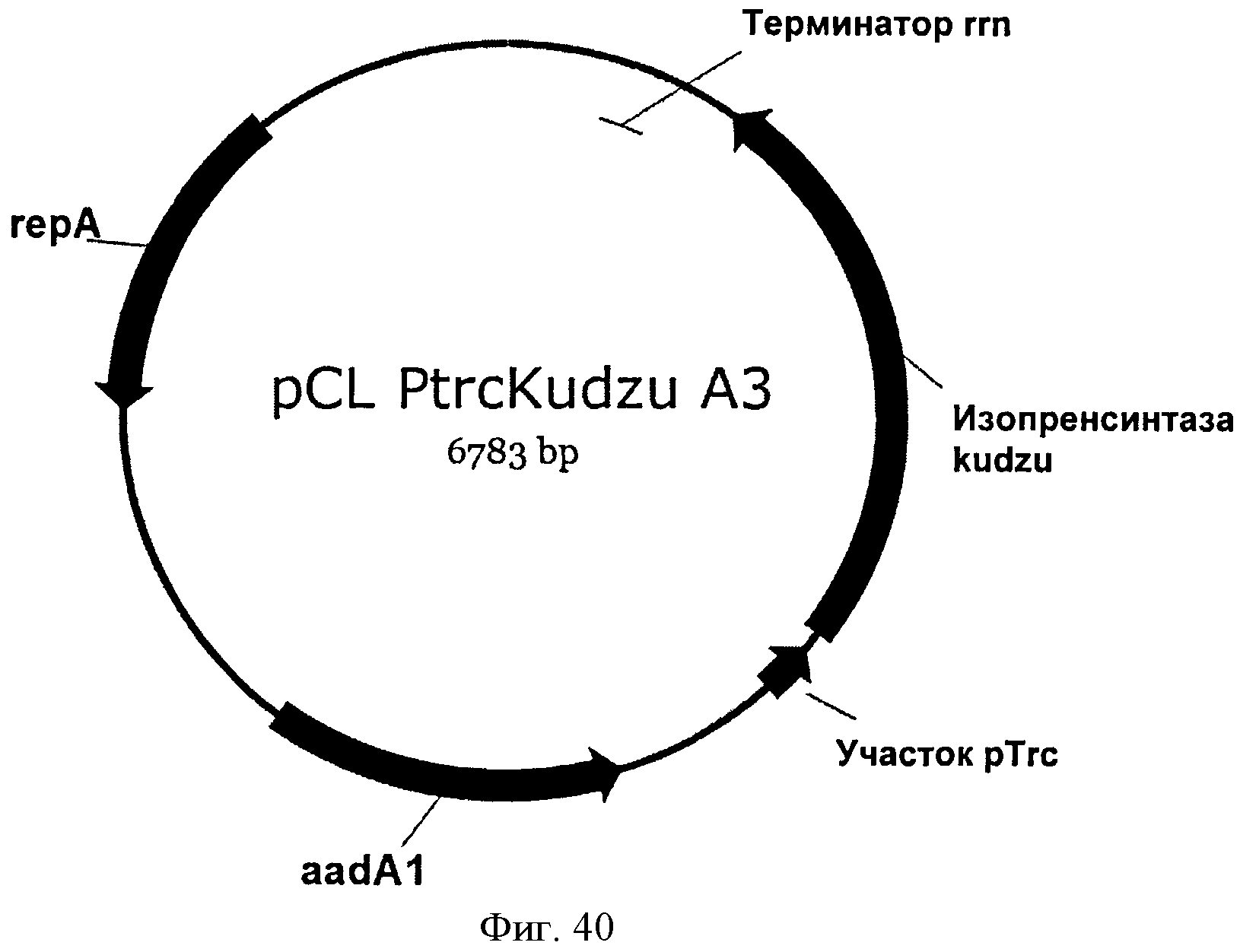
[0087] Фигура 40 представляет собой карту pCL PTrcKudzu A3.
[0088] Фигуры 41А-С представляют собой последовательность нуклеотидов pCL PTrcKudzu A3 (SEQ ID NO: 19).
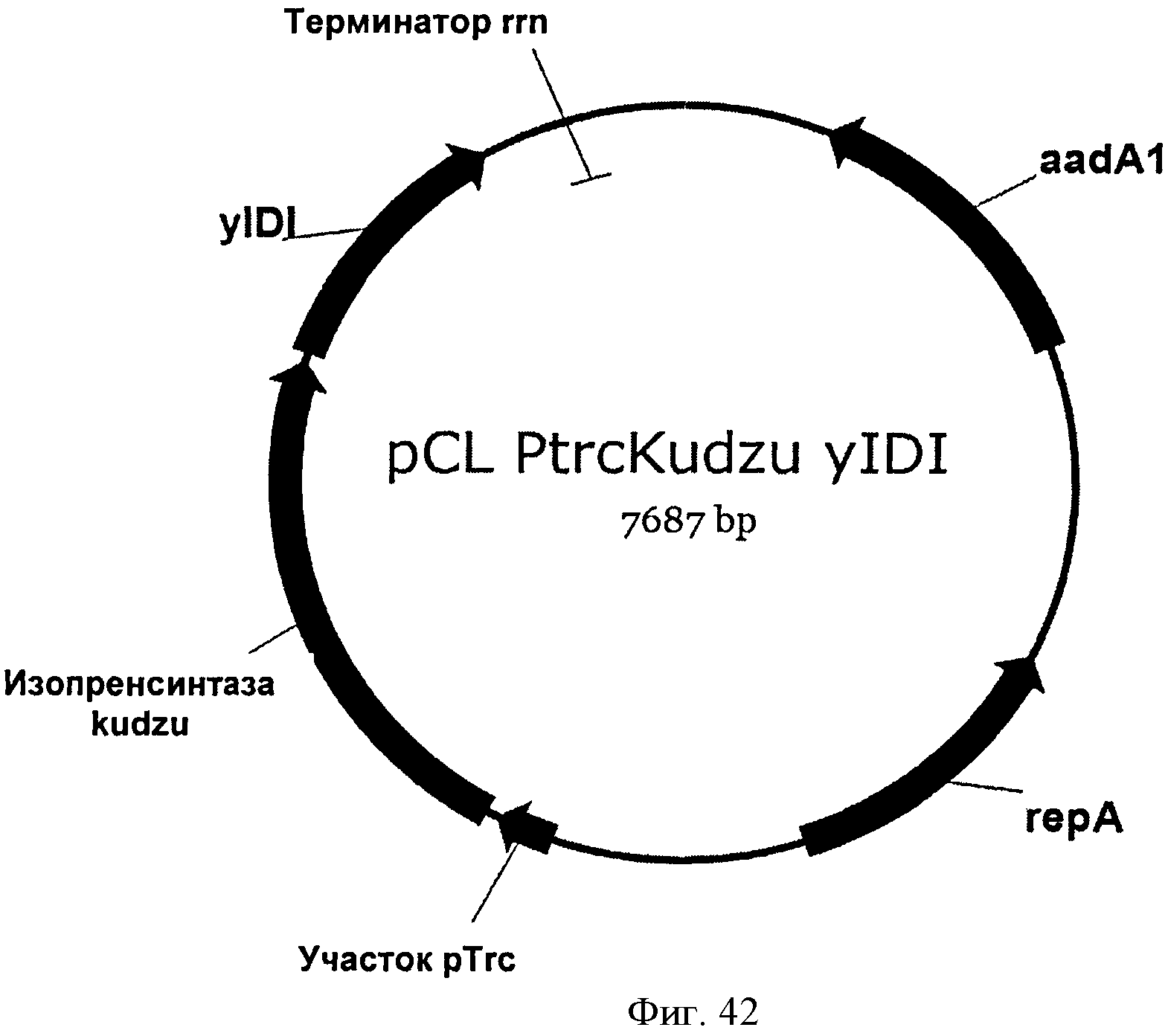
[0089] Фигура 42 представляет собой карту pCL PTrcKudzu yIDI.
[0090] Фигуры 43А-С представляют собой последовательность нуклеотидов pCL PTrcKudzu уIDI (SEQ ID NO: 20).
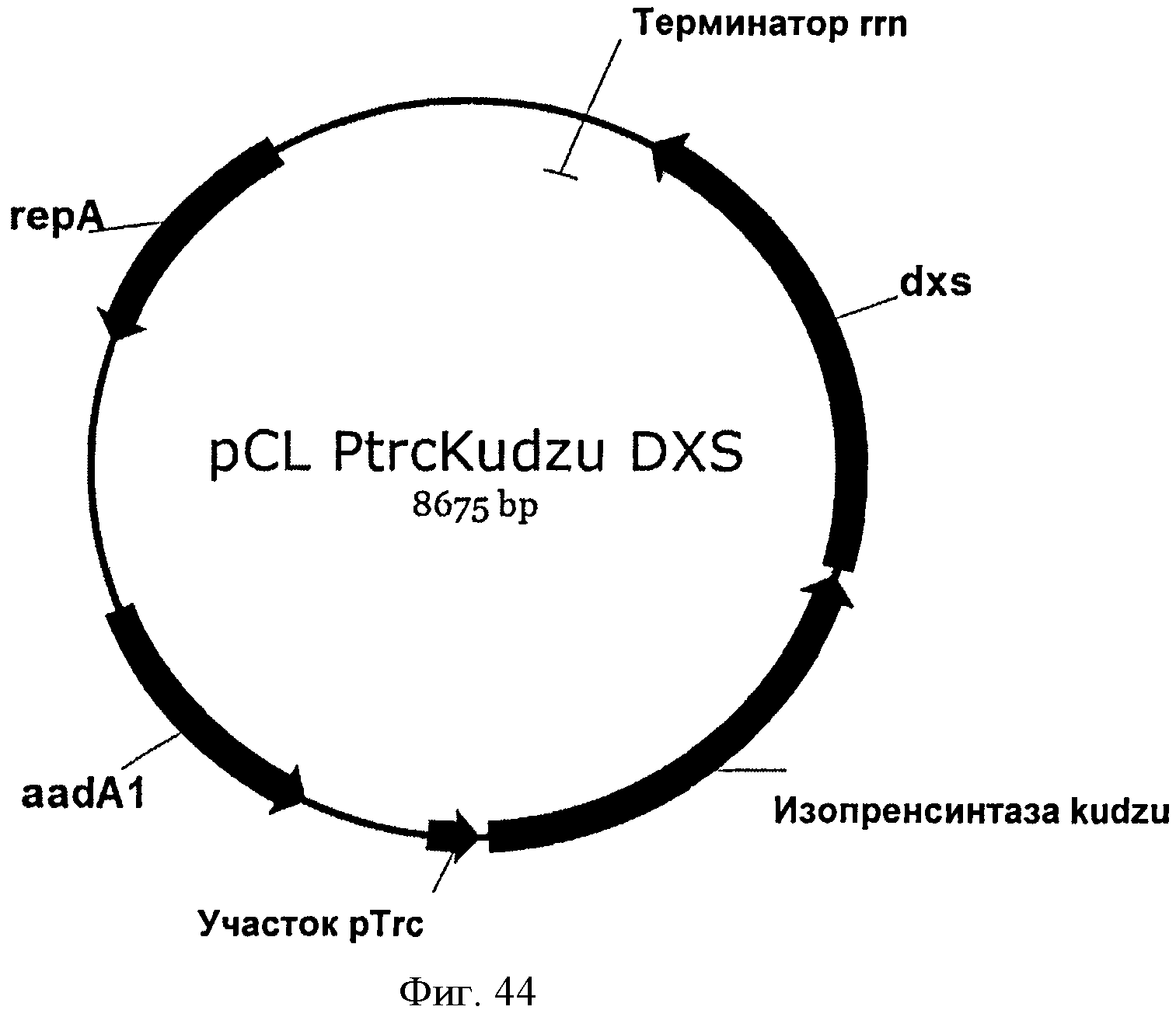
[0091] Фигура 44 представляет собой карту pCL PTrcKudzu DXS.
[0092] Фигуры 45A-D представляют собой последовательность нуклеотидов pCL PTrcKudzu DXS (SEQ ID NO: 21).
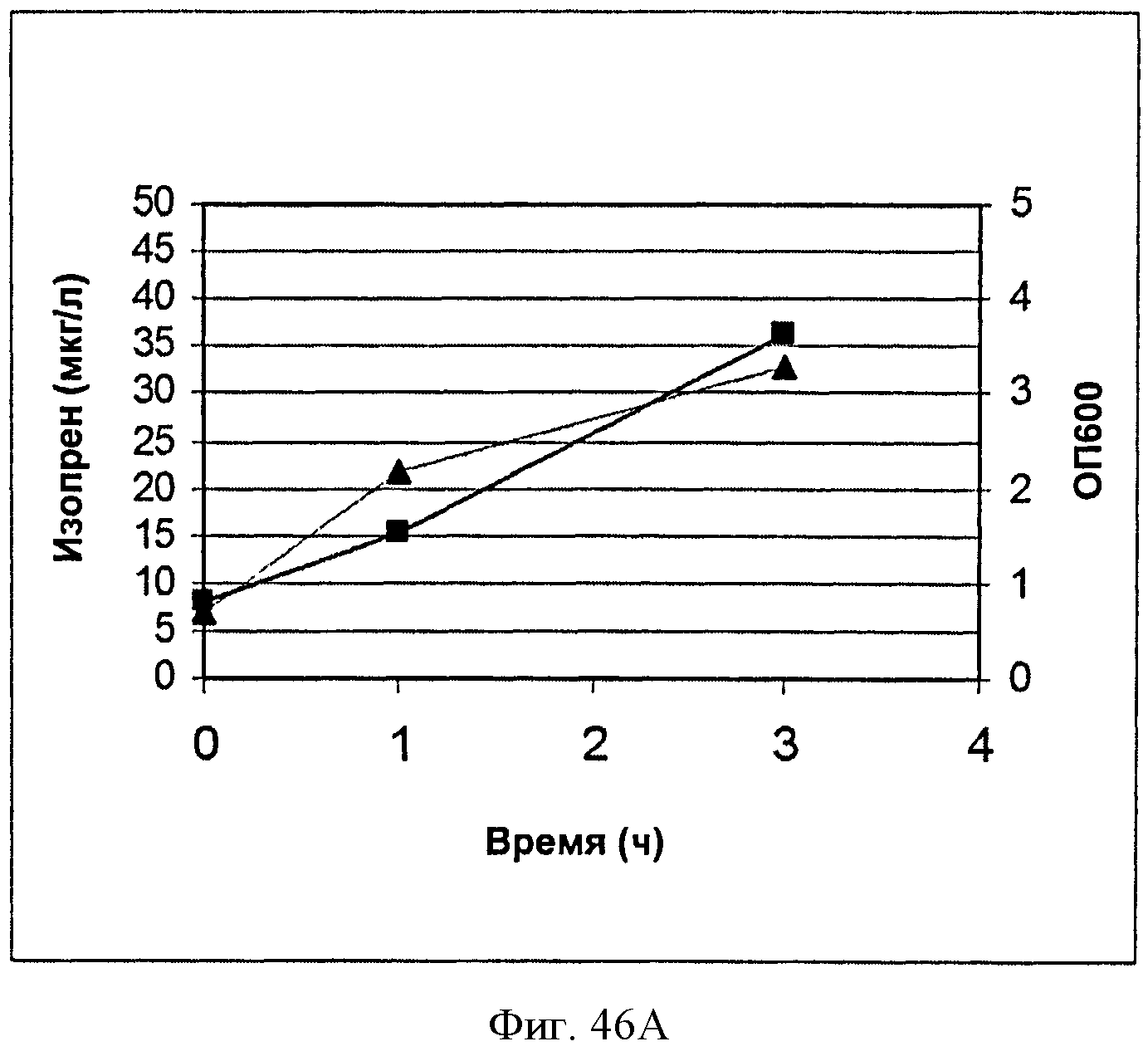
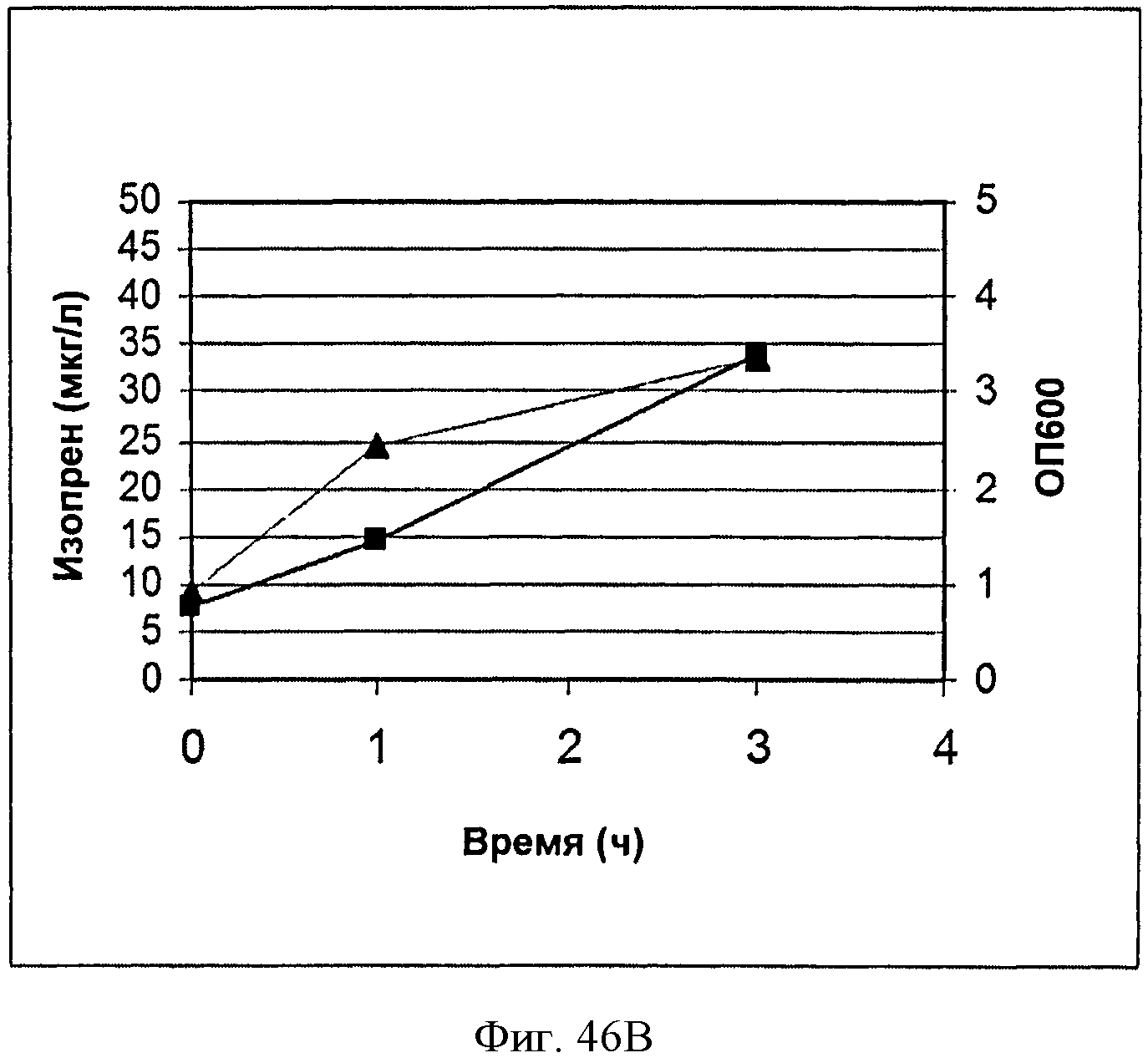
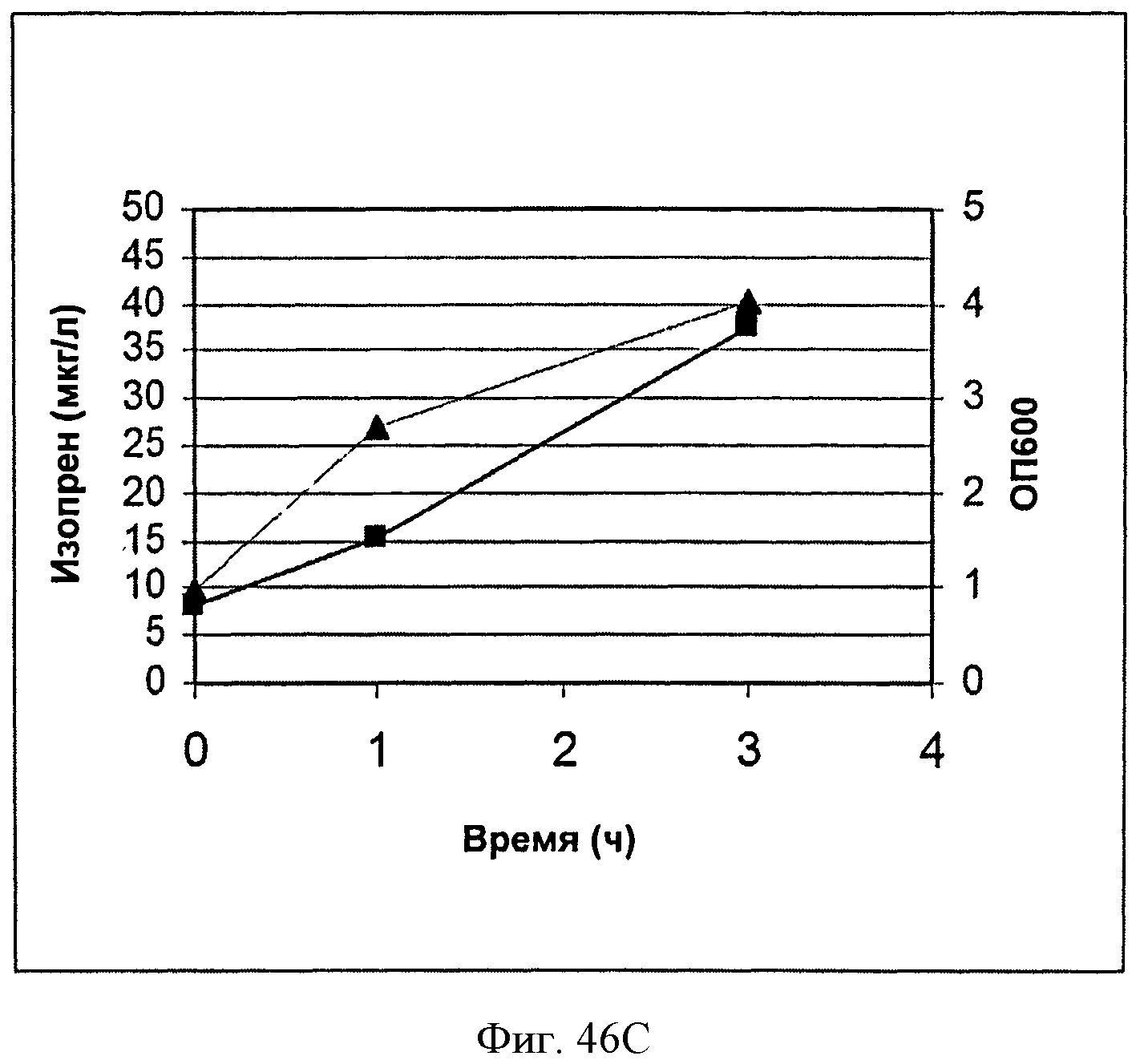
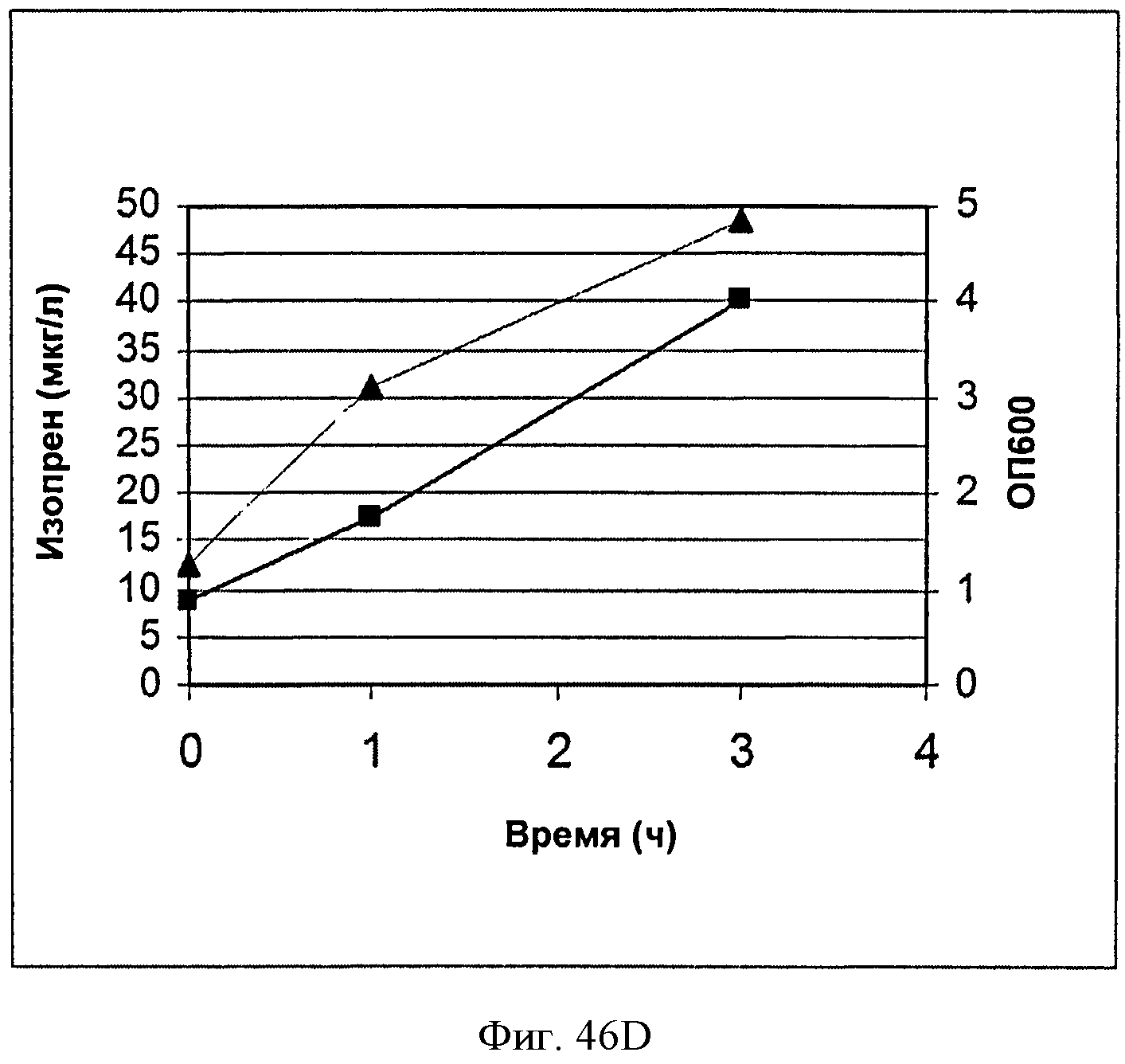
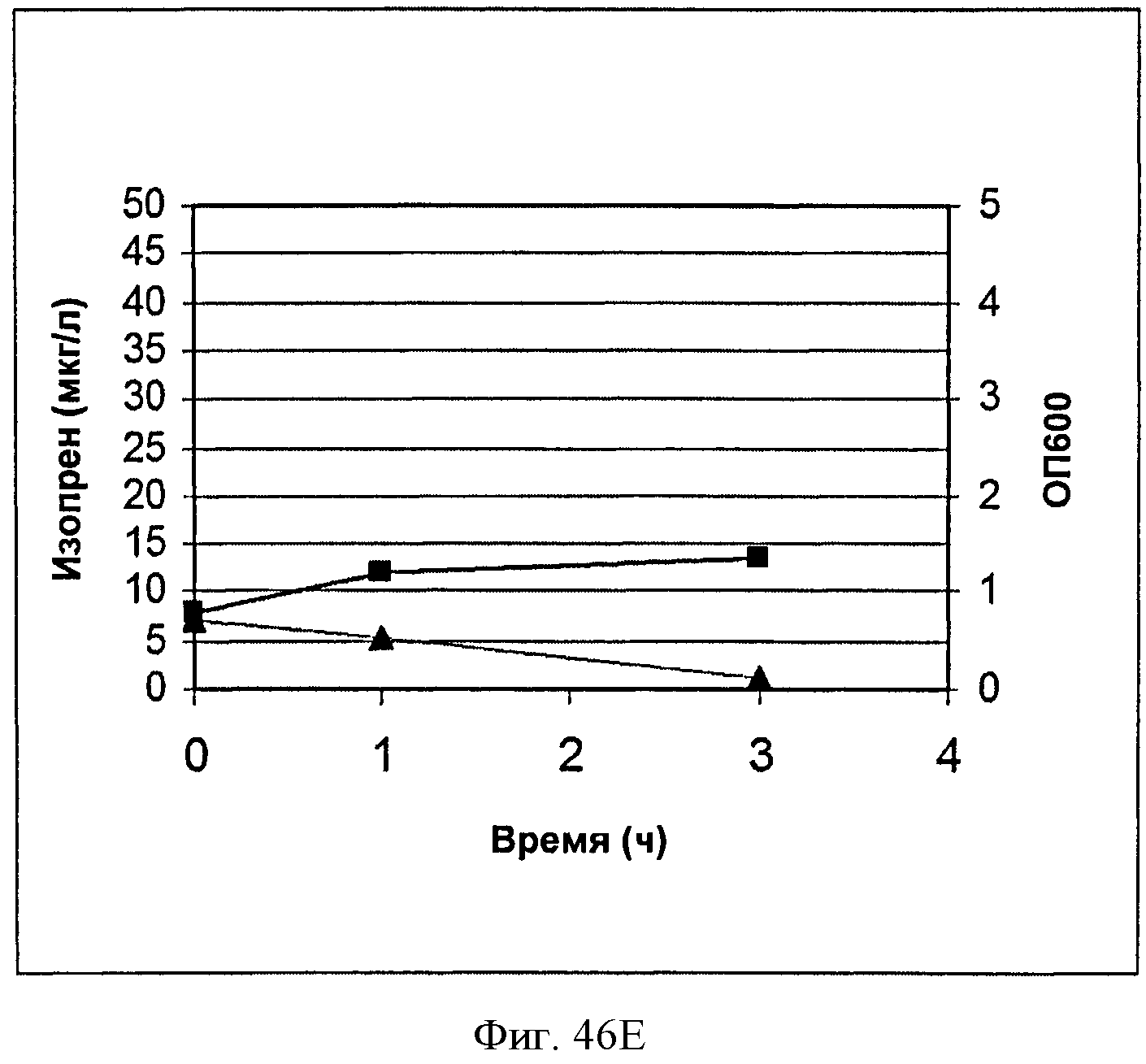
[0093] На Фигурах 46А-Е показаны графики, на которых представлено получение изопрена из биомассы. На Панели А показано получение изопрена из кукурузной соломы, на Панели В показано получение изопрена из багассы, на Панели С показано получение изопрена из хвойной целлюлозы, на Панели D показано получение изопрена из глюкозы и на Панели Е показано получение изопрена из клеток без дополнительной подпитки. Серые квадраты представляют измерения ОП600 культур в указанные моменты времени после инокуляции и черные треугольники представляют продукцию изопрена в указанные моменты времени после инокуляции.
[0094] На Фигуре 47А показан график, на котором представлена продукция изопрена клетками BL21 (λDE3) pTrcKudzu yIDI DXS (kan) в культуре без добавления глюкозы. Квадраты представляют ОП600 и треугольники представляют продуцированный изопрен (мкг/мл).
[0095] На Фигуре 47 В показан график, на котором представлена продукция изопрена из подаваемой 1% глюкозы клетками BL21 (λDE3) pTrcKudzu уIDI DXS (kan). Квадраты представляют ОП600 и треугольники представляют продуцированный изопрен (мкг/мл).
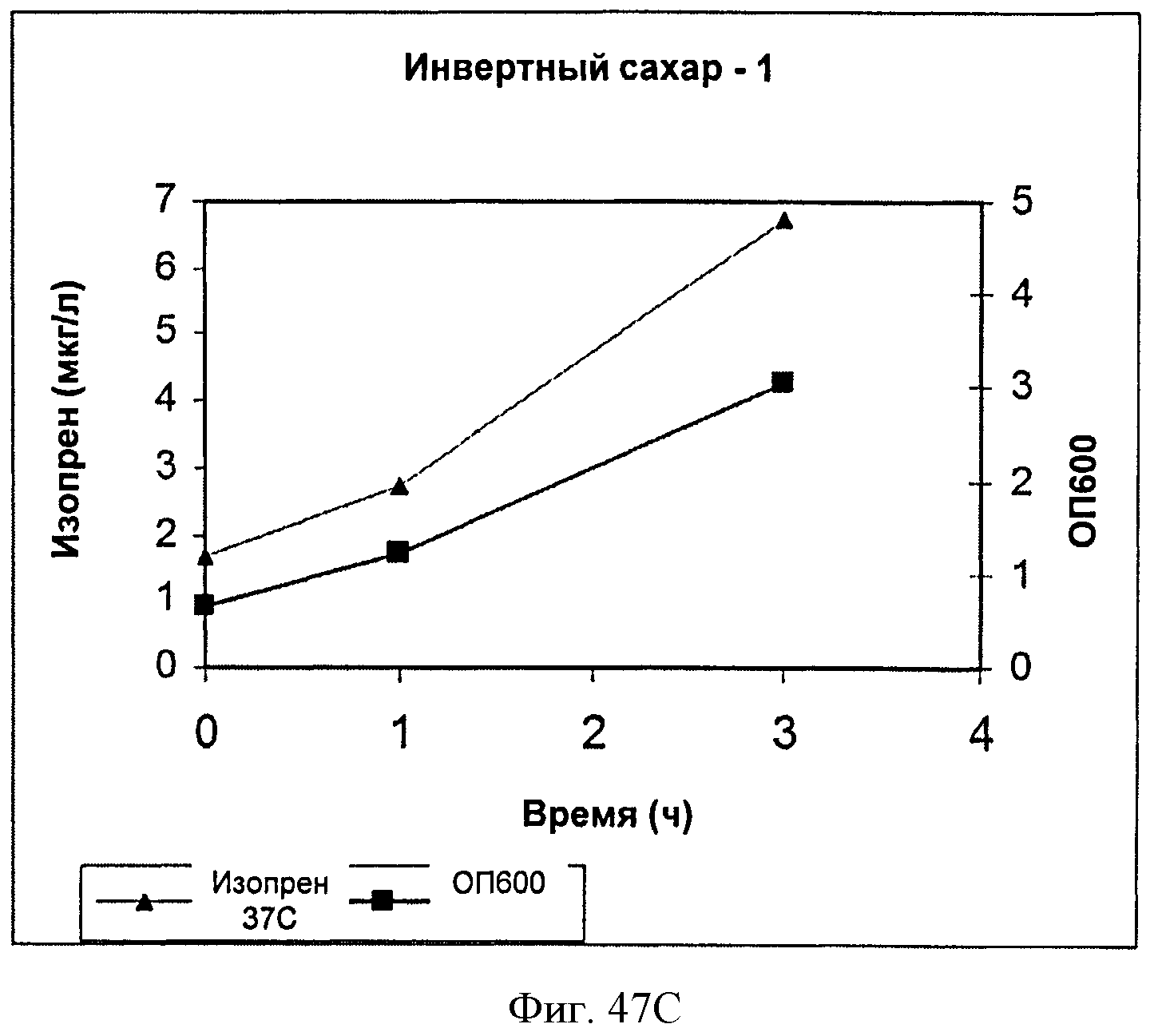
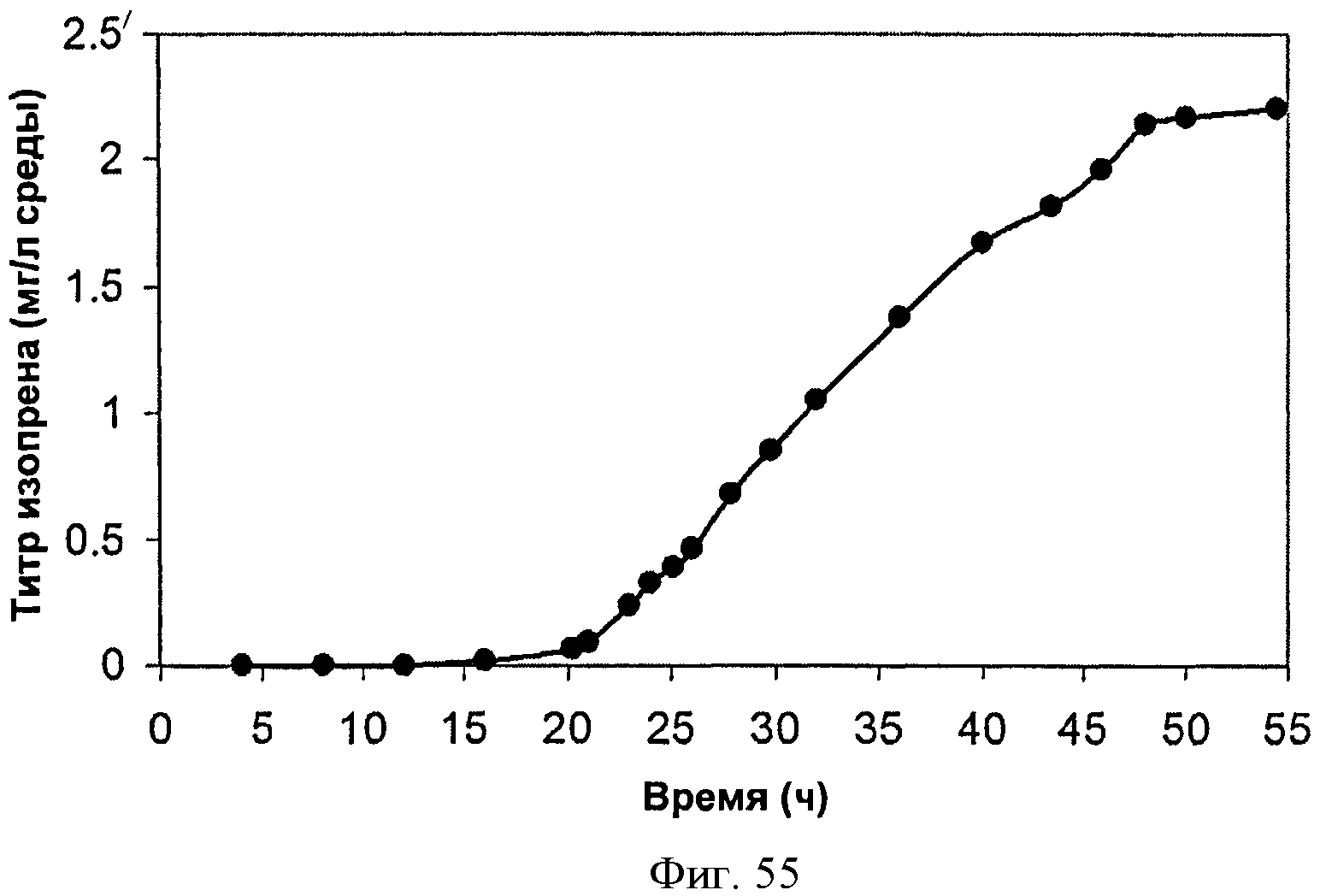
[0096] На Фигуре 47С показан график, на котором представлена продукция изопрена из подаваемого 1% инвертированного сахара клетками BL21 (XDE3) pTrcKudzu уIDI DXS (kan). Квадраты представляют ОП600 и треугольники представляют продуцированный изопрен (мкг/мл).
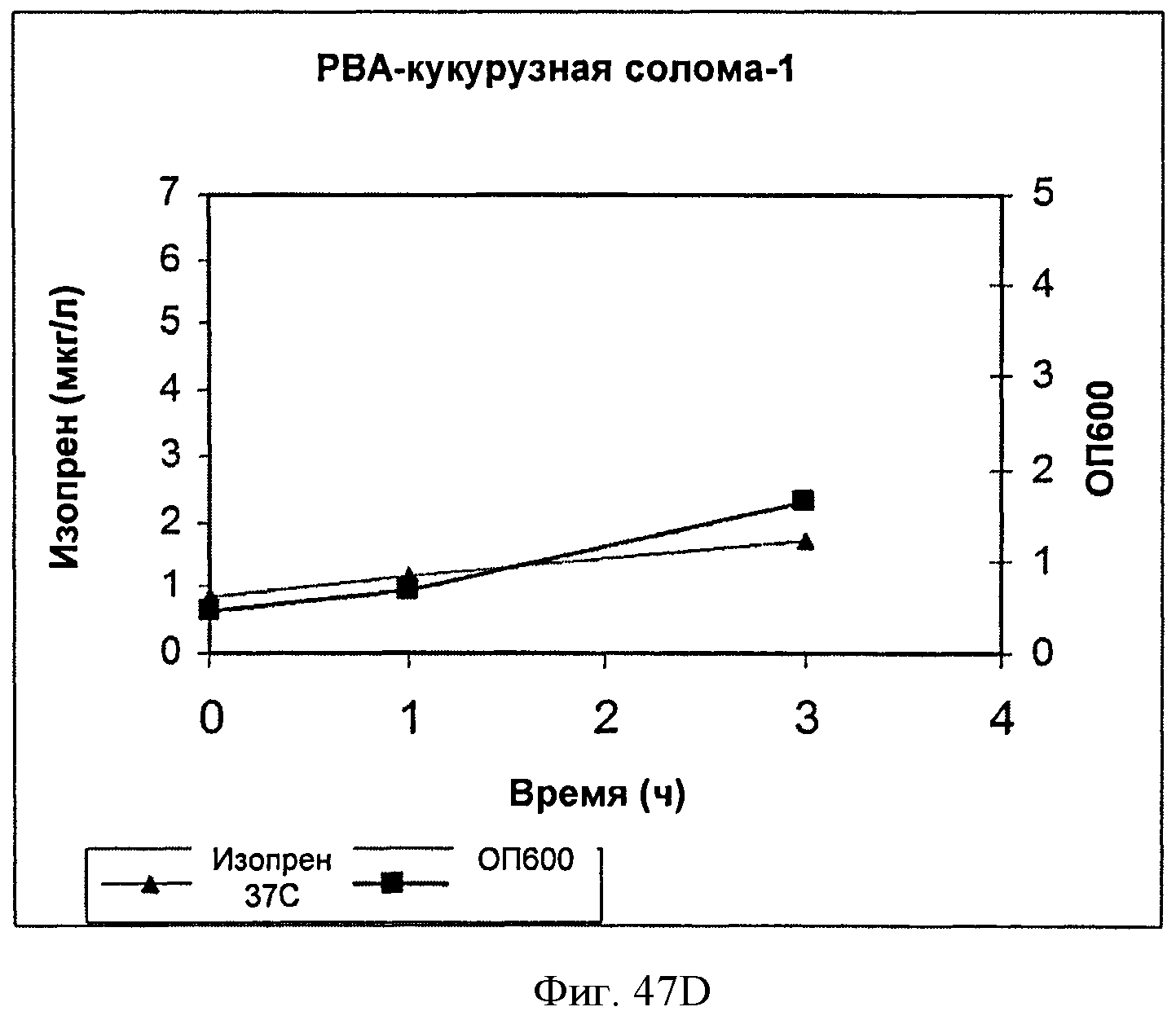
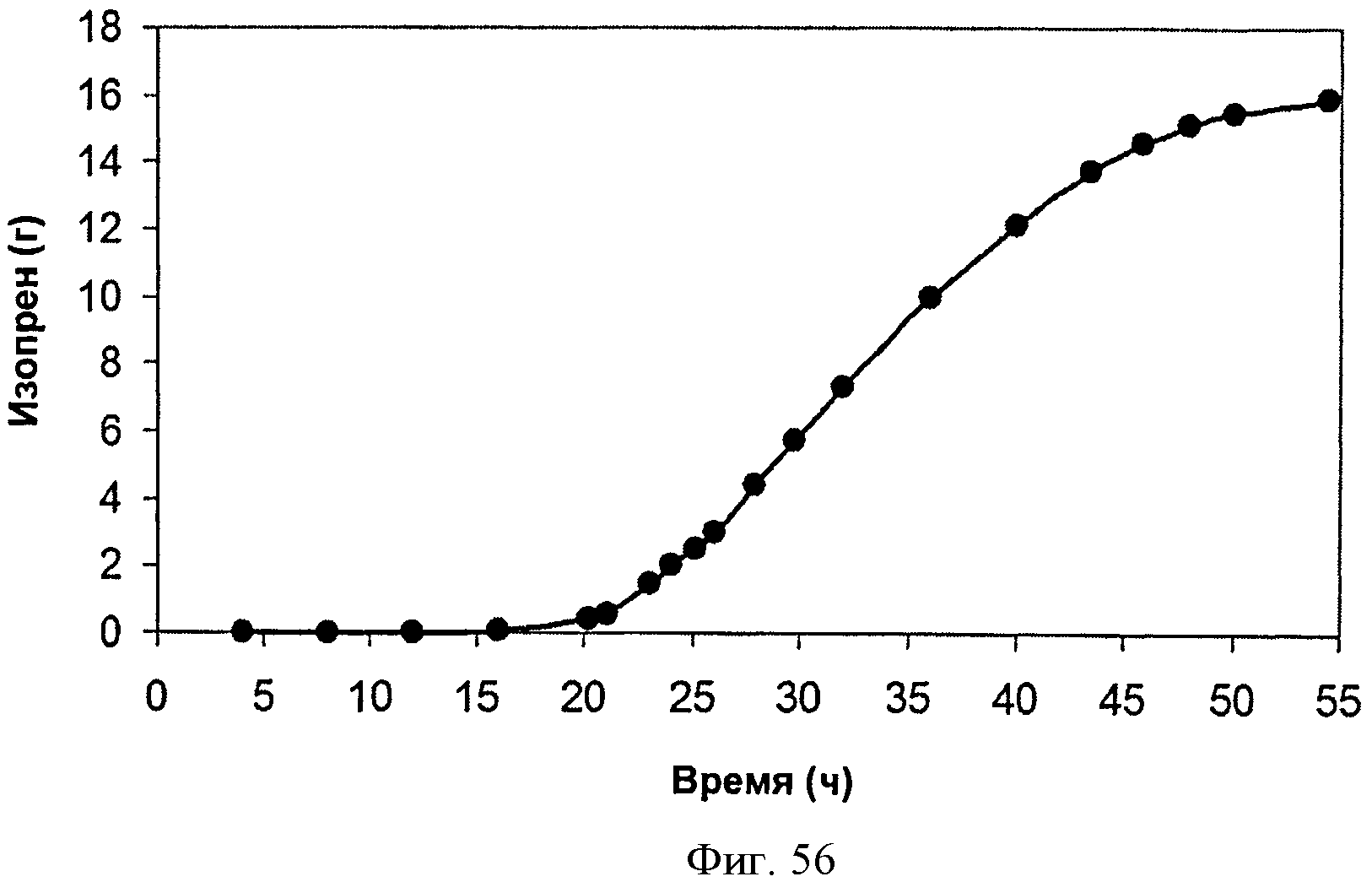
[0097] На Фигуре 47D показан график, на котором представлена продукция изопрена из подаваемой 1% кукурузной соломы AFEX клетками BL21 (λDE3) pTrcKudzu уIDI DXS (kan). Квадраты представляют ОП600 и треугольники представляют продуцированный изопрен (мкг/мл).
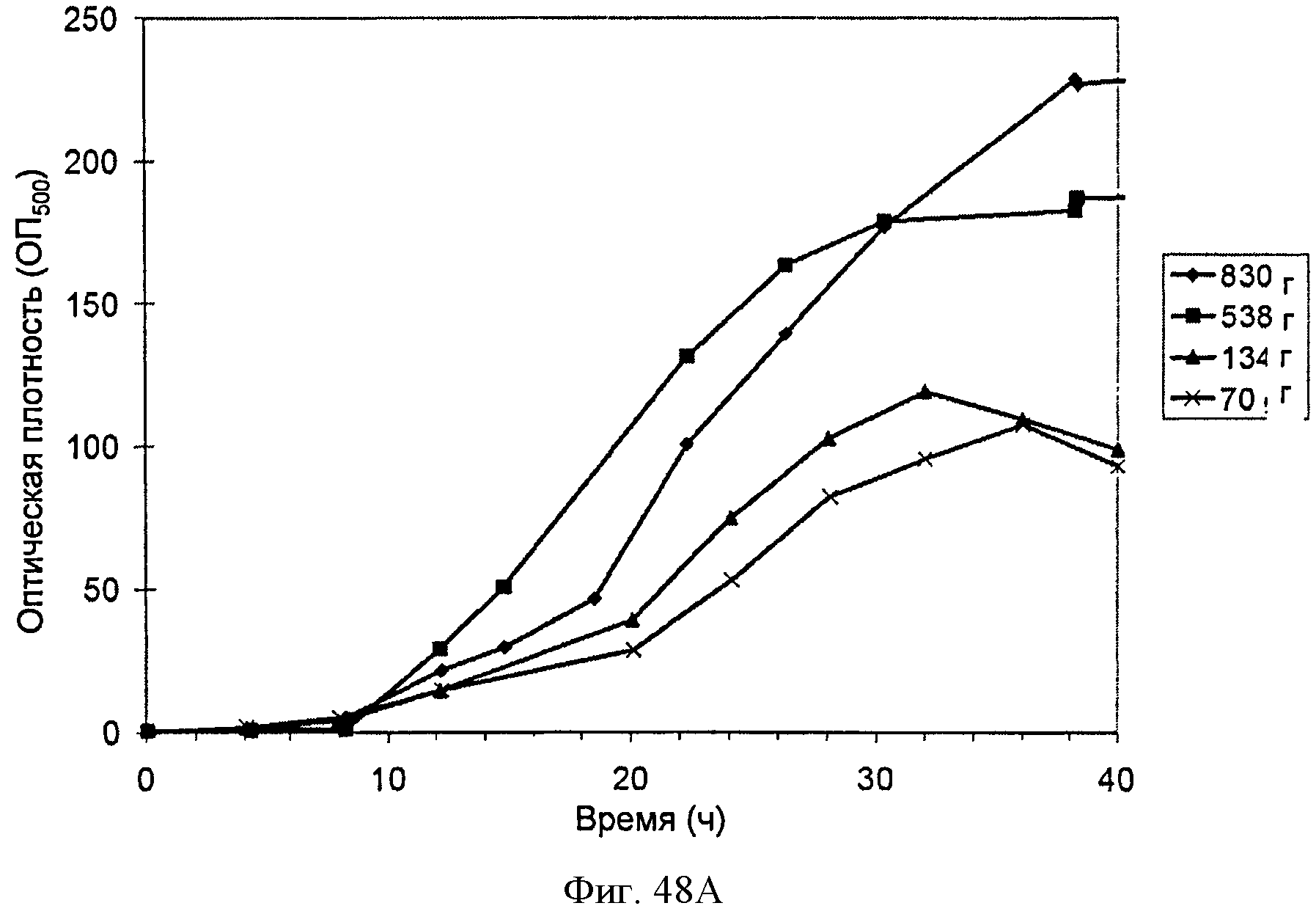
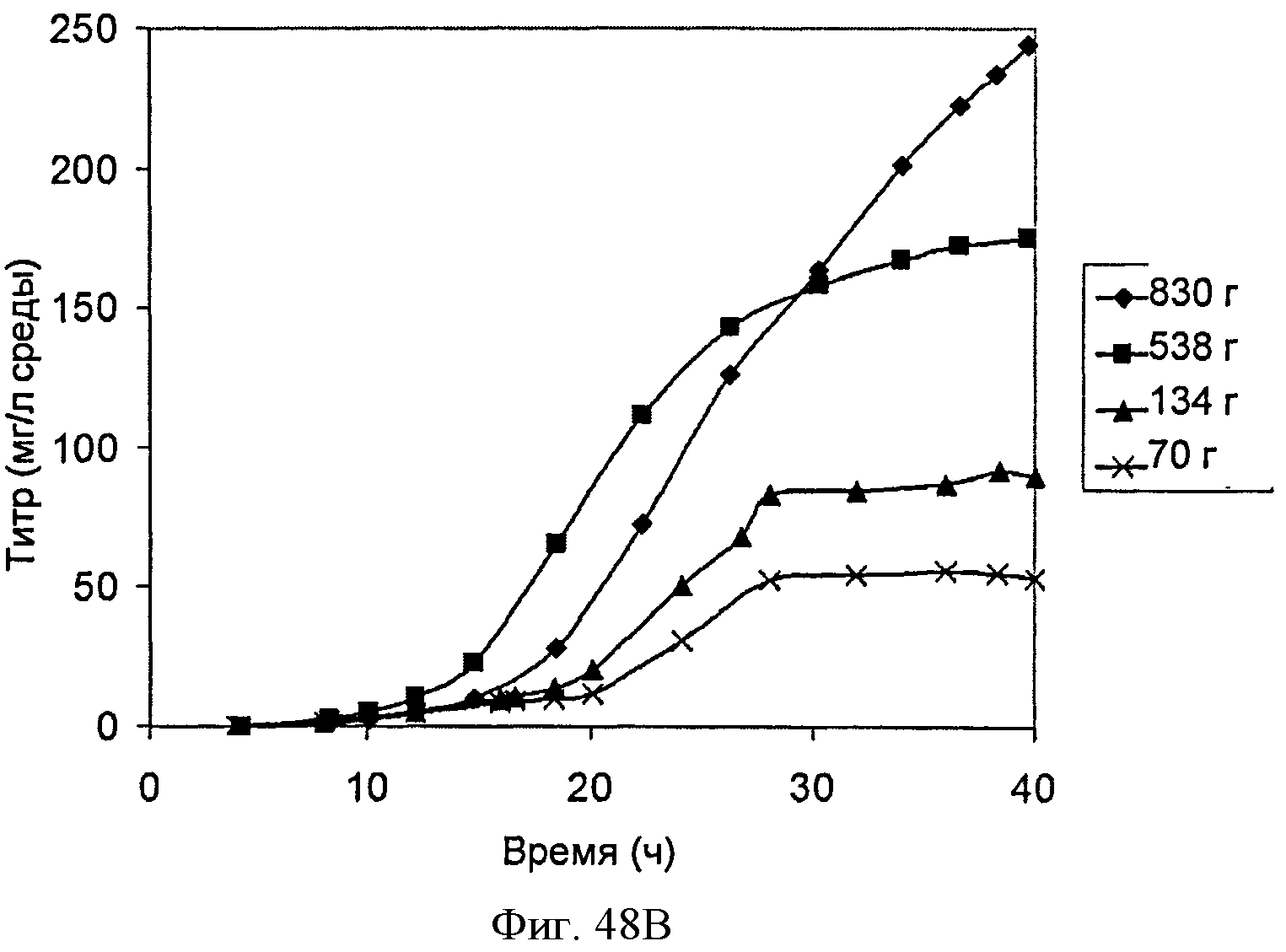
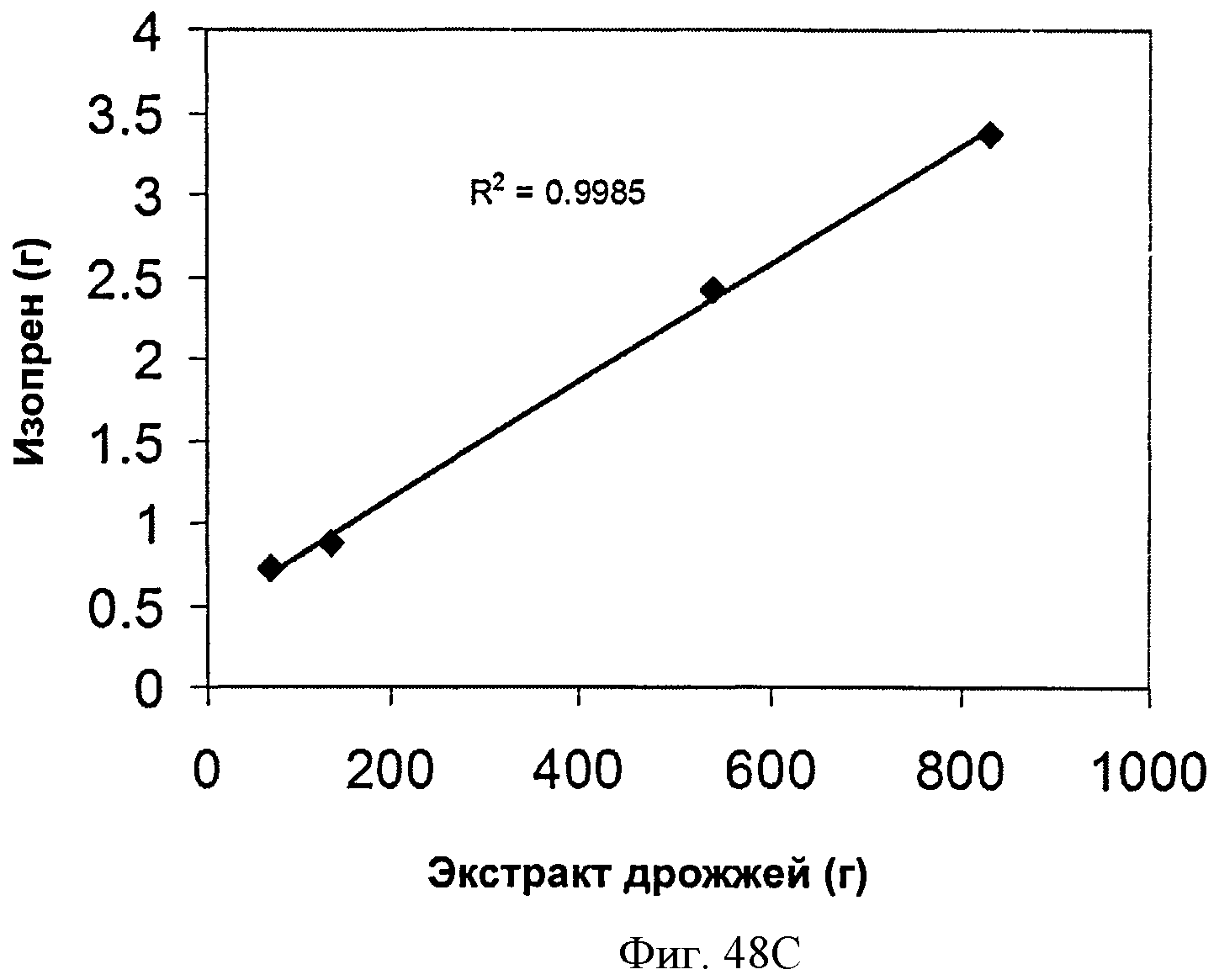
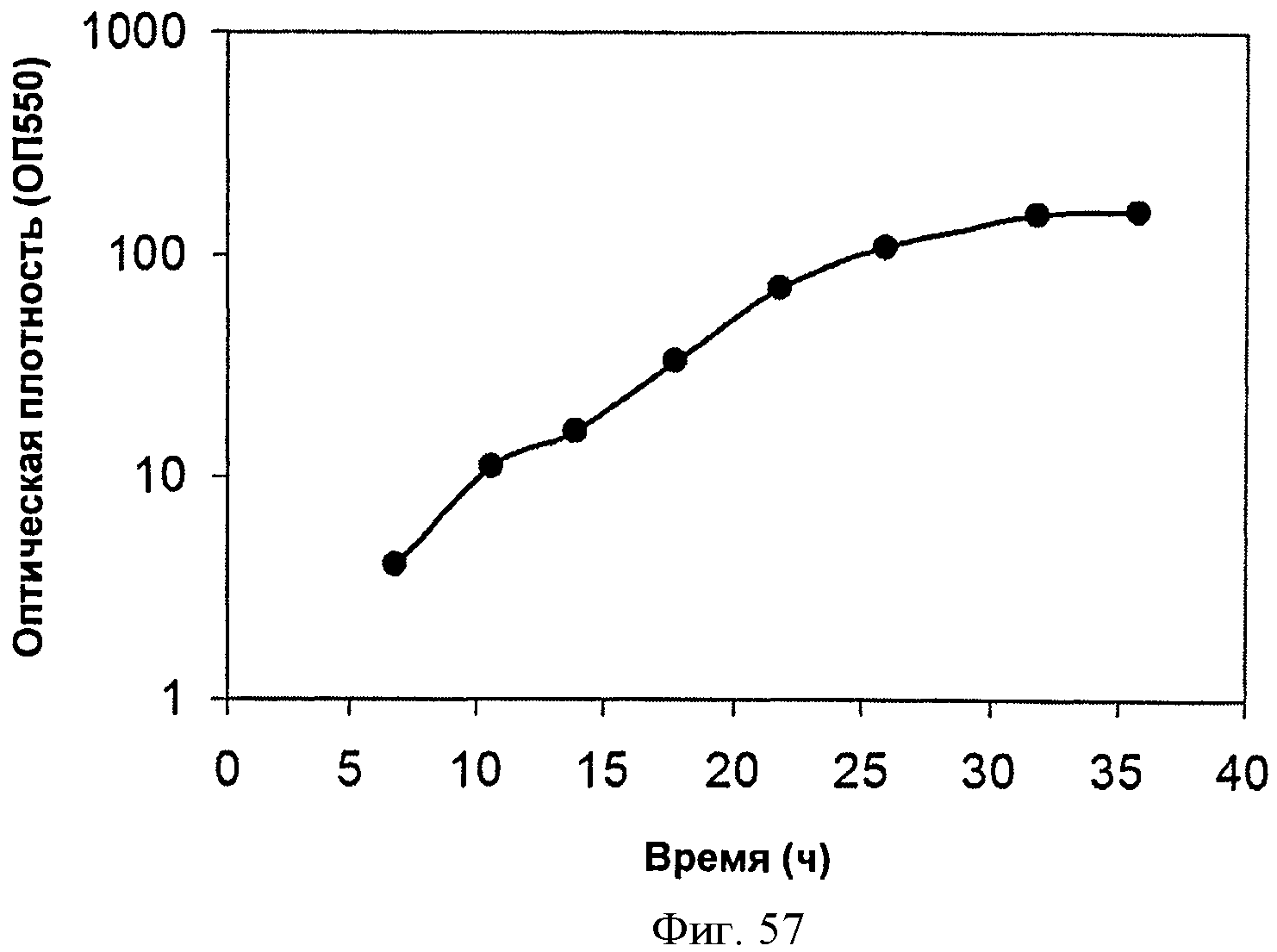
[0098] На Фигурах 48А-С показаны графики, демонстрирующие влияние дрожжевого экстракта на выработку изопрена. На Панели А показана зависимость оптической плотности внутри ферментаторов, в которые подавали различные количества дрожжевого экстракта, от времени. На Панели В показана зависимость титра изопрена внутри ферментаторов, в которые подавали различные количества дрожжевого экстракта, от времени. Титр определяют как количество изопрена, продуцированного на литр ферментационного бульона. На Панели С показано влияние дрожжевого экстракта на продукцию изопрена клетками Е. coli, которые растили в культуре с подпиткой.
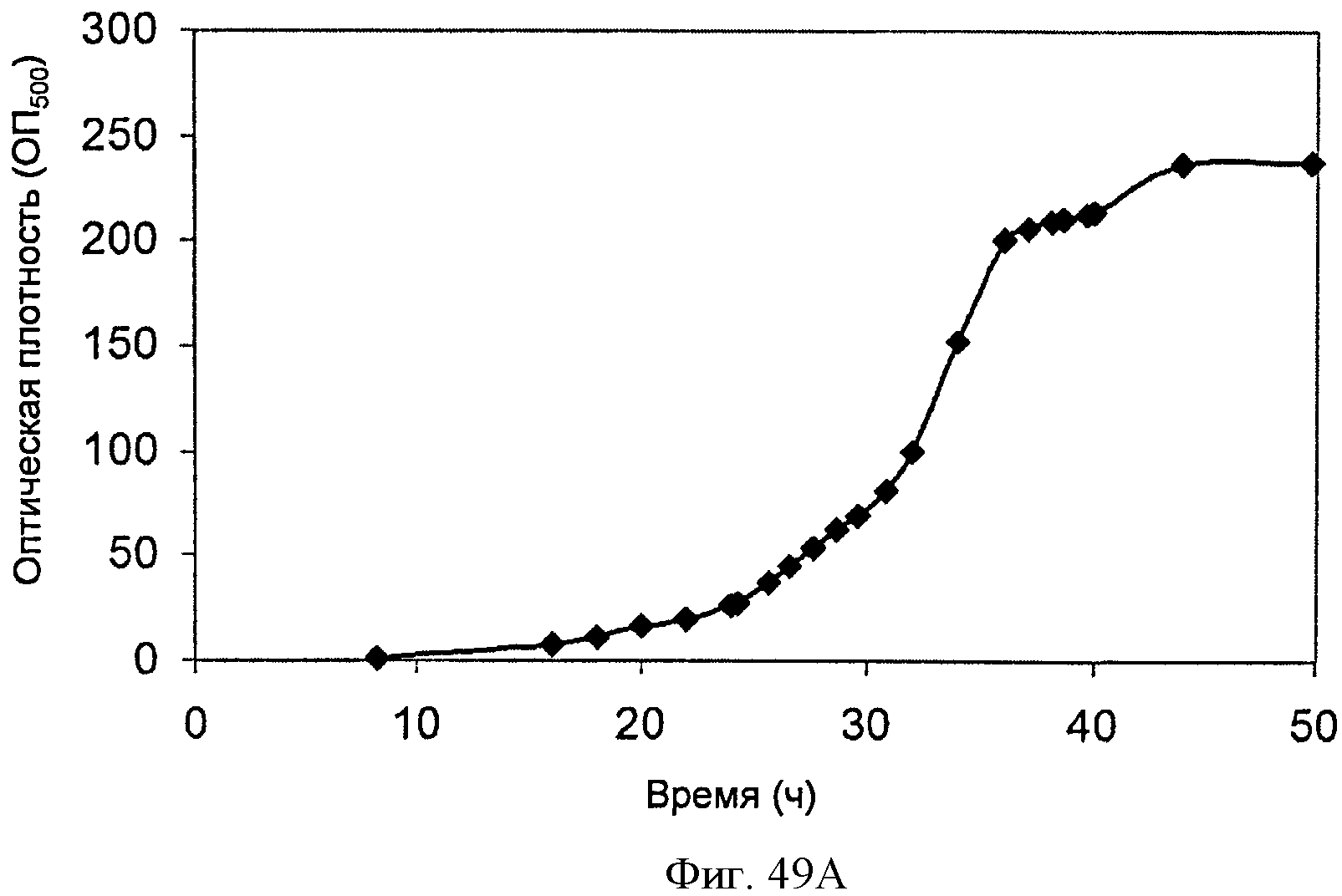
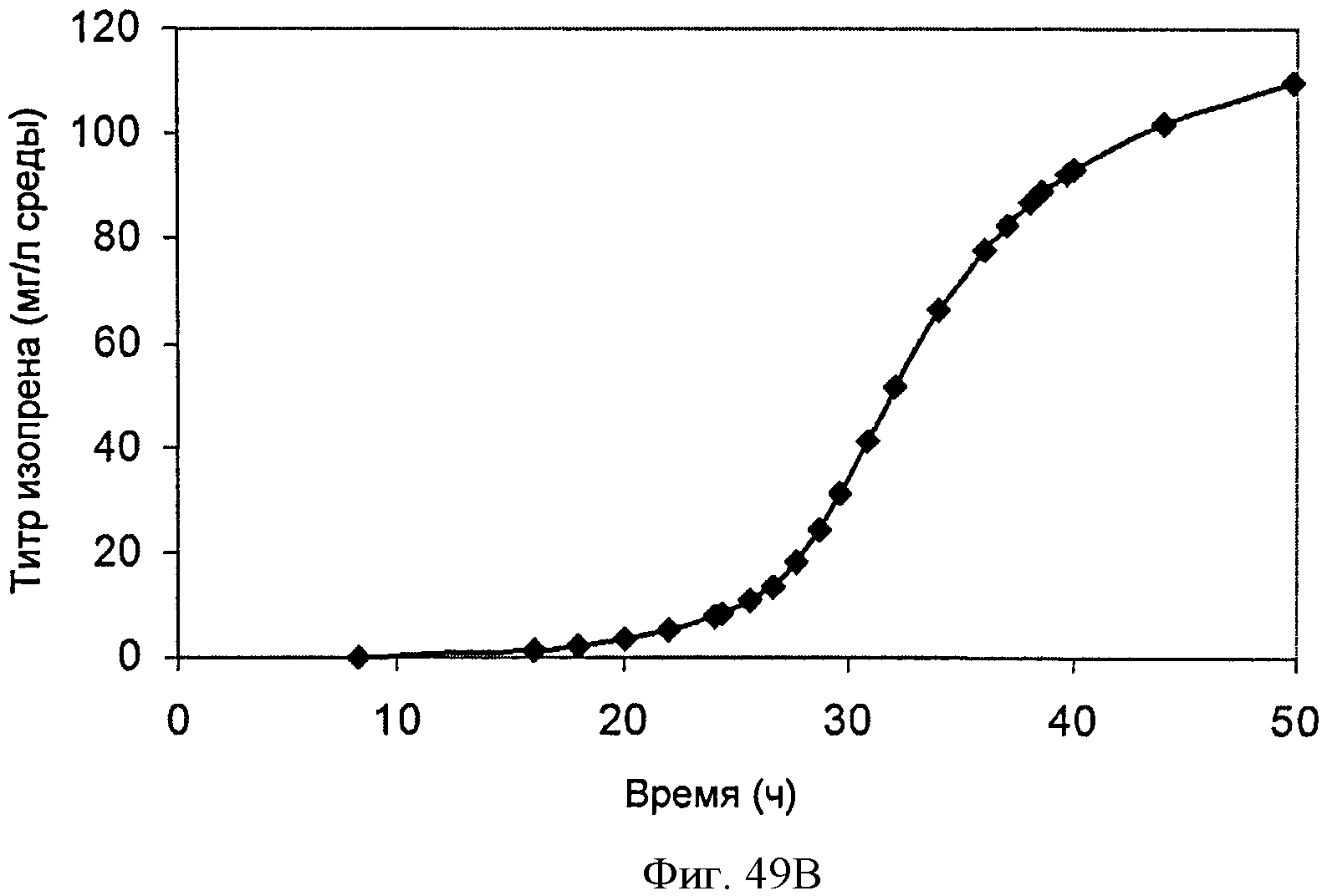
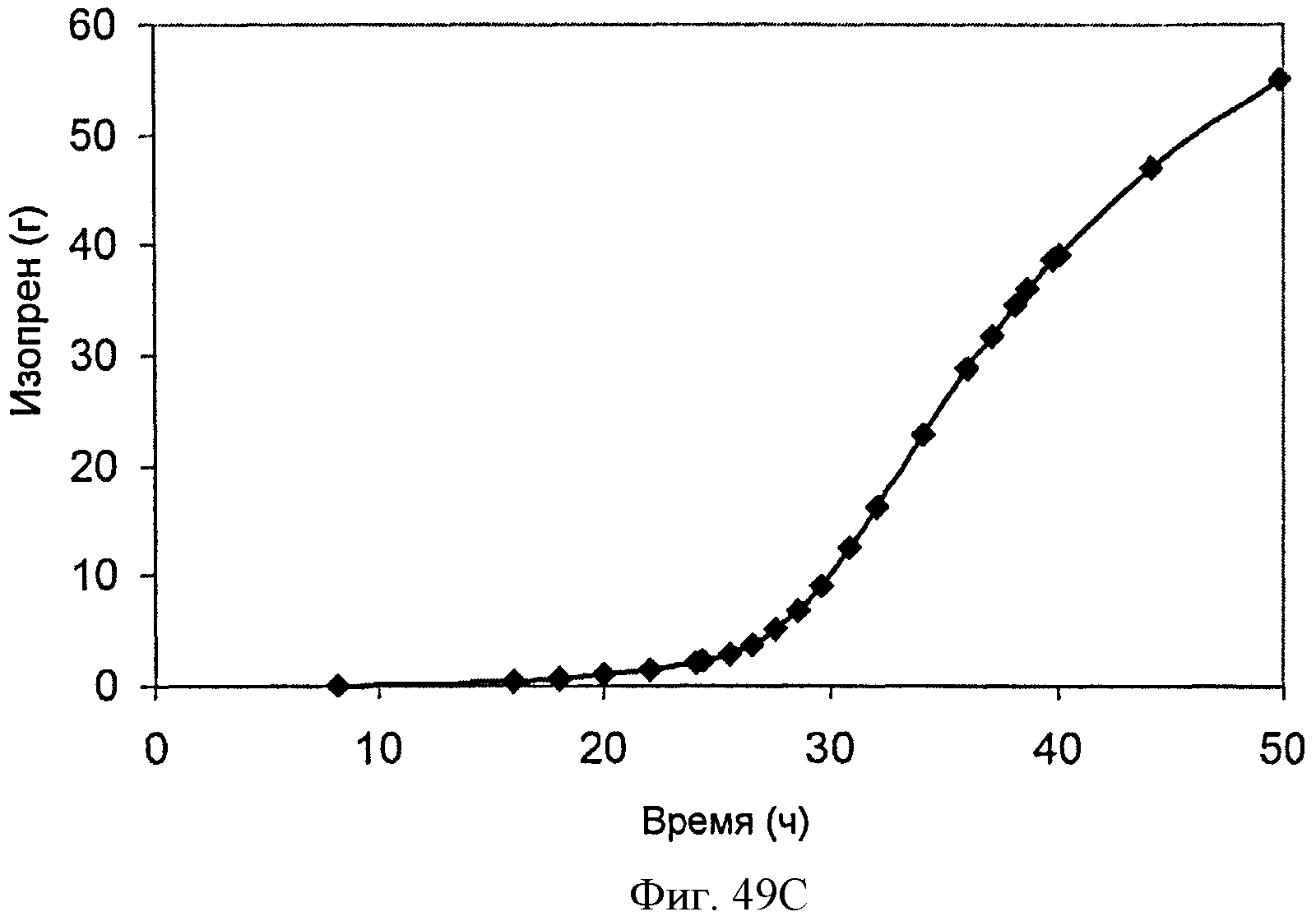
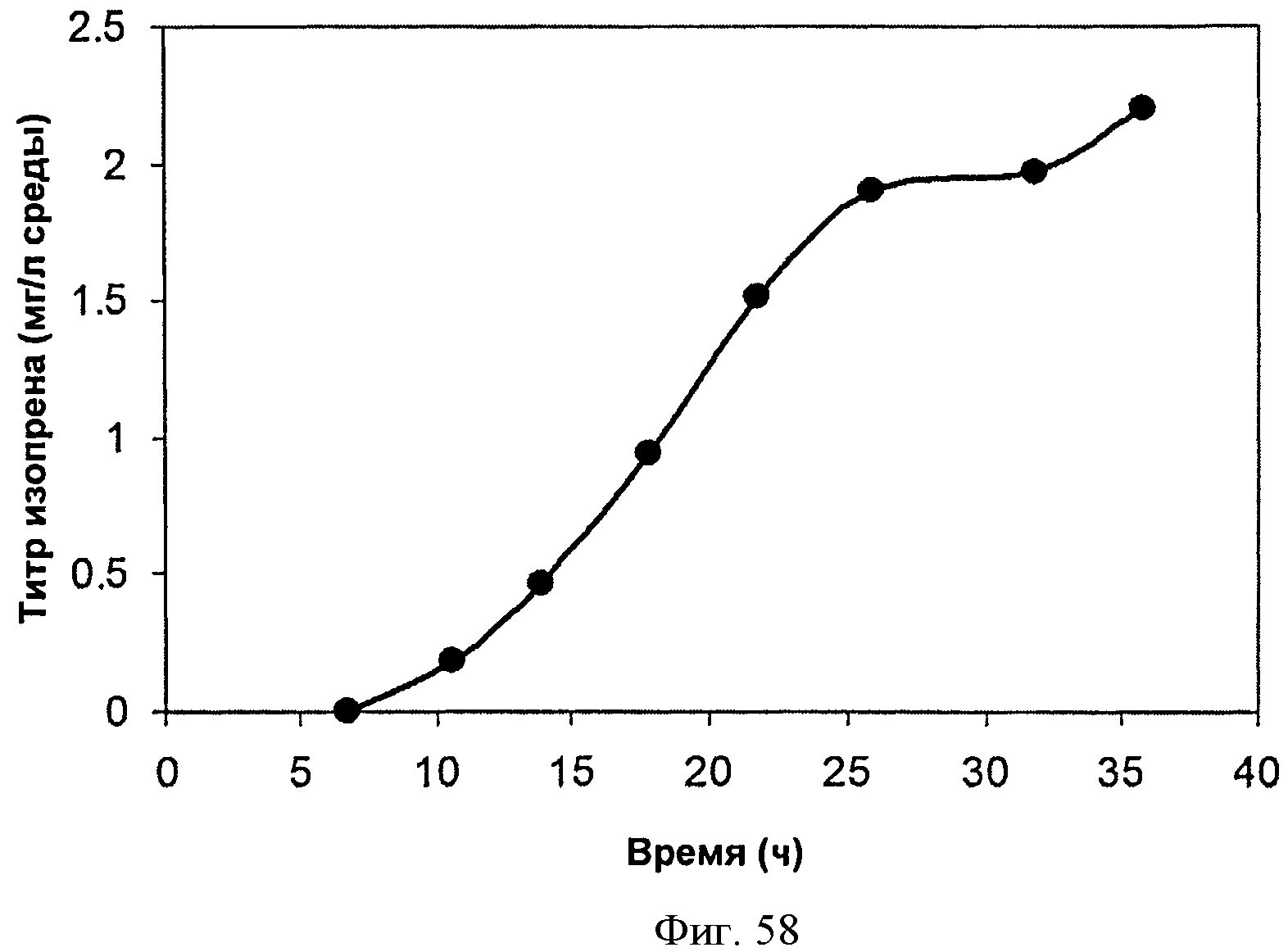
[0099] На Фигурах 49А-С показаны графики, демонстрирующие продукцию изопрена в 500 л биореакторе клетками Е. coli, содержащими плазмиду pTrcKudzu+yIDI+DXS. На Панели А показана зависимость оптической плотности в 500 л биореакторе, в который подавали глюкозу и дрожжевой экстракт, от времени. На Панели В показана зависимость титра изопрена в 500 л биореакторе, в который подавали глюкозу и дрожжевой экстракт, от времени. Титр определяют как количество изопрена, продуцированного на литр ферментационного бульона. На Панели С показана зависимость общего количества изопрена, полученного в 500 л биореакторе, в который подавали глюкозу и дрожжевой экстракт, от времени.
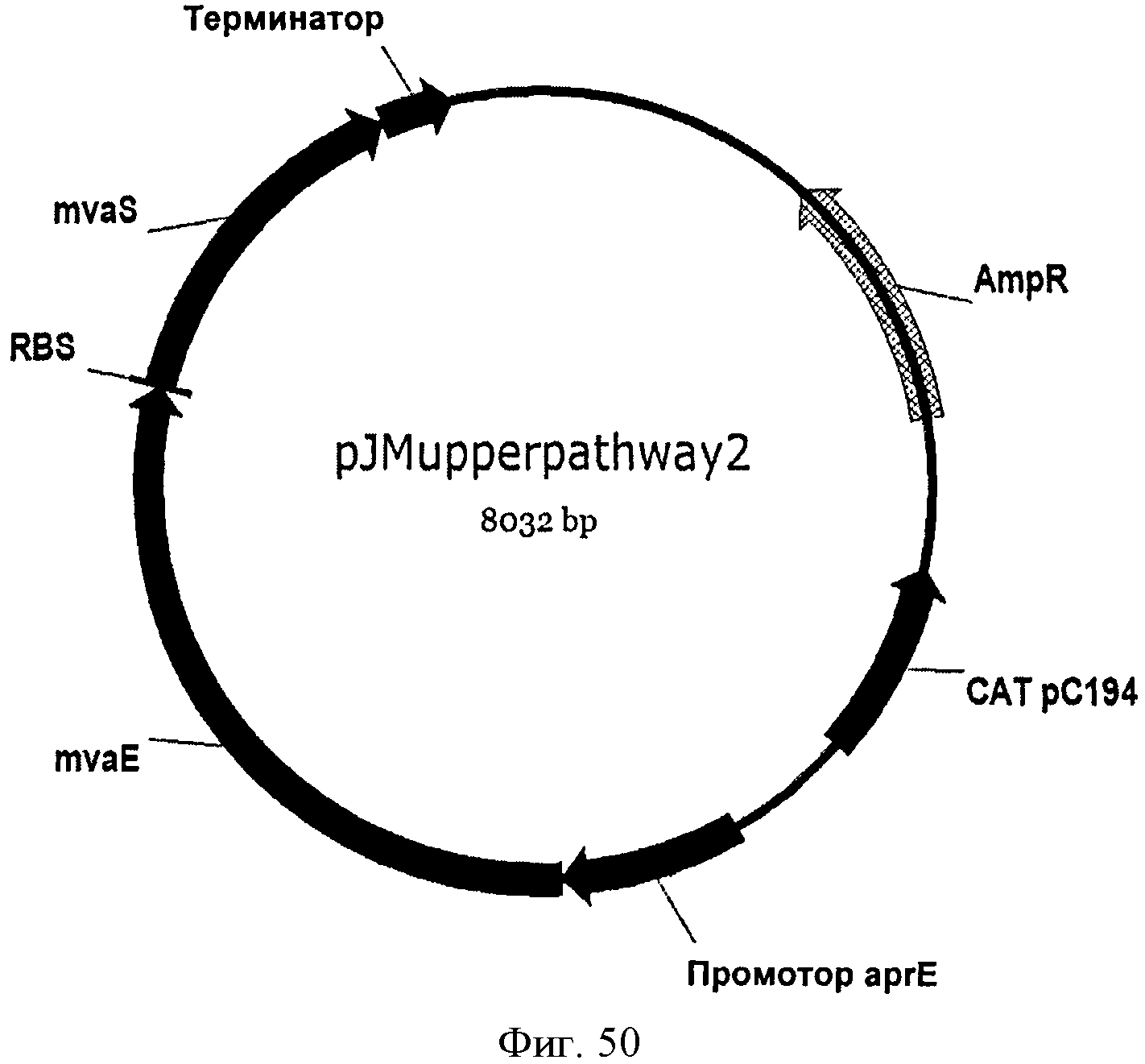
[0100] Фигура 50 представляет собой карту pJMupperpathway2.
[0101] Фигуры 51А-С представляют собой последовательность нуклеотидов pJMupperpathway2 (SEQ ID NO: 22).
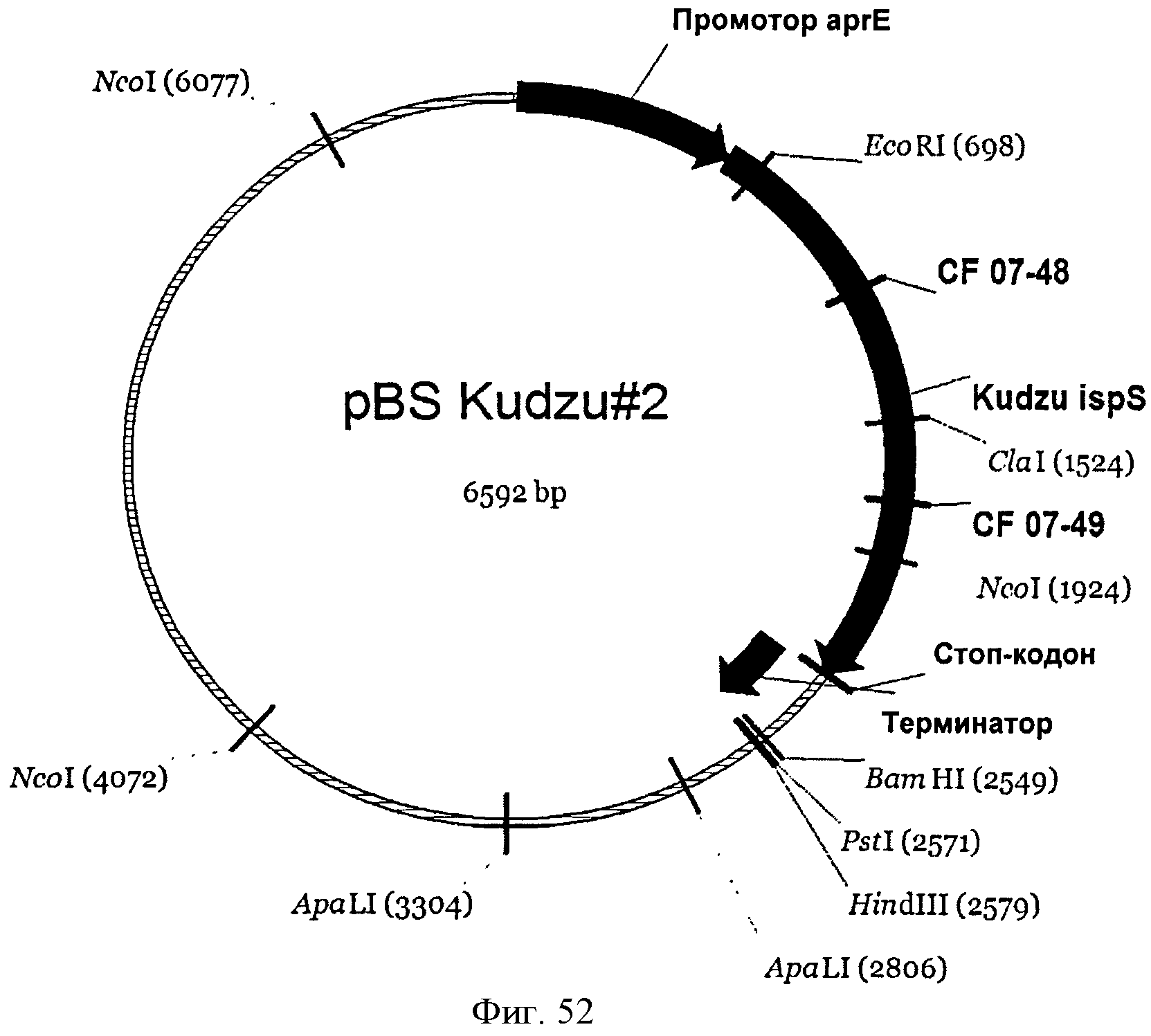
[0102] Фигура 52 представляет собой карту pBS Kudzu #2.
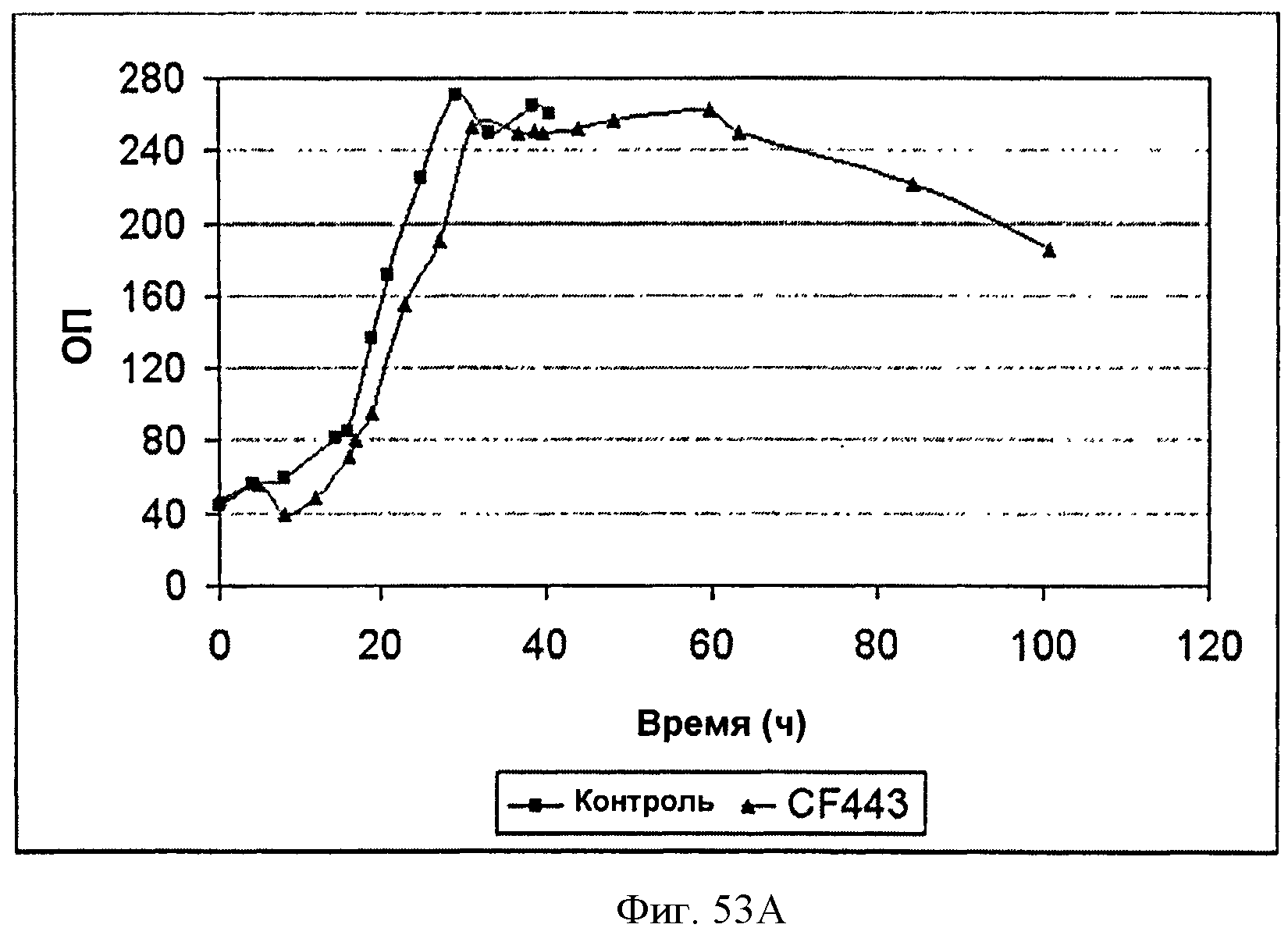
[0103] Фигура 53А представляет собой график, на котором изображен рост во время ферментации Bacillus, экспрессирующих рекомбинантную изопрен синтазу кудзу в 14 литровом ферментаторе периодического действия с подпиткой. Черные ромбы представляют контрольный штамм (BG3594comK) без рекомбинантной изопренсинтазы (продукция нативного изопрена) и серые треугольники представляют CF443, штамм BG3594comK Bacillus с pBS Kudzu (продукция рекомбинантного изопрена).
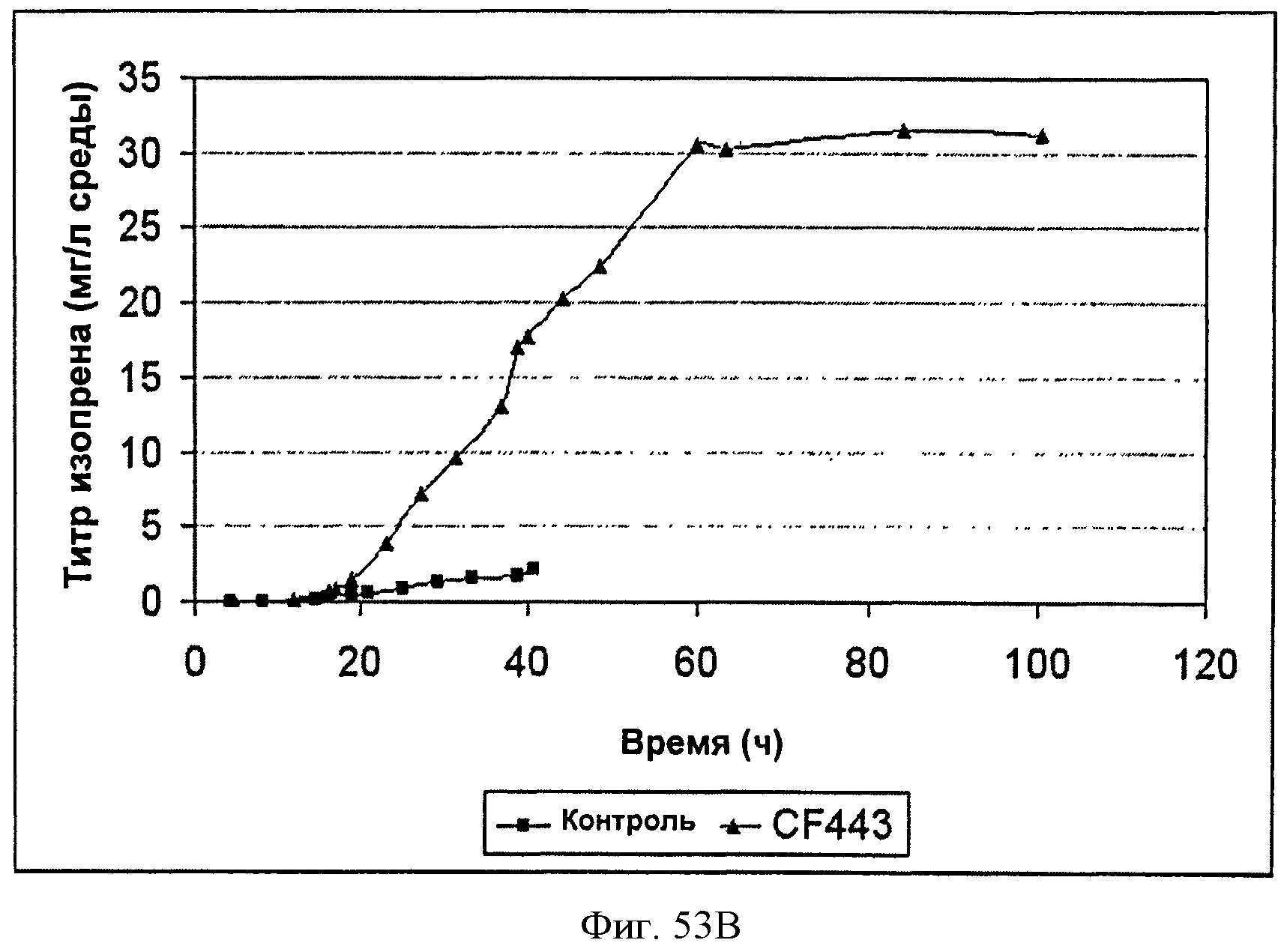
[0104] Фигура 53 В представляет собой график, на котором изображена продукция изопрена во время ферментации Bacillus, экспрессирующих рекомбинантную изопренсинтазу кудзу, в 14 литровом ферментаторе периодического действия с подпиткой. Черные ромбы представляют контрольный штамм (BG3594comK) без рекомбинантной изопренсинтазы (продукция нативного изопрена) и серые треугольники представляют CF443, штамм BG3594comK Bacillus с pBS Kudzu (продукция рекомбинантного изопрена).
[0105] На Фигуре 54 представлена зависимость оптической плотности внутри 15 л биореактора, в который подавали глюкозу, от времени.
[0106] На Фигуре 55 представлена зависимость титра изопрена внутри 15 л биореактора, в который подавали глюкозу, от времени. Титр определяют как количество изопрена, продуцированного на литр ферментационного бульона.
[0107] На Фигуре 56 представлена зависимость общего количества изопрена, полученного внутри 15 л биореактора, в который подавали глюкозу, от времени.
[0108] На Фигуре 57 представлена зависимость оптической плотности внутри 15 л биореактора, в который подавали глицерин, от времени.
[0109] На Фигуре 58 представлена зависимость титра изопрена внутри 15 л биореактора, в который подавали глицерин. Титр определяют как количество изопрена. продуцированного на литр ферментационного бульона, от времени.
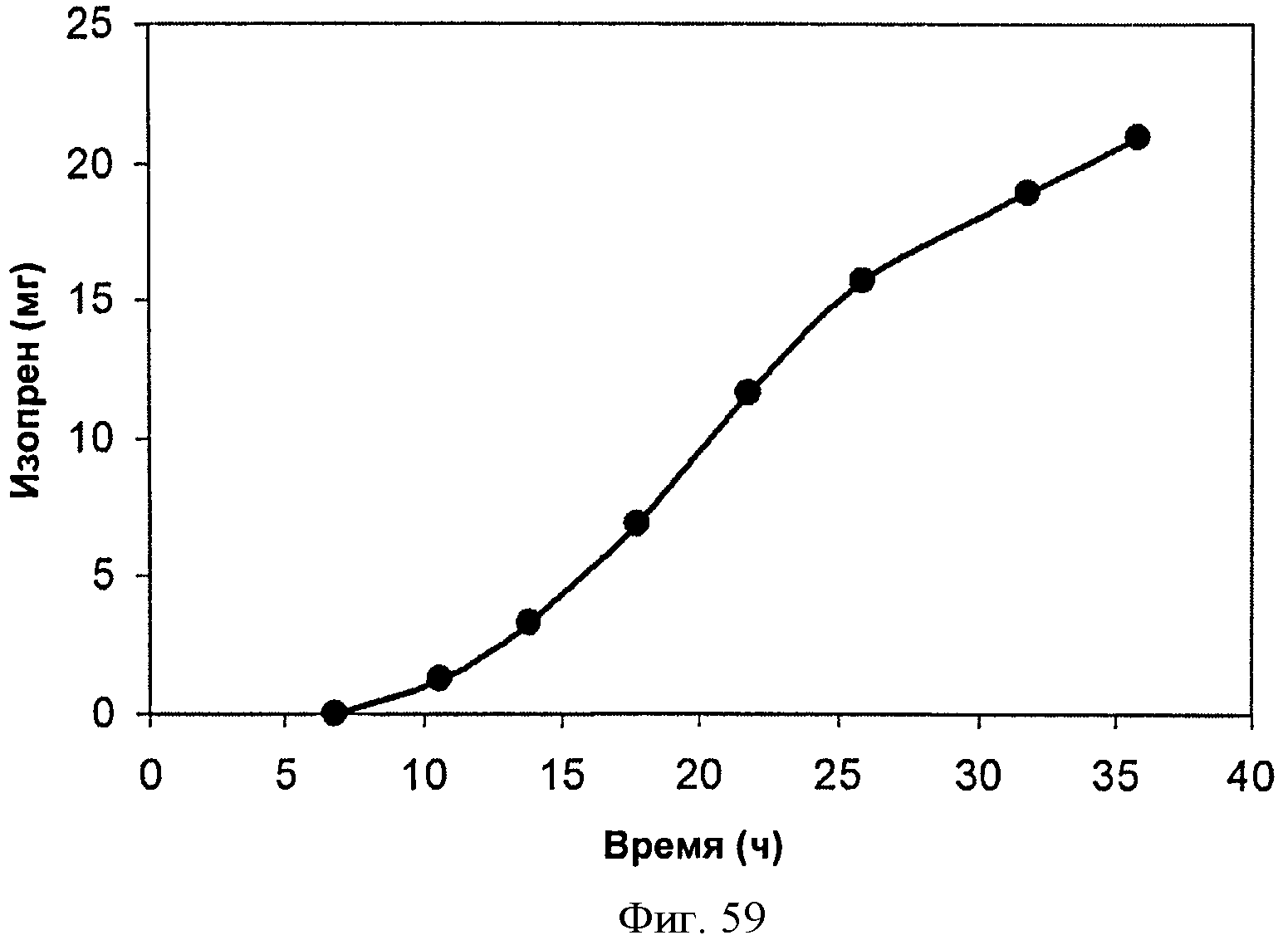
[0110] На Фигуре 59 представлена зависимость общего количества изопрена, полученного внутри 15 л биореактора, в который подавали глицерин, от времени.
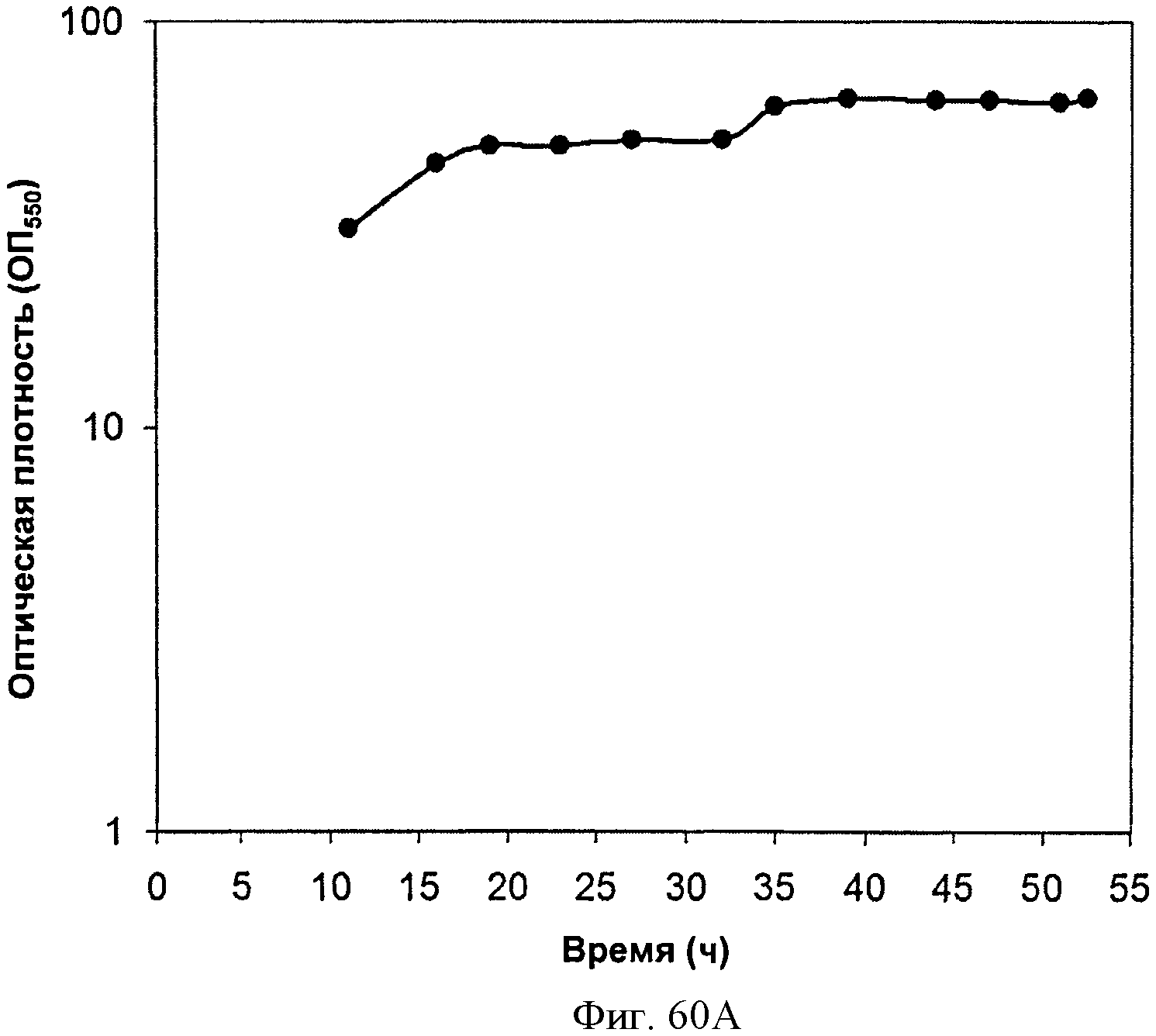
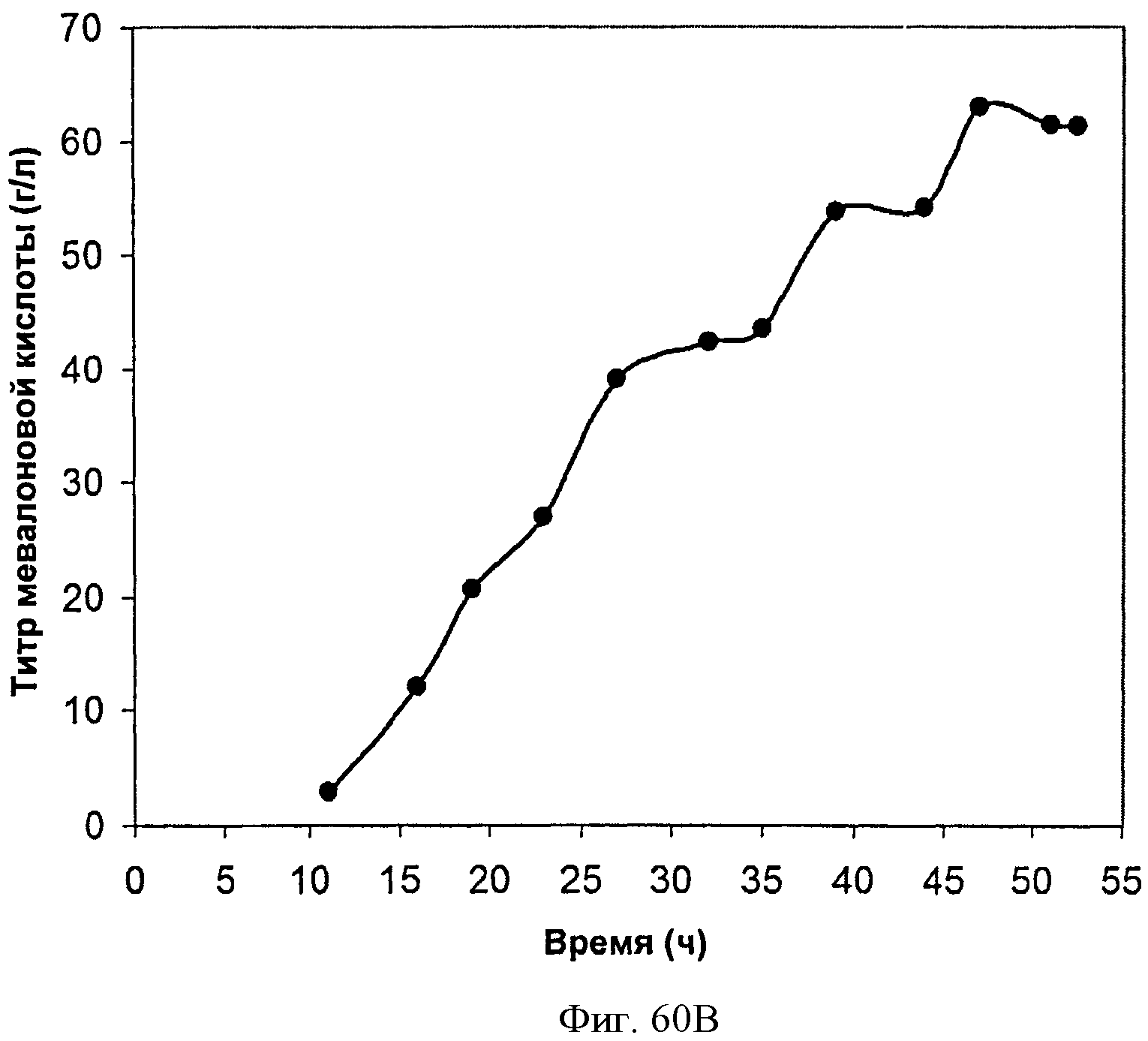
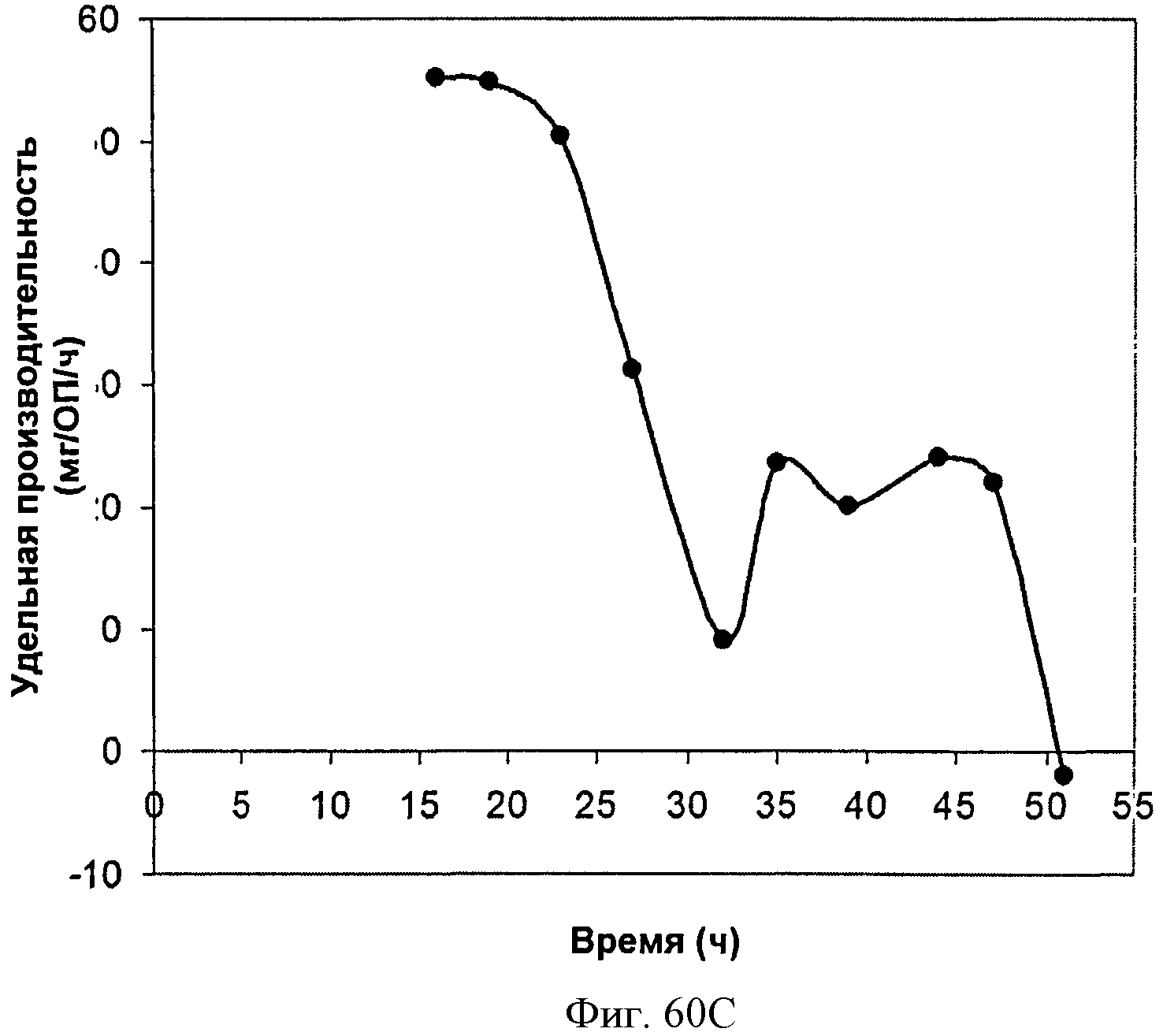
[0111] На Фигурах 60А-60С представлена зависимость оптической плотности, титра мевалоновой кислоты и удельной производительности 150 л биореактора, в который подавали глюкозу, от времени.
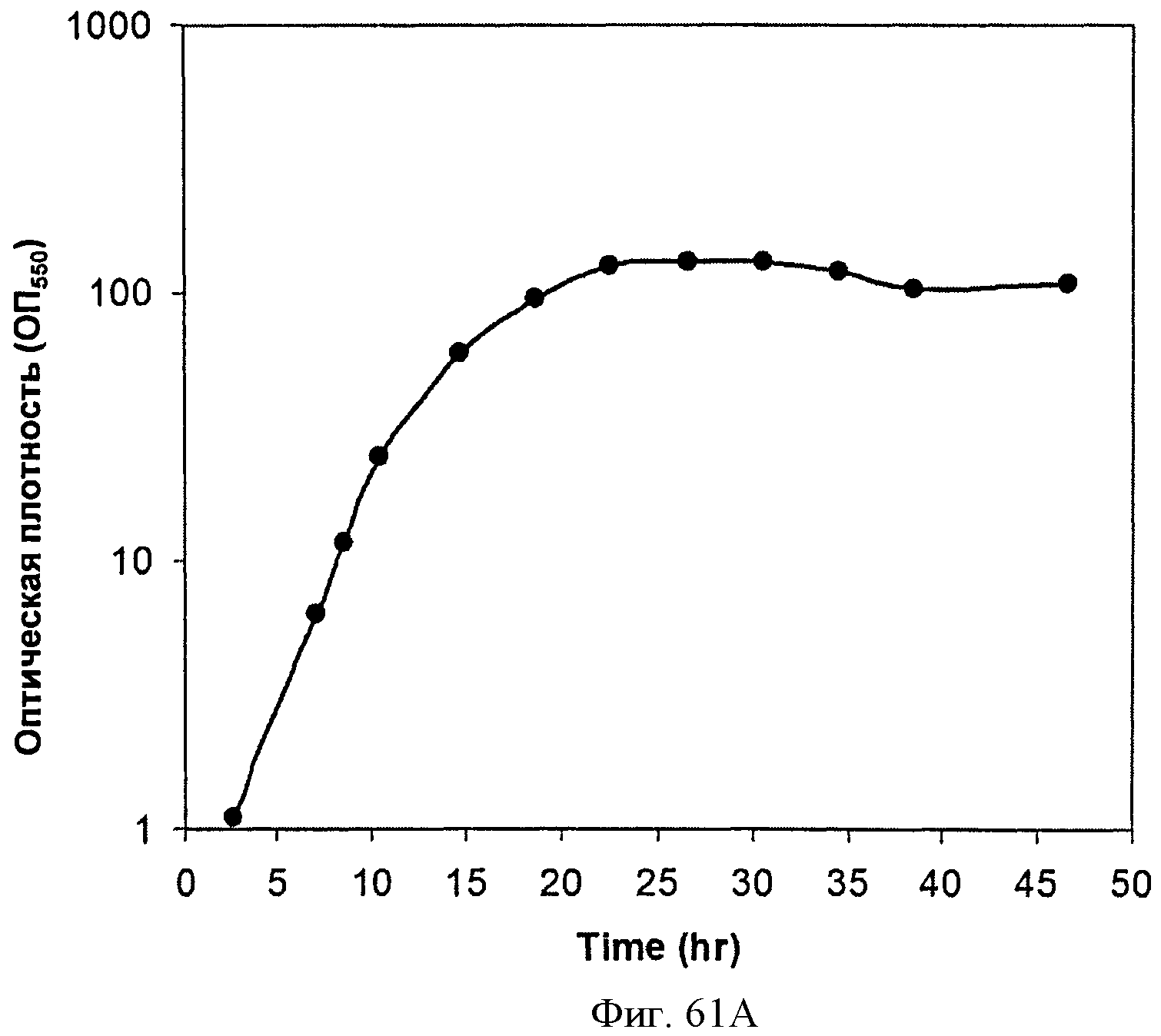
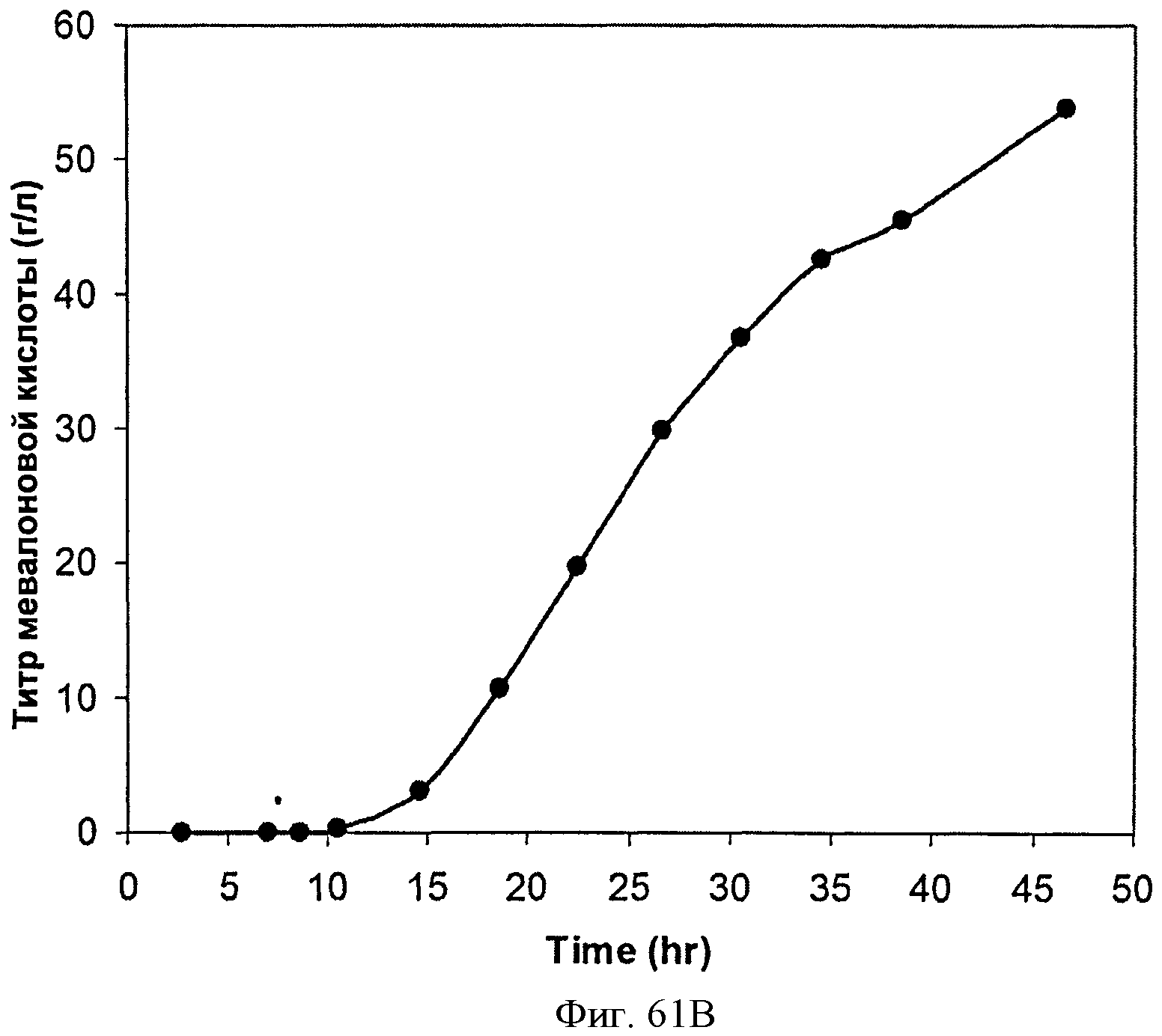
[0112] На Фигурах 61А-61С представлена зависимость оптической плотности, титра мевалоновой кислоты и удельной производительности 15 л биореактора, в который подавали глюкозу, от времени.
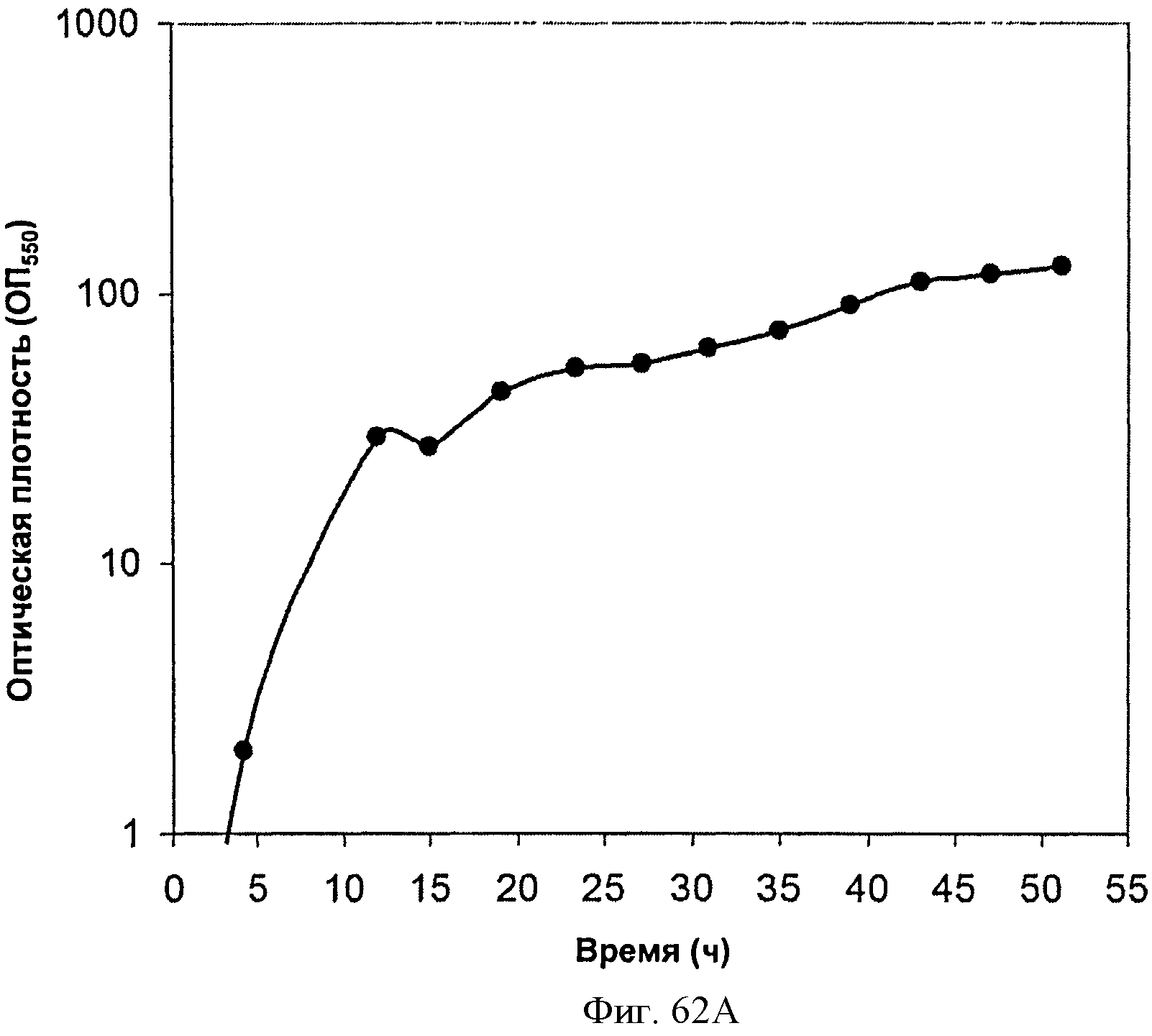
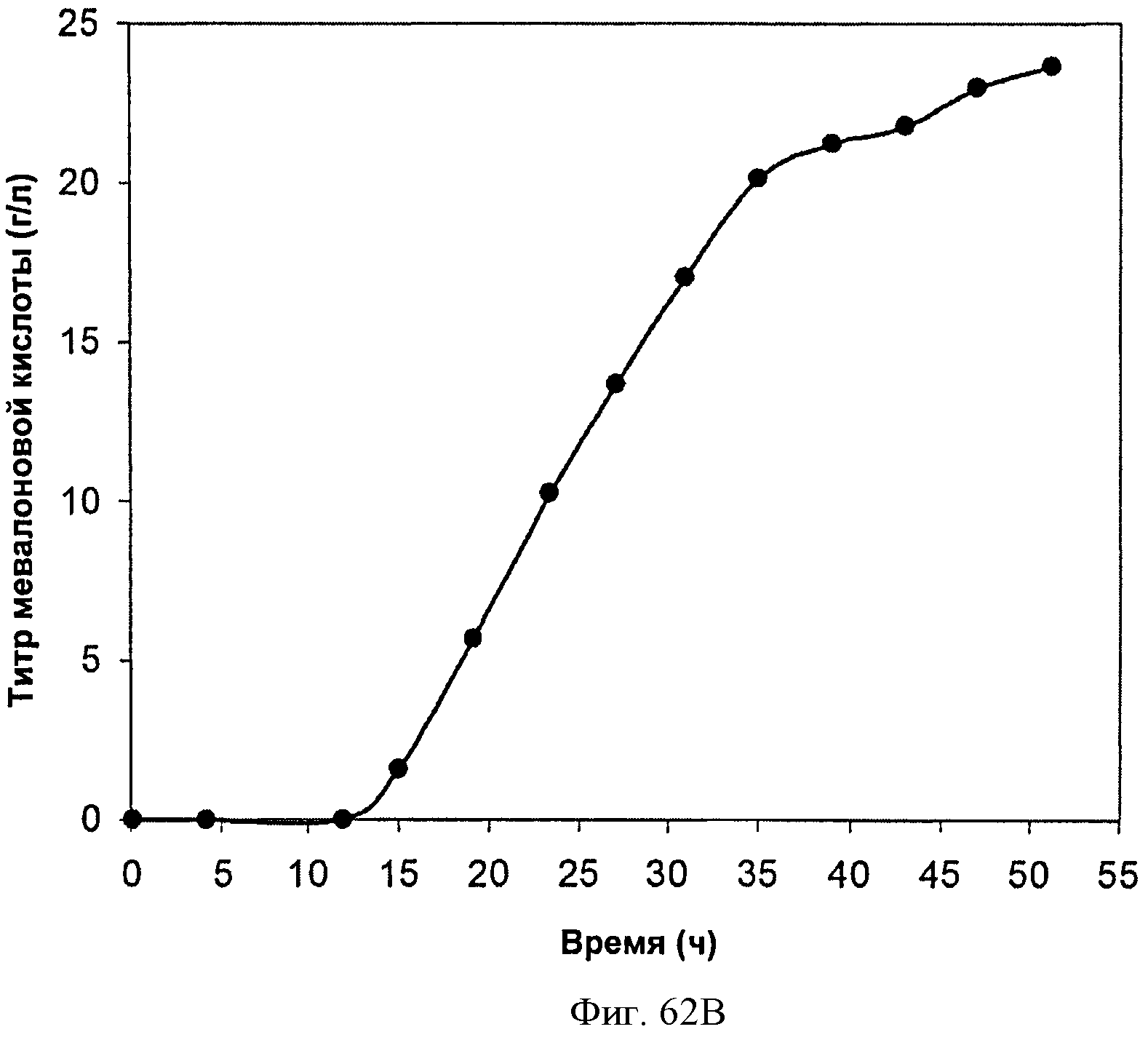
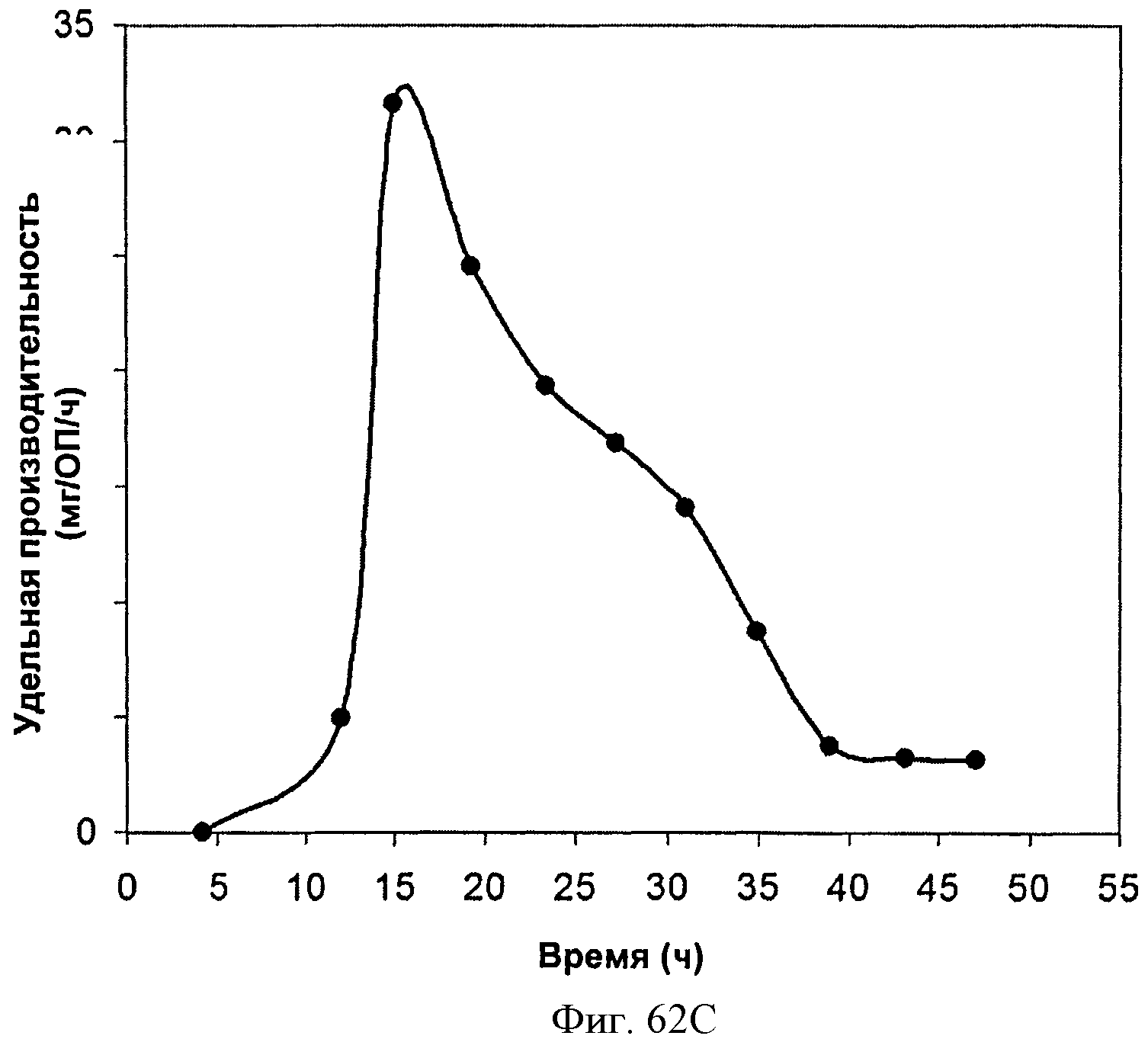
[0113] На Фигурах 62А-62С представлена зависимость оптической плотности, титра мевалоновой кислоты и удельной производительности 15 л биореактора, в который подавали глюкозу, от времени.
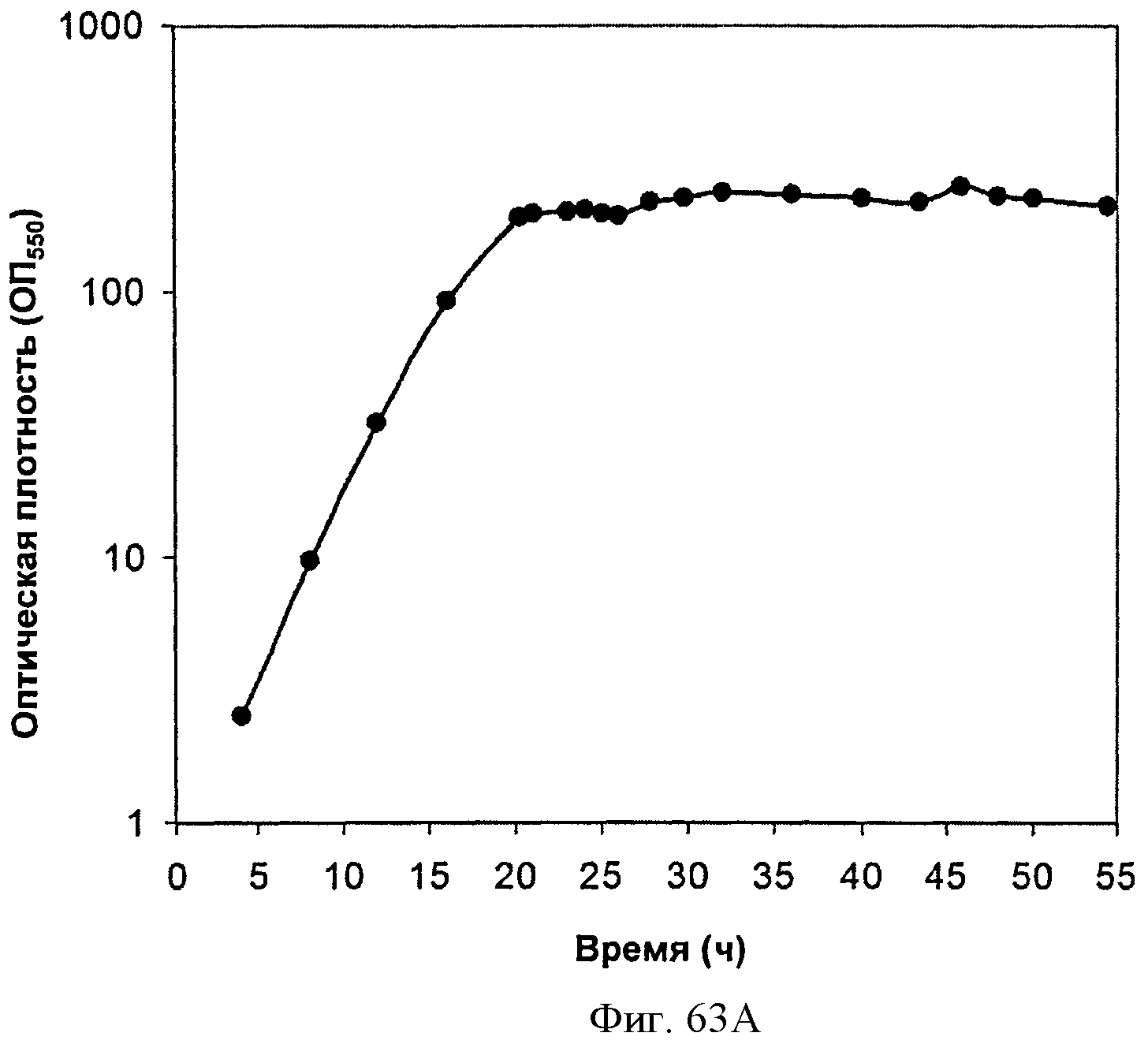
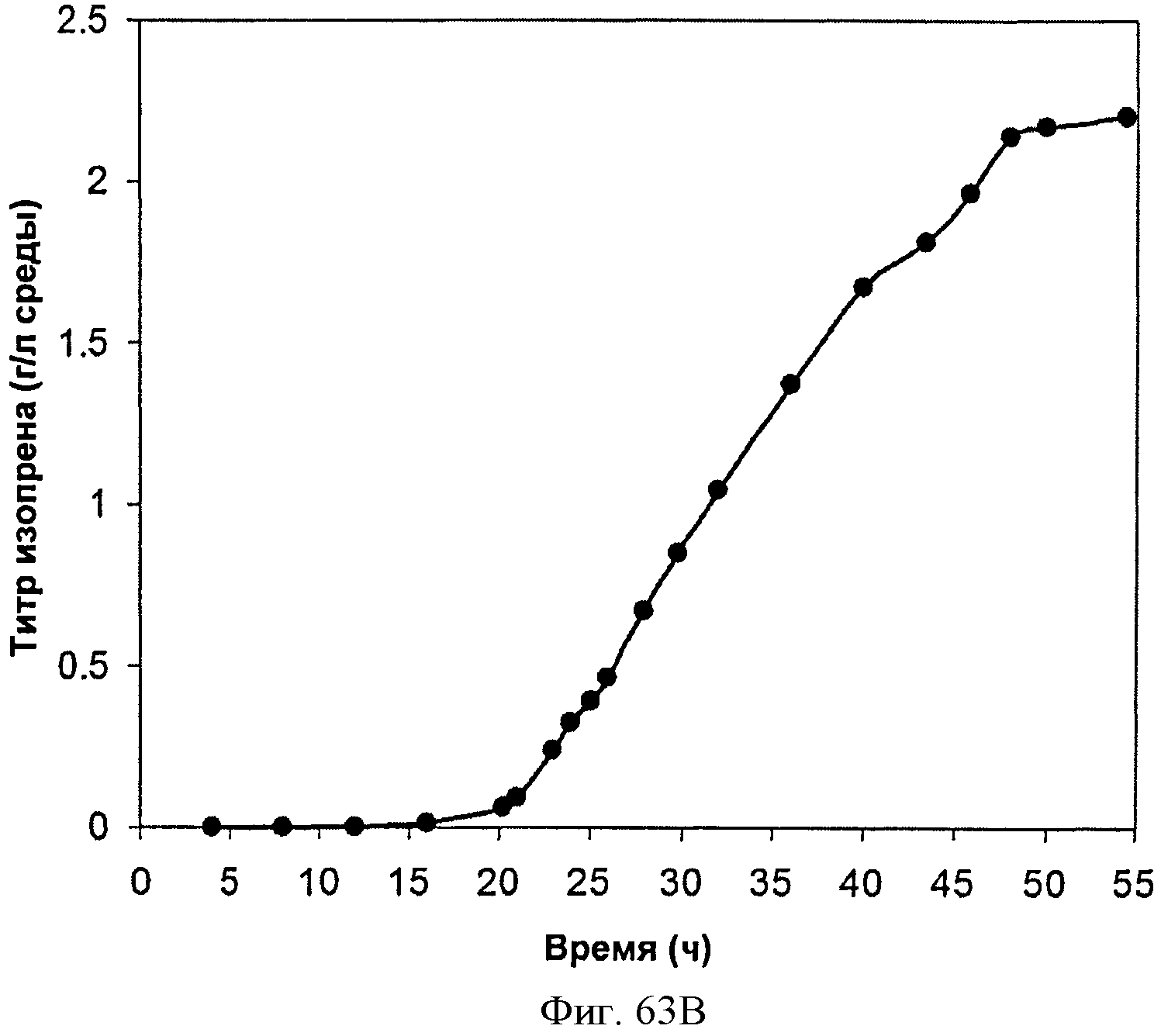
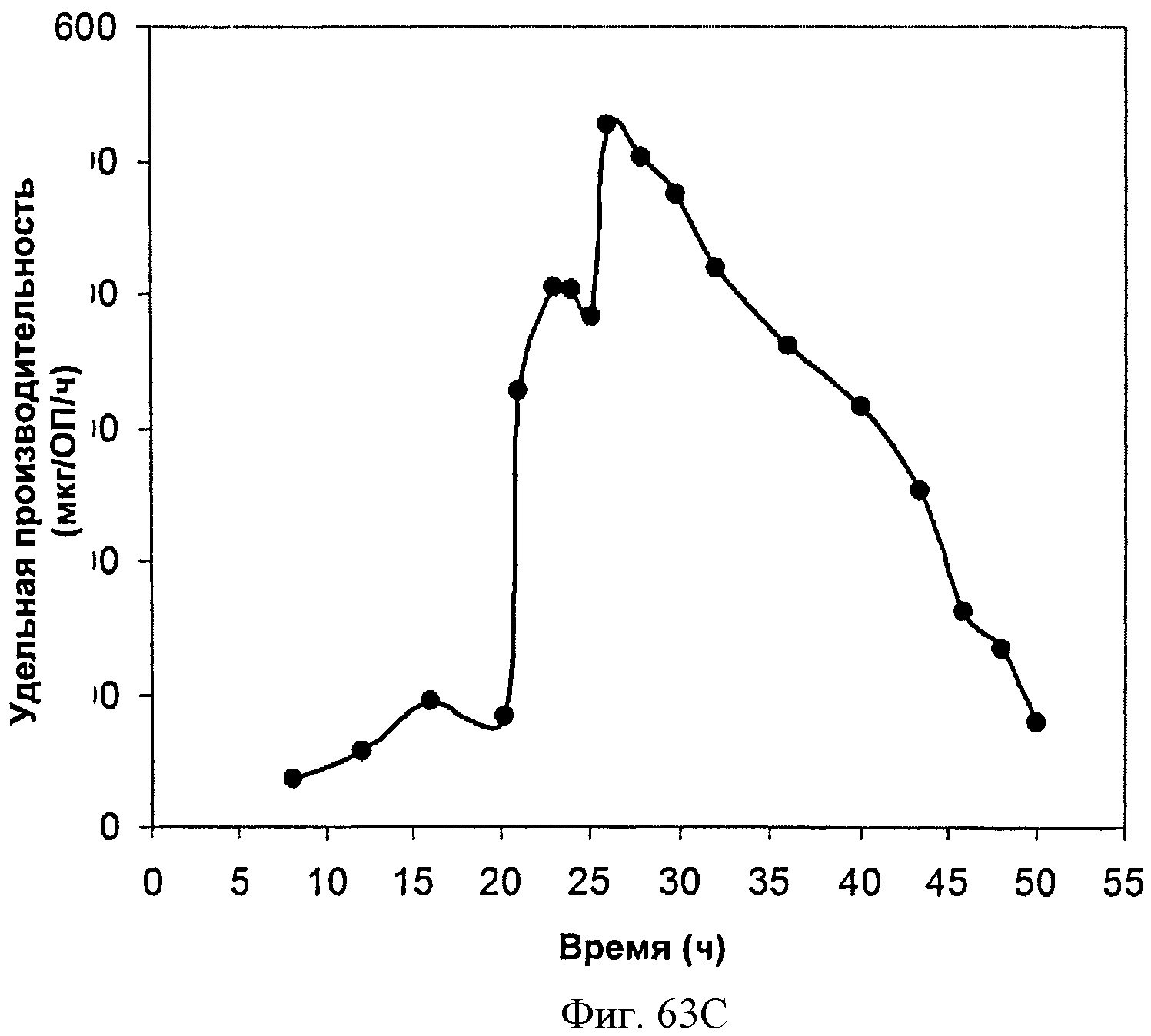
[0114] Фигура 63А-63С представлена зависимость оптической плотности, титра изопрена и удельной производительности 15 л биореактора, в который подавали глюкозу, от времени.
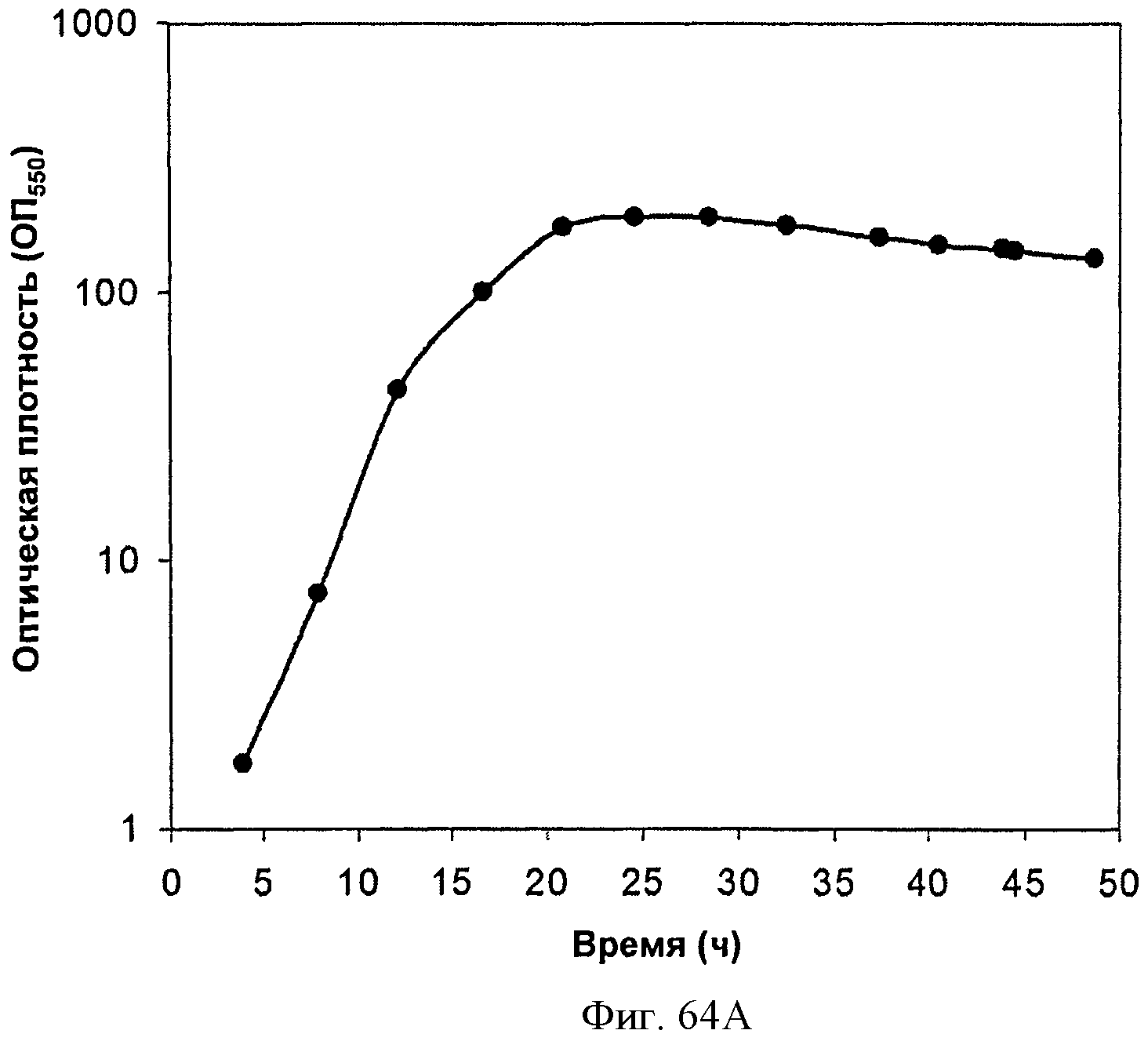
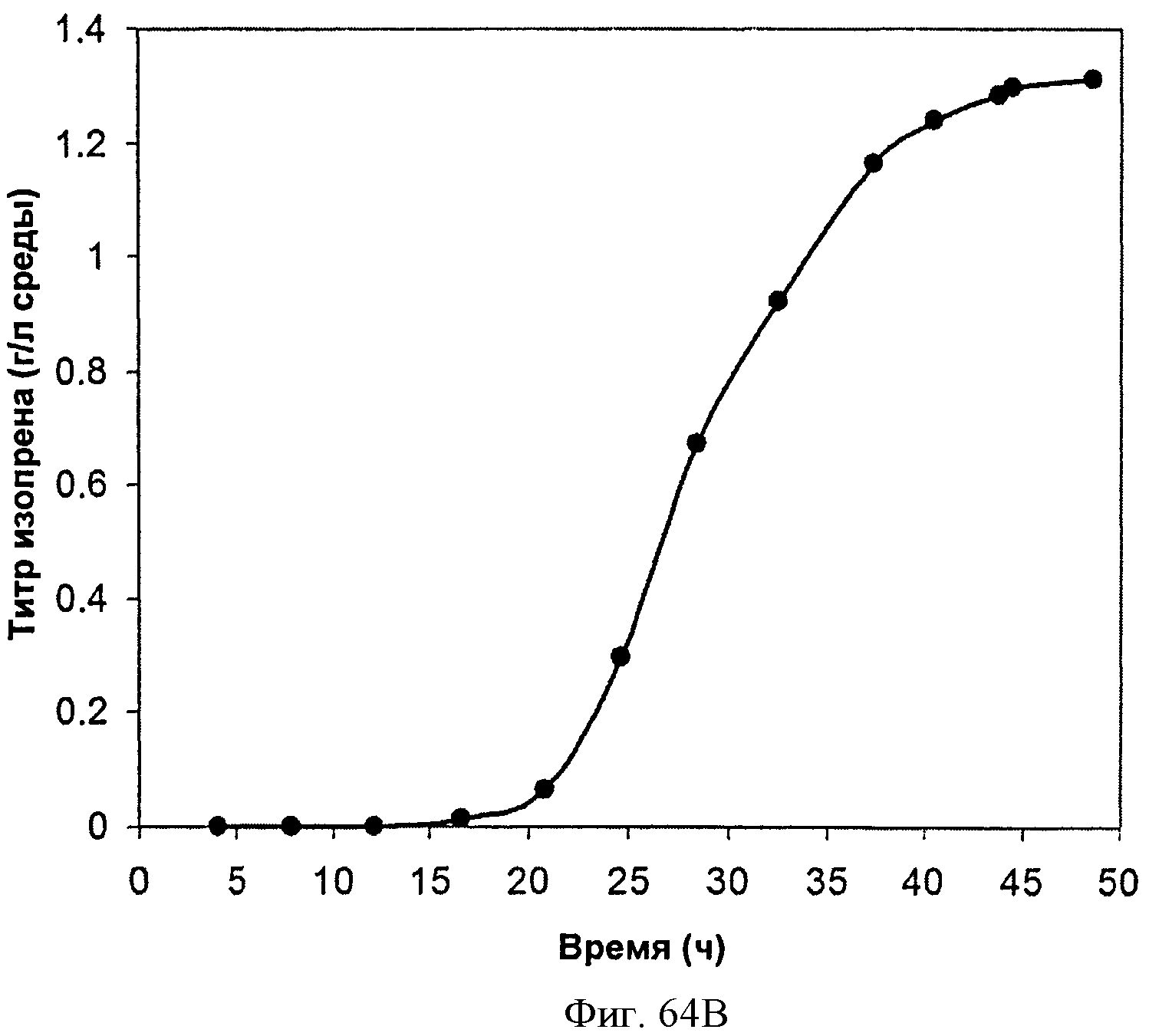
[0115] На Фигурах 64А-64С представлена зависимость оптической плотности, титра изопрена и удельной производительности 15 л биореактора, в который подавали глюкозу, от времени.
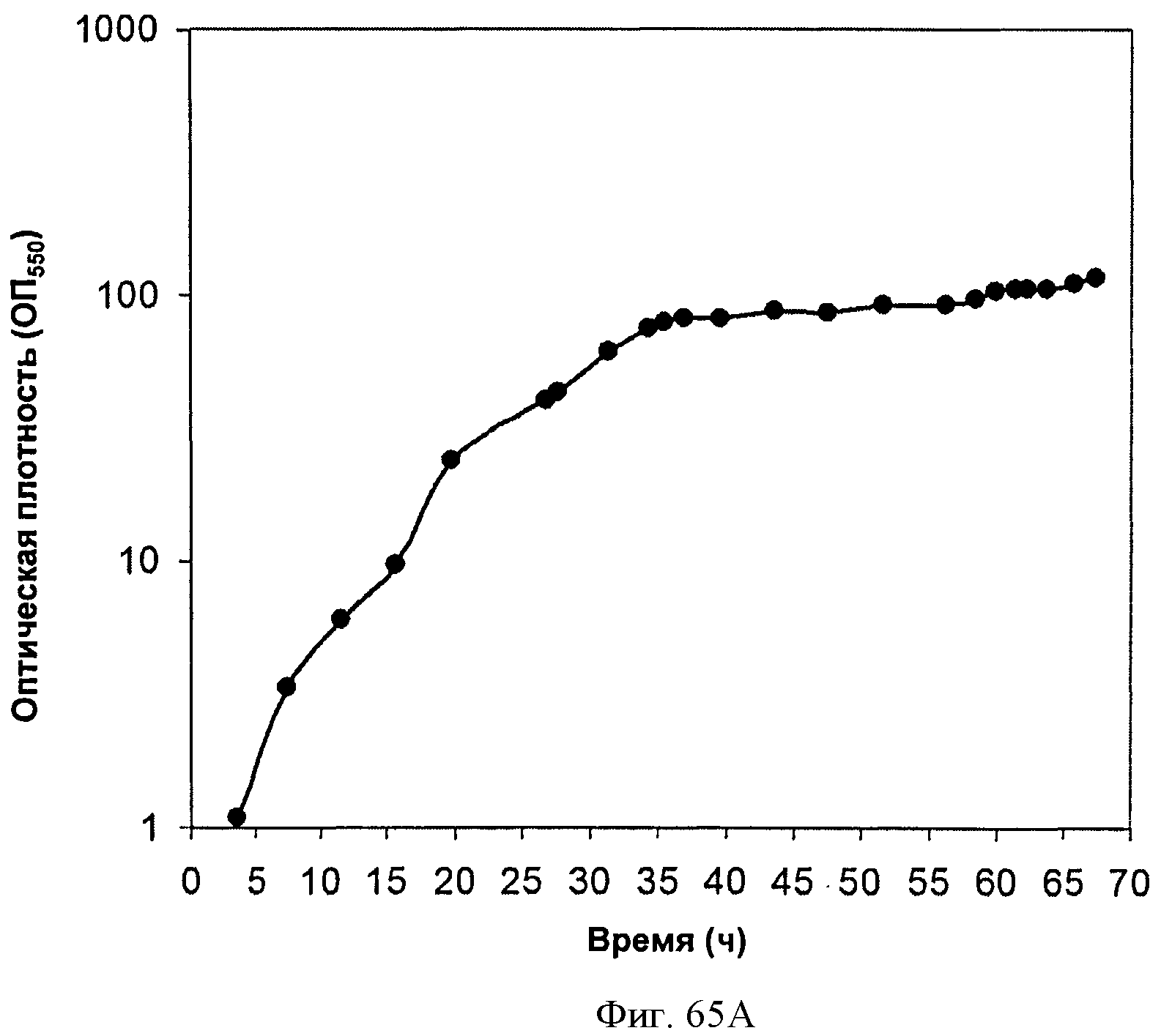
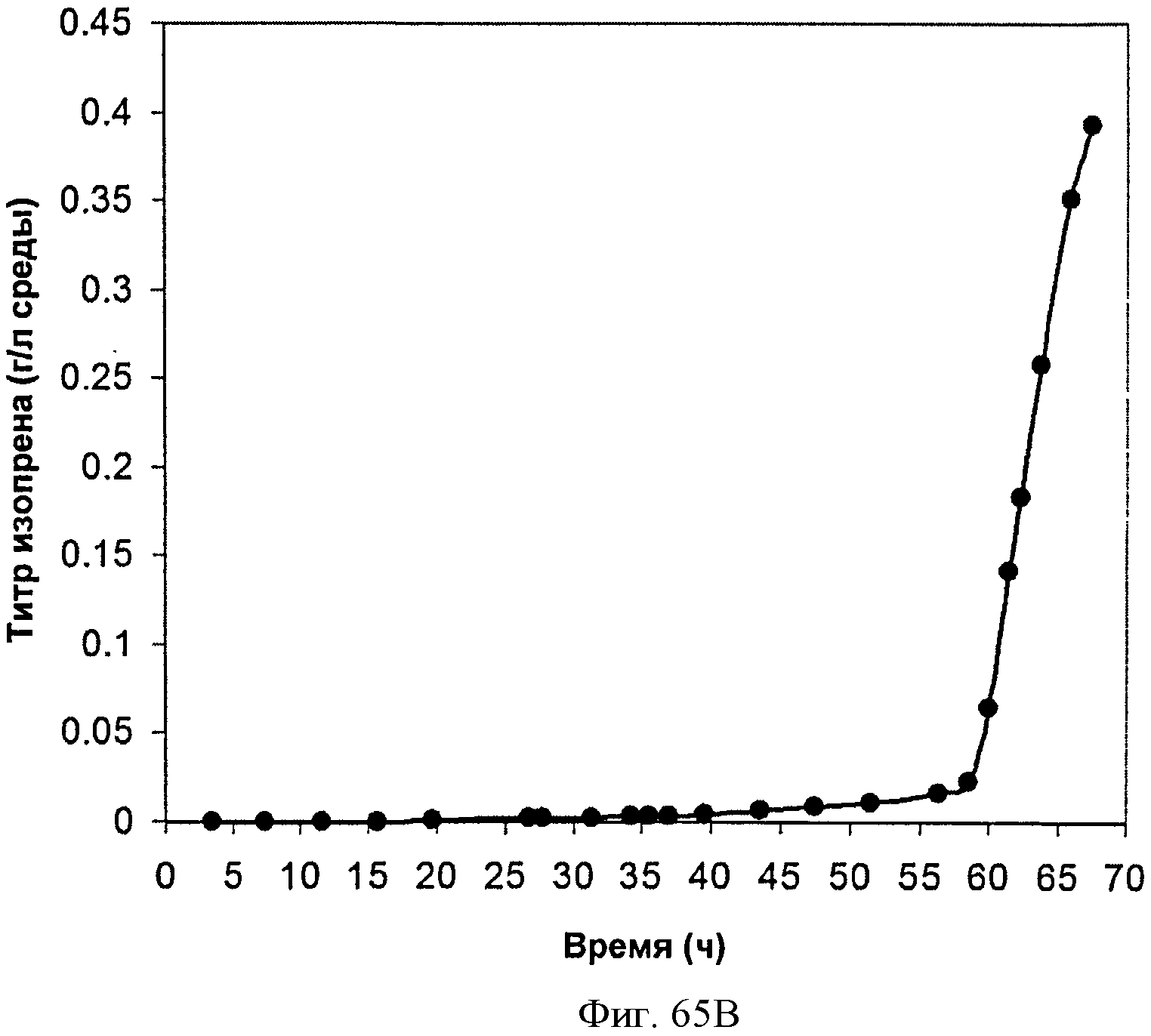
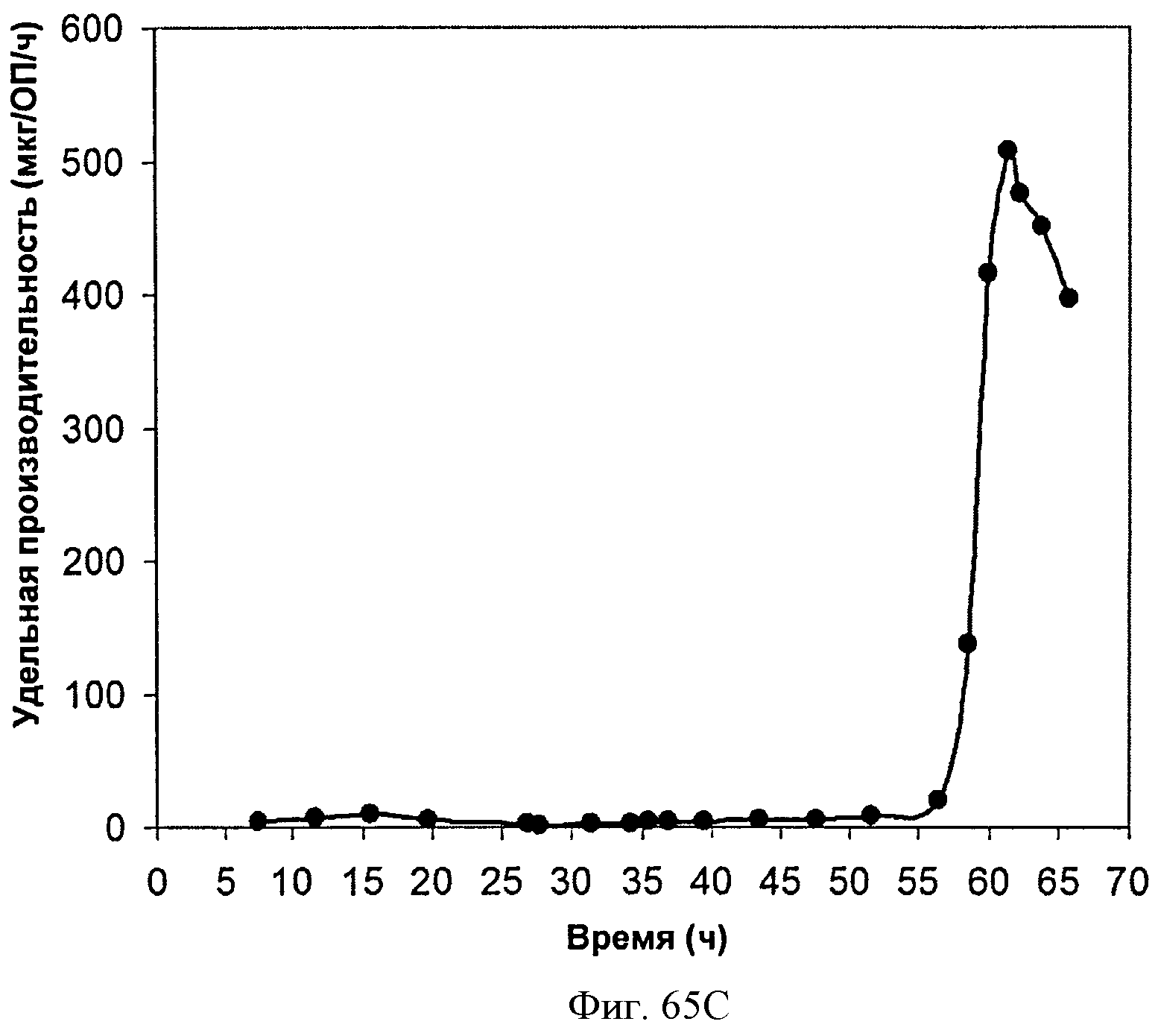
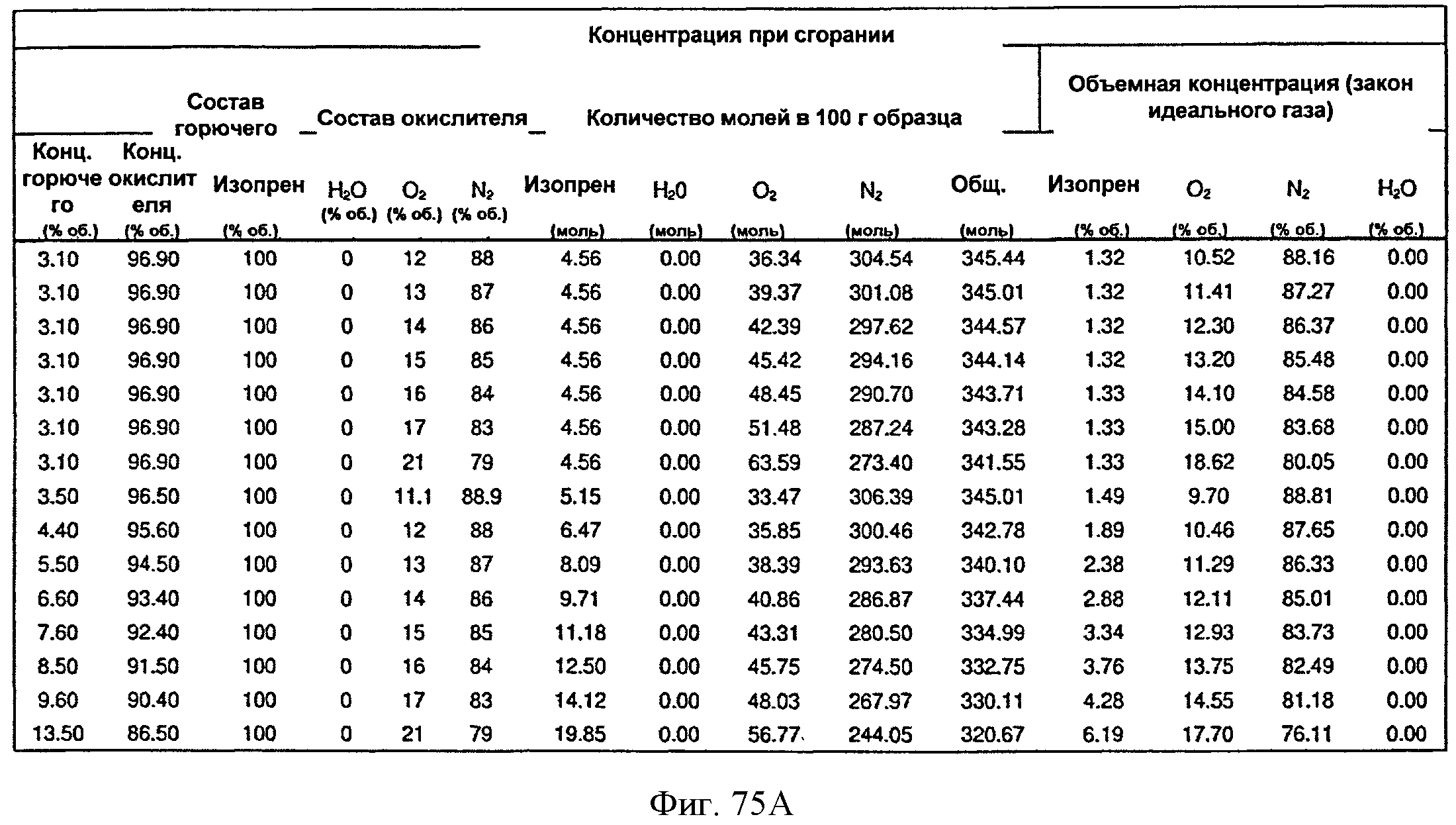
[0116] На Фигурах 65А-65С представлена зависимость оптической плотности, титра изопрена и удельной производительности 15 л биореактора, в который подавали глюкозу, от времени.
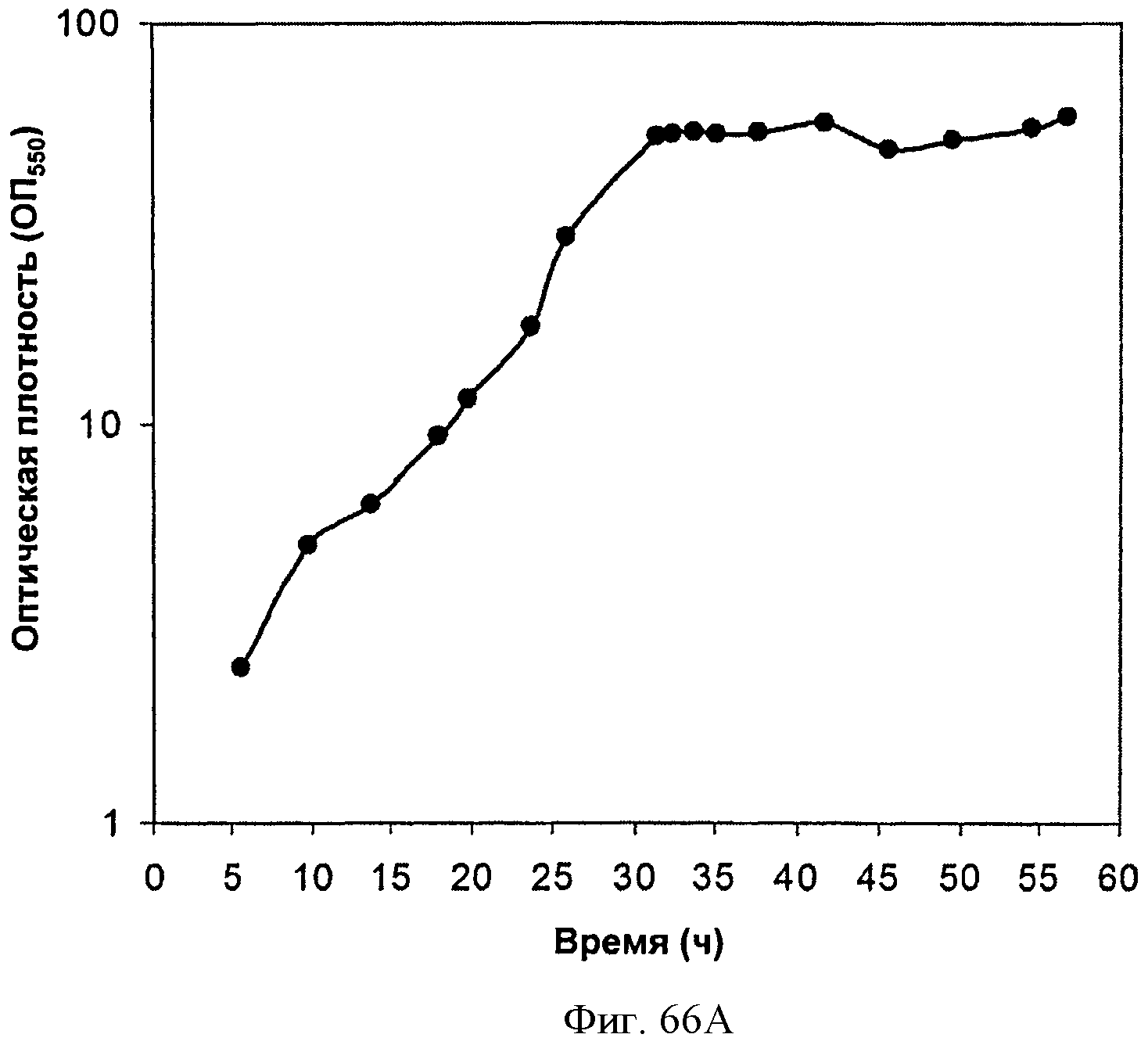
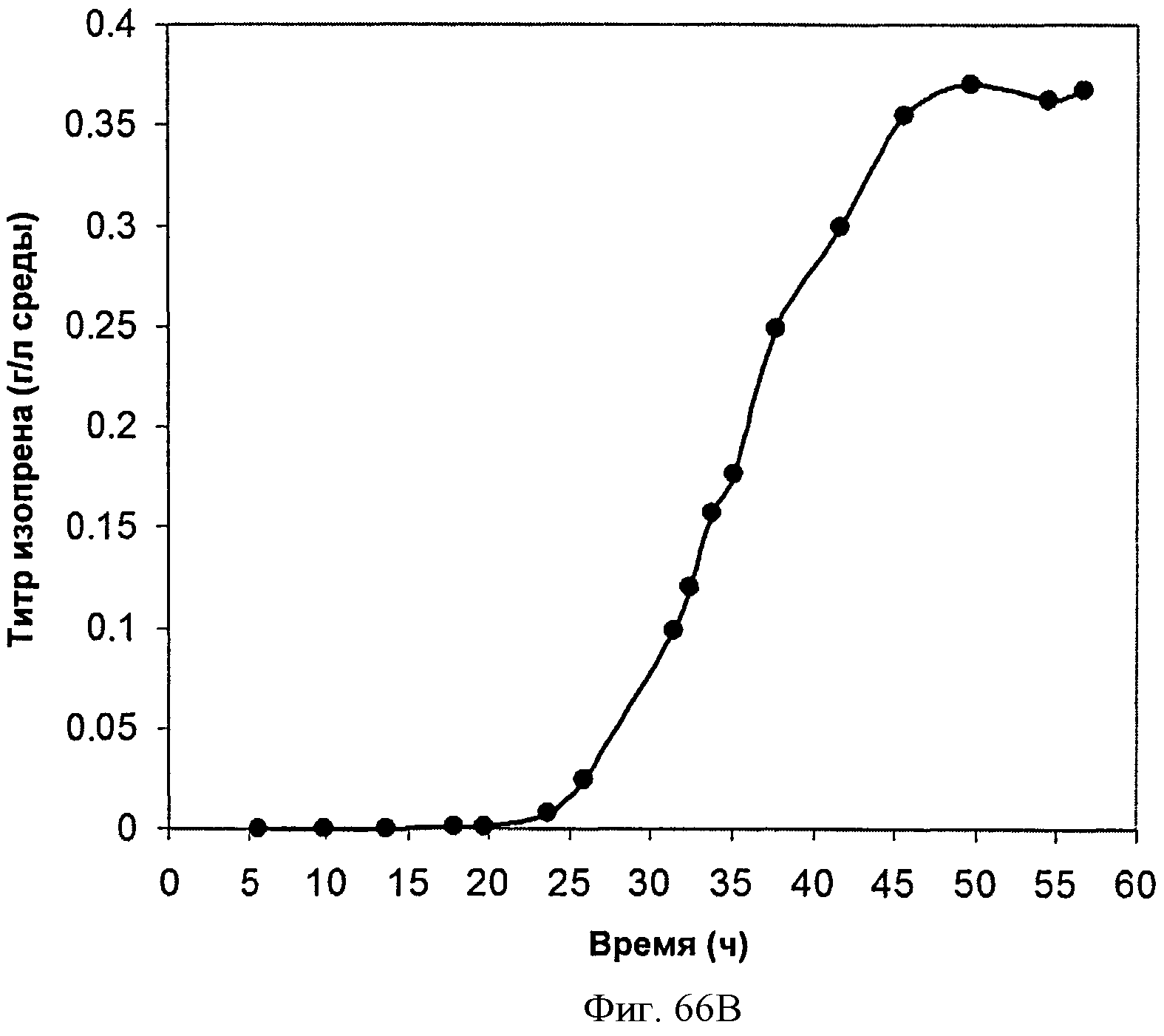
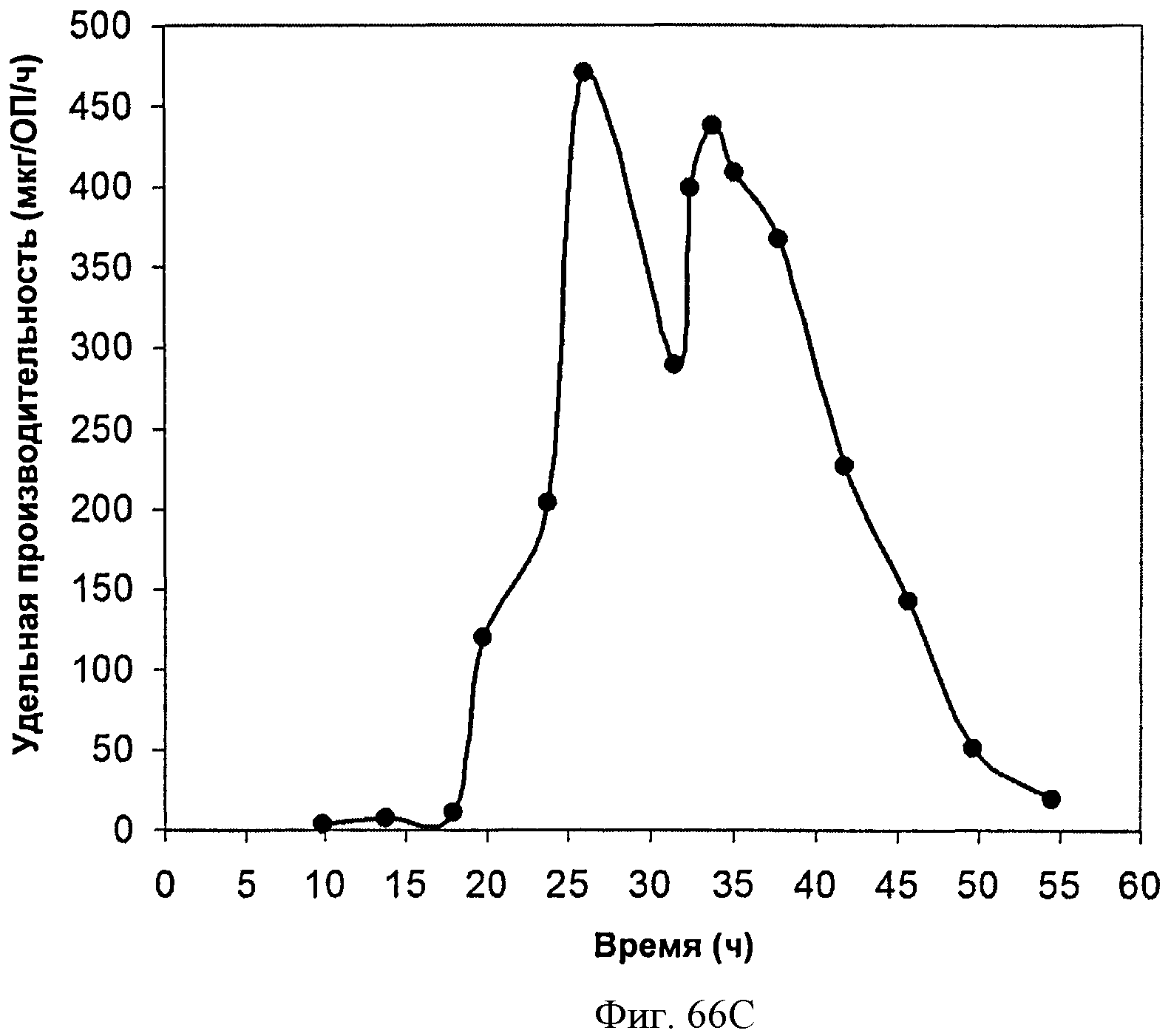
[0117] На Фигурах 66А-66С представлена зависимость оптической плотности, титра изопрена и удельной производительности 15 л биореактора, в который подавали глюкозу, от времени.
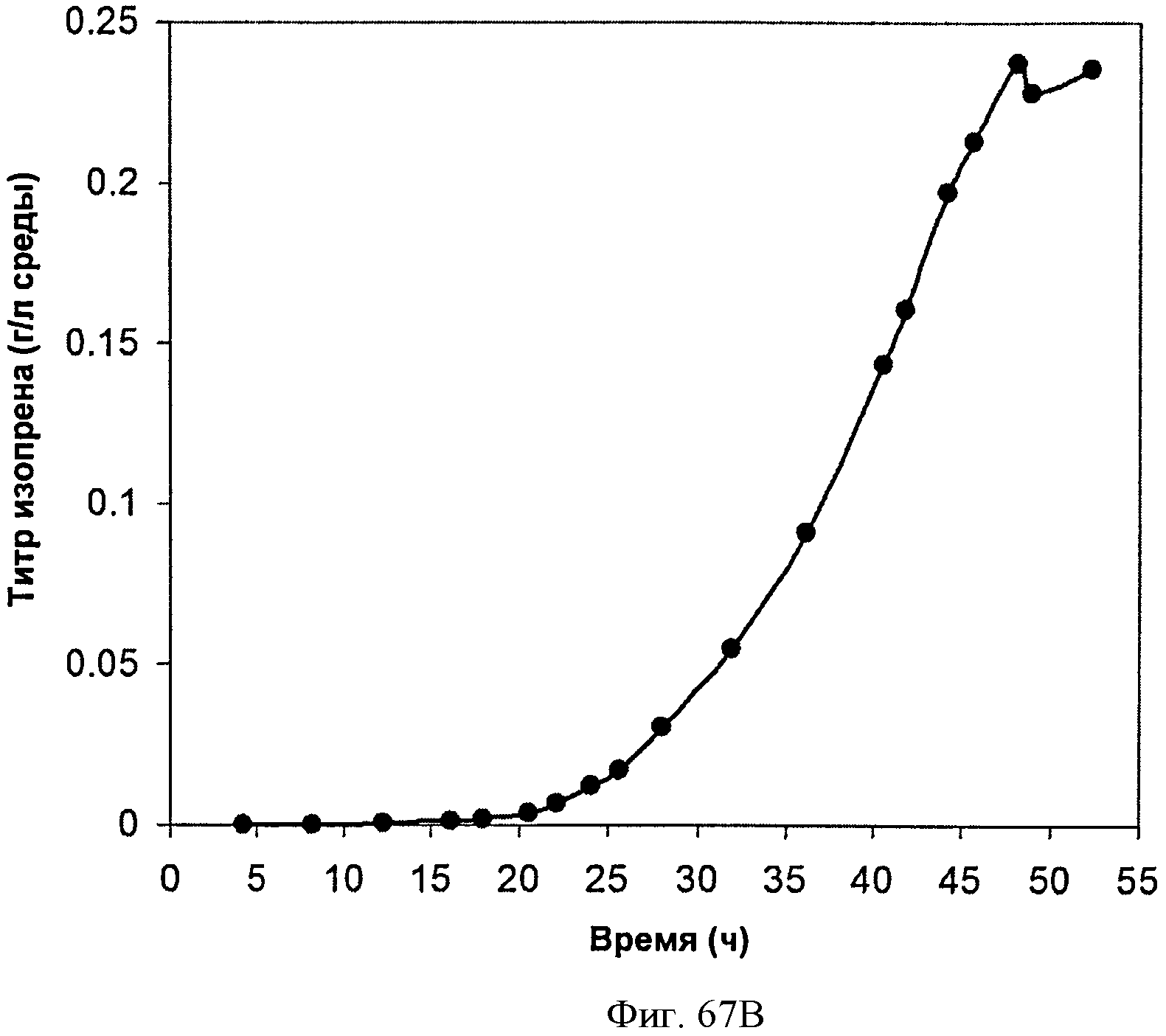
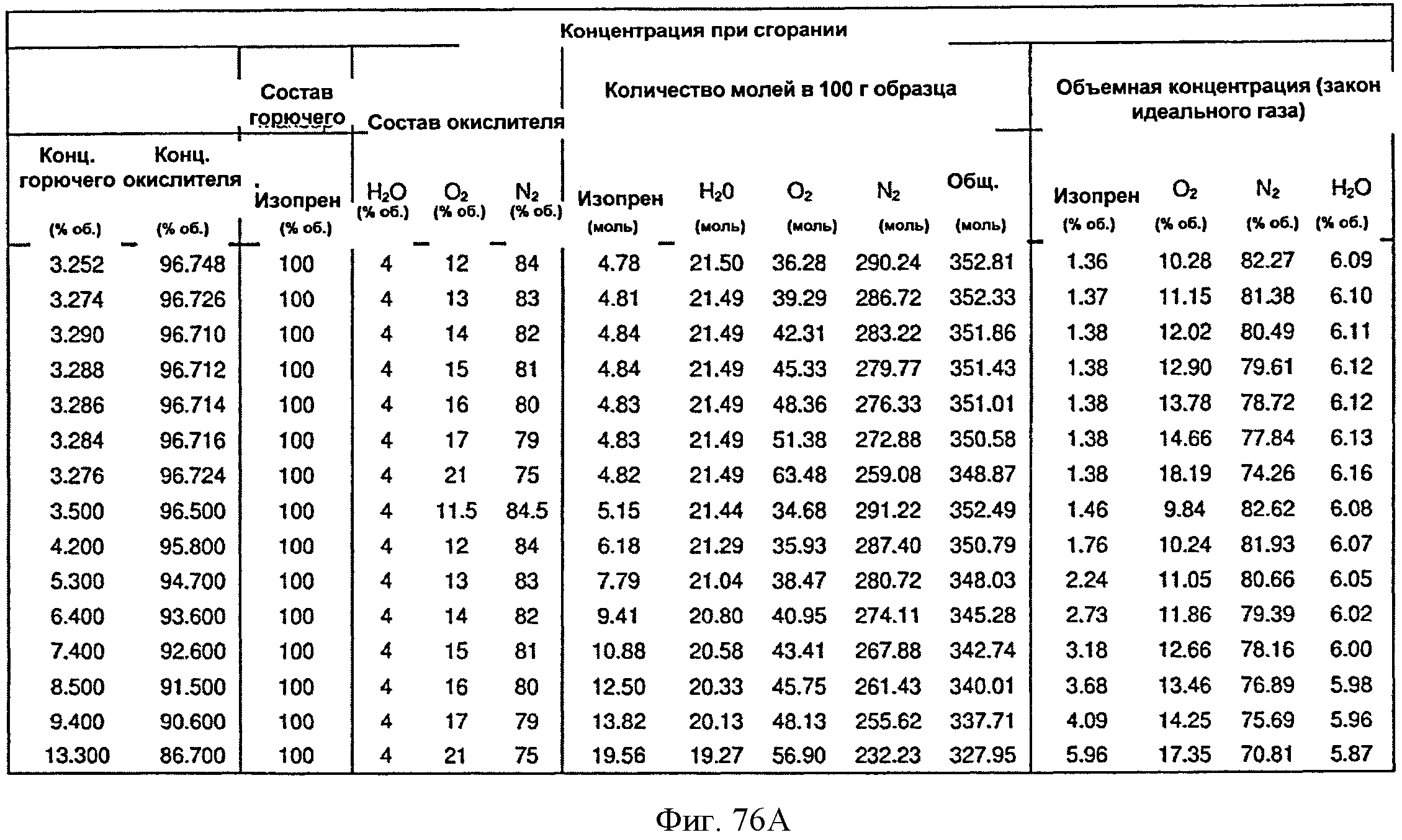
[0118] На Фигурах 67А-67С представлена зависимость оптической плотности, титра изопрена и удельной производительности 15 л биореактора, в который подавали глюкозу, от времени.
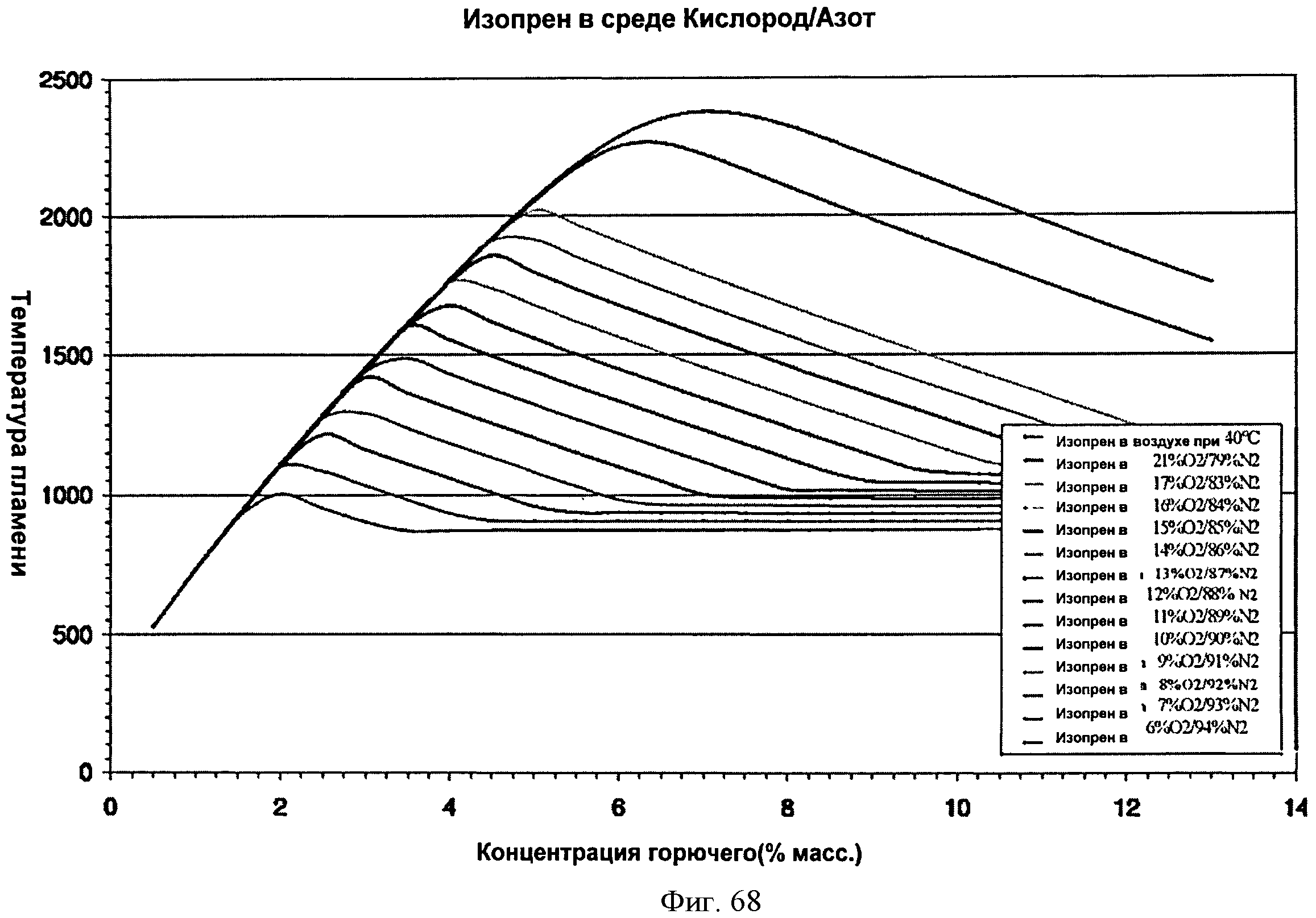
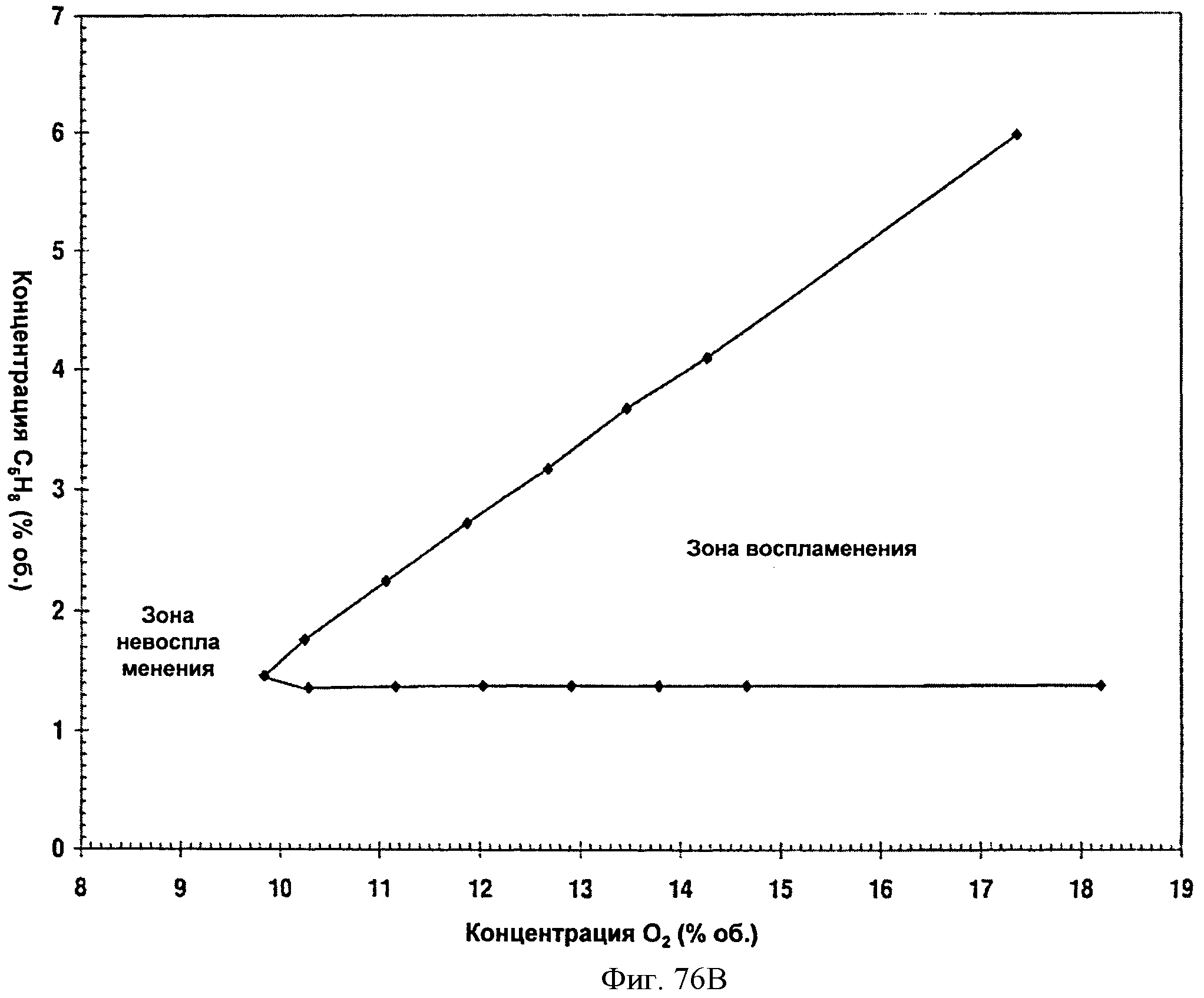
[0119] Фигура 68 представляет собой график рассчитанных адиабатических температур пламени для Партии А как функции концентрации топлива для различных уровней кислорода. На подписи к фигуре перечислены кривые в том порядке, в котором они появляются на графике. Например, первая строка на подписи к фигуре (изопрен в воздухе при 40°С) соответствует верхней кривой на графике.
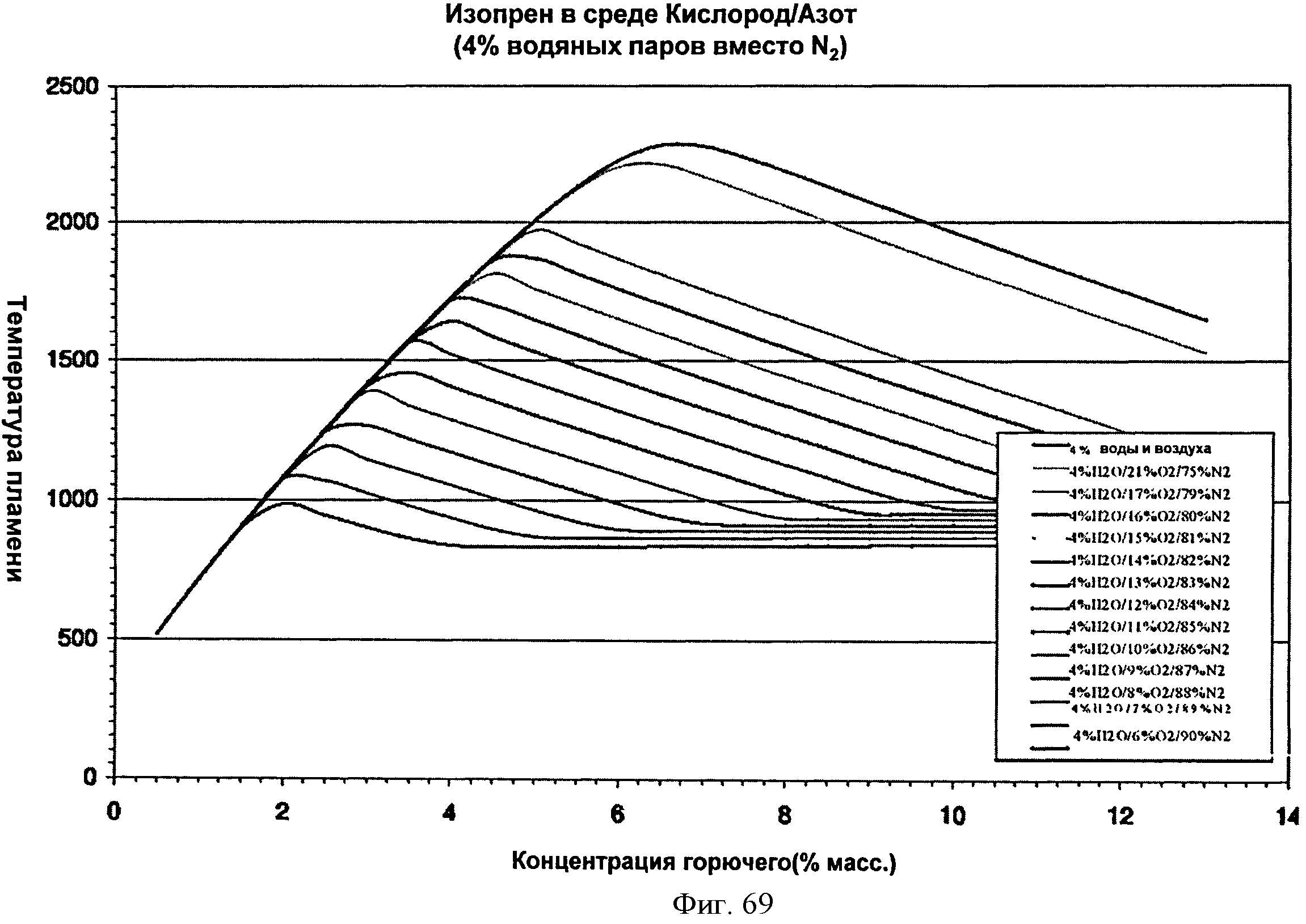
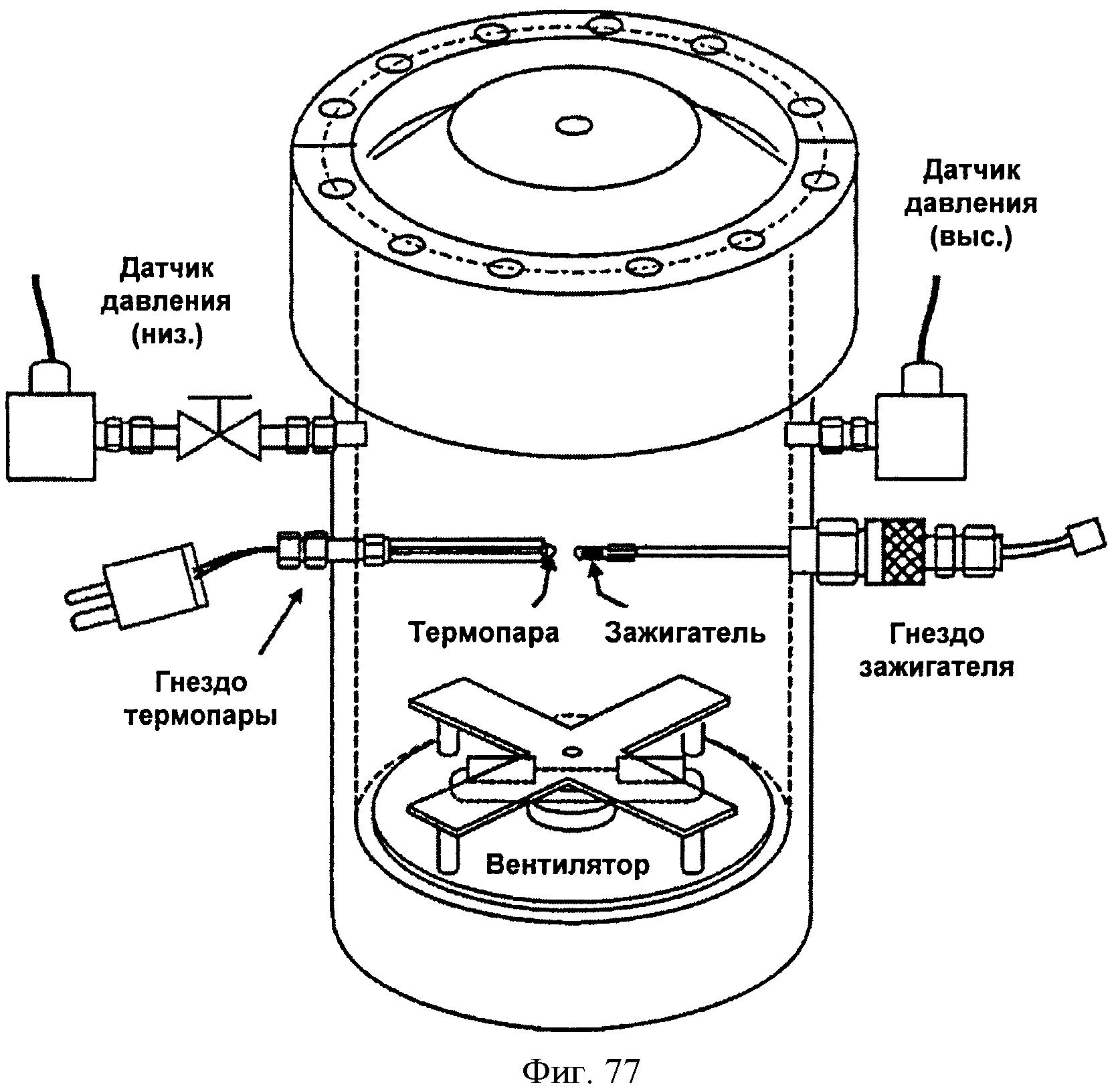
[0120] Фигура 69 представляет собой график рассчитанных адиабатических температур пламени для Партии В как функции концентрации топлива для различных уровней кислорода при 4% воды. На подписи к фигуре перечислены кривые в том порядке, в котором они появляются на графике.
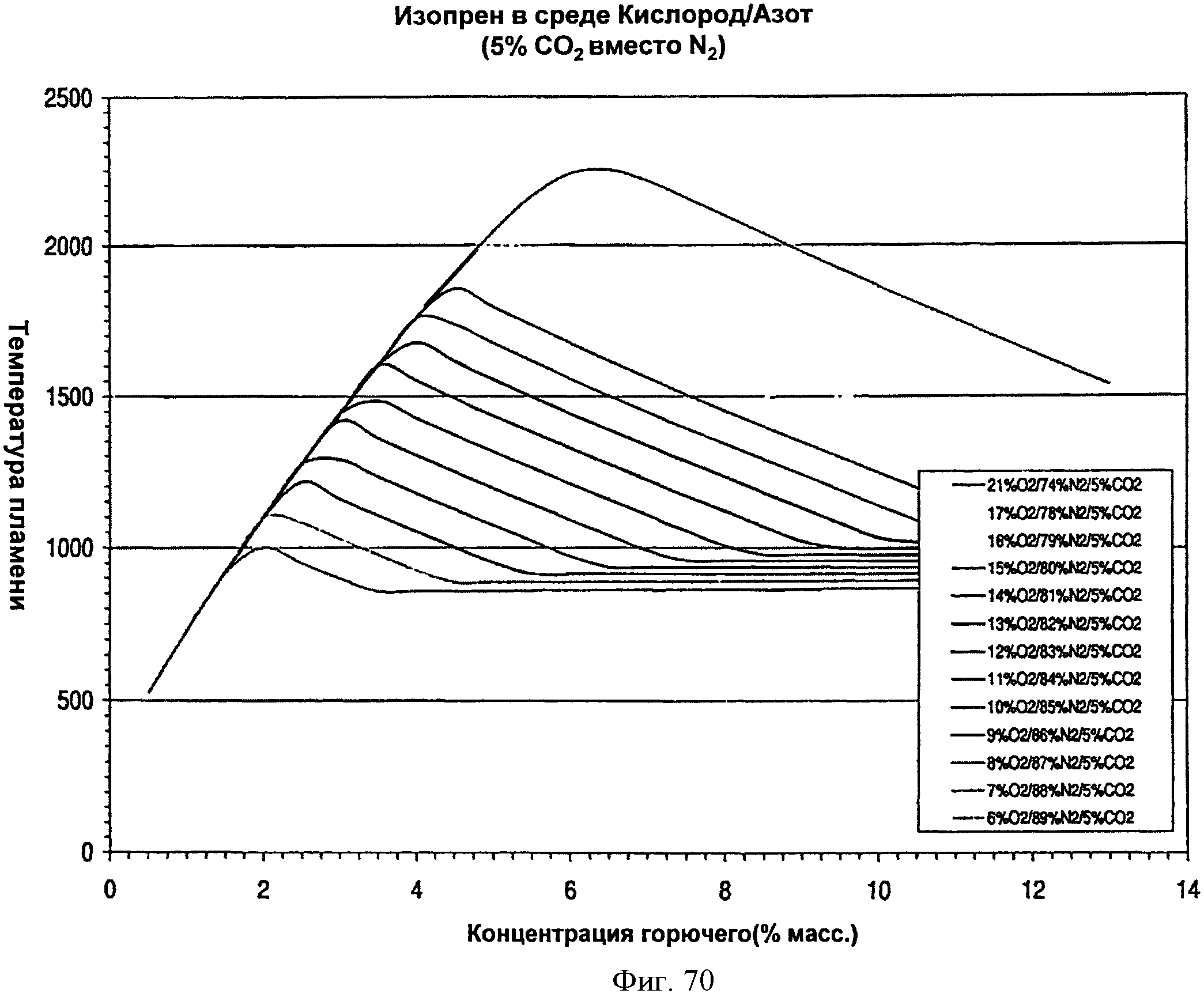
[0121] Фигура 70 представляет собой график рассчитанных адиабатических температур пламени для Партии С как функции концентрации топлива для различных уровней кислорода при 5% CO2. На подписи к фигуре перечислены кривые в том порядке, в котором они появляются на графике.
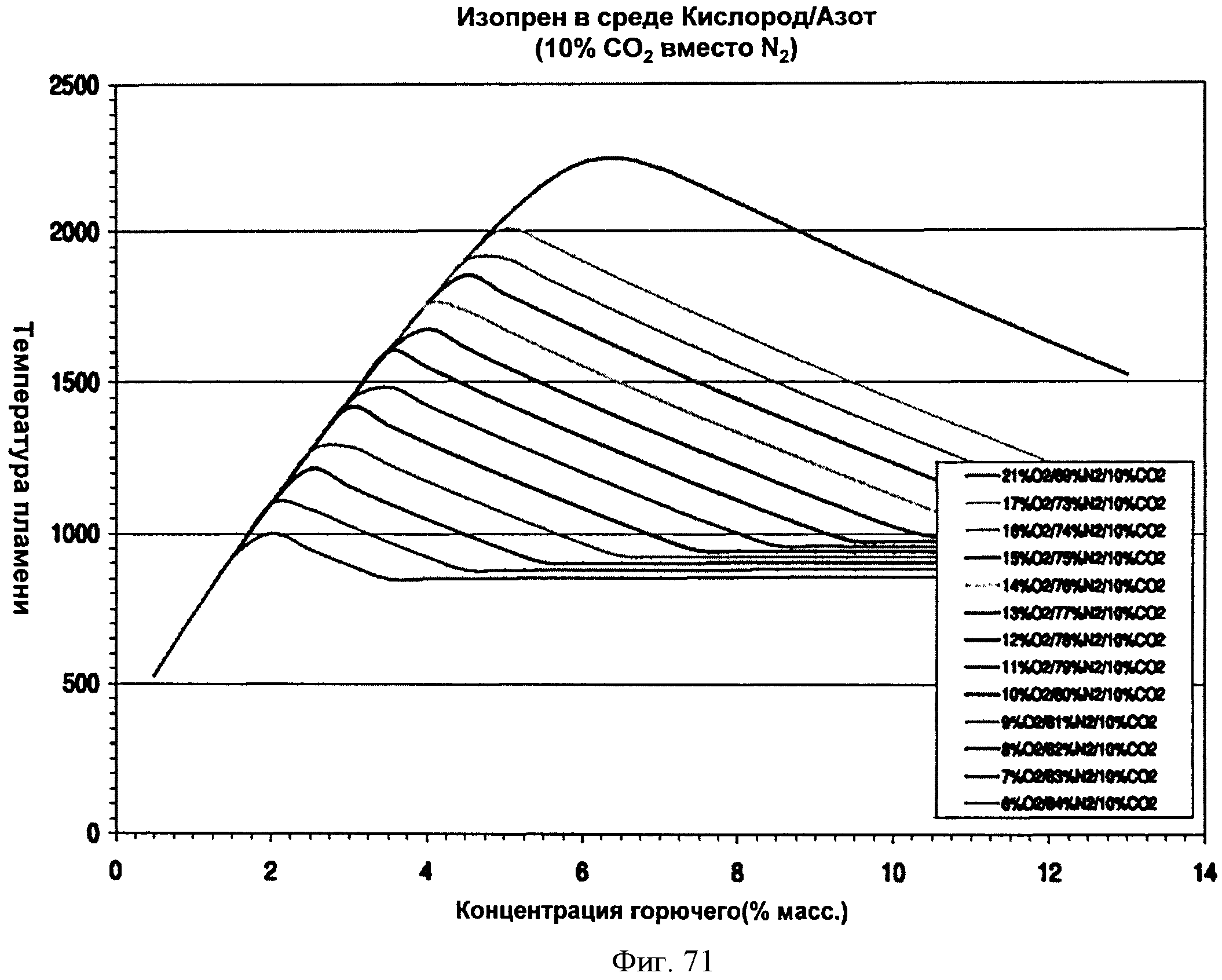
[0122] Фигура 71 представляет собой график рассчитанных адиабатических температур пламени для Партии D как функции концентрации топлива для различных уровней кислорода при 10% СО2. На подписи к фигуре перечислены кривые в том порядке, в котором они появляются на графике.
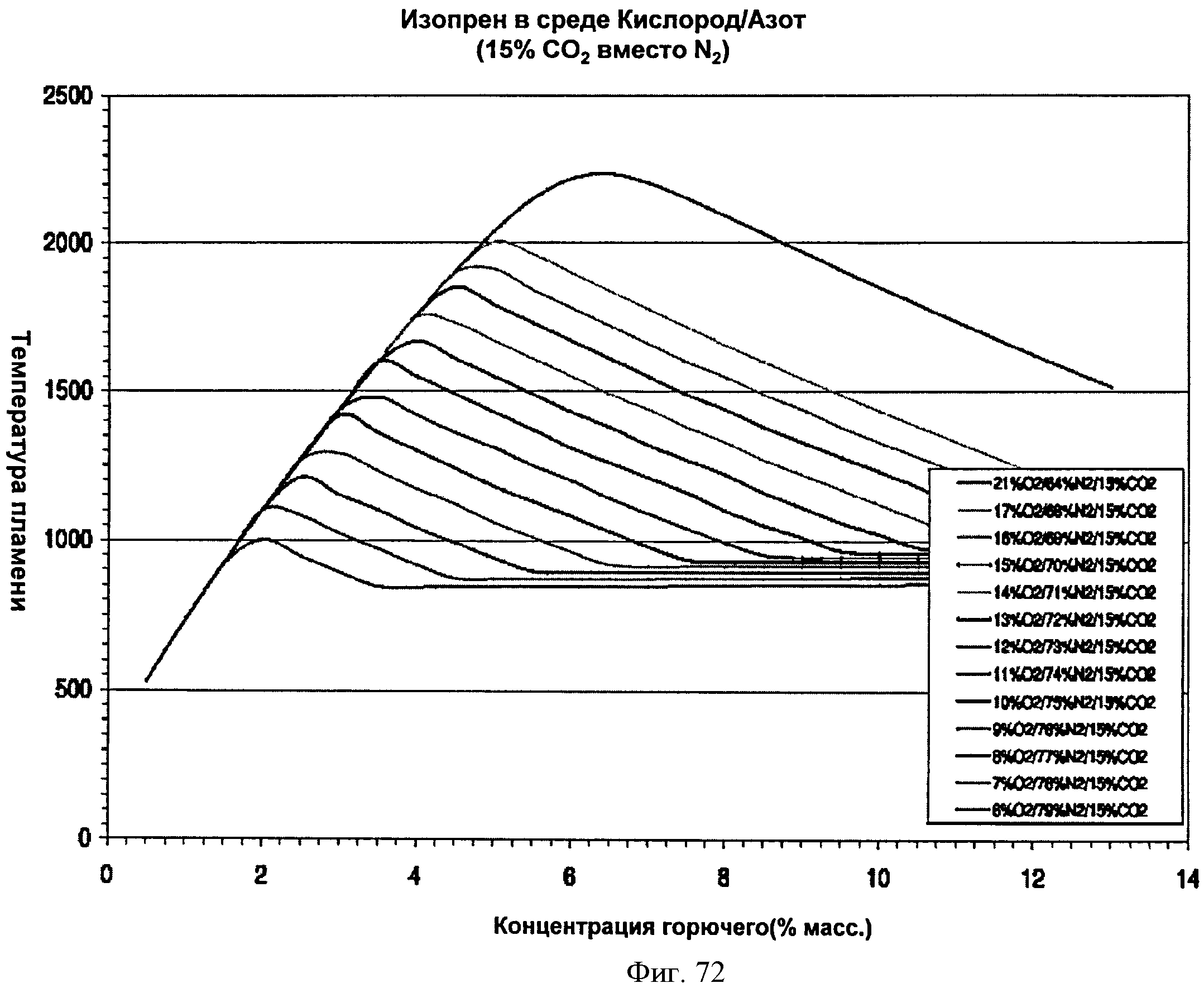
[0123] Фигура 72 представляет собой график рассчитанных адиабатических температур пламени для Партии Е как функции концентрации топлива для различных уровней кислорода при 15% СО2. На подписи к фигуре перечислены кривые в том порядке, в котором они появляются на графике.
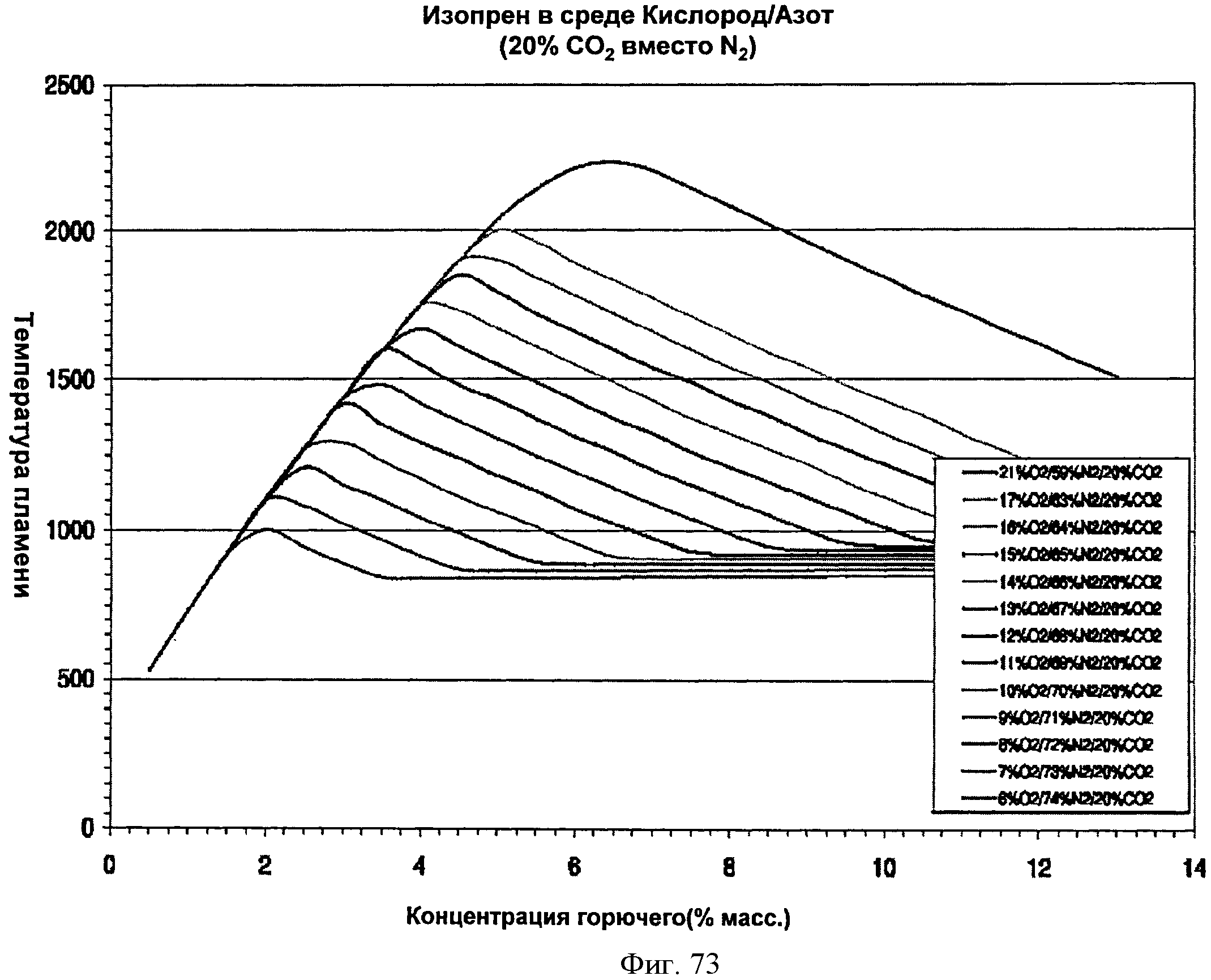
[0124] Фигура 73 представляет собой график рассчитанных адиабатических температур пламени для Партии F как функции концентрации топлива для различных уровней кислорода при 20% СО2. На подписи к фигуре перечислены кривые в том порядке, в котором они появляются на графике.
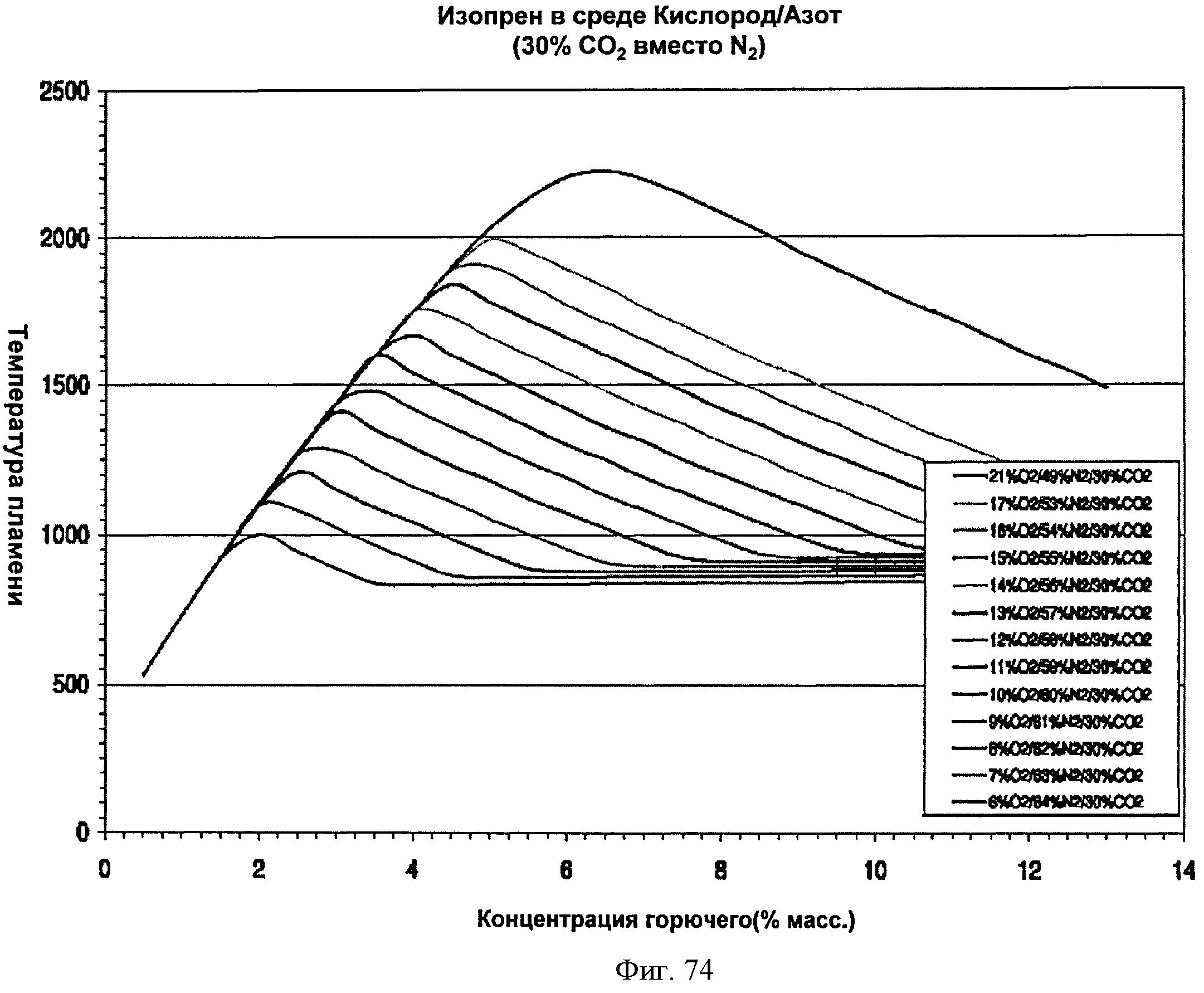
[0125] Фигура 74 представляет собой график рассчитанных адиабатических температур пламени для Партии G как функции концентрации топлива для различных уровней кислорода при 30% СО2. На подписи к фигуре перечислены кривые в том порядке, в котором они появляются на графике.
[0126] Фигура 75А представляет собой таблицу пересчета результатов, полученных с помощью модели CAFT (модели расчета адиабатических температур пламени), из массового процента в объемный процент для Партии А.
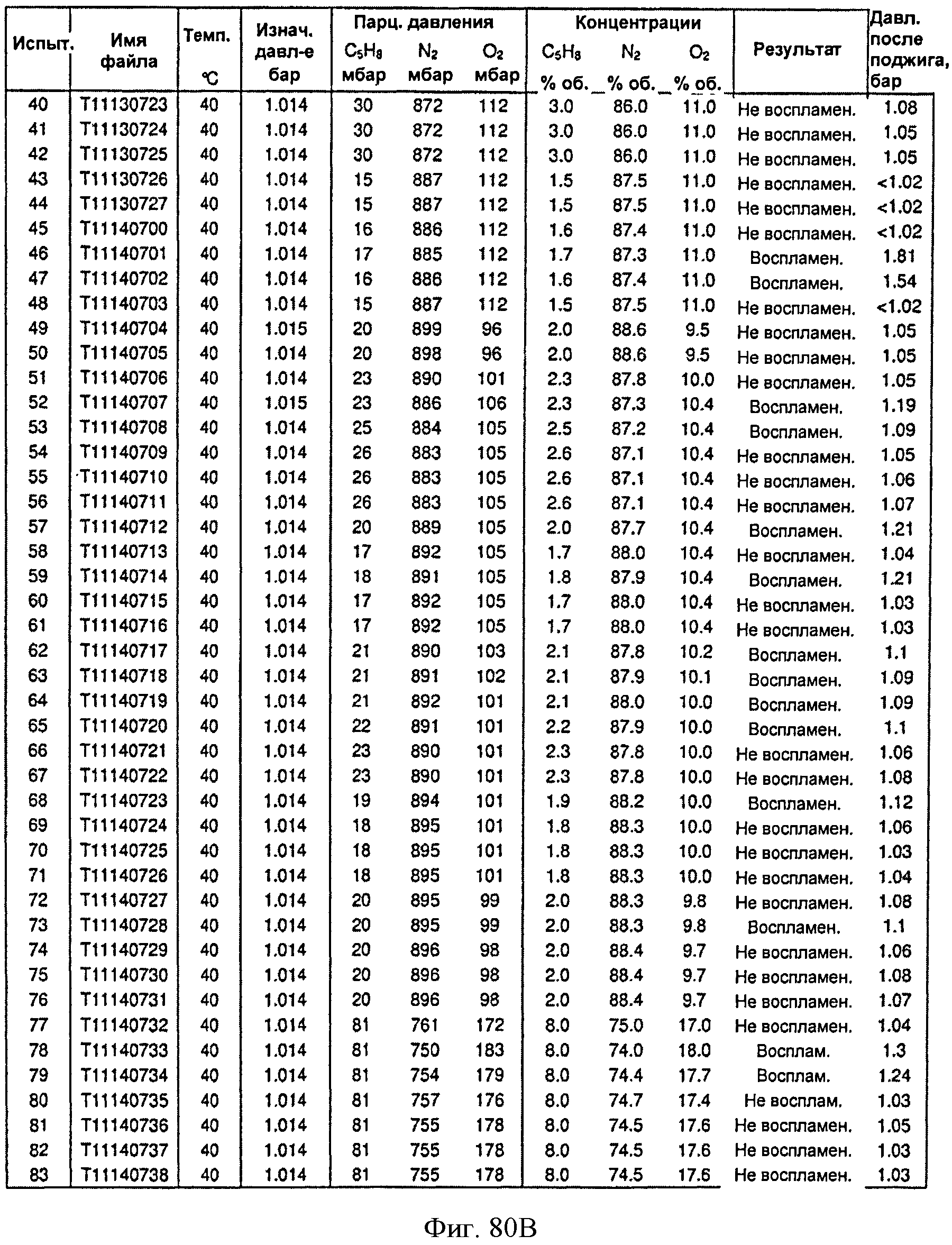
[0127] Фигура 75 В представляет собой график результатов воспламеняемости, полученных с помощью модели CAFT, для Партии А на Фигуре 68, нанесенных на график в виде объемных процентов.
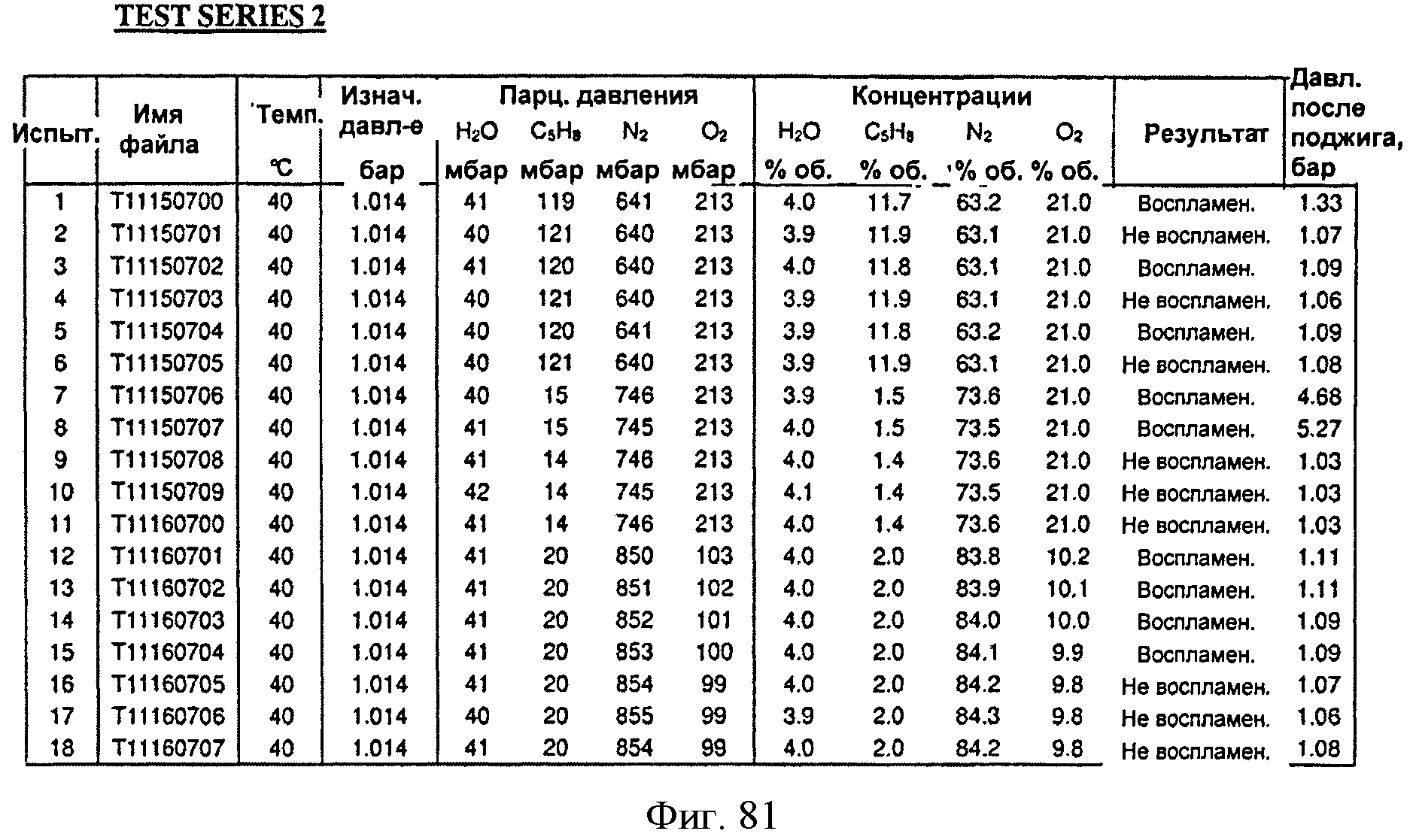
[0128] Фигура 76А представляет собой таблицу пересчета результатов, полученных с помощью модели CAFT, из массового процента в объемный процент для Партии В.
[0129] Фигура 76 В представляет собой график результатов воспламеняемости, полученных с помощью модели CAFT, для Партии В на Фигуре 69, нанесенных на график в виде объемных процентов.
[0130] Фигура 77 представляет собой чертеж, на котором изображен сосуд для тестирования воспламеняемости.
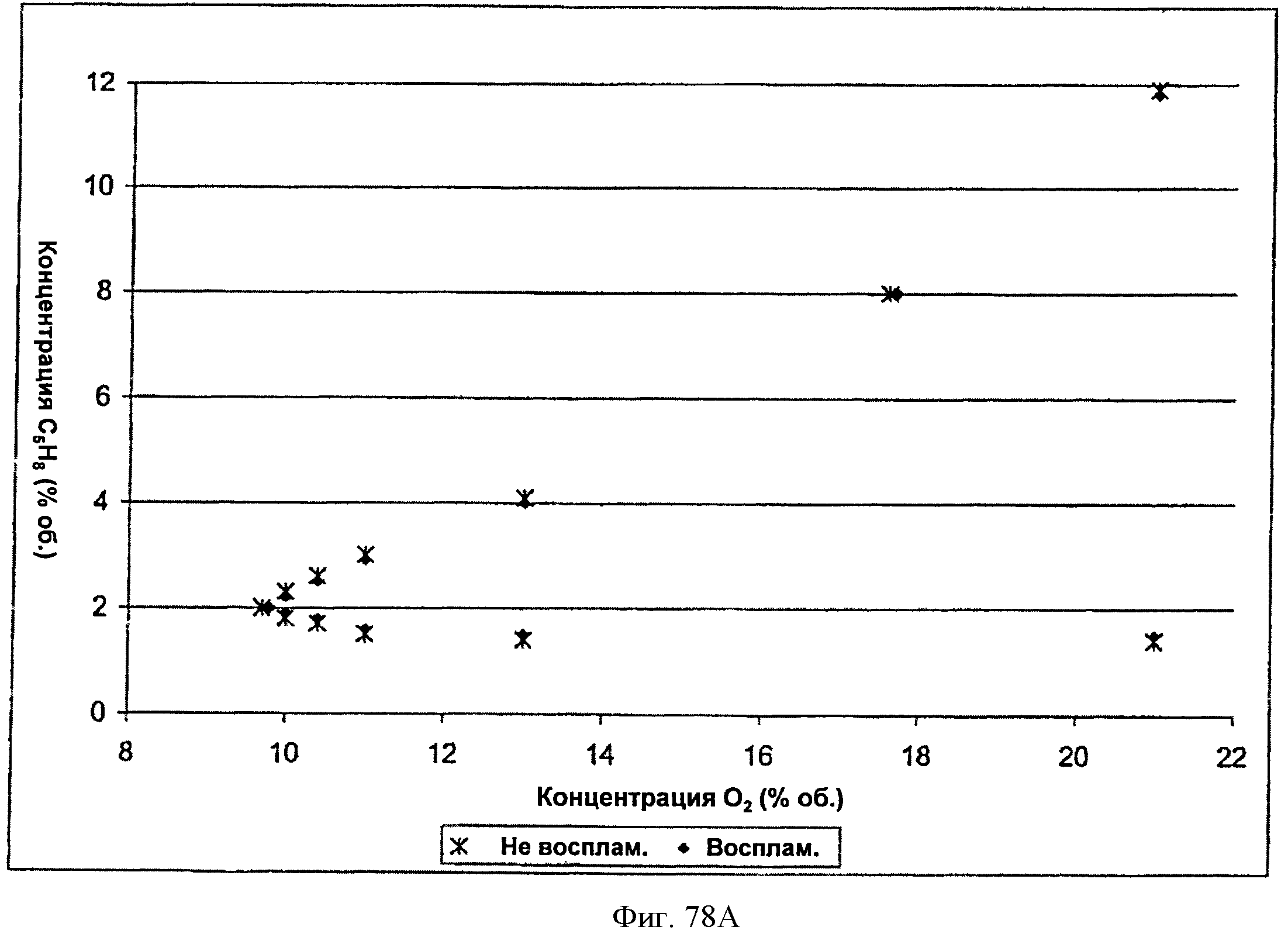
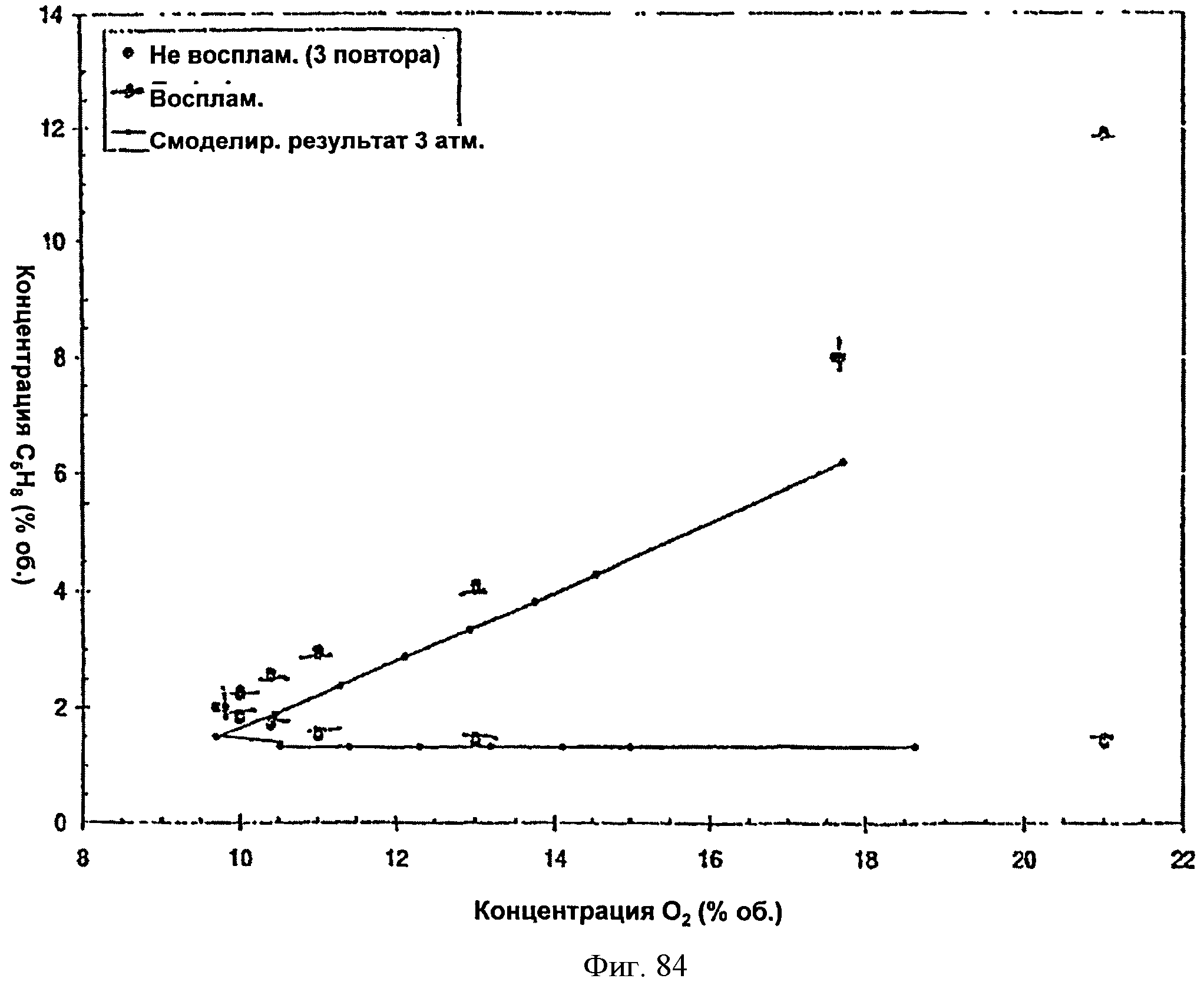
[0131] Фигура 78А представляет собой график кривой воспламеняемости для тестированной Партии 1: 0% пара, 0 фунтов/кв. дюйм изб. (psig) и 40°С.
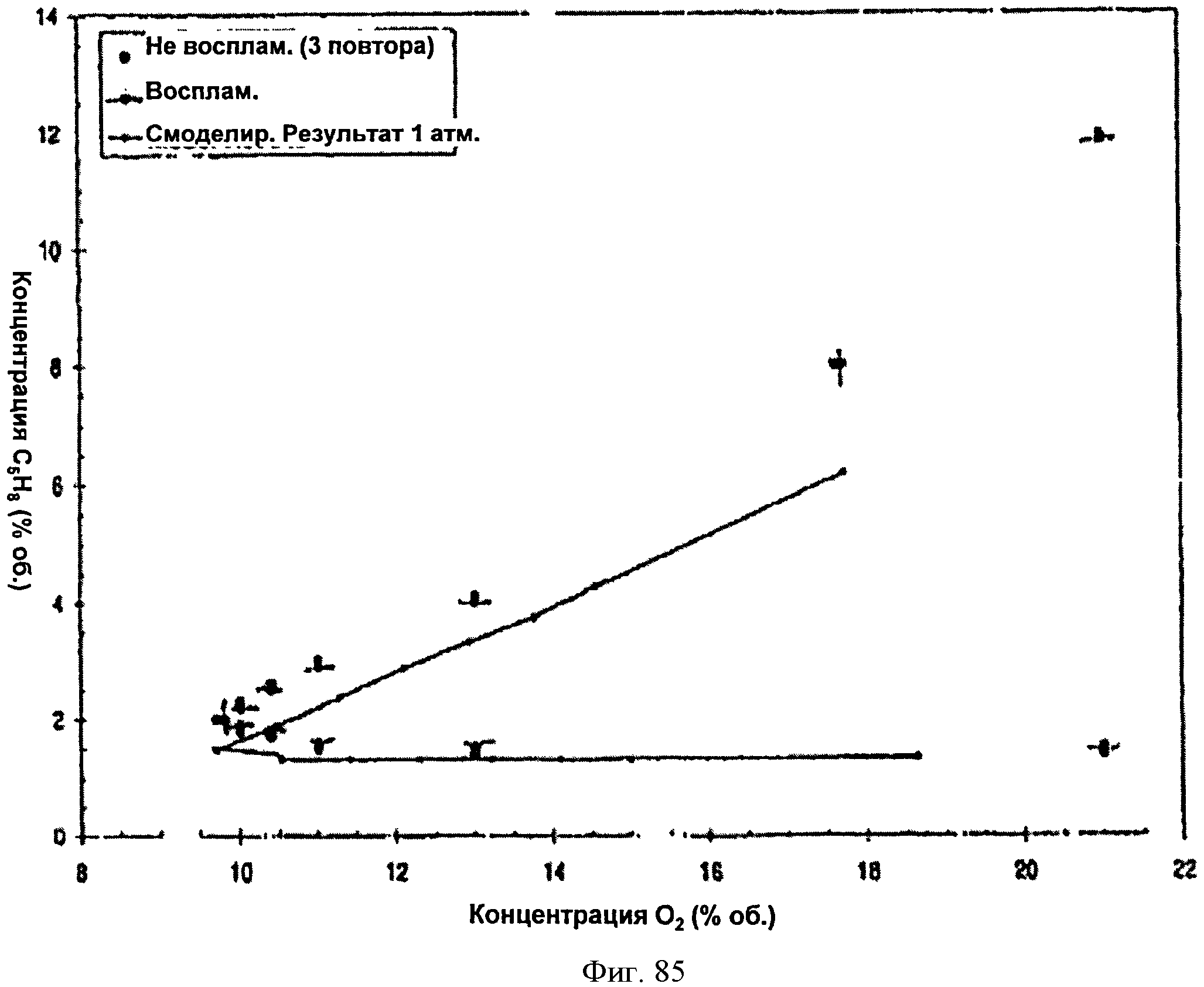
[0132] Фигура 78 В представляет собой таблицу, в которой суммированы экспериментальные точки для взрыва и отсутствия взрыва для тестированной Партии 1.
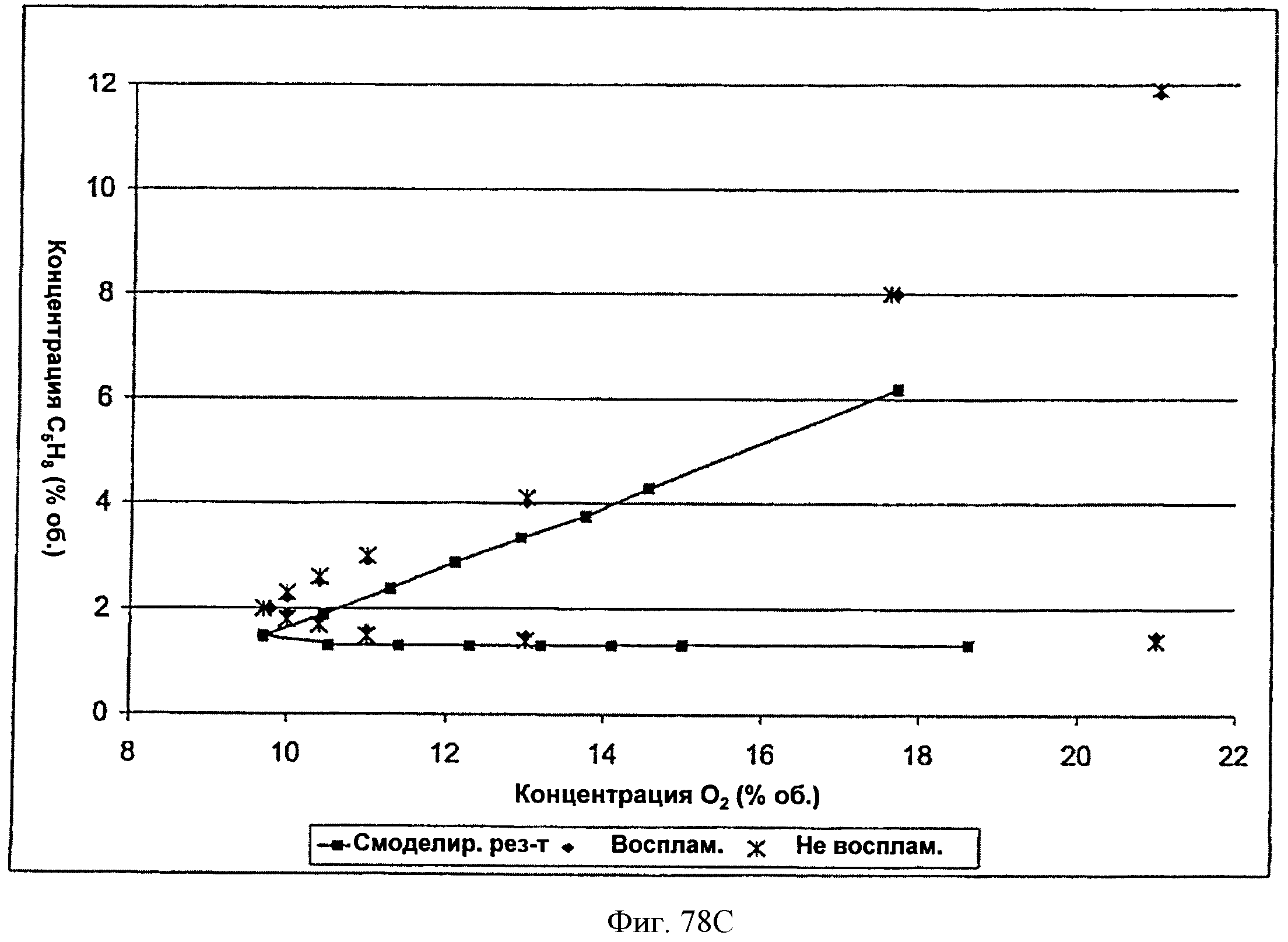
[0133] Фигура 78С представляет собой график кривой воспламеняемости для тестированной Партии 1 по сравнению с воспламеняемостью, рассчитанной в модели CAFT.
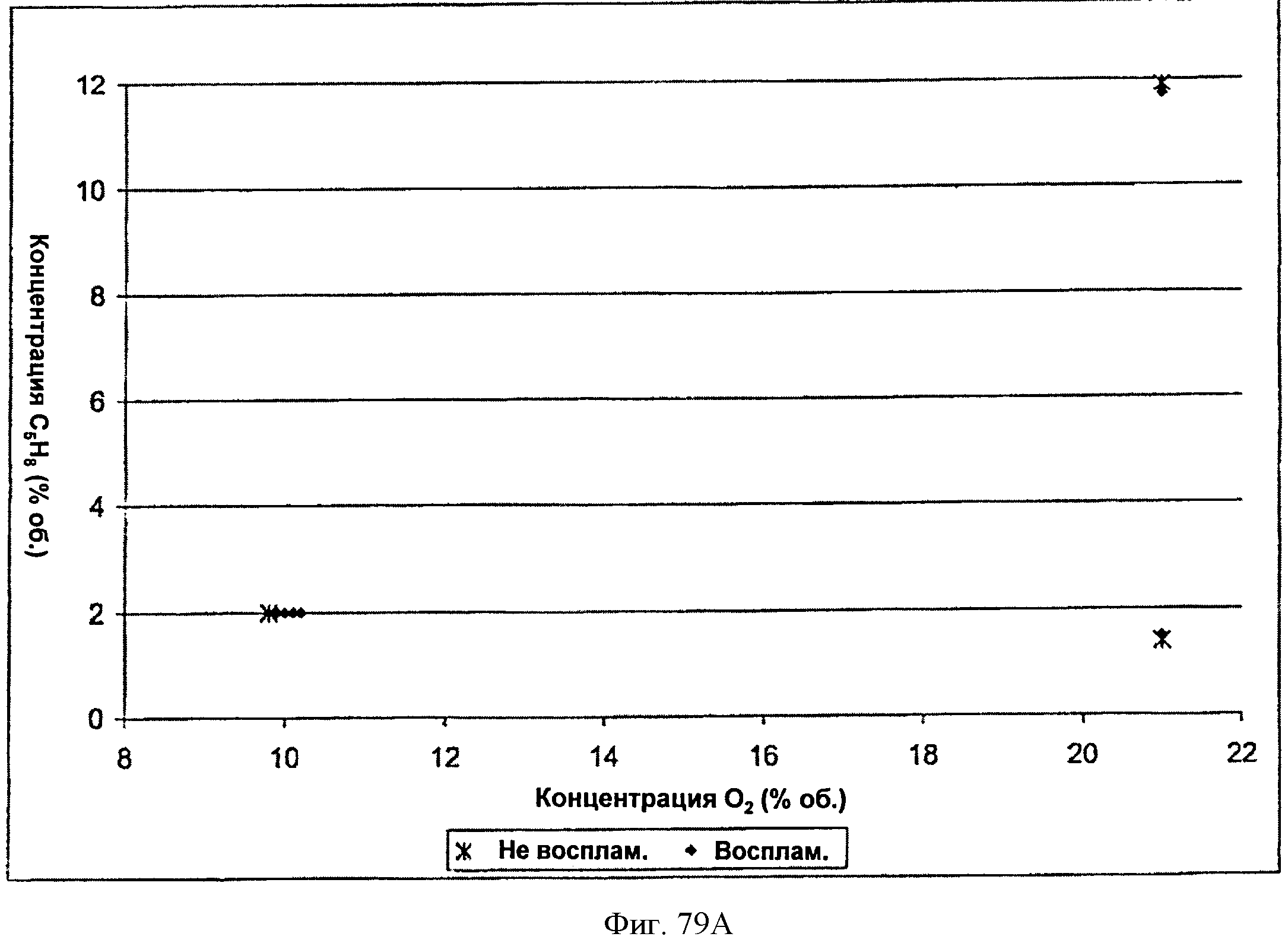
[0134] Фигура 79А представляет собой график кривой воспламеняемости для тестированной Партии 2: 4% пара, 0 фунтов/кв. дюйм изб. и 40°С.
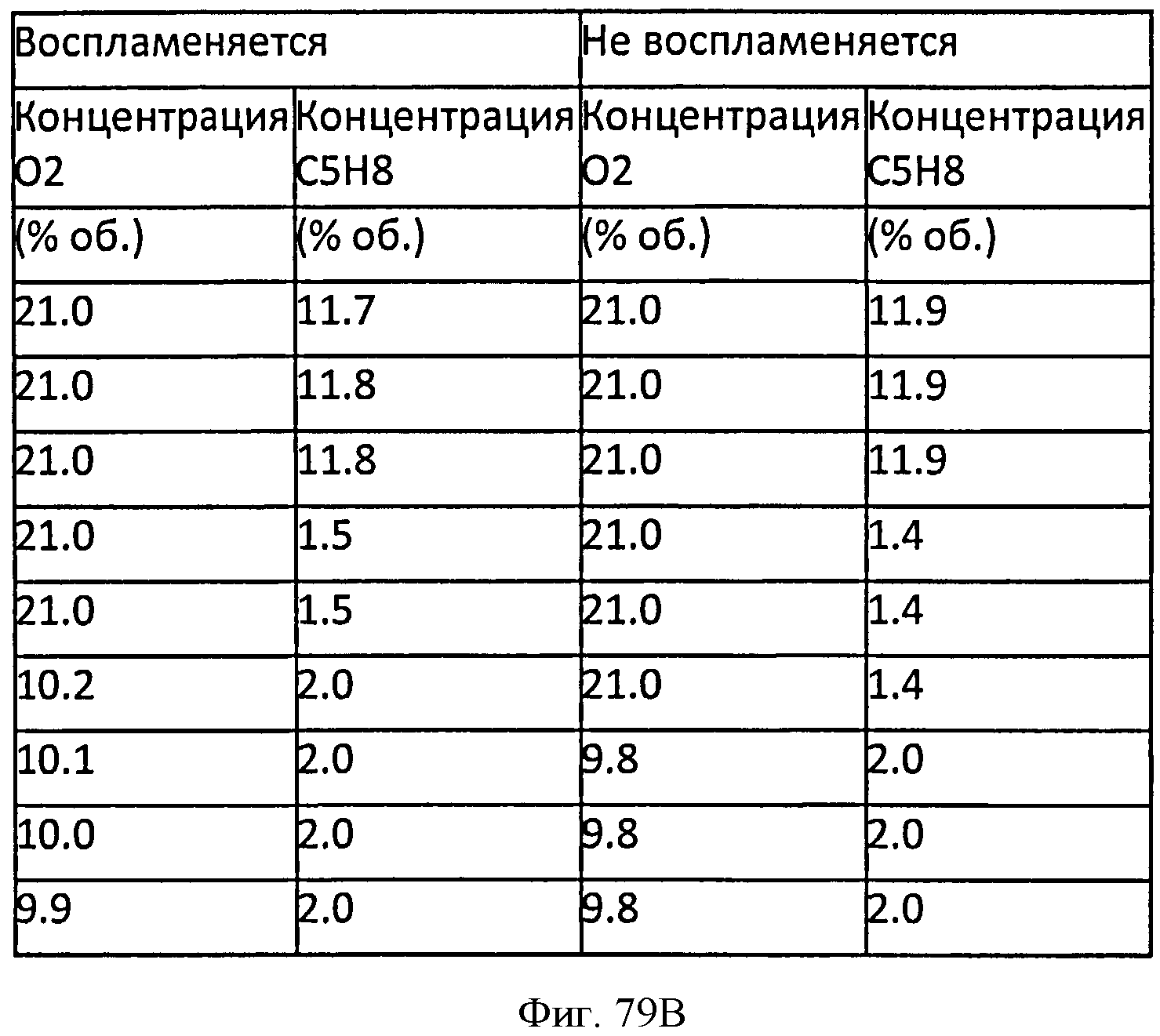
[0135] Фигура 79 В представляет собой таблицу, в которой суммированы экспериментальные точки для взрыва и отсутствия взрыва для тестированной Партии 2.
[0136] Фигура 79С представляет собой график кривой воспламеняемости для тестированной Партии 2 по сравнению с воспламеняемостью, рассчитанной в модели CAFT.
[0137] Фигуры 80А-В представляют собой таблицу, в которой подробно представлены экспериментальные условия и результаты для тестированной Партии 1.
[0138] Фигура 81 представляет собой таблицу, в которой представлены подробные экспериментальные условия и результаты для тестированной Партии 2.
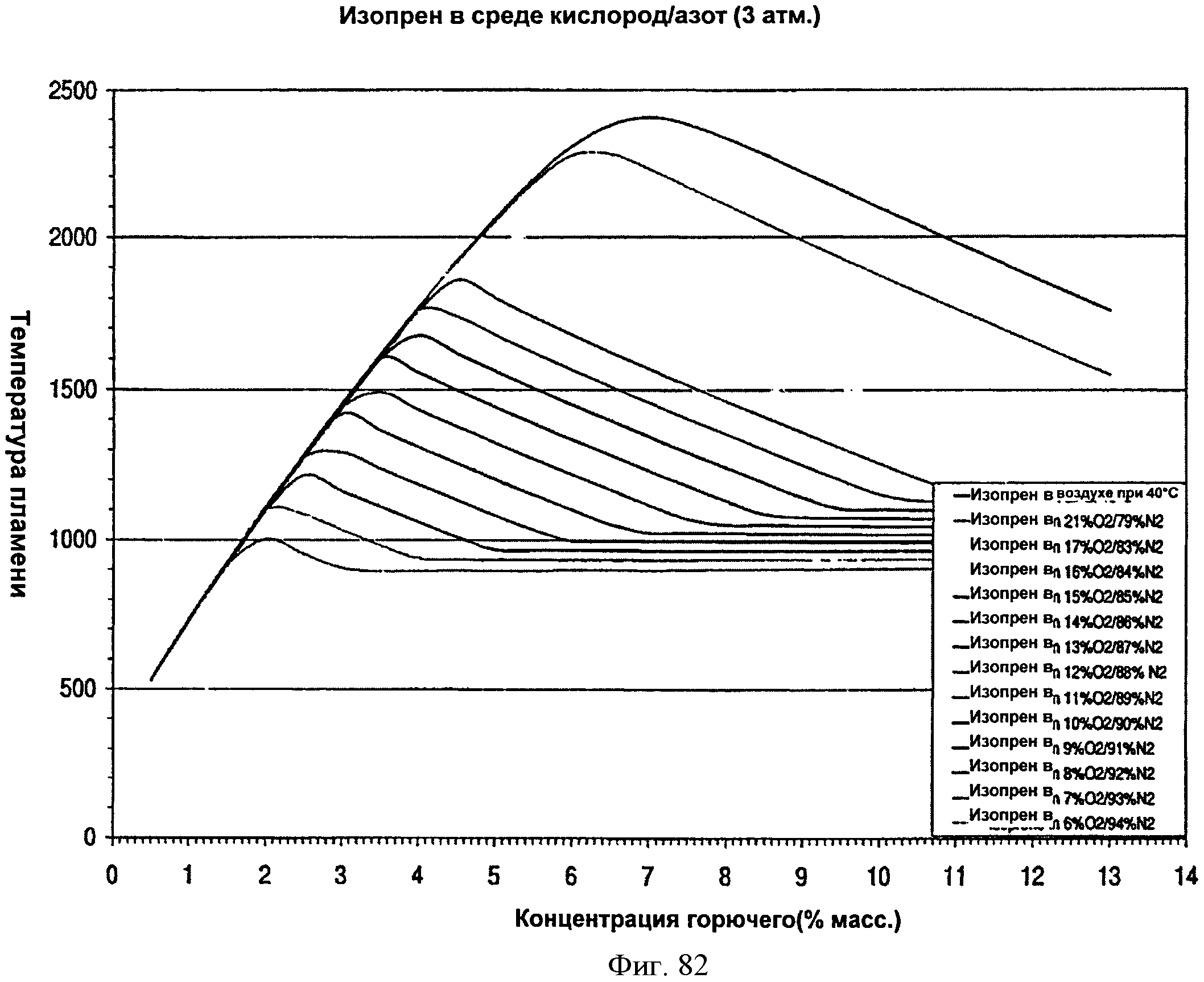
[0139] Фигура 82 представляет собой- график рассчитанной адиабатической температуры пламени, нанесенной на график как функция концентрации топлива, для различных соотношений азот/кислород при давлении 3 атмосферы.
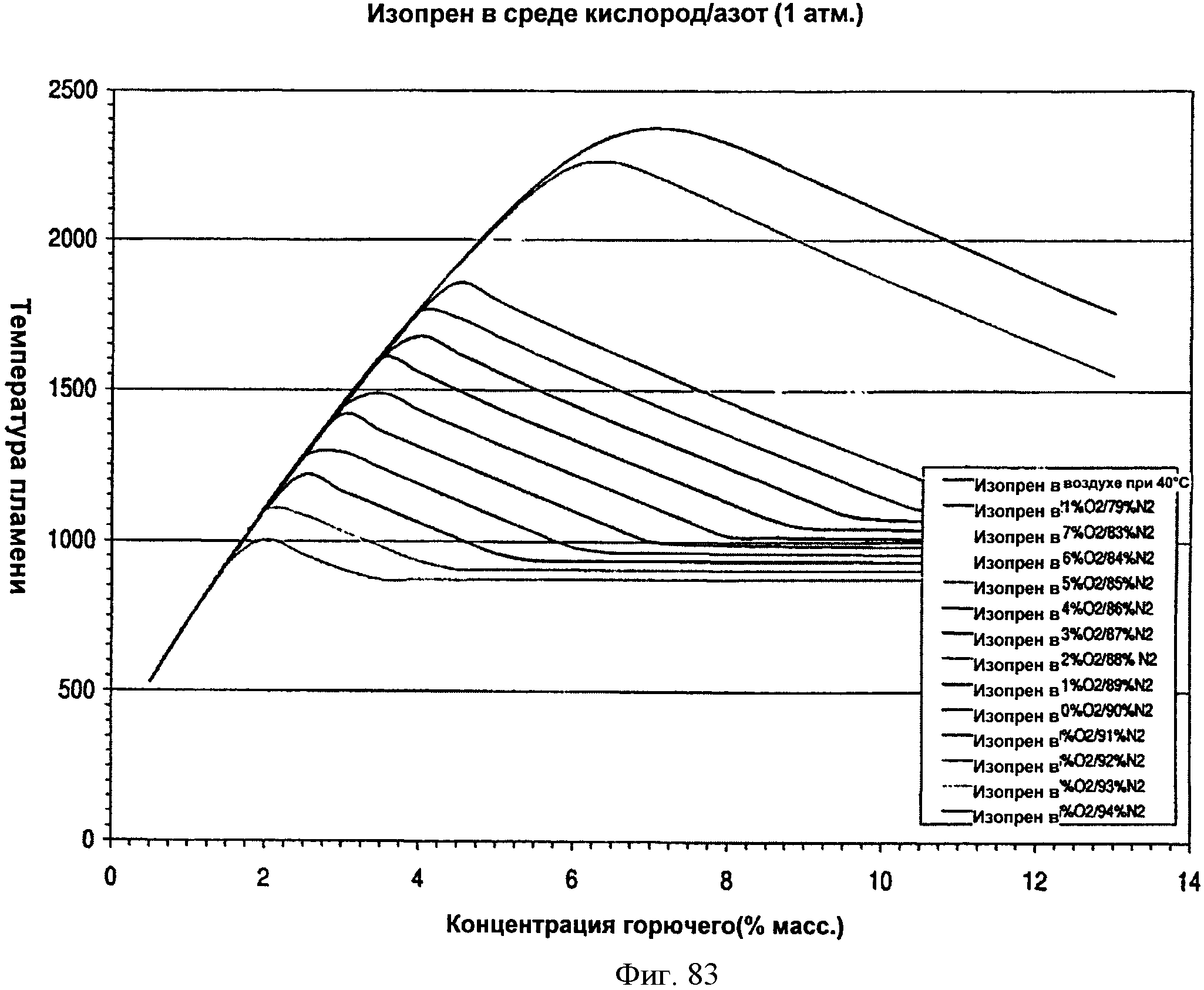
[0140] Фигура 83 представляет собой график рассчитанной адиабатической температуры пламени, нанесенной на график как функция концентрации топлива, для различных соотношений азот/кислород при давлении 1 атмосфера.
[0141] Фигура 84 представляет собой график зоны воспламеняемости, построенной с применением результатов, представленных на Фигуре 82. и следуя методике, описанной в Примере 13. Экспериментальные точки (круги) брали из тестов, описанных в данной заявке, которые осуществляли при исходном давлении в системе, равном 1 атмосфере.
[0142] Фигура 85 представляет собой график зоны воспламеняемости, построенной с применением результатов, представленных на Фигуре 83. и следуя методике, описанной в Примере 13. Экспериментальные точки (круги) брали из тестов, описанных в данной заявке, которые осуществляли при исходном давлении в системе, равном 1 атмосфере.
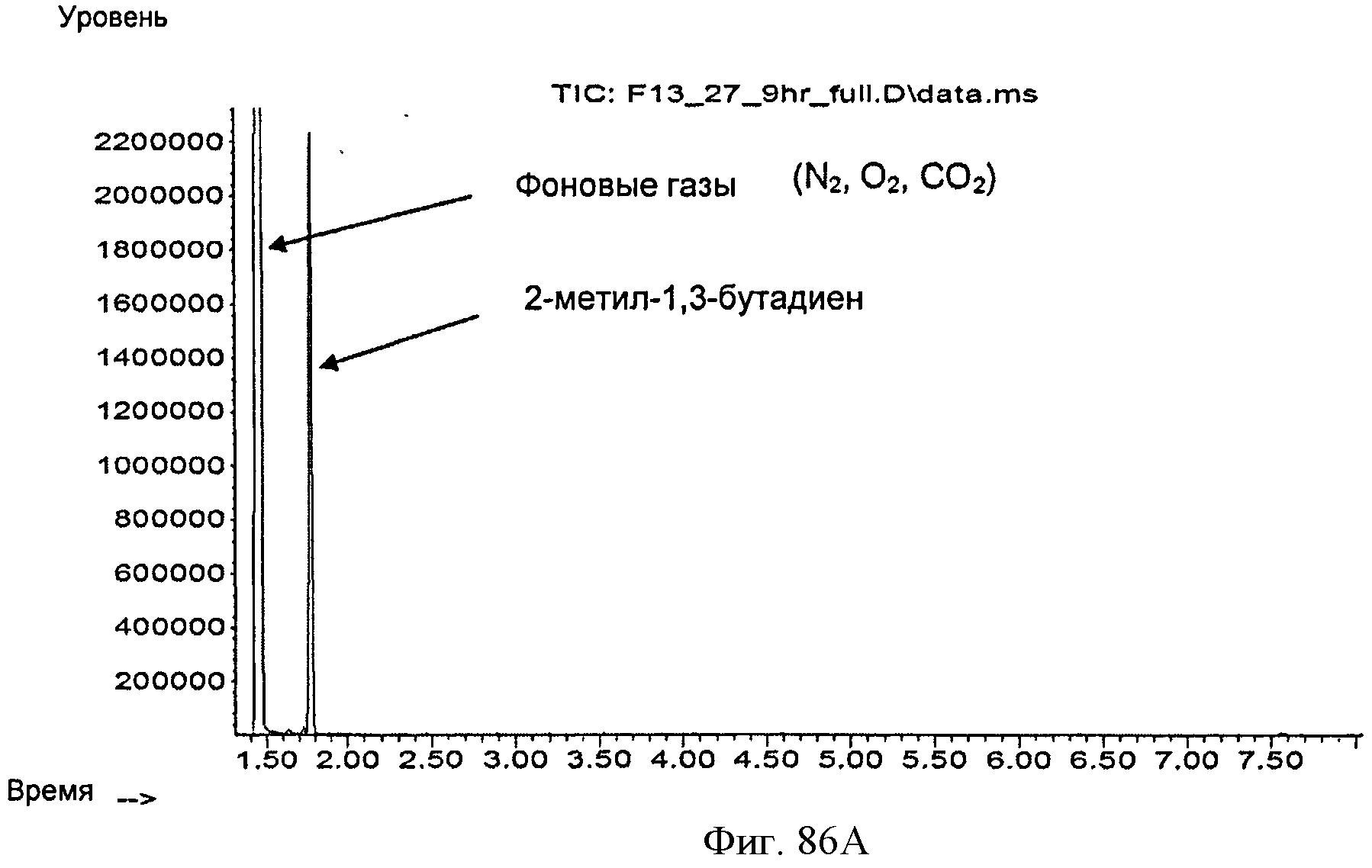
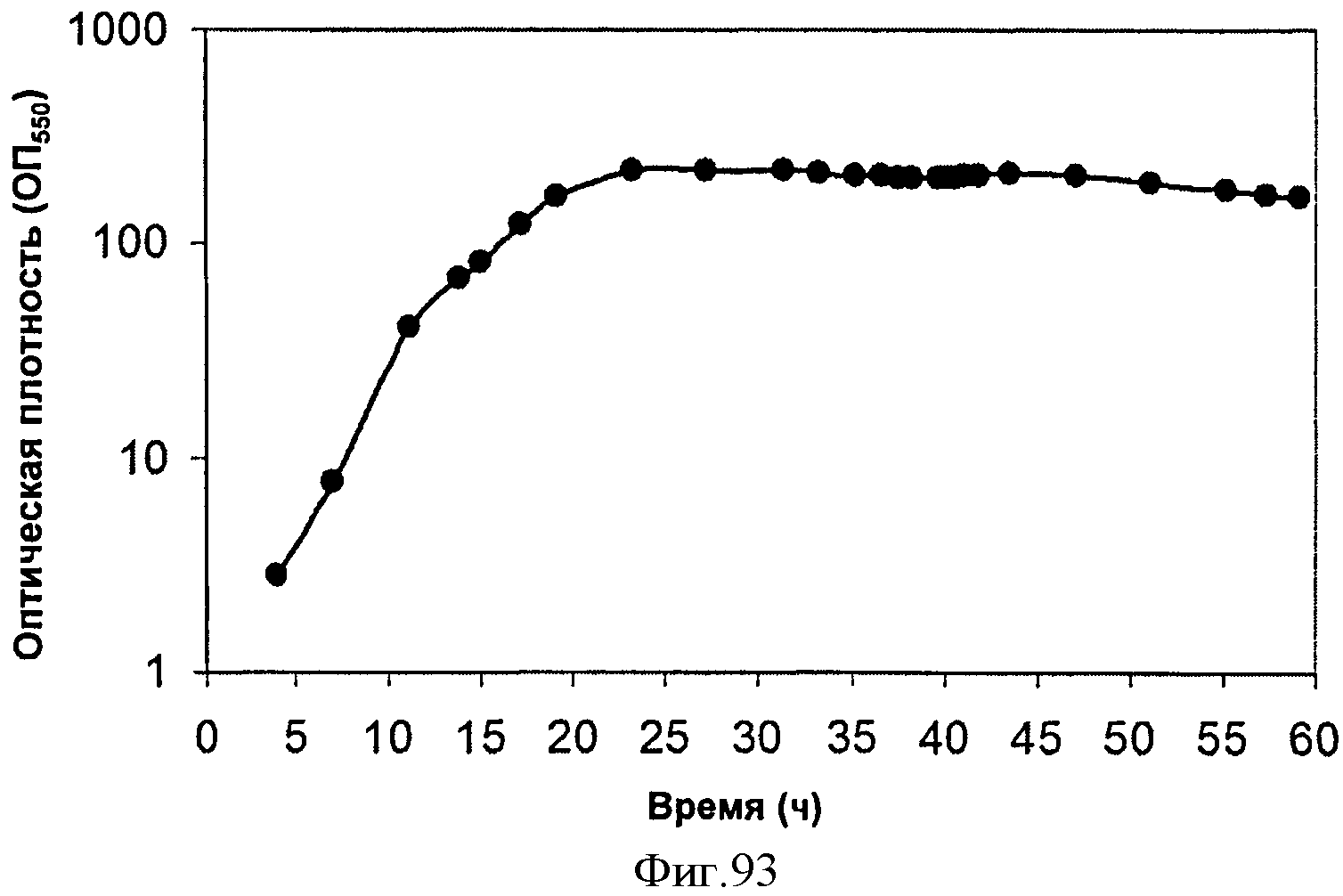
[0143] Фигура 86А представляет собой хроматограмму ГХ/МС выделяющегося при ферментации газа.
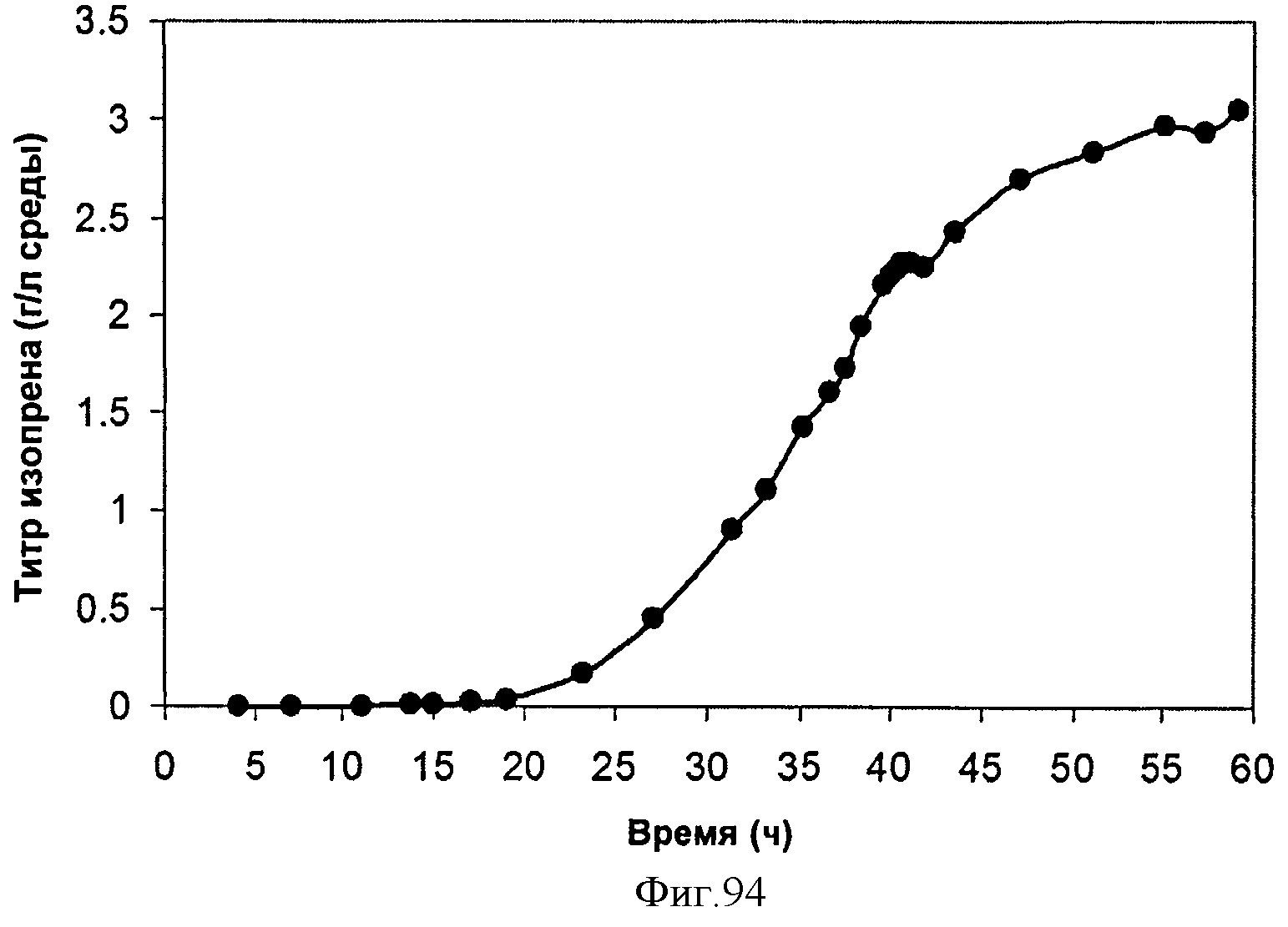
[0144] Фигура 86В представляет собой объяснение Фиг.86А для демонстрации незначительных летучих компонентов, присутствующих в выделяющихся при ферментации газах.
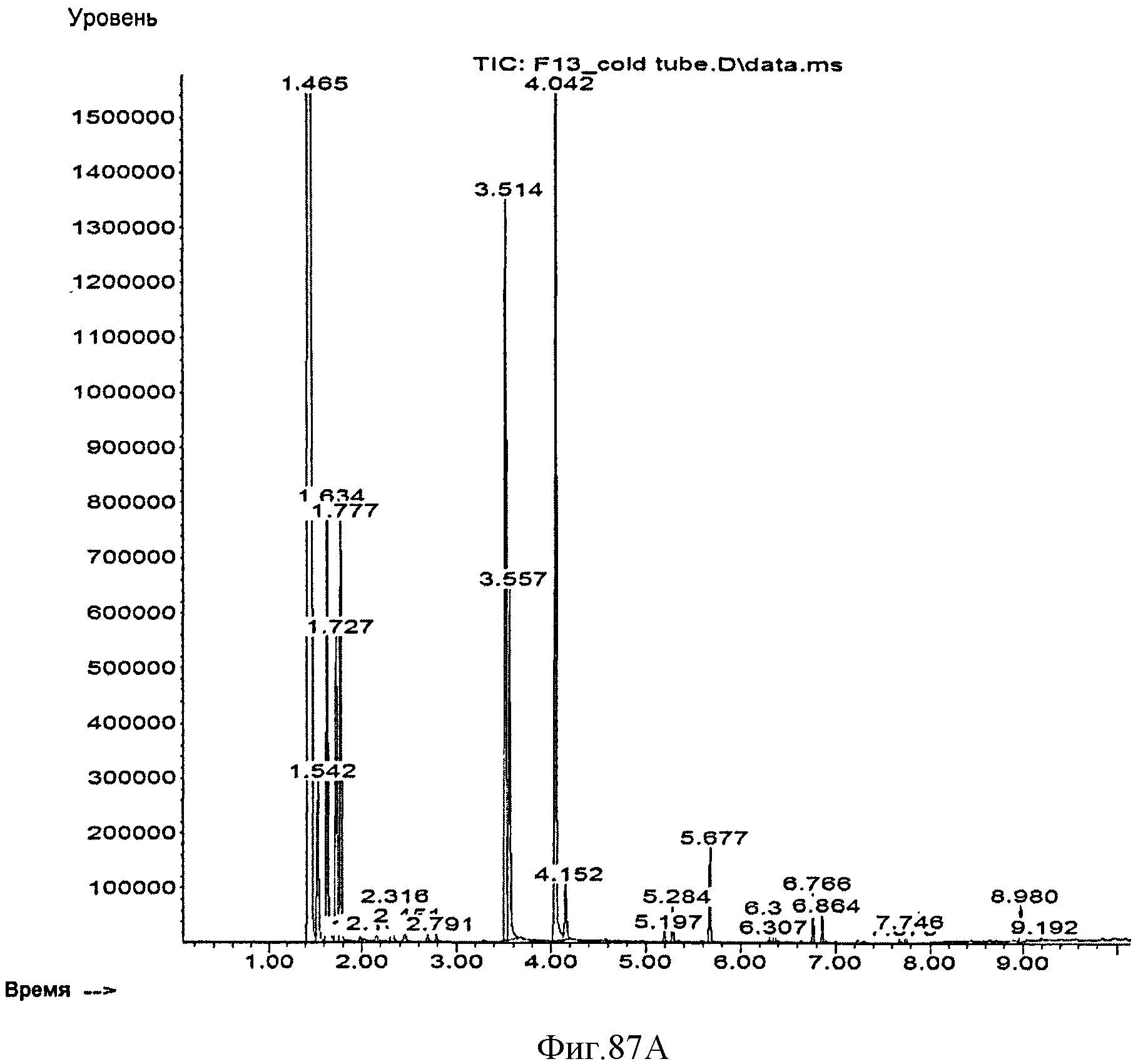
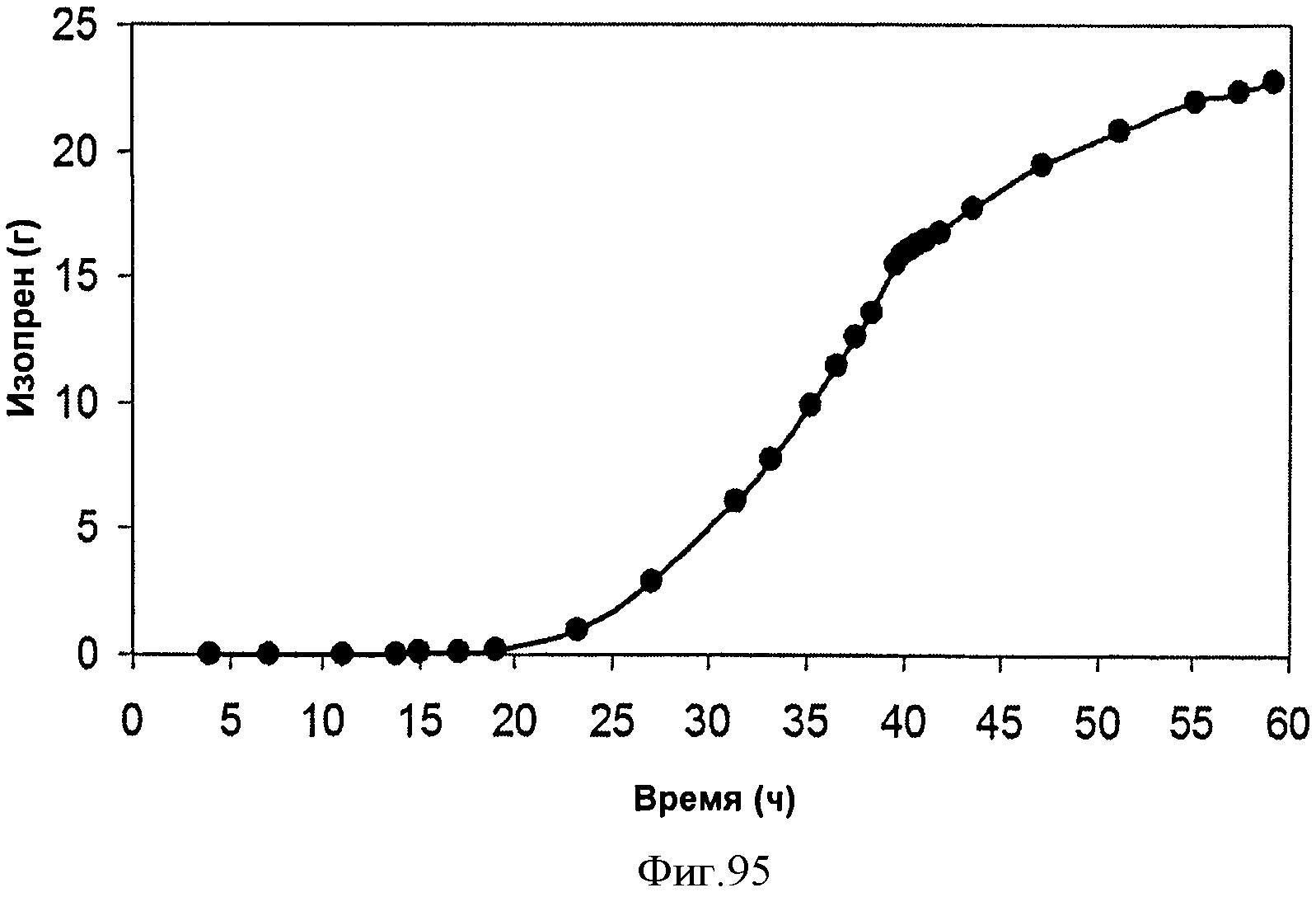
[0145] Фигура 87А представляет собой хроматограмму ГХ/МС остаточных летучих компонентов, присутствующих в выделяющихся газах после криостабилизации при -78°С.
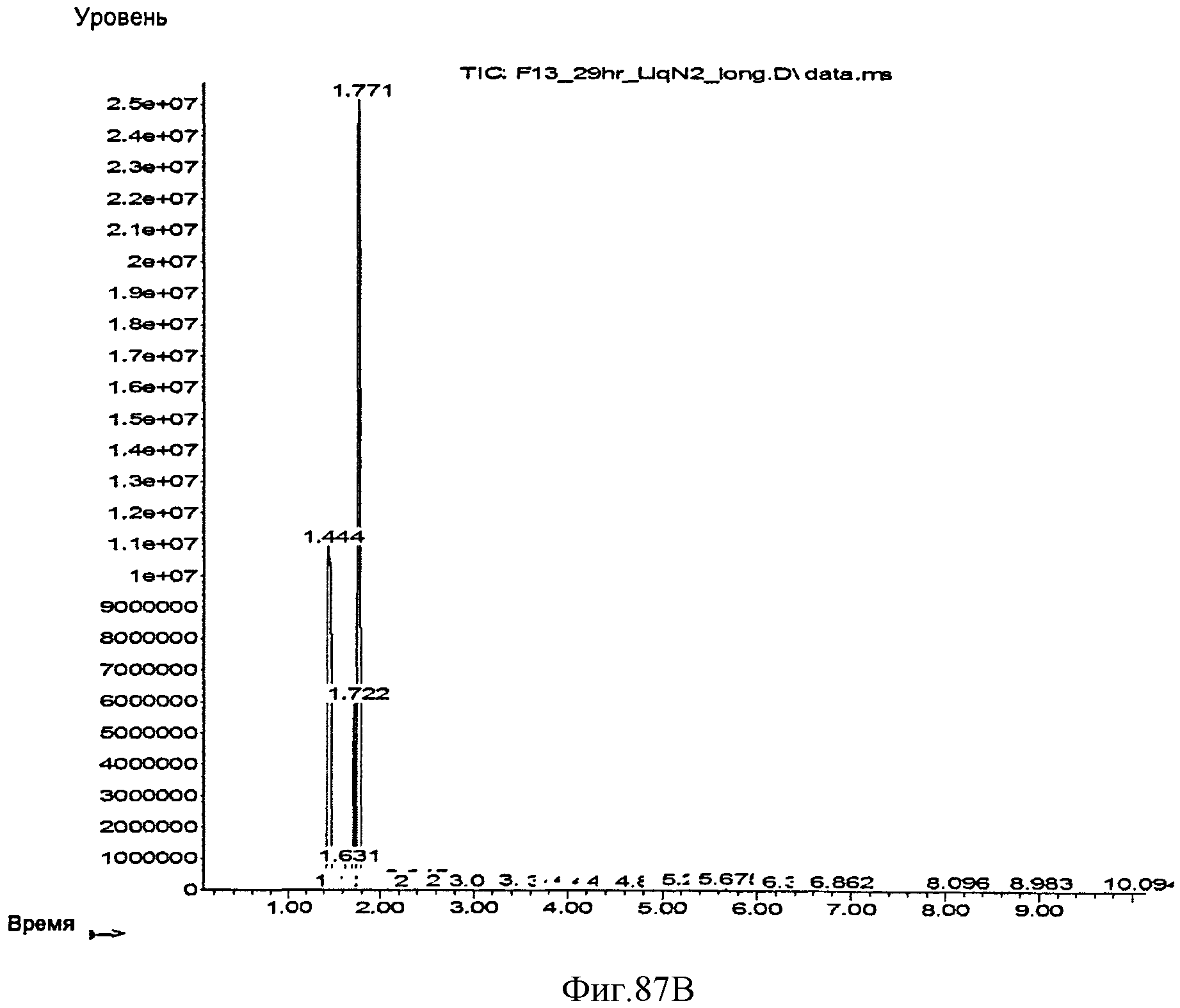
[0146] Фигура 87В представляет собой хроматограмму ГХ/МС остаточных летучих компонентов, присутствующих в выделяющихся газах после криостабилизации при -196°С.
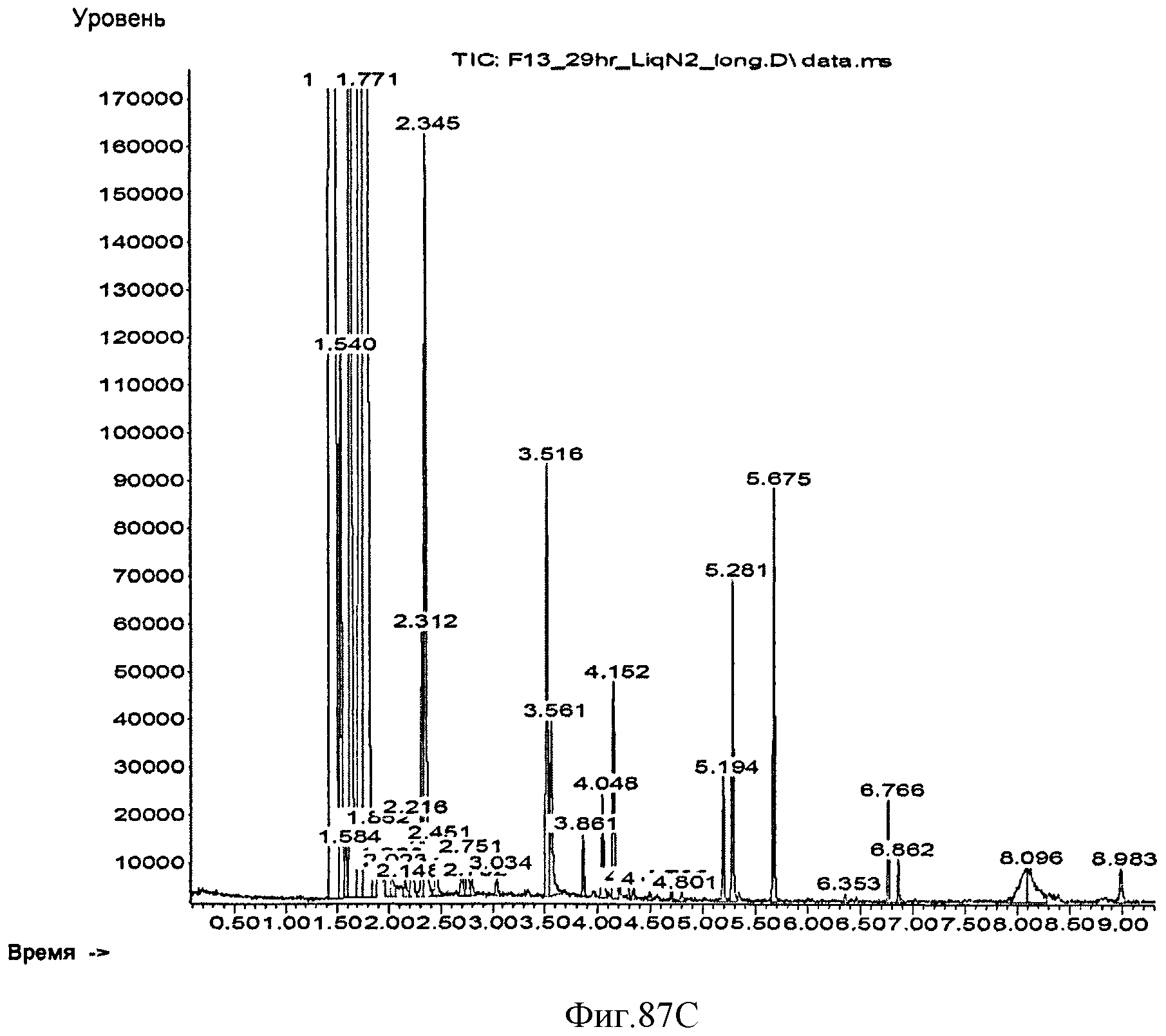
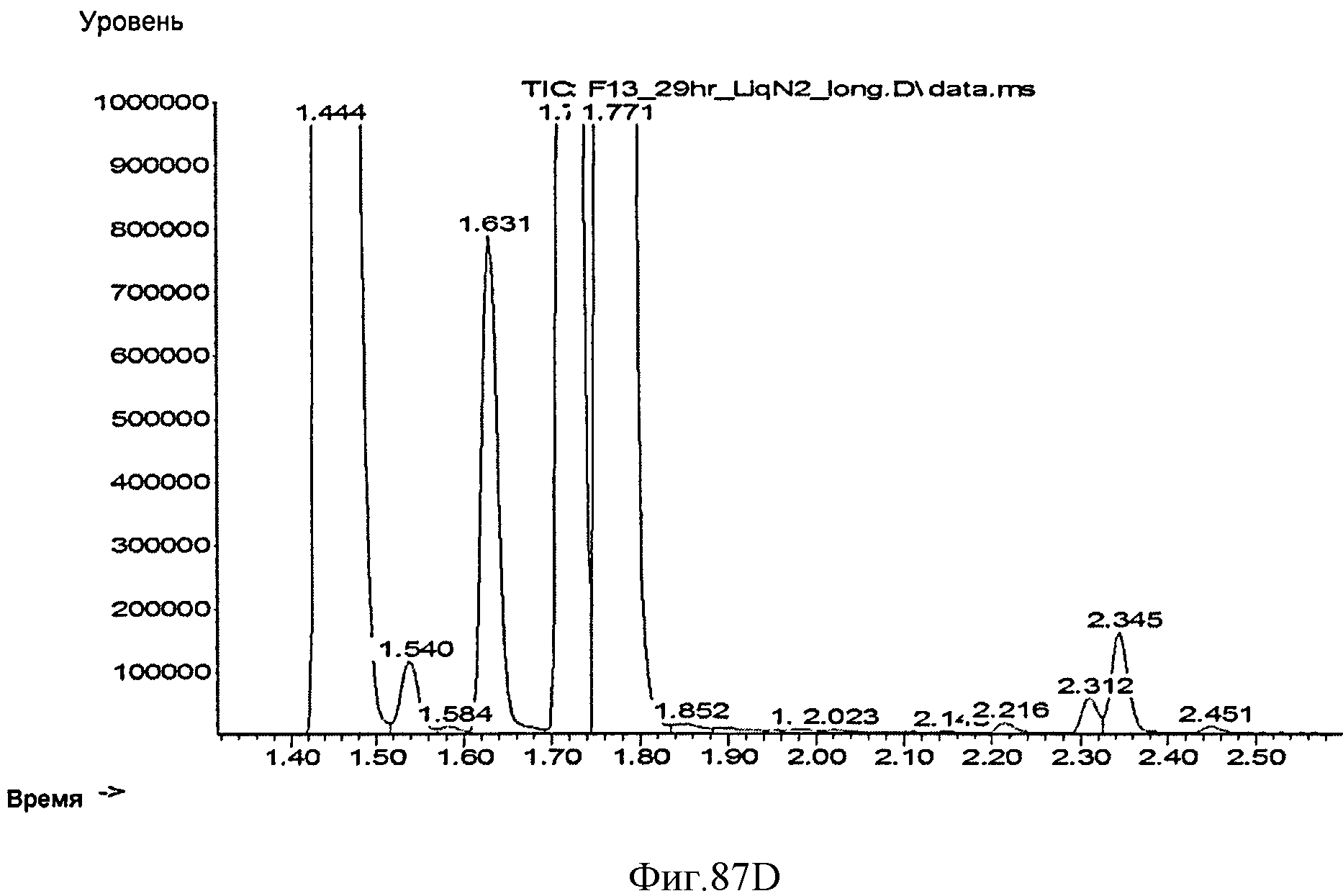
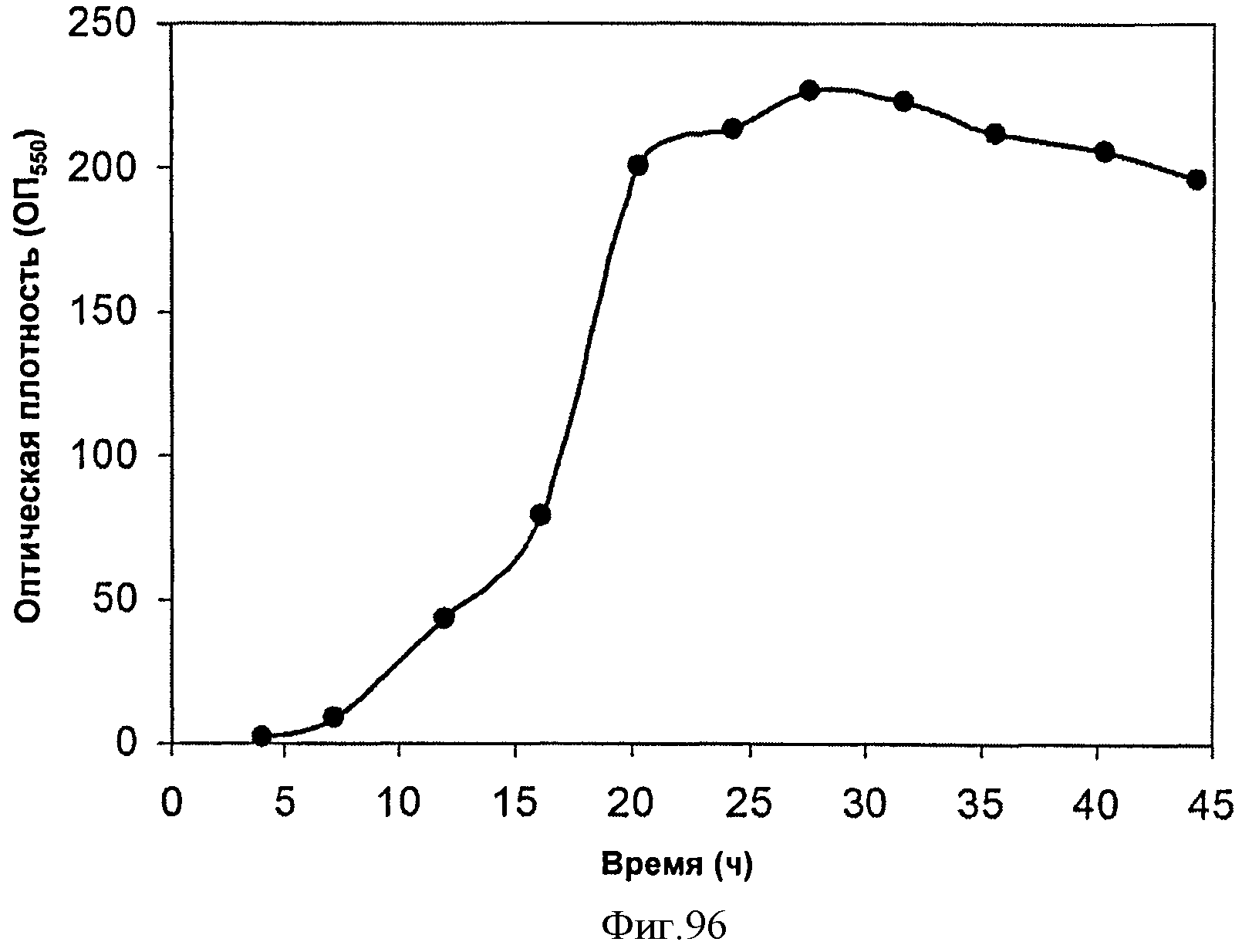
[0147] Фигура 87С представляет собой объяснение Фигуры 87 В. [0148] Фигура 87D представляет собой объяснение Фигуры 87С.
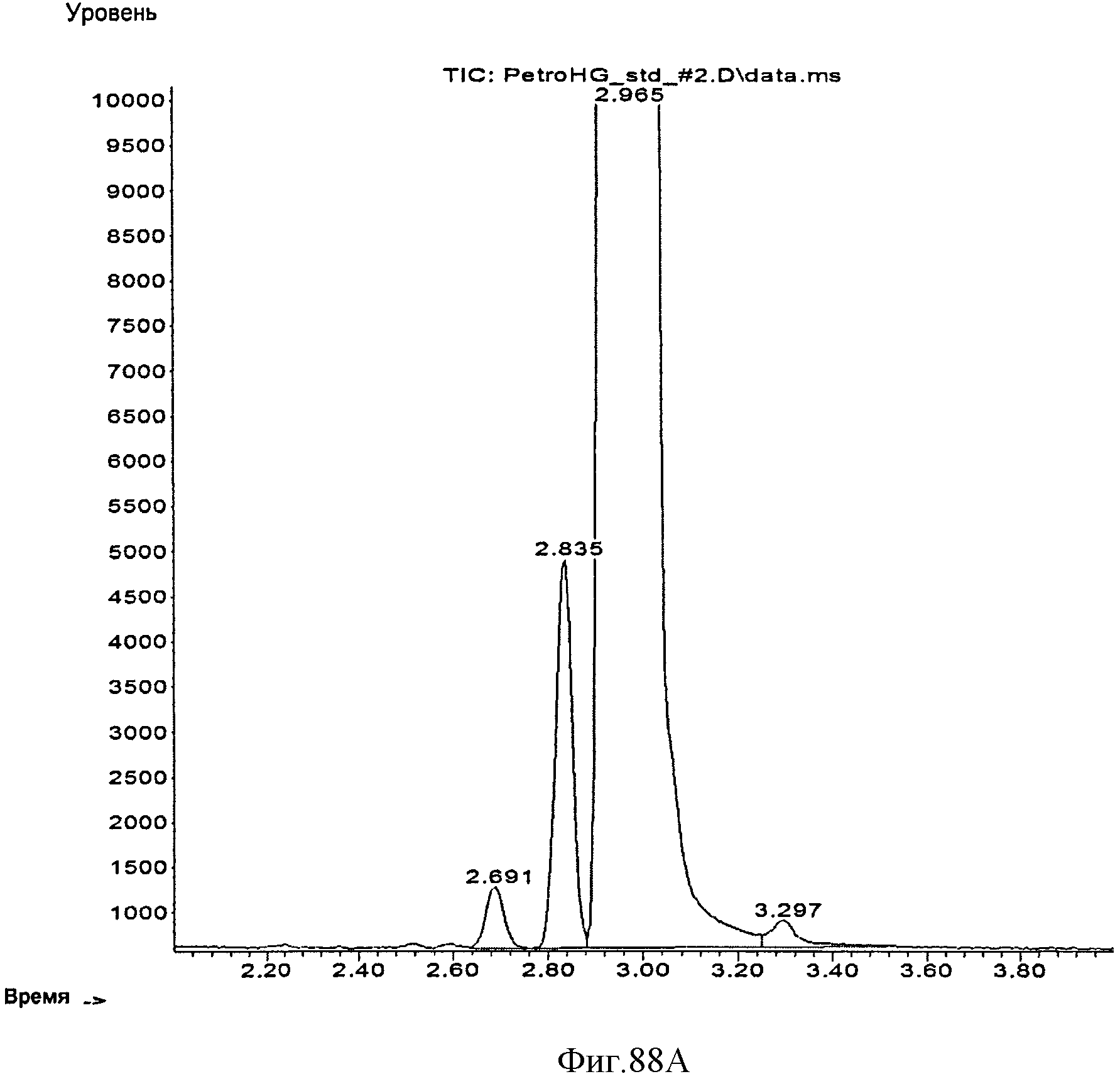
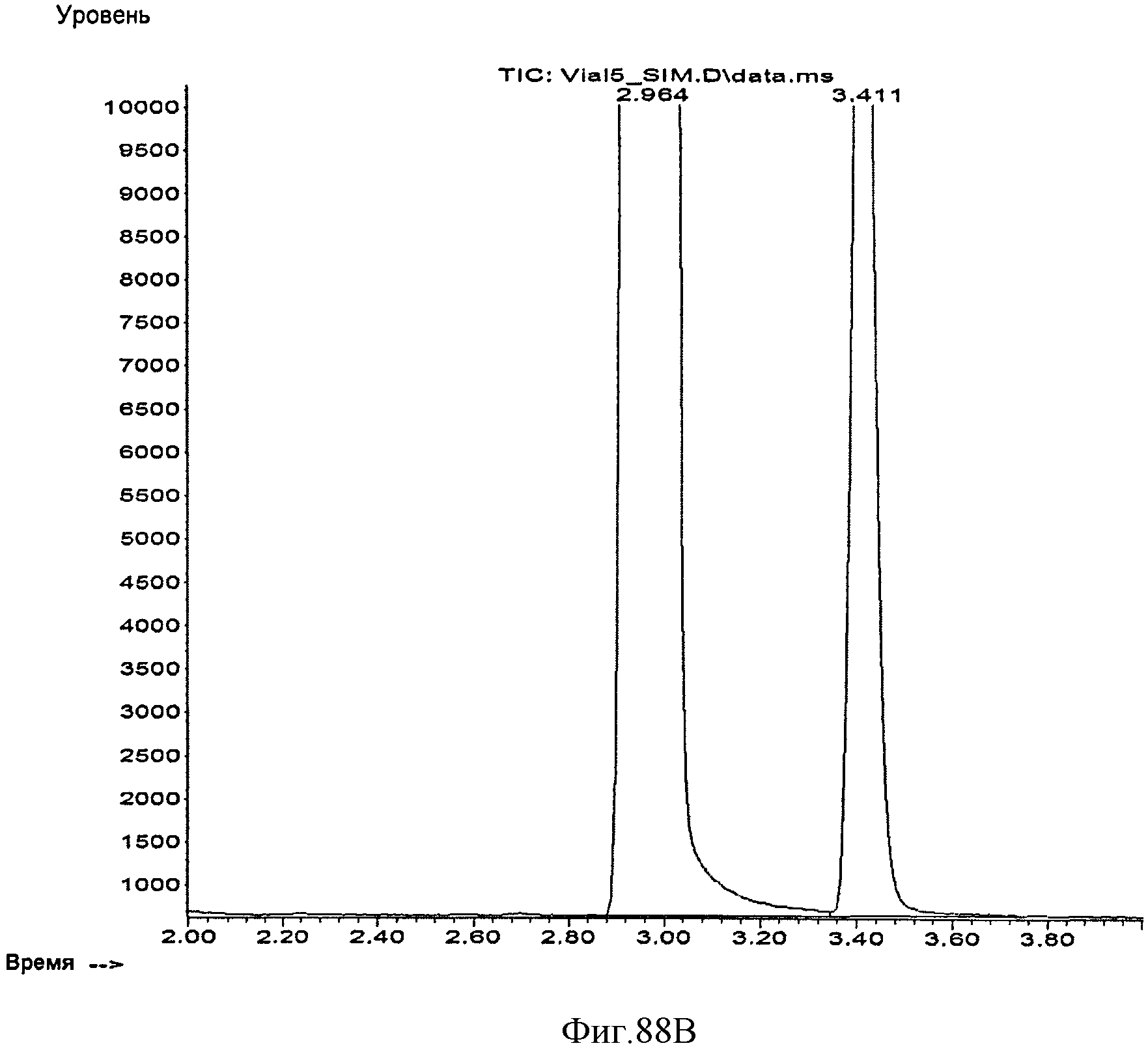
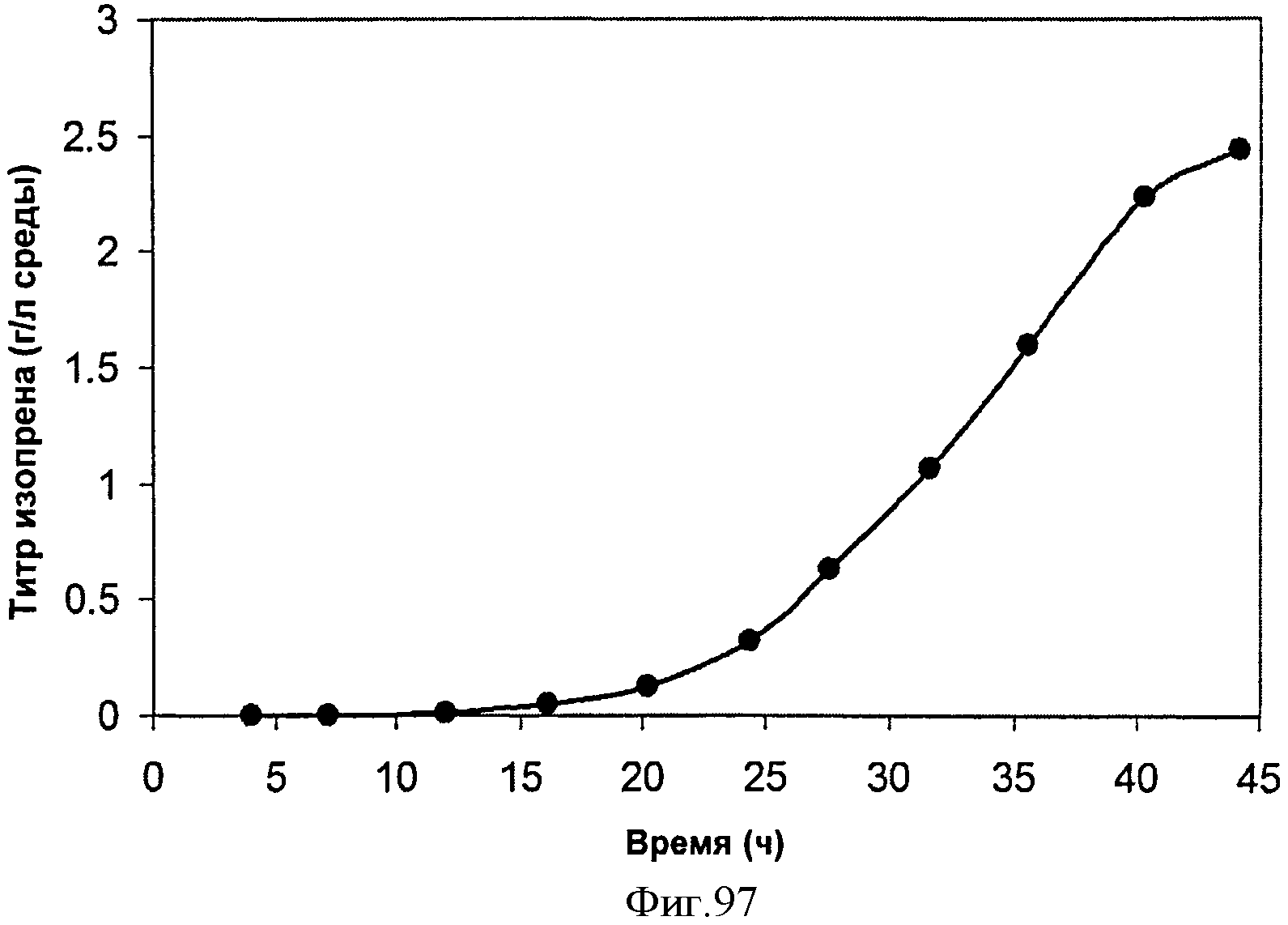
[0149] Фигуры 88А-В представляют собой хроматограмму ГХ/МС, на которой сравниваются С5-углеводороды из полученного из нефти изопрена (Фигура 88А) и полученного биологическим путем изопрена (Фигура 88 В). Стандарт содержит три С5-углеводородные примеси, которые элюируются рядом с основным пиком изопрена (Фигура 88А). В противоположность этому, полученный биологическим путем изопрен содержит некоторые количества этанола и ацетона (рабочее время составляло 3,41 минуты) (Фигура 88А).
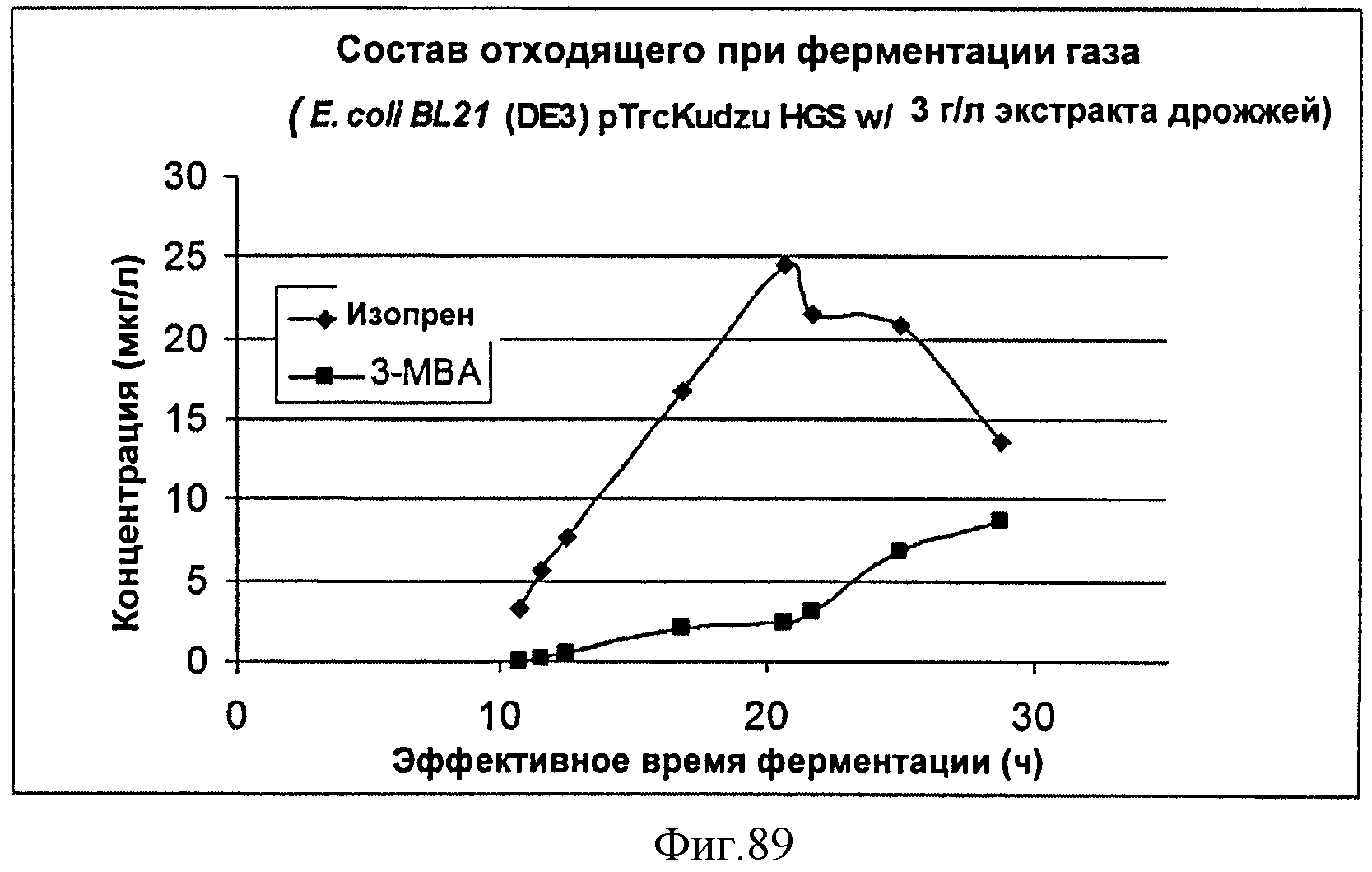
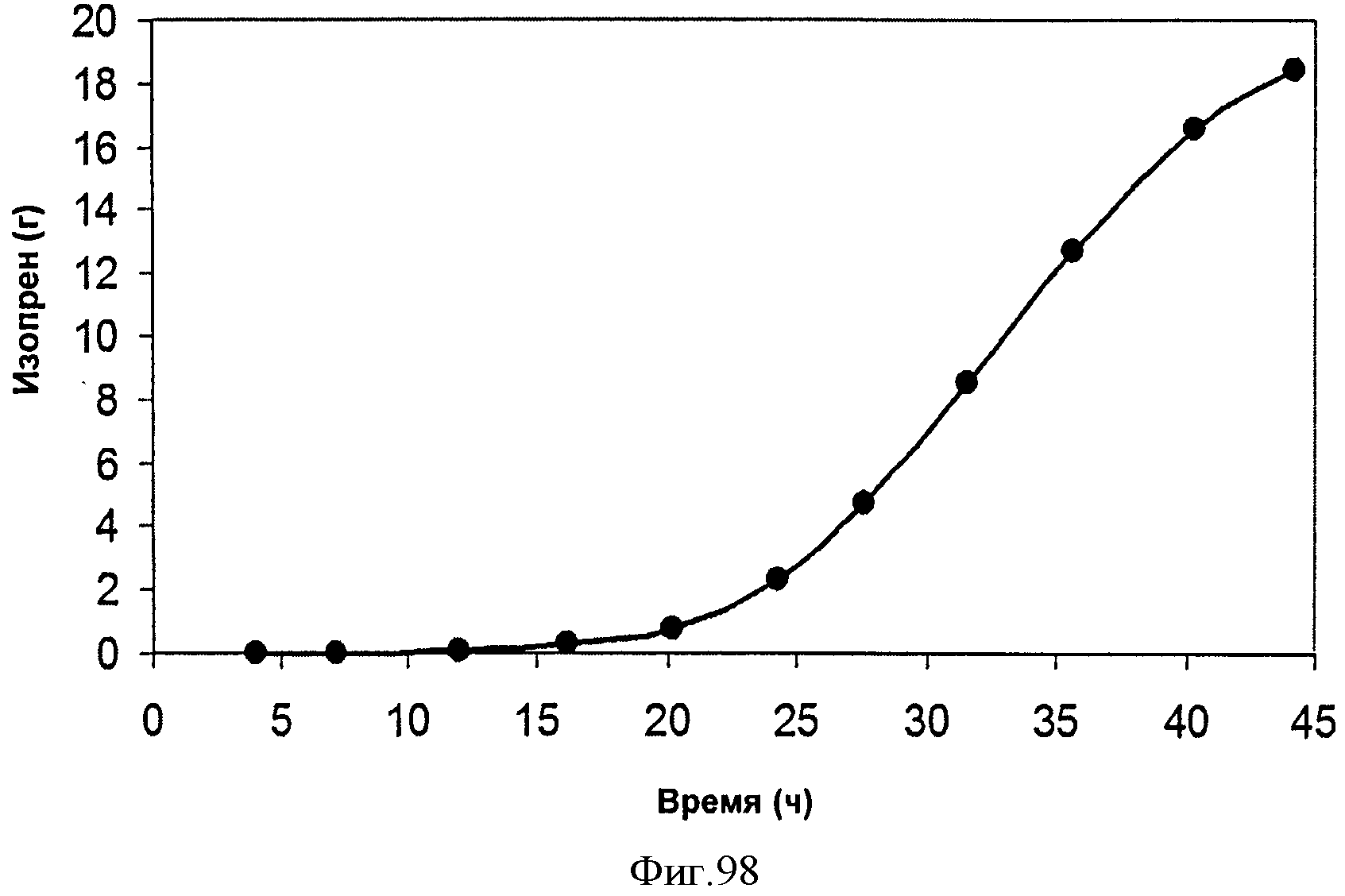
[0150] Фигура 89 представляет собой график анализа выделяющегося газа при ферментации штамма pTrcIS E. coli BL21 (DE3), экспрессирующего изопренсинтазу кудзу и подпитываемого глюкозой с 3 г/л дрожжевого экстракта.
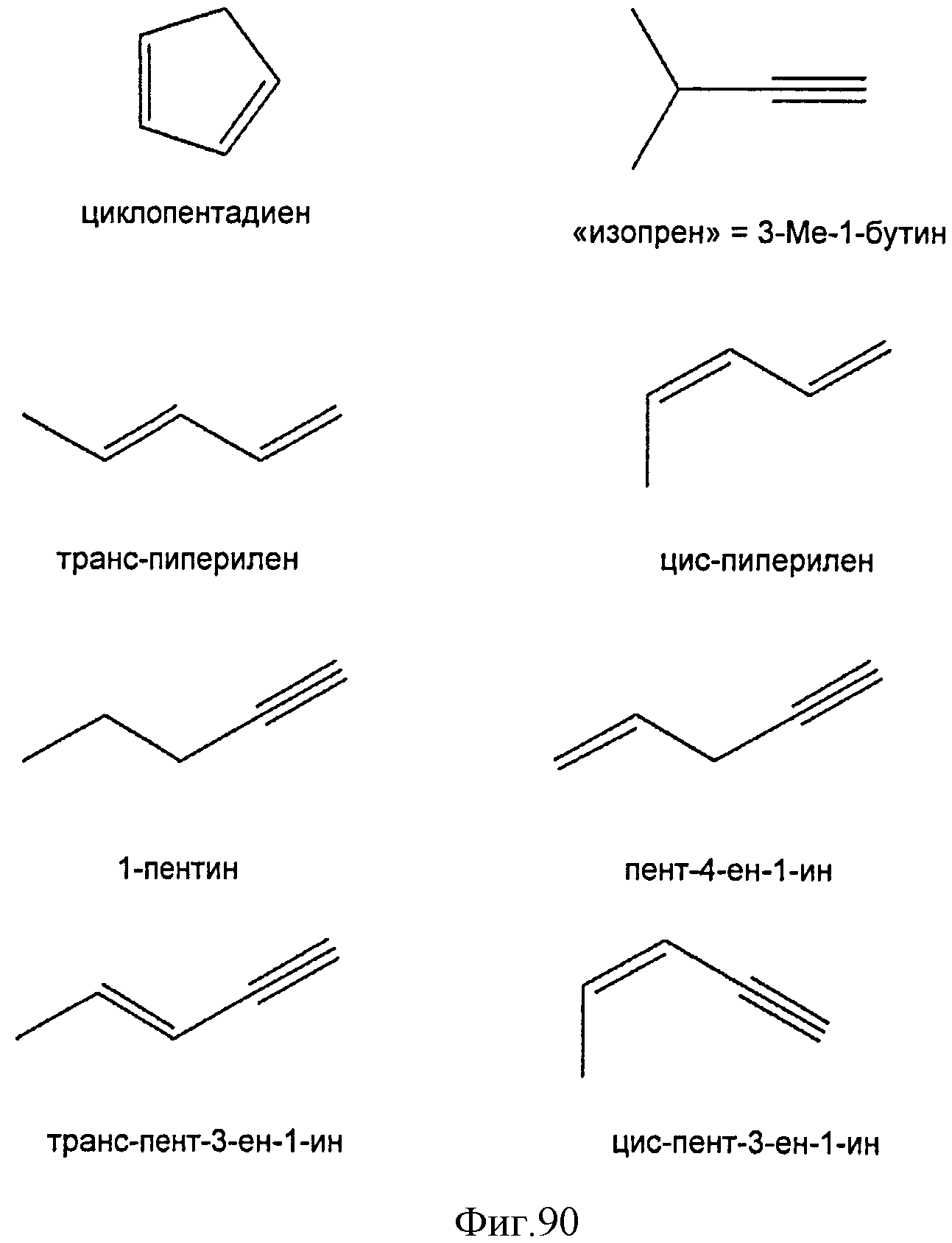
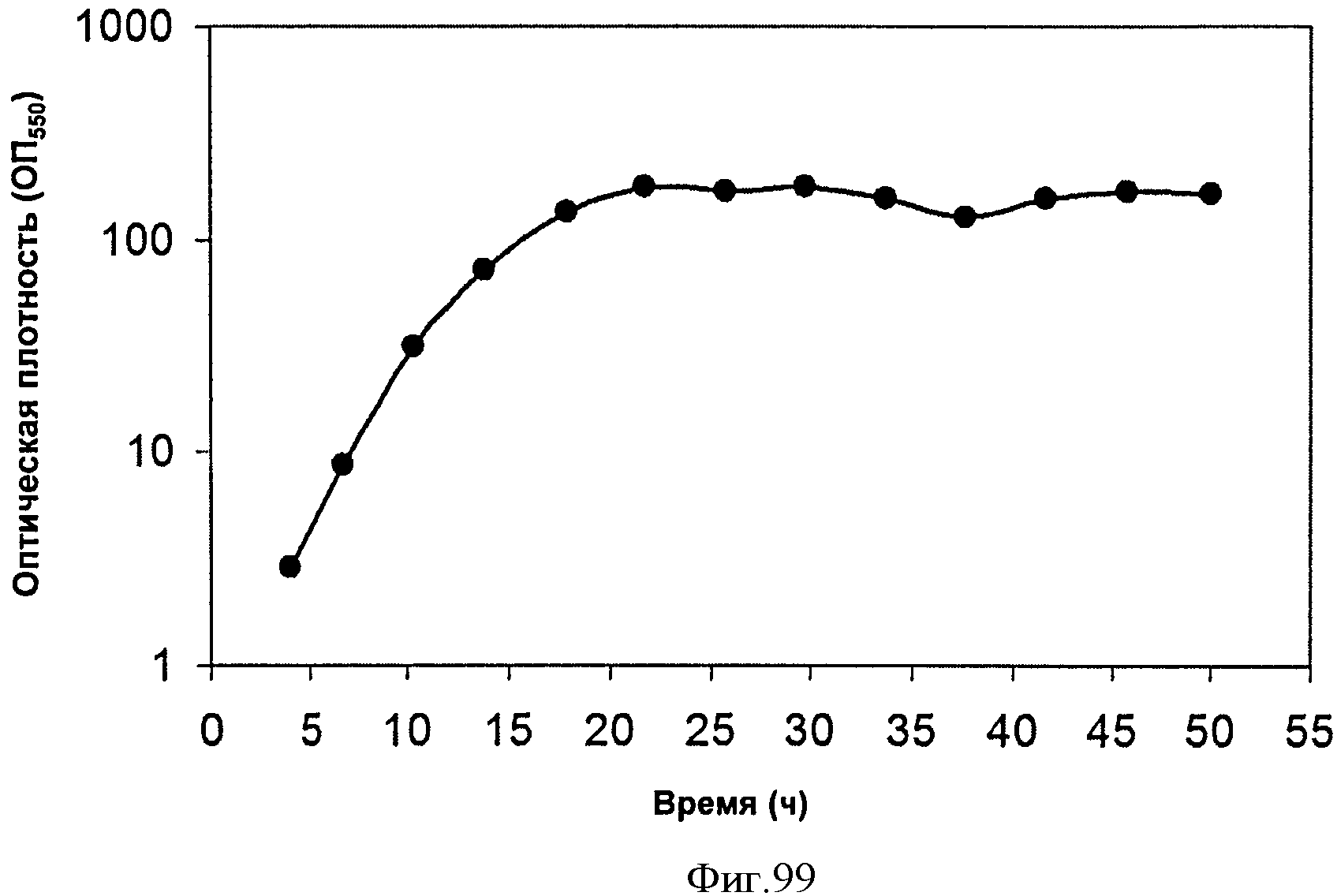
[0151] На Фигуре 90 показаны структуры нескольких примесей, которые сходны по структуре с изопреном и также могут действовать как каталитические яды в отношении полимеризации.
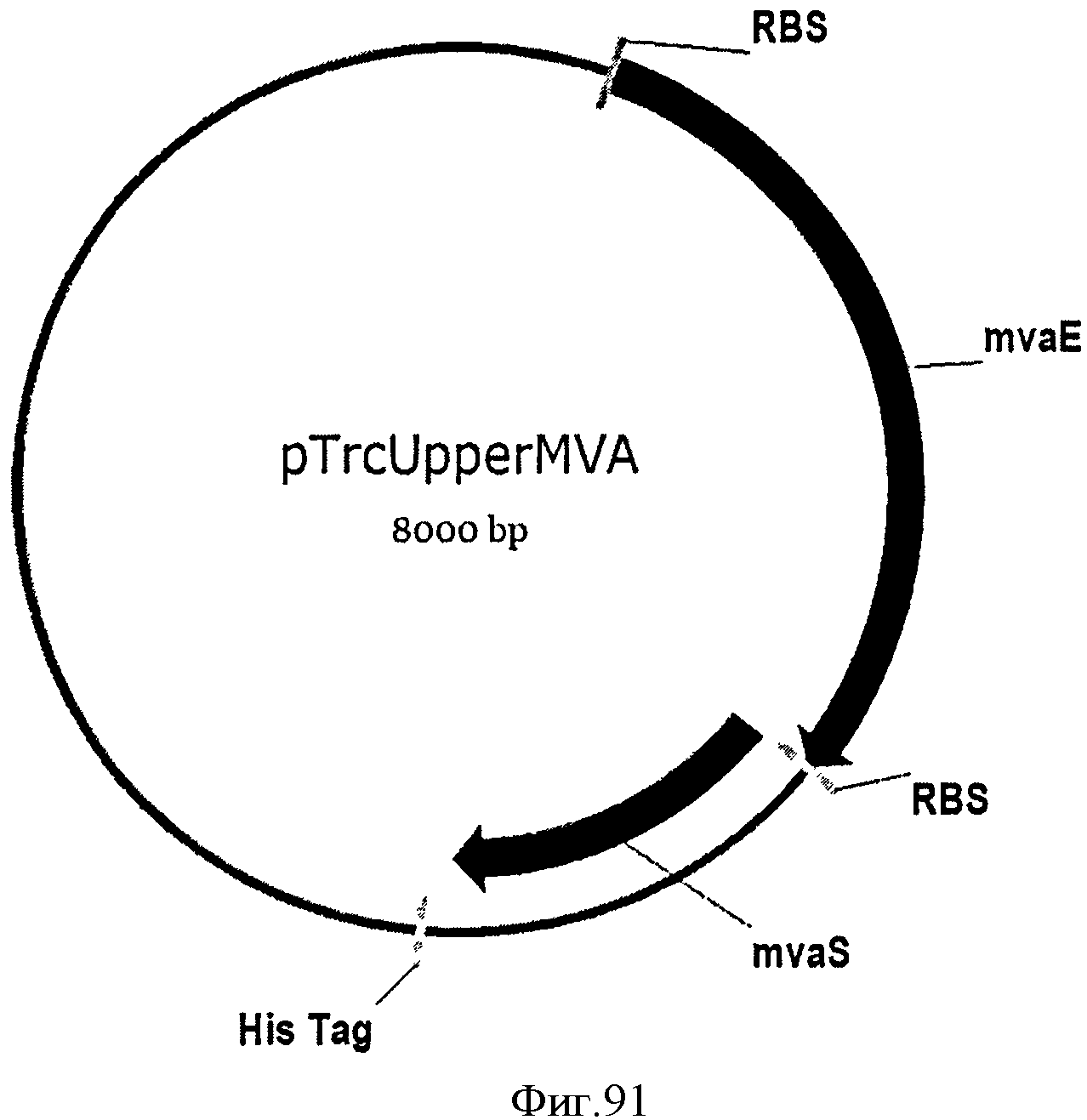
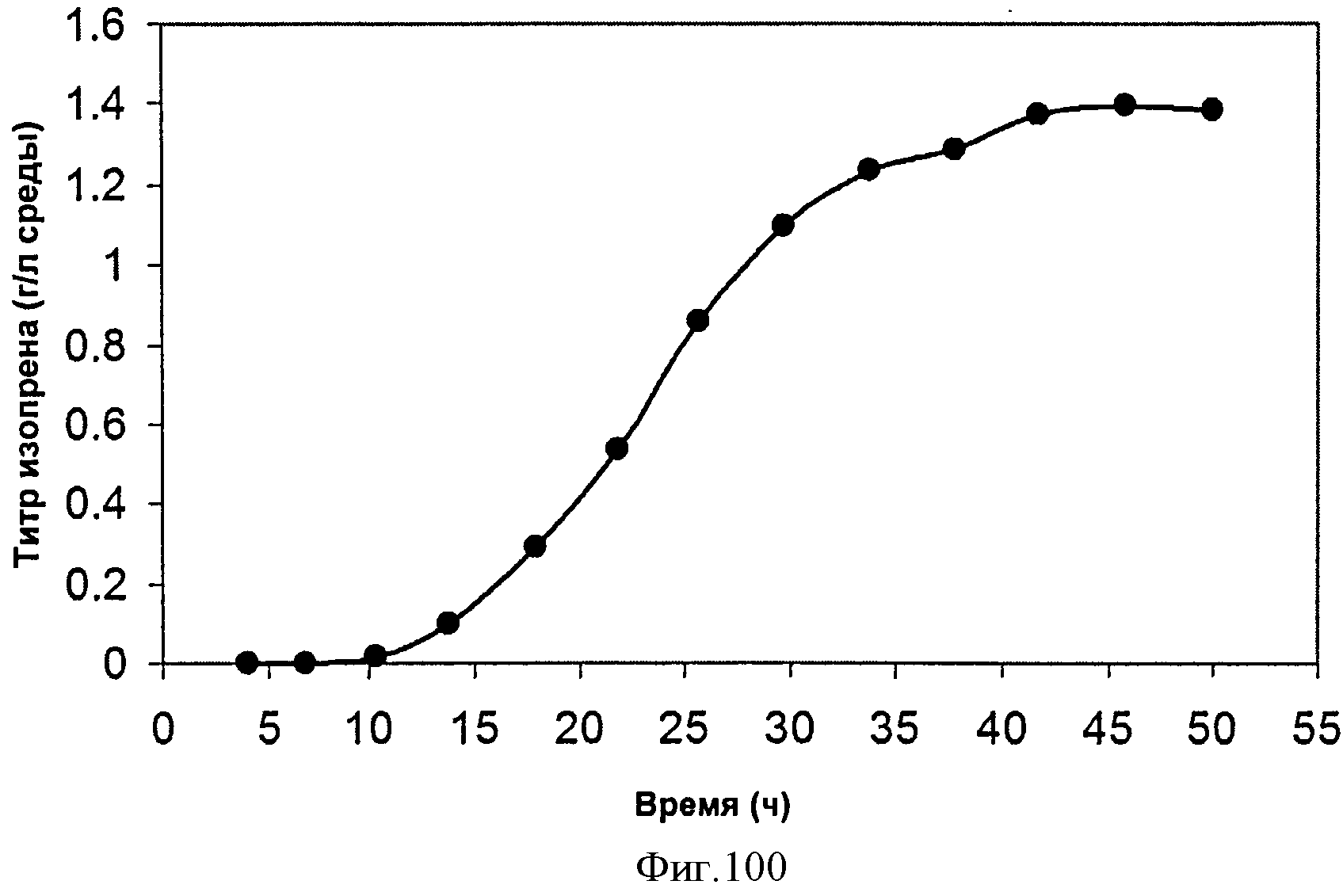
[0152] Фигура 91 представляет собой карту pTrcHis2AUpperPathway (также называемой pTrcUpperMVA).
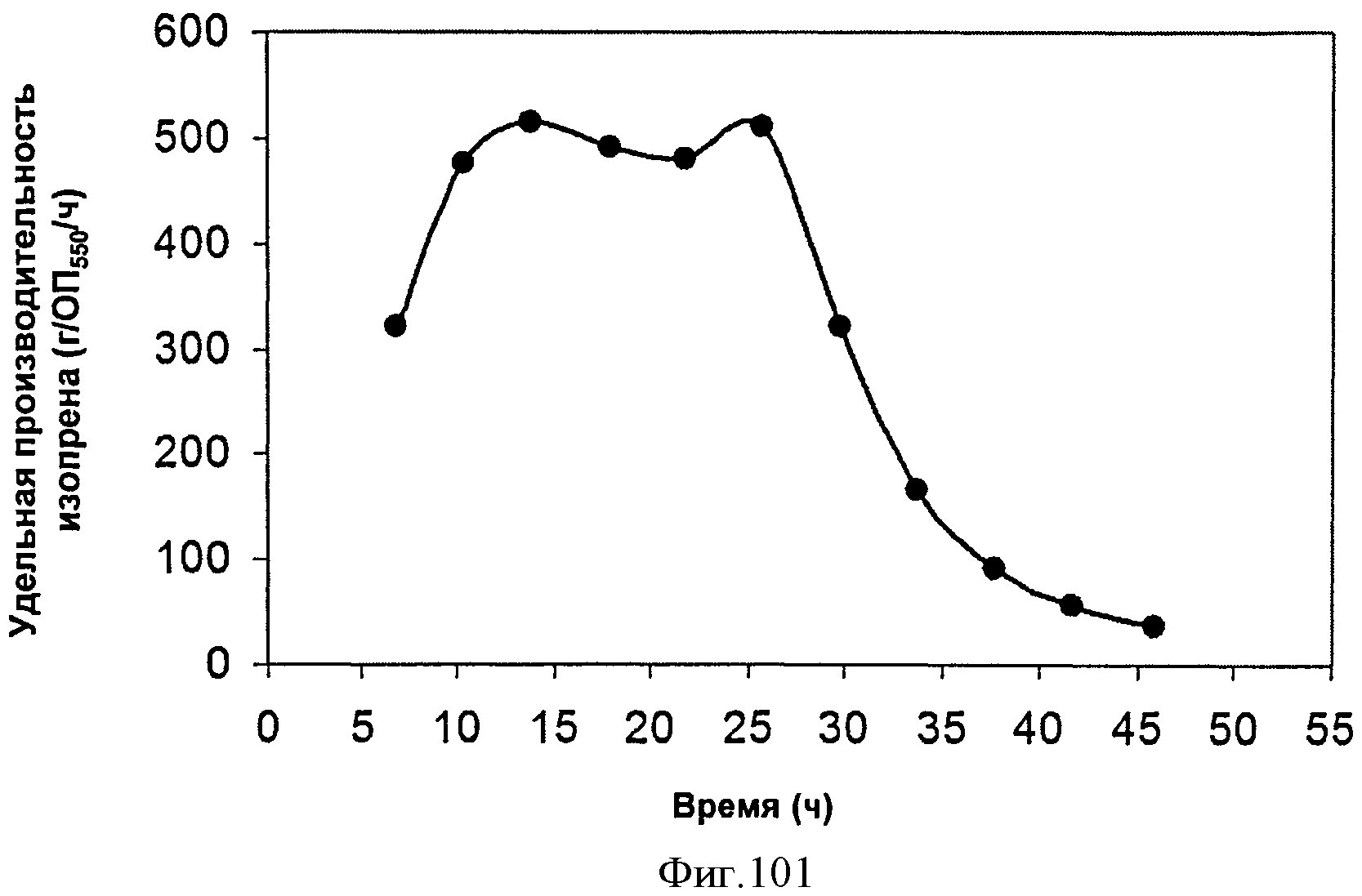
[0153] Фигуры 92А-92С представляют собой последовательность нуклеотидов pTrcHis2AUpperPathway (также называемой pTrcUpperMVA) (SEQ ID NO: 23).
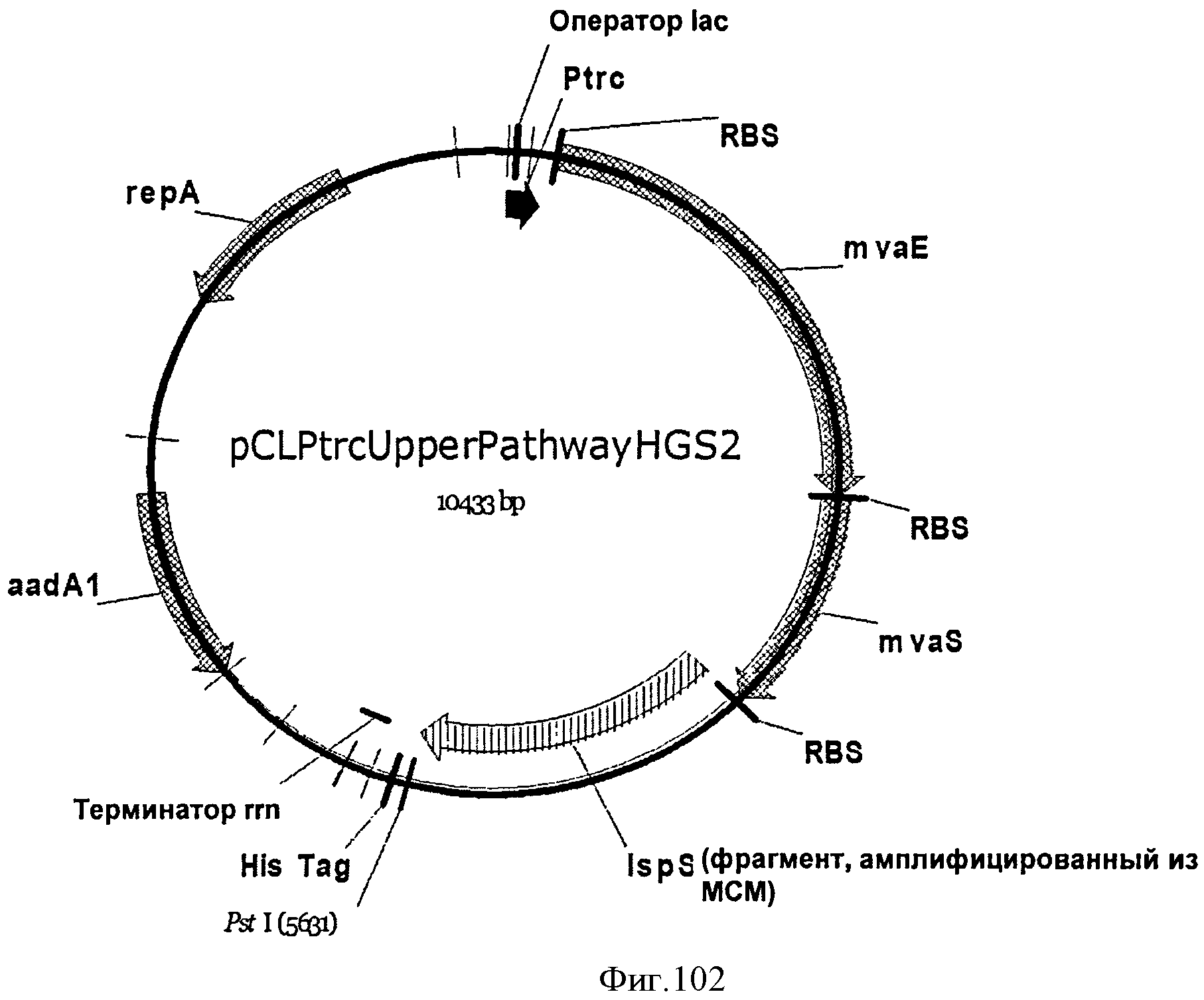
[0154] На Фигуре 93 представлена зависимость оптической плотности внутри 15 л биореактора, в который подавали глюкозу, от времени.
[0155] На Фигуре 94 представлена зависимость титра изопрена внутри 15 л биореактора, в который подавали глюкозу, от времени. Титр определяют как количество изопрена, продуцированного на литр ферментационного бульона.
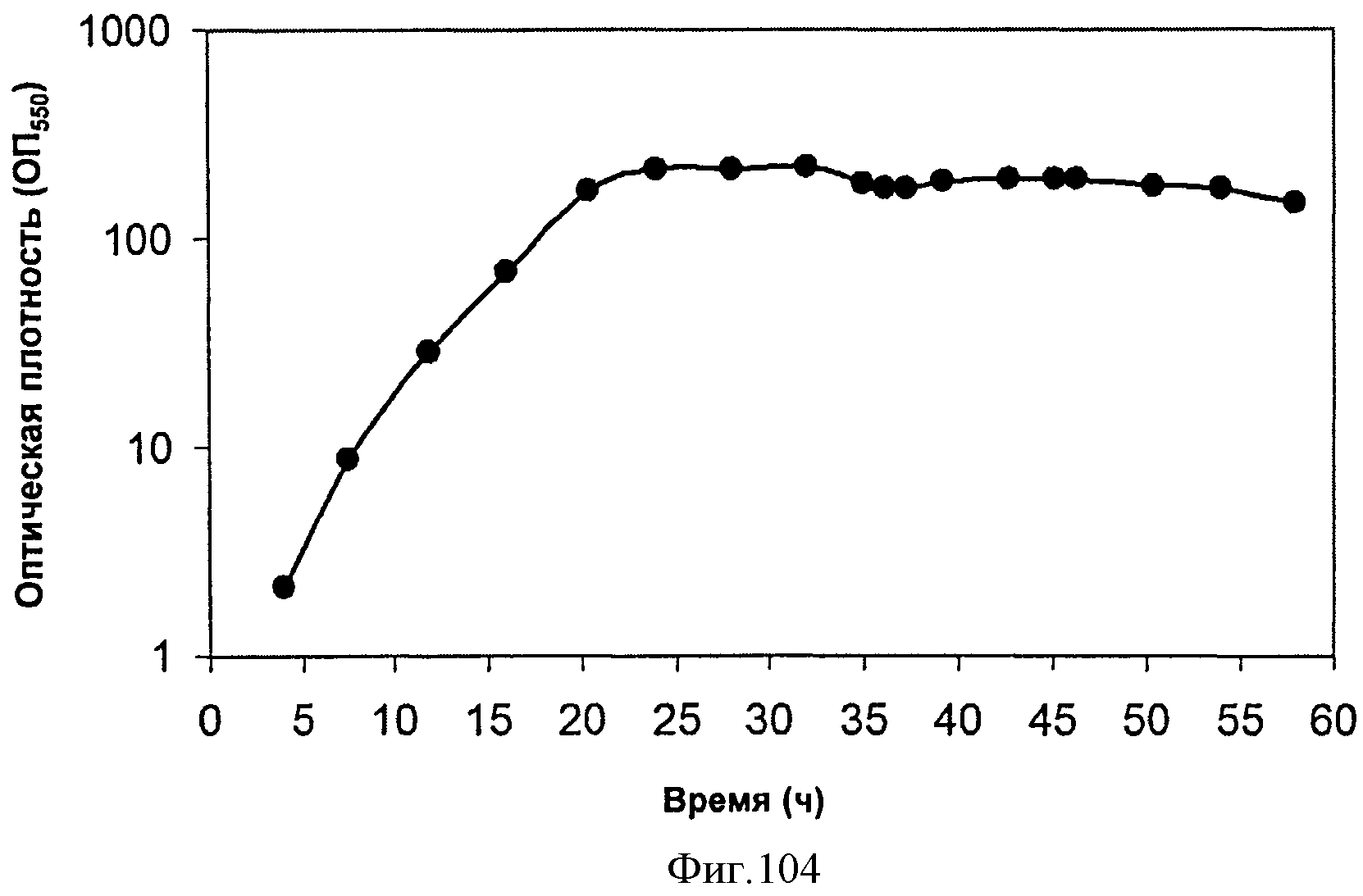
[0156] На Фигуре 95 представлена зависимость общего количества изопрена, полученного внутри 15 л биореактора, в который подавали глюкозу, от времени.
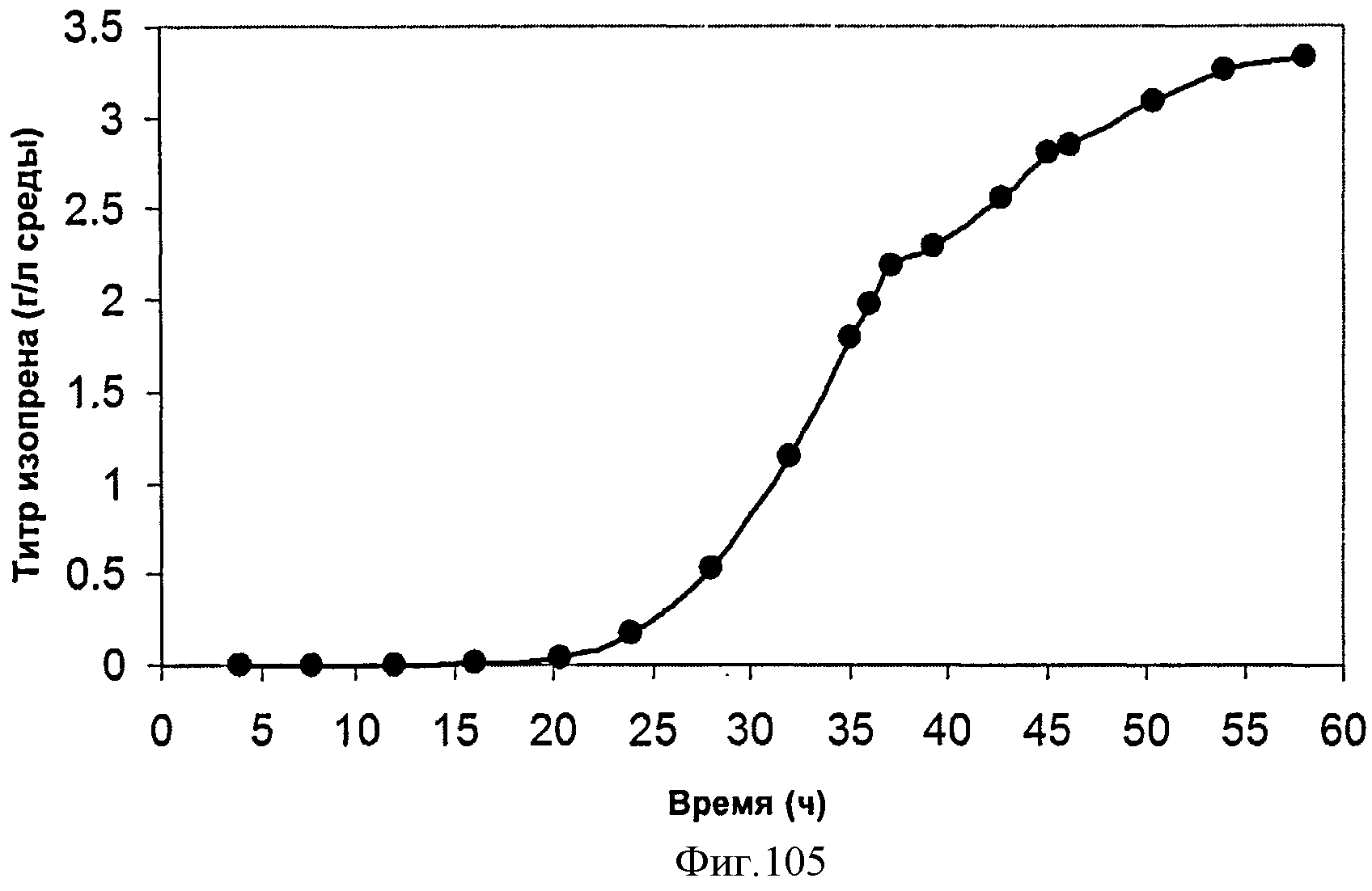
[0157] На Фигуре 96 представлена зависимость оптической плотности внутри 15 л биореактора, в который подавали инвертный сахар, от времени.
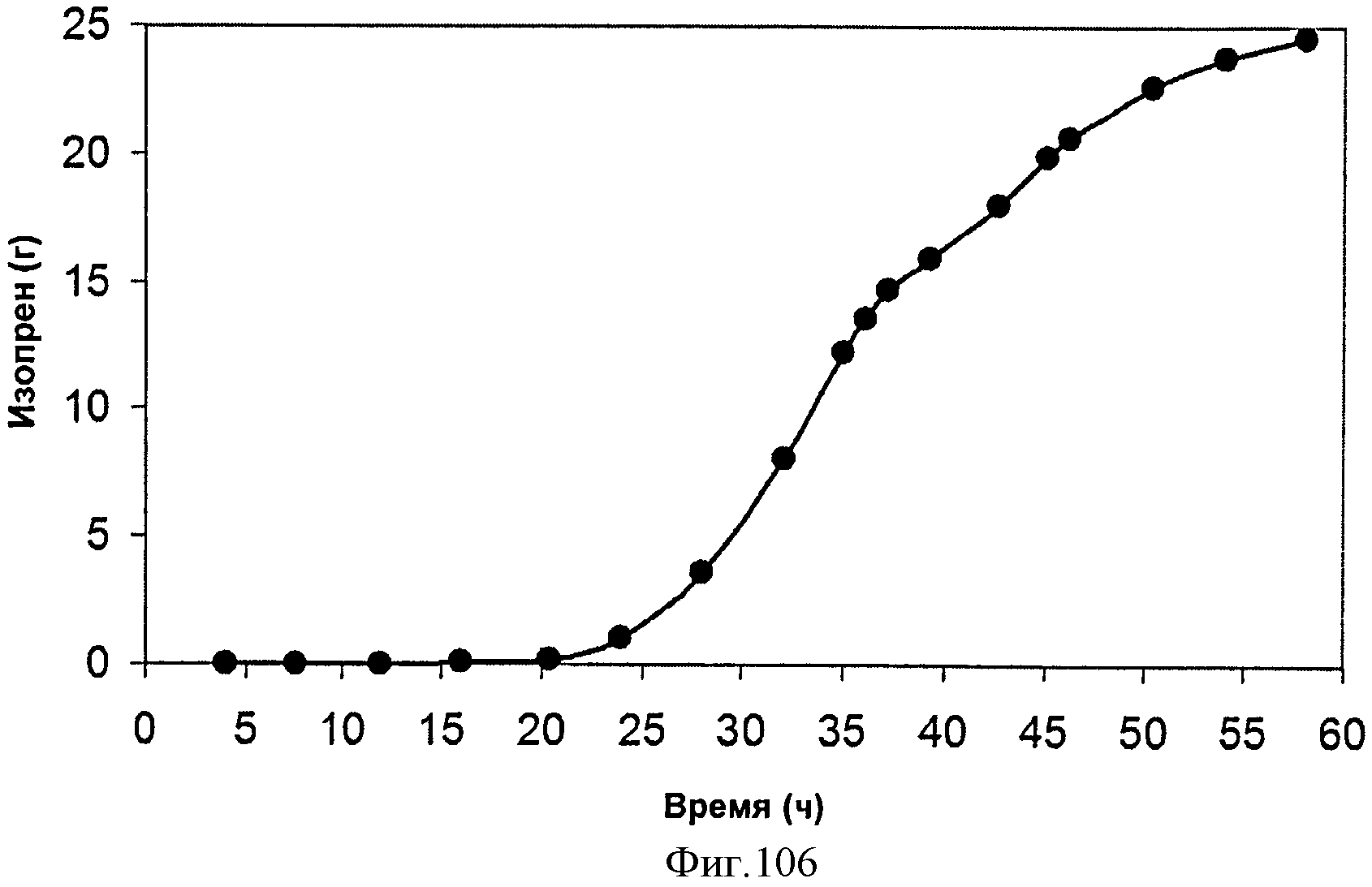
[0158] На Фигуре 97 представлена зависимость титра изопрена внутри 15 л биореактора, в который подавали инвертный сахар, от времени. Титр определяют как количество изопрена, продуцированного на литр ферментационного бульона.
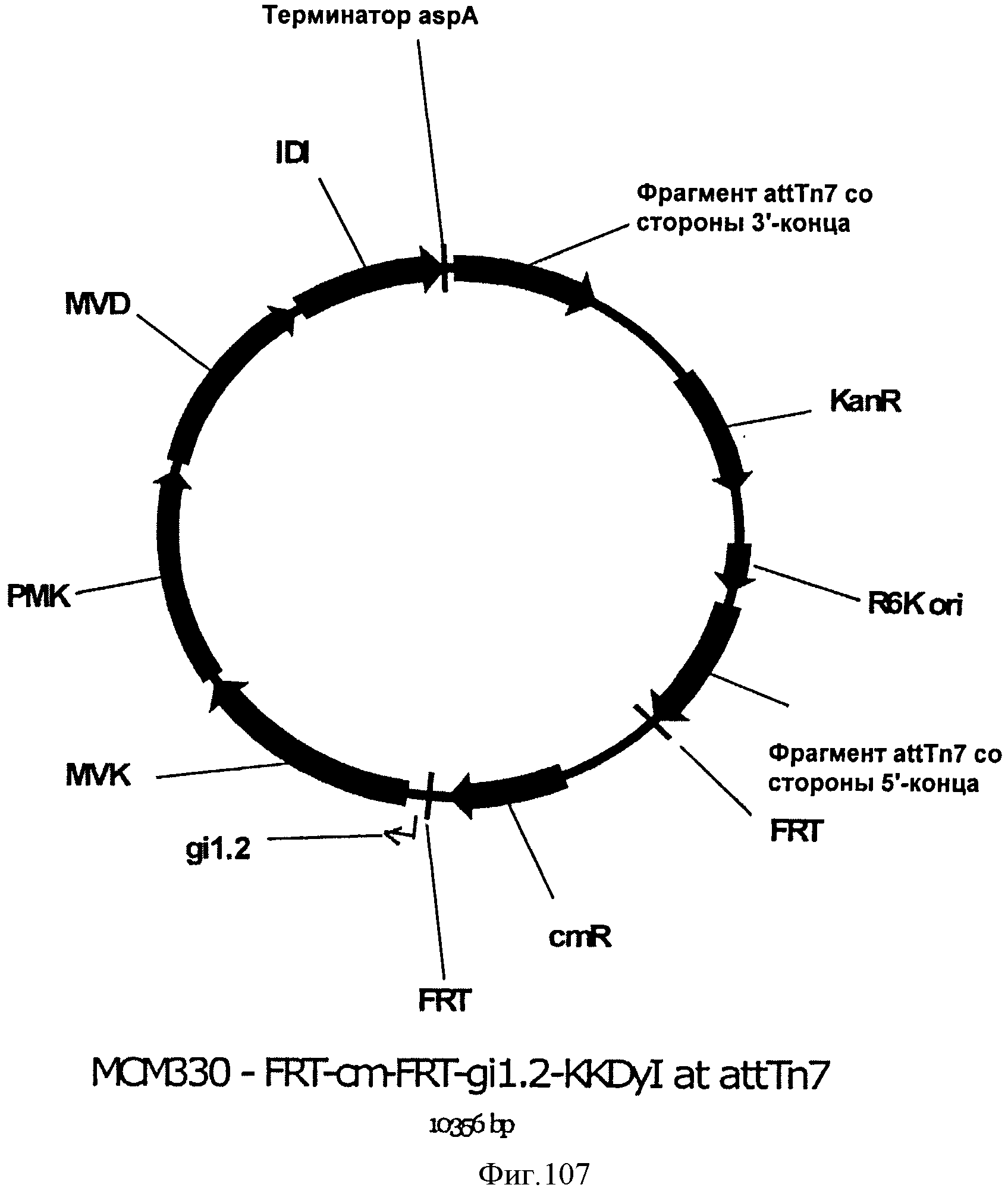
[0159] На Фигуре 98 представлена зависимость общего количества изопрена, полученного внутри 15 л биореактора, в который подавали инвертированный сахар, от времени.
[0160] На Фигуре 99 представлена зависимость оптической плотности внутри 15 л биореактора, в который подавали глюкозу, от времени.
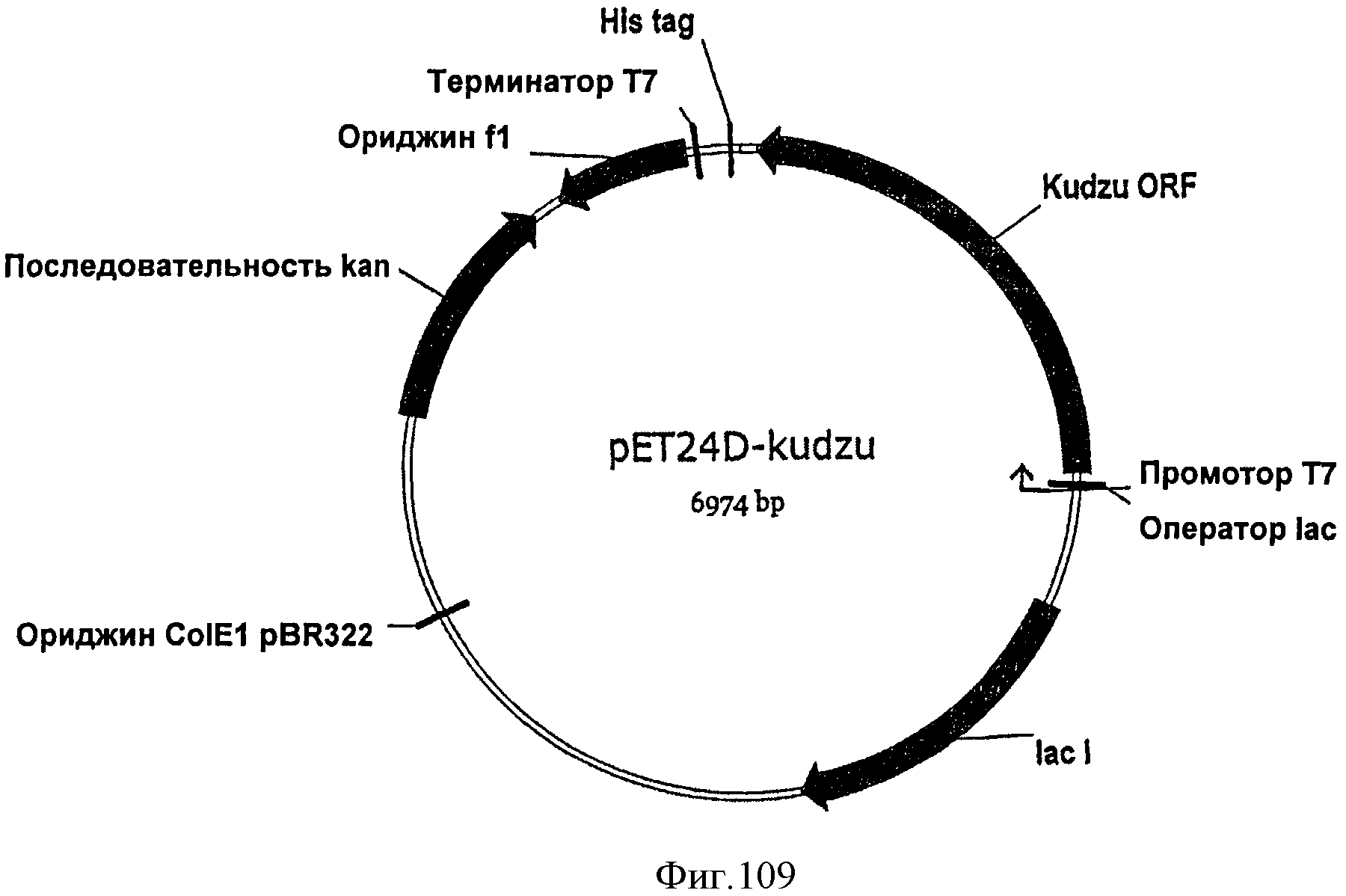
[0161] На Фигуре 100 представлена зависимость титра изопрена внутри 15 л биореактора, в который подавали глюкозу, от времени. Титр определяют как количество изопрена, продуцированного на литр ферментационного бульона.
[0162] На Фигуре 101 представлена зависимость удельной активности изопрена из 15 л биореактора, в который подавали глюкозу, от времени.
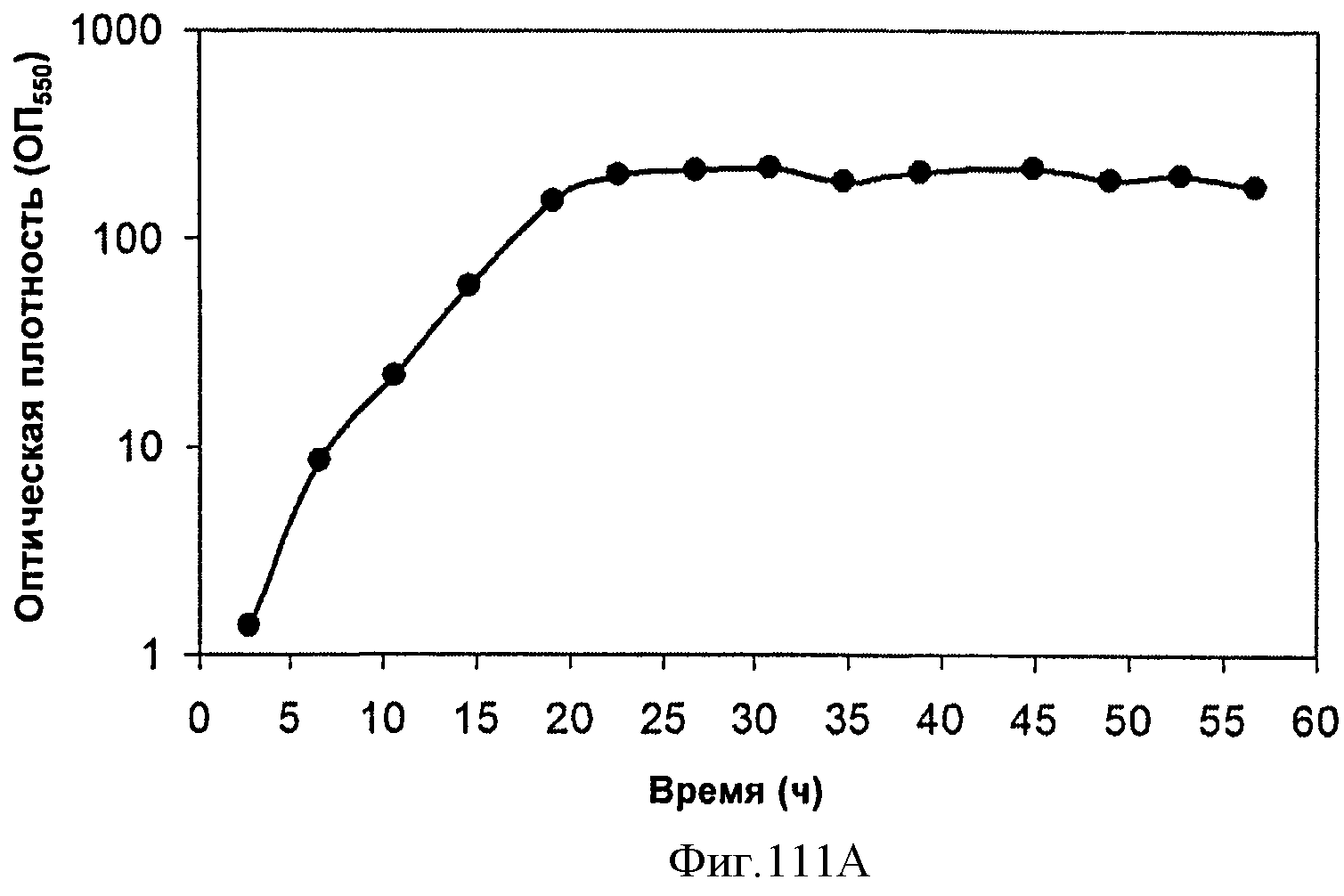
[0163] Фигура 102 представляет собой карту pCLPtrcUpperPathwayHGS2.
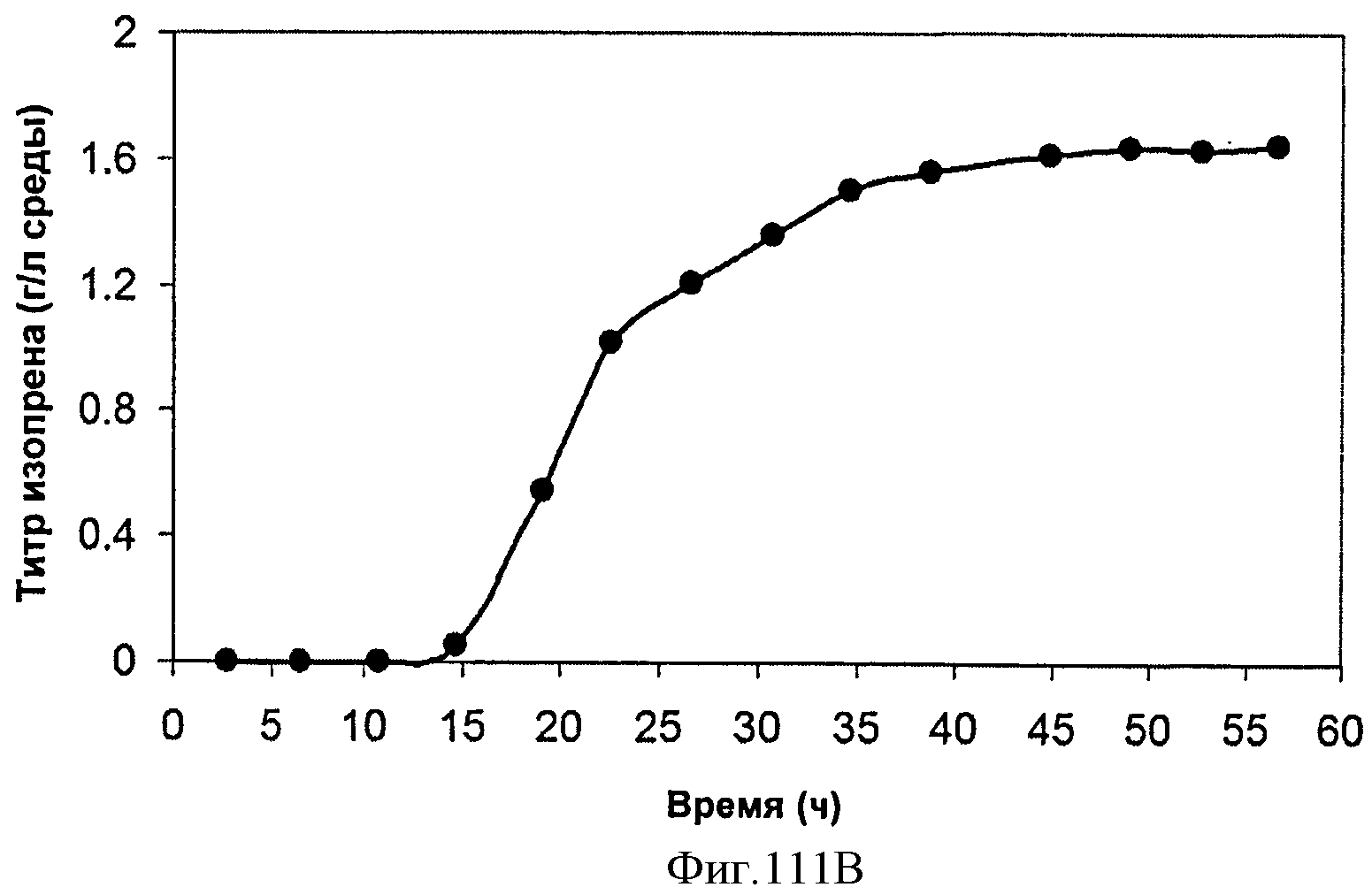
[0164] Фигуры 103А-103С представляют собой последовательность нуклеотидов pCLPtrcUpperPathwayHGS2 (SEQ ID NO: 24).
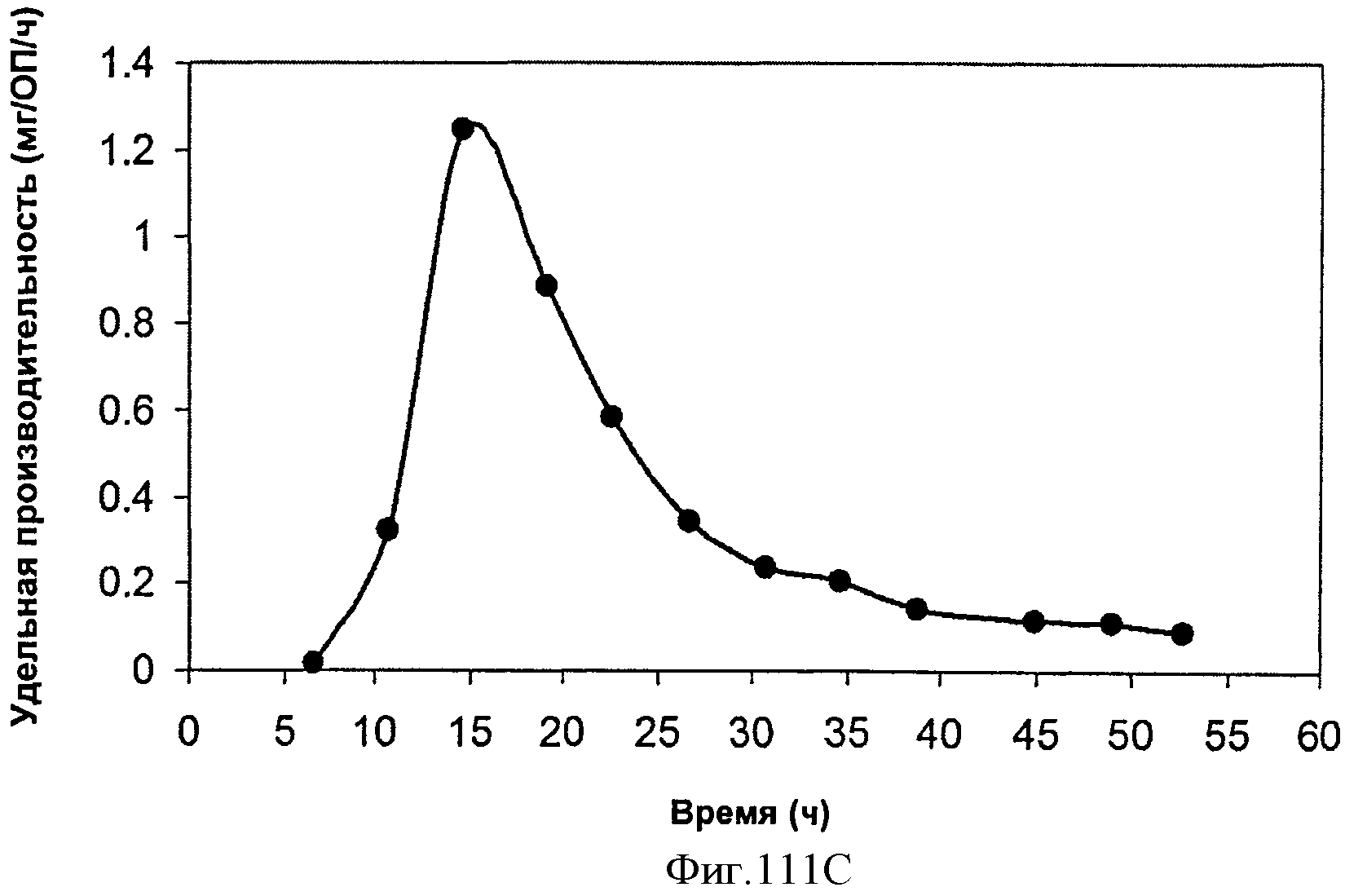
[0165] На Фигуре 104 представлена зависимость оптической плотности внутри 15 л биореактора, в который подавали глюкозу, от времени.
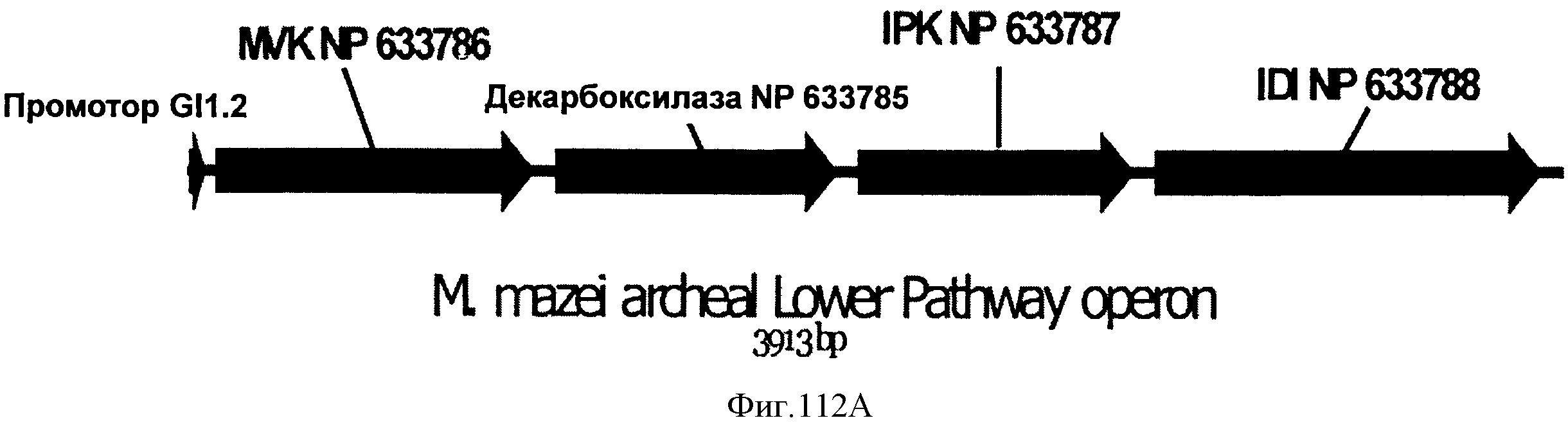
[0166] На Фигуре 105 представлена зависимость титра изопрена внутри 15 л биореактора, в который подавали глюкозу, от времени. Титр определяют как количество изопрена, продуцированного на литр ферментационного бульона.
[0167] На Фигуре 106 представлена зависимость содержания изопрена, полученного внутри 15 л биореактора, в который подавали глюкозу, от времени.
[0168] Фигура 107 представляет собой карту плазмиды МСМ330 (FRT-cm-FRT-gil.2-KKDy at attTn7).
[0169] Фигуры 108А-108С представляют собой последовательность нуклеотидов плазмиды МСМ330 (SEQ ID NO: 25).
[0170] Фигура 109 представляет собой карту pET24D-Kudzu.
[0171] Фигуры 110А-В представляют собой последовательность нуклеотидов pET24D-Kudzu (SEQ ID NO: 26).
[0172] На Фигуре 111А представлена зависимость оптической плотности внутри 15 л биореактора, в который подавали глюкозу, от времени.
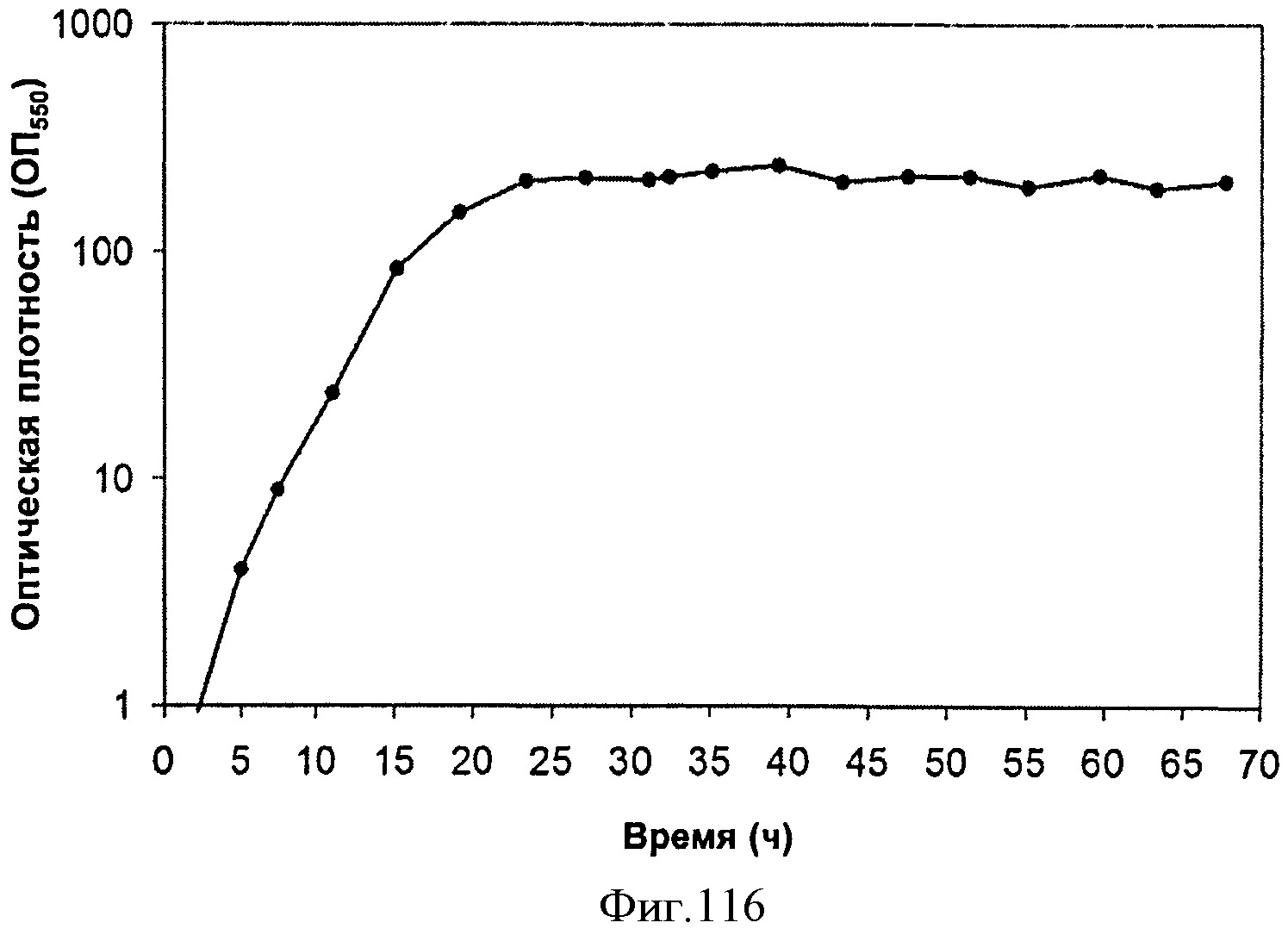
[0173] На Фигуре 111 В представлена зависимость титра изопрена внутри 15 л биореактора, в который подавали глюкозу, от времени. Титр определяют как количество изопрена, продуцированного на литр ферментационного бульона.
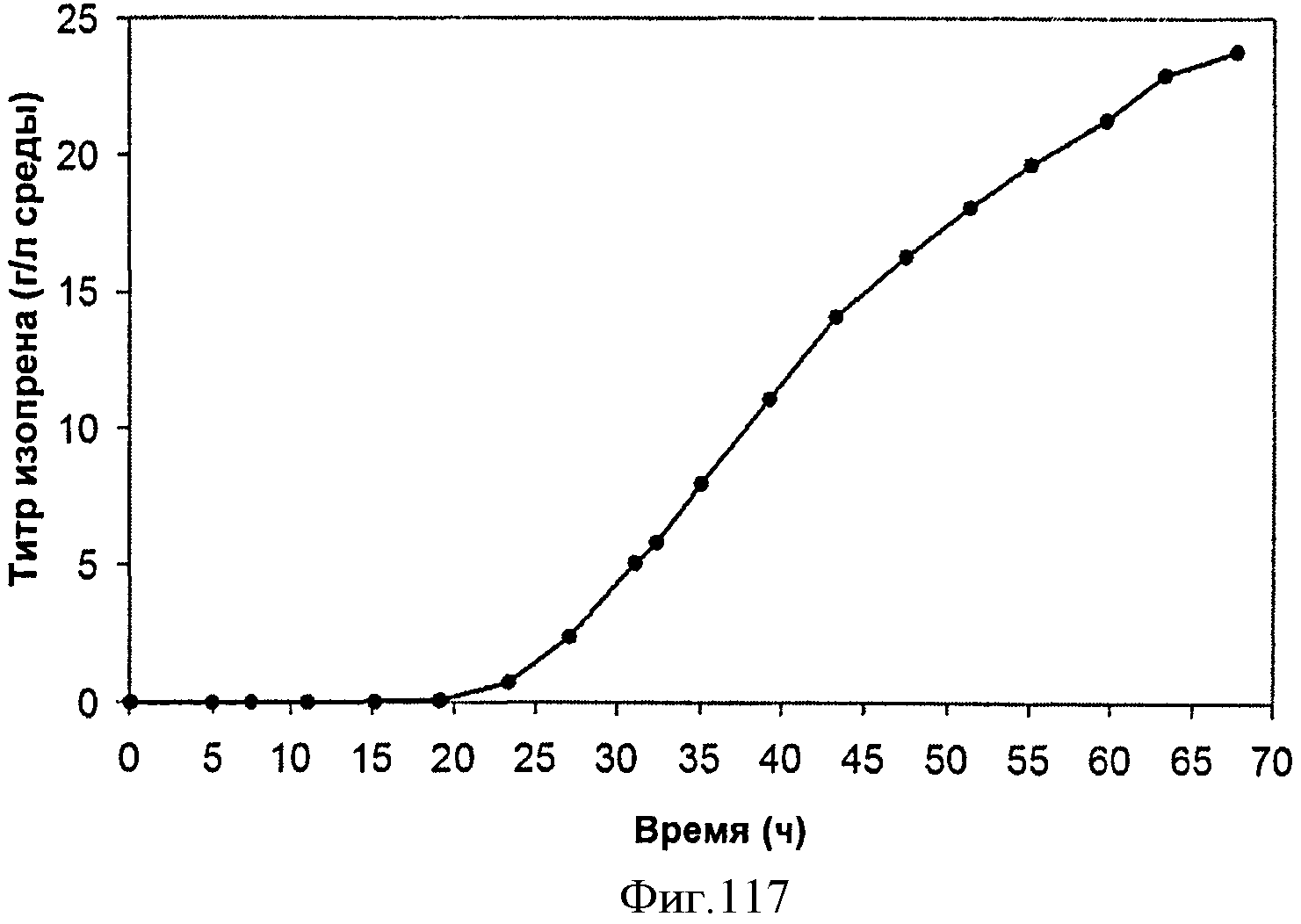
[0174] На Фигуре 111C представлена зависимость удельной производительности в отношении изопрена в 15 л биореакторе, в который подавали глюкозу, от времени.
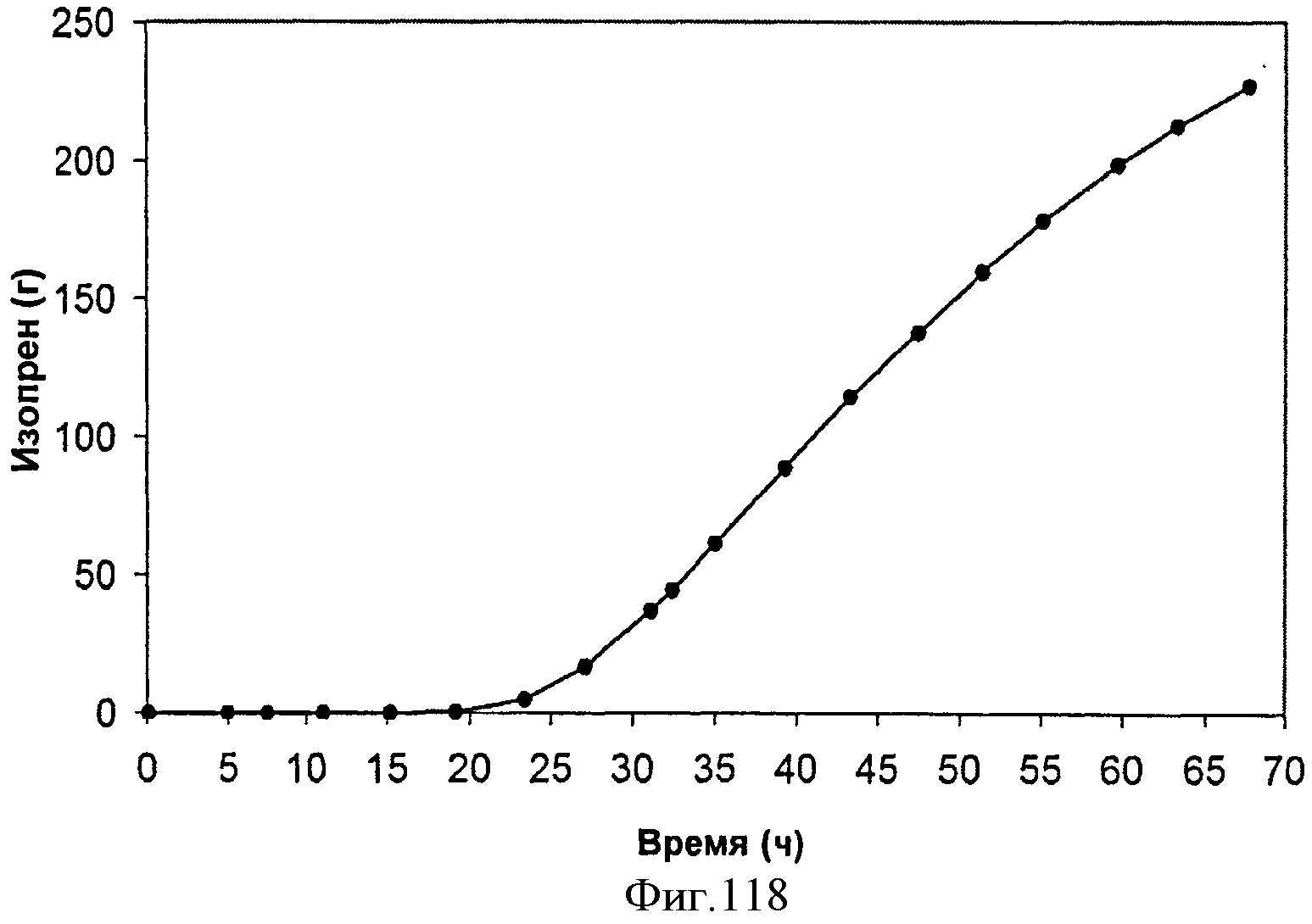
[0175] Фигура 112А представляет собой карту оперона нижнего пути (Lower Pathway) археи М. maw,
[0176] Фигуры 112 В-С представляют собой последовательность нуклеотидов оперона нижнего пути (Lower Pathway) археи М. maw (SEQ ID NO: 27).
[0177] Фигура 113А представляет собой карту МСМ382 - pTrcKudzuMVK(mazei).
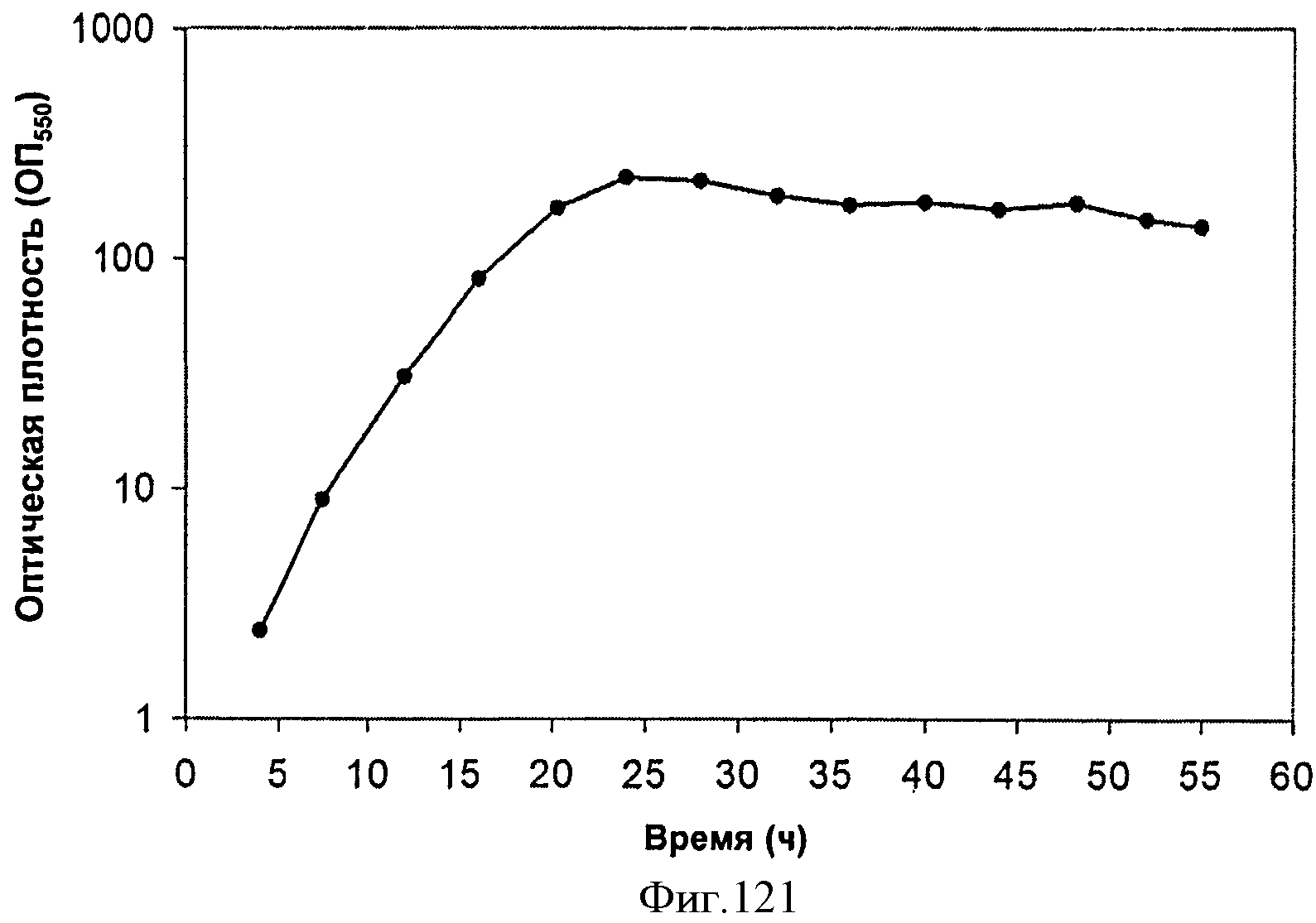
[0178] Фигуры 113 В-С представляют собой последовательность нуклеотидов МСМ382 - pTrcKudzuMVK(mazei) (SEQ ID NO: 28).
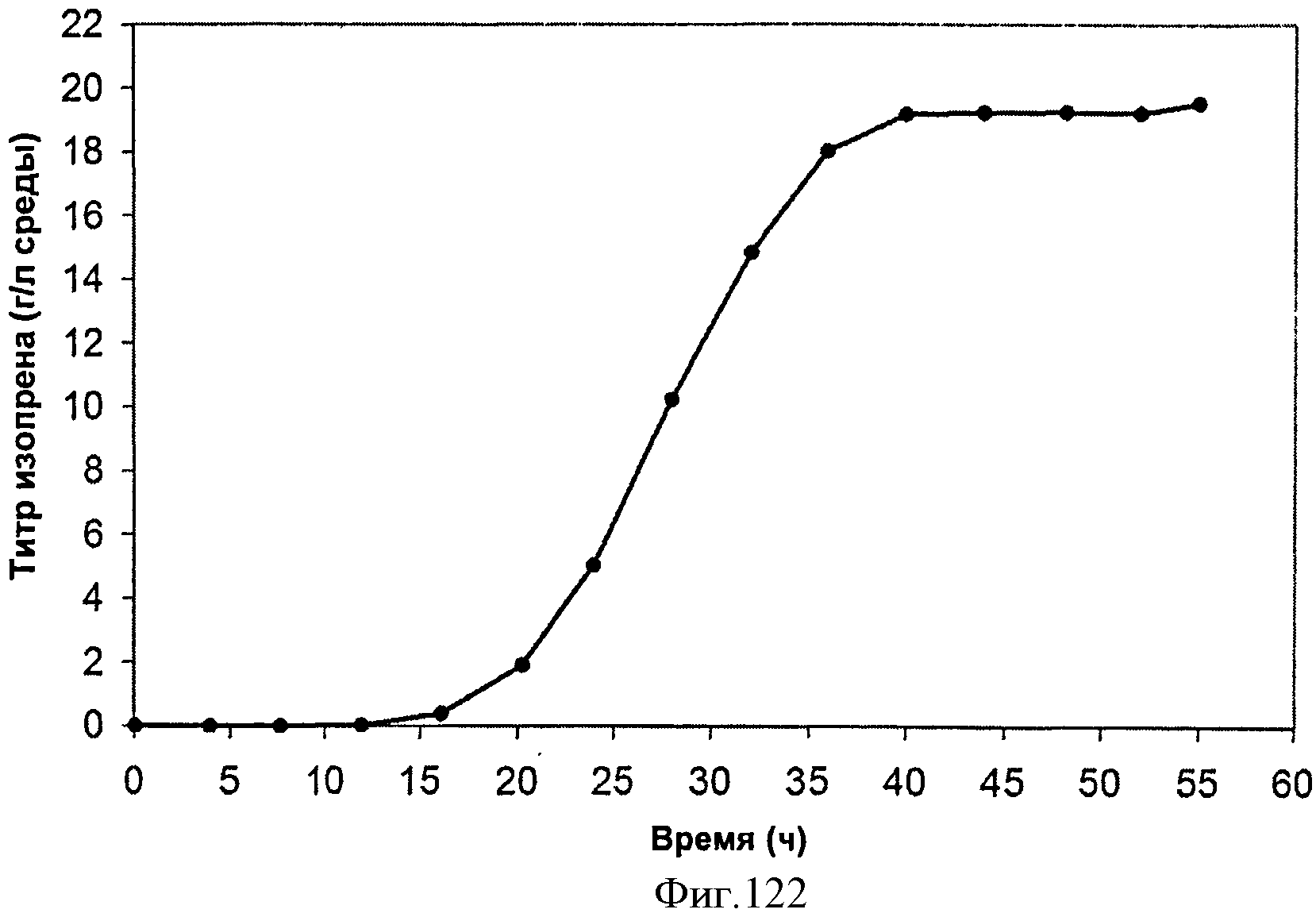
[0179] Фигура 114А представляет собой карту МСМ376 - MVK из нижнего пути археи М. mazei в pET200D.
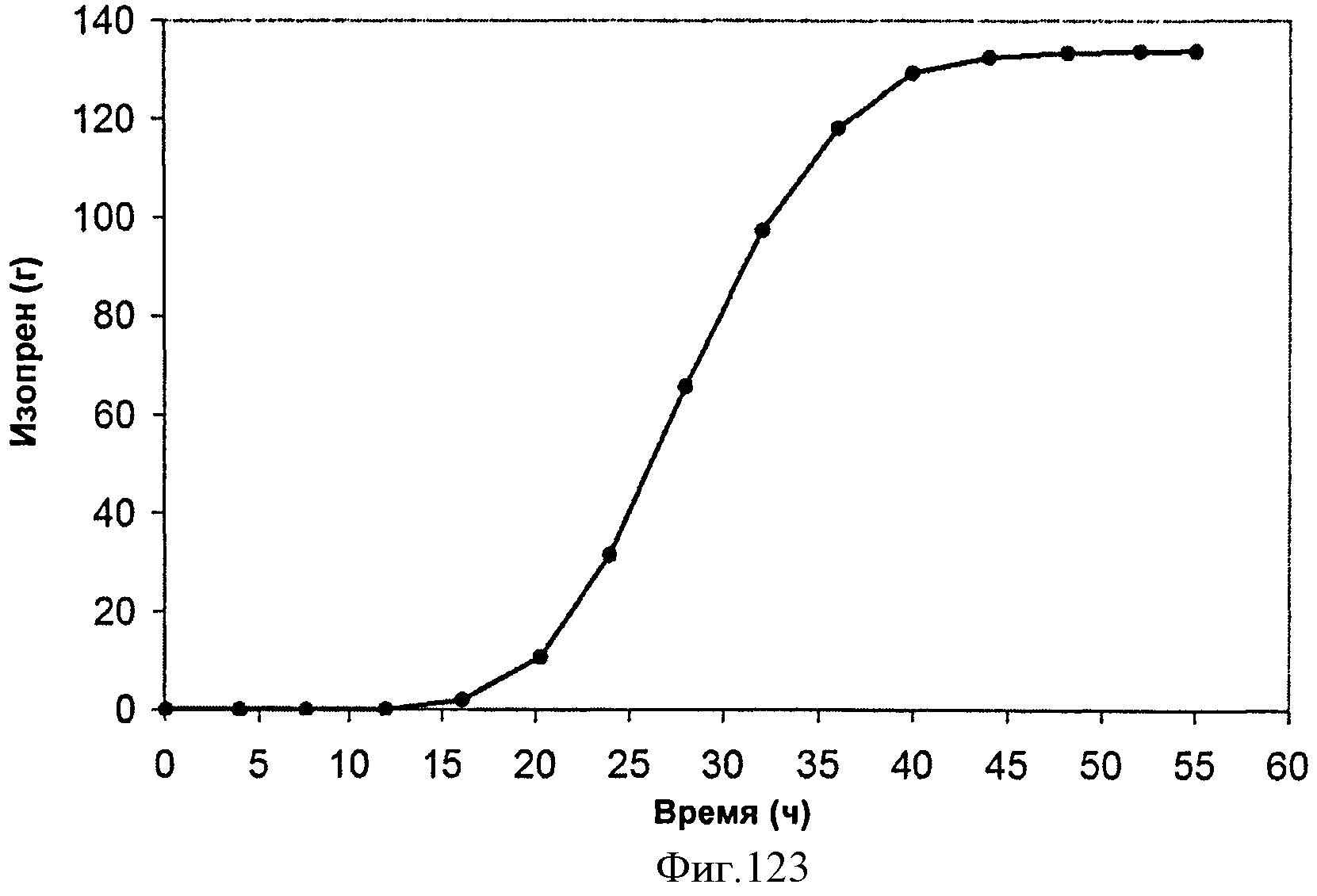
[0180] Фигуры 114 В-С представляют собой последовательность нуклеотидов МСМ376 - MVK из нижнего пути археи М. mazei в pET200D (SEQ ID NO: 29).
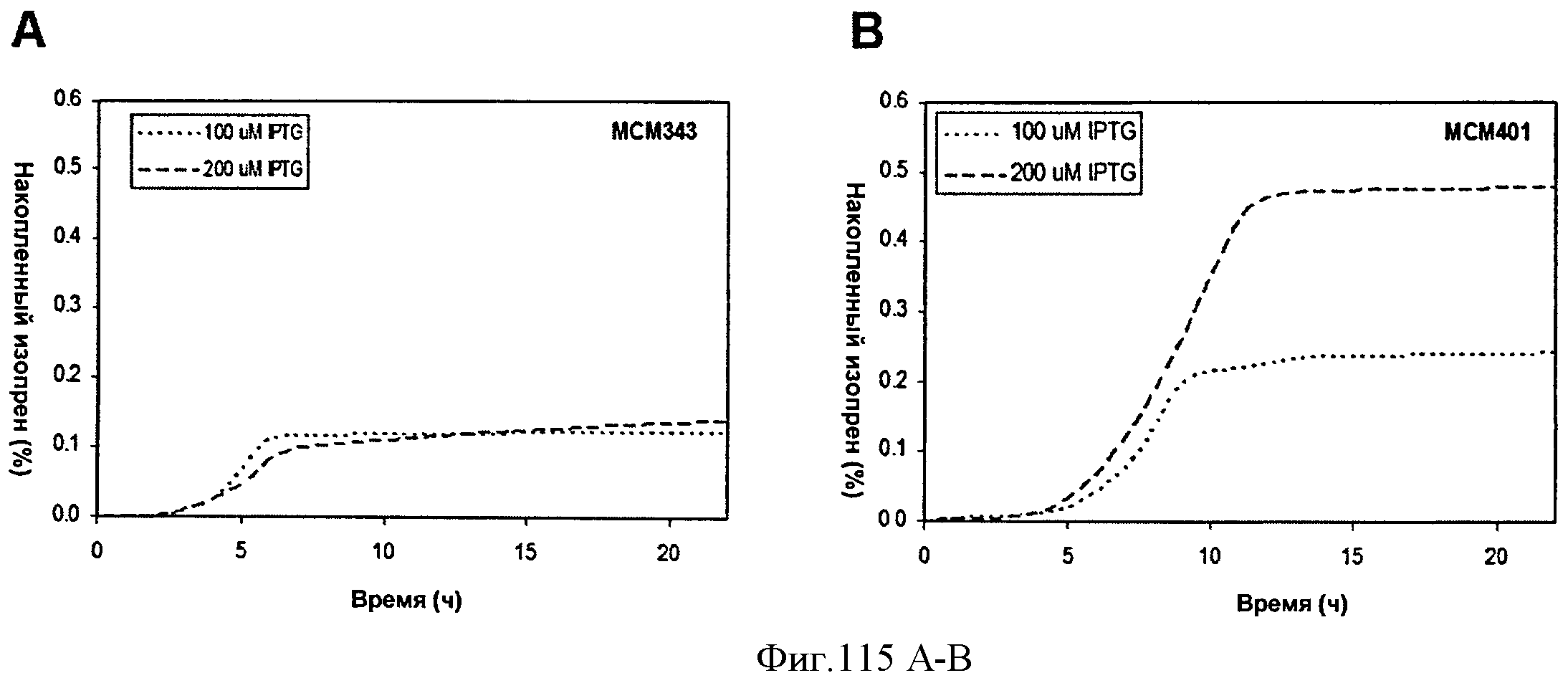
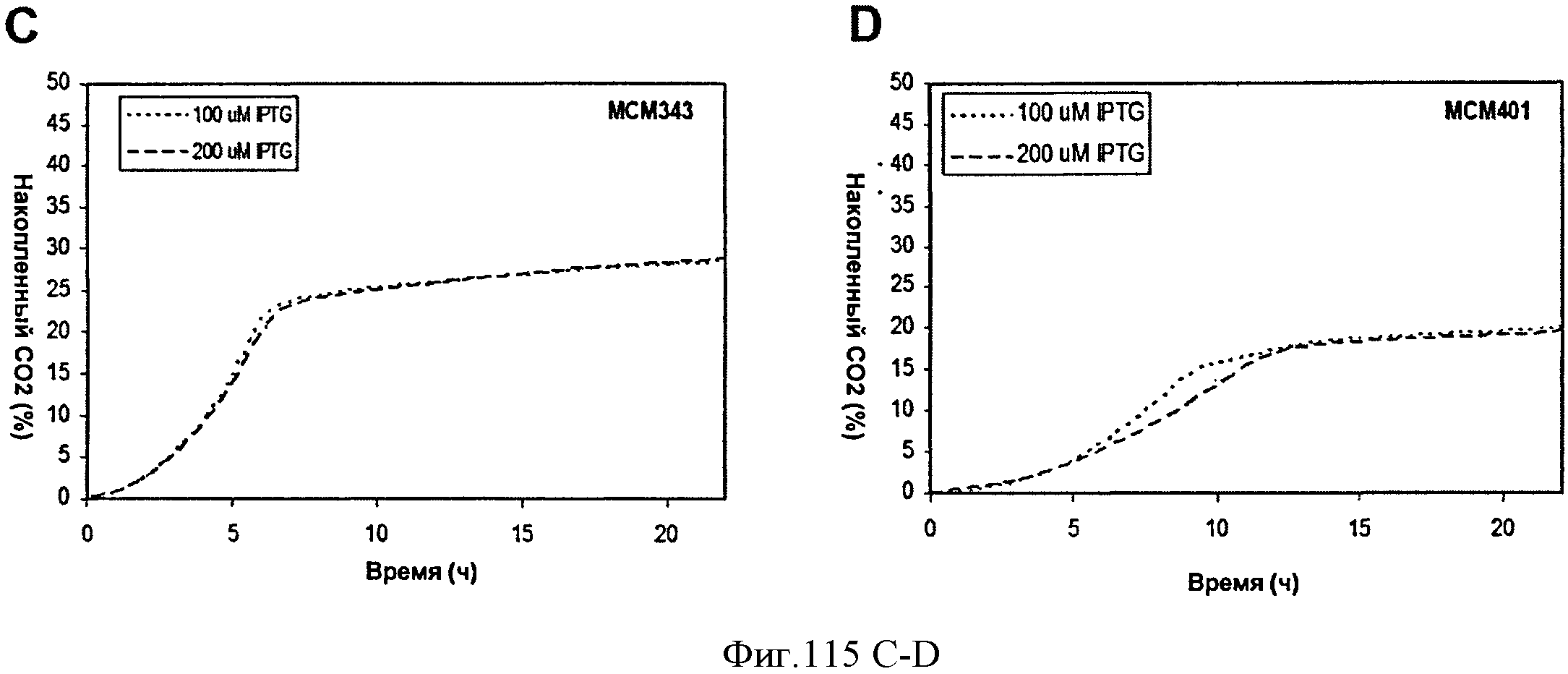
[0181] Фигуры 115A-115D демонстрируют, что повышенная экспрессия MVK и изопренсинтазы приводит к повышенной продукции изопрена. Накопленный изопрен и СО2 из МСМ401 и МСМ343 в процессе роста на глюкозе в 100 мл биореакторах с индукцией продукции изопрена 100 и 200 мкМ IPTG измеряли на протяжении 22 часов. Фигура 115А представляет собой график накопленного изопрена (%) из МСМ343. Фигура 115 В представляет собой график накопленного изопрена (%) из МСМ401. Фигура 115С представляет собой график накопленного CO2 (%) из МСМ343. Фигура 115D представляет собой график накопленного СОз (%) из МСМ401.
[0182] На Фигуре 116 представлена зависимость оптической плотности внутри 15 л биореактора, в который подавали глюкозу, от времени.
[0183] На Фигуре 117 представлена зависимость титра изопрена внутри 15 л биореактора, в который подавали глюкозу, от времени. Титр определяют как количество полученного изопрена на литр ферментационного бульона.
[0184] На Фигуре 118 представлена зависимость общего количества изопрена, полученного внутри 15 л биореактора, в который подавали глюкозу, от времени.
[0185] Фигура 119 представляет собой график общей скорости выделения диоксида углерода (TCER), или профиль метаболической активности, внутри 15 л биореактора, в который подавали глюкозу.
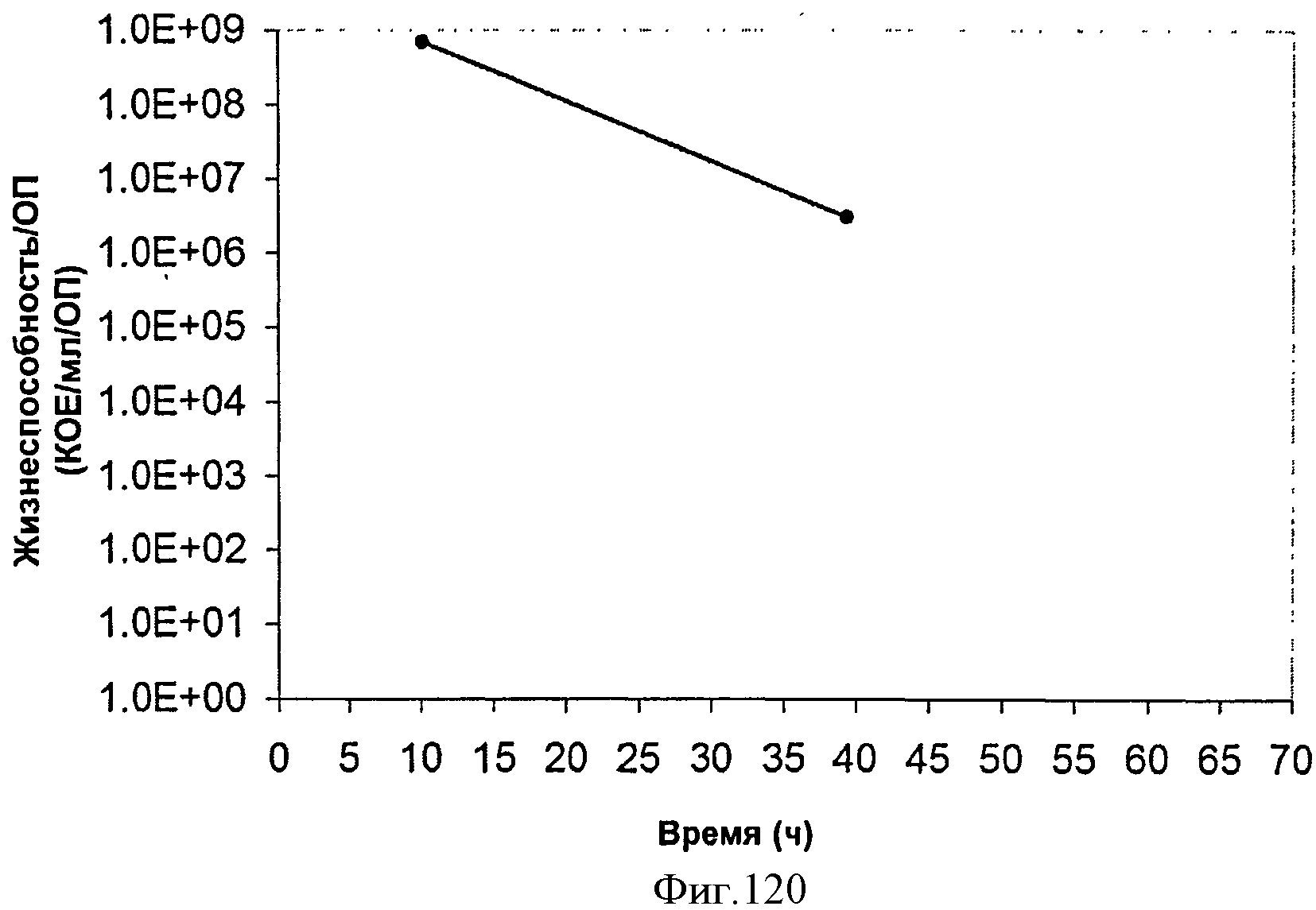
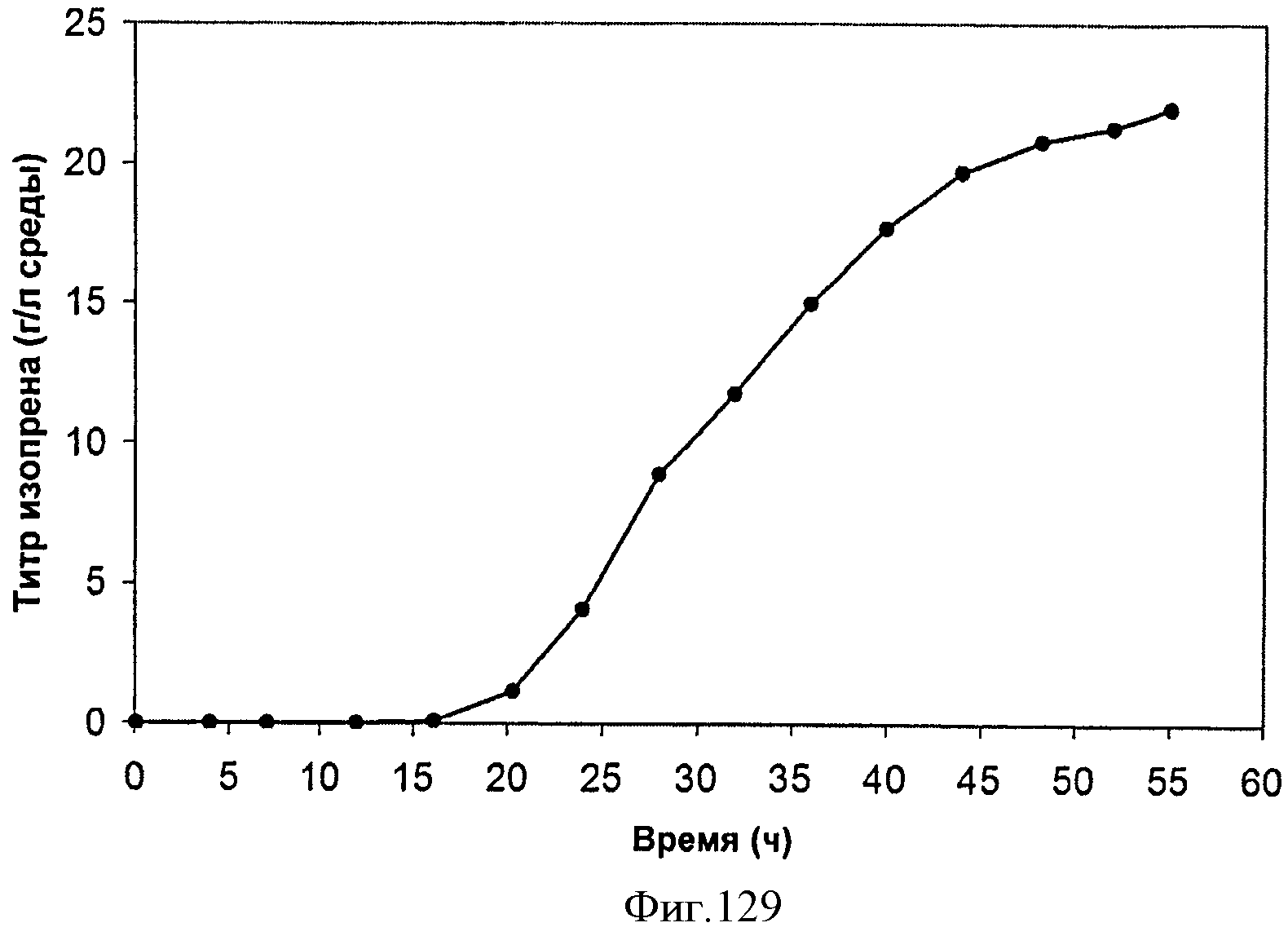
[0186] Фигура 120 представляет собой график жизнеспособности клеток во время продукции изопрена внутри 15 л биореактора, в который подавали глюкозу. TVC/ОП представляет собой общее количество жизнеспособных организмов (колониеобразующие единицы) в 1 мл бульона на единицу оптической плотности (ОП550).
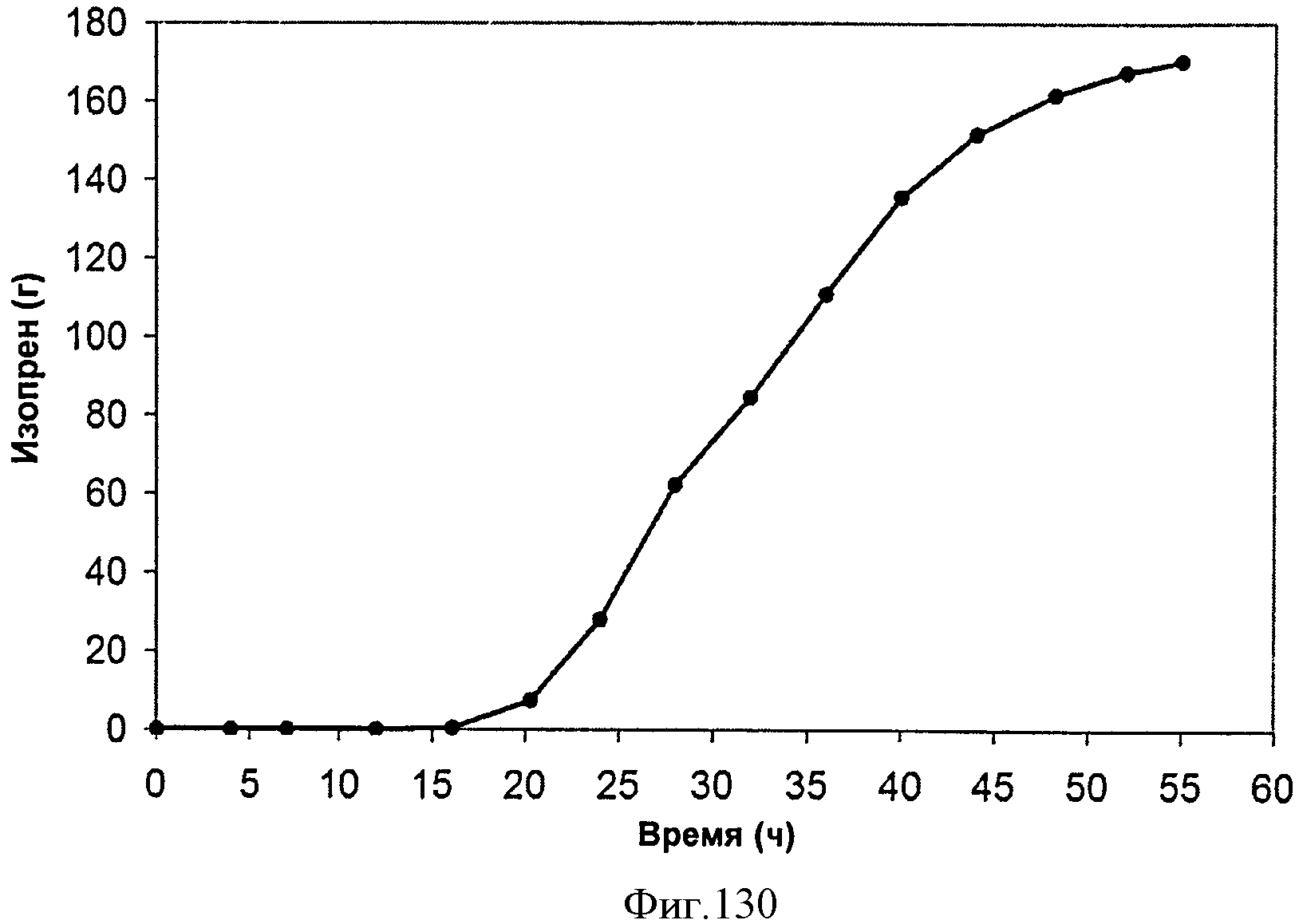
[0187] На Фигуре 121 представлена зависимость оптической плотности внутри 15 л биореактора, в который подавали глюкозу, от времени.
[0188] На Фигуре 122 представлена зависимость титра изопрена внутри 15 л биореактора, в который подавали глюкозу, от времени. Титр определяют как количество изопрена, продуцированного на литр ферментационного бульона.
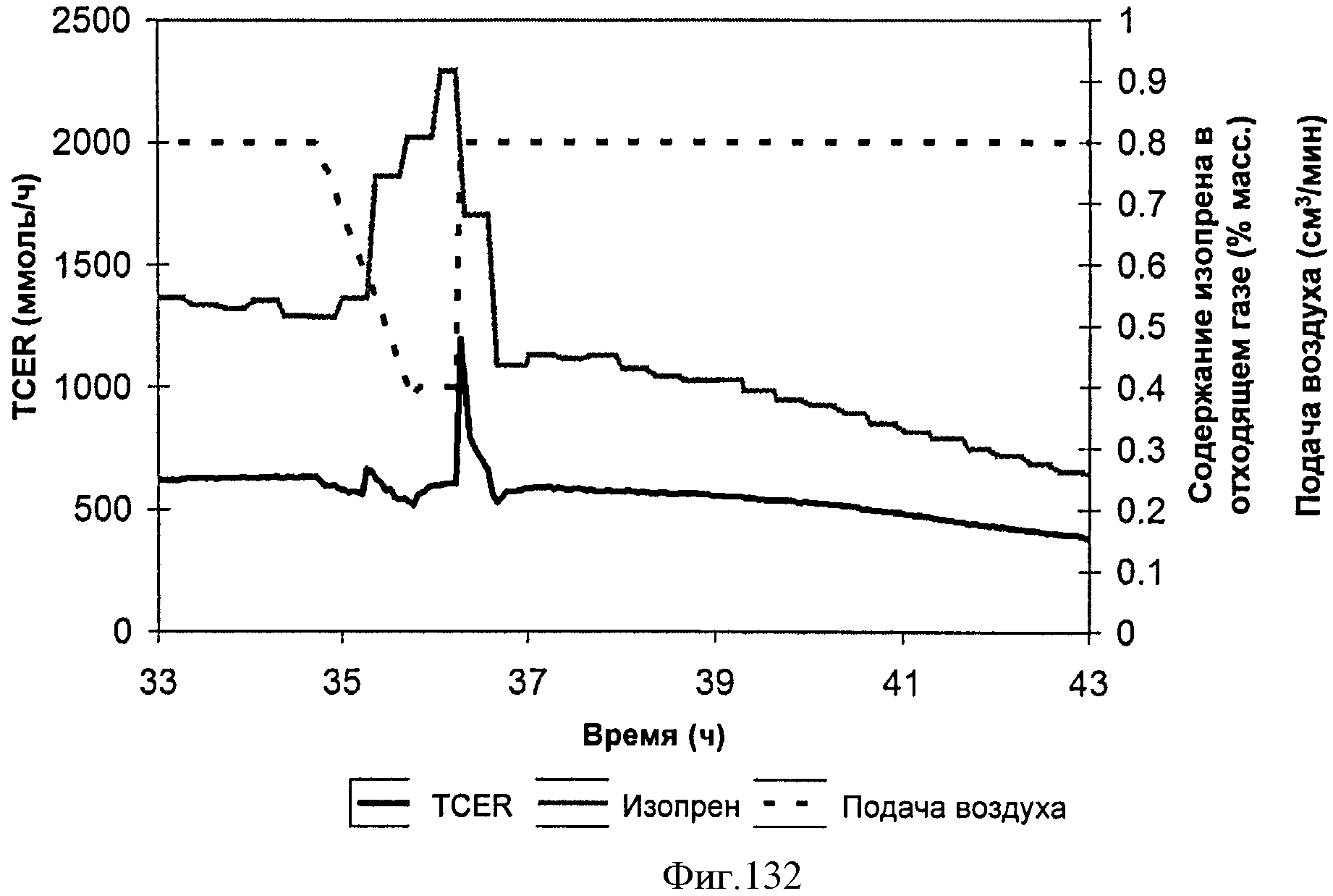
[0189] На Фигуре 123 представлена зависимость общего количества изопрена, полученного внутри 15 л биореактора, в который подавали глюкозу, от времени.
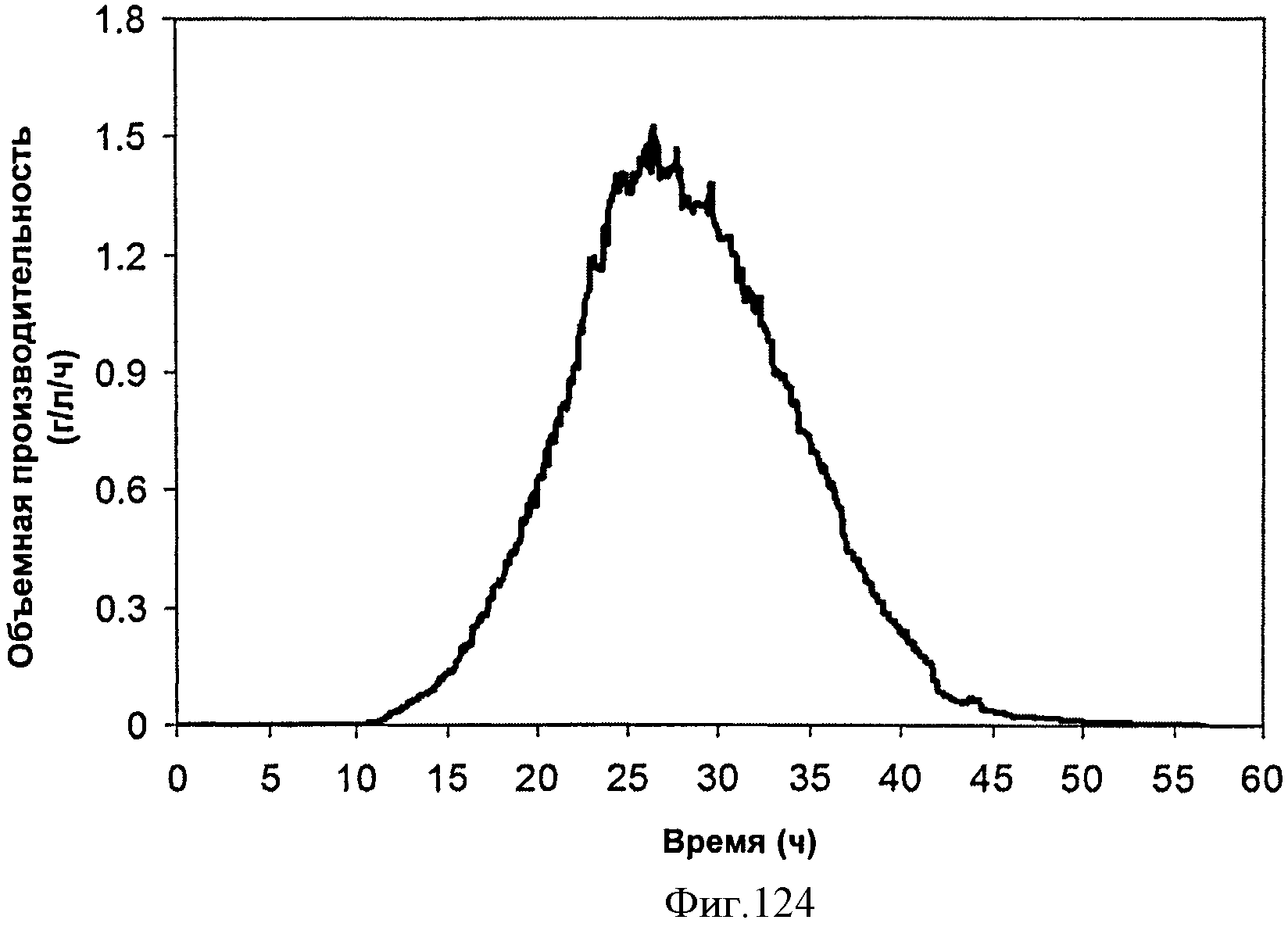
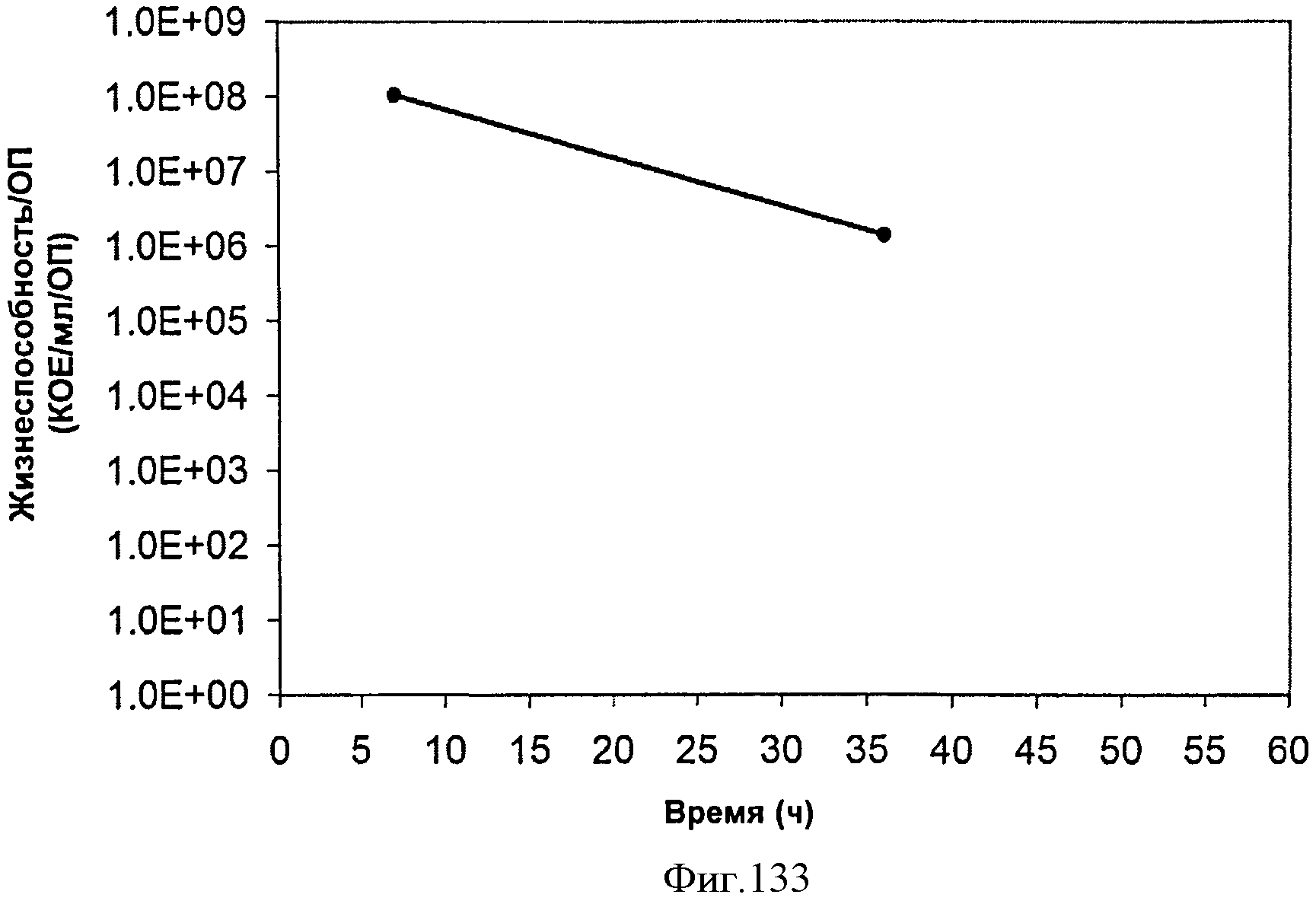
[0190] На Фигуре 124 представлена зависимость объемной производительности внутри 15 л биореактора, в который подавали глюкозу. Объемную производительность определяют как количество изопрена, продуцированного на литр бульона в час.
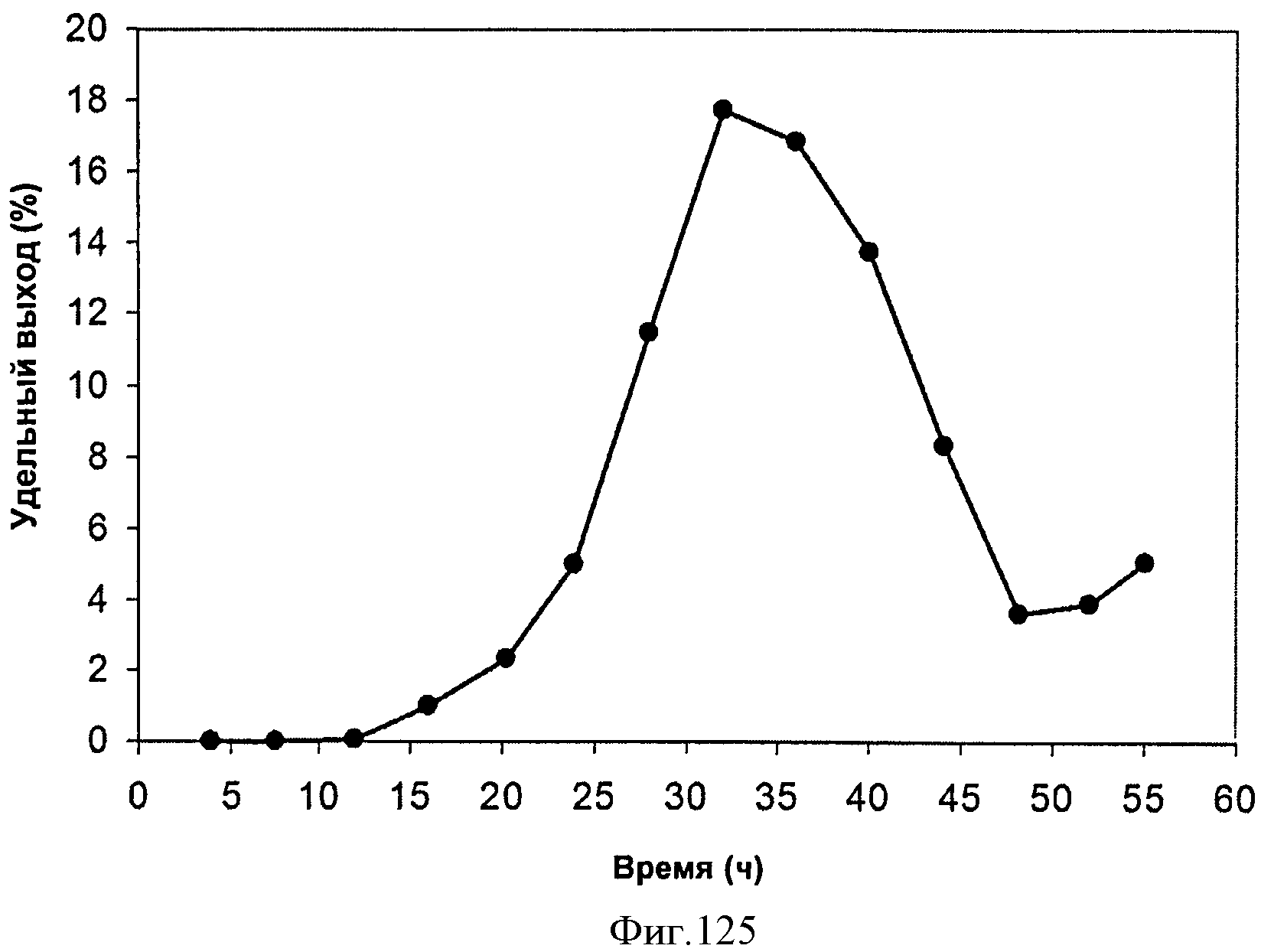
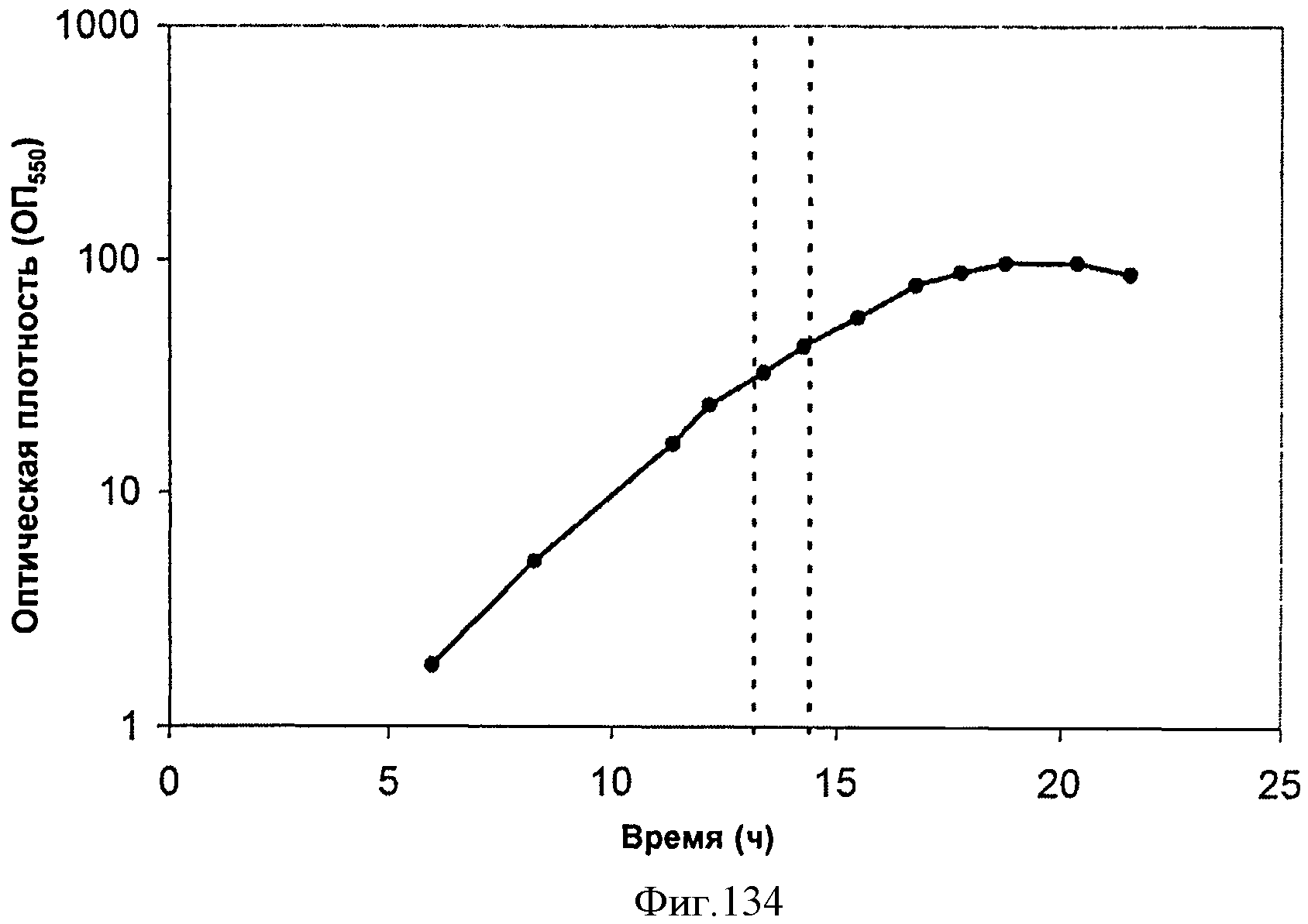
[0191] На Фигуре 125 представлена зависимость мгновенного выхода внутри 15 л биореактора, в который подавали глюкозу. Мгновенный выход определяют как количество изопрена (граммы), продуцированного на количество глюкозы (граммы), которое подали в биореактор (масс./масс.) за промежуток времени между экспериментальными точками.
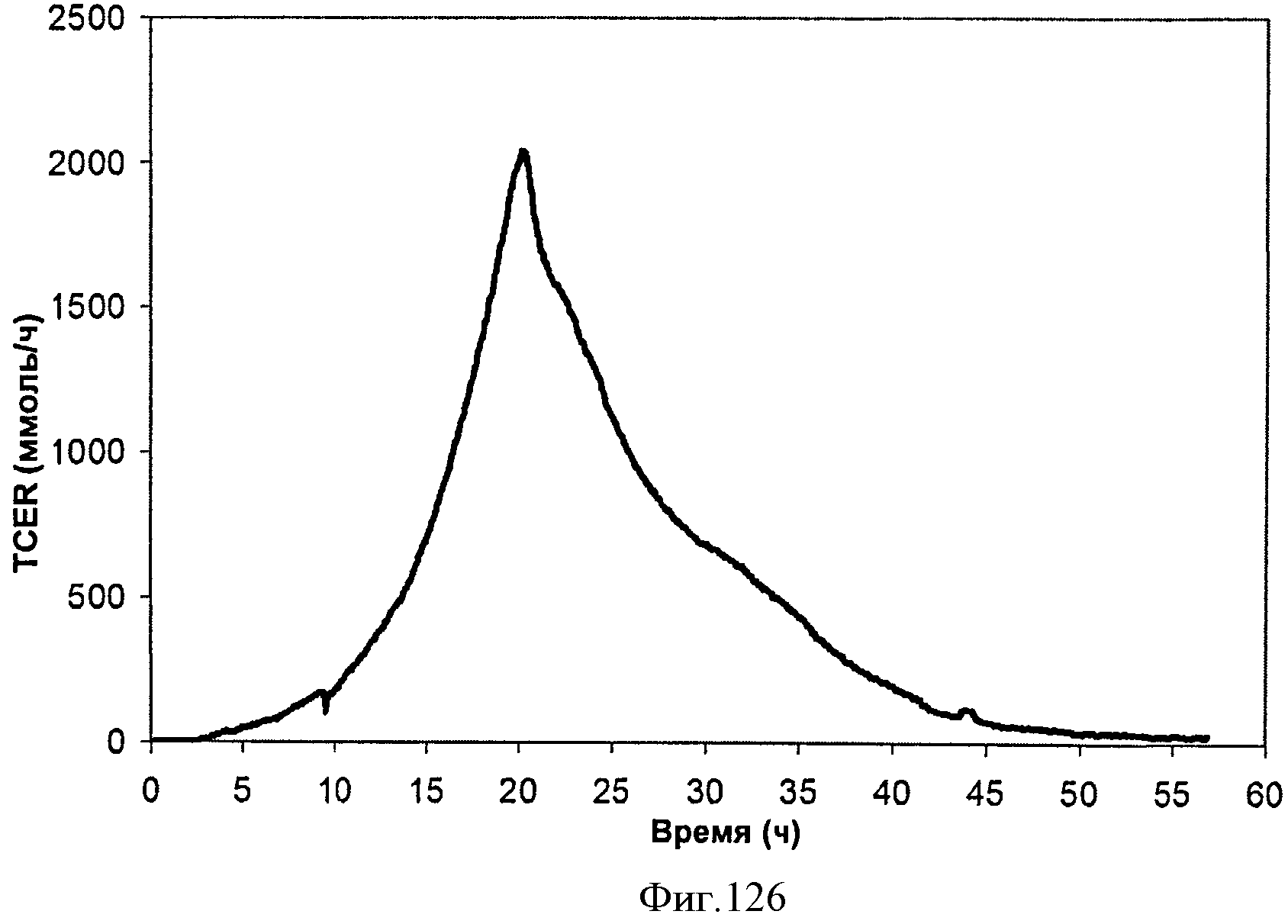
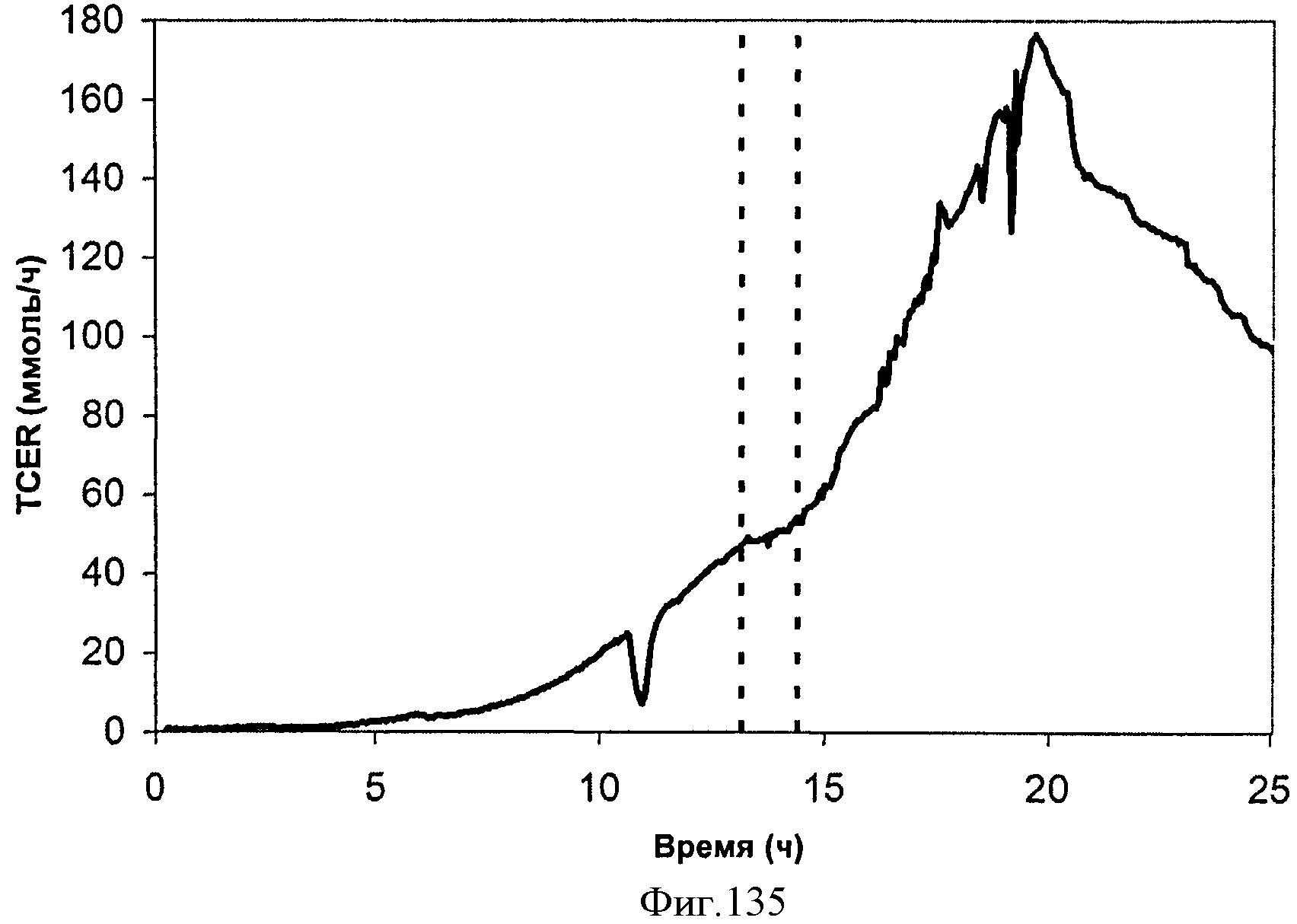
[0192] Фигура 126 представляет собой график общей скорости выделения диоксида углерода (TCER), или профиль метаболической активности, внутри 15 л биореактора, в который подавали глюкозу.
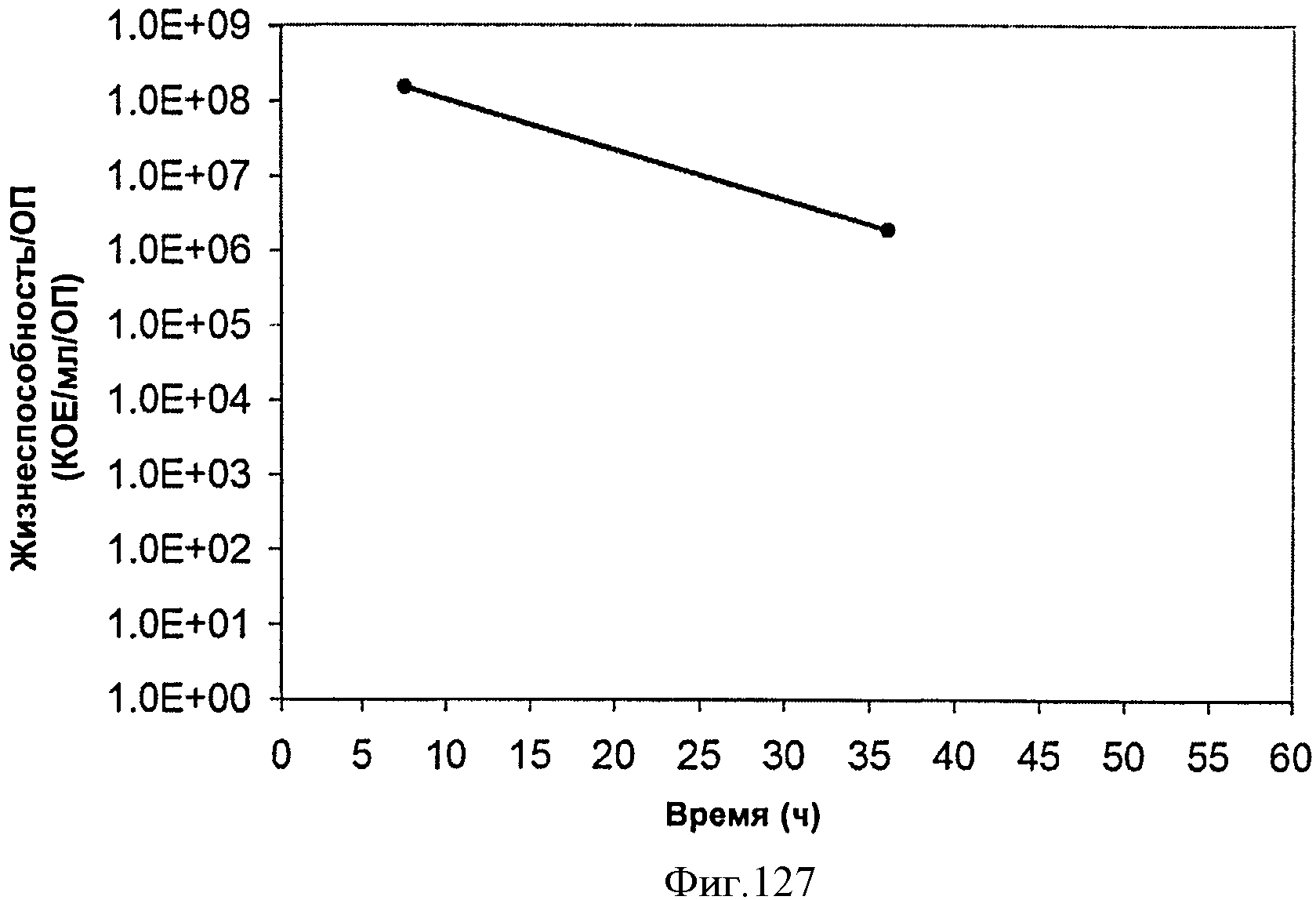
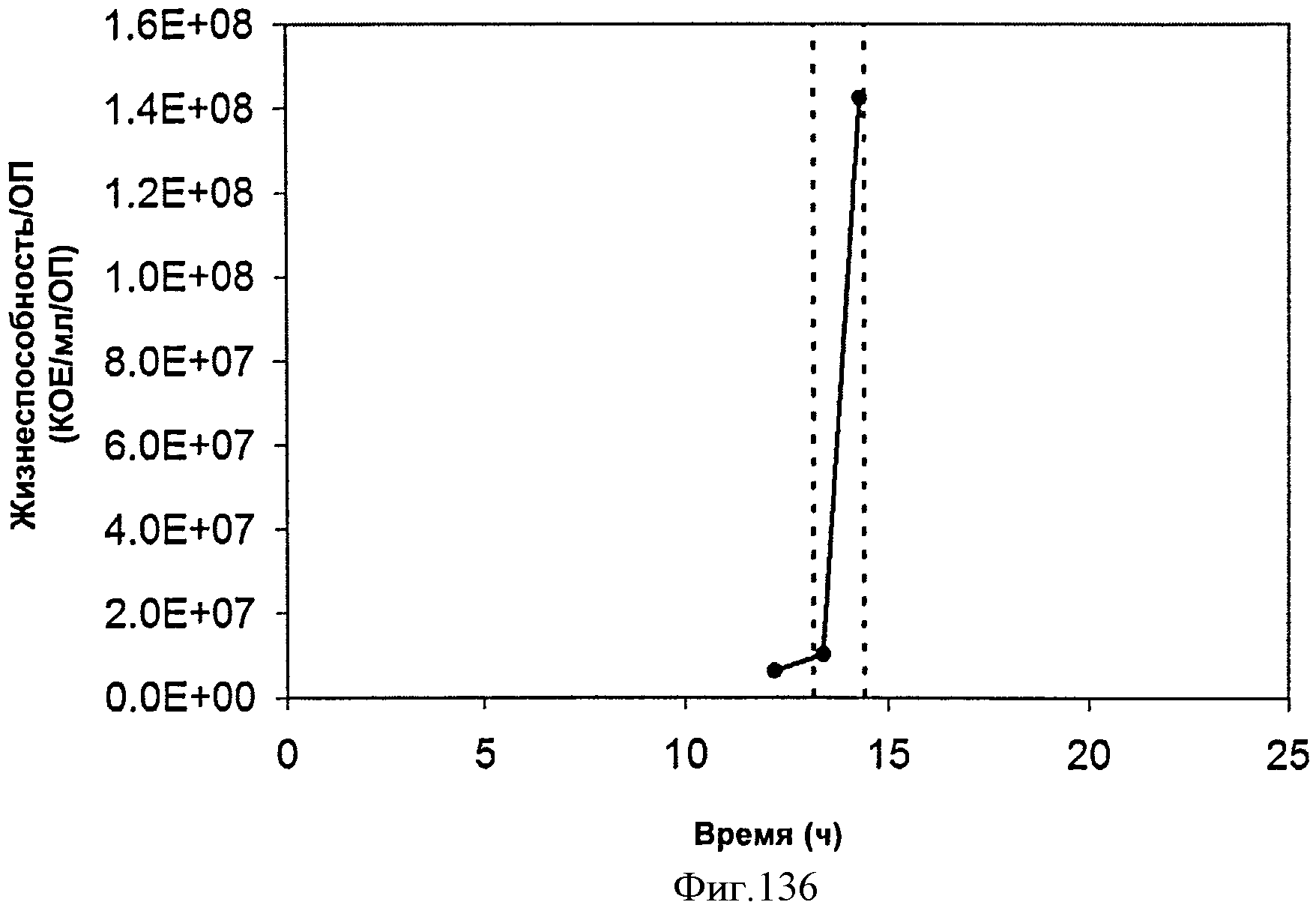
[0193] На Фигуре 127 показана жизнеспособность клеток во время продукции изопрена внутри 15 л биореактора, в который подавали глюкозу. TVC/ОП представляет собой общее количество жизнеспособных организмов (колониеобразующие единицы) в 1 мл бульона на единицу оптической плотности (OH550).
[0194] На Фигуре 128 представлена зависимость оптической плотности внутри 15 л биореактора, в который подавали глюкозу, от времени.
[0195] На Фигуре 129 представлена зависимость титра изопрена внутри 15 л биореактора, в который подавали глюкозу, от времени. Титр определяют как количество изопрена, продуцированного на литр ферментационного бульона.
[0196] На Фигуре 130 представлена зависимость общего количества изопрена, полученного внутри 15 л биореактора, в который подавали глюкозу, от времени.
[0197] Фигура 131 представляет собой график общей скорости выделения диоксида углерода (TCER), или профиль метаболической активности, внутри 15 л биореактора, в который подавали глюкозу.
[0198] Фигура 132 представляет собой график, на котором изображено, что временное уменьшение потока воздуха в биореактор вызвало пик концентрации изопрена в выделяющихся газах, что не вызвало значительного снижения метаболической активности (TCER). TCER, или метаболическая активность, представляет собой общую скорость выделения диоксида углерода.
[0199] Фигура 133 представляет собой график жизнеспособности клеток во время продукции изопрена внутри 15 л биореактора, в который подавали глюкозу. TVC/ОП представляет собой общее количество жизнеспособных организмов (колониеобразующие единицы) в 1 мл бульона на единицу оптической плотности (ОП550).
[0200] На Фигуре 134 представлена зависимость оптической плотности внутри 15 л биореактора, в который подавали глюкозу, от времени. Вертикальные пунктирные линии обозначают интервал времени, в который изопрен вводили в биореактор со скоростью, равной 1 г/л/ч.
[0201] На Фигуре 135 представлена общая скорость выделения диоксида углерода (TCER), или профиль метаболической активности, внутри 15 л биореактора, в который подавали глюкозу. Вертикальные пунктирные линии обозначают интервал времени, в который изопрен вводили в биореактор со скоростью, равной 1 г/л/ч.
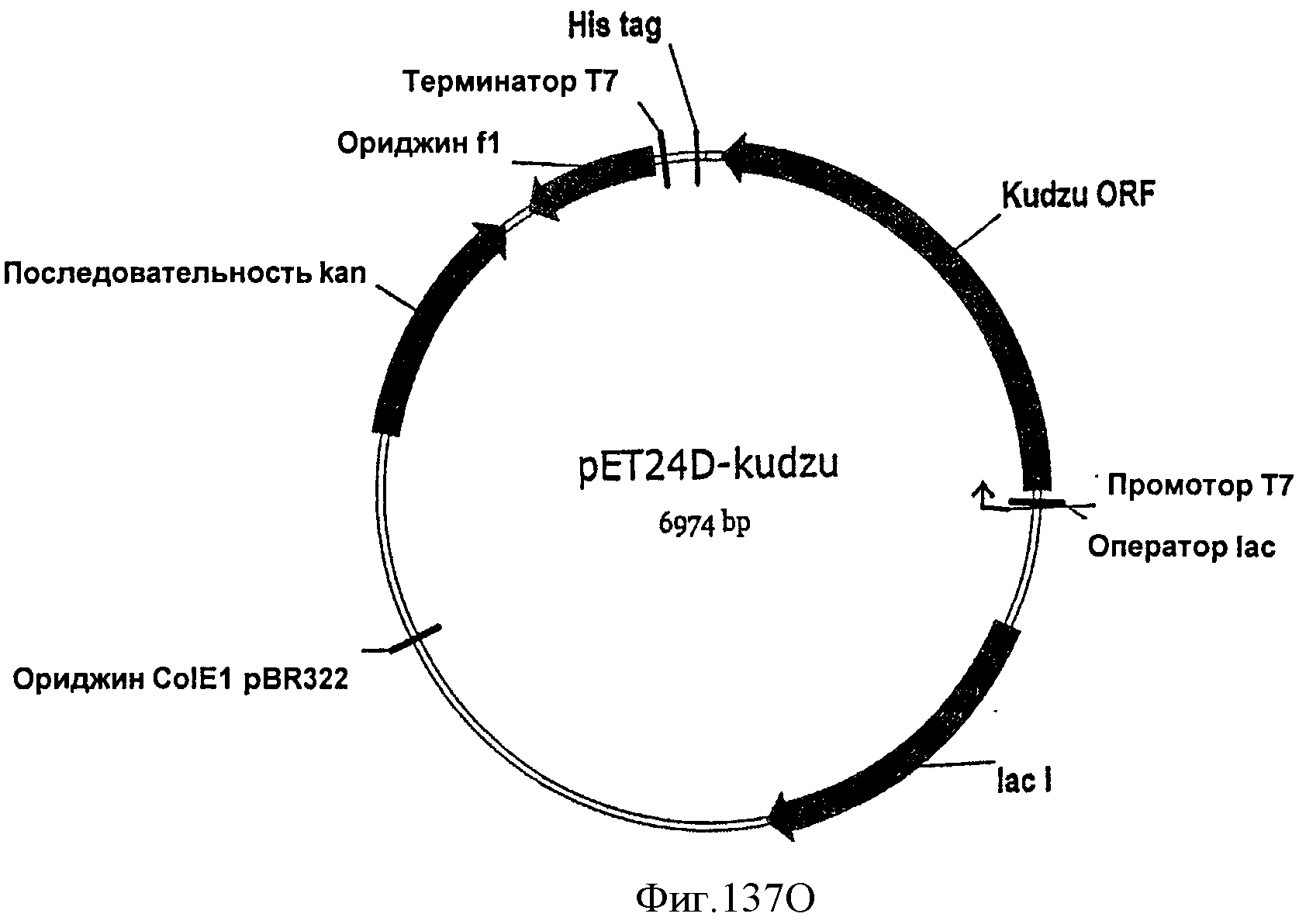
[0202] На Фигуре 136 представлена жизнеспособность клеток во время продукции изопрена внутри 15 л биореактора, в который подавали глюкозу. TVC/ОП представляет собой общее количество жизнеспособных организмов (колониеобразующие единицы) в 1 мл бульона на единицу оптической плотности (ОП550). Вертикальные пунктирные линии обозначают интервал времени, в который изопрен вводили в биореактор со скоростью, равной 1 г/л/ч.
[0203] Фигуры 137А-В представляют собой последовательность рЕТ24а Populus alba: ген изопренсинтазы выделен жирным шрифтом (SEQ ID NO: 30).
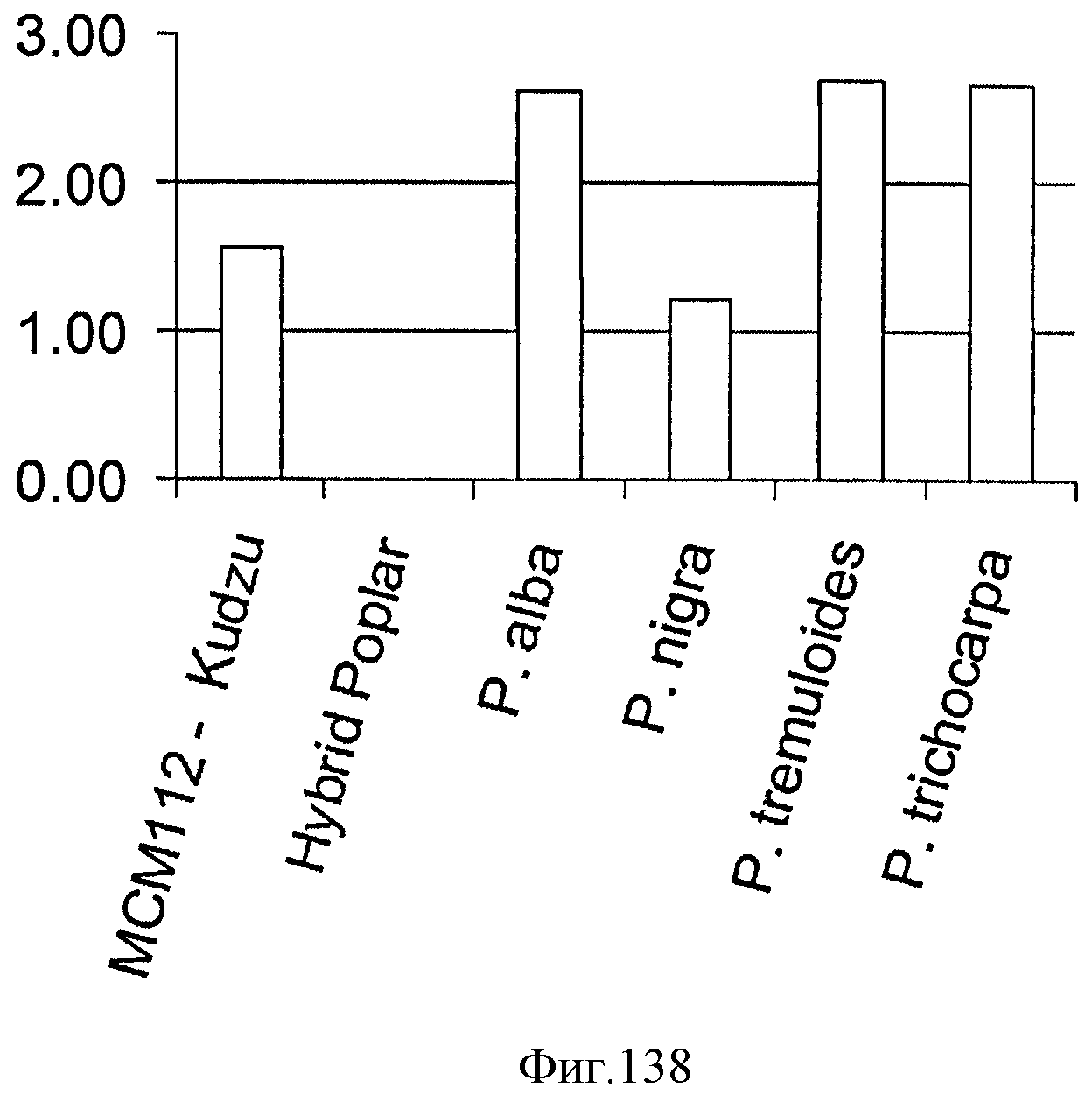
[0204] Фигуры 137C-D представляют собой последовательность рЕТ24а Populus nigra'. ген изопренсинтазы выделен жирным шрифтом (SEQ ID NO: 31).
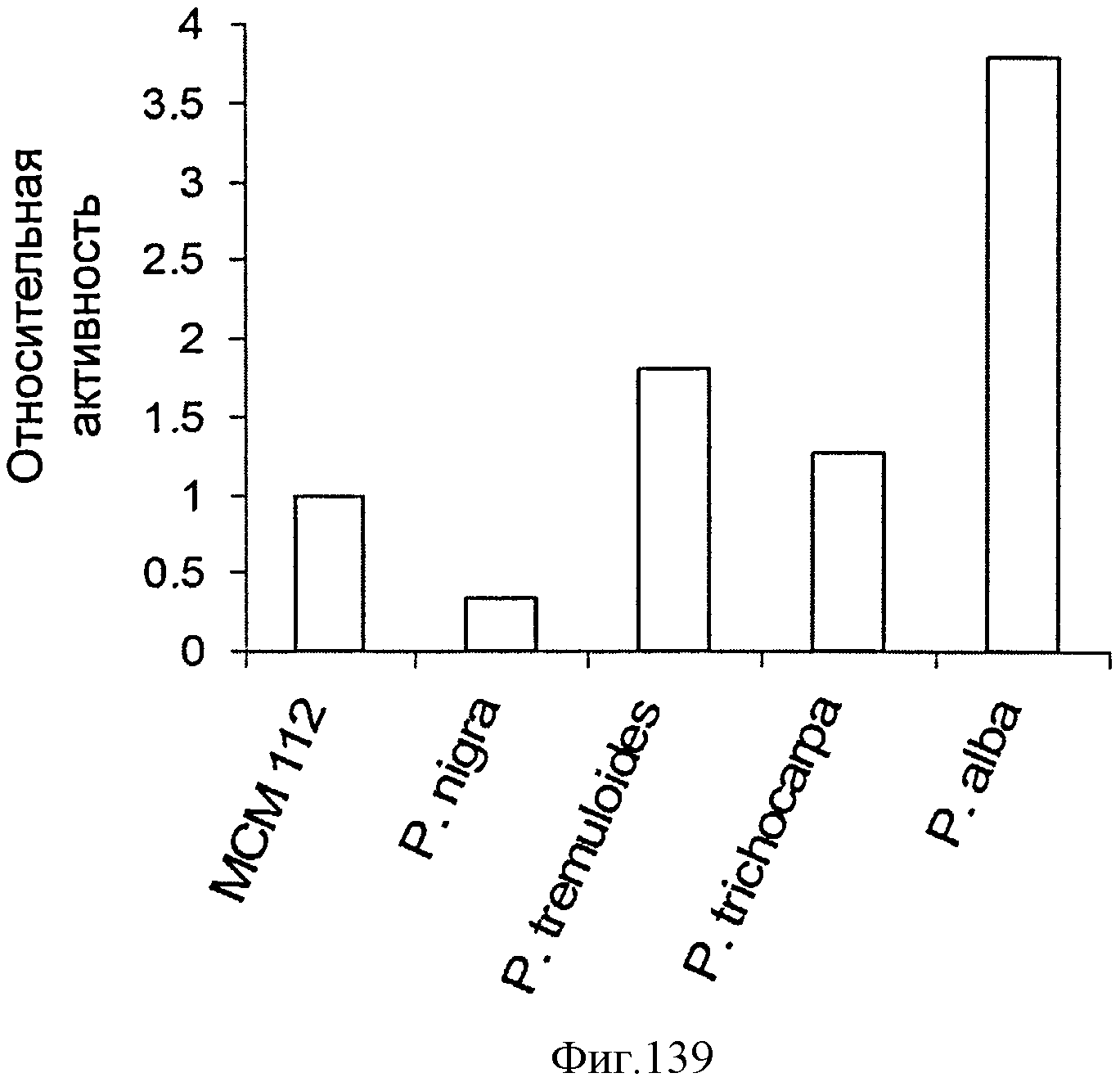
[0205] Фигуры 137E-F представляют собой последовательность рЕТ24а Populus tremuloides (SEQ ID NO: 32).
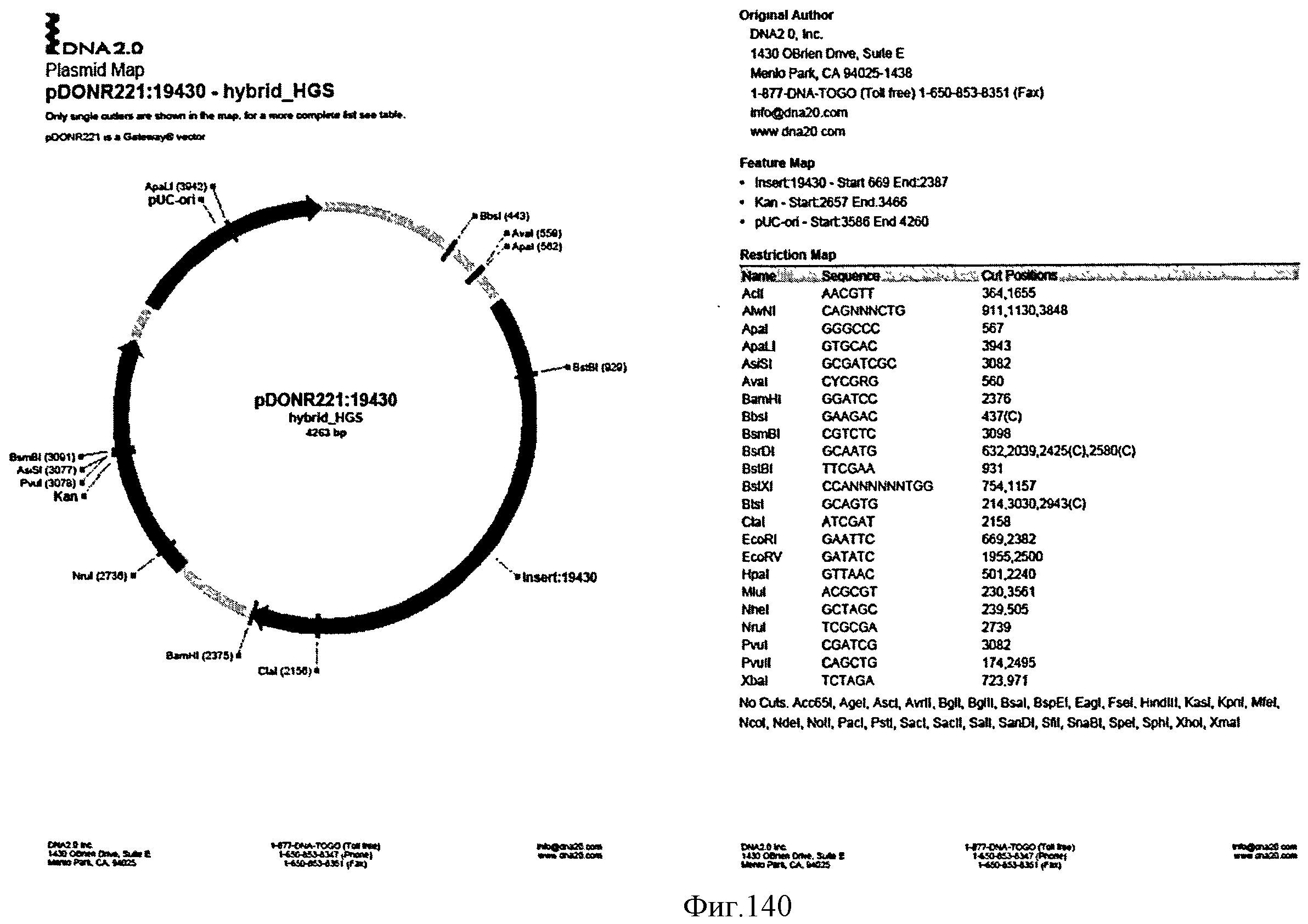
[0206] Фигура 137G представляет собой последовательность аминокислот гена изопренсинтазы Populus tremuloides (SEQ ID NO: 33).
[0207] Фигуры 137Н-1 представляют собой последовательность рЕТ24а Populus trichocarpa: ген изопренсинтазы выделен жирным шрифтом (SEQ ID NO: 34).
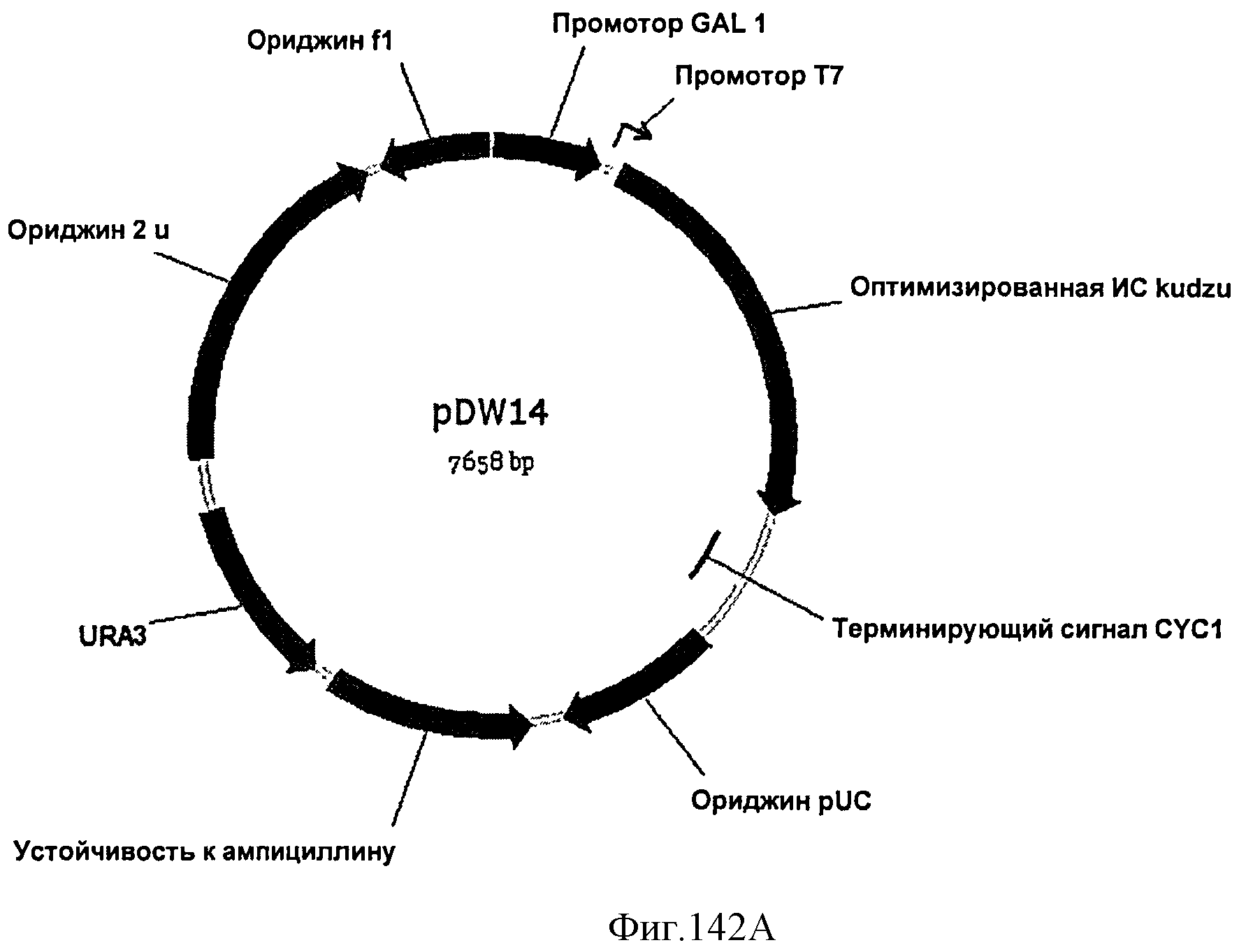
[0208] Фигуры 137J-K представляют собой последовательность рЕТ24а Populus tremula x Populus alba; ген изопренсинтазы выделен жирным шрифтом (SEQ ID NO: 35).
[0209] Фигура 137L представляет собой карту МСМ93, который содержит последовательность, кодирующую IspS кудзу, в остове pCR2.1.
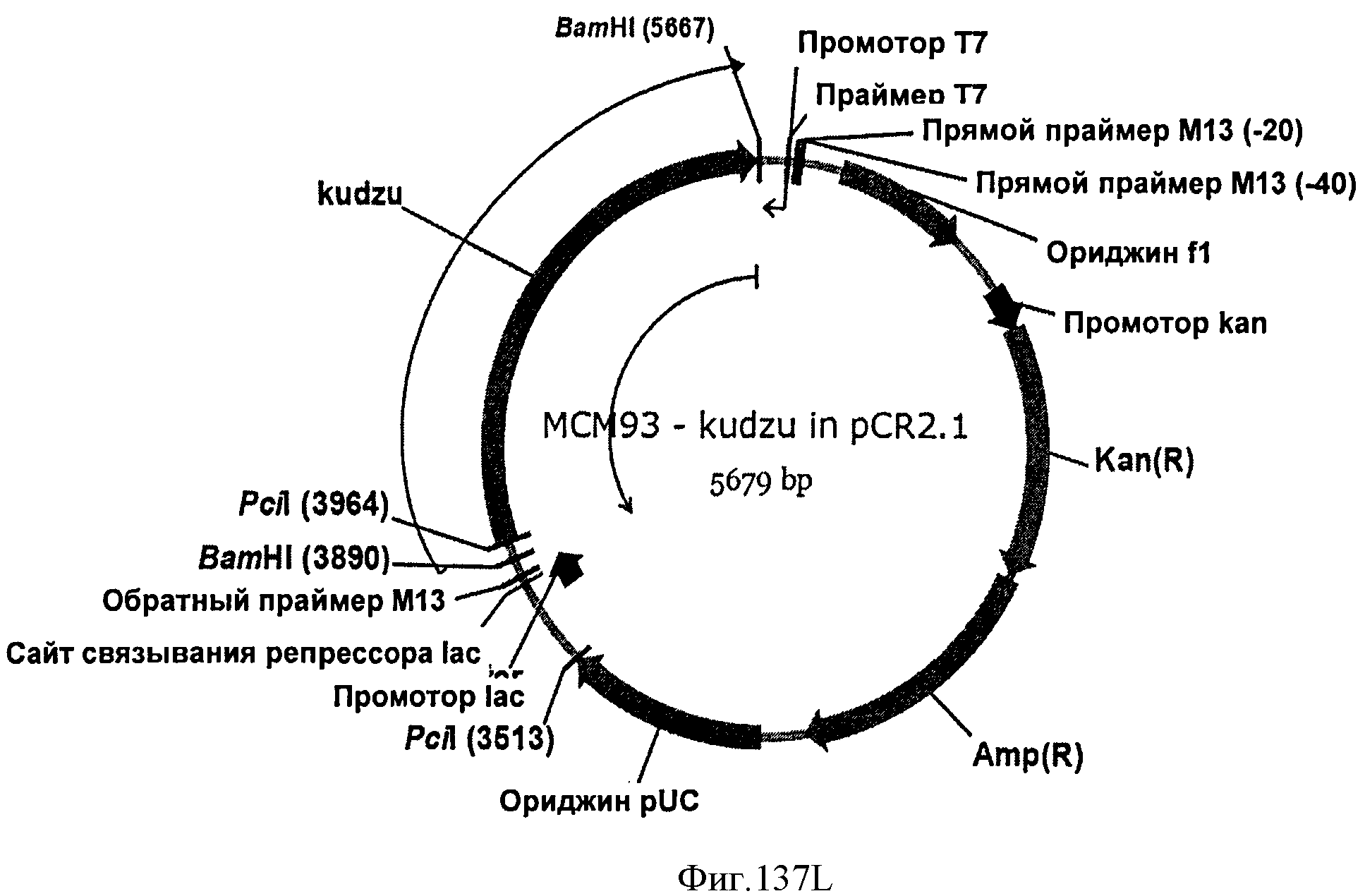
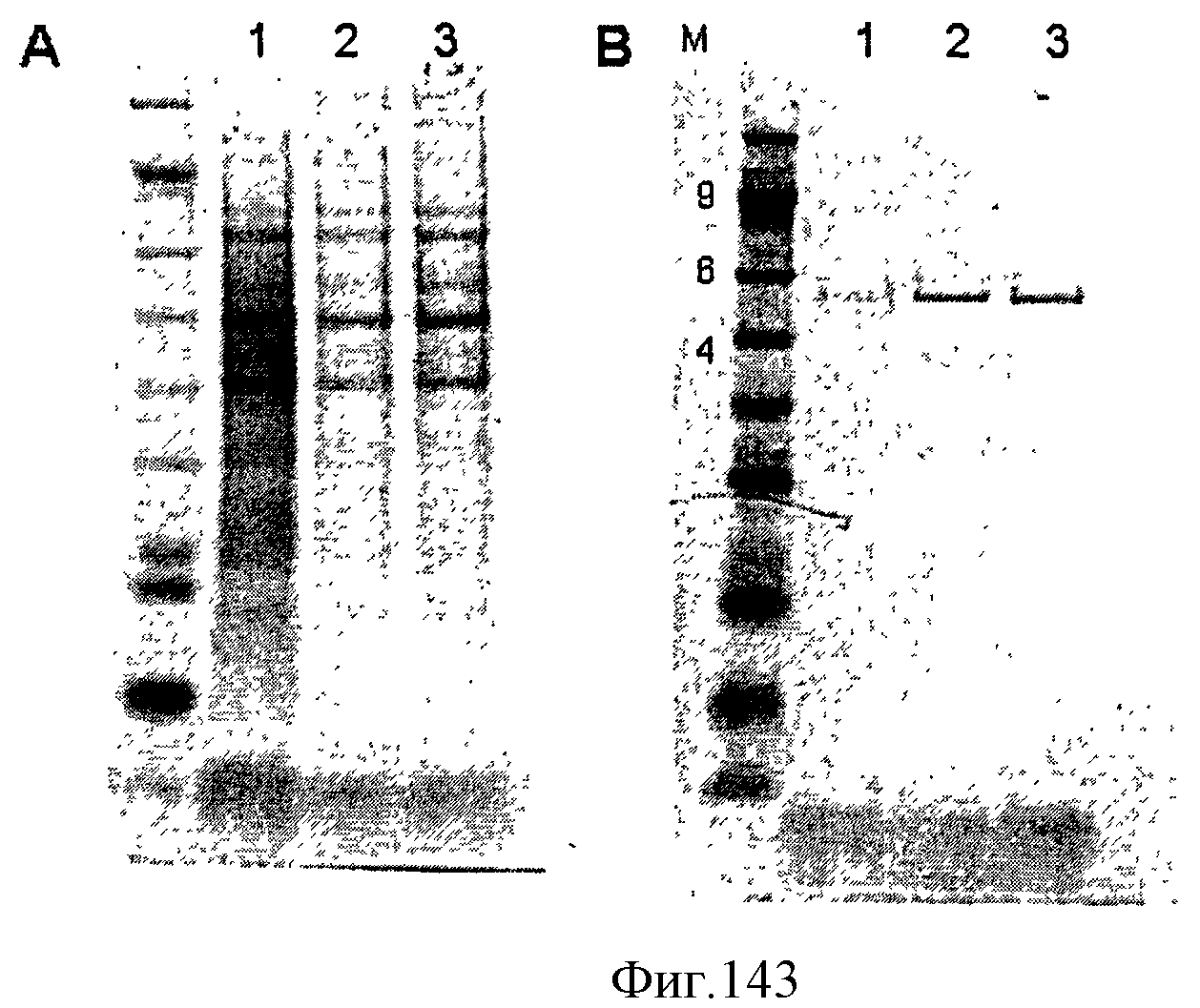
[0210] Фигуры 137M-N представляют собой последовательность МСМ93 (SEQ ID NO: 36).
[0211] Фигура 1370 представляет собой карту pET24D-Kudzu.
[0212] Фигуры 137P-Q представляют собой последовательность pET24D-Kudzu (SEQ ID NO: 37).
[0213] На Фигуре 138 представлены результаты экспрессии изопренсинтазы для различных видов тополя, измеренные в анализе свободного пространства над клетками. На оси у представлены собой мкг/л/ОП изопрена, продуцированного 0,2 мл культуры, индуцированной IPTG.
[0214] На Фигуре 139 представлена относительная активность ферментов изопренсинтазы тополя, измеренная путем анализа DMAPP. Ферменты тополя обладали значительно более высокой активностью, чем изопренсинтаза из кудзу. Ферменты тополя [alba x tremula} обладали лишь незначительной активностью (<1%) и не показаны на диаграмме.
[0215] Фигура 140 представляет собой карту pDONR221:19430 - hybrid_HGS.
[0216] Фигура 141 представляет собой последовательность нуклеотидов pDONR221:1943 0 - hybrid_HGS, последовательность изопренсинтазы Кудзу, кодон-оптимизированную для дрожжей (SEQ ID NO: 38).
[0217] Фигура 142А представляет собой карту pDW14.
[0218] Фигуры 142 В-С представляют собой полную последовательность нуклеотидов pDW14 (SEQ ID NO: 39).
[0219] На Фигуре 143 показаны индуцированные штаммы INVSc-1. несущие pDW14 или pYES-DEST52. Фигура 143А. 4-12% бис-трис-гель (Novex, Invitrogen) лизатов, полученных из штаммов INVSc-1, индуцированных галактозой и окрашенных SimplyBlue SafeStain (Invitrogen). Фигура 143 В. Анализ методом вестерн-блот тех же штаммов с помощью набора WestemBreeze (Invitrogen). Дорожки описаны далее: 1-INVSc-1+pYES-DEST52; 2 - INVSc-1+pDW14 (изолят 1); 3 - INVSc-1+pDW14 (изолят 2). Указана молекулярная масса (MW) (в кДа) (применяли стандарт молекулярных масс SeeBlue Plus2).
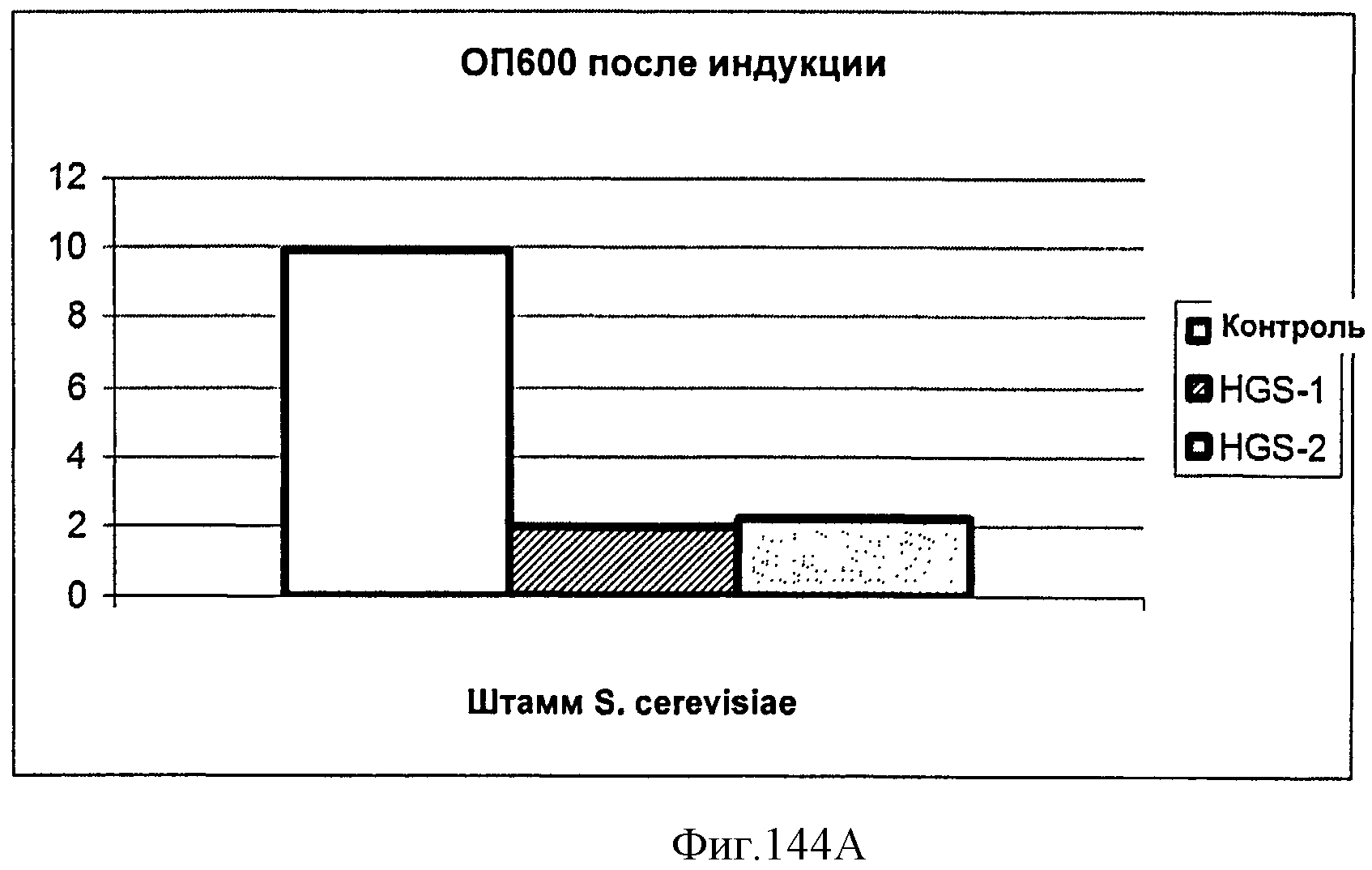
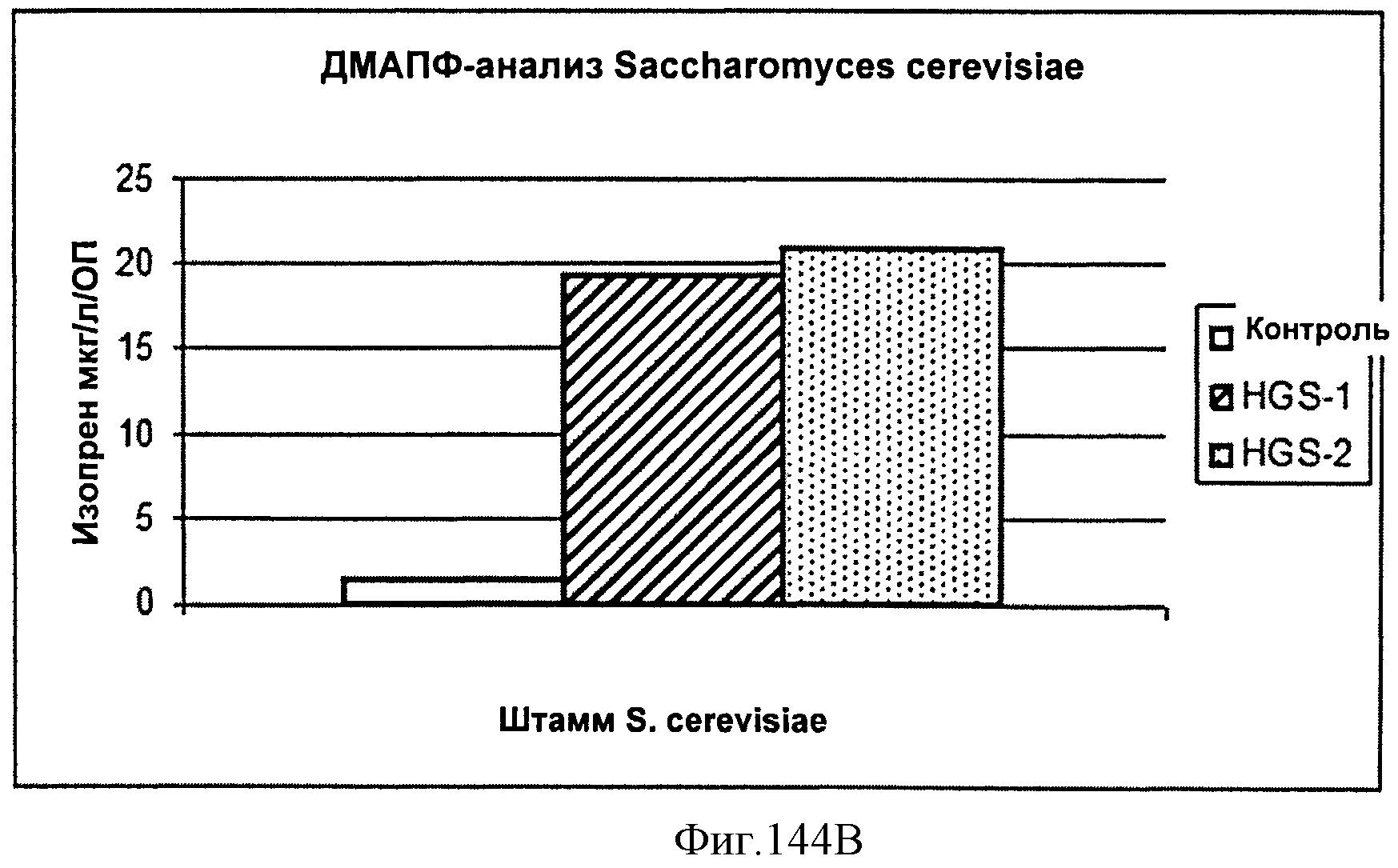
[0220] На Фигуре 144 (Фигуры 144А и 144 В) показаны индуцированные штаммы INVSc-1, содержащие pDW14 или pYES-DEST52. Фигура 144А. ОП600 индуцированных галактозой штаммов перед лизисом. Ось у представляет собой ОП600. Фигура 144 В. Анализ DMAPP свободного пространства над поверхностью активности изопренасинтазы в контрольных штаммах и штаммах, содержащих несущих изопренсинтазу. Удельную активность рассчитывали как мкг HG/л/ОП. образцы описаны далее: Контроль - INVSc-1+pYES-DEST52; HGS-1- INVSc-1+pDW14 (изолят 1); HGS-2 - INVSc-1+pDW14 (изолят 2).
[0221] Фигура 145А представляет собой карту кодон-оптимизированной изопренсинтазы fluo-opt2v2.
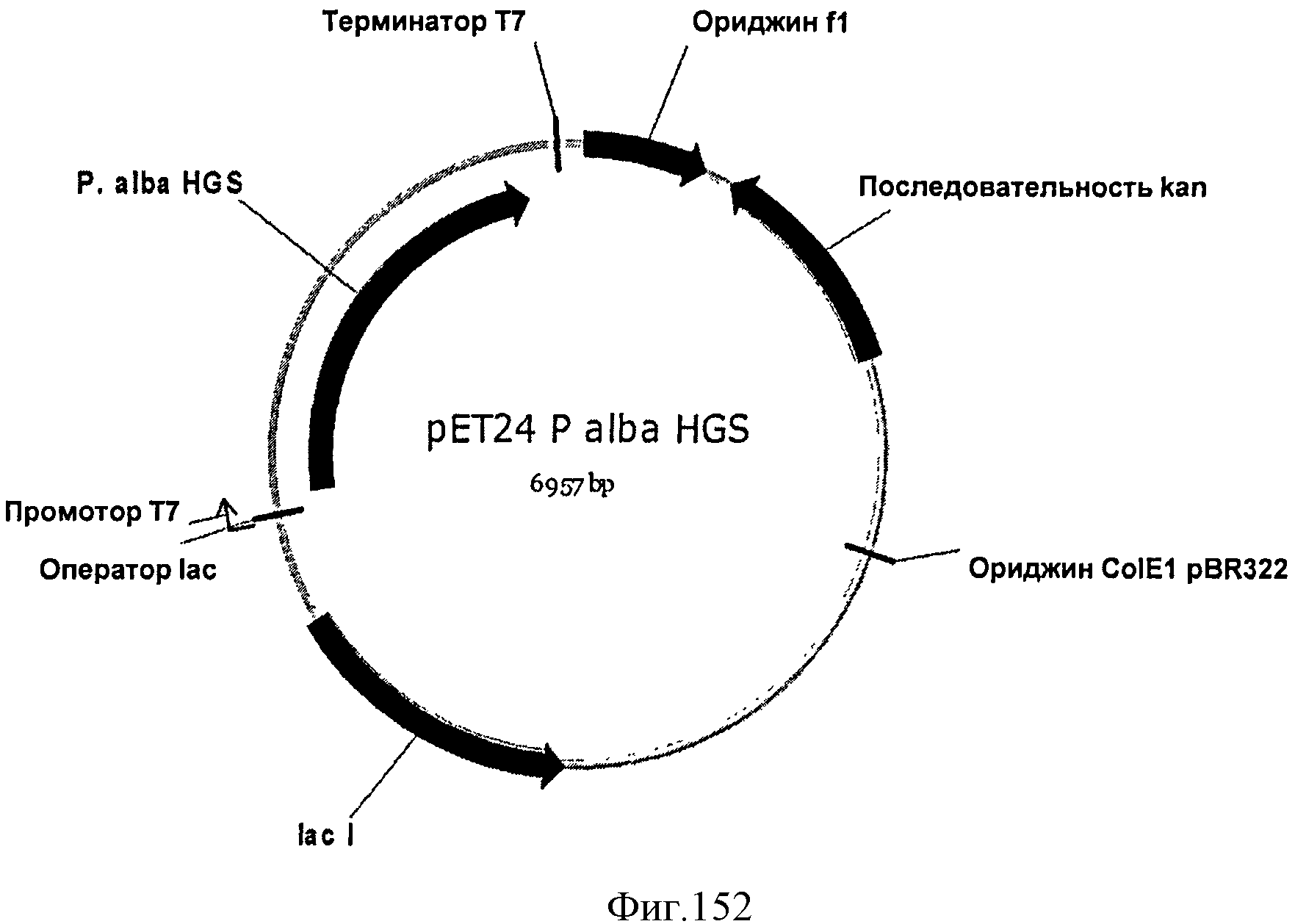
[0222] Фигура 145 В представляет собой последовательность нуклеотидов кодон-оптимизированной изопренсинтазы fluo-opt2v2 (SEQ ID NO: 40).
[0223] Фигура 146А представляет собой карту pBBR1MCS5.
[0224] Фигуры 146 В-С представляют собой последовательность нуклеотидов pBBR1MCS5 (SEQ ID NO: 41).
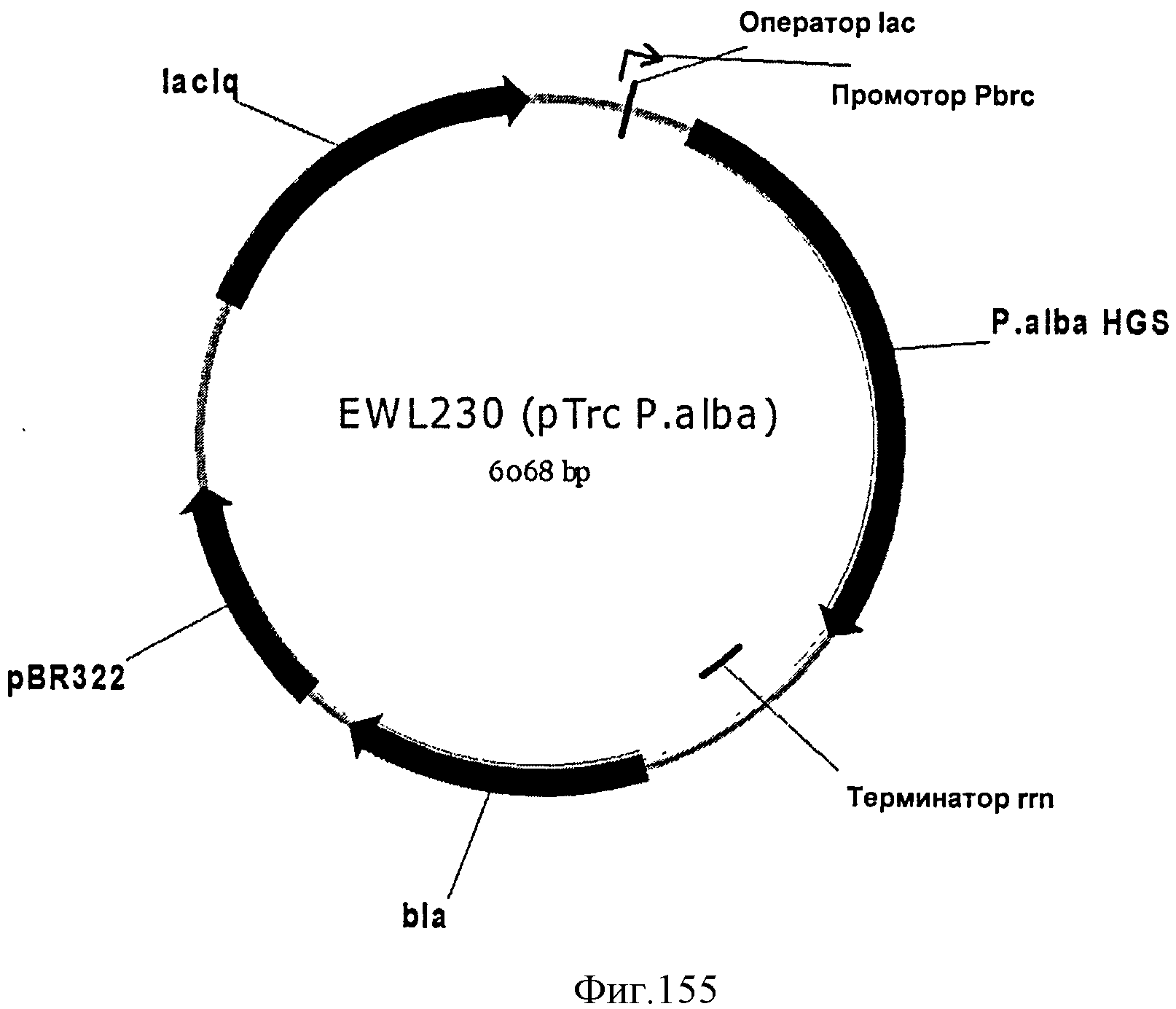
[0225] Фигура 147А представляет собой карту pBBR5HGSOpt2_2.
[0226] Фигуры 147 В-С представляют собой последовательность нуклеотидов pBBR5HGSOpt2_2 (SEQ ID NO: 42).
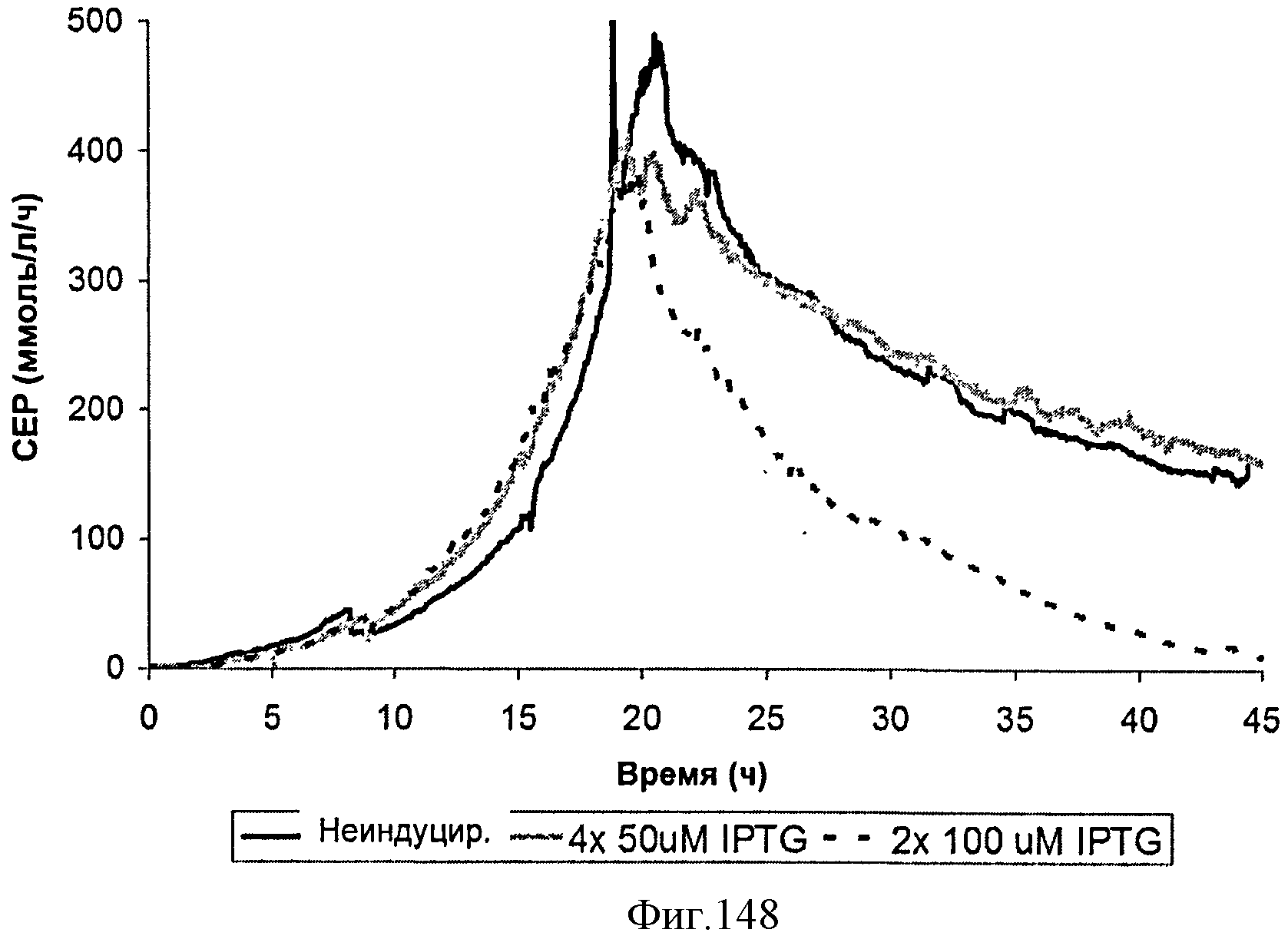
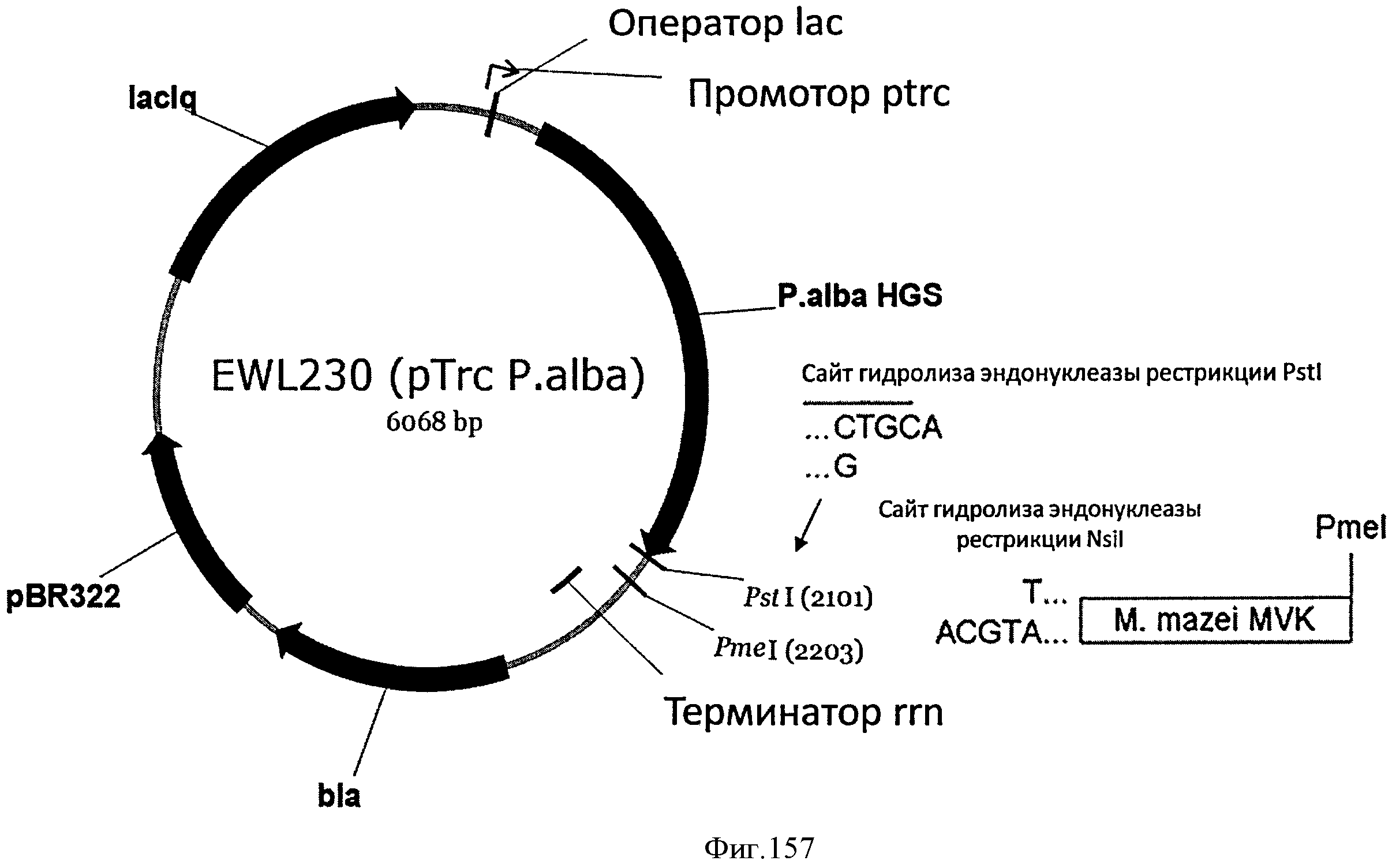
[0227] Фигура 148 представляет собой график зависимости скорости выделения диоксида углерода (CER) от времени ферментации для штамма МСМ401, неиндуцированного, индуцированного IPTG (4×50 мкмоль) или EPTG (2×100 мкмоль).
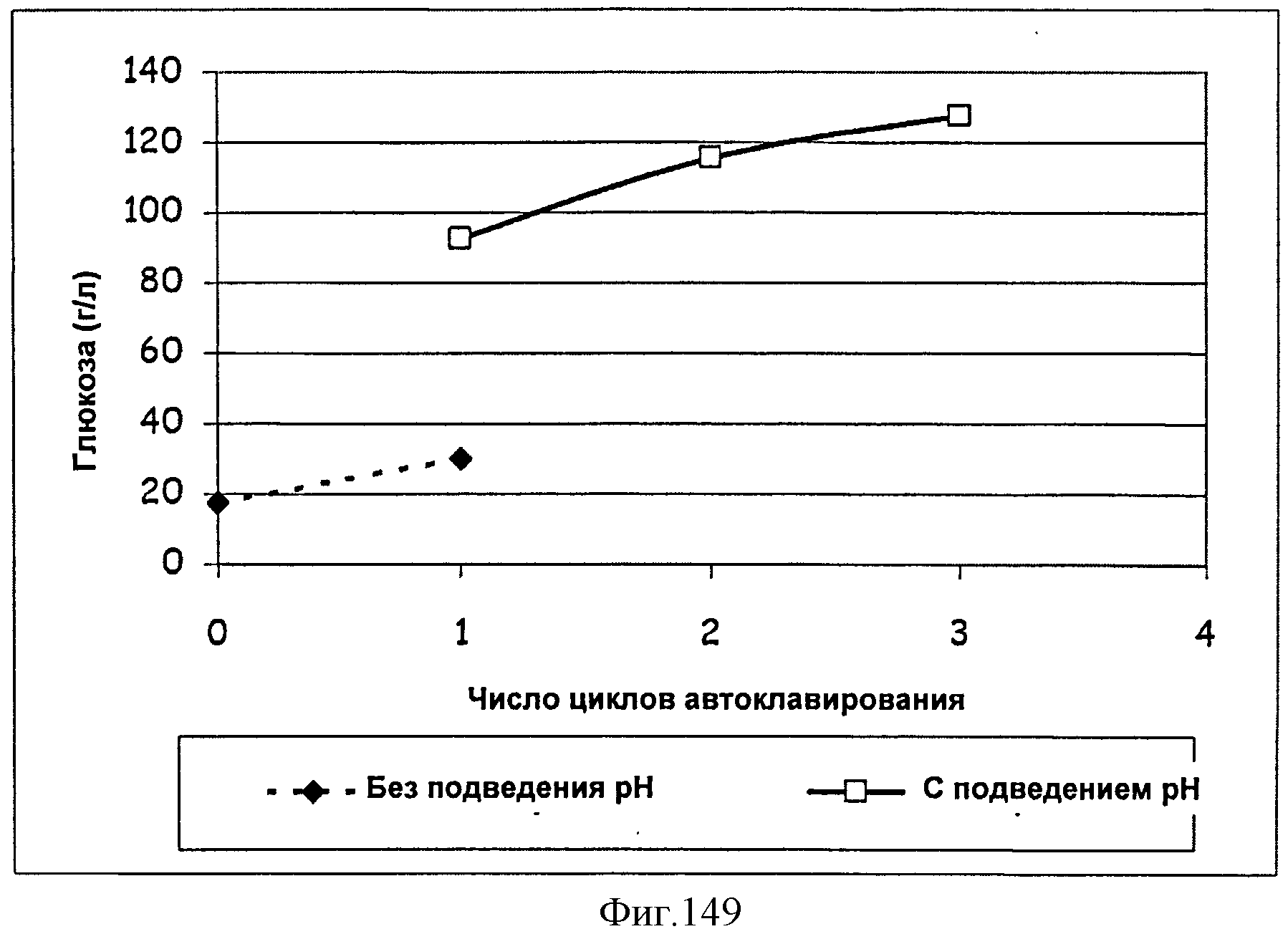
[0228] На Фигуре 149 показана концентрация глюкозы в растворах сахарного тростника, рН подводили или не подводили, как функция количества циклов автоклавной обработки (один цикл=30 мин).
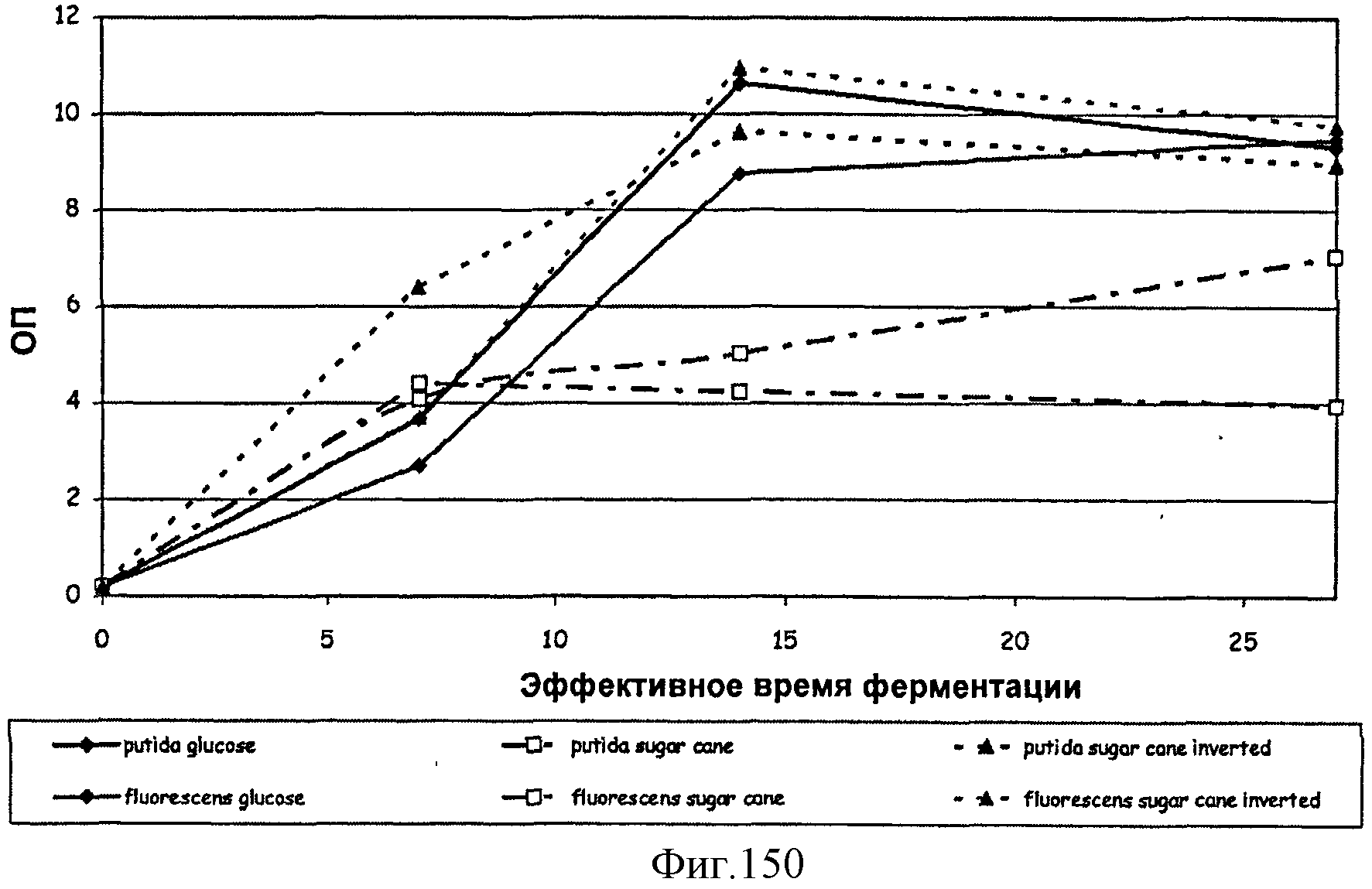
[0229] На Фигуре 150 показаны кривые роста (ОП600 как функция времени) F1 Pseudomonas putida и АТСС13525 Pseudomonas fluorescens на глюкозе, сахарном тростнике и инвертированном сахарном тростнике.
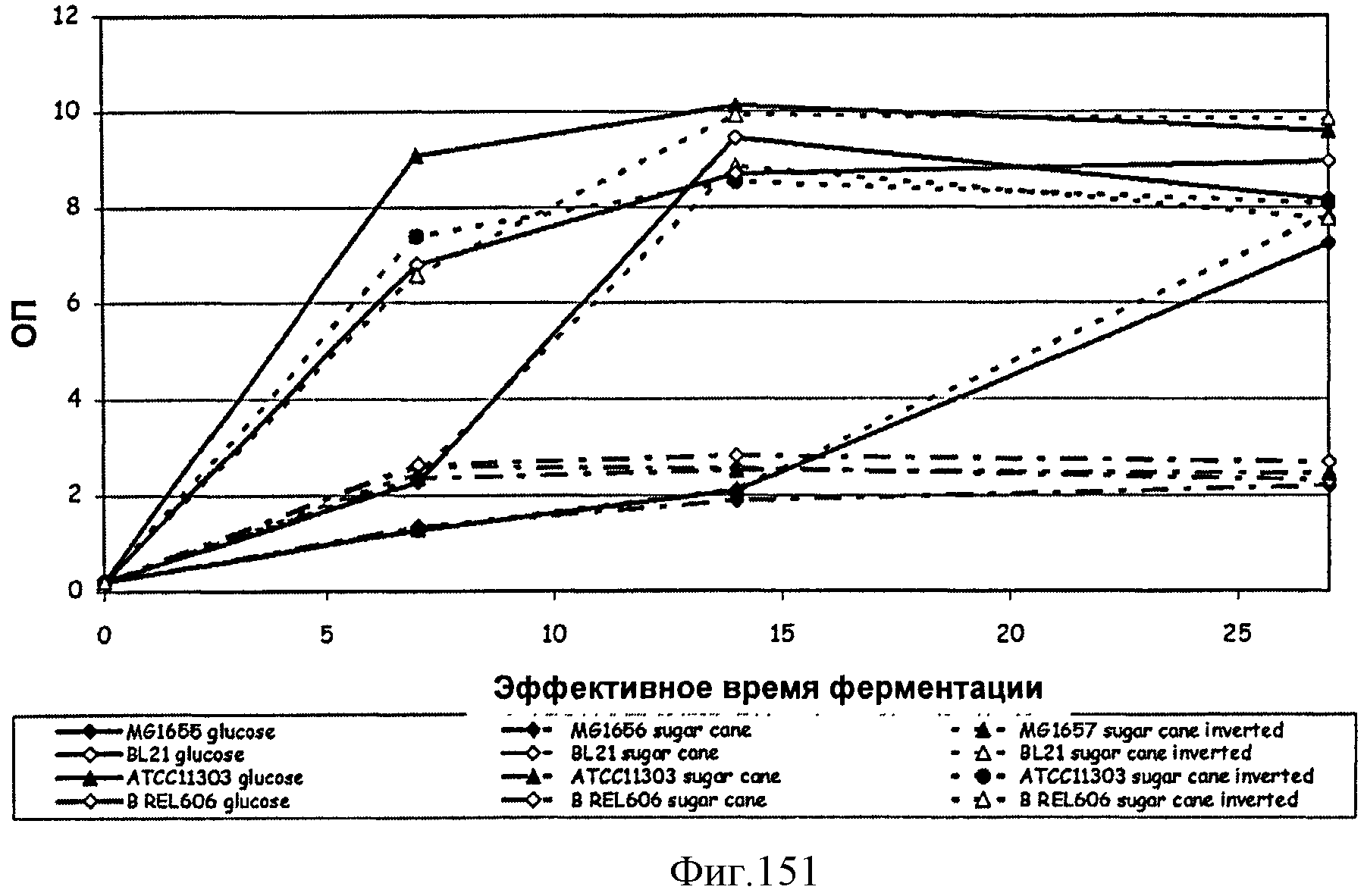
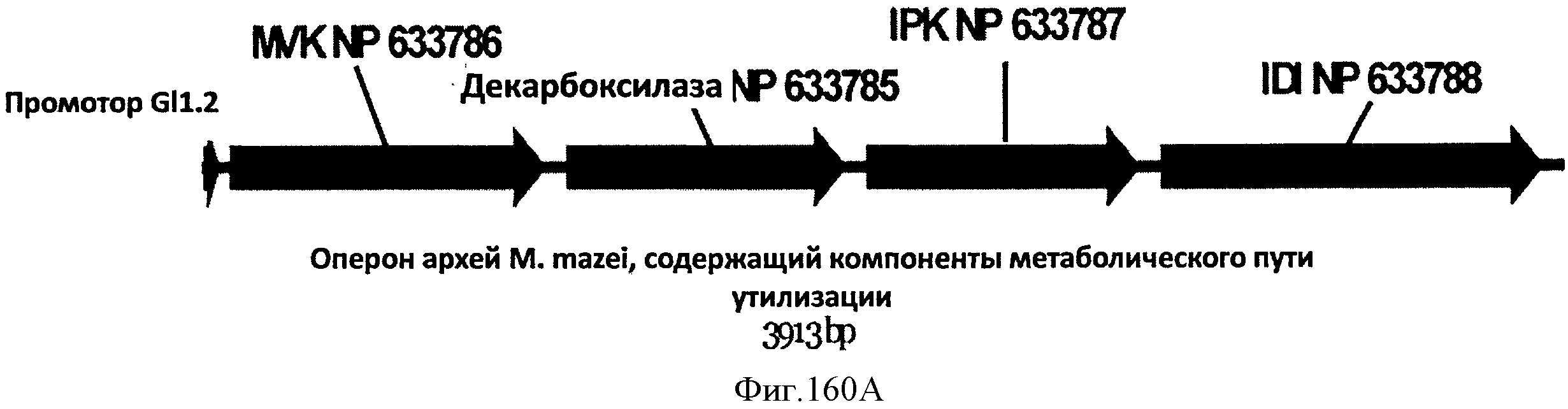
[0230] На Фигуре 151 показаны кривые роста (OП600 как функция времени) BL21(DE3), MG1655, АТСС11303 и В REL 606 Е. coli на глюкозе, сахарном тростнике и инвертированном сахарном тростнике.
[0231] Фигура 152 представляет собой карту плазмиды рЕТ24 Р. alba HGS.
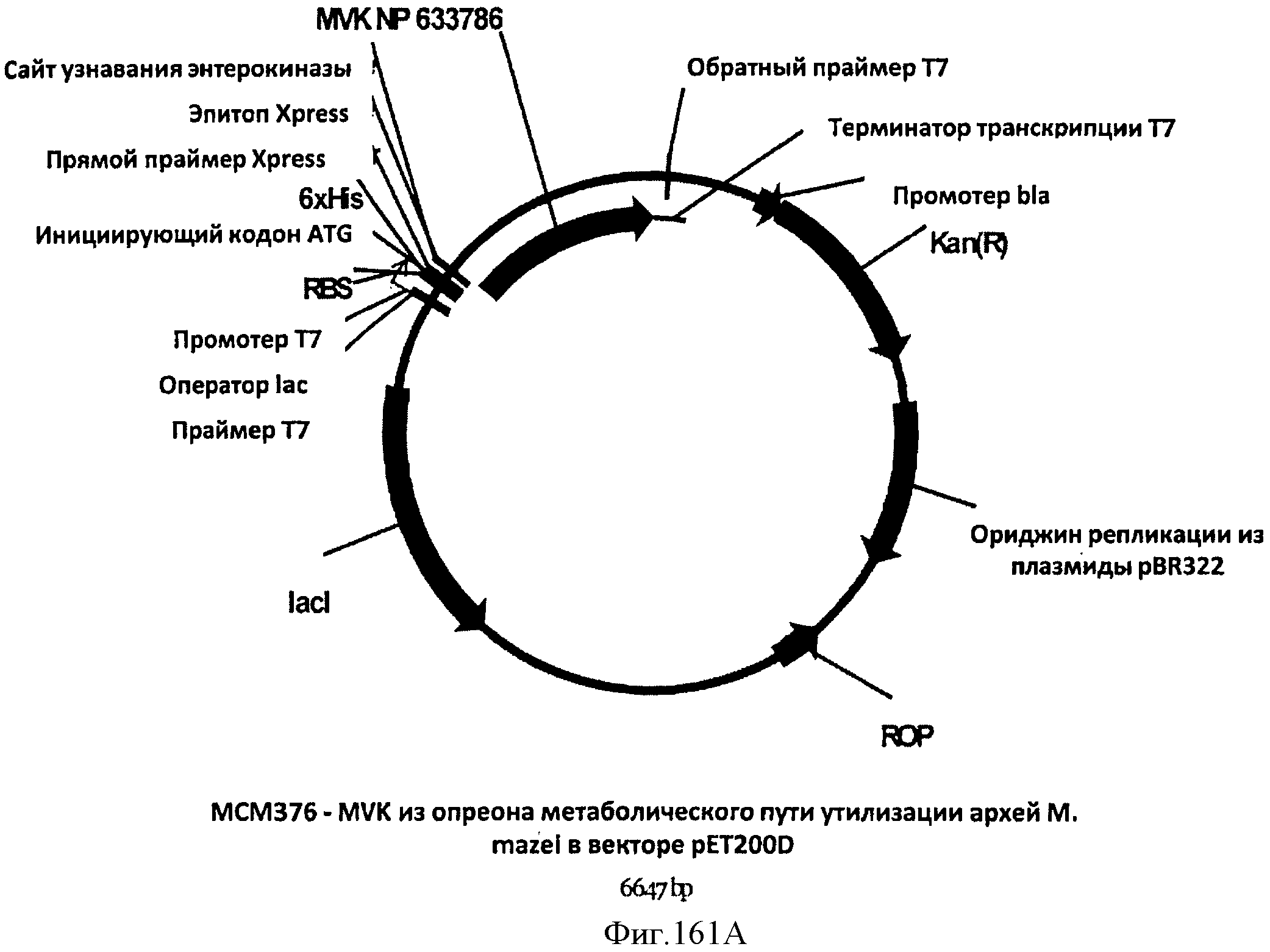
[0232] Фигура 153А-В представляют собой последовательность нуклеотидов плазмиды рЕТ24 Р. alba HGS (SEQ ID NO: 43).
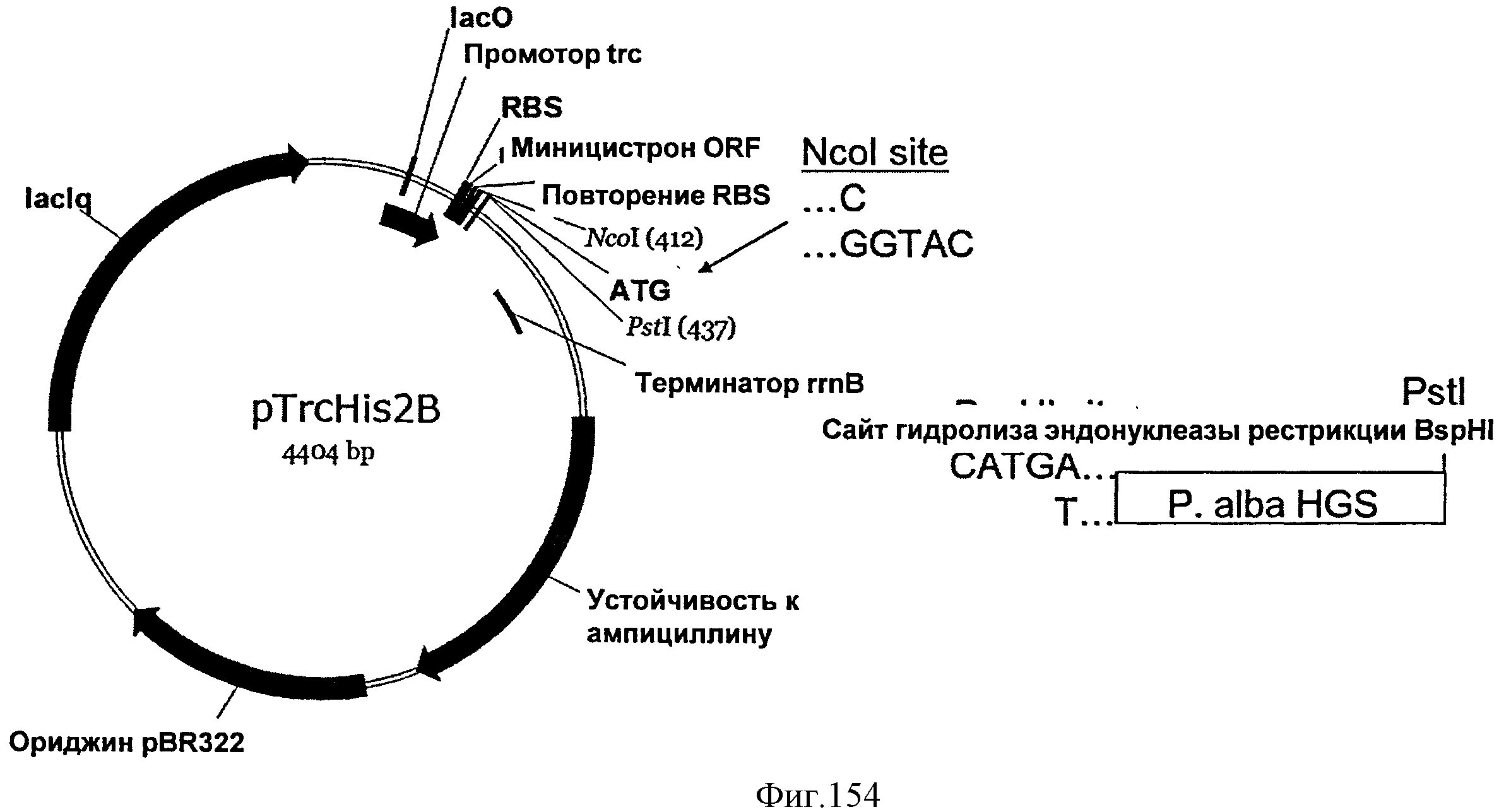
[0233] Фигура 154 представляет собой схематическое изображение, на котором показаны сайты рестрикции, используемые для расщепления эндонуклеазами, чтобы сконструировать плазмиду EWL230, и совместимые липкие концы между сайтами для BspHI и Ncol.
[0234] Фигура 155 представляет собой карту плазмиды.EWL230.
[0235] Фигуры 156А-В представляют собой последовательность нуклеотидов плазмиды EWL230 (SEQ ID NO: 44).
[0236] Фигура 157 представляет собой схематическое изображение, на котором показаны сайты рестрикции, используемые для расщепления эндонуклеазами, чтобы сконструировать плазмиду EWL244, и совместимые липкие концы между сайтами для Nsil и Pstl.
[0237] Фигура 158 представляет собой карту плазмиды EWL244.
[0238] Фигуры 159А-В представляют собой последовательность нуклеотидов плазмиды EWL244 (SEQ ID NO: 45).
[0239] Фигура 160А представляет собой карту оперона нижнего пути (Lower Pathway) археи М. mazei.
[0240] Фигуры 160B-C представляют собой последовательность нуклеотидов оперона нижнего пути (Lower Pathway) археи М. mazei (SEQ ID NO: 46).
[0241] Фигура 161А представляет собой карту MCM37.6-MVK из нижнего пути археи М. mazei в pET200D.
[0242] Фигуры 161B-C представляют собой последовательность нуклеотидов MCM376-MVK из нижнего пути археи М. mazei в pET200D (SEQ ID NO: 47).
[0243] Фигура 162 представляет собой карту плазмиды pBBRCMPGIl.5-pgl.
[0244] Фигуры 163А-B представляют собой последовательность нуклеотидов плазмиды pBBRCMPGILS-pgl (SEQ ID NO: 48).
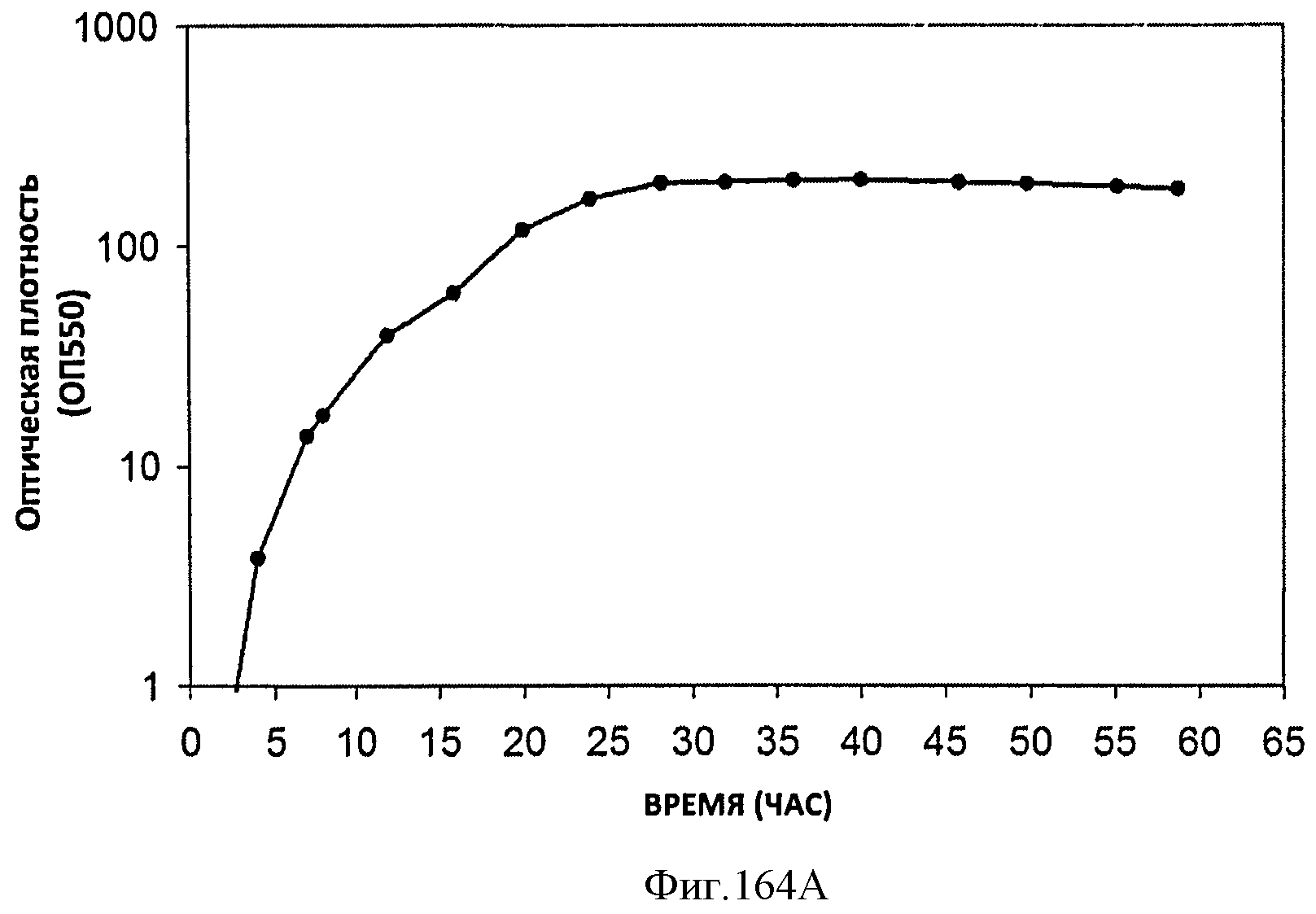
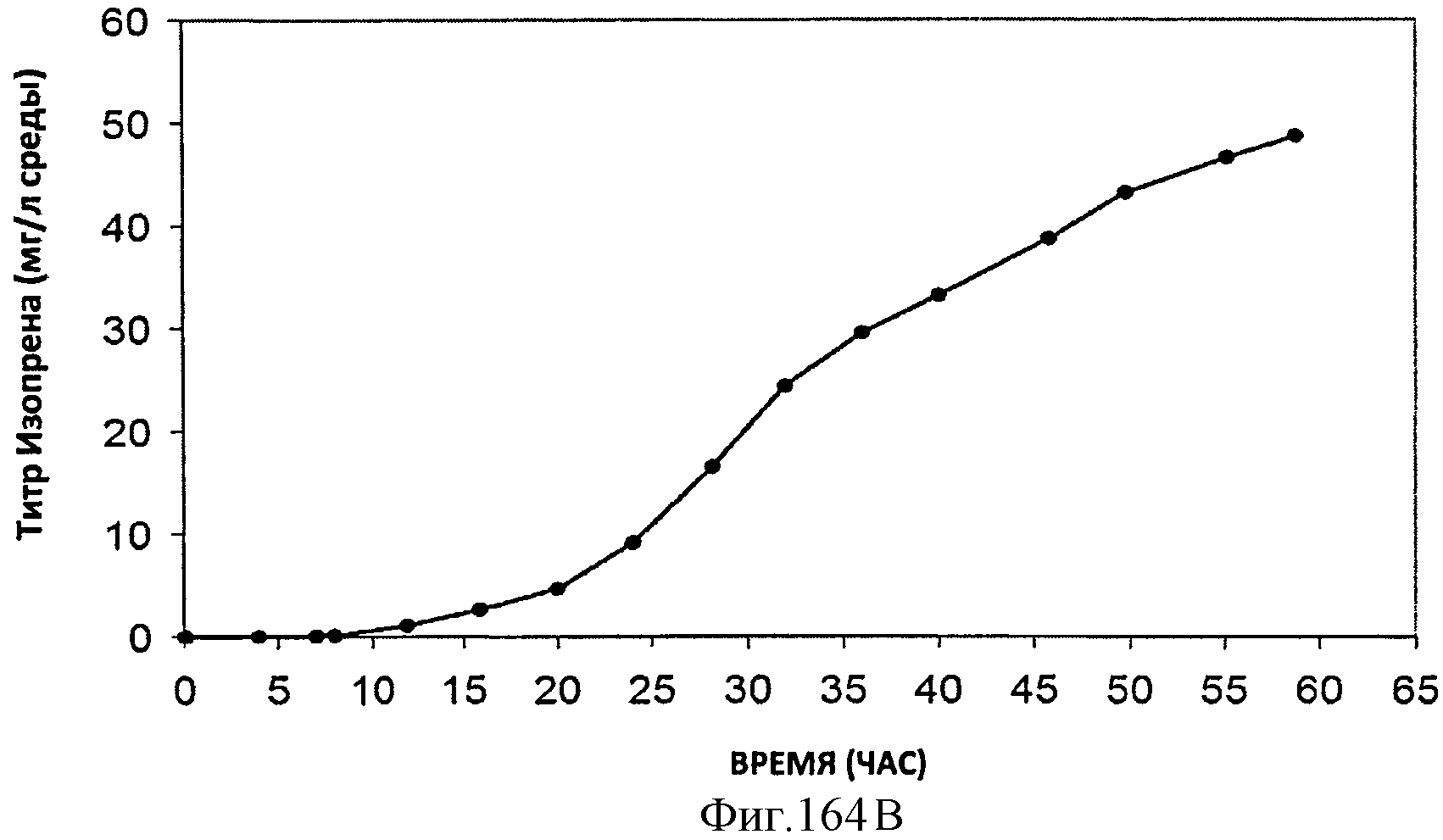
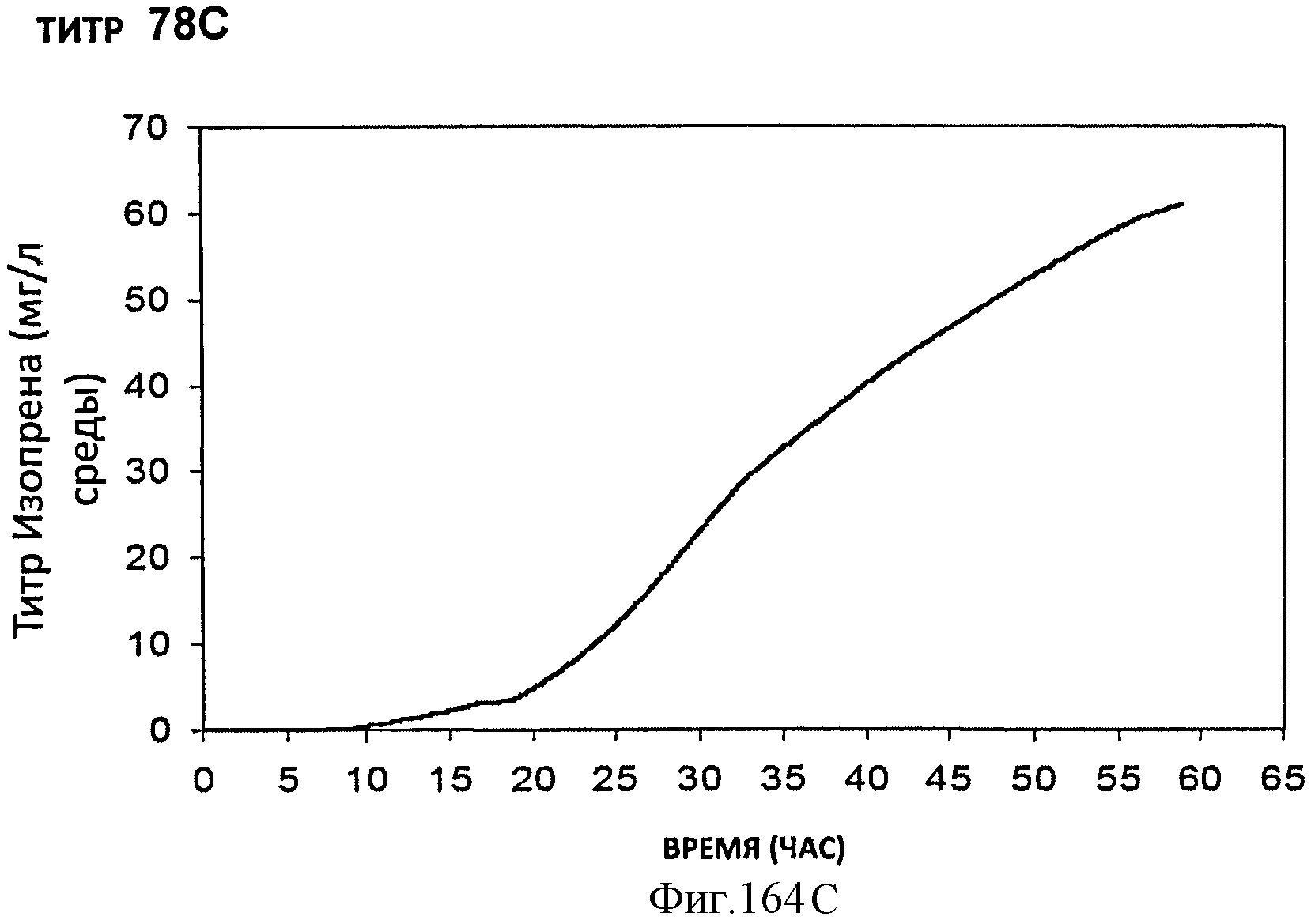
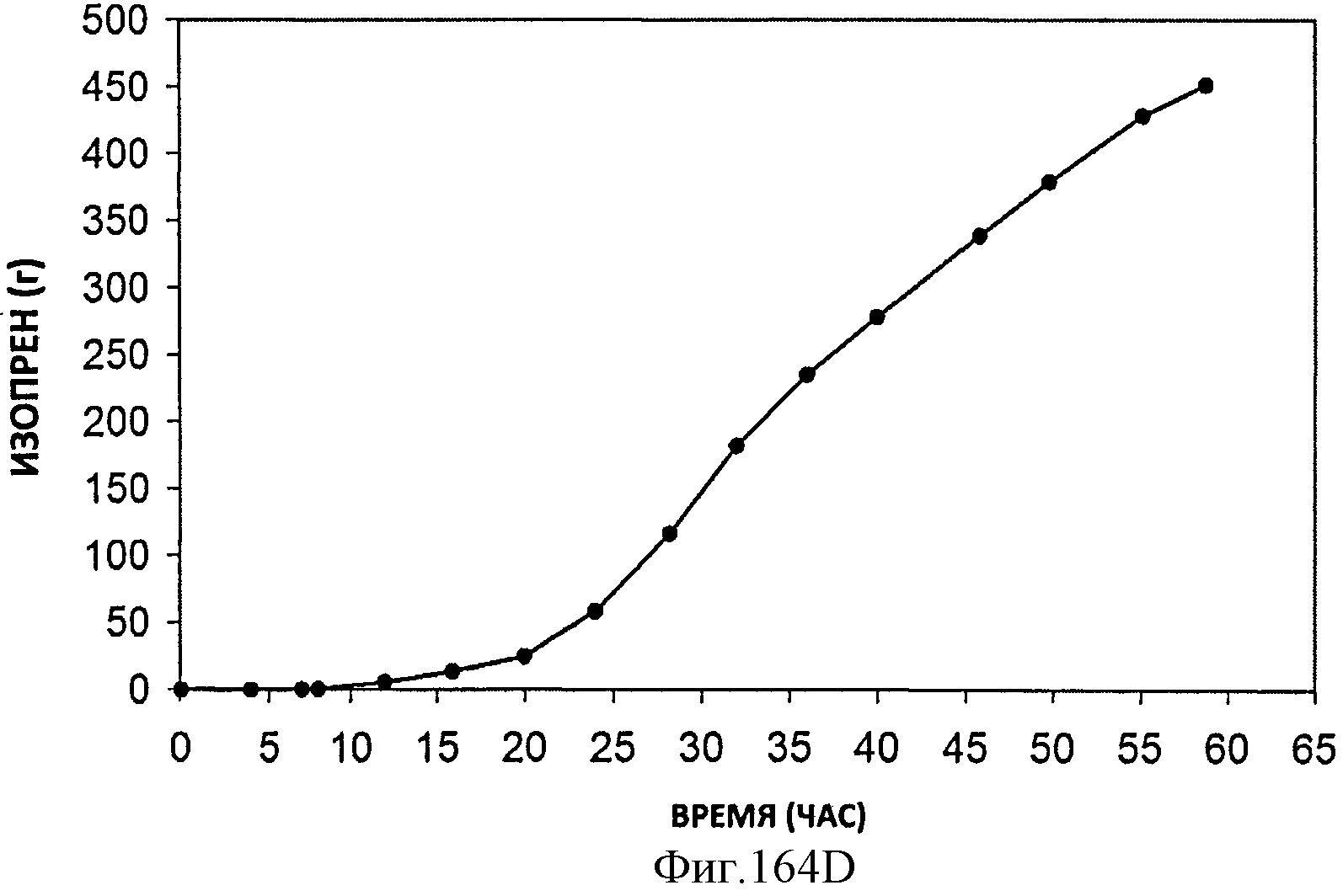
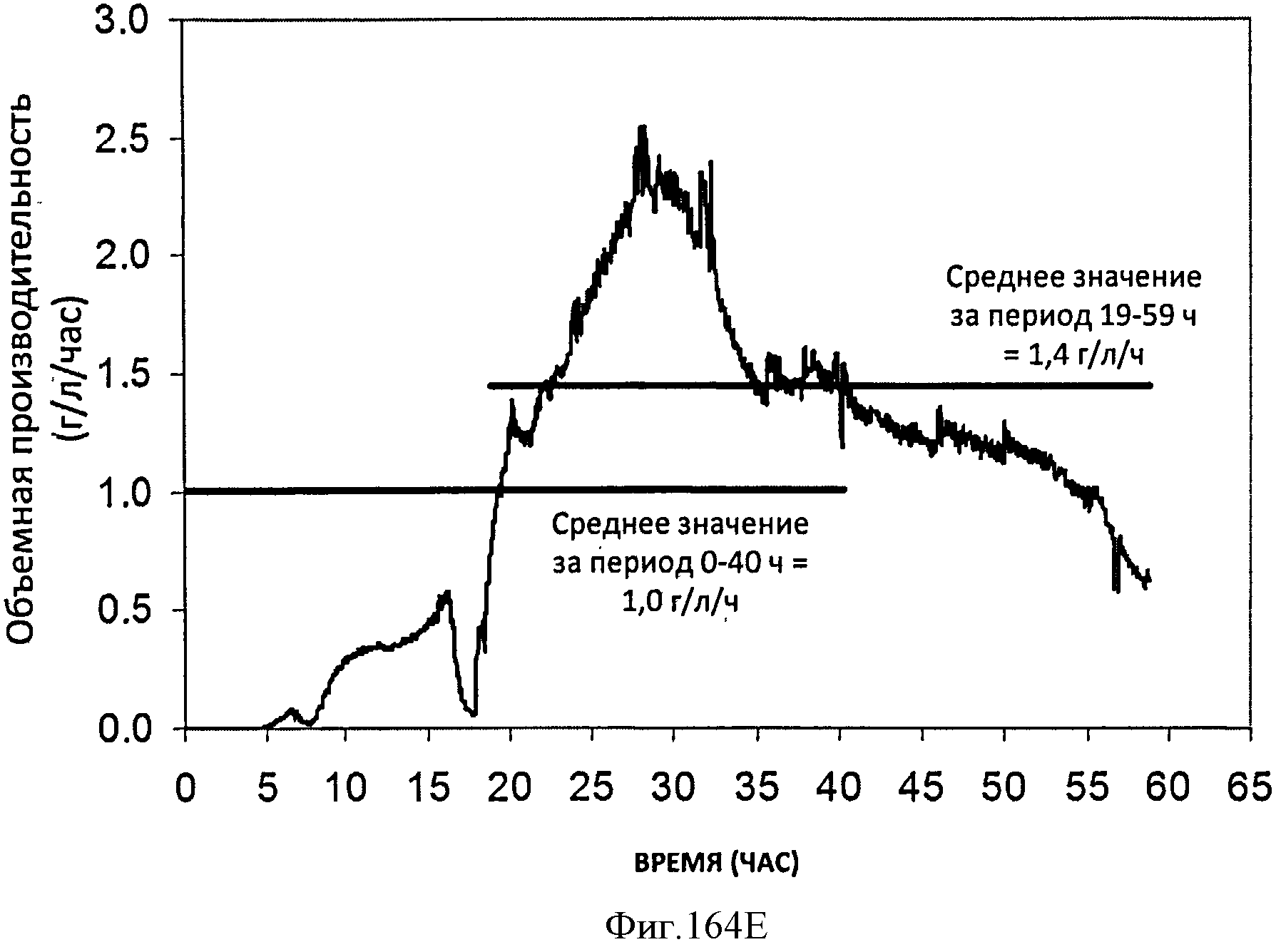
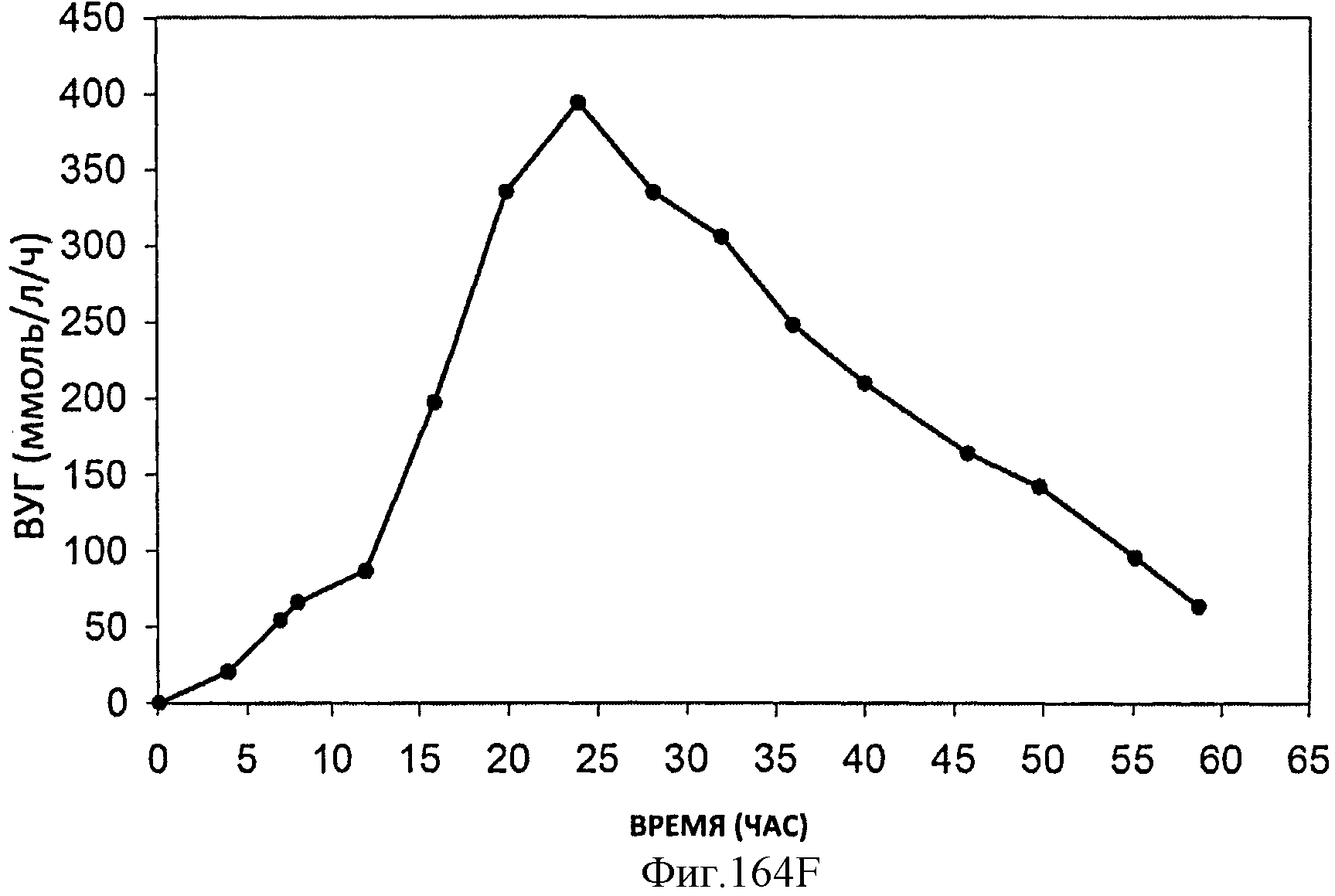
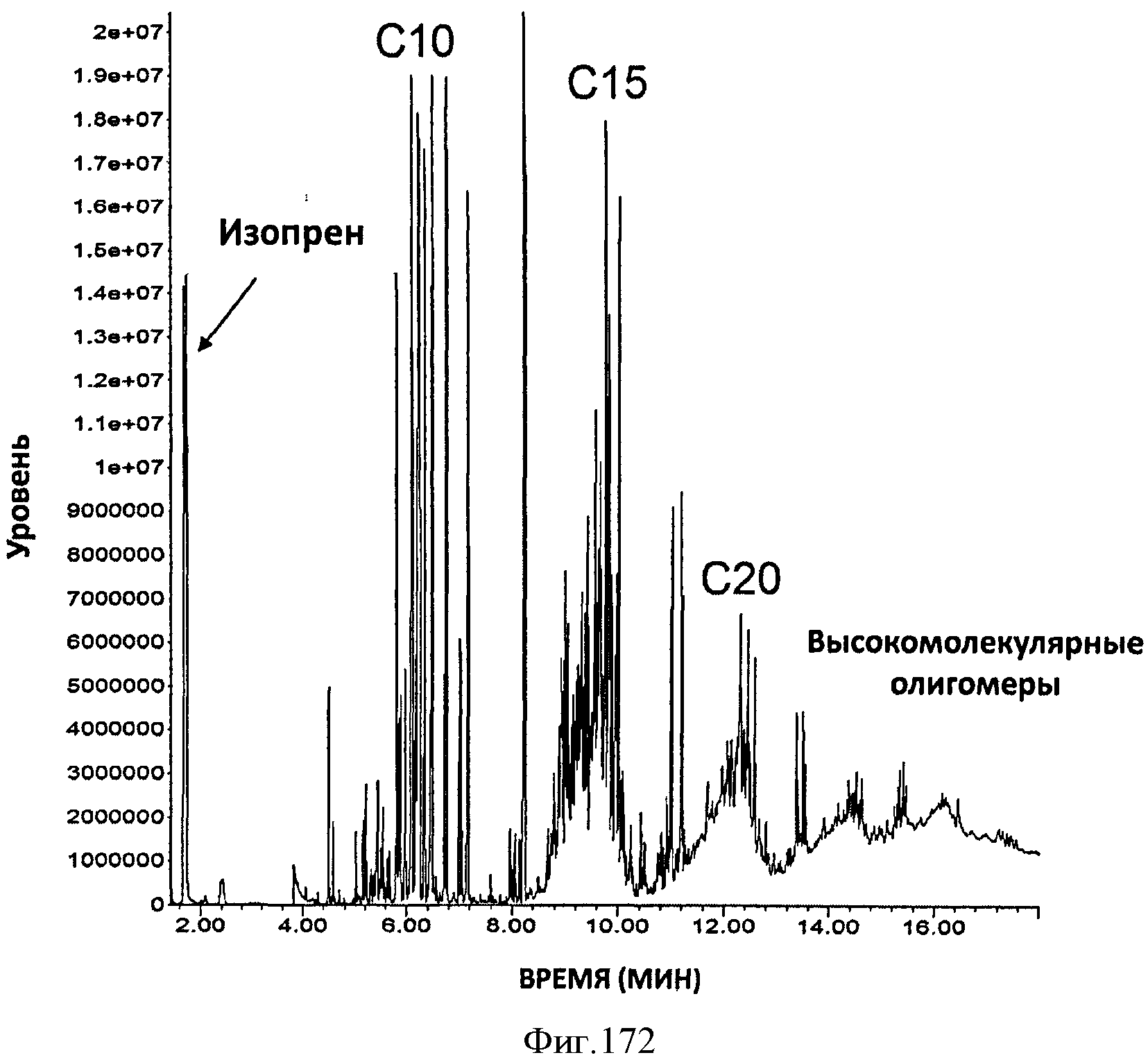
[0245] Фигуры 164А-F представляют собой графики продукции изопрена штаммом Е. coli, экспрессирующим мевалонаткиназу М. mazei, изопренсинтазу Р. alba и pgl (RHM 111 608-2), который растили в культуре с подпиткой в масштабе 15 л. На Фигуре 164А показана зависимость оптической плотности внутри 15 л биореактора, в который подавали глюкозу, от времени. На Фигуре 164В показана зависимость титра изопрена внутри 15 л биореактора, в который подавали глюкозу, от времени. Титр определяют как количество изопрена, продуцированного на. литр ферментационного бульона. Способ определения количества изопрена: совокупное количество изопрена, продуцированного за 59 ч, г/объем ферментатора за 59 ч, л [=] г/л бульона. На Фигуре 164С также показана зависимость титра изопрена внутри 15 л биореактора, в который подавали глюкозу, от времени. Способ определения количества изопрена: ∫мгновенной скорости продукции изопрена, r/n/4)dt от t=0 до 59 часов [=] г/л бульона. На Фигуре 164D показана зависимость содержания изопрена, полученного внутри 15 л биореактора, в который подавали глюкозу, от времени. На Фигуре 164Е показана объемная производительность внутри 15 л биореактора, в который подавали глюкозу. На Фигуре 164F показана скорость выделения диоксида углерода (CER), или профиль метаболической активности, внутри 15 л биореактора, в который подавали глюкозу.
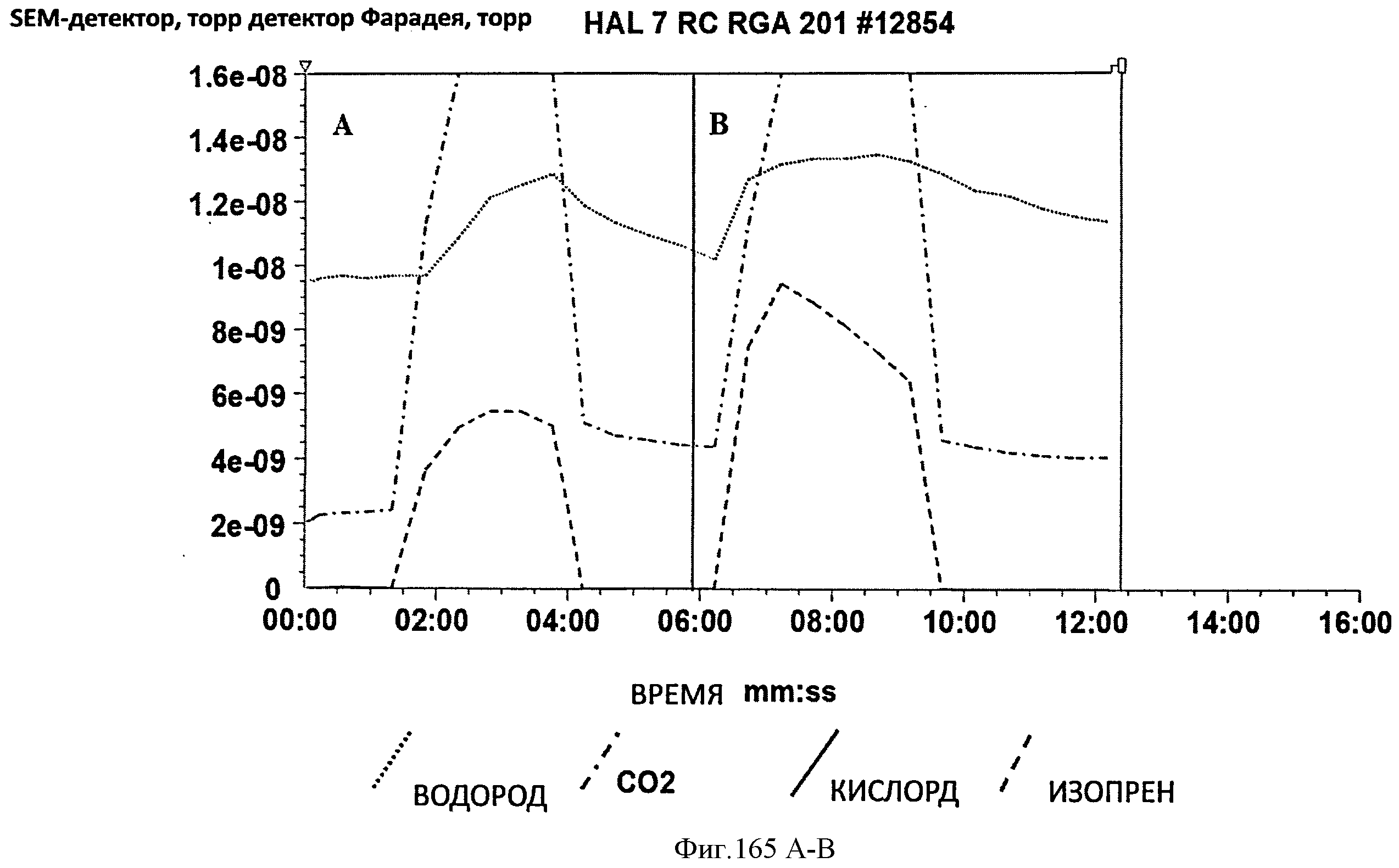
[0246] Фигуры 165А-Б представляют собой графики, на которых показан анализ выделяющегося при ферментации газа в 15 л биореакторах. Образец А представляет собой штамм RM111608-2, отобранный через 64,8 часов. Образец В представляет собой штамм EWL256, который представлял собой Е. coli BL21 (DE3), pCL upper, cmR-gil,2-yKKDyI, pTrcAlba-mMVK, отобранный через 34,5 часов. Уровень водорода детектировали выше исходного (0,95×10"8 торр) для обоих образцов.
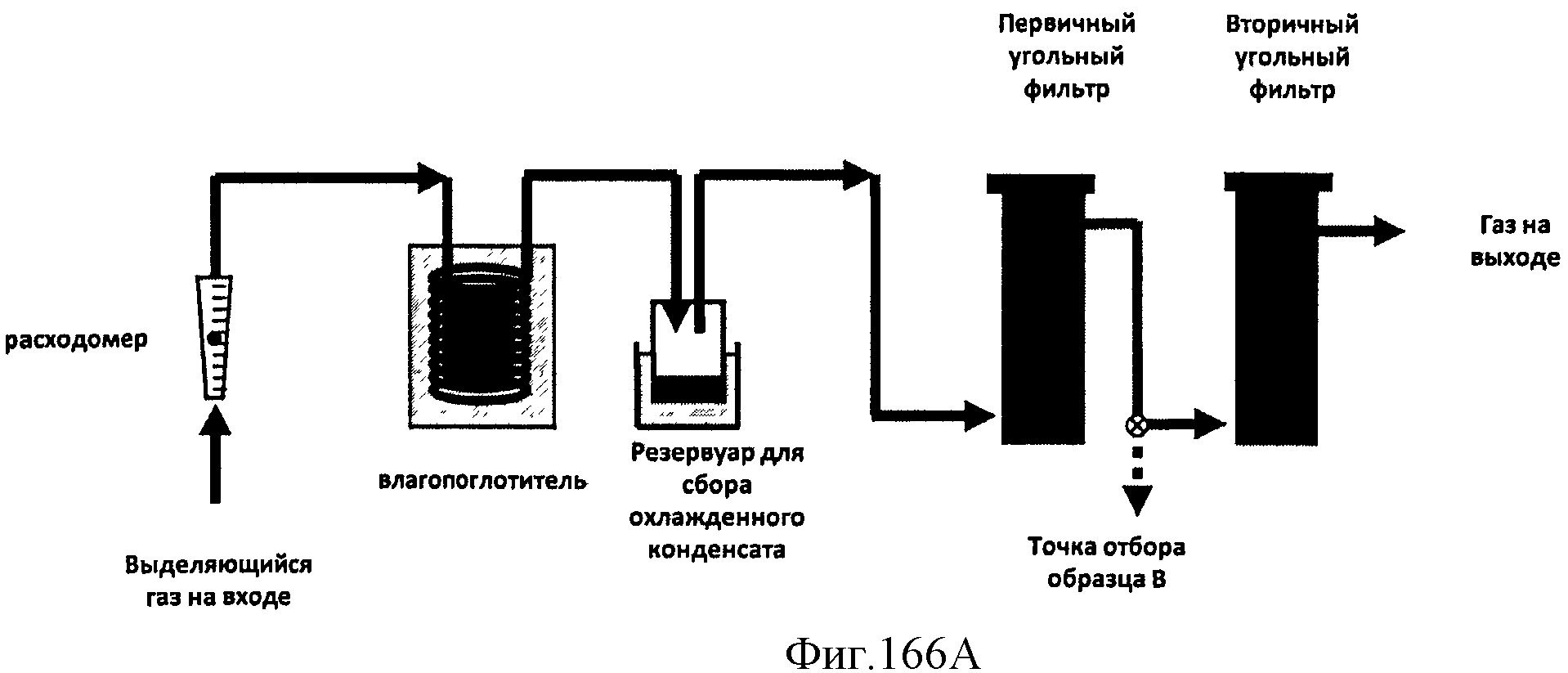
[0247] На Фигуре 166А показано типичное устройство для получения Биоизопрена™.
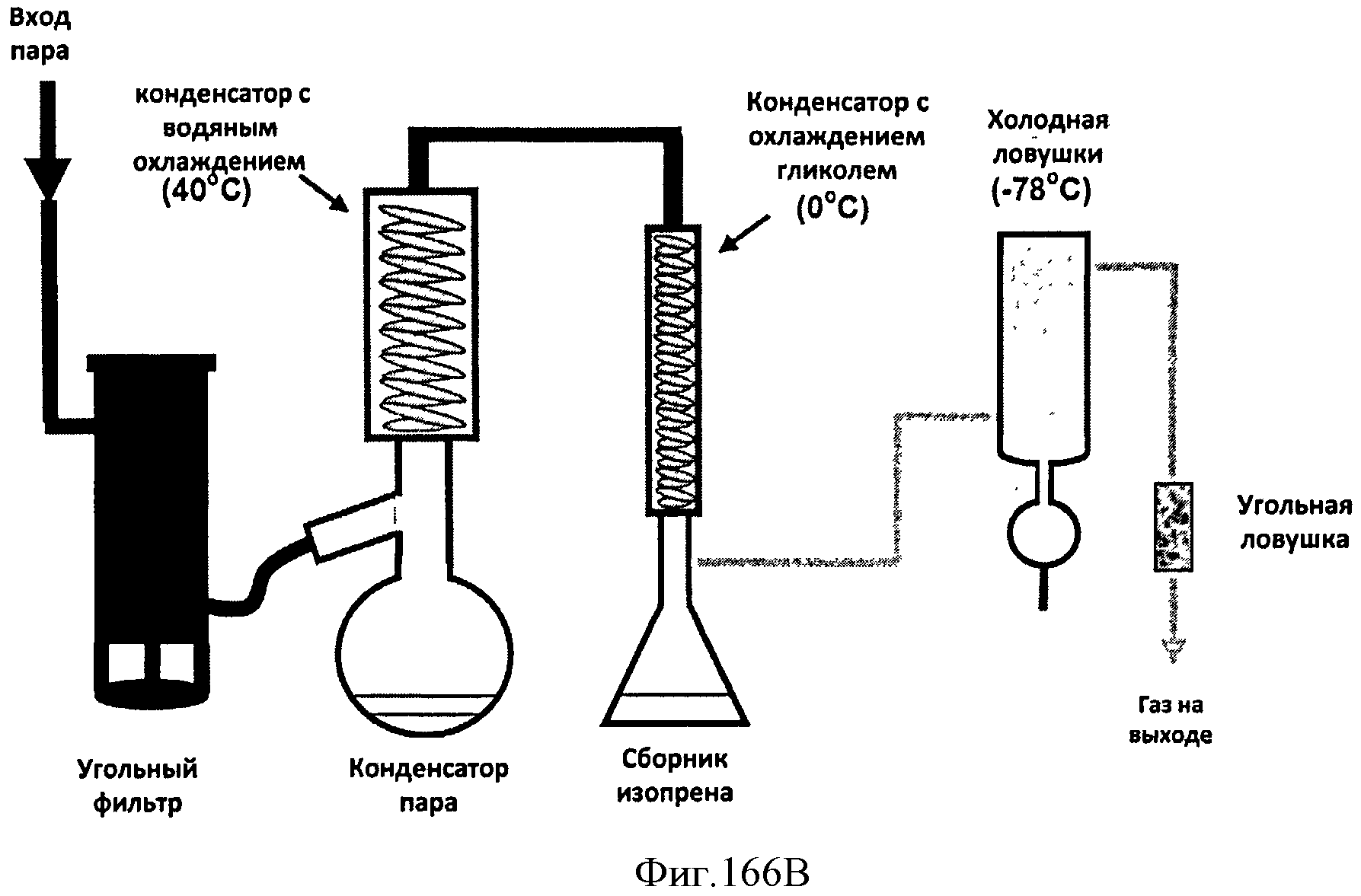
[0248] На Фигуре 166B показана типичная установка десорбции/конденсации Биоизопрена™.
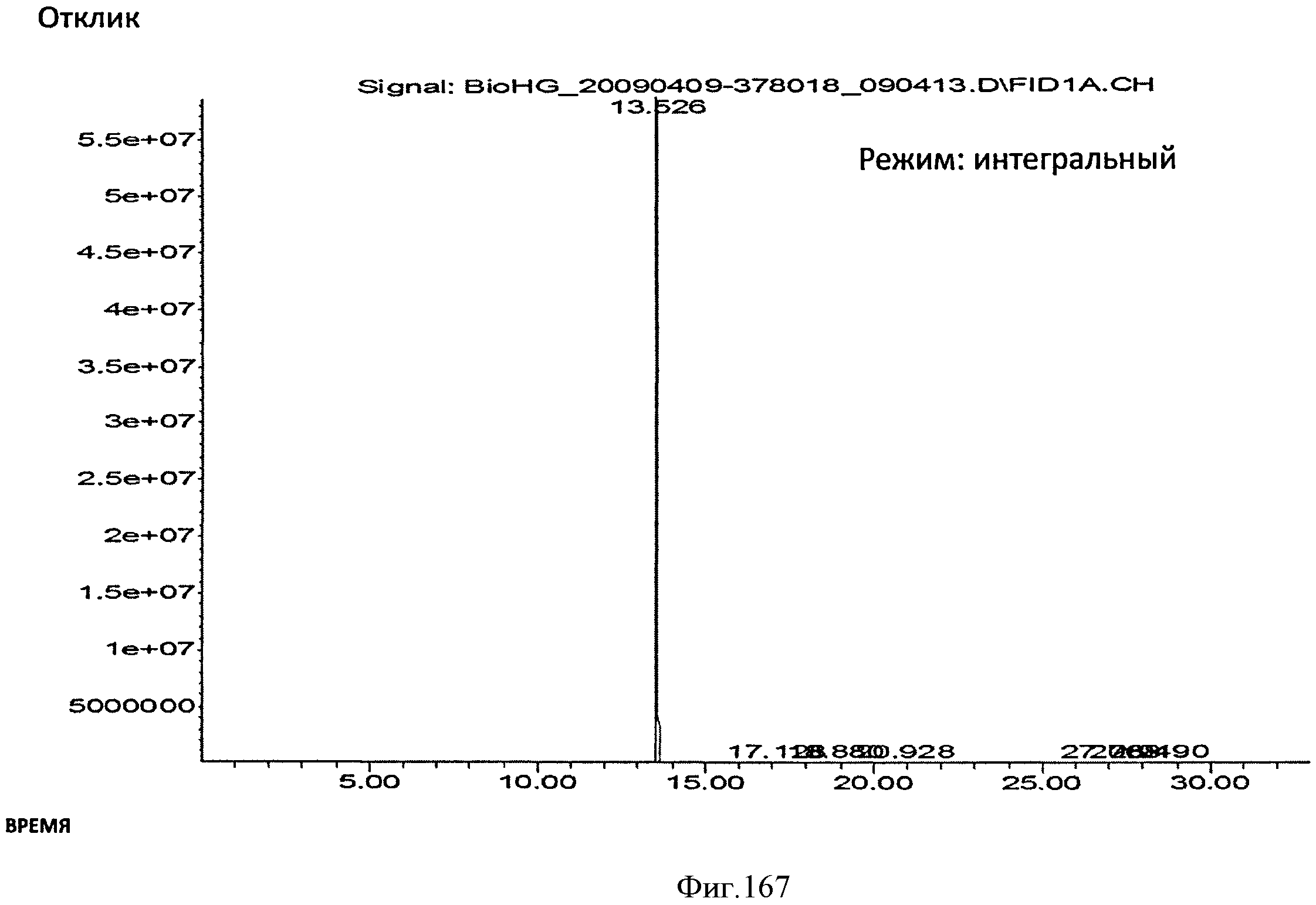
[0249] На Фигуре 167 показана хроматограмма, полученная с помощью газового хроматографа с пламенно-ионизационным детектором (ГХ/ПИД), полученного Биоизопрена™. Определили, что материал имеет чистоту 99,7%.
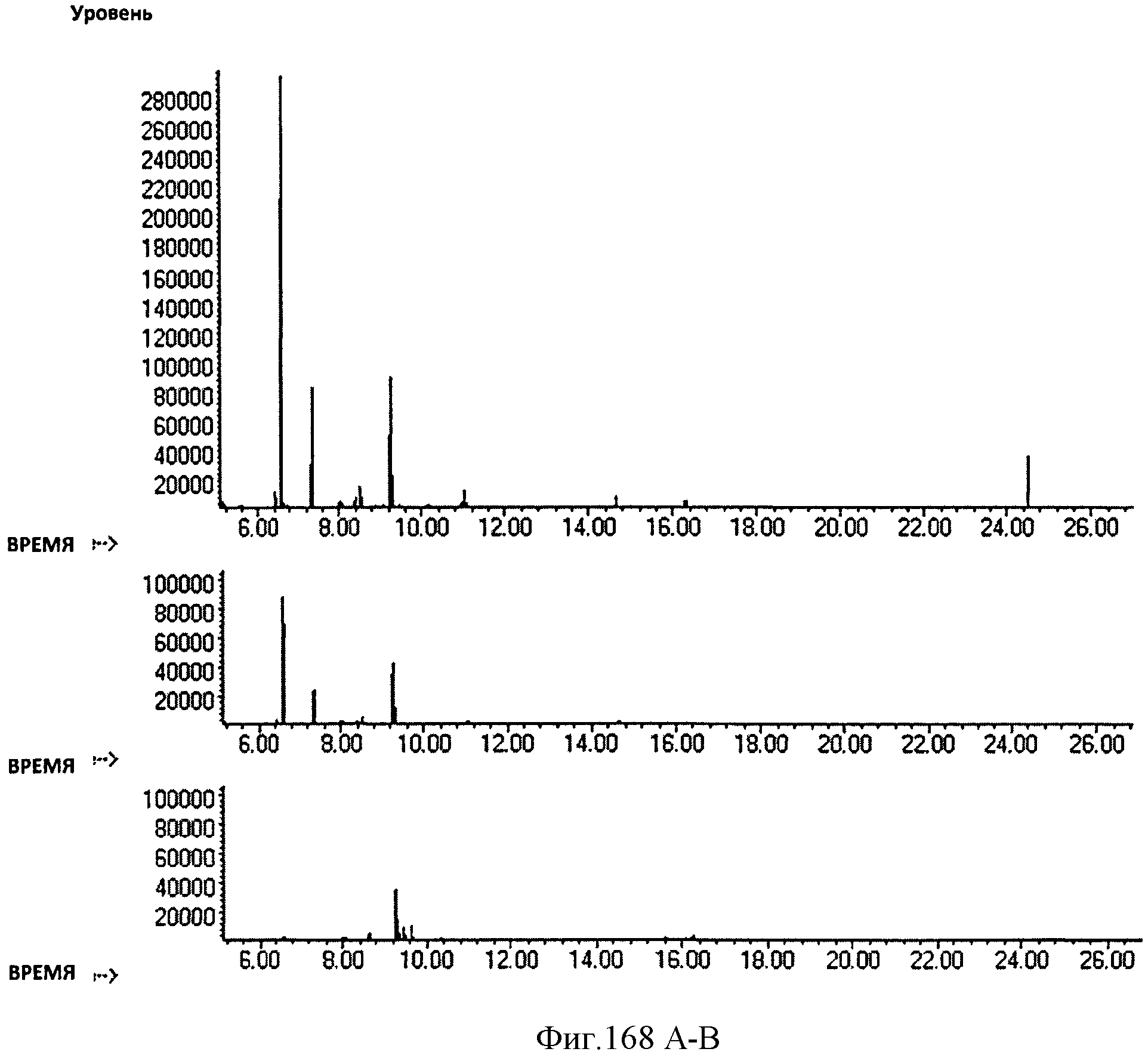
[0250] На Фигуре 168А- в показаны хроматограммы ГХ/ПИД образца Биоизопрена™ перед (А) и после обработки окисью алюминия (В) или кремния (С). Пик изопрена не показан на данных хроматограммах.
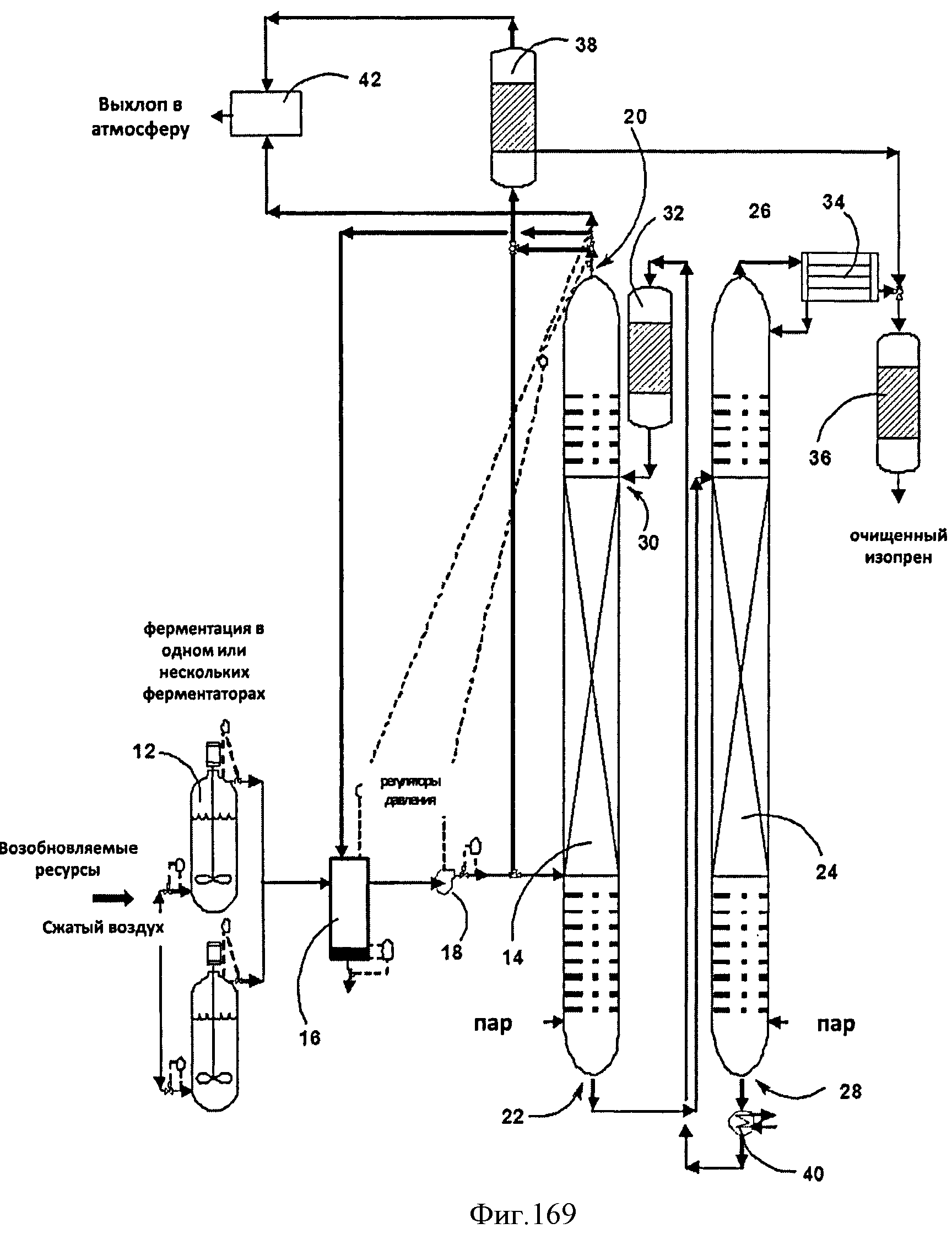
[0251] На Фигуре 169 представлена схема процесса и соответствующего устройства для очистки изопрена из выделяющегося при ферментации газа.
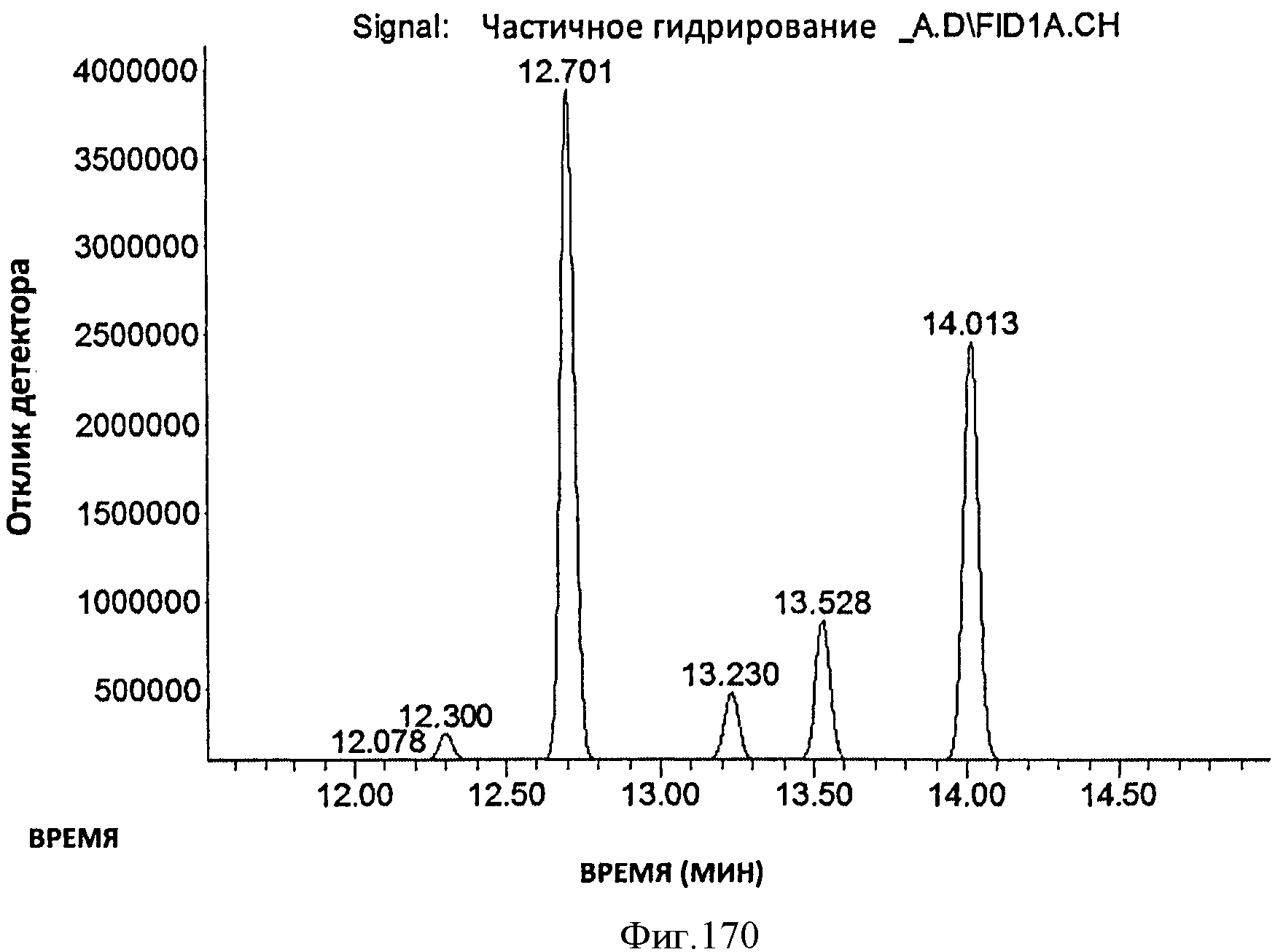
[0252] На Фигуре 170 показана хроматограмма ГХ/ПИД частично гидрированного мономера Биоизопрена™. Соединение 1 (рабочее время=12,30 мин)=3-метил-1-бутен, соединение 2 (рабочее время=12,70 мин)=2-метилбутан, соединение 3 (рабочее время=13,23 мин)=2-метил-1-бутен, соединение 4 (рабочее время=13,53 мин)=изопрен, соединение 5 (рабочее время=14,01 мин)=2-метил-2-бутен).
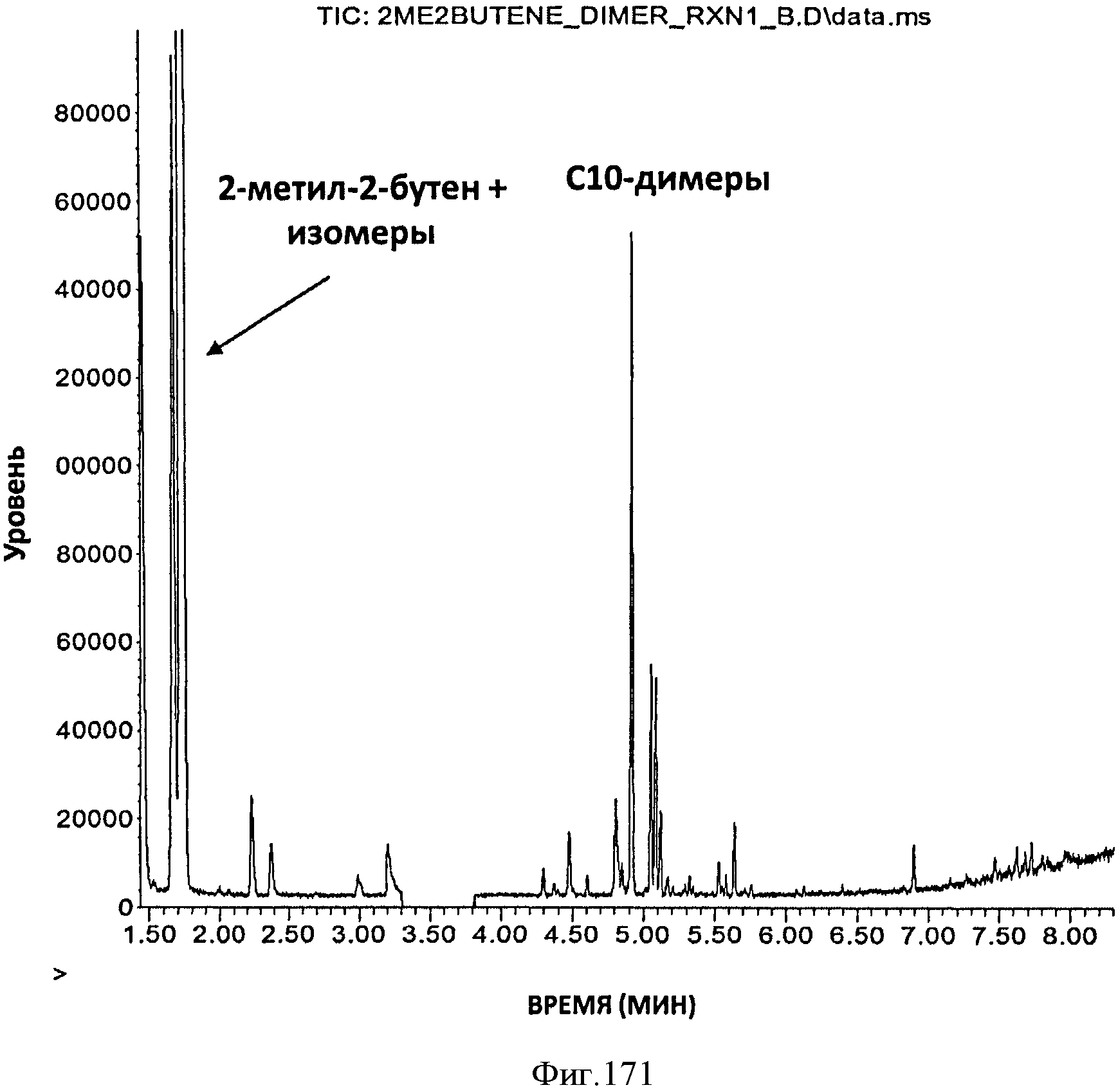
[0253] На Фигуре 171 показана хроматограмма общего ионного тока ГХ/МС продуктов, полученных при димеризации 2-метил-2-бутена, катализированной кислой смолой Amberlyst-15.
[0254] На Фигуре 172 показана хроматограмма общего ионного тока ГХ/МС продуктов, полученных при олигомеризации мономера Биоизопрена™, катализированной кислой смолой Amberlyst-15.
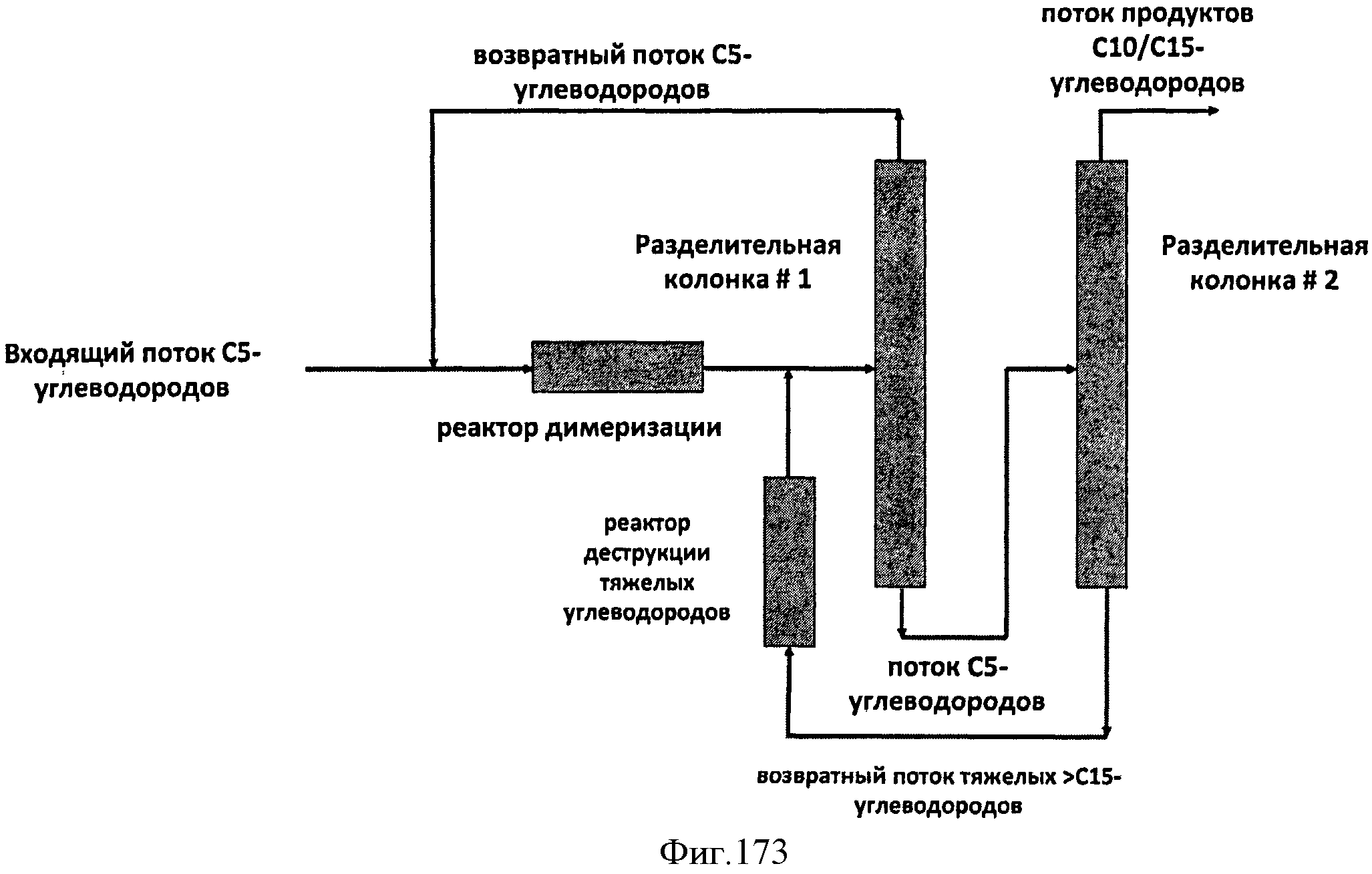
[0255] На Фигуре 173 показана принципиальная схема процесса переработки фракции С5 во фракцию продукта С10/С15 с помощью димеризационного реактора. Фракция С5 включает мономер Биоизопрена™ и/или С5-производные мономера Биоизопрена™.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0256] Согласно настоящему изобретению предложены, среди прочего, композиции и способы получения компонента топлива из изопрена. В настоящем описании предложены компоненты или добавки к топливу, например, циклические димеры и •гримеры изопрена, линейные олигомеры изопрена, ароматические и алициклические производные изопрена и кислородсодержащие производные изопрена. Компонент топлива можно получить путем химических превращений исходных веществ, содержащих коммерчески предпочтительное количество изопрена высокой степени чистоты. В одном аспекте, коммерчески предпочтительное количество изопрена высокой степени чистоты включает биоизопрен. В другом аспекте, коммерчески предпочтительное количество изопрена высокой степени чистоты может составлять биоизопрен. В другом аспекте, коммерчески предпочтительное количество изопрена высокой степени чистоты могут составлять композиции изопрена высокой степени чистоты, полученные путем культивирования клеток, экспрессирующих гетерологичный фермент изопренсинтазу. В других аспектах, изопрен высокой степени чистоты подвергают олигомеризации с получением ненасыщенных олигомеров изопрена, таких как циклические димеры или тримеры и линейные олигомеры. Ненасыщенные олигомеры можно гидрировать с получением насыщенного углеводородного компонента топлива. В некоторых вариантах реализации, реакция изопрена высокой степени чистоты со спиртами в присутствии кислотного катализатора позволяет получить топливные оксигенаты. В другом аспекте, изопрен высокой степени чистоты частично гидрируют с получением изоамиленов. В некоторых вариантах реализации, изоамиленовый продукт, полученный из изопрена высокой степени чистоты, подвергают димеризации с получением изодеценов. В некоторых вариантах реализации, изоамиленовые продукты, полученные из изопрена высокой степени чистоты, приводят в контакт со спиртами в присутствии кислотного катализатора с получением топливных оксигенатов.
[0257] Биоизопрен, полученный из возобновляемого углерода, можно превратить во множество видов углеводородного топлива путем химического катализа. В настоящей заявке предложены способы получения изопрена в результате ферментации и последующей переработки в углеводородное топливо путем химического катализа в соединения с более высокой молекулярной массой. Данные способы включают, но не ограничены перечисленными: получение и очистку изопрена от выделяющегося при ферментации газа и последующий катализ в газообразной или жидкой фазе с получением соединений с энергетическим потенциалом. Предполагается, что в объем настоящего изобретения входят как непрерывные, так и периодические процессы,
[0258] В настоящем описании приведены дополнительные сведения о том, что биоизопреновая композиция отличается от композиции нефтеизопрена (petro-isoprene) тем, что биоизопреновая композиция по существу не содержит какие-либо контаминирующие ненасыщенные С5-углеводороды, которые обычно присутствуют в композициях нефтеизопрена, такие как, не ограничиваясь перечисленными: 1,3-циклопентадиен, транс-1,3-пентадиен, цис-1,3-пентадиен, 1,4-пентадиен, 1-пентин, 2-пентин, 3-метил-1-бутин, пент-4-ен-1-ин, транс-пент-3-ен-1-ин и цис-пент-3-ен-1-ин. Если какие-либо контаминирующие ненасыщенные С5-углеводороды присутствуют в исходном материале биоизопрена, описанном в данной заявке, они присутствуют на более низких уровнях, чем в композициях нефтеизопрена. Соответственно, любые топливные продукты, полученные из биоизопреновых композиций, описанных в данной заявке, по существу не содержат или содержат на более низких уровнях, чем в топливных продуктах, полученных из нефтеизопрена, любые контаминирующие ненасыщенные углеводороды С5 или продукты, полученные из таких контаминирующих ненасыщенных С5-углеводородов. Вдобавок, уровни серы в биоизопреновой композиции ниже, чем уровни серы в композициях нефтеизопрена. Топливные продукты, полученные из биоизопреновых композиций, содержат более низкие уровни серы, чем уровни серы, которые содержатся в топливных продуктах, полученных из нефтеизопрена.
[0259] Биоизопрен отличается от нефтеизопрена тем, что биоизопрен получают вместе с другими биологическими побочными продуктами (соединениями, полученными из биологических источников и/или связанными с биологическими процессами, которые получают вместе с биоизопреном), которые отсутствуют или присутствуют на гораздо более низких уровнях в композициях нефтеизопрена, такими как спирты, альдегиды, кетоны и тому подобные побочные продукты. Биологические побочные продукты могут включать, но не ограничены перечисленными: этанол, ацетон, метанол, ацетальдегид, метакролеин, метилвинилкетон, 2-метил-2-винилоксиран, цис- и транс-3-метил-1,3-пентадиен, пренильные спирты С5 (такие как 3-метил-3-бутен-1-ол или 3-метил-2-бутен-1-ол), 2-гептанон, 6-метил-5-гептен-2-он, 2,4,5-триметилпиридин, 2,3,5-триметилпиразин, цитронеллаль, метантиол, метилацетат, 1-пропанол, диацетил, 2-бутанон, 2-метил-3-бутен-2-ол, этилацетат, 2-метил-1-пропанол, 3-метил-1-бутаналь, 3-метил-2-бутанон, 1-бутанол, 2-пентанон, 3-метил-1-бутанол, этилизобутират.3-метил-2-бутеналь, бутилацетат, 3-метилбутилацетат, 3-метил-3-бутен-1-ил ацетат, 3-метил-2-бутен-1-ил ацетат, 3-гексен-1-ол, 3-гексен-1-ил ацетат, лимонен, гераниол (транс-3,7-диметил-2,6-октадиен-1-ол), цитронеллол (3,7-диметил-6-октен-1-ол), (Е)-3,7-диметил-1,3,6-октатриен, (Z)-3,7-диметил-1,3,б-октатриен, 2,3-циклогептенолпиридин или линейный полимер изопрена (такой как линейный димер изопрена или линейный тример изопрена, полученные в результате полимеризации нескольких единиц изопрена). Топливные продукты, полученные из биоизопрена, включают один или более из биологических побочных продуктов или соединений, полученных из любого из биологических побочных продуктов. Кроме того, топливные продукты, полученные из биоизопрена, могут включать соединения, образованные из данных биологических побочных продуктов в процессе последующего химического превращения. Примеры таких соединений включают соединения, полученные в результате диенофильного циклоприсоединения Дильса-Альдера к изопрену или его топливным производным, окисления изопрена или топливных производных.
[0260] Дополнительно, биоизопрен отличается от нефтеизопрена углеродным отпечатком. В одном аспекте, биоизопрен обладает более высоким содержанием радиоактивного углерода-14 (14С) или более высоким соотношением14С/12С, чем нефтеизопрен. Биоизопрен получают из возобновляемых источников углерода, таким образом, содержание14С или соотношение14С/12С в биоизопрене такое же, как и в атмосфере в настоящее время. Нефтеизопрен, с другой стороны, получают из ископаемого топлива, отложенного тысячи миллионов лет назад, таким образом, содержание14С или соотношение14С/12С уменьшается вследствие радиоактивного распада. В настоящем описании подробно обсуждается, что топливные продукты, полученные из биоизопрена, имеют более высокое содержание14С или соотношение14С/12С, чем топливные продукты, полученные из нефтеизопрена. В одном варианте реализации, топливный продукт, полученный из биоизопрена, описанного в данной заявке, имеет содержание14С или соотношение14С/12С аналогичное таковому в атмосфере. В другом аспекте, биоизопрен можно аналитически отличить от нефтеизопрена с помощью соотношения стабильных изотопов углерода (13С/12С), которое можно называть " значением дельта", обозначенного символом δ13С.Например, для изопрена, полученного в результате экстрактивной перегонки фракций С5 с нефтеперерабатывающих заводов, δ13С составляет от приблизительно -22‰ до приблизительно -24‰. Этот диапазон типичен для легких, ненасыщенных углеводородов, полученных из нефти, и продукты, полученные из изопрена на нефтяной основе, обычно содержат изопреновые единицы с таким же δ13С.Биоизопрен, полученный путем ферментации глюкозы, полученной из кукурузы (δ13С - 10,73‰) с минимальными количествами других содержащих углерод питательных веществ (например, дрожжевого экстракта), позволяет получить изопрен, который может полимеризоваться в полиизопрен с δ13С от -14,66‰ до -14,85‰. Ожидается, что продукты, полученные из такого биоизопрена, имеют значения δ13С менее отрицательные, чем значения, полученные для изопрена на основе нефти.
[0261] Соединения, полученные с помощью описанных способов, включают циклические димеры и тримеры изопрена, линейные. олигомеры, ароматические и алициклические производные. Диизоамилены получают с помощью способов, включающих частичное гидрирование композиций биоизопрена. Данные химические производные изопрена являются подходящими в качестве жидкого транспортного топлива (IsoFuels™) и в качестве добавок к топливу.
[0262] Также в настоящей заявке предложены способы получения кислородсодержащих производных изопрена, включая спирты, кетоны, сложные и простые эфиры. Способы синтеза кислородсодержащих производных изопрена также можно осуществить в жидкой или газообразной фазе, применяя гомогенные и гетерогенные катализаторы. Соединения данного класса химических веществ также подходят в качестве жидкого транспортного топлива, и их можно использовать в топливных смесях в качестве топливных оксигенатов для уменьшения выбросов и в качестве модификаторов топлива, например, в качестве добавок, повышающих цетановое число дизельного топлива.
[0263] Несмотря на то, что изопрен можно получить путем фракционирования нефти, очистка полученного материала дорога и требует временных затрат. Крекинг С5-углеводородной фракции нефти позволяет получить лишь приблизительно 15%. изопрена. Изопрен также продуцируется естественным образом множеством видов микроорганизмов, растений и животных. В частности, идентифицировано два пути биосинтеза изопрена: мевалонатный (MVA) путь и немевалонатный (DXP) путь. Культуры клеток, созданных методами генетической инженерии, позволили получить изопрен в биореакторах более эффективно, в больших количествах, с более высокой степенью чистоты и/или с уникальными профилями распределения примесей, например, описанные в предварительной заявках на патент США с номерами 61/013386 и 61/013574, поданных 13 декабря 2007 г., WO 2009/076676, предварительных заявках на патент США с номерами 61/134094, 61/134947, 61/134,011 и 61/134103, поданных 2 июля 2008 г., WO 2010/003007, предварительной заявке на патент США под номером 61/097163, поданной 15 сентября 2008 г., WO 2010/031079, предварительной заявке на патент США под номером 61/097186, поданной 15 сентября 2008 г., WO 2010/031062, предварительной заявке на патент США под номером 61/097,189, поданной 15 сентября 2008 г„ WO 2010/031077, предварительной заявке на патент США под номером 61/097,200, поданной 15 сентября 2008 г., WO 2010/031068. предварительной заявке на патент США под номером 61/097204, поданной 15 сентября 2008 г., WO 2010/031076, предварительной заявке на патент США под номером 61/141652, поданной декабря 30, 2008, PCT/US09/069862, заявке на патент США под номером 12/335071, поданной 15 декабря 2008 г.(US 2009/0203102 А1) и заявке на патент США под номером 12/429143, поданной 23 апреля 2009 г.(US 2010/0003716 А1), которые полностью включены в настоящее описание посредством ссылки.
Определения
[0264] Если не указано иначе в настоящем описании, все технические и научные термины, используемые в настоящем описании, имеют те же значения, которые обычно понимает средний специалист в области, к которой относится настоящее изобретение. Несмотря на то, что при осуществлении настоящего изобретения находят применение любые методы и материалы, аналогичные или эквивалентные описанным в данной заявке,, предпочтительные методы и материалы описаны в данной заявке. Соответственно, термины, определения которых приведены ниже, наиболее полно описываются исходя из описания в целом. Соответствующие части всех цитированных документов включены в данную заявку посредством ссылки. Тем не менее, цитирование любого документа не должно толковаться как допущение того, что указанный документ является известным уровнем техники по отношению к настоящему изобретению.
[0265] В настоящем описании формы единственного числа включают ссылку на формы множественного числа, если в контексте не указано иное.
[0266] Предполагается, что любое максимальное ограничение числовых значений. приведенное где-либо в настоящем описании, включает каждое более низкое ограничение числовых значений, как если бы такое более низкое числовое ограничение было явно указано в данной заявке. Каждое минимальное ограничение числовых значений, приведенное где-либо в настоящем описании, будет включать каждое более высокое ограничение числовых значений, как если бы такое более высокое числовое ограничение было явно указано в данной заявке. Каждый числовой диапазон, приведенный где-либо в настоящем описании, будет включать каждый более узкий числовой диапазон, который находится в пределах такого более широкого числового диапазона, как если бы такие более узкие числовые диапазоны все были явно указаны в данной заявке.
[0267] Термин "изопрен" относится к 2-метил-1,3-бутадиену (CAS# 78-79-5), который представляет собой прямой и конечный летучий С5-углеводородный продукт отщепления пирофосфата от 3,3-диметилаллилпирофосфата (DMAPP), и не включает образование связи или полимеризацию молекулы (молекул) IPP с молекулой (молекулами) DMAPP. Как правило, не предполагается, что термин "изопрен" ограничен способом его получения, если в настоящем описании не указано иначе.
[0268] В настоящем описании "полученный биологическим путем изопрен" или "биоизопрен" представляет собой изопрен, полученный с помощью любых биологических средств, например, продуцированный созданной методами генетической инженерии культурой клеток, природными микроорганизмами, растениями или животными,
[0269] "Биоизопреновая композиция" относится к композиции, которую можно получить с помощью любых биологических средств, таких как системы (например, клетки), которые сконструированы таким образом, чтобы они продуцировали изопрен. Композиция включает изопрен и другие соединения, которые образуются вместе с изопреном (включая примеси) и/или выделяются вместе с изопреном. Биоизопреновая композиция обычно включает меньше углеводородных примесей, чем изопрен, полученный из нефтехимических источников, и часто требует минимальной обработки, чтобы достичь нужной степени чистоты для полимеризации. В настоящем описании подробно описано, что биоизопреновая композиция также имеет отличный профиль распределения примеси по сравнению с композицией изопрена, полученной нефтехимическим путем.
[0270] В настоящем описании «по меньшей мере часть исходной композиции изопрена» может относиться к по меньшей мере приблизительно 1%, 5%, 10%, 15%, 20%. 25%, 30%. 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%. 80%, 85%, 90%, 91%. 92%, 93%. 94%, 95%, 96%, 97%, 98%, 99%, 99,5%, 99,6%, 99,7%. 99,8%. 99,9% или 100% исходной композиции изопрена, подвергаемой химическому превращению.
[0271] В настоящем описании IsoFuels™ относится к топливу, включая жидкое транспортное топливо, которое получают из изопрена. BioIsoFuels™ относится к топливу, включая жидкое транспортное топливо, которое получают из биоизопрена.
[0272] Термин "олигомеризация" в настоящем описании относится к химическому процессу объединения двух или более мономерных единиц. "Олигомеризация" изопрена позволяет получить производное изопрена, полученное из двух или более молекул изопрена, такое как линейные димеры изопрена, циклические димеры изопрена, линейные тримеры изопрена, циклические тримеры изопрена и тому подобные производные.
[0273] "Полное гидрирование". "полностью гидрировать" или "целиком гидрировать" определяют как присоединение водорода (Н2), обычно в присутствии катализатора для гидрирования, ко всем ненасыщенным функциональным группам, таким как углерод-углеродные двойные связи, в исходном соединении с получением полностью насыщенных соединений продукта. Например, полное гидрирование изопрена позволяет получить изопентан, в результате чего потребляется 2 моля Hz на моль изопрена.
[0274] "Частичное гидрирование" или "частично гидрировать" определяют как присоединение водорода (H2), обычно в присутствии катализатора гидрирования, к по меньшей мере одной, но не всем, ненасыщенным функциональным группам, таким как углерод-углеродные двойные связи, в исходном соединении. Продукт(ы) частичного гидрирования затем можно полностью гидрировать с получением полностью насыщенных соединений продукта. Частичное гидрирование диена приводит к получению одного или нескольких моноолефинов. Например, частичное гидрирование изопрена может привести к получению 3 изомерных изопентенов (2-метилбут-1-ена, 2-метилбут-2-ена и 3-метилбут-1-ена), в результате чего потребляется 1 моль Hz на моль изопрена.
[0275] "Избирательное гидрирование" или "избирательно гидрировать" определяют как присоединение водорода (Hz), обычно в присутствии катализатора гидрирования, к по меньшей мере одной, но не всем, ненасыщенным функциональным группам, таким как углерод-углеродные двойные связи, в исходном соединении, в результате чего предпочтительно гидрируются некоторые ненасыщенные функциональные группы, но не другие ненасыщенные группы при выбранных условиях. Например, избирательное гидрирование изопрена может предпочтительно привести к получению 2-метил-2-бутена, 2-метил-1-бутена, 3-метил-1-бутена или смеси указанных соединений.
[0276] В настоящем описании термин "полипептиды" включает полипептиды, белки, пептиды, фрагменты полипептидов и гибридные полипептиды.
[0277] В настоящем описании "изолированный полипептид" не является частью библиотеки полипептидов, такой как библиотека, включающая 2, 5, 10, 20, 50 или более различных полипептидов, и он отделен от по меньшей мере одного компонента, вместе с которым он встречается в природе. Изолированный полипептид можно получить, например, путем экспрессирования рекомбинантной нуклеиновой кислоты, кодирующей указанный полипептид.
[0278] Под "гетерологичным полипептидом" понимают полипептид, последовательность аминокислот которого не идентична таковой у другого полипептида, который экспрессируется в природе в той же клетке-хозяине. В частности, гетерологичный полипептид не идентичен полипептиду дикого типа, который обнаруживают в той же клетке-хозяине в природе.
[0279] "Вырожденность кодонов" относится к неоднозначности генетического кода, которая позволяет изменение последовательности нуклеотидов без изменения последовательности аминокислот кодированного полипептида. Для квалифицированного специалиста очевидно существование "предпочтения кодонов", которое проявляется конкретной клеткой-хозяином в отношении использования нуклеотидных кодонов для данной конкретной аминокислоты. Следовательно, при синтезировании нуклеиновой кислоты для повышенной экспрессии в клетке-хозяине в некоторых вариантах реализации требуется разработать нуклеиновую кислоту таким образом, чтобы частота использования в нем кодонов достигала частоты предпочтительного использования кодонов клеткой-хозяином.
[0280] В настоящем описании "нуклеиновая кислота" относится к двум или нескольким дезоксирибонуклеотидам и/или рибонуклеотидам, связанным ковалентной связью в одно- или двунитевой форме.
[0281] Под "рекомбинантной нуклеиновой кислотой" понимают интересующую нуклеиновую кислоту, которая не содержит одну или более нуклеиновых кислот (например, генов), которые во встречающемся в природе геноме организма, из которого получена интересующая нуклеиновая кислота, фланкируют интересующую нуклеиновую кислоту. Термин, следовательно, включает, например, рекомбинантную ДНК, которая вставлена в вектор, в автономно реплицирующуюся плазмиду или вирус или в геномную ДНК прокариот или эукариот, или которая существует в виде отдельной молекулы (например, кДНК, фрагмента геномной ДНК или фрагмента кДНК, полученных с помощью ПЦР или рестрикции путем расщепления эндонуклеазами), независимо от других последовательностей.
[0282] Под "гетерологичной нуклеиновой кислотой" понимают нуклеиновую кислоту, последовательность нуклеиновых кислот которой не идентична таковой у другой нуклеиновой кислоты, обнаруживаемой в природе в той же клетке-хозяине. В частности, гетерологичная нуклеиновая кислота не идентична нуклеиновой кислоте дикого типа, которую обнаруживают в той же клетке-хозяине в природе.
[0283] В настоящем описании термин "вектор" означает конструкцию, которая способна доставлять и, желательно, экспрессировать одну или более интересующих нуклеиновых кислот в клетке-хозяине. Примеры векторов включают, но не ограничены перечисленными, плазмиды, вирусные векторы, векторы экспрессии ДНК или РНК, космиды и фаговые векторы.
[0284] В настоящем описании термин "контролирующая экспрессию последовательность" означает последовательность нуклеиновых кислот, которая направляет транскрипцию интересующей нуклеиновой кислоты. Контролирующая экспрессию последовательность может представлять собой промотор, такой как конститутивный или индуцируемый промотор, или энхансер. "Индуцируемый промотор" представляет собой промотор, который активируется под воздействием окружающей среды или на определенной стадии развития. Контролирующая экспрессию последовательность функционально связана с фрагментом нуклеиновой кислоты, который нужно транскрибировать.
[0285] Термин "селективный маркер" или "селектируемый маркер" относится к нуклеиновой кислоте, способной экспрессироваться в клетке-хозяине, которая позволяет облегчить селекцию клеток-хозяев, содержащих введенную нуклеиновую кислоту или вектор. Примеры селектируемых маркеров включают, но не ограничены перечисленными, нуклеиновые кислоты, придающие устойчивость к антибиотикам (например, канамицину, ампициллину, карбенициллину, гентамицину, гигромицину, плеомицину, блеомицину, неомицину или хлорамфениколу), и/или нуклеиновые кислоты, которые обеспечивают метаболическое преимущество, например, связанное с питательными веществами преимущество, клетке-хозяину. Типичные связанные с питательными веществами селективные маркеры включают такие маркеры, известные в данной области, как amdS, argQ и руr4.
Композиции и системы
[0286] Изопрен, полученный из нефтехимических источников, обычно представляет собой неочищенную фракцию С5-углеводородов, которая требует тщательной очистки перед тем, как указанный материал будет пригоден для полимеризации или других химических превращений. Некоторые примеси представляют особенную проблему и3-за их структурного сходства с изопреном и того факта, что такие примеси могут действовать как каталитические яды для полимеризации. Такие соединения включают, но не ограничены перечисленными: 1.3-циклопентадиен, цис- и транс-1,3-пентадиен, 1,4-пентадиен, 1-пентин, 2-пентин, 3-метил-1-бутин, пент-4-ен-1-ин, транс-пент-3-ен-1-ин и цис-пент-3-ен-1-ин. Ниже более подробно описано, что полученный биологическим путем изопрен может быть по существу свободен от любых контаминирующих ненасыщенных С5-углеводородов без прохождения тщательной очистки. Некоторые композиции полученного биологическим путем изопрена содержат этанол, ацетон и С5-пренильные спирты. Данные компоненты легче удалить из фракции изопрена, чем фракции изомерных С5-углеводородов, которые присутствуют в композициях изопрена, полученного из нефтехимических источников. Дополнительно, с такими примесями можно справиться при биологическом процессе, например, путем генетической модификации продуцирующего штамма, изменения углеродного сырья, изменения условий ферментации, модификации процесса получения и дополнительных или альтернативных способов очистки.
[0287] В одном аспекте настоящего изобретения предложены композиции и системы для получения компонента топлива из изопрена, содержащие: (а) коммерчески предпочтительное количество исходной композиции изопрена высокой степени чистоты; и (b) компонент топлива, полученный из по меньшей мере части исходного материала изопрена высокой степени чистоты; в которых по меньшей мере часть коммерчески предпочтительного количества исходной композиции изопрена высокой степени чистоты подвергается химическому превращению. Исходный материал изопрена высокой степени чистоты подвергают химическим реакциям с получением коммерчески предпочтительного количества продукта, который подходит для получения топлива. В одном аспекте, коммерчески предпочтительное количество изопрена высокой степени чистоты включает биоизопрен. В одном аспекте, коммерчески предпочтительное количество изопрена высокой степени чистоты может составлять биоизопрен.
Типичные исходные композиции изопрена
[0288] В некоторых вариантах реализации, указанное коммерчески предпочтительное количество исходной композиции изопрена высокой степени чистоты включает больше или приблизительно 2, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900 или 1000 мг изопрена. В некоторых вариантах реализации, исходная композиция изопрена включает больше или приблизительно 2, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 г изопрена. В некоторых вариантах реализации, исходная композиция изопрена включает больше или приблизительно 0,2, 0,5, 1, 2, 5, 10, 20, 50, 100, 200, 500, 1000 кг изопрена. В некоторых вариантах реализации, количество изопрена в исходной композиции находится в диапазоне от приблизительно 2 до приблизительно 5000 мг, например, в диапазоне от приблизительно 2 до приблизительно 100 мг, от приблизительно 100 до приблизительно 500 мг.от приблизительно 500 до приблизительно 1000 мг, от приблизительно 1000 до приблизительно 2000 мг, или приблизительно 2000 до приблизительно 5000 мг.В некоторых вариантах реализации, количество изопрена в исходной композиции находится в диапазоне от приблизительно 20 до приблизительно 5000 мг, от приблизительно 100 до приблизительно 5000 мг, приблизительно 200 до приблизительно 2000 мг, приблизительно 200 до приблизительно 1000 мг, приблизительно 300 до приблизительно 1000 мг или от приблизительно 400 до приблизительно 1000 мг.В некоторых вариантах реализации, количество изопрена в исходной композиции находится в диапазоне от приблизительно 2 до приблизительно 5000 г, например, в диапазоне от приблизительно 2 до приблизительно 100 г, от приблизительно 100 до приблизительно 500 г, от приблизительно 500 до приблизительно 1000 г, от приблизительно 1000 до приблизительно 2000 г или от приблизительно 2000 до приблизительно 5000 г.В некоторых вариантах реализации, количество изопрена в исходной композиции находится в диапазоне от приблизительно 2 до приблизительно 5000 кг, от приблизительно 10 до приблизительно 2000 кг, от приблизительно 20 до приблизительно 1000 кг, от приблизительно 20 до приблизительно 500 кг, от приблизительно 30 до приблизительно 200 кг или от приблизительно 40 до приблизительно 100 кг.В некоторых вариантах реализации, больше или приблизительно 20, 25, 30, 40, 50, 60, 70, 80, 90 или 95% (масс./масс.) летучей органической фракции исходной композиции представляет собой изопрен.
[0289] В некоторых вариантах реализации, исходная композиция изопрена высокой степени чистоты содержит больше или приблизительно 98,0, 98,5, 99,0, 99,5 или 100% масс. изопрена по отношению к общей массе всех С5-углеводородов в исходной композиции. В некоторых вариантах реализации, исходная композиция изопрена высокой степени чистоты содержит больше или приблизительно 99,90, 99,92, 99,94, 99,96, 99,98 или 100% масс. изопрена по отношению к общей массе всех С5-углеводородов в исходной композиции. В некоторых вариантах реализации, в исходной композиции относительное показание детектора больше или приблизительно равно 98,0, 98,5, 99,0, 99,5 или 100% для изопрена по отношению к показанию детектора для всех С5-углеводородов в исходной композиции. В некоторых вариантах реализации, в исходной композиции относительное показание детектора больше или приблизительно равно 99,90, 99,91, 99,92, 99,93, 99,94, 99,95, 99,96, 99,97, 99,98, 99,99 или 100% для изопрена по отношению к показанию детектора для всех С5-углеводородов в исходной композиции. В некоторых вариантах реализации, исходная композиция изопрена содержит от приблизительно 98,0 до приблизительно 98,5, от приблизительно 98,5 до приблизительно 99,0, от приблизительно 99,0 до приблизительно 99,5, от приблизительно 99,5 до приблизительно 99,8, приблизительно от 99,8 до 100% масс. изопрена по отношению к общей массе всех С5-углеводородов в исходной композиции. В некоторых вариантах реализации, исходная композиция изопрена содержит от приблизительно 99,90 до приблизительно 99,92, от приблизительно 99,92 до приблизительно 99,94, от приблизительно 99,94 до приблизительно 99,96, от приблизительно 99,96 до приблизительно 99,98, приблизительно от 99,98 до 100% масс. изопрена по отношению к общей массе всех С5-углеводородов в исходной композиции.
[0290] В некоторых вариантах реализации, исходная композиция изопрена высокой степени чистоты содержит меньше или приблизительно 2,0, 1,5, 1,0, 0,5, 0,2, 0,12, 0,10, 0,08, 0,06, 0,04, 0,02, 0,01, 0,005, 0,001, 0,0005, 0,0001, 0,00005 или 0,00001% С5-углеводородов, отличных от изопрена (таких, как 1,3-циклопентадиен, цис-1,3-пентадиен, транс-1,3-пентадиен, 1,4-пентадиен, 1-пентин, 2-пентин, 1-пентен, 2-метил-1-бутен, 3-метил-1-бутин, пент-4-ен-1-ин, транс-пент-3-ен-1-ин или цис-пент-3-ен-1-ин), по массе по отношению к общей массе всех С5-углеводородов в исходной композиции. В некоторых вариантах реализации, в исходной композиции относительное показание детектора меньше или приблизительно равно 2,0, 1,5, 1,0, 0,5, 0,2, 0,12, 0,10, 0,08, 0,06, 0,04, 0,02, 0,01, 0,005, 0,001, 0,0005, 0,0001, 0,00005 или 0,00001% для С5-углеводородов, отличных от изопрена, по сравнению с показанием детектора для всех С5-углеводородов в исходной композиции. В некоторых вариантах реализации, в исходной композиции относительное показание детектора меньше или приблизительно равно 2,0, 1.5, 1,0, 0,5, 0,2, 0,12, 0,10, 0,08, 0,06, 0,04, 0,02, 0,01, 0,005, 0,001, 0,0005, 0,0001, 0,00005 или 0,00001% для 1,3-циклопентадиена, цис-1,3-пентадиена, транс-1,3-пентадиена, 1,4-пентадиена, 1-пентина, 2-пентина, 1-пентена, 2-метил-1-бутена, 3-метил-1-бутина, пент-4-ен-1-ина, транс-пент-3-ен-1-ина или цис-пент-3-ен-1-ина по сравнению с показанием детектора для всех С5-углеводородов в исходной композиции. В некоторых вариантах реализации, исходная композиция изопрена высокой степени чистоты содержит от приблизительно 0,02 до приблизительно 0,04%, от приблизительно 0,04 до приблизительно 0,06%, приблизительно от 0,06 до 0,08%, приблизительно от 0,08 до 0,10% или от приблизительно 0,10 до приблизительно 0,12% С5-углеводородов, отличных от изопрена (таких, как 1,3-циклопентадиен, цис-1,3-пентадиен, транс-1,3-пентадиен, 1,4-пентадиен, 1-пентин, 2-пентин, 1-пентен. 2-метил-1-бутен, 3-метил-1-бутин, пент-4-ен-1-ин, транс-пент-3-ен-1-ин или цис-пент-3-ен-1-ин), по массе по отношению к общей массе всех С5-углеводородов в исходной композиции.
[0291] В некоторых вариантах реализации, исходная композиция изопрена высокой степени чистоты содержит меньше или приблизительно 50, 40, 30, 20, 10, 5. 1, 0,5, 0,1, 0,05, 0,01 или 0,005 мкг/л соединения, которое ингибирует полимеризацию изопрена, для любого соединения в исходной композиции, которое ингибирует полимеризацию изопрена. В некоторых вариантах реализации, исходная композиция изопрена содержит от приблизительно 0,005 до приблизительно 50, например, от приблизительно 0,01 до приблизительно 10, от приблизительно 0,01 до приблизительно 5, от приблизительно 0,01 до приблизительно 1, от приблизительно 0,01 до приблизительно 0,5 или от приблизительно 0,01 до приблизительно 0,005 мкг/л соединения, которое ингибирует полимеризацию изопрена, для любого соединения в исходной композиции, которое ингибирует полимеризацию изопрена. В некоторых вариантах реализации, исходная композиция изопрена содержит меньше или. приблизительно 50, 40, 30, 20, 10, 5, 1, 0,5, 0,1, 0,05, 0,01 или 0,005 мкг/л углеводорода, отличного от изопрена (такого, как 1,3-циклопентадиен, цис-1,3-пентадиен, транс-1,3-пентадиен, 1,4-пентадиен, 1-пентин, 2-пентин, 1-пентен, 2-метил-1-бутен, 3-метил-1-бутин, пент-4-ен-1-ин, транс-пент-3-ен-1-ин или цис-пент-3-ен-1-ин). В некоторых вариантах реализации, исходная композиция изопрена содержит от приблизительно 0,005 до приблизительно 50, например, от приблизительно 0,01 до приблизительно 10, от приблизительно 0,01 до приблизительно 5, от приблизительно 0,01 до приблизительно 1, от приблизительно 0,01 до приблизительно 0,5 или от приблизительно 0,01 до приблизительно 0,005 мкг/л углеводорода, отличного от изопрена. В некоторых вариантах реализации, исходная композиция изопрена содержит меньше или приблизительно 50, 40, 30, 20, 10, 5, 1, 0,5, 0,1, 0,05, 0,01 или 0,005 мкг/л белка или жирной кислоты (таких как белок или жирная кислота, которые в природе связаны с природным каучуком).
[0292] В некоторых вариантах реализации, исходная композиция изопрена высокой степени чистоты содержит меньше или приблизительно 10, 5, 1, 0,8, 0,5, 0,1, 0,05, 0,01 или 0,005 промилле альфа-ацетиленов, пипериленов, ацетонитрила или 1.3-циклопентадиена. В некоторых вариантах реализации, исходная композиция изопрена содержит меньше или приблизительно 5, 1, 0,5, 0,1, 0,05, 0,01 или 0,005 промилле серы или алленов. В некоторых вариантах реализации, исходная композиция изопрена содержит меньше или приблизительно 30, 20, 15, 10, 5, 1, 0,5, 0,1, 0,05, 0,01 или 0,005 промилле всех ацетиленов (таких, как 1-пентин, 2-пентин, 3-метил-1-бутин, пент-4-ен-1-ин, транс-пент-3-ен-1-ин и цис-пент-3-ен-1-ин). В некоторых вариантах реализации, исходная композиция изопрена содержит меньше или приблизительно 2000, 1000, 500, 200, 100, 50, 40, 30, 20, 10, 5, 1, 0,5, 0,1, 0,05, 0,01 или 0,005 промилле димеров изопрена, таких как циклические димеры изопрена (например, циклические соединения С10, полученные в результате димеризации двух единиц изопрена).
[0293] В некоторых вариантах реализации, исходная композиция изопрена высокой степени чистоты содержит этанол, ацетон, метанол, ацетальдегид, метакролеин, метилвинилкетон, 2-метил-2-винилоксиран, цис- и транс-3-метил-1,3-пентадиен, пренильные спирты С5 (такие как 3-метил-3-бутен-1-ол или 3-метил-2-бутен-1-ол) или любое из двух или более описанных соединений. В особых вариантах реализации, исходная композиция изопрена содержит больше или приблизительно 0,005, 0,01, 0,05, 0,1, 0,5, 1, 5, 10, 20, 30, 40, 60, 80, 100 или 120 мкг/л этанола, ацетона, метанола, ацетальдегида, метакролеина, метилвинилкетона, 2-метил-2-винилоксирана, цис- и транс-3-метил-1,3-пентадиена, пренильных спиртов С5 (таких как 3-метил-3-бутен-1-ол или 3-метил-2-бутен-1-ол) или любого из двух или более описанных соединений. В некоторых вариантах реализации, композиция изопрена содержит от приблизительно 0,005 до приблизительно 120, например, от приблизительно 0,01 до приблизительно 80, от приблизительно 0,01 до приблизительно 60, от приблизительно 0,01 до приблизительно 40, от приблизительно 0,01 до приблизительно 30, от приблизительно 0,01 до приблизительно 20, от приблизительно 0,01 до приблизительно 10, от приблизительно 0,1 до приблизительно 80, от приблизительно 0,1 до приблизительно 60, от приблизительно 0,1 до приблизительно 40, от приблизительно 5 до приблизительно 80, от приблизительно 5 до приблизительно 60 или от приблизительно 5 до приблизительно 40 мкг/л этанола, ацетона, метанола, ацетальдегида, метакролеина, метилвинилкетона, 2-метил-2-винилоксирана, цис- и транс-3-метил-1,3-пентадиена, пренильных спиртов С5 или любого из двух или более описанных соединений.
[0294] В некоторых вариантах реализации, исходная композиция изопрена высокой степени чистоты содержит один или более из следующих компонентов: 2-гептанон, 6-метил-5-гептен-2-он, 2,4,5-триметилпиридин, 2,3,5-триметилпиразин, цитронеллаль, ацетальдегид, метантиол, метилацетат, 1-пропанол, диацетил, 2-бутанон, 2-метил-3-бутен-2-ол, этилацетат, 2-метил-1-пропанол, 3-метил-1-бутаналь, 3-метил-2-бутанон, 1-бутанол, 2-пентанон, 3-метил-1-бутанол, этилизобутират, 3-метил-2-бутеналь, бутилацетат, 3-метилбутилацетат, 3-метил-3-бутен-1-ил ацетат, 3-метил-2-бутен-1-ил ацетат, 3-гексен-1-ол, 3-гексен-1-ил ацетат, лимонен, гераниол (транс-3,7-диметил-2,6-октадиен-1-ол), цитронеллол (3,7-диметил-6-октен-1-ол), (Е)-3,7-диметил-1,3,6-октатриен, (Z)-3,7-диметил-1,3,6-октатриен, 2,3-циклогептенолпиридин или линейный полимер изопрена (такой как линейный димер изопрена или линейный тример изопрена, полученные в результате полимеризации нескольких единиц изопрена). В различных вариантах реализации, количество одного из перечисленных компонентов по сравнению с количеством изопрена в единицах процента по массе (т.е., масса указанного компонента, деленная на массу изопрена, умноженная на 100) больше или приблизительно составляет 0,01, 0,02, 0,05, 0,1, 0,5, 1, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 или 110% (масс./мacc.). В некоторых вариантах реализации, относительное показание детектора для второго соединения, по сравнению с показанием детектора для изопрена, больше или приблизительно составляет 0,01, 0,02, 0,05, 0,1, 0,5, 1,5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 или 110%. В различных вариантах реализации, количество одного из перечисленных компонентов по сравнению с количеством изопрена в единицах процента по массе (т.е., масса указанного компонента, деленная на массу изопрена, умноженная на 100) находится в диапазоне от приблизительно 0,01 до приблизительно 105% (масс./масс.), например, от приблизительно 0,01 до приблизительно 90, от приблизительно 0,01 до приблизительно 80, от приблизительно 0,01 до приблизительно 50, от приблизительно 0,01 до приблизительно 20, от приблизительно 0,01 до приблизительно 10, от приблизительно 0,02 до приблизительно 50, от приблизительно 0,05 до приблизительно 50, от приблизительно 0,1 до приблизительно 50 или от 0,1 до приблизительно 20% (масс./масс.).
[0295] В некоторых вариантах реализации, по меньшей мере часть исходной композиции изопрена высокой степени чистоты находится в газообразной фазе. В некоторых вариантах реализации, по меньшей мере часть исходной композиции изопрена высокой степени чистоты находится в жидкой фазе (такой как конденсат). В некоторых вариантах реализации, по меньшей мере часть исходной композиции изопрена высокой степени чистоты находится в твердой фазе. В некоторых вариантах реализации, по меньшей мере часть исходной композиции изопрена высокой степени чистоты абсорбирована на твердой подложке, такой как подложка, которая содержит кремний и/или активированный уголь. В некоторых вариантах реализации, исходную композицию изопрена смешивают с одним или несколькими растворителями. В некоторых вариантах реализации, исходную композицию изопрена смешивают с одним или несколькими газами.
[0296] В других вариантах реализации, указанное коммерчески предпочтительное количество исходной композиции изопрена высокой степени чистоты получают с помощью биологического процесса. В некоторых предпочтительных вариантах реализации, исходная композиция изопрена высокой степени чистоты представляет собой биоизопреновую композицию, полученную путем культивирования клеток, которые продуцируют более чем приблизительно 400 нмоль изопрена/грамм клеток для сырой массы клеток/час (нмоль изопрена/гсмк/ч). В одном варианте реализации, указанную биоизопреновую композицию получают путем культивирования клеток, которые превращают более чем приблизительно 0,002% углерода в культуральной среде в изопрен. В других вариантах реализации, указанные клетки содержат гетерологичную нуклеиновую кислоту, которая (i) кодирует полипептид изопренсинтазы, например, встречающийся в природе полипептид из такого растения, как Pueraria, и которая (ii) функционально связана с промотором, например, с промотором Т7. Другие полипептиды изопренсинтазы, например, из тополя, и варианты встречающейся в природе, а также исходной, изопренсинтазы можно применять для получения биоизопрена. Примеры изопренасинтазы и ее вариантов, которые можно применять, описаны в заявке на патент США номер 12/429143, которая полностью включена в настоящее описание.
[0297] В некоторых вариантах реализации, указанные клетки культивируют в культуральной среде, которая содержит источник углерода, такой как, не ограничиваясь перечисленными, углевод, глицерол, глицерин, дигидроксиацетон, одноуглеродный источник углерода, масло, животный жир, животное масло, жирная кислота, липид, фосфолипид, глицеролипид, моноглицерид, диглицерид, триглицерид, возобновляемый источник углерода, полипептид (например, белок или пептид микроорганизма или растения), дрожжевой экстракт, компонент из дрожжевого экстракта или любая комбинация двух или более из перечисленных источников углерода. В некоторых вариантах реализации, указанные клетки культивируют в условиях с ограничением количества глюкозы. В некотором варианте реализации, указанные клетки дополнительно содержат гетерологичную нуклеиновую кислоту, кодирующую полипептид IDI. В некоторых вариантах реализации, указанные клетки дополнительно содержат гетерологичную нуклеиновую кислоту, кодирующую полипептид пути MVA. В некотором варианте реализации, исходная композиция изопрена представляет собой композицию изопрена, обнаруженную или полученную путем культивирования любой из клеток, описанных в предварительной заявке на патент США под номером 61/134094, поданной 2 июля 2008 г., WO 2010/003007, и заявке на патент США под номером 12/335071, поданной 15 декабря 2008 г.(US 2009/0203102 А1), которые полностью включены в настоящее описание посредством ссылки.
[0298] В некоторых вариантах реализации, исходная композиция изопрена высокой степени чистоты содержит газообразную фазу (выделяющийся газ), продуцированную клетками в культуре, которые продуцируют изопрен. В некоторых вариантах реализации, в газообразной фазе находится невоспламеняющаяся концентрация изопрена. В некоторых вариантах реализации, газообразная фаза содержит менее чем приблизительно 9,5% (по объему) кислорода. В некоторых вариантах реализации, газообразная фаза содержит больше или приблизительно 9,5% (по объему) кислорода, и концентрация изопрена в газообразной фазе меньше, чем нижний предел воспламеняемости, или больше, чем верхний предел воспламеняемости. В некоторых вариантах реализации, часть газообразной фазы, отличная от изопрена, содержит от приблизительно 0% до приблизительно 100% (по объему) кислорода, например, в диапазоне от приблизительно 10% до приблизительно 100% (по объему) кислорода. В некоторых вариантах реализации, часть газообразной фазы, отличная от изопрена. содержит от приблизительно 0% до приблизительно 99% (по объему) азота. В некоторых вариантах реализации, часть газообразной фазы, отличная от изопрена, содержит от приблизительно 1% до приблизительно 50% (по объему) СО;.
[0299] В некоторых вариантах реализации, исходная композиция изопрена высокой степени чистоты содержит один или более из следующих компонентов: спирт, альдегид, кетон или сложный эфир (такой как любой из спиртов, альдегидов, кетонов или сложных эфиров, описанных в данной заявке). В некоторых вариантах реализации, композиция изопрена содержит (i) спирт и альдегид, (ii) спирт и кетон, (in) альдегид и кетон или (iv) спирт, альдегид и кетон. В некоторых вариантах реализации, любая из композиций изопрена дополнительно содержит сложный эфир.
[0300] В некоторых вариантах реализации, исходная композиция изопрена высокой степени чистоты, полученная из биологического источника (такого как культура клеток), содержит один или более из следующих компонентов: метанол, ацетальдегид, этанол, метантиол, 1-бутанол, 3-метил-1-пропанол, ацетон, уксусная кислота, 2-бутанон. 2-метил-1-бутанол или индол. В некоторых вариантах реализации, исходная композиция изопрена содержит 1 промилле или более одного или более из следующих компонентов: метанол, ацетальдегид, этанол, метантиол, 1-бутанол, 3-метил-1-пропанол, ацетон, уксусная кислота, 2-бутанон, 2-метил-1-бутанол или индол. В некоторых вариантах реализации, концентрация более чем одного или нескольких из следующих компонентов: метанол, ацетальдегид, этанол, метантиол, 1-бутанол, 3-метил-1-пропанол, ацетон, уксусная кислота, 2-бутанон, 2-метил-1-бутанол или индол, - находится в диапазоне от приблизительно 1 до приблизительно 10000 промилле в исходной композиции изопрена (например, выделяющийся газ перед его очисткой). В некоторых вариантах реализации, исходная композиция изопрена (например, выделяющийся газ после того, как он был подвергнут одному или нескольким этапам очистки) содержит один или более из следующих компонентов: метанол, ацетальдегид, этанол. метантиол, 1-бутанол, 3-метил-1-пропанол, ацетон, уксусная кислота, 2-бутанон, 2-метил-1-бутанол или индол, при концентрации, равной от приблизительно 1 до приблизительно 100 промилле, например, от приблизительно 1 до приблизительно 10 промилле, от приблизительно 10 до приблизительно 20 промилле, от приблизительно 20 до приблизительно 30 промилле, от приблизительно 30 до приблизительно 40 промилле, от приблизительно 40 до приблизительно 50 промилле, от приблизительно 50 до приблизительно 60 промилле, от приблизительно 60 до приблизительно 70 промилле, от приблизительно 70 до приблизительно 80 промилле, от приблизительно 80 до приблизительно 90 промилле или от приблизительно 90 до приблизительно 100 промилле. В некоторых вариантах реализации, исходная композиция изопрена содержит менее чем 1 промилле метантиола (сильный каталитический яд и источник серы в конечном топливном продукте). Летучие органические соединения из культур клеток (такие как летучие органические соединения в пространстве над поверхностью культуры клеток) можно исследовать, применяя стандартные способы, например, описанные в данной заявке, или другие стандартные способы, такие как реакционная масс-спектрометрия с переносом протона (см., например, Bunge и др., Applied and Environmental Microbiology, 74(7):2179-2186. 2008, которая настоящим полностью включена посредством ссылки, в частности, в отношении анализа летучих органических соединений).
[0301] В настоящем изобретении также предложено применение исходной композиции изопрена высокой степени чистоты, который получают из биологического источника (такого как культура клеток), который продуцирует как изопрен, так и водород. В некоторых вариантах реализации, исходные биоизопреновые композиции включают изопрен и водород в соотношении, находящемся в диапазоне от по меньшей мере одного молярного процента изопрена на каждые три молярных процента водорода до по меньшей мере одного молярного процента изопрена на каждые четыре молярных процента водорода. В некоторых вариантах реализации, исходные биоизопреновые композиции содержат изопрен и водород в молярных соотношениях, составляющих приблизительно 1 к 9, 2 к 8, 3 к 7, 4 к 6, 5 к 5,6 к 4,7 к 3, 8 к 2 или 9 к 1. В некоторых вариантах реализации, композиция дополнительно содержит от 1 до 11 молярных процентов изопрена и от 4 до 44 молярных процентов водорода. В некоторых вариантах реализации, композиция дополнительно содержит кислород, диоксид углерода или азот.В некоторых вариантах реализации, композиция дополнительно содержит от 0 до 21 молярного процента кислорода, от 18 до 44 молярных процентов диоксида углерода и от 0 до 78 молярных процентов азота. В некоторых вариантах реализации, композиция дополнительно содержит 1,0×10-4 молярного процента или менее неметановых летучих примесей. В некоторых вариантах реализации, неметановые летучие примеси включают одну или более из следующих примесей: 2-гептанон, 6-метил-5-гептен-2-он, 2,4,5-триметилпиридин, 2,3.5-триметилпиразин, цитронеллаль, ацетальдегид, метантиол, метилацетат, 1-пропан ол, диацетил, 2-бутанон, 2-метил-3-бутен-2-ол, этилацетат, 2-метил-1-пропанол, 3-метил-1-бутаналь, 3-метил-2-бутанон, 1-бутанол, 2-пентанон, 3-метил-1-бутанол, этилизобутират, 3-метил-2-бутеналь, бутилацетат, 3-метилбутилацетат, 3-метил-3-бутен-1-ил ацетат.3-метил-2-бутен-1-ил ацетат, 3-гексен-1-ол, 3-гексен-1-ил ацетат, лимонен, гераниол (транс-3,7-диметил-2,6-октадиен-1-ол), цитронеллол (3,7-диметил-6-октен-1-ол), (Е)-3,7-диметил-1,3,6-октатриен, (2)-3,7-диметил-1,3,б-октатриен, 2,3-циклогептенолпиридин или линейный полимер изопрена (такой как линейный димер изопрена или линейный тример изопрена, полученные в результате полимеризации нескольких единиц изопрена). В некоторых вариантах реализации, композиция изопрена содержит один или более из следующих компонентов: спирт, альдегид или кетон (такой как любой из спиртов, альдегидов или кетонов, описанных в данной заявке). В некоторых вариантах реализации, композиция изопрена содержит (i) спирт и альдегид, (ii) спирт и кетон, (iii) альдегид и кетон или (iv) спирт, альдегид и кетон. В некоторых вариантах реализации, неметановые летучие примеси включают одну или более из следующих примесей: метанол, ацетальдегид, этанол. метантиол. 1-бутанол, 3-метил-1-пропанол, ацетон, уксусная кислота, 2-бутанон, 2-метил-1-бутанол или индол.
[0302] Методики получения изопрена в культурах клеток, которые продуцируют изопрен, описаны в предварительных заявках на патент США с номерами 61/013386 и 61/013,574, поданных 13 декабря 2007 г., WO 2009/076676, предварительных заявках на патент США с номерами 61/134094, 61/134947, 61/134011 и 61/134103, поданных 2 июля 2008 г., WO 2010/003007, предварительной заявке на патент США под номером 61/097,163, поданной 15 сентября 2008 г., WO 2010/031079. предварительной заявке на патент США под номером 61/097186, поданной 15 сентября 2008 г„ WO 2010/031062, предварительной заявке на патент США под номером 61/097189, поданной 15 сентября 2008 г., WO 2010/031077, предварительной заявке на патент США под номером 61/097200, поданной 15 сентября 2008 г., WO 2010/031068, предварительной заявке на патент США под номером 61/097,204, поданной 15 сентября 2008 г., WO 2010/031076, предварительной заявке на патент США под номером 61/141652, поданной 30 декабря 2008 г., PCT/US09/069862, заявке на патент США под номером 12/335071, поданной 15 декабря 2008 г.(US 2009/0203102 А1), и заявке на патент США под номером 12/429143, поданной 23 апреля 2009 г.(US 2010/0003716 А1), идеи которых включены в данную заявку посредством ссылки с целью обучения методикам продукции и получения изопрена с помощью такого процесса. В любом случае, в предварительных заявках на патент США с номерами 61/013386 и 61/013574, поданных 13 декабря 2007 г., WO 2009/076676, предварительных заявках на патент США с номерами 61/134094, 61/134947, 61/134011 и 61/134103. поданных 2 июля 2008 г., WO 2010/003007, предварительной заявке на патент США под номером 61/097,163, поданной 15 сентября 2008 г., WO 2010/031079, предварительной заявке на патент США под номером 61/097186, поданной 15 сентября 2008 г., WO 2010/031062, предварительной заявке на патент США под номером 61/097189, поданной 15 сентября 2008 г., WO 2010/031077. предварительной заявке на патент США под номером 61/097200, поданной 15 сентября 2008 г., WO 2010/031068, предварительной заявке на патент США под номером 61/097204. поданной 15 сентября 2008 г., WO 2010/031076, предварительной заявке на патент США под номером 61/141652, поданной 30 декабря 2008 г., PCT/US09/069862, заявке на патент США под номером 12/335071, поданной 15 декабря 2008 г.(US 2009/0203102 A1), и заявке на патент США под номером 12/429143, поданной 23 апреля 2009 г.(US 2010/0003716 A1), описаны композиции и способы получения повышенных количеств изопрена в культурах клеток. В заявке на патент США под номером 12/335071. поданной 15 декабря 2008 г., и US 2009/0203102 A1 дополнительно описаны композиции и способы одновременного получения изопрена и водорода из культивируемых клеток. В частности, данные композиции и способы повышают скорость продукции изопрена и повышают суммарное количество полученного изопрена. Например, были получены системы культур клеток, которые продуцируют 4,8×104 нмоль изопрена/гсмк/ч (Таблица 1). Эффективность данных систем можно продемонстрировать переработкой приблизительно 2,2% углерода, который клетки потребляют из культуральной среды, в изопрен. В Примерах и Таблице 2 показано, что получили приблизительно 3 г изопрена на литр бульона. При желании, можно получить даже большие количества изопрена, используя другие условия, например, описанные в данной заявке. В некоторых вариантах реализации, для получения изопрена используют возобновляемый источник углерода. В некоторых вариантах реализации, получение изопрена не связано с ростом клеток. В некоторых вариантах реализации, концентрации изопрена и любых окислителей находятся в рамках диапазонов, в которых они не невоспламеняются, чтобы снизить риск или избежать риска, что может возникнуть пожар во время продукции или получения изопрена. Указанные композиции и способы желательны, так как они позволяют добиться высокого выхода изопрена на клетку, высокого выхода углерода, высокой чистоты изопрена, высокой производительности, низких энергозатрат, низкой стоимости производства и инвестиций и минимальных побочных реакций. Такой эффективный, крупномасштабный, биосинтетический процесс получения изопрена обеспечивает источник изопрена для синтетических продуктов на основе изопрена, таких как каучук, и обеспечивает желательную, недорогую альтернативу применению природного каучука.
[0303] Ниже дополнительно обсуждается, что количество изопрена, продуцированного клетками, можно сильно повысить путем введения гетерологичной нуклеиновой кислоты, кодирующей полипептид изопренсинтазы (например, полипептид изопренсинтазы растения) в клетки. Полипептиды изопренсинтазы превращают диметилаллилдифосфат (DMAPP) в изопрен. В Примерах показано, что гетерологичный полипептид изопренсинтазы Pueraria Montana (кудзу) экспрессировали во множестве клеток-хозяев, таких как Escherichia coil, Panteoa citrea. Bacillus subtilis, Yarrowia lipolytica и Trichoderma reesei. Все перечисленные клетки продуцировали больше изопрена, чем соответствующие клетки без гетерологичного полипептида изопренсинтазы. В Таблицах 1 и 2 показано, что получали большие количества изопрена, применяя способы, описанные в данной заявке. Например, клетки В, subtilis с гетерологичной нуклеиновой кислотой изопренсинтазы продуцировали приблизительно в 10 раз больше изопрена в 14-литровом ферментаторе, чем соответствующие контрольные клетки В. subtilis без гетерологичной нуклеиновой кислоты (Таблица 2). Продукция 300 мг изопрена на литр бульона (мг/л, при этом объем бульона включает как объем клеточной среды, так и объем клеток) клетками Е. coli и 30 мг/л клетками В. subtilis в ферментаторах указывает на то, что можно получить значительные количества изопрена (Таблица 2). При желании, изопрен можно получить даже в более крупном масштабе, или можно использовать другие условия, описанные в данной заявке, чтобы дополнительно увеличить количество изопрена. Векторы перечислены в Таблицах 1 и 2, и экспериментальные условия описаны более подробно ниже и в разделе Примеров.
Таблица 1: Типичные количества изопрена, получаемого в колбе на качалке с применением культур клеток и способов, описанных в данной заявке. Анализ для измерения продукции изопрена описан в Примере I, часть II. Для данного анализа, образец отбирают в один или более моментов времени из колбы на качалке и культивируют в течение 30 минут.Затем измеряют количество изопрена, продуцированного данным образцом. Концентрация в пространстве над поверхностью и удельная скорость получения изопрена перечислены в Таблице 1 и описаны далее в настоящем описании.
*Нормированный на 1 мл 1 ОП600, культивированной в течение 1 часа в герметичной виале для парофазного анализа с соотношением объема жидкости к объему свободного пространства над поверхностью 1:19.
Таблица 2: Типичные количества изопрена, получаемого в ферментаторе с применением культур клеток и способов, описанных в данной заявке. Анализ для измерения продукции изопрена описан в Примере I, часть II. Для данного анализа отбирали образец выделяющегося из ферментатора газа и анализировали количество изопрена в нем. Максимальная концентрация в пространстве над поверхностью (которая представляет собой наиболее высокую концентрацию в пространстве над поверхностью во время ферментации), титр (который представляет собой суммарное, общее количество изопрена, продуцированного на литр бульона) и максимальная удельная скорость продукции изопрена (которая представляет собой наиболее высокую удельную скорость во время ферментации) перечислены в Таблице 2 и описаны далее в настоящем описании.
**Нормированный на скорость потока выделяющегося газа, равную 1 vvm (1 объем выделяющегося газа на 1 лбульона в минуту).
[0304] Кроме того, продукцию изопрена клетками, которые содержат гетерологичную нуклеиновую кислоту изопренсинтазы, можно увеличить путем повышения количества полипептида 1-дезокси-0-ксилулоза-5-фосфатсинтазы (DXS) и/или полипептида изопентенилдифосфатизомеразы (IDI), экспрессируемых указанными клетками. Например, можно ввести в клетки нуклеиновую кислоту DXS и/или нуклеиновую кислоту IDI. Нуклеиновая кислота DXS может представлять собой гетерологичную нуклеиновую кислоту или дополнительную копию эндогенной нуклеиновой кислоты. Аналогично, нуклеиновая кислота, кодирующая IDI, может представлять собой гетерологичную нуклеиновую кислоту или дополнительную копию эндогенной нуклеиновой кислоты. В некоторых вариантах реализации, количество полипептида DXS и/или IDI повышают путем замены эндогенных промоторов DXS и/или IDI или регуляторных участков на другие промоторы и/или регуляторные участки, что приводит к усилению транскрипции нуклеиновых кислот DXS и/или IDI. В некоторых вариантах реализации, указанные клетки содержат как гетерологичную нуклеиновую кислоту, кодирующую полипептид изопренсинтазы (например, нуклеиновую кислоту изопренсинтазы растения), так и дополнительную копию эндогенной нуклеиновой кислоты, кодирующей полипептид изопренсинтазы.
[0305] Кодируемые полипептиды DXS и IDI подставляют собой часть пути DXP биосинтеза изопрена (Фигура 19А). Полипептиды DXS превращают пируват и D-глицеральдегид-3-фосфат в 1-дезокси-0-ксилулоза-5-фосфат. Без привязки к какой-либо конкретной теории, полагают, что повышение количества полипептида DXS повышает количество углерода в пути DXP, что приводит к большей продукции изопрена. Полипептиды IDI катализируют взаимное превращение изопентенилдифосфата (IPP) и диметилаллилдифосфата (DMAPP). Без привязки к какой-либо конкретной теории, полагают, что повышение количества полипептида IDI в клетках повышает количество (и скорость превращения) IPP, который превращается в DMAPP, который, в свою очередь, превращается в изопрен.
[0306] Например, для получения изопрена использовали ферментацию клеток Е. coli с нуклеиновыми кислотами изопренсинтазы кудзу, IDI S. cerevisia и DXS Е. coli. Уровни изопрена изменялись от 50 до 300 мкг/л на протяжении 15 часов (Пример 7, часть VII). [0307] В некоторых вариантах реализации, присутствие гетерологичных или дополнительных эндогенных нуклеиновых кислот для изопренсинтазы, IDI и DXS вызывало повышенное размножение или более длительную жизнеспособность клеток по сравнению с соответствующими клетками лишь с одной или двумя из данных гетерологичных или дополнительных эндогенных нуклеиновых кислот.Например, клетки, содержащие гетерологичные нуклеиновые кислоты для изопренсинтазы, IDI и DXS, расли лучше, чем клетки только с гетерологичными нуклеиновыми кислотами для изопренсинтазы и DXS или только с гетерологичной нуклеиновой кислотой для изопренсинтазы. Также, гетерологичные нуклеиновые кислоты для изопренсинтазы, IDI и DXS успешно были функционально связаны с сильным промотором на плазмиде с множеством копий, которая поддерживалась клетками Е. coli, позволяя предложить, что можно экспрессировать большие количества данных полипептидов в клетках, не вызывая чрезмерной токсичности для клеток. Без привязки к какой-либо конкретной теории, полагают, что присутствие нуклеиновых кислот гетерологичной или дополнительной эндогенной изопренсинтазы и IDI может снизить количество одного или нескольких потенциально токсичных интермедиатов, которые, в противном случае, будут накапливаться, если в клетках присутствует только гетерологичная или дополнительная эндогенная нуклеиновая кислота, кодирующая DXS.
[0308] В некоторых вариантах реализации, продукцию изопрена клетками, которые содержат гетерологичную нуклеиновую кислоту изопренсинтазы, усиливали путем повышения количества полипептида MVA, экспрессируемого клетками (Фигуры 19А и 19 В). Типичные полипептиды MVA-пути включают любой из следующих полипептидов: полипептиды ацетил-КоА-ацетилтрансферазы (АА-КоА тиолазы), полипептиды 3-гидрокси-3-метилглутарил-КоА-синтазы (ГМГ-КоА синтазы), полипептиды 3-гидрокси-3-метилглутарил-КоА-редуктазы (ГМГ-КоА редуктазы), полипептиды мевалонаткиназы (MVK), полипептиды фосфомевалонаткиназы (РМК), полипептиды дифосфомевалонатдекарбоксилазы (MVD), полипептиды фосфомевалонатдекарбоксилазы (PMDC), полипептиды изопентенилфосфаткиназы (IPK), полипептиды IDI и полипептиды (например, гибридные полипептиды), обладающие активностью двух или более полипептидов MVA-пути. Например, можно ввести в клетки одну или более нуклеиновых MVA-кислот пути. В некоторых вариантах реализации, указанные клетки содержат нуклеиновые кислоты, кодирующие ферменты верхнего MVA-пути, включая нуклеиновые кислоты для АА-КоА-тиолазы, ГМГ-КоА-синтазы и ГМГ-КоА-редуктазы. В некоторых вариантах реализации, указанные клетки содержат нуклеиновые кислоты, кодирующие ферменты нижнего MVA-пути, включая нуклеиновые кислоты для MVK, РМК, MVD и IDI. В некоторых вариантах реализации, указанные клетки содержат нуклеиновые кислоты, кодирующие ферменты всего MVA-пути, включая нуклеиновые кислоты для АА-КоА-тиолазы, ГМГ-КоА-синтазы, ГМГ-КоА редуктазы, MVK. РМК, MVD и IDI. В некоторых вариантах реализации, указанные клетки содержат нуклеиновые кислоты, кодирующие ферменты всего MVA-пути, включая нуклеиновые кислоты для АА-КоА-тиолазы, ГМГ-КоА-синтазы, ГМГ-КоА-редуктазы, MVK, PMDC, IPK и IDI. Нуклеиновые кислоты, кодирующие ферменты MVA-пути, могут представлять собой гетерологичные нуклеиновые кислоты или дополнительные копии эндогенных нуклеиновых кислот.В некоторых вариантах реализации, количество одного или нескольких полипептидов MVA-пути повышают путем замены эндогенных промоторов или регуляторных участков нуклеиновых кислот MVA-пути на другие промоторы и/или регуляторные участки, что приводит к усилению транскрипции нуклеиновых кислот MVA-пути. В некоторых вариантах реализации, указанные клетки содержат как гетерологичную нуклеиновую кислоту, кодирующую полипептид изопрен синтазы (например, нуклеиновую кислоту изопренсинтазы растения), так и дополнительную копию эндогенной нуклеиновой кислоты, кодирующей полипептид изопренсинтазы.
[0309] Например, клетки Е. coli, содержащие нуклеиновую кислоту, кодирующую полипептид изопренсинтазы кудзу, и нуклеиновые кислоты, кодирующие полипептиды MVK, PMK, MVD и EDI Saccharomyces cerevisiae, продуцировали изопрен со скоростью, равной 6,67×10-4 моль/лбульона/ОП600/ч (см. Пример 8). Дополнительно, ферментация в объеме 14 литров клеток Е. coli с нуклеиновыми кислотами, кодирующими полипептиды АА-КоА-тиолазы, ГМГ-КоА-синтазы и ГМГ-КоА-редуктазы Enterococcus faecalls, позволила получить 22 грамма мевалоновой кислоты (интермедиата MVA-пути). Во встряхиваемой колбе с данными клетками продуцировалось 2-4 грамма мевалоновой кислоты на литр. Полученные результаты указывают на то, что гетерологичные нуклеиновые кислоты MVA-пути активны в клетках Е. coli. Е. coli, которые содержат нуклеиновые кислоты как для верхнего MVA-пути, так и для нижнего пути MVA, а также для изопренсинтазы кудзу (штамм МСМ 127), продуцировали значительно больше изопрена (874 мкг/л) по сравнению с клетками Е. coli, которые содержали нуклеиновые кислоты только для нижнего MVA-пути и для изопренсинтазы кудзу (штамм МСМ 131) (см. таблицу 3 и Пример 8, часть VIII).
[0310] В некоторых вариантах реализации, по меньшей мере часть клеток сохраняла нуклеиновые кислоты для гетерологичной изопренсинтазы, DXS, IDI и/или MVA-пути на протяжении по меньшей мере приблизительно 5, 10, 20, 50, 75, 100, 200, 300 или более клеточных делений в непрерывной культуре (такой как непрерывная культура без разведения). В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, нуклеиновая кислота, включающая гетерологичную или дополнительную копию эндогенной нуклеиновой кислоты для изопренсинтазы, DXS, IDI и/или пути MVA, также включает селективный маркер, такой как нуклеиновая кислота, придающая устойчивость к антибиотику, такому как канамицин, ампициллин, карбенициллин, гентамицин, гигромицин, плеомицин, блеомицин, неомицин или хлорамфеникол.
[0311] В Примере 7, часть VI, указано, что количество продуцированного изопрена можно дополнительно повысить путем добавления дрожжевого экстракта в среду для культивирования. В данном примере, количество продуцированного изопрена было прямо пропорционально количеству дрожжевого экстракта в клеточной среде для тестированных концентраций (Фигура 48С). Кроме того, из клеточной среды с дрожжевым экстрактом и глюкозой получали приблизительно 0,11 грамм изопрена на литр бульона (Пример 7, часть VIII). В обоих данных экспериментах для получения изопрена использовали клетки Е. coli с нуклеиновыми кислотами изопренсинтазы кудзу, IDI S. cerevisia и DXS Е. coli. Увеличение количества дрожжевого экстракта в присутствии глюкозы приводило к продукции большего количества изопрена, чем при увеличении количества глюкозы в присутствии дрожжевого экстракта. Кроме того, увеличение количества дрожжевого экстракта позволяло клеткам продуцировать изопрен на высоком уровне в течение длительного времени и улучшало состояние клеток.
[0312] Продукцию изопрена также продемонстрировали, применяя в качестве источника углерода три типа гидролизованной биомассы (багассу, кукурузную солому и волокнистую массу мягкой древесины) (Фигуры 46А-С). Клетки Е. coli с нуклеиновыми кислотами для изопренсинтазы кудзу, IDI S. cerevisia и DXS Е. coli продуцировали также много изопрена из данной гидролизованной биомассы в качестве источника углерода, как и из эквивалентного количества глюкозы (например, 1% глюкозы, масс./об.). При необходимости, можно использовать в качестве источника углерода любую другую биомассу в композициях и способах, описанных в данной заявке. Биомасса в качестве источника углерода более предпочтительна, так как она дешевле, чем многие традиционные среды, содержащие клетки, и способствует экономически выгодному получению изопрена.
[0313] Кроме того, было показано, что в качестве источника углерода для получения изопрена может выступать инвертированный сахар (Фигуры 47С и 96-98). Например, получали 2,4 г/л изопрена из клеток, экспрессирующих полипептиды пути MVA и изопренсинтазу кудзу (Пример 8, часть XV). Глицерин также использовали в качестве источника углерода с получением 2,2 мг/л изопрена из клеток, экспрессирующих изопренсинтазу кудзу (Пример 8, часть XIV), Экспрессирование нуклеиновой кислоты DXS, нуклеиновой кислоты IDI и/или одной или нескольких нуклеиновых кислот пути MVA (таких как нуклеиновые кислоты, кодирующие весь путь MVA) вдобавок к нуклеиновой кислоте изопренсинтазы может повысить получение изопрена из глицерина.
[0314] В некоторых вариантах реализации, в клеточную среду добавляют масло. Например, клетки В. subtilis, содержащие нуклеиновую кислоту для изопренсинтазы кудзу, продуцировали изопрен при культивировании в клеточной среде, содержащей масло и источник глюкозы (Пример 4, часть III). В качестве другого примера, мутантные клетки Е, coli fadR atoC, содержащие верхний и нижний MVA-путь и изопренсинтазу кудзу, продуцировали изопрен при культивировании в клеточной среде, содержащей пальмовое масло и источник глюкозы (Пример 27, часть II). В некоторых вариантах реализации, в клеточную среду добавляют более чем одно масло (например, 2, 3, 4, 5 или более масел). Без привязки к какой-либо конкретной теории, полагают, что (i) масло может повысить количество углерода в клетках, доступного для превращения в изопрен, (ii) масло может повысить количество ацетил-КоА в клетках, тем самым повышая расход углерода в пути MVA, и/или (iii) масло может обеспечивать дополнительные питательные вещества для клеток, что желательно, так как большое количество углерода в клетках превращается в изопрен, скорее чем в другие продукты. В некоторых вариантах реализации, клетки, которые культивируют в клеточной среде, содержащей масло, естественным образом используют путь MVA для получения изопрена, или они генетически модифицированы таким образом, что они содержат нуклеиновые кислоты для всего пути MVA. В некоторых вариантах реализации, масло частично или полностью гидролизуют перед добавлением в среду для культивирования, чтобы облегчить использование масла клетками-хозяевами.
[0315] Одна из основных трудностей для коммерческого получения малых молекул, таких как изопрен, в клетках (например, бактериях) состоит в отделении процесса продуцирования молекулы от процесса роста клеток. В некоторых вариантах реализации для рентабельного получения изопрена, существенное количество углерода из исходного сырья превращается в изопрен, а не используется для роста и поддержания клеток ("эффективность углерода"), В различных вариантах реализации, указанные клетки превращают больше или приблизительно 0,0015, 0,002, 0,005, 0,01, 0,02, 0,05, 0,1, 0,12, 0,14, 0,16, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,2, 1,4, 1,6, 1,8, 2,0, 2,5, 3,0, 3,5, 4,0, 5,0, 6,0, 7,0 или 8,0% углерода в культуральной среде в изопрен. В особых вариантах реализации, существенная часть углерода из исходного сырья, который превращается в конечные продукты, превращается в изопрен. В Примере 11 дополнительно описано, что для клеток Е. coli, экспрессирующие нуклеиновые кислоты для ферментов MVA-пути и изопренсинтазы кудзу, показано отделение процессов продукции изопрена или интермедиата мевалоновой кислоты от процесса роста, что приводило к высокой эффективности углерода. В частности, мевалоновая кислота образовывалась в клетках, экспрессирующих ферменты верхнего MVA-путь из Enterococcus faecalis. Изопрен образовывался в клетках, экспрессирующих ферменты верхнего MVA-пути из Enterococcus faecalis, нижнего MVA-путь из Saccharomyces cerevisiae и изопренсинтазу из Pueraria montana (Кудзу). Такое отделение процессов продукции изопрена или мевалоновой кислоты от процесса роста было продемонстрировано для четырех различных штаммов Е. coli; BL21(LDE3), BL21(LDE3) Tuner, FM5 и MG1655. Первые два штамма Е. coli представляют собой штаммы В, а последние два представляют собой штаммы К12. Отделение процессов продукции от процесса роста также продемонстрировано для варианта MG1655 с удаленными генами ack и pta. Для этого варианта также продемонстрирована меньшая продукция ацетата. Типичные полипептиды и нуклеиновые кислоты
[0316] Различные полипептиды и нуклеиновые кислоты изопренсинтазы, DXS, IDI, пути MVA, гидрогеназы, фактора созревания или транскрипции гидрогеназы можно применять в композициях и способах, описанных в данной заявке.
[0317] В некоторых вариантах реализации, гибридный полипептид включает часть первого полипептида или первый полипептид целиком (например, полипептид изопренсинтазы, DXS, IDI, MVA-пути, гидрогеназы, фактора созревания или транскрипции гидрогеназы или каталитически активный фрагмент указанного полипептида) и может возможно включать часть второго полипептида или второй полипептид целиком (например, пептид, который способствует очистке или обнаружению гибридного полипептида, такой как гистидиновая метка). В некоторых вариантах реализации, гибридный полипептид обладает активностью двух или более полипептидов MVA-пути (таких как полипептиды АА-КоА тиолазы и ГМГ-КоА редуктазы). В некоторых вариантах реализации, полипептид представляет собой встречающийся в природе полипептид (такой как полипептид, кодируемый нуклеиновой кислотой mvaE Enterococcus faecalis), который обладает активностью двух или более полипептидов MVA-пути.
[0318] В различных вариантах реализации, полипептид состоит из по меньшей мере или приблизительно 50, 100, 150, 175, 200, 250, 300, 350,400 или более аминокислот.В некоторых вариантах реализации, фрагмент полипептида содержит по меньшей мере или приблизительно 25, 50, 75, 100, 150, 200, 300 или более смежных аминокислот из полноразмерного полипептида и обладает по меньшей мере или приблизительно 5%, 10%, 20%, 30%, 40%. 50%, 60%, 70%, 80%, 90%, 95% или 100% активности соответствующего полноразмерного полипептида. В особых вариантах реализации, указанный полипептид включает фрагмент или всю последовательность аминокислот любого встречающегося в природе полипептида изопренсинтазы, DXS, IDI, пути MVA, гидрогеназы, фактора созревания или транскрипции гидрогеназы. В некоторых вариантах реализации, полипептид включает одну или более мутаций по сравнению с последовательностью дикого типа (т.е., со встречающейся в природе последовательностью) полипептида изопренсинтазы, DXS, IDI, пути MVA, гидрогеназы, фактора созревания или транскрипции гидрогеназы.
[0319] В некоторых вариантах реализации, полипептид представляет собой изолированный полипептид. В некоторых вариантах реализации, полипептид представляет собой гетерологичный полипептид.
[0320] В некоторых вариантах реализации, нуклеиновая кислота представляет собой рекомбинантную нуклеиновую кислоту. В некоторых вариантах реализации, нуклеиновая кислота для изопренсинтазы, DXS, IDI, MVA-пути, гидрогеназы, фактора созревания или транскрипции гидрогеназы функционально связана с другой нуклеиновой кислотой, кодирующей весь полипептид или часть другого полипептида, таким образом, что указанная рекомбинантная нуклеиновая кислота кодирует гибридный полипептид, который включает полипептид изопренсинтазы, DXS, IDI, пути MVA, гидрогеназы, фактора созревания или транскрипции гидрогеназы и весь или часть другого полипептида (например, пептида, который способствует очистке или обнаружению гибридного полипептида, такого как гистидиновая метка). В некоторых вариантах реализации, часть или всю рекомбинантную нуклеиновую кислоту синтезируют химическим путем. Должно быть очевидно, что в нуклеиновой кислоте, определенной в настоящем описании, могут встречаться мутации, включая однонуклеотидные мутации.
[0321] В некоторых вариантах реализации, нуклеиновая кислота представляет собой гетерологичную нуклеиновую кислоту. В особых вариантах реализации, нуклеиновая кислота включает фрагмент или всю последовательность нуклеиновых кислот любой встречающейся в природе нуклеиновой кислоты для изопренсинтазы, DXS, IDI, MVA-пути, гидрогеназы, фактора созревания или транскрипции гидрогеназы. В некоторых вариантах реализации, нуклеиновая кислота включает по меньшей мере или приблизительно 50, 100, 150, 200, 300, 400, 500, 600, 700, 800 или более смежных нуклеотидов из встречающейся в природе нуклеиновой кислоты для изопренсинтазы DXS, IDI, MVA-пути, гидрогеназы, фактора созревания или транскрипции гидрогеназы. В некоторых вариантах реализации, нуклеиновая кислота содержит одну или более мутаций по сравнению с последовательностью дикого типа (т.е., с последовательностью, встречающейся в природе) нуклеиновой кислоты для изопренсинтазы, DXS, IDI, MVA-пути, гидрогеназы, фактора созревания или транскрипции гидрогеназы. В некоторых вариантах реализации, нуклеиновая кислота содержит одну или более мутаций (например, молчащую мутацию), которые усиливают транскрипцию или трансляцию нуклеиновой кислоты для изопренасинтазы, DXS, IDI, MVA-пути, гидрогеназы или фактора транскрипции. В некоторых вариантах реализации, нуклеиновая кислота представляет собой вырожденный вариант любой нуклеиновой кислоты, кодирующей полипептид изопренсинтазы, DXS, IDI, MVA-пути, гидрогеназы, фактора созревания или транскрипции гидрогеназы.
[0322] Номера образцов типичных полипептидов и нуклеиновых кислот для изопренсинтазы, DXS, IDI и/или MVA-пути перечислены в Приложении 1 (номера в Приложении 1 и соответствующие последовательности полностью включены в настоящее описание посредством ссылки, особенно в отношении последовательностей аминокислот и нуклеиновых кислот для изопренасинтазы, DXS, EDI и/или MVA-пути). База данных Kegg также включает последовательности аминокислот и нуклеиновых кислот множества типичных полипептидов и нуклеиновых кислот изопренсинтазы, DXS, IDI и/или пути MVA (см., например, страницу в Интернете "genome.jp/kegg/pathway/map/map00100.html" и перечисленные там последовательности, каждая из которых настоящим полностью включена посредством ссылки, особенно в отношении последовательностей аминокислот и нуклеиновых кислот изопренасинтазы, DXS. IDI и/или пути MVA). В некоторых вариантах реализации, один или более из полипептидов и/или нуклеиновых кислот для изопренсинтазы, DXS, IDI и/или MVA-пути имеют последовательность, идентичную общедоступной последовательности, опубликованной 12 декабря 2007 г.или 14 сентября 2008 г., такой как любая из последовательностей, которая соответствует любому из номеров доступа в Приложении 1, или любая из последовательностей, присутствующих в базе данных Kegg. Дополнительные типичные полипептиды и нуклеиновые кислоты для изопренсинтазы, DXS, IDI и/или MVA-пути описаны далее.
Типичные полипептиды и нуклеиновые кислоты для изопренсинтазы [0323] Выше отмечалось, что полипептиды изопренсинтазы превращают диметилаллилдифосфат (DMAPP) в изопрен. Типичные полипептиды изопренсинтазы включают полипептиды, фрагменты полипептидов, пептиды и гибридные полипептиды, которые обладают по меньшей мере одной активностью полипептида изопренсинтазы. Чтобы определить, обладает ли полипептид активностью полипептида изопренсинтазы, можно применять стандартные способы, например. измерение способности полипептида превращать DMAPP в изопрен in vitro, в клеточном экстракте или in vivo. В типичном анализе, клеточные экстракты получают путем выращивания штамма (например, штамма Е. coli/pTrcKudzu, описанного в данной заявке) способом со встряхиваемой колбой, описанным в Примере 1. После завершения индукции, приблизительно 10 мл клеток осаждают путем центрифугирования при 7000×g в течение 10 минут и ресуспендируют в 5 мл РЕВ без глицерина. Клетки лизируют с помощью гомогенизатора French Pressure Cell, применяя стандартные процедуры. В качестве альтернативы, клетки обрабатывают лизоцимом (раствором лизоцима Ready-Lyse; EpiCentre) после цикла замерзания-оттаивания при -80°С.
[0324] Активность полипептида изопренсинтазы в клеточном экстракте можно измерить, например, как описано у Silver и др., J. Biol. Chem. 270:13010-13016, 1995 и в упомянутых в этой статье ссылках, каждая из которых настоящим полностью включена посредством ссылки, особенно в отношении анализов для измерения активности полипептида изопренсинтазы. DMAPP (Sigma) выпаривают досуха в потоке азота и регидратируют до концентрации 100 мМ в 100 мМ калий-фосфатном буфере с рН 8,2, затем хранят при -20°С.Для проведения анализа, раствор 5 мкл 1 М MgCl2, 1 мМ (250 мкг/мл) DMAPP, 65 мкл буфера с растительным экстрактом (РЕВ) (50 мМ Tris-HCl, рН 8,0, 20 мМ MgCb, 5% глицерин и 2 мМ DTT) добавляют к 25 мкл клеточного экстракта в 20 мл виале для парофазного анализа с металлической завинчивающейся крышкой и силиконовой перегородкой с тефлоновым покрытием (Agilent Technologies) и культивируют при 37°С в течение 15 минут при встряхивании. Реакцию гасят путем добавления 200 мкл 250 мМ EDTA и проводят количественный анализ с помощью ГХ/МС, описанной в Примере 1, часть П.
[0325] Типичные нуклеиновые кислоты для изопренсинтазы включают нуклеиновые кислоты, которые кодируют полипептид, фрагмент полипептида, пептид или гибридный полипептид, который обладает по меньшей мере одной активностью полипептида изопренсинтазы. Типичные полипептиды и нуклеиновые кислоты изопренсинтазы включают встречающиеся в природе полипептиды и нуклеиновые кислоты из любого из исходных организмов, описанных в данной заявке, а также мутантные полипептиды и нуклеиновые кислоты, полученные из любого из исходных организмов, описанных в данной заявке.
[0326] В некоторых вариантах реализации, полипептид или нуклеиновая кислота для изопренсинтазы происходят из семейства Бобовые (Fabaceae), например, из подсемейства Мотыльковые (Faboideae). В некоторых вариантах реализации, полипептид или нуклеиновая кислота изопренсинтазы представляет собой полипептид или нуклеиновую кислоту из Puerana montana (кудзу) (Sharkey и др.. Plant Physiology 137: 700-712, 2005), Puerana lobata, тополя (такого как Populus alba, Populus nigra, Populus trichocarpa или Populus alba x tremula (CAC35696) Miller и др., Planta 213: 483-487, 2001), осины (такой как Populus tremuloides) Silver и др.. JBC 270(22); 13010-1316, 1995) или дуба черешчатого (Quercus robur) (Zimmer и др., WO 98/02550), каждая из перечисленных публикаций настоящим полностью включена посредством ссылки, особенно в отношении нуклеиновых кислот изопренсинтазы и экспрессии полипептидов изопренсинтазы. Подходящие изопренсинтазы включают, но не ограничены перечисленными, такие изопренсинтазы, которые указаны под номерами доступа Genbank AY341431. AY316691, AY279379, AJ457070, и AY182241, каждая из которых настоящим полностью включена посредством ссылки, особенно в отношении последовательностей нуклеиновых кислот и полипептидов изопренасинтазы. В некоторых вариантах реализации, полипептид или нуклеиновая кислота изопренсинтазы представляет собой не встречающийся в природе полипептид или нуклеиновую кислоту из Quercus robur (т.е., полипептид или нуклеиновая кислота изопренсинтазы представляет собой полипептид или нуклеиновую кислоту изопренсинтазы, которые отличны от встречающихся в природе полипептида или нуклеиновой кислоты из Quercus robur). В некоторых вариантах реализации, нуклеиновая кислота или полипептид изопренсинтазы представляет собой встречающийся в природе полипептид или нуклеиновую кислоту из тополя. В некоторых вариантах реализации, нуклеиновая кислота или полипептид изопренсинтазы представляет собой не встречающийся в природе полипептид или нуклеиновую кислоту из тополя.
Типичные полипептиды и нуклеиновые кислоты для DXS [0327] Выше отмечалось, что полипептиды 1-дезокси-В-ксилулоза-5-фосфатсинтазы (DXS) превращают пируват и D-глицеральдегид-3-фосфат в 1-дезокси-В-ксилулоза-5-фосфат.Типичные полипептиды DXS включают полипептиды, фрагменты полипептидов, пептиды и гибридные полипептиды, которые обладают по меньшей мере одной активностью полипептида DXS. Чтобы определить, обладает ли полипептид активностью полипептида DXS, можно применять стандартные способы (такие как описанные в данной заявке), например, измерение способности полипептида превращать пируват и D-глицеральдегид-3-фосфат в 1-дезокси-D-ксилулоза-5-фосфат in vitro, в клеточном экстракте или in vivo. Типичные нуклеиновые кислоты DXS 67 включают нуклеиновые кислоты, которые кодируют полипептид, фрагмент полипептида, пептид или гибридный полипептид, который обладает по меньшей мере одной активностью полипептида DXS. Типичные полипептиды и нуклеиновые кислоты DXS включают встречающиеся в природе полипептиды и нуклеиновые кислоты из любого из исходных организмов, описанных в данной заявке, а также мутантные полипептиды и нуклеиновые кислоты, полученные из любого из исходных организмов, описанных в данной заявке.
Типичные полипептиды и нуклеиновые кислоты IDI
[0328] Полипептиды изопентенилдифосфатизомеразы (изопентенилдифосфат-дельта-изомеразы или IDI) катализируют взаимное превращение изопентенилдифосфата (IPP) и диметилаллилдифосфата (DMAPP) (например, превращение IPP в DMAPP и/или превращение DMAPP в IPP). Типичные полипептиды IDI включают полипептиды, фрагменты полипептидов, пептиды и гибридные полипептиды, которые обладают по меньшей мере одной активностью полипептида IDI. Чтобы определить, обладает ли полипептид активностью полипептида IDI, можно применять стандартные способы (такие как описанные в данной заявке), например, измерение способности полипептида катализировать взаимное превращение IPP и DMAPP in vitro, в клеточном экстракте или in vivo. Типичные нуклеиновые кислоты IDI включают нуклеиновые кислоты, которые кодируют полипептид, фрагмент полипептида, пептид или гибридный полипептид, который обладает по меньшей мере одной активностью полипептида IDI. Типичные полипептиды и нуклеиновые кислоты IDI включают встречающиеся в природе полипептиды и нуклеиновые кислоты из любого из исходных организмов, описанных в данной заявке, а также мутантные полипептиды и нуклеиновые кислоты, полученные из любого из исходных организмов, описанных в данной заявке.
Типичные полипептиды и нуклеиновые кислоты для MVA-nymu
[0329] Типичные полипептиды MVA-пути включают полипептиды ацетил-КоА ацетилтрансферазы (АА-КоА тиолазы), полипептиды 3-гидрокси-3-метилглутарил-КоА синтазы (ГМГ-КоА синтазы), полипептиды 3-гидрокси-3-метилглутарил-КоА редуктазы (ГМГ-КоА редуктазы), полипептиды мевалонаткиназы (MVK), полипептиды фосфомевалонаткиназы (РМК), полипептиды дифосфомевалонатдекарбоксилазы (MVD), полипептиды фосфомевалонатдекарбоксилазы (PMDC), полипептиды изопентенилфосфаткиназы (IPK), полипептиды IDI и полипептиды (например, гибридные полипептиды), обладающие активностью двух или более полипептидов пути MVA. В частности, полипептиды пути MVA включают полипептиды, фрагменты полипептидов, пептиды и гибридные полипептиды, которые обладают по меньшей мере одной активностью полипептида мевалонатного пути. Типичные нуклеиновые кислоты пути MVA включают нуклеиновые кислоты, которые кодируют полипептид, фрагмент полипептида, пептид или гибридный полипептид, который обладает по меньшей мере одной активностью полипептида мевалонатного пути. Типичные полипептиды и нуклеиновые кислоты пути MVA включают встречающиеся в природе полипептиды и нуклеиновые кислоты из любого из исходных организмов, описанных в данной заявке, а также мутантные полипептиды и нуклеиновые кислоты, полученные из любого из исходных организмов, описанных в данной заявке.
[0330] В частности, полипептиды ацетил-КоА ацетилтрансферазы (АА-КоА тиолазы или ААСТ) превращают две молекулы ацетил-КоА в ацетоацетил-КоА. Чтобы определить, обладает ли полипептид активностью полипептида АА-КоА тиолазы, можно применять стандартные способы (такие как описанные в данной заявке), например, измерение способности полипептида превращать две молекулы ацетил-КоА в ацетоацетил-КоА in vitro, в клеточном экстракте или in vivo.
[0331] Полипептиды 3-гидрокси-3-метилглутарил-КоА синтазы (ГМГ-КоА синтазы или HMGS) превращают ацетоацетил-КоА в 3-гидрокси-3-метилглутарил-КоА. Чтобы определить, обладает ли полипептид активностью полипептида ГМГ-КоА синтазы, можно применять стандартные способы (такие как описанные в данной заявке), например, измерение способности полипептида превращать ацетоацетил-КоА в 3-гидрокси-3-метилглутарил-КоА in vitro, в клеточном экстракте или in vivo.
[0332] Полипептиды 3-гидрокси-3-метилглутарил-КоА редуктазы (ГМГ-КоА редуктазы или HMGR) превращают 3-гидрокси-3-метилглутарил-КоА в мевалонат.Чтобы определить, обладает ли полипептид активностью полипептида ГМГ-КоА редуктазы, можно применять стандартные способы (такие как описанные в данной заявке), например, измерение способности полипептида превращать 3-гидрокси-3-метилглутарил-КоА в мевалонат in vitro, в клеточном экстракте или in vivo.
[0333] Полипептиды мевалонаткиназы (MVK) фосфорилируют мевалонат с образованием мевалонат-5-фосфата. Чтобы определить, обладает ли полипептид активностью полипептида MVK, можно применять стандартные способы (такие как описанные в данной заявке), например, измерение способности полипептида превращать мевалонат в мевалонат-5-фосфат in vitro, в клеточном экстракте или in vivo. [0334] Полипептиды фосфомевалонаткиназы (РМК) фосфорилируют мевалонат-5-фосфат с образованием мевалонат-5-дифосфата. Чтобы определить, обладает ли полипептид активностью полипептида РМК, можно применять стандартные способы (такие как описанные в данной заявке), например, измерение способности полипептида превращать мевалонат-5-фосфат в мевалонат-5-дифосфат in vitro, в клеточном экстракте или in vivo.
[0335] Полипептиды дифосфомевалонатдекарбоксилазы (MVD или DPMDC) превращают мевалонат-5-дифосфат в изопентенилдифосфат (IPP). Чтобы определить, обладает ли полипептид активностью полипептида MVD, можно применять стандартные способы (такие как описанные в данной заявке), например, измерение способности полипептида превращать мевалонат-5-дифосфат в IPP in vitro, в клеточном экстракте или in vivo.
[0336] Полипептиды фосфомевалонатдекарбоксилазы (PMDC) превращают мевалонат-5-фосфат в изопентенилфосфат (IP). Чтобы определить, обладает ли полипептид активностью полипептида PMDC, можно применять стандартные способы (такие как описанные в данной заявке), например, измерение способности полипептида превращать мевалонат-5-фосфат в IP in vitro, в клеточном экстракте или in vivo.
[0337] Полипептиды изопентенилфосфаткиназы (IPK) фосфорилируют изопентилфосфат (IP) с образованием изопентенилдифосфата (IPP). Чтобы определить, обладает ли полипептид активностью полипептида IPK, можно применять стандартные способы (такие как описанные в данной заявке), например, измерение способности полипептида превращать IP в IPP in vitro, в клеточном экстракте или in vivo.
[0338] Типичные полипептиды и нуклеиновые кислоты для IDI описаны выше.
Типичные полипептиды и нуклеиновые кислоты для гидрогеназы
[0339] Полипептиды гидрогеназы катализируют реакцию: 2Н++2е-↔H2. In vitro эта реакция обратима, но некоторые гидрогеназы могут работать in vivo лишь в одном направлении, либо окисляя H2, либо восстанавливая Н+. Полипептиды гидрогеназы могут быть чувствительны к кислороду, включают сложные металлические кофакторы как часть их каталитического центра, и иногда состоят из нескольких субъединиц, при этом экспрессия гена гидрогеназы иногда требует дополнительных вспомогательных полипептидов, таких как факторы «созревания» или факторы, регулирующие транскрипцию (т.е., активаторы или репрессоры). Гидрогеназы классифицируют на по меньшей мере три обширные группы на основании типа металлического кофактора в их каталитическом центре: (1) никель-железные ("NiFe") гидрогеназы включают кофактор никель/железо; (2) железо-железные гидрогеназы ("FeFe") включают кофактор железо/железо; и (3) железо/бессерные ("Fe") гидрогеназы, в которых отсутствуют кластеры 4Fe4S, обнаруженные в группах (1) и (2), включают кофактор железо и метенилтерагидрометаноптериновый переносчик электронов. См., например, Chung-Jung Chou и др., "Hydrogenesis in hyperthermophilic microorganisms: implications for biofuels", Metabol. Eng. 10:394-404 (2008), и Gonul Vardar-Schara и др., "Metabolically engineered bacteria for producing hydrogen via fermentation", Microbial Blotechnol. 1(2):107-125 (2008), обе публикации полностью включены в данную заявку посредством ссылки, особенно в отношении различных типов и классов гидрогеназ. Хотя многие организмы включают множество гидрогеназ, лишь некоторые включают гены как NiFe, так и FeFe гидрогеназ.
[0340] Каталитический центр гидрогеназ NiFe состоит из атома никеля и атома железа, каждый из которых содержит два лиганда моноксида углерода (СО) и два цианидных лиганда (CN'). Все гидрогеназы NiFe содержат по меньшей мере еще одну субъединицу, включающую множество центров железо-сера (Fe-S) для переноса электронов к каталитическому центру и от него. Гидрогеназы NiFe можно подразделить на четыре основных класса: (1) дыхательные ферменты, которые представляют собой часть многоферментных систем, которые сопрягают окисление Н2 с восстановлением конечных акцепторов электронов, таких как SO42- или NO3-, при анаэробных условиях, или с О2 в аэробных микроорганизмах; (2) сенсоры H2, которые активируют экспрессию метаболически активных гидрогеназ NiFe; (3) цитоплазматические гидрогеназы, содержащие несколько субъединиц, способных утилизировать НАДФ+, которые легко обратимы in vitro, но in vivo могут только окислять H2; и (4) связанные с мембраной энергосберегающие многоферментные комплексы, также обнаруженные в бактериях и археях. Chung-Jung Chou и др., "Hydrogenesis in hyperthermophilic microorganisms: implications for biofuels", Metabol. Eng. 10:394-404 (2008).
[0341] Каталитический центр гидрогеназ FeFe включает каталитический "Н-кластер", который координирует двухъядерный сайт (FeFe), соединенный мостиком с центром [4Fe-4S] посредством единственного белкового лиганда (цистеин). Каждый из двух атомов железа двухъядерного центра имеет два лиганда моноксида углерода (СО) и два цианистых (CN') лиганда, и они также соединены мостиком посредством двух атомов серы, которые являются частью малой органической молекулы. Большинство гидрогеназ FeFe представляют собой мономерные ферменты размером приблизительно 50 килодальтон (кДа), и, похоже, функционируют in vivo, главным образом, чтобы удалять избыток восстанавливающих эквивалентов путем восстанавления протонов до газообразного водорода. Chung-Jung Chou и др., "Hydrogenesis in hyperthermophilic microorganisms: implications for biofuels", Metabol. Eng. 10:394-404 (2008).
[0342] Изначально считали, что каталитический центр гидрогеназ Fe включает активный сайт, основанный на органическом кофакторе без участия металла, но позже было показано, что он включает одноядерный атом Fe. Несмотря на филогенетические различия между тремя типами гидрогеназ, вдобавок к по меньшей мере одному атому железа, все три группы гидрогеназ также включают по меньшей мере один лиганд моноксида углерода (СО) для атома железа в активных центрах, который способствует каталитическому окислению Hz и восстановлению протонов. Chung-Jung Chou и др., "Hydrogenesis in hyperthermophilic microorganisms: implications for biofuels", Metabol. Eng. 10:394-404 (2008).
[0343] Типичные полипептиды гидрогеназы включают, но не ограничены перечисленными, полипептиды гидрогеназы-1 (Hyd-1) E.coli, полипептиды гидрогеназы-2 (Hyd-2) E.coli, полипептиды гидрогеназы-3 (Hyd-3) E. coli, полипептиды гидрогеназы-4 (Hyd-4) E.coli, полипептиды комплекса формиат-водород-лиазы (FHL) E.coli, который позволяет получить газообразный водород из формиата и СО2 при анаэробных условиях и кислом рН (см., например, Akihito Yoshida и др., "Efficient induction of formate hydrogen lyase of aerobically grown Escherichia coli in a three-step biohydrogen production process", Appl. Microbiol. Biotechnol. 74:754-760 (2007), которая полностью включена в данную заявку посредством ссылки, особенно в отношении индукции экспрессии формиат-водород-лиазы в E.coli), полипептиды гидрогеназы Н16 Ralstonia eutropha (R. eutropha HoxH), полипептиды гидрогеназы MR11 Rhodococcus opacus (R. opacus HoxH), полипептиды гидрогеназы РСС 6803 Synechosystis sp.(Syn. РСС 6803 HoxH), полипептиды гидрогеназы Desulfovibrio gigas (D. gigas) и полипептиды гидрогеназы АТСС 7757 Desulfovibrio desulphuricans (D. desulphuricans) (см., например, Gonul Vardar-Schara и др., "Metabolically engineered bacteria for producing hydrogen via fermentation", Microbial Biotechnol. 1(2); 107-125 (2008), которая полностью включена в данную заявку посредством ссылки, особенно в отношении различных типов и классов гидрогеназ), и полипептиды (например, гибридные полипептиды), обладающие активностью двух или более полипептидов гидрогеназы. В частности, полипептиды гидрогеназы включают полипептиды, фрагменты полипептидов, пептиды и гибридные полипептиды, которые обладают по меньшей мере одной активностью полипептида гидрогеназы. Нуклеиновые кислоты типичных гидрогеназ включают нуклеиновые кислоты, которые кодируют полипептид, фрагмент полипептида, пептид или гибридный полипептид, который обладает по меньшей мере одной активностью полипептида гидрогеназы или по меньшей мере одной активностью, необходимой для экспрессии, процессинга или созревания полипептида гидрогеназы. Типичные полипептиды и нуклеиновые кислоты для гидрогеназы включают встречающиеся в природе полипептиды и нуклеиновые кислоты из любого из исходных организмов, описанных в данной заявке, а также мутантные полипептиды и нуклеиновые кислоты, полученные из любого из исходных организмов, описанных в данной заявке.
[0344] Hyd-3 E. coli, которая представляет собой часть анаэробного комплекса формиат-водород-лиазы (FHL), кодируется опероном hyc (включающим гены hycA, hycB, hycC, hycD, hycE, hycF, hycG, hycH и hycl). Hyd-4 E.coli кодируется опероном hyf (включающим гены hyfA, hyfB, hyfC, hyfD, hyfE, hyfF, hyfG, hyfH, hyfl, hyfJ и hyfR). FHL E.coli кодируется шестью генами из оперона hyc (hycB, hycC, hycD, hycE, hycF и hycG) и геном fdhF (кодирующим формиатдегидрогеназу Н (Fdh-Н)). Экспрессия комплекса FHL может дополнительно включать экспрессию пируват-формиат-лиазы (pfl), FhIA, транскрипционного фактора, который активирует транскрипцию fdhF и оперона hyc, или делецию/инактивацию HycA, транскрипционного фактора, кодируемого геном hycA, который негативно регулирует транскрипцию FHL. Совместную продукцию изопрена и водорода можно улучшить путем экспрессирования или инактивации/делеции дополнительных белков, вовлеченных в регуляцию экспрессии гена гидрогеназы и других ферментов, таких как, например, транскрипционный регуляторный комплекс железо-сера (iscR) (Kalim-Akhtar и др., "Deletion of iscR stimulates recombinant Clostridial Fe/Fe hydrogenase activity and H2-accumulation in Escherichia coli BL21(DE3)", Appl. Microblol. Biotechnol. 78:853-862 (2008). которая полностью включена в данную заявку посредством ссылки, особенно в отношении стимуляции активности гидрогеназы Fe/Fe клостридий и накопления водорода в E.coli путем делетирования гена iscR).
[0345] Типичные полипептиды ферредоксин-зависимых гидрогеназ включают, но не ограничены перечисленными, гидрогеназу A Clostridium acetobittulicum (HydA) (см., например, P.W. King и др., "Functional studies of [FeFe] hydrogenase maturation in an Escherichia coil biosynthetic system", J. Bacterial. 188(6); 163-172 (2006), которая полностью включена в данную заявку посредством ссылки, особенно в отношении продукции водорода HydA и тремя родственными HydA ферментами созревания (HydE, HydG и HydF), которые могут экспрессироваться отдельно или совместно с одним или несколькими из перечисленных далее ферментов: (1) ферредоксин-НАДФ+-оксидоредуктаза (NFOR) Bacillus subtilis (см., например, Viet и др., (2008)), которая полностью включена в данную заявку посредством ссылки, особенно в отношении продукции водорода NFOR; см. также номер публикации РСТ WO/2007/089901, которая полностью включена в данную заявку посредством ссылки, особенно в отношении оптимизации штаммов Е. coli для продукции водорода), ферредоксин-НАДФ-оксидоредуктаза (RnfCDGEAB) Clostridium kluyveri (Henning Seedorf и др., 'The genome of Clostridium kluyveri, a strict anaerobe with unique metabolic features", Proc. Nat'l Acad. Sci. U.S.A. 105(6):2128-2133 (2008), которая полностью включена в данную заявку посредством ссылки, особенно в отношении ферредоксин-НАДФ-оксидоредуктазы и в отношении компонентов анаэробного этанол-ацетатного пути ферментации), или ферредоксин-оксидоредуктаза (Fdx) Clostridium pasteuranium;
(2) глицеральдегид-6-фосфат-ферредоксин-оксидоредуктаза ("GAPOR"); или (3) пируват-ферредоксин-оксидоредуктаза ("POR"), и полипептиды (например, гибридные полипептиды), обладающие активностью двух или более полипептидов гидрогеназы или одного или нескольких полипептидов гидрогеназы и активностью одной или нескольких ферредоксин-зависимых оксидоредуктаз. В частности, полипептиды ферредоксин-зависимых гидрогеназ включают полипептиды, фрагменты полипептидов, пептиды и гибридные полипептиды, которые обладают по меньшей мере одной активностью полипептида ферредоксин-зависимой гидрогеназы.
[0346] Типичные полипептиды НАДФ+-зависимых гидрогеназ включают, но не ограничены перечисленными, полипептиды термофильных гидрогеназ, таких как гидрогеназа Pyrococcus furlosus (см., например, J. Woodward и др., "Enzymatic production of biohydrogen". Nature 405(6790); 1014-1015 (2000)), и полипептиды (например, гибридные полипептиды), обладающие активностью двух или более полипептидов НАДФ+-зависимых гидрогеназ. В частности, полипептиды НАДФ+-зависимых гидрогеназ включают полипептиды, фрагменты полипептидов, пептиды и гибридные полипептиды, которые обладают по меньшей мере одной активностью полипептида НАДФ+-зависимой гидрогеназы.
[0347] Типичные толерантные или нечувствительные к кислороду гидрогеназы включают, но не ограничены перечисленными, полипептиды гидрогеназы Rubrivivax gelatinosus (см., например, Р.С.Maness и др., "Characterization of the oxygen tolerance of a hydrogenase linked to a carbon monoxide oxidation pathway in Rubrivivax gelatinosus", Appl. Environ. Microbiol. 68(6):2633-2636 (2002), которая полностью включена в данную заявку посредством ссылки, особенно в отношении гидрогеназы R. gelatinosus) и гидрогеназы Ralstonia eutropha (см., например, Т. Burgdorf и др., «[NiFe]-hydrogenases of Ralstonia eutropha H16: modular enzymes for oxygen-tolerant biological hydrogen oxidation", J. Mol. Microbiol. Biotechnol. 10(2-4); 181-196 (2005), которая полностью включена в данную заявку посредством ссылки, особенно в отношении полипептидов гидрогеназы R. eutropha). В качестве альтернативы, гетерологичные нуклеиновые кислоты, кодирующие полипептиды гидрогеназы, можно мутировать и подвергнуть скринингу на толерантность к Ог или нечувствительность к 02, применяя стандартные способы и тесты (см., например, L.E. Nagy и др., "Application of gene-shuffling for the rapid generation of novel [FeFe]-hydrogenase libraries", Biotechnol. Letts. 29(3)421-430 (2007), которая включена в данную заявку посредством ссылки, особенно в отношении мутагенеза и скрининга на толерантные к кислороду полипептиды гидрогеназы).
[0348] Чтобы определить, обладает ли полипептид гидрогеназной активностью, можно применять стандартные способы (такие как описанные в данной заявке), например, измерение способности полипептида продуцировать газообразный водород in vitro, в клеточном экстракте или in vivo.
Типичные полипептиды и нуклеиновые кислоты для генов, связанных с получением побочных продуктов при ферментации
[0349] Кроме экспрессии или чрезмерной экспрессии гетерологичных или нативных гидрогеназ в Е. coli, совместную продукцию изопрена и водорода можно улучшить путем инактивации анаэробных биосинтетических путей, тем самым блокируя расход углерода на целый ряд метаболитов (т.е., побочных продуктов ферментации), которые продуцируются при условиях ограниченного количества кислорода, или анаэробных условиях, включая, но не ограничиваясь перечисленными, лактат, ацетат, пируват, этанол, сукцинат и глицерин. Типичные полипептиды, участвующие в продукции побочных продуктов ферментации, включают альфа-субъединицу формиатдегидрогеназы N (fdnG), большую субъединицу формиатдегидрогеназы О, (fdoG), нитратредуктазу (пагС), транспортер формиата A (focA), транспортер формиата В (focB), пируватоксидазу (рохВ), компонент ackA/pta пируватдегидрогеназы Е1 (асеЕ), алкогольдегидрогеназу (adhE), мембранный белок фумаратредуктазу (frdC) и лактатдегидрогеназу (ldhA). См., например, Toshinori Maeda и др., "Enhanced hydrogen production from glucose by metabolically engineered Escherichia coli", Appl. Microbiol. Biotechnol. 77(4):879-890 (2007), которая полностью включена посредством ссылки, особенно в отношении получения штаммов Е. coli с модифицированным метаболизмом глюкозы. Типичные полипептиды, вовлеченные в регуляцию или экспрессию генов, участвующих в образовании побочных продуктов ферментации, которые также можно инактивировать, чтобы улучшить совместную продукцию изопрена и водорода, включают, но не ограничены перечисленными, репрессор формиат-водород-лиазы (hycA), регулятор фумаратредуктазы (fnr), ацетил-коэнзим А-синтетазу (acs) и регуляторный белок формиатдегидрогеназы (hycA), который регулирует экспрессию транскрипционного регулятора fhIA (активатор транскрипции формиат-водород-лиазы).
Типичные полипептиды и нуклеиновые кислоты для генов, связанных с обратным захватом водорода
[0350] Типичные полипептиды, вовлеченные в обратный захват водорода, которые также можно инактивировать, чтобы улучшить совместную продукцию изопрена и водорода, включают, но не ограничены перечисленными, гидрогеназу-1 Е. coli (Hyd-1) (оперон hyd) и гидрогеназу-2 Е. coli (Hyd-2) (оперон hyb). Hyd-1 Е. coli кодируется опероном hya (включающим гены hyaA, hyaB, hyaC, hyaD, hyaE и hyaF). Hyd-2 Е. coli кодируется опероном hyb (включающим гены hybA, hybB, hybC, hybD, hybE, hybF, hybG и hybO).
Типичные способы выделения нуклеиновых кислот
[0351] Нуклеиновые кислоты для изопренсинтазы, DXS, IDI, пути MVA, гидрогеназы, фактора созревания и/или транскрипции гидрогеназы можно выделить, применяя стандартные способы. Способы получения необходимых нуклеиновых кислот из интересующего исходного организма (например, из бактериального генома) типичны и хорошо известны в области молекулярной биологии (см., например, WO 2004/033646 и источники, цитированные в данном документе, каждый из которых настоящим полностью включен посредством ссылки, особенно в отношении выделения интересующих нуклеиновых кислот). Например, если последовательность нуклеиновых кислот известна (например, любая из известных нуклеиновых кислот, описанных в данной заявке), можно создать подходящие геномные библиотеки путем расщепления эндонуклеазами рестрикции и можно осуществить скрининг с помощью зондов, комплементарных желательной последовательности нуклеиновых кислот. Как только была выделена последовательность, можно амплифицировать ДНК, применяя стандартные опосредованные праймерами способы амплификации, такие как полимеразная цепная реакция (ГТЦР) (патент США номер 4683202, который полностью включен посредством ссылки, особенно в отношении способов ПЦР), для получения количества ДНК, подходящего для трансформации с помощью подходящих векторов.
[0352] В качестве альтернативы, нуклеиновые кислоты для изопренсинтазы, DXS, IDI, MVA-пути, гидрогеназы, фактора созревания и/или транскрипции для гидрогеназы (такие как любые нуклеиновые кислоты изопренсинтазы, DXS, IDI, MVA-пути, гидрогеназы, фактора созревания и/или транскрипции для гидрогеназы с известной последовательностью нуклеиновых кислот) можно синтезировать химическим путем, применяя стандартные способы.
[0353] Дополнительные полипептиды и нуклеиновые кислоты для изопренсинтазы, DXS, IDI, MVA-пути, гидрогеназы, фактора созревания и/или транскрипции гидрогеназы, которые могут оказаться подходящими для применения в композициях и способах, описанных в данной заявке, можно идентифицировать, применяя стандартные способы. Например, космидные библиотеки хромосомной ДНК организмов, которые, как известно, продуцируют изопрен в природе, можно сконструировать в таких организмах, как Е. coli, а затем подвергнуть скринингу на продукцию изопрена. В частности, можно создать космидные библиотеки, в которых большие фрагменты геномной ДНК (35-45 т.п.о.) упакованы в векторы и используются для трансформации подходящих хозяев. Космидные векторы уникальны, так как они способны вмещать большие количества ДНК. Как правило, космидные векторы включают по меньшей мере одну копию последовательности ДНК cos, которая необходима для упаковки и последующей циркуляризации гетерологичной ДНК. Вдобавок к последовательности cos, данные векторы также включают точку начала репликации, такую как ColEI, и маркеры лекарственной устойчивости, такие как нуклеиновая кислота устойчивости к ампициллину или неомицину. Способы применения космидных векторов для трансформации подходящих бактериальных хозяев хорошо описаны в Sambrook и др.. Molecular Cloning: A Laboratory Manual, 2ое изд.. Cold Spring Harbor, 1989, которая настоящим полностью включена посредством ссылки, особенно в отношении способов трансформации.
[0354] Обычно для клонирования космид гетерологичную ДНК выделяют, применяя подходящие эндонуклеазы рестрикции, и лигируют рядом с участком cos космидного вектора, применяя подходящие лигазы. Космидные векторы, содержащие линеаризованную гетерологичную ДНК, затем приводят в контакт со средством упаковки ДНК, таким как бактериофаг.В процессе упаковки, сайты cos расщепляются и гетерологичная ДНК упаковывается в капсид бактериальной вирусной частицы. Данные частицы затем используют для трансфицирования подходящих клеток-хозяев, таких как Е. coli. При попадании в клетку, гетерологичная ДНК циркуляризуется под влиянием липких концов cos. Таким способом большие фрагменты гетерологичной ДНК можно ввести и экспрессировать в клетках-хозяевах.
[0355] Дополнительные способы получения нуклеиновых кислот для изопренсинтазы, DXS, IDI, MVA-пути, гидрогеназы, фактора созревания и/или транскрипции гидрогеназы включают скрининг метагеномной библиотеки с помощью анализа (такого как анализ свободного пространства над поверхностью, описанный в данной заявке) или с помощью ПЦР с применением праймеров, направленных против нуклеотидов, кодирующих участок консервативных аминокислот (например, по меньшей мере 3 консервативные аминокислоты). Консервативные аминокислоты можно идентифицировать путем выравнивания последовательностей аминокислот известных полипептидов изопренсинтазы, DXS, IDI, пути MVA. гидрогеназы, фактора созревания и/или транскрипции гидрогеназы. Консервативные аминокислоты для полипептидов изопренсинтазы можно идентифицировать на основании выравнивания последовательностей известных полипептидов изопренсинтазы. Организм, который в природе продуцирует изопрен, можно подвергнуть стандартным способам очистки белка (которые хорошо известны в данной области) и полученный в результате этого очищенный полипептид можно секвенировать, применяя стандартные способы. Другие способы можно найти в литературе (см., например, Julsing и др.. Applied. Microbiol. Biotechnol. 75: 1377-84, 2007; Withers и др., Appi Environ Microbiol. 73(19):6277-83, 2007, каждая из перечисленных публикаций настоящим полностью включена посредством ссылки, особенно в отношении идентификации нуклеиновых кислот, вовлеченных в синтез изопрена).
[0356] Дополнительно, можно применять стандартные программы выравнивания последовательностей и/или предсказания структуры, чтобы идентифицировать дополнительные полипептиды и нуклеиновые кислоты для DXS, IDI, MVA-пути, гидрогеназы, фактора созревания и/или транскрипции гидрогеназы на основании сходства первичной и/или предсказанной вторичной структуры полипептида с таковой для известных полипептидов и нуклеиновых кислот для DXS, IDI, MVA-пути, гидрогеназы, фактора созревания и/или транскрипции гидрогеназы. Также можно использовать стандартные базы данных, такие как база данных swissprot-trembi (ссылка в Интернете "expasy.org", Swiss Institute of Bioinformatics Swiss-Prot group CMU - 1 rue Michel Servet CH-1211 Женева 4, Швейцария), чтобы идентифицировать регуляторные полипептиды и нуклеиновые кислоты для изопренсинтазы, DXS, IDI, MVA-пути, гидрогеназы, созревания и/или транскрипции гидрогеназы. Вторичную и/или третичную структуру полипептида изопренсинтазы, DXS, IDI, MVA-пути, гидрогеназы, фактора созревания и/или транскрипции гидрогеназы можно предсказать, применяя параметры по умолчанию программ предсказания стандартных структур, таких как PredictProtein (630 West, 168 Street, BB217, Нью-Йорк, Нью-Йорк 10032, США). В качестве альтернативы, фактическую вторичную и/или третичную структуру полипептида изопренсинтазы, DXS, IDI, MVA-пути, гидрогеназы, фактора созревания и/или транскрипции гидрогеназы можно определить, применяя стандартные способы. Дополнительные нуклеиновые кислоты для изопренсинтазы, DXS, IDI, MVA-пути, гидрогеназы, фактора созревания и/или транскрипции гидрогеназы также можно идентифицировать путем гибридизации с зондами, полученными из известных нуклеиновых кислот для изопренсинтазы, DXS, IDI, MVA-пути, гидрогеназы, фактора созревания и/или транскрипции гидрогеназы.
Типичные промоторы и векторы
[0357] Любую из нуклеиновых кислот изопренсинтазы, DXS, IDI, пути MVA. гидрогеназы, фактора созревания и/или транскрипции гидрогеназы, описанных в данной заявке, можно включить в один или более векторов. Соответственно, в данной заявке также описаны векторы, содержащие одну или более нуклеиновых кислот, кодирующих любой из полипептидов изопренсинтазы, DXS, IDI, пути MVA, гидрогеназы, фактора созревания и/или транскрипции гидрогеназы, которые описаны в данной заявке. В некоторых вариантах реализации, указанный вектор содержит нуклеиновую кислоту под контролем контролирующей экспрессию последовательности.
[0358] В некоторых вариантах реализации, указанный вектор включает селективный маркер или селектируемый маркер. Маркеры, подходящие в векторных системах трансформации Trichoderma, известны в данной области (см., например, Finkelstein, глава 6 в Biotechnology of Filamentous Fungi, Finkelstein и др., ред. Butterworth-Heinemann, Бостон, Массачусетс, глава 6., 1992; и Kinghom и др.. Applied Molecular Genetics of Filamentous Fungi, Blackie Academic and Professional, Chapman и Hall, Лондон, 1992, каждая из перечисленных публикаций настоящим полностью включена посредством ссылки, особенно в отношении селективных маркеров). В некоторых вариантах реализации, указанный селективный маркер представляет собой нуклеиновую кислоту amdS, которая кодирует фермент ацетамидазу, позволяющий трансформированным клеткам расти на ацетамиде в качестве источника азота. Применение нуклеиновой кислоты amdS A, nidulans в качестве селективного маркера описано у Kelley и др., EMBO J. 4:475 - 479, 1985 и Penttila и др.. Gene 61:155-164, 1987 (каждая из перечисленных публикаций настоящим полностью включена посредством ссылки, особенно в отношении селективных маркеров). В некоторых вариантах реализации, регуляторная нуклеиновая кислота для изопренсинтазы, DXS, EDI, MVA-пути, гидрогеназы, созревания или транскрипции гидрогеназы встраивается в хромосому клеток без селективного маркера.
[0359] Подходящие векторы представляют собой такие векторы, которые совместимы с используемой клеткой-хозяином. Подходящие векторы можно получить, например, из бактерии, вируса (такого как бактериофаг Т7 или полученный из М-13 фаг), космиды, дрожжей или растения. Протоколы получения и применения таких векторов известны специалистам в данной области (см., например, Sambrook и др., Molecular Cloning: A Laboratory Manual, 2ое изд.. Cold Spring Harbor, 1989, которая настоящим полностью включена посредством ссылки, особенно в отношении применения векторов).
[0360] Промоторы хорошо известны в данной области. Любой промотор, который функционирует в клетке-хозяине, можно применять для экспрессии нуклеиновой кислоты для изопренсинтазы, DXS, IDI, MVA-пути, гидрогеназы, фактора созревания и/или транскрипции гидрогеназы в клетке-хозяине. Существует множество участков, контролирующих инициацию, или промоторов, которые полезны для запуска экспрессии нуклеиновых кислот для изопренасинтазы, DXS, IDI, MVA-пути, гидрогеназы, фактора созревания и/или транскрипции гидрогеназы в различных клетках-хозяевах, и они знакомы специалистам в данной области (см., например, WO 2004/033646 и источники, цитированные в данном документе, каждый из которых настоящим полностью включен посредством ссылки, особенно в отношении векторов для экспрессирования интересующих нуклеиновых кислот). Можно применять практически любой промотор, способный запускать экспрессию данных нуклеиновых кислот, включая, но не ограничиваясь перечисленными, CYC1, HIS3, GAL1, GAL10, ADH1. PGK. PH05, GAPDH, ADCI, TRP1, URA3, LEU2, ENO и TPI (подходящие для экспрессии в Saccharomyces); AOX1 (подходящий для экспрессии в Pichia); и lac, trp, λPL, λPR,T7, tac и trc (подходящие для экспрессии в Е. coli).
[0361] В некоторых вариантах реализации, применяют промотор глюкоизомеразы (см., например, патент США номер 7132527 и источники, цитированные в данном документе, каждый из которых настоящим полностью включен посредством ссылки, особенно в отношении промоторов и плазмидных систем для экспрессирования интересующих полипептидов). Можно применять описанные мутанты промотора глюкоизомеразы для изменения уровня экспрессии полипептида, кодируемого нуклеиновой кислотой, функционально связанной с промотором глтокоизомеразы (патент США номер 7132527). В различных вариантах реализации, указанный промотор глюкоизомеразы включен в низко-, умеренно- или многокопийную плазмиду (патент США номер 7132527).
[0362] В различных вариантах реализации, нуклеиновая кислота для изопренсинтазы, DXS, IDI, MVA-пути, гидрогеназы, фактора созревания и/или транскрипции гидрогеназы включена в низкокопийную плазмиду (например, плазмиду, которая поддерживается на уровне от приблизительно 1 до приблизительно 4 копий на клетку), умереннокопийную плазмиду (например, плазмиду, которая поддерживается на уровне от приблизительно 10 до приблизительно 15 копий на клетку) или многокопийную плазмиду (например, плазмиду, которая поддерживается на уровне приблизительно 50 или более копий на клетку). В некоторых вариантах реализации, указанная гетерологичная или дополнительная эндогенная нуклеиновая кислота для изопренсинтазы, DXS, IDI, MVA-пути, гидрогеназы, фактора созревания и/или транскрипции гидрогеназы функционально связана с промотором Т7. В некоторых вариантах реализации, гетерологичная или дополнительная эндогенная нуклеиновая кислота для изопренсинтазы, DXS, IDI, MVA-пути, гидрогеназы, фактора созревания и/или транскрипции гидрогеназы, функционально связанная с промотором Т7, включена в умеренно- или многокопийную плазмиду. В некоторых вариантах реализации, гетерологичная или дополнительная эндогенная нуклеиновая кислота для изопренсинтазы, DXS, IDI, MVA-пути, гидрогеназы, фактора созревания и/или транскрипции гидрогеназы функционально связана с промотором Тгс.В некоторых вариантах реализации, гетерологичная или дополнительная эндогенная нуклеиновая кислота для изопренсинтазы, DXS, IDI, MVA-пути, гидрогеназы, фактора созревания и/или транскрипции гидрогеназы, функционально связанная с промотором Тгс, включена в умеренно- или многокопийную плазмиду. В некоторых вариантах реализации, гетерологичная или дополнительная эндогенная нуклеиновая кислота для изопренсинтазы, DXS, IDI, MVA-пути, гидрогеназы, фактора созревания и/или транскрипции гидрогеназы функционально связана с промотором Lac. В некоторых вариантах реализации, гетерологичная или дополнительная эндогенная нуклеиновая кислота для изопренсинтазы, DXS, IDI, MVA-пути, гидрогеназы, фактора созревания и/или транскрипции гидрогеназы, функционально связанная с промотором Lac, включена в низкокопийную плазмиду. В некоторых вариантах реализации, гетерологичная или дополнительная эндогенная нуклеиновая кислота, для изопренсинтазы, DXS, IDI, MVA-пути, гидрогеназы, фактора созревания и/или транскрипции гидрогеназы функционально связана с эндогенным промотором, таким как эндогенный промотор Eschenchia, Panteoa, Bacillus, Yarrowia, Streptomyces или Trichodenna. или эндогенный промотор щелочной сериновой протеазы, изопренсинтазы, DXS, IDI, MVA-пути, гидрогеназы, фактора созревания и/или транскрипции гидрогеназы. В некоторых вариантах реализации, гетерологичная или дополнительная эндогенная нуклеиновая кислота для изопренсинтазы, DXS, IDI, MVA-пути, гидрогеназы, фактора созревания и/или транскрипции гидрогеназы, функционально связанная с эндогенным промотором, включена в многокопийную плазмиду. В некоторых вариантах реализации, вектор представляет собой реплицирующуюся плазмиду, которая не встраивается в хромосому в клетках. В некоторых вариантах реализации, часть вектора или весь вектор встраивается в хромосому в клетках.
[0363] В некоторых вариантах реализации, указанный вектор представляет собой любой вектор, который при введении в грибковую клетку-хозяина интегрируется в геном клетки-хозяина и реплицируется в ней. Перечень векторов можно найти в следующем источнике: Fungal Genetics Stock Center Catalogue of Strains (FGSC, ссылка в Интернете "fgsc.net", и в источниках, цитированных в данном документе, каждый из которых настоящим полностью включен посредством ссылки, особенно в отношении векторов). Дополнительные примеры подходящих векторов экспрессии и/или интеграции приведены в Sambrook и др., Molecular Cloning: A Laboratory Manual, 2ое изд. Cold Spring Harbor, 1989, Current Protocols in Molecular Biology (F. M. Ausubel и др. (ред.) 1987, приложение 30, раздел 7.7.18); van den Hondel и др. у Bennett и Lasure (ред.) More Gene Manipulations in Fungi, Academic Press, стр.396-428, 1991; и в патенте США номер 5874276, каждый из перечисленных документов настоящим полностью включен посредством ссылки, особенно в отношении векторов. Особенно ценные векторы включают pFB6, pBR322, PUC18, pUClOO и pENTR/D.
[0364] В некоторых вариантах реализации, нуклеиновая кислота для изопренсинтазы, DXS, IDI, MVA-пути, гидрогеназы, фактора созревания и/или транскрипции гидрогеназы функционально связана с подходящим промотором, который проявляет транскрипционную активность в грибковой клетке-хозяине. Промотор можно получить из одной или нескольких нуклеиновых кислот, кодирующих полипептид, который является либо эндогенным, либо гетерологичным по отношению к клетке-хозяину, В некоторых вариантах реализации, указанный промотор применим в хозяине Trichoderma. Подходящие неограничивающие примеры промоторов включают промоторы cbh\, cbhl, egl\, egl2, pepA, hfb\, hfb2, xyn\ и ату. В некоторых вариантах реализации, промотор представляет собой такой промотор, который нативен по отношению к клетке-хозяину. Например, в некоторых вариантах реализации, когда хозяин представляет собой Т. reesei, указанный промотор представляет собой нативный промотор Т. reesei. В некоторых вариантах реализации, промотор представляет собой промотор cbhl Т. reesei, который представляет собой индуцируемый промотор, депонированный в GenBank под номером доступа D86235, который полностью включен посредством ссылки, особенно в отношении промоторов. В некоторых вариантах реализации, промотор представляет собой такой промотор, который гетерологичен по отношению к грибковой клетке-хозяину. Другие примеры подходящих промоторов включают промоторы из генов глюкоамилазы (glaA) A. awamori и A. niger (Nunberg и др., Mol. Cell Biol. 4:2306-2315, 1984 и Boel и др., ЕМВО J. 3:1581-1585, 1984, каждая из перечисленных публикаций настоящим полностью включена посредством ссылки, особенно в отношении промоторов); альфа-амилазы Aspergillus niger, амилазы ТАКА Aspergillus огугае, х1п\ Т. reesei и целлобиогидролазы 1 Т. reesei (EP 137280, который полностью включен посредством ссылки, особенно в отношении промоторов).
[0365] В некоторых вариантах реализации, указанный вектор экспрессии также включает терминирующую последовательность. Участки, контролирующие терминацию, также можно получить из различных генов, нативных по отношению к клетке-хозяину. В некоторых вариантах реализации, терминирующую последовательность и промоторную последовательность получают из одного источника. В другом варианте реализации, терминирующая последовательность эндогенна по отношению к клетке-хозяину. Особенно подходящая терминирующая последовательность представляет собой терминирующую последовательность cbh1, полученную из штамма Trichoderma (такого как Т. reesei). Другие полезные грибковые терминаторы включают терминатор из нуклеиновой кислоты глюкоамилазы A. niger или A. awamori (Nunberg и др., Mol. Cell Biol. 4:2306-2315, 1984 и Boel и др., ЕМВО J. 3:1581-1585, 1984; каждая из перечисленных публикаций настоящим полностью включена посредством ссылки, особенно в отношении грибковых терминаторов). Возможно, может быть введен сайт терминации. Для эффективной экспрессии полипептидов, кодирующую полипептид ДНК функционально связывают посредством инициирующих кодонов с выбранными контролирующими экспрессию участками таким образом, что экспрессия приводит к получению подходящей информационной РНК.
[0366] В некоторых вариантах реализации, каждый из промотора, кодирующего участка и терминатора получают из нуклеиновой кислоты для изопренсинтазы, DXS, IDI, MVA-пути, гидрогеназы, фактора созревания и/или транскрипции гидрогеназы, которую нужно экспрессировать. В некоторых вариантах реализации, кодирующий участок для нуклеиновой кислоты для изопренсинтазы, DXS, IDI, MVA-пути, гидрогеназы, фактора созревания и/или транскрипции гидрогеназы вставляют в универсальный вектор экспрессии таким образом, что он находится под транскрипционным контролем последовательностей промотора и терминатора экспрессионной конструкции. В некоторых вариантах реализации, гены или часть гена вставляют по ходу транскрипции от сильного промотора cbh1.
[0367] Нуклеиновую кислоту для изопренсинтазы, DXS, IDI, MVA-пути, гидрогеназы, фактора созревания и/или транскрипции гидрогеназы можно включить в вектор, такой как вектор экспрессии, применяя стандартные методики (Sambrook и др., Molecular Cloning: A Laboratory Manual, Cold Spring Harbor, 1982, которая настоящим полностью включена посредством ссылки, особенно в отношении скрининга подходящих последовательностей ДНК и конструирования векторов). Способы, применяемые для лигирования конструкции ДНК, содержащей интересующую нуклеиновую кислоту (такую как нуклеиновая кислота для изопренсинтазы, DXS, IDI, MVA-пути, гидрогеназы, фактора созревания и/или транскрипции гидрогеназы), промотор, терминатор и другие последовательности, и для ее вставки в подходящий вектор хорошо известны в данной области. Например, можно применять рестрикционные ферменты для расщепления нуклеиновой кислоты изопренсинтазы, DXS, IDI, пути MVA, гидрогеназы, фактора созревания и/или транскрипции гидрогеназы и вектора. Затем, совместимые концы расщепленной нуклеиновой кислоты для изопренсинтазы, DXS, IDI, MVA-пути, гидрогеназы, фактора созревания и/или транскрипции гидрогеназы и расщепленного вектора можно лигировать. Соединение, как правило, осуществляют путем лигирования по удобным сайтам рестрикции. Если таких сайтов нет, применяют синтетические олигонуклеотидные линкеры, в соответствии с обычной практикой (см. Sambrook и др.. Molecular Cloning: A Laboratory Manual, 2ое изд.. Cold Spring Harbor, 1989, и Bennett и Lasure, More Gene Manipulations in Fungi, Academic Press, Сан-Диего, стр.70-76, 1991, каждая из перечисленных публикаций настоящим полностью включена посредством ссылки, особенно в отношении олигонуклеотидных линкеров). Дополнительно, векторы можно сконструировать, применяя известные методики рекомбинации (например, Invitrogen Life Technologies, Gateway Technology).
[0368] В некоторых вариантах реализации, может оказаться желательным чрезмерно экспрессировать нуклеиновые кислоты для изопренсинтазы, DXS, IDI, MVA-пути, гидрогеназы, фактора созревания и/или транскрипции гидрогеназы на уровнях, гораздо более высоких, чем обнаруженные на сегодняшний день во встречающихся в природе клетках. Данного результата можно достичь путем селективного клонирования нуклеиновых кислот, кодирующих данные полипептиды, в многокопийные плазмиды или путем помещения данных нуклеиновых кислот под контроль сильного индуцируемого или конститутивного промотора. Способы чрезмерного экспрессирования желательных полипептидов обычны и хорошо известны в области молекулярной биологии, а примеры можно найти у Sambrook и др.. Molecular Cloning: A Laboratory Manual, 2oe изд.. Cold Spring Harbor. 1989, которая настоящим полностью включена посредством ссылки, особенно в отношении методик клонирования.
[0369] В некоторых вариантах реализации, может оказаться желательным недостаточное экспрессирование (например, мутирование, инактивирование или удаление) нуклеиновых кислот, кодирующих полипептид изопренсинтазы, DXS, IDI, MVA-пути, гидрогеназы, фактор созревания или транскрипции гидрогеназы на уровнях, гораздо более низких, чем обнаруженные на сегодняшний день во встречающихся в природе клетках. Данного результата можно достичь путем мутирования или инактивации белков, регулирующих транскрипцию, необходимых для экспрессии нуклеиновых кислот для изопренасинтазы, DXS, IDI, MVA-пути, гидрогеназы, фактора созревания и/или транскрипции гидрогеназы, путем делеции нуклеиновых кислот изопренсинтазы, DXS, IDI, пути MVA, гидрогеназы, фактора созревания и/или транскрипции гидрогеназы, или путем помещения данных нуклеиновых кислот под контроль сильного репрессируемого промотора. Способы мутирования, инактивирования или удаления желательных полипептидов обычны и хорошо известны в области молекулярной биологии, а примеры можно найти у Sambrook и др.. Molecular Cloning: A Laboratory Manual, 2ое изд.. Cold Spring Harbor, 1989, которая настоящим полностью включена посредством ссылки, особенно в отношении методик клонирования и мутагенеза.
[0370] Следующие источники содержат описания дополнительных основных методик, полезных в соответствии с композициями и способами, описанными в данной заявке: Kreigler, Gene Transfer and Expression; A Laboratory Manual, 1990 и Ausubel и др., ред. Current Protocols in Molecular Biology, 1994. каждый из перечисленных источников настоящим полностью включен посредством ссылки, особенно в отношении методик молекулярной биологии и клонирования.
Типичные исходные организмы
[0371} Нуклеиновые кислоты для изопренсинтазы, DXS, IDI, MVA-пути, гидрогеназы, фактора созревания и/или транскрипции гидрогеназы (и кодируемые ими полипептиды) можно получить из любого организма, который по природе содержит нуклеиновые кислоты для изопренсинтазы, DXS, IDI, MVA-пути. гидрогеназы. фактора созревания и/или транскрипции гидрогеназы. Выше отмечалось, что изопрен в природе продуцируется множеством организмов, таких как бактерии, дрожжи, растения и животные. Организмы содержат ферменты, обеспечивающие MVA-путь, DXP-путь или оба пути продукции изопрена: MVA и DXP (Фигуры 19А и 19 В). Таким образом, нуклеиновые кислоты DXS можно получить, например, из любого организма, который содержит путь DXP или содержит оба пути MVA и DXP. Нуклеиновые кислоты IDI и изопренсинтазы можно получить, например, из любого организма, который содержит путь MVA, путь DXP или оба пути MVA и DXP. Нуклеиновые кислоты MVA-пути можно получить, например, из любого организма, который содержит MVA-путь или содержит оба пути MVA и DXP. Нуклеиновые кислоты гидрогеназы можно получить, например, из любого организма, который окисляет водород или восстанавливает ионы водорода. Гены побочных продуктов ферментации можно идентифицировать или получить, например, из любого организма, который обладает дыханием в условиях ограниченного количества кислорода или анаэробным дыханием, таким как гликолиз.
[0372]- В некоторых вариантах реализации, последовательность нуклеиновых кислот изопренсинтазы, DXS, IDI, пути MVA, гидрогеназы, фактора созревания и/или транскрипции гидрогеназы идентична последовательности нуклеиновой кислоты, которую продуцирует в природе любой из описанных далее организмов. В некоторых вариантах реализации, последовательность аминокислот полипептида изопренсинтазы, DXS. IDI, MVA-пути, гидрогеназы, фактора созревания и/или транскрипции гидрогеназы идентична последовательности полипептида, который продуцирует в природе любой из описанных далее организмов. В некоторых вариантах реализации, нуклеиновая кислота или полипептид изопренсинтазы, DXS, IDI, MVA-пути, гидрогеназы, фактора созревания и/или транскрипции гидрогеназы представляет собой мутантную нуклеиновую кислоту или полипептид, полученный из любых организмов, описанных в данной заявке. В настоящем описании, "полученные из" относится к источнику нуклеиновой кислоты или полипептида, в который ввели одну или более мутаций. Например, полипептид, который "получен из полипептида растения" относится к интересующему полипептиду, который получают путем введения одной или нескольких мутаций в последовательность дикого типа (т.е., во встречающуюся в природе последовательность) полипептида растения.
[0373] В некоторых вариантах реализации, исходный организм представляет собой гриб, примерами которого являются следующие виды: Aspergillus, такой как А. огугае и A. niger, виды Saccharomyces, такие как S. cerevisiae, виды Schiwsaccharomyces, такие как S. pombe, и виды Trichodenna, такие как Т. reesei. В некоторых вариантах реализации, исходный организм представляет собой мицелиальную грибковую клетку. Термин "мицелиальные грибы" относится ко всем мицелиальным формам подгруппы Eumycotlna (см. Alexopoulos, С.J. (1962), Introductory Mycology, Wiley, Нью-Йорк).
Данные грибы характеризуют вегетативным мицелием с клеточной стенкой, состоящей из хитина, целлюлозы и других сложных полисахаридов. Мицелиальные грибы морфологически, физиологически и генетически отличаются от дрожжей. Вегетативный рост мицелиальных грибов происходит засчет элонгации гифов и катаболизм углерода облигатно аэробный. Исходная клетка мицелиальных грибов может представлять собой клетку видов, не ограничиваясь перечисленными, Trichoderma, (например, Trichoderma reesei, неполовой морф Hypocrea jecorina, ранее классифицированный как Г. longibrachiatum, Trichoderma viride, Trichoderma koningii, Trichoderma harzianum) (Sheir-Neirs и др., Appl. Microbiol. Biotechnol 20: 46-53, 1984;
номер АТСС 56765 и номер АТСС 26921); Penlcillium sp., Humicola sp.(например, Н. insolens, Н. lanuginose или Н. grisea); Chrysosporium sp.(например, С.lucknowense), Gliocladium sp., Aspergillus sp.(например, A. oryzae, A. niger, A sojae, A. japonicus, A. nidulans или A. awamori) (Ward и др., Appl, Microbiol. Biotechnol. 39: 7380743, 1993 и Goedegebuur и др., Genet 41: 89-98, 2002), Fusarium sp„ (1Например, F. roseum, F. graminum F. cerealis, F. oxysporuim или F. venenatum), Neurospora sp.. (1Например, N. crassa), Hypocrea sp„ Mucor sp., (например, M. miehei), Rhizopus sp.и Emericella sp.(см. также, Innis и др., Sci. 228: 21-26, 1985). Термин "Trichoderma" или "Trichoderma sp." или "Trichoderma spp." относятся к любому роду грибов, ранее или в настоящее время классифицированному как Trichoderma.
[0374] В некоторых вариантах реализации, гриб представляет собой A. nidulans, A. awamori, A. oryzae, A. aculeatus, A. niger. A. japonicus. Т. reesei, Т. viride, F. oxysporum или F. solani. Штаммы Aspergillus описаны у Ward и др., Appl. Microbiol. Biotechnol. 39:738-743. 1993 и Goedegebuur и др., Curr Gene 41:89-98, 2002, каждая из перечисленных публикаций настоящим полностью включена посредством ссылки, особенно в отношении грибов. В особых вариантах реализации, гриб представляет собой штамм Trichoderma, такой как штамм Т. reesei. Штаммы Т. reesei известны и их неограничивающие примеры включают номер АТСС 13631, номер АТСС 26921, номер АТСС 56764, номер АТСС 56765, номер АТСС 56767 и NRRL 15709, каждый из которых настоящим полностью включен посредством ссылки, особенно в отношении штаммов Т. reesei. В некоторых вариантах реализации, штамм-хозяин представляет собой производный штамм от RL-P37. RL-P37 описан у Sheir-Neiss и др., Appl, Microbiol. Biotechnology 20:46-53, 1984, которая настоящим полностью включена посредством ссылки, особенно в отношении штаммов Т. reesei.
[0375] В некоторых вариантах реализации, исходный организм представляет собой дрожжи, такие как Saccharomyces sp., Schizosaccharomyces sp., Pichia sp.или Candida sp.В некоторых вариантах реализации, Saccharomyces sp.представляет собой Saccharomyces cerevisiae.
[0376] В некоторых вариантах реализации, исходный организм представляет собой бактерию, такую как штаммы Bacillus, такие как В. lichenformis или В, subtilis, штаммы Pantoea, такие как Р. citrea, штаммы Pseudomonas, такие как Р. alcaligenes, P. putida или Р. fluorescens, штаммы Streptomyces, такие как S. lividans или S. rubiginosus, штаммы Corynebacterium sp„ такие как Corynebacterium glutamicum, штаммы Rhodopseudomonas sp„ такие как Rhodopseudomonas palustris или штаммы Escherichia, такие как Е. coli.
[0377] В настоящем описании, "род Bacillus1'' включает все виды рода "Bacillus'3, известные специалистам в данной области, включая, но не ограничиваясь перечисленными, В. subtilis, В. licheniformis, В. lentus, В. brevis. В. stearothennophilus, В. alkalophilus, В. amylollquefaciens, В. clausli, В. halodurans, В. megaterium, В. coagulans, В. circulans, В. lautus и В. thuringiensis. Известно, что род Bacillus продолжает подвергаться таксономической реорганизации. Таким образом, предполагается, что указанный род включают виды, которые были переклассифицированы, включая, но не ограничиваясь перечисленными, такие организмы, как В. stearothennophilus, который теперь называют "Geobacillus stearothennophilus". Продукцию устойчивых эндоспор в присутствии кислорода считают определяющей чертой рода Bacillus, хотя это свойство также распространяется на недавно названных Allcyclobacillus, Amphibacillus, Aneurinibacillus, Anoxybacillus, Brevibacillus, Filobacillus, Gracilibacillus, Halobacillus, Paenibacillus, Salibacillus, Thennobacillus, Urelbacillus и Virgibacillus.
[0378] В некоторых вариантах реализации, исходный организм представляет собой грамположительную бактерию. Неограничивающие примеры включают штаммы Streptomyces (например, S. lividans, S. coelicolor или S. griseus) и Bacillus. В некоторых вариантах реализации, исходный организм представляет собой грамотрицательную бактерию, такую как Е. coli; Rhodopseudomonas sp; такую как Rhodopseudomonas palustris, или Pseudomonas sp., такую как Р. alcaligenes, P. putida или Р. fluorescens.
[0379] В некоторых вариантах реализации, исходный организм представляет собой растение, такое как растение из семейства Бобовых, такое как растение из подсемейства Мотыльковых. В некоторых вариантах реализации, исходный организм представляет собой кудзу, тополь (такой как Populus alba x tremula CAC35696), осину (такой как Populus tremuloides) или Quercus robur.
[0380] В некоторых вариантах реализации, исходный организм представляет собой водоросли, такие как зеленые водоросли, красные водоросли, глаукофиты, хлорарахниофиты, эуглениды, хромисты или динофлагеллаты.
[0381] В некоторых вариантах реализации, исходный организм представляет собой цианобактерии, такие как цианобактерии, отнесенные в любую из следующих групп на основании морфологии: Chroococcales, Pleurocapsales, Oscillatoriales, Nostocales или Stigonematales.
[0382] В некоторых вариантах реализации, исходный организм представляет собой анаэробный организм. Анаэробные организмы могут включать, но не ограничены перечисленными, облигатные анаэробы, факультативные анаэробы и аэротолерантные анаэробы. Такие организмы могут представлять собой любые из организмов, перечисленых выше, бактерии, дрожжи и т.д. В одном варианте реализации, облигатные анаэробы могут представлять собой любой из перечисленных облигатных анаэробов или комбинацию облигатных анаэробов, выбранных из группы, состоящей из Clostridium ljungdahlii, Clostridium autoethanogenum, Eurobacterium Umosum, Clostridium carboxydivorans, Peptostreptococcus productus и Butyribacterium methylotrophicum. Должно быть очевидно, что любую комбинацию любых из исходных организмов, описанных в данной заявке, можно применять для других вариантов реализации настоящего изобретения.
Типичные клетки-хозяева
[0383] Целый ряд клеток-хозяев можно применять для экспрессии полипептидов изопренсинтазы, DXS, IDI, MVA-пути, гидрогеназы, фактора созревания и/или транскрипции гидрогеназы и для совместной продукции изопрена и водорода в способах, описанных в данной заявке. Типичные клетки-хозяева включают клетки из любых из организмов, перечисленых в предыдущем разделе под заголовком "Типичные исходные организмы". Клетка-хозяин может представлять собой клетку, которая по природе продуцирует изопрен, или клетку, которая по природе не продуцирует изопрен, В некоторых вариантах реализации, указанная клетка-хозяин по природе продуцирует изопрен, используя путь DXP, и добавляют нуклеиновую кислоту изопренсинтазы, DXS и/или IDI для повышения продукции изопрена с помощью этого пути. В некоторых вариантах реализации, клетка-хозяин по природе продуцирует изопрен, используя путь MVA. и добавляют одну или более нуклеиновых кислот изопренсинтазы и/или пути MVA для повышения продукции изопрена с помощью этого пути. В некоторых вариантах реализации, клетка-хозяин по природе продуцирует изопрен, используя путь DXP, и добавляют одну или более нуклеиновых кислот для MVA-пути для продукции изопрена с помощью части или всего MVA-пути, а также пути DXP. В некоторых вариантах реализации, клетка-хозяин по природе продуцирует изопрен, используя оба пути DXP и MVA, и добавляют одну или более нуклеиновых кислот для изопренсинтазы, DXS, IDI или MVA-пути для повышения продукции изопрена с помощью одного или обоих из данных путей.
[0384] В некоторых вариантах реализации, клетка-хозяин по природе продуцирует изопрен с помощью обоих путей DXP и MVA, и добавляют одну или более нуклеиновых кислот для изопренсинтазы, DXS, IDI или MVA-пути для повышения продукции изопрена с помощью одного или обоих из данных путей, добавляют одну или более нуклеиновых кислот гидрогеназы для повышения продукции водорода и инактивируют или удаляют гены, экспрессирующие один или более побочных продуктов ферментации, для ограничения образования побочных продуктов ферментации. В некоторых вариантах реализации, клетка-хозяин в природе продуцирует как изопрен, так и водород с помощью обоих путей DXP и MVA, и добавляют одну или более нуклеиновых кислот изопренсинтазы, DXS, IDI или пути MVA для повышения продукции изопрена с помощью одного или обоих из данных путей, добавляют одну или более нуклеиновых кислот гидрогеназы для повышения продукции водорода, инактивируют или удаляют гены, экспрессирующие один или более побочных продуктов ферментации, для ограничения образования побочных продуктов ферментации, и инактивируют или удаляют один или более генов обратного захвата водорода для повышения продукции водорода. В некоторых вариантах реализации, клетка-хозяин в природе продуцирует как изопрен, так и водород с помощью обоих путей DXP и MVA и гидрогеназы, и добавляют одну или более нуклеиновых кислот изопренсинтазы, DXS, IDI или пути MVA для повышения продукции изопрена с помощью одного или обоих из данных путей, добавляют одну или более нуклеиновых кислот гидрогеназы для повышения продукции водорода, добавляют одну или более нуклеиновых кислот созревания гидрогеназы для повышения продукции водорода, инактивирутот или удаляют гены, экспрессирующие один или более побочных продуктов ферментации, для ограничения образования побочных продуктов ферментации, и инактивируют или удаляют один или более генов обратного захвата водорода для повышения продукции водорода. В некоторых вариантах реализации, клетка-хозяин в природе продуцирует как изопрен, так и водород с помощью обоих путей DXP и MVA, и добавляют одну или более нуклеиновых кислот для изопренсинтазы, DXS, IDI или MVA-пути для повышения продукции изопрена с помощью одного или обоих из данных путей, добавляют одну или более нуклеиновых кислот гидрогеназы для повышения продукции водорода, добавляют одну или более нуклеиновых кислот созревания гидрогеназы для повышения продукции водорода, добавляют, или инактивируют, или удаляют одну или более нуклеиновых кислот транскрипционных факторов для усиления экспрессии гидрогеназы, инактивируют или удаляют гены, экспрессирующие один или более побочных продуктов ферментации, для ограничения образования побочных продуктов ферментации, и инактивируют или удаляют один или более генов обратного захвата водорода для повышения продукции водорода.
Типичные способы трансформации
[0385] Нуклеиновые кислоты для изопренсинтазы, DXS, IDI, MVA-пути, гидрогеназы, фактора созревания и/или транскрипции гидрогеназы или векторы, включающие их, можно ввести в клетку-хозяина (например, клетку растения. грибковую клетку, дрожжевую клетку или бактериальную клетку, описанную в данной заявке), применяя стандартные способы экспрессирования кодированных полип ептидов изопренсинтазы, DXS, IDI, MVA-пути, гидрогеназы, фактора созревания и/или транскрипции гидрогеназы. Введение конструкции ДНК или вектора в клетку-хозяина можно осуществить, применяя такие методики, как трансформация, электропорация, микроинъекция в ядро, трансдукция, трансфекция (например. опосредованная липофекцией или ДЭАЭ-декстрином трансфекция или трансфекция с помощью рекомбинантного фагового вируса), инкубирование с кальцийфосфатным преципитатом ДНК, высокоскоростное бомбардирование покрытыми ДНК микрочастицами и слияние протопластов. Основные методики трансформации известны в данной области (см., например. Current Protocols in Molecular Biology (F. M. Ausubel и др. (ред.) глава 9, 1987; Sambrook и др.. Molecular Cloning: A Laboratory Manual, 2ое изд.. Cold Spring Harbor. 1989; и Campbell и др., Curr. Genet. 16:53-56, 1989, каждый из перечисленных источников настоящим полностью включен посредством ссылки, особенно в отношении способов трансформации). Экспрессия гетерологичного полипептида в Trichoderma описана в патенте США номер 6,022,725; патенте США номер 6.268,328; патенте США номер 7,262,041;WO 2005/001036; Harkki и др., Enzyme Microb. Technol. 13:227-233, 1991; Harkki и др., Bio Technol. 7:596-603, 1989; EP 244,234; EP 215,594; и Nevalainen и др., "The Molecular Biology of Trichoderma and its Application to the Expression of Both Homologous and Heterologous Genes", в Molecular Industrial Mycology, ред. Leong и Berka, Marcel Dekker Inc., NY, стр.129 - 148, 1992, каждый из перечисленных документов настоящим полностью включен посредством ссылки, особенно в отношении способов трансформации и экспрессии). Описание трансформации штаммов Aspergillus также можно найти в Сао и др., (Sci. 9:991-1001, 2000; EP 238023; и Yelton и др.. Proceedings. Natl. Acad. Sci. USA 81:1470-1474, 1984 (каждый из перечисленных документов настоящим полностью включен посредством ссылки, особенно в отношении способов трансформации). Введенные нуклеиновые кислоты могут быть интегрированы в хромосомную ДНК или могут поддерживаться как внехромосомные реплицирующиеся последовательности.
[0386] Для селекции трансформантов можно применять любой способ, известный в данной области. В одном неограничивающем примере, стабильные трансформанты, включающие маркер amdS, отличаются от нестабильных трансформантов быстрым ростом и образованием округлых колоний со скорее гладким, чем рваным, контуром на твердой культуральной среде, содержащей ацетамид. Дополнительно, в некоторых случаях проводили дополнительную проверку стабильности путем выращивания трансформантов на твердой неселективной среде (например, среде, в которой отсутствует ацетамид), сбора спор из этой культуральной среды и определения процента этих спор, которые впоследствии прорастают и растут на селективной среде, содержащей ацетамид.
[0387] В некоторых вариантах реализации, грибковые клетки трансформируют с помощью процесса, включающего образование протопластов и трансформирование полученных протопластов, а затем восстановление клеточной стенки известным способом. В одном особом варианте реализации, подготовка Trichoderma sp, к трансформации включает получение протопластов из грибкового мицелия (см. Campbell и др., Curr. Genet. 16:53-56, 1989, который полностью включен посредством ссылки, особенно в отношении способов трансформации). В некоторых вариантах реализации, мицелии получают из пророщенных вегетативных спор. Мицелии обрабатывают ферментом, который расщепляет клеточную стенку, что приводит к получению протопластов. Полученные протопласты затем защищают с помощью осмотического стабилизатора в суспендирующей среде. Такие стабилизаторы включают сорбит, маннит, хлорид калия, сульфат магния и тому подобные. Как правило, концентрация данных стабилизаторов изменяется в диапазоне от 0,8 М до 1,2 М. Желательно использовать приблизительно 1,2 М раствор сорбита в суспендирующей среде.
[0388] Внедрение ДНК в штамм-хозяин Trichoderma sp.зависит от концентрации ионов кальция. Как правило, в растворе для внедрения содержится приблизительно от 10 мМ CaCl2 до 50 мМ CaCl2. Вдобавок к ионам кальция, в растворе для внедрения, как правило, присутствуют другие соединения, такие как буферная система, например, буфер ТЕ (10 мМ Tris, рН 7.4; 1 мМ EDTA) или 10 мМ буфер MOPS, pH 6,0 (морфолинпропансульфоновая кислота), и полиэтиленгликоль (PEG). Без привязки к какой-либо конкретной теории, полагают, что полиэтиленгликоль способствует слиянию клеточных мембран, таким образом позволяя содержимому среды попасть в цитоплазму штамма Trichoderma sp.и плазмидной ДНК перенестись в ядро. При таком слиянии часто множество копий плазмидной ДНК оказываются интегрированными в хромосому хозяина.
[0389] Обычно, для трансформирования используют суспензию, содержащую протопласты или клетки Trichoderma sp., которые были подвергнуты обработке для обеспечения проницаемости, при плотности от 105 до 107/мл (например, 2×106/мл). Данные протопласты или клетки в объеме 100 мкл в подходящем растворе (например, 1,2 М сорбите и 50 мМ CaCl2) смешивают с желательной ДНК. Как правило, в раствор для внедрения добавляют высокую концентрацию PEG. В суспензию протопластов можно добавить от 0,1 до 1 объема 25% PEG 4000. В некоторых вариантах реализации, в суспензию протопластов добавляют приблизительно 0,25 объема PEG 4000. В раствор для внедрения также можно добавить вспомогательные вещества, такие как диметилсульфоксид, гепарин, спермидин, хлорид калия и тому подобные, и способствовать, тем самым, трансформации. Аналогичные процедуры доступны для других грибковых клеток-хозяев (см., например, патенты США под номерами 6,022,725 и 6,268,328, каждый из перечисленных документов настоящим полностью включен посредством ссылки, особенно в отношении способов трансформации).
[0390] Как правило, полученную смесь затем культивируют при приблизительно 0°С на протяжении от 10 до 30 минут.Затем добавляют в смесь дополнительное количетсво PEG, чтобы дополнительно повысить внедрение желательной последовательности нуклеиновых кислот.Как правило, добавляют 25% PEG 4000 в объемах от 5 до 15 раз превышающих объем смеси для трансформации; тем не менее, могут оказаться подходящими большие и меньшие объемы. Желательно, чтобы 25% PEG 4000 приблизительно в 10 раз превышал объем смеси для трансформации. После того, как добавили PEG, смесь для трансформации культивируют либо при комнатной температуре, либо на льду, перед добавлением сорбита и раствора CaCl2. Суспензию протопластов затем дополнительно добавляют в жидкие аликвоты ростовой среды. Если в ростовой среде происходит селекция роста (например, добавлен ацетамид или антибиотик), в ней могут расти только трансформанты.
[0391] Трансформирование бактериальных клеток можно осуществить с помощью обычных способов, например, которые описаны у Sambrook и др.. Molecular Cloning: A Laboratory Manual, Cold Spring Harbor, 1982, которая настоящим полностью включена посредством ссылки, особенно в отношении способов трансформации.
Типичные среды для культивирования клеток
[0392] Также в данной заявке описана клетка или популяция клеток в культуре, которая продуцирует одновременно изопрен и водород. Под "клетками в культуре" понимают две или более клеток в растворе (например, в ростовой среде), который позволяет клеткам перетерпевать одно или более клеточных делений. "Клетки в культуре" не включают клетки растений, которые являются частью живого, многоклеточного растения, содержащего клетки, которые дифференцировались в ткани растения, В различных вариантах реализации, культура клеток содержит по меньшей мере или приблизительно 10, 20, 50, 100, 200, 500, 1000, 5000, 10000 или более клеток.
[0393] Под "клетками в культуре с ограниченным содержанием кислорода" понимают две или более клеток в растворе (например, в ростовой среде), который позволяет клеткам перетерпевать одно или более клеточных делений, при этом указанный раствор содержит ограниченное количество кислорода. Термин "культура с ограниченным содержанием кислорода" означает, что указанная культура либо бескислородна, либо содержит меньшее количество кислорода, чем необходимо для поддержания дыхания путем биологического переноса восстанавливающих эквивалентов на кислород, также в объем термина входят анаэробные культуры. При условиях культивирования с ограничением содержания кислорода, некоторые электроны, возникшие в результате метаболизма углерода, не могут быть приняты, так как концентрации кислорода слишком низки, что заставляет клетки переключиться на продукцию водорода, если они содержат подходящие для этого метаболические пути.
Условия культивирования с ограничением содержания кислорода возникают, когдаскорость переноса кислорода ("OTR") меньше, чем скорость поглощения кислорода ("OUR"), о чем свидетельствует близкие к нулю концентрации растворенного кислорода в культуральной среде.
[0394] Для культивирования клеток-хозяев можно использовать любой источник углерода. Термин "источник углерода" относится к одному или нескольким соединениям, содержащим углерод и способным метаболизироваться клеткой-хозяином или организмом. Например, среда, используемая для культивирования клеток-хозяев, может содержать любой источник углерода, подходящий для поддержания жизнеспособности или выращивания клеток-хозяев.
[0395] В некоторых вариантах реализации, источник углерода представляет собой углевод (такой как моносахарид, дисахарид, олигосахарид или полисахариды), инвертированный сахар (например, ферментативно обработанный сироп сахарозы), глицерол, глицерин (например, глицерин как побочный продукт процесса получения биодизеля или мыловарения), дигидроксиацетон, одноуглеродный источник углерода, масло (например, растительное или овощное масло, такое как кукурузное, пальмовое или соевое масло), животный жир, животное масло, жирная кислота (например, насыщенная жирная кислота, ненасыщенная жирная кислота или полиненасыщенная жирная кислота), липид, фосфолипид, глицеролипид, моноглицерид, диглицерид, триглицерид, полипептид (например, белок или пептид микроорганизма или растения), возобновляемый источник углерода (например, биомасса в качестве источника углерода, например, гидролизованная биомасса в качестве источника углерода), дрожжевой экстракт, компонент из дрожжевого экстракта, полимер, кислота, спирт, альдегид, кетон, аминокислота, сукцинат, лактат, ацетат, этанол или любая комбинация двух или более из перечисленных источников углерода, В некоторых вариантах реализации, источник углерода представляет собой продукт фотосинтеза, включая, но не ограничиваясь глюкозой.
[0396] Типичные моносахариды включают глюкозу и фруктозу; типичные олигосахариды включают лактозу и сахарозу и типичные полисахариды включают крахмал и целлюлозу. Типичные углеводы включают С6-сахара (например, фруктозу, маннозу, галактозу или глюкозу) и С5-сахара (например, ксилозу или арабинозу). В некоторых вариантах реализации, культуральная среда содержит углевод, а также источник углерода, отличный от углевода (например, глицерол, глицерин, дигидроксиацетон, одноуглеродный источник углерода, масло, животный жир, животное масло, жирную кислоту, липид, фосфолипид, глицеролипид, моноглицерид, диглицерид, триглицерид, возобновляемый источник углерода или компонент из дрожжевого экстракта). В некоторых вариантах реализации, культуральная среда содержит углевод, а также полипептид (например, белок или пептид микроорганизма или растения). В некоторых вариантах реализации, микробный полипептид представляет собой полипептид из дрожжей или бактерий. В некоторых вариантах реализации, полипептид растения представляет собой полипептид из сои, кукурузы, канолы, ятрофы, пальмы, арахиса, подсолнуха, кокосового ореха, горчицы, семени рапса, хлопка, ядра кокосового ореха, оливы, сафлора, кунжута или льняного семени.
[0397] В некоторых вариантах реализации, концентрация углевода составляет по меньшей мере или приблизительно 5 грамм на литр бульона (г/л, при этом объем бульона включает как объем культуральной среды, так и объем клеток), например, составляет по меньшей мере или приблизительно 10, 15, 20, 30, 40, 50, 60, 80, 100, 150, 200, 300,400 или более г/л. В некоторых вариантах реализации, концентрация углевода находится в диапазоне между приблизительно 50 и приблизительно 400 г/л, например, в диапазоне между приблизительно 100 и приблизительно 360 г/л, между приблизительно 120 и приблизительно 360 г/л или между приблизительно 200 и приблизительно 300 г/л. В некоторых вариантах реализации, данная концентрация углевода включает общее количество углевода, которое добавлялют перед культивированием клеток-хозяев и/или в процессе культивирования.
[0398] В некоторых вариантах реализации, клетки культивируют в условиях с ограничением количества глюкозы. Под "условиями с ограничением количества глюкозы" понимают, что количество глюкозы, которое добавляют, меньше или приблизительно составляет 105% (например, приблизительно равно 100%) от количества глюкозы, которое потребляется клетками. В особых вариантах реализации, количество глюкозы, которое добавляют в культуральную среду, приблизительно равно количеству глюкозы, которое потребляется клетками в определенный период времени. В некоторых вариантах реализации, скорость роста клеток контролируют путем ограничения количества добавляемой глюкозы таким образом, что клетки растут с такой скоростью, которая может поддерживаться данным количеством глюкозы в клеточной среде. В некоторых вариантах реализации, глюкоза не накапливается в процессе культивирования клеток. В различных вариантах реализации, клетки культивируют при условиях с ограничением количества глюкозы в течение приблизительно 1, 2, 3, 5, 10, 15, 20, 25, 30, 35, 40, 50, 60 или 70 часов или более. В различных вариантах реализации, клетки культивируют в условиях с ограничением количества глюкозы в течение приблизительно 5, 10, 15, 20, 25, 30, 35, 40, 50, 60, 70, 80, 90, 95 или 100% или большего времени культивирования клеток. Без привязки к какой-либо конкретной теории, полагают, что условия с ограничением количества глюкозы могут обеспечить более удобную регуляцию клеток.
[0399] В некоторых вариантах реализации, клетки культивируют в присутствии избытка глюкозы. В особых вариантах реализации, количество добавляемой глюкозы составляет более чем приблизительно 105% (например, приблизительно или больше, чем 110, 120, 150, 175, 200, 250, 300, 400 или 500%) или более от количества глюкозы, которое потребляется клетками в определенный период времени. В некоторых вариантах реализации, глюкоза накапливается в процессе культивирования клеток.
[0400] Типичные липиды представляют собой вещества, включающие одну или более жирных кислот, которые представляют собой жирные кислоты С4 и выше, которые являются насыщенными, ненасыщенными или разветвленными.
[0401] Типичные масла представляют собой липиды, которые являются жидкими при комнатной температуре. В некоторых вариантах реализации, липид включает одну или более жирных кислот С4 и выше (например, включает одну или более насыщенных, ненасыщенных или разветвленных жирных кислот с четырьмя или более атомами углерода). В некоторых вариантах реализации, масло получают из сои, кукурузы, канолы, ятрофы, пальмы, арахиса, подсолнуха, кокосового ореха, горчицы, семени рапса, хлопка, ядра кокосового ореха, оливы, сафлора, кунжута, льняного семени, масляных микробных клеток, китайского сального дерева или из любой комбинации двух или более из перечисленных источников.
[0402] Типичные жирные кислоты включают соединения формулы RCOOH, где "R" представляет собой углеводород. Типичные ненасыщенные жирные кислоты включают соединения, где "R" содержит по меньшей мере одну углерод-углеродную двойную связь. Типичные ненасыщенные жирные кислоты включают, но не ограничены перечисленными, олеиновую кислоту, вакценовую кислоту, линоленовую кислоту, пальмитолеиновую кислоту и арахидоновую кислоту. Типичные полиненасыщенные жирные кислоты включают соединения, где "R" содержит множество углерод-углеродных двойных связей. Типичные насыщенные жирные кислоты включают соединения, где "R" представляет собой насыщенную алифатическую группу. В некоторых вариантах реализации, источник углерода включает одну или более жирных кислот C12-C22, таких как насыщенная жирная кислота C12, насыщенная жирная кислота C14, насыщенная жирная кислота C16, насыщенная жирная кислота C18, насыщенная жирная кислота С20 или насыщенная жирная кислота С22. В типичном варианте реализации, жирная кислота представляет собой пальмитиновую кислоту. В некоторых вариантах реализации, источник углерода представляет собой соль жирной кислоты (например, ненасыщенной жирной кислоты), производное жирной кислоты (например, ненасыщенной жирной кислоты) или соль производного жирной кислоты (например, ненасыщенной жирной кислоты). Подходящие соли включают, но не ограничены перечисленными, соли лития, соли калия, соли натрия и тому подобные соли. Ди- и триглицериды представляют собой сложные эфиры жирных кислот глицерина.
[0403] В некоторых вариантах реализации, концентрация липида, масла, жира, жирной кислоты, моноглицерида, диглицерида или триглицерида составляет по меньшей мере или приблизительно 1 грамм на литр бульона (г/л, при этом объем бульона включает как объем культуральной среды, так и объем клеток), например, составляет по меньшей мере или приблизительно 5, 10, 15, 20, 30, 40, 50, 60, 80, 100, 150, 200, 300, 400 или более г/л. В некоторых вариантах реализации, концентрация липида, масла, жира, жирной кислоты, моноглицерида, диглицерида или триглицерида находится в диапазоне между приблизительно 10 и приблизительно 400 г/л, например, в диапазоне между приблизительно 25 и приблизительно 300 г/л, между приблизительно 60 и приблизительно 180 г/л или между приблизительно 75 и приблизительно 150 г/л. В некоторых вариантах реализации, концентрация включает общее количество липида, масла, жира, жирной кислоты, моноглицерида, диглицерида или триглицерида, которое добавляют перед и/или во время культивирования клеток-хозяев. В некоторых вариантах реализации, источник углерода включает как (i) липид, масло, жир, жирную кислоту, моноглицерид, диглицерид или триглицерид, так и (ii) углевод, такой как глюкоза. В некоторых вариантах реализации, соотношение липида, масла, жира, жирной кислоты, моноглицерида, диглицерида или триглицерида к углеводу составляет приблизительно 1:1 в единицах углерода (т.е., один углерод в липиде, масле, жире, жирной кислоте, моноглицериде, диглицериде или триглицериде на углерод углевода). В особых вариантах реализации, количество липида, масла, жира, жирной кислоты, моноглицерида, диглицерида или триглицерида находится в диапазоне между приблизительно 60 и 180 г/л. а количество углевода находится в диапазоне между приблизительно 120 и 360 г/л.
[0404] Типичные микробные полипептидные источники углерода включают один или более полипептидов из дрожжей или бактерий. Типичные растительные полипептидные источники углерода включают один или более полипептидов из сои, кукурузы, канолы, ятрофы, пальмы, арахиса, подсолнуха, кокосового ореха, горчицы, семени рапса, хлопка, ядра кокосового ореха, оливы, сафлора, кунжута или льняного семени.
[0405] Типичные возобновляемые источники углерода включают пермеат подсырной сыворотки, жидкий кукурузный экстракт, мелассу сахарной свеклы, ячменный солод и компоненты любых из перечисленных источников углерода. Типичные возобновляемые источники углерода также включают глюкозу, гексозу, пентозу и ксилозу, присутствующие в биомассе, такой как кукуруза, просо прутьевидное, сахарный тростник, клеточные отходы процессов ферментации и белковый побочный продукт перемалывания сои, кукурузы или пшеницы. В некоторых вариантах реализации, биомасса в качестве источника углерода представляет собой лигноцеллюлозный, гемицеллюлозный или целлюлозный материал, такой как, но не ограниченный перечисленными, злаковая трава, пшеница, пшеничная солома, багасса, тростниково-сахарная багасса, целлюлозная масса мягкой древесины, кукуруза, сердцевина или обвертка кукурузного початка, зерна кукурузы, волокно из зерен кукурузы, кукурузная солома, просо прутьевидное, продукт из рисовых отрубей или побочный продукт влажного или сухого перемалывания зерновых культур (например, кукурузы, сорго, ржи, тритикале, ячменя, пшеницы и/или спиртовых зерновых культур). Типичные целлюлозные материалы включают дерево, бумагу и отходы целлюлозной массы, травянистые растения и плодовую мякоть. В некоторых вариантах реализации, источник углерода включает любую часть растения, такую как стебли, зерна, корни или клубни. В некоторых вариантах реализации, в качестве источника углерода используют часть любого из следующих растений или все растение: кукуруза, пшеница, рожь, сорго, тритикале, рис, просо, ячмень, кассава, бобовые растения, такие как бобы и горох, картофель, сладкий картофель, бананы, сахарный тростник и/или маниока. В некоторых вариантах реализации, источник углерода представляет собой гидролизат биомассы, такой как гидролизат биомассы, который включает как ксилозу, так и глюкозу, или который включает как сахарозу, так и глюкозу.
[0406] В некоторых вариантах реализации, возобновляемый источник углерода (такой как биомасса) предварительно обрабатывают перед добавлением в культуральную среду. В некоторых вариантах реализации, предварительная обработка включает ферментативную предварительную обработку, химическую предварительную обработку или комбинацию ферментативной и химической предварительной обработки (см., 100 например, Farzaneh и др., Bioresource Technology 96 (18): 2014-2018. 2005; патент США номер 6,176,176; патент США номер 6,106,888; каждый из перечисленных документов настоящим полностью включен посредством ссылки, особенно в отношении предварительной обработки возобновляемых источников углерода). В некоторых вариантах реализации, возобновляемый источник углерода частично или полностью гидролизуют перед добавлением в культуральную среду.
[0407] В некоторых вариантах реализации, возобновляемый источник углерода (такой как кукурузная солома) перед добавлением в культуральную среду подвергают процессу предварительного разрушения целлюлозы аммиаком (AFEX) (см., например, Farzaneh и др., Bioresource Technology 96 (18); 2014-2018, 2005). Во время предварительной обработки AFEX, возобновляемый источник углерода обрабатывают жидким безводным аммиаком при комнатной температуре (такой как от приблизительно 60 до приблизительно 100°С) и высоком давлении (таком как от приблизительно 250 до приблизительно 300 фунтов/кв-дюйм) в течение приблизительно 5 минут. Затем, давление быстро снимают. При этом процессе, комбинированные химические и физические эффекты солюбилизации лигнина, гидролиза гемицеллюлозы, декристаллизации целлюлозы и увеличения площади поверхности позволяют практически полное ферментативное превращение целлюлозы и гемицеллюлозы в сбраживаемые сахара. Предварительная обработка AFEX обеспечивает преимущество, состоящее в том, что практически весь аммиак можно регенерировать и использовать повторно, тогда как оставшийся аммиак служит источником азота для микроорганизмов в последующих процессах. Также, для предварительной обработки AFEX не обязателен промывочный поток. Таким образом, получение сухого вещества после обработки AFEX по существу составляет 100%. AFEX по существу представляет собой обработку от сухого к сухому. Обработанный возобновляемый источник углерода стабилен в течение длительного времени, и его можно подавать в большом количестве загружаемого твердого вещества в процессах ферментативного гидролиза или ферментации. Целлюлоза и гемицеллюлоза хорошо сохраняются в процессе AFEX, лишь с небольшой деградацией или без деградации. Нет необходимости в нейтрализации перед ферментативным гидролизом возобновляемого источника углерода, который подвергли предварительной обработке AFEX. Ферментативный гидролиз обработанных AFEX источников углерода позволяет получить чистые фракции сахара для последующего применения для ферментации.
[0408] В некоторых вариантах реализации, концентрация источника углерода (например, возобновляемого источника углерода) эквивалентна по меньшей мере или приблизительно 0,1, 0,5, 1, 1,5 2, 3, 4, 5, 10, 15, 20, 30, 40 или 50% глюкозы (в отношении массы к объему). Эквивалентное количество глюкозы можно определить путем применения стандартных способов ВЭЖХ с глюкозой в качестве эталона для измерения количества глюкозы, полученного из источника углерода. В некоторых вариантах реализации, концентрация источника углерода (например, возобновляемого источника углерода) эквивалентна от приблизительно 0,1 и до приблизительно 20% глюкозы, например, находится в диапазоне от приблизительно 0,1 и до приблизительно 10% глюкозы, от приблизительно 0,5 и до приблизительно 10% глюкозы, от приблизительно 1 и до приблизительно 10% глюкозы, от приблизительно 1 и до приблизительно 5% глюкозы или от приблизительно 1 и до приблизительно 2% глюкозы.
[0409] В некоторых вариантах реализации, источник углерода включает дрожжевой экстракт или один или более компонентов дрожжевого экстракта. В некоторых вариантах реализации, концентрация дрожжевого экстракта составляет по меньшей мере 1 грамм дрожжевого экстракта на литр бульона (г/л, при этом объем бульона включает как объем культуральной среды, так и объем клеток), например, по меньшей мере или приблизительно 5, 10, 15, 20, 30, 40, 50, 60, 80, 100, 150, 200, 300 или более г/л. В некоторых вариантах реализации, концентрация дрожжевого экстракта находится в диапазоне от приблизительно 1 и до приблизительно 300 г/л, например, в диапазоне от приблизительно 1 и до приблизительно 200 г/л, от приблизительно 5 и до приблизительно 200 г/л, от приблизительно 5 и до приблизительно 100 г/л или от приблизительно 5 и до приблизительно 60 г/л. В некоторых вариантах реализации, концентрация включает общее количество дрожжевого экстракта, которое добавляют перед и/или во время культивирования клеток-хозяев. В некоторых вариантах реализации, источник углерода включает как дрожжевой экстракт (или один или более его компонентов), так и другой источник углерода, такой как глюкоза. В некоторых вариантах реализации, соотношение дрожжевого экстракта и другого источника углерода составляет приблизительно 1:5, приблизительно 1:10 или приблизительно 1:20(масс./масс.).
[0410] Дополнительно, источником углерода также могут быть одноуглеродные субстраты, такие как диоксид углерода или метанол. Продукция глицерина из одноуглеродных источников углерода (например, метанола, формальдегида или формиата) была описана для метилотрофных дрожжей (Yamada и др., Agric. Biol. Chem., 53(2) 541-543, 1989, которая настоящим полностью включена посредством ссылки, особенно в отношении источников углерода) и для бактерий (Hunter и др., Biochemistry, 24, 4148-4155, 1985, которая настоящим полностью включена посредством ссылки, особенно в отношении источников углерода). Данные организмы могут ассимилировать одноуглеродные соединения, отличающиеся по степеням окисления от метана до формиата, и продуцировать глицерин. Путь ассимиляции углерода может проходить через рибулозомонофосфат, через серии или через ксилулозомонофосфат (Gottschalk, Bacterial Metabolism, второе издание, Springer- Verlag: Нью-Йорк, 1986, которая настоящим полностью включена посредством ссылки, особенно в отношении источников углерода). Рибулозомонофосфатный путь включает конденсацию формиата с рибулоза-5-фосфатом с получением шестиуглеродного сахара, который превращается во фруктозу и, в конечном счете, в три углеродных продукта глицеральдегид-3-фосфата. Аналогичным образом, сериновый путь ассимилирует одноуглеродное соединение в гликолитический путь посредством метилентерагидрофолата.
[0411] Также известно, что вдобавок к одно- и двухуглеродным субстратам метилотрофные организмы утилизируют для метаболической активности множество других углеродсодержащих соединений, таких как метиламин, глюкозамин и целый ряд аминокислот. Например, известно, что метилотрофные дрожжи утилизируют углерод из метиламина и продуцируют трегалозу или глицерин (Bellion и др., Microb. Growth Cl Compd., [Международный симпозиум], 7ое изд., 415-32. Редакторы: Murrell и др., Издательство: Intercept, Эндовер, Великобритания, 1993, которая настоящим полностью включена посредством ссылки, особенно в отношении источников углерода). Аналогично, различные виды Candida метаболизируют аланин или олеиновую кислоту (Sulter и др.. Arch. Microbiol. 153(5). 485-9, 1990, которая настоящим полностью включена посредством ссылки, особенно в отношении источников углерода).
[0412] В некоторых вариантах реализации, клетки культивируют в стандартной среде, содержащей физиологические соли и питательные вещества (см., например, Pourquie, J. и др.. Biochemistry and Genetics of Cellulose Degradation, ред. Aubert и др.. Academic Press, стр.71-86, 1988 и Ilmen и др., Appl. Environ. Microbiol. 63:1298-1306, 1997, каждый из перечисленных документов настоящим полностью включен посредством ссылки, особенно в отношении культуральных сред). Типичные ростовые среды обычно представляют собой полученные промышленным путем среды, такие как бульон Луриа-Бертани (LB), бульон Сабуро с декстрозой (SD) или бульон Дрожжевая среда (YM). Также можно применять другие обнаруженные или синтетические ростовые среды, и подходящая среда для роста конкретных клеток-хозяев известна специалисту в области микробиологии или в области ферментации.
[0413] Вдобавок к подходящим источникам углерода, культуральная среда желательно содержит подходящие минеральные вещества, соли, кофакторы, буферы и другие компоненты, известные специалистам в данной области, подходящие для роста культур или повышения продукции изопрена (см., например, WO 2004/033646 и источники, цитированные в данном документе, и WO 96/35796 и источники, цитированные в данном документе, каждый из которых настоящим полностью включен посредством ссылки, особенно в отношении культуральных сред и условий культивирования клеток). В некоторых вариантах реализации, в которых нуклеиновая кислота для изопренсинтазы, DXS, IDI и/или MVA-пути находится под контролем индуцируемого промотора, индуцирующий агент (например, сахар, соль металла или антимикробное средство) желательно добавляют в среду в концентрации, эффективной для индукции экспрессии полипептида изопренсинтазы, DXS, IDI и/или MVA-пути. В некоторых вариантах реализации, культуральная среда содержит антибиотик (такой как канамицин), который соответствует нуклеиновой кислоте, придающей устойчивость к этому антибиотику (такой как нуклеиновая кислота устойчивости к канамицину), на векторе, который включает одну или более нуклеиновых кислот для DXS, IDI или MVA-пути.
Типичные условия культивирования клеток [0414] Материалы и способы, подходящие для поддержания и роста бактериальных культур, хорошо известны в данной области. Типичные методики можно найти в Manual of Methods for General Bacteriology, Gerhardt и др., ред., American Society for Microbiology, Вашингтон, округ Колумбия (1994), или у Brock в Biotechnology: A Textbook of Industrial Microbiology, второе издание (1989), Sinauer Associates, Inc., Сандерленд, Массачусетс, каждый из перечисленных документов настоящим полностью включен посредством ссылки, особенно в отношении методик культивирования клеток. В некоторых вариантах реализации, клетки культивируют в культуральной среде при условиях, позволяющих экспрессию одного или нескольких полипептидов изопренсинтазы, DXS, IDI или MVA-пути, кодируемых нуклеиновой кислотой, введенной в клетки-хозяева.
[0415] Для культивирования клеток можно применять стандартные условия культивирования (см., например, WO 2004/033646 и источники, цитированные в данном документе, каждый из которых настоящим полностью включен посредством ссылки, особенно в отношении культивирования клеток и условий ферментации). Клетки растят и поддерживают при подходящей температуре, газовой смеси и рН (например, при температуре от приблизительно 20°С до приблизительно 37°С, при содержании СО2 от приблизительно 6% до приблизительно 84% и при рН от приблизительно 5 до приблизительно 9). В некоторых вариантах реализации, клетки растят при 35°С в подходящей культуральной среде. В некоторых вариантах реализации, например, культуры культивируют при приблизительно 28°С в подходящей среде при перемешивании или в ферментаторах до достижения желательного количества совместной продукции изопрена и водорода. В некоторых вариантах реализации, диапазоны рН для ферментации составляют от приблизительно рН 5,0 до приблизительно рН 9,0 (например, от приблизительно рН 6,0 до приблизительно рН 8,0 или от приблизительно 6,5 до приблизительно 7,0). Реакции можно осуществить при аэробных, бескислородных или анаэробных условиях, в зависимости от потребностей клеток-хозяев. В некоторых вариантах реализации, клетки культивируют при условиях с ограниченным содержанием кислорода. В некоторых вариантах реализации, клетки культивируют в присутствии кислорода при условиях, при которых на моль продуцированного изопрена поглощается 0,5 моль кислорода. В некоторых вариантах реализации, клетки культивируют при анаэробных условиях. Типичные условия культивирования для данного мицелиального гриба известны в данной области, и их можно найти в научной литературе и/или в источнике грибов, таком как Американская коллекция типовых культур и Грибной центр по хранению генетического материала.
[0416] В различных вариантах реализации, клетки растят с помощью любого известного способа ферментации, такого как периодический, непрерывный процесс или ферментация с подпиткой. В некоторых вариантах реализации, применяют периодический способ ферментации. Классическая периодическая ферментация представляет собой замкнутую систему, в которой составы сред определяют в начале ферментации и не подвергают искусственному изменению во время ферментации.
Таким образом, в начале ферментации культуральную среду инокулирутот желательными клетками-хозяевами и позволяют происходить ферментации, ничего не добавляя в систему. Обычно, тем не менее, "периодическая" ферментация является периодической по отношению к добавлению источника углерода, и часто предпринимают попытки контролировать такие факторы, как рН и концентрация кислорода. В периодических системах, состав метаболитов и биомассы в системе постоянно изменяется до того момента, когда ферментацию останавливают. В периодических культурах, клетки переходят через статистическую латентную фазу в фазу быстрого логарифмического роста и, наконец, в стационарную фазу, в которой скорость роста уменьшается или рост останавливается. В некоторых вариантах реализации, клетки в логарифмической фазе отвечают за основную массу полученного изопрена. В некоторых вариантах реализации, клетки в стационарной фазе продуцируют изопрен.
[0417] В некоторых вариантах реализации, применяют вариант стандартной периодической системы, такой как периодическая система с подпиткой. Процессы периодического культивирования с подпиткой включают обычную периодическую систему, за исключением того, что источник углерода добавляют частями в процессе ферментации. Периодические системы с подпиткой полезны, когда катаболитная репрессия способна ингибировать метаболизм клеток и когда желательно присутствие ограниченных количеств источника углерода в клеточной среде. Периодические ферментации с подпиткой можно вести с ограниченным или избыточным количеством источника углерода (например, глюкозы). Измерение фактической концентрации источника углерода в периодических системах с подпиткой затруднено и, следовательно, оценивается на основании изменений поддающихся измерению факторов, таких как рН, растворенный кислород и парциальное давление отходящих газов, таких как СОз. Периодические ферментации и периодические ферментации с подпиткой типичны и хорошо известны в данной области, и их примеры можно найти у Brock, Biotechnology: A Textbook of Industrial Microbiology, второе издание (1989), Sinauer Associates, Inc., которая настоящим полностью включена посредством ссылки, особенно в отношении культивирования клеток и условий ферментации,
[0418] В некоторых вариантах реализации, применяют способы непрерывной ферментации. Непрерывная ферментация представляет собой открытую систему, в которой определенную ферментационную среду непрерывно добавляют в биореактор и равное количество кондиционированной среды одновременно удаляют для обработки.
При непрерывной ферментации, как правило, культуры поддерживают при постоянной высокой плотности, при которой клетки преимущественно находятся в логарифмической фазе роста.
[0419] Непрерывная ферментация позволяет модуляцию одного фактора или любого количества факторов, которые влияют на рост клеток или продукцию изопрена. Например, в одном способе поддерживают ограничение питательного вещества, такого как источник углерода, или фиксированный уровень азота, и позволяют всем другим параметрам уменьшаться. В других системах, множество факторов, влияющих на рост, можно непрерывно изменять при поддержании постоянной концентрации клеток (например, концентрацию измеряют по мутности среды). Непрерывные системы предназначены для поддержания условий стационарного роста. Таким образом, потеря клеток вследствие отведения среды уравновешена скоростью роста клеток при ферментации. Способы модуляции нутриентов и факторов роста для процессов непрерывной ферментации, а также методики максимизирования скорости образования продукта хорошо известны в области промышленной микробиологии, и целый ряд способов подробно описан у Brock, Biotechnology: A Textbook of Industrial Microbiology, второе издание (1989), Sinauer Associates, Inc., которая настоящим полностью включена посредством ссылки, особенно в отношении культивирования клеток и условий ферментации.
[0420] В некоторых вариантах реализации, клетки иммобилизуют на субстрате в виде цельноклеточных катализаторов и подвергают условиям ферментации для получения изопрена.
[0421] В некоторых вариантах реализации, бутыли с жидкой культурой помещают в шейкеры, чтобы ввести кислород в жидкость и поддерживать однородность культуры. В некоторых вариантах реализации, используют инкубатор для контролирования температуры, влажности, скорости встряхивания и/или других условий, в которых растят культуру. Простейшие инкубаторы представляют собой теплоизолированные ящики с регулируемым нагревательным элементом, обычно нагревающим до ~65°С.Более сложные инкубаторы также могут обладать способностью снижать температуру (путем охлаждения), или способностью контролировать уровни влажности или СО2. Большинство инкубаторов включают таймер; некоторые также можно программировать для осуществления циклов с различными температурами, уровнями влажности и т.д. Инкубаторы могут быть разного размера: от настольных до устройств размером с небольшую комнату.
[0422] При желании, часть или всю культуральную среду можно заменить, чтобы добавить нутриенты и/или избежать накопления потенциально вредных побочных метаболических продуктов и мертвых клеток. В случае суспензионных культур, клетки можно отделить от среды путем центрифугирования или фильтрования суспензионной культуры, а затем ресуспендирования клеток в свежей среде. В случае адгерентных культур, среду можно удалить непосредственно путем аспирации и заменить. В некоторых вариантах реализации, культуральная среда позволяет по меньшей мере части клеток делиться по меньшей мере или приблизительно 5, 10, 20, 40, 50, 60, 65 или более раз в непрерывной культуре (такой как непрерывная культура без разведения).
[0423] В некоторых вариантах реализации, используют конститутивный или индуцибельный промотор (такой как промотор Тгс) и не добавляют соединение (такое как IPTG), чтобы индуцировать экспрессию нуклеиновой кислоты (кислот) изопренсинтазы, DXS, IDI или пути MVA, функционально связанной с промотором. В некоторых вариантах реализации, добавляют соединение (такое как IPTG), чтобы индуцировать экспрессию нуклеиновой кислоты (кислот) изопренсинтазы, DXS, IDI или MVA-пути, функционально связанной с промотором.
Типичные способы отделения процессе продукции изопрена от процесса роста клеток
[0424] Желательно, чтобы углерод из исходного сырья превращался в изопрен, а не использовался для роста и обеспечения клеток. В некоторых вариантах реализации, клетки растят до низкой или умеренной ОП600, тогда начинается или повышается продукция изопрена. Эта стратегия позволяет большой части углерода превратиться в изопрен.
[0425] В некоторых вариантах реализации, клетки достигают такой оптической плотности, при которой они больше не делятся или делятся очень медленно, но продолжают продуцировать изопрен в течение нескольких часов (например, приблизительно 2, 4, 6, 8, 10, 15, 20, 25, 30 или более часов). Например, на Фигурах 60А-67С проиллюстрировано, что клетки могут продолжать продуцировать значительное количество мевалоновой кислоты или изопрена после того, как клетки достигли такой оптической плотности, при которой они больше не делятся или делятся очень медленно. В некоторых случаях, оптическая плотность на 550 нм уменьшается с течением времени (например, уменьшение оптической плотности после того, как клетки перестали находиться в экспоненциальной фазе роста вследствие лизиса клеток), и клетки продолжают продуцировать значительное количество мевалоновой кислоты или изопрена. В некоторых вариантах реализации, оптическая плотность клеток на 550 нм повышается на приблизительно 50% или меньше (например, на меньше или приблизительно 40, 30, 20, 10, 5 или 0%) на протяжении некоторого периода времени (например, на протяжении приблизительно 5, 10, 15, 20, 25, 30, 40, 50 или 60, или более часов), и клетки продуцируют изопрен в количестве, большем или приблизительно равном 1, 10, 25, 50, 100, 150, 200, 250, 300, 400, 500, 600, 700, 800, 900, 1000, 1250, 1500, 1750, 2000, 2500, 3000, 4000, 5000 или более нмоль изопрена/грамм клеток для сырой массы клеток/час (нмоль/гсмк/ч) на протяжении этого периода времени. В некоторых вариантах реализации, количество изопрена находится в диапазоне от приблизительно 2 до приблизительно 5000 нмоль/гсмк/ч, например, в диапазоне от приблизительно 2 до приблизительно 100 нмоль/гсмк/ч, от приблизительно 100 до приблизительно 500 нмоль/гсмк/ч, от приблизительно 150 до приблизительно 500 нмоль/гсмк/ч, от приблизительно 500 до приблизительно 1000 нмоль/гсмк/ч, от приблизительно 1000 до приблизительно 2000 нмоль/гсмк/ч или от приблизительно 2000 до приблизительно 5000 нмоль/гсмк/ч. В некоторых вариантах реализации, количество изопрена находится в диапазоне от приблизительно 20 до приблизительно 5000 нмоль/гсмк/ч, от приблизительно 100 до приблизительно 5000 нмоль/гсмк/ч, от приблизительно 200 до приблизительно 2000 нмоль/гсмк/ч, от приблизительно 200 до приблизительно 1000 нмоль/гсмк/ч, от приблизительно 300 до приблизительно 1000 нмоль/гсмк/ч или от приблизительно 400 до приблизительно 1000 нмоль/гсмк/ч.
[0426] В некоторых вариантах реализации, оптическая плотность клеток на 550 нм повышается на приблизительно 50% или меньше (например, на меньше или приблизительно 40, 30, 20, 10, 5 или 0%) на протяжении некоторого периода времени (например, на протяжении приблизительно 5,10,15,20, 25, 30, 40, 50 или 60, или более часов), и клетки продуцируют кумулятивный титр (общее количество) изопрена в размере, большем или приблизительно равном 1,10, 25, 50, 100, 150, 200, 250, 300,400, 500, 600, 700, 800, 900, 1000, 1250, 1500, 1750, 2000, 2500, 3000, 4000, 5000, 10000, 50000, 100000 или более мг изопрена/л бульона (мг/лбульона. при этом объем бульона включает объем клеток и культуральной среды) на протяжении этого периода времени. В некоторых вариантах реализации, количество изопрена находится в диапазоне от приблизительно 2 до приблизительно 5000 мг/лбульона, например, в диапазоне от приблизительно 2 до приблизительно 100 мг/лбульона. от приблизительно 100 до приблизительно 500 мг/лбульона. от" приблизительно 500 до приблизительно 1000 мг/лбульона, от Приблизительно 1000 до Приблизительно 2000 мг/лбульона ИЛИ от приблизительно 2000 до приблизительно 5000 мг/лбульона. В некоторых вариантах реализации, количество изопрена находится в диапазоне от приблизительно 20 до приблизительно 5000 мг/лбульона, от приблизительно 100 до приблизительно 5000 мг/лбульона. от Приблизительно 200 до Приблизительно 2000 мг/лбульона. от приблизительно 200 до приблизительно 1000 мг/лбульона, от приблизительно 300 до приблизительно 1000 мг/лбульона или от приблизительно 400 до приблизительно 1000 мг/лбульона.
[0427] В некоторых вариантах реализации, оптическая плотность клеток на 550 нм повышается на приблизительно 50% или меньше (например, на меньше или приблизительно 40, 30, 20, 10, 5 или 0%) на протяжении некоторого периода времени (например, на протяжении приблизительно 5,10,15, 20,25, 30,40, 50 или 60, или более часов), и клетки превращают больше или приблизительно 0,0015, 0,002, 0,005, 0,01, 0,02, 0,05, 0,1, 0,12, 0,14, 0,16, 0,2, 0,3, 0,4. 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,2, 1,4, 1,6, 1,8, 2,0, 2,5, 3,0, 3,5, 4,0, 5,0, 6,0, 7,0 или 8,0% углерода в культуральной среде в изопрен на протяжении этого периода времени. В некоторых вариантах реализации, процент превращения углерода в изопрен находится в интервале от приблизительно 0,002 до приблизительно 4.0%, от приблизительно 0,002 до приблизительно 3,0%. от приблизительно 0,002 до приблизительно 2,0%, от приблизительно 0,002 до приблизительно 1,6%, от приблизительно 0,002 до приблизительно 0,005%, от приблизительно 0,005 до приблизительно 0,01%, от приблизительно 0,01 до приблизительно 0,05%, от приблизительно 0,05 до приблизительно 0,15%, от приблизительно 0,15 до приблизительно 0,2%, от приблизительно 0,2 до приблизительно 0,3%, от приблизительно 0,3 до приблизительно 0,5%, от приблизительно 0,5 до приблизительно 0,8%, от приблизительно 0,8 до приблизительно 1,0% или от приблизительно 1,0 до приблизительно 1,6%. В некоторых вариантах реализации, процент превращения углерода в изопрен находится в диапазоне от приблизительно 0,002 до приблизительно 0,4%, от приблизительно 0,002 до приблизительно 0,16%, от приблизительно 0,04 до приблизительно 0,16%. от приблизительно 0,005 до приблизительно 0,3%, от приблизительно 0,01 до приблизительно 0,3% или от приблизительно 0,05 до приблизительно 0,3%.
[0428] В некоторых вариантах реализации, изопрен продуцируется только в стационарной фазе. В некоторых вариантах реализации, изопрен продуцируется как в фазе роста, так и в стационарной фазе, В различных вариантах реализации, количество продуцированного изопрена (например, общее количество продуцированного изопрена или количество изопрена, продуцированного на литр бульона в час на ОП600) во время стационарной фазы приблизительно в 2, 3, 4, 5, 10, 20, 30, 40, 50 или более раз превышает количество изопрена, продуцированного во время фазы роста на протяжении того же периода времени. В различных вариантах реализации, приблизительно 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 95, 99% или больше общего количества продуцированного изопрена (например, изопрена, полученного в процессе ферментации в течение некоторого периода времени, такого как 20 часов) получают, когда клетки находятся в стационарной фазе. В различных вариантах реализации, приблизительно 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 95, 99% или больше общего количества продуцированного изопрена (например, изопрена, полученного в процессе ферментации в течение некоторого периода времени, такого как 20 часов) получают, когда клетки делятся медленно или вообще не делятся, таким образом, что оптическая плотность клеток на 550 нм повышается на приблизительно 50% или меньше (например, на приблизительно 40, 30, 20, 10, 5 или 0% или меньше). В некоторых вариантах реализации, изопрен продуцируется только в фазе роста.
[0429] В некоторых вариантах реализации, одну или более нуклеиновых кислот пути MVA, IDI, DXP или изопренсинтазы помещают под контроль промотора или фактора, который более активен в стационарной фазе, чем в фазе роста. Например, одну или более нуклеиновых кислот пути MVA, IDI, DXP или изопренсинтазы можно поместить под контроль сигма-фактора стационарной фазы, такого как RpoS. В некоторых вариантах реализации, одну или более нуклеиновых кислот пути MVA, IDI, DXP или изопренсинтазы помещают под контроль промотора, индуцируемого в стационарной фазе, такого как промотор, индуцируемый регулятором ответа, активным в стационарной фазе.
Получение изопрена в рамках безопасных диапазонов
[0430] Получение изопрена в рамках безопасных уровней в соответствии с его свойствами воспламеняемости упрощает проектирование и конструирование торговых предприятий, чрезвычайно улучшает возможность безопасной работы и ограничивает возможность возникновения пожара. В частности, оптимальные диапазоны получения изопрена находятся в безопасной зоне, т.е., в диапазоне невоспламеняющихся концентраций изопрена. В одном таком аспекте, в данной заявке описан способ получения изопрена в диапазоне невоспламеняющихся концентраций изопрена (вне зоны воспламеняемости изопрена),
[0431] Таким образом, применяли компьютерное моделирование и экспериментальное исследование, чтобы определить пределы воспламеняемости изопрена (например, для изопрена в присутствии O2, N2, CO2 или любой комбинации двух или более из перечисленных газов), чтобы убедиться в безопасности процесса. Зона воспламеняемости описывается нижним пределом воспламеняемости (LFL). верхним пределом воспламеняемости (UFL), лимитирующей концентрацией кислорода (LOC) и лимитирующей температурой. Для воспламеняемости системы, минимальное количество топлива (такого как изопрен) должно находиться в присутствии минимального количества окислителя, как правило, кислорода. LFL представляет собой минимальное количество изопрена, которое должно присутствовать для поддержания горения, тогда как UFL представляет собой максимальное количество изопрена, которое может присутствовать. Выше этого предела, смесь представляет собой богатую горючую смесь, и фракция кислорода в ней слишком мала, чтобы смесь была воспламеняющейся. LOC указывает на минимальную фракцию кислорода, которая также должна присутствовать, чтобы смесь была воспламеняющейся. Лимитирующая температура определяется точкой воспламенения изопрена и представляет собой такую наименьшую температуру, при которой горение изопрена может распространяться. Данные пределы зависят от концентрации изопрена, типа и концентрации окислителя, инертных компонентов, присутствующих в системе, температуры и давления в системе. Композиции, которые находятся в пределах зоны воспламеняемости, распространяют воспламенение и требуют дополнительных мер предосторожности как при разработке, так и при работе с оборудованием для данного процесса.
[0432] Следующие условия проверили с помощью компьютерного моделирования, математического анализа и экспериментального исследования. При желании, можно проверить другие условия (такие как другая температура, давление и постоянный газовый состав), применяя способы, описанные в данной заявке, чтобы определить концентрации LFL, UFL и LOC.
(1) Компьютерное моделирование и математический анализ
Набор тестов 1:
изопрен: 0% масс.-14% масс.
O2: 6% масс.- 21% масс.
N2: 79% масс.- 94% масс.
Набор тестов 2:
изопрен: 0% масс.-14% масс.
О2: 6% масс.- 21% масс.
N2: 79% масс.- 94% масс.
Насыщен Н2O
Набор тестов 3:
изопрен: 0% масс.-14% масс.
O2: 6% масс.- 21% масс.
N2: 79% масс.- 94% масс.
СО2: 5% масс.- 30% масс.
(2) Экспериментальное исследование для окончательного определения пределов воспламеняемости
Набор тестов 1:
изопрен: 0% масс.-14% масс.
O2: 6% масс.- 21% масс.
N2: 79% масс.- 94% масс.
Набор тестов 2:
изопрен: 0% масс.-14% масс.
O2: 5% масс.- 21% масс.
N2: 79% масс.- 94% масс.
Насыщен Н2O
[0433] Моделирующее программное обеспечение применяли для получения оценки свойств воспламеняемости системы для нескольких различных условий тестирования. СО2 не проявил существенного влияния на пределы воспламеняемости системы. Наборы тестов 1 и 2 подтвердили с помощью экспериментального исследования. Результаты моделирования согласовывались с результатами экспериментального исследования. Лишь небольшие изменения обнаружили при добавлении воды.
[0434] Определили, что LOC составляла 9,5% об. смеси изопрена, O2, N; и СО2 при 40°С и 1 атмосфере. Добавление СО2 до 30% существенно не влияло на свойства воспламеняемости смеси изопрена, О2 и N2. Лишь небольшие изменения в свойствах воспламеняемости были показаны между сухой и водонасыщенной системой изопрена, О2 и N2. Лимитирующая температура составляла приблизительно -54°С.Температуры ниже приблизительно -54°С были слишком низкими для распространения горения изопрена.
[0435] В некоторых вариантах реализации, LFL изопрена находится в диапазоне от приблизительно 1,5% об. до приблизительно 2,0% об„ и UFL изопрена находится в диапазоне от приблизительно 2,0% об. до приблизительно 12,0% об., в зависимости от количества кислорода в системе. В некоторых вариантах реализации, LOC составляет приблизительно 9,5% об. кислорода. В некоторых вариантах реализации, LFL изопрена находится в диапазоне от приблизительно 1,5% об. до приблизительно 2,0% об., UFL изопрена находится в диапазоне от приблизительно 2,0% об. до приблизительно 12,0% об. и LOC составляет приблизительно 9,5% об. кислорода, когда температура находится в диапазоне от приблизительно 25°С до приблизительно 55°С (например, приблизительно равна 40°С) и давление находится в диапазоне между приблизительно 1 атмосферой и 3 атмосферами.
[0436] В некоторых вариантах реализации, изопрен получают в присутствии менее чем приблизительно 9,5% об. кислорода (то есть, ниже LOC, необходимой для получения воспламеняющейся смеси изопрена). В некоторых вариантах реализации, в которых изопрен получают в присутствии приблизительно 9,5% об. кислорода или больше, концентрация изопрена ниже LFL (например, ниже приблизительно 1,5% об.). Например, количество изопрена можно держать ниже LFL путем разбавления композиции изопрена инертным газом (например, путем непрерывного или периодического добавления инертного газа, такого как азот, чтобы держать количество изопрена в композиции ниже LFL). В некоторых вариантах реализации, в которых изопрен получают в присутствии приблизительно 9,5% об. кислорода или больше, концентрация изопрена выше UFL (например, выше приблизительно 12% об.). Например, количество изопрена можно поддерживать выше UFL путем применения системы (такой как любая из систем культур клеток, описанных в данной заявке), котрая продуцирует изопрен в концентрации выше UFL. При желании, можно использовать относительно низкий уровень кислорода, чтобы UFL также был относительно низким. В данном случае, необходима более низкая концентрация изопрена, чтобы оставаться выше UFL.
[0437] В некоторых вариантах реализации, в которых изопрен получают в присутствии приблизительно 9,5% об. кислорода или больше, концентрация изопрена находится в рамках зоны воспламеняемости (например, между LFL и UFL). В некоторых вариантах реализации, когда концентрация изопрена может находиться в рамках зоны воспламеняемости, осуществляют один или более этапов, чтобы снизить вероятность воспламенения или взрыва. Например, можно избежать одного или нескольких источников зажигания (таких как любые материалы, которые могут вырабатывать искру). В некоторых вариантах реализации, осуществляют один или более этапов, чтобы уменьшить количество времени, на протяжении которого концентрация изопрена остается в рамках зоны воспламеняемости. В некоторых вариантах реализации, применяют датчик, чтобы обнаружить, когда концентрация изопрена приближается или находится в рамках зоны воспламеняемости. При желании. концентрацию изопрена можно измерить в один или более моментов времени в процессе культивирования клеток, и условия культивирования клеток и/или количество инертного газа можно отрегулировать, применяя стандартные способы, если концентрация изопрена приближается или находится в рамках зоны воспламеняемости. В особых вариантах реализации, условия культивирования клеток (такие как условия ферментации) корректируют, чтобы либо уменьшить концентрацию изопрена до уровня ниже LFL, либо увеличить концентрацию изопрена до уровня выше UFL. В некоторых вариантах реализации, количество изопрена поддерживают на уровне ниже LFL путем разбавления композиции изопрена инертным газом (например, путем непрерывного или периодического добавления инертного газа, чтобы поддерживать композицию изопрена на уровне ниже LFL).
[0438] В некоторых вариантах реализации, количество воспламеняющихся летучих компонентов, отличных от изопрена (таких как один или более Сахаров), по меньшей мере приблизительно в 2, 5, 10, 50, 75 или 100 раз меньше, чем количество продуцированного изопрена. В некоторых вариантах реализации, часть газообразной фазы, отличная от газообразного изопрена, включает от приблизительно 0% до приблизительно 100% (по объему) кислорода, например, включает кислород в диапазоне от приблизительно 0% до приблизительно 10%. от приблизительно 10% до приблизительно 20%, от приблизительно 20% до приблизительно 30%, от приблизительно 30% до приблизительно 40%, от приблизительно 40% до приблизительно 50%, от приблизительно 50% до приблизительно 60%, от приблизительно 60% до приблизительно 70%, от приблизительно 70% до приблизительно 80%, от приблизительно 90% до приблизительно 90% или от приблизительно 90% до приблизительно 100% (по объему). В некоторых вариантах реализации, часть газообразной фазы, отличная от газообразного изопрена, включает от приблизительно 0% до приблизительно 99% (по объему) азота, например, включает азот в диапазоне от приблизительно 0% до приблизительно 10%, от приблизительно 10% до приблизительно 20%, от приблизительно 20% до приблизительно 30%, от приблизительно 30% до приблизительно 40%, от приблизительно 40% до приблизительно 50%, от приблизительно 50% до приблизительно 60%, от приблизительно 60% до приблизительно 70%, от приблизительно 70% до приблизительно 80%, от приблизительно 90% до приблизительно 90% или от приблизительно 90% до приблизительно 99% (по объему).
[0439] В некоторых вариантах реализации, часть газовой фазы, отличная от газообразного изопрена, включает от приблизительно 1% до приблизительно 50% (по объему) СО2, например, включает СО2 в диапазоне от приблизительно 1% до приблизительно 10%, от приблизительно 10% до приблизительно 20%, от приблизительно 20% до приблизительно 30%, от приблизительно 30% до приблизительно 40% или от приблизительно 40% до приблизительно 50% (по объему).
[0440] В некоторых вариантах реализации, композиция изопрена также содержит этанол. Например, этанол можно применять для экстрактивной перегонки изопрена, что приводит к получению композиций (таких как фракции промежуточного продукта), которые содержат как этанол, так и изопрен. Желательно, чтобы количество этанола находилось вне зоны воспламеняемости этанола. LOC этанола составляет приблизительно 8,7% по объему, и LFL этанола составляет приблизительно 3,3% по объему при стандартных условиях, таких как приблизительно 1 атмосфера и приблизительно 60°F (NFPA 69 Standard on Explosion Prevention Systems, издание 2008 г., которое настоящим полностью включено посредством ссылки, особенно в отношении значений LOC, LFL и UFL). В некоторых вариантах реализации, композиции, которые содержат изопрен и этанол, получали в присутствии меньшей концентрации, чем LOC, необходимая для образования воспламеняющейся смеси этанола (например, менее чем приблизительно 8,7% по объему). В некоторых вариантах реализации, в которых композиции, которые содержат изопрен и этанол, получали в присутствии большей или приблизительно равной LOC концентрации, необходимой для образования воспламеняющейся смеси этанола, концентрация этанола была ниже LFL (например, меньше, чем приблизительно 3,3% по объему).
[0441] В различных вариантах реализации, количество окислителя (такого как кислород) было ниже LOC любого топлива в системе (такого как изопрен или этанол). В различных вариантах реализации, количество окислителя (такого как кислород) было меньше, чем приблизительно 60,40, 30, 20, 10 или 5% от LOC изопрена или этанола. В различных вариантах реализации, количество окислителя (такого как кислород) было меньше, чем LOC изопрена или этанола на по меньшей мере 2. 4, 5 или более абсолютных процентных точек (% по объему). В особых вариантах реализации, количество кислорода по меньшей мере на 2 абсолютные процентные точки (% по объему) меньше, чем LOC изопрена или этанола (например, концентрация кислорода меньше, чем 7,5% по объему, когда LOC изопрена составляет 9,5% по объему). В различных вариантах реализации, количество топлива (такого как изопрен или этанол) меньше или приблизительно составляет 25, 20, 15, 10 или 5% LFL для данного топлива.
Высокоэффективная продукция и получение изопрена, летучего углеводорода, с помощью ферментации
[0442] В настоящем описании предусмотрены способы получения изопрена, включающие а) культивирование клеток при условиях, подходящих для продукции изопрена; и b) получение изопрена, при котором концентрация изопрена в жидкой фазе меньше, чем приблизительно 200 мг/л. В некоторых вариантах реализации, концентрация изопрена в жидкой фазе в культуре меньше, чем приблизительно любая из перечисленных концентраций: 175 мг/л, 150 мг/л, 125 мг/л, 100 мг/л, 75 мг/л, 50 мг/л, 25 мг/л, 20 мг/л, 15 мг/л, 10 мг/л, 5 мг/л или 2,5 мг/л. В некоторых вариантах реализации, концентрация изопрена в жидкой фазе в культуре находится в диапазоне приблизительно от 0,1 мг/л до 200 мг/л, от 1 мг/л до 200 мг/л. от 1 мг/л до 150 мг/л, от 1 мг/л до 100 мг/л, от 1 мг/л до 50 мг/л, от 1 мг/л до 25 мг/л, от 1 мг/л до 20 мг/л или от 10 мг/л до 20 мг/л. В некоторых вариантах реализации, изопрен получают в любой концентрации или в любом количестве, описанном в разделе под заголовком "Типичное получение изопрена". В некоторых вариантах реализации, концентрация в жидкой фазе ниже предела растворимости изопрена.
[0443] В некоторых вариантах реализации указанных способов, клетки продуцируют более чем приблизительно 400 нмоль изопрена/гсмк/час.В некоторых вариантах реализации, количество изопрена находится в любом из перечисленных далее диапазонов: приблизительно от 400 нмоль/гсмк/час до 1 моль/гсмк/час, от 400 нмоль/гсмк/час до 1 ммоль/гсмк/час, от 400 нмоль/гсмк/час до 40 ммоль/гсмк/час, от 400 нмоль/гсмк/час до 4 ммоль/гсмк/час, от 1 ммоль/гсмк/час до 1,5 ммоль/гсмк/час, от 1,5 ммоль/гсмк/час до 3 ммоль/гсмк/час, от 3 ммоль/гсмк/час до 5 ммоль/гсмк/час, от 5 ммоль/гсмк/час до 25 ммоль/гсмк/час, от 25 ммоль/гсмк/час до 100 ммоль/гсмк/час, от 100 ммоль/гсмк/час до 500 ммоль/гсмк/час или от 500 ммоль/гсмк/час до 1000 ммоль/гсмк/час.В некоторых вариантах реализации, количество изопрена приблизительно составляет 1 ммоль/гсмк/час, 1,5 ммоль/гсмк/час, 2 ммоль/гсмк/час, 3 ммоль/гсмк/час, 4 ммоль/гсмк/час или 5 ммоль/гсмк/час.
[0444] Низкое значение коэффициента Генри (в единицах М·атм-1) означает, что изопрен можно получить из ферментационного бульона путем деаэрирования при низкой скорости барботажа, например, от 0,01 vvm (объем воздуха/объем бульона/минуту) до 2 vvm. В некоторых вариантах реализации, скорость барботажа газа находится в любом из перечисленных далее диапазонов: приблизительно от 0,1 vvm до 1 vvm, от 0,01 vvm до 0,5 vvm, от 0,2 vvm до 1 vvm или от 0,5 vvm до 1 vvm. В некоторых вариантах реализации, скорость барботажа газа приблизительно равна 0,1 vvm, 0,25 vvm, 0,5 vvm, 0,75 vvm, 1 vvm, 1,25 vvm, 1,5 vvm, 1,75 vvm или 2 vvm. В некоторых вариантах реализации, на протяжении всего запуска ферментации, во время фазы роста или во время стационарной фазы поддерживают низкие скорости барботажа. В некоторых вариантах реализации, низкие скорости барботажа поддерживают в течение приблизительно от 1 часа до 5 часов, от 5 часов до 10 часов, от 10 часов до 20 часов, от 20 часов до 30 часов, от 30 часов до 40 часов, от 40 часов до 50 часов или от 50 часов до 60 часов. Более низкий желательный предел барботажа газа определяют по моменту, в который водная фаза становится насыщенной изопреном и образуется жидкая органическая фаза. Это может произойти только ниже точки кипения изопрена (34,1°С при 1 атмосфере), выше которой жидкая фаза изопрена никогда не образуется. При температурах ниже точки кипения изопрена, образование жидкой фазы определяют по растворимости изопрена в воде, которая составляет приблизительно 650 мг/л при 25°С.Хотя весьма желательно избежать образования жидкой фазы изопрена, это не является абсолютно необходимым условием в том случае, если клетки могут переносить присутствие жидкого изопрена без токсического действия на них со стороны последнего.
[0445] В некоторых вариантах реализации, кислород, СО2 и изопрен присутствуют в любых количествах или концентрациях, которые обсуждаются в разделе под заголовком "Получение изопрена в рамках безопасных диапазонов". В некоторых вариантах реализации, весь кислород потребляется клетками при поддержании полностью аэробного метаболизма. В некоторых вариантах реализации, применяют избыток кислорода, чтобы удовлетворить потребность клеток в кислороде. Желательные диапазоны кислорода в выделяющемся газе составляют менее чем 20%, или менее чем 15%, или менее чем 10% (об./об.). Уровни кислорода ниже лимитирующей концентрации кислорода, необходимые для горения изопрена (9,5% об./об. при 1 атмосфере), особенно желательны. В некоторых вариантах реализации, обогащенный кислородом воздух используют для того, чтобы позволить минимальные скорости продувки газом, при этом удовлетворяя потребность клеток в кислороде. В некоторых вариантах реализации, часть газообразной фазы продуваемого газа содержит от приблизительно 0,1% до приблизительно 10%, от приблизительно 10% до приблизительно 20% или от приблизительно 20% до приблизительно 30% (по объему) кислорода. В некоторых вариантах реализации, ферментацию изопрена осуществляют при высоком давлении, чтобы минимизировать количество избыточного кислорода, необходимое для поддержания необходимых уровней растворенного кислорода в жидкой фазе.
[0446] В некоторых вариантах реализации, уменьшение скорости продувки газа через ферментатор предпочтительно для интегрированного процесса получения изопрена, поскольку такие условия обогащают уровни изопрена в выделяющемся газе до приблизительно 30000 мкг/л (приблизительно 1% об./об.) без неблагоприятного влияния на физиологию клеток.
[0447] В некоторых вариантах реализации, пониженные скорости продувки газом не оказывают существенного неблагоприятного влияния на физиологию клеток. В некоторых вариантах реализации, скорость выделения клетками диоксида углерода в культуре с пониженными скоростями продувки газом находится в любом из перечисленных далее диапазонов: от приблизительно 1×10-18 ммоль/л/час до приблизительно 1 моль/л/час, от 1 ммоль/л/час до 1 моль/л/час, от 25 ммоль/л/час до 750 ммоль/л/час, от 25 ммоль/л/час до 75 ммоль/л/час, от 250 ммоль/л/час до 750 ммоль/л/час или от 450 ммоль/л/час до 550 ммоль/л/час. В некоторых вариантах реализации, скорость выделения диоксида углерода приблизительно составляет 50 ммоль/л/час, 100 ммоль/л/час, 150 ммоль/л/час, 200 ммоль/л/час, 250 ммоль/л/час, 300 ммоль/л/час, 350 ммоль/л/час, 400 ммоль/л/час, 450 ммоль/л/час или 500 ммоль/л/час. В некоторых вариантах реализации, жизнеспособность клеток при пониженных скоростях продувки газом уменьшается в менее чем приблизительно 1,75 раза, 1,5 раза, 1,25 раза, 1 раз, 0,75 раза, 0,5 раза или 0,25 раза. В некоторых вариантах реализации, жизнеспособность клеток при пониженных скоростях продувки газом уменьшается приблизительно в 2 раза. В некоторых вариантах реализации, жизнеспособность при пониженных скоростях продувки газом клеток, экспрессирующих РНК и/или белок MVA-пути и/или DXP-пути с одной или нескольких гетерологичных и/или дополнительных копий нуклеиновой кислоты пути MVA и/или пути DXP сравнивают с контрольными клетками, в которых отсутствует одна или более гетерологичных и/или дополнительных копий нуклеиновой кислоты для MVA-пути и/или DXP-пути. при пониженных скоростях продувки газом. В некоторых вариантах реализации, жизнеспособность при пониженных скоростях продувки газом клеток, экспрессирующих РНК и/или белок MVA-пути и/или DXP-пути с одной или нескольких гетерологичных и/или дополнительных копий нуклеиновой кислоты MVA-пути и/или DXP-пути под контролем индуцируемого промотора, при этом указанный промотор индуцирован, сравнивают с контрольными клетками, содержащими одну или более гетерологичных и/или дополнительных копий нуклеиновой кислоты MVA-пути и/или DXP-пути под контролем индуцируемого промотора, при этом указанный промотор не индуцирован (неиндуцированный), при пониженных скоростях продувки газом. В некоторых вариантах реализации, индуцируемый промотор представляет собой промотор бета-галактозидазы.
[0448] В некоторых вариантах реализации, при ферментации генетически модифицированный организм хозяина превращает по меньшей мере 5% общего количества углерода, потребляемого указанным организмом, в летучий ненасыщенный углеводород. В некоторых вариантах реализации, продукция ненасыщенного углеводорода происходит при такой скорости, что он присутствует в выделяющемся в результате ферментации газе на уровне, равном по меньшей мере приблизительно 100 мкг/л, 500 мкг/л. 1000 мкг/л, 2500 мкг/л, 5000 мкг/л, 7500 мкг/л или 10000 мкг/л.
[0449] В некоторых вариантах реализации, ненасыщенный углеводород получают из потока выделяющегося газа таким способом, который подходит для высокой скорости продукции, что соответствует концентрации в выделяющемся газе, равной по меньшей мере приблизительно 100 мкг/л, 500 мкг/л, 1000 мкг/л. 2500 мкг/л, 5000 мкг/л, 7500 мкг/л или 10000 мкг/л. В некоторых вариантах реализации, непрерывное экстрагирование и получение ненасыщенного углеводорода из выделяющегося при ферментации газа, в частности, при низких скоростях продувки газом, происходит таким образом, что полученный в результате этого выделяющийся газ обогащен интересующим летучим компонентом. В некоторых вариантах реализации, получение летучего компонента углеводорода осуществляют с помощью способов, которые зависят от повышенных концентраций летучего компонента. Например, эффективное улавливание изопрена в выделяющемся при ферментации газе осуществляют путем применения технологий сжатия/конденсации или экстрактивной перегонки. Также предполагается применение картриджей с активированным углем вдобавок к силикагелевым адсорбентам, применение десорбции и концентрации изопрена из углеродных картриджей и/или осуществление конструирования и ферментации организма хозяина, такого как штаммы Е. coli, который может превратить приблизительно 5% или более субстрата-глюкозы в изопрен, что приведет к концентрации изопрена в выделяющемся газе, большей чем приблизительно 15000 мкг/л. Способы получения включают любые из способов, описанных в настоящей заявке.
[0450] Также в настоящем описании предусмотрены способы получения соединения, в которых указанное соединение обладает одним или несколькими свойствами, выбранными из группы, состоящей из перечисленных свойств: (а) коэффициент закона Генри составляет менее чем приблизительно 250 моль/атм и (b) растворимость в воде составляет менее чем приблизительно 100 г/л. В некоторых вариантах реализации, указанный способ включает: а) культивирование клеток при условиях, подходящих для получения соединения, при этом газ добавляют (например, газ добавляют в систему, такую как ферментационная система) при скорости барботажа газа, равной от приблизительно 0,01 vvm до приблизительно 2 vvm; и b) получение указанного соединения.
[0451] В некоторых вариантах реализации, количество соединения, которое перерабатывается в клеточную массу, не включено в значения растворимости жидкой фазы. В некоторых вариантах реализации, концентрация в жидкой фазе ниже предела растворимости соединения.
[0452] В некоторых вариантах реализации, можно непрерывно получать соединения из ферментационного бульона путем деаэрирования при скоростях барботажа газа от умеренных до низких скоростей, в частности, такие соединения, которые имеют коэффициенты закона Генри, равные приблизительно менее чем 250 моль/атм, 200 моль/атм, 150 моль/атм, 100 моль/атм, 75 моль/атм, 50 моль/атм, 25 моль/атм, 10 моль/атм, 5 моль/атм или 1 моль/атм. Примеры включают альдегиды, такие как ацетальдегид (15 моль/атм), кетоны, такие как ацетон (30 моль/атм) или 2-бутанон (20 моль/атм), или спирты, включая метанол (220 моль/атм), этанол (200 моль/атм), 1-бутанол (120 моль/атм) или спирты С5, включая 3-метил-3-бутен-1-ол и 3-метил-2-бутен-1-ол (50 - 100 моль/атм). Эфиры спиртов, как правило, имеют более низкие постоянные Генри, чем соответствующие спирты, например, этилацетат (6-9 моль/атм) или ацетиловые эфиры спиртов С5 (<5 моль/атм). Соединения с коэффициентами закона Генри, меньшими чем 1 моль/атм, представляют собой особенно желательные соединения. Примеры включают гемитерпены, монотерпены или сескивитерпены, вдобавок к другим углеводородам, таким как углеводороды с С1 по С5 (например, метан, этан, этилен или пропилен). В некоторых вариантах реализации, углеводороды, такие как углеводороды с С1 по С5, являются насыщенными, ненасыщенными или разветвленными.
[0453] Обычно, существует корреляция между коэффициентом закона Генри и растворимостью в воде, заключающаяся в том, что соединения с очень низкими коэффициентами умеренно растворимы в воде (по существу нерастворимы в воде). Хотя летучие компоненты с бесконечными растворимостями в воде (например, ацетон или этанол) можно удалить путем деаэрирования, желательный предел растворимости составляет менее чем приблизительно 100 г/л, 75 г/л, 50 г/л, 25 г/л, 10 г/л, 5 г/л или 1 г/л.
[0454] В некоторых вариантах реализации любого из способов получения любых соединений, описанных выше, скорость барботажа газа находится в любом из перечисленных далее диапазонов: приблизительно от 0,1 vvm до 1 vvm, от 0,2 vvm до 1 vvm или от 0,5 vvm до 1 vvm. В некоторых вариантах реализации, скорость барботажа газа приблизительно равна 0,1 vvm, 0,25 vvm, 0,5 vvm, 0,75 vvm, 1 vvm, 1,25 vvm, 1,5 vvm, 1,75 vvm или 2 vvm. В некоторых вариантах реализации, низкие скорости барботажа поддерживают на протяжении всего запуска ферментации, во время фазы роста или во время стационарной фазы. В некоторых вариантах реализации, низкие скорости барботажа поддерживают на протяжении приблизительно от 1 часа до 5 часов, от 5 часов до 10 часов, от 10 часов до 20 часов, от 20 часов до 30 часов, от 30 часов до 40 часов, от 40 часов до 50 часов или от 50 часов до 60 часов.
[0455] Любые из систем, описанных в данной заявке, можно применять в способах получения соединения, описанных выше. Для очистки используют стандартные способы, такие как описанные в разделе под заголовком "Типичные способы очистки". Разделение можно осуществить после получения, например, путем перегонки или с помощью методик селективной адсорбции.
Типичное получение биоизопрена
[0456] В некоторых вариантах реализации, клетки культивируют в культуральной среде при условиях, позволяющих продукцию изопрена клетками.
[0457] Под "максимальной абсолютной производительностью" понимают максимальное абсолютное количество изопрена в выделяющемся газе в процессе культивирования клеток в течение определенного периода времени (например, культивирования клеток во время определенного запуска ферментации). Под "моментом времени максимальной абсолютной производительности" понимают момент времени в процессе запуска ферментации, в который абсолютное количество изопрена в выделяющемся газе максимально в процессе культивирования клеток в течение определенного периода времени (например, культивирования клеток во время определенного запуска ферментации). В некоторых вариантах реализации, количество изопрена измеряют в момент времени максимальной абсолютной производительности. В некоторых вариантах реализации, максимальная абсолютная производительность клеток составляет приблизительно любые из количеств изопрена, описанных в настоящей заявке.
[0458] Под "максимальной удельной производительностью" понимают максимальное количество изопрена, продуцированного на клетку, в процессе культивирования клеток в течение определенного периода времени (например, культивирования клеток во время определенного запуска ферментации). Под "моментом времени максимальной удельной производительности" понимают момент времени в процессе культивирования клеток в течение определенного периода времени (например, культивирования клеток во время определенного запуска ферментации), в который количество изопрена, продуцированного на клетку, максимально. Максимальную удельную производительность определяют путем деления общей производительности на количество клеток, которое определяют по оптической плотности на 600 нм (ОП600).
В некоторых вариантах реализации, количество изопрена измеряют в момент времени максимальной удельной производительности. В некоторых вариантах реализации, максимальная удельная производительность клеток составляет приблизительно любые из количеств изопрена на клетку, описанных в настоящей заявке.
[0459] Под "максимальной объемной производительностью" понимают максимальное количество изопрена, продуцированного на объем бульона (включая объем клеток и культуральной среды) в процессе культивирования клеток в течение определенного периода времени (например, культивирования клеток во время определенного запуска ферментации). Под "моментом времени максимальной удельной объемной производительности" понимают момент времени в процессе культивирования клеток в течение определенного периода времени (например, культивирования клеток во время определенного запуска ферментации), в который количество изопрена, продуцированного на объем бульона, максимально. Максимальную удельную объемную производительность определяют путем деления общей производительности на объем бульона и количество времени. В некоторых вариантах реализации, количество изопрена измеряют в момент времени максимальной удельной объемной производительности. В некоторых вариантах реализации, максимальная удельная объемная производительность клеток составляет приблизительно любые из количеств изопрена на объем на время, описанных в настоящей заявке.
[0460] Под "максимальной концентрацией" понимают максимальное количество изопрена, продуцированного в процессе культивирования клеток в течение определенного периода времени (например, культивирования клеток во время определенного запуска ферментации). Под "моментом времени максимальной концентрации" понимают момент времени в процессе культивирования клеток в течение определенного периода времени (например, культивирования клеток во время определенного запуска ферментации), в который количество изопрена, продуцированного на клетку, максимально. В некоторых вариантах реализации, количество изопрена измеряют в момент времени максимальной концентрации. В некоторых вариантах реализации, максимальная концентрация для клеток составляет приблизительно любые из количеств изопрена, описанных в настоящей заявке.
[0461] Под "средней объемной производительностью" понимают среднее количество изопрена, продуцированного на объем бульона (включая объем клеток и культуральной среды) в процессе культивирования клеток в течение определенного периода времени (например, культивирования клеток во время определенного запуска ферментации). Среднюю объемную производительность определяют путем деления общей производительности на объем бульона и количество времени. В некоторых вариантах реализации, средняя удельная объемная производительность клеток составляет приблизительно любые из количеств изопрена на объем на время, описанных в настоящей заявке.
[0462] Под "суммарной общей производительностью" понимают кумулятивное общее количество изопрена, продуцированного в процессе культивирования клеток в течение определенного периода времени (например, культивирования клеток во время определенного запуска ферментации). В некоторых вариантах реализации, измеряют кумулятивное общее количество изопрена. В некоторых вариантах реализации, кумулятивная общая производительность клеток составляет приблизительно любые из количеств изопрена, описанных в настоящей заявке.
[0463] В настоящем описании, "относительный отклик детектора" относится к отношению отклика детектора (такого как площадь ГХ/МС) для одного соединения (такого как изопрен) к отклику детектора (такому как площадь ГХ/МС) для одного или нескольких соединений (таких как все углеводороды С5). Отклик детектора можно измерить, как описано в настоящей заявке, например, анализ ГХ/МС осуществляли на системе Agilent 6890 GC/MS, оборудованной колонкой Agilent HP-5MS GC/MS (30 м × 250 мкм; толщина пленки 0,25 мкм). При желании, относительный отклик детектора можно преобразовать в массовый процент, используя факторы отклика для каждого из соединений. Данный фактор отклика представляет собой меру того, насколько сильный сигнал сгенерировался для данного количества конкретного соединения (то есть, насколько детектор чувствителен к конкретному соединению). Данный фактор отклика можно использовать в качестве коэффициента коррекции для пересчета относительного отклика детектора в массовый процент, когда детектор обладает различной чувствительностью к сравниваемым соединениям. В качестве альтернативы, массовый процент можно апроксимировать предположив, что факторы отклика одинаковы для сравниваемых соединений. Таким образом, можно предполагать, что массовый процент приблизительно такой же, как и относительный отклик детектора.
[0464] В некоторых вариантах реализации, клетки в культуре продуцируют изопрен в количестве, большем или приблизительно равном 1, 10, 25, 50, 100, 150, 200, 250, 300, 400, 500, 600, 700, 800, 900, 1000, 1250, 1500, 1750, 2000, 2500, 3000, 4000, 5000, 10000, 12500, 20000, 30000, 40000, 50000, 75000, 100000, 125000, 150000, 188000 или более нмоль изопрена/грамм клеток для сырой массы клеток/час (нмоль/гсмк/ч). В некоторых вариантах реализации, количество изопрена находится в диапазоне от приблизительно 2 до приблизительно 200000 нмоль/гсмк/ч, например, в диапазоне от приблизительно 2 до приблизительно 100 нмоль/гсмк/ч. от приблизительно 100 до приблизительно 500 нмоль/гсмк/ч, от приблизительно 150 до приблизительно 500 нмоль/гсмк/ч, от приблизительно 500 до приблизительно 1000 нмоль/гсмк/ч, от приблизительно 1000 до приблизительно 2000 нмоль/гсмк/ч или от приблизительно 2000 до приблизительно 5000 нмоль/гсмк/ч, от приблизительно 5000 до приблизительно 10000 нмоль/гсмк/ч, от приблизительно 10000 до приблизительно 50000 нмоль/гсмк/ч, от приблизительно 50000 до приблизительно 100000 нмоль/гсмк/ч, от приблизительно 100000 до приблизительно 150000 нмоль/гсмк/ч или от приблизительно 150000 до приблизительно 200000 нмоль/гсмк/ч. В некоторых вариантах реализации, количество изопрена находится в диапазоне от приблизительно 20 до приблизительно 5000 нмоль/гсмк/ч, от приблизительно 100 до приблизительно 5000 нмоль/гсмк/ч, от приблизительно 200 до приблизительно 2000 нмоль/гсмк/ч, от приблизительно 200 до приблизительно 1000 нмоль/гсмк/ч, от приблизительно 300 до приблизительно 1000 нмоль/гсмк/ч или от приблизительно 400 до приблизительно 1000 нмоль/гсмк/ч, от приблизительно 1000 до приблизительно 5000 нмоль/гсмк/ч, от приблизительно 2000 до приблизительно 20000 нмоль/гсмк/ч, от приблизительно 5000 до приблизительно 50000 нмоль/гсмк/ч, от приблизительно 10000 до приблизительно 100000 нмоль/гсмк/ч, от приблизительно 20000 до приблизительно 150000 нмоль/гсмк/ч или от приблизительно 20000 до приблизительно 200000 нмоль/гсмк/ч.
[0465] Количество изопрена в единицах нмоль/гсмк/ч можно измерить, как описано в патенте США номер 5849970, который настоящим полностью включен посредством ссылки, особенно в отношении измерения продукции изопрена. Например, два мл свободного пространства над поверхностью (например, свободного пространства над поверхностью культуры, такой как культура объемом 2 мл, культивируемая в герметично закрытом сосуде при 32°С при встряхивании на 200 об/мин в течение приблизительно 3 часов) анализируют на содержание изопрена, применяя стандартную систему для газовой хроматографии, такую как система, эксплуатируемая изотермически (85°С), с колонкой н-октан/порасил С (Alltech Associates, Inc., Дирфилд, Иллинойс), и соединенная с газовым детектором восстановления оксида ртути RGD2 (Trace Analytical, Менло Парк, Калифорния) (см., например, Greenberg и дp., Atmos. Environ. 27A: 2689-2692. 1993; Silvern др.. Plant Physiol. 97:1588-1591. 1991, каждый из перечисленных документов настоящим полностью включен посредством ссылки, особенно в отношении измерения продукции изопрена). Единицы площади газовой хроматографии преобразовывают в нмоли изопрена с помощью градуировочной кривой стандартных концентраций изопрена. В некоторых вариантах реализации, значение для грамма клеток для сырой массы клеток рассчитывают путем получения значения А600 для образца культуры клеток, а затем преобразовывают значение А600 в граммы клеток на основании градуировочной кривой сырых масс клеток для культур клеток с известным значением А600. В некоторых вариантах реализации, граммы клеток оценивают, предположив, что один литр бульона (включая культуральную среду и клетки) со значением А600, равным 1, имеет сырую массу клеток, равную 1 грамм. Полученное значение также делят на количество часов, в течение которых культуру инкубировали, например, на три часа.
[0466] В некоторых вариантах реализации, клетки в культуре продуцируют изопрен в количестве, большем или приблизительно равном 1, 10, 25, 50, 100, 150, 200, 250, 300, 400, 500, 600, 700, 800, 900, 1000, 1250, 1500, 1750, 2000, 2500, 3000, 4000, 5000, 10000, 100000 или более нг изопрена/грамм клеток для сырой массы клеток/ч (нг/гсмк/ч). В некоторых вариантах реализации, количество изопрена находится в диапазоне от приблизительно 2 до приблизительно 5000 нг/гсмк/ч, например, в диапазоне от приблизительно 2 до приблизительно 100 нг/гсмк/ч, от приблизительно 100 до приблизительно 500 нг/гсмк/ч, от приблизительно 500 до приблизительно 1000 нг/гсмк/ч, от приблизительно 1000 до приблизительно 2000 нг/гсмк/ч или от приблизительно 2000 до приблизительно 5000 нг/гсмк/ч. В некоторых вариантах реализации, количество изопрена находится в диапазоне от приблизительно 20 до приблизительно 5000 нг/гсмк/ч, от приблизительно 100 до приблизительно 5000 нг/гсмк/ч, от приблизительно 200 до приблизительно 2000 нг/гсмк/ч, от приблизительно 200 до приблизительно 1000 нг/гсмк/ч, от приблизительно 300 до приблизительно 1000 нг/гсмк/ч или от приблизительно 400 до приблизительно 1000 нг/гсмк/ч. Количество изопрена в нг/гсмк/ч можно рассчитать путем умножения значения продукции изопрена в единицах нмоль/гсмк/ч, которое обсуждалось выше, на 68,1 (как описано в Уравнении 5 ниже).
[0467] В некоторых вариантах реализации, клетки в культуре продуцируют кумулятивный титр (общее количество) изопрена в размере, большем или приблизительно равном 1, 10, 25, 50, 100, 150, 200, 250, 300, 400, 500, 600, 700, 800, 900, 1000, 1250, 1500, 1750, 2000, 2500, 3000, 4000, 5000, 10000, 50000, 100000 или более мг изопрена/л бульона (мг/лбульона. при этом объем бульона включает объем клеток и культуральной среды). В некоторых вариантах реализации, количество изопрена находится в диапазоне от приблизительно 2 до приблизительно 5000 мг/лбульона, например, в диапазоне от приблизительно 2 до приблизительно 100 мг/лбульона, от приблизительно 100 до приблизительно 500 мг/лбульона, от приблизительно 500 до приблизительно 1000 мг/лбульона, от приблизительно 1000 до приблизительно 2000 мг/лбульона или от приблизительно 2000 до приблизительно 5000 мг/лбульона. В некоторых вариантах реализации, количество изопрена находится в диапазоне от приблизительно 20 до приблизительно 5000 мг/лбульона. от приблизительно 100 до приблизительно 5000 мг/лбульона, от приблизительно 200 до приблизительно 2000 мг/лбульона, от приблизительно 200 до приблизительно 1000 мг/лбульона, от приблизительно 300 до приблизительно 1000 мг/лбульона или от приблизительно 400 до приблизительно 1000 мг/лбульона-.
[0468] Удельную производительность в отношении изопрена в мг изопрена/л свободного пространства над поверхностью во встряхиваемой колбе, или для аналогичных культур, можно измерить путем отбора 1 мл образца из культуры клеток при значении ОП600, равном приблизительно 1,0, помещения его в 20 мл сосуд, инкубирования в течение 30 минут, а затем измерения количества изопрена в свободном пространстве над поверхностью (как описано, например, в Примере I, часть II). Если значение ОП600 не равно 1,0, тогда измерение можно нормировать до значения ОП600, равного 1,0, путем деления на значение ОП600. Значение мг изопрена/л свободного пространства над поверхностью можно преобразовать в мг/лбульона/ч/ОП600 культурального бульона путем умножения на 38. Указанное значение в единицах мг/лбульона/ч/ОП600 можно умножить на количество часов и значение ОП600, чтобы получить кумулятивный титр в единицах мг изопрена/л бульона.
[0469] В некоторых вариантах реализации, клетки в культуре обладают средней объемной производительностью по изопрену, равной больше или приблизительно 0,1, 1,0, 10, 25, 50, 100, 150, 200, 250, 300, 400, 500, 600, 700, 800, 900, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000, 2100, 2200, 2300, 2400, 2500, 2600, 2700, 2800, 2900, 3000, 3100, 3200, 3300, 3400, 3500 или более мг изопрена/л бульона/ч (мг/лбульона/ч, при этом объем бульона включает объем клеток и культуральной среды). В некоторых вариантах реализации, средняя объемная производительностью по изопрену находится в диапазоне от приблизительно 0,1 до приблизительно 3500 мг/лбульона/ч, например, в диапазоне от приблизительно 0,1 до приблизительно 100 мг/лбульона/ч, от Приблизительно 100 до Приблизительно 500 мг/лбульона/ч, от приблизительно 500 до приблизительно 1000 мг/лбульона/ч, от приблизительно 1000 до приблизительно 1,500 мг/лбульона/ч, от приблизительно 1500 до приблизительно 2000 мг/лбульона/ч, от приблизительно 2000 до приблизительно 2500 мг/лбульона/ч, от приблизительно 2500 до приблизительно 3000 мг/лбульона/ч или от приблизительно 3000 до приблизительно 3500 мг/лбульона/ч. В некоторых вариантах реализации, средняя объемная производительностью по изопрену находится в диапазоне от приблизительно 10 до приблизительно 3500 мг/лбульона/ч, от приблизительно 100 до приблизительно 3500 мг/лбульона/ч, от приблизительно 200 до приблизительно 1000 мг/лбульона/ч, от приблизительно 200 до приблизительно 1500 мг/лбульона/ч, от приблизительно 1000 до приблизительно 3000 мг/лбульона/ч или от приблизительно 1500 до приблизительно 3000 мг/лбульона/ч.
[0470] В некоторых вариантах реализации, клетки в культуре обладают максимальной объемной производительностью по изопрену, равной больше или приблизительно 0,5, 1,0, 10, 25, 50, 100, 150, 200, 250, 300, 400, 500, 600, 700, 800, 900, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, 2000, 2100, 2200, 2300, 2400, 2500, 2600, 2700, 2800, 2900, 3000, 3100, 3200, 3300, 3400, 3500, 3750, 4000, 4250, 4500, 4750, 5000, 5250, 5500, 5750, 6000, 6250, 6500, 6750, 7000, 7250, 7500, 7750, 8000, 8250, 8500, 8750, 9000, 9250, 9500, 9750, 10000, 12500, 15000 или более мг изопрена/л бульона/ч (мг/лбульона/ч, при этом объем бульона включает объем клеток и культуральной среды). В некоторых вариантах реализации, максимальная объемная производительность по изопрену находится в диапазоне от приблизительно 0,5 до приблизительно 15000 мг/лбульона/ч, например, в диапазоне от приблизительно 0,5 до приблизительно 10 мг/лбульона/ч. от приблизительно 1,0 до приблизительно 100 мг/лбульона/ч, от приблизительно 100 до приблизительно 500 мг/лбульона/ч, от приблизительно 500 до приблизительно 1000 мг/лбульона/ч, от приблизительно 1000 до приблизительно 1500 мг/лбульона/ч, от приблизительно 1500 до приблизительно 2000 мг/лбульона/ч, от приблизительно 2000 до приблизительно 2500 мг/лбульона/ч, от приблизительно 2500 до приблизительно 3000 мг/лбульона/ч, от приблизительно 3000 до приблизительно 3500 мг/лбульона/ч, от приблизительно 3500 до приблизительно 5000 мг/лбульона/ч, от приблизительно 5000 до приблизительно 7500 мг/лбульона/ч, от приблизительно 7500 до приблизительно 10000 мг/лбульона/ч, от приблизительно 10000 до приблизительно 12500 мг/лбульона/ч или от приблизительно 12500 до приблизительно 15000 мг/лбульона/ч. В некоторых вариантах реализации, максимальная объемная производительность по изопрену находится в диапазоне от приблизительно 10 до приблизительно 15000 мг/лбульона/ч, от приблизительно 100 до приблизительно 2500 мг/лбульона/ч, от Приблизительно 1000 до Приблизительно 5000 мг/лбульона/ч, от приблизительно 2500 до приблизительно 7500 мг/лбульона/ч, от приблизительно 5000 до приблизительно 10000 мг/лбульона/ч, от приблизительно 7500 до приблизительно 12500 мг/лбульона/ч или от Приблизительно 10000 до Приблизительно 15000 мг/лбульона/ч.
[0471] Мгновенную скорость продукции изопрена в мг/лбульона/ч в ферментаторе можно измерить путем отбора образца выделяющегося в ферментаторе газа, анализирования его на количество изопрена (в таких единицах, как мг изопрена на лгаза). как описано, например, в Примере I, часть II, и умножения этого значения на скорость, с которой выделяющийся газ пропускается через каждый литр бульона (например, при 1 vvm (объем воздуха/объем бульона/минуту) она равна 60 лгаза в час). Таким образом, уровень выделяющегося газа, равный 1 мг/лгаза. соответствует мгновенной скорости продукции 60 мг/лбульона/ч при потоке воздуха, равном 1 vvm. При желании, значение в единицах мг/лбульона/ч можно разделить на значение ОП600 с получением удельной скорости в единицах мг/лбульона/ч/ОП. Среднее значение мг изопрена/лгаза можно преобразовать в общую производительность продукта (граммы изопрена на литр ферментационного бульона, мг/лбульона) путем умножения этой средней концентрации изопрена в выделяющемся газе на общее количество выделяющегося газа, барботированного на литр ферментационного бульона в процессе ферментации. Таким образом, средняя концентрация изопрена в выделяющемся газе, равная 0,5 мг/лбульона/ч в течение 10 часов при 1 vvm, соответствует общей концентрации продукта, равной 300 мг изопрена/лбульона.
[0472] В некоторых вариантах реализации, клетки в культуре превращают больше или приблизительно 0,0015, 0,002, 0,005, 0,01, 0,02, 0,05, 0,1, 0,12, 0,14, 0,16, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,2, 1,4, 1,6, 1,8, 2,0, 2,2, 2,4, 2,6, 3,0, 4,0, 5,0, 6,0, 7,0, 8,0, 9,0, 10,0, 11,0, 12,0, 13,0, 14,0, 15,0, 16,0, 17,0, 18,0, 19,0, 20,0, 21,0, 22,0, 23,0, 23,2, 23,4, 23,6, 23,8, 24,0, 25,0, 30,0, 31,0, 32,0, 33,0, 35,0, 37,5, 40,0, 45,0, 47,5, 50,0, 55,0, 60,0, 65,0, 70,0, 75,0, 80,0, 85,0 или 90,0 молярных % углерода в культуральной среде в изопрен. В некоторых вариантах реализации, процент превращения углерода в изопрен находится в диапазоне от приблизительно 0,002 до приблизительно 90,0 молярных %, например, от приблизительно 0,002 до приблизительно 0,005%, от приблизительно 0,005 до приблизительно 0,01%, от приблизительно 0,01 до приблизительно 0,05%, от приблизительно 0,05 до приблизительно 0,15%, от приблизительно 0,15 до приблизительно 0,2%, от приблизительно 0,2 до приблизительно 0,3%, от приблизительно 0,3 до приблизительно 0,5%, от приблизительно 0,5 до приблизительно 0,8%, от приблизительно 0,8 до приблизительно 1,0%, от приблизительно 1,0 до приблизительно 1,6%, от приблизительно 1,6 до приблизительно 3,0%, от приблизительно 3,0 до приблизительно 5,0%, от приблизительно 5,0 до приблизительно 8,0%, от приблизительно 8,0 до приблизительно 10,0%, от приблизительно 10,0 до приблизительно 15,0%, от приблизительно 15,0 до приблизительно 20,0%, от приблизительно 20,0 до приблизительно 25,0%, от приблизительно 25,0% до приблизительно 30,0%, от приблизительно 30,0% до приблизительно 35,0%, от приблизительно 35,0% до приблизительно 40,0%, от приблизительно 45,0% до приблизительно 50,0%, от приблизительно 50,0% до приблизительно 55,0%, от приблизительно 55,0% до приблизительно 60,0%, от приблизительно 60,0% до приблизительно 65,0%, от приблизительно 65,0% до приблизительно 70,0%, от приблизительно 75,0% до приблизительно 80,0%, от приблизительно 80,0% до приблизительно 85,0% или от приблизительно 85,0% до приблизительно 90,0%. В некоторых вариантах реализации, процент превращения углерода в изопрен находится в диапазоне от приблизительно 0,002 до приблизительно 0,4 молярного %, от приблизительно 0,002 до приблизительно 0,16 молярного %, от приблизительно 0,04 до приблизительно 0,16 молярного %, от приблизительно 0,005 до приблизительно 0,3 молярного %, от приблизительно 0,01 до приблизительно 0,3 молярного %, от приблизительно 0,05 до приблизительно 0,3 молярного %, от приблизительно 0,1 до приблизительно 0,3 молярного %, от приблизительно 0,3 до приблизительно 1,0 молярного %, от приблизительно 1,0 до приблизительно 5,0 молярных %, от приблизительно 2 до приблизительно 5,0 молярных %, от приблизительно 5,0 до приблизительно 10,0 молярных %, от приблизительно 7 до приблизительно 10,0 молярных %, от приблизительно 10,0 до приблизительно 20,0 молярных %, от приблизительно 12 до приблизительно 20,0 молярных %, от приблизительно 16 до приблизительно 20,0 молярных %, от приблизительно 18 до приблизительно 20,0 молярных %, от приблизительно 18 до приблизительно 23,2 молярного %, от приблизительно 18 до приблизительно 23,6 молярного %, от приблизительно 18 до приблизительно 23,8 молярного %, от приблизительно 18 до приблизительно 24,0 молярных %, от приблизительно 18 до приблизительно 25,0 молярных %, от приблизительно 20 до приблизительно 30,0 молярных %, от приблизительно 30 до приблизительно 40,0 молярных %, от приблизительно 30 до приблизительно 50,0 молярных %, от приблизительно 30 до приблизительно 60,0 молярных %, от приблизительно 30 до приблизительно 70,0 молярных %, от приблизительно 30 до приблизительно 80,0 молярных % или от приблизительно 30 до приблизительно 90,0 молярных %.
[0473] Процент превращения углерода в изопрен (также называемый "% выхода углерода") можно измерить путем деления молей углерода в полученном изопрене на моли углерода в источнике углерода (например, моли углерода в дозированной и подаваемой глюкозе и дрожжевом экстракте). Полученное число умножают на 100% с получением процентного значения (как указано в Уравнении 1).
Уравнение 1
% выхода углерода=(моли углерода в продуцированном изопрене)/(моли углерода в источнике углерода) * 100
[0474] Для данного расчета, можно предполагать, что дрожжевой экстракт содержит 50% Macc./масс.углерода. В качестве примера, для 500 литров, описанных в Примере 7, часть VIII, процент превращения углерода в изопрен можно рассчитать, как показано в Уравнении 2.
Уравнение 2
% выхода углерода=(39,1 г изопрена * 1/68,1 моль/г * 5 С/моль)/[(181221 г глюкозы * 1/180 моль/г * 6 С/моль)+(17780 г дрожжевого экстракта * 0,5 * 1/12 моль/г)] * 100=0,042%
[0475] Для двух ферментации в 500 л, описанных в данной заявке (Пример 7, части VII и VIII), процент превращения углерода в изопрен находится между 0,04-0,06%. % выхода углерода, равного 0,11-0,16, достигли, применяя 14-литровые системы, описанные в настоящей заявке. В части V Примера 11 описано превращение 1,53% углерода в изопрен с помощью способов, описанных в данной заявке. [0476] Специалист в данной области сможет легко преобразовать скорости продукции изопрена или количество продуцированного изопрена в любые другие единицы. Типичные уравнения для взаимного преобразования единиц перечислены ниже.
Единицы скорости продукции изопрена (общие и удельные)
Уравнение 3
1 г изопрена/лбульона/ч=14,7 ммоль изопрена/лбульона/ч (общая объемная скорость)
Уравнение 4
1 нмоль изопрена/гсмк/ч=1 нмоль изопрена/лбульона/ч/ОП600 (В данном преобразовании допустили, что один литр бульона со значением ОП600, равным 1, содержит сырую массу клеток, равную 1 грамму).
Уравнение 5
1 нмоль изопрена/гсмк/ч=68,1 нг изопрена/гсмк/ч (с учетом молекулярной массы изопрена)
Уравнение 6
1 нмоль изопрена/лгаза 02/ч=90 нмоль изопрена/лбульона/ч (при скорости потока О2, равной 90 л/ч на л культурального бульона)
Уравнение 7
1 мкг изопрена/лгаза изопрена в выделяющемся газе=60 мкг изопрена/лбульона/ч при скорости потока, равной 60 лгаза на лбульона (1 vvm).
Единицы для титра (общие и удельные)
Уравнение 8
1 нмоль изопрена/мг клеточного белка=150 нмоль изопрена/лбульона/ОП600 (В данном преобразовании допускают, что один литр бульона со значением ОП600, равным 1, содержит общий клеточный белок в количестве приблизительно 150 мг) (удельная производительность).
Уравнение 9
1 г изопрена/лбульона=14,7 ммоль изопрена/лбульона (общий титр)
[0477] При желании, Уравнение 10 можно применять для преобразования любых единиц, которые включают сырую массу клеток, в соответствующие единицы, которые включают сухую массу клеток.
Уравнение 10
Сухая масса клеток=(сырая масса клеток)/3,3
[0478] При необходимости, Уравнение 11 можно применять для взаимного преобразования единиц промилле и мкг/л. В частности, "промилле" означает части на миллион, определенные в единицах мкг/г (масс./масс.). Концентрации газов также можно выразить волюметрически, применяя "ppmv" (части на миллион по объему), определенные в единицах мкл/л (об./об.). Преобразование мкг/л в промилле (например, мкг аналита на г газа) можно осуществить путем определения массы на л выделяющегося газа (т.е., плотности газа). Например, литр воздуха при стандартной температуре и давлении (STP; 101,3 кПа (1 бар) и 273,15К) имеет плотность, равную приблизительно 1,29 г/л. Таким образом, концентрация, равная 1 промилле (мкг/г), равна 1,29 мкг/л при STP (Уравнение 11). Преобразование промилле (мкг/г) в мкг/л представляет собой функцию давления, температуры и полного состава выделяющегося газа.
Уравнение 11
1 промилле (мкг/г) равна 1,29 мкг/л при стандартной температуре и давлении (STP;
101,3 кПа(1 бар)и273,15К).
[0479] Преобразование мкг/л в ppmv (например, мкл аналита на л газа) можно осуществить, применяя Универсальный газовый закон (Уравнение 12). Например, концентрация выделяющегося газа, равная 1000 мкг/лгаза, соответствует 14,7 мкмоль/лгаза. Универсальная газовая постоянная представляет собой 0,082057 л.атм К-1моль-1, таким образом, применяя Уравнение 12 можно определить, что объем, занимаемый 14,7 мкмолями HG при STP, равен 0,329 мл. Следовательно, концентрация 1000 мкг/л HG равна 329 ppmv или 0,0329% (об./об.) при STP. Уравнение 12
[0480] PV=nRT, где "Р" представляет собой давление, "V" представляет собой объем, "n" представляет собой моли газа, "R" представляет собой универсальную газовую постоянную и "Т" представляет собой температуру в градусах Кельвина.
[0481] Количество примесей в композициях изопрена обычно измеряют в настоящем описании в единицах массы к объему (масс./об.), например, в единицах мкг/л. При необходимости, измерения в единицах мкг/л можно преобразовать в единицы мг/м3, применяя Уравнение 13.
Уравнение 13
1 мкг/л=1 мг/м3
[0482] В некоторых вариантах реализации, описанных в данной заявке, клетка, содержащая гетерологичную нуклеиновую кислоту, кодирующую полипептид изопренсинтазы, продуцирует количество изопрена, которое по меньшей мере или приблизительно в 2 раза, 3 раза. 5 раз, 10 раз, 25 раз, 50 раз, 100 раз, 150 раз, 200 раз, 400 раз или в большее количество раз выше, чем количество изопрена, продуцированного соответствующей клеткой, которую растили по существу при таких же условиях без гетерологичной нуклеиновой кислоты, кодирующей полипептид изопренсинтазы.
[0483] В некоторых вариантах реализации, описанных в данной заявке, клетка, содержащая гетерологичную нуклеиновую кислоту, кодирующую полипептид изопренсинтазы, и одну или более гетерологичных нуклеиновых кислот, кодирующих полипептид DXS, BDI и/или MVA-пути, продуцирует количество изопрена, которое по меньшей мере или приблизительно в 2 раза, 3 раза, 5 раз, 10 раз, 25 раз, 50 раз, 100 раз, 150 раз, 200 раз, 400 раз или в большее количество раз выше, чем количество изопрена, продуцированного соответствующей клеткой, которую растили по существу при таких же условиях без гетерологичных нуклеиновых кислот.
[0484] В некоторых вариантах реализации, композиция изопрена содержит больше или приблизительно 99,90, 99,92, 99,94, 99,96, 99,98 или 100% масс.изопрена по отношению к общей массе всех С5-углеводородов в указанной композиции. В некоторых вариантах реализации, композиция вызывает относительный отклик детектора, больший или приблизительно равный 99,90, 99.91. 99,92, 99,93, 99,94, 99,95, 99,96,99,97, 99,98,99,99 или 100% для изопрена, по сравнению с показанием детектора для всех С5-углеводородов в указанной композиции. В некоторых вариантах реализации, композиция изопрена содержит от приблизительно 99,90 до приблизительно 99,92, от приблизительно 99,92 до приблизительно 99.94, от приблизительно 99,94 до приблизительно 99,96, от приблизительно 99,96 до приблизительно 99,98, от приблизительно 99,98 до 100% масс.изопрена по отношению к общей массе всех С5-углеводородов в указанной композиции.
[0485] В некоторых вариантах реализации, композиция изопрена содержит меньше или приблизительно 0,12, 0,10, 0,08, 0,06, 0,04, 0,02. 0,01. 0,005, 0,001, 0,0005, 0,0001. 0,00005 или 0,00001% масс.С5-углеводородов, отличных от изопрена (таких, как 1,3-циклопентадиен, цис-1,3-пентадиен, транс-1,3-пентадиен, 1,4-пентадиен, 1-пентин, 2-пентин, 1-пентен, 2-метил-1-бутен, 3-метил-1-бутин, пент-4-ен-1-ин, транс-пент-3-ен-1-ин или цис-пент-3-ен-1-ин), по отношению к общей массе всех С5-углеводородов в указанной композиции. В некоторых вариантах реализации, композиция вызывает относительный отклик детектора, меньший или приблизительно равный 0,12, 0,10, 0,08, 0,06, 0,04, 0,02, 0,01, 0,005, 0,001, 0,0005, 0,0001, 0,00005 или 0,00001%, для С5-углеводородов, отличных от изопрена, по сравнению с показанием детектора для всех С5-углеводородов в указанной композиции, В некоторых вариантах реализации, композиция вызывает относительный отклик детектора, меньший или приблизительно равный 0,12, 0,10, 0,08, 0,06, 0,04, 0,02, 0,01, 0,005, 0,001, 0,0005, 0,0001, 0,00005 или 0,00001%, для 1,3-циклопентадиена, цис-1,3-пентадиена, транс-1,3-пентадиена, 1,4-пентадиена, 1-пентина, 2-пентина, 1-пентена, 2-метил-1-бутена, 3-метил-1-бутина, пент-4-ен-1-ина, транс-пент-3-ен-1-ина или цис-пент-3-ен-1-ина по сравнению с показанием детектора для всех С5-углеводородов в указанной композиции. В некоторых вариантах реализации, композиция изопрена содержит от приблизительно 0,02 до приблизительно 0,04%, от приблизительно 0,04 до приблизительно 0,06%, от приблизительно от 0,06 до 0,08%, от приблизительно от 0,08 до 0,10% или от приблизительно 0,10 до приблизительно 0,12% масс.С5-углеводородов, отличных от изопрена (таких, как 1,3-циклопентадиен, цис-1,3-пентадиен, транс-1,3-пентадиен, 1,4-пентадиен, 1-пентин, 2-пентин, 1-пентен, 2-метил-1-бутен, 3-метил-1-бутин, пент-4-ен-1-ин, транс-пент-3-ен-1-ин или цис-пент-3-ен-1-ин), по отношению к общей массе всех С5-углеводородов в указанной композиции.
[0486] В некоторых вариантах реализации, композиция изопрена содержит меньше или приблизительно 50, 40, 30, 20, 10, 5, 1, 0,5, 0,1, 0,05, 0,01 или 0,005 мкг/л соединения, которое ингибирует полимеризацию изопрена, для любого соединения в указанной композиции, которое ингибирует полимеризацию изопрена. В некоторых вариантах реализации, композиция изопрена содержит от приблизительно 0,005 до приблизительно 50, например, от приблизительно 0,01 до приблизительно 10, от приблизительно 0,01 до приблизительно 5, от приблизительно 0,01 до приблизительно 1, от приблизительно 0,01 до приблизительно 0,5 или от приблизительно 0,01 до приблизительно 0,005 мкг/л соединения, которое ингибирует полимеризацию изопрена, для любого соединения в указанной композиции, которое ингибирует полимеризацию изопрена. В некоторых вариантах реализации, композиция изопрена содержит меньше или приблизительно 50, 40, 30, 20, 10, 5, 1, 0,5, 0,1, 0,05, 0,01 или 0,005 мкг/л углеводорода, отличного от изопрена (такого, как 1,3-циклопентадиен, цис-1,3-пентадиен, транс-1,3-пентадиен, 1,4-пентадиен, 1-пентин, 2-пентин, 1-пентен, 2-метил-1-бутен, 3-метил-1-бутин, пент-4-ен-1-ин, транс-пент-3-ен-1-ин или цис-пент-3-ен-1-ин). В некоторых вариантах реализации, композиция изопрена содержит от приблизительно 0,005 до приблизительно 50, например, от приблизительно 0,01 до приблизительно 10, от приблизительно 0,01 до приблизительно 5, от приблизительно 0,01 до приблизительно 1, от приблизительно 0,01 до приблизительно 0,5 или от приблизительно 0,01 до приблизительно 0,005 мкг/л углеводорода, отличного от изопрена. В некоторых вариантах реализации, композиция изопрена содержит меньше или приблизительно 50, 40, 30, 20, 10, 5, 1, 0,5, 0,1, 0,05, 0,01 или 0,005 мкг/л белка или жирной кислоты (таких как белок или жирная кислота, которые в природе связаны с природным каучуком).
[0487] В некоторых вариантах реализации, композиция изопрена содержит меньше или приблизительно 10, 5, 1, 0,8, 0,5, 0,1, 0,05, 0,01 или 0,005 промилле альфа-ацетиленов, пипериленов, ацетонитрила или 1,3-циклопентадиена. В некоторых вариантах реализации, композиция изопрена содержит меньше или приблизительно 5, 1, 0,5, 0,1, 0,05, 0,01 или 0,005 промилле серы или алленов. В некоторых вариантах реализации, композиция изопрена содержит меньше или приблизительно 30, 20,15, 10, 5, 1, 0,5, 0,1, 0,05, 0,01 или 0,005 промилле всех ацетиленов (таких, как 1-пентин, 2-пентин, 3-метил-1-бутин, пент-4-ен-1-ин, транс-пент-3-ен-1-ин и цис-пент-3-ен-1-ин). В некоторых вариантах реализации, композиция изопрена содержит меньше или приблизительно 2000, 1000, 500, 200, 100, 50, 40, 30, 20, 10, 5, 1, 0,5, 0,1, 0,05, 0,01 или 0,005 промилле димеров изопрена, таких как циклические димеры изопрена (например, циклические соединения С 10, полученные в результате димеризации двух единиц изопрена).
[0488] В некоторых вариантах реализации, композиция изопрена содержит этанол, ацетон, С5-пренильные спирты (такие как 3-метил-3-бутен-1-ол или 3-метил-2-бутен-1-ол) или любое из двух или более описанных соединений. В особых вариантах реализации, композиция изопрена содержит больше или приблизительно 0,005, 0,01, 0,05, 0,1, 0,5, 1,5, 10, 20, 30, 40, 60, 80, 100 или 120 мкг/л этанола. ацетона, пренильных спиртов С5 (таких как 3-метил-3-бутен-1-ол или 3-метил-2-бутен-1-ол) или любых из двух или более описанных соединений. В некоторых вариантах реализации, композиция изопрена содержит от приблизительно 0,005 до приблизительно 120, например, от приблизительно 0,01 до приблизительно 80, от приблизительно 0,01 до приблизительно 60, от приблизительно 0,01 до приблизительно 40, от приблизительно 0,01 до приблизительно 30, от приблизительно 0,01 до приблизительно 20, от приблизительно 0,01 до приблизительно 10, от приблизительно 0,1 до приблизительно 80, от приблизительно 0,1 до приблизительно 60, от приблизительно 0,1 до приблизительно 40, от приблизительно 5 до приблизительно 80, от приблизительно 5 до приблизительно 60 или от приблизительно 5 до приблизительно 40 мкг/л этанола, ацетона, пренильных спиртов С5 или любых из двух или более описанных соединений.
[0489] В некоторых вариантах реализации, композиция изопрена содержит один или более из следующих компонентов: 2-гептанон, 6-метил-5-гептен-2-он, 2,4,5-триметилпиридин, 2,3,5-триметилпиразин, цитронеллаль, ацетальдегид, метантиол, метилацетат, 1-пропанол, диацетил, 2-бутанон, 2-метил-3-бутен-2-ол, этилацетат, 2-метил-1-пропан ол, 3-метил-1-бутаналь, 3-метил-2-бутанон, 1-бутанол, 2-пентанон, 3-метил-1-бутан ол, этилизобутират, 3-метил-2-бутеналь, бутилацетат, 3-метилбутилацетат, 3-метил-3-бутен-1-ил ацетат, 3-метил-2-бутен-1-ил ацетат, 3-гексен-1-ол, 3-гексен-1-ил ацетат, лимонен, гераниол (транс-3,7-диметил-2,6-октадиен-1-ол). цитронеллол (3,7-диметил-6-октен-1-ол), (Е)-3,7-диметил-1,3,6-октатриен, (Z)-3,7-диметил-1,3,6-октатриен, 2,3-циклогептенолпиридин или линейный полимер изопрена (такой как линейный димер изопрена или линейный тример изопрена, полученные в результате полимеризации нескольких единиц изопрена). В различных вариантах реализации, количество одного из перечисленных компонентов по сравнению с количеством изопрена в единицах процента по массе (т.е., масса указанного компонента, деленная на массу изопрена, умноженная на 100) больше или приблизительно составляет 0,01.0,02, 0,05,0,1, 0,5, 1,5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 или 110% (масс./масс.). В некоторых вариантах реализации, относительный отклик детектора для второго соединения, по сравнению с показанием детектора для изопрена, больше или приблизительно составляет 0,01, 0,02, 0,05, 0,1, 0,5, 1, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 или 110%. В различных вариантах реализации, количество одного из перечисленных компонентов по сравнению с количеством изопрена в единицах процента по массе (т.е., масса указанного компонента, деленная на массу изопрена, умноженная на 100) находится в диапазоне от приблизительно 0,01 до приблизительно 105% (масс./масс.), например, от приблизительно 0,01 до приблизительно 90, от приблизительно 0,01 до приблизительно 80, от приблизительно 0,01 до приблизительно 50, от приблизительно 0,01 до приблизительно 20, от приблизительно 0,01 до приблизительно 10, от приблизительно 0,02 до приблизительно 50, от приблизительно 0,05 до приблизительно 50, от приблизительно 0,1 до приблизительно 50 или от приблизительно 0,1 до приблизительно 20% (масс./масс.).
[0490] В некоторых вариантах реализации, композиция изопрена содержит один или более из следующих компонентов: спирт, альдегид или кетон (например, любой из спиртов, альдегидов или кетонов, описанных в данной заявке). В некоторых вариантах реализации, композиция изопрена содержит (i) спирт и альдегид, (ii) спирт и кетон, (in) альдегид и кетон или (iv) спирт, альдегид и кетон.
[0491] В некоторых вариантах реализации, композиция изопрена содержит один или более из следующих компонентов: метанол, ацетальдегид, этанол, метантиол, 1-бутанол, 3-метил-1-пропанол, ацетон, уксусная кислота, 2-бутанон, 2-метил-1-бутанол или индол. В некоторых вариантах реализации, композиция изопрена содержит 1 промилле или более одного или нескольких из следующих компонентов; метанол, ацетальдегид, этанол, метантиол, 1-бутанол, 3-метил-1-пропанол, ацетон, уксусную кислоту, 2-бутанон, 2-метил-1-бутанол или индол. В некоторых вариантах реализации, концентрация более чем одного или нескольких из следующих компонентов: метанола, ацетальдегида, этанола, метантиола, 1-бутанола, 3-метил-1-пропанола, ацетона, уксусной кислоты, 2-бутанона, 2-метил-1-бутанола или индола, - находится в диапазоне от приблизительно 1 до приблизительно 10000 промилле в композиции изопрена (например, в выделяющемся газе перед его очисткой). В некоторых вариантах реализации, композиция изопрена (например, выделяющийся газ после того, как он был подвергнут одному или нескольким этапам очистки) содержит один или более из следующих компонентов: метанол, ацетальдегид, этанол, метантиол, 1-бутанол, 3-метил-1-пропанол, ацетон, уксусную кислоту, 2-бутанон, 2-метил-1-бутанол или индол, при концентрации, равной от приблизительно 1 до приблизительно 100 промилле, например, от приблизительно 1 до приблизительно 10 промилле, от приблизительно 10 до приблизительно 20 промилле, от приблизительно 20 до приблизительно 30 промилле, от приблизительно 30 до приблизительно 40 промилле, от приблизительно 40 до приблизительно 50 промилле, от приблизительно 50 до приблизительно 60 промилле, от приблизительно 60 до приблизительно 70 промилле, от приблизительно 70 до приблизительно 80 промилле, от приблизительно 80 до приблизительно 90 промилле или от приблизительно 90 до приблизительно 100 промилле. Летучие органические соединения из культур клеток (такие как летучие органические соединения в пространстве над поверхностью культуры клеток) можно исследовать, применяя стандартные способы, такие как описанные в данной заявке, или другие стандартные способы, такие как реакционная масс-спектрометрия с переносом протона (см., например, Bunge и др.. Applied and Environmental Microbiology, 74(7):2179-2186, 2008, которая настоящим полностью включена посредством ссылки, в частности, в отношении анализа летучих органических соединений).
[0492] В некоторых вариантах реализации, композиция содержит более чем приблизительно 2 мг изопрена, например, приблизительно или более 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900 или 1000 мг изопрена. В некоторых вариантах реализации, композиция содержит больше или приблизительно 2, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 г изопрена. В некоторых вариантах реализации, количество изопрена в указанной композиции находится в диапазоне от приблизительно 2 до приблизительно 5000 мг, например, в диапазоне от приблизительно 2 до приблизительно 100 мг, от приблизительно 100 до приблизительно 500 мг, от приблизительно 500 до приблизительно 1000 мг, от приблизительно 1000 до приблизительно 2000 мг или от приблизительно 2000 до приблизительно 5000 мг. В некоторых вариантах реализации, количество изопрена в указанной композиции находится в диапазоне от приблизительно 20 до приблизительно 5000 мг, от приблизительно 100 до приблизительно 5000 мг, от приблизительно 200 до приблизительно 2000 мг, от приблизительно 200 до приблизительно 1000 мг, от приблизительно 300 до приблизительно 1000 мг или от приблизительно 400 до приблизительно 1000 мг. В некоторых вариантах реализации, больше или приблизительно 20, 25, 30, 40, 50, 60, 70, 80, 90 или 95% масс. летучей органической фракции указанной композиции составляет изопрен.
[0493] В некоторых вариантах реализации, композиция содержит этанол. В некоторых вариантах реализации, композиция содержит от приблизительно 75 до приблизительно 90% масс. этанола, например, в диапазоне от приблизительно 75 до приблизительно 80%, от приблизительно 80 до приблизительно 85% или от приблизительно 85 до приблизительно 90% масс. этанола. В некоторых вариантах реализации, в которых композиция содержит этанол, указанная композиция также содержит от приблизительно 4 до приблизительно 15% масс. изопрена, например, в диапазоне от приблизительно 4 до приблизительно 8%, от приблизительно 8 до приблизительно 12% или от приблизительно 12 до приблизительно 15% масс. изопрена.
[0494] В некоторых вариантах реализации, описанных в данной заявке, клетка, содержащая одну или более гетерологичных нуклеиновых кислот, кодирующих полипептид изопренсинтазы, полипептид DXS, полипептид IDI и/или полипептид пути MVA, продуцирует количество изопреноидного соединения (например, соединения с 10 или более атомами углерода, которые образовались в результате реакции одной или нескольких молекул IPP с одной или несколькими молекулами DMAPP), которое больше или приблизительно в 2 раза, 3 раза, 5 раз, 10 раз, 25 раз, 50 раз, 100 раз, 150 раз, 200 раз, 400 раз или в большее число раз выше, чем количество изопреноидного соединения, продуцированного соответствующей клеткой, которую растили по существу при таких же условиях, без одной или нескольких гетерологичных нуклеиновых кислот, В некоторых вариантах реализации, описанных в данной заявке. клетка, содержащая одну или более гетерологичных нуклеиновых кислот, кодирующих полипептид изопренсинтазы, полипептид DXS, полипептид IDI и/или полипептид пути MVA, продуцирует количество пренильных спиртов С5 (таких как 3-метил-3-бутен-1-ол или 3-метил-2-бутен-1-ол), которое больше или приблизительно в 2 раза, 3 раза, 5 раз, 10 раз, 25 раз, 50 раз, 100 раз, 150 раз, 200 раз, 400 раз или в большее число раз выше, чем количество пренильных спиртов С5, продуцированных соответствующей клеткой, которую растили по существу при таких же условиях, без одной или нескольких гетерологичных нуклеиновых кислот.
Типичное совместное получение биоизопрена и водорода
[0495] В некоторых вариантах реализации, любые из продуцирующих изопрен клеток, описанных в данной заявке, которые содержат одну или более гетерологичных нуклеиновых кислот, кодирующих полипептид изопренсинтазы, полипептид DXS, полипептид IDI и/или полипептид пути MVA, функционально связанных с промотором, дополнительно содержат гетерологичную нуклеиновую кислоту, также функционально связанную с промотором, кодирующую один или более полипептидов гидрогеназы или один или более полипептидов, вовлеченных в регуляцию или экспрессию полипептидов гидрогеназы (например, белков созревания гидрогеназы или транскрипционных факторов). В некоторых вариантах реализации, любые из продуцирующих изопрен клеток, описанных в данной заявке, которые содержат одну или более гетерологичных нуклеиновых кислот, кодирующих полипептид изопренсинтазы. полипептид DXS, полипептид IDI, полипептид пути MVA, один или более полипептидов гидрогеназы или один или более полипептидов, вовлеченных в регуляцию или экспрессию полипептидов гидрогеназы, функционально связанных с промотором, дополнительно содержат мутацию или делению, инактивирующую один или более полипептидов, вовлеченных в образование побочных продуктов ферментации, один или более полипептидов, вовлеченных в регуляцию или экспрессию генов, отвечающих за образование побочных продуктов ферментации, или один или более полипептидов, вовлеченных в обратный захват водорода. Такие клетки могут одновременно продуцировать изопрен и водород.
[0496] В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, клетки представляют собой бактериальные клетки, такие как грамположительные бактериальные клетки (например, клетки Bacillus, такие как клетки Bacillus subtilis или клетки Streptomyces, такие как клетки Streptomyces lividans, Streptomyces coelicolor или Streptomyces griseus). В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, клетки представляют собой грамотрицательные бактериальные клетки (например, клетки Escherichia, такие как клетки Escherichia coli, клетки Rhodopseudomonas sp., такие как клетки Rhodopseudomonas palustris, клетки Pseudomonas sp., такие как клетки Pseudomonas fluorescens или клетки Pseudomonas putida, или клетки Pantoea, такие как клетки Pantoea citrea). В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, клетки представляют собой грибковые клетки, такие как мицелиальные грибковые клетки (например, клетки Trichoderma, такие как клетки Trichoderma reesei, или клетки Aspergillus, такие как клетки Aspergillus огугае и Aspergillus niger), или дрожжевые клетки (например, клетки Yarrowia, такие как клетки Yarrowia lipolytica, или клетки Sacchraomyces, такие как клетки Saccaromyces cerevisiae).
[0497] В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, полипептид изопренсинтазы представляет собой полипептид из такого растения, как Pueraria (например, Pueraria montana или Pueraria lobata) или Populus (например, Populus tremuloides, Populus alba, Populus nigra, Populus trichocarpa или гибрид Populus alba x Populus tremula).
[0498] В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, указанные клетки дополнительно содержат гетерологичную нуклеиновую кислоту, кодирующую полипептид IDI. В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, клетки дополнительно содержат вставленную копию эндогенной нуклеиновой кислоты, кодирующей полипептид IDI, В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, клетки дополнительно содержат гетерологичную нуклеиновую кислоту, кодирующую полипептид DXS. В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, клетки дополнительно содержат вставленную копию эндогенной нуклеиновой кислоты, кодирующей полипептид DXS. В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, клетки дополнительно содержат одну или более нуклеиновых кислот, кодирующих полипептид IDI и полипептид DXS. В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, одна нуклеиновая кислота кодирует полипептид изопренсинтазы, полипептид IDI и полипептид DXS. В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, один вектор кодирует полипептид изопренсинтазы, полипептид IDI и полипептид DXS. В некоторых вариантах реализации, вектор содержит селективный маркер или селектируемый маркер, такой как нуклеиновая кислота, придающая устойчивость к антибиотику.
[0499] В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, клетки дополнительно содержат гетерологичную нуклеиновую кислоту, кодирующую полипептид пути MVA (такой как полипептид пути MVA из Saccharomyces cerevisia или Enterococcus faecalis). В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, клетки дополнительно содержат вставленную копию эндогенной нуклеиновой кислоты, кодирующей полипептид пути MVA (такой как полипептид пути MVA из Saccharomyces cerevisia или Enterococcus faecalis). В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, клетки содержат нуклеиновую кислоту изопренсинтазы, DXS и пути MVA. В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, клетки содержат нуклеиновую кислоту изопренсинтазы, нуклеиновую кислоту DXS, нуклеиновую кислоту IDI и нуклеиновую кислоту пути MVA.
[0500] В некоторых вариантах реализации, продуцирующие изопрен клетки, описанные в данной заявке, дополнительно содержат гетерологичную нуклеиновую кислоту, кодирующую полипептид гидрогеназы, функционально связанный с промотором. В некоторых вариантах реализации, полипептид гидрогеназы включает полипептид гидрогеназы-1 (Hyd-1) Е. coli, гидрогеназы-2 (Hyd-2) Е. coli, гидрогеназы-3 (Hyd-3) Е. coli, гидрогеназы-4 (Hyd-4) Е. coli, формиат-водород-лиазного (FHL) комплекса Е. coli, который продуцирует газообразный водород из формиата и СО; при анаэробных условиях при кислом рН, гидрогеназы MR11 Rhodococcus opacus (HoxH R. opacus), гидрогеназы РСС 6803 Synechosystis sp.(HoxH PCC 6803 Syn.), гидрогеназы Desulfovibrio gigas (D. gigas) и гидрогеназы АТСС 7757 Desulfovibrio desulphuricans (D. desulphuricans). В некоторых вариантах реализации, продуцирующие изопрен клетки, дополнительно содержащие гетерологичную нуклеиновую кислоту, кодирующую полипептид гидрогеназы, функционально связанную с промотором. дополнительно содержат нуклеиновую кислоту гидрогеназы-3 (Hyd-3) E.coli, пируват-формиат-лиазы (pfl) E.coli и формиат-водород-лиазного (FHL) комплекса E.coli.
[0501] В некоторых вариантах реализации, полипептид гидрогеназы кодирует ферредоксин-зависимый полипептид гидрогеназы. В некоторых вариантах реализации, ферредоксин-зависимый полипептид гидрогеназы включает полипептид гидрогеназы A (HydA) Clostridium acetobutulicum, который может экспрессироваться совместно с одним или несколькими из перечисленных полипептидов: (1) ферредоксин-НАДФ+-оксидоредуктаза (NFOR) Bacillus subtilis или ферредоксин-НАДФ-оксидоредуктаза (RnfCDGEAB) Clostridium kluyveri, ферредоксин-оксидоредуктаза (Fdx) Clostridium pasteuranium; (2) глицеральдегид-6-фосфат-ферредоксин-оксидоредуктаза (GAPOR); или (3) пируват-ферредоксин-оксидоредуктаза (POR). В некоторых вариантах реализации, ферредоксин-зависимый полипептид гидрогеназы, полипептид гидрогеназы A (HydA) Clostridium acetobutulicum, экспрессируется с тремя связанными с HydA ферментами созревания (HydE, HydG и HydF), и дополнительно вместе с одним или несколькими из перечисленных полипептидов: (1) ферредоксин-НАДФ+-оксидоредуктаза (NFOR) Bacillus subtilis или ферредоксин-НАДФ-оксидоредуктаза (RnfCDGEAB) Clostridium kluyveri, ферредоксин-оксидоредуктаза (Fdx) Clostridium pasteuranium; (2) глицеральдегид-6-фосфат-ферредоксин-оксидоредуктаза (GAPOR); или (3) пируват-ферредоксин-оксидоредуктаза (POR).
[0502] В некоторых вариантах реализации, полипептид гидрогеназы кодирует полипептид НАДФ+-зависимой гидрогеназы. В некоторых вариантах реализации, полипептид НАДФ+-зависимой гидрогеназы включает гидрогеназу Pyrococcus furiosus. В некоторых вариантах реализации, полипептид гидрогеназы кодирует толерантную к кислороду гидрогеназу. В некоторых вариантах реализации, толерантная к кислороду гидрогеназа включает гидрогеназу Rubrivivax gelatinosus и гидрогеназу Ralstonia eutropha.
[0503] В некоторых вариантах реализации, продуцирующие изопрен клетки, описанные в данной заявке, дополнительно содержат мутацию или делецию, инактивирующую ген, вовлеченный в регуляцию гидрогеназной активности, такой как транскрипционный регуляторный комплекс железо-сера (iscR) (Kalim-Akhtar и др., "Deletion of iscR stimulates recombinant Clostridial Fe/Fe hydrogenase activity and H2-accumulation in Escherichia coli BL21(DE3)", Appl. Microbiol. Blotechnol. 78:853-862 (2008), которая полностью включена в данную заявку посредством ссылки, особенно в отношении стимуляции Fe/Fe-гидрогеназной активности клостридий и накопления водорода в Е. coli при делетировании гена iscR).
[0504] В некоторых вариантах реализации, продуцирующие изопрен клетки, описанные в данной заявке, дополнительно содержат мутацию или делецию, инактивирующую ген, кодирующий один или более клеточных полипептидов, участвующих в образовании побочных продуктов ферментации, таких как лактат, ацетат, пируват, этанол, сукцинат и глицерин. В некоторых вариантах реализации, инактивированные полипептиды, участвующие в образовании побочных продуктов ферментации, включают один или более полипептидов, кодирующих альфа-субъединицу формиатдегидрогеназы N (fdnG), большую субъединицу формиатдегидрогеназы О (fdoG), нитратредуктазу (narG), транспортер формиата А (focA), транспортер формиата В (focB), пируватоксидазу (рохВ), компонент ackA/pta пируватдегидрогеназы Е1 (.асеЕ), алкогольдегидрогеназу (adhE), мембранный белок фумаратредуктазы (frdC) или лактатдегидрогеназу (IdhA).
[0505] В некоторых вариантах реализации, продуцирующие изопрен клетки, описанные в данной заявке, дополнительно содержат мутацию или делецию, инактивирующую ген, кодирующий один или более клеточных полипептидов, вовлеченных в регуляцию или экспрессию генов, участвующих в образовании побочных продуктов ферментации. В некоторых вариантах реализации, инактивированные полипептиды, вовлеченные в регуляцию или экспрессию генов, участвующих в образовании побочных продуктов ферментации, включают репрессор формиат-водород-лиазы (hycA), регулятор фумаратредуктазы (fhr), ацетил-коэнзим А-синтетазу (acs) и регуляторный белок формиатдегидрогеназы (hycA).
[0506] В некоторых вариантах реализации, продуцирующие изопрен клетки, описанные в данной заявке, дополнительно содержат мутацию или делецию, инактивирующую ген, кодирующий один или более клеточных полипептидов, вовлеченных в обратный захват водорода. В некоторых вариантах реализации, инактивированные полипептиды, вовлеченные в обратный захват водорода, включают гидрогеназу-1 (Hyd-1) Е. coli (оперон hya) и гидрогеназу-2 (Hyd-2) Е. coli (оперон hyb).
[0507] В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, нуклеиновая кислота гетерологичной изопренсинтазы, полипептида DXS, полипептида IDI, MVA-пути, гидрогеназы, полипептида фактора созревания или транскрипции гидрогеназы функционально связана с промотором Т7, таким как промотор Т7, вставленный в умеренно- или многокопийную плазмиду. В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, нуклеиновая кислота гетерологичной изопренсинтазы, полипептида DXS, полипептида IDI, MVA-пути, гидрогеназы, фактора созревания или транскрипции гидрогеназы функционально связана с промотором LAc, таким как промотор Lac, вставленный в умеренно- или многокопийную плазмиду. В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, нуклеиновая кислота гетерологичной изопренсинтазы, полипептида DXS, полипептида IDI, MVA-пути, гидрогеназы, фактора созревания или транскрипции гидрогеназы функционально связана с промотором Lac, таким как промотор Lac, вставленный в низкокопийную плазмиду. В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, нуклеиновая кислота гетерологичной изопренсинтазы, полипептида DXS, полипептида IDI, MVA-пути, гидрогеназы, фактора созревания или транскрипции гидрогеназы функционально связана с эндогенным промотором, таким как эндогенный промотор щелочной сериновой протеазы. В некоторых вариантах реализации, нуклеиновая кислота гетерологичной изопренсинтазы, полипептида DXS, полипептида IDI, MVA-пути, гидрогеназы, фактора созревания или транскрипции гидрогеназы встраивается в хромосому клеток без селективного маркера или без селектируемого маркера.
[0508] В некоторых вариантах реализации, одну или более нуклеиновых кислот для MVA-пути, IDI, DXS, изопренсинтазы, гидрогеназы, фактора созревания или транскрипции гидрогеназы помещают под контроль промотора или фактора, который более активен в стационарной фазе, чем в фазе роста. Например, одну или более нуклеиновых кислот для MVA-пути, IDI, DXS, изопренсинтазы, гидрогеназы, фактора созревания или транскрипции гидрогеназы можно поместить под контроль сигма-фактора стационарной фазы, такого как RpoS. В некоторых вариантах реализации, одну или более нуклеиновых кислот для MVA-пути, IDI, DXS, изопренсинтазы, гидрогеназы, фактора созревания или транскрипции гидрогеназы помещают под контроль промотора, индуцируемого в стационарной фазе, такого как промотор, индуцируемый регулятором ответа, активным в стационарной фазе.
[0509] В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, по меньшей мере часть клеток сохраняет нуклеиновую кислоту гетерологичной изопренсинтазы, полипептида DXS, полипептида IDI, MVA-пути, гидрогеназы, фактора созревания или транскрипции гидрогеназы в течение по меньшей мере или приблизительно 5, 10, 20, 40, 50, 60, 65 или более клеточных делений в непрерывной культуре (такой как непрерывная культура без разведения). В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, нуклеиновая кислота, содержащая нуклеиновую кислоту изопренсинтазы, полипептида DXS, полипептида IDI, MVA-пути, гидрогеназы, фактора созревания или транскрипции гидрогеназы, также включает селективный маркер или селектируемый маркер, такой как нуклеиновая кислота, придающая устойчивость к антибиотику.
[0510] В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, клетки, которые продуцируют одновременно изопрен и водород, культивируют в любых из культуральных сред, описанных в данной заявке, при условиях с ограниченным содержанием кислорода, чтобы обеспечить совместную продукцию клетками изопрена и водорода. В некоторых вариантах реализации, клетки растят в культуре с ограниченным содержанием кислорода. В некоторых вариантах реализации, клетки растят в присутствии 0,5 молей кислорода на моль изопрена. В некоторых вариантах реализации, указанные клетки растят анаэробно, в отсутствии кислорода.
[0511] В некоторых вариантах реализации, любую из клеток, описанных в данной заявке, выращивают в культуре с ограниченным содержанием кислорода, и они продуцируют одновременно изопрен и водород. В некоторых вариантах реализации, указанные клетки в культуре с ограниченным содержанием кислорода продуцируют изопрен при скорости, большей чем приблизительно 400 нмоль/гсмк/ч, и продуцируют водород при скорости, большей чем приблизительно 125 нмоль/гсмк/ч. В некоторых вариантах реализации, клетки в культуре с ограниченным содержанием кислорода продуцируют изопрен при скорости от приблизительно 400 нмоль/гсмк/ч до приблизительно 2,0×105 нмоль/гсмк/ч и продуцируют водород при скорости от приблизительно 125 нмоль/гсмк/ч до приблизительно 1,25×104 нмоль/гсмк/ч. В некоторых вариантах реализации, клетки в культуре с ограниченным содержанием кислорода продуцируют изопрен при скорости между приблизительно 400 нмоль/гсмк/ч и приблизительно 2,0×105 нмоль/гсмк/ч, между приблизительно 500 нмоль/гсмк/ч и приблизительно 1,5×105 нмоль/гсмк/ч, между приблизительно 750 нмоль/гсмк/ч и приблизительно 1×105 нмоль/гсмк/ч, между приблизительно 1000 нмоль/гсмк/ч и приблизительно 1×105 нмоль/гсмк/ч, между приблизительно 2500 нмоль/гсмк/ч и приблизительно 1×105 нмоль/гсмк/ч, между приблизительно 5000 нмоль/гсмк/ч и приблизительно 1×105 нмоль/гсмк/ч, между приблизительно 7500 нмоль/гсмк/ч и приблизительно 1×105 нмоль/гсмк/ч и между приблизительно 1×104 нмоль/гсмк/ч и приблизительно 1×105 нмоль/гсмк/ч. В некоторых вариантах реализации, клетки в культуре с ограниченным содержанием кислорода продуцируют больше, чем приблизительно 400, 500, 600, 700, 800, 900, 1000, 1250, 1500, 1750, 2000, 2500, 3000, 4000, 5000 или более нмоль изопрена/гсмк/ч. В некоторых вариантах реализации, клетки в культуре с ограниченным содержанием кислорода продуцируют водород при скорости от приблизительно 125 нмоль/гсмк/ч до приблизительно 1,25×104нмоль/гсмк/ч, от приблизительно 250 нмоль/гсмк/ч до приблизительно 1,25×104нмоль/гсмк/ч, от приблизительно 500 нмоль/гсмк/ч до приблизительно 1,25×104нмоль/гсмк/ч, от приблизительно 750 нмоль/гсмк/ч до приблизительно 1,25×104нмоль/гсмк/ч, от приблизительно 1000 нмоль/гсмк/ч до приблизительно 1,25×104нмоль/гсмк/ч, от приблизительно 1250 нмоль/гсмк/ч до приблизительно 1,25×104нмоль/гсмк/ч, от приблизительно 2500 нмоль/гсмк/ч до приблизительно 1,25×104нмоль/гсмк/ч, от приблизительно 5000 нмоль/гсмк/ч до приблизительно 1,25×104нмоль/гсмк/ч, от приблизительно 7500 нмоль/гсмк/ч до приблизительно 1,25×104нмоль/гсмк/ч, и от приблизительно 1,00×104 нмоль/гсмк/ч до приблизительно 1,25×104нмоль/гсмк/ч. В некоторых вариантах реализации, клетки в культуре с ограниченным содержанием кислорода продуцируют больше, чем приблизительно 125, 250, 500, 750, 1000, 1250, 1500, 1750, 2000, 2500, 3000, 4000, 5000, 7500, 10000 или более нмоль водорода/гсмк/ч.
[0512] В некоторых вариантах реализации, любую из клеток, описанных в данной заявке, выращивают в культуре с ограниченным содержанием кислорода, и указанная клетка продуцирует одновременно изопрен и водород. В некоторых вариантах реализации, клетки в культуре с ограниченным содержанием кислорода обладают средней объемной производительностью по изопрену, составляющей более чем приблизительно 0,1 мг/лбульона/ч, и средней объемной производительностью по водороду, составляющей более чем приблизительно 0,005 мг/лбульона/ч. В некоторых вариантах реализации, клетки в культуре с ограниченным содержанием кислорода обладают максимальной объемной производительностью по изопрену, составляющей более чем приблизительно 1000 мг/лбульона/ч, и максимальной объемной производительностью по водороду, составляющей более чем приблизительно 5 мг/лбульона/ч. В некоторых вариантах реализации, клетки в культуре с ограниченным содержанием кислорода обладают максимальной объемной производительностью по изопрену, составляющей более чем приблизительно 3000 мг/лбульона/ч, и максимальной объемной производительностью по водороду, составляющей более чем приблизительно 5 мг/лбульона/ч. В некоторых вариантах реализации, клетки в культуре с ограниченным содержанием кислорода обладают максимальной объемной производительностью по изопрену, составляющей более чем приблизительно 5000 мг/лбульона/ч, и максимальной объемной производительностью по водороду, составляющей более чем приблизительно 5 мг/лбульона/ч. В некоторых вариантах реализации, клетки в культуре с ограниченным содержанием кислорода обладают средней объемной производительностью по изопрену между приблизительно 0,1 мг/лбульона/ч и приблизительно 5000 мг/лбульона/ч, и средней объемной производительностью по водороду, составляющей между приблизительно 0,005 мг/лбульона/ч и приблизительно 5 мг/лбульона/ч. В некоторых вариантах реализации, клетки в культуре с ограниченным содержанием кислорода обладают средней объемной производительностью по изопрену между приблизительно 1 мг/лбульона/ч и приблизительно 5000 мг/лбульона/ч, между приблизительно 5 мг/лбульона/ч и приблизительно 5000 мг/лбульона/ч, между приблизительно 10 мг/лбульона/ч и приблизительно 5000 мг/лбульона/ч, между приблизительно 25 мг/лбульона/ч и приблизительно 5000 мг/лбульона/ч, между приблизительно 50 мг/лбульона/ч и приблизительно 5000 мг/лбульона/ч, между приблизительно 100 мг/лбульона/ч и приблизительно 5000 мг/лбульона/ч, между приблизительно 250 мг/лбульона/ч и приблизительно 5000 мг/лбульона/ч, между приблизительно 500 мг/лбульона/ч и приблизительно 5000 мг/лбульона/ч, между приблизительно 1000 мг/лбульона/ч и приблизительно 5000 мг/лбульона/ч и между приблизительно 2500 мг/лбульона/ч и приблизительно 5000 мг/лбульона/ч, и средней объемной производительностью по водороду, составляющей между приблизительно 0,01 мг/лбульона/ч и приблизительно 5 мг/лбульона/ч, между приблизительно 0,025 мг/лбульона/ч и приблизительно 5 мг/лбульона/ч, между приблизительно 0,05 мг/лбульона/ч и приблизительно 5 мг/лбульона/ч, между приблизительно 0,1 мг/лбульона/ч и приблизительно 5 мг/лбульона/ч, между приблизительно 0,25 мг/лбульона/ч и приблизительно 5 мг/лбульона/ч, между приблизительно 0,5 мг/лбульона/ч и приблизительно 5 мг/лбульона/ч, между приблизительно 1 мг/лбульона/ч и приблизительно 5 мг/лбульона/ч и между приблизительно 2,5 мг/лбульона/ч и приблизительно 5 мг/лбульона/ч.
[0513] В некоторых вариантах реализации, любую из клеток, описанных в данной заявке, выращивают в культуре с ограниченным содержанием кислорода, и она продуцирует одновременно изопрен и водород. В некоторых вариантах реализации, указанные клетки в культуре с ограниченным содержанием кислорода превращают более чем приблизительно 0,002 молярного процента углерода, который клетки потребляют из культуральной среды, в изопрен, и продуцируют водород, эквивалентно более чем приблизительно 0,024 молярного процента углерода, который клетки потребляют из культуральной среды. В некоторых вариантах реализации, клетки в культуре с ограниченным содержанием кислорода превращают более чем приблизительно 0,002 молярного процента углерода, который клетки потребляют из культуральной среды, в изопрен, и продуцируют водород, эквивалентно более чем приблизительно 400 молярным процентам углерода, который клетки потребляют из культуральной среды.
[0514] В некоторых вариантах реализации, любую из клеток, описанных в данной заявке, которые продуцируют одновременно изопрен и водород, растили в культуре с ограниченным содержанием кислорода. В некоторых вариантах реализации, клетки в культуре с ограниченным содержанием кислорода продуцируют одновременно изопрен и водород в соотношении, находящемся в диапазоне от по меньшей мере одного молярного процента изопрена на каждые три молярных процента водорода до по меньшей мере одного молярного процента изопрена на каждые четыре молярных процента водорода. В некоторых вариантах реализации, указанные клетки в культуре с ограниченным содержанием кислорода продуцируют выделяющийся газ, содержащий от 1 до 11 молярных процентов изопрена и от 3 до 33 молярных процентов водорода. В некоторых вариантах реализации, клетки продуцируют от 1 до 11 молярных процентов изопрена и от 4 до 44 молярных процентов водорода. В некоторых вариантах реализации, клетки в культуре с ограниченным содержанием кислорода также продуцируют выделяющийся газ, содержащий кислород, диоксид углерода или азот.В некоторых вариантах реализации, клетки в культуре с ограниченным содержанием кислорода продуцируют выделяющийся газ, содержащий от 0 до 21 молярного процента кислорода, от 18 до 44 молярных процентов диоксида углерода и от 0 до 78 молярных процентов азота.
[0515] В другом аспекте, в настоящем описании предусмотрены клетки в культуре с ограниченным содержанием кислорода, продуцирующие одновременно изопрен и водород, которые содержат гетерологичную нуклеиновую кислоту, кодирующую полипептид изопренсинтазы, при этом указанные клетки: (i) продуцируют изопрен при скорости, большей чем приблизительно 400 нмоль/гсмк/ч, и продуцируют водород при скорости, большей чем приблизительно 125 нмоль/гсмк/ч; (ii) обладают средней объемной производительностью по изопрену, составляющей более чем приблизительно 0,1 мг/лбульона/ч, и средней объемной производительностью по водороду, составляющей более чем приблизительно 0,005 мг/лбульона/ч; или (iii) превращают более чем приблизительно 0,002 молярного процента углерода, который клетки потребляют из культуральной среды, в изопрен, и продуцируют водород, эквивалентно более чем приблизительно 0,024 молярного процента углерода, который клетки потребляют из культуральной среды.
[0516] В некоторых вариантах реализации, клетки в культуре с ограниченным содержанием кислорода содержат гетерологичную нуклеиновую кислоту, кодирующую полипептид изопренсинтазы, при этом указанная гетерологичная нуклеиновая кислота функционально связана с промотором, и при этом клетки продуцируют более чем приблизительно 400 нмоль изопрена/гсмк/ч и более чем приблизительно 125 нмоль/гсмк/ч водорода. В некоторых вариантах реализации, клетки в культуре с ограниченным содержанием кислорода содержат гетерологичную нуклеиновую кислоту, кодирующую полипептид изопренсинтазы, при этом указанная гетерологичная нуклеиновая кислота функционально связана с промотором, и при этом клетки обладают средней объемной производительностью по изопрену, составляющей более чем приблизительно 0,1 мг/лбульона/ч, и средней объемной производительностью по водороду, составляющей более чем приблизительно 0,005 мг/лбульона/ч. В некоторых вариантах реализации, клетки в культуре с ограниченным содержанием кислорода содержат гетерологичную нуклеиновую кислоту, кодирующую полипептид изопренсинтазы, при этом указанная гетерологичная нуклеиновая кислота функционально связана с промотором, и при этом клетки превращают более чем приблизительно 0,002 молярного процента углерода, который клетки потребляют из культуральной среды, в изопрен, и превращают более чем приблизительно 0,024 молярного процента углерода, который клетки потребляют из культуральной среды, в водород. В некоторых вариантах реализации, полипептид изопренсинтазы представляет собой полипептид изопренсинтазы растения.
[0517] В некоторых вариантах реализации, клетки в культуре с ограниченным содержанием кислорода, содержащие гетерологичную нуклеиновую кислоту, кодирующую полипептид изопренсинтазы, продуцируют изопрен при скорости между приблизительно 400 нмоль/гсмк/ч и приблизительно 2,0×105 нмоль/гсмк/ч, между приблизительно 500 нмоль/гсмк/ч и приблизительно 1,5×105 нмоль/гсмк/ч. между приблизительно 750 нмоль/гсмк/ч и приблизительно 1×105 нмоль/гсмк/ч, между приблизительно 1000 нмоль/гсмк/ч и приблизительно 1×105 нмоль/гсмк/ч, между приблизительно 2500 нмоль/гсмк/ч и приблизительно 1×105 нмоль/гсмк/ч, между приблизительно 5000 нмоль/гсмк/ч и приблизительно 1×105 нмоль/гсмк/ч, между приблизительно 7500 нмоль/гсмк/ч и приблизительно 1×105 нмоль/гсмк/ч и между приблизительно 1×104 нмоль/гсмк/ч и приблизительно 1×105 нмоль/гсмк/ч, и продуцируют водород при скорости от приблизительно 125 нмоль/гсмк/ч до приблизительно 1,25×104 нмоль/гсмк/ч, от приблизительно 250 нмоль/гсмк/ч до приблизительно 1,25×104 нмоль/гсмк/ч, от приблизительно 500 нмоль/гсмк/ч до приблизительно 1,25×104 нмоль/гсмк/ч, от приблизительно 750 нмоль/гсмк/ч до приблизительно 1,25×104 нмоль/гсмк/ч, от приблизительно 1000 нмоль/гсмк/ч до приблизительно 1,25×104 нмоль/гсмк/ч, от приблизительно 1250 нмоль/гсмк/ч до приблизительно 1,25×104 нмоль/гсмк/ч, от приблизительно 2500 нмоль/гсмк/ч до приблизительно 1,25×104 нмоль/гсмк/ч, от приблизительно 5000 нмоль/гсмк/ч до приблизительно 1,25×104 нмоль/гсмк/ч, от приблизительно 7500 нмоль/гсмк/ч до приблизительно 1,25×104 нмоль/гсмк/ч и от приблизительно 1,00×104 нмоль/гсмк/ч до приблизительно 1,25×104 нмоль/гсмк/ч.
[0518] В некоторых вариантах реализации, в настоящем описании предусмотрены способы совместной продукции изопрена и водорода, указанные способы включают:
(а) культивирование клеток при условиях, подходящих для совместной продукции изопрена и водорода; и (b) совместную продукцию изопрена и водорода, при этом клетки продуцируют более чем приблизительно 400 нмоль изопрена/гсмк/час, и при этом клетки продуцируют более чем приблизительно 125 нмоль водорода/гсмк/ч.
[0519] В некоторых вариантах реализации, клетки в культуре с ограниченным содержанием кислорода, содержащие гетерологичную нуклеиновую кислоту, кодирующую полипептид изопренсинтазы, продуцируют изопрен при скорости между приблизительно 400 нмоль/гсмк/ч и приблизительно 2,0×105 нмоль/гсмк/ч, между приблизительно 500 нмоль/гсмк/ч и приблизительно 1,5×105 нмоль/гсмк/ч, между приблизительно 750 нмоль/гсмк/ч и приблизительно 1×105 нмоль/гсмк/ч, между приблизительно 1000 нмоль/гсмк/ч и приблизительно 1×105 нмоль/гсмк/ч, между приблизительно 2500 нмоль/гсмк/ч и приблизительно 1×105 нмоль/гсмк/ч, между приблизительно 5000 нмоль/гсмк/ч и приблизительно 1×105 нмоль/гсмк/ч, между приблизительно 7500 нмоль/гсмк/ч и приблизительно 1×105 нмоль/гсмк/ч и между приблизительно 1×104 нмоль/гсмк/ч и приблизительно 1×105 нмоль/гсмк/ч, и продуцируют водород при скорости от приблизительно 125 нмоль/гсмк/ч до приблизительно 1,25×104 нмоль/гсмк/ч, от приблизительно 250 нмоль/гсмк/ч до приблизительно 1,25×104 нмоль/гсмк/ч, от приблизительно 500 нмоль/гсмк/ч до приблизительно 1,25×104 нмоль/гсмк/ч, от приблизительно 750 нмоль/гсмк/ч до приблизительно 1,25×104 нмоль/гсмк/ч, от приблизительно 1000 нмоль/гсмк/ч до приблизительно 1,25×104 нмоль/гсмк/ч, от приблизительно 1250 нмоль/гсмк/ч до приблизительно 1,25×104 нмоль/гсмк/ч, от приблизительно 2500 нмоль/гсмк/ч до приблизительно 1,25×104 нмоль/гсмк/ч, от приблизительно 5000 нмоль/гсмк/ч до приблизительно 1,25×104 нмоль/гсмк/ч, от приблизительно 7500 нмоль/гсмк/ч до приблизительно 1,25×104 нмоль/гсмк/ч и от приблизительно 1,00×104 нмоль/гсмк/ч до приблизительно 1,25×104 нмоль/гсмк/ч.
[0520] В некоторых вариантах реализации, в настоящем описании предусмотрены способы совместной продукции изопрена и водорода, указанные способы включают:
(а) культивирование клеток при условиях, подходящих для совместной продукции изопрена и водорода; и (b) совместную продукцию изопрена и водорода, при этом указанные клетки обладают средней объемной производительностью по изопрену, составляющей более чем приблизительно 0,1 мг/лбульона/ч, и средней объемной производительностью по водороду, составляющей более чем приблизительно 0,005 мг/лбульона/ч.
[0521] В некоторых вариантах реализации, в настоящем описании предусмотрены способы совместной продукции изопрена и водорода, указанные способы включают:
(а) культивирование клеток при условиях, подходящих для совместной продукции изопрена и водорода; и (b) совместную продукцию изопрена и водорода, при этом указанные клетки превращают более чем приблизительно 0,002 молярного процента углерода, который клетки потребляют из культуральной среды, в изопрен, и продуцируют водород, эквивалентно более чем приблизительно 0,024 молярного процента углерода, который клетки потребляют из культуральной среды,
[0522] В некоторых вариантах реализации, в настоящем описании предусмотрены композиции, содержащие изопрен и водород в соотношении, находящемся в диапазоне от по меньшей мере одного молярного процента изопрена на каждые три молярных процента водорода до по меньшей мере одного молярного процента изопрена на каждые четыре молярных процента водорода, и 0,1 молярного процента или менее летучих примесей. В некоторых вариантах реализации, композиции дополнительно содержат от 1 до 11 молярных процентов изопрена и от 4 до 44 молярных процентов водорода. В некоторых вариантах реализации, композиции дополнительно содержат кислород, диоксид углерода или азот.В некоторых вариантах реализации, композиции дополнительно содержат от 0 до 21 молярного процента кислорода, от 18 до 44 молярных процентов диоксида углерода и от 0 до 78 молярных процентов азота. В некоторых вариантах реализации, композиция дополнительно содержит 1,0×10-4молярный процент или менее неметановых летучих примесей. В некоторых вариантах реализации, неметановые летучие примеси включают одну или более из следующих примесей: 2-гептанон, 6-метил-5-гептен-2-он, 2,4,5-триметилпиридин, 2,3,5-триметилпиразин, цитронеллаль, ацетальдегид, метантиол, метилацетат, 1-пропанол, диацетил, 2-бутанон, 2-метил-3-бутен-2-ол, этилацетат, 2-метил-1-пропанол, 3-метил-1-бутаналь, 3-метил-2-бутанон, 1-бутанол, 2-пентанон, 3-метил-1-бутанол, этилизобутират, 3-метил-2-бутеналь, бутилацетат.3-метилбутилацетат, 3-метил-3-бутен-1-ил ацетат, 3-метил-2-бутен-1-ил ацетат, 3-гексен-1-ол, 3-гексен-1-ил ацетат, лимонен, гераниол (транс-3,7-диметил-2,6-октадиен-1-ол), цитронеллол (3,7-диметил-6-октен-1-ол), (Е)-3,7-диметил-1,3,6-октатриен, (г)-3,7-диметил-1,3,6-октатриен, 2,3-циклогептенолпиридин или линейный полимер изопрена (такой как линейный димер изопрена или линейный тример изопрена, полученные в результате полимеризации нескольких единиц изопрена). В некоторых вариантах реализации, композиция изопрена содержит одну или более из следующих примесей: спирт, альдегид или кетон (такой как любой из спиртов, альдегидов или кетонов, описанных в данной заявке). В некоторых вариантах реализации, композиция изопрена содержит (i) спирт и альдегид, (ii) спирт и кетон, (iii) альдегид и кетон или (iv) спирт, альдегид и кетон. В некоторых вариантах реализации, неметановые летучие примеси включают одну или более из следующих примесей: метанол, ацетальдегид, этанол, метантиол, 1-бутанол, 3-метил-1-пропанол, ацетон, уксусную кислоту, 2-бутанон, 2-метил-1-бутанол или индол.
[0523] Также в настоящем описании предусмотрены способы совместной продукции изопрена и водорода, указанные способы включают: а) культивирование клеток при условиях, подходящих для совместной продукции изопрена и водорода; и b) совместную продукцию изопрена и водорода, при этом максимальная концентрация изопрена, продуцированного клетками в культуре с ограниченным содержанием кислорода, составляет более чем приблизительно 10 нг/лбульона, и скорость выделения клетками водорода составляет более чем приблизительно 0,0025 ммоль/лбульона/час.В некоторых вариантах реализации любых из данных способов, скорость выделения водорода находится в любом из перечисленных далее диапазонов: между приблизительно 0,0025 ммоль/лбульона/ч и приблизительно 10 ммоль/лбульона/ч, между приблизительно 0,0025 ммоль/лбульона/ч и приблизительно 5 ммоль/лбульона/ч, между приблизительно 0,0025 ммоль/лбульона/ч и приблизительно 2,5 ммоль/лбульона/ч, между приблизительно 0,0025 ммоль/лбульона/ч и приблизительно 1 ммоль/лбульона/ч, между приблизительно 0,0025 ммоль/лбульона/ч и приблизительно 0,5 ммоль/лбульона/ч, между приблизительно 0,0025 ммоль/лбульона/ч и приблизительно 0,25 ммоль/лбульона/ч, между приблизительно 0,0025 ммоль/лбульона/ч и приблизительно 0,025 ммоль/лбульона/ч, между приблизительно 0,025 ммоль/лбульона/ч и приблизительно 0,5 ммоль/лбульона/ч, между приблизительно 0,025 ммоль/лбульона/ч и приблизительно 1 ммоль/лбульона/ч, между приблизительно 0,025 ммоль/лбульона/ч и приблизительно 2,5 ммоль/лбульона/ч, между приблизительно 0,025 ммоль/лбульона/ч и приблизительно 5 ммоль/лбульона/ч, между приблизительно 0,025 ммоль/лбульона/ч и приблизительно 10 ммоль/лбульона/ч, между приблизительно 0,25 ммоль/лбульона/ч и 1 ммоль/лбульона/ч, между приблизительно 0,25 ммоль/лбульона/ч И 2,5 ммоль/лбульона/ч, между приблизительно 0,25 ммоль/лбульона/ч И 2,5 ммоль/лбульона/ч и между приблизительно 0,25 ммоль/лбульона/ч И 10 ммоль/лбульона/ч.
[0524] В настоящем описании также предусмотрены способы совместной продукции изопрена и водорода, включающие а) культивирование клеток при условиях, подходящих для совместной продукции изопрена и водорода; и b) совместную продукцию изопрена и водорода, при этом концентрация изопрена в жидкой фазе меньше, чем приблизительно 200 мг/л, клетки продуцируют более чем приблизительно 400 нмоль изопрена/гсмк/час и скорость выделения клетками водорода составляет более чем приблизительно 0,0025 ммоль/л/час.В некоторых вариантах реализации, концентрация изопрена в жидкой фазе в культуре меньше, чем приблизительно любая из перечисленных концентраций: 175 мг/л, 150 мг/л, 125 мг/л, 100 мг/л, 75 мг/л, 50 мг/л, 25 мг/л, 20 мг/л, 15 мг/л, 10 мг/л, 5 мг/л или 2,5 мг/л. В некоторых вариантах реализации, концентрация изопрена в жидкой фазе в культуре находится в любом из перечисленных далее диапазонов: приблизительно от 0,1 мг/л до 200 мг/л, от 1 мг/л до 200 мг/л, от 1 мг/л до 150 мг/л, от 1 мг/л до 100 мг/л, от 1 мг/л до 50 мг/л, от 1 мг/л до 25 мг/л, от 1 мг/л до 20 мг/л или от 10 мг/л до 20 мг/л. В некоторых вариантах реализации любых из данных способов, скорость выделения водорода находится в любом из перечисленных далее диапазонов: между приблизительно 0,0025 ммоль/лбульона/ч и приблизительно 10 ммоль/лбульона/ч. между приблизительно 0,0025 ммоль/лбульона/ч и приблизительно 5 ммоль/лбульона/ч, между приблизительно 0,0025 ммоль/лбульона/ч и приблизительно 2,5 ммоль/лбульона/ч, между приблизительно 0,0025 ммоль/лбульона/ч и приблизительно 1 ммоль/лбульона/ч, между приблизительно 0,0025 ммоль/лбульона/ч и приблизительно 0,5 ммоль/лбульона/ч, между приблизительно 0,0025 ммоль/лбульона/ч и приблизительно 0,25 ммоль/лбульона/ч. между приблизительно 0,0025 ммоль/лбульона/ч и приблизительно 0,025 ммоль/лбульона/ч, между приблизительно 0,025 ммоль/лбульона/ч и приблизительно 0,5 ммоль/лбульона/ч, между приблизительно 0,025 ммоль/лбульона/ч И приблизительно 1 ммоль/лбульона/ч, между приблизительно 0,025 ммоль/лбульона/ч и приблизительно 2,5 ммоль/лбульона/ч, между приблизительно 0,025 ммоль/лбульона/ч и приблизительно 5 ммоль/лбульона/ч, между приблизительно 0,025 ммоль/лбульона/ч и приблизительно 10 ммоль/лбульона/ч, между приблизительно 0,25 ммоль/лбульона/ч И 1 ммоль/лбульона/ч, между приблизительно 0,25 ммоль/лбульона/ч И 2,5 ммоль/лбульона/ч, между приблизительно 0,25 ммоль/лбульона/ч И 2,5 ммоль/лбульона/ч и между приблизительно 0,25 ммоль/лбульона/ч И 10 ммоль/лбульона/ч.
[0525] В одном аспекте, в настоящем описании предусмотрены клетки в культуре с ограниченным содержанием кислорода, которые продуцируют одновременно изопрен и водород. В некоторых вариантах реализации, культура с ограниченным содержанием кислорода является анаэробной. В некоторых вариантах реализации, указанные клетки в культуре с ограниченным содержанием кислорода продуцируют больше, чем приблизительно 400 нмоль изопрена/гсмк/ч, и больше, чем приблизительно 125 нмоль водорода/гсмк/ч. В некоторых вариантах реализации, клетки содержат гетерологичную нуклеиновую кислоту, которая (i) кодирует полипептид изопренсинтазы и (ii) функционально связана с промотором. В некоторых вариантах реализации, клетки культивируют в культуральной среде, которая содержит источник углерода, такой как, но не ограниченный перечисленными, углевод, глицерол, глицерин, дигидроксиацетон, одноуглеродный источник углерода, масло, животный жир, животное масло, жирная кислота, липид, фосфолипид, глицеролипид, моноглицерид, диглицерид, триглицерид, возобновляемый источник углерода, полипептид (например, белок или пептид микроорганизма или растения), дрожжевой экстракт, компонент из дрожжевого экстракта или любая комбинация двух или более из перечисленных источников углерода. В некоторых вариантах реализации, клетки культивируют в условиях с ограничением количества глюкозы.
[0526] В некоторых вариантах реализации, в настоящем описании предусмотрены клетки в культуре с ограниченным содержанием кислорода, которые превращают более чем приблизительно 0,002% углерода в культуральной среде в изопрен и продуцируют водород, эквивалентно более чем приблизительно 0,024 молярного процента углерода в культуральной среде. В некоторых вариантах реализации, культура с ограниченным содержанием кислорода является анаэробной. В некоторых вариантах реализации, указанные клетки содержат гетерологичную нуклеиновую кислоту, которая (i) кодирует полипептид изопренсинтазы и (ii) функционально связана с промотором. В некоторых вариантах реализации, клетки культивируют в культуральной среде, которая содержит источник углерода, такой как, но не ограниченный перечисленными, углевод, глицерол, глицерин, дигидроксиацетон, одноуглеродный источник углерода, масло, животный жир, животное масло, жирная кислота, липид, фосфолипид, глицеролипид, моноглицерид, диглицерид, триглицерид, возобновляемый источник углерода, полипептид (например, белок или пептид микроорганизма или растения), дрожжевой экстракт, компонент из дрожжевого экстракта или любая комбинация двух или более из перечисленных источников углерода. В некоторых вариантах реализации, клетки культивируют в условиях с ограничением количества глюкозы.
[0527] В некоторых вариантах реализации, в настоящем описании предусмотрены клетки в культуре с ограниченным содержанием кислорода, которые содержат гетерологичную нуклеиновую кислоту, кодирующую полипептид изопренсинтазы. В некоторых вариантах реализации, культура с ограниченным содержанием кислорода является анаэробной. В некоторых вариантах реализации, указанные клетки содержат гетерологичную нуклеиновую кислоту, которая (i) кодирует полипептид изопренсинтазы и (ii) функционально связана с промотором. В некоторых вариантах реализации, клетки культивируют в культуральной среде, которая содержит источник углерода, такой как, но не ограниченный перечисленными, углевод, глицерол, глицерин, дигидроксиацетон, одноуглеродный источник углерода, масло, животный жир, животное масло, жирная кислота, липид, фосфолипид, глицеролипид, моноглицерид, диглицерид, триглицерид, возобновляемый источник углерода, полипептид (например, белок или пептид микроорганизма или растения), дрожжевой экстракт, компонент из дрожжевого экстракта или любая комбинация двух или более из перечисленных источников углерода. В некоторых вариантах реализации, клетки культивируют в условиях с ограничением количества глюкозы.
[0528] В одном аспекте, в настоящем описании предусмотрены способы совместной продукции изопрена с другим соединением, такие как способы с применением любой из клеток, описанных в данной заявке, для совместной продукции изопрена и водорода. В некоторых вариантах реализации, указанный способ включает культивирование клеток при условиях с ограниченным содержанием кислорода, достаточных для продукции более чем приблизительно 400 нмоль изопрена/гсмк/ч и более чем приблизительно 125 нмоль водорода/гсмк/ч. В некоторых вариантах реализации, культура с ограниченным содержанием кислорода является анаэробной. В некоторых вариантах реализации, указанный способ также включает получение изопрена и водорода, продуцированных клетками. В некоторых вариантах реализации, указанный способ дополнительно включает очистку изопрена и водорода, продуцированных клетками. В некоторых вариантах реализации, указанный способ включает полимеризацию изопрена, В некоторых вариантах реализации, указанные клетки содержат гетерологичную нуклеиновую кислоту, которая (i) кодирует полипептид изопренсинтазы и (ii) функционально связана с промотором. В некоторых вариантах реализации, клетки культивируют в культуральной среде, которая содержит источник углерода, такой как, но не ограниченный перечисленными, углевод, глицерол, глицерин, дигидроксиацетон, одноуглеродный источник углерода, масло, животный жир, животное масло, жирная кислота, липид, фосфолипид, глицеролипид, моноглицерид, диглицерид, триглицерид, возобновляемый источник углерода, полипептид (например, белок или пептид микроорганизма или растения), дрожжевой экстракт, компонент из дрожжевого экстракта или любая комбинация двух или более из перечисленных источников углерода. В некоторых вариантах реализации, клетки культивируют в условиях с ограничением количества глюкозы. В различных вариантах реализации, количество продуцированного изопрена (например, общее количество продуцированного изопрена или количество изопрена, продуцированного на литр бульона в час на ОП600) во время стационарной фазы больше или приблизительно в 2 или более раз выше, чем количество изопрена, продуцированного во время фазы роста на протяжении того же периода времени.
[0529] В некоторых вариантах реализации, указанный способ включает культивирование клеток при условиях с ограниченным содержанием кислорода, достаточных для превращения более чем приблизительно 0,002% углерода (моль/моль) в культуральной среде в изопрен и для продукции водорода, эквивалентно более чем приблизительно 0,024 молярного процента углерода в культуральной среде. В некоторых вариантах реализации, культура с ограниченным содержанием кислорода является анаэробной. В некоторых вариантах реализации, способ также включает получение изопрена и водорода, продуцированных клетками. В некоторых вариантах реализации, способ дополнительно включает очистку изопрена и водорода, продуцированных клетками. В некоторых вариантах реализации, способ включает полимеризацию изопрена. В некоторых вариантах реализации, указанные клетки содержат гетерологичную нуклеиновую кислоту, которая (i) кодирует полипептид изопренсинтазы и (ii) функционально связана с промотором. В некоторых вариантах реализации, клетки культивируют в культуральной среде, которая содержит источник углерода, такой как, но не ограниченный перечисленными, углевод, глицерол, глицерин, дигидроксиацетон, одноуглеродный источник углерода, масло, животный жир, животное масло, жирная кислота, липид, фосфолипид, глицеролипид, моноглицерид, диглицерид, триглицерид, возобновляемый источник углерода, полипептид (например, белок или пептид микроорганизма или растения), дрожжевой экстракт, компонент из дрожжевого экстракта или любая комбинация двух или более из перечисленных источников углерода.
[0530] В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, источник углерода микробный полипептид включает один или более полипептидов из дрожжей или бактерий. В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, источник углерода полипептид растения включает один или более полипептидов из сои, кукурузы, канолы, ятрофы, пальмы, арахиса, подсолнуха, кокосового ореха, горчицы, семени рапса, хлопка, ядра кокосового ореха, оливы, сафлора, кунжута или льняного семени.
[0531] В некоторых вариантах реализации, изопрен и водород продуцируются вместе только в стационарной фазе. В некоторых вариантах реализации, изопрен и водород продуцируются вместе как в фазе роста, так и в стационарной фазе. В различных вариантах реализации, количество продуцированного изопрена (например, общее количество продуцированного изопрена или количество изопрена, продуцированного на литр бульона в час на ОП600) во время стационарной фазы больше или приблизительно в 2, 3, 4, 5, 10, 20, 30, 40, 50 или большее число раз превышает количество изопрена, продуцированного во время фазы роста на протяжении того же периода времени. В различных вариантах реализации, количество продуцированного водорода (например, общее количество продуцированного водорода или количество водорода, продуцированного на литр бульона в час на ОП600) во время стационарной фазы больше или приблизительно в 2, 3, 4, 5, 10, 20, 30, 40, 50 или большее число раз превышает количество водорода, продуцированного во время фазы роста на протяжении того же периода времени.
[0532] В некоторых вариантах реализации, композиции, предусмотренные в настоящем описании, содержат водород и больше или приблизительно 99,90, 99,92, 99,94, 99,96, 99,98 или 100% масс.изопрена по отношению к общей массе всех С5-углеводородов в указанной композиции. В некоторых вариантах реализации, композиция содержит меньше или приблизительно 0,12, 0,10, 0,08, 0,06, 0,04, 0,02, 0,01, 0,005, 0,001, 0,0005, 0,0001, 0,00005 или 0,00001% масс.С5-углеводородов, отличных от изопрена (таких, как 1,3-циклопентадиен, цис-1,3-пентадиен, транс-1,3-пентадиен, 1,4-пентадиен, 1-пентин, 2-пентин, 1-пентен, 2-метил-1-бутен, 3-метил-1-бутин, пент-4-ен-1-ин, транс-пент-3-ен-1-ин или цис-пент-3-ен-1-ин), по отношению к общей массе всех С5-углеводородов в указанной композиции. В некоторых вариантах реализации, композиция содержит меньше или приблизительно 0,12, 0,10, 0,08, 0,06, 0,04, 0,02, 0,01, 0,005. 0,001, 0,0005, 0,0001, 0,00005 или 0,00001% масс.1,3-циклопентадиена, цис-1,3-пентадиена. транс-1,3-пентадиена, 1,4-пентадиена, 1-пентина, 2-пентина, 1-пентена, 2-метил-1-бутена, 3-метил-1-бутина, пент-4-ен-1-ина, транс-пент-3-ен-1-ина или цис-пент-3-ен-1-ина, по отношению к общей массе всех С5-углеводородов в указанной композиции. В особых вариантах реализации, композиция содержит более чем приблизительно 2 мг изопрена и больше или приблизительно 99,90, 99,92, 99,94, 99,96, 99,98 или 100% масс.изопрена, по отношению к общей массе всех С5-углеводородов в указанной композиции. В некоторых вариантах реализации, композиция содержит меньше или приблизительно 50, 40, 30, 20, 10, 5, 1, 0,5, 0,1, 0,05, 0,01 или 0,005 мкг/л соединения, которое ингибирует полимеризацию изопрена, для любого соединения в указанной композиции, которое ингибирует полимеризацию изопрена. В особых вариантах реализации, композиция также содержит более чем приблизительно 2 мг изопрена и более чем приблизительно 0,48 мг водорода.
[0533] В некоторых вариантах реализации, летучая органическая фракция газообразной фазы содержит меньше или приблизительно 50, 40, 30, 20, 10, 5, 1. 0,5, 0,1, 0,05, 0,01 или 0,005 мкг/л соединения, которое ингибирует полимеризацию изопрена, для любого соединения в летучей органической фракции газообразной фазы, которое ингибирует полимеризацию изопрена. В особых вариантах реализации, летучая органическая фракция газообразной фазы также содержит более чем приблизительно 2 мг изопрена и более чем приблизительно 0,48 мг водорода.
[0534] В некоторых вариантах реализации, системы включают любую из клеток и/или композиций, описанных в данной заявке. В некоторых вариантах реализации, указанная система включает реактор, который представляет собой камеру. содержащую клетки в культуре с ограниченным содержанием кислорода, которые продуцируют более чем приблизительно 400, 500, 600, 700, 800, 900, 1000, 1250, 1500, 1750, 2000, 2500, 3000, 4000, 5000 или более нмоль изопрена/гсмк/ч и более чем приблизительно 125, 250, 500, 750, 1000, 1250, 1500, 1750, 2000, 2500, 3000, 4000, 5000, 7500, 10000 или более нмоль водорода/гсмк/ч. В некоторых вариантах реализации, указанная система не является замкнутой системой. В некоторых вариантах реализации, по меньшей мере часть изопрена удаляют из системы. В некоторых вариантах реализации, указанная система включает газообразную фазу, содержащую изопрен и водород. В различных вариантах реализации, газообразная фаза содержит любую из композиций, описанных в данной заявке.
[0535] В одном аспекте, в настоящем описании охарактеризован продукт, полученный с помощью любых композиций или способов, описанных в данной заявке.
Жизнеспособность клеток при высоком титре изопрена
[0536] Изопрен представляет собой гидрофобную молекулу, секретируемую многими растениями, животными и микроорганизмами. Бактерии, такие как Bacillus, продуцируют изопрен на довольно низких уровнях. Тогда как существуют доказательства, подтверждающие, что растения секретируют изопрен для термической защиты, была предложена гипотеза, состоящая в том, что изопрен может оказывать антагонистическое действие на цианобактерии или грибы, или действовать как противомикробный агент.См., например, Ladygina и др.. Process Biochemistry 41:1001-1014 (2006), которая полностью включена посредством ссылки, особенно в отношении антагонистического действия изопрена. Так как очень низкие уровни продукции, встречающиеся в природе, достаточны для проявления противомикробных свойств, вызывал глубокое беспокойство вопрос, не убьют ли микроорганизмов-хозяев титры и уровни производительности изопрена, необходимые для его коммерциализации.
[0537] Мы разработали способы получения титров и уровней производительности изопрена, необходимых для коммерциализации изопрена, при одновременном поддержании жизнеспособности и/или метаболической активности клеток, о чем свидетельствует скорость выделения диоксида углерода или общая скорость выделения диоксида углерода.
[0538] В настоящем описании предусмотрены способы получения изопрена, включающие: а) культивирование клеток при условиях, подходящих для продукции изопрена; и b) получение изопрена, при котором клетки продуцируют более чем приблизительно 400 нмоль изопрена/гсмк/час, и скорость выделения клетками диоксида углерода составляет более чем приблизительно 1×10-18 ммоль/л/час.В некоторых вариантах реализации, изопрен получают в любой концентрации или количестве, описанном в разделе под заголовком "Типичное получение изопрена". В некоторых вариантах реализации, количество изопрена находится в любом из перечисленных далее диапазонов: приблизительно от 400 нмоль/гсмк/час до 1 моль/гсмк/час, от 400 нмоль/гсмк/час до 1 ммоль/гсмк/час, от 400 нмоль/гсмк/час до 40 ммоль/гсмк/час, от 400 нмоль/гсмк/час до 4 ммоль/гсмк/час, от 1 ммоль/гсмк/час до 1,5 ммоль/гсмк/час, от 1,5 ммоль/гсмк/час до 3 ммоль/гсмк/час, от 3 ммоль/гсмк/час до 5 ммоль/гсмк/час, от 5 ммоль/гсмк/час до 25 ммоль/гсмк/час, от 25 ммоль/гсмк/час до 100 ммоль/гсмк/час, от 100 ммоль/гсмк/час до 500 ммоль/гсмк/час или от 500 ммоль/гсмк/час до 1000 ммоль/гсмк/час.В некоторых вариантах реализации, количество изопрена приблизительно составляет 1 ммоль/гсмк/час, 1,5 ммоль/гсмк/час, 2 ммоль/гсмк/час, 3 ммоль/гсмк/час, 4 ммоль/гсмк/час или 5 ммоль/гсмк/час.В некоторых вариантах реализации, скорость выделения диоксида углерода находится в любом из перечисленных далее диапазонов: от приблизительно 1×10-18 ммоль/л/час до приблизительно 1 моль/л/час, от 1 ммоль/л/час до 1 моль/л/час, от 25 ммоль/л/час до 750 ммоль/л/час, от 25 ммоль/л/час до 75 ммоль/л/час, от 250 ммоль/л/час до 750 ммоль/л/час или от 450 ммоль/л/час до 550 ммоль/л/час.В некоторых вариантах реализации, скорость выделения диоксида углерода приблизительно равна 50 ммоль/л/час, 100 ммоль/л/час.150 ммоль/л/час, 200 ммоль/л/час, 250 ммоль/л/час, 300 ммоль/л/час, 350 ммоль/л/час, 400 ммоль/л/час, 450 ммоль/л/час или 500 ммоль/л/час.
[0539] В настоящем описании также предусмотрены способы получения изопрена, включающие: а) культивирование клеток при условиях, подходящих для продукции изопрена; и b) получение изопрена, при котором клетки продуцируют более чем приблизительно 400 нмоль изопрена/гсмк/час и жизнеспособность клеток уменьшается менее чем приблизительно в два раза. В некоторых вариантах реализации, изопрен получают в любой концентрации или количестве, описанном в разделе под заголовком "Типичное получение изопрена". В некоторых вариантах реализации, количество изопрена находится в любом из перечисленных далее диапазонов: приблизительно от 400 нмоль/гсмк/час до 1 моль/гсмк/час.от 400 нмоль/гсмк/час до 1 ммоль/гсмк/час, от 400 нмоль/гсмк/час до 40 ммоль/гсмк/час, от 400 нмоль/гсмк/час до 4 ммоль/гсмк/час, от 1 ммоль/гсмк/час до 1,5 ммоль/гсмк/час, от 1,5 ммоль/гсмк/час до 3 ммоль/гсмк/час, от 3 ммоль/гсмк/час до 5 ммоль/гсмк/час, от 5 ммоль/гсмк/час до 25 ммоль/гсмк/час, от 25 ммоль/гсмк/час до 100 ммоль/гсмк/час, от 100 ммоль/гсмк/час до 500 ммоль/гсмк/час или от 500 ммоль/гсмк/час до 1000 ммоль/гсмк/час.В некоторых вариантах реализации, количество изопрена приблизительно составляет 1 ммоль/гсмк/час, 1,5 ммоль/гсмк/час, 2 ммоль/гсмк/час, 3 ммоль/гсмк/час, 4 ммоль/гсмк/час или 5 ммоль/гсмк/час.В некоторых вариантах реализации, жизнеспособность клеток уменьшается в менее чем приблизительно 1,75 раз, 1,5 раза, 1,25 раз, 1 раз, 0,75 раз, 0,5 раза или 0,25 раз. В некоторых вариантах реализации, жизнеспособность клеток уменьшается приблизительно в 2 раза.
[0540] Дополнительно в настоящем описании предусмотрены способы получения изопрена, включающие: а) культивирование клеток при условиях, подходящих для продукции изопрена; и b) получение изопрена, при котором кумулятивная общая производительность изопрена, продуцированного клетками в культуре, составляет более чем приблизительно 0,2 мг/лбульона/час, и скорость выделения клетками диоксида углерода составляет более чем приблизительно 1×10-18 ммоль/л/час.В некоторых вариантах реализации, кумулятивная общая производительность в отношении изопрена представляет собой любую концентрацию или количество, описанное в разделе под заголовком "Типичное получение изопрена". В некоторых вариантах реализации, кумулятивная общая производительность изопрена находится в любом из перечисленных далее диапазонов: приблизительно от 0,2 мг/лбульона/час до 5 г/лбульона/час, от 0,2 мг/лбульона/час до 1 г/лбульона/час, от 1 г/лбульона/час до 2,5 г/лбульона/час, от 2,5 г/лбульона/час до 5 г/лбульона/час.В некоторых вариантах реализации, скорость выделения диоксида углерода находится в любом из перечисленных далее диапазонов: от приблизительно 1×10-18 ммоль/л/час до приблизительно 1 моль/л/час, от 1 ммоль/л/час до 1 моль/л/час, от 25 ммоль/л/час до 750 ммоль/л/час, от 25 ммоль/л/час до 75 ммоль/л/час, от 250 ммоль/л/час до 750 ммоль/л/час или от 450 ммоль/л/час до 550 ммоль/л/час.В некоторых вариантах реализации, скорость выделения диоксида углерода приблизительно равна 50 ммоль/л/час, 100 ммоль/л/час, 150 ммоль/л/час, 200 ммоль/л/час, 250 ммоль/л/час, 300 ммоль/л/час, 350 ммоль/л/час, 400 ммоль/л/час, 450 ммоль/л/час или 500 ммоль/л/час.
[0541] В настоящем описании предусмотрены способы получения изопрена, включающие: а) культивирование клеток при условиях, подходящих для продукции изопрена; и b) получение изопрена, при котором кумулятивная общая производительность изопрена, продуцированного клетками в культуре, составляет более чем приблизительно 0,2 мг/лбульона/час и жизнеспособность клеток уменьшается менее чем приблизительно в два раза. В некоторых вариантах реализации, кумулятивная общая производительность в отношении изопрена представляет собой любую концентрацию или количество, описанное в разделе под заголовком "Типичное получение изопрена". В некоторых вариантах реализации, кумулятивная общая производительность изопрена находится в любом из перечисленных далее диапазонов: приблизительно от 0,2 мг/лбульона/час до 5 г/лбульона/час, от 0,2 мг/лбульона/час до 1 г/лбульона/час, от 1 г/лбульона/час до 2,5 г/лбульона/час, от 2,5 г/лбульона/час до 5 г/лбульона/час.В некоторых вариантах реализации, жизнеспособность клеток уменьшается в менее чем приблизительно 1,75 раз, 1,5 раза, 1,25 раз, 1 раз, 0,75 раз, 0,5 раза или 0,25 раз.
[0542] В настоящем описании также предусмотрены способы получения изопрена, включающие: а) культивирование клеток при условиях, подходящих для продукции изопрена; и b) получение изопрена, при котором максимальная концентрация изопрена, продуцированного клетками в культуре, составляет более чем приблизительно 10 нг/лбульона, и скорость выделения клетками диоксида углерода составляет более чем приблизительно 1×10-18 ммоль/л/час. В некоторых вариантах реализации, максимальная концентрация изопрена представляет собой любую концентрацию или количество, описанное в разделе под заголовком "Типичное получение изопрена". В некоторых вариантах реализации, максимальная концентрация изопрена находится в любом из перечисленных далее диапазонов: приблизительно от 10 нг/лбульона до 500 нг/лбульона, от 500 нг/лбульона до 1 мкг/лбульона, от 1 мкг/лбульона до 5 мкг/лбульона, от 5 мкг/лбульона до 50 мкг/лбульона, от 5 мкг/лбульона до 100 мкг/лбульона, от 5 мкг/лбульона до 250 мкг/лбульона, от 250 мкг/лбульона до 500 мкг/лбульона, от 500 мкг/лбульона до 1 мг/лбульона, от 1 мг/лбульона до 50 мг/лбульона, от 1 мг/лбульона до 100 мг/лбульона, от 1 мг/лбульона до 200 мг/лбульона, от 10 нг/лбульона до 200 мг/лбульона, от 5 мкг/лбульона до 100 мг/лбульона или от 5 мкг/лбульона до 200 мг/лбульона. В некоторых вариантах реализации, максимальная концентрация представляет собой любую из концентраций, приблизительно равных 10 нг/лбульона, 100 нг/лбульона, 1 мкг/лбульона, 5 мкг/лбульона, 1 мг/лбульона, 30 мг/лбульона, 100 мг/лбульона или 200 мг/лбульона. В некоторых вариантах реализации, скорость выделения диоксида углерода находится в любом из перечисленных далее диапазонов: от приблизительно 1×10-18 ммоль/л/час до приблизительно 1 моль/л/час, от 1 ммоль/л/час до 1 моль/л/час, от 25 ммоль/л/час до 750 ммоль/л/час, от 25 ммоль/л/час до 75 ммоль/л/час, от 250 ммоль/л/час до 750 ммоль/л/час или от 450 ммоль/л/час до 550 ммоль/л/час. В некоторых вариантах реализации, скорость выделения диоксида углерода приблизительно равна 50 ммоль/л/час, 100 ммоль/л/час, 150 ммоль/л/час, 200 ммоль/л/час, 250 ммоль/л/час, 300 ммоль/л/час, 350 ммоль/л/час, 400 ммоль/л/час, 450 ммоль/л/час или 500 ммоль/л/час.
[0543] Вдобавок, в настоящем описании также предусмотрены способы получения изопрена, включающие: а) культивирование клеток при условиях, подходящих для продукции изопрена; и b) получение изопрена, при котором максимальная концентрация изопрена, продуцированного клетками в культуре, составляет более чем приблизительно 10 нг/лбульона, и жизнеспособность клеток уменьшается менее чем приблизительно в два раза. В некоторых вариантах реализации, максимальная концентрация изопрена представляет собой любую концентрацию или количество, описанное в разделе под заголовком "Типичное получение изопрена". В некоторых вариантах реализации, максимальная концентрация изопрена находится в любом из перечисленных далее диапазонов: приблизительно от 10 нг/лбульона до 500 нг/лбульона, от 500 нг/лбульона до 1 мкг/лбульона, от 1 мкг/лбульона до 5 мкг/лбульона, от 5 мкг/лбульона до 50 мкг/лбульона, от 5 мкг/лбульона до 100 мкг/лбульона, от 5 мкг/лбульона до 250 мкг/лбульона, от 250 мкг/лбульона до 500 мкг/лбульона. от 500 мкг/лбульона до 1 мг/лбульона, от 1 мг/лбульона до 50 мг/лбульона, от 1 мг/лбульона до 100 мг/лбульона, от 1 мг/лбульона до 200 мг/лбульона, от 10 нг/лбульона до 200 мг/лбульона, от 5 мкг/лбульона до 100 мг/лбульона или от 5 мкг/лбульона до 200 мг/лбульона В некоторых вариантах реализации, максимальная концентрация Представляет собой любую из Приблизительно 10 нг/лбульона, 100 нг/лбульона, 1 мкг/лбульона, 5 мкг/лбульона, 1 мг/лбульона, 30 мг/лбульона, 100 мг/лбульона или 200 мг/лбульона. В некоторых вариантах реализации, жизнеспособность клеток уменьшается в менее чем приблизительно 1,75 раз, 1,5 раза, 1,25 раз, 1 раз, 0,75 раз, 0,5 раза или 0,25 раз. В некоторых вариантах реализации, жизнеспособность клеток уменьшается приблизительно в 2 раза.
[0544] В настоящем описании также предусмотрены клетки в культуре, содержащие нуклеиновую кислоту, кодирующую полипептид изопренсинтазы, при этом указанные клетки продуцируют более чем приблизительно 400 нмоль изопрена/гсмк/час, и скорость выделения клетками диоксида углерода составляет более чем приблизительно 1×10-18 ммоль/л/час.В некоторых вариантах реализации, изопрен получают в любой концентрации или количестве, описанном в разделе под заголовком "Типичное получение изопрена". В некоторых вариантах реализации, количество изопрена находится в любом из перечисленных далее диапазонов: приблизительно от 400 нмоль/гсмк/час до 1 моль/гсмк/час, от 400 нмоль/гсмк/час до 1 ммоль/гсмк/час, от 400 нмоль/гсмк/час до 40 ммоль/гсмк/час, от 400 нмоль/гсмк/час до 4 ммоль/гсмк/час, от 1 ммоль/гсмк/час до 1,5 ммоль/гсмк/час, от 1,5 ммоль/гсмк/час до 3 ммоль/гсмк/час, от 3 ммоль/гсмк/час до 5 ммоль/гсмк/час, от 5 ммоль/гсмк/час до 25 ммоль/гсмк/час, от 25 ммоль/гсмк/час до 100 ммоль/гсмк/час, от 100 ммоль/гсмк/час до 500 ммоль/гсмк/час или от 500 ммоль/гсмк/час до 1000 ммоль/гсмк/час.В некоторых вариантах реализации, количество изопрена приблизительно составляет 1 ммоль/гсмк/час.1,5 ммоль/гсмк/час, 2 ммоль/гсмк/час, 3 ммоль/гсмк/час, 4 ммоль/гсмк/час или 5 ммоль/гсмк/час.В некоторых вариантах реализации, скорость выделения диоксида углерода находится в любом из перечисленных далее диапазонов: от приблизительно 1×10-18 ммоль/л/час до приблизительно 1 моль/л/час, от 1 ммоль/л/час до 1 моль/л/час, от 25 ммоль/л/час до 750 ммоль/л/час, от 25 ммоль/л/час до 75 ммоль/л/час, от 250 ммоль/л/час до 750 ммоль/л/час или от 450 ммоль/л/час до 550 ммоль/л/час.В некоторых вариантах реализации, скорость выделения диоксида углерода приблизительно равна 50 ммоль/л/час.100 ммоль/л/час, 150 ммоль/л/час, 200 ммоль/л/час, 250 ммоль/л/час, 300 ммоль/л/час, 350 ммоль/л/час, 400 ммоль/л/час, 450 ммоль/л/час или 500 ммоль/л/час.
[0545] В настоящем описании также предусмотрены клетки в культуре, содержащие нуклеиновую кислоту, кодирующую полипептид изопренсинтазы, при этом кумулятивная общая производительность изопрена, продуцированного клетками в культуре, составляет более чем приблизительно 0,2 мг/лбульона/час, и скорость выделения клетками диоксида углерода составляет более чем приблизительно 1×10-18ммоль/л/час.В некоторых вариантах реализации, кумулятивная общая производительность в отношении изопрена представляет собой любую концентрацию или количество, описанное в разделе под заголовком "Типичное получение изопрена". В некоторых вариантах реализации, кумулятивная общая производительность изопрена находится в любом из перечисленных далее диапазонов: приблизительно от 0,2 мг/лбульона/час до 5 г/лбульона/час, от 0,2 мг/лбульона/час до 1 г/лбульона/час, от 1 г/лбульона/час до 2,5 г/лбульона/час, от 2,5 г/лбульона/час до 5 г/лбульона/час.В некоторых вариантах реализации, скорость выделения диоксида углерода находится в любом из перечисленных далее диапазонов: от приблизительно 1×10-18 ммоль/л/час до приблизительно 1 моль/л/час, от 1 ммоль/л/час до 1 моль/л/час, от 25 ммоль/л/час до 750 ммоль/л/час, от 25 ммоль/л/час до 75 ммоль/л/час, от 250 ммоль/л/час до 750 ммоль/л/час или от 450 ммоль/л/час до 550 ммоль/л/час.В некоторых вариантах реализации, скорость выделения диоксида углерода приблизительно равна 50 ммоль/л/час, 100 ммоль/л/час, 150 ммоль/л/час, 200 ммоль/л/час, 250 ммоль/л/час, 300 ммоль/л/час, 350 ммоль/л/час, 400 ммоль/л/час, 450 ммоль/л/час или 500 ммоль/л/час.
[0546] Вдобавок, в настоящем описании предусмотрены клетки в культуре, содержащие нуклеиновую кислоту, кодирующую полипептид изопренсинтазы, при этом максимальная концентрация изопрена, продуцированного клетками в культуре, составляет более чем приблизительно 10 нг/лбульона, и скорость выделения клетками диоксида углерода составляет более чем приблизительно 1×10-18 ммоль/л/час. В некоторых вариантах реализации, максимальная концентрация изопрена представляет собой любую концентрацию или количество, описанное в разделе под заголовком "Типичное получение изопрена". В некоторых вариантах реализации, максимальная концентрация изопрена находится в любом из перечисленных далее диапазонов:
приблизительно от 10 нг/лбульона до 500 нг/лбульона. от 500 нг/лбульона до 1 мкг/лбульона, от 1 мкг/лбульона до 5 мкг/лбульона, от 5 мкг/лбульона до 50 мкг/лбульона, от 5 мкг/лбульона до 100 мкг/лбульона, от 5 мкг/лбульона до 250 мкг/лбульона, от 250 мкг/лбульона до 500 мкг/лбульона, от 500 мкг/лбульона до 1 мг/лбульона, от 1 мг/лбульона до 50 мг/лбульона, от 1 мг/лбульона до 100 мг/лбульона, от 1 мг/лбульона до 200 мг/лбульона, от 10 нг/лбульона до 200 мг/лбульона. от 5 мкг/лбульона до 100 мг/лбульона или от 5 мкг/лбульона до 200 мг/лбульона. В некоторых вариантах реализации, максимальная концентрация представляет собой любую из концентраций. Приблизительно равных 10 нг/лбульона, 100 нг/лбульона. 1 мкг/лбульона. 5 мкг/лбульона. 1 мг/лбульона, 30 мг/лбульона, 100 мг/лбульона или 200 мг/лбульона. В некоторых вариантах реализации, скорость выделения диоксида углерода находится в любом из перечисленных далее диапазонов: от приблизительно 1×10-18 ммоль/л/час до приблизительно 1 моль/л/час, от 1 ммоль/л/час до 1 моль/л/час, от 25 ммоль/л/час до 750 ммоль/л/час, от 25 ммоль/л/час до 75 ммоль/л/час, от 250 ммоль/л/час до 750 ммоль/л/час или от 450 ммоль/л/час до 550 ммоль/л/час.В некоторых вариантах реализации, скорость выделения диоксида углерода приблизительно равна 50 ммоль/л/час, 100 ммоль/л/час, 150 ммоль/л/час, 200 ммоль/л/час, 250 ммоль/л/час, 300 ммоль/л/час, 350 ммоль/л/час, 400 ммоль/л/час, 450 ммоль/л/час или 500 ммоль/л/час.
[0547] В некоторых вариантах реализации любых из способов и клеток, описанных в данной заявке, скорость выделения диоксида углерода и/или жизнеспособность клеток, экспрессирующих РНК и/или белок пути MVA и/или пути DXP с одной или несколькими гетерологичными и/или дополнительными копиями нуклеиновой кислоты пути MVA и/или пути DXP, сравнивают с контрольными клетками, в которых отсутствует одна или более гетерологичных и/или дополнительных копий нуклеиновой кислоты пути MVA и/или пути DXP. В некоторых вариантах реализации, скорость выделения диоксида углерода и/или жизнеспособность клеток, экспрессирующих РНК и/или белок пути MVA и/или пути DXP с одной или несколькими гетерологичными и/или дополнительными копиями нуклеиновой кислоты пути MVA и/или пути DXP под контролем индуцируемого промотора, при этом указанный промотор индуцирован, сравнивают с контрольными клетками, содержащими одну или более гетерологичных и/или дополнительных копий нуклеиновой кислоты пути MVA и/или пути DXP под контролем индуцируемого промотора, при этом указанный промотор не индуцирован (неиндуцированный). В некоторых вариантах реализации, индуцируемый промотор представляет собой промотор бета-галактозидазы.
[0548] В некоторых вариантах реализации, способы получения изопрена включают: а) культивирование клеток при условиях, подходящих для продукции изопрена; и b) получение изопрена, при котором клетки продуцируют более чем приблизительно 400 нмоль изопренаАсмк/час, и скорость выделения клетками диоксида углерода составляет более чем приблизительно 1×10-18 ммоль/л/час.Дополнительно в настоящем описании предусмотрены способы получения изопрена, включающие: а) культивирование клеток при условиях, подходящих для продукции изопрена; и b) получение изопрена, при котором кумулятивная общая производительность изопрена, продуцированного клетками в культуре, составляет более чем приблизительно 0,2 мг/лбульона/час, и скорость выделения клетками диоксида углерода составляет более чем приблизительно 1×10-18 ммоль/л/час.В настоящем описании также предусмотрены способы получения изопрена, включающие: а) культивирование клеток при условиях, подходящих для продукции изопрена; и b) получение изопрена, при котором максимальная концентрация изопрена, продуцированного клетками в культуре, составляет более чем приблизительно 10 нг/лбульона. и скорость выделения клетками диоксида углерода составляет более чем приблизительно 1×10-18 ммоль/л/час.В некоторых вариантах реализации любых из данных способов, скорость выделения диоксида углерода находится в любом из перечисленных далее диапазонов: от приблизительно 1×10-18ммоль/л/час до приблизительно 1 моль/л/час, от 1 ммоль/л/час до 1 моль/л/час, от 25 ммоль/л/час до 750 ммоль/л/час, от 25 ммоль/л/час до 75 ммоль/л/час, от 250 ммоль/л/час до 750 ммоль/л/час или от 450 ммоль/л/час до 550 ммоль/л/час.В некоторых вариантах реализации, скорость выделения диоксида углерода составляет приблизительно 50 ммоль/л/час или приблизительно 500 ммоль/л/час.
[0549] Дополнительно в настоящем описании предусмотрены клетки в культуре, содержащие нуклеиновую кислоту, кодирующую полипептид изопренсинтазы, при этом указанные клетки продуцируют более чем приблизительно 400 нмоль изопрена/Гсмх/час, и скорость выделения клетками диоксида углерода составляет более чем приблизительно 1×10-18 ммоль/л/час.В настоящем описании также предусмотрены клетки в культуре, содержащие нуклеиновую кислоту, кодирующую полипептид изопренсинтазы, при этом кумулятивная общая производительность изопрена, продуцированного клетками в культуре, составляет более чем приблизительно 0,2 мг/лбульона/час, и скорость выделения клетками диоксида углерода составляет более чем приблизительно 1×10-18 ммоль/л/час.Вдобавок, в настоящем описании предусмотрены клетки в культуре, содержащие нуклеиновую кислоту, кодирующую полипептид изопренсинтазы, при этом максимальная концентрация изопрена, продуцированного клетками в культуре, составляет более чем приблизительно 10 нг/лбульона, и скорость выделения клетками диоксида углерода составляет более чем приблизительно 1×10-18 ммоль/л/час.В некоторых вариантах реализации любых из данных клеток в культуре, скорость выделения диоксида углерода находится в любом из перечисленных далее диапазонов: от приблизительно 1×10-18 ммоль/л/час до приблизительно 1 моль/л/час, от 1 ммоль/л/час до 1 моль/л/час, от 25 ммоль/л/час до 750 ммоль/л/час, от 25 ммоль/л/час до 75 ммоль/л/час, от 250 ммоль/л/час до 750 ммоль/л/час или от 450 ммоль/л/час до 550 ммоль/л/час.В некоторых вариантах реализации, скорость выделения диоксида углерода составляет приблизительно 50 ммоль/л/час или приблизительно 500 ммоль/л/час.
[0550] В настоящем описании также предусмотрены способы получения изопрена, включающие а) культивирование клеток при условиях, подходящих для продукции изопрена; и b) получение изопрена, при котором концентрация изопрена в жидкой фазе меньше, чем приблизительно 200 мг/л, и указанные клетки продуцируют более чем приблизительно 400 нмоль изопрена/гсмк/час.В некоторых вариантах реализации, концентрация изопрена в жидкой фазе в культуре меньше, чем приблизительно любая из перечисленных концентраций: 175 мг/л, 150 мг/л, 125 мг/л, 100 мг/л, 75 мг/л, 50 мг/л, 25 мг/л, 20 мг/л, 15 мг/л, 10 мг/л, 5 мг/л или 2,5 мг/л. В некоторых вариантах реализации, концентрация изопрена в жидкой фазе в культуре находится в любом из перечисленных далее диапазонов: приблизительно от 0,1 мг/л до 200 мг/л, от 1 мг/л до 200 мг/л, от 1 мг/л до 150 мг/л, от 1 мг/л до 100 мг/л, от 1 мг/л до 50 мг/л, от 1 мг/л до 25 мг/л, от 1 мг/л до 20 мг/л или от 10 мг/л до 20 мг/л.
[0551] Также в настоящем описании предусмотрены способы получения соединения, при этом указанное соединение обладает одним или несколькими свойствами, выбранными из группы, состоящей из следующих свойств: (а) коэффициент закона Генри составляет менее чем приблизительно 250 моль/атм и (b) растворимость в воде составляет менее чем приблизительно 100 г/л. В некоторых вариантах реализации, способ включает: а) культивирование клеток при условиях, подходящих для получения указанного соединения, при этом газ добавляют (например, газ добавляют в систему, такую как ферментационная система) при скорости барботажа газа, равной от приблизительно 0,01 vvm до приблизительно 2 vvm; и b) получение указанного соединения. В некоторых вариантах реализации, коэффициент закона Генри указанного соединения составляет меньше, чем приблизительно 200 моль/атм, 150 моль/атм, 100 моль/атм, 75 моль/атм, 50 моль/атм, 25 моль/атм, 10 моль/атм, 5 моль/атм или 1 моль/атм. В некоторых вариантах реализации, растворимость в воде указанного соединения составляет меньше, чем приблизительно 75 г/л, 50 г/л, 25 г/л, 10 г/л, 5 г/л или 1 г/л. В некоторых вариантах реализации, соединение выбирают из группы, состоящей из изопрена, альдегида (например, ацетальдегида), кетона (например, ацетона или 2-бутанона), спирта (например, метанола, этанола, 1-бутанола или спиртов С5, таких как 3-метил-3-бутен-1-ол или 3-метил-2-бутен-1-ол), сложного эфира спирта (например, этилацетата или ацетиловых эфиров спиртов С5), гемитерпена, монотерпена, сесквитерпена и углеводородов с С1 по С5 (например, метана, этана, этилена или пропилена). В некоторых вариантах реализации, углеводороды с С1 по С5 являются насыщенными, ненасыщенными или разветвленными. В особых вариантах реализации, соединение представляет собой изопрен. В некоторых вариантах реализации способов получения любых из соединений, описанных выше, скорость барботажа газа находится в любом из перечисленных далее диапазонов: приблизительно от 0,1 vvm до 1 vvm, от 0,2 vvm до 1 vvm или от 0,5 vvm до 1 vvm.
[0552] В одном аспекте, клетки в культуре используют для получения изопрена. В некоторых вариантах реализации, указанные клетки в культуре продуцируют более чем приблизительно 400 нмоль изопрена/грамм клеток для сырой массы клеток/час (нмоль изопрена/гсмк/ч). В некоторых вариантах реализации, клетки содержат гетерологичную нуклеиновую кислоту, которая (i) кодирует полипептид изопренсинтазы и (ii) функционально связана с промотором. В некоторых вариантах реализации, клетки культивируют в культуральной среде, которая содержит источник углерода, такой как, но не ограниченный перечисленными, углевод, глицерол, глицерин, дигидроксиацетон, одноуглеродный источник углерода, масло, животный жир, животное масло, жирная кислота, липид, фосфолипид, глицеролипид, моноглицерид, диглицерид, триглицерид, возобновляемый источник углерода, полипептид (например, белок или пептид микроорганизма или растения), дрожжевой экстракт, компонент из дрожжевого экстракта или любая комбинация двух или более из перечисленных источников углерода. В некоторых вариантах реализации, клетки культивируют в условиях с ограничением количества глюкозы.
[0553] В некоторых вариантах реализации, указанные клетки в культуре превращают более чем приблизительно 0,002% углерода в культуральной среде в изопрен. В некоторых вариантах реализации, клетки содержат гетерологичную нуклеиновую кислоту, которая (i) кодирует полипептид изопренсинтазы и (ii) функционально связана с промотором. В некоторых вариантах реализации, клетки культивируют в культуральной среде, которая содержит источник углерода, такой как, но не ограниченный перечисленными, углевод, глицерол, глицерин, дигидроксиацетон, одноуглеродный источник углерода, масло, животный жир, животное масло, жирная кислота, липид, фосфолипид, глицеролипид, моноглицерид, диглицерид, триглицерид, возобновляемый источник углерода, полипептид (например, белок или пептид микроорганизма или растения), дрожжевой экстракт, компонент из дрожжевого экстракта или любая комбинация двух или более из перечисленных источников углерода. В некоторых вариантах реализации, клетки культивируют в условиях с ограничением количества глюкозы.
[0554] В некоторых вариантах реализации, указанные клетки в культуре содержат гетерологичную нуклеиновую кислоту, кодирующую полипептид изопренсинтазы. В некоторых вариантах реализации, клетки содержат гетерологичную нуклеиновую кислоту, которая (i) кодирует полипептид изопренсинтазы и (ii) функционально связана с промотором. В некоторых вариантах реализации, клетки культивируют в культуральной среде, которая содержит источник углерода, такой как, но не ограниченный перечисленными, углевод, глицерол, глицерин, дигидроксиацетон, одноуглеродный источник углерода, масло, животный жир, животное масло, жирная кислота, липид, фосфолипид, глицеролипид, моноглицерид, диглицерид, триглицерид, возобновляемый источник углерода, полипептид (например, белок или пептид микроорганизма или растения), дрожжевой экстракт, компонент из дрожжевого экстракта или любая комбинация двух или более из перечисленных источников углерода. В некоторых вариантах реализации, клетки культивируют в условиях с ограничением количества глюкозы.
[0555] В одном аспекте, в данной заявке описаны способы получения изопрена, такие как способы с применением любой из клеток, описанных в данной заявке, для получения изопрена. В некоторых вариантах реализации, указанный способ включает культивирование клеток при условиях, достаточных для продукции более чем приблизительно 400 нмоль изопрена/гсмк/ч. В некоторых вариантах реализации, способ также включает получение изопрена, продуцированного клетками. В некоторых вариантах реализации, способ включает очистку изопрена, продуцированного клетками. В некоторых вариантах реализации, способ включает полимеризацию изопрена. В некоторых вариантах реализации, указанные клетки содержат гетерологичную нуклеиновую кислоту, которая (i) кодирует полипептид изопренсинтазы и (ii) функционально связана с промотором. В некоторых вариантах реализации, клетки культивируют в культуральной среде, которая содержит источник углерода, такой как, но не ограниченный перечисленными, углевод, глицерол, глицерин, дигидроксиацетон, одноуглеродный источник углерода, масло, животный жир, животное масло, жирная кислота, липид, фосфолипид, глицеролипид, моноглицерид, диглицерид, триглицерид, возобновляемый источник углерода, полипептид (например, белок или пептид микроорганизма или растения), дрожжевой экстракт, компонент из дрожжевого экстракта или любая комбинация двух или более из перечисленных источников углерода. В некоторых вариантах реализации, клетки культивируют в условиях с ограничением количества глюкозы. В различных вариантах реализации, количество продуцированного изопрена (например, общее количество продуцированного изопрена или количество изопрена, продуцированного на литр бульона в час на ОП600) во время стационарной фазы больше или приблизительно в 2 или более раз выше, чем количество изопрена, продуцированного во время фазы роста на протяжении того же периода времени. В некоторых вариантах реализации, газообразная фаза содержит больше или приблизительно 9,5% (по объему) кислорода, и концентрация изопрена в газообразной фазе меньше, чем нижний предел воспламеняемости, или больше, чем верхний предел воспламеняемости. В особых вариантах реализации, (i) концентрация изопрена в газообразной фазе меньше, чем нижний предел воспламеняемости, или больше, чем верхний предел воспламеняемости, и (ii) клетки продуцируют более чем приблизительно 400 нмоль изопрена/гсмк/ч.
[0556] В некоторых вариантах реализации, указанный способ включает культивирование клеток при условиях, достаточных для превращения более чем приблизительно 0,002% углерода (моль/моль) в культуральной среде в изопрен. В некоторых вариантах реализации, способ также включает получение изопрена, продуцированного клетками. В некоторых вариантах реализации, способ включает очистку изопрена, продуцированного клетками. В некоторых вариантах реализации, способ включает полимеризацию изопрена. В некоторых вариантах реализации, указанные клетки содержат гетерологичную нуклеиновую кислоту, которая (i) кодирует полипептид изопренсинтазы и (п) функционально связана с промотором. В некоторых вариантах реализации, клетки культивируют в культуральной среде, которая содержит источник углерода, такой как, но не ограниченный перечисленными, углевод, глицерол, глицерин, дигидроксиацетон, одноуглеродный источник углерода, масло, животный жир, животное масло, жирная кислота, липид, фосфолипид, глицеролипид, моноглицерид, диглицерид, триглицерид, возобновляемый источник углерода, полипептид (например, белок или пептид микроорганизма или растения), дрожжевой экстракт, компонент из дрожжевого экстракта или любая комбинация двух или более из перечисленных источников углерода. В некоторых вариантах реализации, клетки культивируют в условиях с ограничением количества глюкозы.
[0557] В некоторых вариантах реализации, изопрен продуцируется только в стационарной фазе. В некоторых вариантах реализации, изопрен продуцируется как в фазе роста, так и в стационарной фазе. В различных вариантах реализации, количество продуцированного изопрена (например, общее количество продуцированного изопрена или количество изопрена, продуцированного на литр бульона в час на ОП600) во время стационарной фазы больше или приблизительно в 2, 3, 4, 5, 10, 20, 30, 40, 50 или большее число раз превышает количество изопрена, продуцированного во время фазы роста на протяжении того же периода времени.
[0558] В одном аспекте, в данной заявке описаны композиции и системы, которые включают изопрен. В некоторых вариантах реализации, указанная композиция содержит больше или приблизительно 2, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900 или 1000 мг изопрена. В некоторых вариантах реализации, композиция содержит больше или приблизительно 2, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 г изопрена (масс./масс.) в летучей органической фракции.
[0559] В некоторых вариантах реализации, композиция содержит больше или приблизительно 99,90, 99,92, 99,94, 99,96, 99,98 или 100% масс.изопрена по отношению к общей массе всех С5-углеводородов в указанной композиции. В некоторых вариантах реализации, композиция содержит меньше или приблизительно 0,12, 0,10, 0,08. 0,06. 0,04, 0,02. 0,01, 0,005, 0,001, 0,0005, 0,0001, 0,00005 или 0,00001% масс.С5-углеводородов, отличных от изопрена (таких, как 1,3-циклопентадиен, цис-1,3-пентадиен, транс-1,3-пентадиен, 1,4-пентадиен, 1-пентин, 2-пентин, 1-пентен. 2-метил-1-бутен, 3-метил-1-бутин, пент-4-ен-1-ин, транс-пент-3-ен-1-ин или цис-пент-3-ен-1-ин), по отношению к общей массе всех С5-углеводородов в указанной композиции. В некоторых вариантах реализации, композиция содержит меньше или приблизительно 0,12, 0,10, 0,08. 0,06, 0,04, 0,02. 0,01, 0,005, 0,001, 0,0005, 0,0001, 0,00005 или 0,00001% масс.1,3-циклопентадиена, цис-1,3-пентадиена, транс-1,3-пентадиена, 1,4-пентадиена, 1-пентина, 2-пентина, 1-пентена, 2-метил-1-бутена, 3-метил-1-бутана, пент-4-ен-1-ина, транс-пент-3-ен-1-ина или цис-пент-3-ен-1-ина по отношению к общей массе всех С5-углеводородов в указанной композиции. В особых вариантах реализации, композиция содержит более чем приблизительно 2 мг изопрена и содержит больше или приблизительно 99,90, 99,92, 99,94, 99,96, 99,98 или 100% масс.изопрена по отношению к общей массе всех С5-углеводородов в указанной композиции.
[0560] В некоторых вариантах реализации, композиция содержит меньше или приблизительно 50, 40, 30, 20, 10, 5, 1, 0,5, 0,1, 0,05, 0,01 или 0,005 мкг/л соединения, которое ингибирует полимеризацию изопрена, для любого соединения в указанной композиции, которое ингибирует полимеризацию изопрена. В особых вариантах реализации, композиция также содержит более чем приблизительно 2 мг изопрена.
[0561] В некоторых вариантах реализации, композиция содержит одно или более соединений, выбранных из группы, состоящей из этанола, ацетона, пренильных спиртов С5 и изопреноидных соединений с 10 или более атомами углерода. В некоторых вариантах реализации, композиция содержит больше или приблизительно 0,005, 0,01, 0,05, 0,1, 0,5, 1, 5, 10, 20, 30, 40, 60, 80, 100 или 120 мкг/л этанола, ацетона, пренильных спиртов С5 (таких как 3-метил-3-бутен-1-ол или 3-метил-2-бутен-1-ол) или любых из двух или более описанных соединений. В особых вариантах реализации, композиция содержит более чем приблизительно 2 мг изопрена и содержит одно или более соединений, выбранных из группы, состоящей из этанола, ацетона, пренильных спиртов С5 и изопреноидных соединений с 10 или более атомами углерода.
[0562] В некоторых вариантах реализации, композиция содержит изопрен и одно или более дополнительных соединений, выбранных из группы, состоящей из 2-гептанона, 6-метил-5-гептен-2-она, 2,4,5-триметилпиридина, 2,3,5-триметилпиразина, цитронеллаля, ацетальдегида, метантиола, метилацетата, 1-пропанола, диацетила, 2-бутанона, 2-метил-3-бутен-2-ола, этилацетата, 2-метил-1-пропанола, 3-метил-1-бутаналя, 3-метил-2-бутанона, 1-бутанола, 2-пентанона, 3-метил-1-бутанола, этилизобутирата, 3-метил-2-бутеналя, бутилацетата, 3-метилбутилацетата, 3-метил-3-бутен-1-ил ацетата, 3-метил-2-бутен-1-ил ацетата. 3-гексен-1-ола, 3-гексен-1-ил ацетата, лимонена, гераниола (транс-3,7-диметил-2,6-октадиен-1-ола), цитронеллола (3,7-диметил-6-октен-1-ола), (Е)-3,7-диметил-1,3,6-октатриена, (г)-3,7-диметил-1,3,6-октатриена и 2,3-циклогептенолпиридина. В различных вариантах реализации, количество одного из данных дополнительных компонентов по сравнению с количеством изопрена в единицах процента масс.(т.е., масса указанного компонента, деленная на массу изопрена, умноженная на 100) больше или приблизительно составляет 0,01, 0,02, 0,05, 0,1, 0,5, 1, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 или 110% (масс./масс.).
[0563] В некоторых вариантах реализации, композиция содержит (i) газообразную фазу, которая включает изопрен, и (ii) клетки в культуре, которые продуцируют более чем приблизительно 400 нмоль изопрена/гсмк/ч. В некоторых вариантах реализации, композиция содержит замкнутую систему, и газообразная фаза включает больше или приблизительно 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 мкг/л изопрена при нормировке на 1 мл культуры с ОП600, равной 1, культивированной в течение 1 часа. В некоторых вариантах реализации, композиция содержит открытую систему, и газообразная фаза включает больше или приблизительно 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 мкг/л изопрена, барботируемого со скоростью, равной 1 vvm. В некоторых вариантах реализации, летучая органическая фракция газообразной фазы включает больше или приблизительно 99,90, 99,92, 99,94, 99,96, 99,98 или 100% масс.изопрена по отношению к общей массе всех С5-углеводородов в летучей органической фракции. В некоторых вариантах реализации, летучая органическая фракция газообразной фазы включает меньше или приблизительно 0,12, 0,10, 0,08, 0,06, 0,04. 0,02. 0,01, 0,005, 0,001, 0,0005, 0,0001, 0,00005 или 0,00001% масс.С5-углеводородов, отличных от изопрена (таких, как 1,3-циклопентадиен, цис-1,3-пентадиен, транс-1,3-пентадиен, 1,4-пентадиен, 1-пентин, 2-пентин, 1-пентен, 2-метил-1-бутен, 3-метил-1-бутин, пент-4-ен-1-ин, транс-пент-3-ен-1-ин или цис-пент-3-ен-1-ин), по отношению к общей массе всех С5-углеводородов в летучей органической фракции. В некоторых вариантах реализации, летучая органическая фракция газообразной фазы содержит меньше или приблизительно 0,12, 0,10, 0,08, 0,06, 0,04, 0,02, 0,01, 0,005, 0,001, 0,0005, 0,0001, 0,00005 или 0,00001% масс.1,3-циклопентадиена, цис-1,3-пентадиена, транс-1,3-пентадиена, 1,4-пентадиена, 1-пентина, 2-пентина, 1-пентена, 2-метил-1-бутена, 3-метил-1-бутина, пент-4-ен-1-ина, транс-пент-3-ен-1-ина или цис-пент-3-ен-1-ина по отношению к общей массе всех С5-углеводородов в летучей органической фракции. В особых вариантах реализации, летучая органическая фракция газообразной фазы содержит более чем приблизительно 2 мг изопрена и содержит больше или приблизительно 99,90, 99,92, 99,94, 99,96. 99,98 или 100% масс.изопрена по отношению к общей массе всех С5-углеводородов в летучей органической фракции.
[0564] В некоторых вариантах реализации, летучая органическая фракция газообразной фазы содержит меньше или приблизительно 50, 40, 30, 20, 10, 5, 1, 0,5, 0,1, 0,05, 0,01 или 0,005 мкг/л соединения, которое ингибирует полимеризацию изопрена, для любого соединения в летучей органической фракции газообразной фазы, которое ингибирует полимеризацию изопрена. В особых вариантах реализации, летучая органическая фракция газообразной фазы также содержит более чем приблизительно 2 мг изопрена.
[0565] В некоторых вариантах реализации, летучая органическая фракция газообразной фазы содержит одно или более соединений, выбранных из группы, состоящей из этанола, ацетона, пренильных спиртов С5 и изопреноидных соединений с 10 или более атомами углерода. В некоторых вариантах реализации, летучая органическая фракция газообразной фазы содержит больше или приблизительно 0,005, 0,01, 0,05, 0,1, 0,5, 1, 5, 10, 20, 30, 40, 60, 80, 100 или 120 мкг/л этанола, ацетона, пренильных спиртов С5 (таких как 3-метил-3-бутен-1-ол или 3-метил-2-бутен-1-ол) или любых из двух или более из описанных соединений. В особых вариантах реализации, летучая органическая фракция газообразной фазы содержит более чем приблизительно 2 мг изопрена и содержит одно или более соединений, выбранных из группы, состоящей из этанола, ацетона, пренильных спиртов С5 и изопреноидных соединений с 10 или более атомами углерода.
[0566] В некоторых вариантах реализации, летучая органическая фракция газообразной фазы включает изопрен и одно или более дополнительных соединений, выбранных из группы, состоящей из 2-гептанона, 6-метил-5-гептен-2-она, 2,4,5-триметилпиридина, 2,3,5-триметилпиразина, цитронеллаля, ацетальдегида, метантиола, метилацетата, 1-пропанола, диацетила, 2-бутанона, 2-метил-3-бутен-2-ола, этилацетата. 2-метил-1-пропанола, 3-метил-1-бутаналя, 3-метил-2-бутанона, 1-бутанола, 2- пентанона, 3-метил-1-бутанола. этилизобутирата, 3-метил-2-бутеналя, бутилацетата, 3-метилбутилацетата, 3-метил-3-бутен-1-ил ацетата, 3-метил-2-бутен-1-ил ацетата, 3-гексен-1-ола, 3-гексен-1-ил ацетата, лимонена, гераниола (транс-3,7-диметил-2,б-октадиен-1-ола), цитронеллола (3,7-диметил-6-октен-1-ола), (Е)-3,7-диметил-1,3,6-октатриена, (г)-3,7-диметил-1,3,б-октатриена и 2,3-циклогептенолпиридина. В различных вариантах реализации, количество одного из данных дополнительных компонентов по сравнению с количеством изопрена в единицах процента масс.(т.е., масса указанного компонента, деленная на массу изопрена, умноженная на 100) больше или приблизительно составляет 0,01, 0,02, 0,05, 0,1. 0,5, 1, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 или 110% (масс./масс.) в летучей органической фракции газообразной фазы.
[0567] В некоторых вариантах реализации любой из композиций, описанных в данной заявке, по меньшей мере часть изопрена находится в газообразной фазе. В некоторых вариантах реализации, по меньшей мере часть изопрена находится в жидкой фазе (такой как конденсат). В некоторых вариантах реализации, по меньшей мере часть изопрена находится в твердой фазе. В некоторых вариантах реализации, по меньшей мере часть изопрена адсорбирована на твердой подложке, такой как подложка, которая содержит кремний и/или активированный уголь. В некоторых вариантах реализации, указанная композиция содержит этанол. В некоторых вариантах реализации, композиция содержит от приблизительно 75 до приблизительно 90% масс.этанола, например, в диапазоне от приблизительно 75 до приблизительно 80%, от приблизительно 80 до приблизительно 85% или от приблизительно 85 до приблизительно 90% масс.этанола. В некоторых вариантах реализации, композиция содержит от приблизительно 4 до приблизительно 15% масс.изопрена, например, в диапазоне от приблизительно 4 до приблизительно 8%, от приблизительно 8 до приблизительно 12% или от приблизительно 12 до приблизительно 15% масс.изопрена.
[0568] В некоторых вариантах реализации, системы включают любые из клеток и/или композиций, описанных в данной заявке. В некоторых вариантах реализации, указанная система включает реактор, который представляет собой камеру, содержащую клетки в культуре, которые продуцируют более чем приблизительно 400, 500, 600, 700, 800, 900, 1000, 1250, 1500, 1750, 2000, 2500, 3000, 4000, 5000 или более нмоль изопрена/гсмк/ч. В некоторых вариантах реализации, указанная система не является замкнутой системой. В некоторых вариантах реализации, по меньшей мере часть изопрена удаляют из системы. В некоторых вариантах реализации, указанная система включает газообразную фазу, содержащую изопрен. В различных вариантах реализации, газообразная фаза содержит любую из композиций, описанных в данной заявке.
[0569] В некоторых вариантах реализации любых из композиций, систем и способов, описанных в данной заявке, получают невоспламеняющуюся концентрацию изопрена в газообразной фазе. В некоторых вариантах реализации, газообразная фаза содержит менее чем приблизительно 9,5% (по объему) кислорода. В некоторых вариантах реализации, газообразная фаза содержит больше или приблизительно 9,5% (по объему) кислорода, и концентрация изопрена в газообразной фазе меньше, чем нижний предел воспламеняемости, или больше, чем верхний предел воспламеняемости. В некоторых вариантах реализации, часть газообразной фазы, отличная от изопрена, содержит от приблизительно 0% до приблизительно 100% (по объему) кислорода, например, в диапазоне от приблизительно 10% до приблизительно 100% (по объему) кислорода. В некоторых вариантах реализации, часть газообразной фазы, отличная от изопрена, содержит от приблизительно 0% до приблизительно 99% (по объему) азота. В некоторых вариантах реализации, часть газообразной фазы, отличная от изопрена, содержит от приблизительно 1% до приблизительно 50% (по объему) СО2.
[0570] В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, клетки в культуре продуцируют изопрен в количестве, равном больше или приблизительно 400, 500, 600, 700, 800, 900, 1000, 1250, 1500, 1750, 2000, 2500, 3000, 4000, 5000 или более нмоль изопрена/гсмк/ч. В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, клетки в культуре превращают больше или приблизительно 0,002, 0,005, 0,01, 0,02, 0,05, 0,1, 0,12, 0,14, 0,16, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0, 1,2, 1,4, 1,6% или более углерода в культуральной среде в изопрен. В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, клетки в культуре продуцируют изопрен в количестве, равном больше или приблизительно 1, 10, 25, 50, 100, 150, 200, 250, 300, 400, 500, 600, 700, 800, 900, 1000, 1250, 1500, 1750, 2000, 2500, 3000, 4000, 5000, 10000, 100000 или более нг изопрена/грамм клеток для сырой массы клеток/ч (нг/гсмк/ч). В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, клетки в культуре продуцируют кумулятивный титр (общее количество) изопрена в размере, большем или приблизительно равном 1, 10, 25, 50, 100, 150, 200, 250, 300, 400, 500, 600, 700, 800, 900, 1000, 1250, 1500, 1750, 2000, 2500, 3000, 4000, 5000, 10000, 50000, 100000 или более мг изопрена/л бульона (мг/лбульона. при этом объем бульона включает объем клеток и культуральной среды). Другие типичные скорости продукции изопрена и общие количества полученного изопрена описаны в настоящей заявке.
[0571] В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, клетки дополнительно содержат гетерологичную нуклеиновую кислоту, кодирующую полипептид EDI. В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, клетки дополнительно содержат вставленную копию эндогенной нуклеиновой кислоты, кодирующей полипептид IDI. В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, клетки дополнительно содержат гетерологичную нуклеиновую кислоту, кодирующую полипептид DXS. В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, клетки дополнительно содержат вставленную копию эндогенной нуклеиновой кислоты, кодирующей полипептид DXS. В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, клетки дополнительно содержат одну или более нуклеиновых кислот, кодирующих полипептид IDI и полипептид DXS. В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, одна нуклеиновая кислота кодирует полипептид изопренсинтазы, полипептид IDI и полипептид DXS. В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, один вектор кодирует полипептид изопренсинтазы, полипептид IDI и полипептид DXS. В некоторых вариантах реализации, указанный вектор включает селективный маркер, такой как нуклеиновая кислота, придающая устойчивость к антибиотику.
[0572] В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, гетерологичная нуклеиновая кислота изопренсинтазы функционально связана с промотором Т7, таким как промотор Т7, вставленный в умеренно- или многокопийную плазмиду. В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, гетерологичная нуклеиновая кислота изопренсинтазы функционально связана с промотором Тгс, таким как промотор Тгс, вставленный в умеренно- или многокопийную плазмиду. В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, гетерологичная нуклеиновая кислота изопренсинтазы функционально связана с промотором Lac. таким как промотор Lac, вставленный в низкокопийную плазмиду. В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, гетерологичная нуклеиновая кислота изопренсинтазы функционально связана с эндогенным промотором, таким как эндогенный промотор щелочной сериновой протеазы. В некоторых вариантах реализации, гетерологичная нуклеиновая кислота изопренсинтазы встраивается в хромосому клеток без селективного маркера.
[0573] В некоторых вариантах реализации, одну или более нуклеиновых кислот пути MVA, IDI, DXP или изопренсинтазы помещают под контроль промотора или фактора, который более активен в стационарной фазе, чем в фазе роста. Например, одну или более нуклеиновых кислот пути MVA, IDI, DXP или изопренсинтазы можно поместить под контроль сигма-фактора стационарной фазы, такого как RpoS. В некоторых вариантах реализации, одну или более нуклеиновых кислот пути MVA. IDI, DXP или изопренсинтазы помещают под контроль промотора, индуцируемого в стационарной фазе, такого как промотор, индуцируемый регулятором ответа, активным в стационарной фазе.
[0574] В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, по меньшей мере часть клеток сохраняет гетерологичную нуклеиновую кислоту изопренсинтазы на протяжении по меньшей мере или приблизительно 5, 10, 20, 40, 50, 60, 65 или более клеточных делений в непрерывной культуре (такой как непрерывная культура без разведения). В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, нуклеиновая кислота, которая включает нуклеиновую кислоту изопренсинтазы, IDI или DXS, также включает селективный маркер, такой как нуклеиновая кислота, придающая устойчивость к антибиотику.
[0575] В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, клетки дополнительно содержат гетерологичную нуклеиновую кислоту, кодирующую полипептид пути MVA (такой как полипептид пути MVA из Saccharomyces cerevisia или Enterococcus faecalis). В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, клетки дополнительно содержат вставленную копию эндогенной нуклеиновой кислоты, кодирующей полипептид пути MVA (такой как полипептид пути MVA из Saccharomyces cerevisia или Enterococcus faecalis). В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, клетки содержат нуклеиновую кислоту изопренсинтазы, DXS и пути MVA. В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, клетки содержат нуклеиновую кислоту изопренсинтазы, нуклеиновую кислоту DXS, нуклеиновую кислоту IDI и нуклеиновую кислоту пути MVA (вдобавок к нуклеиновой кислоте IDI).
[0576] В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, полипептид изопренсинтазы представляет собой полипептид из такого растения, как Pueraria (например, Pueraria montana или Pueraria lobata) или Populus (например, Populus tremuloides, Populus alba, Populus nigra, Populus trichocarpa или гибрид Populus alba x Populus tremuld),
[0577] В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, клетки представляют собой бактериальные клетки, такие как грамположительные бактериальные клетки (например, клетки Bacillus, такие как клетки Bacillus subtilis, или клетки Streptomyces, такие как клетки Streptomyces lividans, Streptomyces coelicolor или Streptomyces griseus). В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, клетки представляют собой грамотрицательные бактериальные клетки (например, клетки Escherichia, такие как клетки Escherichia coli, клетки Rhodopseudomonas sp., такие как клетки Rhodopseudomonas palustris, клетки Pseudomonas sp., такие как клетки Pseudomonas fluorescens или клетки Pseudomonas putida, или клетки Pantoea, такие как клетки Pantoea citrea). В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, клетки представляют собой грибковые клетки, такие как мицелиальные грибковые клетки (например, клетки Trichoderma, такие как клетки Trichoderma reesei, или клетки Aspergillus, такие как клетки Aspergillus oryzae и Aspergillus niger) или дрожжевые клетки (например, клетки Yarrowia, такие как клетки Yarrowia lipolytica, или клетки Sacchraomyces, такие как клетки Saccaromyces cerevisiae).
[0578] В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, источник углерода микробный полипептид включает один или более полипептидов из дрожжей или бактерий. В некоторых вариантах реализации любого из аспектов, описанных в данной заявке, источник углерода полипептид растения включает один или более полипептидов из сои, кукурузы, канолы, ятрофы, пальмы, арахиса, подсолнуха, кокосового ореха, горчицы, семени рапса, хлопка, ядра кокосового ореха, оливы, сафлора, кунжута или льняного семени.
Получение изопрена в анаэробных микроорганизмах с помощью газа для химического синтеза в качестве источника энергии
[0579] В некоторых вариантах реализации, биоизопреновуто композицию получают в анаэробных микроорганизмах, применяя газ для химического синтеза в качестве источника энергии, как описано в предварительных заявках на патент США с номерами 61/289,347 и 61/289,355, поданных декабря 22, 2009 г., описания которых полностью включены в данную заявку посредством ссылки.
[0580] Продукция изопрена из синте3-газа анаэробными организмами может обеспечить множество преимуществ над продукцией изопрена из сахара аэробными организмами. Во-первых, ниже дополнительно обсуждается, что максимальный теоретический выход массы изопрена может быть больше для анаэробных организмов. Во-вторых, анаэробные организмы не обладают избыточной восстанавливающей способностью в виде НАДФ-Н, которая должна превращаться в процессе роста клеток, способностью образовывать побочные продукты (такие как глицерин, молочная кислота или этанол) или окислять молекулярным кислородом. Без этой необходимости круговорота НАДФ-Н, анаэробные организмы могут вырабатывать большее количество энергии, иметь более низкую потребность в кислороде, более низкую теплоту ферментации и более низкие затраты на энергию, необходимую для запуска процесса. В-третьих, вследствие отсутствия кислорода в системе, анаэробные организмы могут обеспечивать большую концентрацию изопрена в выделяющемся газе, более низкую вероятность образования воспламеняющейся смеси изопрен-кислород, более легкое получение и более высокое качество изопрена. В-четвертьгх, анаэробные организмы легче растить, примененяя существующую инфраструктуру. такую как существующие растения, разработанные для получения биоэтанола.
[0581] Анаэробные организмы, полезные для получения изопрена, могут включать облигатные анаэробы, факультативные анаэробы и аэротолерантные анаэробы. Облигатные анаэробы могут представлять собой один или комбинацию анаэробных организмов, выбранных из группы, состоящей из: Clostridium ljungdahlii, Clostridium autoethanogenum, Eurobacterium limosum, Clostridium carboxydivorans, Peptostreptococcus productus и Butyribacterium methylotrophicum. Синте3-газ, полезный в качестве источника энергии для получения изопрена, можно получить из сырья с помощью множества процессов, включая риформинг метана, сжижение угля, совместное сжигание, ферментативные реакции, энзиматические реакции и газификацию биомассы.
Типичные способы очистки
[0582] В некоторых вариантах реализации, любой из способов, описанных в настоящем описании, дополнительно включает получение совместно продуцированных соединений. В некоторых вариантах реализации, любой из способов, описанных в настоящем описании, дополнительно включает получение изопрена. В некоторых вариантах реализации, любой из способов, описанных в настоящем описании, дополнительно включает получение водорода с помощью способов разделения, основанных на криогенных мембранно-адсорбционных матрицах.
[0583] Изопрен и водород, полученные с помощью композиций и способов, описанных в данной заявке, можно получить, применяя стандартные методики, такие как деаэрирование, улучшенное разделение с помощью мембран, фракционирование, адсорбция/десорбция, первапорация, термальная или вакуумная десорбция изопрена из твердой фазы или экстрагирование изопрена, иммобилизованного или абсорбированного на твердой фазе, с помощью растворителя (см., например, патенты США под номерами 4,703,007, 4,570,029, и 4.740,222 ("Recovery and Purification of Hydrogen from Refinery and Petrochemical Off-gas Streams"), каждый из перечисленных документов настоящим полностью включен посредством ссылки, особенно в отношении способов получения и очистки изопрена (патенты '007 и '029) и в отношении способов получения и очистки водорода (патент '222)). В особых вариантах реализации, для получения изопрена применяют экстрактивную перегонку со спиртом (таким как этанол, метанол, пропанол или комбинация перечисленных спиртов). В некоторых вариантах реализации, получение изопрена включает выделение изопрена в жидкой форме (такой как раствор изопрена в чистом виде или раствор изопрена в раствореителе). Деаэрирование включает удаление испарения изопрена из выделяющегося при ферментации потока газа в непрерывном режиме. Такого удаления можно добиться несколькими различными способами, включая, но не ограничиваясь перечисленными, адсорбцию на твердой фазе. разделение в жидкой фазе или прямую конденсацию (такую как конденсация под воздействием конденсационной спирали или вследствие повышения давления). В некоторых вариантах реализации, обогащение с помощью мембран разжиженного потока пара изопрена, температура которого превышает температуру конденсации пара, приводит к конденсации жидкого изопрена. В некоторых вариантах реализации, изопрен сжимают и конденсируют.
[0584] Получение изопрена может включать один этап или множество этапов, В некоторых вариантах реализации, удаление испарения изопрена из выделяющегося при ферментации газа и перевод изопрена в жидкую фазу осуществляют одновременно. Например, можно осуществить прямую конденсацию изопрена из потока выделяющегося газа с получением жидкости. В некоторых вариантах реализации, удаление испарения изопрена из выделяющегося при ферментации газа и перевод изопрена в жидкую фазу осуществляют последовательно. Например, изопрен можно адсорбировать на твердой фазе, а затем экстрагировать из твердой фазы с помощью растворителя.
[0585] Получение водорода может включать один этап или множество этапов. В некоторых вариантах реализации, удаление газообразного водорода из выделяющегося при ферментации газа и перевод водорода в жидкую фазу осуществляют одновременно. В некоторых вариантах реализации, удаление газообразного водорода из выделяющегося при ферментации газа и перевод водорода в жидкую фазу осуществляют последовательно. Например, водород можно адсорбировать на твердой фазе, а затем десорбировать с твердой фазы с помощью циклов давлений. В некоторых вариантах реализации, полученный газообразный водород концентрируют и сжимают.
[0586] В некоторых вариантах реализации, любой из способов, описанных в настоящей заявке, дополнительно включает очистку изопрена. Например, изопрен, полученный с помощью композиций и способов, описанных в данной заявке, можно очистить с помощью стандартных методик. Очистка относится к процессу, при котором изопрен отделяют от одного или нескольких компонентов, которые присутствуют при получении изопрена. В некоторых вариантах реализации, изопрен получают в виде по существу чистой жидкости. Примеры способов очистки включают (i) перегонку из раствора в жидком экстрагирующем агенте и (ii) хроматографию. В настоящем описании, "очищенный изопрен" означает изопрен, который отделили от одного или нескольких компонентов, которые присутствуют при получении изопрена. В некоторых вариантах реализации, изопрен составляет по меньшей мере приблизительно 20% масс.. в свободном от других компонентов, которые присутствуют при получении изопрена, виде. В различных вариантах реализации, изопрен имеет чистоту по меньшей мере или приблизительно 25%, 30%, 40%, 50%, 60%, 70%, 75%, 80%, 90%, 95% или 99% по массе. Чистоту можно проанализировать с помощью любого подходящего способа, например, с помощью колоночной хроматографии, анализа ВЭЖХ или анализа ГХ-МС.
[0587] В некоторых вариантах реализации, любой из способов, описанных в настоящем описании, дополнительно включает очистку водорода. Например, водород, полученный с помощью композиций и способов, описанных в данной заявке, можно очистить с помощью стандартных методик. Очистка относится к процессу, посредством которого водород отделяют от одного или нескольких компонентов, которые присутствуют при получении водорода. В некоторых вариантах реализации, водород получают в виде по существу чистого газа. В некоторых вариантах реализации, водород получают в виде по существу чистой жидкости. Примеры способов очистки включают (i) низкотемпературную конденсацию и (ii) адсорбцию на твердой матрице. В настоящем описании, "очищенный водород" означает водород, который отделили от одного или нескольких компонентов, которые присутствуют при получении водорода. В некоторых вариантах реализации, водород на по меньшей мере приблизительно 20% по массе свободен от других компонентов, которые присутствуют при получении водорода. В различных вариантах реализации, водород имеет чистоту на по меньшей мере или приблизительно 25%, 30%. 40%, 50%, 60%, 70%, 75%, 80%. 90%, 95% или 99% по массе. Чистоту можно проанализировать с помощью любого подходящего способа, например, с помощью колоночной хроматографии или анализа ГХ-МС.
[0588] В некоторых вариантах реализации, по меньшей мере часть газообразной фазы, оставшейся после одного или нескольких этапов отделения изопрена, используют повторно путем введения указанной газообразной фазы в систему культивирования клеток (такую как ферментатор) для получения изопрена.
[0589] Способы и устройство для очистки биоизопреновой композиции от выделяющегося при ферментации газа описано в предварительной заявке на патент США номер 61/88,142, поданной декабря 18, 2009 г., которая полностью включена в данную заявку посредством ссылки.
[0590] Биоизопреновая композиция из выделяющегося при ферментации газа может содержать биоизопрен с летучими примесями и примесями побочных биологических продуктов. В некоторых вариантах реализации, биоизопреновую композицию из выделяющегося при ферментации газа очищают, применяя способ, включающий: (а) приведение выделяющегося при ферментации газа в контакт с растворителем в первой колонке с получением: обогащенного изопреном раствора, содержащего растворитель, основную часть изопрена и основную часть примеси побочного биологического продукта; и пара, содержащего основную часть летучей примеси; (b) перемещение обогащенного изопреном раствора из первой колонки во вторую колонку; и (с) отделение изопрена из обогащенного изопреном раствора во второй колонке с получением: обедненного изопреном раствора, содержащего основную часть примеси побочного биологического продукта; и очищенной композиции изопрена.
[0591] На Фигуре 169 проиллюстрирован типичный способ и типичное устройство для очистки изопрена. Выделяющийся при ферментации газ, содержащий изопрен, можно получить из возобновляемых источников (например, источников углерода) с помощью любого способа, известного в данной области, например, описанного в предварительной заявке на патент США номер 61/187944, содержание которой настоящим включено посредством ссылки, особенно в отношении способов получения выделяющегося при ферментации газа, содержащего изопрен. Выделяющийся при ферментации газ, полученный в одном или нескольких отдельных ферментаторах 12 (например, в 1, 2, 3, 4, 5, 6, 7, 8 или более ферментаторах, соединенных последовательно и/или параллельно), можно направить в первую колонку 14. Ниже описано, что выделяющийся при ферментации газ можно направить через блок выделения 16 и/или сжать с помощью устройств сжатия, таких как компрессионная система 18. Дополнительно, температуру выделяющегося из ферментатора газа можно снизить в любой момент, например, чтобы получить конденсат или частичный конденсат перед приведением в контакт с растворителем (что может способствовать растворению одного или нескольких компонентов выделяющегося газа, таких как изопрен). Выделяющийся при ферментации газ можно привести в контакт (например, абсорбировать) с колонкой 14 с помощью растворителя (например, любого растворителя, описанного в данной заявке, такого как неполярный растворитель с высокой точкой кипения). Летучие примеси, обладающие меньшей склонностью к поглощению растворителем (особенно неполярными растворителями с высокой точкой кипения), отделяют от оставшейся смеси растворитель/выделяющийся при ферментации газ, что приводит к получению пара, содержащего основную часть летучих примесей (например, выходящих через отверстие 20), и обогащенного изопреном раствора, содержащего основную часть изопрена и основную часть примеси побочного биологического продукта (например, выходящего через отверстие 22). Растворитель возможно нагревают с помощью любых подходящих средств (например, с помощью пара) перед, одновременно и/или после взаимодействия с выделяющимся при ферментации газом, что может способствовать отделению летучей примеси от оставшегося раствора. Пар можно направить через колонку (в любом подходящем положении, например, рядом с впуском выделяющегося газа и/или на противоположном конце, откуда выходит летучая примесь, как показано на Фигуре 169), чтобы обеспечить фазу продувки паром, которая может способствовать удалению летучей примеси.
[0592] Обогащенный изопреном раствор, содержащий основную часть изопрена и основную часть примеси побочного биологического продукта, можно направить (например, через отверстие 22) во вторую колонку 24. Вторая колонка может быть отделена от первой колонки 14 (как показано на Фигуре 169) или может представлять собой часть единой колонки, содержащей как первую, так и вторую колонки (например, тандемная колонка, в которой растворитель входит в первую колонку в одном конце или рядом с ним и выходит из второй колонки на противоположном конце или рядом с ним). Изопрен можно отделить от обогащенного изопреном раствора во второй колонке с получением очищенной композиции изопрена (например, выходящей через отверстие 26) и обедненного изопреном раствора, содержащего основную часть примеси побочного биологического продукта (например, выходящего через отверстие 28). Обогащенный изопреном раствор можно нагреть с помощью любых подходящих средств (например, с помощью пара), что может способствовать отделению изопрена от оставшегося раствора. Пар можно направить через колонку (в любом подходящем положении, например, с противоположного конца от места входа обогащенного изопреном раствора и/или рядом с концом, из которого выходит обедненный изопреном раствор, как показано на Фигуре 169).
[0593] В настоящей заявке описано, что колонки могут быть обычными и могут иметь любой подходящий размер. Типичные типы колонок доступны для приобретения у производителей, включая Koch Modular Process Systems (Парамус, Нью-Джерси), Fluor Corporation (Ирвинг, Техас), Kuhni USA (Маунт Холли, Северная Каролина). Обычно, колонки разрабатывают таким образом, чтобы максимизировать контакт пар/жидкость, для достижения желательной эффективности. Этого можно добиться путем наполнения колонки либо набивочным материалом, либо тарелками, расположенными на равных расстояниях друг от друга вдоль всей колонки. Подходящие набивочные материалы включают как нерегулярные, так и структурированные типы материалов на основе металла, стекла, полимера и керамики. Типичные типы нерегулярных материалов включают кольца Рашига, кольца Палля, кольца А-РАК, седловидные насадки, Pro-Pak, Heli-Pak, керамические седловидные насадки и FLEXIRINGS®. Структурированные набивочные материалы включают материалы в виде проволочной сетки и перфорированной металлической тарелки. Производители, специализирующиеся в области набивочных материалов для колонок, включают ACS Separations & Mass-Transfer Products (Хьюстон, Техас), Johnson Bros. Metal Forming Co. (Беркли, Иллинойс) и Koch Glitsch, Inc. Knight Div. (Ист-Кантон, Огайо). Эффективность деаэраторной колонки выражается в единицах высоты теоретической тарелки и общего количества тарелок в колонке. Обычно, чем большее количество теоретических тарелок присутствует, тем большей эффективностью обладает колонка.
Лабораторные колонки можно приобрести у Асе Glass (Вайнленд, Нью-Джерси), Sigma-Aldrich (Сент-Луис, Миссури) и Chemglass (Вайнленд, Нью-Джерси). Подходящие типы стеклянных колонок включают колонки типа Vigreux, Snyder, Hemple и Perforated-plate. Колонки могут содержать набивочные материалы или элементы, разработанные для максимизирования контакта пар/жидкость. Лабораторный газоочистительный блок (часть # CG-1830-10) доступен для приобретения у Chemglass и состоит из набитой стеклянной колонки, резервуара для растворителя и рециркуляционного насоса для растворителя.
[0594] Очищенную композицию изопрена из второй колонки 24 (например, выходящую через отверстие 26) можно дополнительно очистить с помощью любых подходящих средств (например, путем применения дефлегматора 34 и/или адсорбционной системы 36, такой как кварцевая адсорбционная система). Кипение с обратным холодильником уменьшает количество композиции растворителя в изопреновом продукте. Обедненный изопреном раствор можно снова направить в первую колонку для повторного использования (например, как показано на Фигуре 169, через отверстие 30). Обедненный изопреном раствор можно очистить с помощью любых подходящих средств (например, путем экстрагирования жидкости жидкостью и/или с помощью адсорбционной системы 32, такой как кварцевая адсорбционная система) перед возвращением в первую колонку 14, чтобы уменьшить количество побочного биологического продукта. Дополнительно, температуру обедненного изопреном раствора можно снизить с помощью любых подходящих средств перед возвращением в первую колонку 14 (например, перед, одновременно и/или после возможной очистки раствора изопрена). На Фигуре 169 показан пример снижения температуры обедненного изопреном раствора, выходящего через отверстие 40, перед очисткой обедненного изопреном раствора (в данном случае, применяя для снижения температуры хладагент),
[0595] Пар, содержащий основную часть летучей примеси (например, пар, выходящий через отверстие 20 на Фигуре 169), может содержать незначительную часть изопрена (например, остаточный изопрен, не оставшийся в обогащенном изопреном растворе). Для использования остаточного изопрена, его можно снова собрать из пара, содержащего основную часть летучей примеси, с помощью любых подходящих средств (например, с помощью адсорбционной системы 38, такой как адсорбционная система с активированным углем), и, в некоторых случаях, как показано на Фигуре 169, можно объединить с очищенной композицией изопрена (например, перед, во время или после дополнительной очистки, например, с помощью адсорбционной системы, аналогичной системе 36). На Фигуре 169 также показано возможное улавливающее устройство 42 (например, термоокислитель и/или система улавливания СО2), способное уменьшать количество нежелательных компонентов, высвобождаемых из пара в атмосферу (например, СО2).
Типичные химические превращения изопрена
[0596] Несмотря на то, что на сегодняшний день изопрен используется в промышленности преимущественно для получения синтетического каучука, изопрен представляет собой реакционноспособный конъюгированный диен, и подвергается множеству химических превращений с образованием оксигенатов и более высокомолекулярных углеводородов. Например, комплексы палладия(О) (Pd(acac)2-Рh3Р и Рd(ОАс)2-Рh3Р) катализируют димеризацию и теломеризацию изопрена в спиртовых растворителях с образованием линейных димеров изопрена (например, 2,7-диметил-1,3,7-октатриена) и метоксидиметилоктадиенов (Zakharkin, L. I. и Babich, S. А. Russ. Chem. Bull. (1976), стр.1967-1968.) Adams, J. M. и Clapp, T. V. (Clay and Clay Minerals (1986), 34(3), 287-294) описали реакции изопрена над замещенными двухвалентными и трехвалентными переходными металлами монтмориллонитами (например, на Сr3+-монтмориллонитом) с образованием димеров изопрена и аддуктов с метанолом. Линейная димеризация изопрена, катализированная Ni(0)-аминофосфинитными системами, позволяет получить региоселективные линейные димеры в ориентации «хвост к хвосту», с последующей конкурентной реакцией циклодимеризации (Denis, Philippe; Croizy, Jean Francois; Mortreux, Andre; Petit, Francis, Journal of Molecular Catalysis (1991), 68(2), 159-75. Denis, Philippe; Jean, Andre; Croizy, Jean Francois; Mortreux, Andre; Petit, Francis, Journal of the American Chemical Society (1990), 112(3), 1292-4.) Новые хиральные аминофосфинитные лиганды, например, (+)-MeCH2CHMeCH(NH2)CH2OPPh2, исследовали в качестве гомогенных катализаторов для линейной димеризации изопрена, что позволило получить уровень конверсии, приблизительно равный 50% (Masotti, Henriette; Peiffer, Gilbert; Siv, Chhan; Courbis, Pierre; Sergent, Michelle; Phan Tan Luu, Roger, Bulletin des Societes Chimiques Beiges (1991). 100(1), 63-77.)
[0597] Термическая димеризация изопрена при 110-250 в присутствии динитрокрезола в качестве ингибитора полимеризации позволяет получить высокий выход димеров и малое количество полимера (патент США номер 4,973,787.)
Катализированная Ni димеризация изопрена позволяет получить диметил-1.5-циклооктадиеновую смесь, состоящую из 80% 1,5-диметил-1,5-циклооктадиена и 20% 1,б-диметил-1,5-циклооктадиена (Doppelt, Pascal; Baum, Thomas H.; Ricard, Louis, Inorganic Chemistry (1996), 35(5), 1286-91.) Изопрен превращают в диметилциклооктадиены в присутствии каталитического количества Cp*Ru(T|4-изопрен)С1 и AgOTf (Itoh, Kenji; Masuda, Katsuyuki; Fukahori, Takahiko; Nakano, Katsumasa; Aoki, Katsuyuki; Nagashima, Hideo, Organometalllcs (1994), 13(3), 1020-9). В JP59065026A (1984) описано получение 1,6-диметил-1,5-циклооктадиена путем циклической димеризации изопрена в присутствии катализаторов, включающих карбоксилаты Ре или р-дикетоновые соединения, алюминийорганические или магнийорганические соединения и 2,2'-дипиридиловые производные с электронодонорными группами. Диметилциклооктадиен получали путем циклодимеризации изопрена над 3-компонентными катализаторами, содержащими карбоксилаты Ni или Р-кетоны, алюминийорганические или магнийорганические соединения и содержащий заместители трифенилфосфит (JP58055434A, 1983). 1,5-диметил-1,5-циклооктадиен получали путем циклодимеризации изопрена при 100-300° в инертном органическом растворителе в присутствии гомогенного катализатора, содержащего соль Fe(3), алюминийорганическое соединение и активатор (SU615056A1, 1978), в присутствии гомогенного катализатора, содержащего ацетилацетонат Ni, триарилфосфит и пергидроалюмофенолен (SU493455A1, 1975), в присутствии катализатора, содержащего смесь карбоксилата Ni или карбоксилатных или хелатных соединений Ni и 1-гидрокси-3-карбонильных соединений, триалкилалюминия, диалкилмагния или активных магнийорганических соединений, полученных из конъюгированных диенов и Mg, триарилфосфитов и третичных аминов (JP48064049A, 1973), или в присутствии катализатора, состоящего из нафтената Ni, EtaAl и три-орто-крезилфосфата (Suga, К.; Watanabe, S.; Fujita, Т.; Shimada, Т., Israel Journal of Chemistry (1972), 10(1), 15-18). В патенте США номер 3,954,665 описана димеризация изопрена в присутствии продуктов реакции [(η3-C6H5)NiBr]2 или [M(NO)2X]2 (М=Fe, Со; Х=Сl,I,Вr) с карбонилами Fe, Co или Ni. В европейском патенте номер 2411(1981) описана циклодимеризация изопрена над Fe(NO)2Cl-6Hc(l,5-циклооктадиен)никелевым катализатором при температуре от -5 до +20°С получением 1-метил- и 2-метил-4-изопропенил-1-циклогексена и 1,4- и 2,4-диметил-4-винил-1-циклогексена. В патенте США номер 4,189.403 описано получение 1,5-диметил-1,5-циклооктадиена и 1,4-диметил-4-винил-1-циклогексена путем приведения изопрена в контакт со смешанным катализатором, состоящим из трис(содержащий заместители гидрокарбил)-фосфита, арсенита или антимонита и соединения металла(О) Группы VIII (например, ацетилацетоната Ni). Jackstell, R.; Grotevendt, A.; Michalik, D.; El Firdoussi, L.; Beller, M. J. Organometallic Chem. (2007) 692(21). В 4737-4744 цитируется применение палладий/карбеновых катализаторов для димеризации изопрена. Bowen, L.; Charemsuk, M.; Wass, D.F. Chem. Commun. (2007). В 2835-2837 описано применение катализатора хром-N,N-бис(диарилфосфино)амина для получения линейных и циклических тримеров изопрена.
[0598] Сообщали, что изопрен димеризовался в присутствии Ni-катализатора с получением цис-2-изопропенил-1-метилвинилциклобутана (Billups, W. E.; Cross, J. Н.; Smith, С.V., Journal of the American Chemical Society (1973), 95(10), 3438-9.) Олигомеризация изопрена [78-79-5], катализированная нафтенатом никеля и изопренмагнием в присутствии различных фосфитов в качестве доноров электронов, позволяла получить циклические димеры, содержащие диметилциклооктадиен [39881-79-3]; в частности 1,1,1-трис(гидроксиметил)пропанфосфит [39865-19-5] позволял избирательно получить триметилциклододекатриен [39881-80-6] (Suga, Kyoichi; Watanabe, Shoji; Fujita, Tsutomu; Shimada, Takashi, Journal of Applied Chemistry & Biotechnology (1973), 23(2), 131-8.) В W02006/051011 описано получение триметилциклододекатриена, применяемого в парфюмерных изделиях и душистых веществах, путем тримеризации изопрена в присутствии каталитической системы, содержащей Ni и/или Ti, одно или более металлоорганических соединений и соединение Группы VA, при этом реакцию осуществляли в растворителе, содержащем гидроксильные группы. У Ligabue, R. A.; Dupont, J.; de Souza, R. F., Alegre, R.S. J, Mol. Cat. A: Chem. (2001), 169(1-2), 11-17, описана селективная димеризация изопрена в шестичленные димеры с помощью нитрозилжелезного катализатора в ионной жидкости. У Huchette, D.; Nicole, J.; Petit, P., Tetrahedron Letters (1979), (12), 1035-8, описано электрохимическое получение нитрозилжелезного катализатора и последующее применение для димеризации изопрена в циклогексеновые димеры. У Zakharkin, L. I.; Zhigareva, G. G.; Pryanishnikov, A. P. Zhurnal Obshchei Khimii (1987), 57(11), 2551-6, описана циклоолигомеризация изопрена на комплексных никелевых и железных катализаторах.
[0599] Исходные композиции изопрена высокой степени чистоты, описанные в данной заявке, подвергают химическому превращению с помощью каталитических систем и условий реакции, описанных в цитированных источниках. Специалист в данной области может применять для исходных композиций изопрена другие катализаторы и условия реакции, известные в данной области, такие как катализаторы и условия реакции, применяемые для химических превращений 1,3-бутадиена.
Димеризация и тримеризация
[0600] В некоторых вариантах реализации, коммерчески предпочтительное количество исходного материала изопрена высокой степени чистоты подвергают каталитическому химическому превращению с получением димеров и тримеров. Каталитические системы определяют с помощью способов, известных в данной области. Предпочтительные катализаторы включают такие катализаторы, про которые известно, что они превращают изопрен в димеры и тримеры с высокой эффективностью. Примеры включают катализаторы на основе палладия, никеля, кобальта, железа и хрома.
[0601] В некоторых вариантах реализации, коммерчески предпочтительное количество исходного материала изопрена высокой степени чистоты подвергают термической или каталитической димеризации. Исходную композицию изопрена превращают в смесь димеров, которая содержит ненасыщенные 6- и 8-членные кольца, путем нагревания исходной композиции под давлением. В некоторых вариантах реализации, исходную композицию изопрена нагревают до температуры выше или приблизительно равной 100, 125, 150, 175, 200, 225 или 250°С под давлением. В некоторых вариантах реализации, исходную композицию изопрена нагревают в присутствии антиокислителя (например, 2,6-ди-трет-бутил-4-метилфенола), чтобы предотвратить опосредованную радикалами полимеризацию. В некоторых вариантах реализации, реакцию ускоряют с помощью одного или нескольких катализаторов, выбранных из катализаторов, известных в данной области для катализа циклической димеризации изопрена, например, с помощью катализаторов галогенидов нитрозилжелеза, описанных в патентах США 4,144,278, 4,181,707, 5,545,789 и европейском патенте ЕPO397266А2. Применение нитрозилжелезных катализаторов в ионных жидкостях описано у Ligabue и др. (2001) J. Mol. Catalysis A: Chemical, 169 (2), 11-17. Примеры катализаторов включают, но не ограничены перечисленными: Fe(NO)2Cl2 и Сr3+-монтмориллонит.В другом примере, исходную композицию изопрена превращают в циклические димеры С 10 (например, в смесь диметилциклооктадиенов), применяя рутениевый катализатор (Itoh, Kenji; Masuda, Katsuyuki; Fukahori, Takahiko; Nakano, Katsumasa; Aoki, Katsuyuki; Nagashima, Hideo, Organometallics (1994). 13(3), 1020-9.)
[0602] В конкретном варианте реализации, исходную композицию изопрена в жидком состоянии нагревают до температуры выше 100°С под давлением и в присутствии антиокислителя с получением смеси димеров, которая содержит 6- и 8-членные кольца, например, лимонен (1-метил-4-(проп-1-ен-2-ил)циклогекс-1-ен), 1-метил-5-(проп-1-ен-2-ил)циклогекс-1-ен, 1,4-диметил-4-винилциклогексен, 2,4-диметил-4-винилциклогексен, 1,5-диметилциклоокта-1,5-диен, 1,6-диметилциклоокта-1,5-диен. 2,6-диметил-1,3-циклооктадиен, 2,6-диметил-1,4-циклооктадиен, 3.7-диметил-1,5-циклооктадиен, 3,7-диметил-1,3-циклооктадиен, 3,б-диметил-1,3-циклооктадиен и другие 8-членные кольцевые димеры изопрена, описанные в Organometallics (1994), 13(3), 1020-9. Все стереоизомеры данных соединений включены в настоящее описание. Превращение изопрена в димеры лучше всего осуществить в отсутствии кислорода, чтобы избежать образования нежелательных продуктов реакции.
[0603] В некоторых вариантах реализации, коммерчески предпочтительное количество исходного материала изопрена высокой степени чистоты подвергают фотодимеризации с получением 4-членных кольцевых димеров. Исходную композицию изопрена превращают путем облучения светом в смесь, содержащую одно или более из перечисленных далее соединений: 1,2-ди(проп-1-ен-2-ил)циклобутан, 1,3-ди(проп-1-ен-2-ил)циклобутан, 1-метил-1-винил-3-(проп-1-ен-2-ил)циклобутан, 1-метил-1-винил-2-(проп-1-ен-2-ил)циклобутан, 1,3-диметил-1,3-дивинилциклобутан, 1,2-диметил-1,2-дивинилциклобутан и стереоизомеры перечисленных соединений. В некоторых вариантах реализации, исходный материал изопрена высокой степени чистоты димеризуют в присутствии катализатора (например, никелевого катализатора) или фотосенсибилизатора (например, бензофенона) с получением 4-членных кольцевых димеров, например, цис-2-изопропенил-1-метилвинилциклобутана, вдобавок к 6- и 8-членным кольцам [См. Hammond, J.S.; Turro, N.J.; Liu, R.S.H. (1963) "Mechanisms of Photochemical Reactions in Solution. XVI. Photosensitized Dimerization of Conjugated Dienes. J. Org. Chem., 28, 3297-3303.]
[0604] В некоторых вариантах реализации, коммерчески предпочтительное количество исходного материала изопрена высокой степени чистоты превращают в циклический тример в присутствии каталитической системы. В некоторых вариантах реализации, указанный циклический тример представляет собой триметилциклододекатриен. В некоторых вариантах реализации, указанная каталитическая система включает никелевый катализатор. В некоторых вариантах реализации, каталитическая система включает соединение титана. В некоторых вариантах реализации, каталитическая система включает никелевый катализатор и соединение титана. В некоторых вариантах реализации, каталитическая система включает одно или более металлоорганических соединений и соединение Группы VA. В некоторых вариантах реализации, каталитическое превращение осуществляют в растворителе, содержащем гидроксильную группу. В конкретном варианте реализации, исходную композицию изопрена превращают в триметилциклододекатриен в присутствии каталитической системы, включающей Ni и/или Ti, одно или более металлоорганических соединений и соединение Группы VA, при этом реакцию осуществляют в растворителе, содержащем гидроксильную группу.
[0605] В некоторых вариантах реализации, коммерчески предпочтительное количество исходного материала изопрена высокой степени чистоты подвергают термическому или каталитическому превращению в углеводороды в диапазоне от С7 до С14 путем обработки ненасыщенным углеводородом от С2 до С5. Углеводород от С2 до С5 может представлять собой алкен, диен или алкин. Например, в некоторых вариантах реализации, изопрен приводят в контакт с этиленом и подходящим катализатором с получением соединений С7. В другом варианте реализации, изопрен приводят в контакт с 1,3-бутадиеном с получением циклических углеводородов С9. Гидрирование этих углеводородов от С7 до С14 приводит к получению композиций, подходящих для применения в качестве реактивного топлива и другого авиационного топлива. В дополнительном варианте реализации, ненасыщенные углеводороды от С7 до С14, полученные из изопрена и одного или нескольких ненасыщенных углеводородов, подвергают дегидрированию с получением ароматических производных, подходящих для применения в качестве реактивного топлива и другого авиационного топлива, или в качестве сырья для смешивания для такого топлива.
[0606] В некоторых вариантах реализации, коммерчески предпочтительное количество исходного материала изопрена высокой степени чистоты превращают в смесь линейных димеров и триммеров, применяя каталитическую систему в спиртовых растворителях. Эта реакция также позволяет получить алкоксильные производные, если ее ведут в метаноле или этаноле. В некоторых вариантах реализации, указанная каталитическая система представляет собой каталитическую систему на основе палладия, например, систему ацетилацетонаттрифенилфосфин палладия или систему ацетаттрифенилфосфин палладия. В некоторых вариантах реализации, спиртовой растворитель представляет собой метанол, этанол или изопропиловый спирт.Природа продуктов зависит от используемого катализатора и растворителя. Например, при применении каталитической системы на основе палладия, например, Рd(асас)2-Рh3Р или Рd(ОАс)2-Рh3Р, в изопропиловом спиртовом растворителе, образуются линейные димеры изопрена, например, 2,7-диметил-1,3,7-октатриен и 2,7-диметил-2,4,6-октатриен. Если данную реакцию осуществляют в метаноле, образуются метоксидиметилоктадиены (например, 1-метокси-2,7-диметил-2,7-октадиен и 3-метокси-2,7-диметил-1,7-октадиен), вдобавок к линейным димерам изопрена, таким как диметилоктатриены. Некоторые реакции позволяют получить линейные тримеры изопрена, такие как α-фарнезен (3,7,11-триметил-1,3,6,10-додекатетраен), β-фарнезен (7,11-диметил-3-метилен-1,6,10-додекатриен) и другие позиционные изомеры (например, добавление единиц изопрена осуществляется от конфигураций «хвост к хвосту» до конфигураций «голова к голове»). В другом примере, изопрен превращают в линейные и циклические тримеры С 15, применяя катализатор хром-N,N-бис(диарилфосфино)амин (Bowen, L.; Charemsuk, M.; Wass, D.F. Chem. Commun. (2007) 2835-2837.)
Превращение в оксигенаты
[0607] В некоторых вариантах реализации, коммерчески предпочтительное количество исходного материала изопрена высокой степени чистоты превращают в топливные оксигенаты путем осуществления реакции с этанолом и другими спиртами в присутствии кислотного катализатора. В одном варианте реализации, указанный кислотный катализатор представляет собой серную кислоту. В другом варианте реализации, кислотный катализатор представляет собой твердофазную серную кислоту (например, Dowex Marathon®). Другие катализаторы включают как жидкие, так и твердофазные фторсульфоновые кислоты, например, трифторметансульфоновую кислоту и нафион-Н (DuPont). Также можно применять цеолитовые катализаторы, например, бета-цеолит, при условиях, аналогичных описанным у Hensel и др. [Hensen, К.; Mahaim, С.; Holderich, W.F„ Applied Catalysis A: General (1997) 140(2), 311-329.] для метоксилирования лимонена и аналогичных монотерпенов. В некоторых вариантах реализации, исходный материал изопрена высокой степени чистоты превращают в спирты и эфиры с помощью процесса гидроксилирования/этерификации или других реакций алкенов, известных в данной области, например, пероксидирования в эпоксиды с помощью перкислот, таких как перуксусная кислота и 3-хлорпербензойная кислота; и гидратации с получением спиртов и диолов с помощью: i) воды и кислотных катализаторов и ii) способов гидроборирования. Такие реакции описаны, например, у Michael В. Smith и Jerry March, Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, шестое издание, John Wiley & Sons, 2007. На Фигурах 3 и 4 показаны примеры спиртов и оксигенатов, которые можно получить из исходных композиций изопрена.
Частичное гидрирование
[0608] В некоторых вариантах реализации, коммерчески предпочтительное количество исходного материала изопрена высокой степени чистоты частично гидрируют в моноолефин (например, 2-метилбут-1-ен, 3-метилбут-1-ен и 2-метилбут-2-ен). В некоторых вариантах реализации, моноолефин подвергают димеризации или реакции с другими олефинами, применяя обычный углеводородный катионный катализ, например, который применяют для превращения изобутилена в изооктан. См., например, Н.М. Lybarger. Isoprene в Kirk-Othmer Encyclopedia of Chemical Technology, 4oe изд., Wiley, Нью-Йорк (1995), 14, 934-952. В некоторых предпочтительных вариантах реализации, исходный материал изопрена высокой степени чистоты представляет собой биоизопреновую композицию.
[0609] В некоторых вариантах реализации, коммерчески предпочтительное количество исходного материала изопрена высокой степени чистоты подвергают частичному гидрированию с получением моноолефинов (например, 2-метилбут-1-ен, 3-метилбут-1-ен и 2-метилбут-2-ен). В некоторых предпочтительных вариантах реализации, исходный материал изопрена высокой степени чистоты представляет собой биоизопреновую композицию. В некоторых вариантах реализации, частичное гидрирование исходного материала изопрена позволяет получить высокий выход моноолефинов с минимальным превращением в изопентан и низкими остаточными уровнями изопрена. В некоторых вариантах реализации, получают смесь моноолефина и изопентана, с низкими остаточными уровнями изопрена. В некоторых вариантах реализации, частичное гидрирование представляет собой избирательное гидрирование, при котором предпочтительно получают определенный моноолефин, такой как 2-метилбут-2-ен, 2-метилбут-1-ен или 3-метилбут-1-ен. Предпочтительные катализаторы гидрирования проявляют высокую каталитическую активность, сохраняют каталитическую активность с течением времени и являются высокоселективными по отношению к превращению изопрена в моноолефины.
[0610] Подходящие катализаторы для частичного гидрирования исходной композиции изопрена могут включать металл платиновой группы, такой как платина, палладий, родий, или рутений, или переходный металл, такой как никель, кобальт, медь, железо, молибден, или благородный металл, такой как серебро или золото в элементной форме, или соль или комплекс с органическими и неорганическими лигандами. В некоторых случаях также можно применять сплавы данных металлов. Данные металлы и их производные могут быть чистыми или смешанными с другими активными и инертными материалами. Катализаторы могут быть адсорбированы на материале подложки (таком как активированный уголь, окись алюминия или кремния), чтобы максимизировать эффективную площадь поверхности. Известно, что физическая структура катализаторов гидрирования оказывает значительное влияние на их эффективность. Предпочтительные катализаторы гидрирования включают гетерогенные палладиевые катализаторы, такие как палладий на углероде (Pd/C), палладий на окиси алюминия (Рd/Al2O3) или палладий на кремнии (Pd/SiO2), со степенями чистоты в диапазоне от 0,1% Pd до 20% Pd (масс./масс.) по сравнению с материалом подложки. Пример подходящего избирательного катализатора гидрирования представляет собой LD 2773, толерантный в отношении серы модифицированный Pd на окиси алюминия (Axens, Рюэй-Мальмезон, Франция). Катализаторы частичного гидрирования, которые позволяют превращение изопрена в изоамилены с минимальным превращением в изопентан, включают катализатор Линдлара (Pd/BaSO4, обработанный хинолином), Pd/C, обработанный трифенильным производным элемента группы 15 (N, P, As), Pd/C, обработанный серасодержащим соединением, сульфид молибдена и сплавы Pd/Fe. Один предпочтительный катализатор включает палладий, адсорбированный на окиси алюминия типа яичной скорлупы (5-А120з). Катализаторы, применяемые в перерабатывающей промышленности для удаления диолефинов и алкинов из пиробензина, являются особенно предпочтительными, например, катализаторы на основе Ni/Al2O3 и Pd/Al2O3. Другой подходящий класс катализаторов для превращения изопрена в изоамилены представляет собой класс катализаторов, применяемых в промышленности для гидрообработки пиробензина. См., например, патенты США с номерами 7,014,750 и 6,9949,686, и источники, цитированные в данных документах. Обычно, катализаторы, применяемые при гидрообработке пиролитического газа, позволяют избирательное превращение ацетиленов и диолефинов (например, изопрена и пипериленов) в моноолефины.
[0611] Источник водорода может представлять собой газообразный водород или источник водорода, включая, но не ограничиваясь перечисленными, газообразный водород (Н2), муравьиную кислоту, гидразин или изопропанол. Источник водорода может иметь либо химическое, либо биологическое происхождение. В некоторых вариантах реализации, водород, применяемый для гидрирования, образовался вместе с изопреном в процессе ферментации. Гидрирование можно осуществить при давлениях водорода в диапазоне от 0,5 атм. до 200 атм., или при более высоком давлении. Температура может лежать в диапазоне от 0°С до 200°С.
[0612] Ожидается, что продукты частичного гидрирования биоизопреновой композиции содержат некоторые примеси, изначально присутствующие в исходной композиции изопрена, и/или гидрированные производные указанных примесей, такие как ацетон, этанол, амиловый спирт, этилацетат, изоамилацетат, метилэтилкетон и другие насыщенные полярные примеси.
[0613] В некоторых вариантах реализации, исходную композицию изопрена подвергают частичному гидрированиию или избирательному гидрированию в присутствии палладиевого катализатора. Например, было показано, что палладиевые катализаторы, такие как Pd/СаСО3, Pd/BaSO4, Pd/C, палладиевая чернь, Pd/SiО3, Pd/ Al2O3 или Pd/SiO2, превращают изопрен в моноолефины с избирательностью, составляющей более чем 95%, по сравнению с полностью восстановленными алканами С5. Применение данных палладиевьгх катализаторов позволяет получить смесь моноолефиновых продуктов, при этом 5%Pd/CaCО3 обладает наибольшей избирательностью по отношению к 3-метилбут-1-ену, и 5% Pd/SiO2 обладает наибольшей избирательностью по отношению к 2-метилбут-2-ену (см. G.C. Bond и A.F. Rawle. J. Mol. Catalysis A: Chemical 109 (1996) 261-271.) Bond и Rawie также показали, что катализаторы палладий-золото и палладий-серебро (например, Pd-Au/SiO2 и Pd-Ag/SiO2) обладают высокой избирательностью по отношению к восстановлению изопрена до моноолефинов по сравнению с полностью восстановленными алканами С5. В некоторых вариантах реализации, комплексы дендримера полиамидоамина (РАМАМ) с палладием на кремниевой подложке применяют, чтобы избирательно катализировать восстановление циклических и ациклических диенов до смеси изомеров моноолефина. Избирательность по отношению к различным изомерам моноолефина зависела от конкретного лиганда РАМАМ, использованного в катализаторе (см. P.P. Zweni и Н. Alper. Adv. Synth. Catal. 348 (2006) 725-731). В некоторых вариантах реализации, восстановление изопрена до моноолефинов можно осуществить, применяя в качестве катализатора металл Группы VIB на подложке из неорганического материала (например, металла цеолита). Например, катализатор Мо/АЬОз применяли для избирательного восстановления 1,3-бутадиена в соответствующие моноолефины (см. US 6,235,954 В1). В некотором варианте реализации, изопрен можно восстановить до моноолефинов, применяя металлический катализатор из металла Группы VIII, модифицированный металлом из Групп IB, VIB, VIIB или цинком, чтобы уменьшить отравление катализатора (см. US 6,949,686 В2). В некоторых вариантах реализации, изопрен можно восстановить до моноолефинов, применяя монолитный слой катализатора, который может находиться в сотовой конфигурации. Материалы подложки катализатора для монолитного слоя катализатора могут включать металлы, такие как никель, платина, палладий, родий, рутений, серебро, железо, медь, кобальт, хром, иридий, олово, и их сплавы или смеси (см. US 7,014,750 В2). В некоторых вариантах реализации, изопрен можно восстановить до моноолефинов, применяя катализатор типа яичной скорлупы Pd/δ-Аl2О3, особенно если в реакции нет воды. Катализатор типа яичной скорлупы Pd/δ-Аl2О3 избирателен по отношению к моноолефинам по сравнению с полностью восстановленными алканами, и 2-метилбут-2-ен представляет собой термодинамически благоприятный изомер (см. J.-R. Chang и С.-Н. Cheng. Ind. Eng. Chem. Res. 36 (1997) 4094-4099).
[0614] Легкие олефины (С3-С6) легко можно димеризовать, применяя кислотные катализаторы, с получением высших олефинов (С6-С12), также известных как диматы. Например, в данной области хорошо известно превращение изобутилена (2-метилпропена) в изооктен с применением целого ряда кислотных катализаторов, включая серную, фосфорную и другие неорганические кислоты, сульфоновые кислоты, фторсульфоновые кислоты, цеолиты и кислотные смолы.
[0615] В некоторых вариантах реализации, исходную композицию изопрена подвергают частичному гидрированию или избирательному гидрированию с получением моноолефина, и полученный моноолефин подвергают димеризации или реакции с другими олефинами, применяя обычный углеводородный катионный катализ, например, который используют для превращения изобутилена в изооктан, например, применяя серную, фосфорную и другие неорганические кислоты, сульфоновые кислоты, фторсульфоновые кислоты, цеолиты и кислотные смолы. См., например, Н.М. Lybarger. Isoprene в Kirk-Othmer Encyclopedia of Chemical Technology, 4oe изд., Wiley, Нью-Йорк (1995), 14, 934-952. В некоторых предпочтительных вариантах реализации, исходный материал изопрена высокой степени чистоты представляет собой биоизопреновую композицию. Можно применять кислотный катализатор как в жидкой, так и в твердой форме. Кислотные смолы являются предпочтительными и включают Amberiyst 15, 35, ХЕ586, XN1010 (Rohm и Haas) и аналогичные кислотные ионообменные смолы. Кислотные молекулярные сита также являются предпочтительными катализаторами, включая кислотное молекулярное сито со средним размером пор, такое как ZSM-5, ферриерит, ZSM-22 и ZSM-23.
[0616] В некоторых вариантах реализации, исходную композицию изопрена подвергают частичному гидрированию или избирательному гидрированию с получением изоамиленов. В некоторых вариантах реализации, изоамилены димеризуют с получением диматов С 10, таких как изодецены. В некоторых вариантах реализации, изоамилены димеризуют с олефином, таким как пропилен, бутан или изобутен, с получением диматов С8-С10. В некоторых вариантах реализации, моноолефин подвергают димеризации, применяя катализатор из смолы (например, Amberiyst, Amberiyst 35, Amberiyst 15, Amberiyst XN1010, Amberiyst ХЕ586) с получением диизоамиленов. Было показано, что применение таких катализаторов из смолы минимизирует крекинг и последующие реакции олигомеризации, и при оптимальных условиях катализаторы из смолы обеспечивают избирательность по отношению к димерам, составляющую более чем 92%, при этом образуется менее 8% тримеров. См., например, М. Marchionna и др. Catalysis Today 65 (2001) 397-403. В некоторых вариантах реализации, моноолефин подвергают димеризации, применяя каталитический материал, содержащий кислотное мезопористое молекулярное сито, такое как мезопористое сито, заключенное в цеолитовую структуру, ZSM-5, ферриерит, ZSM-22 или ZSM-23. В конкретном варианте реализации, каталитический материал термически стабилен при высоких температурах (например, при по меньшей мере 900°С). В другом конкретном варианте реализации, моноолефин по существу свободен от многоненасыщенных углеводородов, таких как изопрен. Применение для димеризации каталитического материала, содержащего кислотное мезопористое молекулярное сито, может обеспечить избирательность по отношению к димерам в избытке, составляющем 80%. См., например, US 2007/0191662 А1. В некоторых вариантах реализации, моноолефин подвергают димеризации, применяя твердый кислотный катализатор (например, твердый катализатор из фосфорной кислоты, кислотные ионообменные смолы). Избирательность по отношению к димерам при применении твердого катализатора из фосфорной кислоты может составлять по меньшей мере 75%, по меньшей мере 85% или по меньшей мере 90%. См., например, US 2009/0099400 А1 и US 6.660,898 Bl.
[0617] Для эффективной димеризации иногда может требоваться присутствие полярного компонента(ов), такого как вода и кислородсодержащее соединение, в потоке поступающего материала. Примеры включают спирты, такие как метанол, этанол и трет-бутанол, простые эфиры, такие как метил-трет-бутиловый эфир (МТВЕ) и метил-трет-амиловый эфир (TAME), или сложный эфир, такой как ацетаты от С1 до С5. В некоторых вариантах реализации, изоамилены можно превратить в простые эфиры, такие как TAME, путем обработки спиртами в присутствии кислотного катализатора.
[0618] В некоторых вариантах реализации, димеры С10 моноолефинов, полученные с помощью любого из способов, описанных в настоящем описании, можно восстановить до полностью насыщенных алкилатов С10 (например, путем гидрирования). В конкретном варианте реализации, изопрен или моноолефин можно восстановить до алкилата, применяя катализатор, включающий кислотный компонент, такой как серная кислота, фторсульфоновая кислота, пергалогеноалкилсульфоновая кислота, ионная жидкость или смесь кислот Брэнстеда и кислот Льюиса, смешанный с полимерным компонентом, таким как полиакрилат (см. US 2010/0094072 А1).
[0619] В некоторых вариантах реализации, коммерчески предпочтительное количество исходного материала изопрена высокой степени чистоты подвергают олигомеризации в присутствии кислотных катализаторов с получением димеров, тримеров, высших олигомеров, ароматических продуктов и/или полимерных продуктов. Кинетический контроль реакции может позволить получение некоторых продуктов, например, низших олигомеров, хотя известно, что образование камеди и закоксовывание приводит к деактивации катализатора.
Типичные ненасыщенные производные изопрена
[0620] В некоторых вариантах реализации, композиции и системы для получения компонента топлива из изопрена дополнительно включают ненасыщенный углеводородный или оксигенатный интермедиат для химического превращения исходной композиции изопрена в компонент топлива. В некотором варианте реализации, ненасыщенный углеводородный интермедиат включает один или более ненасыщенных димеров изопрена, выбранных из группы, состоящей из 1,2-ди(проп-1- ен-2-ил)циклобутана, 1,3-ди(проп-1-ен-2-ил)циклобутана, 1-метил-1-винил-3-(проп-1-ен-2-ил)циклобугана, 1-метил-1-винил-2-(проп-1-ен-2-ил)циклобутана, 1,3-диметил-1,3-дивинилциклобутана, 1,2-диметил-1,2-дивинилциклобутана, 1-метил-4-(проп-1-ен- 2-ил)циклогекс-1-ена), 1-метил-5-(проп-1-ен-2-ил)циклогекс-1-ена, 1,4-диметил-4-винилциклогексена, 2,4-диметил-4-винилциклогексена, 1,5-диметилциклоокта-1,5-диена, 1,6-диметилциклоокта-1,5-диена, 1,4-диметил-4-винил-1-циклогексена, 2,4-диметил-4-винил-1-циклогексена, 2,7-диметил-1,3,7-октатриена, 2,7-диметил-2,4,6-октатриена, 2,6-диметил-1,3-циклооктадиена, 2,6-диметил-1,4-циклооктадиена, 3,7-диметил-1,5-циклооктадиена, 3,7-диметил-1,3-циклооктадиена и 3,6-диметил-1,3-циклооктадиена. В некоторых вариантах реализации, ненасыщенный углеводородный интермедиат включает один или более ненасыщенных тримеров, таких как а-фарнезен, Р-фарнезен, триметилциклододекатриены (например, 1,5,9-триметил-(1Д,5Е,9Д)-циклододекатриен и позиционные и геометрические изомеры указанных соединений) и триметилдодекатетраены и тому подобные соединения. В некоторых вариантах реализации, ненасыщенный оксигенатный интермедиат включает один или более ненасыщенных метиловых эфиров, таких как 1-метокси-2,7-диметил-2,7-октадиен и 3-метокси-2,7-диметил-1,7-октадиен и тому подобные эфиры. В некоторых вариантах реализации, ненасыщенный оксигенатный интермедиат включает один или более ненасыщенных этиловых эфиров, таких как этил-3-метил-3-бутениловый эфир, Этил-1,1-диметил-2-пропениловый эфир, этил-1,2-диметил-2-пропениловый эфир, этил-2-метил-3-бутениловый эфир и тому подобные эфиры. В некоторых вариантах реализации, ненасыщенный оксигенатный интермедиат включает один или более ненасыщенных спиртов, таких как 3-метил-3-бутен-1-ол, 2-метил-3-бутен-2-ол, 3-метил-3-бутен-2-ол, 2-метил-3-бутен-1-ол и тому подобные спирты. В некоторых вариантах реализации, ненасыщенный оксигенатный интермедиат включает один или более ненасыщенных сложных эфиров, таких как 3-метил-3-бутен-1-илацетат.2-метил-3-бутен-2-илацетат, 3-метил-3-бутен-2-илацетат, 2-метил-3-бутен-1-илацетат и сложные эфиры других алифатических карбоновых кислот С3-C18. В некотором варианте реализации, ненасыщенный углеводородный интермедиат включает один или более изоамиленов, например, 2-метилбут-1-ен, 3-метилбут-1-ен и 2-метилбут-2-ен. В некоторых вариантах реализации, ненасыщенный углеводородный интермедиат включают один или более диизоамиленов, полученных в результате димеризации изоамиленов.
Схема I. Типичные ненасыщенные интермедиаты с 6- и 8-членными кольцами
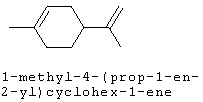
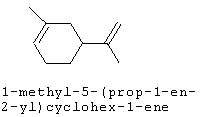
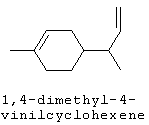
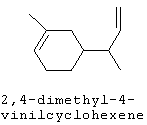
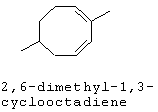
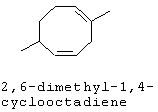
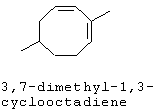
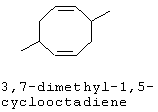
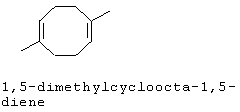
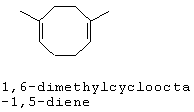
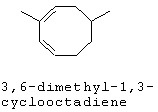
1-метил-4-(проп-1-ен-2-ил)циклогекс-1-ен
1-метил-5-(проп-1-ен-2-ил)циклогекс-1-ен
1,4-диметил-4-винилциклогексен
2,4-диметил-4-винилциклогексен
2,6-диметил-1,3-циклооктадиен
2,6-диметил-1,4-циклооктадиен
3,7-диметил-1,3-циклооктадиен
3,7-диметил-1,5-циклооктадиен
1,5-диметилциклоокта-1,5-диен
1,6-диметилциклоокта-1,5-диен
3,6-диметил-1,3-циклооктадиен
Схема II. Типичные ненасыщенные интермедиаты с 4-членным кольцом

1-метил-3-(проп-1-ен-2-ил)-1-винилциклобутан
1,3-диметил-1,3-дивинилциклобутан
1,2-ди(проп-1-ен-2-ил)циклобутан
1-метил-2-(проп-1-ен-2-ил)-1-винилциклобутан
1,2-диметил-1,2-дивинилциклобутан
1,3-ди(проп-1-ен-2-ил)циклобутан
Схема III. Типичные ненасыщенные теломеризационные и оксигенатные интермедиаты изопрена

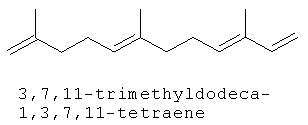

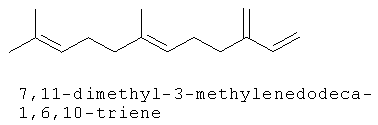
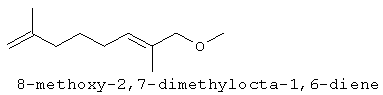
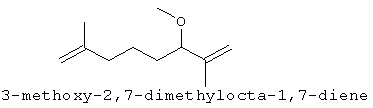
2,7-диметилокта-1,3,7-триен
2,7-диметилокта-2,4,6-триен
3,7,11-триметилдодека-1,3,7,11-тетраен
3,7,11-триметилдодека-1,3,6,10-тетраен
7,11-диметил-3-метилендодека-1,6,10-триен
8-метокси-2,7-диметилокта-1,6-диен
3-метокси-2,7-диметилокта-1,7-диен
Схема IV. Типичные ненасыщенные интермедиаты с этиловым эфиром
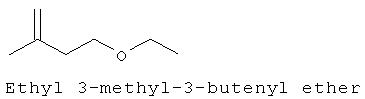

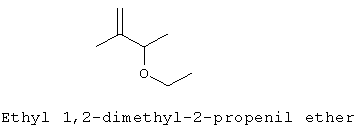
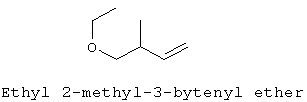
этил-3-метил-3-бутениловый эфир
этил-1,1-диметил-2-пропениловый эфир
этил-1,2-диметил-2-пропениловый эфир
этил-2-метил-3-бутениловый эфир
Схема V. Типичные ненасыщенные спиртовые интермедиаты
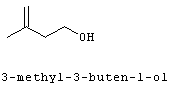

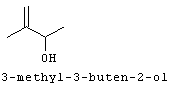
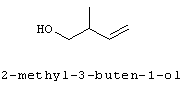
3-метил-3-бутен-1-ол
2-метил-3-бутен-2-ол
3-метил-3-бутен-2-ол 2-метил-3-бутен-1-ол
Схема VI. Типичные ненасыщенные эфирные интермедиаты ОАс

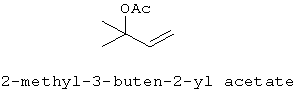
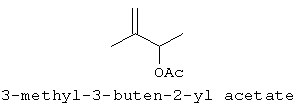

3-метил-3-бутен-1-илацетат
2-метил-3-бутен-2-илацетат
3-метил-3-бутен-2-илацетат 2-метил-3-бутен-1-илацетат
Типичное гидрированив ненасыщенных интермедиатов
[0621] Ненасыщенные производные изопрена подвергают гидрированию в присутствии катализатора гидрирования с получением насыщенных соединений. Описаны насыщенные соединения, и определена их ценность в качестве топлива. В некоторых вариантах реализации, источник водорода для гидрирования представляет собой газообразный водород. В некоторых вариантах реализации, газообразный водород образуется вместе с биоизопреном, как описано в предварительной заявке на патент США под номером 61/141,652, поданной 30 декабря, 2008 г., и US 2009/0203102 А1. В некоторых вариантах реализации, катализатор гидрирования представляет собой катализатор на основе палладия, такой как Pd/C (например, 5% (масс.) Pd/C). В некоторых вариантах реализации, катализатор гидрирования представляет собой никелевый катализатор Ренея. В некоторых вариантах реализации, катализатор гидрирования представляет собой гомогенный катализатор, такой как гомогенные катализаторы гидрирования на основе рутения или родия. В некоторых вариантах реализации, ненасыщенные димеры и тримеры изопрена гидрируют с получением насыщенных С10 и С15-углеводородов, подходящих для получения топлива. В некоторых вариантах реализации, ненасыщенные циклические димеры гидрируют с получением насыщенных циклических С10-углеводородов, таких как 1,2-бис(изопропил)циклобутан, 1,2-бис(изопропил)циклобутан, 1-метил-4-изопропилциклогексан, 1-метил-3-изопропилциклогексан, 1-этил-1,4-диметилциклогексан, 1-этил-1,3-диметилциклогексан, 1,5-диметилциклооктан и 1,4-диметилциклооктан. В некоторых вариантах реализации, ненасыщенные циклические тримеры гидрируют с получением насыщенных циклических углеводородов С15, таких как 1,5,9-триметилциклододекан и 1.5,10-триметилциклододекан (см. Схему VII). В некоторых вариантах реализации, ненасыщенные линейные димеры гидрируют с получением насыщенных алифатических С10-углеводородов, таких как 2,6-диметилоктан, 2,7-диметилоктан и 3,6-диметилоктан. В некоторых вариантах реализации, ненасыщенные линейные тримеры гидрируют с получением насыщенных алифатических углеводородов С15, таких как 2,6,10-триметилдодекан, 2,7,10-триметилдодекан и 3,7,10-триметилдодекан (см. Схему VIII). В некоторых вариантах реализации, продукты димеризации изоамиленов (диамилены или диматы С 10) полностью гидрируют в изопарафины (например, 2,3,4,4-тетраметилгексан, 2,2,3,4-тетраметилгексан, 2,3,3,4-тетраметилгексан и 3,3,5-триметилгептан) (см. Схему VIIIa). В некоторых вариантах реализации, коммерчески предпочтительное количество исходной композиции изопрена высокой степени чистоты подвергают гидрированию с получением продукта, содержащего 2-метилбутан. В некоторых вариантах реализации, ненасыщенные продукты гидроксилирования изопрена гидрируют с получением насыщенных продуктов гидроксилирования, таких как спирты и диолы С5 (например, 3-метилбутан-1-ол, 2-метилбутан-1-ол и 2-метилбутан-2-ол, 3-метилбутан-1,3-диол и 2-метилбутан-2,3-диол), спирты и диолы С10 (например, 3,7-диметилоктан-1-ол, 2,7-диметилоктан-1-ол, 2,7-диметилоктан-2-ол и 2,7-диметилоктан-2,7-диол) и циклические С10-спирты (например, 2-(4-метилциклогексил)пропан-2-ол, 2-(4-метилциклогексил)пропан-1-ол, 2-(1,4-диметилциклогексил)этанол и 4-этил-1,4-диметилциклогексанол) (см. Схему IX). В некоторых вариантах реализации, ненасыщенные оксигенаты изопрена гидрируют с получением насыщенных простых эфиров, таких как 1,3-диэтокси-3-метилбутан, 1-этокси-3-метилбутан, 1-метокси-2,7-диметилоктан и 3-метокси-2,7-диметилоктан (см. Схему X). Должно быть очевидно, что когда молекулу алкена подвергают гидрированию, получают один или более стереоизомеров. Относительные соотношения стереоизомеров зависят от используемых условий реакции и катализаторов. Когда это применимо, предполагается, что все без исключения стереоизомеры входят в насыщенные углеводороды и оксигенаты, описанные в данной заявке.
Схема VII. Примеры циклических углеводородов, полученных из изопрена
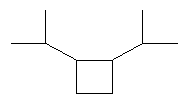

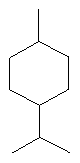
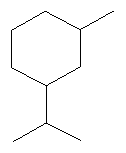

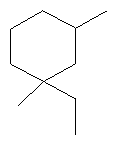
циклогексаны, полученные в результате термической или каталитической циклодимеризации
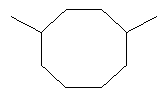
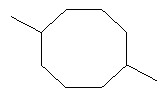
1,5-диметил- и 1,6-диметилциклооктан, полученные в результате термической или каталитической циклодимеризации
1,5,9- и 1,5,10-триметилциклододекан, полученные в результате циклической тримеризации изопрена
Схема VIII. Примеры алифатических углеводородов, полученных из изопрена
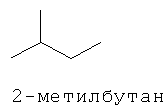
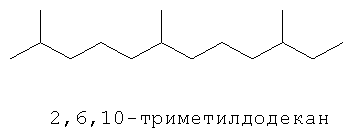
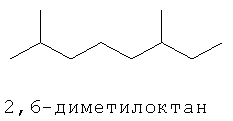

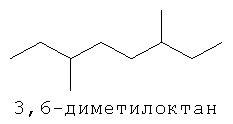
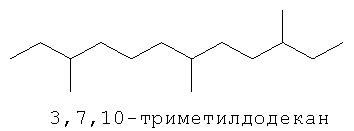
Схема VIIIa. Примеры изодеканов, полученных из изоамиленов
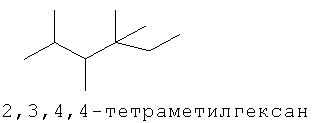

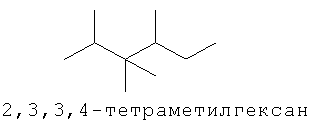
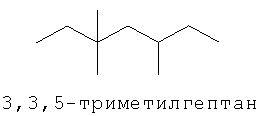
Схема IX. Примеры спиртов IsoFuel™, полученных из изопрена
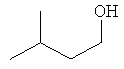
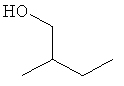
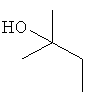
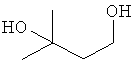
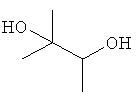
C5 - спирты и диолы
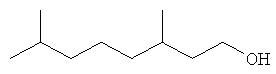
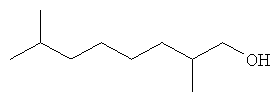


С10 - спирты и диолы
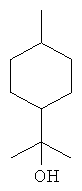
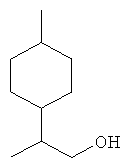
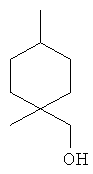
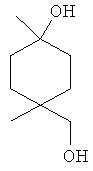
Циклические С10 - спирты
Схема X. Примеры оксигенатов IsoFuel™, полученных из изопрена
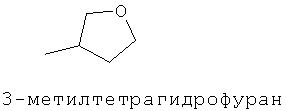
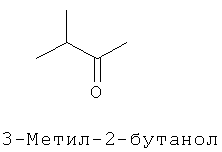
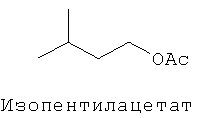

Продукты реакции изопрена и этанола (см. прикрепленную презентацию от S. Reyer)

Алкоксипроизводные, полученные путем катализируемой Pd теломеризации изопрена в метанольном растворителе (см. Zakharkin (1976))
[0622] В некотором варианте реализации, компонент топлива, полученный путем химического превращения коммерчески предпочтительного количества исходной композиции изопрена высокой степени чистоты, включает насыщенные производные изопрена. В некоторых вариантах реализации, указанный компонент топлива включает насыщенные углеводороды С 10 и С 15, полученные из изопрена. В некоторых вариантах реализации, указанный компонент топлива включает один или более насыщенных циклических углеводородов С10, выбранных из группы, состоящей из 1,2-бис(изопропил)циклобутана, 1,2-бис(изопропил)циклобутана, 1-метил-4-изопропилциклогексана, 1-метил-3-изопропилциклогексана, 1-этил-1,4-диметилциклогексана, 1-этил-1,3-диметилциклогексана, 1,5-диметилциклооктана и 1,4-диметилциклооктана. В некоторых вариантах реализации, указанный компонент топлива включает один или более насыщенных циклических углеводородов С 15, выбранных из группы, состоящей из 1,5,9-триметилциклододекана и 1,5,10- триметилциклододекана. В некоторых вариантах реализации, компонент топлива включает один или более насыщенных алифатических углеводородов С 10, выбранных из группы, состоящей из 2,6-диметилоктана, 2,7-диметилоктана и 3,6-диметилоктана. В некоторых вариантах реализации, компонент топлива включает один или более насыщенных алифатических углеводородов С 15, выбранных из группы, состоящей из 2,6,10-триметилдодекана, 2,7,10-триметилдодекана и 3,7,10-триметилдодекана. В некоторых вариантах реализации, компонент топлива включает 2-метилбутан. В некоторых вариантах реализации, компонент топлива включает один или более изопарафинов, выбранных из группы, состоящей из 2,3.4,4-тетраметилгексана, 2,2,3,4-тетраметилгексана, 2,3,3,4-тетраметилгексана и 3,3,5-триметилгептана. В некоторых вариантах реализации, компонент топлива включает один или более насыщенных продуктов гидроксилирования, выбранных из группы, состоящей из 3-метилбутан-1-ола, 2-метилбутан-1-ола и 2-метилбутан-2-ола, 3-метилбутан-1,3-диола, 2-метилбутан-2,3-диола, 3,7-диметилоктан-1-ола, 2,7-диметилоктан-1-ола, 2,7-диметилоктан-2-ола, 2,7-диметилоктан-2,7-диола, 2-(4-метилциклогексил)пропан-2-ола, 2-(4-метилциклогексил)пропан-1-ола, 2-(1,4-диметилциклогексил)этанола и 4-этил-1,4-диметилциклогексанола. В некоторых вариантах реализации, компонент топлива включает один или более насыщенных простых эфиров, выбранных из группы, состоящей из 1,3-диэтокси-3-метилбутана, 1-этокси-3-метилбутана, 1-метокси-2,7-диметилоктана и 3-метокси-2,7-диметилоктана. В некоторых вариантах реализации, компонент топлива включает один или более оксигенатов изопрена, выбранных из группы, состоящей из 3-метилтетрагидрофурана, 3-метил-2-бутанона и изопентилацетата.
[0623] В некоторых вариантах реализации, композиции и системы для получения компонента топлива из изопрена дополнительно включают катализаторы для катализа химического превращения исходной композиции изопрена в компонент топлива или интермедиат для получения компонента топлива. В некоторых вариантах реализации, композиции и системы для получения компонента топлива из изопрена дополнительно включают катализаторы для катализа гидрирования ненасыщенного интермедиата с получением насыщенного компонента топлива. В некоторых вариантах реализации, указанный катализатор представляет собой любой описанный катализатор или комбинацию одного или нескольких из катализаторов, описанных в данной заявке.
Способы и/или процессы получения топлива
[0624] Согласно настоящему изобретению предложены способы и/или процессы получения компонента топлива из изопрена, включающие: (а) получение коммерчески предпочтительного количества изопрена высокой степени чистоты; и (b) химическое превращение по меньшей мере части коммерчески предпочтительного количества изопрена высокой степени чистоты в компонент топлива. В одном варианте реализации, композицию изопрена высокой степени чистоты превращают в компонент топлива в непрерывном химическом процессе. В другом варианте реализации, изопрен высокой степени чистоты дополнительно очищают перед химическим превращением в топливную композицию. В дополнительном варианте реализации, изопрен высокой степени чистоты подвергают химическому превращению в промежуточную композицию; промежуточную композицию подвергают дополнительным химическим превращениям с получением топлива или компонента топлива. В дополнительном варианте реализации, полученный компонент топлива смешивают с нефтяным дистиллятом и возможно другими вспомогательными веществами для получения топлива. В некоторых предпочтительных вариантах реализации, изопрен высокой степени чистоты представляет собой биоизопреновую композицию.
[0625] В некоторых вариантах реализации, способ получения компонента топлива из изопрена включает получение коммерчески предпочтительного количества композиции изопрена высокой степени чистоты. В некоторых вариантах реализации, композиция изопрена высокой степени чистоты, подходящая для настоящего изобретения, содержит больше или приблизительно 2, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 200, 300, 400, 500, 600, 700, 800, 900 или 1000 мг изопрена. В некоторых вариантах реализации, композиция изопрена высокой степени чистоты содержит больше или приблизительно 2, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 г изопрена. В некоторых вариантах реализации, исходная композиция изопрена содержит больше или приблизительно 0,2, 0,5, 1, 2, 5, 10, 20, 50,100, 200, 500, 1000 кг изопрена.
[0626] В некоторых вариантах реализации, способ получения компонента топлива из изопрена включает получение коммерчески предпочтительного количества композиции изопрена высокой степени чистоты. В некоторых вариантах реализации, исходная композиция изопрена высокой степени чистоты содержит больше или приблизительно 98,0, 98,5, 99,0, 99,5 или 100% масс.изопрена по отношению к общей массе всех С5-углеводородов в исходной композиции. В некоторых вариантах реализации, композиция изопрена высокой степени чистоты, подходящая для настоящего изобретения, содержит больше или приблизительно 99,90, 99,92. 99,94, 99,96, 99,98 или 100% масс.изопрена по отношению к общей массе всех С5-углеводородов в указанной композиции. В некоторых вариантах реализации, композиция изопрена высокой степени чистоты содержит меньше или приблизительно 2,0, 1,5, 1,0, 0,5, 0,2, 0,12, 0,10, 0,08, 0,06, 0,04, 0,02, 0,01, 0,005, 0,001, 0,0005, 0,0001, 0,00005 или 0,00001% масс. С5-углеводородов, отличных от изопрена (таких, как 1,3-циклопентадиен, цис-1,3-пентадиен, транс-1,3-пентадиен, 1,4-пентадиен, 1-пентин, 2-пентин, 1-пентен, 2-метил-1-бутен. 3-метил-1-бутин, пент-4-ен-1-ин, транс-пент-3-ен-1-ин или цис-пент-3-ен-1-ин), по отношению к общей массе всех С5-углеводородов в указанной композиции. В некоторых вариантах реализации, композиция изопрена высокой степени чистоты содержит меньше или приблизительно 2,0, 1,5, 1,0, 0,5, 0,2, 0,12, 0,10, 0,08, 0,06, 0,04, 0,02, 0,01, 0,005, 0,001, 0,0005, 0,0001, 0,00005 или 0,00001% масс.1,3-циклопентадиена, цис-1,3-пентадиена, транс-1,3-пентадиена, 1,4-пентадиена, 1-пентина, 2-пентина, 1-пентена, 2-метил-1-бутена, 3-метил-1-бутина, пент-4-ен-1-ина, транс-пент-3-ен-1-ина или цис-пент-3-ен-1-ина, по отношению к общей массе всех С5-углеводородов в указанной композиции. В особых вариантах реализации, композиция изопрена высокой степени чистоты содержит более чем приблизительно 2 мг изопрена и содержит больше или приблизительно 98,0, 98,5, 99,0, 99,5, 99,90, 99,92, 99,94, 99,96, 99,98 или 100% масс.изопрена по отношению к общей массе всех С5-углеводородов в указанной композиции.
[0627] В некоторых вариантах реализации, способ получения компонента топлива из изопрена включает получение коммерчески предпочтительного количества композиции изопрена высокой степени чистоты. В некоторых вариантах реализации, композиция изопрена высокой степени чистоты, подходящая для настоящего изобретения, содержит меньше или приблизительно 50, 40, 30, 20, 10, 5, 1, 0,5, 0,1, 0,05, 0,01 или 0,005 мкг/л соединения, которое ингибирует полимеризацию изопрена, для любого соединения в указанной композиции, которое ингибирует полимеризацию изопрена. В особых вариантах реализации, композиция также содержит более чем приблизительно 2 мг изопрена.
[0628] В некоторых вариантах реализации, способ получения компонента топлива из изопрена включает получение коммерчески предпочтительного количества композиции изопрена высокой степени чистоты. В некоторых вариантах реализации, композиция изопрена высокой степени чистоты, подходящая для настоящего изобретения, содержит одно или более соединений, выбранных из группы, состоящей из этанола, ацетона, пренильных спиртов С5 и изопреноидных соединений с 10 или более атомами углерода. В некоторых вариантах реализации, композиция изопрена высокой степени чистоты содержит больше или приблизительно 0,005, 0,01, 0,05, 0,1, 0,5, 1, 5, 10, 20, 30, 40, 60, 80, 100 или 120 мкг/л этанола, ацетона, пренильных спиртов С5 (таких как 3-метил-3-бутен-1-ол или 3-метил-2-бутен-1-ол) или любых из двух или более описанных соединений. В особых вариантах реализации, композиция изопрена высокой степени чистоты содержит более чем приблизительно 2 мг изопрена и содержит одно или более соединений, выбранных из группы, состоящей из этанола, ацетона, пренильных спиртов С5 и изопреноидных соединений с 10 или более атомами углерода.
[0629] В некоторых вариантах реализации, способ получения компонента топлива из изопрена включает получение коммерчески предпочтительного количества композиции изопрена высокой степени чистоты. В некоторых вариантах реализации, композиция изопрена высокой степени чистоты, подходящая для настоящего изобретения, содержит изопрен и одно или более дополнительных соединений, выбранных из группы, состоящей из 2-гептанона, 6-метил-5-гептен-2-она, 2,4,5-триметилпиридина, 2,3,5-триметилпиразина, цитронеллаля, ацетальдегида, метантиола, метилацетата, 1-пропанола, диацетила, 2-бутанона, 2-метил-3-бутен-2-ола, этилацетата, 2-метил-1-пропанола, 3-метил-1-бутаналя, 3-метил-2-бутанона, 1-бутанола, 2-пентанона, 3-метил-1-бутанола, этилизобутирата, 3-метил-2-бутеналя, бутилацетата, 3-метилбутилацетата, 3-метил-3-бутен-1-илацетата, 3-метил-2-бутен-1-илацетата, 3-гексен-1-ола, 3-гексен-1-илацетата, лимонена, гераниола (транс-3,7-диметил-2,6-октадиен-1-ола), цитронеллола (3,7-диметил-6-октен-1-ола), (Е)-3,7-диметил-1,3,6-октатриена, (г)-3,7-диметил-1,3,6-октатриена и 2,3-циклогептенолпиридина. В различных вариантах реализации, количество одного из данных дополнительных компонентов по сравнению с количеством изопрена в единицах процента по массе (т.е., масса указанного компонента, деленная на массу изопрена, умноженная на 100) больше или приблизительно составляет 0,01, 0,02, 0,05, 0,1, 0,5, 1, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 или 110% (масс./масс.). В некоторых вариантах реализации, количество метантиола по сравнению с количеством изопрена в единицах процента по массе составляет менее чем 0,01% (масс./масс.).
[0630] В некоторых вариантах реализации, способ получения компонента топлива из изопрена включает получение коммерчески предпочтительного количества композиции изопрена высокой степени чистоты. В некоторых вариантах реализации, указанный способ включает получение коммерчески предпочтительного количества композиции изопрена высокой степени чистоты в результате биологического процесса, включающего: (а) культивирование клеток, содержащих гетерологичную нуклеиновую кислоту, кодирующую полипептид изопренсинтазы, при подходящих для получения изопрена культуральных условиях, при этом указанные клетки (i) продуцируют более чем приблизительно 400 нмоль изопрена/гсмк/ч, (ii) превращают более чем приблизительно 0,002 молярного процента углерода, который клетки потребляют из культуральной среды, в изопрен, или (iii) обладают средней объемной производительностью по изопрену, составляющей более чем приблизительно 0,1 мг изопрена/лбульона/ч; и (b) получение изопрена. В некоторых вариантах реализации, указанные клетки содержат гетерологичную нуклеиновую кислоту, которая (i) кодирует полипептид изопренсинтазы, например, встречающийся в природе полипептид из такого растения, как Pueraria; и (ii) функционально связана с промотором, например, с промотором Т7. В некоторых вариантах реализации, клетки культивируют в культуральной среде, которая содержит источник углерода, такой как, но не ограниченный перечисленными, углевод, глицерол. глицерин, дигидроксиацетон, одноуглеродный источник углерода, масло, животный жир, животное масло, жирная кислота, липид, фосфолипид, глицеролипид, моноглицерид, диглицерид, триглицерид, возобновляемый источник углерода, полипептид (например, белок или пептид микроорганизма или растения), дрожжевой экстракт, компонент из дрожжевого экстракта или любая комбинация двух или более из перечисленных источников углерода. В некоторых вариантах реализации, клетки культивируют в условиях с ограничением количества глюкозы. В некотором варианте реализации, клетки дополнительно содержат гетерологичную нуклеиновую кислоту, кодирующую полипептид IDI. В некоторых вариантах реализации, клетки дополнительно содержат гетерологичную нуклеиновую кислоту, кодирующую полипептид пути MVA. В некотором варианте реализации, указанный способ включает получение изопрена с помощью способов, описанных в предварительной заявке на патент США под номером 61/134,094. поданной 2 июля 2008 г., WO 2010/003007, и заявке на патент США под номером 12/335,071, поданной 15 декабря 2008 г.(US 2009/0203102 А1), которые полностью включены в настоящее описание посредством ссылки.
[0631] В некотором варианте реализации, указанный способ включает получение газообразной фазы (выделяющегося газа), продуцированной клетками в культуре, которые продуцируют изопрен. В некоторых вариантах реализации, указанные клетки в культуре продуцируют более чем приблизительно 400 нмоль изопрена/гсмк/ч. В некоторых вариантах реализации, газообразная фаза содержит больше или приблизительно 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 мкг/л изопрена, когда ее барботируют со скоростью, равной 1 vvm. В некоторых вариантах реализации, летучая органическая фракция газообразной фазы содержит больше или приблизительно 99,90, 99,92, 99,94, 99,96, 99,98 или 100% масс.изопрена по отношению к общей массе всех С5-углеводородов в летучей органической фракции. В некоторых вариантах реализации, летучая органическая фракция газообразной фазы содержит меньше или приблизительно 2,0, 1,5, 1,0, 0,5, 0,2, 0,12. 0,10, 0,08. 0,06, 0,04, 0,02, 0,01, 0,005, 0,001, 0,0005, 0,0001, 0,00005 или 0,00001% масс, С5-углеводородов, отличных от изопрена (таких, как 1,3-циклопентадиен, цис-1,3-пентадиен, транс-1.3-пентадиен, 1,4-пентадиен, 1-пентин, 2-пентин, 1-пентен, 2-метил-1-бутен, 3-метил-1-бутин, пент-4-ен-1-ин, транс-пент-3-ен-1-ин или цис-пент-3-ен-1-ин), по отношению к общей массе всех С5-углеводородов в летучей органической фракции. В некоторых вариантах реализации, летучая органическая фракция газообразной фазы содержит меньше или приблизительно 2,0, 1,5, 1,0, 0,5, 0,2, 0,12, 0,10, 0,08, 0,06, 0,04, 0,02, 0,01, 0,005, 0,001, 0,0005, 0,0001, 0,00005 или 0,00001% масс.1,3-циклопентадиена, цис-1,3-пентадиена, транс-1,3-пентадиена, 1,4-пентадиена, 1-пентина, 2-пентина, 1-пентена, 2-метил-1-бутена, 3-метил-1-бутина, пент-4-ен-1-ина, транс-пент-3-ен-1-ина или цис-пент-3-ен-1-ина, по отношению к общей массе всех С5-углеводородов в летучей органической фракции. В особых вариантах реализации, летучая органическая фракция газообразной фазы содержит более чем приблизительно 2 мг изопрена и содержит больше или приблизительно 99,90, 99,92, 99,94, 99,96, 99,98 или 100% масс.изопрена по отношению к общей массе всех С5-углеводородов в летучей органической фракции.
[0632] В некотором варианте реализации, указанный способ включает получение газообразной фазы (выделяющегося газа), продуцированной клетками в культуре, которые продуцируют изопрен, В некоторых вариантах реализации, летучая органическая фракция газообразной фазы содержит меньше или приблизительно 50, 40, 30, 20, 10, 5, 1, 0,5, 0,1, 0,05, 0,01 или 0,005 мкг/л соединения, которое ингибирует полимеризацию изопрена, для любого соединения в летучей органической фракции газообразной фазы, которое ингибирует полимеризацию изопрена. В особых вариантах реализации, летучая органическая фракция газообразной фазы также содержит более чем приблизительно 2 мг изопрена. В некоторых вариантах реализации, летучая органическая фракция газообразной фазы содержит одно или более соединений, выбранных из группы, состоящей из этанола, ацетона, пренильных спиртов С5 и изопреноидных соединений с 10 или более атомами углерода. В некоторых вариантах реализации, летучая органическая фракция газообразной фазы содержит больше или приблизительно 0,005, 0,01, 0,05, 0,1, 0,5, 1, 5. 10, 20, 30, 40, 60, 80, 100 или 120 мкг/л этанола, ацетона, пренильных спиртов С5 (таких как 3-метил-3-бутен-1-ол или 3-метил-2-бутен-1-ол) или любых из двух или более описанных соединений. В особых вариантах реализации, летучая органическая фракция газообразной фазы содержит более чем приблизительно 2 мг изопрена и содержит одно или более соединений, выбранных из группы, состоящей из этанола, ацетона, пренильных спиртов С5 и изопреноидных соединений с 10 или более атомами углерода. В некоторых вариантах реализации, летучая органическая фракция газообразной фазы содержит изопрен и одно или более дополнительных соединений, выбранных из группы, состоящей из 2-гептанона, 6-метил-5-гептен-2-она, 2,4,5-триметилпиридина, 2,3,5-триметилпиразина, цитронеллаля, ацетальдегида, метантиола, метилацетата, 1-пропанола, диацетила, 2-бутанона, 2-метил-3-бутен-2-ола, этилацетата, 2-метил- 1-пропанола, 3-метил-1-бутаналя, 3-метил-2-бутанона, 1-бутанола, 2-пентанона, 3-метил-1-бутанола, этилизобутирата, 3-метил-2-бутеналя, бутилацетата, 3-метилбутилацетата, 3-метил-3-бутен-1-илацетата, 3-метил-2-бутен-1-илацетата, 3-гексен-1-ола, 3-гексен-1-илацетата, лимонена, гераниола (транс-3,7-диметил-2,6-октадиен-1-ола), цитронеллола (3,7-диметил-6-октен-1-ола), (Е)-3,7-диметил-1,3,6-октатриена, (г)-3.7-диметил-1,3,6-октатриена и 2,3-циклогептенолпиридина. В различных вариантах реализации, количество одного из данных дополнительных компонентов в летучей органической фракции газообразной фазы по сравнению с количеством изопрена в единицах процента по массе (т.е., масса указанного компонента, деленная на массу изопрена, умноженная на 100) больше или приблизительно составляет 0,01, 0,02, 0,05, 0,1, 0,5, 1, 5, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100 или 110% (масс./масс.). В некоторых вариантах реализации, указанный способ дополнительно включает получение изопрена из газообразной фазы. Например, можно получить изопрен из газообразной фазы, содержащей изопрен, применяя стандартные методики, такие как деаэрирование, улучшенное разделение с помощью мембран, фракционирование, адсорбция/десорбция, первапорация, термальная или вакуумная десорбция изопрена из твердой фазы или экстрагирование изопрена, иммобилизованного или абсорбированного на твердой фазе, с помощью растворителя (см., например, патенты США под номерами 4,703,007 и 4,570,029, каждый из перечисленных документов настоящим полностью включен посредством ссылки, особенно в отношении способов получения и очистки изопрена). В некоторых конкретных вариантах реализации, для получения изопрена применяют экстрактивную перегонку со спиртом (таким как этанол, метанол, пропанол или комбинация перечисленных). В некоторых вариантах реализации, получение изопрена включает выделение изопрена в жидкой форме (например, в виде раствора изопрена в чистом виде или раствора изопрена в раствореителе). Деаэрирование включает удаление испарившегося изопрена из выделяющегося при ферментации потока газа в непрерывном режиме. Такого удаления можно добиться несколькими различными способами, включая, но не ограничиваясь перечисленными, адсорбцию на твердой фазе, разделение в жидкой фазе или прямую конденсацию (такую как конденсация под воздействием конденсационной спирали или вследствие повышения давления). В некоторых вариантах реализации, обогащение с помощью мембран разжиженного потока пара изопрена, температура которого превышает температуру конденсации пара, приводит к конденсации жидкого изопрена. В некоторых вариантах реализации, полученный изопрен сжимают и конденсируют.
[0633] Получение изопрена может включать один этап или множество этапов. В некоторых вариантах реализации, удаление испарения изопрена из выделяющегося при ферментации газа и перевод изопрена в жидкую фазу осуществляют одновременно. Например, можно осуществить прямую конденсацию изопрена из потока выделяющегося газа с получением жидкости. В некоторых вариантах реализации, удаление испарения изопрена из выделяющегося при ферментации газа и перевод изопрена в жидкую фазу осуществляют последовательно. Например, изопрен можно адсорбировать на твердой фазе, а затем экстрагировать из твердой фазы с помощью растворителя.
[0634] В некоторых вариантах реализации, предусмотрен способ получения циклического димера изопрена, включающий нагревание чистого биоизопрена. Циклические димеры полученного изопрена могут представлять собой 6-членные кольцевые димеры (например, продукт электрохимической циклизации [2+4], такой как лимонен) или 8-членные кольцевые димеры, или смеси указанных соединений. Примеры 6-членных кольцевых димеров включают, но не ограничены перечисленными: 1-метил-4-(проп-1-ен-2-ил)циклогекс-1-ен, 1-метил-5-(проп-1-ен-2-ил)циклогекс-1-ен, 1,4-диметил-4-винилциклогексен, 2,4-диметил-4-винилциклогексен и тому подобные соединения. Примеры 8-членных кольцевых димеров включают, но не ограничены перечисленными: 1,5-диметилциклоокта-1,5-диен, 1,6-диметилциклоокта-1,5-диен и тому подобные соединения. В одном варианте реализации, чистый полученный биологическим путем изопрен димеризуют путем нагревания до температуры, равной от приблизительно 100°С до приблизительно 300°С, предпочтительно от приблизительно 150°С до приблизительно 250°С.Давление поддерживают на уровне приблизительно от 2 до 3 атм. В другом варианте реализации, можно применять катализатор, подходящий для катализа димеризации конъюгированных диенов. Соотношения различных димеров в смеси продуктов можно контролировать с помощью катализатора и других условий реакции. Например, никелевый катализатор может вызвать образование 8-членных кольцевых димеров.
[0635] В некоторых вариантах реализации, предусмотрен способ получения циклического димера изопрена, включающий фотодимеризацию биоизопрена. Циклический димер полученного изопрена может представлять собой один или более 4-членных кольцевых димеров или смеси указанных димеров. Примеры 4-членных кольцевых димеров включают, но не ограничены перечисленными: 1,2-ди(проп-1-ен-2-ил)циклобутан, 1,3-ди(проп-1-ен-2-ил)циклобутан, 1-метил-1-винил-3-(проп-1-ен-2-ил)циклобутан, 1-метил-1-винил-2-(проп-1-ен-2-ил)циклобутан, 1,3-диметил-1,3-дивинилциклобутан, 1,2-диметил-1,2-дивинилциклобутан и тому подобные соединения. В одном варианте реализации, чистый полученный биологическим путем изопрен димеризуют путем облучения ультрафиолетовым излучением, предпочтительно в присутствии фотосенсибилизатора, такого как бензофенон.
[0636] Димеры изопрена можно гидрировать с получением насыщенных углеводородов С 10, которые могут служить в качестве топлива или могут быть смешаны с топливом. В одном варианте реализации, ненасыщенные димеры изопрена подвергают каталитическому гидрированию с получением частично гидрированных и/или полностью гидрированных продуктов. Примеры полностью гидрированных продуктов включают, но не ограничены перечисленными: 1-метил-4-изопропилциклогексан и 1-метил-5-изопропилциклогексан, 1,4-диметил-4-этилциклогексан, 2,4-диметил-4-этилциклогексан, 1,2-диизопропилциклобутан и 1,3-диизопропилциклобутан, 1-метил-1-винил-3-(проп-1-ен-2-ил)циклобутан, 1-метил-1-этил-2-(проп-2-ил)циклобутан, 1,3-диметил-1,3-этилциклобутан, 1,2-диметил-1,2-диэтилциклобутан, 1,5-диметилциклооктан, 1,6-диметилциклооктан и тому подобные продукты.
[0637] В некоторых вариантах реализации, указанный способ получения компонента топлива из изопрена включает: (а) получение коммерчески предпочтительного количества любой из исходных композиций изопрена высокой степени чистоты, описанных в настоящем описании; (b) химическое превращение по меньшей мере части исходной композиции изопрена высокой степени чистоты в компонент топлива, включающее: (i) нагревание композиции изопрена высокой степени чистоты до температуры, приблизительно равной 100°С или выше, под давлением; (п) превращение по меньшей мере части исходной композиции изопрена в ненасыщенные циклические димеры изопрена; и (in) гидрирование ненасыщенных циклических димеров изопрена с получением насыщенных циклических димеров изопрена. В некоторых вариантах реализации, исходную композицию изопрена нагревают до температуры, приблизительно равной 100,125,150, 175, 200, 225 или 250°С или выше, под давлением. В некоторых вариантах реализации, исходную композицию изопрена нагревают в присутствии антиокислителя (например, 2,6-ди-трет-бутил-4-метилфенола), чтобы предотвратить опосредованную радикалами полимеризацию. В одном варианте реализации, термическую димеризацию изопрена осуществляют в присутствии динитрокрезола в качестве ингибитора полимеризации. В качестве ингибиторов полимеризации можно применять подходящие антиокислители. В некоторых вариантах реализации, по меньшей мере часть исходной композиции изопрена превращают в смесь ненасыщенных димеров, которая содержит 6- и 8-членные кольца, например, лимонен (1-метил-4-(проп-1-ен-2-ил)циклогекс-1-ен), 1-метил-5-(проп-1-ен-2-ил)циклогекс-1-ен, 1,4-диметил-4-винилциклогексен, 2,4-диметил-4-винилциклогексен, 1,5-диметилциклоокта-1,5-диен, 1,6-диметилциклоокта-1,5-диен, 2,6-диметил-1,3-циклооктадиен, 2,6-диметил-1,4-циклооктадиен, 3,7-диметил-1,5-циклооктадиен, 3,7-диметил-1,3-циклооктадиен и 3,6-диметил-1,3-циклооктадиен. В некоторых вариантах реализации, больше или приблизительно 20, 30, 40, 50, 60, 70, 75, 80, 85, 90, 95, 98, 99 или 100% изопрена в исходной композиции изопрена превращают в ненасыщенные циклические димеры изопрена. В некоторых вариантах реализации, гидрирование ненасыщенных циклических димеров изопрена катализируется катализатором гидрирования, таким как катализатор на основе палладия (например, Pd/C, например, 5% (масс.) Pd/C.) В некоторых вариантах реализации, насыщенные циклические димеры изопрена включают один или более углеводородов С10, выбранных из группы, состоящей из 1-метил-4-изопропилциклогексана, 1-метил-3-изопропилциклогексана, 1,5-диметилциклооктана и 1,4-диметилциклооктана. В некоторых предпочтительных вариантах реализации, исходная композиция изопрена представляет собой биоизопреновую композицию.
[0638] В некоторых вариантах реализации, способ получения компонента топлива из изопрена включает: (а) получение коммерчески предпочтительного количества любой из исходных композиций изопрена высокой степени чистоты, описанных в настоящем описании; (b) химическое превращение по меньшей мере части исходной композиции изопрена высокой степени чистоты в компонент топлива, включающее: (i) приведение в контакт композиции изопрена высокой степени чистоты с каталитической системой; (ii) превращение по меньшей мере части исходной композиции изопрена в ненасыщенные димеры и/или тримеры изопрена; и (iii) гидрирование ненасыщенных димеров и/или тримеров с получением насыщенных углеводородов С 10 и/или С 15. В некоторых вариантах реализации, больше или приблизительно 20, 30, 40, 50, 60, 70, 75, 80, 85, 90, 95, 98, 99 или 100% изопрена в исходной композиции изопрена превращают в ненасыщенные димеры и/или тримеры изопрена. В некоторых вариантах реализации, исходную композицию изопрена приводят в контакт с подходящими каталитическими системами, известными в данной области, с получением одного или нескольких ненасыщенных циклических димеров изопрена, выбранных из группы, состоящей из 1,2-ди(проп-1-ен-2-ил)циклобутана, 1,3-ди(проп-1-ен-2-ил)циклобутана, 1-метил-1-винил-3-(проп-1-ен-2-ил)циклобутана, 1-метил-1-винил-2-(проп-1-ен-2-ил)циклобутана, 1,3-диметил-1,3-дивинилциклобутана, 1,2-диметил-1,2-дивинилциклобутана, 1-метил-4-(проп-1-ен-2-ил)циклогекс-1-ена), 1-метил-5-(проп-1-ен-2-ил)циклогекс-1-ена, 1,4-диметил-4-винилциклогексена, 2,4-диметил-4-винилциклогексена, 1,5-диметилциклоокта-1,5-диена, 1,6-диметилциклоокта-1,5-диена, 1,4-диметил-4-винил-1-циклогексена, 2,4-диметил-4-винил-1-циклогексена, 2,7-диметил-1,3,7-октатриена, 2,7-диметил-2,4,6-октатриена, 2,6-диметил-1,3-циклооктадиена, 2,6-диметил-1,4-циклооктадиена, 3,7-диметил-1,5-циклооктадиена, 3,7-диметил-1,3-циклооктадиена и 3,6-диметил-1,3-циклооктадиена. В некоторых вариантах реализации, исходную композицию изопрена приводят в контакт с подходящими каталитическими системами, известными в данной области, с получением одного или нескольких ненасыщенных циклических тримеров изопрена, таких как триметилциклододекатриены и триметилдодекатетраены и тому подобные соединения. В некоторых вариантах реализации, исходную композицию изопрена приводят в контакт с подходящими каталитическими системами, известными в данной области, с получением одного или нескольких ненасыщенных линейных димеров и/или тримеров изопрена, таких как диметилоктатриены (например, 2,7-диметил-1,3,7-октатриен и 2,7-диметил-2,4,6-октатриен) и триметилдодекатетраены (например, 2,6,10-триметил-1,5,9,11-додекатетраен, α-фарнезен и β-фарнезен), и тому подобные соединения. В некоторых предпочтительных вариантах реализации, исходная композиция изопрена представляет собой биоизопреновую композицию.
[0639] В некоторых вариантах реализации, способ получения компонента топлива из изопрена включает приведение в контакт композиции изопрена высокой степени чистоты с каталитической системой для превращения по меньшей мере части исходной композиции изопрена в ненасыщенные димеры и/или тримеры изопрена. В некоторых вариантах реализации, указанная каталитическая система включает катализатор на основе Ni, Fe или Со, и изопрен в исходной композиции превращается в 8-членный кольцевой димер изопрена, включающий диметилциклооктадиены, такие как 1,5-диметилциклоокта-1,5-диен и 1,6-диметилциклоокта-1,5-диен. В некоторых вариантах реализации, каталитическая система включает соединение никеля. Катализированная Ni димеризация изопрена позволяет получить смесь диметил-1,5-циклооктадиенов, состоящую из 1,5-диметил-1,5-циклооктадиена до 1,6-диметил-1,5-циклооктадиена в соотношении приблизительно от 90 до 10, от 80 до 20, от 70 до 30, от 60 до 40, от 50 до 50, от 40 до 60, от 30 до 70, от 20 до 80 и от 10 до 90. В одном варианте реализации, каталитическая система включает 3-компонентный катализатор, содержащий карбоксилаты Ni или р-кетоны, алюминийорганические или магнийорганические соединения и содержащий заместители трифенилфосфит. Например, дегазированный раствор исходной композиции изопрена высокой степени чистоты в безводном толуоле смешивают с Ni(acac)2, Еt3Al и трис(3,4-бис(диметиламино)фенил)фосфитом в атмосфере азота, и полученную смесь греют при 95°С с получением диметилциклооктадиена. В другом варианте реализации, каталитическая система включает карбоксилаты Fe или р-дикетоновые соединения, алюминийорганические или магнийорганические соединения и 2,2'-дипиридиловые производные с электронодонорными группами. Например, исходную композицию изопрена греют со смесью ацетилацетоната Fe, 4,4'-диметил-2,2'-дипиридилом и Et3Al в толуоле, что позволяет получить 1,6-диметил-1,5-циклооктадиен с хорошим выходом. В некоторых предпочтительных вариантах реализации, исходная композиция изопрена представляет собой биоизопреновую композицию.
[0640] В некоторых вариантах реализации, способ получения компонента топлива из изопрена включает приведение в контакт композиции изопрена высокой степени чистоты с каталитической системой для превращения по меньшей мере части исходной композиции изопрена в ненасыщенные димеры и/или тримеры изопрена. В некоторых вариантах реализации, каталитическая система включает катализатор на основе Ru, Fe, Ni или Pd или их комбинации, и изопрен в исходной композиции превращают в смесь, содержащую 6-членные кольцевые димеры изопрена. В одном варианте реализации, указанная каталитическая система представляет собой Fе(NО)2Сl-бис(1,5-циклооктадиен)никелевую каталитическую систему, и изопрен в исходной композиции циклодимеризуется при низких температурах (например, от -5 до+20°С) с получением 1-метил- и 2-метил-4-изопропенил-1-циклогексена и 1,4- и 2,4-диметил-4-винил-1-циклогексена. В другом варианте реализации, взаимодействие со смешанным катализатором, состоящим из трис(содержащий заместители гидрокарбил)фосфита, арсенита или антимонита и соединения металла(О) Группы VIII (например, ацетилацетоната Ni), превращает изопрен в исходной композиции в 1,4-диметил-4-винил-1-циклогексен и 1,5-диметил-1,5-циклооктадиен. В другом варианте реализации, взаимодействие исходной композиции изопрена с рутениевым катализатором (например, см. Itoh, Kenji; Masuda, Katsuyuki; Fukahori, Takahiko; Nakano, Katsumasa; Aoki. Katsuyuki; Nagashima, Hideo, Organometallics (1994), 13(3), 1020-9) превращает изопрен в циклические димеры С 10 (например, в смесь диметилциклооктадиенов). Рутениевый катализатор можно синтезировать в два этапа из RuCl3 и пентаметилциклопентадиена (С5Ме5Н). Указанный процесс можно осуществить в периодическом режиме с извлечением и повторным использованием катализатора. В некоторых предпочтительных вариантах реализации, исходная композиция изопрена представляет собой биоизопреновую композицию. Один вариант реализации указанного способа показан на Схеме XI.
[0641] В некоторых вариантах реализации, способ получения компонента топлива из изопрена включает приведение в контакт композиции изопрена высокой степени чистоты с каталитической системой для превращения по меньшей мере части исходной композиции изопрена в ненасыщенные димеры и/или тримеры изопрена. В некоторых вариантах реализации, каталитическая система включает катализатор на основе Ni, Ti, А1 или Mg или смеси указанных металлов, и изопрен в исходной композиции превращают в смесь, содержащую циклические тримеры изопрена, такие как триметилциклододекатриены. В одном варианте реализации, каталитическая система для тримеризации изопрена включает Ni и/или Ti, одно или более металлоорганических соединений и соединение Группы VA. Указанную реакцию можно осуществить в растворителе, содержащем гидроксильную группу. В другом варианте реализации, олигомеризация изопрена, катализированная нафтенатом никеля и изопренмагнием в присутствии различных фосфитов в качестве доноров электронов, позволяет получить циклические димеры, включающие диметилциклооктадиен, в частности, 1,1,1-трис(гидроксиметил)пропанфоефит позволяет избирательно получить триметилциклододекатриен.
Схема XI
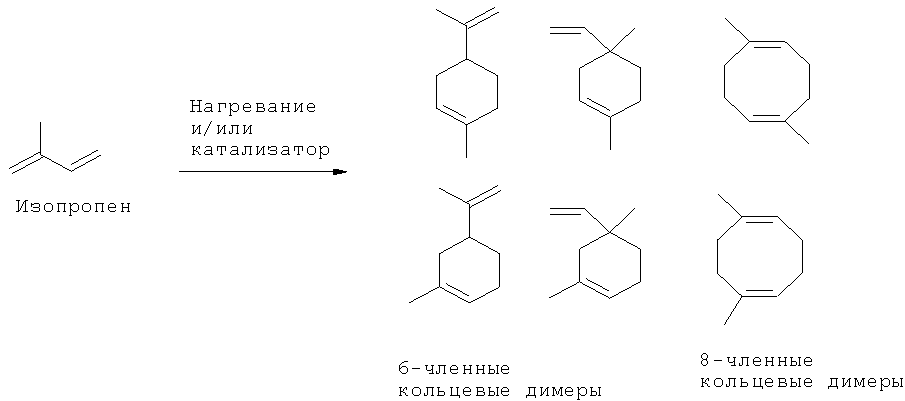
[0642] В некоторых вариантах реализации, способ получения компонента топлива из изопрена включает приведение в контакт композиции изопрена высокой степени чистоты с каталитической системой для превращения по меньшей мере части исходной композиции изопрена в ненасыщенные димеры и/или тримеры изопрена. В некоторых вариантах реализации, каталитическая система включает катализатор на основе Ni, Pd или Сr или смеси указанных металлов, и изопрен в исходной композиции превращается в теломеры или линейные димеры и/или тримеры. В одном варианте реализации, каталитическая система, включающая комплексы Pd(0) (например, Рd(асас)2-Рh3Р и Рd(ОАс)2-Рh3Р), катализирует димеризацию и теломеризацию изопрена с получением линейных димеров изопрена (например, 2,7-диметил-1,3,7-октатриена). В одном варианте реализации, реакцию осуществляют в метаноле в качестве растворителя, и получают метиловые эфиры, такие как метоксидиметилоктадиены (например, 1-метокси-2,7-диметил-2,7-октадиен и 3-метокси-2,7-диметил-1,7-октадиен). В другом варианте реализации, каталитическая система включает замещенные двухвалентными и трехвалентными переходными металлами монтмориллониты (например, Сr3+-монтмориллонит). В другом варианте реализации, каталитическая система включает катализатор №(0)-аминофосфинит, и изопрен в исходной композиции превращают в региоселективные линейные димеры в ориентации хвост к хвосту. В некоторых вариантах, образование линейного димера сопровождается конкурентной реакцией циклодимеризации. В другом варианте реализации, каталитическая система включает катализатор хром N.N-бис(диарилфосфино)амин (например, см. Bowen, L.; Charemsuk, M.; Wass, D.F. Chem. Commun. (2007) 2835-2837), и изопрен превращается в линейные и циклические тримеры С15. В одном варианте реализации, хромовый катализатор получают in situ из СrСl3(ТГФ)3 и фосфинового лиганда PNP.
[0643] В некоторых вариантах реализации, способ получения компонента топлива из биоизопреновой композиции включает химическое превращение значительной части изопрена в указанной биоизопреновой композиции путем (i) приведения в контакт биоизопреновой композиции с катализатором для катализа тримеризации изопрена с получением ненасыщенного тримера изопрена и (ii) гидрирования полученного тримера изопрена с получением компонента топлива. В некоторых вариантах реализации, по меньшей мере приблизительно 95% изопрена в указанной биоизопреновой композиции превращается в неизопреновые соединения в процессе химического превращения.
[0644] В некоторых вариантах реализации, способ получения компонента топлива из изопрена включает: (а) получение коммерчески предпочтительного количества любой из исходных композиций изопрена высокой степени чистоты, описанных в настоящем описании; (b) превращение по меньшей мере части исходной композиции изопрена в ненасыщенные производные изопрена; и (с) гидрирование ненасыщенных производных изопрена с получением насыщенных соединений. В некоторых вариантах реализации, гидрирование ненасыщенных производных изопрена в насыщенные соединения осуществляют в периодическом режиме. В некоторых вариантах реализации, гидрирование ненасыщенных производных изопрена в насыщенные соединения осуществляют в непрерывном режиме. Один вариант реализации указанного способа показан на Схеме XII.
Схема XII
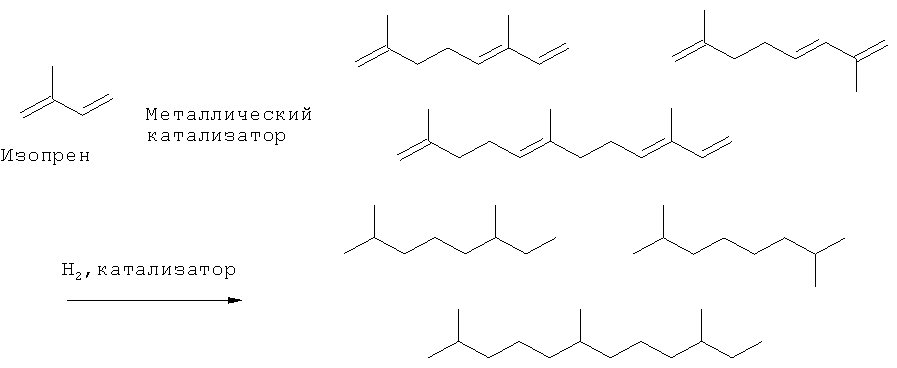
[0645] В некоторых вариантах реализации, указанный способ получения компонента топлива из изопрена включает: (а) получение коммерчески предпочтительного количества любой из исходных композиций изопрена высокой степени чистоты, описанных в настоящем описании; (b) превращение по меньшей мере части исходной композиции изопрена в кислородсодержащие производные изопрена; и возможно (с) гидрирование любых ненасыщенных кислородсодержащих производных изопрена с получением насыщенных оксигенатов. В некоторых вариантах реализации, исходную композицию изопрена приводят в контакт с катализатором в присутствии спиртов (например, метанола или этанола, или их смеси) с получением кислородсодержащих производных изопрена, включающих один или более ненасыщенных или насыщенных простых эфиров (например, метиловые эфиры или этиловые эфиры, или их смеси). В некоторых вариантах реализации, катализатор представляет собой кислотный катализатор, такой как серная кислота, твердофазная серная кислота (например, Dowex Marathon®), жидкие и твердофазные фторсульфоновые кислоты (например, трифторметансульфоновая кислота и нафион-Н (DuPont)). Также можно применять цеолитовые катализаторы, например, бета-цеолит, при условиях, аналогичных описанным у Hensel и др. [Hensen, К.; Mahaim, С.; Holderich, W.F., Applied Catalysis А: General (1997) 140(2), 311-329.] для метоксилирования лимонена и аналогичных монотерпенов. В некоторых вариантах реализации, исходные композиции изопрена или ненасыщенные димеры или тримеры изопрена подвергают окислению/гидрированию с получением гидроксилированных производных изопрена, включающих один или более спиртов, таких как спирты и диолы С5, С10 и С15. В некоторых вариантах реализации, исходную композицию изопрена подвергают гидроксилированию/этерификации с получением спиртов и эфиров. Например, биоизопрен или ненасыщенный интермедиат подвергают пероксидированию перкислотами, такими как перуксусная и 3-хлорпербензойная кислота, с получением эпоксидов; и гидратации i) с помощью воды и кислотных катализаторов и ii) с помощью способов гидроборирования, с получением спиртов и диолов. Такие реакции описаны, например, у Michael В. Smith и Jerry March, Advanced Organic Chemistry: Reactions, Mechanisms, and Structure, шестое издание, John Wiley & Sons, 2007. В некоторых предпочтительных вариантах реализации, исходная композиция изопрена представляет собой биоизопреновую композицию.
[0646] В некоторых вариантах реализации, способ получения компонента топлива из изопрена включает: (а) получение коммерчески предпочтительного количества любой из исходных композиций изопрена высокой степени чистоты, описанных в настоящем описании; (b) частичное гидрирование исходной композиции изопрена с получением моноолефинов (например, 2-метилбут-1-ена, 3-метилбут-1-ена и 2-метилбут-2-ена); и (с) получение компонента топлива из моноолефинов. В одном варианте реализации, моноолефин подвергают димеризации. В другом варианте реализации, осуществляют реакцию моноолефина с другими олефинами, применяя обычный углеводородный катионный катализ, например, который используется для превращения изобутилена в изооктан. Продукт димеризации или реакции с другими олефинами затем подвергают гидрированию с получением насыщенных компонентов топлива. В некоторых предпочтительных вариантах реализации, изопрен высокой степени чистоты представляет собой биоизопреновую композицию. В некотором варианте реализации, исходную композицию изопрена подвергают частичному гидрированию, применяя палладиевый катализатор, такой как Pd/СаСО3, Pd/BaSO4, Pd/C, палладиевая чернь, Pd/SiO3, Ро/Аl2О3 или Pd/SiO2. В некотором варианте реализации, исходную композицию изопрена подвергают частичному гидрированию, применяя комплекс дендримера полиамидоамина (РАМАМ) с палладием на кремниевой подложке. В некотором варианте реализации, исходную композицию изопрена подвергают частичному гидрированию, применяя катализаторы палладий-золото и палладий-серебро (например, Pd-Au/SiO2 и Pd-Ag/SiO2), обладающие высокой избирательностью по отношению к восстановлению изопрена в моноолефины по сравнению с полностью восстановленными алканами С5. В некотором варианте реализации, исходную композицию изопрена подвергают частичному гидрированию, применяя в качестве катализатора металл Группы VIB на подложках из неорганического материала (например, металла цеолита), например, катализатор Мо/Аl2О3. В некотором варианте реализации, исходную композицию изопрена подвергают частичному гидрированию, применяя монолитный слой катализатора, который может находиться в сотовой конфигурации. Материалы подложки для монолитного слоя катализатора могут включать металлы, такие как никель, платина, палладий, родий, рутений, серебро, железо, медь, кобальт, хром, иридий, олово и сплавы или смеси перечисленных металлов. В некотором варианте реализации, исходную композицию изопрена подвергают частичному гидрированию, применяя катализатор типа яичной скорлупы Рd/δ-Аl2О3, особенно если в реакции нет воды. В некотором варианте реализации, исходную композицию изопрена подвергают частичному гидрированию, применяя катализатор с металлом Группы VIII, модифицированный металлом Группы IB. VIB, VIIB или цинком для уменьшения отравления катализатора. Способы превращения изопрена в изоамилены (моноолефины) можно осуществить в непрерывном или периодическом режиме, применяя либо гомогенные, либо гетерогенные катализаторы. Один вариант реализации указанного способа показан на Схеме XIII.
[0647] В некоторых вариантах реализации, изоамилены, полученные в результате частичного гидрирования изопрена, подвергают тримеризации в жидкой фазе на ионообменных смолах и цеолитах. См., GranGranollers, Ind. Eng. Chem. Res., 49 (8), стр.3561-3570 (2001). Схема XIII
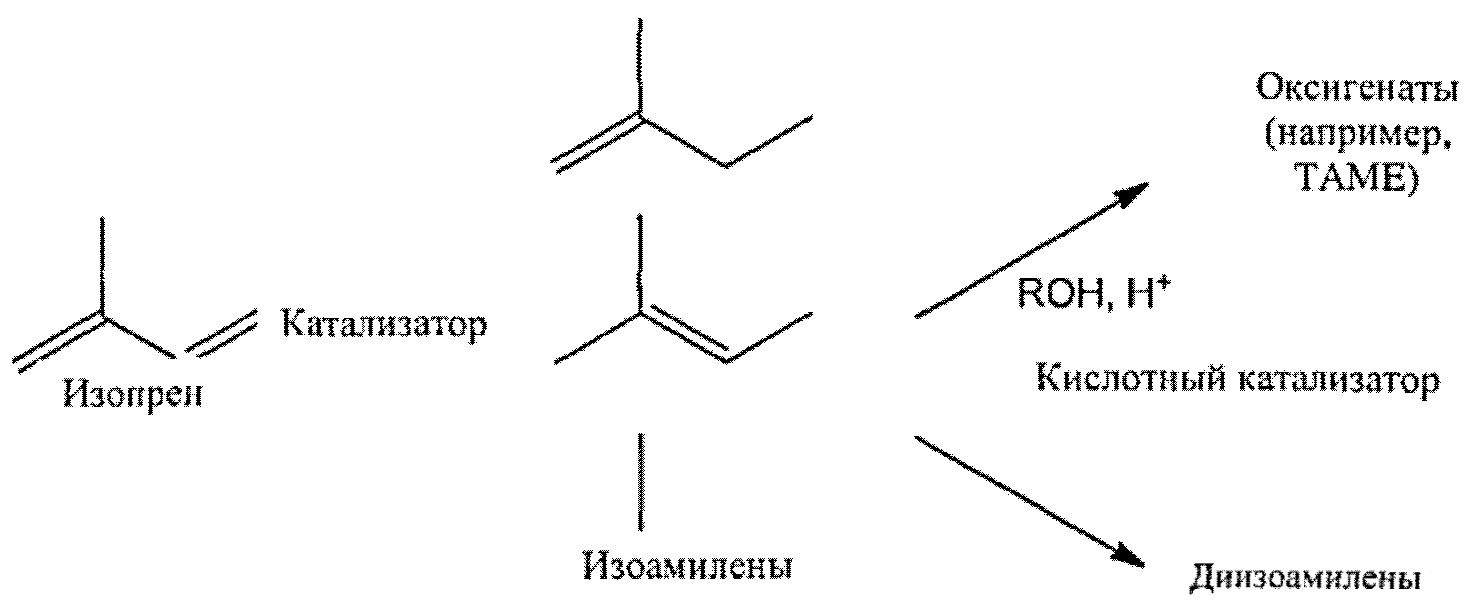
[0648] В некоторых вариантах реализации, способ получения компонента топлива из изопрена включает: (а) получение коммерчески предпочтительного количества любой из исходных композиций изопрена высокой степени чистоты, описанных в настоящем описании; (b) частичное гидрирование исходной композиции изопрена с получением моноолефина (например, 2-метилбут-1-ена, 3-метилбут-1-ена и 2-метилбут-2-ена); (с) приведение в контакт полученного моноолефина с катализатором для димеризации моноолефинов с получением димата с другим моноолефином; и (d) гидрирование продукта димеризации (димата) с получением насыщенных углеводородных компонентов топлива. В некоторых предпочтительных вариантах реализации, изопрен высокой степени чистоты представляет собой биоизопреновую композицию. В некоторых вариантах реализации, указанный другой моноолефин представляет собой изоамилен, полученный из исходной композиции изопрена высокой степени чистоты. В некоторых вариантах реализации, другой моноолефин представляет собой олефин, полученный из другого источника, такого как пропилен, бутан или изобутен. В некоторых вариантах реализации, катализатор для димеризации представляет собой катализатор из смолы (например, Amberlyst, Amberlyst 35, Amberlyst 15, Amberlyst XN1010, Amberlyst XE586). В некоторых вариантах реализации, катализатор для димеризации представляет собой каталитический материал, включающий кислотное мезопористое молекулярное сито, такое как мезопористое сито, заключенное в цеолитовую структуру, ZSM-5, ферриерит, ZSM-22 или ZSM-23. В некоторых вариантах реализации, катализатор для димеризации представляет собой каталитический материал, который термически стабилен при высоких температурах (например, при по меньшей мере 900°С). В некоторых вариантах реализации, катализатор для димеризации представляет собой каталитический материал, включающий кислотное мезопористое молекулярное сито. В некоторых вариантах реализации, катализатор для димеризации представляет собой твердый кислотный катализатор (например, твердый катализатор из фосфорной кислоты, кислотные ионообменные смолы). Один вариант реализации указанного способа показан на Схеме XIV.
Схема XIV
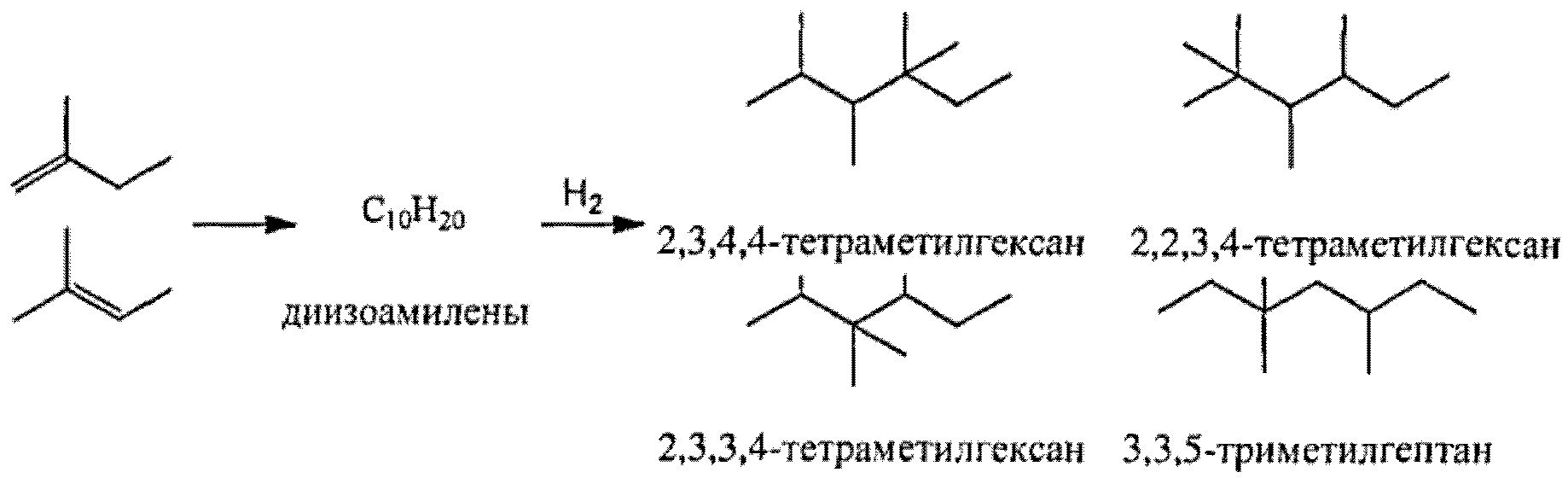
[0649] В некоторых вариантах реализации, способ получения компонента топлива из изопрена включает: (а) получение коммерчески предпочтительного количества любой из исходных композиций изопрена высокой степени чистоты, описанных в настоящем описании; (b) частичное гидрирование исходной композиции изопрена с получением изоамилена (например, 2-метилбут-1-ена, 3-метилбут-1-ена и 2-метилбут-2-ена); (с) приведение изоамилена в контакт со спиртом и катализатором с получением оксигената; и (с) получение компонента топлива из оксигената изоамилена. В некоторых предпочтительных вариантах реализации, изопрен высокой степени чистоты представляет собой биоизопреновую композицию. В некоторых вариантах реализации, изоамилен приводят в контакт с этанолом, в результате чего образуется топливный оксигенат представляющий собой эфир, такой как TAME.
[0650] В некоторых вариантах реализации, любой из способов, описанных в настоящей заявке, дополнительно включает очистку исходной композиции изопрена перед химическим превращением. Например, изопрен, полученный с применением композиций и способов согласно настоящему изобретению, можно очистить с помощью стандартных методик. Очистка относится к процессу, при котором изопрен отделяют от одного или нескольких компонентов, которые присутствуют при получении изопрена. В некоторых вариантах реализации, изопрен получают в виде по существу чистой жидкости. Примеры способов очистки включают (i) перегонку из раствора в жидком экстрагирующем агенте и (ii) хроматографию. В настоящем описании, "очищенный изопрен" означает изопрен, который отделили от одного или нескольких компонентов, которые присутствуют при получении изопрена. В некоторых вариантах реализации, изопрен по меньшей мере приблизительно на 20% по массе свободен от других компонентов, которые присутствуют при получении изопрена. В различных вариантах реализации, изопрен является чистым на по меньшей мере или приблизительно 25%, 30%, 40%. 50%, 60%, 70%. 75%, 80%. 90%, 95% или 99% по массе. Чистоту можно проанализировать с помощью любого подходящего способа, например, с помощью колоночной хроматографии, анализа ВЭЖХ или анализа ГХ-МС. В некоторых вариантах реализации, биоизопрен получают из выделяющегося при ферментации газа путем предварительной адсорбции на активированном угле, а затем десорбции и конденсации с получением жидкой композиции изопрена для химического превращения в компонент топлива.
Непрерывный процесс получения топлива
[0651] Согласно настоящему изобретению также предложен непрерывный процесс получения компонента топлива из изопрена, включающий: (а) непрерывное получение коммерчески предпочтительного количества изопрена высокой степени чистоты; и (b) непрерывное химическое превращение по меньшей мере части коммерчески предпочтительного количества изопрена высокой степени чистоты в компонент топлива. В непрерывном процессе согласно настоящему изобретению, поток изопрена высокой степени чистоты получают непрерывно, например, с помощью биологического процесса (например, путем культивирования клеток, продуцирующих изопрен) и запускают в реактор для химического превращения. В некоторых вариантах реализации, изопрен из выделяющегося при ферментации газа отделяют от воды и других постоянных газов (например, O2, N; и СО2), применяя экстрактивную перегонку, конденсацию, адсорбцию или мембраны, в блоке непрерывной очистки, где уровень кислорода снижен до уровня промилле и другие беспокоящие примеси удалены; пар изопрена в каталитических условиях превращают в димеры (С 10) и тримеры (С15), применяя гетерогенный катализатор; желательный продукт отделяют и непрореагировавший изопрен возвращают в реактор для дальнейшего превращения. В некоторых вариантах реализации, каталитическую димеризацию контролируют путем измерения уровней желательных углеводородов С 10 в газообразной фазе.
[0652] В некоторых вариантах реализации, поток полученного биологическим путем изопрена пропускают через химический реактор (например, реакционную пробирку), в котором поддерживается температура от приблизительно 100°С до приблизительно 300°С, где полученный биологическим путем изопрен подвергают реакции димеризации. В одном варианте реализации, полученные димеры изопрена отделяют от фракции продуктов, и по меньшей мере часть непрореагировавшего изопрена возвращают обратно в химический реактор. В одном варианте реализации, полученные ненасыщенные димеры изопрена приводят в контакт с катализатором гидрирования и источником водорода во втором химическом реакторе, в котором получают частично гидрированные и/или полностью гидрированные продукты. Указанный процесс может дополнительно включать этап получения изопрена из газа, выделяющегося в биореакторе, в котором продуцируется изопрен.
[0653] В некоторых вариантах реализации, поток биоизопрена, содержащий продуцированный совместно с ним водород, сначала отделяют от газообразного водорода, а затем фракцию биоизопрена пропускают через химический реактор (например, через реакционную пробирку), в котором поддерживается температура от приблизительно 100°С до приблизительно 300°С, где полученный биологическим путем изопрен подвергают реакции димеризации. В одном варианте реализации, полученные димеры изопрена отделяют от фракции продуктов, и по меньшей мере часть непрореагировавшего изопрена возвращают обратно в химический реактор. В одном варианте реализации, полученные ненасыщенные димеры изопрена приводят в контакт с катализатором гидрирования и источником водорода во втором химическом реакторе, в котором получают частично гидрированные и/или полностью гидрированные продукты. В одном варианте реализации, фракцию водорода, отделенную от потока совместно продуцированных изопрена и водорода, используют на этапе гидрирования. Указанный процесс может дополнительно включать этап получения изопрена из газа, выделяющегося в биореакторе, в котором продуцируется изопрен. Процесс может дополнительно включать этап очистки фракции водорода, выделенного из потока совместно продуцированных изопрена и водорода, с помощью способов очистки, известных в данной области, таких как низкотемпературная конденсация и адсорбция на твердой матрице.
Удаление диенов и полимеров из топливных продуктов
[0654] Топливные композиции часто включают ненасыщенные соединения (олефины, диолефины и полиолефины), которые с течением времени могут образовывать камеди, смолы, полимеры и другие нежелательные побочные продукты (например, см. в Pereira и Pasa (2006) Fuel, 85, 1860-1865 и в упомянутых там ссылках). Как правило, чем больше степень ненасыщенности данного соединения, тем более вероятно указанное соединение даст такие побочные продукты. Изопрен представляет собой 1,3-диен, который легко образует нежелательные полимерные побочные продукты, присутствующие в топливных композициях. Несмотря на то, что существуют добавки к топливу (антиокислители, тушители радикалов и т.д.), которые могут снижать степень образования побочных продуктов, такие побочные продукты все же могут образоваться с течением времени. Олефины также могут способствовать образованию приземного слоя озона, когда они высвобождаются в атмосферу при испарении топлива или в результате неполного сгорания содержащего олефин топлива.
[0655] Соответственно, топливные композиции, полностью или частично полученные из изопрена, должны содержать малое количество или не должны вообще содержать свободный изопрен. Можно применять ряд способов, состоящих либо в удалении изопрена из топливных композиций, например, с помощью очистки путем перегонки, взаимодействия со спиртами с образованием простых эфиров, либо в гидрировании для превращения изопрена в насыщенные производные. В качестве альтернативы, изопрен можно обработать диенофилом, таким как яблочный ангидрид, с образованием инертных аддуктов, которые не способствуют образованию нежелательных побочных продуктов.
[0656] Предусмотрены топливные композиции, содержащие производные изопрена, которые по существу не содержат изопрен. В некоторых вариантах реализации, топливная композиция содержит менее чем 0,01%, 0,1%, 1%, 2%, 3%, 4%. 5%, 10% или 15% изопрена. Также предусмотрены способы химического превращения биоизопреновой композиции в топливные композиции, содержащие производные изопрена, которые по существу не содержат изопрен. В некоторых вариантах реализации, значительную часть изопрена из биоизопреновой композиции превращают в компоненты топлива. В некоторых вариантах реализации, значительную часть изопрена из биоизопреновой композиции превращают в интермедиаты, которые затем можно подвергнуть превращению с получением компонентов топлива. В некоторых вариантах реализации, значительную часть изопрена из биоизопреновой композиции превращают в соединения, отличные от изопрена. "Значительная часть" представляет собой 99,99%, 99,9%, 99%, 98%, 97%, 96%, 95%, 90%, 85% или 80%.
[0657] В некоторых случаях, изопрен и другие конъюгированные диены могут образовывать полимерные продукты со смолистой консистенцией, которые могут снизить выход желательных продуктов и/или деактивировать катализаторы (см., например, R.C.C. Pereira и V.M.D. Pasa. Fuel 85 (2006) 1860-1865). В некоторых вариантах реализации, предусмотрены способы определения количества конъюгированного диена, присутствующего в смеси продуктов. D.F. Andrade и др. описали различные способы определения количества присутствующих конъюгированных диенов (Fuel (2010), doi:10,106/j.fuel/2010,01,003), включая следующие способы: 1) способ UOP-326 (способ с применением малеинового ангидрида), полуколичественный способ, при котором измеряют количество малеинового ангидрида, участвующего в реакции Дильса-Альдера с диеном; 2) полярографию; 3) газовую хроматографию, при которой диен можно привести в контакт с дериватизационным агентом, таким как 4-метил-1,2,4-триазолин-3,5-дион (MTAD) или 4-фенил-1,2,4-триазолин-3,5-дион (PTAD); 4) ВЭЖХ; 5) сверхкритическую жидкостную хроматографию; 6) ЯМР; 7) спектроскопию в УФ- и ближней ИК-области; и 8) другие спектроскопические способы, которые могут включать предварительную дериватизацию диена фторборатом пара-нитрофенилдиазония.
[0658] В настоящем описании предусмотрены способы минимизирования образования камеди и/или уменьшения количества продуцированной камеди. В некоторых вариантах реализации, для минимизирования образования камеди применяют антиокислитель. В других вариантах реализации, полимерные побочные продукты возвращают обратно в технологический поток. В некоторых вариантах реализации, осуществляют деполимеризацию полимерных побочных продуктов путем метатезиса олефинов. Метатезис олефинов можно осуществить, применяя катализатор на основе молибдена или вольфрама, такой как бис(2-третбутилфеноксид) 2,6-диизопропилфенилимидонеофилиден молибдена (см, US 5,446,102).
[0659] В некоторых вариантах реализации, любой из способов, описанных в настоящей заявке, дополнительно включает характеристику продуктов данных реакций и оценку вероятного энергетического потенциала. Например, продукты можно охарактеризовать с помощью стандартных способов, известных в данной области, например, с помощью ГХ/МС, ЯМР, спектроскопии в УФ-видимой области и в ИК-области спектра, определения температуры кипения, плотности и других физических свойств. Продукты можно дополнительно охарактеризовать с помощью двойного метода «отпечатка пальцев» изотопов углерода (см. патент США номер 7,169,588). Вероятный энергетический потенциал продуктов оценивают с помощью параметров, представляющих собой меру свойств топлива, таких как удельная энергоемкость, теплота сгорания, растворимость в воде, октановое/цетановое число, плотность, вязкость, поверхностное натяжение, энтальпия испарения, диффузность пара, точка воспламенения, точка самовозгорания, пределы воспламеняемости, температура помутнения и химическая стабильность.
[0660] Также, как и для промышленного нефтяного топлива, можно исследовать кислотность, плотность, содержание микроэлементов, бензола, общее содержание ароматических соединений, содержание воды и коррозивность продуктов BioIsoFuel™. Чтобы удостовериться в том, что незначительные примеси в продуктах BioIsoFuel™ не оказывают нежелательного влияния на свойства материалов, образцы также можно проверить на коррозивность и совместимость с топливными системами с помощью стандартных тестов Американского общества по испытанию материалов (ASTM), таких как определение воды по методу Карла Фишера и проба медной пластинкой на коррозивность.
Топливные композиции
[0661] Согласно настоящему изобретению предложена топливная композиция, содержащая компонент топлива, полученный с помощью любого из способов и процессов, описанных в данной заявке. В некоторых вариантах реализации, указанный компонент топлива включает один или более из углеводородов, выбранных из группы, состоящей из насыщенных углеводородов С 10 и С 15, полученных из изопрена, и кислородсодержащих производных изопрена. Ожидается, что углеводородные продукты BioIsoFuel™ будут абсолютно совместимы с бензином и дизелем. Ожидается, что смеси BioIsoFuel™ с промышленным нефтяным топливом будут обладать лучшими свойствами, так как они не содержат кислоты, серу, ароматические соединения или другие нежелательные примеси.
[0662] В некоторых предпочтительных вариантах реализации, указанный компонент топлива включает производные биоизопрена. Ожидается, что возникнет существенная потребность в топливе, полученном из биоизопрена, который получают из возобновляемых источников на не нефтехимической основе. Полагают, что коммерческие заказчики и потребители будут предпочитать покупать компоненты топлива, полученные из таких экологически благоприятных источников, тем компонентам топлива, которые получают с использованием изопрена, полученного в результате нефтехимического процесса. Также полагают, что заказчики захотят платить повышенную цену за такие экологически благоприятные продукты, которые получают из возобновляемых источников. Компоненты топлива, полученные из биоизопреновых композиций, описанных в данной заявке, дают преимущество, состоящее в том, что существует возможность подтверждения того, что они были получены из источников на не нефтехимической основе.
[0663] В некоторых вариантах реализации, компонент топлива включает один или более из насыщенных циклических С10-углеводородов, таких как 1,2-бис(изопропил)циклобутан, 1,2-бис(изопропил)циклобутан, 1-метил-4-изопропилциклогексан, 1-метил-3-изопропилциклогексан. 1-этил-1,4-диметилциклогексан, 1-этил-1,3-диметилциклогексан, 1,5-диметилциклооктан и 1,4-диметилциклооктан. В некоторых вариантах реализации, указанный компонент топлива включает один или более из насыщенных циклических углеводородов С 15, таких как 1,5,9-триметилциклододекан и 1,5,10-триметилциклододекан. В некоторых вариантах реализации, компонент топлива включает один или более из насыщенных алифатических С10-углеводородов, таких как 2,6-диметилоктан, 2,7-диметилоктан и 3,6-диметилоктан. В некоторых вариантах реализации, компонент топлива включает один или более из насыщенных алифатических углеводородов С 15, таких как 2,6,10-триметилдодекан, 2,7,10-триметилдодекан и 3,7,10-триметилдодекан. В некоторых вариантах реализации, компонент топлива включает 2-метилбутан. В некоторых вариантах реализации, компонент топлива включает один или более из углеводородов, выбранных из группы, состоящей из 1,2-бис(изопропил)циклобутана, 1,2-бис(изопропил)циклобутана, 1-метил-4-изопропилциклогексана, 1-метил-3-изопропилциклогексана, 1-этил-1,4-диметилциклогексана, 1-этил-1,3-диметилциклогексана, 1,5-диметилциклооктана, 1,4-диметилциклооктана, 1,5,9-триметилциклододекана, 1,5,10-триметилциклододекана, 2,6-диметилоктана, 2,7-диметилоктана, 3,6-диметилоктана, 2,6,10-триметилдодекана, 2,7,10-триметилдодекана, 3,7,10-триметилдодекана и 2-метилбутана.
[0664] В некоторых вариантах реализации, указанный компонент топлива включает один или более из насыщенных продуктов гидроксилирования, таких как спирты и диолы С5 (например, 3-метилбутан-1-ол, 2-метилбутан-1-ол и 2-метилбутан-2-ол, 3-метилбутан-1,3-диол и 2-метилбутан-2,3-диол), спирты и диолы С10 (например, 3.7-диметилоктан-1-ол, 2,7-диметилоктан-1-ол, 2,7-диметилоктан-2-ол и 2,7-диметилоктан-2,7-диол) и циклические С10-спирты (например, 2-(4-метилциклогексил)пропан-2-ол, 2-(4-метилциклогексил)пропан-1-ол, 2-(1,4-диметилциклогексил)этанол и 4-этил-1.4-диметилциклогексанол). В некоторых вариантах реализации, компонент топлива включает один или более из насыщенных простых эфиров, таких как 1,3-диэтокси-3- метилбутан, 1-этокси-3-метилбутан, 1-метокси-2,7-диметилоктан и 3-метокси-2,7-диметилоктан. В некоторых вариантах реализации, компонент топлива включает один или более из полученных из изопрена оксигенатов, выбранных из группы, состоящей из 3-метилбутан-1-ола, 2-метилбутан-1-ола, 2-метилбутан-2-ола, 3-метилбутан-1,3-диола, 2-метилбутан-2,3-диола, 3,7-диметилоктан-1-ола, 2,7-диметилоктан-1-ола, 2,7-диметилоктан-2-ола, 2,7-диметилоктан-2,7-диола, 2-(4-метилциклогексил)пропан-2-ола, 2-(4-метилциклогексил)пропан-1-ола, 2-(1,4-диметилциклогексил)этанола, 4-этил-1,4-диметилциклогексанола, 1,3-диэтокси-3-метилбутана, 1-этокси-3-метилбутана, 1-метокси-2,7-диметилоктана и 3-метокси-2,7-диметилоктана.
[0665] В некоторых вариантах реализации, указанный компонент топлива включает меньше или приблизительно 0,5 мкг/л продукта из углеводорода С5, отличного от изопрена, после того, как его подвергли этапам Согласно любому из способов и процессов, описанных в данной заявке. В одном варианте реализации, компонент топлива по существу свободен от продукта из углеводорода С5, отличного от изопрена, после того, как его подвергли этапам Согласно любому из способов и процессов, описанных в данной заявке. В некоторых вариантах реализации, компонент топлива включает меньше или приблизительно 0,2, 0,12, 0,10, 0,08, 0,06, 0,04, 0,02, 0,01, 0,005, 0,001, 0,0005, 0,0001, 0,00005 или 0,00001% масс.С5-углеводородов, отличных от изопрена (таких, как 1,3-циклопентадиен, цис-1,3-пентадиен, транс-1,3-пентадиен, 1,4-пентадиен, 1-пентин, 2-пентин, 1-пентен, 2-метил-1-бутен, 3-метил-1-бутин, пент-4-ен-1-ин, транс-пент-3-ен-1-ин или цис-пент-3-ен-1-ин), по отношению к общей массе всех С5-углеводородов в исходной композиции. В некоторых вариантах реализации, указанный компонент топлива включает углеводороды С5, отличные от изопрена (такие как 1,3-циклопентадиен, транс-1,3-пентадиен, цис-1,3-пентадиен, 1,4-пентадиен, 1-пентин, 2-пентин, 1-пентен, 2-метил-1-бутен, 3-метил-1-бутин, пент-4-ен-1-ин, транс-пент-3-ен-1-ин или цис-пент-3-ен-1-ин), в концентрации менее чем 100, 10, 1. 0,1 или 0,01 промилле.
[0666] Должно быть очевидно, что компоненты, отличные от изопрена, в биоизопреновых композициях, описанных в данной заявке, будут превращены в различные продукты после осуществления различных процессов, описанных в данной заявке. Чувствительность катализаторов на основе металлов, применяемых в способах/процессах, к компонентам, отличным от изопрена, различны, в зависимости от природы и уровней данных компонентов. Для процесса термической димеризации, допускается гораздо более широкий диапазон соединений. В некоторых случаях, компонент, отличный от изопрена, будет реагировать с изопреном с образованием аддуктов, например, в реакциях Дильса-Альдера метакролеина и метилвинилкетона с изопреном образуются 6-членные продукты. Ненасыщенные аддукты можно впоследствии гидрировать с получением насыщенных производных, которые присутствуют в компонентах топлива и композициях, например, 1,4-диметил-1-(гидроксиметил)циклогексана и 1-(1-гидроксиэтил)-4-метилциклогексана (см. Схему XV).
Схема XV. Примеры остаточных следовых примесей, получаемых из Биоизопрена™
i) Гидрированные аддукты Дильса-Альдера ОН
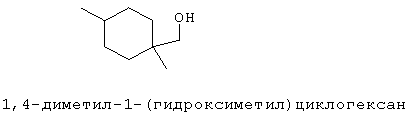
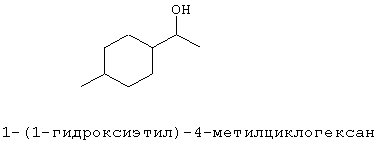
ii) Алкил
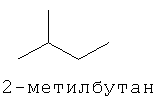
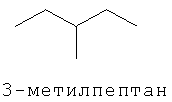
iii) Спирты

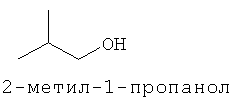

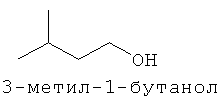
iv) Сложные эфиры
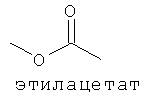
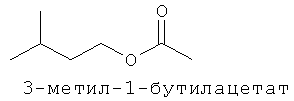
[0667] В некоторых вариантах реализации, компонент топлива включает продукт из соединения, выбранного из группы, состоящей из этанола, ацетона, пренильных спиртов С5 и изопреноидных соединений с 10 или более атомами углерода, после того, как его подвергли этапам Согласно любому из способов и процессов, описанных в данной заявке. В некоторых вариантах реализации, указанный компонент топлива включает один или более продуктов из одного или нескольких соединений, выбранных из группы, состоящей из этанола, ацетона, метанола, ацетальдегида, метакролеина, метилвинилкетона, 2-метил-2-винилоксирана, цис- и транс-3-метил-1,3-пентадиена, пренильных спиртов С5 (таких как 3-метил-3-бутен-1-ол или 3-метил-2-бутен-1-ол), 2-гептанона, 6-метил-5-гептен-2-она, 2,4,5-триметилпиридина, 2,3,5-триметилпиразина, цитронеллаля, метантиола, метилацетата, 1-пропанола, диацетила, 2-бутанона, 2-метил-3-бутен-2-ола, этилацетата, 2-метил-1-пропанола, 3-метил-1-бутаналя, 3-метил-2-бутанона, 1-бутанола, 2-пентанона, 3-метил-1-бутанола, этилизобутирата, 3-метил-2-бутеналя, бутилацетата, 3-метилбутилацетата, 3-метил-3-бутен-1-илацетата, 3-метил-2-бутен-1-илацетата, 3-гексен-1-ола, 3-гексен-1-илацетата, лимонена, гераниола (транс-3,7-диметил-2,6-октадиен-1-ола), цитронеллола (3,7-диметил-6-октен-1-ола), (Е)-3.7-диметил-1,3,б-октатриена, (г)-3,7-диметил-1,3,6-октатриена и 2,3-циклогептенолпиридина, после того, как его подвергли этапам Согласно любому из способов и процессов, описанных в данной заявке. В некоторых вариантах реализации, компонент топлива включает одно или более соединений, выбранных из группы, состоящей из 1,4-диметил-1-(гидроксиметил)циклогексана, 1-(1-гидроксиэтил)-4-метилциклогексана, 2-метилбутана, 3-метилпентана, 2-пропанола, 2-метил-1-пропанола, 2-бутанола, 3-метил-1-бутанола, этилацетата и 3-метил-1-бутилацетата. В некоторых вариантах реализации, компонент топлива включает одно или более соединений, выбранных из группы, состоящей из 1,4-диметил-1-(гидроксиметил)циклогексана, 1-(1-гидроксиэтил)-4-метилциклогексана, 2-метилбутана, 3-метилпентана, 2-пропанола, 2-метил-1-пропанола, 2-бутанола, 3-метил-1-бутанола, этилацетата и 3-метил-1-бутилацетата, в количестве, большем или приблизительно равном 10 промилле, 1 промилле, 100 част/млрд, 10 част/млрд или 1 част/млрд.
[0668] В некоторых вариантах реализации, указанный компонент топлива включает одно или более соединений, выбранных из группы, состоящей из этанола, ацетона, метанола, ацетальдегида, метакролеина, метилвинилкетона, 2-метил-2-винилоксирана, цис- и транс-3-метил-1,3-пентадиена, пренильных спиртов С5 (таких как 3-метил-3- бутен-1-ол или 3-метил-2-бутен-1-ол), 2-гептанона, 6-метил-5-гептен-2-она, 2,4,5-триметилпиридина, 2,3,5-триметилпиразина, цитронеллаля, метантиола, метилацетата, 1-пропанола, диацетила, 2-бутанона, 2-метил-3-бутен-2-ола, этилацетата, 2-метил-1-пропанола, 3-метил-1-бутаналя, 3-метил-2-бутанона, 1-бутанола, 2-пентанона, 3-метил-1-бутанола, этилизобутирата, 3-метил-2-бутеналя, бутилацетата, 3-метилбутилацетата, 3-метил-3-бутен-1-илацетата, 3-метил-2-бутен-1-илацетата, 3-гексен-1-ола, 3-гексен-1-илацетата, лимонена, гераниола (транс-3,7-диметил-2,6-октадиен-1-ола), цитронеллола (3,7-диметил-6-октен-1-ола), (Е)-3,7-диметил-1,3,6-октатриена, (г)-3,7-диметил-1,3,б-октатриена и 2,3-циклогептенолпиридина, в количестве, большем или приблизительно равном 10 промилле, 1 промилле, 100 част/млрд, 10 част/млрд или 1 част/млрд.
Метод «отпечатка пальцев» углерода
[0669] BioIsoFuels, полученные из биоизопрена, можно отличить от топлива, полученного из нефтехимического углерода, с помощью двойного метода «отпечатка пальцев» изотопов углерода. Дополнительно, с помощью двойного метода «отпечатка пальцев» изотопов углерода можно определить конкретный источник углерода, полученного из биологического источника (например, является ли им глюкоза или глицерин) (см. патент США номер 7,169,588, который включен в настоящее описание посредством ссылки).
[0670] Данный способ позволяет эффективно различить химически-идентичные материалы и распределение углерода в продуктах по источнику (и возможно году роста) компонента биосферы (растения). Изотопы,14С и13С, обеспечивают дополнительную информацию для решения этого вопроса. Датирование по радиоактивному изотопу углерода (14С), период полураспада которого составляет 5730 лет, позволяет четко различить, относится ли углерод образца к ископаемому ("мертвому") или биосферному ("живому") сырью [Currie, L. A. "Source Apportionment of Atmospheric Particles", Characterization of Environmental Particles, J. Buffle и Н. P. van Leeuwen, ред.., 1 том I из серии ШРАС Environmental Analytical Chemistry Series (Lewis Publishers, Inc) (1992) 3 74]. Основное допущение при датировании по радиоактивному углероду состоит в том, что постоянство концентрации14С в атмосфере приводит к постоянству концентрации14С в живых организмах. При изучении изолированного образца, возраст образца можно приблизительно определить с помощью соотношения t=(-5730/0,693)ln(А/АO) (Уравнение 14), где t=возраст, 5730 лет представляет собой период полураспада радиоактивного изотопа углерода и А и АО представляют собой удельную активность14С образца и современного стандарта, соответственно [Hsieh, Y„ Soil Sci. Soc. Am J., 56, 460, (1992)]. Тем не менее, вследствие испытаний ядерного оружия в атмосфере начиная с 1950 г.и сжигания ископаемого топлива начиная с 1850 г., у14С появилась еще одна геохимическая временная характеристика. Концентрация14С в атмосферном СО2 - и, следовательно, в живой биосфере - приблизительно удвоилась на пике испытаний ядерного оружия, в середине 1960-х годов. С тех пор она постепенно возвращается на постоянный космогенный (атмосферный) исходный уровень соотношения изотопов (14С/13С), равный приблизительно 1,2×10-12, с приблизительным "периодом релаксации", равным 7-10 лет (этот период не должен восприниматься буквально; скорее, следует использовать точную функцию атмосферного ядерного вклада/распада, чтобы проследить изменение атмосферного и биосферного14С с начала ядерного века). В этой упомянутой выше биосферной характеристике времени14С, которая позволит получить ежегодные данные о современном биосферном углероде,14С можно измерить с помощью ускорительной масс-спектрометрии (AMS) и получить результаты в единицах "фракции современного углерода" (fм). fм определена Национальным институтом по стандартам и технологиям (NIST) для стандартных образцов материалов (SRM) 4990 В и 4990С, известных как стандарты щавелевых кислот HOxI и HOxII, соответственно. Фундаментальное определение относится к 0,95, умноженному на соотношение изотопов14С/12С в HOxI (описано в AD 1950). Это приблизительно эквивалентно дереву до индустриальной революции, с коррекцией на распад. Для современной живой биосферы (растительного материала) fМ≈1,1.
[0671] Соотношение стабильных изотопов углерода (13С/12С) обеспечивает дополнительный способ распознавания и разделения источников. Соотношение13С/12С в данном материале из биологического источника является следствием соотношения13С/12С в атмосферном диоксиде углерода на момент фиксации диоксида углерода, и также точно отражает метаболический путь. Также происходят региональные изменения. Нефть, растения С3 (широколистный табак), растения С4 (травы) и морские карбонаты сильно отличаются по13С/12С и соответствующим значениям δ13С. Более того, липидная составляющая растений С3 и С4 дает результаты, отличные от материалов, полученных из углеводных компонентов тех же растений, что является следствием различных путей метаболизма. В рамках точности измерения, количество13С сильно изменяется, вследствие эффекта фракционирования изотопов, при этом наиболее важными для настоящего изобретения являются изменения в фотосинтетическом механизме. Основной причиной различия в соотношении изотопов углерода в растениях является различие в путях фотосинтетического метаболизма углерода в растениях, особенно при реакции, происходящей во время первичного карбоксилирования, например, первоначальной фиксации атмосферного СО2. Существует два больших класса растительности: растения, в которых функционирует фотосинтетический цикл "С3" (или цикл Кальвина-Бенсона), и растения, в которых функционирует фотосинтетический цикл "С4" (или цикл Хетча-Слека). Растения С3, такие как деревья твердых пород и деревья хвойных пород, преобладают в умеренных климатических зонах. У растений С3, реакция первичной фиксации СО2 или карбоксилирования происходит под действием фермента рибулоза-1,5-дифосфаткарбоксилазы, и первым стабильным продуктом данной реакции является 3-углеродное соединение. Растения С4, с другой стороны, включают такие растения, как тропические травы, кукуруза и сахарный тростник. У растений С4, первичной реакцией карбоксилирования является дополнительная реакция карбоксилирования с участием другого фермента, фосфоенолпируваткарбоксилазы. Первым стабильным углеродным соединением является 4-углеродная кислота, которая впоследствии декарбоксилируется. СО2, высвобожденный в результате этого процесса, снова фиксируется в цикле С3.
[0672] Оба типа растений С4 и С3 имеют диапазон значений изотопных отношений13С/12С, но обычные значения составляют приблизительно с -10 по -14 промилле (С4) и с -21 по -26 промилле (С3) [Weber и др., J. Agric. Food Chem., 45, 2942 (1997)]. Уголь и нефть, как правило, имеют значения, попадающие в последний диапазон. Шкалу измерений13С изначально определили как шкалу, у которой нулевое значение имеет пи-ди-белемнитовый (PDB) известняк, а остальные значения задаются как части на тысячу отклонений от значения для данного материала. Значения "δ13С", представляющие собой части на тысячу (промилле), сокращенно пишут ‰, и рассчитывают, как описано далее (Уравнение 15);
С тех пор, как эталонный материал (ЭМ) PDB выработали, был разработан ряд альтернативных ЭМ в сотрудничестве с IAEA, USGS, NIST и другими выбранными международными лабораториями, исследующими изотопы. Для отклонений от PDB на тысячу ввели обозначение δ13С.Измерения для СO2 получают с помощью высокоточной масс-спектрометрии соотношений стабильных изотопов (IRMS) на молекулярных ионах с массами 44, 45 и 46.
[0673] Для изопрена, полученного в результате экстрактивной перегонки фракций Cs с нефтеперерабатывающих заводов, δ13С составляет от приблизительно -22‰ до приблизительно -24‰. Этот диапазон типичен для легких ненасыщенных углеводородов, полученных из нефти, и продукты, полученные из изопрена на нефтяной основе, обычно включают изопреновые единицы с таким же δ13С. Биоизопрен, полученный путем ферментации глюкозы, происходящей из кукурузы (δ13С -10,73‰), с минимальными количествами других содержащих углерод нутриентов (например, дрожжевого экстракта), может полимеризоваться в полиизопрен с δ13С от -14,66‰ до -14,85‰. Ожидается, что продукты, полученные из такого биоизопрена, имеют менее отрицательные значения δ13С, чем значения, полученные для изопрена на нефтяной основе. Для изопрена, полученного в результате реакции изобутилена с формальдегидом, значения δ13С могут составлять приблизительно -34,4‰, так как формальдегид часто получают из сырья с гораздо более отрицательными значениями δ13С.
[0674] Топливо и компоненты топлива согласно настоящему изобретению, которые получают с использованием изопрена из культур клеток, которые утилизируют биовозобновляемые источники углерода, можно идентифицировать по существу на основании их значения δ13С и других свойств топлива. В некоторых вариантах реализации, компонент топлива, полученный из биоизопрена, обладает значениями δ13С, большими (менее отрицательными) чем -22‰. В некоторых вариантах реализации, компонент топлива, полученный из биоизопрена, обладает значениями δ13С, большими чем -20, -18, -16, -14, -12 или -10 ‰. В некоторых вариантах реализации, компонент топлива, полученный из биоизопрена, обладает значением δ13С, которое находится в диапазоне от -22 до -10, от -21 до -12 или от -20 до -14 ‰. В некоторых вариантах реализации, компонент топлива, полученный из биоизопрена, обладает значением δ13Сδ13Сδ13С, которое находится в диапазоне от -34 до -24. от -34 до -25, от -33 до -25, от -32 до -24, от -32 до -25, от -31 до -25, от -30 до -29, от -30,0 до -29,5, от -29,5 до -28,5 или от -29,0 до -28,5 ‰.
[0675] В некоторых вариантах реализации, компонент топлива, полученный из биоизопрена, содержит радиоактивный изотоп углерода-14. В некоторых вариантах реализации, соотношение14С/12С больше или приблизительно составляет 1,0×10-12, 1,05×10-12, 1,1×10-12, 1,15×10-12 или 1,2×10-12. В некоторых вариантах реализации, компонент топлива, полученный из биоизопрена, обладает значением 1 м, большим или приблизительно равным 0,9, 0,95, 1,0, 1,05 или 1,1. В некоторых вариантах реализации, компонент топлива, полученный из биоизопрена, обладает значением Гм, большим или приблизительно равным 0,9, 0,95, 1,0, 1,05 или 1,1 и значениями δ13С, большими (менее отрицательными), чем -22‰. В некоторых вариантах реализации, компонент топлива, полученный из биоизопрена, обладает значением Гм, большим или приблизительно равным 0,9, 0,95, 1,0, 1,05 или 1,1, и значением δ13С, которое находится в диапазоне от -22 до -10, от -21 до -12 или от -20 до -14 ‰. В некоторых вариантах реализации, компонент топлива, полученный из биоизопрена, обладает значением fM, большим или приблизительно равным 0,9, 0,95, 1,0, 1,05 или 1,1 и значением δ13С, которое находится в диапазоне от -34 до -24, от -34 до -25, от -33 до -25, от -32 до -24, от -32 до -25, от -31 до -25, от -30 до -29. от -30,0 до -29,5, от -29,5 до -28.5 или -29,0 до -28,5 ‰.
[0676] Производные биоизопрена и полученные из него BioIsoFuels, интермедиаты и смеси можно полностью отличить от аналогичных продуктов на нефтехимической основе на основании14С (fм) и двойного метода «отпечатка пальцев» изотопов углерода, что свидетельствует о новизне композиций химических соединений.
[0677] В некоторых вариантах реализации, указанный компонент топлива согласно настоящему изобретению обладает более высокой удельной энергоемкостью, чем этанол. В некоторых вариантах реализации, компонент топлива повышает цетановое число топлива, например, топлива на нефтяной основе. В некоторых вариантах реализации, компонент топлива снижает выбросы от топлива на нефтяной основе. В некоторых вариантах реализации, указанная топливная композиция имеет октановое число в диапазоне от приблизительно 80 до приблизительно 120. В некоторых вариантах реализации, топливная композиция имеет цетановое число в диапазоне от приблизительно 30 до приблизительно 130.
[0678] В некоторых вариантах реализации, топливная композиция согласно настоящему изобретению содержит одно или более диметилциклооктановых соединений. В некоторых вариантах реализации, топливная композиция Согласно настоящему изобретению содержит один или более С10-углеводородов, таких как содержащие заместители циклогексаны. В некоторых вариантах реализации, топливная композиция согласно настоящему изобретению содержит один или более полученных из изопрена оксигенатов, описанных в данной заявке. В некоторых вариантах реализации, любые из топливных композиций, описанных в данной заявке, дополнительно содержат топливо на нефтяной основе в количестве, равном от приблизительно 1% до приблизительно 95% по массе или объему, на основании общей массы или объема всей топливной композиции.
[0679] Согласно настоящему изобретению дополнительно предложены способы получения топливной композиции, включающие получение нефтяного дистиллята и добавление компонента топлива согласно настоящему изобретению.
[0680] Пониманию настоящего изобретения дополнительно могут способствовать следующие примеры, которые предусмотрены исключительно для иллюстрирования, но не для ограничения сущности и объема настоящего изобретения.
ПРИМЕРЫ
Пример 1: Получение изопрена с помощью Е. coli, экспрессирующей рекомбинантную изопренсинтазу кудзу
I. Конструирование вектора для экспрессии изопренсинтазы кудзу в Е. coli
[0681] Последовательность белка для гена, кодирующего изопренсинтазу кудзу (Pueraria montand), (IspS) получили в базе данных GenBank (AAQ84170). Ген изопренсинтазы кудзу, кодон-оптимизированный в Е. coli, приобрели в DNA2.0 (SEQ ID NO: 1). Ген изопренсинтазы выделяли из приобретенной плазмиды путем разрезания плазмиды с помощью рестрикционных эндонуклеаз BspLUllIIPstI, очищали в геле и лигировали в вектор pTrcHis2B (Invitrogen), разрезанный с помощь рестриктаз NcoI/Pst. Конструкцию составили таким образом, что терминирующий кодон гена изопренсинтазы соединялся с 5'-концом вектора в Pstl-сайте. Таким образом, при экспрессии, белок изопренсинтазы не содержал His-Tag регион. Полученную плазмиду pTrcKudzu проверяли путем ее секвенирования (Фигуры 2 и 3, SEQ ID NO: 2).
[0682] Также ген изопренсинтазы клонировали в вектор pET16b (Novagen). При этом, ген изопренсинтазы встроили в вектор pET16b таким образом, что рекомбинантный белок изопренсинтазы содержал на N-конце His-Tag регион. Ген изопренсинтазы амплифицировали методом ПЦР на основе плазмиды pTrcKudzu с использованием набора праймеров pET-His-Kudzu-2F: 5'-CGTGAGATCATATGTGTGCGACCTCTTCTCAATTTAC (SEQ ID NO: 49) и pET-His-Kudzu-R: 5'-CGGTCGACGGATCCCTGCAGTTAGACATACATCAGCTG (SEQ ID NO: 50). Данные праймеры добавляли NdeI-сайт к 5'-концу и Bam-сайт к 3'-концу гена соответственно. Описанную выше плазмиду pTrcKudzu использовали в качестве ДНК-матрицы, полимеразу Herculase (Stratagene) использовали в соответствии с инструкциями производителя, и праймеры были добавлены в количестве 10 пМоль. Общий объем ПЦР-смеси составлял 25 мкл. Полученный ПЦР-продукт обрабатывали рестриктазами NdeVBamH\ и клонировали в вектор рЕТ16b, подвергнутый обработке этими же ферментами. Лигазной смесью трансформировали Е. coli Top 10 (Invitrogen) и корректный клон определяли путем секвенирования. Полученную таким образом плазмиду, в которой под контролем промотора Т7 проходила экспрессия изопренсинтазы кудзу, обозначали как pETNHisKudzu (Фигуры 4 и 5; SEQ ID NO: 51).
[0683] Также ген изопренсинтазы кудзу клонировали в низкокопийную плазмиду pCL1920. Для амплификации гена изопренсинтазы кудзу на основе матрицы плазмиды pTrcKudzu использовали праймеры, описанные выше. Прямой праймер добавлял к 5'-концу гена HindIII-сайт и консенсусную последовательность сайта связывания с рибосомой Е. coli. Плазмида pTrcKudzu уже содержала РstI-сайт клонирования, сразу за терминирующим кодоном, на 3'-конце, поэтому обратный праймер был создан исходя из того, что бы конечный ПЦР-продукт содержал РstI-сайт. Использовали следующие последовательности праймеров: HindIII-rbs-Kudzu F: 5'-CATATGAAAGCTTGTATCGATTAAATAAGGAGGAATAAACC (SEQ ID NO: 51) и BamHI-Kudzu R:
[0684] 5'- CGGTCGACGGATCCCTGCAGTTAGACATACATCAGCTG (SEQ ID NO: 50). ПЦР-продукт амплифицировали с использованием полимеразы Herculase, праймеров в количестве 10 пМоль и 1 нг ДНК-матрицы (pTrcKudzu). Протокол амплификации включал 30 циклов (95°С в течение 1 минуты, 60°С в течение 1 минуты, 72°С в течение 2 минут). ПЦР-продукт обрабатывали рестриктазами HindlH и Psti и дотировали в вектор pCL1920, который также подвергали обработке этими же ферментами HindIII и Psti. Лигазной смесью трансформировали Е. coli Top 10. Несколько трансформантов проверяли путем секвенирования. Полученную таким образом плазмиду обозначали pCL-lac-Kudzu (Фигуры 6 и 7, SEQ ID NO: 4).
II. Определение продукции изопрена
[0685] При культивировании во флаконах на качалке, в виалы для парофазного анализа объемом 20 мл (виалы Agilent кат.№5188 2753; крышки кат.№5188 2759) вносили один мл культуры из встряхиваемых флаконов. Крышки плотно закручивали и виалы инкубировали при эквивалентной температуре при 250 об/мин. Спустя 30 минут виалы вынимали из инкубатора и анализировали, как будет описано ниже (см. Таблицу 1, в которой представлены некоторые экспериментальные данные описываемого анализа).
[0686] При анализе продукции изопрена в ферментаторе, отбирали образцы отходящего из ферментатора газа и анализировали их незамедлительно, как будет описано ниже (см. Таблицу 2, в которой представлены некоторые экспериментальные данные описываемого анализа).
[0687] Анализ проводили с использованием системы Agilent 6890 ГХ/МС, оснащенной автосэмплером СТС Analytics (Швейцария) CombiPAL, настроенном на работу по парофазному методу. Для разделения анализируемых веществ использовали колонку для ГХ/МС Agilent HP-5MS (30 м×0.25 мм; толщина пленки 0,25 мкм). Сэмплер настраивали для введения 500 мкл газовой фазы над жидкостью. Согласно используемому методу ГХ/МС анализа, в качестве газа-носителя использовали гелий при скорости потока 1 мл/мин. Температуру инжектора поддерживали на уровне 250°С, при делении потока - 50:1. Температуру термостата поддерживали на уровне 37°С, продолжительность анализа составляла 2 минуты. Масс-селективный детектор Agilent 5793N настраивали на работу в режиме селективного мониторинга ионов (SIM) при m/z 67. Детектор отключали на 1,4 -1,7 минут для обеспечения выхода постоянных газов. При описанных условиях, выход изопрена (2-метил-1,3-бутадиен) наблюдали через 1,78 минут. Для оценки абсолютного количества изопрена использовали калибровочную таблицу, которая на интервале от 1 мкг/л до 70000 мкг/л показывала линейное соотношение. Установили, что предел обнаружения при использовании данного метода составлял от 50 до 100 нг/л.
III. Получение изопрена в клетках Е. coli, экспрессирующих рекомбинантную изопренсинтазу, при культивировании во флаконах на качалке
[0688] Описанные выше вектора вводили в клетки штамма BL21 Е, coli (Novagen) и получали штаммы; BL21/ptrcKudzu, BL21/pCL-lac-Kudzu и BL21/pETHisKudzu. Для изолирования штаммы рассевали на LA (Лурия агар)+карбенициллина (50 мкг/мл) и инкубировали одну ночь при 37°С.Отдельные колонии пересевали в 250 мл флаконы для качалки, содержащие 20 мл Лурия Бертани бульона (LB) и карбенициллин (100 мкг/мл). Культуры выращивали в течение одной ночи при 20°С, при перемешивании 200 об/мин. Измеряли ОП600 культуры, выращенной в течение ночи, и культуру разводили во флаконах для качалки объемом 250 мл, содержащих 30 мл MagicMedia (Invitrogen)+карбенициллин (100 мкг/мл) до ОП600 ~0,05. Культуру инкубировали при 30°С, при перемешивании 200 об/мин. После того как ОП600 достигали ~ 0,5 - 0,8, к культуре добавляли 400 мкМ ИПТТ (изопропил-β-D-тиогалактопиранозид, EPTG) и инкубировали еще 6 часов при 30°С с перемешиванием 200 об/мин. По прошествии 0, 2, 4 и 6 часов после индукции с ИПТТ из флаконов отбирали по 1 мл аликвоты, измеряли ОП600 и измеряли количество образующегося изопрена, как описано выше. Результаты представлены на Фигуре 8.
IV Получение изопрена с помощью штамма BL21/ptrcKudzu в 14-литровом ферментаторе
[0689] Крупномасштабную продукцию изопрена в клетках Е. coli, содержащих рекомбинантный ген изопренсинтазы кудзу, оценивали при культивировании с подпиткой. Приготовление ферментационной питательной субстанции (ТМ2) на 1 литр ферментационной среды, как указано далее: К2НPO4 13,6 г, КН2РO4 13,6 г, MgSO4*7Н2O 2 г, моногидрат лимонной кислоты 2 г, железа аммония цитрат 0,3 г, (NH4)2SO4 3,2 г, дрожжевой экстракт 5 г, 1000× Модифицированный Раствор Микроэлементов 1 мл. Все эти компоненты вносили совместно и растворяли в деионизированной воде. рН раствора доводили до значения 6,8 при помощи гидроксида калия (КОН) и при необходимости доводили до нужного объема. Конечный продукт стерилизовали путем пропускании через фильтр с размером пор 0.22 мкм (автоклавирование не проводили). Приготовление 1000× Модифицированного Раствора Микроэлементов: лимонная кислота * Н2O 40 г, MnSO4 * Н2O 30 г, NaCl 10 г, FeSO4*7Н2O 1 г.CoCl2*6Н2O 1 г, ZnSO4*7Н2O 1 г, CuSO4*5Н2O 100 мг.Н3ВО3 100 мг, NaMoO4 * 2Н2O 100 мг. Каждый компонент растворяли по очереди в деионизированной воде, рН доводили до 3,0 при помощи HCl/NaOH, затем при необходимости доводили до нужного объема и стерилизовали путем пропускания через фильтр с размером пор 0,22 мкм.
[0690] С целью проведения мониторинга образования изопрена из глюкозы, при предпочтительных условиях ферментации, рН 6,7 и температуре 34°С, данный эксперимент проводили в 14-литровом биореакторе. Инокуляционный материал штамма Е. coli BL21/ptrcKudzu брали из замороженной виалы и подготавливали в питательной среде на основе сойтона (Soytone), дрожжевого экстракта и глюкозы. Для внесения клеточной суспензии в биореактор (70 мл инокулята с ОП 3,1), после того как ОП550 инокулята достигал 0,6, два флакона объемом 600 мл центрифугировали и их содержимое ресуспендировали в 70 мл супернатанта. Через разные промежутки времени после инокуляции, из биореактора отбирали образцы и оценивали количество образующегося изопрена, как описано выше. Результаты представлены на Фигуре 9.
Пример 2: Получение изопрена с помощью Е. coli, экспрессирующей рекомбинантную изопренсинтазу тополя
[0691] Последовательность белка для гена, кодирующего изопренсинтазу тополя (Populus alba x Populus tremula) (Schnitzler, J-P, et al. (2005) Planta 222:777-786) получили в базе данных GenBank (CAC35696). Ген изопренсинтазы, кодон-оптимизированный Е. coli, приобрели в DNA2.0 (р979б-рор1аг, Фигуры 30 и 31; SEQ ID NO: 14). Ген изопренсинтазы выделяли из приобретенной плазмиды путем разрезания плазмиды с помощью рестрикционных эндонуклеаз BspLUllllPstI, очищали в геле и лидировали в вектор pTrcHis2B, разрезанный с помощь рестриктаз NcoI/Pst. Конструкцию составили таким образом, что терминирующий кодон во вставке находился перед PstI-сайтом, таким образом при использовании данной конструкции белок изопренсинтазы не содержал His-Tag регион. Полученную плазмиду pTrcPoplar (Фигуры 32 и 33; SEQ ID NO: 15),проверяли путем ее секвенирования.
Пример 2Б: Демонстрация активности нескольких изопренсинтаз тополя
[0692] Проверяли следующие изопренсинтазы; Populus alba (Номер доступа BAD98243; Фигуры 137А и В; SEQ ID NO: 30), Populus nigra (Номер доступа CAL69918; Фигуры 137С и D; SEQ ID NO: 31), Populus tremuloides (Номер доступа AAQ16588; Фигуры 137Е, F и G; SEQ ID NO:32-33), Populus trichocarpa (Номер доступа ACD70404; Фигуры 137Н и I; SEQ ID NO: 34), Populus alba x Populus tremula (Номер доступа CAJ29303; Фигуры 137J и I; SEQ ID NO: 35), и МСМ112-Kudzu.
[0693] Изопренсинтазу pET24Kudzu (так же обозначаемая, как МСМ112) конструировали следующим образом: ген изопренсинтазы кудзу из вектора pCR2.1 (Invitrogen) субклонировали в вектор pET24d (Novagen). Ген кудзу IspS амплифицировали на основе ДНК-матрицы плазмиды pTrcKudzu с использованием праймеров: МСМ50 5'-GATCATGCAT TCGCCCTTAG GAGGTAAAAAAACATGTGTGCGACCTCTTC TCAATTTACT (SEQ ID NO: 52); и МСМ53 5'-CGGTCGACGGATCCCTGCAG TTAGACATAC ATCAGCTG (SEQ ID NO: 50). ПЦР проводили с использованием ДНК-полимеразы Taq (Invitrogen) и полученный ПЦР-продукт клонировали в pCR2.1-TOPO ТА вектор клонирования (Invitrogen), которым трансформировали химически компетентные клетки Е. coli Ton 10 (Invitrogen). Трансформантов рассевали на L-агаре, содержащем карбенициллин (50 мкг/мл), и инкубировали одну ночь при 37°С.Отдельных трансформантов пересевали в среду, содержащую 5 мл Бульона Лурия и 50 мкг/мл карбенициллина и растили одну ночь при 37°С. Пять выделенных колоний проверили на наличие корректной вставки путем секвенирования ДНК плазмиды, выделенной из 1 мл жидкой культуры (Бульон Лурия) и очищенной с помощью QIAprep Spin Mini-prep Kit (Qiagen). Полученная плазмида, обозначенная как МСМ93, содержала кодирующую последовательность гена кудзу IspS в составе вектора pCR2.1 (Фигура 137L), Последовательность МСМ93 (SEQ ID NO: 36) представлена на Фигурах 137М и N.
[0694] Кодирующую последовательность кудзу выделяли путем обработки рестрикционными эндонуклеазами PciI и BamH1 (Roche) и очищали в геле с использованием QIAquick Gel Extraction kit (Qiagen). ДНК-вектор pET24d обрабатывали рестриктазами NcoI и BamH1 (Roche), креветочной щелочной фосфатазой (Roche) и очищали с помощью QIAprep Spin Mini-prep Kit (Qiagen). Фрагмент с геном кудзу IspS лигировали в вектор pET24d, обработанный рестриктазами NcoVBamHl, с помощью Rapid DNA Ligation Kit (Roche) при соотношении фрагмента к вектору 5:1, при общем объеме 20 мкл. Часть лигазной смеси (5 мкл) использовали для трансформации химически компетентных клеток Е. coli Top 10 и рассевали их на L-агаре, содержащем канамицин (50 мкг/мл). Корректным трансформантом, что определяли путем секвенирования, трансформировали химически компетентные клетки BL21(XDE3)pLysS (Novagen). Единичную колонию выделяли после выращивания клеток в течение одной ночи при 37°С на L-агаре, содержащем канамицин (50 мкг/мл). Карта получившейся плазмиды, обозначенной как pET24D-Kudzu представлена на Фигуре 1370. Последовательность pET24D-Kudzu (SEQ ID NO: 37) представлена на Фигурах 137Р и Q.
[0695] Оптимизированные в Escherichia coli, клонированные в экспрессирующий вектор рЕТ24а (Novagen), гены изопренсинтаз Populus tremuloides, Populus alba, Populus nigra and Populus trichocarpa приобрели в DNA2.0 (Menio Park, Канада). Синтезированные гены с удаленной хлоропластной транзитной пептидной последовательностью, при их экспрессии образовывался зрелый белок.
[0696] Конструкцию, содержащую изопренсинтазу кудзу, использовали в настоящем примере в качестве контроля. Плазмиды трансформировали в Е. coli экспрессию генов BL21(DE3)plysS, и трансформантов выращивали в питательной среде ТМЗ в объеме 0,6 мл. Приготовление среды ТМЗ, как указано ниже: К2НPO4 (13,6 г/л), КН2PO4 (13,6 г/л), MgSO4 * 7H2O (2 г/л), моногидрат лимонной кислоты (2 г/л), железа аммония цитрат (0,3 г/л), (NH4)2SO4 (3,2 г/л), дрожжевой экстракт (0,2 г/л), 1 мл 1000х раствор микроэлементов, рН до уровня 6,8 доводили гидроксидом аммония, при необходимости доводили до нужного объема стерильной деионизированной водой и стерилизовали путем пропускании через фильтр с размером пор 0,22 мкм. Приготовление 1000х раствора микроэлементов: лимонная кислота * Н2O (40 г/л), MnSO4 * Н2O (30 г/л). NaCl (10 г/л), FeSO4 * 7 Н2O (1 г/л), СоСl2 * 6 Н2O (1 г/л), ZnSO4 * 7 Н2O (1 г/л), CuSO4 * 5 Н2O (100 мг/л), Н3ВО3 (100 мг/л), NaMoO4 * 2 Н2O (100 мг/л). Каждый компонент растворяли по очереди в деионизированной воде, рН доводили до 3,0 при помощи HCl/NaOH, затем при необходимости доводили до нужного объема и стерилизовали путем пропускании через фильтр с размером пор 0,22 мкм.
[0697] Культуры индуцировали путем добавления 400 мкл ИПТТ и растили пока ОП600 не достигала приблизительно 5. Аликвоты культур переносили в стеклянную плашку с глубокими лунками и лунки герметично закрывали алюминиевым покрытием для планшетов. Планшет инкубировали при 25°С в течение 30 минут при перемешивании 450 об/мин. Процесс инактивировали тепловым воздействием за счет увеличения температуры до 70°С на 5 минут. Проводили анализ газовой фазы при неповрежденных клетках способом ГХ/МС, как описано в Примере 1, Часть II.
[0698] Для получения значение Km, культуры растили схожим образом, но клетки собирали и лизировали способом заморозки-оттаивания в присутствии лизоцима. Объем культуры в 400 мкл переносили в новый 96-луночный планшет (Perkin Elmer, Catalog №6008290), клетки собирали путем центрифугирования в центрифуге Beckman Coulter Allegra 6R при 2500 об/мин. Осадок ресуспендировали в 200 мл гипотонического буфера (5 мМ MgCL2, 5 мМ Трис НСl, 5 мМ ДТТ, рН 8,0) и планшет замораживали и выдерживали при -80°С в течение по меньше мере 60 минут. Для приготовления клеточного лизата планшет размораживали и добавляли 32 мл буфера для анализа изопренсинтазы с использованием ДМАПФ (диметилаллилпирофосфат) (57 мМ Трис НСl, 19 мМ MgCl2. 74 мг/мл DNase I (Sigma Catalog №DN-25), 2,63×105Ед/мл раствора лизоцима ReadyLyse (Epicentre Catalog №R1802M) и 5 мг/мл grade BSA, подходящей для использования в молекулярной биологии. Планшет при постоянном перемешивании инкубировали при 25°С в течение 30 минут после чего переносили на лед, Лизат и ДМАПФ смешивали в соответствующих концентрациях в стеклянном блоке с глубоким лунками для целых клеток, герметизировали и далее анализировали газовую фазу, как описано выше. Реакция протекала в течение 1 часа и затем ее останавливали тепловым воздействием, как описано выше, и проводили анализ газовой фазы, что также описано выше.
[0699] При альтернативном подходе, активность фермента измеряли в культуре клеток объемом 25 мл, при этом реакцию индуцировали аналогичным способом, как описано выше. Клетки собирали путем центрифугирования и осадок лизировали в аппарате для разрушения клеток "френч пресс" в буфере, содержащем 50% глицерина, смешанном в соотношении 1: 1 с 20 мМ Трис/HCl рН7,4, 20 мМ MgCl2, 200 мМ КСl и 1 мМ ДТТ. Для анализа активности изопренсинтазы, лизат, в количестве 25 мкл, переносили в виалы с завинчивающимися крышками объемом 2 мл, содержащими 75 мкл буфера для анализа (66,6 мМ Трис/НСl рН 8, 6,66 мМ ДМАПФ, 43 мМ MgCl2). Реакция проходила в течение 15 минут при 30°С после чего ее останавливали путем добавления через колпачок виалы 100 мкл 250 мМ ЭДТА. Количество изопрена измеряли способом ГХ/МС, как описано в Примере 1, Часть II.
[0700] Применение всех методов оценки активности показало, что ферменты тополя, выделенные из чистосортных линий тополей в несколько раз превосходили ферменты Populus [alba x tremula}. На Фигурах 138 и 139 представлены результаты анализа газовой фазы и ДМАПФ-анализа, соответственно, которые показывают, что неожиданно ферменты, выделенные из Р. nigra, P. tremuloides, P. trichocarpa и Р. alba, характеризовались более высокой активностью по сравнению с гибридом [Р. alba x Р.tremula}.
[0701] ДМАПФ-анализ проводили следующим образом: культуру, объемом 400 мкл, переносили в новый 96-луночный планшет (Perkin Elmer, Catalog №6008290), клетки собирали путем центрифугирования в центрифуге Beckman Coulter Allegra 6R при 2500 об/мин. Осадок ресуспендировали в 200 мкл гипотонического буфера (5 мМ MgCL2, 5 мМ Трис НСl, 5 мМ ДТТ рН 8,0) и планшет замораживали и выдерживали при -80°С в течение по меньше мере 60 минут. Для приготовления клеточного лизата планшет размораживали и добавляли 32 мл буфера для анализа активности изопренсинтазы с использованием ДМАПФ (диметилаллилпирофосфат) (57 мМ Трис НСl, 19 мМ MgCl2, 74 мг/мл DNase I (Sigma Catalog №DN-25), 2,63×105 Ед/мл раствора лизоцима ReadyLyse (Epicentre Catalog №R1802M) и 5 мг/мл grade BSA, подходящей для использования в молекулярной биологии. Планшет при постоянном перемешивании инкубировали при 25°С в течение 30 минут после чего переносили на лед. Для определения продукции изопрена аликвоты лизата объемом 80 мл переносили в 96-луночный стеклянный планшет (Zinsser Catalog №3600600) и добавляли в лунки по 20 мл раствора, содержащего 10 мМ раствор ДМАПФ в 100 мМ КНPO4, рН 8,2 (Cayman Chemical Catalog №63180). Планшет герметизировали алюминиевым покрытием для планшетов (Beckman Coultor Catalog №538619) и инкубировали при 30°С в течение 60 минут. Ферментативную реакцию останавливали путем нагрева стеклянного планшета (70°С в течение 5 минут). Проводили количественный анализ газовой фазы, как описано в Примере 1, Часть II.
[0702] Следует заметить, что активности изопрен синтаз Р. alba, P.tremuloides, P. trichocarpa были выше, чем активность изопренсинтазы кудзу. Наибольший уровень активности среди всех анализируемых ферментов был у фермента, полученного из Р. alba. Более высокие показатели активности при использовании клеточных лизатов по сравнению с использованием неповрежденных клеток, вероятно объясняются ограниченным поступлением ДМАПФ, субстрата данных ферментов, в клетку, доставка которого опосредуется эндогенным метаболизмом диоксиксилулоза-5-фосфата (ДКФ) в клетке.
[0703] Кинетический параметр Km для всех ферментов, участвующих в анализе, оценивали при диапазоне концентраций 2-3 мМ.
Пример 3: Получение изопрена с помощью Panteoa citrea, экспрессирующей рекомбинантную изопренсинтазу кудзу
[0704] Описанные в примере I плазмиды pTrcKudzu и pCL-lac-Kudzu ввели методом электропорации в Р. citrea (Патент США №7,241,587). Селекцию трансформантов проводили на LA, содержащем карбенициллин (200 мкг/мл) или спектиномицин (50 мкг/мл), соответственно. Получение изопрена при культивировании во флаконах на качалке и определение количества образующегося изопрена проводили как описано выше в Примере I для штаммов Е. coli, экспрессирующих рекомбинантную изопренсинтаза кудзу. Результаты представлены на Фигуре 10.
Пример 4: Получение изопрена с помощью Bacillus subtllis. экспрессирующей рекомбинантную изопренсинтазу кудзу
I. Конструирование реплицирующейся плазмиды для В. subtilis, для экспрессии изопренсинтазы кудзу
[0705] Ген изопренсинтазы кудзу экспрессировался в штамме Bacillus subtilis aprEnprE Pxyl-comK (BG3594comK), содержащем реплицирующуюся плазмиду (pBS19, содержащую кассету устойчивости к хлорамфениколу) и ген находился под контролем промотора аргЕ. Ген изопренсинтазы, промотор аргЕ и терминатор транскрипции амплифицировали отдельно и объединяли методом ПЦР. Затем конструкцию клонировали в вектор pBS19 и трансформировали в В. subtilis.
а) Амплификация промотора аргЕ
[0706] Промотор аргЕ амплифицировали на основе хромосомной ДНК, полученной из Bacillus subtilis, с использованием следующих праймеров: CF 797 (+) Начало промотора аргЕ, Mfel-сайт рестрикции 5'- GACATCAATTGCTCCATTTTCTTCTGCTATC (SEQ ID NO: 53)
CF 07-43 (-) Связывает промотор аргЕ с ispS кудзу 5'- ATTGAGAAGAGGTCGCACACACTCTTTACCCTCTCCTTTTA (SEQ ID NO: 54)
б) Амплификация гена изопренсинтазы
[0707] Ген изопренсинтазы кудзу амплифицировали на основе плазмиды pTrcKudzu (SEQ ID NO: 2). Данный ген был кодон-оптимизирован в Е. coli и был синтезирован в DNA 2.0. Использовали следующие праймеры: CF 07-42 (+) Связывает промотор аргЕ с геном изопренсинтазы кудзу (GTG - инициирующий кодон)
5'- TAAAAGGAGAGGGTAAAGAGTGTGTGCGACCTCTTCTCAAT (SEQ ID NO: 55)
CF 07-45 (-) Связывает 3'-конец гена изопренсинтазы кудзу с терминатором 5'- CCAAGGCCGGTTTTTTTTAGACATACATCAGCTGGTTAATC (SEQ ID NO: 56)
в) Амплификация терминатора транскрипции
[0708] Терминатор щелочной сериновой протеазы от Bacillus amyliquefaciens амплифицировали на основе плазмиды pJHPms382, которая ранее уже была секвенирована с использованием следующих праймеров:
CF 07-44 (+) Связывает 3'-конец гена изопренсинтазы кудзу с терминатором 5'- GATTAACCAGCTGATGTATGTCTAAAAAAAACCGGCCTTGG (SEQ ID NO: 57)
CF 07-46 (-) Конец терминатора В. amyliquefaciens (BamHI) 5'- GACATGACGGATCCGATTACGAATGCCGTCTC (SEQ ID NO: 58)
[0709] Фрагмент кудзу объединяли с терминатором, путем проведения ПЦР-реакции со следующими праймерами:
CF 07-42 (+) Связывает промотор аргЕ с геном изопренсинтазы кудзу (GTG - инициирующий кодон)
5'- TAAAAGGAGAGGGTAAAGAGTGTGTGCGACCTCTTCTCAAT (SEQ ID NO: 55)
CF 07-46 (-) Конец терминатора В. amyliquefaciens (BamHI-) 5'- GACATGACGGATCCGATTACGAATGCCGTCTC (SEQ ID NO: 58)
[0710] Терминатор кудзу объединяли с фрагментом промотора, путем проведения ПЦР-реакции со следующими праймерами:
CF 797 (+) Начало арrЕ промотора Mfel 5'- GACATCAATTGCTCCATTTTCTTCTGCTATC (SEQ ID NO: 53)
CF 07-46 (-) Конец терминатора В. amyliquefaciens (BamHI) 5'- GACATGACGGATCCGATTACGAATGCCGTCTC (SEQ ID NO: 58)
[0711] Объединенный ПЦР-фрагмент очищали с помощью Qiagen kit и обрабатывали рестрикционными ферментами Mfel и BamW. Обработанный ДНК-фрагмент очищали в геле с использованием набора Qiagen и лигировали в вектор, известный как pBS19, который предварительно обрабатывали рестриктазами EcoRl и BamW и очищали в геле.
[0712] Лигазной смесью трансформировали клетки Е. coli Top 10 и проводили селекцию колоний на LA+50 карбенициллинчашек. В общей сложности отобрали шесть колоний, которые растили одну ночь на LA+50 карбенициллин, после чего выделили плазмиды с использованием Qiagen kit. Для проверки наличия вставок, плазмиды обрабатывали рестриктазами EcoRI и ВаmHI и три корректные плазмиды были отосланы на секвенирование с использованием следующих праймеров:
СР 149 (+) EcoRI начало аргЕ промотора 5'- GACATGAATTCCTCCATTTTCTTCTGC (SEQ ID NO: 59)
CF 847 (+) Последовательность из рХХ 049 (конец промотора аргЕ) У- AGGAGAGGGTAAAGAGTGAG (SEQ ID NO: 60)
CF 07-45 (-) Связывает 3'-конец гена изопренсинтазы кудзу с терминатором 5'- CCAAGGCCGGTTTTTTTTAGACATACATCAGCTGGTTAATC (SEQ ID NO: 56)
CF 07-48 (+) Праймер для секвенирования изопренсинтазы кудзу 5'- CTTTTCCATCACCCACCTGAAG (SEQ ID NO: 61)
CF 07-49 (+) Секвенирование изопренсинтазы кудзу 5'- GGCGAAATGGTCCAACAACAAAATTATC (SEQ ID NO: 62)
[0713] Согласно проведенному секвенированию плазмида, обозначенная как pBS Kudzu №2 (Фигуры 52 и 12; SEQ ID NO: 5) являлась корректной и трансформирована в штамм-хозяин Bacillus subtilis - BG 3594 comK. Селекцию проводили на LA+5 хлорамфениколчашки. Отобранных трансформантов сначала рассеивали штрихом на LA+5 хлорамфеникол, а затем растили в LB+5 хлорамфеникол до достижения ОП600 значения 1,5. Их хранили в замороженном состоянии в флаконах при -80° в присутствии глицерина. Полученный штамм обозначали как CF 443.
II. Получение изопрена во флаконах на качалке, содержащих В. subtilis, экспрессирующих рекомбинантную изопренсинтазу
[0714] Культуру, культивированную в течение одной ночи, инокулировали с одиночной колонией CF 443 с LA+5 хлорамфеникол(Ст, 25 мкг/мл). Культуры растили в LB+Cm при 37°С, при перемешивании 200 об/мин. Культуру (1 мл), культивированную в течение одной ночи, пересевали во флаконы для качалки объемом 250 мл, содержащие 25 мл среды Гранта II (Grants II media) и хлорамфеникол в конечной концентрации 25 мкг/мл. Приготовление среды Гранта II: 10 г сойтона, 3 мл 1М К2НPO4, 75 г глюкозы, 3,6 г мочевины, 100 мл 10Х раствора МПС (3-(N-морфолино)-пропансульфоновая кислота)), при необходимости доводили Н2О до 1 л, рН 7,2; приготовление 10Х раствора МПС: 83,72 г МПС, 7,17 г трицина, 12 г КОН в хлопьях, 10 мл 0,276 М раствора K2SO4, 10 мл 0,528 М раствора MgCl2, 29,22 г Nad, 100 мл 100Х раствора питательных микроэлементов, при необходимости доводили Н2О до 1 л; приготовление 100Х раствора питательных микроэлементов: 1,47 г CaCl2*2H2O, 0,4 г FeSO4*7H2O, 0,1 г MnSO4*H2O, 0.1 г ZnSO4*H2O, 0,05 г СuСl2*2Н2О, 0,1 г СоСl2*6Н2О, 0,1 г Na2MoC4*2H2O, при необходимости доводили Н2O до 1 л. Флаконы инкубировали при 37°С и по прошествии 18, 24 и 44 часов проводили отбор проб. По прошествии 18 часов отобрали пробы газовой фазы CF443 и отобрали контрольный штамм. Это отражает накопление изопрена за 18 часов. Количество изопрена определяли методом газовой хроматографии, как описано в Примере 1. Продукция изопрена была значительно увеличена в случае экспрессии рекомбинантной изопренсинтазы (Фигура 11).
III. Продукция изопрена штаммом CF443 в 14-литровом ферментаторе
[0715] Крупномасштабное получение изопрена в клетках ЕВ. subtilis, содержащих рекомбинантный ген изопренсинтазы кудзу в составе реплицирующейся плазмиды, оценивали при культивировании с подпиткой. Штамм бацилл CF 443, экспрессирющий ген изопренсинтазы кудзу, и контрольный штамм, который не экспрессировал ген изопренсинтазы кудзу, культивировали стандартным способом культивирования с подпиткой в питательной среде, содержащей соевую муку (Cargill), фосфат натрия и фосфат калия, сульфат магния и растворы лимонной кислоты, хлорида железа и хлорида марганца. до начала ферментации питательную среду мацерировали в течение 90 минут, для этого использовали смесь ферментов, включавщуюцеллюлазы, гемицеллюлазы и пектиназы (см. WO 95/04134). 14-литровый ферментатор периодического действия подпитывали 60% (мас./мас.) раствором глюкозы (Cargill DE99 декстроза, ADM Versadex сахар-сырец или Danisco инвертный сахар) и 99%(мас./мас.) маслом (соевое масло Western Family, в данном случае 99% (мас./мас.) означает концентрацию масла до того, как оно поступила в клеточную культуральную среду). Подпитку начинали, когда уровень глюкозы снижался до неопределяемого уровня. Уровень подпитки снижали на протяжении нескольких часов и корректировали таким образом, что бы количество поступаемого масла соответствовало количеству поступающего углерода. Уровень рН поддерживали на уровне 6,8 - 7,4 с использованием 28% мас./об. гидроксида аммония. В случае образования пены, в среду добавляли пеногаситель. Температуру ферментации поддерживали на уровне 37°С и осуществляли перемешивание ферментационной культуры со скоростью 750 об/мин. Также в ходе процесса проводили наблюдение за другими параметрами, такими как рН, процент растворенного кислорода, расход воздуха и давление. Уровень растворенного кислорода поддерживали на уровне около 20%. Образцы отбирали с периодичностью 36 часов и определяли уровень роста клеток (ОП550) и продукцию изопрена. Результаты данных экспериментов представлены на Фигурах 53А и 53 В. IV. Интеграция гена изопренсинтазы кудзу (ispS) в В. subtilis
[0716] Ген изопренсинтазы кудзу клонировали в интегрированную плазмиду (pJHIOl-cmpR) под контроль промотора аргЕ. В условиях проведенного анализа, не было обнаружено продукции изопрена.
Пример 5: Продукция изопрена в Trichoderma
I. Конструирование вектора для экспрессии изопренсинтазы кудзу в Trichoderma reesei
[0717] Кодон-оптимизированный Yarrowia lipolytica ген изопренсинтазы (ИС) кудзу синтезировали в DNA 2.0 (SEQ ID NO: 6) (Фигура 13). Данную плазмиду использовали в качестве матрицы для процесса амплификации в следующей ПЦР реакции: 1 мкл матрицы плазмиды (20 нг/мкл), 1 мкл Праймера EL-945 (10 мкМ) 5'-GCTTATGGATCCTCTAGACTATTACACGTACATCAATTGG (SEQ ID NO: 63). 1 мкл Праймера EL-965 (10 мкМ) 5'-CACCATGTGTGCAACCTCCTCCCAGnTAC (SEQ ID NO: 64), 1 мкл дНТФ (10 мМ), 5 мкл 10х буфера для полимеразы PfuUltra II Fusion HS DNA Polymerase Buffer, 1 мкл полимеразы PfuUltra II Fusion HS DNA Polymerase, 40 мкл воды, общий объем реакции 50 мкл. Прямой праймер содержал 4 дополнительных нуклеотида на 5'-конце, которые не соответствовали кодон-оптимизированному гену изопренсинтазы кудзу Y. lipolytica, но их наличие было необходимо для клонирования гена в вектор pENTR/D-TOPO. Обратный праймер содержал 21 дополнительный нуклеотид на 5'-конце, которые не соответствовали кодон-оптимизированному гену изопренсинтазы кудзу Y. lipolytica, но были включены для возможности клонирования гена в другие вектора. Данную ПЦР реакцию проводили в MJ Research РТС-200 Thermocycler по следующей схеме: 95°С в течение 2 минут (только в первом цикле), 95°С в течение 30 секунд, 55°С в течение 30 секунд, 72°С в течение 30 секунд (повторить 27 циклов), 72°С в течение 1 минуты после завершения последнего цикла. Для подтверждения успешной амплификации кодон-оптимизированного гена изопренсинтазы кудзу Y. lipolytica, ПЦР-продукт анализировали в 1,2% геле E-gel.
[0718] Затем ПЦР-продукт клонировали с использованием набора ТОРО pENTR/D-ТОРО Cloning Kit в соответствии с инструкциями производителя: 1 мкл ПЦР-продукта, 1 мкл солевого раствора, 1 мкл вектора ТОРО pENTR/D-TOPO и 3 мкл воды в общем объеме реакции 6 мкл. Реакция проходила в течение 5 минут при комнатной температуре. Химически компетентные клетки Е. coli ТОР10 трансформировали одним микролитром реакционной смеси ТОРО. Селекцию трансформантов проводили на LA+50 мкг/мл канамицин чашках. Отобрали несколько колоний, каждую из которых пересевали в пробирку объемом 5 мл, содержащую LB+50 мкг/мл канамицин-среду, и растили культуры одну ночь при 37°С при перемешивании 200 об/мин. Затем из культуральных пробирок, культивированных в течение ночи, выделяли плазмиды с использованием набора QIAprep Spin Miniprep Kit, в соответствии с инструкциями производителя. С целью проверить корректность ДНК-последовательностей, несколько плазмид секвенировали. -
[0719] Одну из плазмид pENTR/D-TOPO, кодирующую кодон-оптимизированный ген изопренсинтазы кудзу Y. lipolytica использовали для Gateway клонирования в специально изготовленный вектор pTrex3g. Конструирование вектора pTrex3g описано в WO 2005/001036 А2. Реакцию проводили в соответствии с инструкциями производителя с использованием набора Gateway LR Clonase II Enzyme Mix Kit (Invitrogen): 1 мкл вектора-донора pENTR/D-TOPO, содержащего кодон-оптимизированный ген изопренсинтазы кудзу У. lipolytica, 1 мкл "разрезанного" вектора pTrex3g, 6 мкл ТЕ-буфера, рН 8,0, общий объем реакции 8 мкл. Реакция проходила при комнатной температуре в течение 1 часа, затем в реакционную смесь добавляли 1 мкл раствора протеиназы К и реакцию продолжали еще 10 минут при 37°С.Затем химически компетентные клетки Е. coli ТОР10 трансформировали 1 мкл реакционной смеси. Селекцию трансформантов проводили на LA+50 мкг/мл карбенициллинчашках. Отобрали несколько колоний, каждую из которых пересевали в пробирку объемом 5 мл, содержащую LB+50 мкг/мл карбенициллин, и растили культуры одну ночь при 37°С при перемешивании 200 об/мин. Затем из культуральных пробирок, культивированных в течение ночи, выделяли плазмиды с использованием набора QIAprep Spin Miniprep Kit (Qiagen, Inc.), в соответствии с инструкциями производителя. С целью проверить корректность ДНК-последовательностей, несколько плазмид секвенировали.
[0720] Проводили биолистическую трансформацию, содержащей кодон-оптимизированный изопренсинтазы кудзу pTrex3g плазмиды Y. lipolytica (Фигура 14), с четырьмя инактивированным генами (quad delete strain) Trichoderma reesei с использованием системы Biolistic PDS-1000/HE Particle Delivery System (см. WO 2005/001036 A2). Выделение стабильных трансформантов и оценку культивированию на качалке проводили Согласно протоколу, приведенному в Примере 11 патентной публикации WO 2005/001036 A2.
II. Продукция изопрена с помощью рекомбинантного штамма Г. reesei
[0721] В виалы для парофазного анализа переносили по одному мл культур трансформантов, синтезирующих изопренсинтазу, возраста 15 и 36 часов. Виалы герметично закрывали и инкубировали в течение 5 часов при 30°С. Анализ газовой фазы и идентификацию изопрена проводили способами, описанными в Примере 1. Два трансформанта демонстрировали следовые количества изопрена. Более высокое количество изопрена можно было наблюдать при увеличении времени инкубации до 14 часов. У двух положительных образцов содержание изопрена достигало приблизительно 0,5 мкг/л за 14 часов инкубации. В контроле, содержащем нетрансформированные культуры, не поддающиеся обнаружению следовые количества изопрена. Данный эксперимент показывает, что Т. reesei способен продуцировать изопрен из эндогенных предшественников при наличии изопренсинтазы, полученной извне.
Пример 6: Продукция изопрена с помощью Yarrowia
I. Конструирование вектора для экспрессии изопренсинтазы кудзу в Yarrowia lipolytica
[0722] Отправной точкой при конструировании вектора для экспрессии изопренсинтазы кудзу в Yarrowia lipolytica являлся вектор pSPZl(MAP29Spb). Полная последовательность данного вектора (SEQ ID NO: 7) представлена на Фигуре 15.
[0723] Методом ПЦР амплифицировали следующие фрагменты на основе хромосомной ДНК штамма У. lipolytica GICC 120285 в качестве матрицы: вариант гена URA3, не содержащий промоторную область; фрагмент гена 18S рибосомальной РНК;
терминатор транскрипции гена XPR2 Y. lipolytica; и два ДНК-фрагмента, содержащие промоторы генов XPR2 и ICL1. Для ПЦР использовали следующие праймеры:
ICL13
5'- GGTGAATTCAGTCTACTGGGGATTCCCAAATCTATATATACTGCAGGTGAC
(SEQ ID NO: 65)
ICL1 5 5'- GCAGGTGGGAAACTATGCACTCC (SEQ ID NO: 66)
XPR3 5'- CCTGAATTCTGTTGGATTGGAGGATTGGATAGTGGG (SEQ ID NO: 67)
XPR5 5'- GGTGTCGACGTACGGTCGAGCTTATTGACC (SEQ ID NO: 68)
XPRT3 5'- GGTGGGCCCGCATTTTGCCACCTACAAGCCAG (SEQ ID NO: 69)
XPRT5 5'- GGTGAATTCTAGAGGATCCCAACGCTGTTGCCTACAACGG (SEQ ID NO: 70)
Y18S3 5'- GGTGCGGCCGCTGTCTGGACCTGGTGAGTTTCCCCG (SEQ ID NO: 71)
Y18S5 5'- GGTGGGCCCATTAAATCAGTTATCGTTTATTTGATAG (SEQ ID NO: 72)
YURA3 5'- GGTGACCAGCAAGTCCATGGGTGGTTTGATCATGG (SEQ ID NO: 73)
YURA 50 5'- GGTGCGGCCGCCTTTGGAGTACGACTCCAACTATG (SEQ ID NO: 74)
YURA51 5'- GCGGCCGCAGACTAAATTTATTTCAGTCTCC (SEQ ID NO: 75)
[0724] Для амплификации методом ПЦР, в соответствиями инструкциями производителя, использовали полимеразу PfuUltraII polymerase (Stratagene), поставляемый для нее производителем буфер и дНТФы, 2,5 мкМ праймеры и обозначенную матрицу ДНК. Амплификацию проводили Согласно следующему циклу: 95°С в течение 1 минуты; 34х (95°С в течение 30 секунд; 55°С в течение 30 секунд; 72°С в течение 3 минут) и 10 минут при 72°С, с дальнейшим охлаждением до 4°С.[0725] Синтетические молекулы ДНК, кодирующие кодон-оптимизированный ген изопренсинтазы кудзу Yarrowia, приобрели в DNA 2.0 (Фигура 16; SEQ ID NO: 8). Подробные схемы плазмид pYLA(KZl) и pYLI(KZl), несущих синтетический ген изопренсинтазы кудзу под контролем промоторов XPR2 и ICL1, соответственно, представлены на Фигуре 18. Также конструировали контрольные плазмиды, в которые вместо гена изопренсинтазы вставили «mating factor» ген (МАР29) (Фигуры 18Е и 18F). [0726] Аналогичные процедуры клонирования можно использовать для экспрессии гена изопренсинтазы тополя (Populus alba x Populus tremula). Последовательности изопрена тополя описаны у Miller В. et al. (2001) Planta 213,483-487 и представлены на Фигуре 17 (SEQ ID NO: 9). Схема конструирования плазмид pYLA(POPl) и pYLI(POPl), несущих синтетический ген изопренсинтазы тополя, находящийся под контролем промоторов XPR2 и ICL1, соответственно, представлена на Фигурах 18А и В.
II. Получение изопрена с помощью рекомбинантного штамма У. lipolytica.
[0727] Векторы pYLA(KZl), pYLI(KZl), pYLA(MAP29) и pYLI(MAP29) обрабатывали SacII и трансформировали ими штамм Y. lipolytica CUB 122 стандартным способом трансформации с помощью ацетата лития / полиэтилен гликоля на основании прототрофности к уридину. Кратко, клетки дрожжей выращивали на среде YEPD (1% дрожжевого экстракта, 2% пептона, 2% глюкозы) в течение одной ночи, собирали путем центрифугирования (4000 об/мин, 10 минут) однократно промывали стерильной водой и суспендировали в 0,1 М ацетате лития, рН 6,0. Аликвоты клеточной суспензии в 200 мкл смешивали с раствором ДНК линеаризованной плазмиды (10-20 мкг), инкубировали в течение 10 минут при комнатной температуре и смешивали с 1 мл 50% ПЭГ 4000 в этом же буфере.
Суспензии инкубировали еще 1 час при комнатной температуре и далее подвергали тепловому шоку, 42°С в течение 2 минут. Затем клетки рассевали на чашки со средой SC с гистидином и лейцином (0,67% азотной дрожжевой основы, 2% глюкозы, по 100 мг/л лейцина и гистидина). Трансформанты появлялись на 3 - 4 день инкубации при 30°С.
[0728] Три изолята трансформантов pYLA(KZl), три изолята трансформантов pYLI(KZl), два изолята трансформантов pYLA(MAP29) и два изолята трансформантов pYLI(MAP29) растили в течение 24 часов в среде YEP7 (1% дрожжевого экстракта, 2% пептона, рН 7,0) при 30°С с перемешиванием. Клетки из культуры в количестве 10 мл собирали путем центрифугирования, ресуспендировали в 3 мл свежеприготовленной среды YEP7 и переносили во флаконы с завинчивающимися крышками объемом 15 мл. Флаконы инкубировали одну ночь при комнатной температуре с небольшим перемешиванием (60 об/мин). Содержание изопрена в газовой фазе флаконов анализировали методом газовой хроматографии с использованием масс-спектрометрического детектора, как описано в Примере 1. Все трансформанты с плазмидами pYLA(KZl) и pYLI(KZl) продуцировали легко обнаруживаемые количества изопрена (от 0,5 мкг/л до 1 мкг/л, Фигура 20). Изопрен не удалось обнаружить в газовой фазе флаконов, в которых культивировали штаммы, несущих ген фитазы вместо гена изопренсинтазы.
Пример 7: Продукция изопрена с помощью Е. coli, экспрессирующей изопренсинтазу кудзу и idi или dxs или idi и dxs
1. Конструирование вектора, кодирующего изопренсинтазу кудзу и idi или dxs или idi и dxs для продукции изопрена с помощью Е. coli
i) Конструирование pTrcKudzuKan
[0729] Ген bla из вектора pTrcKudzu (описан в Примере 1) заменяли на ген, обеспечивающий устойчивость к канамицину. Для удаления гена bla, плазмиду pTrcKudzu обрабатывали рестриктазой BspW, креветочной щелочной фосфатазой (КЩФ), инактивировали ферменты тепловым воздействием 65°С и затем защищали концы при помощи фрагмента Кленова и дНТФ. Фрагмент размером 5 т.п.н. выделяли и очищали из агарозного геля и лигировали с геном kanr, который предварительно амплифицировали методом ПЦР на основе матрицы плазмиды pCR-Blunt-11-TOPO с использованием праймеров МСМ22 5'- GATCAAGCTTAACCGGAATTGCCAGCTG (SEQ ID NO: 76) ИМСМ23 5'- GATCCGATCGTCAGAAGAACTCGTCAAGAAGGC (SEQ ID NO: 77), обрабатывали рестриктазами HindlH и Pvul и ставили защиту на концы. Селекцию трансформантов, несущих плазмиду, обеспечивающую устойчивость канамицину (pTrcKudzuKan), проводили на LA, содержащем 50 мкг/мл канамицина.
ii) Конструирование pTrcKudzu yIDI Kan
[0730] Плазмиду pTrcKudzuKan обрабатывали рестриктазой Psti, КЩФ, инактивировали ферменты тепловым воздействием и очищали в геле. Далее разрезанный вектор лигировали с ПЦР-продуктом, кодирующим ген idi S, cerevisiae совместно с синтетическим сайтом связывания с рибосомой. Для ПЦР использовали следующие праймеры: NsiI-YIDI I F 5'-CATCAATGCATCGCCCTTAGGAGGTAAAAAAAAATGAC (SEQ ID NO: 78) и Pstl-YIDI 1 R 5'- CCTTCTGCAGGACGCGTTGTTATAGC (SEQ ID NO: 79); и геномную ДНК S. cerevisiae в качестве матрицы. до начала лигирования полученный ПЦР-продукт обрабатывали рестриктазами Nsil и Psti и очищали в геле. Лигазной смесью трансформировали химически компетентные клетки ТОР10 и проводили их селекцию на LA, содержащем 50 мкг/мл канамицина. Выделили несколько трансформантов и провели секвенирование образовавшихся плазмид, которые обозначали как pTrcKudzu-yIDI(kan) (Фигуры 34 и 35; SEQ ID NO: 16).
iii) Конструирование pTrcKudzu DXS Kan
[0731] Плазмиду pTrcKudzuKan обрабатывали рестриктазой Psti, КЩФ, инактивировали тепловым воздействием и очищали в геле. Далее разрезанный вектор лигировали с ПЦР-продуктом, кодирующим ген dxs E.coli совместно с синтетическим сайтом связывания с рибосомой. Для ПЦР использовали следующие праймеры: МСМ13 5'-GATCATGCATTCGCCCTTAGGAGGTAAAAAAACATGAGTTTTGATATTGCCAAAT ACCCG (SEQ ID NO: 80) и МСМ14 5'-CATGCTGCAGTTATGCCAGCCAGGCCTTGAT (SEQ ID NO: 81); и геномную ДНК E.coli в качестве матрицы. до начала лигирования полученный ПЦР-продукт обрабатывали рестриктазами Nsil и Psti и очищали в геле. Полученной реакционной смесью трансформировали клетки ТОР10 и проводили их селекцию на LA, содержащем 50 мкг/мл канамицина. Выделили несколько трансформантов и провели секвенирование образовавшихся плазмид, которые обозначали как pTrcKudzu-DXS(kan) (Фигуры 36 и 37; SEQ ID NO: 17).
iv) Конструирование pTrcKudzu-yIDI-dxs (kan)
[0732] Плазмиду pTrcKudzu-yIDI(kan) обрабатывали рестриктазой Psti, КЩФ, инактивировали тепловым воздействием и очищали в геле. Далее разрезанный вектор лигировали с ПЦР-продуктом, кодирующим ген dxs E.coli совместно с синтетическим сайтом связывания с рибосомой(праймеры МСМ13 5'-GATCATGCATTCGCCCTTAGGAGGTAAAAAAACATGAGTTTTGATATTGCCAAAT ACCCG (SEQ ID NO: 80) и МСМ14 5'-CATGCTGCAGTTATGCCAGCCAGGCCTTGAT (SEQ ID NO: 81); матрица - клетки ТОР10), которые предварительно обрабатывали рестриктазами Nsil и Psti и очищали геле. Полученную таким образом плазмиду обозначали pTrcKudzu-yIDI-dxs (kan) (Фигуры 21 и 22, SEQ ID NO: 10).
v) Конструирование pCL PtrcKudzu
[0733] Фрагмент ДНК, содержащий промотор, структурный ген и терминатор, описанный выше в Примере 1, вырезали из плазмиды pTrcKudzu с помощью рестриктазы Sspl и очищали в геле. Его лигировали с вектором pCL1920, который предварительно обрабатывали рестриктазой pvmii, КЩФ и инактивировали тепловым воздействием. Полученной лигазной смесью трансформировали клетки ТОР10 и проводили их селекцию на LA, содержащем 50 мкг/мл спектиномицина. Несколько образовавшихся клонов выделили и провели секвенирование, отобрали два клона. Векторы pCL PtrcKudzu и pCL PtrcKudzu (A3) содержали вставки осуществленные в противоположных направлениях (Фигуры 38-41; SEQ ID NO:18-19).
vi) Конструирование pCL PtrcKudzu уIDI
[0734] Обработанный рестриктазами Nsil и Psti, очищенный геле ПЦР-амплификон гена IDI, описанный выше в пункте (ii), лигировали в вектор pCL PtrcKudzu, который предварительно обрабатывали рестриктазой Psti, КЩФ и инактивировали тепловым воздействием. Полученной лигазной смесью трансформировали клетки ТОР10 и проводили их селекцию на LA, содержащем 50 мкг/мл спектиномицина. Выделили несколько клонов и провели секвенирование образовавшейся плазмиды, которую обозначали как pCL PtrcKudzu yIDI (Фигуры 42 и 43; SEQ ID NO: 20).
vii) Конструирование pCL PtrcKudzu DXS
[0735] Обработанный рестриктазами Nsil и Psti, очищенный геле ПЦР-амплификон гена DXS, описанный выше в пункте (iii), лигировали в вектор pCL PtrcKudzu (A3), который предварительно обрабатывали рестриктазой Psti, КЩФ и инактивировали тепловым воздействием. Полученной лигазной смесью трансформировали клетки ТОР10 и проводили их селекцию на LA, содержащем 50 мкг/мл спектиномицина. Выделили несколько клонов и провели секвенирование образовавшейся плазмиды, которую обозначали как pCL PtrcKudzu DXS (Фигуры 44 и 45; SEQ ID NO: 21).
II. Измерение количества изопрена в газовой фазе культур, экспрессирующих различное число копий изопренсинтазы кудзу, idi, и/или dxs
[0736] Культуры Е. coli BL21(XDE3), которые ранее трансформировали плазмидами pTrcKudzu(kan) (A), pTrcKudzu-DXS kan (В), pTrcKudzu-DXS kan (С), pTrcKudzu-yIDI-DXS kan (D), растили в LB, содержащей 50 мкг/мл канамицина. Культуры, трансформированные pCL PtrcKudzu (Е), pCL PtrcKudzu, pCL PtrcKudzu-yIDI (F) и pCL PtrcKudzu-DXS (G) растили в LB, содержащей 50 мкг/мл спектиномицина. В начальный момент времени (0) (ОП600 составляла приблизительно 0,5) культуры индуцировали с 400 мкМ ИПТГ и отобрали пробы газовой фазы для измерения количества изопрена (см. Пример 1). Результаты представлены на Фигурах 23A-23G.
[0737] Плазмиду pTrcKudzu-yIDI-dxs (kan) внесли в штамм Е. coli BL21 методом трансформации. Полученный штамм BL21/pTrc Kudzu IDI DXS растили одну ночь в LB, содержащей канамицин (50 мкг/мл) при 20°С и затем пересевали во флаконы, содержащие среду ТМЗ (13.6 г К2РО3, 13,6 г КН2PO4. 2,0 г MgSO4*7H2O. 2.0 г лимонной кислоты моногидрат, 0,3 г железа аммония цитрата, 3,2 г (NH4)2SO4, 0,2 г дрожжевого экстракта, 1,0 ml 1000х Модифицированный Раствор Микроэлементов, рН подведенный до 6,8 и объем при необходимости доводили Н2O, стерилизовали фильтрацией) с содержанием глюкозы 1%. Флаконы инкубировали при 30°С пока значение ОП600 не достигало 0,8, после чего культуру индуцировали с 400 мкл ИПТГ. Образцы отбирали через различные временные промежутки после индукции и измеряли количество изопрена в газовой фазе как описано в Примере 1. Результаты представлены на Фигуре 23 Н.
III. Получение изопрена на основе различного сырья с помощью Е. соli/pTrcKudzu yIDI DXS
[0738] Штамм BL21 pTrcKudzuIDIDXS тестировали на способность продуцировать изопрен на трех типах сырья: багасса, кукурузная солома и мягкая древесная пульпа, в качестве контроля использовали глюкозу. Гидролизат из сырья готовили ферментативным гидролизом (Brown. L and Torget, R„ 1996, NREL standard assay method Lap-009 "Enzymatic Saccharification of Lignocellulosic Biomass") и разводили исходя из значения глюкозного эквивалента. В настоящем исследовании глюкозный эквивалент составлял 1%. Одиночную колонию с чашки недавно трансформированных клеток BL21 (DE3) pTrcKudzu уIDI DXS (kan) пересевали в 5 мл LB+канамицин (50 мкг/мл). Культуру инкубировали одну ночь при 25°С при перемешивании. На следующий день культуру, культивированную в течение ночи, разводили до ОП600 0,05 в объеме 25 мл среды ТМЗ+0,2% дрожжевого экстракта+1% базового сырья. В качестве базового сырья использовали: кукурузную солому, багассу, мягкую древесную пульпу. В качестве позитивного контроля использовали глюкозу, в качестве негативного контроля - безглюкозную среду. Культуры инкубировали при 30°С, при перемешивали 180 об/мин. Проводили мониторинг ОП600 и когда значение ОП600 достигало приблизительно 0,8 проводили анализ продукции изопрена 1 и 3 часа, как описано в Примере 1. Культуры не индуцировали. Все культуры, которые потребляли базовое сырье, продуцировали изопрен в количествах, эквивалентных позитивному контролю. Эксперимент повторяли 2 раз и данные представлены на Фигуре 46.
IV Получение изопрена на основе инвертного сахара с помощью Е. coli/pTrcKudzuIDIDXS
[0739] Одиночную колонию с чашки недавно трансформированных клеток BL21 (XDE3) pTrcKudzu уIDI DXS (kan) пересевали в 5 мл LB+канамицин (50 мкг/мл). Культуру инкубировали одну ночь при 25°С при перемешивании. На следующий день культуру, культивированную в течение ночи, разводили до ОП600 0,05 в объеме 25 мл среды ТМЗ+0,2% дрожжевого экстракта+1% базового сырья. В качестве базового сырья использовали глюкозу, инвертную глюкозу и кукурузную солому. Базовое сырье на основе инвертного сахара (Danisco Invert Sugar) готовили ферментной обработкой сахарного сиропа. AFEX-кукурузную солому готовили, как описано ниже (Часть V). Клетки выращивали при 30°С и первый образец отбирали, когда ОП600 культуры достигала значения приблизительно 0,8-1,0 (0 часов). Проводили анализ роста культуры путем измерения ОП600 и продукции изопрена, как описано в Примере 1, спустя 0,1 и 3 часа. Результаты представлены на Фигуре 47.
V. Приготовления гидролизата из кукурузной соломы, подвергнутой предварительной обработке AFEX
[0740] Кукурузную солому, подвергнутой предварительной обработке AFEX, приобретали в Мичиганском Биотехнологическом Институте. Условия обработки:
влажность 60%, соотношение аммиака 1:1, 30 минут при 90 "С и затем сушка на воздухе. Влажность кукурузной соломы, подвергнутой предварительной обработке AFEX, составляла 21.27%. Количество глюканов и ксиланов в кукурузной соломе, подвергнутой предварительной обработке AFEX, составляло 31,7% и 19,1% (от сухого веса), соответственно. Осахаривание проводили следующим образом: 20 г кукурузной соломы, подвергнутой предварительной обработке AFEX, вносили в колбу объемом 500 мл, содержащую 5 мл 1М цитратно-натриевого буфера с рН 4,8, 2,25 мл Accellerase 1000, 0,1 мл Grindamyi H121 (Danisco, продукт на основе ксиланазы Aspergillus niger, предназначенный для хлебопекарных производств) и 72,65 мл деионизированной воды. Колбу помещали на шейкер орбитального типа и инкубировали при 50°С в течение 96 часов. Анализировали одну пробу, отобранную из шейкера, методом ВЭЖХ. Гидролизат содержал 38,5 г/л глюкозы, 21,8 г/л ксилозы и 10,3 г/л олигомеров глюкозы и/или ксилозы.
VI. Влияние дрожжевого экстракта на продукцию изопрена с использованием Е. coli при культивировании с подпиткой
[0741] Ферментацию проводили в крупномасштабном 14-литровом ферментаторе, как описано выше, для клеток Е. coli несущих плазмиду pTrcKudzu уIDI DXS. Дрожжевой экстракт (Bio Springer, Монреаль, Квебек, Канада) потреблялся культурой экспоненциально. Общее количество дрожжевого экстракта, внесенного в ферментатор, варьировало между 70 - 830 г при продолжительности процесса ферментации в 40 часов. Оптическую плотность культуральной жидкости измеряли при длине волны 550 нм. Конечное значение оптической плотности культуры было пропорционально количеству внесенного дрожжевого экстракта (Фигура 48А). Содержание изопрена в отходящем из ферментатора газе измеряли, как описано выше. Титр изопрена увеличивался в ходе процесса ферментации(Фигура 48 В). Количество образовавшегося изопрена было линейнопропорционально количеству потребленного дрожжевого экстракта (Фигура 48С).
VII. Получение изопрена с использованием pTrcKudzu DXS yIDI в 500-литровом ферментаторе
[0742] Для получения изопрена использовали 500-литровый ферментатор и клетки Е. coli, несущие ген изопренсинтазы кудзу, S. cerevisiae IDI и Е. coli DXS нуклеиновые кислоты (Е. coli BL21 (λDЕЗ) pTrc Kudzu dxs yidi). Содержание изопрена варьировалось от 50 до 300 мкг/л в течение 15 часов. На основе данных о средней концентрации изопрена, средних уровнях потоков через систему и выхода изопрена, вычислили количество полученного изопрена, которое составило приблизительно 17 г.
VIII. Получение изопрена с использованием Е. coli в 500-литровом ферментаторе при культивировании с подпиткой
Приготовление среды (на литр среды для ферментации):
[0743] К2НPO4 7,5 г, MgSO4*7H2O 2 г, моногидрат лимонной кислоты 2 г, железа аммония цитрат 0,3 г, дрожжевой экстракт 0,5 г, 1000Х Модифицированный Раствор Микроэлементов 1 мл. Все эти компоненты вносили и растворяли совместно в деионизированной воде. Данный раствор автоклавировали. рН раствора подводили до значения 7,0 при помощи аммиачного газа (NН3) и при необходимости доводили до нужного объема. После стерилизации и подведения рН в раствор вносили 10 г глюкозы, 0,1 г тиамина* НСL и антибиотик. 1000Х Модифицированный Раствор Микроэлементов:
[0744] Лимонная кислота * Н2O 40 г, MnSO4 * H2O 30 г, NaCl 10 г.FeSO4 * 7Н2O 1 г, CoCl2 * 6Н2O 1 г, ZnSO4 * 7Н2O 1 г, CuSO4 * 5Н2O 100 мг, Н3ВО3 100 мг.NaMoO4 * 2H2O 100 мг. Каждый компонент растворяли по очереди в деионизированной воде, рН доводили до 3,0 при помощи HCl/NaOH, затем при необходимости доводили до нужного объема и стерилизовали путем пропускания через фильтр с размером пор 0,22 мкм.
[0745] Ферментацию проводили в 500-литровом биореакторе с использованием клеток Е. coli, несущих плазмиду pTrcKudzu yIDI DXS. Данный эксперимент проводили с целью проанализировать образование изопрена при использовании глюкозы и дрожжевого экстракта при желательных условиях ферментации: рН 7,0 и температуре 30°С.
Инокулят, штамм Е. coli, брали из замороженной виалы и подготавливали в питательной среде на основе сойтона (Soytone), дрожжевого экстракта и глюкозы. После того как ОП инокулята достигала значения 0,15 при 550 нм, отбирали 20 мл и переносили в биореактор, содержащий 2,5 л питательной среды на основе сойтона (Soytone), дрожжевого экстракта и глюкозы. Процесс в биореакторе объемом 2,5 л проводили при 30°С пока ОП не достигала значения 1,0, после чего 2 л переносили в 500-литровый биореактор.
[0746] Дрожжевой экстракт (Bio Springer, Монреаль, Квебек, Канада) и глюкоза потреблялись культурой экспоненциально. Общее количество глюкозы и дрожжевого экстракта, внесенного в процессе ферментации продолжительностью 50 часов, составило 181,2 кг и 17, 6 кг, соответственно. Изменение оптической плотности культуры в биореакторе с течением времени представлено на Фигуре 49А. Содержание изопрена в отходящем из биореактора газе измеряли, как описано выше. Титр изопрена увеличивался в ходе прохождения процесса ферментации (Фигура 49 В). Общее количество полученного изопрена при культивировании продолжительностью 50 часов составило 55,1 г, продукция в зависимости от времени представлена на Фигуре 49С.
Пример 8: Получение изопрена с помощью Е. coli, экспрессирующей изопренсинтазу кудзу и гены метаболического пути мевалоновой кислоты (МVА-пути)
I. Клонирование генов нижнего (lower) MVA-пути
[0747] Использовали следующую стратегию для клонирования генов нижнего MVA-пути. Амплифицировали четыре гена, участвующих в MVA-пути: мевалонаткиназы (МВК), фосфомевалонаткиназы (ФМК), дифосфомевалонатдекарбоксилазы (МД) и изопентилдифосфатизомеразы. Гены амплифицировали методом ПЦР на основе хромосомной ДНК S. cerevisiae и индивидуально клонировали их в плазмиды pCR BluntII TOPO (Invitrogen). Также, в некоторых вариантах, ген idi амплифицировали на основе хромосомной ДНК Е. coli. Праймеры подбирали таким образом, что бы консенсусная последовательность сайта связывания с рибосомой (AGGAGGT (SEQ ID NO: 82) или AAGGAGG (SEQ ID NO: 83)) примыкала к 5'-концу гена, на расстоянии 8 п.о. от инициирующего кодона, и что бы к 3'-концу примыкал PstI-сайт. Затем гены по очереди клонировали в вектор pTrcHis2B и таким образом получали полный набор генов.
[0748] Хромосомную ДНК штамма S. cerevisiae S288C получили от АТСС (АТСС 204508D). Ген МВК амплифицировали на основе хромосомной ДНК S. cerevisiae с использованием следующих праймеров MVKF (5'-AGGAGGTAAAAAAACATGTCATTACCGTTCTTAACTTCTGC, SEQ ID NO: 84) и MVK-Pstl-R (5'-ATGGCTGCAGGCCTATCGCAAATTAGCTTATGAAGTCCATGGTAAATTCGTG, SEQ ID NO: 85) и полимеразы PfuTurbo в соответствии с инструкциями производителя. ПЦР-продукт был корректного размера (1370 п.о.), что проверяли путем электрофореза в 1,2% геле E-gel (Invitrogen), и его клонировали в pZeroBLUNT TOPO. Полученную плазмиду обозначали как pMVKl. Плазмиду pMVKl разрезали рестрикционными эндонуклеазами Sad и Taq1, очищали в геле и лигировали в pTrcHis2B, обработанный Sad и BstBl. Полученную плазмиду обозначали как pTrcMVKl.
[0749] Второй ген нижнего MVA-пути - ФМК амплифицировали методом ПЦР с использованием следующих праймеров: PstI-PMKI R (5'-GAATTCGCCCTTCTGCAGCTACC, SEQ ID NO: 86) и BsiHKA I-PMK1 F (5'-CGACTGGTGCACCCTTAAGGAGGAAAAAAACATGTCAG, SEQ ID NO: 87). В ПЦР-реакции использовали полимеразу Pfu Turbo polymerase (Stratagene) в соответствии с инструкциями производителя. Полученный ПЦР-продукт был корректного размера (1387 п.о.), его разрезали с помощью PstI и BsiHKI и лигировали в вектор pTrcMVKl, разрезанный Pstl. Полученную плазмиду обозначали как рТrсКК. Гены МД и idi клонировали таким же способом. Для ПЦР использовали следующие пары праймеров:
PstI-MVD I R (5'-GTGCTGGAATTCGCCCTTCTGCAGC. SEQ ID NO: 88) и NsiI-MVD 1 F (5'-GTAGATGCATGCAGAATTCGCCCTTAAGGAGG, SEQ ID NO: 89) для амплификации гена МД; и PstI-YIDI I R (5'-CCTTCTGCAGGACGCGTTGTTATAGC, SEQ ID NO: 79) и NsiI-YIDI 1 F (5'-CATCAATGCATCGCCCTTAGGAGGTAAAAAAAAATGAC, SEQ ID NO: 78) для амплификации гена уIDI. Также в некоторых случаях использовали ген ИДФ-изомеразы (изопентилдифосфатизомераза) idi E. coli. Для амплификации idi на основе хромосомной ДНК E. coli использовали следующий набор праймеров: PstI-CIDI I R (5'-GTGTGATGGATATCTGCAGAATTCG, SEQ ID NO: 90) и NsiI-CIDI 1 F (5'-CATCAATGCATCGCCCTTAGGAGGTAAAAAAACATG, SEQ ID NO: 91). В качестве матрицы ДНК использовала хромосомную ДНК, выделенную стандартными способами из E. coli FM5 (WO 96/35796 и WO 2004/033646, каждая из которых включена в настоящую заявку во всей своей полноте посредством ссылки, а именно части, касающиеся выделения нуклеиновых кислот). Полученные плазмиды обозначали как pKKDIy - содержащую конструкцию, кодирующую ген idi дрожжей, и pKKDIc - содержащую конструкцию, кодирующую ген idi Е. coli. Плазмидами трансформировали хозяйские клетки Е. coli BL21 и использовали их в дальнейшем анализе. Также создали вариант, в котором ген изопренсинтазу кудзу клонировали в плазмиду pKKDIy, данный вариант плазмиды обозначали pKKDIyIS.
[0750] Также гены нижнего MVA-пути клонировали в вектор рТгс, содержащий маркер устойчивости к антибиотику канамицину. Плазмиду pTrcKKDIy разрезали рестрикционными эндонуклеазами Apal и Psti и, после разделения в 1,2% агарозном геле E-gel, выделяли фрагмент размером 5930 п.о. и очищали его с использованием набора Qiagen Gel Purification kit, в соответствии с инструкциями производителя. Описанную в Примере 7 плазмиду pTrcKudzuKan разрезали рестрикционными эндонуклеазами АраI и PstI и фрагмент размером 3338 п.о. очищали в 1,2% геле E-gel с использованием набора Qiagen Gel Purification kit. Фрагмент вектора размером 3338 п.о. и фрагмент размером 5930 п.о. содержащий гены нижнего MVA-пути лигировали с использованием набора Roche Quick Ligation kit. Лигазной смесью трансформировали клетки Е. coli ТОР10 и трансформантов растили при 37°С в течение одной ночи на LA, содержащем канамицин (50 мкг/мл). Трансформантов проверяли путем обработки рестрикционными ферментами и одного из трансформантов заморозили для дальнейшего хранения. Данную плазмиду обозначали как pTrcKanKKDIy.
II. Клонирование гена изопренсинтазы кудзу в pTrcKanKKDIy
[0751] Ген изопренсинтазы кудзу амплифицировали методом ПЦР на основе плазмиды pTrcKudzu, описанной в Примере 1, с использованием следующих праймеров: МСМ50 5'-GATCATGCATTCGCCCTTAGGAGGTAAAAAAACATGTGTGCGACCTCTTCTCAAT ТТАСТ (SEQ ID NO: 52) и МСМ53 5'-CGGTCGACGGATCCCTGCAGTTAGACATACATCAGCTG (SEQ ID NO: 50). Полученный ПЦР-фрагмент клонировали в вектор pCR2.1 и трансформировали им клетки Е. coli ТОР10. Данный фрагмент содержал кодирующую последовательность гена изопренсинтазы кудзу и располагающийся перед ним регион сайта связывания рибосом Е. coli. Для селекции трансформантов растили при 37° в течение одной ночи на LA, содержащем карбенициллин (50 мкг/мл). Корректность вставки фрагмента проверяли путем секвенирования и данный штамм обозначали как МСМ93.
[0752] Плазмиду из штамма МСМ93 разрезали рестрикционными эндонуклеазами Nsil и Psti, при этом высвобождался фрагмент размером 1724 п.о., содержащий сайт связывания рибосом и ген изопренсинтазы кудзу. Данный фрагмент размером 1724 п.о. разделяли на 1,2% агарозном геле E-gel и очищали с использованием набора Qiagen Gel Purification kit, в соответствии с инструкциями производителя. Плазмиду pTrcKanKKDIy разрезали рестрикционной эндонуклеазой Psti, обрабатывали КЩФ 30 минут при 37°С и очищали с использованием набора Qiagen PCR cleanup kit. Данную плазмиду и ДНК-фрагмент, кодирующий изопренсинтазу кудзу, лигировали с использованием набора Roche Quick Ligation kit. Лигазной смесью трансформировали клетки Е. coli TOP10, для селекции трансформантов растили при 37°С в течение одной ночи на LA, содержащем канамицин (50 мкг/мл). Корректность трансформантов проверяли путем рестрикции и корректную плазмиду обозначали как pTrcKKDyIkISKan (Фигуры 24 и 25, SEQ ID NO: 11). Данной плазмидой трансформировали клетки BL21(XDE3) (Invitrogen).
III. Получение изопрена из мевалоната с помощью Е. coli, экспрессирующей рекомбинантные компоненты нижнего MVA-пути и изопренсинтазы кудзу.
[0753] Штамм BL21/pTrcKKDyIkISKan культивировали в питательной среде на основе МПС (морфолинопропансульфонат) (Neidhardt et al„ (1974) J. Bacteriology 119:736-747) с рН 7,1 и с добавлением 0,5% глюкозы и 0,5% мевалоновой кислоты. Также, в качестве контроля, растили культуру в среде такого же состава, но не содержащей 0,5% мевалоновой кислоты. В качестве посевного материала использовали культуру, культивированную в течение ночи, с содержанием инокулята 1%, после того как ОП600 достигала значения от 0,3 до 0,5, культуру индуцировали 500 мкг ИГПТ. Культуры выращивали при 30°С, с перемешиванием 250 об/мин. Продукцию изопрена анализировали спустя 3 часа после индукции, путем анализа газовой фазы флакона, как описано в Примере 1. Максимальная продукцию изопрена составляла 6,67×10-4моль/Lсреды /ОП600/н, где Lсреды - объем среды, включающий объем питательного раствора и объем клеток. Контрольная культура, которую растили без мевалоновой кислоты, не продуцировала изопрен в детектируемых количествах.
IV Клонирование генов верхнего (upper) MVA-пути
[0754] Гены верхнего MVA-пути, включающие два гена, имеющих ферментативную активность 3 типов, клонировали из Enterococcus faecalis. Ген mvaE кодирует белок с ферментативной активностью ацетил-КоА ацетилтрансферазы и 3-гидрокси-3-метилглутарил-КоА (ГМГ-КоА) редуктазы, первый и третий ферменты MVA-пути, и ген mvaS, кодирует второй фермент MVA-пути, ГМГ-КоА-синтазу. Ген mvaE амплифицировали на основе геномной ДНК Е. faecalis (ATCC 700802D-5) и соединили с сайтом связывания с рибосомой Е. coli и находящимся перед ним спейсером с использованием следующих праймеров:
CF 07-60 (+) Начало гена mvaE w/ сайт связывания рибосом+ATG инициирующий кодон Sad
5' - GAGACATGAGCTCAGGAGGTAAAAAAACATGAAAACAGTAGTTATTATTG (SEQ ID NO: 93)
CF 07-62 (-) Связывает mvaE с mvaS, между ними располагается сайт связывания рибосом
5' - TTTATCAATCCCAATTGTCATGTTTTTTTACCTCCTTTATTGTnTCTTAAATC (SEQ ID NO: 94)
[0755] Ген mvaS амплифицировали на основе геномной ДНК Е. faecalis (ATCC 700802D-5) и соединили с сайтом связывания рибосом и спейсером Е. coli и с использованием следующих праймеров: CF 07-61 (+) Связывает mvaE с mvaS, между ними располагается сайт связывания рибосом
5' GATTTAAGAAAACAATAAAGGAGGTAAAAAAACATGACAATTGGGATTGATAAA (SEQ ID NO: 95)
CF 07-102 (-) Конец mvaS гена BglU 5' -GACATGACATAGATCTTTAGTTTCGATAAGAACGAACGGT (SEQ ID NO: 96)
[0756] ПЦР-фрагменты объединяли друг с другом методом ПЦР с использованием следующих праймеров:
CF 07-60 (+) Начало гена mvaE w/ сайт связывания рибосом+ATG инициирующий кодон SacI5' GAGACATGAGCTCAGGAGGTAAAAAAACATGAAAACAGTAGTTATTATTG (SEQ ID NO: 93)
CF 07-102 (-) Конец mvaS гена BglII 5'-GACATGACATAGATCTTTAGTTTCGATAAGAACGAACGGT (SEQ ID NO: 96)
[0757] Объединенный ПЦР-фрагмент очищали с помощью набора Qiagen и разрезали рестрикционными ферментами Sad и Bglll. Разрезанный ДНК-фрагмент очищали в геле с использованием набора Qiagen kit и лигировали в коммерчески доступный вектор pTrcHis2A, который предварительно разрезали Sad и Bglll и очищали в геле. [0758] Лигазной смесью трансформировали клетки Е. coli Top 10 и проводили селекцию колоний на LA+50 мкг/мл карбенициллин чашках. В общей сложности отобрали шесть колоний, которые растили одну ночь на LA+50 мкг/мл карбенициллин, после чего из них выделяли плазмиды с использованием набора Qiagen kit. Для проверки наличия вставок, плазмиды разрезали Sad and Bglll и одну корректную плазмиду секвенировали с использованием следующих праймеров:
CF 07-58 (+) Начало гена mvaE 5' - ATGAAAACAGTAGTTATTATTGATGC (SEQ ID NO: 97)
CF 07-59 (-) Конец гена mvaE
5' - ATGTTATTGTTTTCTTAAATCATTTAAAATAGC (SEQ ID NO: 98)
CF 07-82 (+) Начало гена mvaS
5' - ATGACAATTGGGATTGATAAAATTAG (SEQ ID NO: 99)
CF 07-83 (-) Конец гена mvaS
5' - TTAGTTTCGATAAGAACGAACGGT (SEQ ID NO: 100)
CF 07-86 (+) Последовательность гена mvaE
5' - GAAATAGCCCCATTAGAAGTATC (SEQ ID NO: 101)
CF 07-87 (+) Последовательность гена mvaE
5' -TTGCCAATCATATGATTGAAAATC (SEQ ID NO: 102)
CF 07-88 (+) Последовательность гена mvaE
5' - GCTATGCTTCATTAGATCCTTATCG (SEQ ID NO: 103) 276
CF 07-89 (+) Последовательность гена mvaS
5' - GAAACCTACATCCAATCTTTTGCCC (SEQ ID NO: 104)
[0759] Данная плазмида, обозначенная как pTrcHis2AUpperPathway.Nol, являлась корректной, что подтвердили секвенированием, и ей трансформировали коммерчески доступный штамм Е. coli BL21. Селекцию проводили на LA+50 мкг/мл карбеницилин. Два отобранных трансформанта выращивали в LB+50 мкг/мл карбеницилин до достижения ОП600 значения 1,5. Оба штамма хранили в замороженном состоянии в виалах при -80(в присутствии глицерина. Штаммы обозначали как CF 449 -pTrcHis2AUpperPathwayX9l в BL21, изолят №1 и CF 450 - pTrcHis2AUpperPathway№1 в BL21, изолят №2. При анализе было установлено, что оба клон ведут себя идентично.
V. Клонирование генов верхнего MVA-пути в pCL1920
[0760] Для выделения фрагмента, содержащего pTrc-/nva£-wva5-(His-tag)-терминатор, плазмиду pTrcHis2AUpperPathway разрезали рестрикционной эндонуклеазой Sspl. В этом фрагменте, His-tag-регион не транслируется. Фрагмент размером 4,5 т.п.о. с защищенными концами очищали в 1,2% геле E-gel с использованием набора Qiagen Gel Purification kit. Дефосфорилированный, с защищенными концами фрагмент размером 4,2 т.п.о. выделяли из pCL1920 путем разрезания вектора рестрикционной нуклеазой PvuII и обработкой КЩВ, и затем очищали в 1,2% геле E-gel с использованием набора Qiagen Gel Purification kit. Два этих фрагмента лигировали с использованием набора Roche Quick Ligation Kit и трансформировали химически компетентные клетки ТОР10. Селекцию трансформантов проводили на LA„ содержащем спектиномицин (50 мкг/мл). Для выявления корректных клонов, проводили скрининг содержащих вставку клонов, методом ПЦР. Данную плазмиду обозначали как pCL PtrcUpperPathway (Фигуры 26 и 27A-27D; SEQ ID NO:12).
VI. Штаммы, совместно экспрессирующие компоненты верхнего и нижнего MVA-путей
[0761] Для получения штаммов, экспрессирующих все компоненты MVA-пути плюс изопренсинтазу кудзу, компетентные клетки BL21(XDE3) (Invitrogen) совместно трансформировали плазмидами pTrcKKDyIkISkan и pCLpTrcUpperPathway и селекцию трансформантов проводили на LA. содержащем канамицин (50 мкг/мл) и спектиномицин (50 мкг/мл). Для проверки того, что обе плазмиды оказались в хозяине, из трансформантов выделяли плазмиды способом лизиса клеток щелочью. Полученный штамм обозначали как МСМ127.
VII. Получение мевалоновой кислоты из глюкозы с помощью Е. coli/pUpperpathway
[0762] Одиночные колонии штаммов BL21/pTrcHis2A-mva£/mva5 и FM5/p pTrcHis2A-ftivaЕ/mvaS переносили в LB+карбенициллин (100 мкг/мл) и растили одну ночь при 37°С с перемешиванием 200 об/мин. Культуры разводили в 50 мл среды, во флаконах объемом 250 мл, до значения ОП600 0,1. Использовали среду ТМЗ+1 или 2% глюкозы+карбенициллин (100 мкг/мл) или среду ТМЗ+1% глюкозы+гидролизованное соевое масло+карбенициллин (100 мкг/мл) или ТМЗ+питательное сырье (готовая багасса, кукурузная солома или просо прутьевидное). Культуры выращивали при 30°С, с перемешиванием 200 об/мин, в течение приблизительно 2-3 часов, пока ОП600 культуры не достигала значения 0,4. На этой стадии экспрессию конструкций, содержащих mvaE mvaS, индуцировали добавлением ИПТГ (400 мкМ). Культуры инкубировали еще от 20 до 40 часов и отбирали образцы с интервалом 2 часа на протяжении первых 6 часов и затем, при необходимости, на 24, 36 и 48 час после индукции. Для анализа отбирали 1 мл культуры, измеряли ОП600, осаждали клетки в микроцентрифуге, удаляли супернатант и определяли содержание мевалоновой кислоты в осадке.
[0763] При культивировании в объеме 14 л клетки Е. coli, содержащие нуклеиновые кислоты, кодирующие полипептиды Enterococcus faecalis АА-КоА-тиолазы, ГМГ-КоА синтазы и ГМГ-КоА-редуктазы, продуцировали 22 г мевалоновой кислоты в клеточной среде, содержащей среду ТМЗ и 2% глюкозы. Во флаконах на качалке данные клетки продуцировали 2-3 г мевалоновой кислоты на литр культуральной клеточной среды LB, содержащей 1% глюкозы. Продуцирование мевалоновой кислоты данными штаммами указывает на то, что МК функционален в Е. coli.
VIII. Получение изопрена с помощью штаммов Е. coli BL21. содержащих компоненты верхнего и нижнего МVА-пути плюс изопренсинтазу кудзу
[0764] Путем трансформации различными комбинациями плазмид, которые содержали гены компонентов верхнего и нижнего MVA-пути и ген изопренсинтазы кудзу, описанные выше, и плазмид, которые содержали гены idi, dxs и dxr и гены изопренсинтазы, описанные в Примере 7, создали перечисленные ниже штаммы. В качестве клеток-хозяев использовали химически компетентные клетки линии BL21(XDE3), трансформацию проводили стандартными способами. Селекцию трансформантов проводили на L-агаре, содержащем канамицин (50 мкг/мл) или канамицин плюс спектиномицин (концентрация каждого 50 мкг/мл). Чашки растили при 37°С. Получаемые штаммы обозначали следующим образом:
Выращенные с канамицином и спектиномицином (каждого по 50 мкг/мл) МСМ127 - pCL Upper MVA+pTrcKKDyIkIS (kan) в BL21(λDE3) MCM131- pCL1920+pTrcKKDyIkIS (kan) в BL21(λDE3) MCM125 - pCL Upper MVA+pTrcHis2B (kan) в BL21(λDE3)
Выращенные с канамицином (50 мкг/мл)
МСМ64 - pTrcKudzu yIDI DXS (kan) в BL2(λDE3)
MCM50 - pTrcKudzu (kan) в BL21 (λDE3)
MCM123 - pTrcKudzu yEDI DXS DXR (kan) в ВL21(λDE3)
[0765] Указанные штаммы рассевали штрихом из замороженных виал на LA+соответствующий антибиотик и растили одну ночь при 37°С.Для инокуляции среды при выращивании во флаконах на качалке (25 мл LB+соответствующий антибиотик) использовали единичную колонию с каждой чашки. Флаконы инкубировали при 22°С в течение одной ночи с перемешиванием 200 об/мин. На следующее утро флаконы переносили в термостат с температурой 37°С и растили в течение следующих 4,5 часов с перемешиванием 200 об/мин. Затем 25 мл культуры центрифугировали, выделяли клеточный осадок и ресуспендировали клетки в 5 мл LB+соответствующий антибиотик. Культуры разводили до объема 25 мл LB+1% глюкозы+соответствующий антибиотик, до значения ОП600 0,1. Готовили по два флакона с каждым штаммом, один для последующего индицирования с ИПТГ (800 мкМ), другой оставляли неиндуцированным. Культуры инкубировали при 37°С с перемешиванием 250 об/мин. Спустя 1,5 часа проводили индукцию культур в наборе флаконов (незамедлительно после индукции отбирали первый образец из флаконов, временная точка 1). При отборе проб на каждой временной точке измеряли ОП600 и определяли количество изопрена как описано в Примере 1. Результаты представлены в Таблице 3.
Количество произведенного изопрена для каждого конкретного штамма выражается в пиковой продукции изопрена.
н/д: недетектируемо следовые количества; пик наблюдался, но недостаточный для определения количества
IX. Анализ мевалоновой кислоты
[0766] Мевалолактон (1,0 г, 7,7 ммоль) (СА8№503-48-0) приобретенный в Sigma-Aldrich (Висконсин, США) в виде сиропа, разводили водой (7,7 мл) и добавляли к нему гидроксид калия (7,7 ммоль) с целью получить калийную соль мевалоновой кислоты. Превращение в мевалоновую кислоту подтверждали путем1Н - ЯМР анализа. Образцы для ВЭЖХ-анализа подготавливали следующим образом: для избавления от клеток образец центрифугировали при 14000 об/мин в течение 5 минут, затем к 300 мкл аликвоты супернатанта добавляли 900 мкл воды. Затем добавляли хлорную кислоту (36 мкл 70% раствора), перемешивали и охлаждали на льду в течение 5 минут. Затем образцы снова центрифугировали (14000 об/мин в течение 5 минут) и супернатант использовали для ВЭЖХ-анализа, Стандартные пробы мевалоновой кислоты (20, 10, 5, 1 и 0,5 г/л) готовили таким же способом. Анализ мевалоновой кислоты (вводимый объем 20 мкл) проводили методом ВЭЖХ с использованием BioRad Aminex 87-H+колонка (300×7,0 мм), в качестве элюента 5 мМ серная кислота, при скорости потока 0,6 мл/мин определяли рефракционный индекс (РИ). При описанных условиях, выход мевалоновой кислоты наблюдали в форме лактона через 18,5 минут.
X. Получение изопрена с помощью Е. coli BL21, содержащей компоненты верхнего MVA-пути плюс изопренсинтазу кудзу
[0767] Для получения изопрена при культивировании с подпиткой клеток Е. coli, экспрессирующих полипептиды MVA-пути и изопренсинтазу кудзу, проводили ферментацию в объеме 15 литров. Эксперимент демонстрировал, что при выращивании клеток в условиях дефицита глюкозы продукция изопрена составляла 2,2 г/л.
Приготовление среды (на литр среды для ферментации):
[0768] Среду готовили с использованием следующих компонентов на литр ферментационной среды; К2НPO4 7,5 г, MgSO4 *7H2O 2 г, моногидрат лимонной кислоты 2 г, железа аммония цитрат 0,3 г, дрожжевой экстракт 0,5 г, 1000х Модифицированный Раствор Микроэлементов 1 мл. Все эти компоненты вносили и растворяли совместно в деионизированной воде. Данный раствор автоклавировали. рН раствора доводили до значения 7,0 при помощи гидроксида аммония (30%) и при необходимости доводили до нужного объема. После стерилизации и доведения рН в раствор вносили 10 г глюкозы, 0,1 г тиамина* НСL и антибиотики.
1000Х Модифицированный Раствор Микроэлементов:
[0769] 1000Х Модифицированный Раствор Микроэлементов готовили с использованием следующих компонентов: лимонная кислота * I-hO 40 г, MnSO4 * H2O 30 г, NaCl 10 г.FeSO4 * 7Н2O 1 г, СоСl * 6Н2O 1 г.ZnSO4 * 7H2O 1 г, CuSO4 * 5Н2O 100 мг, Н3ВО3 100 мг и NaMo04 * 2H2O 100 мг. Каждый компонент растворяли по очереди в деионизированной воде, рН доводили до 3,0 при помощи HCl/NaOH, затем при необходимости доводили до нужного объема и стерилизовали путем пропускания через фильтр с размером пор 0,22 микрон.
[0770] Ферментацию проводили в 15-литровом биореакторе с использованием штамма Е. coli BL21 (DE3), несущего плазмиды pCL PtrcUpperPathway (Фигура 26) и pTrcKKDyIkIS. Данный эксперимент проводили для мониторинга образования изопрена из глюкозы при предпочтительных условиях ферментации: рН 7,0 и температуре 30°С.Для приготовления инокулята штамм Е. coli брали из замороженной виалы, рассевали штрихом на чашках с LB-агаром (с антибиотиком) и инкубировали при 37°С. Одиночную колонию пересевали в питательную среду на основе сойтона (Soytone), дрожжевого экстракта и глюкозы. После того как ОП инокулята достигала значения 1,0 при 550 нм, 500 мл культуры пересевали в 5-литровый биореактор.
[0771] Глюкозу подавали экспоненциально, пока культура не переходила на стационарную фазу. Далее подачу глюкозы сокращали исходя из метаболических потребностей. Общее количество глюкозы, внесенное в процессе ферментации продолжительностью 54 часа, составило 3,7 кг. Индукцию осуществляли путем добавления изопропил-бета-0-1-тиогалактопиранозида (ИПТТ). После достижения культурой оптической плотности значения 10 при 550 нм (ОП550). вносили ИПТГ до получения концентрации 25 мкМ. Концентрацию ИПТГ повышали до 50 мкМ, после того как ОП550 достигала значения 190. Концентрацию ИПТГ повышали до 100 мкМ через 38 часов ферментации. Изменение профиля ОП550 в биореакторе с течением времени представлено на Фигуре 54. Содержание изопрена в отходящем из биореактора газе измеряли, как описано в настоящей заявке. Титр изопрена увеличивался в ходе прохождения процесса ферментации до конечного значения 2,2 г/л (Фигура 55). Общее количество полученного изопрена при ферментации продолжительностью в 54 часа составило 15,9 г, продукция в зависимости от времени представлена на Фигуре 56,
XI. Ферментативное получение изопрена с помощью Е. coli, экспрессирующей гены MVA-пути, при культивировании с подпиткой клеток в объеме 15 литров
[0772] Для получения изопрена при культивировании с подпиткой клеток Е. coli, экспрессирующих полипептиды MVA-пути и изопренсинтазу кудзу, проводили ферментацию в объеме 15 литров. Эксперимент демонстрировал, что при выращивании клеток в условиях дефицита глюкозы продукция изопрена составляла 3,0 г/л.
Приготовление среды (на литр среды для культивирования):
[0773] Среду готовили с использованием следующих компонентов на литр среды: К2НPO4 7,5 г, MgSO4 *7H2O 2 г, моногидрат лимонной кислоты 2 г, железа аммония цитрат 0,3 г, дрожжевой экстракт 0,5 г, 1000х Модифицированный Раствор Микроэлементов 1 мл. Все эти компоненты вносили совместно и растворяли в деионизированной воде. Данный раствор автоклавировали. рН раствора доводили до значения 7,0 при помощи гидроксида аммония (30%) и при необходимости доводили до нужного объема. После стерилизации и доведения рН в раствор вносили 10 г глюкозы, 0,1 г тиамина* НСL и антибиотики.
1000Х Модифицированный Раствор Микроэлементов:
[0774] 1000Х Модифицированный Раствор Микроэлементов готовили с использованием следующих компонентов: лимонная кислота * Н2O 40 г, MnSdt * Н2О 30 г, NaCl 10 г, FeSO4 * 7Н2O 1 г, СоСl2 * 6Н2O 1 г, ZnSO4 * 7Н2O 1 г, CuSO4 * 5Н2О 100 мг, Н3ВО3 100 мг и NaMoO4 * 2Н2O 100 мг. Каждый компонент растворяли по очереди в деионизированной воде, рН доводили до 3,0 при помощи HCl/NaOH, затем при необходимости доводили до нужного объема и стерилизовали путем пропускания через фильтр с размером пор 0,22 микрон.
[0775] Ферментацию проводили в 15-литровом биореакторе с использованием штамма Е. coli BL21 (DE3), несущего плазмиды pCL PtrcUpperMVA и pTrc KKDyDdS. Данный эксперимент проводили для мониторинга образование изопрена из глюкозы при предпочтительных условиях ферментации; рН 7,0 и температуре 30°С.Для приготовления инокулята штамм Е. coli брали из замороженной виалы, рассевали штрихом на чашках с LB-агаром (с антибиотиком) и инкубировали при 37°С. Одиночную колонию пересевали в питательную среду на основе триптона и дрожжевого экстракта. После того как ОП инокулята достигала значения 1,0 при 550 нм, 500 мл культуры пересевали в 5-литровый биореактор.
[0776] Глюкозу подавали экспоненциально, пока культура не переходила на стационарную фазу. Далее подача глюкозы сокращали исходя из метаболических потребностей. Общее количество глюкозы, внесенное в процессе ферментации продолжительностью 59 часов, составило 2,2 кг. Индукцию осуществляли путем добавления ИПТГ. После достижения культурой оптической плотности значения 10 при 550 нм (ОП550), вносили ИПТТ до получения концентрации 25 мкМ. Концентрацию ИПТТ повышали до 50 мкМ, после того как ОП550 достигала значения 190. Изменение профиля ОП550 в биореакторе с течением времени представлено на Фигуре 93. Содержание изопрена в отходящем из биореактора газе измеряли, как описано в настоящей заявке. Титр изопрена увеличивался в ходе прохождения процесса ферментации до конечного значения 3,0 г/л (Фигура 94). Общее количество полученного изопрена при ферментации продолжительностью 59 часов составило 22,8 г, продукция в зависимости от времени представлена на Фигуре 95. Молярная доля потребленного культурой углерода, который был затрачен на продукцию изопрена в ходе ферментации, составила 2,2%. Массовый процентный выход изопрена относительно глюкозы составил 1,0%.
XII. Ферментативное получение изопрена с помощью Е. coli, экспрессирующей гены MVA-пути, при культивировании с подпиткой в объеме 15 литров
[0777] Для получения изопрена при культивировании с подпиткой клеток Е. coli, экспрессирующих полипептиды MVA-пути, изопренсинтазу Pueraria lobata, и изопренсинтазу кудзу проводили ферментацию в объеме 15 литров. Эксперимент демонстрировал, что при выращивании клеток в условиях дефицита глюкозы продукция изопрена составляла 3,3 г/л.
i) Конструирование pCLPtrcUpperPathwayHGS2
[0778] Ген, кодирующий изопренсинтазу Pueraria lobata, амплифицировали методом ПЦР с использованием праймеров NsiI-RBS-HGS F (CTTGATGCATCCTGCATTCGCCCTTAGGAGG. SEQ ID NO: 105) и pTrcR (CCAGGCAAATTCTGTTTTATCAG, SEQ ID NO: 106) и плазмиды pTrcKKDyIkIS в качестве матрицы. Полученный таким образом ПЦР-продукт разрезали рестриктазами Nsil и Psti и очищали в геле. Плазмиду pCL PtrcUpperPathway разрезали рестриктазой Psti и дефосфорилировали с использованием щелочной фосфатазы rAPid (Roche) в соответствии с инструкциями производителя.
[0779] ДНК-фрагменты лигировали друг с другом и лигазной смесью трансформировали химически компетентные клетки Е. coli TopIO (Invitrogen), клетки рассевали на L-arape, содержащем спектиномицин (50 мкг/мл), и инкубировали одну ночь при 37 "С.Из 6 клонов выделили плазмидную ДНК с использованием набора Qiaquick Spin Mini-prep kit. Для идентификации клонов, в которых вставка имела правильную ориентацию (т.е., гены были ориентированы в том же направлении, что и промотор рТгс), плазмидную ДНК разрезали рестриктазами EcoRV и МluI.
[0780] Корректную плазмиду обозначали как pCLPtrcUpperPathwayHGS2. Плазмиду испытывали на способность трансформированных клеток Е. coli Top 10 продуцировать изопрен, что оценивали анализом газовой фазы, как описано выше в настоящей заявке, было показано, что клетки продуцируют изопрен, что подтверждает функциональность гена. Плазмидой трансформировали клетки BL21(LDE3), уже несущие плазмиду pTrcKKDyIkIS, и таким образом получали штамм BL21/pCLPtrcUpperPathwayHGS2-pTrcKKDyDdS. Данный штамм содержал дополнительные копии изопренсинтазы по сравнению со штаммами BL21/pCL PtrcUpperMVA и рТгс KKDyIkIS (Пример 8, Часть XI). Данный штамм также характеризовался повышенной экспрессией и активность ГМГ-коА-синтаза (HMGS) по сравнению со штаммами BL21/pCL PtrcUpperMVA и рТrс KKDyIkIS, которые использовали в Примере 8 часть XI.
ii) Ферментативное получение изопрена с помощью Е. coli, экспрессирующей плазмиду pCLPtrcUpperPathwayHGS2-pTrcKKDyIkIS, при культивировании с подпиткой в объеме 15 литров
Приготовление среды (на литр среды для ферментации):
[0781] Среду готовили с использованием следующих компонентов на литр среды: К2НPO4 7,5 г, MgSO4 *7H2O 2 г, моногидрат лимонной кислоты 2 г, железа аммония цитрат 0,3 г, дрожжевой экстракт 0,5 г, 1000х Модифицированный Раствор Микроэлементов 1 мл. Все эти компоненты вносили совместно и растворяли в деионизированной воде. Данный раствор автоклавировали. рН раствора доводили до значения 7,0 при помощи гидроксида аммония (30%) и при необходимости доводили до нужного объема. После стерилизации и доведения рН в раствор вносили 10 г глюкозы, 0,1 г тиамина* НСL и антибиотики.
1000Х Модифицированный Раствор Микроэлементов:
[0782] 1000Х Модифицированный Раствор Микроэлементов готовили с использованием следующих составляющих: лимонная кислота * H2O 40 г, MnSO4 * Н2O 30 г, NaCl 10 г, FeSO4 * 7Н2O 1 г, СоСl3 * 6Н2O 1 г, ZnSO4 * 7H2O 1 г, CuSO4 * 5Н2O 100 мг, Н3ВО3 100 мг и NaMoO4 * 2H2O 100 мг. Каждый компонент растворяли по очереди в деионизированной воде, рН доводили до 3,0 при помощи HCl/NaOH, затем при необходимости доводили до нужного объема и стерилизовали путем пропускания через фильтр с размером пор 0,22 микрон.
[0783] Ферментацию проводили в 15-литровом биореакторе с использованием штамма Е. coli BL21 (DE3), несущего плазмиды pCLPtrcUpperPathwayHGS2 и pTrc KKDyMS. Данный эксперимент проводили для мониторинга образования изопрена из глюкозы при предпочтительных условиях ферментации: рН 7,0 и температуре 30°С.Для приготовления инокулята штамм Е. coli брали из замороженной виалы, рассевали штрихом на чашках с LB-агаром (с антибиотиком) и инкубировали при 37°С.Одиночную колонию пересевали в питательную среду на основе триптона и дрожжевого экстракта. После того как ОП инокулята достигала значения 1,0 при 550 нм, 500 мл культуры пересевали в 5-литровый биореактор.
[0784] Глюкозу подавали экспоненциально, пока культура не переходила на стационарную фазу. Далее подачу глюкозы сокращали исходя из метаболических потребностей. Общее количество глюкозы, внесенное в процессе ферментации продолжительностью 58 часов, составило 2,1 кг. Индукцию осуществляли путем добавления ИПТТ. После достижения культурой оптической плотности значения 9 при 550 нм (ОП550), вносили ИПТГ до получения концентрации 25 мкМ. Концентрацию ИПТГ повышали до 50 мкМ, после того как ОП550 достигала значения 170. Изменение профиля ОП550 в биореакторе с течением времени представлено на Фигуре 104. Содержание изопрена в отходящем из биореактора газе измеряли, как описано в настоящей заявке. Титр изопрена увеличивался в ходе прохождения процесса ферментации до конечного значения 3,3 г/л (Фигура 105). Общее количество полученного изопрена при культивировании продолжительностью 58 часа составило 24,5 г, продукция в зависимости от времени представлена на Фигуре 106. Молярная доля потребленного культурой углерода, который был затрачен на продукцию изопрена в ходе ферментации, составила 2,5%. Массовый процентный выход изопрена относительно глюкозы составил 1,2%. Анализ показал, что активность изопренсинтазы была увеличена приблизительно в 3-4 раза по сравнению со штаммом BL21 экспрессирующим плазмиды CL PtrcUpperMVA и pTrc KKDyIkIS (данные не представлены).
XIII. Хромосомная интеграция компонентов нижнего MVA-пути в Е. coli.
[0785] В хромосому Е. coli интегрировали синтетический оперон, содержащий гены: мевалонаткиназы, мевалонатфосфаткиназы, мевалонатпирофосфатдекарбоксилазы и ИДФ-изомеразы. При необходимости, возможно регулировать экспрессию за счет интеграции различных промоторов на 5'-конце оперона.
[0786] В Таблице 4 приведены праймеры, которые использовали в данном исследовании.
i) Конструирование целевого вектора
[0787] Для интеграции выбрали сайт attTn7. Регионы, гомологичные вышележащей (attTn7 up) (праймеры МСМ78 и МСМ79) и нижележащей (attTn7 down) (праймеры МСМ88 и МСМ89) амплифицировали методом ПЦР на основе клеток линии MG1655. Реакционную смесь общим объемом 50 мкл, содержащую по 1 мкл 10 мкМ раствора каждого праймера, 3 мкл бидистиллированной воды, 45 мкл смеси для ПЦР повышенной точности Platinum PCR Supermix High Fidelity и соскоб колонии MG1655, денатурировали при 94°С в течение 2:0, проводили 25 циклов реакции (94°С в течение 2:0, 50°С в течение 0:30, 68°С в течение 1:0), выдерживали при 72°С в течение 7:0 и охлаждали до 4°С.Полученные ДНК фрагменты клонировали в вектор pCR2.1 (Invitrogen) в соответствии с инструкциями производителя и таким образом получали плазмиды МСМ278 (attTn7 up) и МСМ252 (attTn7 down). Фрагмент размером 832 п.о., полученный путем обработки плазмиды МСМ252 ApaI-PvuI и последующей очисткой в геле, клонировали в плазмиду pR6K, которую предварительно разрезали Apal-Pvul и очищали в геле, и получали, таким образом, плазмиду МСМ276. Фрагмент размером 825 п.о., полученный путем обработки плазмиды МСМ278 PstI-NotI и последующей очисткой в геле, клонировали в плазмиду МСМ276, которую предварительно разрезали рестриктазами Pstl-NotI и очищали в геле, и получали, таким образом, плазмиду МСМ281.
ii) Клонирование компонентов нижнего MVA-пути и промотора
[0788] Гены МВК - ФМК - МД - IDI амплифицировали на основе плазмиды pTrcKKDyIkIS с использованием праймеров МСМ104 и МСМ105 и системы для ПЦР-реакции Roche Expand Long PCR System, в соответствии с инструкциями производителя. Полученный ПЦР-продукт разрезали с помощью NotI и ApaI и клонировали в МСМ281, который ранее разрезали NotI и ApaI и очищали геле. Для амплификации МУХ-кассеты (маркер устойчивости к хлорамфениколу) использовали праймеры МСМ120 и МСМ127 и в качестве ДНК матрицы фрагмент GeneBridges FRT-gb2-Cm-FRT от компании GeneBridges, использовали полимеразу Stratagene Pfu Ultra II. Использовали следующий ПЦР-протокол: денатурация 95°С в течение 4:0; 5 циклов 95°С в течение 0:20, 55°С в течение 0:20, 72°С в течение 2:0; 25 циклов 95°С в течение 0:20, 58°С в течение 0:20, 72°С в течение 2:0; 72°С в течение 10:0; и охлаждение до 4°С.Реакцию проводили в четырех повторностях, каждая, объемом 50 мкл, включала 1 мкл -10 нг/мкл матрицы, по 1 мкл каждого праймера, 1,25 мкл 10 мМ дНТФ, 5 мкл 10х буферного раствора, 1 мкл фермента и 39,75 мкл бидистиллированной воды. Реакционные смеси объединяли в одну, очищали с использованием колонки для очистки Qiagen PCR cleanup column и электропорировали очищенный водой фрагмент в клетки Pirl, содержащие плазмиду МСМ296. Электропорацию проводили в кювете с размером щели 2 мм, воздействуя 2,5 кВ и 200 Ом. После электропорации клетки восстанавливались в LB в течение 3 часов при 30°С.
Селекцию трансформантов МСМ330 проводили на LA, содержащем хлорамфеникол 5. канамицин 50 (Фигуры 107 и 108А-108С; SEQ ID NO: 25).
Интеграция в хромосому Е. coli
[0789] ДНК из клеток МСМ330, выделяли путем лизиса клеток щелочью (miniprepped) (набор Qiaquick Spin kit), разрезали SnaBI и электропорировали фрагмент в клетки BL21(DE3) (Novagen) или MG1655, содержащие плазмиду GeneBridges plasmid pRedET Carb от. Клетки растили при 30°С до значения ОП приблизительно 1, индуцировали 0,4% L-арабинозой в течение 1,5 часов. Затем, перед проведением электропорации с 2 мкл ДНК, клетки трижды промывали бидистиллированной водой с температурой 4°С. Селекцию интегрантов проводили на L-агаре, содержащем хлорамфеникол (5 мкг/мл), и затем подтверждали интеграцию отсутствием роста на L-агаре+канамицин (50 мкг/мл). Интегранты клеток BL21- МСМ331 и клеток MG1655 -МСМ333 заморозили.
iv) Конструирование плазмиды pET24D-Kudzu, кодирующей изопренсинтазу кудзу
[0790] Ген изопренсинтазы кудзу субклонировали в вектор pET24d (Novagen) из вектора pCR2.1 (Invitrogen). Более подробно, ген изопренсинтазы кудзу амплифицировали на основе ДНК-матрицы pTrcKudzu с использованием следующих праймеров МСМ50 5'-GATCATGCAT TCGCCCTTAG GAGGTAAAAA AACATGTGTG CGACCTCTTC TCAATTTACT (SEQ ID NO: 52) и МСМ53 5'-CGGTCGACGG ATCCCTGCAG TTAGACATAC ATCAGCTG (SEQ ID NO: 50). ПЦР-реакцию проводили с использованием ДНК-полимеразы Taq DNA Polymerase (Invitrogen) и полученный ПЦР-продукт клонировали в вектор клонирования pCR2.1-ТОРО ТА (Invitrogen), которым трансформировали химически компетентные клетки Е. coli Ton 10 (Invitrogen). Трансформантов рассевали на L-агаре, содержащем карбенициллин (50 мкг/мл), и инкубировали одну ночь при 37°С.Отдельных трансформантов пересевали в среду, содержащую 5 мл Бульона Лурия и 50 мкг/мл карбенициллина и растили одну ночь при 37°С. Пять выделенных колоний проверили на наличие корректной вставки путем секвенирования ДНК плазмиды, выделенной из 1 мл жидкой культуры (Бульона Лурия) и очищенной с помощью набора QIAprep Spin Mini-prep Kit (Qiagen). Полученная плазмида, обозначенная как МСМ93, содержала кодирующую последовательность гена изопренсинтазы кудзу в составе вектора pCR2.1.
[0791] Кодирующую последовательность кудзу выделяли путем обработки рестрикционными эндонуклеазами PciI и BamHl (Roche) и очищали в геле с использованием набора QIAquick Gel Extraction kit (Qiagen). ДНК вектор pET24d разрезали с помощью NcoI и ВаmHI (Roche), обрабатывали креветочной щелочной фосфатазой (Roche) и очищали с помощью набора QIAprep Spin Mini-prep Kit (Qiagen). Фрагмент изопренсинтазы кудзу дотировали в вектор pET24d, разрезанный NcoVBamW, с помощью набора Rapid DNA Ligation Kit (Roche) при соотношении фрагмента к вектору 5:1, при общем объеме 20 мкл. Часть лигазной смеси (5 мкл) использовали для трансформации химически компетентных клеток Е. coli Top 10 и рассевали их на L-агаре, содержащем канамицин (50 мкг/мл). Корректным трансформантом, что определяли путем секвенирования, трансформировали химически компетентные клетки BL21(λDE3)pLysS (Novagen). Единичные колонии выделяли после выращивания клеток в течение одной ночи при 37°С на L-агаре, содержащем канамицин. Карта получившейся плазмиды, обозначенной как pET24D-Kudzu, представлена на Фигуре 109. Последовательность pET24D-Kudzu (SEQ ID NO: 26) представлена на Фигурах 110А и НОВ. Активность изопренсинтазы подтверждали с использованием метода анализа газовой фазы,
v) Получение штаммов
[0792] Штаммы МСМ331 и МСМ333 совместно трансформировали плазмидой pCLPtrcupperpathway и одной из плазмид pTrcKudzu или pETKudzu, полученные таким образом штаммы описаны в Таблице 5.
Таблица 5. Получение штаммов
vi) Ферментативное получение изопрена с помощью Е. coli, экспрессирующей гены MVA-пути, при культивировании с подпиткой в объеме 15 литров
Приготовление среды (на литр среды для ферментации):
[0793] Среду готовили с использованием следующих компонентов на литр среды: К2НPO4 7,5 г, MgSO4 *7H2O 2 г, моногидрат лимонной кислоты 2 г, железа аммония цитрат 0,3 г, дрожжевой экстракт 0,5 г, 1000Х Модифицированный Раствор Микроэлементов 1 мл. Все эти компоненты совместно вносили и растворяли в деионизированной воде. Данный раствор автоклавировали. рН раствора доводили до значения 7,0 при помощи гидроксида аммония (30%) и при необходимости доводили до нужного объема. После стерилизации и подведения рН в раствор вносили 10 г глюкозы, 0,1 г тиамина* НСL и антибиотики.
1000Х Модифицированный Раствор Микроэлементов:
[0794] 1000Х Модифицированный Раствор Микроэлементов готовили с использованием следующих составляющих: лимонная кислота * Н2O 40 г.MnSO4 * Н2O 30 г.Nad 10 г, FeSO4 * 7Н2O 1 г.CoCh * 6Н2O 1 г, ZnSO4 * 7Н2O 1 г.CuSO4 * 5Н2O 100 мг.Н3ВО3 100 мг и NaMoO4 * 2H2O 100 мг. Каждый компонент растворяли по очереди в деионизированной воде, рН доводили до 3,0 при помощи HCl/NaOH, затем при необходимости доводили до нужного объема и стерилизовали путем пропускания через фильтр с размером пор 0,22 микрон.
[0795] Ферментацию проводили в 15-литровом биореакторе с использованием штамма Е. coli BL21 (DE3), несущего интегрированные в gil.2 компоненты нижнего MVA-пути, как описано выше, и плазмиды pCL PtrcUpperMVA и pTrcKudzu. Данный эксперимент проводили для мониторинга образования изопрена из глюкозы при предпочтительных условиях ферментации: рН 7,0 и температуре 30°С.Для приготовления инокулята штамм Е. coli брали из замороженной виалы, рассевали штрихом на чашку с LB-агаром (с антибиотиком) и инкубировали при 37°С.Одиночную колонию пересевали в питательную среду на основе триптона и дрожжевого экстракта. После того как ОП инокулята достигала значения 1,0 при 550 нм, 500 мл пересевали в 5-литровый биореактор.
[0796] Глюкозу подавали экспоненциально, пока культура не переходила на стационарную фазу. Далее подачу глюкозы сокращали исходя из метаболических потребностей. Общее количество глюкозы, внесенное в процессе ферментации продолжительностью 57 часов, составило 3,9 кг. Индукцию осуществляли путем добавления ИПТГ. После того как выход диоксида углерода достиг значения 100 ммоль/л/ч уровень ИПТГ довели до 100 мкМ. Изменение профиля ОП550 в биореакторе с течением времени представлено на Фигуре 111А. Содержание изопрена в отходящем из биореактора газе измеряли, как описано в настоящей заявке. Титр изопрена увеличивался в ходе прохождения процесса ферментации до конечного значения 1,6 г/л (Фигура 111 В). Удельная производительность изопрена в ходе прохождения процесса ферментации представлена на Фигуре 111C и достигала значения 1,2 мг/ОП/ч. Общее количество произведенного изопрена при культивировании продолжительностью 57 часов, составило 16,2 г.Молярная доля потребленного культурой углерода, который был затрачен на продукцию изопрена в ходе ферментации, составила 0,9%. Массовый процентный выход изопрена относительно глюкозы составил 0,4%.
XIV. Получение изопрена с помощью штамма Е. coli BL21, содержащего изопренсинтазу кудзу при использовании глицерина в качестве источника углерода
[0797] Для получения изопрена на основе глицерина при культивировании с подпиткой клеток Е. coli, экспрессирующих изопренсинтазу кудзу, проводили ферментация в объеме 15 литров. Эксперимент демонстрировал, что при выращивании клеток в присутствии глицерина, в отсутствии глюкозы, продукция изопрена составляла 2,2 г/л.
Приготовление среды (на литр среды для ферментации):
[0798] Среду готовили с использованием следующих компонентов на литр среды: К2НPO4 7,5 г, MgSO4 *7H2O 2 г, моногидрат лимонной кислоты 2 г, железа аммония цитрат 0,3 г, 1000Х Модифицированный Раствор Микроэлементов 1 мл. Все эти компоненты вносили совместно и растворяли в деионизированной воде. Данный раствор автоклавировали. рН раствора доводили до значения 7,0 при помощи гидроксида аммония (30%) и при необходимости доводили до нужного объема. После стерилизации и доведения рН в раствор вносили 5,1 г глицерина, 0,1 г тиамина* HCl и антибиотики.
1000Х Модифицированный Раствор Микроэлементов:
[0799] 1000Х Модифицированный Раствор Микроэлементов готовили с использованием следующих компонентов: лимонная кислота * Н2О 40 г, MnSO4 * Н2O 30 г, NaCl 10 г, FeSO4 * 7Н2O 1 г, СоСl2 * 6Н2О 1 г, ZnSO4 * 7Н2О 1 г, CuSO4 * 5H2O 100 мг, Н3ВО3 100 мг и NaMo04 * 2Н2О 100 мг. Каждый компонент растворяли по очереди в деионизированной воде, рН доводили до 3,0 при помощи HCl/NaOH, затем при необходимости доводили до нужного объема и стерилизовали путем пропускания через фильтр с размером пор 0,22 микрон.
[0800] Ферментацию проводили в 15-литровом биореакторе с использованием клеток Е. coli, BL21 (DE3), несущих плазмиду pTrcKudzu. Данный эксперимент проводили для мониторинга образования изопрена на основе глицерина при предпочтительных условиях ферментации: рН 7,0 и температуре 35°С, Для приготовления инокулята штамм Е. coli брали из замороженной виалы, рассевали штрихом на чашке с LB-агаром (с антибиотиком) и инкубировали при 37°С.Одиночную колонию пересевали в питательную среду на основе сойтона (Soytone), дрожжевого экстракта и глюкозы и растили при 35°С.После того как ОП инокулята достигала значения 1,0 при 550 нм. 600 мл пересевали в 7,5-литровый биореактор.
[0801] Глицерин подавали экспоненциально, пока оптическая плотность при 550 нм (ОП550) не достигала значения 153. Общее количество глицерина, внесенного в процессе ферментации продолжительностью 36 часов, составило 1,7 кг. За исключением глюкозы, поступившей в биореактор вместе с инокулятом, глюкозы в биореактор не вносили. Индукцию осуществляли путем добавления ИПТТ. После достижения культурой ОП550 значения 50, вносили ИПТТ до получения концентрации 20 мкМ. Изменение профиля ОП550 в биореакторе с течением времени представлено на Фигуре 57. Содержание изопрена в отходящем из биореактора газе измеряли, как описано в настоящей заявке. Титр изопрена увеличивался в ходе прохождения процесса ферментации до конечного значения 2,2 г/л (Фигура 58). Общее количество полученного изопрена при культивировании продолжительностью 54 часа составило 20,9 мг, продукция в зависимости от времени представлена на Фигуре 59.
XV. Ферментативное получение изопрена с помощью Е. coli, экспрессирующей гены MVA-пути, при культивировании с подпиткой клеток в объеме 15 литров и при использовании инвертного сахара в качестве источник углерода
[0802] Для получения изопрена при культивировании с подпиткой клеток Е. coli, экспрессирующих полипептиды MVA-пути и изопренсинтазу кудзу, на основе инвертного сахара проводили ферментацию в объеме 15 литров. Эксперимент демонстрировал, что при выращивании клеток в присутствии инвертного сахара продукция изопрена составляла 2,2 г/л.
Приготовление среды (на литр среды для ферментации):
[0803] Среду готовили с использованием следующих компонентов на литр среды: К2НРO4 7,5 г, MgSO4 *7H2O 2 г, моногидрат лимонной кислоты 2 г, железа аммония цитрат 0,3 г, дрожжевой экстракт 0,5 г, 1000Х Модифицированный Раствор Микроэлементов 1 мл. Все эти компоненты вносили совместно и растворяли в деионизированной воде. Данный раствор автоклавировали. рН раствора доводили до значения 7,0 при помощи гидроксида аммония (30%) и при необходимости доводили до нужного объема. После стерилизации и доведения рН в раствор вносили 10 г инвертного сахара, 0,1 г тиамина* НСl и антибиотики.
1000Х Модифицированный Раствор Микроэлементов:
[0804] 1000Х Модифицированный Раствор Микроэлементов готовили с использованием следующих компонентов: лимонная кислота * H2O 40 г, MnSO4 * Н2О 30 г, NaCl 10 г, FeSO4 * 7Н2O 1 г.CoCl2 * 6Н2O 1 г, ZnSO4 * 7Н2O 1 г, CuSO4 * 5H2O 100 мг, Н3ВО3 100 мг и NaMoO4 * 2H2O 100 мг. Каждый компонент растворяли по очереди в деионизированной воде, рН доводили до 3,0 при помощи HCl/NaOH, затем при необходимости доводили до нужного объема и стерилизовали путем пропускания через фильтр с размером пор 0,22 микрон.
[0805] Ферментацию проводили в 15-литровом биореакторе с использованием штамма Е. coli BL21 (DE3), несущего плазмиды pCL PtrcUpperMVA и pTrc KKDyIkIS. Данный эксперимент проводили для мониторинга образования изопрена на основе инвертного сахара при предпочтительных условиях ферментации: рН 7,0 и температуре 30°С.Для приготовления инокулята штамм Е. coli брали из замороженной виалы, рассевали штрихом на чашке с LB-агаром (с антибиотиком) и инкубировали при 37°С.Одиночную колонию пересевали в питательную среду на основе триптона и дрожжевого экстракта. После того как ОП инокулята достигала значения 1,0 при 550 нм, 500 мл культуры пересевали в 5-литровый биореактор.
[0806] Инвертный сахар подавали экспоненциально, пока культура не переходила на стационарную фазу. Далее подачу инвертного сахара сокращали исходя из метаболических потребностей. Общее количество инвертного сахара, внесенное в процессе ферментации продолжительностью 44 часов, составило 2,4 кг. Индукцию осуществляли путем добавления ИПТТ. После достижения культурой оптической плотности значения 9 при 550 нм (ОП550), вносили ИПТГ до получения концентрации 25 мкМ. Концентрацию ИПТГ повышали до 50 мкМ, после того как ОП550 достигала значения 200. Изменение профиля ОП550 в биореакторе с течением времени представлено на Фигуре 96. Содержание изопрена в отходящем из биореактора газе измеряли, как описано в настоящей заявке. Титр изопрена увеличивался в ходе прохождения процесса ферментации до конечного значения 2,4 г/л (Фигура 97). Общее количество полученного изопрена при культивировании продолжительностью 44 часа составило 18,4 г, продукция в зависимости от времени представлена на Фигуре 98. Молярная доля потребленного культурой углерода, который был затрачен на продукцию изопрена в ходе ферментации, составила 1,7%. Массовый процентный выход изопрена относительно глюкозы составил 0,8%.
Пример 9 Конструкция, содержащая компоненты верхнего и нижнего МVА-путей, для интеграции в Bacillus subtilis
I. Конструкция, содержащая компоненты верхнего MVA-пути, для экспрессии в Bacillus subtilis
[0807] Компоненты верхнего MVA-пути от Enterococcus faecalis интегрировали в В. subtilis под контролем промотора аргЕ. К компонентам верхнего MVA-пути относятся два гена: mvaE, который кодирует ААКТ (ацето-ацетил-КоА-трансфераза) и ГМГР (гидрокси-3-метилглутарил-КоА-редуктазы), и ген mvaS, кодирующий ГМГС (гидрокси-3-метилглутарил-КоА-синтаза). Эти два гена объединяли вместе таким образом, что, между ними располагался терминирующий кодон, перед геном mvaS располагался сайт связывания с рибосомой и все находилось под контролем промотора арrЕ, Терминатор располагали после гена mvaE. Маркер устойчивости к хлорамфениколу клонировали в позиции после гена mvaE и конструкцию интегрировали в локус арrЕ путем двойного кроссинговера с использованием фланкирующих их гомологичных областей.
[0808] Методом ПЦР амплифицировали четыре ДНК-фрагмента с использованием праймеров, которые добавляли по краям дополнительные нуклеотиды, что позволяло объединить эти фрагменты в один путем проведения ПЦР-реакции. ПЦР-амплификацию проводили с использованием полимеразы Herculase, в соответствии с инструкциями производителя.
1. PaprE
CF 07-134 (+) Начало аргЕ промотора PstI 5'- GACATCTGCAGCTCCATTTTCTTCTGC (SEQ ID NO: 115)
CF 07-94 (-) Связывает РарrЕ с mvaE
5'- CAATAATAACTACTGTTTTCACTCTTTACCCTCTCCTTTTAA (SEQ ID NO: 116)
Матрица: Хромосомная ДНК Bacillus subtilis
1. mvaE
CF 07-93 (+) Связывает mvaE с промотором аргЕ (инициирующий кодон - GTG)
5'- TTAAAAGGAGAGGGTAAAGAGTGAAAACAGTAGTTATTATTG (SEQ ID NO: 117)
CF 07-62 (-) Связывает mvaE с mvaS, между ними располагается сайт связывания с рибосомой
5'- TTTATCAATCCCAATrGTCATGTTTTTTTACCTCCTTTATTGTTTTCTTAAATC (SEQ ID NO: 94)
Матрица: Хромосомная ДНК Enterococcus faecalis (от АТСС) 3. mvaS
CF 07-61 (+) Связывает mvaE с mvaS, между ними располагается сайт связывания с рибосомой
5'-GATTTAAGAAAACAATAAAGGAGGTAAAAAAACATGACAATTGGGATTGATAAA (SEQ ID NO: 95)
CF 07-124 (-) Связывает конец гена mvaS с терминатором
5'- CGGGGCCAAGGCCGGTTTTTTTTAGTTTCGATAAGAACGAACGGT (SEQ ID NO: 118)
Матрица: Хромосомная ДНК Enterococcus faecalis
4. Терминатор щелочной сериновой протеазы В. amyliquefaciens
CF 07-123 (+) Связывает конец гена mvaS с терминатором
5'- ACCGTTCGTTCTTATCGAAACTAAAAAAAACCGGCCTTGGCCCCG (SEQ ID NO: 119)
CF 07-46 (-) Конец терминатора BamHI В. Amyliquefaciens
5'- GACATGACGGATCCGATTACGAATGCCGTCTC (SEQ ID NO: 58)
Матрица: Хромосомная ДНК Bacillus amyliquefaciens ПЦР- реакции синтеза
5. Объединение mvaE с mvaS
CF 07-93 (+) Связывает mvaE с промотором аргЕ (инициирующий кодон - GTG)
5'- TTAAAAGGAGAGGGTAAAGAGTGAAAACAGTAGTTATTATTG (SEQ ID NO: 117)
CF 07-124 (-) Связывает конец mvaS с терминатором
5'- CGGGGCCAAGGCCGGTTTTTTTTAGTTTCGATAAGAACGAACGGT (SEQ ID NO: 118)
Матрица: №2 и №3 сверху
6. Объединение mvaE-mvaS с промотором аргЕ
CF 07-134 (+) Начало аргЕ промотора PstI
5'- GACATCTGCAGCTCCATTTTCTTCTGC (SEQ ID NO: 115)
CF 07-124 (-) Связывает конец mvaS с терминатором 297
5'- CGGGGCCAAGGCCGGTTTTTTTTAGTTTCGATAAGAACGAACGGT (SEQ ID NO: 118)
Матрица: №1 и №4 сверху 7. Объединение РартЕ-mvaE-mvaS с терминатором
CF07-134 (+) Начало аргЕ промотора PstI 5'- GACATCTGCAGCTCCATTTTCTTCTGC (SEQ ID NO: 115)
CF 07-46 (-) Конец терминатора BamHI В. amyliquefaciens У- GACATGACGGATCCGATTACGAATGCCGTCTC (SEQ ID NO: 58)
Матрица: №4 и №6
[0809] Продукт разрезали рестрикционными эндонуклеазами PstVBamW и лигировали в pJM102 (Perego, M. 1993. Integrational vectors for genetic manipulation in Bacillus sublilis, p.615-624. In A. L. Sonenshein, J. A. Hoch, and R. Losick (ed.). Bacillus subtilis and other gram-positive bacteria: biochemistry, physiology, and molecular genetics. American Society for Microbiology, Washington.D.C.), который предварительно разрезали PstVBamW. Лигазной смесью трансформировали химически компетентные клетки Е. coli Top 10 и проводили селекцию трансформантов на LA, содержащем карбенициллин (50 мкг/мл). Корректную плазмиду идентифицировали путем секвенирования и обозначали ее, как pJMUpperpathway2 (Фигуры 50 и 51). Очищенной плазмидной ДИК трансформировали клетки Bacillus subtilis aprEnprE Pxyl-comK, селекцию трансформантов проводили на L-агаре, содержащем хлорамфеникол (5 мкг/мл). Выделяли корректные колонии и последовательно пересевали их на L-агаре, содержащем хлорамфеникол в концентрациях 10, 15 и 25 мкг/мл с целью амплифицировать число копий кассеты, содержащих компоненты верхнего MVA-пути.
[0810] Полученный штамм испытывали на продукцию мевалоновой кислоты при выращивании на LB, содержащей 1% глюкозы и 1%. Культуру анализировали на содержание мевалоновой кислоты методом ГХ.
[0811] Данный штамм использовали как хозяина для интеграции в него компонентов нижнего MVA-путь.
[0812] Для секвенирования различных указанных выше конструкций использовали следующие праймеры:
Праймеры для секвенирования:
CF07-134 (+) Начало аргЕ промотора PstI 5'- GACATCTGCAGCTCCATTTTCTTCTGC (SEQ ID NO: 115)
CF 07-58 (+) Начало гена mvaE
5' - ATGAAAACAGTAGTTATTATTGATGC (SEQ ID NO: 97)
CF 07-59 (-) Конец гена mvaE
5'- ATGTTATTGTTTTCTTAAATCATTTAAAATAGC (SEQ ID NO: 98)
CF 07-82 (+) Начало гена mvaS
5' - ATGACAATTGGGATTGATAAAATTAG (SEQ ID NO: 99)
CF 07-83 (-) Конец гена mvaS
5' - TTAGTTTCGATAAGAACGAACGGT (SEQ ID NO: 100)
CF 07-86 (+) Последовательность из mvaE
5'- GAAATAGCCCCATTAGAAGTATC (SEQ ID NO: 101)
CF 07-87 (+) Последовательность из mvaE
5'- TTGCCAATCATATGATTGAAAATC (SEQ ID NO: 102)
CF 07-88 (+) Последовательность из mvaE
5'- GCTATGCTTCATTAGATCCTTATCG (SEQ ID NO: 103)
CF 07-89 (+) Последовательность mvaS
5'- GAAACCTACATCCAATCTTTTGCCC (SEQ ID NO: 104)
[0813] Селекцию трансформантов проводили на LA, содержащем хлорамфеникол в концентрации 5 мкг/мл. Одну колонию, для которой подтвердили корректную интеграции путем секвенирования, пересевали на чашках с LA в течение нескольких дней с увеличением концентрации хлорамфеникола до конечной концентрации 25 мкг/мл. Это приводило к амплификации числа копий кассеты, содержащей интересующие гены. Полученный штамм обозначали как CF 455: pJMupperpathway#l X Bacillus subtilis aprEnprE Pxyl comK (адаптирован для роста на LA с содержанием хлорамфеникола 25 мкг/мл).
II. I. Конструкция содержащая компоненты нижнего MVA-пути для экспрессии в Bacillus subtilis
[0814] К компонентам нижнего MVA-пути относятся гены mvkl, pmk, mpd и idi, данные гены комбинировали в кассету, дополнительно содержащую: фланкирующие ДНК участки региона пргЕ хромосомы В. subtilis (сайт интеграции), промотор аргЕ и маркер устойчивости к спектиномицину (см. Фигуры 28 и 29; SEQ ID NO: 13). Данную кассету синтезировала компания DNA2.0 и ее интегрировали в хромосому В. subtilis, содержащую компоненты верхнего MVA-пути, интегрированные в локус аргЕ. Ген изопренсинтазы кудзу экспрессировался благодаря наличию реплицирующейся плазмиды, описанной в Примере 4, которой трансформировали штамм, содержащий интегрированные компоненты верхнего и нижнего MVA-путей.
Пример 10: Примеры композиций изопрена и способы их получения
I. Анализ состава отходящего при ферментации газа, содержащего изопрен
[0815] Ферментацию проводили в объеме 14 литров, использовали рекомбинантный штамм Е. coli BL21 (DE3), содержащий две плазмиды pCL upperMev; pTrcKKDyDdS, полностью кодирующих MVA-путь биосинтеза предшественников изопреноидов, изопренилпирофосфатизомеразу дрожжей и изопренсинтазу кудзу. Газ, отходящий из 14-литрового реактора, собирали в виалы для парофазного анализа объемом 20 мл в период максимального выхода изопрена (27,9 часов, время ферментации "ВФ") и анализировали газовую фазу методом ГХ/МС на содержание летучих компонентов.
[0816] Анализ газовой фазы проводили с использованием системы Agilent 6890 ГХ/МС, оснащенной колонкой Agilent HP-5MS ГХ/МС (30 м×250 мкм, толщина пленки фазы 0,25 мкм). Для отбора аликвот объемом 500 мкл из виалы для парофазного анализа объемом 20 мл использовали автоматический инжектор CombiPAL. Согласно используемому методу ГХ/МС анализа, в качестве газа-носителя применяли гелий при скорости потока 1 мл/мин. Температуру инжектора поддерживали на уровне 250°С, - при делении потока 50:1. Температуру термостата поддерживали на уровне 37°С, в течение первых двух минут анализа и затем повышали до 237°С со скоростью 25°С/мин, общая продолжительность анализа составляла 10 минут. Диапазон сканирования масс-селективного детектора Agilent 5793N составлял от 29 m/z до 300 m/z. Предел обнаружения данной системы составлял приблизительно 0,1 мкг/лгаз или приблизительно 0,1 промилле. При необходимости можно использовать более чувствительное оборудование с более низким пределом обнаружения.
[0817] Отходящий газ на 99,925% (об/об) состоял из неконденсирующихся газов (Nz, СО2 и Ог) приблизительно на 0,075% из изопрена (2-метил-1,3-бутадиен) (-750 промилле по объему, 2100 мкг/л) и следовых количеств (<50 промилле по объему) этанола, ацетона и двух пятиатомных прениловых спиртов. Количество водяных паров не определяли, но предположительно их количество соответствовало уравнению давления пара при 0°С. Состав летучих органических фракций определяли интегрированием площадей пиков на ГХ/МС-хроматограмме (Фигуры 86А и 86 В), указанный состав приведен в таблице 6. Калибровочные кривые для стандартов этанола и ацетона позволяли переводить площадь пика на хроматограмме в единицы концентрации в газовой фазе с использованием стандартных методик.
Таблица 6. Состав летучих органических компонентов отходящего при ферментации газа. Отходящий газ анализировали во временной точке, соответствующей 27,9 часам проведения ферментации с использованием штамма Е. coli BL21 (DE3), для которого характерен гетерологичный MVA-путь, изопренил пирофосфат изомеразы, полученной из дрожжей и изопренсинтазы кудзу.
II. Измерение следовых летучих органических - соединений (ДОС), продуцируемых совместно с изопреном в ходе ферментации рекомбинантного штамма Е. coli
[0818] Ферментацию проводили в объеме 14 литров с рекомбинантным штаммом Е. coli BL21 (DE3), содержащим две плазмиды (pCL upperMev и pTrcKKDyIkIS), кодирующие весь MVA-путь биосинтеза предшественников изопрена, изопренил пирофосфат изомеразой, полученной из дрожжей и изопренсинтазой кудзу.
[0819] Отходящий в ходе ферментации газ пропускали через охлажденные виалы для парофазного анализа с целью концентрирования и обнаружения следовых количеств летучих органических компонентов. Отходящий в ходе ферментации газ отбирали при скорости 1 л/мин в течение 10 минут пропусканием через виалу для парофазного анализа объемом 20 мл, заполненную кварцевой стекловатой (2 г) и охлажденную до -78°С с помощью сухого льда. Виалу закрывали новой крышкой и анализировали парогазовую фазу методом ГХ/МС на наличие захваченных летучих органических соединений (ЛОС) при условиях, описанных в Примере 10 часть 1. Соотношения соединений, представленные на Фигурах 87А - 87D, представляют собой конечное содержание данных соединений в отходящем в ходе ферментации газе, при относительном давлении пара, соответствующему -78°С, и существующей точности масс-спектрометрического детектора. Так, например, низкое содержание изопрена, по сравнению с кислородсодержащими летучими органическими соединениями (такими как ацетон и этанол), представляет собой функцию высокой летучести данного вещества, так что изопрен не накапливается в паровой фазе над жидкостью при температуре -78°С.
[0820] Наличие многих из данных соединений характерно только для композиций на основе изопрена, получаемых из биологических источников. Результаты представлены на Фигурах 87А-87D и представлены в Таблицах 7А и 7В
Таблица 7А: Наличие следовых летучих соединений в отходящем из ферментатора газе, продуцируемые штаммом Е. coli BL21 (DE3) (pCL upperMev; pTrcKKDyIkIS), определяемые криозахватом при -78°С.
1 Площадь пика ГХ - не пересчитанная площадь, ограниченная пиком на хроматограмме, соответствующим указанному соединению.
2 Площадь % - площадь пика, выраженная в % от суммы площадей пиков всех соединений.
3 Уровень % - площадь пика, выраженная в % от площади пика 2-метил-1,3-бутадиена.
Таблица 7 В: Наличие следовых летучих соединений в отходящем из ферментатора газе, продуцируемые штаммом Е. coli BL21 (DE3) (pCL upperMev;
pTrcKKDyIRIS), определяемые криозахватом при •196°С.
1 Площадь пика ГХ - не пересчитанная площадь, ограниченная пиком на хроматограмме, соответствующем указанному соединению.
2 Площадь % - площадь пика, выраженная в % от суммы площадей пиков всех соединений.
3 Уровень % - площадь пика, выраженная в % от площади пика 2-метил-1,3-бутадиена.
III. Отсутствие С5-углеводородных изомеров в изопрене, получаемом при ферментации
[0821] Крио-улавливание изопрена, присутствующего в отходящем в ходе ферментации газе осуществляли, используя виалы для парофазного анализа объемом 2 мл, охлажденные в жидком азоте. Отходящий газ (1 л/мин) сначала пропускали через виалу объемом 20 мл, содержащую гидроксид натрия в виде пеллет с целью минимизировать накопление льда и твердого СО2 в виалах объемом 2 мл (-196°С). Приблизительно 10 литров отходящего газа пропускали через виалу, после чего виалу оставляли для нагревания до -78°С с возможностью выхода газа, после чего флакон виалу закрывали новой крышкой и анализировали методом ГХ/МС.
[0822] Анализ паровой фазы над жидкостью методом ГХ/МС проводили с использованием системы Agilent 6890 ГХ/МС и газонепроницаемого шприца объемом 100 мкл, в режиме отбора проб из паровой фазы над жидкостью. Для разделения анализируемых веществ использовали колонку для ГХ/МС Zebron ZB-624 GC/MS (30 м×250 мкм; толщина пленки фазы 1,40 мкм). Автоматический инжектор для ГХ использовали вместе с газонепроницаемым шприцом объемом 100 мкл, игла которого была подобрана для того, что бы было возможно отбирать пробу паровой фазы объемом 50 мкл из виалы для ГХ объемом 2 мл. Для ГХ/МС анализа в качестве газа носителя использовали гелий при скорости потока 1 мл/мин. Температуру инжектора поддерживали на уровне 200°С.при делении потока - 20:1. Температуру термостата поддерживали на уровне 37°С, продолжительность анализа составляла 5 минут. Масс-селективный детектор Agilent 5793n настраивали на работу в режиме селективного мониторинга ионов (SIM) при m/z 55, 66, 67 и 70. При описанных условиях, выход изопрена наблюдали через 2,966 минуты (Фигура 88 В). Также этим методом анализировали стандарты нефтяных производных изопрена (Sigma-Aldrich), в которых обнаруживали дополнительные С5-углеводородные изомеры, выход которых наблюдали незадолго до или после главного пика, данные пики охарактеризовывали на основе скорректированной площади пика (Фигура 88А).
Таблица 8А: ГХ/МС-анализ нефтяных производных изопрена
Таблица 8В: ГХ/МС-анализ изопрена, полученного при ферментации (% от общего числа С5-углеводородов)
[0823] В отдельном эксперименте анализировали стандартную смесь С5-углеводородов для определения, является ли чувствительность детектора одинаковой по отношению к каждому из соединений. Указанные соединения представляли собой:
2-метил-1-бутен, 2-метил-1,3-бутадиен, (Е)-2-пентен, (г)-2-пентен и (Е)-1,3-пентадиен. В этом эксперименте использовали колонку Agilent DB-Petro (100 м×0.25 мм, толщина пленки фазы 0,50 мкм) и поддерживали температуру 50°С в течение 15 минут. Для ГХ/МС анализа, в качестве газа носителя использовали гелий при скорости потока 1 мл/мин. Температуру инжектора поддерживали на уровне 200°С, при делении потока - 50:1. Диапазон сканирования масс-селективного детектора Agilent 5793N в режиме полного сканирования (full scan mode) составлял m/z от 19 до 250. В данных условиях каждый стандарт в концентрации 100 мкг/мл показывал одинаковый ответ детектора с учетом ошибки эксперимента.
IV. Композиции, содержащие изопрен адсорбированный в твердой фазе.
[0824] Биологически полученный изопрен адсорбировали на активированном угле с образованием твердой фазы, содержащей от 50 до 99,9% углерода, от 0,1 до 50% изопрена, от 0,01% до 5% воды и следовые (<0,1%) количества летучих органических соединений.
[0825] Отходящий из ферментатора газ пропускали через медный конденсационный змеевик с температурой 0°С и затем для удаления паров воды, фильтровали через гранулированный силикатный влагопоглотитель. Осушенный отходящий газ затем пропускали через углесодержащий фильтр (Koby Jr, Koby Filters, MA) до состояния, пока проходящий через фильтр изопрен не удавалось обнаружить методом ГХ/МС. Количество адсорбированного в картридже изопрена можно вычислить косвенно, зная концентрацию изопрена в отходящем газе, общую скорость потока и процентное количество изопрена, прошедшего через фильтр за время сбора. В качестве альтернативы, адсорбированный изопрен можно выделить из фильтра методами термической или вакуумной десорбции или путем вытеснения растворителем.
V. Сбор и анализ конденсированного изопрена.
[0826] Отходящий из ферментатора газ осушали и удаляли из него СО2 путем фильтрации через подходящий адсорбент (например, аскарит). Получаемый на выходе газовый поток пропускали через конденсатор, охлаждаемый жидким азотом для конденсации присутствующих в потоке ЛОС. Для ингибирования получаемого изопренового конденсата, сборник содержал t-бутил катехин. С целью оценки чистоты, конденсат анализировали стандартными методами ГХ/МС и ЯМРС, такими как описаны в настоящей заявке.
VI. Ферментативное получение прениловых спиртов
[0827] Анализ отходящего газа при культивировании штамма Е. coli BL21 (DE3), экспрессирующего изопренсинтаза кудзу, показал наличие изопрена и 3-метил-3-бутен-1-ола (изопренола). Содержание указанных двух компонентов в отходящем газе в ходе ферментации показан на Фигуре 89, причем указанное содержание определяли путем анализа паровой фазы над жидкостью методом ГХ/МС. В данном эксперименте содержание изопренола (3-метил-3-бутен-1-ола, 3-МБК) составлял приблизительно 10 мкг/лотх.газ. В дополнительных экспериментах содержание [МБК] в отходящем при ферментации газе составляло 20 мкг/л.
Пример 11: Независимое изучение продукции изопрена и роста культуры Е. coli, экспрессирующей гены MVA-пути, при культивировании с подпиткой
[0828] В Примере 11 демонстрируется независимость клеточного роста от продукции мевалоновой кислоты и продукции изопрена.
I. Условия ферментации Приготовление среды (на литр среды для ферментации):
[0829] Среду готовили с использованием следующих компонентов на литр среды: К2НPO4 7,5 г, MgSO4 *7H2O 2 г, моногидрат лимонной кислоты 2 г, железа аммония цитрат 0,3 г, дрожжевой экстракт 0,5 г, 1000Х Модифицированный Раствор Микроэлементов 1 мл. Все эти компоненты совместно вносили и растворяли в деионизированной воде. Данный раствор автоклавировали. рН раствора доводили до значения 7,0 при помощи гидроксида аммония (30%) и при необходимости доводили до нужного объема. После стерилизации и доведения рН в раствор вносили 10 г глюкозы, 0,1 г тиамина* НСL и антибиотики.
1000Х Модифицированный Раствор Микроэлементов:
[0830] 1000Х Модифицированный Раствор Микроэлементов готовили с использованием следующих компонентов: лимонная кислота * Н2О 40 г, MnSO4 * Н2О 30 г, NaCl 10 г, FeSO4 * 7Н2О 1 г, CoCl2 * 6Н2O 1 г, ZnSO4 * 7Н2О 1г. CuSO4 * 5H2O 100 мг, Н3ВО3 100 мг и NaMoC4 * 2Н2О 100 мг. Каждый компонент растворяли по очереди в деионизированной воде, рН доводили до 3,0 при помощи HCl/NaOH, затем при необходимости доводили до нужного объема и стерилизовали путем пропускания через фильтр с размером пор 0,22 микрон.
[0831] Ферментацию проводили с помощью клеток Е. coli, содержащих плазмиду pTrcHis2AUpperPathway (также обозначаемая как pTrcUpperMVA, Фигуры 91 и 92А-92С; SEQ ID NO: 23) (50 мкг/мл карбенициллина) или pCL PtrcUpperMVA (также обозначаемая как pCL PtrcUpperPathway (Фигура 26)) (50 мкг/мл спектиномицина). В экспериментах с получением изопрена использовали клетки Е. coli, которые дополнительно содержали плазмиду pTrc KKDyIkIS (50 мкг/мл канамицина). Данный эксперимент проводили для мониторинга образование мевалоновой кислоты или изопрена из глюкозы при предпочтительных условиях ферментации: рН 7,0 и температуре 30°С.Для приготовления инокулята штамм Е. coli брали из замороженной виалы, рассевали штрихом на чашке к LA-агаром (с антибиотиком) и инкубировали при 37°С.Одиночную колонию пересевали в питательную среду на основе триптона и дрожжевого экстракта. После того как оптическая плотность инокулята достигала значения 1,0 при 550 нм, культуру использовали для пересева в биореактор.
[0832] Глюкозу подавали экспоненциально, пока культура не переходила на стационарную фазу. Далее подачу глюкозы сокращали исходя из метаболических потребностей. Индукцию осуществляли путем добавления ИПТТ. Концентрацию мевалоновой кислоты в культуральной жидкости определяли обработкой хлорной кислотой (Sigma-Aldrich №244252) обработанные образцы (0,3 М, выдерживали при 4°С в течение 5 минут) и вносили в колонку, предназначенную для разделения органических кислот методом ВЭЖХ (BioRad №125-0140), Концентрацию определяли путем сравнения пика питательной среды на основе мевалоновой кислоты, с калибровочной кривой, составленной на основе мевалонолацетона (Sigma-Aldrich №М4667), обработанного хлорной кислотой с образованием В,L-мевалоната. Содержание изопрена в отходящем из биореактора газе измеряли, как описано в настоящей заявке. Титр изопрена определяли как количество изопрена, образующегося на литр ферментационной питательной среды.
II. Продукция мевалоновой кислоты клетками Е. coli BL21 (DE3), экспрессирующими плазмиду pTrcUpperMVA в объеме 150 литров
[0833] Клетки BL21 (DE3), которые выращивали на чашке, как описано выше, в Примере 11, часть I, засевали во флакон, содержащий 45 мл среды на основе триптона и дрожжевого экстракта и инкубировали при 30°С и перемешивании 170 об/мин в течение 5 часов. Полученный раствор переносили в 5-литровый биореактор, со средой на основе триптона и дрожжевого экстракта, где клетки растили при 30°С и перемешивании 27,5 об/мин пока ОП550 не достигала значения 1,0. 5 литров инокулята переносили в 150-литровый биореактор. содержащий 45 кг среды. После достижения культурой ОП550 значения 10, вносили ИПТГ до получения концентрации 1,1 мкМ. Изменение профиля ОП550 в биореакторе с течением времени представлено на Фигуре 60А. Титр мевалоновой кислоты увеличивался в ходе прохождения процесса ферментации до конечного значения 61,3 г/л (Фигура 60В). Изменение удельной продуктивности в ходе процесса ферментации показано на Фигуре 60С, и вместе с Фигурой 60А данные свидетельствуют об отсутствии связи между ростом культуры и продукцией мевалоновой кислоты. Общее количество произведенной мевалоновой кислоты при культивировании продолжительностью 52,5 часов, составило 4,0 кг на 14,1 кг израсходованной глюкозы. Молярная доля потребленного культурой углерода, который был затрачен на продукцию мевалоновой кислоты в ходе ферментации, составила 34,2%.
III. Продукция мевалоновой кислоты клетками Е. coli BL21 (DE3), экспрессирующими плазмиду pTrcUpperMVA в объеме 15 литров
[0834] Клетки BL21 (DE3), которые выращивали на чашке, как описано выше. в Примере 11 часть I, засевали во флакон, содержащий 500 мл среды на основе триптона и дрожжевого экстракта и инкубировали при 30°С и перемешивании 160 об/мин пока ОП550 культуры не достигало значения 1,0. Полученный материал переносили в 15-литровый биореактор, содержащий 4,5 кг среды. После достижения культурой ОП550 значения 10, вносили ИПТГ до получения концентрации 1,0 мкМ. Изменение профиля ОП550 в биореакторе с течением времени представлено на Фигуре б1А. Титр мевалоновой кислоты увеличивался в ходе прохождения процесса ферментации до конечного значения 53,9 г/л (Фигура 61 В). Изменение удельной продуктивности в ходе процесса ферментации показано на Фигуре 61C, и вместе с Фигурой б1А данные свидетельствуют об отсутствии связи между ростом культуры и продукцией мевалоновой кислоты. Общее количество произведенной мевалоновой кислоты при культивировании продолжительностью 46,6 часов, составило 491 г на 2,1 кг израсходованной глюкозы. Молярная доля потребленного культурой углерода, который был затрачен на продукцию мевалоновой кислоты в ходе ферментации, составила 28,8%.
IV Продукция мевалоновой кислоты клетками Е. coli FM5, экспрессирующими плазмиду pTrcUpperMVA в объеме 15 литров
[0835] Клетки FM5, которые выращивали на чашке, как описано выше, в Примере 11 часть I, засевали во флакон, содержащий 500 мл среды на основе триптона и дрожжевого экстракта и инкубировали при 30°С и перемешивании 160 об/мин пока ОП550 культуры не достигало значения 1,0. Полученный материал переносили в 15-литровый биореактор, содержащий 4,5 кг среды. После достижения культурой ОП550 значения 30, вносили ИПТГ до получения концентрации 1,0 мкМ. Изменение профиля ОП550 в биореакторе с течением времени представлено на Фигуре 62А. Титр мевалоновой кислоты увеличивался в ходе прохождения процесса ферментации до конечного значения 23,7 г/л (Фигура 62В). Изменение удельной продуктивности в ходе процесса ферментации показано на Фигуре 62С, и вместе с Фигурой 62А данные свидетельствуют об отсутствии связи между ростом культуры и продукцией мевалоновой кислоты. Общее количество произведенной мевалоновой кислоты при культивировании продолжительностью 51,2 часов, составило 140 г на 1,1 кг израсходованной глюкозы. Молярная доля потребленного культурой углерода, который был затрачен на продукцию мевалоновой кислоты в ходе ферментации, составила 15,2%.
V. Продукция изопрена клетками Е. coli BL21 (DE3), экспрессирующими плазмиды pCL PtrcUpperMVA и pTrc KKDyDdS в 15-литровом ферментаторе
[0836] Клетки BL21 (DE3), экспрессирующие плазмиды pCL PtrcUpperMVA и pTrc KKDyIkIS, которые выращивали на чашке, как описано выше, в Примере 11 часть I, засевали во флакон, содержащий 500 мл среды на основе триптона и дрожжевого экстракта и инкубировали при 30°С и перемешивании 160 об/мин пока ОП550 культуры не достигало значения 1,0. Полученный материал переносили в 15-литровый биореактор, содержащий 4,5 кг среды. После достижения культурой ОП550 значения 10, вносили ИПТГ до получения концентрации 25 мкМ. Концентрацию ИПТТ повышали до 50 мкМ, после того как ОП550 достигала значения 190. Концентрацию ИПТГ повышали до 100 мкМ через 38 часов ферментации. Изменение профиля ОП550 в биореакторе с течением времени представлено на Фигуре 63А. Титр изопрена увеличивался в ходе прохождения процесса ферментации до конечного значения 2,2 г/л культуральной жидкости (Фигура 63 В). Изменение удельной продуктивности в ходе процесса ферментации показано на Фигуре 63С, и вместе с Фигурой 63А данные свидетельствуют об отсутствии связи между ростом культуры и продукцией изопрена. Общее количество произведенного изопрена при культивировании продолжительностью 54,4 часов, составило 15,9 г на 2,3 кг израсходованной глюкозы. Молярная доля потребленного культурой углерода, который был затрачен на продукцию изопрена в ходе ферментации, составила 1,53%.
VI. Продукция изопрена клетками Е. coli BL21 tuner (DE3), экспрессирующими плазмиды pCL PtrcUpperMVA и pTrc KKDyIkIS в объеме 15 литров
[0837] Клетки BL21 (DE3) BL21 tuner, экспрессирующие плазмиды pCL PtrcUpperMVA и рТгс KKDyIkIS, которые выращивали на чашке, как описано выше. в Примере 11 часть I. засевали во флакон, содержащий 500 мл среды на основе триптона и дрожжевого экстракта и инкубировали при 30°С и перемешивании 160 об/мин пока ОП550 культуры не достигало значения 1,0. Полученный материал переносили в 15-литровый биореактор, содержащий 4,5 кг среды. После достижения культурой ОП550 значения 10, вносили ИПТГ до получения концентрации 26 мкМ. Концентрацию ИПТТ повышали до 50 мкМ, после того как ОП550 достигала значения 175. Изменение профиля ОП550 в биореакторе с течением времени представлено на Фигуре 64А. Титр изопрена увеличивался в ходе прохождения процесса ферментации до конечного значения 1,3 г/л культуральной жидкости (Фигура 64 В). Изменение удельной продуктивности в ходе процесса ферментации показано на Фигуре 64С, и вместе с Фигурой 64А данные свидетельствуют об отсутствии связи между ростом культуры и продукцией изопрена. Общее количество произведенного изопрена при культивировании продолжительностью 48,6 часов, составило 9,9 г на 1,6 кг израсходованной глюкозы. Молярная доля потребленного культурой углерода, который был затрачен на продукцию изопрена в ходе ферментации, составила 1,34%.
VII. Продукция изопрена клетками Е. coli MG1655, экспрессирующими плазмиды pCL PtrcUpperMVA и рТгс KKDyIkIS в объеме 15 литров
[0838] Клетки MG1655, экспрессирующие плазмиды pCL PtrcUpperMVA и рТгс KKDyBdS, которые выращивали на чашке, как описано выше, в Примере 11 часть I, засевали во флакон, содержащий 500 мл среды на основе триптона и дрожжевого экстракта и инкубировали при 30°С и перемешивании 160 об/мин пока ОП550 культуры не достигало значения 1,0. Полученный материал переносили в 15-литровый биореактор, содержащий 4,5 кг среды. После достижения культурой ОП550 значения 45. вносили ИПТТ до получения концентрации 24 мкМ. Изменение профиля ОП550 в биореакторе с течением времени представлено на Фигуре 65А. Титр изопрена увеличивался в ходе прохождения процесса ферментации до конечного значения 393 мг/л культуральной жидкости (Фигура 65 В). Изменение удельной продуктивности в ходе процесса ферментации показано на Фигуре 65С, и вместе с Фигурой 65А данные свидетельствуют об отсутствии связи между ростом культуры и продукцией изопрена. Общее количество произведенного изопрена при культивировании продолжительностью 67,4 часов, составило 2,2 г на 520 г израсходованной глюкозы.
Молярная доля потребленного культурой углерода, который был затрачен на продукцию изопрена в ходе ферментации, составила 0,92%.
VIII. Продукция изопрена клетками Е. coli MG1655ack-pta, экспрессирующими плазмиды pCL PtrcUpperMVA и pTrc KKDyIkIS в объеме 15 литров
[0839] Клетки MG1655ack-pta, экспрессирующие плазмиды pCL PtrcUpperMVA и pTrc KKDyIkIS, которые выращивали на чашке, как описано выше, в Примере 11 часть I, засевали во флакон, содержащий 500 мл среды на основе триптона и дрожжевого экстракта и инкубировали при 30°С и перемешивании 160 об/мин пока ОП550 культуры не достигало значения 1,0. Полученный материал переносили в 15-литровый биореактор, содержащий 4,5 кг среды. После достижения культурой ОП550 значения 10, вносили ИПТТ до получения концентрации 30 мкМ. Изменение профиля ОП550 в биореакторе с течением времени представлено на Фигуре 66А. Титр изопрена увеличивался в ходе прохождения процесса ферментации до конечного значения 368 мг/л культуральной жидкости (Фигура 66 В). Изменение удельной продуктивности в ходе процесса ферментации показано на Фигуре 66С, и вместе с Фигурой 66А данные свидетельствуют об отсутствии связи между ростом культуры и продукцией изопрена. Общее количество произведенного изопрена при культивировании продолжительностью 56,7 часов, составило 1,8 г на 531 г израсходованной глюкозы. Молярная доля потребленного культурой углерода, который был затрачен на продукцию изопрена в ходе ферментации, составила 0,73%.
IX. Продукция изопрена клетками Е. coli FM5, экспрессирующими плазмиды pCL PtrcUpperMVA и pTrc KKDyIkIS в объеме 15 литров
[0840] Клетки FM5, экспрессирующие плазмиды pCL PtrcUpperMVA и pTrc KKDyIkIS, которые выращивали на чашке, как описано выше в Примере 11 часть I, засевали во флакон, содержащий 500 мл среды на основе триптона и дрожжевого экстракта и инкубировали при 30°С и перемешивании 160 об/мин пока ОП550 культуры не достигало значения 1,0. Полученный материал переносили в 15-литровый биореактор, содержащий 4,5 кг среды. После достижения культурой ОП550 значения 15, вносили ИПТГ до получения концентрации 27 мкМ. Изменение профиля ОП550 в биореакторе с течением времени представлено на Фигуре 67А. Титр изопрена увеличивался в ходе прохождения процесса ферментации до конечного значения 235 мг/л культуральной жидкости (Фигура 67 В). Изменение удельной продуктивности в ходе процесса ферментации показано на Фигуре 67С, и вместе с Фигурой 67А данные свидетельствуют об отсутствии связи между ростом культуры и продукцией изопрена. Общее количество произведенного изопрена при культивировании продолжительностью 52,3 часов, составило 1,4 г на 948 г израсходованной глюкозы. Молярная доля потребленного культурой углерода, который был затрачен на продукцию изопрена в ходе ферментации, составила 0,32%.
Пример 12: Продукция изопрена в период экспоненциальной фазы роста культуры Е. coli, экспрессирующей гены МVА-пути. при культивировании с подпиткой
[0841] В Примере 12 представлена продукция изопрена в период экспоненциальной фазы роста клеток.
Приготовление среды (на литр среды для ферментации):
[0842] Среду готовили с использованием следующих компонентов на литр среды:
К2НPO4 7,5 г, MgSO4 *7Н2O 2 г, моногидрат лимонной кислоты 2 г, железа аммония цитрат 0,3 г, дрожжевой экстракт 0,5 г, 1000Х Модифицированный Раствор Микроэлементов 1 мл. Все эти компоненты совместно вносили и растворяли в деионизированной воде. Данный раствор автоклавировали. рН раствора доводили до значения 7,0 при помощи гидроксида аммония (30%) и при необходимости доводили до нужного объема. После стерилизации и подведения рН в раствор вносили 10 г глюкозы, 0,1 г тиамина* НСL и антибиотики.
1000Х Модифицированный Раствор Микроэлементов:
[0843] 1000Х Модифицированный Раствор Микроэлементов готовили с использованием следующих компонентов: лимонная кислота * Н2О 40 г, MnSO4 * Н2O 30 г, NaCl 10 г, FeSO4 * 1W 1 г, CoCl2 * 6Н2О 1 г, ZnSO4 * 7H2O 1 г, CuSO4 * 5H2O 100 мг, Н3ВО3 100 мг и NaMoC4 * 2Н2О 100 мг. Каждый компонент растворяли по очереди в деионизированной воде, рН доводили до 3,0 при помощи HCl/NaOH, затем при необходимости доводили до нужного объема и стерилизовали путем пропускания через фильтр с размером пор 0,22 микрон.
[0844] Ферментацию проводили в 15-литровом биореакторе с использованием штамма Е. coli АТСС11303, несущего плазмиды pCL PtrcUpperMVA и pTrc KKDyIkIS. Данный эксперимент проводили для мониторинга образование изопрена из глюкозы при предпочтительных условиях ферментации: рН 7,0 и температуре 30°С.Для приготовления инокулята штамм Е. coli брали из замороженной виалы, рассевали штрихом на чашке с LB-агаром (с антибиотиком) и инкубировали при 37°С.Одиночную колонию пересевали в питательную среду на основе триптона и дрожжевого экстракта. После того как ОП инокулята достигала значения 1,0 при 550 нм, 500 мл культуры пересевали в 5-литровый биореактор.
[0845] Глюкозу подавали экспоненциально, пока культура не переходила на стационарную фазу. Далее подачу глюкозы сокращали исходя из метаболических потребностей. Общее количество глюкозы, внесенное в процессе ферментации продолжительностью 50 часов, составило 2,0 кг. Индукцию осуществляли путем добавления ИГПТ. После достижения оптической плотности значения 10 при 550 нм (ОП550). вносили ИПТТ до получения концентрации 25 мкМ. Концентрацию ИПТГ повышали до 50 мкМ, после того как ОП550 достигала значения 190. Изменение профиля ОП550 в биореакторе с течением времени представлено на Фигуре 99. Содержание изопрена в отходящем из биореактора газе измеряли, как описано в настоящей заявке. Титр изопрена увеличивался в ходе прохождения процесса ферментации до конечного значения 1,4 г/л (Фигура 100). Общее количество полученного изопрена при культивировании продолжительностью 50 часа составило 10,0 г.Изменение удельной продуктивности изопрена в ходе процесса ферментации показано на Фигуре 101. Молярная доля потребленного культурой углерода, который был затрачен на продукцию изопрена в ходе ферментации, составила 1,1%. Массовый процентный выход изопрена относительно глюкозы составил 0,5%.
Пример 13: Моделирование и экспериментальное определение воспламеняемости изопрена
I, Краткое описание моделирования и экспериментального определения воспламеняемости изопрена
[0846] Моделирование воспламеняемости и сопутствующие эксперименты проводили для различных углеводород/кислород/азот/вода/диоксид углерода смесей. Данное моделирование и экспериментальные тесты были направлены на построение кривых воспламеняемости изопрена и кислорода/азота при определенных концентрациях пара и монооксида углерода при фиксированных давлении и температуре. Основные данные о модельных условиях представлены в Таблице 9 и основные данные о проведенных экспериментах представлены в Таблице 5.
II. Описание математической модели адиабатической температуры пламени (ММАТП)
[0847] Для определения диапазона воспламеняемости изопрена использовали математическую модель адиабатической температуры пламени (ММАТП) совместно с выбранным пределом температуры горения при распространении возгорания. Для расчетов температуры пламени использовали компьютерную программу NASA Glenn Research Center CEA (Chemical Equilibrium with Applications).
[0848] Определение диапазона воспламеняемости с использованием модели адиабатической температуры пламени при гомогенном механизме возгорания (горючее и окислитель оба в газообразном состоянии) включало пять этапов: выбор интересующих реагентов, выбор условий моделирования, выбор предельной температуры горения, модификацию реагентов и построение диапазона воспламеняемости по полученным расчетам.
[0849] На первом шаге, при выборе интересующих реагентов, следует принять решение какие формы реагентов и в каком количестве будут присутствовать в системе. Во многих случаях расчетные компьютерные программы уже содержат список реагентов и их форм. Если какая-либо информация о интересующем веществе отсутствует в программе, ее можно найти в других источниках, например в таблицах JANAF (Joint Army Navy Air Force) или в Интернете. В испытываемое модели данные для воды, азота, кислорода и диоксида углерода присутствовали в программной базе данных. В программной базе данных не было данных об изопрене как о соединении, поэтому его термодинамических свойствах вводили вручную.
[0850] На следующем этапе следует решить при каких начальных давлении и температуре будет проходить процесс горения. В настоящей модели давление составляло 1 атмосферу (абсолютное) и температура составляла 40°С (точка кипения изопрена).
[0851] Предел температуры горения пламени также можно выбрать исходя из теоретических принципов или определить экспериментально. В каждом случае имеются собственные ограничения.
[0852] На основании предыдущих исследований, для углеводородов предел температуры горения находятся в интервале от 1000 К до 1500 К. Для настоящей модели выбрали значение 1500 К. При данной температуре реакция перехода монооксида углерода в диоксид углерода (экзотермическая реакция, которая составляет значительную долю энергии горения) становится самоподдерживающейся.
[0853] После определения предела температуры горения, проводили расчет модели для заданной смеси реагентов (концентрации соединений) и определяли адиабатическую температуру пламени. Предполагается, что распространение пламени может происходить только если температура больше, чем предел температуры горения. Состав композиций реагентов модифицировали с целью создать подгруппы распространяющихся и не распространяющихся смесей.
[0854] Данный вариант модели находится в хорошем соответствии с экспериментально определенными пределами воспламеняемости. Регионы за пределами рассчитанной зоны пламени являются невоспламеняющимися, а регионы внутри являются воспламеняющимися. Форма диапазона являлась в виде выступа.
Выступ диапазона зависит от лимитирующей концентрации кислорода (ЛКК) в газообразном горючем.
III. Результаты расчетов Согласно математической модели адиабатической температуры пламени (ММАТП)
[0855] Диаграммы, представленные на Фигурах 68 - 74, представляют собой результаты ММАТП для Серий А - G, соответственно. На данных диаграммах представлены расчеты адиабатической температуры пламени (используя программу NASA CEA program), как функции концентрации горючего (по массе) для нескольких соотношений кислород/азот (по массе). Части кривых, находящихся выше отметки 1500 К, выбранный предел температуры горения, представляют уровни горючего, достаточные для распространения пламени. Данные результаты могут быть сложны для интерпретации в той форме, в которой они представлены на Фигурах 68 -74. Кроме того, представленная форма не удобна для сравнения расчетных данных с экспериментальными данными, которые обычно выражают в объемных процентах.
[0856] На примере Серии А, представленной на Фигуре 68, данные могут быть представлены в виде традиционного диапазона воспламеняемости. На Фигуре 68, если провести линию от оси ординат в значении 1500 К, можно определить концентрацию горючего для каждого значения предела температуры горения, для этого следует определить значение на оси абсцисс для каждой точки пересечения с кривой (соотношение кислорода и азота). Значения можно привести в табличной форме, как массовый процент горючего в смеси для конкретного массового процента окислителя (Фигура 75А). Таким образом, зная состав горючего (100 массовый % изопрена) и состав окислителя (относительное содержание воды, кислорода и азота), можно определить молярные величины.
[0857] Исходя из молярных величин, можно рассчитать объемные концентрации. Концентрации, выраженные в объемных процентах, можно использовать для построения диапазона воспламеняемости (Фигура 75 В). Площадь, ограниченная диапазоном относится к взрывоопасной зоне, и площадь, выходящая за пределы диапазона, относится к не взрывоопасной зоне. "Выступ" диапазона является лимитирующей концентрацией кислорода. На Фигурах 76А и 76В представлены вычисленные объемные концентрации и построенный диапазон воспламеняемости для Серии В, составленные на основе данных, представленных на Фигуре 69. Аналогичный подход можно применить для данных, представленных на Фигурах 70-74.
IV Оборудование и методики для экспериментального определения воспламеняемости
[0858] Определение воспламеняемости проводили с помощью баллона высокого давления объемом 4 литра. Баллон имел цилиндрическую форму, внутренний диаметр составлял 6 дюймов, внутренняя высота составляла 8,625 дюймов. Температуру баллона (и газа внутри баллона) поддерживали при помощи внешнего нагревателя с ПИД (пропорционально-интегрально-дифференциальной) регуляцией. Для предотвращения потери тепла баллон оборачивали изоляционным материалом на основе керамики, шерсти и отражающего материала. Для измерения температуры газовой прослойки, так же как и самого баллона, использовали термопары типа К. На Фигуре 77 изображен баллон для испытаний.
[0859] Перед началом эксперимента, из баллона откачивали газ и прокачивали через него азот для удаления остатков газа из предыдущих экспериментов. Затем в баллоне создавали вакуум. После этого типовое давление внутри баллона как правило составляло 0,06 бар. Так как предварительно через баллон прогоняли азот, подразумевали, что начальное давление создается азотом. Для достижения соответствующих экспериментальных условий воду, изопрен, азот и кислород закачивали в соответствующих количествах в баллон, исходя из парциальных давлений, до. Баллон был снабжен воздуходувкой с магнитным приводом, которую использовали для перемешивания газовой смеси. Газовую фазу перемешивали в течение 2 минут, и примерно за 1 минуту до поджигания вентилятор выключали.
[0860] Зажигатель состоял из Ni/Cr- катушки с сопротивлением 1,5 Ом, соединенный с источником переменного тока с системой синхронизации. С помощью осциллоскопа, определили, что в зажигателе создавалось напряжение переменного тока в 34,4 В на 3,2 секунды. Максимальная сила тока в 3,8 А возникала приблизительно посреди цикла поджига. Таким образом, максимальная мощность составила 131 Вт и полная энергия, полученная в цикле поджига составила 210 Дж.
[0861] Данные о сгорании собирали при помощи магнитоэлектрического измерительного преобразователя давления Validyne DP215, соединенного с системой для сбора данных. Было предположено, что газовая смесь сгорала мгновенно, если давление возрастало более чем или примерно на 5%.
V. Результаты исследования воспламеняемости
[0862] Первую серию экспериментов (Серия 1) проводили при 40°С и давлении О фунтов на квадратный дюйм, в отсутствии пара. Кривые воспламеняемости, полученные в исследовании при различных концентрациях изопрена и кислорода. представлены на Фигуре 78А. На диаграмме показаны только точки, которые ограничивают кривую. Подробные данные о всех точках, полученных в данной серии, представлены на Фигурах 80А и SOB.
[0863] На Фигуре 78 В представлены данные о точках воспламеняемости, представленных на Фигуре 78А. На Фигуре 78С представлено сравнение экспериментальных данных с данными, полученными с помощью CAFT модели, в которой определяли огибающую воспламеняемости. Модель хорошо согласуется с экспериментальными данными. Расхождения могут быть связаны с неадиабатическими условиями внутри камеры для испытаний и ограничениями модели. Указанная модель подразумевает бесконечный временной промежуток для реакции окисления и не рассматривает кинетические ограничения реакций.
[0864] Кроме того, модель ограничена в том, количеством химических веществ, для которых в программной базе данных приведены данные для равновесного состояния, в результате чего может не в полной степени отражать пиролитические состояния. Также, огибающая воспламеняемости разработана для модели, в которой используют одно значение предела температуры горения (1500 К). Предел температуры горения может быть выбран из интервала 1000-1500 К, в зависимости от химических веществ, участвующих в реакции. Сложная природа пиролитических химических форм соединений, образующихся при данных концентрациях горючего, и стехиометрическое отношение горючего/окислителя - еще одна причина того, почему модель может недостоверно точно предсказывать верхний предел воспламеняемости в данной системе.
[0865] Вторую серию экспериментов (Серия 2) проводили при 40°С и давлении О фунтов на квадратный дюйм, при концентрации пара 4%. Кривые воспламеняемости, полученные в экспериментах при различных концентрациях изопрена и кислорода, представлены на Фигуре 79А. На диаграмме показаны только точки, которые ограничивают кривую. Подробные данные о всех точках, полученных в данной серии, представлены на Фигуре 81. В виду того, что эта серия экспериментов во многом схожа с серией 1, проводили испытание только ключевых точек, по которым определяли нижний предел воспламеняемости, лимитирующую концентрацию кислорода и верхний предел воспламеняемости. Добавление 4% пара к исследуемой смеси на оказала значительного влияния на основные параметры огибающей воспламеняемости. Следует заметить, что более высокие концентрации пара/воды и других инертных компонентов могут влиять на огибающую воспламеняемости.
[0866] На Фигуре 79В представлены данные о точках воспламеняемости, представленных на Фигуре 79А. На Фигуре 79С представлено сравнение экспериментальных данных с данными, полученными с помощью CAFT модели, в которой определяли огибающую воспламеняемости. Модель очень хорошо согласуется с экспериментальными данными. Расхождения могут быть связаны с теми же факторами, которые были указаны для Серии 1.
VI. Расчет пределов воспламеняемости изопрена в воздухе при давлении в 3 атмосферы
[0867] Методы, описанные в Примере 13, части I-IV, также использовали для расчета пределов воспламеняемости изопрена в системе при абсолютном давлении 3 атмосферы при 40°С.Полученные результаты сравнивали с результатами, полученными в Примере 13, части I-IV, при давлении 1 атмосфера при 40°С.Испытание проводили при более высоком давлении так как огибающая воспламеняемости расширяется при увеличении давления в системе. Главным образом изменяется верхний предел воспламеняемости, а также лимитирующая доля кислорода. Нижний предел воспламеняемости изменяется в наименьшей степени (см, для примера, "Bulletin 627 - Flammability Characteristics of Combustible Gases and Vapors" written by Michael G. Zabetakis and published by the former US Bureau of Mines (1965), которая включена в настоящую заявку во всей своей полноте посредством ссылки, в частности в части, касающейся пределов воспламеняемости).
[0868] На Фигуре 82 приведена рассчитанная адиабатическая температура пламени как функция от концентрации изопрена (горючего), выраженная в массовых процентах от общего количества горючего/азота/кислорода, при начальном давлении в системе 3 атмосферы. Вычисленная температура пламени была схожа с температурой. определенной ранее для 1 атмосферы (Фигура 83). Также, при построении огибающей воспламеняемости на основании рассчитанных адиабатических температур, кривые были схожи в значительной степени (см. Фигуры 84 и 85). Таким образом, исходя из теоретических расчетов можно заключить, что увеличение давления в системе с 1 до 3 атмосфер не приводит к значительному увеличению/расширению огибающей воспламеняемости. При желании данные, полученные на данной модели могут быть проверены с использованием экспериментальных проверочных систем (таких как испытания, описанные в настоящей заявке, для давления 1 атмосфера).
VII. Заключение к изучению воспламеняемости
[0869] Численную модель расчета адиабатической температуры разработали для построения кривой воспламеняемости смеси изопрен/кислород/азот/вода/диоксид углерода в системе при 40°С и давлении 0 фунтов на квадратный дюйм. Разработанная модель CAFT хорошо согласуется с экспериментальными данными полученными в настоящем исследовании. Результаты экспериментов Серии 1 и Серии 2 подтверждает смоделированные в Серии А и Серии В результаты.
Пример 14: Конструкции и штаммы для экспрессии
I. Конструирование плазмиды, кодирующей мевалонаткиназу.
[0870] Конструкцию, кодирующую компоненты нижнего MVA-пути Methanosarcina maw (Номера доступа NC_003901.1. NC_003901.1, NC_003901.1 и NC.003901.1, каждый из которых включен в настоящую заявку во всей своей полноте посредством ссылки) синтезировали путем кодон-оптимизации для экспрессии Е. coli. Данная конструкция, которую обозначали как оперон М. maw archeal Lower Pathway (Фигуры 112A-112C; SEQ ID NO: 27), содержала кодирующие последовательности ферментов:
МВК М. maw, предполагаемой декарбоксилазы, ИПК (изопентилфосфат киназа) и ИДИ (изопентилдифосфат изомераза). Ген, кодирующий МВК (Номер доступа NC_003901.1) амплифицировали методом ПЦР с использованием праймеров МСМ165 и МСМ177 (Таблица 11) и набора Strategene Herculase II Fusion kit в соответствии с протоколом, рекомендуемым производителем 30 циклов, включающих отжиг при температуре 55°С и временной период 60 секунд. Ампликон очищали с использованием колонки Qiagen PCR column и разрезали рестриктазой Pmel (37°С.объем реакционной смеси 10 мкл, в присутствии буфера NEB 4 и БСА). Спустя один час добавили Nsil и буфер Roche H и выдерживали еще один час при 37°С. Разрезанную ДНК очищали с помощью колонки Qiagen PCR column и лигировали с плазмидой МСМ29 (МСМ29 представляет собой плазмиду, выделенную из клеток Е. coli TOP10 (Invitrogen), трансформированных pTrcKudzu, которая кодирует изопренсинтазу кудзу), которую разрезали, очищали схожим образом. Лигазная смесь объемом 11 мкл,5 мкл лигазного буфера Roche Quick Ligase buffer 1, 1 мкл буфера 2, 1 мкл плазмиды, 3 мкл ампликона и 1 uL лигазы (1 час при комнатной температуре). МСМ 29 представляет собой pTrcKudzuKan. Лигазную смесь вводили в клетки ТОР10 (Invitrogen), селекцию трансформантов проводили на LA/ канамицин50 чашке с инкубацией при 37°С в течение одной ночи. Вставленную МВК из полученной плазмиды МСМ382 секвенировали (Фигуры 113А-113С; SEQ ID NO: 28).
II. Создание штаммов с повышенной экспрессией мевалонаткиназы и изопренсинтазы.
[0871] Плазмидой МСМ382 трансформировали клетки МСМ331 (которые содержали хромосомную конструкцию gil.2KKDyI, кодирующую мевалонаткиназу, мевалонатфосфаткиназу, мевалонат пирофосфатдекарбоксилазу и ИДФ-изомеразу из S. cerevisiae), растили в LB-среде, снимали в лог-фазе и три раза промывали охлажденной стерильной водой. Один мкл ДНК добавляли к 50 мкл клеточной суспензии и полученную смесь электропорировали в кювете с размером щели 2 мм, воздействуя 2,5 В, 25 мкФ, затем клетки незамедлительно восстанавливали в 500 мкл LB в течение 1 часа при 37 "С.Селекцию трансформантов проводили на LA/ кан50, и обозначали их МСМ391. Плазмиду МСМ82 вводили в этот штамм, используя тот же самым протокол электропорации, и затем проводили селекцию на 1А/кан50 / спек50. Полученный штамм МСМ401 содержал хромосомную конструкцию gil.2KKDyI, маркированную устойчивостью к хлорамфениколу, плазмиду МСМ382, маркированную устойчивостью к канамицину, и плазмиду МСМ82, маркированную устойчивостью к спектиномицину (которая представляет собой конструкцию pCL PtrcUpperPathway, кодирующую mvaE и mvaS E.faecalis). См. Таблицу 12.
Таблица 12. Штаммы с повышенной экспрессией мевалонаткиназы и изопренсинтазы.
III. Конструирование плазмиды МСМ376, содержащей МВК М. maw из оперона archeal Lower в pET200D.
[0872] Открытая рамка считывания (ОРС) МВК из оперона М. mazei archeal Lower Pathway (Фигуры 112А-112С; SEQ ID NO: 27) амплифицировали методом ПЦР с использованием праймеров МСМ161 и МСМ162 (Таблица 11) и смеси для ПЦР Invitrogen Platinum HiFi PCR mix. В смесь для ПЦР объемом 45 мкл добавляли 1 мкл матрицы, по 1 мкл каждого праймера в концентрации 10 мкМ и 2 мкл воды. Реакция циклически повторялась следующим образом: 94°С в течение 2:00; 30 циклов: 94°С в течение 0:30, 55°С в течение 0:30 и 68°С в течение 1:15; и 72°С в течение 7:00 и 4°С до охлаждения смеси. 3 мкл реакционной смеси дотировали с плазмидой pET200D (Invitrogen), в соответствии с инструкциями производителя. 3 мкл лигазной смеси вводили в клетки Invitrogen TOP10 cells, селекцию трансформантов проводили на LA/KaH50. Из одного трансформанта выделяли плазмиду и проводили секвенирование вставки, полученную плазмиду обозначали МСМ376 (Фигуры 114А-114С; SEQ ID NO: 29).
IV Создание штамма для экспрессии МСМ378. [0873] Плазмидой МСМ376 трансформировали клетки BL21(DE3) pLys cells в соответствии с инструкциями производителя. Селекцию трансформантов МСМ378 проводили на LA/KaH50.
Пример 15: Получение изопрена с помощью Е. coli. экспрессирующей компоненты верхнего МVА-пути, содержащей интегрированные компоненты нижнего МVА-пути
(gi1.2KKDyI). мевалонаткиназу М. mazei и изопренсинтазу кудзу. при культивировании с подпиткой в объеме 20 мл.
Приготовление среды (на литр среды для ферментации):
[0874] Каждый литр среды для ферментации содержит: К2НPO4 13,6 г, КН2РО4 13,6 г, MgSO4*7H2O 2 г, моногидрат лимонной кислоты 2 г, железа аммония цитрат 0,3 г, (NH4)2SO4 3,2 г, дрожжевой экстракт 1 г, 1000Х Раствор Микроэлементов 1 мл. Все эти компоненты вносили совместно и растворяли в деионизированной воде. рН раствора доводили до значения 6,8 при помощи гидроксида аммония (30%) и доводили до нужного объема. Среду стерилизовали путем пропускания через фильтр с размером пор 0,22 микрон. После стерилизации и доведения рН в раствор вносили глюкозу (2,5 г) и антибиотики.
1000Х Раствор Микроэлементов:
[0875] 1000Х Раствор Микроэлементов содержал: лимонная кислота * Н2O 40 г, MnSO4 * Н2O 30 г. NaCl 10 г, FeSO4 * 7Н2O 1 г, CoCl2 * 6Н2О 1 г, ZnSO * 7Н2O 1 г, CuSO4 * 5Н2О 100 мг, Н3ВО3 100 мг. NaMoO4 * 2H2O 100 мг. Каждый компонент растворяли по очереди в деионизированной воде, рН доводили до 3,0 при помощи HCl/NaOH, затем доводили до нужного объема и стерилизовали путем пропускания через фильтр с размером пор 0,22 мкм. Штаммы:
[0876] Клетки МСМ343 представляют собой клетки Е. coli BL21 (DE3), содержащие компоненты верхнего MVA-пути (pCL Upper), интегрированные в хромосому компоненты нижнего MVA-пути (gil.2KKDyI) и изопренсинтазу кудзу (pTrcKudzu).
[0877] Клетки МСМ401 представляют собой клетки Е. coli BL21 (DE3), содержащие компоненты верхнего MVA-пути (pCL PtrcUpperPathway), интегрированные в хромосому компоненты нижнего MVA-пути (gil.2KKDyI) и мевалонаткиназу М. maw и изопренсинтазу кудзу (pTrcKudzuMVK(M.mazei)), которые характеризуются повышенной экспрессией.
[0878] Продукцию изопрена оценивали при выращивании указанных штаммов в объеме 20 мл, в 100-мл биореакторе, при рабочей температуре 30°С. Для приготовления инокулята штамм Е.coli брали из замороженной виалы, рассевали штрихом на чашке с LB-агаром (с антибиотиком) и инкубировали при 30°С.
Одиночную колонию пересевали в питательную среду и растили в течение одной ночи. Бактериальную колонию разводили питательной средой до 20 мл и получали суспензию с оптической плотностью 0,05, измеренную при длине волны 550 нм. 100-мл биореактор герметично закрывали и начинали подачу воздуха со скоростью 8 мл/мин. Адекватное перемешивание среды создавали при помощи перемешивания со скоростью 600 об/мин, используя магнитные мешалки. Отходящий из биореактора газ анализировали с использованием масс-спектрометра Hiden HPR-20, работающего в режиме реального времени. Проводили мониторинг масс-спектрометрических данных, соответствующих изопрену, СО2 и другим газам, присутствующим в воздухе. Накопление изопрена и выход СО2 рассчитывали как сумму концентраций (в процентах) соответствующих газов за определенное время. С целью определить количество СО2, образовавшегося в результате метаболической активности, из общей суммы вычитали содержание атмосферного СО2.
[0879] В 100-мл биореакторе продукция изопрена штаммом, экспрессирующим все компоненты полного MVA-пути и изопренсинтазу кудзу (МСМ343), была соизмерима со штаммом, который обладал повышенной экспрессией МВК М. maw и изопренсинтазы кудзу(МСМ401). Бактерии выращивали в идентичных условиях в среде определенного состава с глюкозой в качестве источника углерода. Индукцию продукции изопрена осуществляли путем добавления изопропил-бета-D-l-тиогалактопиранозида (ИПТГ) до концентрации 100 мкМ или 200 мкМ. Измерение отходящего газа показали, что штамм с повышенной экспрессией МВК и изопренсинтазы (МСМ401) продуцировал значительно больше изопрена по сравнению со штаммом, экспрессирующим только компоненты MVA-пути и изопренсинтазу кудзу (МСМ343), что показано на Фигурах 115A-115D. При индукции 100 мкМ, штамм МСМ401 продуцировал в два раза больше изопрена, по сравнению со штаммом МСМ343. При индукции ИПТГ 200 мкМ, штамм МСМ401 продуцировал в три-четыре раза больше изопрена, по сравнению со штаммом МСМ343. Анализ СО2 в отходящем из биореактора газа, что является показателем метаболической активности, указывает на то, что метаболическая активность не зависит от индукции ИПТГ и продукции изопрена.
Пример 16: Получение изопрена с помощью Е. coli, экспрессирующей компоненты верхнего МVА-пути, содержащей интегрированные компоненты нижнего МVА-пути (gil.2KKDvI). мевалонаткиназу М. maw и изопренсинтазу кудзу, при культивировании с подпиткой в объеме 15 литров
Приготовление среды (на литр среды для ферментации):
[0880] Каждый литр среды для ферментации содержал: K2HPO4 7,5 г, MgSO 4*7H2O2 г, моногидрат лимонной кислоты 2 г, железа аммония цитрат 0,3 г, дрожжевой экстракт 0,5 г, 1000Х Модифицированный Раствор Микроэлементов 1 мл. Все эти компоненты вносили совместно и растворяли в деионизированной воде. Данный раствор автоклавировали. рН раствора доводили до значения 7,0 при помощи гидроксида аммония (30%) и при необходимости доводили до нужного объема. После стерилизации и подведения рН в раствор вносили 10 г глюкозы, 0,1 г тиамина* НСL и антибиотики.
1000Х Модифицированный Раствор Микроэлементов:
[0881] 1000Х Модифицированный Раствор Микроэлементов содержал: лимонная кислота * Н2O 40 г, MnSO4 * W 30 г, NaCl 10 г. FeSO4 * 7H2O 1 г, CoCl2 * 6Н2O 1 г, ZnSO4 * 7Н2O 1 г, CuSO4 * 5Н2O 100 мг.Н3ВО3 100 мг, NaMoO4 * 2W 100 мг. Каждый компонент растворяли по очереди в деионизированной воде, рН доводили до 3,0 при помощи HCl/NaOH, затем при необходимости доводили до нужного объема и стерилизовали путем пропускания через фильтр с размером пор 0,22 мкм.
[0882] Ферментацию проводили в 15-литровом биореакторе с использованием клеток Е. coli BL21 (DE3), которые содержали компоненты верхнего MVA-пути (pCL PtrcUpperPathway, которая кодирует гены mvaE и mvaS Е. faecalls}, интегрированные в хромосому компоненты нижнего MVA-пути (gil.2KKDyI, которая кодирует мевалонаткиназу, мевалонатфосфаткиназу, мевалонатпирофосфатдекарбоксилазу и ИДФ-изомеразу из S. cerevisiae) и, с повышенной экспрессией, мевалонаткиназу М. maw и изопренсинтазу кудзу (pTrcKudzuMVK(M.mazei)). Данный эксперимент проводили для мониторинга образования изопрена из глюкозы при предпочтительных условиях ферментации: рН 7,0 и температуре 30°С.Для приготовления инокулята штамм Е. coli брали из замороженной виалы, рассевали штрихом на чашке с LB-агаром (с антибиотиком) и инкубировали при 37°С.Одиночную колонию пересевали в питательную среду на основе триптона и дрожжевого экстракта. После того как ОП инокулята достигала значения 1,0 при 550 нм, 500 мл пересевали в 15-литровый биореактор, содержащий 5 литров среды.
[0883] Глюкозу подавали экспоненциально, пока культура не переходила на стационарную фазу. Далее подачу глюкозы сокращали исходя из метаболических потребностей. Общее количество глюкозы, внесенное в процессе ферментации продолжительностью 68 часов, составило 3,8 кг. Индукцию осуществляли путем добавления изопропил-бета-0-1-тиогалактопиранозида (ИПТТ). После достижения культурой оптической плотности 9 при 550 нм (ОП550), вносили ИПТТ до получения концентрации 51 мкМ. Концентрацию ИПТГ повышали до 88 мкМ, после того как ОП550 достигала значения 149. Дополнительно концентрацию ИПТГ повышали до 119 мкМ при ОП550=195 и до 152 мкМ при ОП550=210. Изменение профиля ОП550 в биореакторе с течением времени представлено на Фигуре 116. Содержание изопрена в отходящем из биореактора газе измеряли с помощью масс-спектрометра Hiden. Титр изопрена увеличивался в ходе прохождения процесса ферментации до конечного значения 23,8 мг/л (Фигура 117). Общее количество полученного изопрена при культивировании продолжительностью 68 часов составило 227,2 г.продукция в зависимости от времени представлена на Фигуре 118. Изменение профиля метаболической активности культуры, оцененное как TCER, представлено на Фигуре 119. Общее количество жизнеспособных микроорганизмов (общее число колониеобразующих единиц) уменьшалось на два порядка за период времени между 10 и 39 часами ферментации (Фигура 120). Молярная доля потребленного культурой углерода, который был затрачен на продукцию изопрена в ходе ферментации, составила 13,0%, Массовый процентный выход изопрена относительно глюкозы составил 6,3%.
Пример 17: Получение изопрена с помощью Е. coli, экспрессирующей компоненты верхнего МVА-пути, содержащей интегрированные компоненты нижнего МVА-пути (gil.2KKDvI). мевалонаткиназу М. mazei и изопренсинтазу кудзу, при культивировании с подпиткой в объеме 15 л (при двукратной индукции ИПТТ 100 мкМ).
Приготовление среды (на литр среды для ферментации):
[0884] Каждый литр среды для ферментации содержал: К2НPO4 7,5 г, MgSO 4*7H2O 2 г, моногидрат лимонной кислоты 2 г, железа аммония цитрат 0,3 г, дрожжевой экстракт 0,5 г, 1000х Модифицированный Раствор Микроэлементов 1 мл. Все эти компоненты вносили и растворяли совместно в деионизированной воде. Данный раствор автоклавировали. рН раствора доводили до значения 7,0 при помощи гидроксида аммония (30%) и при необходимости доводили до нужного объема. После стерилизации и доведения рН в раствор вносили 10 г глюкозы, 0,1 г тиамина* НСL и антибиотики.
1000Х Модифицированный Раствор Микроэлементов:
[0885] 1000Х Модифицированный Раствор Микроэлементов содержал: лимонная кислота * Н2O 40 г. MnSO4 * W 30 г, NaCl 10 г. FeSO4 * 7Н2О 1 г, CoCl2 * 6Н2О 1 г, ZnSO4 * 7H2O 1 г, CuSO4 * 5Н2O 100 мг.Н3ВО3 100 мг. NaMoO4 * 2Н2O 100 мг. Каждый компонент растворяли по очереди в деионизированной воде, рН доводили до 3,0 при помощи HCl/NaOH, затем при необходимости доводили до нужного объема и стерилизовали путем пропускания через фильтр с размером пор 0,22 мкм.
[0886] Ферментацию проводили в 15-литровом биореакторе с использованием клеток Е. coli BL21 (DE3),; которые содержат: компоненты верхнего MVA-пути (pCL PtrcUpperPathway, которая кодирует гены mvaE и mvaS Е. faecalis), интегрированные в хромосому компоненты нижнего MVA-пути (gil.2KK.DyI, которая кодирует мевалонаткиназу, мевалонатфосфаткиназу, мевалонат пирофосфат декарбоксилазу и ИДФ-изомеразу из S. cerevisiae) и, с повышенной экспрессией, мевалонаткиназу М. mazei и изопренсинтазу кудзу (pTrcKudzuMVK(M.mazei)). Данный эксперимент проводили для мониторинга образование изопрена из глюкозы при предпочтительных условиях ферментации: рН 7,0 и температуре 30°С.Для приготовления инокулята штамм Е. coli брали из замороженного стока, рассевали штрихом на чашках с LB-агаром (с антибиотиком) и инкубировали при 37°С.Одиночную колонию пересевали в питательную среду на основе триптона и дрожжевого экстракта. После того как ОП инокулята достигала значения 1,0 при 550 нм, 500 мл культуры пересевали в 15-литровый биореактор, содержащий 5 литров среды.
[0887] Глюкозу подавали экспоненциально, пока культура не переходила на стационарную фазу. Далее подача глюкозы сокращали исходя из метаболических потребностей культуры. Общее количество глюкозы, внесенное в биореактор в процессе ферментации продолжительностью 55 часов, составило 1,9 кг. Индукцию осуществляли путем добавления изопропил-бета-0-1-тиогалактопиранозида (ИПТГ). После достижения культурой оптической плотности 9 при 550 нм (ОП550), вносили ИПТГ до получения концентрации 111 мкМ. Концентрацию ИПТГ повышали до 193 мкМ, после того как ОП550 достигала значения 155. Изменение профиля ОП550 культуры в биореакторе с течением времени представлено на Фигуре 121. Содержание изопрена в отходящем из биореактора газе измеряли с помощью масс-спектрометра Hiden. Титр изоперена увеличивался в ходе процесса культивирования до конечного значения 19,5 г/л (Фигура 122). Общее количество полученного изопрена при культивировании продолжительностью 55 часов составило 133,8 г, продукция в зависимости от времени представлена на Фигуре 123. Удельный, объемный уровень продуктивности достигал значения 1,5 г изопрена/литр среды/час (Фигура 124). Удельный уровень выхода достигал значения 17,7% (масс./масс.) (Фигура 125). Изменение профиля метаболической активности культуры, оцененное как TCER, представлено на Фигуре 126. Общее количество жизнеспособных микроорганизмов (общее число колониеобразующих единиц) уменьшалось на два порядка за период времени между 8 и 36 часами ферментации (Фигура 127). Молярная доля потребленного культурой углерода, который был затрачен на продукцию изопрена в ходе ферментации, составила 15,8%. Массовый процентный выход изопрена относительно глюкозы за весь период культивирования составил 7,4%.
[0888] Дополнительно, в качестве контроля, в 15-литровом биореакторе проводили ферментацию с использованием клеток Е. coli BL21 (DE3), которые содержат:
компоненты верхнего MVA-пути (pCL PtrcUpperPathway, которая кодирует гены mvaE и mvaS Е. faecalis), интегрированные компоненты нижнего MVA-пути (gil.2KKDyI, которая кодирует мевалонаткиназу, мевалонатфосфаткиназу, мевалонат пирофосфат декарбоксилазу и ИДФ-изомеразу из S. cerevisiae) и, с повышенной экспрессией, мевалонаткиназу М. maw и изопренсинтазу Kyn3y(pTrcKudzuMVK(M.mazei)). Данный эксперимент проводили для мониторинга метаболической активности в неиндуцированных клетках, что оценивали как CER, при использовании глюкозы в предпочтительных условиях ферментации: рН 7,0 и при температуре 30°С.Для приготовления инокулята штамм Е. coli (описанный выше МСМ401) брали из замороженного стока, рассевали штрихом на чашке с LB-агаром (с антибиотиком) и инкубировали при 37°С.Одиночную колонию пересевали в питательную среду на основе триптона и дрожжевого экстракта. После того как ОП инокулята достигала значения 1,0 при 550 нм, 500 мл культуры пересевали в 15-литровый биореактор, содержащий 5 литров среды. Глюкозу подавали экспоненциально, пока культура не переходила на стационарную фазу. Далее подачу глюкозы сокращали исходя из метаболических потребностей культуры.
[0889] На Фигуре 148 представлено сравнение CER-профилей неиндуцированных клеток, описанных выше, и клеток, индуцированных действием изопропил-бета-D-l-тиогалактопиранозидом (ИПТГ) из Примеров 16 и 17.
Пример 18: Получение изопрена с помощью Е. coli, экспрессирующей компоненты верхнего МVА-пути, содержащей интегрированные компоненты нижнего МVА-пути (gil.2KKDyI). мевалонаткиназу М. mazei и изопренсинтазу кудзу, при культивировании с подпиткой в объеме 15 л (при однократной индукции ИПТГ 50 мкМ и индукции ИПТТ в питательном растворе 150 мкМ).
Приготовление среды (на литр среды для культивирования):
[0890] Каждый литр среды для культивирования содержал: К2НPO4 7,5 г, MgSO 4*7Н2O 2 г, моногидрат лимонной кислоты 2 г, железа аммония цитрат 0,3 г, дрожжевой экстракт 0,5 г, 1000Х Модифицированный Раствор Микроэлементов 1 мл. Все эти компоненты совместно вносили и растворяли в деионизированной воде. Полученный раствор автоклавировали. рН раствора доводили до значения 7,0 при помощи гидроксида аммония (30%) и при необходимости доводили до нужного объема. После стерилизации и доведения рН в раствор вносили 10 г глюкозы, 0.1 г тиамина* НСL и антибиотики.
1000Х Модифицированный Раствор Микроэлементов:
[0891] 1000Х Модифицированный Раствор Микроэлементов содержал; лимонную кислоту * Н2O 40 г, MnSO4 * W 30 г, NaCl 10 г, FeSO4 * 7Н2O 1 г, CoCl2 * 6Н2O 1 г, ZnSO4 * 7H2O 1 г, CuSO4 * 5Н2O 100 мг, Н3ВО3 100 мг, NaMoO4 * 2Н2O 100 мг. Каждый компонент растворяли по очереди в деионизированной воде, рН доводили до 3,0 при помощи HCl/NaOH, затем при необходимости доводили до нужного объема и стерилизовали путем пропускания через фильтр с размером пор 0,22 мкм.
[0892] Ферментацию проводили в 15-литровом биореакторе с использованием клеток Е. coli BL21 (DE3), которые содержат: компоненты верхнего MVA-пути (pCL PtrcUpperPathway, которая кодирует гены mvaE и mvaS Е. faecalis), интегрированные компоненты нижнего MVA-пути (gil.2KKDyI, которая кодирует мевалонаткиназу, мевалонатфосфаткиназу, мевалонат пирофосфат декарбоксилазу и ИДФ-изомеразу из S. cerevisiae) и, с повышенной экспрессией, мевалонаткиназу М. mazei и изопренсинтазу Kyn3y(pTrcKudzuMVK(M.mazei)). Данный эксперимент проводили для мониторинга образования изопрена из глюкозы при предпочтительных условиях ферментации: рН 7,0 и температуре 30°С.Для приготовления инокулята штамм Е. coli брали из замороженного стока, рассевали штрихом на чашке с LB-агаром (с антибиотиком) и инкубировали при 37°С. Одиночную колонию пересевали в питательную среду на основе триптона и дрожжевого экстракта. После того как ОП инокулята достигала значения 1,0 при 550 нм, 500 мл культуры пересевали в 15-литровый биореактор, содержащий 5 литров среды.
[0893] Глюкоза подавалась экспоненциально, пока культура не переходила на стационарную фазу. Далее подачу глюкозы сокращали исходя из метаболических потребностей культуры. Общее количество глюкозы, внесенное в процессе ферментации продолжительностью 55 часов, составило 3,7 кг. Индукцию осуществляли путем добавления изопропил-бета-0-1-тиогалактопиранозида (ИПТГ). После достижения культурой оптической плотности 10 при 550 нм (ОП550), вносили ИПТГ до получения концентрации 51 мкМ. Дополнительно к воздействию ИПТГ при достижении культурой ОП550=10, после 164 мг ИПТГ вводили с постоянной скоростью на протяжении 18 часов. Изменение профиля ОП550 культуры в биореакторе с течением времени представлено на Фигуре 128. Содержание изопрена в отходящем из биореактора газе измеряли с помощью масс-спектрометра Hiden. Титр изоперена увеличивался в ходе процесса культивирования до конечного значения 22,0 г/л (Фигура 129). Общее количество полученного изопрена при культивировании продолжительностью 55 часа составило 170,5 г, продукция в зависимости от времени представлена на Фигуре 130. Изменение профиля метаболической активности культуры, оцененное как TCER. представлено на Фигуре 131. При уменьшении подачи воздуха в биореактор с 8 ст.литров/мин до 4 ст.литров/мин на 1,7 часа, концентрация изопрена в отходящем газе увеличилась с 0,51 до 0,92 мас./мас.% (Фигура 132). Данное увеличение в содержании изопрена не имело никакого негативного влияния на активность клеточного метаболизма, Согласно измерению общего выхода диоксида углерода, TCER уменьшилось только на 7% в период между 37,2 и 39,3 часами (Фигура 132). Общее количество жизнеспособных микроорганизмов (общее число колониеобразующих единиц) уменьшалось на два порядка за период времени между 7 и 36 часами ферментации (Фигура 133). Молярная доля потребленного культурой углерода, который был затрачен на продукцию изопрена в ходе ферментации, составила 16,6%. Массовый процентный выход изопрена относительно глюкозы за весь период культивирования составил 7,7%.
Пример 19: Влияние поступающего извне изопрена на рост Е. coli дикого типа при культивировании с подпиткой в объеме 1 литр.
Приготовление среды (на литр среды для культивирования):
[0894] Каждый литр среды для культивирования содержал: К2НPO4 7,5 г. MgSO 4*7Н2O 2 г, моногидрат лимонной кислоты 2 г, железа аммония цитрат 0,3 г, дрожжевой экстракт 0,5 г.1000х Модифицированный Раствор Микроэлементов 1 мл. Все эти компоненты совместно вносили и растворяли в деионизированной воде. Полученный раствор автоклавировали. рН раствора доводили до значения 7,0 при помощи гидроксида аммония (30%) и при необходимости доводили до нужного объема. После стерилизации и доведения рН в раствор вносили 10 г глюкозы, 0,1 г тиамина* НСL и антибиотики.
1000Х Модифицированный Раствор Микроэлементов:
[0895] 1000Х Модифицированный Раствор Микроэлементов содержал: лимонную кислоту * Н2О 40 г, MnSO4 * Н2O 30 г, NaCl 10 г. FeSO4 * 7Н2O 1 г, CoCh * 6Н2O 1 г, ZnSO4 * 7Н2O 1 г, CuSO4 * 5Н2O 100 мг, Н3ВО3 100 мг, NaMoO4 * 2Н2O 100 мг. Каждый компонент растворяли по очереди в деионизированной воде, рН доводили до 3,0 при помощи HCl/NaOH, затем при необходимости доводили до нужного объема и стерилизовали путем пропускания через фильтр с размером пор 0,22 мкм.
[0896] Ферментацию проводили в 1-литровом биореакторе с использованием клеток Е. coli, BL21 (DE3). Данный эксперимент проводили для мониторинга влияния изопрена на жизнеспособность клеток и их метаболическую активность в биореакторе для культивирования с подпиткой, с использованием глюкозы, при предпочтительных условиях ферментации: рН 7,0 и температуре 30°С. Инокулят штамм Е. coli из замороженного стока засевали в среду на основе триптона и дрожжевого экстракта. После того как ОП инокулята достигала значения 1,0 при 550 нм, 50 мл культуры пересевали в 1-литровый биореактор, содержащий 0,5 литра среды.
[0897] Глюкоза подавалась экспоненциально, пока культура не переходила на стационарную фазу. Далее подачу глюкозы сокращали исходя из метаболических потребностей культуры. Изопрен подавали в биореактор в смеси с азотом в качестве газа-носителя. Изопрен начинали подавать со скоростью 1 г/л/ч в середине фазы экспоненциального роста (ОП550=31-34) и подавали в общей сложности в течение 75 минут (13,2-14,4 ч) Изменение профиля ОH550 культуры в биореакторе с течением времени представлено на Фигуре 134. Изменение профиля метаболической активности культуры, оцененное как TCER, представлено на Фигуре 135. Общее количество жизнеспособных микроорганизмов (общее число колониеобразующих единиц) увеличивалось в 14 в период подачи изопрена в биореактор (Фигура 136).
Пример 20: Получение изопрена и экспрессия изопренсинтазы в Saccharomvces cerevisiae
[0898] Ген фермента изопренсинтазы кудзу, оптимизированный для экспрессии Согласно таблице используемых кодонов для гибрида Saccharomyces cerevisiae/Pichia pastoris, синтезировали и клонировали в вектор pDONR221:19430 (DNA 2.0, карта вектора на Фигуре 140, последовательность на Фигуре 141 (SEQ ID NO: 38)). Проводили реакцию Gateway® Cloning (Invitrogen), в соответствии с протоколом, рекомендуемым производителем. В виду того, что вектор pDONR221:19430 представлял собой "входной" вектор, для вставки оптимизированного для экспрессии в системе кодонов гена изопренсинтазы в целевой вектор pYES-DEST52 (Invitrogen) использовали фермент LR Clonase II (LR-реакция).
[0899] Затем продуктом LR-реакции трансформировали химически компетентные клетки Тор10 (Invitrogen), в соответствии с протоколом, рекомендуемым производителем, и проводили селекцию бактерий, несущих плазмиду pYES-DEST52, содержащую ОРС изопренсинтазы кудзу, на LA-агаре, содержащем карбенициллин 50 мкг/мл. Отдельных положительных трансформантов проверяли на наличие вставки методом "ПЦР с колонии" (концентрации праймеров и программа термоциклера приведены ниже) с использованием illustra PuReTaq Ready-To-Go™ PCR Beads (GE Healthcare) и прямого праймера Т7 и обратного праймера изопренсинтазы дрожжей Rev2 (См. Таблицу 13).
Таблица 13. Последовательности праймеров для амплификации изопренсинтазы.
[0900] Плазмиды, которые содержали ПЦР-фрагменты корректного размера (1354 т.п.о.) очищали методом лизиса щелочью (Qiagen) и отправляли для проведения секвенирования (компания Quintara Biosciences, Berkeley, Канада) с использованием праймеров T7 Forward и Yeast HGS -For2 (см. Таблицу 13). Результаты секвенирования сравнивали с известной последовательностью вектора pDONR221:19430 (использовали программный пакет Vector NTI, Invitrogen), для дальнейших исследований выбрали одну плазмиду, обозначаемую как pDW14 (карта плазмиды на Фигуре 142А, полная последовательность на Фигурах 142 В и С (SEQ ID NO: 39)). Последовательность из плазмиды pDW14 отличалась от pDONR221:19430 одним нуклеотидом (на Фигуре 142Б данный нуклеотид выделен полужирным шрифтом). Одиночная нуклеотидная замена (G на А) не приводит к изменению ОРС, так как она приходится на третий нуклеотид кодона, кодирующего лизин.
[0901] Штамм Saccharomyces cerevisiae INVSc-1 трансформировали очищенной плазмидой pDW14, с использованием протокола, прилагающегося к набору S. с.EasyComp Transformation kit (Invitrogen). Селекцию и поддержание штаммов INVSc-1, несущих pDW14 или pYES-DEST52 (данный вектор содержит работоспособный ген URA3), проводили на Минимальной Питательной Среде SC с содержанием глюкозы 2%, не содержащей урацил, как описано в руководстве к вектору pYES-DEST52 Gateway Vector (Invitrogen). Для дальнейшего анализа отобрали два независимых изолята INVSc-1, содержащих pDW14, и один контрольный изолят, содержащий pYES-DEST52.
[0902] Для индуцирования экспрессии изопренсинтазы культуры выращивали в течение ночи в жидкой Минимальной Питательной Среде SC. Культуры разводили приблизительно до значения ОП600 0,2 и растили еще 2-3 часа. Культуры осаждали путем центрифугирования, однократно промывали, ресуспендировали в эквивалентном объеме (10 мл) Минимальной Питательной Среды SC, содержащей 1% раффинозы, 2% галактозы, не содержащей урацила, и выращивали в течение ночи для индуцирования экспрессии изопренсинтазы. Определяли ОП600 культур (Фигура 144А), культуры выделяли путем центрифугирования и ресуспендировали в буфере для лизиса (смесь 1:1 50% глицерина и РЕВ-буфера (буфер для экстракции белков): Трис основной 2,423 г/л, MgCl2 (безводный) 1,904 г/л, КС114,910 г/л, ДТТ 0,154 г/л, глицерин 50 мл/л).
[0903] Лизат пропускали через аппарат для разрушения клеток "френч пресс" три раза после чего анализировали методом ДСН-ПААГ. Для анализа с помощью красителя Кумасси (Фигура 143А), образцы растворяли в соотношении 1:1 в 2Х ДСН-буфере с восстановителем, вносили в 4-12% bis-tris гель (20 мкл), разгоняли в буфере на основе МЭС (морфолиноэтансульфоновая кислота) и окрашивали с помощью SimplyBlue SafeStain в соответствии с протоколом, рекомендуемым производителем (Invitrogen No vex system).
[0904] Для переноса и выявления белка изопренсинтазы на нитроцеллюлозой мембране использовали набор WestemBreeze kit (Invitrogen). В качестве первичных антител использовали 1799А, разведенные в соотношении 1:1000 в растворителе для антител (Invitrogen). Для количественной оценки, после связывания первичных антител проводили обработку вторичными антителами, мечеными Alexa Fluor 488 (Invitrogen Catalog No. A-11008). Вестерн-блот анализ проводили Согласно протоколу Invitrogen. Флуоресцентный сигнал обнаруживали и регистрировали с использованием системы Dynamics Storm, настроенной для работы в режиме синего фильтра, и анализировали с помощью программного пакета Molecular Dynamics ImageQuant. Удельную активность членов библиотеки рассчитывали как отношение количества произведенного изопрена к значению ОП600 (А600) индуцированных культур, либо к концентрации белка изопренсинтазы, определенной методом Вестерн-блоттинга. На Фигуре 143 В показано, что изопренсинтаза присутствует в штаммах INVSc-1, несущих pDW14 (дорожки 2 и 3) в отличии от контрольного штамма, несущего pYES-DEST52 (дорожка 1).
[0905] Проводили анализ активности изопренсинтазы с использованием ДМАПФ и измерением изопрена в паровой фазе, использовали по 25 мкл лизата каждого штамма и добавляли к нему: 5 мкл 1 М MgCl2, 5 мкл 100 мМ ДМАПФ и 65 мкл 50 мМ Трис рН 8. Реакцию проводили при 30°С в течение 15 минут в герметичной пробирке для ГХ объемом 1,8 мл. Реакции останавливали путем добавления 100 мкл 250 мМ ЭДТА рН 8. На Фигуре 144 В представлена удельная активность (выраженная в мкг газа/л/ОП) в индуцированных штаммах, несущих pDW14 в сравнении с контрольным штаммом. Индуцированные штаммы, несущие pDW14 демонстрировали приблизительно в 20 раз более высокую активность по сравнению с контрольным штаммом, не содержащим изопренсинтазы.
Параметры ПЦР
[0906] Использовали готовую смесь Illustra PuReTaq Ready-To-Go™ PCR Beads (GE Healthcare) и пары олигонуклеотидных праймеров с концентрацией 0,4 мкМ, общий объем реакционной смеси 25 мкл. Для анализа плазмид, образовавшихся при проведении реакции с LR Clonase (Invitrogen), небольшое количество бактерий из одиночных колоний с селективной среды переносили в пробирки, содержащие описанные выше смеси для ПЦР. Использовали следующий протокол реакции: 1) 95°С в течение 4 минут; 2) 95°С в течение 20 секунд; 3) 52°С в течение 20 секунд; 4) 72°С в течение 30 секунд; 5 циклов шаги 2-4; 5) 95°С в течение 20 секунд; 6) 55°С в течение 20 секунд; 7) 72°С в течение 30 секунд; 25 циклов шаги 5-7, 72°С в течение 10 минут, и 4°С до охлаждения.
Пример 21: Получение изопрена с помощью Pseudomonas и других грамотрицательных бактерий. Конструирование плазмиды pBBR5HGSOpt2 2. конъюгация в Pseudomonas и измерение активности изопренсинтазы.
[0907] Ген, кодирующий изопренсинтазу Pueraria lobata (кудзу), оптимизированный для экспрессии в системе кодонов различных видов (Таблица 14, выбранная последовательность fluo-opt2v2) был получен DNA2.0, Menio Park, Канада. Карта последовательности fluo-opt2v2 представлена на Фигурах 145А и 145 В (SEQ ID NO: 40). Для облегчения клонирования к синтезированной последовательности добавили сайты рестрикции для HindIII и BamHI, и для усиления транскрипции перед кодоном ATG поместили ССР.
[0908] Количество редких кодонов для каждого варианта изопренсинтазы Pueraria lobata, оптимизированной для экспрессии в системе кодонов, являлось характеристикой последовательности для каждого вида микроорганизмов. Через серию оптимизаций получили последовательность гена, который не содержал редких кодонов для всех видов, представляющих интерес
Таблица 14. Число редких кодонов.
[0909] Данный ген был получен у DNA2.0 в составе вектора клонирования. Вектор разрезали рестриктазами HindIII и BamHI, полоску, соответствующую интересующему фрагменту, выделяли из геля и объединяли с обработанным рестриктазами HindIII и BamHI вектором pBBR1MCS5 (Kovach et al. Gene 166:175-176, 1995, данная публикация включена в настоящую заявку полностью посредством ссылки, и в частности разделы, касающиеся pBBR1MCS5), карта представлена на Фигуре 146А и последовательность представлена на Фигурах 146 В и 146С (SEQ ID NO: 41). Полученная плазмида pBBR5HGSOpt2_2 (карта представлена на Фигуре 147А и последовательность представлена на Фигурах 147 В и 147С (SEQ ID NO: 42)) содержала изопренсинтазу, экспрессия которой находилась под контролем промотора lac, присутствующего в pBBR1MCS5.
[0910] Данным вектором трансформировали штамм Е. coli S17-1 и скрещивали с Pseudomonas putida Fl ATCC700007 и Pseudomonas fluorescens ATCC 13525. После конъюгации в LB-среде, проводили селекцию штаммов Pseudomonas, несущих интересующую плазмиду, на среде М9, содержащей 16 мМ цитрата натрия и 50 мкг/мл гентамицина. Наличие плазмиды у полученных таким образом штаммов проверяли путем выделения плазмид с использованием набора Qiagen kit (Valencia, Канада).
[0911] Активность изопренсинтазы рекомбинантных штаммов Р. putida, pBBR5HGSOpt2_2 и Р. fluorescens, pBBR5HGSOpt2_2 измеряли следующим образом: штаммы выравнивали в питательной среде ТМЗ (как описано в Примере 1, Часть II), содержащей 10 г/л глюкозы, биомассу собирали в период лаг-фазы, клетки разрушали с помощью аппарата "френч пресс", активность измеряли методом ДМАПФ-анализа. Результаты представлены в Таблице 15. Наличие активности при использовании ДМАПФ-анализа свидетельствует о том, что изопренсинтаза экспрессируетcя в Pseudomonas.
[0912] Активность изопренсинтазы определяли в штаммах Pseudomonas putida и Pseudomonas fluorescens, экспрессирующих изопренсинтазу под контролем промотора lac, в составе плазмиды pBBR5HGSOpt2_2.
Пример 22: Сравнительный рост штаммов Е. coli и Pseudomonas и экспрессия изопренсинтазы на тростниковом сахаре и глюкозе
I. Приготовление сиропа из тростникового сахара
[0913] Кристаллический тростниковый сахар-сырец растворяли в воде следующим образом: К 750 г воды добавляли 250 г сахара. Раствор перемешивали и аккуратно нагревали до максимального растворения. Некоторая часть не растворялась. После растворения массу раствора доводили до 1 кг для восполнения испарившейся воды. Объем раствора при измерении составил 940 мл. Таким образом концентрация раствора составляла 265 г/л. Согласно информации на этикетке, на 15 г тростникового сахара-сырца приходится 14 г углеводов. Таким образом, концентрация углеводов в растворе составляла 248 г/л. Согласно измерению, содержание твердого вещества составляло 24,03%, что было близко к ожидаемому 250 г/кг, рН раствора составляло 5,49. Концентрацию глюкозы измеряли с использованием ферментативного метода спектрометрии, с использованием глюкозооксидазы. Концентрация глюкозы составила 17,4 г/л.
[0914] Так как большинство микроорганизмов не используют сахарозу, но могут употреблять глюкозу и фруктозу, раствор разделяли на две части. Одну часть автоклавировали в течение 30 минут (необработанный тростниковый сахар). Происходила частичная инверсия и содержание глюкозы увеличивалось до 29,75 г/л (см. Фигуру 149). рН другой части раствора доводили до значения 4,0 с использованием фосфорной кислоты, затем раствор инвертировали путем автоклавировали (инвертированный тростниковый сахар). Три цикла продолжительностью 30 минут полностью осуществляли инверсию, что показано на Фигуре 149. Оба раствора использовали для построения кривых роста, описанных ниже.
II. Кривые роста различных штаммов Е. coli и Pseudomonas на тростниковом сахаре и глюкозе
[0915] Одну колонию каждого штамма, перечисленных в Таблице 16, пересевали в 25 мл питательной среды ТМЗ, содержащей 10 г/л глюкозы, и выращивали в течение ночи при 30°С с перемешиванием 200 об/мин. Состав ТМЗ приведены в Примере 7 Раздел II. На следующее утро, по 1 мл каждой культуры пересевали во флаконы, содержащие 25 мл питательной среды ТМЗ и 10 г/л глюкозы, 10 г/л необработанного тростникового сахара или 10 г/л инвертированного тростникового сахара (растворы тростникового сахара описаны выше). Флаконы инкубировали при 30°С с перемешиванием 200 об./мин и регулярно проводили отбор проб. На Фигурах 150 и 151 показано, что скорость роста и продукция биомассы были сопоставимы при выращивании на глюкозе и инвертированном тростниковом сахаре, как для штаммов Pseudomonas, так и штаммов Е. coli. P. fluorescens продемонстрировала некоторые признаки способности потреблять неинвертированный тростниковый сахар.
III. Сравнительное получение изопрена с использованием Е. coli, экспрессирующим изопренсинтазу, на глюкозе или тростниковом сахаре
[0916] Штамм Е. coli MCM401 (BL21(DE3)), содержащий все компоненты MVA-пути, мевалонаткиназу М. maw и изопренсинтазу Pueraria lobata, описанную в Примере 14, Раздел П, выращивали в питательной среде ТМЗ, содержащей либо 10 г/л глюкозы, либо 10 г/л инвертированного тростникового сахара (в зависимости от концентрации углеводов в сиропе). Культуру, характеризующуюся ОП600=0,2, выращенную в течение ночи в питательной среде ТМЗ, содержащей 10 г/л глюкозы, переносили во флаконы. При необходимости добавляли антибиотики. Через два часа культуры Е. coli индуцировали 400 мкМ ИПТГ. Через 6 часов роста измеряли продукцию изопрена и активность изопренсинтазы с использованием ДМАПФ, как описано в Примере 2 В. Результаты представлены в Таблице 17 и ясно демонстрируют, что инвертированный тростниковый сахар эквивалентен глюкозе относительно продукции изопрена и изопренсинтазы, приведенный относительно количества клеток.
Пример 23: Конструирование штаммов Е. coli экспрессирующих оперон gil.2K.KDvI S. cerevisiae. изопренсинтазу Р. alba. мевалонаткиназу М. mazei, pCL Upper MVA (гены mvaE и mvaS Е. faecalis) и vbhE (pel).
(i) Конструирование штамма EWL201 (BL21, Cm-GI1.2.KKDyI)
[0917] Клетки Е. coli BL21 (Novagen brand, EMD Biosciences, Inc.) использовали в качестве реципиентов и трансдуцировали их лизатом клеток МСМ331 Р1 (лизат готовили Согласно способу описанному в Ausubel, et al.. Current Protocols in Molecular Biology. John Wiley and Sons, Inc.). Клетки МСМ331 содержат хромосомную конструкцию gil.2KKDyI кодирующую мевалонаткиназу, мевалонатфосфаткиназу, мевалонатпирофосфат декарбоксилазу и ИДФ-изомеразу S. cerevisiae (то есть. оперон gil.2-KKDyI S. cerevisiae). Селекцию трансдуктантов проводили путем посева клеток на LA-агаре содержащем 20 мкг/мл хлорамфеникола. Чашки инкубировали при 30°С в течение ночи. При анализе трансдуктантов никаких колоний не было обнаружено на контрольных чашках (контрольная чашка вода+клетки для обнаружения реверсии и контрольная чашка вода и лизат Р1 для обнаружения загрязнений лизата).
[0918] Выбирали четырех трансдуктантов и пересеивали их в 5 мл LB-среды, содержащей 10 мкг/мл хлорамфеникола. Культуры выращивали при 30°С в течение ночи, с перемешиванием 200 об./мин. Для выделения геномной ДНК трансдуктантов для проведения ПЦР-анализа, 1,5 мл ночной культуры центрифугировали. Клеточный осадок ресуспендировали в 400 мкл Буфере для ресуспендирования клеток (20 мМ Трис, 1 мМ ЭДТА, 50 мМ NaCI, pH 7,5) и добавляли 4 мкл чистой, не содержащей ДНК-азу, РНК-азу (Roche). Пробирки инкубировали при 37°С в течение 30 минут, затем добавляли 4 мкл 10% ДСН и 10 мг/мл маточного раствора Протеиназы К (Sigma-Aldrich). Пробирки инкубировали при 37°С в течение 1 часа. Клеточный лизат переносили в пробирки Phase Lock Light Gel объемом 2 мл (Eppendorf) и добавляли по 200 мкл насыщенного фенола pH 7,9 (Ambion Inc.) и хлороформа. Пробирки тщательно перемешивали и центрифугировали в течение 5 минут. Второй этап экстракции проводили путем добавления 400 мкл хлороформа после чего водную фазу переносили в новую пробирку эппендорф. Для осаждения геномной ДНК к раствору добавляли 1 мл 100% этанола и центрифугировали в течение 5 минут. Осадок геномной ДНК промывали 1 мл 70% этанола. Этанол удаляли и осадок геномной ДНК высушивали на воздухе. Осадок геномной ДНК ресуспендировали в 200 мкл ТЕ-буфера.
[0919] В соответствии с протоколом, рекомендуемым производителем, приготовили 2 серии реакционных смесей для ПЦР с использованием полимеразы Pfu Ultra П DNA (Stratagene) и 200 нг/мкл геномной ДНК в качестве матрицы. В первой серии использовали праймеры МСМ130 и GB Cm-Rev (Таблица 18) для подтверждения, что трансдуктанты успешно получили вставку в локус attTn7. Для первой серии использовали следующие параметры ПЦР: 95°С в течение 1 минуты (только перед первым циклом), 95°С в течение 25 секунд, 55°С в течение 25 секунд, 72°С в течение 25 секунд (повторение шагов 2-4 28 раз), 72°С в течение 2 минут. Во второй серии использовали праймеры MVD For и MVD Rev (Таблица 18) для подтверждения, что оперон gil-2-KKDyI был интегрирован соответствующим образом. Для первой серии использовали следующие параметры ПЦР: 95°С в течение 2 минут (только перед первым циклом), 95°С в течение 25 секунд, 55°С в течение 25 секунд, 72°С в течение 10 секунд (повторение шагов 2-4 28 раз), 72°С в течение 2 минут. Анализ ПЦР-ампликонов, проведенный в 1,2% E-gel (Invitrogen Corp.) показал, что все четыре трансдуктанта содержали корректные вставки. Один из трансдуктантов сохранили и обозначали в дальнейшем как EWL201.
(ii) Конструирование штамма EWL204 (BL21. loopout-GIl.2-KKDyI)
[0920] Маркер устойчивости к хлорамфениколу выводили из строя в штамме EWL201 с использованием плазмиды рСР20, как описано у Datsenko and Wanner (2000) (Datsenko et al„ Proc Natl. Acad. Sci USA 97:6640-6645. 2000). One-step inactivation of chromosomal genes in Escherichia coil K-12 using PCR products. (Datsenko et al., PNAS, 97: 6640-6645, 2000). Клетки EWL201 выращивали в LB-среде, снимали в лог-фазе и три раза промывали холодной стерильной водой. Аликвоту клеточной суспензии объемом 50 мкл смешивали с 1 мкл рСР20 и затем смесь электропорировали в кювете с размером щели 2 мм (Invitrogen Corp.), воздействуя 2,5 В и 25 мкФ с использованием Gene Pulser Electroporator (Bio-Rad Inc.). Затем к клеткам незамедлительно добавляли 1 мл питательной среды LB, и переносили суспензию в полипропиленовую пробирку объемом 14 мл (Sarstedt) с металлической крышкой. Клетки восстанавливались в течение 1 часа при 30°С.Селекцию трансформантов проводили на LA-агаре, содержащем 20 мкг/мл хлорамфеникола и 50 мкг/мл карбенициллина и инкубировали при 30°С в течение одной ночи. На следующий день одиночную колонию пересевали и выращивали в 10 мл LB-среды, содержащей 50 мкг/мл карбенициллина, при 30°С, пок культура не переходила в лог-фазу. Затем температуру культуры поднимали до 42°С на 2 часа. Сделали несколько разведении культуры и клетки рассевали на LA-агаре (без антибиотика) и инкубировали в течение ночи при 30°С.На следующий день отбирали 20 колоний и пересеивали их на LA-агар (без антибиотика) и на LA-агар. содержащий 20 мкг/мл хлорамфеникола. Чашки инкубировали при 30°С в течение ночи. Клетки, выросшие на LA-агаре, но не на LA-агаре, содержащем 20 мкг/мл хлорамфеникола, рассматривали как клетки с выведенным из строя маркером устойчивости к хлорамфениколу (одну колонию отобрали и обозначали в дальнейших исследованиях как EWL204).
(iii) Конструирование плазмиды pEWL230 (pTrc P. alba)
[0921] Синтетический ген, кодирующий изопренсинтазу Populus alba (P. alba HGS), приобрели у DNA2.0 Inc. (Menio Park, Канада), данная последовательность была оптимизирована методикой компании для экспрессии в системе кодонов Е. coli. Данный синтетический ген по заказу клиента был клонирован в плазмиду рЕТ24а (Novagen brand, EMD Biosciences, Inc.) и его доставили в лиофилизированном виде (Фигуры 152. 153А-Б; SEQ ID NO: 43).
[0922] Для амплификации изопренсинтазы Р. alba (P. alba HGS) проводили ПЦР с использованием рЕТ24 Р. alba HGS в качестве матрицы, праймеров МСМ182 и МСМ192 и полимеразы Herculase II Fusion DNA (Stratagene) в соответствии с протоколом, рекомендуемым производителем. Для проведения ПЦР применяли следующие условия: 95°С в течение 2 минут (первый цикл), 95°С в течение 25 секунд, 55°С в течение 20 секунд, 72°С в течение 1 минуты (25 циклов), и затем финальное удлинение цепи при 72°С в течение 3 минут. ПЦР-продукт изопренсинтазы Р. alba очищали с использованием набора QIAquick PCR Purification Kit (Qiagen Inc.).
[0923] ПЦР-продукт изопренсинтазы Р. alba разрезали в реакционной смеси объемом 20 мкл, содержащей 1 мкл эндонуклеазы BspW (New England Biolabs) и 2 мкл 10Х буфера NEB 4. Реакция проходила в течение 2 часов при температуре 37°С.Затем разрезанный ПЦР-фрагмент очищали с использованием набора QIAquick PCR Purification Kit. Второй этап рестрикции проводили в реакционной смеси объемом 20 мкл, содержащей 1 мкл эндонуклеазы Psti (Roche) и 2 мкл 10Х буфера Н. Реакция проходила в течение 2 часов при температуре 37С.Затем разрезанный ПЦР-фрагмент очищали с использованием набора QIAquick PCR Purification Kit. Плазмиду pTrcHis2B (Invitrogen Corp.) разрезали в реакционной смеси объемом 20 мкл, содержащей 1 мкл эндонуклеазы Ncol (Roche) и 2 мкл 10Х буфера Н. Реакция проходила в течение 2 часов при температуре 37°С. Разрезанный вектор pTrcHis2B очищали путем разделения в 1,2% геле E-gel (Invitrogen Corp.) и выделяли с использованием набора QIAquick Gel Extraction Kit (Qiagen) (Фигура 154). На основании совместимых липких концов сайтов рестрикции BspHI и Ncol, готовили 20 мкл реакционной лигазной смеси, состоящей из 5 мкл изопренсинтазы Р. alba, 2 мкл вектора рТгс, 1 мкл лигазы Т4 DNA (New England Biolabs), 2 мкл 10Х лигазного буфера и 10 мкл бидистиллированной воды. Реакция проходила в течение 40 минут при комнатной температуре. Лигазную смесь обессоливали, для этого фильтр из нитроцеллюлозной мембраны с размером пор 0,025 мкм (Millipore) погружали в бидистиллированную воду в чашке Петри и аккуратно наносили лигазную смесь на фильтр из нитроцеллюлозной мембраны, оставляли на 30 минут при комнатной температуре. Клетки МСМ446 (см. Раздел II) выращивали в LB-среде, снимали в лог-фазе и три раза промывали холодной стерильной водой. Аликвоту клеточной суспензии объемом 50 мкл смешивали с 5 мкл обессоленной лигазной смеси рТrс P.alba HGS. Смесь электропорировали в кювете с размером щели 2 мм (Invitrogen Corp.), воздействуя 2,5 В и 25 мкФ с использованием Gene Pulser Electroporator Затем к клеткам незамедлительно добавляли 1 мл питательной среды LB, и переносили суспензию в полипропиленовую пробирку объемом 14 мл (Sarstedt) с металлической крышкой. Клетки восстанавливались в течение 2 часов при 30°С.Селекцию трансформантов проводили на LA-агаре, содержащем 50 мкг/мл карбенициллина и 10 мМ мевалоновой кислоты с инкубацией при 30°С.На следующий день отобрали 6 трансформантов и выращивали их в LB-среде, содержащей 50 мкг/мл карбенициллина, в пробирках в объеме 5 мл в течение ночи при температуре 30°С. Выделение плазмид проводили из ночной культуры с использованием набора QIAquick Spin Miniprep Kit (Qiagen). Так как для размножения плазмид использовали клетки BL21, для достижения высокого качества очистки плазмидной ДНК в стандартном протоколе, рекомендуемом производителям, произвели модификацию, касающуюся промывки промывочных колонок, 5Х фосфатным буфером и ЗХ буфером для экстракции белков. Плазмиды разрезали рестриктазой Psti в объеме 20 мкл для подтверждения того, что линейные фрагменты были корректного размера. Все 6 плазмид были корректного размера и для секвенирования с использованием праймеров МСМ65, МСМ66, EL1000 (Таблица 18) их отправили в компанию Quintara Biosciences (Berkeley, Канада). Результаты секвенирования ДНК показали, что все 6 плазмид были корректными. Одну из плазмид сохраняли и обозначали как EWL230 (Фигуры 155, 156А-Б; SEQ ID NO: 44).
(iv) Конструирование плазмиды pEWL244 (pTrc P. alba-mMVK)
[0924] Для амплификации гена МВК Methanosarcina maw (M. maw) проводили ПЦР с использованием МСМ376 в качестве матрицы (см. Раздел V, ниже), праймеры МСМ165 и МСМ177 (см. Таблицу 18) и полимеразу Pfu Ultra II Fusion DNA (Stratagene) в соответствии с протоколом, рекомендуемым производителем. Для проведения ПЦР применяли следующие условия: 95°С в течение 2 минут (первый цикл), 95°С в течение 25 секунд, 55°С в течение 25 секунд, 72°С в течение 18 секунд (28 циклов), и затем финальное удлинение цепи при 72°С в течение 1 минуты, ПЦР-продукт МВК M. maw очищали с использованием набора QIAquick PCR Purification Kit (Qiagen Inc.).
[0925] ПЦР-продукт МВК M. mazei разрезали в реакционной смеси объемом 40 мкл, содержащей 8 мкл ПЦР-продукта, 2 мкл эндонуклеазы Pmel (New England Biolabs), 4 мкл 10Х буфера NEB 4, 4 мкл 10Х NEB БСА и 22 мкл бидистиллированной воды.
Реакция проходила в течение 3 часов при температуре 37°С.Затем разрезанный ПЦР-фрагмент очищали с использованием набора QIAquick PCR Purification Kit. Второй этап рестрикции проводили в реакционной смеси объемом 47 мкл, содержащей 2 мкл эндонуклеазы Nsil (Roche) и 4,7 мкл 10Х буфера Н и 40 мкл разрезанного рестриктазой Pmel фрагмента МВК М. maw. Реакция проходила в течение 3 часов при температуре 37°С.Затем разрезанный ПЦР-фрагмент очищали путем разделения в 1,2% E-gel и вырезали из геля с использованием Ha6opaQIAquick Gel Extraction Kit. Плазмиду EWL230 разрезали в реакционной смеси объемом 40 мкл, содержащей 10 мкл плазмиды, 2 мкл эндонуклеазы Pmel, 4 мкл 10Х буфера NEB 4, 4 мкл 10Х NEB БСА и 20 мкл бидистиллированной воды. Реакция проходила в течение 3 часов при температуре 37°С.Затем разрезанный ПЦР-фрагмент очищали с использованием набора QIAquick PCR Purification Kit. Второй этап рестрикции проводили в реакционной смеси объемом 47 мкл, содержащей 2 мкл эндонуклеазы PstI и 4,7 мкл 10Х буфера Н и 40 мкл разрезанного рестриктазой Pmel линейного фрагмента вектора EWL230. Реакция проходила в течение 3 часов при температуре 37°С.Затем разрезанный ПЦР-фрагмент очищали путем разделения в 1,2% E-gel и вырезали из геля с использованием Ha6opaQIAquick Gel Extraction Kit (Фигура 157). На основании совместимых липких концов сайтов рестрикции Nsil и PstI, готовили 20 мкл реакционной лигазной смеси, состоящей из 8 мкл вставки МВК М. maw, 3 мкл плазмиды EWL230, 1 мкл лигазы Т4 DNA, 2 мкл 10Х лигазного буфера и 6 мкл бидистиллированной воды. Лигазную смесь инкубировали при 16°С в течение ночи. На следующий день лигазную смесь обессоливали, для этого фильтр из нитроцеллюлозной мембраны с размером пор 0,025 мкм погружали в бидистиллированную воду в чашке Петри и аккуратно наносили лигазную смесь на фильтр из нитроцеллюлозной мембраны, оставляли на 30 минут при комнатной температуре. Клетки МСМ446 выращивали в LB-среде, снимали в лог-фазе и три раза промывали холодной стерильной водой. Аликвоту клеточной суспензии объемом 50 мкл смешивали с 5 мкл обессоленной лигазной смеси pTrc P.alba-mMVK. Смесь электропорировали в кювете с размером щели 2 мм (Invitrogen Corp.), воздействуя 2,5 В и 25 мкФ с использованием Gene Pulser Electroporator Затем к клеткам незамедлительно добавляли 1 мл питательной среды LB, и переносили суспензию в полипропиленовую пробирку объемом 14 мл с металлической крышкой. Клетки восстанавливались в течение 2 часов при 30°С.Селекцию трансформантов проводили на LA-агаре, содержащем 50 мкг/мл карбенициллина и 5 мМ мевалоновой кислоты с инкубацией при 30°С.На следующий день отобрали 6 трансформантов и выращивали их в LB-среде, содержащей 50 мкг/мл карбенициллина, в пробирках в объеме 5 мл в течение ночи при at 30°С. Выделение плазмид проводили из ночной культуры с использованием набора QIAquick Spin Miniprep Kit. Так как для размножения плазмид использовали клетки BL21, для достижения высокого качества очистки плазмидной ДНК в стандартном протоколе, рекомендуемом производителям, произвели модификацию, касающуюся промывки промывочных колонок, 5Х фосфатным буфером и ЗХ буфером для экстракции белков. Плазмиды разрезали рестриктазой PstI в объеме 20 мкл для подтверждения того, что линейные фрагменты были корректного размера. Три из 6 плазмид были корректного размера и для их секвенирования с использованием праймеров МСМ65, МСМ66, EL1000, EL1003 и EL1006 (Таблица 18) их отправили в компанию Quintara Biosciences. Результаты секвенирования ДНК показали, что все 3 плазмид были корректными. Одну из плазмид сохраняли и обозначали как EWL244 (Фигуры 158, 159А-B; SEQ ID NO: 45).
v) Конструирование плазмиды МСМ376, содержащей МВК М. maw из оперона archaeal Lower в векторе pET200D.
[0926] Транслируемую область (ОРС) мевалоновой кислоты (МВК) из оперона М. maw archaeal Lower Pathway (Фигуры 160А-C; SEQ ID NO: 46) амплифицировали методом ПЦР с использованием праймеров МСМ161 и МСМ162 (Таблица 18) и смеси для ПЦР Invitrogen Platinum HiFi PCR mix. В смесь для ПЦР объемом 45 мкл добавляли 1 мкл матрицы, по 1 мкл каждого праймера в концентрации 10 мкМ и 2 мкл воды. Использовали следующий протокол реакции: 94°С в течение 2 минут; 30 циклов: 94°С в течение 30 секунд, 55°С в течение 30 секунд и 68°С в течение 1 минуты 15 секунд; и 72°С в течение 7 минут и 4°С до охлаждения смеси. 3 мкл реакционной смеси лидировали с плазмидой pET200D (Invitrogen), в соответствии с инструкциями производителя. 3 мкл лигазной смеси вводили в клетки ТОР10 (Invitrogen), отбор трансформантов проводили на LA/50 канамицин-агаре. Из одного трансформанта выделяли плазмиду и проводили секвенирование вставки, полученную плазмиду обозначали МСМ376 (Фигуры 161А-C).
vi) Конструирование штамма EWL251 (BL21(DE3), Cm-GI1.2-KKDyI, pTrc P.alba-mMVK)
[0927] Клетки МСМ331 (которые содержали интегрированную в хромосому конструкцию gil.2KKDyI, содержащую мевалонаткиназу, мевалонатфосфаткиназу, мевалонат пирофосфат декарбоксилазу и ИДФ-изомеразу из S. cerevisiae) выращивали в LB-среде, снимали в лог-фазе и три раза промывали холодной стерильной водой. 50 мкл клеточной суспензии смешивали с 1 мкл плазмиды EWL244. Смесь электропорировали в кювете с размером щели 2 мм (Invitrogen Corp.), воздействуя 2,5 В и 25 мкФ с использованием Gene Pulser Electroporator Затем к клеткам незамедлительно добавляли 1 мл питательной среды LB, и переносили суспензию в полипропиленовую пробирку объемом 14 мл с металлической крышкой. Клетки восстанавливались в течение 2 часов при 30°С.Селекцию трансформантов проводили на LA-агаре, содержащем 50 мкг/мл карбенициллина и 5 мМ мевалоновой кислоты с инкубацией при 37°С.Одну колонию сохраняли и обозначали в дальнейшем как EWL251.
vii) Конструирование штамма EWL256 (BL21(DE3), Cm-GI1.2-KKDyI, pTrc P.alba-mMVK, pCL Upper MVA)
[0928] Клетки EWL251 выращивали в LB-среде, снимали в лог-фазе и три раза промывали холодной стерильной водой. 50 мкл клеточной суспензии смешивали с 1 мкл плазмиды МСМ82 (содержащей pCL PtrcUpperPathway (также обозначаемой как "pCL Upper MVA"), в которую включены гены mvaE и mvaS Е, faecalis). Плазмиду pCL Ptrc Upper Pathway конструировали как описано выше в Примере 8. Смесь электропорировали в кювете с размером щели 2 мм (Invitrogen Corp.), воздействуя 2,5 В и 25 мкФ с использованием Gene Pulser Electroporator Затем к клеткам незамедлительно добавляли 1 мл питательной среды LB. Клетки переносили в полипропиленовую пробирку объемом 14 мл с металлической крышкой. Клетки восстанавливались в течение 2 часов при 30°С.Селекцию трансформантов проводили на LA-агаре, содержащем 50 мкг/мл карбенициллина и 50 мкг/мл спектиномицина с инкубацией при 37°С.Одну колонию сохраняли и обозначали в дальнейшем как EWL256.
viii) Конструирование штамма RM111608-2 (Cm-GI1.2-KKDyI, pTrc P.alba-mMVK, pCL Upper MVA, pBBRCMPGI1.5-pgl)
[0929] Сконструировали штамм на основе Е. coli BL21 (EWL256) с конститутивной экспрессией гена ybhE (кодирующего 6-фосфоглюконолактоназу Е. coli) в реплицирующейся плазмиде pBBRlMCS5(reHTaMHmw) (предоставлена доктором К. Петерсоном, Университет Штата Луизиана).
[0930] Кассету с FRT-последовательностями, плазмиду для Red/ET-опосредованной интеграции и вектор для выключения маркера устойчивости к антибиотику приобретали у компании Gene Bridges GmbH (Германия). При использовании данных материалов применяли протоколы, рекомендованные компанией Gene Bridges. Для амплификации кассеты устойчивости на основе матрицы FRT-gb2-Cm-FRT использовали праймеры Pgl-F (SEQ ID NO: 139) и PglGI1.5-R (SEQ ID NO: 140) и набор Stratagene Herculase II Fusion kit в соответствии с протоколом, рекомендуемым производителем. Смесь для ПЦР (общий объем 50 мкл) содержала: 5 мкл буфера. 1 мкл ДНК-матрицы (FRT-gb2-Cm-F от компании Gene Bridges), 10 пмоль каждого праймера и 1,5 мкл 25 мМ смеси дНТФ, дистиллированную воду в объеме, необходимом для доведения реакции до 50 мкл. Использовали следующий протокол реакции: 1×2 минуты 95°С, затем 30 циклов (30 секунд 95°С; 30 секунд 63°С; 3 минуты 72°С).
[0931] Полученный ПЦР-продукт очищали с использованием набора QiaQick PCR purification kit (Qiagen) и электропорировали им клетки MG1655, несущие плазмиду с рекомбиназой pRed-ET. Для этого клетки выращивали при 30°С в 5 мл LB-среды до ОП600∼0,6. В клетках индуцировали экспрессию рекомбиназы путем добавления 4% арабинозы и оставляли их для дальнейшего роста в течение 30 минут при 30°С, а затем 30 минут при 37°С. Аликвоту клеток объемом 1,5 мл промывали 3-4 раза холодной дистиллированной водой. Полученный клеточный осадок ресуспендировали в 40 мкл холодной дистиллированной воды и добавляли 2-5 мкл ПЦР-продукта. Электропорацию проводили в кювете с размером щели 1 мм, воздействую 1,3 В с помощью Gene Pulser Electroporator (Bio-Rad Inc.). Клетки восстанавливались в течение 1-2 часов при 30°С после чего их рассевали на LA-агаре, содержащем хлорамфеникол (5 мкг/мл). Пять трансформантов анализировали методом ПЦР и затем секвенировали с использованием праймеров, фланкирующих интегрируемый участок (2 набора праймеров: pgl и 49 rev и 3' EcoRV-pglstop; Bottom Pgb2 и Top GB's CMP (946)). Один корректный трасформант сохранили и в дальнейшем этот штамм обозначали как MG1655 GI1.5-pgl::CMP.
[0932] Хромосомную ДНК штамма MG1655 GI1.5-pgl::CMP использовали в качестве матрицы для получения ПЦР-фрагмента. содержащего конструкцию FRT-CMP-FRT-GI1.5 - ybhE. Данную конструкцию клонировали в вектор рВВР1МС85(гентамицин), как описано ниже. Даннй фрагмент, обозначаемый в настоящем описании как СМР-GI1.5-pgl, амплифицировали с использованием 5' праймера Pglconfirm-F (SEQ ID NO: 141) и 3' праймера 3' EcoRV-pglstop (SEQ ID NO: 142). Полученный фрагмент клонировали в плазмидный вектор pCR-Blunt II-TOPO с использованием набора Invitrogen TOPO-Blunt cloning kit, в соответствии с рекомендациями производителя. Фрагмент, несущий CMP-GIl-5-pgl, имеющий на концах NsiI-сайт рестрикции, клонировали в вектор pBBR1MCS5 (гентамицин), имеющий на концах РstI-сайт рестрикции. Готовили 20 мкл реакционной лигазной смеси, состоящей из 5 мкл фрагмента для вставки CMP-GI1.5-pgl, 2 мкл вектора pBBR1MCS5 (гентамицин), 1 мкл лигазы Т4 DNA (New England Biolabs), 2 мкл 10Х лигазного буфера и 10 мкл бидистиллированной воды. Лигазную смесь инкубировали при комнатной температуре в течение 40 минут и затем 2-4 мкл смеси использовали для электропорации электрокомпетентных клеток Тор10 cells (Invitrogen) Согласно методике, описанной выше. Селекцию трансформантов проводили на LA-агаре, содержащем 10 мкг/мл хлорамфеникола и 5 мкг/мл гентамицина. Секвенирование выбранных клонов проводили с использованием описанных выше праймеров, а также с использованием внутренних праймеров ТЗ и обратных праймеров, приобретенных у компании Sequetech, Канада. Указанную плазмиду обозначали как pBBRCMPGI1.5-pgl (Фигуры 162, 163А-В и SEQ ID NO: 48).
[0933] Плазмиду pBBRCMPGI1.5-pgl электропорировали в клетки EWL256, описанным в настоящей заявке способом, и трансформантов рассевали на LA-агаре, содержащем хлорамфеникол (10 мкг/мл), гентамицин (5 мкг/мл), спектиномицин (50 мкг/мл) и карбенициллин (50 мкг/мл). Один трансформант сохраняли и обозначали данный штамм в дальнейшем как RM111608-2. Праймеры:
Pgl-F
5'-
ACCGCCAAAAGCGACTAATTTTAGCTGTTACAGTCAGTTGAATTAACCCTCACTA AAGGGCGGCCGC-3' (SEQ ID NO: 139)
PglGI1.5-R
5'-
GCTGGCGATATAAACTGTTTGCTTCATGAATGCTCCTTTGGGTTACCTCCGGGAA
ACGCGGTTGATTTGTTTAGTGGTTGAATTATTTGCTCAGGATGTGGCATAGTCAA
GGGCGTGACGGCTCGCTAATACGACTCACTATAGGGCTCGAG-3' (SEQ ID NO: 140)
3' EcoRV-pglstop:
5'-CTT GAT АТС TTA GTG TGC GTT AAC CAC CAC (SEQ ID NO: 142)
pgl+49 rev: CGTGAATTTGCTGGCTCTCAG (SEQ ID NO: 136) Bottom Pgb2: GGTTTAGTTCCTCACCTTGTC (SEQ ID NO: 135)
Top GB's CMP (946): ACTGAAACGTTTTCATCGCTC (SEQ ID NO: 92)
Pglconfirm-F
5'-ACCGCCAAAAGCGACTAATTTTAGCT-3' (SEQ ID NO: 141)
Пример 24: Улучшение продукции изопрена штаммом Е. coli конститутивно экспрессирующим ген vhhE (pgl)
[0934] В данном примере представлены данные о продукции изопрена штаммом, который конститутивно экспрессирует ген ybhE (pgl) Е. coli, в сравнении с контрольным штаммом, экспрессирующим ген ybhE на уровне дикого типа. Ген ybhE (pgl) кодирует 6-фосфоглюконолактоназу, фермент, который супрессирует посттранскрипционное гликозидирование гетерологичных белков и повышает растворимость и увеличивает выход продукта и в тоже время повышает прирост биомассы и активность пентозо-фосфатного пути (Aon et al.. Applied and Environmental Microbiology, 74(4): 950-958. 2008).
i) Анализ в небольшом объеме
[0935] Приготовление среды (на литр среды для культивирования): К;НPO4 13,6 г, КН2PO4 13,6 г, MgSO4*7H2O 2 г, моногидрат лимонной кислоты 2 г, железа аммония цитрат 0,3 г, (NH4)2SO4 3,2 г, дрожжевой экстракт 5 г, 1000х Раствор Микроэлементов 1 мл. Все эти компоненты совместно вносили и растворяли в деионизированной воде. рН раствора доводили до значения 6,8 при помощи гидроксида аммония (30%) и доводили до нужного объема. Среду стерилизовали путем пропускания через фильтр с размером пор 0,22 микрон. После стерилизации и доведения рН в раствор вносили 5 г глюкозы и антибиотики.
[0936] 1000х Раствор Микроэлементов (на 1 литр): лимонная кислота * Н2О 40 г, MnSO4 * Н2O 30 г, NaCl 10 г, FeSO4 * 7 W 1 г. СоО3 * 6 Н2O 1 г. ZnSO4 * 7 Н2О 1 г, CuSO4 * 5 Н2O 100 мг, Н3ВО3 100 мг. NaMoO4 * 2 Н2O 100 мг. Каждый компонент растворяли по очереди в деионизированной воде. рН доводили до 3,0 при помощи HCl/NaOH, затем раствор доводили до нужного объема и стерилизовали путем пропускания через фильтр с размером пор 0,22 микрон.
(а) Экспериментальные методики
[0937] Для анализа продукции изопрена штаммы выращивали в мини-биореакторе Cellerator™ от компании MicroReactor Technologies, Inc. Рабочий объем каждой из 24 лунок составлял 4,5 мл. Температуру поддерживали на уровне 30°С, начальный уровень рН составлял 7,0, устанавливали начальный поток кислорода 20 см3/мин и скорость перемешивания 800 об./мин. Для приготовления инокулята штамм Е. coli брали из замороженного стока, рассевали штрихом на чашках с LB-агаром (с антибиотиком) и инкубировали при 30°С. Одиночную колонию пересевали в питательную среду с антибиотиком и выращивали в течение ночи. Бактерию разводили питательной средой с антибиотиком до 4,5 мл и получали суспензию с оптической плотностью 0,05, измеренную при длине волны 550 нм.
[0938] Анализ изопрена в отходящем газе проводили с помощью газового хроматографа с масс-спектрометром (ГХ/МС) (Agilent), отбирая пробы из паровой фазы. Образцы подготавливали следующим способом: 100 мкл культуральной жидкости помещали во флакон для ГХ, герметично закрывали и инкубировали при 30°С в течение 30 минут (фиксированное время). Затем культуру инактивировали тепловым воздействием, повышая температуру инкубации до 70°С на 5 минут, и после проводили ГХ-анализ образцов.
[0939] Оптическую плотность (ОП) при длине волны 550 нм измеряли с использованием считывателя для микропланшетов (Spectramax), измерение проводили на протяжении всего анализа. Значение удельной продуктивности получали путем деления концентрации этилена (мкг/л) на значение ОП, которое определяли в той же временной точке (часы).
[0940] Провели оценку продуктивности двух штаммов EWL256 и RM 11608-2, которые индуцировали ИПТГ в концентрации 200 и 400 мкМ. Продукцию изопрена и клеточный рост (ОП550) определяли в образцах на 1, 2,5, 4,75 и 8 час после индукции. Проводили два параллельных измерения.
(б) Результаты
[0941] Данный эксперимент продемонстрировал, что при двух различных концентрациях ИПТГ, штамм, экспрессирутощий ген ybhE (pgl), характеризовался значительным, 2-3 кратным, увеличением удельной продуктивности изопрена, по сравнению с контрольным штаммом.
ii) Ферментативное получение изопрена с помощью Е. coli, экспрессирующей: оперон Cm-GI1.2-KKDyI, мевалонаткиназу М. maw, изопренсинтазу Р. alba и ybhE (pgl) (RM111608-2), при культивировании клеток с подпиткой в объеме 15 литров
[0942] Приготовление среды (на 1 литр среды для культивирования): К2НPO4 7,5 г, MgSO 4*7Н2O 2 г, моногидрат лимонной кислоты 2 г, железа аммония цитрат 0,3 г, дрожжевой экстракт 0,5 г, 1000х Модифицированный Раствор Микроэлементов 1 мл. Все эти компоненты совместно вносили и растворяли в деионизированной воде. Полученный раствор автоклавировали. рН раствора доводили до значения 7,0 при помощи гидроксида аммония (30%) и при необходимости доводили до нужного объема. После стерилизации и доведения рН в раствор вносили 10 г глюкозы, 0,1 г тиамина* НСL и антибиотики.
[0943] 1000Х Модифицированный Раствор Микроэлементов: лимонная кислота * Н2О 40 г, MnSO4 * Н2O 30 г, NaCl 10 г, FeSO4 * 7Н2O 1 г, CoCl2 * 6Н2О 1 г, ZnSO4 * 7H2O 1 г. CuSO4 * 5H2O 100 мг, Н3ВО3 100 мг, NaMoO4 * 2Н2O 100 мг. Каждый компонент растворяли по очереди в деионизированной воде, рН доводили до 3,0 при помощи HCVNaOH, затем при необходимости доводили до нужного объема и стерилизовали путем пропускания через фильтр с размером пор 0,22 мкм.
[0944] Ферментацию проводили в 15-литровом биореакторе с использованием клеток Е. coli BL21 (DE3), содержащих: компоненты верхнего MVA-пути (pCL Upper), интегрированные компоненты нижнего MVA-пути (gil.2KKDyI), мевалонаткиназу М. mazei (повышенная экспрессия) и изопренсинтазу Р. alba (pTrcAlba-mMVK), а также ген pgl Е. coli (pBBR-pgl), характеризующийся повышенной экспрессией. Данный эксперимент проводили для мониторинга образования изопрена из глюкозы при предпочтительных условиях ферментации: рН 7,0 и температуре 34°С.Замороженный сток штамма Е. coli размораживали и засевали в среду на основе триптона и дрожжевого экстракта. После того как ОП инокулята достигала значения 1,0 при 550 нм, 500 мл культуры пересевали в 15-литровый биореактор, с начальным объемом среды 5 литров.
[0945] Глюкоза подавалась экспоненциально, пока культура не переходила на стационарную фазу. Далее подачу глюкозы сокращали исходя из метаболических потребностей культуры. Общее количество глюкозы, внесенное в процессе ферментации продолжительностью 40 часов (59 часов), составило 3,1 кг (4,2 кг при культивировании продолжительностью 59 часов). Индуцирование осуществляли путем добавления ИПТТ. После достижения культурой оптической плотности значения 4 при 550 нм (ОП550), вносили ИГТТГ до получения концентрации 110 мкМ. Концентрацию ИПТГ повышали до 192 мкМ, после того как ОП550 достигала значения 150. Изменение профиля ОП550 культуры в биореакторе с течением времени представлено на Фигуре 164А. Содержание изопрена в отходящем из биореактора газе измеряли с помощью масс-спектрометра Hiden. Титр изоперена увеличивался в ходе прохождения процесса культивирования до конечного значения 33,2 г/л при культивировании продолжительностью 40 часов (48,6 г/л при культивировании продолжительностью 59 часов) (Фигура 164В). Титр изоперена увеличивался в ходе прохождения процесса культивирования до максимального значения 40,0 г/л при культивировании продолжительностью 40 часов (60,5 г/л при культивировании продолжительностью 59 часов) (Фигура 164С). Общее количество полученного изопрена при культивировании продолжительностью 40 часов (59 часов) составило 281,3 г (451,0 г при культивировании продолжительностью 59 часов), продукция в зависимости от времени представлена на Фигуре 164D. Изменение удельной объемной продуктивности изопрена в течении культивирования представлено на Фигуре 164Е, где показано, что средняя скорость 1,0 г/л/ч сохранялась между 0 и 40 часами (1,4 г/л/ч между 19 и 59 часами, при культивировании продолжительностью 59 часов). Изменение профиля метаболической активности культуры, оцененное как CER, представлено на Фигуре 164F. Молярная доля потребленного культурой углерода, который был затрачен на продукцию изопрена в ходе ферментации, составила 19,6% при культивировании продолжительностью 40 часов (23,6% при культивировании продолжительностью 59 часов). Массовый процентный выход изопрена относительно глюкозы составил 8,9% при культивировании продолжительностью 40 часов (10,7% при культивировании продолжительностью 59 часов)..
Пример 25: Совместное получение изопрена и водорода с помощью штаммов Е. coli, экспрессирующих: мевалонаткиназу М. mazei, изопренсинтазу Р. alba, pCL Upper MVA (гены mvaE и mvaS Е. faecalis) и vbhE (pel).
Отбор проб и анализ уровня водорода и изопрена в отходящем в ходе ферментации газе
[0946] Ферментацию проводили с использованием штаммов: RM111608-2 (Е. coli BL21 (DE3), pCL Upper MVA, cmR-gil.2-yKKDyI, pTrcAlba-mMVK, pBBR cmR-gil.5- pgl) и EWL 256 (E. coli BL21 (DE3), pCL Upper MVA, cmR-gi 1,2-yKKDyI, pTrcAlba-mMVK). Конструирование указанных бактериальных штаммов приведено выше, в Примере 23.
[0947] Крупномасштабное получение изопрена с помощью Е. coli проводили при культивировании с подпиткой штаммов Е. coli EWL256 и RM 111608-2, экспрессирующих мевалонаткиназу М. maw, изопренсинтазу Р. alba, pCL Upper MVA (гены mvaE и mvaS Е. faecalis), а также характеризующихся конститутивной повышенной (RM 111 608-2) или нормальной (EWL256) экспрессией гена ybhE (pgl). В результате эксперимента показано, что при выращивании клеток в присутствии глюкозы наблюдалась совместная продукция изопрена и водорода.
[0948] Приготовление ферментационной среды (ТМ2), на 1 литр: К2НРO4 13.6 г, КН2РO4 13,6 г, MgSO4*7H2O 2 г, моногидрат лимонной кислоты 2 г, железа аммония цитрат 0,3 г, (NH4)2SO4 3,2 г, дрожжевой экстракт 5 г, 1000х Модифицированный Раствор Микроэлементов 1 мл.
1000Х Модифицированный Раствор Микроэлементов: лимонная кислота * Н2O 40 г, MnSO4 * H2O 30 г, NaCl 10 г, FeSO4 * 7H2O 1 г, CoCl2 * 6H2O 1 г, ZnSO4 * 7Н2О 1 г, CuSO4 * 5H2O 100 мг, Н3ВО3 100 мг, NaMoO4 * 2H2O 100 мг. При приготовлении 1000Х Модифицированного Раствора Микроэлементов каждый компонент растворяли по очереди в деионизированной воде, рН доводили до 3,0 при помощи HCl/NaOH, затем доводили до нужного объема и стерилизовали путем пропускания через фильтр с размером пор 0,22 мкм (данный раствор не автоклавировали). При приготовлении среды ТМ2 все компоненты совместно вносили и растворяли в деионизированной воде, рН раствора подводили до значения 6,8 при помощи гидроксида калия (КОН), при необходимости доводили до нужного объема и затем стерилизовали путем пропускания через фильтр с размером пор 0,22 мкм. В качестве источника глюкозы использовали смесь Cargill, характеризующуюся ДЭ99 (декстрозный эквивалент), в виде сиропа с содержанием ТВ (твердое вещество) 71%.
[0949] Ферментацию проводили в 15-литровом биореакторе с использованием штаммов Е. coli EWL256 или RM111608-2, содержащих: компоненты верхнего MVA-пути (pCL Upper MVA), интегрированные компоненты нижнего MVA-пути (cmR-gi 1.2-yKKDyI), мевалонаткиназу М. mazei и изопренсинтазу Р. alba (pTrcAlba-mMVK), а также характеризующихся конститутивной повышенной (RM111608-2) или нормальной (EWL256) экспрессией гена ybhE (pgl). Данный эксперимент проводили для мониторинга образования изопрена из глюкозы при предпочтительных условиях ферментации (рН 7,0 и температура 34°С).
[0950] Инокулят соответствующего штамма Е. coli из замороженного стока подготавливали в среде на основе пептона и дрожжевого экстракта. После того как ОП550 инокулята достигала значения 0,6, 600 мл культуры пересевали в 15-литровый биореактор, содержащий среду ТМ2. Глюкоза подавалась экспоненциально, пока культура не переходила на стационарную фазу. Далее подачу глюкозы сокращали исходя из метаболических потребностей культуры. Общее количество глюкозы, внесенное в процессе ферментации продолжительностью 67 часов, составило 3,9 кг. Индуцирование осуществляли путем добавления изопропил-бета-D-1-тиогалактопиранозида (ИПТТ). После достижения культурой оптической плотности 9 при 550 нм (ОП550). вносили ИПТГ до получения концентрации 102 мкМ. Концентрацию ИПТГ повышали до 192 мкМ, после того как ОП550 достигала 140. Через разные промежутки времени после инокуляции, из биореактора отбирали образцы и оценивали количество образующегося изопрена, как описано ниже. Содержание водорода, азота, кислорода, диоксида углерода и изопрена в отходящем из биореактора газе определяли с использованием масс-спектрометра Hiden HPR-20, способом описанным ниже.
[0951] Образцы отходящего в ходе ферментации из 15-литрового биореактора газа собирали в стеклянные флаконы объемом 20 мл путем пропускания потока отходящего газа со скоростью 1 л/мин через флакон в течение 10 секунд и герметично закрывали флакон металлической крышкой с включенной в нее септой с тефлоновым покрытием (Agilent, Канада). Содержимое флаконов анализировали через 30 минут после отбора. [0952] Для анализа в масс-спектрометр Hiden HPR-20 (Hiden Analytics, Соединенное Королевство) вводили образцы из двух ферментеров со скоростью 4 см3/мин (4 мл/мин), для этого всасывающую трубу спектрометра помещали в открытые флаконы на 1-2 минуты. HPR-20 настраивали для сканирования масс, соответствующих водороду (т/г.2), азоту (т/г 28), кислороду (т/г 32), диоксиду углерода (т/г.44) и изопрена (т/г.67). Для обнаружения масс, соответствующих 28, 34, 44 и 67 использовали детектор Фарадея. Для определения водорода (т/г.2) использовали сканирующий (SEM) детектор. Ответ детектора регистрировали во внесистемных единицах давления (Торр). Абсолютный уровень водорода определяли путем сравнения показаний с аутентичным ответом на стандарт водорода. Результаты регистрировали с использованием программы MASsoft V 6.21.0.51 (Hiden Analytics,
Соединенное Королевство).
Результаты
[0953] Образцы отходящего в ходе двух ферментации газа отбирали и анализировали как описано выше.
[0954] А) Штамм RM111608-2 (Е. coli BL21 (DE3), pCL upper, cmR-gil.2-yKKDyI. pTrcAlba-mMVK, pBBR cmR-gil.5-pgl). Образец отбирали через 64,8 часов ферментации, во время отбора создавали анаэробные условия ферментации, подавали азот, отношения Объема подаваемого газа к Объему культуральной жидкости в Минуту (ООМ) составляло 1.
[0955] Б) Штамм EWL256 (Е. coli BL21 (DЕЗ). pCL upper, cmR-gil.2-yKKDyI. pTrcAlba-mMVK). Образец отбирали через 34,5 часа ферментации, во время отбора ферментация проходила в аэробных условиях, подавали воздух, отношения Объема подаваемого газа к Объему культуральной жидкости в Минуту (ООМ) составляло 1.
[0956] Результаты отображены на Фигурах 165А-В. В обоих вариантах, дополнительно к изопрену, кислороду и диоксиду углерода, обнаруживали водород в низких концентрациях. Базовая линия предела обнаружения водорода находилась на уровне 0,95×10-8 Торр. В обоих образцах А и В содержание водорода находилось на уровне 1,35×10-8 Торр. По результатам сравнения со стандартом водорода, количество водорода, присутствующего в отходящем газе образцов А и В составляло менее 10 промилле (об.), но находилось выше базовой линии. Как показано на Фигурах 165А-В, в обоих образцах А и В также присутствовали изопрен и диоксид углерода в значительных концентрациях.
Пример 26: Совместное получение изопрена и водорода с помощью штаммов Е. coli, экспрессирующих: мевалонаткиназу М. mazei. изопренсинтазу Р. alba. pCL Upper MVA (гены mvaE и mvaS Е. faecalis) и vbhE (pel).
Отбор проб и анализ уровня водорода и изопрена в отходящем в ходе ферментации газе
[0957] Целью настоящего эксперимента является совместное получение водорода и изопрена с помощью искусственно созданного штамма Е. coli. Для этого создавали конструкцию, в которой экспрессировался оперон hyc, кодирующий гидрогеназу-3 Е. coll. конструкцию создавали описанным в настоящей заявке способом на основе штамма EWL256 [BL21 (DE3), pCL upper, cmR-gil.2-yKKDyI, pTrcAlba-mMVK], хотя для этого можно использовать любой бактериальный штамм, описанный в настоящей заявке, например, штамм RM 111608-2 можно модифицировать аналогичным способом. Конструкцию для экспрессии оперона hyc, включающего гены hycB (gill 6130631), hycC (gill 6130630). hycD (gill 6130629), hycE (gill6130628), hycF (gill6130627) и hycG (gill6130626), получали стандартными, известным в данной области техники способами, на основе последовательностей генов, находящихся в открытом доступе. Данную конструкцию вводили в штамм EWL256, и таким образом получили новый штамм EWL256+Hyd-3.
[0958] Оценивали влияние дополнительных одиночных мутаций и комбинаций мутаций на совместное получение водорода и изопрена с помощью штамма EWL256+Hyd-3. Проводили следующие модификации: введение генов, вовлеченных в активацию и регуляцию активности гидрогеназы-3 (e.g., hycH (gill6130625) и hycl (gill6130624)); инактивацию или удаление генов, вовлеченных в потребление или транспорт водорода (e.g., гидрогеназа-1 (оперон hya) и гидргеназа-2 (оперон hyb) E.coli) или связанных с данными процессами белков (e.g., формиатдегидрогеназа (fdhF (gill6130624)), репрессор формиат лиазы (hycA (gill6130632)), альфа-субъединица формиатдегидрогеназы N (fdnG (gill 6129433)), большая субъединица формиатдегидрогеназы О (fdoG (gill6131734)), нитратредуктаза (narG (gill 6129187)), регулятор фумаратредуктазы (frir (gill6129295)) и ацетил-КоА-синтаза (acs (gill6131895))); активация генов, регулирующих активность гидрогеназ (e.g., активатор формиат-водород лиазы (ftilA (gill6130638)); активация или удаление генов, вовлеченных в продуцирование продуктов брожения (e.g., лактат дегидрогеназа (IdhA (gill6129341)), мембранный белок фумарат редуктаза (frdC (gi 116131977)), алкогольдегидрогеназа (adhE (gill6129202)), пируватоксидаза (рохВ (gill6128839)), компонент E1 пируватдегидрогеназы ackAlpta (aceE (gill 6128107)), регуляторный белок формиат дегидрогеназы (hycA (gill6130632)), транспортеры формиата А и В (FocA (gill6128871) и FocB (gill6130417)); экспрессия гетрологичных генов, участвующих в метаболизме водорода (e.g., глицеральдегид-3-фосфатдегидрогеназа Clostridium acetobutylicum (gapC (gill 5893997)).
[0959] Ферментацию проводили используя сконструированные варианты штамма EWL 256+Hyd-3 (BL21 (DE3), pCL upper, cmR-gil.2-yKKDyI, pTrcAlba-mMVK и hycB-F), которые содержали одну или комбинацию из более, чем одной из упомянутых выше дополнительных мутаций, главным образом комбинации, приведенные выше в Примере 25. Совместное получение водорода и изопрена оценивали путем анализа образцов отходящего газа как описано выше. Селекцию штаммов для дальнейших анализов проводили исходя из уровня совместной продукция изопрена и водорода.
[0960] Здесь и далее, если не определено другое, значение всех использованных технических и научных терминов является понятным специалисту в области техники, к которой относится настоящее изобретение. В словарях Singleton, et al.. Dictionary of Microbiology and Molecular Biology, 2nd ed., John Wiley and Sons. New York (1994), и Hale & Marham, The Harper Collins Dictionary of Biology, Harper Perennial, N.Y. (1991) приведены общеупотребительные толкования многих из использованных в настоящем изобретении терминов. Следует понимать, что данное изобретение не ограничивается конкретными, приведенными в описании, способами, протоколами и реагентами, которые можно варьировать. Специалисту в данной области техники будет понятно, что любой способ или материал, схожий или эквивалентный тем, которые приведены в описании, так же можно использовать в практическом применении или для проверки настоящего изобретения.
Пример 27: Получение изопрена или мевалоната из жирных кислот или пальмового масла с помощью штаммов Е. coli fadR atoC LS5218. содержащих компоненты верхнего или верхнего и нижнего МУА-пути и изопренсинтазу кудзу
[0961] Штамм Escherichia coli fadR atoC LS5218 (№6966) получили из Coli Genetic Stock Center. FadR кодирует транскрипционной репрессор, который негативно регулирует экспрессию генов, кодирующих ферменты, участвующие в деградации жирных кислот (Campbell et al„ J. Bacterial. 183: 5982-5990, 2001). AtoC является промежуточным регулятором в двухкомпонентной регуляторной системе, в которой AtoS регулирует метаболизм ацетолактата. Штамм, несущий fadR atoC, обеспечивает конститутивную экспрессию генов, участвующих в деградации жирных кислот, и включение жирных кислот с длинной цепью в состав длинноцепочечных полигидроксиалканоатов. При использовании пальмового масла в качестве источника углерода для получения изопрена или эфиров мевалоната, пальмовое масло перерабатывали в глицерин и жирные кислоты. Способы переработки хорошо известны в данной области техники, переработку можно осуществить ферментативным путем при инкубации с липазой (например, панкреатическая свиная липаза, липаза Candida rugosa или другая схожая липаза) или химически, путем сапонификации в присутствии основания, такого как гидроксид натрия.
i) Штамм Е. coli fadR atoC, экспрессирующий компоненты верхнего MVA- пути
[0962] Штамм WW4 создали путем электропорации плазмиды pCLPtrcUpperPathway в клетки LS5218 с использованием стандартных способов (Sambrooke et al., Molecular Cloning: A Laboratory Manual, 2nd ed.. Cold Spring Harbor, 1989). Включение плазмиды подтверждали путем получения мевалоновой кислоты (МК) при культивировании клеток в питательной среде ТМЗ, обогащенной либо С 12 жирными кислотами, либо пальмовым маслом, в качестве источников углерода. Для подтверждения продукции клетками WW4 МК из жирных кислот, клетки из ночной культуры разводили в соотношении 1:100 и пересевали в 5 мл модифицированной среды ТМЗ (не содержащей дрожжевой экстракт), обогащенной 0,25% С12-жирными кислотам (Sigma кат.№L9755). Первые признаки продукции МК (24 мг/л) можно было обнаружить после инкубации культуры, индуцированной ИГПТ, в течение ночи при 30°С.За три дня продукция МК увеличивалась до конечного значения 194 мг/л. Для подтверждения продукции клетками WW4 МК из масла, клетки из культуры, выращенной за ночь, разводили в соотношении 1:100 и пересевали в 5 мл модифицированной среды ТМЗ, обогащенной 200 мг гидролизированного пальмового масла. Первые признаки продукции МК (50 мг/л) можно было обнаружить после инкубации культуры, индуцированной ИГПТ, в течение ночи при 30°С.За три дня продукция МК увеличивалась до конечного значение 500 мг/л.
ii) Штамм Е. coli fadR atoC, экспрессирующий компоненты верхнего и нижнего MVA-путей и изопренсинтазу кудзу
[0963] Штамм Escherichia coli WW4 (LS5218 fadR atoC pCLPtrcUpperPathway) трансформировали плазмидой рМСМ118 [pTrcKKDyIkIS], полученный штамм обозначали как WW10. Включение плазмиды подтверждали путем получения изопрена при культивировании клеток трансформированного штамма, индуцированных ИПТТ (100, 300 или 900 мкМ), в среде ТМЗ, содержащей глюкозу. Данный штамм оказался относительно чувствительным к ИПТГ и значительное усиление роста наблюдали уже при 100 мкМ ИПТГ. Результаты представлены на Фигуре 70А.
[0964] Для проверки возможности штамма WW10 продуцировать изопрен из додекановой кислоты, клетки штамма выращивали в течение ночи в LB-среде, содержащей спектиномицин (50 мкг/мл) и канамицин (50 мкг/мл), при 37°С с перемешиванием 200 об./мин. Клетки центрифугировали и промывали модифицированной питательной средой ТМЗ. затем клетки ресуспендировали в этой среде до первоначального объема. После того как клетки начальной культуры промывали и ресуспендировали. их разводили в соотношении 1:100 и 1:10 в 5 мл модифицированной питательной среде ТМЗ, содержащей 0,125% С12-жирных кислот (Sigma кат.№L9755).
[0965] Для подтверждения продукции мевалоната из пальмового масла, для высвобождения из масла жирных кислот, масло предварительно, в течение нескольких дней при 37°С и с перемешиванием 250 об./мин, гидролизовали под воздействием липазы (свидетельством прохождения гидролиза служило появление пены при встряхивании пробирки).
[0966] Дополнительно, промытые клетки разводили в соотношении 1:10 модифицированной питательной средой ТМЗ, содержащей пальмовое масло. В другом варианте, к оставшимся промытым клеткам (2,5 мл) без дополнительных разведении добавляли 0,125% С12-жирных кислот (биоконверсия). Культуры выращивали в течение 3,75 часов при 30°С с перемешиванием 250 об./мин, после чего все культуры индуцировали путем добавления 50 мкМ ИГПТ. Инкубацию продолжали 4 часа, после чего отбирали по 200 мкл каждой культуры и использовали для анализа накопления изопрена модифицированным способом анализа газовой фазы (1 час накопления при 30°С с перемешиванием 500 об./мин). Дополнительно анализ изопрена провели после инкубации анализируемого блока в течение 12 часов перед ГХ/МС-анализом. Инкубацию индуцированных культур продолжали в течение ночи, после чего на следующее утро еще раз отбирали аликвоты в 200 мкл каждой культуры и анализировали продукцию изопрена (1 час при 30°С с перемешиванием 500 об./мин на шейкере Shel-Lab). Анализ этой партии показал продукцию значительного количества изопрена. Наибольшее содержание изопрена определили в культуре, которую получили разведением 1:10 начальной культуры, выращенной в течение ночи, индуцировали и инкубировали в течение ночи. Эти результаты дают возможность предположить, что культура продолжала расти и увеличивала плотность клеток Результаты представлены на Фигуре 70 В. Плотность клеток нельзя было измерить напрямую, в виду того, что суспензия жирных кислот является мутным раствором. Поэтому плотность клеток в данной культуре определяли путем рассева аликвоты культуры, и плотность составила 8×107 колониеобразующих единиц. Что приблизительно соответствует значению ОП600 0,1. Тем не менее, данные культуры демонстрировали значительную продукцию изопрена; в то же время изопрен не получали при использовании аналогичных штаммов, которые не содержали компонентов MVA-пути, описанных в данном примере.
Пример 28: Экспрессия растительной изопренсинтазы в Streptomyces sp
[0967] Ген изопренсинтазы кудзу выделяли из плазмиды pJ201:19813. Плазмида pJ201:19813 кодирует изопренсинтазу Pueraia lobata (растение кудзу), которую оптимизировали для экспрессии в системе кодонов Pseudomonas fluorescens, Pseudomonas putida, Rhodopseudomonas palustris \\Corynebacterium (Фигуры 79А-79С (SEQ ID NO: 123)). Разрезание плазмиды pJ201:19813 с помощю рестрикционных эндонуклеаз Ndel и BamHI приводило к высвобождению гена isol9813, который лигировали в челночный вектор pUWL201PW (Streptomyces-E.coli) (Doumith et al., Mol. Gen. Genet. 264: 477-485, 2000; Figure 71), таким образом получали вектор pUWL201_iso. Успешность клонирования подтверждали рестрикционными анализом вектора pUWL201_iso. Экспрессия изопренсинтазы isol9813 находилась под контролем промотора erm, который обеспечивает конститутивную экспрессию у видов Streptomycetes, но у Е, coli экспрессия отсутствует.
[0968] Вектора PUWL201PW (без вставки) и pUWL201_iso вводили в клетки штамма Streptomyces albus Л 074 (Sanchez et al„ Chem. Blol. 9:519-531, 2002) путем трансформации протопластов, как описано в в Hopwood et al.. The John innes foundation, Norwich, 1985.
[0969] Аликвоту суспензии протопластов объемом 200 мкл трансформировали либо 1,9 мкг вектора pUWL201PW, либо 2,9 мкг вектора pUWL201_iso. Трансформантов инкубировали в течение ночи при 28°С на агаризованной среде без селективного агента R5, после для селекции положительных трансформантов инкубацию в течение 4 дней продолжали на агаризованной среде R3, содержащей тиострептон (250 мкг/мл). Для проверки наличия плазмиды pUWL в устойчивых к тиострептону трансформантах, плазмиду выделяли с использованием набора Plasmid Mini Kit (Qiagen). Выделенную плазмидную ДНК заново вводили в клетки Е. coli DH5a с целью наработать достаточное количество плазмидной ДНК для проведения рестрикционного анализа.
Селекцию положительных трансформантов проводили на LA-агаре, содержащем ампициллин, анализ наличия вставки проводили путем разрезания плазмидной ДНК эндонуклеазами Ndel и ВаmHI. Ген изопренсинтазы идентифицировали как фрагмент размером 1,7 т.п.о., присутствующий в положительных клонах pUWL201_iso, в то время как контрольные штаммы (pUWL201PW) такого фрагмента не образовывали.
[0970] Штамм дикого типа и трансформанты S. albus, содержащие контрольную плазмиду pUWL201PW или плазмиду, несущую изопрен синтазу, pUWL201_iso, анализировали на образование изопрена. Штаммы культивировали двумя параллельными определениями на твердых средах (трипсиновый соевый агар, ТСА, 2,5 мл) содержащих и не содержащих тиострептон (200 мкг/мл) в течение 4 дней при 28°С в герметично закрытых флаконах (объем 20 мл). Образцы паровой фазы объемом 500 мкл (конечная точка) анализировали методом ГХ/МС в режиме селективного мониторинга (SIM), изопрен идентифицировали исходя из данных о времени выхода и молекулярной массе (67 m/z). Количество изопрена в паровой фазе определяли с помощью предварительно построенной калибровочной кривой. В то время как штамм дикого типа S. albus и контрольный штамм, несущий плазмиду pUWL201PW, продуцировали изопрен в концентрациях, близких к пределу обнаружения (0,04 - 0,07 промилле), штамм S. albus несущий плазмиду pUWL201_iso продуцировал, по меньше мере, в 10 раз больше изопрена, по сравнению с контролем (0,75 промилле. Фигура 72). Полученные данные демонстрируют успешную экспрессию изопренсинтазы растительного происхождения в прокариотических организмах, принадлежащих к группе Actinomycetes.
Пример 29: Выделение Биоизопрена (Bioisoprene™)
[0971] Биоизопрен (Bioisoprene™) выделяли из продуктов ферментации четырех ферментативных процессов, каждый в объеме 14 литров, в два этапа, которые включали; выделение изопрена из потока отходящего при ферментации газа путем адсорбции этилена на активированном угле и последующую независимую паровую десорбцию и конденсацию изопрена с получением жидкого Биоизопрена (Bioisoprene™)(Фигуры 166A и 166В). Общее количество Биоизопрена (Bioisoprene™), произведенное в четырех ферментаторах составило 1150 г (16,9 моль), из которых 953 г (14 моль, 83%) адсорбировалось на угольных фильтрах. По завершению следующего этапа паровой десорбции/конденсации, количество выделенного жидкого Биоизопрена (Bioisoprene™) составил 810 г, что соответствует конечной степени выделения 70%. Выделенный Биоизопрен (Bioisoprene™) анализировали на содержание примесей.
Анализ и профиль примесей в жидком Биоизопрене (Bioisoprene™)
[0972] Восстановленный жидкий Биоизопрен (Bioisoprene™) анализировали методами ГХ/МС и газовой хроматографии с использованием пламенно-ионизационного детектора (ГХ/ПИД) с целью определить природу и содержание примесей. Установили, что чистота продукта составила >99,5% и наряду с минорными компонентами в примесях выделили несколько доминант.ГХ/ПИД-хроматограмма представлена на Фигуре 167 и типичные уровни различных примесей приведены в Таблице 19. Профиль примесей был схож между разными партиями Биоизопрена (Bioisoprene™), полученными при данном масштабе культивирования.
Очистка Биоизопрена (Bioisoprene™) адсорбентом
[0973] Адсорбенты широко используются в отрасли для удаления следовых примесей из углеводородного сырья. К подходящим адсорбентам относятся: цеолит, окись алюминия и материалы на основе силикагеля. Для очистки Биоизопрен (Bioisoprene™) можно пропускать через силикагель и, в меньшей степени, через оксид алюминия. На Фигуре 168 показаны ГХ/ПИД хроматограммы образцов Биоизопрена (Bioisoprene™) до (А) и после обработки окись алюминия (В) или силикагелем (С). Коммерческий адсорбент Selexsorb™ от компании BASF один из выбранных адсорбентов для удаления примесей из Биоизопрена (Bioisoprene™). Особенно предпочтительны марки Selexsorb CD и CDX, которые показали хорошую способность к удалению полярных примесей из изопренового или бутадиенового сырья.
Пример 30: Химические превращения Биоизопрена (Bioisoprene™)
[0974] Используемые химические реагенты и растворители приобретали в компании Sigma Aldrich Corp (Висконсин, США). Биоизопрен (Bioisoprene™) получали при ферментации штаммов Е. coli BL21 экспрессирующих изопренсинтазу и гетерологичные компоненты метаболического пути биосинтеза изопрена из мевалоновой кислоты (МК). Биоизопрен выделяли из отходящего в ходе ферментации газа путем адсорбции на активированном угле и затем, для получения неочищенного жидкого Биоизопрена, проводили паровую десорбцию и конденсацию. Непосредственно перед использованием Биоизопрен очищали методом фракционной перегонки.
1Н ЯМР-анализ
[0975] Проводили снятие протонного (1Н) ЯМР-спектра с помощью системы Varian VNMRS 500 MHz NMR. Стандартом для всех ЯМР-спектров служил тетраметилсилан (ТМС, 0 промилле) или хлороформ (СНСl3, 7,26 промилле) и, если не указано иное, частота пиков зарегистрирована в промилле. Образцы растворяли в дейтерохлороформе (CDCl3) либо в (СО3ОD) дейтерометаноле.
ГХ/МС-анализ
[0976] Анализ проводили с использованием системы Agilent 6890 ГХ/МС, оснащенной автосэмплером СТС Analytics (Швейцария) CombiPAL, настроенном на работу в режиме отбора проб из паровой фазы над жидкостью. Для разделения анализируемых веществ использовали колонку для ГХ/МС Agilent HP-5MS (30 м×0.25 мм; толщина пленки фазы 0,25 мкм). Автосэмплер настраивали на введение 1 мкл жидкого образца с использованием жидкостного шприца объемом 10 мкл. Для ГХ/МС анализа, в качестве газа-носителя использовали гелий при скорости потока 1 мл/мин. Температуру инжектора поддерживали на уровне 250°С, при делении потока - 100:1. Начальная температура термостата составляла 50°С в течение 2 минут, затем температуру повышали до 250°С со скоростью 25°С/мин и поддерживали еще в течение 1 минуты, при этом общая продолжительность анализа составляла 10 минут. Диапазон сканирования масс-селективного детектора Agilent 5793N составлял m/z от 29 до 500. Задержка выхода растворителя составляла 1,5 минуты. При описанных условиях, выход изопрена (2-метил-1,3-бутадиена) наблюдали через 0,675 минут.
ГХ/ПИД-анализ
[0977] Анализ проводили с использованием системы Agilent 6890 ГХ/ПИД, оснащенной автосэмплером СТС Analytics (Швейцария) CombiPAL, для отбора жидких проб. Для разделения анализируемых веществ использовали колонку для ГХ Agilent DB-Petro (100 м×0.25 мм; толщина пленки фазы 0,50 мкм). Автосэмплер настраивали на введение 1 мкл жидкого образца с использованием жидкостного шприца объемом 10 мкл. Для ГХ/ПИД-анализа, в качестве газа-носителя использовали гелий при скорости потока 1 мл/мин. Температуру инжектора поддерживали на уровне 200°С, при отношении деления потока - 50:1. Начальная температура термостата составляла 50°С в течение 15 минут, затем температуру повышали до 250°С со скоростью 25°С/мин и выдерживали еще в течение 10 минут, при этом общая продолжительность анализа составляла 33 минуты. Температура ПИД-детектора составляла 280°Св режиме непрерывной подачи, со скоростью подачи водорода 35 мл/мин, и скоростью подачи воздуха 250 мл/мин. При описанных условиях, выход изопрена (2-метил-1,3-бутадиена) наблюдали через 13,54 минут.
I.____Получение циклических димеров изопрена Согласно термической реакции циклоприсоединения Дильса - Альдера
[0978] Изопрен (1,02 г, 0,015 моль) выдерживали при 150°С в течение 24 часов в присутствии 2,6-ди-трет-бутил-4-метилфенола (0,165 г, 0,05 моль), действующего как ингибитор термической полимеризации. Реакцию проводили в герметично-закрытой толстостенной стеклянной колбе, которую предварительно до начала реакции сушили в вакуум-сушильном шкафу в течение 24 часов. Реакционную смесь перемешивали при помощи магнитной мешалки. Процесс протекания реакции отслеживали методом газовой хроматографии с использованием масс-спектрометрического детектора (ГХ/МС). После завершения реакции, реакционную смесь изомеров очищали методом хроматографии на силикагеле с использованием гексана в качестве растворителя. Проводили концентрацию смеси с использованием вакуумного испарителя и затем проводили анализ продукта методами ГХ/МС и1Н-ЯМР. ГХ/МС: продукт А: 5,17,5,19 мин; продукт В: 5,72, 5,74 мин; продукт С: 6,11 мин.1Н-ЯМР (СDСl3) d: 5,8 (m); 5,4 (m); 4,95 (m); 2,4-1,2 (m).
II___Получение олигомеров изопрена по реакции олигомеризации с Pd-катали затором
[0979] Изопрен (2,03 г, 0,03 моль) смешивали с изопропанолом (1,79 г, 0,03 моль) в герметично-закрытой толстостенной стеклянной колбе. до начала реакции колбу сушили в вакуум-сушильном шкафу в течение 24 часов. Перенос всех реагентов проводили в атмосфере инертного азота. В реакционную смесь добавляли ацетилацетонат палладия (0,55 мг, 0,06 ммоль) и трифенилфосфин (1,49 мг, 0,19 ммоль). Реакционную колбу выдерживали при 100°С в течение 24 часов при перемешивании посредством магнитной мешалки. Процесс протекания реакции отслеживали методом ГХ/МС. После завершения реакции, продукты реакции выделяли методом хроматографии на силикагеле с использованием гексана в качестве растворителя. Полученные продукты анализировали методами ГХ/МС и1Н-ЯМР-спектроскопии. ГХ/МС: продукт А: 5,54 мин; продукт В: 6,6 мин; продукт С: 6,85 мин.
Ш. Гидрирование ненасыщенных соединений
[0980] Смесь изомеров, полученную Согласно Примеру II (1,36 г, 0,01 моль) помещали в стеклянную камеру, оснащенную магнитной мешалкой и содержащую катализатор гидрирования (Pd/C, 5 масс.%) (0,21 г, 0,1 ммоль). до проведения эксперимента всю стеклянную посуду сушили под вакуумом. В систему подавали водород и поддерживали давление в 3 атмосферы. Через несколько часов реакционную смесь Pd/C- отфильтровывали из реакционной смеси и выделяли продукты реакции методом хроматографии на силикагеле. Проводили финальный анализ методами ГХ/МС и ЯМР.
IV___Получение этоксилированных производных изопрена
[0981] Изопрен (0,982 г, 0,014 моль) смешивали с абсолютным этанолом (0,665 г, 0,014 моль) в толстостенной стеклянной камере, оснащенной магнитной мешалкой. В реакционную смесь добавили каталитическое количество концентрированной серной кислоты и выдерживали в течение ночи при перемешивании при температуре 85°С.Процесс протекания реакции отслеживали методом ГХ/МС. После нагревания в течение 16 часов нагрева ГХ/МС-анализ показал наличие смеси изомеров, характеризующихся следующим временем выхода: продукт А: 2,66 мин m/z+=99; продукт В: 3,88 мин m/z+=99. 114; продукт С: 5,41 мин, m/z+=87, 99, 114.
V____Превращение изопрена в С10-циклические димеры с использованием рутениевого катализатора
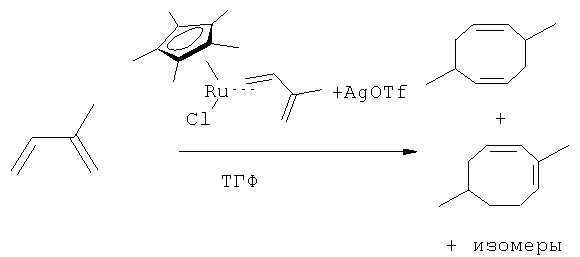
[0982] Высокий выход продукта при превращении изопрена в С10-циклические димеры получали в случае использования рутениевого катализатора в смеси с диметил-циклооктадиеном (Itoh, Kenji; Masuda, Katsuyuki; Fukahori, Takahiko; Nakano, Katsumasa; Aoki, Katsuyuki; Nagashima, Hideo, Organometallics (1994), 13(3), 1020-9). Показано, что при средней температуре (например, 60°С) достигается превращение с выходом более 95%. Катализатор, органометаллическое комплексное соединение рутения с пентаметилциклопентадиеном, можно приготовить в два проcтых этапа на основе хлорида рутения (RuCb) и пентаметилциклопентадиена (С5МезН). Для проведения реакции димеризации, катализатор активировали действием трифлата серебра (AgOTf), но так же можно использовать и другие активаторы.
VI. Превращение изопрена в С15-тримерные соединения с использованием хромового катализатора
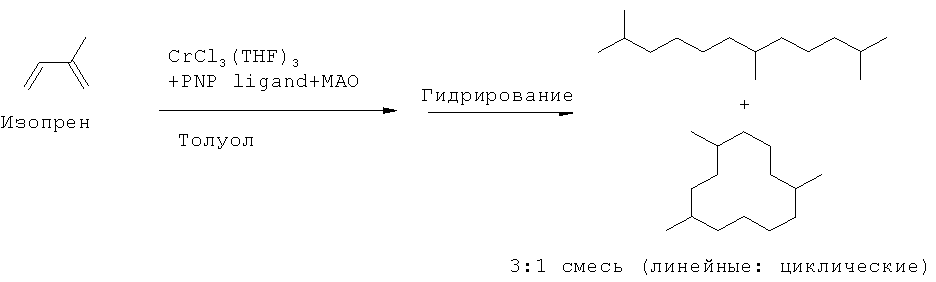
[0983] Превращение изопрена в С15-тримерные соединения можно осуществить с использованием хромового катализатора с P-N-P-лигандом, N.N-бис(диарилфосфино)амином. Катализатор готовили in situ и активировали МАО (метил алюмоксан), как описано в Bowen, L.; Charemsuk, M.; Wass, D.F. Chem. Commun. (2007) 2835-2837. При описанном способе превращения изопрена в С15-тримерные соединения, полученная смесь содержала линейные и циклические продукты в соотношении 3:1, выход составлял 95% при средних температурах (70°С). Во всех случаях обнаруживали тетрамерные соединения, как доминирующие фракции остальных продуктов.
VII. Гидрирование изопрена
[0984] Проводили гидрирование изопрена (10 мл 10% раствора в абсолютном этаноле (об./об.)) до 2-метилбутана (изопентана) в непрерывном режиме с использованием реактора гидрирования H-cube (ThalesNano, Принетон, Нью-Джерси, США). Раствор изопрена прокачивали со скоростью 0,5 мл/мин через картридж катализатора 10% Pd/C, при температуре 70°С. Водород вводили в режиме "full mode" под давлением 1 атмосфера. Продукт собирали и анализировали методами1Н-ЯМР и ГХ/ПИД, в результате чего было подтверждено превращение изопрена в 2-метилбутан с выходом более 90%, а также наличие минорных количеств частично гидрированных моно-олефинов.1Н-ЯМР (500 МГц, CDCl3): δ 0.8 (т, 9Н, СН3); 1,12 (т, 2Н, СH2); 1.37 (т.1Н, СН). ГХ/ПИД: 2-метилбуган; время выхода=12,69 минут.
VIII. Частичное гидрирование изопрена
[0985] Биоизопрен (Bioisoprene™) (50 мл, 0,5 моль) смешивали с толуолом (200 мл) и частично гидрировали с использованием 5% Pd/C катализатора и реактора гидрирования Midi-Cube (ThalesNano, Будапешт, Венгрия) при температуре 40°С и давлении водорода 5 бар. Субстрат подавали со скоростью 10 мл/мин, водород со скоростью 125 мл/мин (5 ммоль/мин). Пар продукта рециркулировал в аппарате в течение 2 часов, после чего анализировали аликвоту смеси методами ГХ/МС и ГХ/ПИД, в результате чего было определено, что большая часть исходного материала превратилась в смесь изоамиленов (2-метил-1-бутен, 2 метил-2-бутен и 3-метил-1-бутен) и изопентана, и также содержала небольшое количество непрореагировавшего изопрена (Фигура 170).
DC. Селективное гидрирование Биоизопрена (Bioisoprene™)
[0986] Биоизопрен (Bioisoprene™) селективно гидрировали в условиях, описанных в предыдущем примере, с использованием матового катализатора Pd/5-Al2O3, в результате чего образовывалась смесь изоамиленов, в которой Согласно ГХ/МС-анализу преобладал 2-метил-2-бутен, доля которого составляла >50% от общего количества изоамиленов, и в наименьшем количестве, составлявшем <25% от общего количества изоамиленов, был представлен 3-метил-1-бутен. Количество изопентана и остаточного изопрена составляло <10% от общего потока продукта. Схожий результат был получен, при использовании для проведения реакции сульфидированного палладия на углеродном катализаторе.
X:___Частичное гидрирование Биоизопрена (Bioisoprene™) в газовой фазе
[0987] Поток сухого газа, содержащий Биоизопрен (Bioisoprene™), смешивали с водородом при небольшом избытке водорода (мол/мол) и пропускали газовую смесь через гетерогенный катализатор для гидрирования, такой как, например, усиленный группировкой IB палладиевый катализатор с большим объемом пор. описанный в заявке на патент США №20090203520, для получения смеси изоамиленов и одного или более компонентов примеси, полученного в процессе ферментации, в котором также был получен Биоизопрен (Bioisoprene™). Процесс превращения проводили при давлении от 0,5 до 200 бар и температуре от 0°С до 200°С.
XI. Димеризация изоамиленов с использованием твердого кислого катализатора
[0988] 2-метил-2-бутен (1,5 мл) и толуол (4 мл) перемешивали при комнатной температуре с кислой ионообменной смолой Amberlyst 15 (186 мг) в течение 12 часов. Аликвоту (500 мкл) реакционной смеси переносили в виалу для ГХ-анализа. Анализ смеси, проводимый методом ГХ/МС (Фигура 171), показал частичное превращение в С10-димеры (диизоамилены), пригодные для применения в качестве компонент Biolsofuel™.
[0989] Продукты реакции димеризации (диизоамилены. С10-димеры) необязательно полностью гидрировали в условиях, описанных в Примере 30, часть VII, или в условиях, известных в области техники для гидрирования олефинов с получением изопарафинов (для примера см. Marichonna (2001)).
XII. Олигомеризация Биоизопрена (Bioisoprene™) с использованием твердого кислого катализатора
Ионообменная смола | Amberlyst 15

[0990] Смесь мономеров Биоизопрена (Bioisoprene™), 2-метил-2-бутена (1,5 мл) и толуола (4 мл) перемешивали при комнатной температуре с кислой ионообменной смолой Amberlyst 15 (186 мг) в течение 12 часов. Аликвоту (500 мкл) реакционной смеси переносили в виалу для ГХ-анализа. Анализ смеси, проводимый методом ГХ/МС (Фигура 172), показал наличие сложной смеси продуктов, состоящей из изопрена, линейных, циклических и ароматических С 10, С 15 и высших олигомеров.
ХIII. Непрерывная олигомеризация Биоизопрена (Bioisoprene™) с использованием твердого кислого катализатора
[0991] Проводили непрерывный процесс превращения мономерного Биоизопрена (Bioisoprene™) в С10-димеры и С15-тримеры в реакторе димеризации. содержащем ионообменную смолу Amberiyst 15 или эквивалентный катализатор. Сырьевой поток содержал мономерный Биоизопрен (Bioisoprene™) и необязательно С5-производные Биоизопрена (Bioisoprene™), и сорастворитель. Процесс проводили при температуре от 20 до 200°С и давлении от 0,5 до 200 бар. Для отделения непрореагировавшего изопрена от высших (>С5) олигомеров, продукты, полученные на этапе димеризации, фракционировали с помощью первой фракционирующей колонки. Фракцию С5 возвращали в реактор для димеризации, а тяжелую (>С5) фракцию вводили во вторую фракционирующую колонку, с помощью которой из парового потока отбирали целевую фракцию С10/С15. Нижнюю фракцию, состоящую из олигомеров с длиной цепи более С15, подавали в реактор для рецикла тяжелого продукта, содержащий катализатор метатезиса, такой как, например, катализатор Grubbs второго поколения. Катализатор метатезиса превращал часть фракции высших олигомеров в легкие компоненты за счет реакций перекрестного диспропорционирования олефинов, которые затем подавали во фракционирующую колонку №1, как показано на Фигуре 173.
[0992] Таким образом, описанный процесс приводил к превращению мономерного Биоизопрена в С10 димерных и С15 тримерных предшественников Biolsofuel™, которые затем подвергали частичному или полному гидрированию в условиях. описанных в Примере 30, раздел VII. Получаемые частично или полностью насыщенные соединения являлись пригодными для композиций или подготовительных смесей в составе Biolsofuel™.
Пример 31: 13С/12С-изотопный анализ
[0993]13С-изотопный анализ можно проводить с использованием Costech ECS4010 Elemental Analyzer в качестве предварительного этапа перед масс-спектрометром для определения соотношения изотопов ThermoFinhigan Delta Plus XP, для этого образцы от 0,5 до 1,0 мг, помещали в жестяные цилиндры для углеродно-изотопного анализа. Образцы вносили в реактор сгорания из кобальта/оксида кобальта при 1020°С, при этом продукты сгорания пропускали в потоке гелия (85 мл/мин) через медный реактор (650°С) для превращения NOx в N2. CO2 и N2 разделяли при помощи 3-х метровой колонки с 5А молекулярными ситами. Затем соотношение изотопов13С/12С калибровали Согласно шкале Венского Вторичного Стандарта (VPDB) с использованием двух лабораторных стандартов (Ацетанилид В, -29,52±0,02‰т и кукурузный крахмал А, -11.01±0.02‰), для калибровки которых использовали автономное сжигание и двойной анализ с использованием двух стандартов Согласно подходу, описанному в Т. В. Coplen et al. New Guidelines for δ13C Measurements, Anal. Chern., 78, 2439-2441 (2006). Концепция Коплена включена в настоящую заявку во всей своей полноте посредством ссылки с целью описания методики определения значения δ13С.
[0994] В предварительной заявке на патент США №61/133521, поданной 30 июня 2008 года и в публикации WO 2010/05525 A1 приведены значения δ13С для сырья и полимеров на основе изопрена, полученных из различных источников, включая значения, приведенные в Таблице 20.
Пример 32: Примерные Горючие Свойства
[0995] В Таблице 21 приведены горючие свойства некоторых соединений, которые можно получить из изопрена с использованием способов, описанных в настоящей заявке.
Таблица 21
[0996] Все приведенные в настоящем описании признаки не являются ограничениями различных аспектов или вариантов реализации изобретения, которые могут быть доступны по ссылке на описание настоящего изобретения в общем.
[0997] Все публикации, заявки на выдачу патента и патенты, упомянутые в настоящем описании, включены в настоящее описание посредством ссылок, как если бы для каждой отдельной публикации, заявки на выдачу патента или патент было индивидуально конкретно указано, что они включены в настоящее описание посредством ссылки. В частности, упомянутые в настоящем описании публикации прямо включены в настоящую заявку посредством ссылки с целью описания и раскрытия композиций и методик, которые можно применять в соответствии с изобретением. Хотя изложенное выше изобретение описано подробно с помощью иллюстраций и примеров для более ясного понимания, для среднего специалиста в данной области техники при изучении данного изобретения будет очевидно, что могут быть внесены определенные изменения и модификации без изменения сущности и объема изобретения согласно прилагаемой формулы изобретения.
Реферат
Изобретение относится к способу производства компонента топлива из биоизопреновой композиции. Способ включает в себя химическое преобразование изопрена в биоизопреновой композиции до неизопреновых соединений посредством: (a) нагревания биоизопреновой композиции или воздействия на нее каталитическими условиями, подходящими для димеризации изопрена с образованием димера изопрена с последующей каталитической гидрогенизацией этого димера изопрена с образованием С10-насыщенного компонента топлива; или (b) (i) частичной гидрогенизации биоизопреновой композиции для производства изоамилена, (ii) димеризации изоамилена с моноолефином, выбранным из группы, состоящей из изоамилена, пропилена и изобутена, с образованием двойного соединения и (iii) полной гидрогенизации этого двойного соединения с получением компонента топлива. При этом биоизопреновую композицию производят созданной методами генетической инженерии культурой клеток, природными микроорганизмами, растениями или животными. Также изобретение относится к системе для производства топлива и топливной композиции. Получаемое топливо содержит меньшее количество примесей, присущих топливу, получаемому при использовании нефтеизопрена. 3 н. и 25 з.п. ф-лы, 21 табл., 32 пр., 173 ил.
Формула
(a) нагревания биоизопреновой композиции или воздействия на нее каталитическими условиями, подходящими для димеризации изопрена с образованием димера изопрена с последующей каталитической гидрогенизацией этого димера изопрена с образованием С10-насыщенного компонента топлива; или
(b) (i) частичной гидрогенизации биоизопреновой композиции для производства изоамилена, (ii) димеризации изоамилена с моноолефином, выбранным из группы, состоящей из изоамилена, пропилена и изобутена, с образованием двойного соединения и (iii) полной гидрогенизации этого двойного соединения с получением компонента топлива;
отличающийся тем, что биоизопреновую композицию производят созданной методами генетической инженерии культурой клеток, природными микроорганизмами, растениями или животными.
(a) (i) один или более из химических реагентов, способных димеризовывать изопрен в биоизопреновой композиции, или источник тепла, способный димеризовывать изопрен в биоизопреновой композиции; и (ii) катализатор, способный осуществлять гидрогенизацию димера изопрена с образованием С10-насыщенного компонента топлива; или
(b) (i) химический реагент, способный осуществлять частичную гидрогенизацию изопрена в биоизопреновой композиции, производя изоамилен, (ii) химический реагент, способный димеризовывать изоамилен с моноолефином, выбранным из группы, состоящей из изоамилена, пропилена и изобутена, образуя двойное соединение, и (iii) химический реагент, способный осуществлять полную гидрогенизацию этого двойного соединения, производя компонент топлива;
отличающаяся тем, что биоизопреновую композицию производят созданной методами генетической инженерии культурой клеток, природными микроорганизмами, растениями или животными.



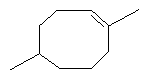
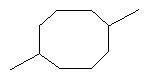

Комментарии