Применение соединений в качестве энергетических материалов - RU2725424C2
Код документа: RU2725424C2
Чертежи












Описание
ОБЛАСТЬ ТЕХНИКИ
Данное изобретение относится к области энергетических материалов, и в частности относится к использованию соединений типа перовскита как энергетических материалов.
УРОВЕНЬ ТЕХНИКИ
Энергетические соединения являются типом взрывчатого вещества с высокой энергетической плотностью. Чёрный порох, который является первым известным энергетическим материалом, открытым в древнем Китае в девятом веке, готовится путём смешивания серы, нитрата калия и угольного порошка, и имеет слабый эффект и нестабильную эффективность. В современное время обнаружили, что нитроглицерин, который первоначально был открыт как медицинский продукт, является сильно-взрывчатым веществом для использования в промышленности. Хотя нитроглицерин демонстрирует гораздо большую эффективность по сравнению с чёрным порохом, он очень опасен при производстве и транспортировке из-за высокой чувствительности. Благодаря беспрестанному производству и исследованию Альфред Бернхард Нобель открыл, что диатомит может поглощать нитроглицерин, который, за счет определенной эффективности взрыва, может эффективно повысить безопасность продукции. Таким образом, нитроглицерин стал успешно применяться в промышленности. В наши дни взрывчатые вещества с более высокой эффективностью, чем нитроглицерин, были открыты и внедрены в Применение, одно за другим. Хорошо известный тринитротолуол (ТНТ) и органические энергетические вещества, такие как циклотриметилентринитрамин (RDX) и октоген (НМХ), которые имеют высокую эффективность детонации по сравнению с ТНТ, широко применяются в оружии и боеприпасах во всем мире. За последние годы процесс индустриализации гексанитрогексаазаизовюрцитана (CL-20), органического взрывчатого вещества с высокой эффективностью, высокой стоимостью и сложным процессом изготовления был открыт китайскими учеными, что расширило перспективы усовершенствования вооружения в Китае. За последние годы некоторые металлоорганические структуры, содержащие энергетические органические лиганды (например, Angew. Chem. Int. Ed. 2013, 52, 14031; Chem. Eur. J. 2013, 19, 1706) привлекают все больше внимания. Учитывая широкие
возможности регулирования лигандов и высокую эффективность детонации, рассчитанную теоретически, такие энергетические металлоорганические структуры рассматриваются как важное направление для взрывчатых веществ следующего поколения.
В ходе разработки современных взрывчатых веществ были продемонстрированы несколько улучшенных свойств в различных аспектах, но при этом они также неизбежно сопровождаются некоторыми их собственными дефектами. Например, взрывчатый перхлорат калия когда-то использовался как прооксидантный компонент для осветительных бомб, но, в конце концов, его Применение было прекращено из-за его высокой чувствительности к ударным нагрузкам, что делало его склонным к детонации при перевозке (см. "High Energy Materials: Propellants, Explosives and Pyrotechnics", p. 347, edited by Jai Prakash Agrawal, Wiley-VCH Press, 2010"). Помимо существующих органических энергетических материалов, а также энергетических материалов с металлоорганической структурой, которые все ещё находятся на стадии фундаментальных исследований, нередко можно найти такие, которые имеют превосходную эффективность детонации, но большинство из них трудно применяются из-за недостатков сложного процесса синтеза, многочисленных этапов производства, высокой стоимости и слабой стабильности, а также высокой чувствительности к ударным нагрузкам и трению. Поэтому постоянной целью в области энергетических материалов является поиск того, как разработать и синтезировать нечувствительные высокоэнергетические материалы с достоинствами низкой стоимости, высокой энергетической плотности и низкой чувствительности (высокобезопасные).
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ Первая задача настоящей заявки — предложить вид новых энергетических материалов.
Вторая задача настоящей заявки — предложить вид новых энергетических материалов с высокой безопасностью.
Третья задача настоящей заявки — предложить вид новых энергетических материалов с высокой эффективностью детонации.
Четвёртая задача настоящей заявки — предложить вид новых энергетических материалов с высокой энергетической плотностью.
В области энергетических материалов настоящая заявка впервые рассматривает соединения типа перовскита как энергетические материалы, и совершает прорыв в том, что соединения типа перовскита особенно подходят для использования как энергетические материалы.
Упомянутые соединения типа перовскита имеют энергетическую группу, такую как СlO4- энергетическую группу. Этот тип энергетических материалов может использоваться, в частности, как взрывчатое вещество. Например, этот материал далее может использоваться как ракетное топливо, топливо для реактивных двигателей или газогенератор предохранительных подушек безопасности.
Соединение типа перовскита является твёрдым соединением, имеющим такой же тип кристаллической структуры, что и титанат кальция (CaTiO3). У них одна и та же общая химическая формула АВХ3, где А и В являются катионами разного размера, а X - анионом. Идеальная структура является высокосимметричной кубической структурой, и структурные отличительные признаки могут быть описаны следующим образом: каждый катион В-участка соединен с шестью примыкающими Х-анионами, и каждый Х-анион соединен с двумя примыкающими катионами В-участка, посредством чего формируется трехмерная анионная структура, состоящая из кубических каркасных единиц. Полости этих кубических каркасных единиц заполнены катионами А-участка. А - по меньшей мере один катион, В - по меньшей мере один катион, а X - по меньшей мере один анион. Когда перовскит включает в себя более одного А-катиона, разные А-катионы могут распределяться на А-участках упорядоченным или неупорядоченным образом. Когда перовскит включает в себя более одного В-катиона, разные В-катионы могут распределяться на В-участках упорядоченным или неупорядоченным образом. Когда перовскит включает в себя более одного Х-аниона, разные Х-анионы могут распределяться на Х-участках упорядоченным или неупорядоченным образом.
В настоящее время соединения типа перовскита в целом изучаются и применяются как сегнетоэлектрические материалы, фотоэлектрические материалы, электромагнитные материалы и т. д.
В настоящей заявке открыто, что трехмерная структура формируется в соединении типа перовскита, в котором катион А больше, чем катион В, а X является энергетической анионной группой. В дополнение к приданию соединению свойств энергетических
материалов такая структура может также позволить соединению преодолеть некоторые недостатки существующих энергетических материалов. Например, как объясняет изобретатель, структурные характеристики соединения типа перовскита обеспечивают соединение высокой стабильностью, преодолевая таким образом небезопасность взрывчатых веществ, имеющих слабую стабильность в уровне техники; кроме того, структурные характеристики соединения, такие как ценные энергетические группы, а также попеременное расположение окислительных энергетических анионов и уменьшение органических катионов в пространстве, придают соединению отличную эффективность мгновенного высвобождения энергии при детонации. Низкая чувствительность при хранении и мгновенный взрыв при детонации, эти две кажущиеся противоречащими характеристики объединены благодаря трехмерным пространственным структурным характеристикам соединений типа перовскита, что позволяет соединению подходить в частности для использования как энергетического материала, такого как нечувствительные высокоэнергетические взрывчатые вещества.
Энергетический лиганд относится к взрывчатому лиганду. Однако не все соединения, содержащие взрывчатые лиганды, являются взрывчатыми; является соединение взрывчатым или нет, зависит от всей его молекулярной структуры, а не от отдельного лиганда (см. The Study of Explosives, p. 3, Zhang Huazhu, et al., Beijing: Ordnance Industry Press, 2004). Общераспространенные взрывчатые лиганды включают в себя СlO3-, СlO4-, NO3-, ONC-, N(NO2)2-, азо-лиганды, азид-ионы и нитро-лиганды.
X в настоящей заявке является по меньшей мере одним анионным энергетическим лигандом. При необходимости X является окислительным анионным энергетическим лигандом, предпочтительно одновалентным анионным энергетическим лигандом, и более предпочтительно - одновалентным галоген-содержащим энергетическим лигандом.
В некоторых вариантах осуществления анионный энергетический лиганд (X) может быть одним, двумя или более из: СlO4-, ВrO4-, IO4-, ONC-, NO3- и N(NO2)2-.
В некоторых предпочтительных вариантах осуществления анионный энергетический лиганд (X) может быть одним, двумя или более из: СlO4-, ВrO4- и IO4-.
"А" в настоящей заявке является по меньшей мере одним органическим катионом. В частности, А является восстановленным органическим катионом.
Предпочтительно, А является по меньшей мере одним азотсодержащим органическим катионом.
Предпочтительно, А является по меньшей мере одним азотсодержащим гетероциклическим органическим катионом.
более предпочтительно, А является по меньшей мере одним азотсодержащим шестичленным гетероциклическим органическим катионом.
В качестве возможного варианта осуществления, А является одним, двумя или более органическими катионами, образованным присоединением протона к следующим органическим веществам и производным органических катионов:
1.1- диазобицикло[2,2,2]октан, пиразин, пиперазин, 3-аминопирролидин, имидазолин, аминотриазол, аминотетразол, этандиамин, дициандиамин, фенилендиамин,
1.2- диаминопентан, циклогександиамин и тому подобные.
В качестве возможного варианта реализации А выбирается из одного, двух или более следующих исходных органических катионов и производных таковых:




Производные органических катионов компонента А таковы, что атомы водорода в органических катионных основаниях замещаются замещающим(и) лигандом(ами)одновременно или раздельно. Общераспространенные замещающие лиганды включают в себя метил, этил, изопропил, монотрет-бутил, гидрокси, карбонил, карбоксил, галоген, сульфгидрил, пероксил, азо-лиганд, нитрил и тому подобные.
"В" является по меньшей мере одним одновалетным катионом.
В качестве возможного варианта реализации В выбирается из одного, двух или более следующих катионов: ион щелочного металла, NH4+.
Ион щелочного металла предпочтительно выбирается из одного, двух или более Na+, K+, Rb+ и Cs+.
Предпочтительно, А выбирается из одного, двух или более 1,4-диазабицикло[2.2.2]окт-1,4-дииум, 1-гидрокси-1,4-диазабицикло[2.2.2]октан-1,4-дииум, 1,4-дигидрокси-1,4-диазабицикло[2.2.2]октан-1,4-дииум и их производных. Более предпочтительно, А выбирается из одного или двух органических катионов, таких как 1,4-диазабицикло[2.2.2]октан-1,4-дииум и 1,4-дигидрокси-1,4-диазабицикло[2.2.2]октан-1,4-дииум.
Предпочтительно, В выбирается из одного, двух или более Na+, К+ и NH4+. Более предпочтительно, В выбирается из Na+ и NH4+. Более предпочтительно, В выбирается из NH4+
Более предпочтительно, X выбирается из одного, двух или более СlO4-, NO3- и IO4-. Более предпочтительно, X выбирается из одного или двух СlO4- и NO3-, или выбирается из одного или двух СlO4- и IO4-. Более предпочтительно, X выбирается из СlO4-.
В качестве дальнейшего предпочтительного варианта осуществления, в АВХ3настоящей заявки:
А выбирается из одного, двух или более органических катионов 1,4-диазабицикло[2.2.2]окт-1,4-дииум, пиразин-1,4-дииумпиразин-1,4-дииум, пиперазин-1.4-дииумпиперазим-1.4-дииум, 1-гидрокси-1,4-диазабицикло[2.2.2]октан-1,4-дииум и 1,4-дигидрокси-1,4-диазабицикло[2.2.2]октан-1,4-дииум.
В выбирается из одного, двух или более Na+, K+, Rb+ и NH4+.
X выбирается из одного, двух или более ClO4-, NO3- и IO4-. Более предпочтительно, X выбирается из одного или двух СlO4- и IO4-, или выбирается из одного или двух СlO4- и NO3-.
В качестве дальнейшего предпочтительного варианта осуществления, в АВХ3настоящей заявки:
А выбирается из одного, двух или более органических катионов, таких как 1,4-диазабицикло[2.2.2]окт-1,4-дииум, 1-гидрокси-1,4-диазабицикло[2.2.2]октан-1,4-дииум и 1,4-дигидрокси-1,4-диазабицикло[2.2.2]октан-1,4-дииум.
В выбирается из одного, двух или более Na+, K+, Rb+ и NH4+.
X выбирается из одного или двух СlO4- и NO3-, или одного или двух СlO4- и IO4-; более предпочтительно, X выбирается из СlO4-.
В качестве дальнейшего предпочтительного варианта осуществления, в АВХ3настоящей заявки:
А выбирается из одного или двух органических катионов, таких как 1,4-диазабицикло[2.2.2]октан-1,4-дииум и 1,4-дигидрокси-1,4-диазабицикло[2.2.2]октан-1,4-дииум.
В выбирается из одного, двух или более Na+, K+, Rb+ и NH4+.
X выбирается из одного или двух СlO4- и NO3-, или из одного или двух СlO4- и IO4-. Более предпочтительно, X выбирается из СlO4-.
В качестве более предпочтительного варианта осуществления, в АВХ3 настоящей
заявки:
А выбирается из одного или двух органических катионов, таких как 1,4-диазабицикло[2.2.2]октан-1,4-дииум и 1,4-дигидрокси-1,4-диазабицикло[2.2.2]октан-1,4-дииум.
В выбирается из одного, двух или более Na+, K+ и NH4+.
X выбирается из одного или двух СlO4- и NO3-, или из одного или двух СlO4- и IO4-. Более предпочтительно, X выбирается из СlO4-.
В качестве наиболее предпочтительного варианта осуществления, в АВХ3настоящей заявки:
А является органическим катионом как 1,4-диазабицикло[2.2.2]окт-1,4-дииум. В выбирается из одного или двух Na+ и NH4+.
X выбирается из одного или двух СlO4- и NO3-, или из одного или двух СlO4- и IO4-. Более предпочтительно, X выбирается из СlO4-.
В качестве частного варианта осуществления, в АВХ3 настоящей заявки: А и X выбираются из вышеупомянутых любых возможных комбинаций, а В выбирается из NH4+.
В качестве более конкретного частного варианта осуществления,
А выбирается из одного, двух или более органических катионов, таких как 1,4-диазабицикло[2.2.2]окт-1,4-дииум, пиразин-1,4-дииум, пиперазин-1.4-дииум, 1-гидрокси-1,4-диазабицикло[2.2.2]октан-1,4-дииум,
1,4-дигидрокси-1,4-диазабицикло[2.2.2]октан-1,4-дииум и производных таковых.
X выбирается из одного, двух или более СlO4-, ВrO4- и IO4-. В выбирается из NH4+.
Когда В - это NH4+, и после того, как соединение полностью детонирует, не остается твёрдых веществ солей металла, и газ, образуемый на моль, может составлять до 15,25 молей. При такой природе, соединение более предпочтительно используется как взрывчатое вещество, ракетное топливо, топливо для реактивных двигателей или газогенератор предохранительных подушек безопасности и т. д., и в частности, подходит для областей применения с высокими требованиями для добычи газа. Например, соединение используется как ракетное топливо.
В качестве другого конкретного варианта осуществления, в АВХ3 настоящей заявки: А и X выбираются из вышеупомянутых любых возможных комбинаций, а В - это Na+.
В качестве более конкретного частного варианта осуществления,
А выбирается из одного, двух или более органических катионов, таких как 1,4-диазабицикло[2.2.2]окт-1,4-дииум, пиразин-1,4-дииум, пиперазин-1.4-дииум, 1-гидрокси-1,4-диазабицикло[2.2.2]октан-1,4-дииум,
1,4-дигидрокси-1,4-диазабицикло[2.2.2]октан-1,4-дииум и производных таковых. X выбирается из одного, двух или более СlO4-, ВrO4- и IO4-. В выбирается из Na+.
Более предпочтительно, А является 1,4-диазабицикло[2.2.2]окт-1,4-дииум, X выбирается из СlO4-, а В выбирается из Na+.
Когда В является Na+ конкретные преимущества следующие: теоретически, по сравнению с такой ситуацией, что В является K+, плотность уменьшена. Принято считать, что уменьшенная плотность **р может уменьшить эффективность энергетического материала (уравнение Камлет-Джейкоба о получении скорости детонации D и давления детонации Р энергетического материала: D = 1.01Ф1/2 (1+1,30р**), Р = 1,558Ф**р2, где Ф = 31,68N(MQ)1/2; N - это количество молей газа, образованных единицей массы материала; М - это средняя молярная масса газового продукта; и Q - это отдача тепла на единицу массы материала. Поэтому плотность положительно коррелируется со влиянием скорости детонации и давления детонации, и в частности отношении квадрата показателя к влиянию давления детонации). Однако в настоящей заявке обнаружено, что (см. вариант осуществления 1), когда соединение используется как энергетический материал, просто и
понятно предугадывается, что легкие ионы натрия могут уменьшить плотность материала, в соответствии с чем можно сделать вывод, что может проявиться отрицательное влияние на скорость детонации и давление детонации материала, но все эксперименты и теоретические расчеты доказали, что, напротив, Применение ионов натрия оказывает лучший эффект на многие показатели. Например, при сравнении с DAP-1 (см. вариант осуществления 1, В соединения типа перовскита является Na+) и DAP-2 (см. вариант осуществления 2, В соединения типа перовскита является K+) отдача тепла на единицу массы увеличивается, и число молей газа на единицу массы увеличивается, так что теоретически предсказанные значения скорости детонации и давления детонации DAP-1 оба выше, чем таковые для DAP-2. Кроме того, перхлорат натрия, служащий сырьем для DAP-1, легче растворяется в полярном растворителе, чем перхлорат калия, служащий сырьем для DAP-2, так что количество растворителя для синтеза DAP-1 намного меньше, чем количество растворителя для синтеза DAP-2. Поэтому при экспериментах и производстве DAP-1 более удобен для синтеза. DAP-1, возможно, более подходит для применения в области высоких взрывчатых веществ и ракетного топлива, чем DAP-2.
В качестве другого частного варианта осуществления в АВХ3 настоящей заявки А и X выбираются из вышеупомянутых любых возможных комбинаций, а X - это N03". В качестве более конкретного частного варианта осуществления, А выбирается из одного, двух или более органических катионов, таких как 1,4-диазабицикло[2.2.2]окт-1,4-дииум, пиразин-1,4-дииум, пиперазин-1.4-дииум, 1-гидрокси-1,4-диазабицикло[2.2.2]октан-1,4-дииум,
1,4-дигидрокси-1,4-диазабицикло[2.2.2]октан-1,4-дииум и производных таковых. В выбирается из одного, двух или более Na+, K+, Rb+ и NH4+. X - это NO3-.
Когда X является NO3-, соединение не содержит галогеновый элемент, так что галогениды водорода не образуются после взрыва соединения, тем самым снижая характеристические сигналы и уменьшая загрязнение окружающей среды. Этот характер позволяет соединению быть особенно подходящим для применения с требованиями к слабым характеристическим сигналам. Например, соединение используется как топливо для реактивного двигателя или ракетное топливо со слабым характеристическим сигналом.
АВХ3 может быть получен реакцией компонента А, компонента В и компонента X, которые добавляются в жидкую реакционную систему в соответствии с любым порядком. Жидкая реакционная система предпочтительно является полярным растворителем, способным растворять компонент А, компонент В и компонент X, или она получается путём использования известного способа синтеза. Нет ограничения по температуре реакции, которая может регулироваться в очень большом диапазоне, таком как от 0° до 100°С.
В качестве одного решения реализации настоящая заявка предлагает способ приготовления соединения, содержащий:
1) добавление компонента А в полярный растворитель, затем добавление компонента X и равномерное перемешивание;
2) растворение компонента В в полярном растворителе;
3) смешивание растворителя, полученного на шаге 1) с растворителем, полученном на шаге 2), выполнение полного перемешивания и фильтрации, промывка остаточных продуктов этанолом и выполнение вакуумной сушки, таким образом получая белое порошковое энергетическое соединение.
Упомянутый компонент А является по меньшей мере одним из 1,4-диазабицикло[2.2.2]октана или его производным, пиразином или его производным, пиперазином или его производным, 1,4-диазабицикло[2.2.2]октан 1-оксидом или его производным, 1,4-диазабицикло[2.2.2]октан 1,4-диоксидом или его производным, органической солью, содержащей 1,4-диазабицикло[2.2.2]октан-1,4-дииум, или её производным, органической солью, содержащей пиразин-1,4-дииум, или её производным, органической солью содержащей пиперазин-1,4-дииум, или её производным, органической солью, содержащей 1-гидрокси-1,4-диазабицикло[2.2.2]октан-1,4-дииум, или её производным, и органической солью, содержащей
1,4-дигидрокси-1,4-диазабицикло[2.2.2]октан-1,4-дииум, или её производным.
Предпочтительно, катион компонента В выбирается из одного, двух или более ионов щелочного металла и NH4+. Компонент В является по меньшей мере одним из аммониевой соли, соли натрия, калийной соли, соли рубидия, соли цезия, щелочи аммония, щелочи натрия, щелочи калия, щелочи рубидия и щелочи цезия.
Упомянутый компонент X является по меньшей мере одной из галогенсодержащих энергетических кислот и галогенсодержащих энергетических солей.
Упомянутый полярный растворитель являются одним, двумя или более водой, этанолом и метанолом.
В качестве не ограничивающего примера, органическая соль, содержащая 1,4-диазабицикло[2.2.2]октан-1,4-дииум, является гидрохлоридом 1,4-диазабицикло[2.2.2]октана.
Упомянутая органическая соль, содержащая 1,4-диазабицикло[2.2.2]октан-1,4-дииум производную является по меньшей мере одной из гидрохлорида 2-гидрокси-1,4-диазабицикло[2.2.2]октан, гидрохлорид 2-карбонил-1,4-диазабицикло[2.2.2]октана и гидрохлорид 2-метил-1,4-диазабицикло[2.2.2]октан.
Упомянутая органическая соль, содержащая пиразин-1,4-дииум, является гидрохлоридом пиразина.
Упомянутая органическая соль, содержащая производную пиразин-1,4-дииума, является по меньшей мере одной из гидрохлорида 2-гидроксипиразина и гидрохлорида 2-метил-пиразина.
Упомянутая органическая соль, содержащая пиперазин-1,4-дииум, является гидрохлоридом пиперазина.
Упомянутая органическая соль, содержащая производную пиперазин-1,4-дииума, является по меньшей мере одной из гидрохлорида 2-гидрокси-пиперазин и гидрохлорид of 2-метил-пиперазина.
Упомянутая органическая соль, содержащая 1-гидрокси-1,4-диазабицикло[2.2.2]октан-1,4-дииум является гидрохлоридом 1,4-диазабицикло[2.2.2]октан 1-оксида.
Упомянутая органическая соль, содержащая производную
1- гидрокси-1,4-диазабицикло[2.2.2]октан-1,4-дииума, является по меньшей мере одной из гидрохлорида 2-гидрокси-1,4-диазабицикло[2.2.2]октан 1-оксида и гидрохлорида
2- карбонил-1,4-диазабицикло[2.2.2]октан 1-оксида.
Упомянутая органическая соль, содержащая 1,4-дигидрокси-1,4-диазабицикло[2.2.2]октан-1,4-дииум является гидрохлоридом 1,4-диазабицикло[2.2.2]октан 1,4-диоксида.
Упомянутая органическая соль, содержащая производную 1,4-дигидрокси-1,4-диазабицикло[2.2.2]октан-1,4-дииума, является по меньшей мере одной из 2-гидрокси-1,4-диазабицикло[2.2.2]октан 1,4-диоксида и гидрохлорида 2-карбонил-1,4-диазабицикло[2.2.2]октан 1,4-диоксида.
Упомянутая аммониевая соль является по меньшей мере одной из перхлората аммония, тетрафторбората аммония, периодата аммония, перрената аммония, карбоната аммония, нитрата аммония, фосфата аммония, хлорида аммония и фторида аммония.
Упомянутая соль натрия является по меньшей мере одной из перхлората натрия, тетрафторбората натрия, периодата натрия, перрената натрия, карбоната натрия, нитрата натрия, фосфата натрия, хлорида натрия и фторида натрия.
Упомянутая соль калия является по меньшей мере одной из перхлората калия, тетрафторбората калия, периодата калия, перрената калия, карбоната калия, нитрата калия, фосфата калия, хлорида калия и фторида калия.
Упомянутая соль рубидия является по меньшей мере одной из перхлората рубидия, тетрафторбората рубидия, периодата рубидия, перрената рубидия, карбоната рубидия, нитрата рубидия, фосфата рубидия, хлорида рубидия и фторида рубидия.
Упомянутая соль цезия является по меньшей мере одной из перхлората цезия, тетрафторбората цезия, периодата цезия, перрената цезия, карбоната цезия, нитрата цезия, фосфата цезия, хлорида цезия и фторида цезия.
Упомянутая аммонийная щелочь является водным раствором аммиака.
Упомянутая натриевая щелочь является гидроксидом натрия.
Упомянутая калиевая щелочь является гидроксидом калия.
Упомянутая рубидиевая щелочь является гидроксидом рубидия.
Упомянутая цезиевая щелочь является гидроксидом цезия.
Предпочтительно, упомянутый компонент X является перхлоратным радикалом, содержащим соединение. Например, это предпочтительно перхлорная кислота.
Упомянутый полярный растворитель является по меньшей мере водой, этанолом или метанолом.
В некоторых вариантах осуществления, когда соединение типа перовскита АВХ3содержит перхлоратный радикал, характеристические пики инфракрасных спектров поглощения перхлоратного радикала варьируются от 1070 до 1100 см-1 и от 617 до 637 см-1.
Когда соединение типа перовскита АВХ3 содержит нитратный радикал, характеристические пики инфракрасных спектров поглощения нитратного радикала варьируются от 1375 до 1390 см-1 и от 845 до 860 см-1.
В кубической системе угол 20, вмещающий характерные пики модели порошковой рентгеновской дифракции, приблизительно составляет: 12.1±0.70°, 21.1±1.00° и 24.4±1.20°. Далее, угол 20, вмещающий характерные пики модели порошковой рентгеновской дифракции, приблизительно составляет: 12.1±0.70°, 21.1±1.00°, 24.4±1.20°, 27.4±1.30° и 36.57±0.88°.
Или в моноклинальной системе угол 20, вмещающий характерные пики модели порошковой рентгеновской дифракции, приблизительно составляет: 12.6±0.5°, 21.7+0.5°, 22.4±0.5°, 22.7±0.5°, 25.4±0.5° и 26.8±0.5°. Далее, угол 20, вмещающий характерные пики модели порошковой рентгеновской дифракции, приблизительно составляет: 12.6±0.5°, 21.7±0.5°, 22.4±0.5°, 22.7±0.5°, 25.4±0.5°, 26.8±0.5°, 27.2±0.5°, 37.7±0.5° и 38.4±0.5°.
Или в гексагональной системе угол 20, вмещающий характерные пики модели порошковой рентгеновской дифракции, приблизительно составляет: 17.7±0.5°, 20.4±0.5°, 23.9±0.5°, 24.8±0.5°, 29.7±0.5° и 30.5±0.5°. Далее, угол 20, вмещающий характерные пики модели порошковой рентгеновской дифракции, приблизительно составляет: 10.3±0.5°, 17.7±0.5°, 20.4±0.5°, 23.9±0.5°, 24.8±0.5°, 27.0±0.5°, 29.7±0.5°, 30.5±0.5° и 32.2±0.5° и 37.0±0.5°.
Настоящая заявка имеет отличные положительные эффекты, которые:
(1) энергетическое соединение настоящей заявки имеет высокую теплоту детонации и высокую энергетическую плотность; теоретическая теплота детонации может составлять до 1,53 ккал/г; плотность кристалла находится в пределах от 1,8 до 2,3 г/см3; соответствующая энергетическая плотность может достигать 3,11 ккал/г3;
(2) энергетическое соединение настоящей заявки имеет высокую скорость детонации; теоретическая скорость детонации может достигать 8,85 км/с, рассчитанные по формуле Камлет-Джейкоба;
(1) энергетическое соединение настоящей заявки имеет высокое давление детонации; теоретическое давление детонации может достигать 37,3 ГПа, рассчитанные по формуле Камлет-Джейкоба;
(2) энергетическое соединение настоящей заявки высокобезопасно, а также имеет крайне низкую чувствительность к ударным нагрузкам, трению и электростатическому воздействию, и температура тепловой активации точки взрыва может составлять 340°С;
(3) энергетическое соединение настоящей заявки нелетучее и может храниться в течение долгого времени без распада или гигроскопической характеристики;
(4) энергетическое соединение настоящей заявки имеет одиночную кристалличность при комнатной температуре, и может безопасно готовиться в партиями из дешевого и готового сырья с помощью простого процесса.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1 - структурная схема энергетического соединения DAP-1.
Фиг. 2 - схема порошковой рентгеновской дифракции энергетических соединений в соответствии с вариантами осуществления 1-7.
Фиг. 3 - инфракрасный спектр энергетического соединения DAP-1 в соответствии с вариантом осуществления 1.
Фиг. 4 - график термического гравиметрического анализа энергетического соединения DAP-1 в соответствии с вариантом осуществления 1.
Фиг. 5 - график дифференциальной сканирующей калориметрии энергетического соединения DAP-1 в соответствии с вариантом осуществления 1.
Фиг. 6 - график термического гравиметрического анализа энергетического соединения DAP-2 в соответствии с вариантом осуществления 2.
Фиг. 7 - график дифференциальной сканирующей калориметрии энергетического соединения DAP-2 в соответствии с вариантом осуществления 2.
Фиг. 8 - график термического гравиметрического анализа энергетического соединения DAP-3 в соответствии с вариантом осуществления 3.
Фиг. 9 - график дифференциальной сканирующей калориметрии энергетического соединения DAP-3 в соответствии с вариантом осуществления 3.
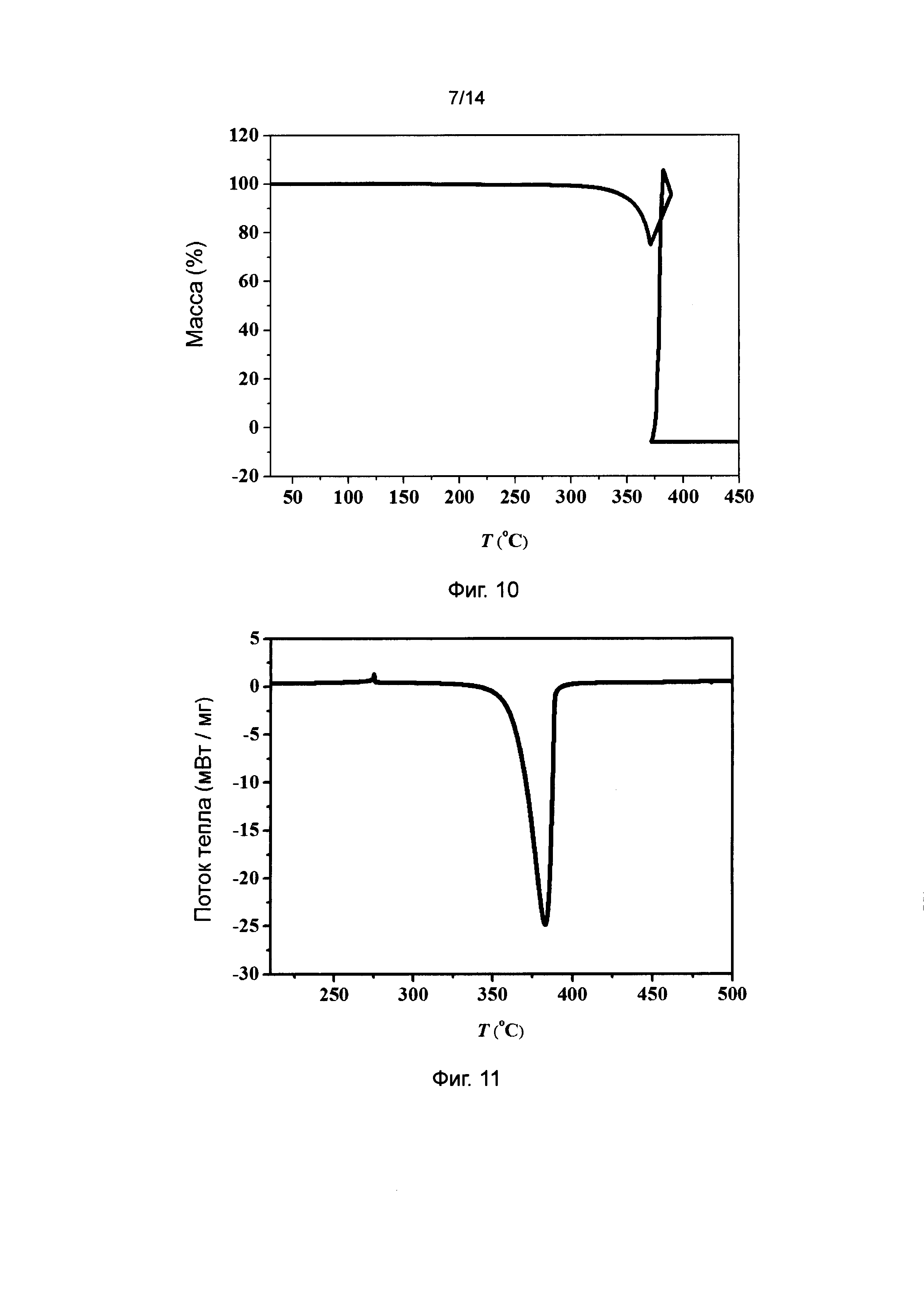
Фиг. 10 - график термического гравиметрического анализа энергетического соединения DAP-4 в соответствии с вариантом осуществления 4.
Фиг. 11 - график дифференциальной сканирующей калориметрии энергетического соединения DAP-4 в соответствии с вариантом осуществления 4.
Фиг. 12 - график термического гравиметрического анализа энергетического соединения DAP-022 в соответствии с вариантом осуществления 5.
Фиг. 13-график дифференциальной сканирующей калориметрии энергетического соединения DAP-022 в соответствии с вариантом осуществления 5.
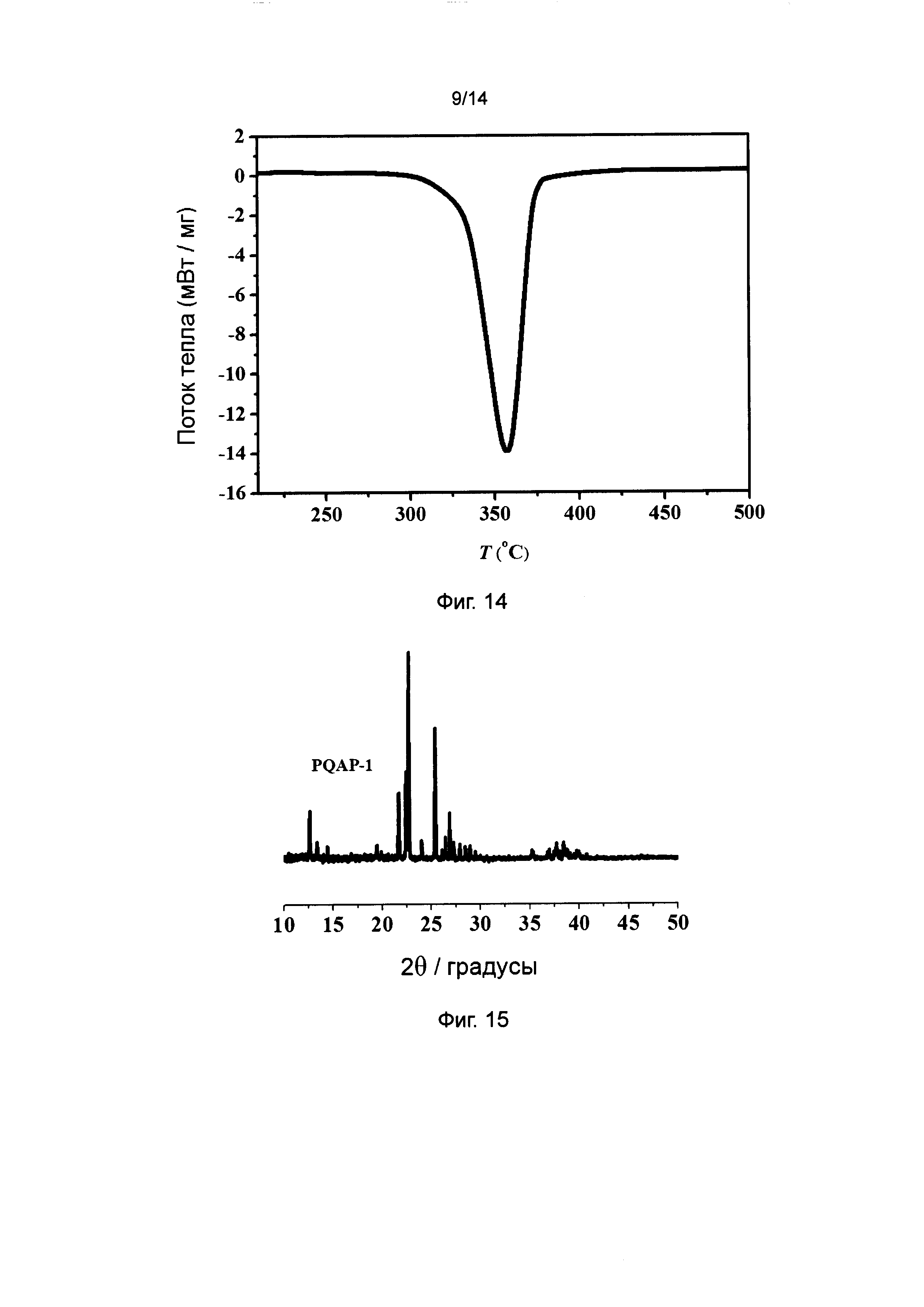
Фиг. 14 - график дифференциальной сканирующей калориметрии энергетического соединения DAP-024 в соответствии с вариантом осуществления 7.
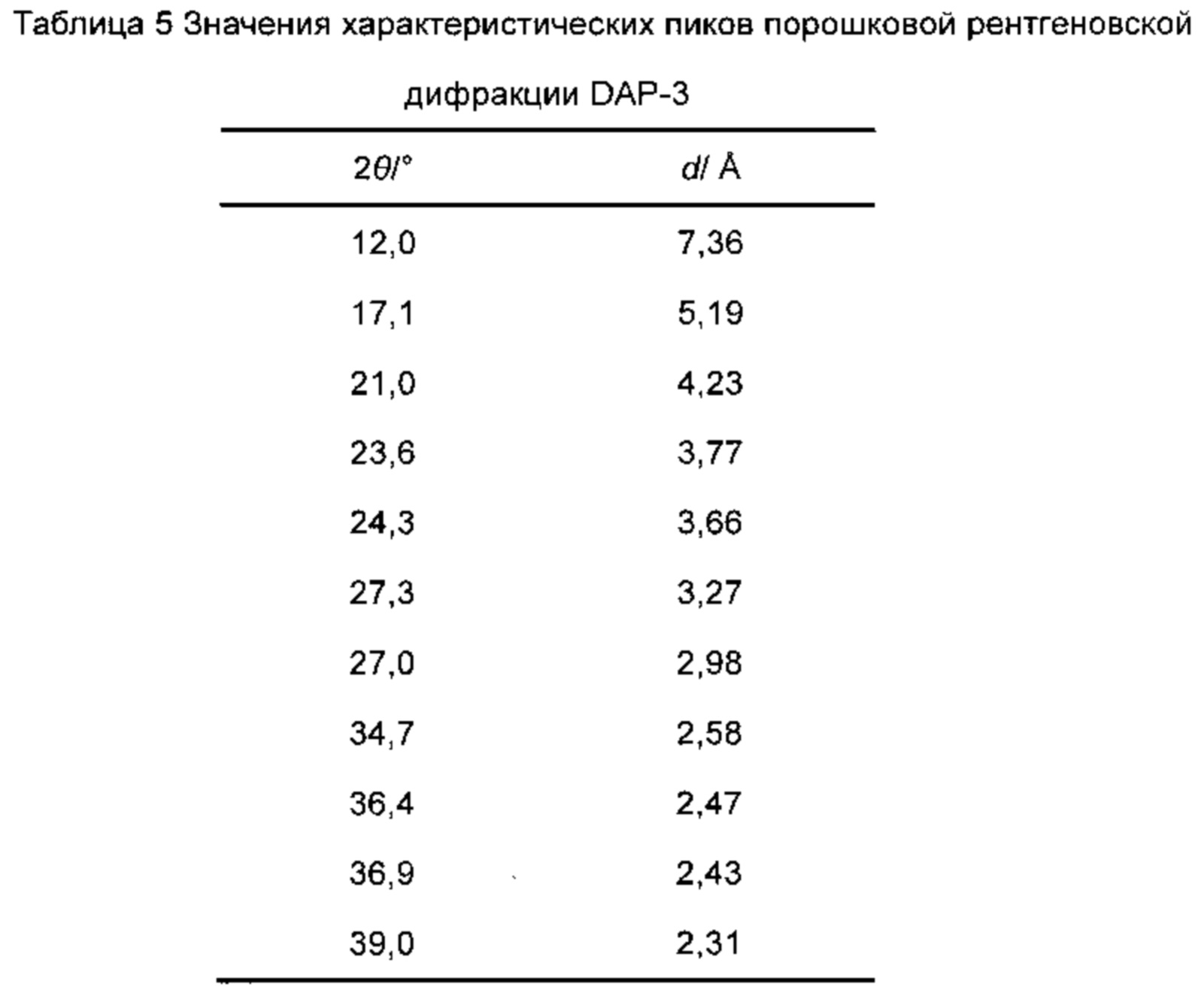
Фиг. 15-схема порошковой рентгеновской дифракции энергетического соединения РАР-1 в соответствии с вариантом осуществления 8.
Фиг. 16 - график термического гравиметрического анализа энергетического соединения РАР-1 в соответствии с вариантом осуществления 8.
Фиг. 17-график дифференциальной сканирующей калориметрии энергетического соединения РАР-1 в соответствии с вариантом осуществления 8.
Фиг. 18-график дифференциальной сканирующей калориметрии энергетического соединения РАР-4 в соответствии с вариантом осуществления 9.
Фиг. 19-схема порошковой рентгеновской дифракции энергетического соединения DAN-2 в соответствии с вариантом осуществления 10.
Фиг. 20 - инфракрасная спектрограмма энергетического соединения DAN-2 в соответствии с вариантом осуществления 10.
Фиг. 21 - график термического гравиметрического анализа энергетического соединения DAN--2 в соответствии с вариантом осуществления 10.
Фиг. 22 - график дифференциальной сканирующей калориметрии энергетического соединения DAN--2 в соответствии с вариантом осуществления 10.
Фиг. 23 - схема порошковой рентгеновской дифракции энергетического соединения DAN-4 в соответствии с вариантом осуществления 11.
Фиг. 24 - график термического гравиметрического анализа энергетического соединения DAN--4 в соответствии с вариантом осуществления 11.
Фиг. 25 - график дифференциальной сканирующей калориметрии энергетического соединения DAN-4 в соответствии с вариантом осуществления 11.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретатель разработал ряд соединений типа перовскита, имеющих энергетические группы, и проводит соответствующие эксперименты и исследования по перспективам этих соединений, служащих новаторскими высокоэффективными взрывчатыми веществами в области энергетики. В настоящей заявке предложены такие энергетические соединения типа перовскита (АВХ3, соответствующие аббревиатуре DAP в последующих вариантах осуществления и имеющие соответствующие номера), имеющие энергетические лиганды. Эксперименты и расчеты показывают, что их энергетические плотности и эффективность взрыва могут быть сравнимы с этими показателями у высокоэффективных находящихся на вооружении вооруженных сил взрывчатых веществ RDX и НМХ. Кроме того, соединения имеют отличные показатели безопасности с характеристиками нелетучести и не гигроскопичности, и подготовлены из дешевых и имеющихся в доступе сырьевых материалов с помощью простого процесса синтеза. Эти соединения являются новаторскими энергетическими соединениями, имеющими практическую ценность в области энергетики.
АВХ3 может синтезироваться способом синтеза настоящей заявки. Способ синтеза (Z.M.Jin, Y.J.Pan, X.F.Li, M.L.Hu, L.Shen, Journal of Molecular Structure, 2003, 660, 67) соединения типа перовскита (C6H14N2)[K(ClO4)3], который раскрыт Z.M.Jin и др., может также использоваться в качестве ссылки.
X в АВХ3 является по меньшей мере одним анионным энергетическим лигандом. Энергетический лиганд является взрывчатым лигандом. Общераспространенные взрывчатые лиганды включают в себя, но не ограничиваясь этим, СlO3-, СlO4-, IO4-, NO3-, ONC-, азо-лиганд, азид-ион, нитрил и тому подобные.
В АВХ3, например, X может включать в себя один или более ион. Например, 2, 3, 4, 5, 6, 7, 8, 9, 10... типов Х-ионов может существовать одновременно. То же относится к А и В. Когда перовскит включает в себя более одного типа А-катионов, разные А-катионы могут распределяться на А участках упорядоченным или неупорядоченным образом. Когда перовскит включает в себя более одного типа В-катиона, разные В-катионы могут распределяться на В-участках упорядоченным или неупорядоченным образом. Когда перовскит включает в себя более одного типа Х-аниона, разные Х-анионы могут распределяться на Х-участках упорядоченным или неупорядоченным образом.
Основываясь на этой характеристике, вышеупомянутое "X является по меньшей мере одним... лигандом/ионом", А является по меньшей мере одним... лигандом/ионом", "В является по меньшей мере одним... лигандом/ионом", "X выбирается из...", "А выбирается из...", "В выбирается из..." и т. д. должно пониматься, например, что для X АВХ3трехмерная структура включает в себя много Х-участков, каждый из которых состоит из одного типа ионов. В трехмерной структуре множество Х-участков может состоять из одного и того же типа ионов, и также может состоять из разных типов ионов. Когда Х-участки состоят из разных ионов, по меньшей мере некоторые участки (или большинство участков) являются... лигандами/ионами. В этот момент такая ситуация, что несколько участков в целой трехмерной структуре АВХ3 не являются... лигандами/ионами или некоторыми другими инородными ионами, не исключается, поскольку количество этих участков может не влиять на общую эффективность в большой степени. Некоторые из участков могут, например, иметь количество молей менее 50 процентов, например, не более 40 процентов, 30 процентов, 25 процентов, 20 процентов, 15 процентов, 10 процентов, 9 процентов, 8 процентов, 7 процентов, 6 процентов, 5 процентов, 4 процентов, 3 процентов, 2 процентов или 1 процента... Для А и В это то же самое.
В настоящей заявке выполняются различные способы идентификации и характеризации, включая идентификацию порошковой рентгеновской дифракции, испытание на определение характеристик монокристаллической структуры, инфракрасное спектральное исследование, характеризацию термической стойкости, дифференциальную сканирующую калориметрию (DSC), характеризацию чувствительности и расчет теплоты детонации / давления детонации / скорости детонации.
Здесь данные порошковой рентгеновской дифракции в условиях комнатной температуры получены с Применением дифрактометра Bruker D8 Advance посредством луча Cu-Kа*. Режим сканирования следующий: *: 2* связывание, поэтапное сканирование, длина шага 2* составляет 0.02о. Данные монокристаллической рентгеновской дифракции получены на дифрактометре Oxford Gemini S Ultra CCD с помощью графитового монохроматора *-сканирующим образом с Применением рентгеновского луча Мо-K*а. Использовалась программа SADABS для поправки на поглощение. Для анализа использовался прямой способ, а затем рассчитывались координаты водорода с Применением метода дифференциальной функции Фурье и метода наименьших
квадратов, и в конце структура уточнялась с Применением полноматричного метода наименьших квадратов. Органические атомы водорода генерировались геометрически. Расчеты завершались на ПК с помощью программных пакетов Olех2 и SHELX. Инфракрасные спектральные данные получены инструментом IR Tensor 27. Высушенный образец и КВr прессовались в прозрачный тонколистовой испытательный образец. Термический гравиметрический анализ выполнялся инструментом ТА Q50 в азотной атмосфере со скоростью сканирования 5°С/мин. Кривая DSC была получена инструментом ТА DSC Q2000 в азотной атмосфере при скорости сканирования 5°С/мин.
Оценка чувствительности подразумевала испытание чувствительности к ударным нагрузкам, трению и температуре в соответствии с Национальными военными стандартами GJB772A-97 Народной Республики Китай. Чувствительность к ударным нагрузкам испытывалась способом вероятности взрыва 601.1. Чувствительность к трению испытывалась способом вероятности взрыва 602.1. Чувствительность к температуре испытывалась способом 5-секундной задержки точки взрыва 606.1. Электростатическая чувствительность испытывалась по третьему разделу промышленного способа испытания взрывчатых материалов WJ/T 9038.3-2004: испытание на чувствительность к электростатической искре.
При комнатной температуре характеристические пики лиганда перхлоратного радикала в инфракрасном поглощающем спектре варьируются от 1070 до 1100 см-1 (в соответствии с ассиметричным валентным колебанием) и 617-637 см-1 (в соответствии с ассиметричным изгибным колебанием). Характеристические пики лиганда перхлоратного радикала в инфракрасном поглощающем спектре варьируются от 1375 до 1390 см-1 (в соответствии с ассиметричным валентным колебанием) и 845-860 см-1 (в соответствии с ассиметричным изгибным колебанием).
В одном предпочтительном варианте осуществления используемое соединение, служащее энергетическим материалом, является (C6H14N2)[Na(ClO4)3] (которое записано как DAP-1) и кристаллизуется в кубической пространственной группе Ра-3 при 223 К с длиной ячейки 14.1537(1)А. Угол 2*, вмещающий характерные пики модели порошковой рентгеновской дифракции (рентгеновского луча Cu-K*а) соединения при комнатной температуре, составляет примерно: 12.3±0.5°, 21.5±0.5°, 24.9±0.5°, 27.9±0.5°, 35.6±0.5° и 37.2±0.5°. Результат анализа термической стойкости показывает, что температура взрыва
соединения может достигать 360°С. Результат дифференциальной сканирующей калориметрии показывает, что тепло, выделяющееся при 360°С, составляет 4398 Дж/г. Результат характеризации безопасности показывает, что DAP-1 нечувствительно при испытаниях на чувствительность к ударным нагрузкам, трению и электростатической искре по Национальным Военным стандартам. По стандарту Федерального института исследования и испытания материалов (ВАМ), чувствительность к ударным нагрузкам DAP-1 составляет приблизительно 17Дж, а чувствительность к трению составляет приблизительно 36 Н. Точка взрыва DAP-1 составляет 340°С (метод 5-секундной задержки). Значения теплоты детонации, скорости детонации и давления детонации, полученные в соответствии с теорией функционала плотности (DFT), соответственно составляют 1,53 ккал/г, 8,85 км/с и 37,31 ГПа.
В другом предпочтительном варианте осуществления используемое соединение, служащее энергетическим материалом, является (C6H14N2)[K(ClO4)3] (которое записано как DAP-2) и кристаллизуется в кубической пространственной группе Ра-3 при 223 K с длиной ячейки 14.1537(1)**А. Угол 2*, вмещающий характерные пики модели порошковой рентгеновской дифракции (рентгеновского луча Cu-Ка) соединения при комнатной температуре, составляет примерно: 12.15±0.5°, 21.27±0.5°, 24.63±0.5°, 27.64±0.5°, 35.20±0.5° и 36.89±0.5°. Результат анализа термической стойкости показывает, что температура взрыва соединения может достигать 362°С. Результат дифференциальной сканирующей калориметрии показывает, что тепло, выделяющееся при 377°С, составляет 4076 Дж/г. Результат определения характеристик безопасности показывает, что по стандарту Федерального института исследования и испытания материалов (ВАМ), чувствительность к ударным нагрузкам DAP-2 составляет приблизительно 16 Дж, а чувствительность к трению составляет приблизительно 42 Н. Значения теплоты детонации, скорости детонации и давления детонации, полученные теоретически DFT, соответственно составляют 1,46 ккал/г, 8,64 км/с и 35,73 ГПа.
В другом предпочтительном варианте осуществления используемое соединение, служащее энергетическим материалом, является (C6H14N2)[Rb(ClO4)3] (которое записано как DAP-3) и кристаллизуется в кубической пространственной группе Ра -3 при 223 K с длиной ячейки 14.453(2)А. Угол 29, вмещающий характерные пики модели порошковой рентгеновской дифракции (рентгеновского луча Cu-Ка) соединения при комнатной
температуре, составляет примерно: 12.0±0.5°, 21.0±0.5°, 24.3±0.5°, 27.3±0.5°, 34.7±0.5° и 36.4±0.5°. Результат анализа термической стойкости показывает, что температура взрыва соединения может достигать 343°С. Результат дифференциальной сканирующей калориметрии показывает, что тепло, выделяющееся при 369°С, составляет 3797 Дж/г. Результат характеризации безопасности показывает, что по стандарту Федерального института исследования и испытания материалов (ВАМ), чувствительность к ударным нагрузкам DAP-3 составляет приблизительно 22 Дж, а чувствительность к трению составляет приблизительно 28 Н. Значения теплоты детонации, скорости детонации и давления детонации, полученные теоретически DFT, соответственно составляют 1,33 ккал/г, 8,43 км/с и 35,14 ГПа.
В другом предпочтительном варианте осуществления используемое соединение, служащее энергетическим материалом, является (C6H14N2)[NH4(ClO4)3] (которое записано как DAP-4) и кристаллизуется в кубической пространственной группе Ра-3 при 223 К с длиной ячейки 14.4264(1)А**. Угол 2*, вмещающий характерные пики модели порошковой рентгеновской дифракции (рентгеновского луча Cu-K**а) дифракции соединения при комнатной температуре, составляет примерно: 12.0±0.5°, 21.0±0.5°, 24.4±0.5°, 27.3±0.5°, 34.8±0.5° и 36.5±0.5°. Результат анализа термической стойкости показывает, что температура взрыва соединения может достигать 370°С. Результат дифференциальной сканирующей калориметрии показывает, что тепло, выделяющееся при 364°С, составляет 5177 Дж/г. Результат характеризации безопасности показывает, что по стандарту Федерального института исследования и испытания материалов (ВАМ), чувствительность к ударным нагрузкам DAP-4 составляет приблизительно 23 Дж, а чувствительность к трению составляет приблизительно 36 Н.
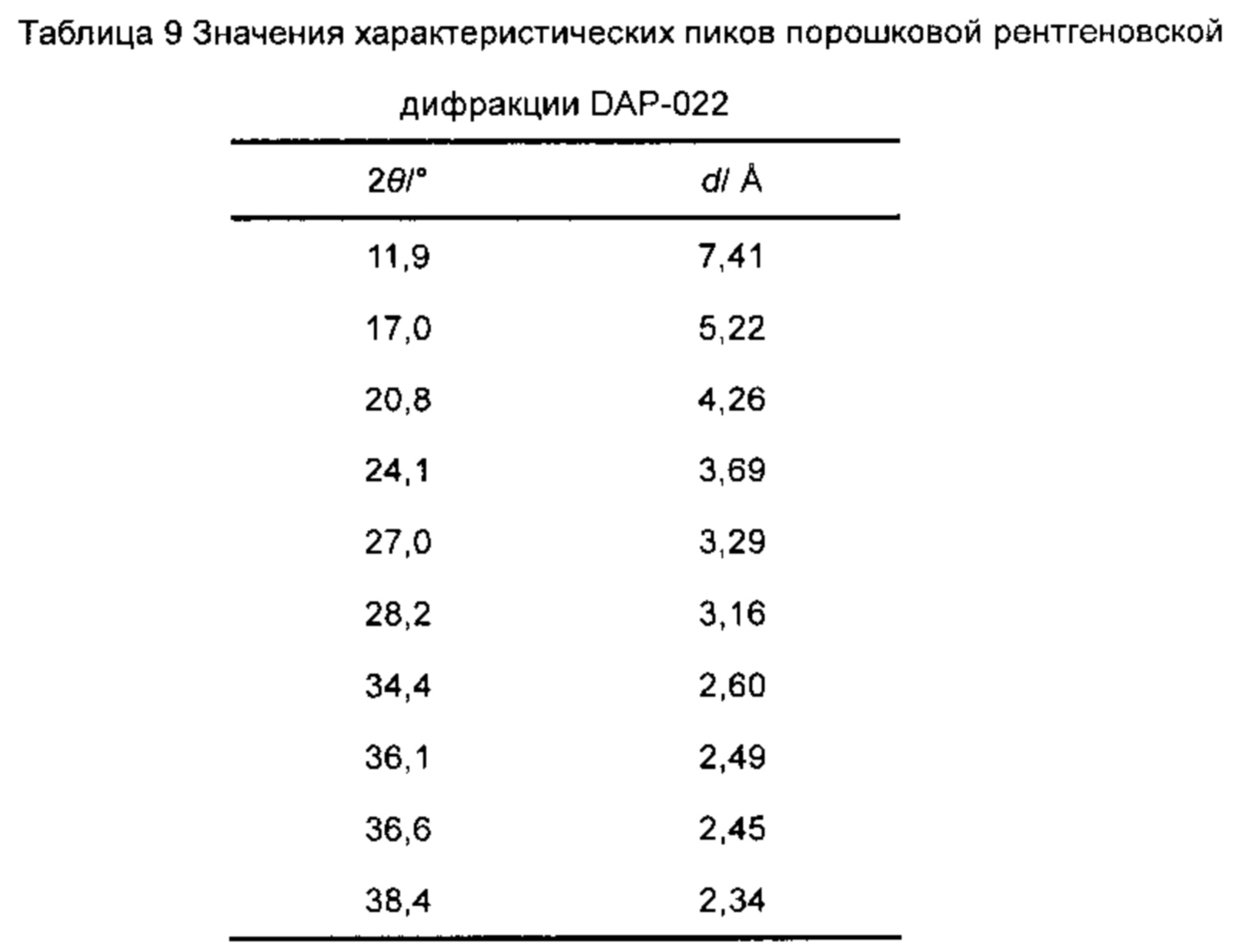
В другом предпочтительном варианте осуществления используемое соединение, служащее энергетическим материалом, является (C6H14N2O2)[K(ClO4)3] (которое записано как DAP-022) и кристаллизуется в кубической пространственной группе Fm-3c при 298 К с длиной ячейки 14.745(3)А**. Угол 20, вмещающий характерные пики модели порошковой рентгеновской дифракции (рентгеновского луча Cu-K*а) соединения при комнатной температуре, составляет примерно: 11.9±0.5°, 20.8±0.5°, 24.1±0.5°, 27.0±0.5°, 34.4±0.5° и 36.1 ±0.5°. Результат анализа термической стойкости показывает, что температура детонации соединения может составлять 354°С. Результат
дифференциальной сканирующей калориметрии показывает, что тепло, выделяющееся при 358°С, составляет 5424 Дж/г. Результат характеризации безопасности показывает, что по стандарту Федерального института исследования и испытания материалов (ВАМ), чувствительность к ударным нагрузкам DAP-022 составляет приблизительно 11 Дж, а чувствительность к трению составляет приблизительно 14 Н.
В другом предпочтительном варианте осуществления используемое соединение, служащее энергетическим материалом, является (C6H14N2O)[K(ClO4)3] (которое записано как DAP-012). Угол 2*, вмещающий характерные пики модели порошковой рентгеновской дифракции (рентгеновского луча Cu-K*а) соединения при комнатной температуре, составляет примерно: 12.1±0.5°, 21.1±0.5°, 24.4±0.5°, 27.3±0.5°, 34.8±0.5° и 36.5±0.5°.
В другом предпочтительном варианте осуществления используемое соединение, служащее энергетическим материалом, является (C6H14N2O2)[NH4(ClO4)3] (которое записано как DAP-024). Угол 2*, вмещающий характерные пики модели порошковой рентгеновской дифракции (рентгеновского луча Cu-Kа) соединения при комнатной температуре, составляет примерно: 11.9±0.5°, 20.8±0.5°, 24.0±0.5°, 27.0±0.5°, 34.4±0.5° и 36.0±0.5°. Результат дифференциальной сканирующей калориметрии показывает, что тепло, выделяющееся при 357°С, составляет 4632 Дж/г. Результат определения характеристики безопасности показывает, что по стандарту Федерального института исследования и испытания материалов (ВАМ), чувствительность к ударным нагрузкам DAP-024 составляет приблизительно 4 Дж, а чувствительность к трению составляет приблизительно 32 Н.
В другом предпочтительном варианте осуществления используемое соединение, служащее энергетическим материалом, является (C4H12N2)[Na(ClO4)3] (которое записано как РАР-1). Угол 2*, вмещающий характерные пики модели порошковой рентгеновской дифракции (рентгеновского луча Cu-Kа*) соединения при комнатной температуре, составляет примерно: 12.6±0.5°, 21.7±0.5°, 22.4±0.5°, 22.7±0.5°, 25.4±0.5°, 26.8±0.5°, 27.2±0.5°, 37.7±0.5° и 38.4±0.5°. Результат дифференциальной сканирующей калориметрии показывает, что тепло, выделяющееся при 375°С, составляет 4685 Дж/г.
В другом предпочтительном варианте осуществления используемое соединение, служащее энергетическим материалом, является (C4H12N2)[NH4(ClO4)3] (которое
записано как РАР-4). Результат дифференциальной сканирующей калориметрии показывает, что тепло, выделяющееся при 356°С, составляет 3780 Дж/г.
В другом предпочтительном варианте осуществления используемое соединение, служащее энергетическим материалом, является (C6H14N2)[K(NO3)3] (которое записано как DAN-2). Угол 2*, вмещающий характерные пики модели порошковой рентгеновской дифракции (рентгеновского луча Cu-Ка) соединения при комнатной температуре, составляет примерно: 12.6±0.5°, 17.9±0.5°, 22.0±0.5°, 25.5±0.5°, 28.6±0.5°, 31.3±0.5°, 36.4±0.5°, 38.7±0.5°, 40.9±0.5° и 43.0±0.5°. Результат дифференциальной сканирующей калориметрии показывает, что тепло, выделяющееся при 177°С, составляет 1222 Дж/г. Результат определения характеристики безопасности показывает, что по стандарту Федерального института исследования и испытания материалов (ВАМ), чувствительность к ударным нагрузкам DAN-2 составляет приблизительно 29 Дж, а чувствительность к трению составляет более 360 Н.
В другом предпочтительном варианте осуществления используемое соединение, служащее энергетическим материалом, является (C6H14N2)[NH4(NO3)3] (которое записано как DAN-4). Угол 2*, вмещающий характерные пики модели порошковой рентгеновской дифракции (рентгеновского луча Cu-K*а) соединения при комнатной температуре, составляет примерно: 10.3±0.5°, 17.7±0.5°, 20.4±0.5°, 23.9±0.5°, 24.8±0.5°, 27.0±0.5°, 29.7±0.5°, 30.5±0.5°, 32.2±0.5° и 37.0±0.5°. Результат дифференциальной сканирующей калориметрии показывает, что тепло, выделяющееся при 170°С, составляет 1098 Дж/г.
ВАРИАНТ ОСУЩЕСТВЛЕНИЯ 1 Синтез и испытание (C6H14N2)[Na(ClO4)3] Способ синтеза:
1) добавление 112,88 г 1,4-диазабицикло[2.2.2]октана в 100 мл воды, затем добавление 360,00 г раствора перхлорной кислоты с массовой долей 70-72 процента, и перемешивание смеси при нормальной температуре в течение 5 минут;
2) добавление 140,52 г натрий перхлорат моногидрата в 50 мл воды, а затем перемешивание при нормальной температуре для растворения натрий перхлорат моногидрата;
3) смешивание растворов, полученных на шагах 1) и 2), перемешивание смеси в течение 30 минут, а затем фильтрация смеси, промывка остаточных продуктов этанолом три раза и выполнение вакуумной сушки промытых остатков, чтобы получить белое порошковое твёрдое вещество, которое идентифицируется как соединение типа перовскита (C6H14N2)[Na(ClO4)3] (No. DAP-1) с выходом приблизительно 80 процентов. Диаграмма идентификации порошковой рентгеновской дифракции: Диаграмма порошковой рентгеновской дифракции при комнатной температуре показана на фиг. 2, и значения её характеристических пиков приведены в таблице 1.

Испытание на определение характеристик монокристаллической структуры:
Подробные данные испытания кристаллической структуры показаны в таблице 2. Структурная схема трехмерной кристаллической структуры показана на фиг. 1. На фиг. 1 видно, что: Na+ ион в В-участке соединен с 6 примыкающими анионами СlO4- на Х-участке, и каждый анион СlO4- соединен с двумя примыкающими ионами Na+, посредством чего образуется трехмерная анионная структура, состоящая из кубических каркасных единиц. Полости каждой кубической каркасной единицы заполняются органическими катионами на А-участках, а именно 1,4-дигидрокси-1,4-диазобицикло[2.2.2]октан-1,4-дииум (C6H14N22+).

Инфракрасное спектральное исследование DAP-1:
Инфракрасный спектр DAP-1 такой, как показан на фиг. 3. На фиг. 3 видно, что: характеристические пики органических являются пиками валентных колебаний 3452, 3188, 3055, 3013, 2924, 2795 и 2706 см-1-СН2- группы; пик валентных колебаний NH+ составляет 2606 см-1; и характеристические пики радикала перхлората составляют асимметричные валентные колебания 1078 см-1 и асимметричное изгибное колебание 627 см-1.
Характеризация термической стойкости DAP-1:
Термогравиметрическая кривая DAP-1 показана на фиг. 4. На фиг. 4 видно, что: при условии, что объём загружаемой пробы составляет 3,291 мг, а скорость нагрева
составляет 5°С/мин, энергетическое соединение DAP-1 варианта осуществления 1 взрывается при 360°С.
Дифференциальная сканирующая калориметрия (DSC) DAP-1:
Кривая DSC DAP-1 показана на фиг. 5. На фиг. 5 видно, что: порошковое энергетическое соединение DAP-1 в ненагруженном состоянии варианта осуществления 1 распадается при 360°С и высвобождает большое количество тепла (около 4398 Дж/г).
Определение характеристик чувствительности к ударным нагрузкам, трению, тепловому и электростатическому воздействию DAP-1:
Чувствительность к ударным нагрузкам, трению и тепловому воздействию испытывалась в соответствии со стандартом GJB772A-97. Чувствительность к ударным нагрузкам испытывалась способом вероятности взрыва 601.1. Во время испытания (вес молота 10 кг, высота падения 500 мм), вероятность взрыва ТНТ составляет 9/25, но вероятность взрыва DAP-1 составляет 0 процентов. Чувствительность к трению испытывалась способом вероятности взрыва 602.1. Во время испытания (2,45 МПа, угол отклонения 80 градусов), вероятность взрыва PETN составляет 2/25, но вероятность взрыва DAP-1 составляет 0 процентов. Метод испытания чувствительности к тепловому воздействию является метод 5-секундной задержки точки взрыва 606.1. Измерение показывает, что DAP-1 резко взрывается при 340°С, что указывает, что точка взрыва DAP-1 составляет 340 °С. Способ испытания электростатической чувствительности - третий раздел промышленного способа испытания взрывчатых материалов WJ/T 9038.3-2004: испытание на чувствительность к электростатической искре. Половина напряжения запускающего сигнала V50 из 25 мг испытуемого образца составляет 4,77 кВ (стандартное отклонение составляет 0,21 кВ), а половина энергии запускающего сигнала Е50 составляет 0,53 Дж, и именно чувствительность к электростатической искре DAP-1 составляет 21,2 Дж.
В соответствии с методом испытания Федерального института исследования и испытания материалов (ВАМ), чувствительность к ударным нагрузкам DAP-1 составляет приблизительно 17 Дж, а чувствительность к трению составляет приблизительно 36 Н.
Значения тепла детонации, давления детонации и скорости детонации энергетического соединения DAP-1 получены теоретически DFT:
Значение теплоты детонации (значение энтальпии распада *AHdet) DAP-1 составляет около 1,53 ккал/г, рассчитано на базе DFT (J. Am. Chem. Soc. 2012, 134, 1422), которое выше, чем эти значения для находящихся на вооружении энергетических материалов НМХ (1,26 ккал/г) и RDX (1,27 ккал/г). Энергетическая плотность составляет 3,11 ккал/см3, полученные путём превращения плотности кристалла при 223 К, что также выше, чем эти показатели для находящихся на вооружении энергетических материалов НМХ (2,38 ккал/см3) и RDX (2,29 ккал/см3). Согласно формуле Камлета-Джейкоба, DAP-1 имеет скорость детонации приблизительно 8,85 км/с, а давление детонации составляет около 37,31 ГПа, что сравнимо с соответствующими значениями находящихся на вооружении энергетических материалов (НМХ : скорость детонации 9,20 км/с, давление детонации 39,50 ГПа; RDX: скорость детонации 8,80 км/с, а давление детонации 33,80 ГПа).
Количество газа, образуемого DAP-1, на число молей
Для оценки продуктов, полученных при полном взрыве энергетического материала в бескислородной среде, в соответствии с документом (J. Am. Chem. Soc. 2012, 134, 1422; J. Phys. Chem. A. 2014, 118, 4575; Chem. Eur. J. 2016, 22, 1141), продукты конечного распада включают в себя газообразные вещества, такие как азот, галогеноводород, воду и диоксид углерода и твёрдые вещества, такие как хлориды металла и элементарный углерод (если атомов кислорода недостаточно для полного превращения все атомов углерода в диоксид углерода). Поэтому 1 моль DAP-1 может производить 12 молей газообразных веществ после полного взрыва в бескислородной среде, с 3 моль элементарного углерода и 1 моль твёрдого хлористого натрия в остатке. При условии, что достаточное количество окислителя (такого как широко применяющийся NH4CI04) смешивается, DAP-1 на моль дает 1 моль твёрдого осадка хлористого натрия после полного взрыва.
ВАРИАНТ ОСУЩЕСТВЛЕНИЯ 2 Синтез и испытание (C6H14N2)[K(ClO4)3]
Способ синтеза:
1) добавление 2,24 г 1,4-диазабицикло[2.2.2]октана в 100 мл воды, затем добавление 5,74 г раствора перхлорной кислоты с массовой долей 70-72 процента, и перемешивание смеси при нормальной температуре в течение 5 минут;
2) добавление 2,77 перхлорта калия в 100 мл воды, а затем нагревание и перемешивание смеси для растворения перхлорта калия.
3) смешивание растворов, полученных на шагах 1) и 2), перемешивание смеси в течение 30 минут, фильтрация смеси, промывка остаточных продуктов этанолом три раза и выполнение вакуумной сушки промытых остатков, чтобы получить белое порошковое твёрдое вещество, которое идентифицируется как соединение типа перовскита (C6H14N2)[K(ClO4)3] (No. DAP-2) с выходом приблизительно 90 процентов.

Испытание на определение характеристик монокристаллическои структуры:
Подробные данные испытания кристаллической структуры показаны в таблице 4.
Диаграмма идентификации порошковой рентгеновской дифракции: Диаграмма порошковой рентгеновской дифракции при комнатной температуре показана на фиг. 2, и значения её характеристических пиков приведены в таблице 3.

Характеризация термической стойкости DAP-2:
Термогравиметрическая кривая DAP-2 показана на фиг. 6. На фиг. 6 видно, что: при условии, что объём загружаемой пробы составляет 6,65 мг, а скорость нагрева составляет 5°С/мин, энергетическое соединение DAP-2 варианта осуществления 2 взрывается при 362°С.
Дифференциальная сканирующая калориметрия (DSC) DAP-2:
Кривая DSC DAP-2 показана на фиг. 7. На фиг. 7 видно, что: порошковое энергетическое соединение DAP-2 в ненагруженном состоянии варианта осуществления 2 распадается при 377°С и высвобождает большое количество теплоты (около 4076 Дж/г).
Определение характеристик чувствительности к ударным нагрузкам и трению
DAP-2:
В соответствии с методом испытания Федерального института исследования и испытания материалов (ВАМ), чувствительность к ударным нагрузкам DAP-2 составляет приблизительно 16 Дж, а чувствительность к трению составляет приблизительно 42 Н.
Значения теплоты детонации, давления детонации и скорости детонации энергетического соединения DAP-2 получены теоретически DFT:
Значение теплоты детонации (значение энтальпии распада *AHdet) DAP-2 составляет около 1,46 ккал/г, рассчитано на базе DFT (J. Am. Chem. Soc. 2012, 134, 1422), которое выше, чем эти значения для находящихся на вооружении энергетических материалов НМХ (1,26 ккал/г) и RDX (1,27 ккал/г). Энергетическая плотность составляет 3,01 ккал/см3, полученные путём превращения плотности кристалла при 223 К, что также выше, чем эти показатели для находящихся на вооружении энергетических материалов НМХ (2,38 ккал/см3) и RDX (2,29 ккал/см3). Согласно формуле Камлета-Джейкоба, DAP-2 имеет скорость детонации приблизительно 8,64 км/с, а давление детонации составляет около 35,73 ГПа.
Количество газа, образуемого DAP-2, на число молей
Для оценки продуктов, полученных при полном взрыве энергетического материала в бескислородной среде, в соответствии с документом (J. Am. Chem. Soc. 2012, 134, 1422; J. Phys. Chem. A. 2014, 118, 4575; Chem. Eur. J. 2016, 22, 1141), продукты конечного распада включают в себя газообразные вещества, такие как азот, галогеноводород, воду и диоксид углерода и твёрдые вещества, такие как хлориды металла и элементарный углерод (если атомов кислорода недостаточно для полного превращения все атомов углерода в диоксид углерода). Поэтому 1 моль DAP-2 может производить 12 молей газообразных веществ после полного взрыва в бескислородной среде, с 3 моль элементарного углерода и 1 моль твёрдого хлорида калия в остатке. При условии, что достаточное количество окислителя (такого как широко применяющийся NH4ClO4) смешивается, DAP-2 на моль дает 1 моль твёрдого осадка хлорида калия после полного взрыва.
ВАРИАНТ ОСУЩЕСТВЛЕНИЯ 3 Синтез и испытание (C6H14N2)[Rb(ClO4)3]
Способ синтеза:
1) добавление 2,24 г 1,4-диазабицикло[2.2.2]октана в 100 мл воды, затем добавление 5,74 г раствора перхлорной кислоты с массовой долей 70-72 процента, и перемешивание смеси при нормальной температуре в течение 5 минут;
2) добавление 3,70 перхлората рубидия в 100 мл воды, а затем нагревание и перемешивание смеси для растворения перхлорат рубидия;
3) смешивание растворов, полученных на шагах 1) и 2), перемешивание смеси в течение 30 минут, фильтрация смеси, промывка остаточных продуктов этанолом три раза и выполнение вакуумной сушки промытых остатков, чтобы получить белое порошковое твёрдое вещество, которое идентифицируется как соединение типа перовскита (C6H14N2)[Rb(ClO4)3] (No. DAP-3) с выходом приблизительно 85 процентов.
Испытание на определение характеристик монокристаллическои структуры:
Подробные данные испытания кристаллической структуры показаны в таблице 6.
Диаграмма идентификации порошковой рентгеновской дифракции: Диаграмма порошковой рентгеновской дифракции при комнатной температуре показана на фиг. 2, и значения её характеристических пиков приведены в таблице 5.

Характеризация термической стойкости DAP-3:
Термогравиметрическая кривая DAP-3 показана на фиг. 8. На фиг. 8 видно, что: при условии, что объём загружаемой пробы составляет 4,45 мг, а скорость нагрева составляет 5°С/мин, энергетическое соединение DAP-3 варианта осуществления 3 взрывается при 343°С.
Дифференциальная сканирующая калориметрия (DSC) DAP-3:
Кривая DSC DAP-3 показана на фиг. 9. На фиг. 9 видно, что: порошковое энергетическое соединение DAP-3 в ненагруженном состоянии варианта осуществления 3 распадается при 369°С и высвобождает большое количество теплоты (около 3797 Дж/г).
Определение характеристик чувствительности к ударным нагрузкам и трению
DAP-3:
В соответствии с методом испытания Федерального института исследования и испытания материалов (ВАМ), чувствительность к ударным нагрузкам DAP-3 составляет приблизительно 22 Дж, а чувствительность к трению составляет приблизительно 28 Н.
Значения теплоты детонации, давления детонации и скорости детонации энергетического соединения DAP-3 получены теоретически DFT:
Значение теплоты детонации (значение энтальпии распада *AHdet) DAP-3 составляет около 1,33 ккал/г, рассчитано на базе DFT (J. Am. Chem. Soc. 2012, 134, 1422), которое выше, чем эти значения для находящихся на вооружении энергетических материалов НМХ (1,26 ккал/г) и RDX (1,27 ккал/г). Энергетическая плотность составляет 2,92 ккал/см3, полученные путём превращения плотности кристалла при 223 К, что также выше, чем эти показатели для находящихся на вооружении энергетических материалов НМХ (2,38 ккал/см3) и RDX (2,29 ккал/см3). Согласно формуле Камлета-Джейкоба, DAP-3 имеет скорость детонации приблизительно 8,43 км/с, а давление детонации составляет около 35,14 ГПа.
Количество газа, образуемого DAP-3, на число молей
Для оценки продуктов, полученных при полном взрыве энергетического материала в бескислородной среде, в соответствии с документом (J. Am. Chem. Soc. 2012, 134, 1422; J. Phys. Chem. A. 2014, 118, 4575; Chem. Eur. J. 2016, 22, 1141), продукты конечного распада включают в себя газообразные вещества, такие как азот, галогеноводород, воду и диоксид углерода и твёрдые вещества, такие как хлориды металла и элементарный углерод (если атомов кислорода недостаточно для полного превращения все атомов углерода в диоксид углерода). Поэтому 1 моль DAP-3 может производить 12 молей газообразных веществ после полного взрыва в бескислородной среде, с 3 моль элементарного углерода и 1 моль твёрдого перхлорат рубидия в остатке. При условии, что достаточное количество окислителя (такого как широко применяющийся NH4ClO4) смешивается, DAP-3 на моль дает 1 моль твёрдого осадка перхлорат рубидия после полного взрыва.
ВАРИАНТ ОСУЩЕСТВЛЕНИЯ 4 Синтез и испытание (C6H14N2)[NH4(ClO4)3]
Способ синтеза:
1) добавление 2,24 г 1,4-диазабицикло[2.2.2]октана в 5 мл воды, затем добавление 5,74 г раствора перхлорной кислоты с массовой долей 70-72 процента, и перемешивание смеси при нормальной температуре в течение 5 минут;
2) добавление 2,35 г перхлората аммония в 10 мл воды, а затем перемешивание смеси при нормальной температуре для растворения перхлората аммония;
3) смешивание растворов, полученных на шагах 1) и 2), перемешивание смеси в течение 10 минут, фильтрация смеси, промывка остаточных продуктов этанолом три раза и выполнение вакуумной сушки промытых остатков, чтобы получить белое порошковое твёрдое вещество, которое идентифицируется как соединение типа перовскита (C6H14N2)[NH4(ClO4)3] (No. DAP-4) с выходом приблизительно 90 процентов.

Испытание на определение характеристик монокристаллической структуры:
Подробные данные испытания кристаллической структуры показаны в таблице 8.
Диаграмма идентификации порошковой рентгеновской дифракции: Диаграмма порошковой рентгеновской дифракции при комнатной температуре показана на фиг. 2, и значения её характеристических пиков приведены в таблице 7.

Характеризация термической стойкости DAP-4:
Термогравиметрическая кривая DAP-4 показана на фиг. 10. На фиг. 10 видно, что: при условии, что объём загружаемой пробы составляет 4,825 мг, а скорость нагрева составляет 5°С/мин, энергетическое соединение DAP-4 варианта осуществления 4 взрывается при 370°С.
Дифференциальная сканирующая калориметрия (DSC) DAP-4: Кривая DSC DAP-4 показана на фиг. 11. На фиг. 11 видно, что: порошковое энергетическое соединение DAP-4 в ненагруженном состоянии варианта осуществления 4 распадается при 364°С и высвобождает большое количество теплоты (около 5177 Дж/г).
Определение характеристик чувствительности к ударным нагрузкам и трению
DAP-4:
В соответствии с методом испытания Федерального института исследования и испытания материалов (ВАМ), чувствительность к ударным нагрузкам DAP-4 составляет приблизительно 23 Дж, а чувствительность к трению составляет приблизительно 36 Н.
Количество газа, образуемого DAP-4, на число молей
Для оценки продуктов, полученных при полном взрыве энергетического материала в бескислородной среде, в соответствии с документом (J. Am. Chem. Soc. 2012, 134, 1422; J. Phys. Chem. A. 2014, 118, 4575; Chem. Eur. J. 2016, 22, 1141), продукты конечного распада включают в себя газообразные вещества, такие как азот, галогеноводород, воду и диоксид углерода и твёрдые вещества, такие как элементарный углерод (если атомов кислорода недостаточно для полного превращения все атомов углерода в диоксид углерода). Поэтому 1 моль DAP-4 может производить 14,25 моль газообразных веществ после полного взрыва в бескислородной среде с 3,75 моль элементарного углерода в остатке. При условии, что достаточное количество окислителя (такого как широко применяющийся NH4ClO4) смешивается, DAP-4 не производит твёрдого остатка после полного взрыва.
ВАРИАНТ ОСУЩЕСТВЛЕНИЯ 5 Синтез и испытание (C6H14N2O2)[K(ClO4)3] Способ синтеза:
1) помещение 1,01 г 1,4-диазабицикло[2.2.2]октана в сосуд, постепенное добавление 6,0 г пероксида водорода с массовой долей 30 процентов для полной реакции, таким образом получая водный раствор 1,4-диазабицикло[2.2.2]октан 1,4-диоксид, затем добавление 2,64 г раствора перхлорной кислоты с массовой долей от 70 до 72 процентов, и перемешивание смеси в течение 20 минут;
2) добавление 0,42 г перхлорта калия в 20 мл воды, а затем нагревание смеси до её закипания и перемешивание смеси для растворения перхлорта калия;
3) смешивание растворов, полученных на шагах 1) и 2), перемешивание смеси в течение 10 минут и отстаивание смеси для постепенного образования кристаллов; фильтрация кристаллов и промывка остатков этанолом три раза; и выполнение вакуумной сушки промытых остатков, чтобы получить белое порошковое твёрдое вещество, которое
идентифицируется как соединение типа перовскита (С6H14N2O2)[K(ClO4)3] (DAP-O22) с
выходом приблизительно 55 процентов.
Диаграмма идентификации порошковой рентгеновской дифракции: Диаграмма порошковой рентгеновской дифракции при комнатной температуре
показана на фиг. 2, и значения её характеристических пиков приведены в таблице 9.
Испытание на определение характеристик монокристаллической структуры: Подробные данные испытания кристаллической структуры показаны в таблице 10.

Характеризация термической стойкости DAP-022:
Термогравиметрическая кривая DAP-022 показана на фиг. 12. На фиг. 12 видно, что: при условии, что объём загружаемой пробы составляет 4,175 мг, а скорость нагрева составляет 5°С/мин, энергетическое соединение DAP-022 варианта осуществления 5 распадается при 354°С.
Дифференциальная сканирующая калориметрия (DSC) DAP-022: Кривая DSC DAP-022 показана на фиг. 13. На фиг. 13 видно, что: порошковое энергетическое соединение DAP-022 в ненагруженном состоянии варианта осуществления 5 распадается при 358°С и высвобождает большое количество теплоты (около 5424 Дж/г).
Определение характеристик чувствительности к ударным нагрузкам и трению DAP-022:
В соответствии с методом испытания Федерального института исследования и испытания материалов (ВАМ), чувствительность к ударным нагрузкам DAP-022 составляет приблизительно 11 Дж, а чувствительность к трению составляет приблизительно 14 Н.
Количество газа, образуемого DAP-022, на число молей
Для оценки продуктов, полученных при полном взрыве энергетического материала в бескислородной среде, в соответствии с документом (J. Am. Chem. Soc. 2012, 134, 1422; J. Phys. Chem. A. 2014, 118, 4575; Chem. Eur. J. 2016, 22, 1141), продукты конечного распада включают в себя газообразные вещества, такие как азот, галогеноводород, воду и диоксид углерода и твёрдые вещества, такие как хлориды металла и элементарный углерод (если атомов кислорода недостаточно для полного превращения все атомов углерода в диоксид углерода). Поэтому 1 моль DAP-022 может производить 13 молей газообразных веществ после полного взрыва в бескислородной среде, с 2 моль элементарного углерода и 1 моль твёрдого хлорида калия в остатке. При условии, что достаточное количество окислителя (такого как широко применяющийся NH4ClO4) смешивается, DAP-022 на моль дает 1 моль твёрдого осадка хлорида калия после полного взрыва.
ВАРИАНТ ОСУЩЕСТВЛЕНИЯ 6 Синтез и испытание (C6H14N2O)[K(ClO4)3] Способ синтеза:
1) помещение 1,01 г 1,4-диазабицикло[2.2.2]октана в сосуд для непрерывного нахождения в ледяной ванне, постепенное и медленное добавление 2,0 г пероксида водорода с массовой долей 30 процентов, таким образом получая водный раствор 1,4-диазабицикло[2.2.2]октан 1-оксид, затем добавление 2,64 г раствора перхлорной кислоты с массовой долей от 70 до 72 процентов, и перемешивание смеси в течение 20 минут;
2) добавление 0,42 г перхлорта калия в 20 мл воды, а затем нагревание смеси до её закипания и перемешивание смеси для растворения перхлорта калия;
3) смешивание растворов, полученных на шагах 1) и 2), перемешивание смеси в течение 10 минут и отстаивание смеси для постепенного образования кристаллов;
фильтрация кристаллов и промывка остатков этанолом три раза; и выполнение вакуумной сушки промытых остатков, чтобы получить белое порошковое твёрдое вещество, которое идентифицируется как соединение типа перовскита (C6H14N2O)[K(ClO4)3] (DAP-O12) с выходом приблизительно 30 процентов.
График идентификации порошковой рентгеновской дифракции: График порошковой рентгеновской дифракции при комнатной температуре показана на фиг. 2, и значения её характеристических пиков приведены в таблице 11.

Количество газа, образуемого DAP-012, на число молей
Для оценки продуктов, полученных при полном взрыве энергетического материала в бескислородной среде, в соответствии с документом (J. Am. Chem. Soc. 2012, 134, 1422; J. Phys. Chem. A. 2014, 118, 4575; Chem. Eur. J. 2016, 22, 1141), продукты конечного распада включают в себя газообразные вещества, такие как азот, галогеноводород, воду и диоксид углерода и твёрдые вещества, такие как хлориды металла и элементарный углерод (если атомов кислорода недостаточно для полного превращения все атомов углерода в диоксид углерода). Поэтому 1 моль DAP-012 может производить 12,5 молей газообразных веществ после полного взрыва в бескислородной среде, с 2,5 моль элементарного углерода и 1 моль твёрдого хлорида калия в остатке. При условии, что
достаточное количество окислителя (такого как широко применяющийся NH4ClO4) смешивается, DAP-012 на моль дает 1 моль твёрдого осадка хлорида калия после полного взрыва.
ВАРИАНТ ОСУЩЕСТВЛЕНИЯ 7 Синтез и испытание (C6H14N2O2)[NH4(ClO4)3] Способ синтеза:
1) помещение 0,34 г 1,4-диазабицикло[2.2.2]октана в сосуд, постепенное и медленное добавление 0,69 г пероксида водорода с массовой долей 30 процентов при нормальной температуре, таким образом получая водный раствор 1,4-диазабицикло[2.2.2]октан 1,4-диоксид, затем добавление 0,86 г раствора перхлорной кислоты с массовой долей от 70 до 72 процентов, и перемешивание смеси в течение 20 минут;
2) добавление 0,41 г перхлорта калия в 20 мл воды, перемешивание смеси для растворения перхлорта калия;
3) смешивание растворов, полученных на шагах 1) и 2), перемешивание смеси в течение 10 минут и отстаивание смеси для постепенного образования кристаллов; фильтрация кристаллов и промывка остатков этанолом три раза; и выполнение вакуумной сушки промытых остатков, чтобы получить белое порошковое твёрдое вещество, которое идентифицируется как соединение типа перовскита (C6H14N2O2)[NH4(ClO4)3] (DAP-O24) с выходом приблизительно 30 процентов.
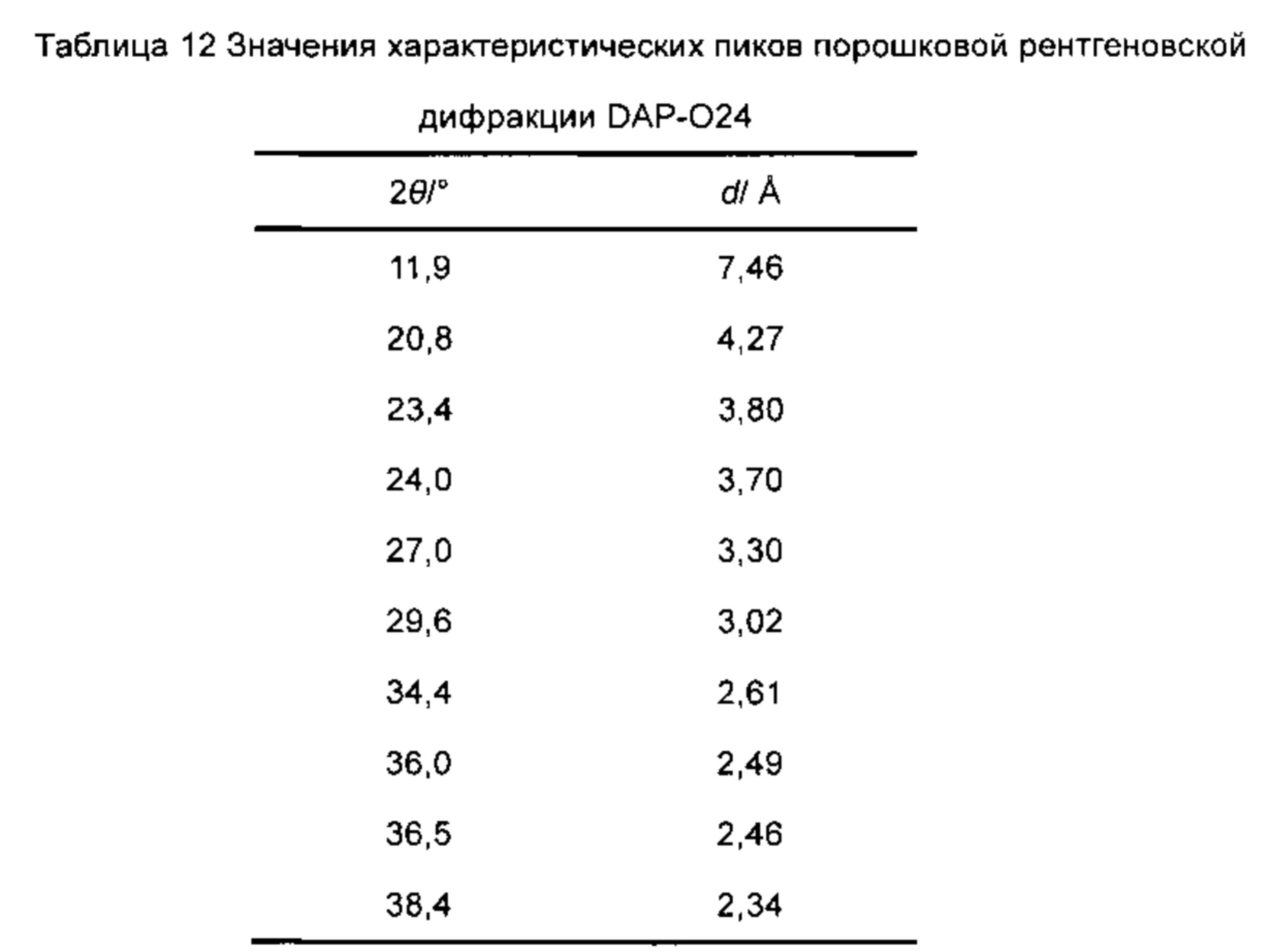
Диаграмма идентификации порошковой рентгеновской дифракции: Диаграмма порошковой рентгеновской дифракции при комнатной температуре показана на фиг. 2, и значения её характеристических пиков приведены в таблице 12.
Дифференциальная сканирующая калориметрия (DSC) DAP-024:
Кривая DSC DAP-024 показана на фиг. 14. На фиг. 14 видно, что: порошковое энергетическое соединение DAP-024 в ненагруженном состоянии варианта осуществления 7 распадается при 357°С и высвобождает большое количество теплоты (около 4632 Дж/г).
Определение характеристик чувствительности к ударным нагрузкам и трению DAP-024:
В соответствии с методом испытания Федерального института исследования и испытания материалов (ВАМ), чувствительность к ударным нагрузкам DAP-024 составляет приблизительно 4 Дж, а чувствительность к трению составляет приблизительно 32 Н.
Количество газа, образуемого DAP-024, на число молей
Для оценки продуктов, полученных при полном взрыве энергетического материала в бескислородной среде, в соответствии с документом (J. Am. Chem. Soc. 2012, 134, 1422; J. Phys. Chem. A. 2014, 118, 4575; Chem. Eur. J. 2016, 22, 1141), продукты конечного распада включают в себя газообразные вещества, такие как азот, галогеноводород, воду и диоксид углерода и твёрдые вещества, такие как элементарный углерод (если атомов кислорода недостаточно для полного превращения все атомов углерода в диоксид углерода). Поэтому 1 моль DAP-024 может производить 15,25 моль газообразных веществ
после полного взрыва в бескислородной среде с 2,75 моль элементарного углерода в остатке. При условии, что достаточное количество окислителя (такого как широко применяющийся NH4ClO4) смешивается, DAP-024 не производит твёрдого остатка после полного взрыва.
ВАРИАНТ ОСУЩЕСТВЛЕНИЯ 8 Синтез и испытание (C4H12N2)[Na(ClO4)3] Способ синтеза:
1) добавление 0,87 г пиперазина в 6 мл воды, затем добавление 1,7 г раствора перхлорной кислоты с массовой долей 70-72 процента, и перемешивание смеси при нормальной температуре в течение 5 минут;
2) добавление 1,24 г перхлората натрия в 7 мл воды, перемешивание смеси при нормальной температуре для растворения перхлората натрия;
3) смешивание растворов, полученных на шагах 1) и 2); нагрев смеси для её концентрирования; перемешивание концентрированной смеси в течение 30 минут, фильтрация смеси и промывка остаточных продуктов этанолом три раза и выполнение вакуумной сушки остатков, чтобы получить белое порошковое твёрдое вещество, которое идентифицируется как соединение типа перовскита (C4H12N2)[Na(ClO4)3] (No. РАР-1) с выходом приблизительно 50 процентов.
Диаграмма идентификации порошковой рентгеновской дифракции: Диаграмма порошковой рентгеновской дифракции при комнатной температуре показана на фиг. 15, и значения её характеристических пиков приведены в таблице 13.

Испытание на определение характеристик монокристаллической структуры:
Подробные данные испытания кристаллической структуры показаны в таблице 14.

Характеризации термической стойкости РАР-1:
Термогравиметрическая кривая РАР-1 показана на фиг. 16. На фиг. 16 видно, что: при условии, что объём загружаемой пробы составляет 2,23 мг, а скорость нагрева составляет 5°С/мин, энергетическое соединение РАР-1 варианта осуществления 8 взрывается при 367°С.
Дифференциальная сканирующая калориметрия (DSC) РАР-1:
Кривая DSC РАР-1 показана на фиг. 17. На фиг. 17 видно, что: порошковое
энергетическое соединение РАР-1 в ненагруженном состоянии варианта осуществления 8 распадается при 375°С и высвобождает большое количество теплоты (около 4685 Дж/г). Количество газа, образуемого РАР-1, на число молей
Для оценки продуктов, полученных при полном взрыве энергетического материала в бескислородной среде, в соответствии с документом (J. Am. Chem. Soc. 2012, 134, 1422; J. Phys. Chem. A. 2014, 118, 4575; Chem. Eur. J. 2016, 22, 1141), продукты конечного распада включают в себя газообразные вещества, такие как азот, галогеноводород, воду и диоксид углерода и твёрдые вещества, такие как хлориды металла и элементарный углерод (если атомов кислорода недостаточно для полного превращения все атомов углерода в диоксид углерода). Поэтому 1 моль РАР-1 может производить 11,5 моль газообразных веществ после полного взрыва в бескислородной среде, с 0,5 моль элементарного углерода и 1 моль твёрдого хлористого натрия в остатке. При условии, что достаточное количество окислителя (такого как широко применяющийся NH4ClO4) смешивается, РАР-1 на моль дает 1 моль твёрдого осадка хлористого натрия после полного взрыва.
ВАРИАНТ ОСУЩЕСТВЛЕНИЯ 9 Синтез и испытание (C4H12N2)[NH4(ClO4)3] Способ синтеза:
1) добавление 0,8 мл водного раствора аммиака в 0,9 мл раствора перхлорной кислоты с массовой долей 70-72 процента , перемешивание смеси при нормальной температуре в течение 5 минут, и затем добавление 1,6 мл раствора перхлорной кислоты с массовой долей 70-72 процента;
2) добавление нужного количества воды в 0,87 г пиперазина и перемешивание при нормальной температуре для растворения пиперазина;
3) смешивание растворов, полученных на шагах 1) и 2); нагрев смеси для её концентрирования; и перемешивание концентрированной смеси в течение 30 минут, фильтрация смеси и промывка остаточных продуктов этанолом три раза и выполнение вакуумной сушки промытых остатков, чтобы получить белое порошковое твёрдое вещество, которое идентифицируется как соединение типа перовскита (C4H12N2)[NH4(ClO4)3] (No. РАР-4) с выходом приблизительно 40 процентов.
Дифференциальная сканирующая калориметрия (DSC) РАР-4:
Кривая DSC РАР-1 показана на фиг. 18. На фиг. 18 видно, что: порошковое энергетическое соединение РАР-4 в ненагруженном состоянии варианта осуществления 9 распадается при 356°С (высвобожденная теплота составляет около 3780 Дж/г).
Количество газа, образуемого РАР-4, на число молей
Для оценки продуктов, полученных при полном взрыве энергетического материала в бескислородной среде, в соответствии с документом (J. Am. Chem. Soc. 2012, 134, 1422; J. Phys. Chem. A. 2014, 118, 4575; Chem. Eur. J. 2016, 22, 1141), продукты конечного распада включают в себя газообразные вещества, такие как азот, галогеноводород, воду и диоксид углерода и твёрдые вещества, такие как хлориды металла и элементарный углерод (если атомов кислорода недостаточно для полного превращения все атомов углерода в диоксид углерода). Поэтому 1 моль РАР-4 может производить 13,75 моль газообразных веществ после полного взрыва в бескислородной среде с 1,25 моль элементарного углерода в остатке. При условии, что достаточное количество окислителя (такого как широко применяющийся NH4ClO4) смешивается, РАР-4 на моль не производит твёрдого остатка после полного взрыва.
ВАРИАНТ ОСУЩЕСТВЛЕНИЯ 10 Синтез и испытание (C6H14N2)[K(NO3)3] Способ синтеза:
1) добавление 1,12 г 1,4-диазабицикло[2.2.2]октана в подходящее количество воды, затем добавление 1,4 мл раствора азотной кислоты с массовой долей 65 процентов, и перемешивание смеси при нормальной температуре в течение 5 минут;
2) добавление 1,01 г нитрата калия в необходимое количество воды и перемешивание смеси при нормальной температуре для растворения нитрата калия;
3) смешивание растворов, полученных на шагах 1) и 2), перемешивание и фильтрация смеси, промывка остаточных продуктов этанолом три раза и выполнение вакуумной сушки промытых остатков, чтобы получить белое порошковое твёрдое вещество, которое идентифицируется как соединение типа перовскита (C6H14N2)[K(NO3)3] (No. DAN-2) с выходом приблизительно 50 процентов.
Диаграмма идентификации порошковой рентгеновской дифракции:
Диаграмма порошковой рентгеновской дифракции при комнатной температуре показана на фиг. 19, и значения её характеристических пиков приведены в таблице 15.

Испытание на определение характеристик монокристаллической структуры:
Подробные данные испытания кристаллической структуры показаны в таблице 16.

Инфракрасное спектральное исследование DAN-2:
Инфракрасный спектр DAN-2 показан на фиг. 20. На фиг. 20 видно, что характеристические пики нитрогруппы являются асимметричным валентным колебанием 1385 см-1 и асимметричным изгибным колебанием 852 см-1.
Характеризация термической стойкости DAN-2:
Термогравиметрическая кривая DAN-2 показана на фиг. 21. На фиг. 21 видно, что: при условии, что объём загружаемой пробы составляет 3,33 мг, а скорость нагрева составляет 5°С/мин, энергетическое соединение DAN-2 варианта осуществления 10 начинает распадаться при 177°С.
Дифференциальная сканирующая калориметрия (DSC) DAN-2:
Кривая DSC DAN-2 показана на фиг. 22. На фиг. 22 видно, что: порошковое энергетическое соединение DAN-2 в ненагруженном состоянии варианта осуществления 10 постепенно распадается при 177°С (высвобожденная теплота составляет около 1222 Дж/г).
Определение характеристик чувствительности к ударным нагрузкам и трению DAN-2:
В соответствии с методом испытания Федерального института исследования и испытания материалов (ВАМ), чувствительность к ударным нагрузкам DAN-2 составляет приблизительно 29 Дж, а чувствительность к трению составляет приблизительно 360 Н.
ВАРИАНТ ОСУЩЕСТВЛЕНИЯ 11 Синтез и испытание (С6Н14N2)[NН4(NO3)3] Способ синтеза:
1) добавление 2,0 мл раствора азотной кислоты с массовой долей 65 процентов в 0,78 мл водного раствора аммиака с массовой долей 28 процентов, и перемешивание смеси при нормальной температуре;
2) добавление 1,14 г of 1,4-диазабицикло[2.2.2]октана в необходимое количество воды и перемешивание смеси при нормальной температуре для растворения 1,4-диазабицикло[2.2.2]октана;
3) смешивание растворов, полученных на шагах 1) и 2), перемешивание и фильтрация, промывка остаточных продуктов этанолом три раза и выполнение вакуумной сушки промытых остатков, чтобы получить белое порошковое твёрдое вещество, которое идентифицируется как гексагональное соединение типа перовскита (С6Н14N2)[NН4(NО3)3] (No. DAN-4) с выходом приблизительно 60 процентов.
Диаграмма идентификации порошковой рентгеновской дифракции:
Диаграмма порошковой рентгеновской дифракции при комнатной температуре показана на фиг. 23, и значения её характеристических пиков приведены в таблице 17.

Испытание на определение характеристик монокристаллической структуры:
Подробные данные испытания кристаллической структуры показаны в таблице 18.

Характеризация термической стойкости DAN-4:
Термогравиметрическая кривая DAN-4 показана на фиг. 24. На фиг. 24 видно, что: при условии, что объём загружаемой пробы составляет 6,48 мг, а скорость нагрева составляет 5°С/мин, энергетическое соединение DAN-4 варианта осуществления 11 начинает распадаться при 167°С.
Дифференциальная сканирующая калориметрия (DSC) DAN-4: Кривая DSC DAN-4 показана на фиг. 25. На фиг. 25 видно, что: порошковое энергетическое соединение DAN-4 в ненагруженном состоянии варианта осуществления
11 постепенно распадается при 170°С (высвобожденная теплота составляет около 1098 Дж/г).
Количество газа, образуемого DAN-4, на число молей
Для оценки продуктов, полученных при полном взрыве энергетического материала в бескислородной среде, в соответствии с документом (J. Am. Chem. Soc. 2012, 134, 1422; J. Phys. Chem. A. 2014, 118, 4575; Chem. Eur. J. 2016, 22, 1141), продукты окончательного распада включают в себя газообразные вещества, такие как азот и вода, и твёрдые вещества, такие как элементарный углерод (учитывая, что атомы кислорода предпочтительно объединяются с атомами водорода, образуя воду). Поэтому 1 моль DAN-4 может производить 12 молей газообразных веществ после полного взрыва в бескислородной среде с 6 молями элементарного углерода в остатке. При условии, что достаточное количество окислителя (такого как широко применяющийся NH4NO3) смешивается, DAN-4 на моль не производит твёрдого остатка после полного взрыва. В частности, без галогенных элементов DAN-4 не образует газ гидрогалогенида после взрыва, посредством чего снижаются характеристические сигналы в фактическом применении и уменьшается загрязнение окружающей среды.
Энергетическое соединение типа перовскита настоящей заявки отличается высокой теплотой детонации, высокой энергетической плотностью, высокой скоростью детонации, высоким давлением детонации, высокой безопасностью и исключительно низкой чувствительностью к к ударным нагрузкам, трению и электростатическому воздействию с характеристиками не-летучести, отсутствия распада и не-гигроскопичности. Соединение может готовиться в партиями из дешевого и готового сырья с помощью простого процесса синтеза, которые не дает побочных продуктов.
Энергетическое соединение типа перовскита настоящей заявки может производить некоторые эффекты, которые неожиданны в уровне техники, когда они используются как энергетические материалы, такие как взрывчатые вещества. Хотя анион перхлората является энергетическим лигандом, большинство содержащих перхлорат соединений в настоящее время не могут использоваться как практические энергетические материалы из-за различных недостатков (см. "High Energy Materials: Propellants, Explosives and Pyrotechnics", p. 28, Jai Prakash Agrawal, Wiley-VCH Press, 2010). Например, обычные соли перхлората, такие как перхлорат натрия и перхлорат лития являются высоко
гигроскопичными по своей природе, и перхлорат калия использовался как прооксидант для осветительных бомб, но позже было обнаружено, что он имеет высокую чувствительность к ударному воздействию и легко взрываются при транспортировке. Теоретическая теплота детонации перхлората аммония, которые все ещё классифицируется как взрывчатое вещество, составляет только 1972 Дж/г, что гораздо ниже уровня теплоты детонации энергетического соединения настоящей заявки. Однако даже если соединение типа перовскита настоящей заявки содержит такие взрывчатые лиганды, он может тем не менее сохранять превосходную термическую стойкость и свойство негигроскопичности, что делает его высоко безопасным и простым в хранении энергетическим материалом. В то же время из-за богатых энергетических лигандов, попеременно расположенных окислительных энергетических анионов и восстановленных органических катионов в пространстве, высокой плотности кристалла, мощной мгновенной взрывной способности, высокой энергетической плотности и высокой теплоты детонации энергетическое соединение типа перовскита, как взрывчатые вещества, сделало большой скачок в эффективности по сравнению с уровнем техники.
Вышеупомянутые варианты осуществления являются предпочтительными вариантами реализации настоящей заявки, но варианты реализации настоящей заявки не ограничиваются вышеупомянутыми вариантами осуществления. Любые другие вариации, модификации, замены, комбинации и упрощения, сделанные без отклонения от сущности и теории настоящей заявки все должны быть эквивалентными вариантами замены и подпадают в область защиты настоящей заявки.
Реферат
Изобретение относится к области энергетических соединений, и в частности относится к использованию соединения, имеющего кристаллическую структуру типа перовскита АВХ, как энергетического материала. Структурные характеристики соединения, такие как попеременно расположенные окислительные анионы и восстановительные органические катионы в пространстве, наделяют соединение высокой эффективностью мгновенного высвобождения энергии при детонации. Трехмерная структура позволяет соединению не только иметь эффект энергетического материала, но также преодолевать недостатки существующих энергетических материалов. Высокая стабильность такого соединения позволяет получить высоко безопасный энергетический материал с высокой эффективностью детонации и высокой энергетической плотностью. 2 н. и 40 з.п. ф-лы, 25 ил., 18 табл., 11 пр.
Формула





Комментарии