Катализатор и способ получения метилэтилкетона - RU2275960C1
Код документа: RU2275960C1
Описание
Изобретение относится к области основного органического синтеза, а именно к способу получения метилэтилкетона (МЭК=СН3СОС2Н5) каталитическим окислением н-бутенов кислородом, а также к катализаторам для его осуществления.
Вследствие исключительно высокой растворяющей способности метилэтилкетон (МЭК) находит широкое промышленное применение. Его используют в производстве полиуретановых лаков, служащих для покрытия магнитных лент компьютеров, инструмента, аудио- и видеокассет, является лучшим депарафинизатором смазочных масел, обеспечивая их морозостойкость, является растворителем в производстве пенопластов, различных красок, эпоксидных и глифталевых смол, полихлорвинила, искусственной кожи, служит основой топографических красок и чернил для печатания.
МЭК используют в качестве сырья при получении метилизопропил-кетона, 2,3-бутандиона, оксима метилэтилкетона, предотвращающего образование пленок при хранении масляных красок. Используют для получения этилакриловой и изомерных метилкротоновых кислот, антиоксидантов резин, для пластификации нитроцеллюлозы, используемой в производстве бездымных порохов, находит применение как растворитель для пленочных покрытий таблеток и капсул лекарств, как реагент и экстрагент во многих фармацевтических производствах. Пероксид МЭК`а является инициатором полимеризации ненасыщенных полиэфиров в производстве армированных пластиков.
В промышленном масштабе МЭК получают несколькими способами. Один из них основан на жидкофазном свободнорадикальном окислении н-бутана по схеме (1). В этом способе выход МЭК не превышает 23%, основной же продукт - уксусная кислота. Побочно образуется большое количество отходов, которые сжигаются.

Достоинством этого способа является дешевизна исходного сырья, а недостатком - обилие побочных продуктов, сильно осложняющих и удорожающих процесс выделения МЭК.
Основным промышленным способом синтеза МЭК является трехстадийная переработка бутиленовой фракции, являющейся отходом производства дивинила на заводах синтетического каучука. Способ отличается дешевизной сырья; он включает реакции (2)-(4):



Из них реакции (2) и (3) - жидкофазные, а реакция (4) - гетерогенная каталитическая, а в некоторых вариантах - жидкофазная. Недостатками этого способа являются: обилие вредных необезвреживаемых отходов в виде загрязненной кислыми гудронами серной кислоты; высокая коррозионная активность среды в реакциях (2) и (3); высокая энергоемкость реакции (4); сложность процесса отделения МЭК от многочисленных примесей.
Разновидностью этого способа является процесс, в котором вместо H2SO4 используют уксусную кислоту, а промежуточным продуктом является втор-бутилацетат:


Катализатором стадий (2а) и (3а) служит сульфокатионит, который быстро забивается смолами и потому имеет малый срок службы. Использованный сульфокатионит также является необезвреживаемым отходом производства, серьезно ухудшающим его экологию.
В последнее время были предложены и другие кислые катализаторы этих стадий, например безванадиевые гетерополикислоты [Cai Tianxi, Huang He, Lin Jinlong, He Min, Zhang Suofang, Li Luhui // Shiyou Huagong, 1988, V.17, N.9, P.565-567], однако, они не обеспечивают существенного улучшения способа. Во втор-бутилацетатном способе получения МЭК (2а)+(3а)+(4) отходов стало меньше, чем в сернокислотном. Недостатком его стала неэкономичность, вызванная большими капиталовложениями и текущими затратами на единицу продукции из-за коррозионных свойств водной уксусной кислоты.
В последние годы предпринимались многократные попытки создания новых технологий получения МЭК из н-бутенов. Об этом свидетельствуют многочисленные патенты. Наибольший интерес из них представляют два новых способа: трехстадийный, включающий реакции (5)-(7) с промежуточным получением гидроперекиси втор-бутилбензола [Пат. США 5304684, 1994], и прямое окисление н-бутенов по реакции (8).



Трехстадийный способ основан на реакциях, подобных используемым в современном промышленном способе получения фенола и ацетона через гидроперекись кумола. Однако получение и разложение гидроперекиси втор-бутилбензола на стадиях (6) и (7) протекает с меньшей избирательностью, чем получение и разложение гидроперекиси кумола. В реакциях (6) и (7), наряду с МЭК и фенолом, образуются карбоновые кислоты, их эфиры, альдегиды, непредельные кетоны, смолы. Побочные продукты удаляют щелочью, что существенно ухудшает экологию производства. Способ (5)-(7) мог стать перспективным для промышленности при условии существенного повышения избирательности на стадиях (6) и (7) получения и разложения гидроперекиси втор-бутилбензола.
В одностадийном способе получения МЭК гомогенная каталитическая реакция (8) аналогична реакции ваккеровского окисления этилена в ацетальдегид [Jira R., Freiesleben W. // in: Organometallic Reactions / Ed.: E.I.Becker, M.Tsutsui. Vol.3 - New York et al.: Wiley Intersci., 1972 - P.1 - 190]:

Реакцию (8) можно проводить в одном реакторе, подавая в него стехиометрическую смесь н-C4H8:O2=2:1, которая прежде считалась невзрывоопасной [Справочник химика. 2-е изд. Дополнительный том. - Л.: Химия, 1968 - С.434]. Однако для улучшения селективности и снижения степени риска реакцию следует проводить в две стадии: 1) взаимодействие н-бутилена с раствором промежуточного обратимо действующего окислителя Ох в присутствии соли палладия по уравнению (9); 2) регенерация Ох кислородом по уравнению (10):


В качестве Ох использовали хлорную медь CuCl2 [Jira R., Freiesleben W., см. выше], восстановленная форма которой - ион CuCl2- - легко окисляется кислородом. Однако синтез МЭК по реакции (9) в присутствии хлоридной системы (PdCl2+CuCl2) сопровождался образованием большого количества побочных хлорбутанонов (до 25%). В отсутствии Cl-- ионов или при их недостатке ([Cl-]:[Cu2+]<5) медь вообще не способна служить обратимым окислителем. Поэтому для окисления н-бутиленов такая система оказалась совершенно непригодной.
В изобретениях [SU 700973, B 01 J 23/44, 1994; 822417, B 01 J 23/44, 1994; 1669109, B 01 J 23/44, 1994] впервые было предложено использовать в качестве обратимого окислителя (Ох) Mo-V-фосфорные гетерополикислоты структуры Кеггина, имеющие общую формулу H3+nPVnMo12-nO40, обозначенные нами через ГПК1. С их участием бутиленовая реакция описывалась уравнением (9а), а кислородная - уравнением (10а):
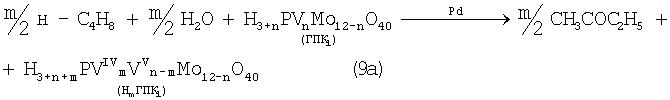

В этом способе (Ох=ГПК1) каталитическая система (PdII+ГПК1) не содержала Cl--ионов и потому обеспечивала полное отсутствие хлорорганических соединений в продуктах реакции. Избирательность системы достигала 95÷98%, а активность в бутиленовой реакции (9а) в 100 раз превышала активность хлоридной системы (PdCl2+CuCl2). Каталитическая система (Pd+ГПК1 ) могла успешно использоваться как для окисления стехиометрической смеси н-С4Н8:O2=2:1 в МЭК (одностадийный вариант), так и для проведения реакций (9а) и (10а) в разных реакторах (двухстадийный вариант). Последний вариант исключал контакт кислорода или воздуха с бутенами и с МЭК`ом и обеспечивал безопасность производства. Однако в последнем случае происходило глубокое восстановление молекул ГПК1. Это приводило к значительным изменениям химического состава и свойств как ионов Pd2+, так и самих молекул ГПК1. Этот вариант нестационарного катализа оказался связанным со снижением устойчивости каталитической системы (Pd+ГПК1).
Устойчивость катализатора в отношении ионов Pd2+ и
молекул ГПК1 по-разному зависела от числа атомов V в молекуле ГПК1 (n) и от отношения m:n,(m - степень восстановления молекулы ГПК1). При малых значениях n(1≤
n≤3) и m≈n неустойчивым оказывался палладий, который выделялся на поверхности восстановленного раствора в виде тонких зеркальных пленок, прилипавших к стенкам реактора. При большом числе
атомов ванадия (4
За последние 30 лет было предпринято много попыток стабилизировать палладий в катализаторе (Pd+ГПК1), однако, все они по разным причинам оказались неприемлемыми для технологии. Простейший способ удержать Pd2+ в растворе введением малых концентраций Cl--ионов, соответствующих атомным отношениям Cl-:Pd=5÷50, был предложен в патенте фирмы Catalytica Inc. (США) [Заявка WO 91/13852, 19.09.1991]. Однако даже при таких концентрациях хлор из раствора катализатора быстро переходил в продукты реакции с образованием хлорорганических соединений. Для поддержания стабильности палладия в катализатор приходилось непрерывно добавлять соляную кислоту и одновременно из продуктов реакции удалять и обезвреживать хлорорганические соединения. Поэтому "малохлоридный катализатор" (PdCl2+ ГПК1) также не нашел промышленного применения.
Использование палладия в виде комплексов с пиридинкарбоновыми кислотами (α-пиколиновой или дипиколиновой) повышает его стабильность [SU 1584200, B 01 J 23/44, 1994; 1669109, B 01 J 23/44, 1995]. Однако при этом в 10 и более раз снижается активность катализатора в реакции (9а), и падает его производительность. Это происходит потому, что комплекс Pd с производными пиридина оказывается слишком прочным, и он чрезмерно стабилизирует палладий в высшей степени окисления (Pd2+). Поэтому такой способ оказался нетехнологичным.
В изобретении [Пат. Японии 07-149685, 1995] катализаторы (Pd+ГПК1) использовались в смешанных растворителях, содержащих менее 50% воды. В качестве таковых использовались диоксан, этанол, тетрагидрофуран, γ-бутиролактон или сульфолан. Реакцию (8) проводили одностадийно: растворенный α-бутен при 80°С и давлении O2 9 кг/см2 окислялся в МЭК. Устойчивость палладия обеспечивалась тем, что реакции (9а) и (10а) протекали одновременно (в одном реакторе). Однако конверсия α-бутена в МЭК была невелика: 21% за час в водном диоксане и 14% в водном этаноле. В остальных растворителях она была еще меньше. Этот способ нетехнологичен и небезопасен. Идея использования неводных растворителей для реакции (8) оказалась неперспективной, поскольку эта реакция протекает через стадии (9а) и (10а), в которых вода является сокатализатором реакции (8), и понижение ее содержания резко снижает скорость реакции.
Эта же причина позволяет понять малую активность в реакции (8) гетерогенизированных катализаторов (Pd+ГПК1), нанесенных на твердый носитель [Stobbe-Kreemers A.W., van der Zon M., Makkee M., Scholten J.J.F. // J. Molec. Cat., A: Chem. - 1996 - V.107 (1-3) - P.247-253]. При применении таких катализаторов использовалась не жидкая вода, которая необходима, а водяной пар, который мог давать воду, только конденсируясь в порах носителя. Поэтому стадия (9а), состоящая из этапов (9а`) и (9а''), в гетерогенном варианте реакции (8) протекала очень медленно.
Существенным недостатком известных методов синтеза МЭК на катализаторах (Pd+ГПК) оказался неучет влияния продуктов коррозии аппаратурных материалов на эксплуатационные свойства катализатора. Неучет обусловливался тем, что в прежних разработках в качестве аппаратурного материала намечалось использовать титан, который не корродирует при контакте с катализатором (Pd+ГПК). Однако, исходя из требований технологии, возникла необходимость контактировать катализатор со многими частями арматуры, которые требовалось изготовить из спецсталей.
Наш эксперимент показал, что водные растворы Mo-V-фосфорных гетерополикислот (ГПК), составляющие катализатор (Pd+ГПК), обладают высокой коррозионной активностью в отношении большинства спецсталей. Лишь немногие спецстали оказались достаточно коррозионно-стойкими, пригодными для аппаратуры, контактирующей с катализатором (Pd+ГПК). Однако продукты их коррозии (Me=Fe2+(3+), Cr3+, Ni2+) отрицательно влияли на реакционную способность и устойчивость катализатора.
Главным и наиболее сильно действующим загрязнителем оказались ионы железа Fe3+. В концентрациях [Me]≤0,05 М продукты коррозии снижали реакционную способность и устойчивость молекул ГПК, а также уменьшали устойчивость комплекса Pd0·Pc. Снижение реакционной способности молекул ГПК1 проявлялось в замедлении на 15÷20% скорости кислородной реакции, а уменьшение устойчивости - в выпадении из окисленной формы катализатора (при 190°С в процессе кислородной реакции) ванадийсодержащих осадков с ионами железа. Снижение устойчивости палладия в присутствии Me проявлялось в постепенном выпадении палладиевой черни из восстановленной формы катализатора (при 60÷100°С после бутиленовой реакции).
Ионы железа в концентрациях 0≤ [Fe3+]≤0,06 М попадали в катализатор вместе с сырьем (V2O5 х.ч.) еще на стадии его приготовления. Процесс коррозии спецсталей повышал концентрацию Fe3+-ионов и приводил к осадкообразованию. Поэтому предельно допустимое содержание продуктов коррозии Me, при котором катализатор (Pd+ГПК) должен устойчиво работать, удалось ограничить пределами 0≤[Me]≤0,1 М. В этом интервале концентраций Me осадкообразование из окисленной формы катализатора удалось исключить введением в молекулу ГПК небольших добавок ионов натрия и увеличением в ней содержания фосфора. Последняя мера также обеспечивала повышение стабильности восстановленной формы молекулы ГПК. В результате был разработан новый патентоспособный состав (Pd· Рс+ГПК-7Р4), описанный ниже.
Прототипом предлагаемого способа и катализатора получения МЭК является способ [SU 1584200, B 01 J 23/44, 1994], в котором в качестве катализатора используют водный раствора соли палладия, производного пиридина и кислой соли молибдованадофосфорной гетерополикислоты (ГПК1). Реакцию окисления проводят путем взаимодействия катализатора с н-бутиленом при температурах 50-70°С, а после отделения метилэтилкетона окисляют восстановленную форму катализатора кислородом или воздухом при температуре 130-160°С (двухстадийный вариант). В этом способе реакция (8) по-прежнему осуществляется в условиях нестационарного катализа. От глубины и скорости изменений химического состава, окислительных и других физико-химических свойств катализатора зависят его производительность и устойчивость на каждой стадии реакции (8). Оптимизация МЭК-технологии требует, чтобы изменения состава и свойств катализатора при протекании обеих стадий (9а) и (10а) были быстрыми, глубокими и обратимыми. Однако из-за выпадения осадков на стадии (9а) требование обратимости нарушается в отношении как палладия, так и молекул ГПК1 структуры Кеггина. Выпадение палладия в бутиленовом реакторе с неполным возвращением его в раствор в воздушном реакторе (нестабильность палладия) является недостатком каталитической системы (Pd+ ГПК1). Еще более серьезным ее недостатком является нестабильность молекул ГПК1, обусловленная потерей ими части ванадия, выпадавшего в осадок на стадии (9а) и не возвратившегося в раствор на стадии (10а).
Изобретение решает задачу увеличения эффективности процесса за счет повышения стабильности компонентов катализатора (Pd+ГПК), что обеспечит его технологичность, а также позволит значительно повысить производительность катализатора и его активность в обеих реакциях.
Задача решается составом катализатором получения метилэтилкетона окислением н-бутенов кислородом и/или кислородсодержащим газом, который состоит из водного раствора ГПК-7Р4 - молибдованадофосфорной гетерополикислоты или смеси гетерополикислоты и/или ее соли, а также палладия с молярной концентрацией 5 · 10-4 ÷ 1 · 10-2, стабилизированного фталоцианиновым лигандом Рс при мольном отношении [Pd]:[Pc]=0,5÷2. Используют Mo-V-фосфорную ГПК-7Р4 состава H11P4Mo18V7O87 или ее кислую натриевую соль состава Na1,2H9,8P4Mo18V7O87 при концентрации ванадия в водном растворе 0,4-2,2 грамм-атома на литр.
Задача решается также способом получения метилэтилкетона МЭК путем каталитического окисления н-бутенов с использованием катализатора, который состоит из водного раствора ГПК-7Р4-молибдованадофосфорной гетерополикислоты (7 - число атомов ванадия в молекуле ГПК-7, содержащей 4 атома фосфора) или смеси гетерополикислоты и/или ее соли, а также палладия с концентрацией 5·10-4÷1·10-2 М, стабилизированного фталоцианиновым лигандом Рс при мольном отношении [Pd]:[Рс]=0,5÷2. Используют ГПК-7Р4 состава H11P4Mo18V7 O87 или ее кислую натриевую соль состава Na1,2H9,8P4Mo18V7O87 при концентрации ванадия в водном растворе 0,4-2,2 грамм-атома на литр.
Способ окисления н-бутенов в МЭК осуществляют непрерывно в двухстадийном режиме, в котором реакцию окисления н-бутенов ведут в интервале температур 15÷ 90°С, а регенерацию катализатора проводят путем взаимодействия его с кислородом или кислородсодержащим газом в интервале температур 140÷190°С при давлении кислорода 1÷10 ата.
Основным отличием предлагаемого способа синтеза МЭК на катализаторе (Pd+ГПК-7Р4) является то, что были использованы гетерополикислота ГПК-7Р4 нового состава и новые методы стабилизации компонентов катализатора (различные для палладия и ванадия). Новый состав ГПК-7Р4 и новые методы стабилизации были найдены нами в результате анализа причин нестабильности системы (Pd+ГПК1) в присутствии продуктов коррозии аппаратурных материалов, а также на основе исследований кинетики и механизма реакций (9а) и (10а).
Для устранения недостатков известных катализаторов (Pd+ ГПК1) и для создания катализатора с высокой производительностью и устойчивостью ион палладия был стабилизирован комплексообразованием с фталоцианиновым лигандом Рс, а молекулы ГПК1 кеггиновской структуры заменены молекулами ГПК-7Р4 некеггиновского состава. В результате получен новый катализатор (Pd· Pc+ГПК-7P4).
Предлагаемые катализаторы на основе ГПК-7Р4 готовят способом, аналогичным известному [SU 1782934, С 01 В 25/16, 1992].
Такие катализаторы имеют высокую гидролитическую устойчивость и не дают осадков при проведении стадий (9a1), (9a2) и (10а) реакции (8) в условиях промышленного использования катализатора (Pd·Рс+ГПК-7Р4). Активность и производительность катализаторов в широких пределах можно регулировать тремя способами: а) изменениями концентрации ГПК-7Р4 или ее кислых солей; б) вариациями концентраций комплекса Pd·Pc; 3) регулированием температуры реакции (9а).
Для контроля степени восстановления катализатора (или степени его окисленности) впервые использован метод измерения окислительного потенциала (Е) контактного раствора. Найденное значение Е (относительно нормального водородного электрода) сравнивается с полученной заранее кривой зависимости Е от m для катализатора, где m - это степень восстановления молекулы ГПК-7Р4 (m=[V(IV)]/[ГПК-7Р4]). По значению Е находят текущее значение m. В приведенных таблицах примеров имеется отдельная графа, где приведены значения Е окисленных растворов катализаторов. По ним судят о том, насколько хорошо регенерирован катализатор, так как от этого зависит его производительность.
Отличием предлагаемого катализатора является высокая концентрация ванадия (0,4-2,2 грамм-атом на литр), приводящая к повышению производительности катализатора с обеспечением его стабильности.
Следующим отличием способа получения метилэтилкетона является то, что регенерируют катализатор взаимодействием с кислородом или/и кислородсодержащим газом, а повышение производительности способа обеспечивается более высокой температурой регенерации (до 190°С) и парциальным давления кислорода (PO2) до 10 ата.
Другим отличием является то, что бутиленовую реакцию проводят и при более низких, чем в способе-прототипе, температурах (от +15°С), поскольку катализатор (Pd·Pc+ГПК-7P4) обладает значительно большей активностью, чем катализатор способа-прототипа, где палладий стабилизирован дипиколиновой кислотой.
Предлагаемый катализатор (Pd· Рс+ГПК-7Р4) обладает существенно меньшей коррозионной активностью в отношении спецсталей, из которых могут быть изготовлены узлы установки синтеза МЭК, а также значительно меньшей чувствительностью к продуктам коррозии этих сталей (Me=Fe3+, Cr3+, Ni2+), он не снижает своей стабильности в присутствии [Me]≤0,1 М.
Ниже приведен способ синтеза катализатора (Pd·Рс+ГПК-7Р4), а также даны примеры, иллюстрирующие сущность изобретения.
Все катализаторы, описанные в примерах 1-8, готовят известным способом [SU 1782934, С 01 В 25/16, 1992]. Вначале синтезируют раствор ГПК или ее кислой соли заданного состава и заданной концентрации, исходя из стехиометрических количеств компонентов Н3Р04, МоО3 и V2O5. Затем в полученный раствор вводят навески PdCl2 и фталоцианина.
Пример синтеза 250 мл ГПК состава Na1,2H9,8P4Mo18V7087 с концентрацией 0,23 М.
Расчет количеств исходных компонентов ведут по уравнению:
4H3PO4+18MoO3+3,5V2O5+0,6Na2CO3→
→Na1,2H9,8P4Mo18 V7O87+0,6CO2+1,1H2O
Используют 149,04 г МоО3 х.ч., 36,63 г V2O5 х.ч., 3,66 г Na2СО3, 32,02 мл 7,183-молярного раствора Н3PO4 и 30%-ную Н2O2 ос.ч. Растворение реагентов проводят в четыре этапа:
1) 149,04 г МоО3+3,66 г Na2CO3 +19,02 мл Н3PO4+1500 мл Н2O+2 мл Н2O2
2) 12,63 г V2O5+700 мл Н2 O+50 мл Н2O2+5,0 мл Н3PO4
3) 12,00 г V2O5+700 мл Н2O+50 мл Н2O2+4,0 мл Н3 PO4
4) 12,00 г V2O5+700 мл Н2O+50 мл Н2O2+4,0 мл Н3PO4
Для растворения МоО3 в коническую 3-литровую колбу загружают всю навеску МоО3, 1,5 л дистиллированной воды, 3,66 г Na2СО3, 19,02 мл Н3PO4, 2 мл 30%-ной Н2O2 х.ч. Полученную смесь кипятят (она приобретает соломенно-желтую окраску) и постепенно упаривают до ˜0,8 л. В кипящую смесь последовательно вводят растворы, полученные, как описано ниже, растворением V2O5 в воде в присутствии Н2O2 и Н3PO4. Каждую последующую порцию раствора V2O5+Н3PO4 вводят после упаривания смеси в колбе до ˜1 л.
Для операции 2) - растворения V2O5 - в 1-литровый стакан загружают 12,63 г V2O5, 0,7 л дистиллированной воды и 50 мл Н2О2. Полученную смесь перемешивают при +15÷20°С (не выше) в течение 10÷15 мин до получения темно-красно-коричневого раствора. Еще до растворения V2O5 к смеси (при перемешивании) добавляют 5 мл Н3PO4 и ожидают прекращения выделения O2, образующегося за счет разложения перекисных комплексов ванадия. Полученный красно-коричневый (почти черный) прозрачный раствор переливают в колбу с кипящей суспензией МоО3+Н3 PO4 и упаривают до ˜1 л.
Аналогично проводят операцию 3) - растворение V2O5 и добавление полученного раствора к суспензии МоО3+V2O5+Н3PO4. Эту смесь кипятят и упаривают до объема ˜1 л, после чего проводят операцию 4), совпадающую с операцией 3). Объединенный раствор упаривают до ˜400 мл. Растворение МоО3 контролируют визуально: после прекращения перемешивания и стояния на дне колбы не должно оставаться белого осадка МоО3.
Полученный раствор ГПК фильтруют через бумажный фильтр с красной полосой и фильтр промывают водой. Если осадок на фильтре превышает 2% от массы исходной V2O5, то его вместе с фильтром обрабатывают в стакане 5÷10%-ной Н2O2 (˜150 мл). Раствор кипятят до полного разложения Н2О2, остатки фильтра отделяют и фильтрат присоединяют к объединенному раствору ГПК с промывными водами. Готовый раствор упаривают до 250 мл.
Раствор H11P4Mo18V7O87 готовят аналогично. При этом синтез ведут без добавления Na2CO3 по уравнению: 4 Н3PO4+18 МоО3+3,5 V2O5→H911P4 MO18V7O87+0,5 Н2O.
Катализаторы для опытов, содержащие ГПК, PdCl2 и фталоцианин, обычно готовят в количестве 20 мл. Например, для получения катализатора состава [Na1,2H9,8P4Mo18V7O87]=0,23 М, [Pd2+]=6·10-3 М с мольным соотношением [Pc]:[Pd2+]=1:1 в раствор 0,23 М ГПК вводят навески 0,0212 г PdCl2 и 0,096 г фталоцианина. Раствор нагревают и кипятят 8-10 мин до полного растворения навесок. Затем раствор охлаждают и доводят его объем до 20 мл.
Пример 1. В реактор типа "каталитическая утка" на 120 мл, закрепленный на качалке, вливают 20 мл раствора катализатора состава: [H11 P4Mo18V7O87]=0.25 М, [Pd+2]=6·10-3 М мольное отношение [Pc]:[Pd]=1.5. Реактор термостатируют при 60°С, при атмосферном давлении продувают его 10-кратным объемом α-бутилена состава, %: α-С4Н8 - 96,3, сумма цис- и транс-β-C4H8 - 1,4, н-бутан - 2,2, тяжелые примеси - 0,1. Соединяют реактор с бюреткой, заполненной α-бутиленом, и при интенсивном встряхивании реактора проводят окисление C4H8 по реакции (9). За 32 мин раствор катализатора окисляет 325 мл α-бутилена (m=5,24


Примеры 2-3 (по аналогу - RU 2230612).
В первом варианте разработанного нами катализатора (Pd·Pc+ГПК-7) мы остановились на составе ГПК-7=Н10Р3Мо18V7O84. Катализатор обладает хорошими показателями активности в бутиленовой и кислородной реакциях (пример 2, см. табл.1), однако, в процессе исследований коррозионных свойств этого катализатора было установлено, что продукты коррозии спецсталей (Me=Fe3+, Ni2+, Cr3+) существенным образом снижают его стабильность и каталитическую активность. Показано, что наибольшее влияние на катализатор оказывают катионы Fe3+. Это влияние иллюстрирует пример 3 (табл.2).
Пример 2. По примеру 1, отличающемуся тем, что в качестве катализатора используют [Н10Р3Мо18V7O84 ]=0.25 М, [Pd+2]=6·10-3 М при мольном отношении [Pc]:[Pd]=1.5. Катализатор испытывают в 5 циклах (табл.1). Избирательность его была стабильной 98-99%. Металлический палладий в процессе испытаний не появляется.
Пример 3. По примеру 2, отличающемуся тем, что в качестве катализатора используют [Fe0.2Н9.4Р3Мо18V7O84]=0.25 М. Катализатор также испытан в 5 циклах (табл.2). Избирательность его была 98-98.5%, однако, в процессе испытаний восстановленный раствор выделял заметное количество металлического палладия, а окисленный катализатор постепенно выделяет ванадийсодержащие осадки. Активность катализатора монотонно снижается.
Сравнивая примеры 2 и 3, можно видеть, что введение катионов железа в раствор катализатора (Pd+ГПК-7) ухудшает его активность в отношении бутилена, а также его стабильность как в восстановленном, так и в окисленном состоянии.
Примеры 4-8.
Недостаточную устойчивость восстановленной формы катализатора на основе Н10Р3Мо18V7O84 удалось устранить использованием ГПК-7 нового состава - H11P4Mo18V7O87 (ГПК-7Р4), в молекуле которой содержится четыре атома фосфора. Однако еще более эффективным оказался катализатор на основе кислой натриевой соли этой ГПК (см. пример 4), поскольку дозированное введение катиона Na+ позволяет увеличить стабильность ванадия также и в окисленной форме катализатора.
Катализатор (Pd+ГПК-7Р4) нового состава, где ГПК-7Р4 является кислой солью H11P4Mo18V7 O87, отвечающей составу Na1,2H9,8P4Mo18V7O87, полученный дополнительным введением в раствор H10P3 Mo18V7O84 фосфорной кислоты и катионов натрия, отличается физико-химическими свойствами от своего предшественника H10P3Mo18V7O84. На чертеже приведены кривые зависимостей окислительного потенциала (Е) и рН этих растворов от степени восстановления ГПК (Зависимости Е (кривые 1-3) и рН (кривые 1` -3`) от m (


Пример 4. По примеру 2, отличающемуся тем, что в качестве катализатора используют [Na1,2H9,8P4Mo18V7O87]=0.23 М. Катализатор испытан в 12 циклах (табл.3), причем после 10 цикла в раствор вводят катионы Fe3+. Избирательность катализатора остается стабильной 98-98.5%, раствор сохраняет гомогенность. Введение катионов железа в раствор катализатора (Pd+ГПК-7Р4) не ухудшает его активность и стабильность, т.е. он стал значительно менее чувствительным к продуктам коррозии аппаратуры (Me) по сравнению с катализатором на основе H10P3Mo18V7O84. В этом примере температуру регенерации катализатора под давлением кислорода снижают со 190°С до 180°С, несколько увеличивая при этом ее длительность (с 20 мин до 23-25 мин). Снижение температуры регенерации на 10 градусов заметно упрощает решение технологических задач МЭК-процесса.
Пример 5. По примеру 4, отличающемуся тем, что в качестве катализатора используют 0,4 М раствор Na1,2H9,8P4Mo18V7 O87 при мольном отношении [Рс]:[Pd]=0,5, за 17 мин окисляют 270 мл α-C4H8 (m=2,81 e) с избирательностью 98,5%. После отпарки МЭК катализатор окисляют в автоклаве при условиях, аналогичных примеру 1. На втором цикле активность и избирательность катализатора не меняется.
Пример 6. По примеру 1, отличающемуся тем, что в качестве катализатора используют [H11P4Mo18V7O87]=0,2 M, [Pd]=5·10-4 при мольном отношении [Pd]:[Рс]=1, за 30 мин окисляют 174 мл α-C4H8 (m=3,06 e) с избирательностью 98,7%. После отпарки МЭК катализатор окисляют в автоклаве при условиях, аналогичных примеру 1. На втором цикле активность и избирательность катализатора не меняется.
Пример 7. По примеру 4, отличающемуся тем, что в качестве катализатора используют 0,3 М раствор Na1,2H9,8P4 Mo18V7O87 при мольном отношении [Рс]:[Pd]=2 (или [Pd]:[Pc]=0,5), за 24 мин окисляют 335 мл α-C4H8 (m=4,56 e) с избирательностью 98,2%. После отпарки МЭК катализатор окисляют в автоклаве при условиях, аналогичных примеру 1. На втором цикле его активность и избирательность не меняется.
Пример 8. По примеру 7, отличающемуся тем, что в качестве катализатора используют 0,3 М раствор смеси Na1,2H9,8P4Mo18V7O87 и H11P4Mo18V7O87 в соотношении 1:1, мольное отношение [Рс]:[Pd]=2 (или [Pd]:[Pc]=0,5), за 24 мин окисляют 335 мл α-C4H8 (m=4,56 e) с избирательностью 98, 2%. После отпарки МЭК катализатор окисляют в автоклаве при условиях, аналогичных примеру 1. На втором цикле его активность и избирательность не меняется.
Результаты, полученные в этой серии исследований нового катализатора (Pd+ГПК-7P4) на стабильность, позволяют сделать несколько важных выводов. Главным из них является то, что регенерацию катализатора можно проводить при 180°С, если на ˜15-20% увеличить время кислородной реакции по сравнению с ее временем при 190°С (20 мин). Из таблицы 3 видно, что 20-минутное окисление катализатора при 180° С не обеспечивает требуемых конечных степеней восстановления (mох˜1.6-1.5




Полученные результаты показывают также, что введение в раствор катализатора продуктов коррозии Me (катионов Fe2+) практически не изменяет стабильность и активность катализатора (см. 11 и 12 циклы, табл.3). Некоторое снижение окислительного потенциала раствора при добавлении катионов железа (на 11 цикле значение Ео при введении Fe2+ снижается с 1.036 до 1.029 В) практически не меняет рабочий интервал Δm - изменений m при работе катализатора.
Реферат
Изобретение относится к области основного органического синтеза, а именно к способу получения метилэтилкетона каталитическим окислением н-бутенов. Описан катализатор получения метилэтилкетона каталитическим окислением н-бутенов кислородом и/или кислородсодержащим газом на основе палладия, стабилизированного комплексообразующим лигандом, и гетерополикислоты и/или ее кислых солей, в качестве гетерополикислоты катализатор содержит ГПК-7P4 - молибдованадофосфорную гетерополикислоту состава H11P4Mo18V7O87 и/или ее кислую соль состава Na1.2H9.8P4Mo18V7O87, а в качестве комплексообразующего лиганда - фталоцианиновый лиганд Рс. Регенерируют катализатор взаимодействием его с кислородом или кислородсодержащим газом при температуре 140÷190°С и давлении кислорода 1÷10 ата. Описан также способ окисления н-бутенов в МЭК, который осуществляют непрерывно в двухстадийном режиме при температуре 15÷90°С в присутствии описанного выше катализатора. Технический результат - увеличение эффективности процесса за счет повышения стабильности катализатора, что позволяет значительно повысить производительность катализатора и его избирательность. 2 н. и 5 з.п. ф-лы, 3 табл., 1 ил.


Комментарии